KAJIAN FISIOLOGI REPRODUKSI IKAN NILA MERAH
(Oreochromis sp.) SETELAH PEMBERIAN HORMON
TIROKSIN DAN DIPELIHARA PADA BEBERAPA
MEDIA SALINITAS
ERNA THALIB
C151090161
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Tesis dengan judul “Kajian Fisiologi Reproduksi Ikan Nila Merah (Oreochromis sp.) setelah Pemberian Hormon Tiroksin dan Dipelihara pada Beberapa Media Salinitas” adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Maret 2012
ABSTRACT
ERNA THALIB. Study of Reproductive Physiology of Red Tilapia (Oreochromis sp.) after Tyroxine Treatment and Rearing at various Salinity Media. Under supervision of M. ZAIRIN JUNIOR and IRZAL EFFENDI.
Tyroxine or tetrayodotyronine (T4) hormone and salinity are the two most important variables for osmoregulation, metabolism, and reproduction of fish. The research was conducted to evaluate reproductive physiology of red tilapia under different media salinity and tyroxine doses. Thyroxine was administrated to the fish by injection four times every two week. The research consist of nine treatments and three replications with combination between tyroxine and media salinity were (A) Thyroxine (T4)0 ng /g body weigh (BW),salinity 0 ppt; (B) 0,10; (C) 0,20; (D) 50, 0; (E) 50, 10; (F) 50, 20; (G) 100, 0; (H) 100, 10; and (I) 100, 20. The result showed that tyroxine administration could increase osmotic gradient, fat and protein retention. Thyroxine administration also have influenced to gonadal development including gonado somatic index, hepato somatic index and fecundity. The combination between tyroxine 100 ng/g BW and media salinity 10 ppt and gave the best for reproduction performance of red tilapia.
RINGKASAN
ERNA THALIB. Kajian Fisiologi Reproduksi Ikan Nila (Oreochromis sp.) setelah Pemberian Hormon Tiroksin dan Dipelihara pada beberapa Media Salinitas. Dibimbing oleh M. ZAIRIN JUNIOR dan IRZAL EFFENDI.
Permintaan akan ikan nila yang semakin tinggi dibarengi kompetisi lahan air tawar yang semakin meningkat sementara ketersediaan wilayah tambak masih cukup besar membuat para pembudidaya terus mencari alternatif untuk meningkatkan produksinya. Salah satu yang dilakukan adalah dengan mencoba memelihara ikan nila pada media bersalinitas.
Pemindahan pemeliharaan ikan dari media air tawar ke payau atau laut mengharuskan ikan beradaptasi melalui pengaturan osmoregulasi, upaya mengontrol keseimbangan air dan ion antara tubuh dan lingkungan ikan. Dalam proses osmoregulasi tersebut dibutuhkan hormon untuk mengontrol, salah satunya adalah tiroksin.
Penelitian ini dilakukan dengan tujuan untuk mengkaji sejauh mana hormon tiroksin berpengaruh terhadap reproduksi ikan nila merah yang dipelihara pada beberapa media salinitas dan menentukan dosis hormon yang baik untuk mengurangi beban osmotik ikan yang dipelihara pada media salinitas berbeda. Ikan yang digunakan dalam penelitian ini adalah induk ikan nila merah dengan bobot tubuh berkisar antara 200-230 g/ekor, sedangkan bahan yang digunakan adalah hormon tiroksin atau tetraiodotironin (T4). Penelitian ini terdiri dari
sembilan perlakuan dan tiap-tiap perlakuan diulang sebanyak tiga kali dengan rancangan penelitian; (A) tiroksin (T4) 0 ng/g bobot tubuh, salinitas 0 ppt; (B) 0,
10; (C) 0, 20; (D) 50, 0; (E) 50, 10; (F) 50, 20; (G) 100, 0; (H) 100, 10 dan (I) 100, 20.
Hasil penelitian menunjukkan bahwa interaksi perlakuan kombinasi tiroksin 100 ng/g bobot tubuh dan pemeliharaan pada media salinitas 10 ppt secara nyata mempengaruhi nilai fekunditas dan retensi protein (P<0,05). Fekunditas rataan mencapai 1477 butir/ekor dan protein rataan sebesar 19,50%. Pemeliharaan ikan nila pada media salinitas berbeda mempengaruhi nilai gonad somatik indeks (GSI), hepato somatik indeks (HSI), tingkat konsumsi oksigen. Performa reproduksi ikan nila menurun pada salinitas 20 ppt. Pemberian tiroksin secara signifikan mempengaruhi nilai retensi lemak dengan pola semakin tinggi konsentrasi tiroksin yang diberikan semakin ikan dapat memanfaatkan energi pakan.
Hasil pengukuran kualitas air menunjukan kisaran nilai yang masih layak untuk pemeliharaan ikan nila pada semua perlakuan sehingga dapat disimpulkan bahwa parameter kualitas air pada penelitian ini bukan merupakan faktor yang dapat mempengaruhi ikan nila yang dipelihara.
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar bagi IPB
KAJIAN FISIOLOGI REPRODUKSI IKAN NILA MERAH
(Oreochromis sp.) SETELAH PEMBERIAN HORMON
TIROKSIN DAN DIPELIHARA PADA BEBERAPA
MEDIA SALINITAS
ERNA THALIB
C151090161
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Fisiologi Reproduksi Ikan Nila Merah (Oreochromis sp.) setelah Pemberian Hormon Tiroksin dan Dipelihara pada Beberapa Media Salinitas
Nama : Erna Thalib NRP : C151090161
Disetujui
Prof. Dr. M. Zairin Junior, M.Sc. Ir. Irzal Effendi, M.Si. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof. Dr. Ir. Enang Harris, M.S. Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Maha suci Allah pemilik segala puji. Sujud syukur penulis panjatkan atas segala limpahan kekuatan, kesempatan dan keberkahan sehingga penulisan tesis dengan judul “Kajian fisiologi reproduksi ikan nila Oreochromis sp setelah pemberian hormon tiroksin dan dipelihara pada beberapa media salinitas” dapat terselesaikan.
Pada kesempatan ini, rasa terima kasih tak terhingga Penulis ucapkan kepada Bapak Prof. Dr. Muhammad Zairin junior, M.Sc., dan Bapak Ir. Irzal Effendi, M.Si., selaku Dosen Pembimbing atas bantuan tak ternilai dalam memberikan arahan, nasehat, motivasi serta bimbinganberharga selama proses penulisan tesis ini. Penulis juga mengucapkan terima kasih kepada Ibu Dr. Ir. Widanarni, M.Si sebagai dosen penguji yang bersedia menguji dan memberikan arahan, kritik serta masukan-masukan yang bermanfaat kepada Penulis dalam penyempurnaan tesis.
Ucapan terima kasih juga ingin penulis sampaikan kepada :
1. Keluarga besar tercinta; Ayahanda H. Thalib Achmad Martapure dan Ibunda Hj. Dawang Robo, Kakak Mahani Thalib, Nilawati Thalib, Kartini Thalib dan Adik Erni Thalib atas segala doa dan semangat yang diberikan selama penulis mengikuti studi di Pascasarjana IPB.
2. Teman-teman Ilmu Akuakultur 2009; Sefti Heza Dwinanti, Wahyuni Fanggi Tasik, Zuraida, Muliyani, Riri Ezraneti, Iko Imelda Arisa, Novy Mayasari, Muznah Toatubun, Dian Febriani, Dewi Puspaningsih, Jenni Abidin, Eulis Marlina, Mariana Beruatjaan, Jacqueline Sahetapi, Jakomina Metungun, Hari Kretiawan, Reza Samsudin, Tanbiyaskur, Aras Syazili, Safrizal Putra, Alfabetian H. Condro Haditomo, Rahman, Anwar Hasan, Romeos Kalvari, Ari S dan Anna Oktavera, Rindy Revsylia.
3. Adik-adik terkasih; Hasliana Diski, Rezki Amelia, Ria Hariati, atas dukungan dan doa kepada penulis selama Penulis mengikuti studi pascasarjana di IPB.
Semoga karya ini dapat memberikan manfaat bagi kita semua.
RIWAYAT HIDUP
DAFTAR TABEL
Halaman 1. Tingkat kematangan gonad ovarium ikan nila ... 7 2. Perlakuan percobaan kajian reproduksi ikan nila merah
(Oreochromis sp.) setelah pemberian tiroksin dan
dipelihara pada beberapa media salinitas ... 21 3. Nilai rataan hepato somatik indeks (HSI, %) ikan nila merah
(Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas ... 28 4. Nilai rataan diameter telur (DM, mm) ikan nila merah
(Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas ... 29 5. Nilai rataan gonad somatik indeks (GSI, %) ikan nila merah
(Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas ... 30 6. Nilai rataan fekunditas (FK, butir/ekor) ikan nila merah
(Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas ... 31 7. Nilai rataan tingkat konsumsi oksigen TKO, mgO2/g tubuh/jam)
ikan nila merah (Oreochromis sp.) yang diberi perlakuan
tiroksin dan salinitas ... 36 8. Glukosa darah ikan nila merah (Oreochromis sp.) yang
diberi perlakuan tiroksin dan salinitas selama pemeliharaan ... 37 9. Nilai rataan retensi protein (RP, %) ikan nila merah
(Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas ... 38 10. Nilai rataan retensi lemak (RL, %) ikan nila merah
(Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas ... 40 11. Nilai rataan pertumbuhan harian (PH, %) ikan nila merah
DAFTAR GAMBAR
Halaman 1. Kerjasama berbagai jenis hormon dalam tubuh ikan ... 9 2. Proses pengeluaran dan penyerapan ion dan air dalam tubuh
ikan air tawar dan air laut ... 11 3. Kontrol endokrin terhadap osmoregulasi ikan ... 11 4. Faktor eksternal dan internal yang mempengaruhi
metabolisme dan pertumbuhan ikan ... 15 5. Perkembangan persentase nilai HSI ikan nila merah
(Oreochromis sp.) pada masing-masing perlakuan selama
pemeliharaan ... 27 6. Perkembangan diameter telur (DM, mm) ikan nila merah
(Oreochromis sp.) pada masing-masing perlakuan selama
pemeliharaan ... 29 7. Perkembangan persentase nilai GSI ikan nila merah
(Oreochromis sp.) pada masing-masing perlakuan selama
pemeliharaan ... 30 8. Pengaruh tiroksin terhadap nilai fekunditas ikan nila merah
(Oreochromis sp.) ... 32 9. Pengaruh salinitas terhadap nilai fekunditas ikan nila merah
(Oreochromis sp.) ... 32 10.Pengaruh interaksi antara tiroksin dan salinitas terhadap
nilai fekunditas ikan nila merah (Oreochromis sp.) ... 33 11.Struktur histologi ikan nila merah (Oreochromis sp.) pada
Perlakuan H dan B (control) ... 34 12.Gradien osmotik tubuh dan media pemeliharaan ikan nila
merah (Oreochromis sp.) setelah pemberian hormon
tiroksin dan dipelihara pada beberapa media salinitas ... 35 13.Glukosa darah ikan nila merah (Oreochromis sp.) setelah
Pemberian hormon tiroksin dan dipelihara pada beberapa
14.Pengaruh pemberian tiroksin terhadap nilai retensi
protein ikan nila merah (Oreochromis sp.) ... 38 15.Pengaruh salinitas terhadap nilai retensi protein
ikan nila merah (Oreochromis sp.) ... 39 16.Pengaruh interaksi antara tiroksin dan salinitas terhadap
Nilai retensi protein ikan nila merah (Oreochromis sp.) ... 39 17.Pertumbuhan harian ikan nila merah (Oreochromis sp.)
setelah pemberian tiroksin dan dipelihara pada beberapa
DAFTAR LAMPIRAN
Halaman 1. Tata letak wadah percobaan dan media pemeliharaan
ikan nila merah (Oreochromis sp.) ... 54
2. Dokumentasi wadah penelitian ... 56
3. Prosedur histologi gonad ... 57
4. Prosedur pengukuran gradien osmotik ... 59
5. Prosedur pengukuran kadar glukosa darah ... 61
6. Diameter telur ikan nila pada perlakuan terbaik (perlakuan H) dan perlakuan kontrol (perlakuan B) ... 62
7. Osmolaritas tubuh dan media pemeliharaan ikan nila Pada masing-masing perlakuan selama pemeliharaan ... 65
8. Sidik ragam (ANOVA) dan uji lanjut Duncan nilai HSI ikan nila merah setelah pemberian tiroksin dan dipelihara pada beberapa media salinitas ... 66
9. Sidik ragam (ANOVA) dan uji lanjut Duncan diameter telur (mm) ikan nila merah setelah pemberian tiroksin dan dipelihara pada beberapa media salinitas … ... 67
10.Sidik ragam (ANOVA) dan uji lanjut Duncan nilai GSI ikan nila merah setelah pemberian tiroksin dan dipelihara pada beberapa media salinitas … ... 68
11.Sidik ragam (ANOVA) dan uji lanjut Duncan tingkat konsumsi oksigen ikan nila merah setelah pemberian tiroksin dan dipelihara pada beberapa media salinitas … ... 69
12.Sidik ragam (ANOVA) dan uji lanjut Duncan nilai retensi protein ikan nila merah setelah pemberian tiroksin dan dipelihara pada beberapa media salinitas ... 70
14.Sidik ragam (ANOVA) dan uji lanjut Duncan pertumbuhan Ikan nila merah setelah pemberian tiroksin dan
PENDAHULUAN
Latar belakang
Ikan nila merupakan salah satu komoditas unggulan perikanan yang memiliki potensi cukup baik untuk dikembangkan. Beberapa kelebihan yang dimiliki ikan ini adalah mudah dipelihara, bernilai ekonomis tinggi, responsif terhadap pakan tambahan, kelangsungan hidupnya tinggi, dapat mentolerir salinitas pada kisaran yang luas, mampu berkembangbiak dengan cepat, serta memiliki struktur daging putih bersih, tebal dan kenyal (KKP 2010).
Untuk pasar ekspor, Amerika merupakan yang paling potensial, dan membutuhkan pasokan nila fillet per tahunnya sekitar 90 ton/thn. Masih banyak yang membutuhkan pasokan ikan nila dalam jumlah yang besar, diantaranya adalah Hongkong, Singapura, Jepang dan Eropa. Menurut FAO (Food Agricultural Organization), pasar dunia sampai 2010 masih kekurangan pasokan ikan nila sebanyak 2 juta ton/tahun. Permintaan pasar akan ikan nila yang cenderung meningkat dari tahun ke tahun menuntut para pelaku budidaya untuk meningkatkan produksinya, baik secara kualitas maupun kuantitas. Salah satu upaya untuk mendapatkan produksi yang tinggi adalah melalui pengelolaan induk yang baik dengan mengoptimalkan faktor lingkungan yang dapat mendukung kondisi fisiologi dari ikan yang dibudidayakan.
yang mempengaruhi reproduksi pada induk ikan nila seperti fekunditas, nilai GSI (gonad somatik indeks), perkembangan embrio dan waktu inkubasi telur. Watanabe dan Kuo (1988), mengemukakan bahwa penampilan dan reproduksi ikan nila lebih baik pada salinitas 5-15 ppt dari pada di air tawar dan air laut 30 ppt.
Selain faktor lingkungan, keberadaan hormon, seperti tiroksin juga memegang peranan penting dalam pengaturan fisiologi tubuh ikan nila seperti osmoregulasi, metabolisme dan reproduksi. Hormon tiroksin berperan dalam mengontrol adaptasi salinitas, meningkatkan konsumsi oksigen, laju metabolisme protein dan lemak sehingga secara tidak langsung berpengaruh terhadap reproduksi ikan nila (Handayani 1997). Hasil penelitian Matty (1985), menyatakan selama maturasi pada induk ikan mas koki, Carassius auratus hormon tiroksin turut berperan dalam proses vitelogenesis oosit. Konsentrasi gonadotropin berbeda nyata antara kontrol (tanpa pemberian salmon gonadotropin dan tiroksin), tanpa pemberian tiroksin dan pemberian salmon gonadotropin yang ditambahkan dengan hormon tiroksin. Pentingnya peranan hormon dalam reproduksi ikan menjadi penting untuk dikaji sehingga penelitian ini perlu untuk dilakukan.
Perumusan Masalah
Keterlibatan hormon tiroid dalam osmoregulasi berhubungan dengan aktivitas Na+,K+-ATPase, sehingga dapat meningkatkan aktivitas transport natrium pada berbagai jaringan epitel termasuk ginjal. Selain berperan dalam pengaturan osmoregulasi, pada beberapa penelitian menunjukkan bahwa hormon tiroid juga mempengaruhi laju metabolisme protein, karbohidrat dan lemak (Matty 1985). Hal serupa didukung oleh Woo et al. (1991), bahwa pemberian hormon tiroksin dalam pakan dapat meningkatkan laju pertumbuhan, aktivitas enzim pencernaan pada usus dan aktivitas enzim yang terlibat dalam metabolisme karbohidrat. Hormon tiroid berintegrasi dengan hormon lain secara sinergistis dalam mengatur laju metabolisme, memfasilitasi pelepasan growth hormone (GH) dari sel-sel hipofisis, meningkatkan lipolisis serta pengambilan pakan sehingga berpengaruh secara tidak langsung terhadap reproduksi ikan (Fujaya 2004). Energi yang berasal dari lemak digunakan selama pembentukan vitelogenesis, gonadogenesis dan fekunditas. Sementara energi protein digunakan untuk gonadogenesis, gametogenesis, vitelogenesis, hormon dan enzim (Finstad et al. 2001). Tiroksin juga secara langsung berpengaruh terhadap reproduksi. Kelancaran sekresi tiroksin oleh kelenjar tirod merupakan salah satu syarat untuk kelangsungan reproduksi secara normal pada ternak (Toelihere 1979). Sechman et al. (2009) mengemukakan bahwa pada ayam tiroid dapat meningkatkan konsentrasi progesteron yang berperan penting dalam proses ovulasi. Pada manusia, keadaan hipotiroid menyebabkan kegagalan perkembangan gonad dan sistem saluran reproduksi, perpanjangan masa kebuntingan dan penurunan jumlah anak pada babi (Robertson dan Falconer 1961). Pada ikan hormon tiroid dalam plasma induk akan ditransfer kedalam telur dan kemudian kedalam kantung kuning telur larva (Ayson dan Lam 1993).
Pada ikan hormon tiroid memainkan peran dalam fungsi dan perkembangan sistem reproduks meskipun mekanisme secara detail belum sepenuhnya diketahui.
Strategi pemeliharaan ikan nila di perairan laut atau payau perlu mendapat perhatian terutama menyangkut osmoregulasi sehingga ikan dapat memperkecil ketersediaan energi untuk reproduksi. Strategi yang dapat dilakukan adalah memilih strain yang adaptif terhadap kadar garam dan penggunaan hormon yang salah satunya adalah hormon tiroid (T4). Pemberian hormon tiroksin dapat
membantu ikan dalam mengatur osmoregulasi melalui pengambilan ion-ion oleh tubuh agar energi yang digunakan untuk osmoregulasi dapat ditekan sekecil mungkin dan dapat digunakan secara optimal untuk reproduksi. Keberadaan tiroksin mempengaruhi perkembangan gonad melalui rangsangan terhadap hormon gonadotropin (Matty 1985).
Keadaan hipotiroidisme atau kekurangan tiroid dalam tubuh dapat menghambat saluran reproduksi. Kerusakan gonad juga dapat terjadi bila mencapai keadaan hipertiroidisme dalam tubuh (Toelihere 1979). Pemberian tiroksin akan memberi pengaruh-pengaruh stimulasi atau keracunan sehingga perlu diperhatikan dosis dan spesies yang digunakan. Mengacu pada permasalahan tersebut diatas, maka perlu dilakukan penelitian terkait dengan pemberian hormon dengan dosis berbeda pada media bersalinitas sehingga diharapkan dapat memberikan pengaruh terbaik terhadap berbagai aspek reproduksi ikan nila, baik secara langsung maupun secara tidak langsung.
Tujuan dan Manfaat
Penelitian ini bertujuan untuk mengkaji sejauh mana hormon tiroksin mempengaruhi fisiologi reproduksi ikan nila yang dipelihara pada beberapa media salinitas. Manfaat yang diharapkan dari penelitian ini adalah dapat memberikan informasi dasar tentang dosis optimum hormon tiroksin (T4) terhadap reproduksi
Hipotesis
TINJAUAN PUSTAKA
Biologi Ikan Nila (Oreochromis sp.)
Nila merah (Oreochromis sp.) merupakanikan hasil hibridisasi antara ikan Oreochromis mossambicus dan Oreochromis niloticus. Tergolong dalam ordo Percomorphi, sub ordo Percoidea, family Cichlidae dan genus Oreochromis (Stickney 2006). Sebagai ikan yang tergolong euryhalin, ikan nila merah dapat dibudidayakan di perairan tawar, payau dan laut. Kondisi lingkungan yang optimal bagi pertumbuhan ikan nila adalah suhu berkisar antara 27-29oC, oksigen terlarut 3-8,5 ppm, pH 7-8,3; alkalinitas 90-190 ppm, kesadahan 62-79 mg CaCO3, Ikan tilapia digolongkan sebagai ikan herbivora (Tengjaroenkul et al.
2000), dapat memakan jenis-jenis pakan tambahan seperti dedak halus, tepung bungkil kacang, ampas kelapa dan sebagainya. Untuk budidaya ikan nila tumbuh lebih cepat dengan pakan yang mengandung protein >20-25 %.
Ikan nila umumnya lebih dikenal atau dipelihara di perairan tawar, mulai dari lingkungan yang sempit seperti kolam pekarangan, kolam tadah hujan dan sawah sampai dengan lingkungan yang sangat luas seperti tambak, sungai atau waduk (dengan sistem keramba jaring apung). Toleransi terhadap kadar garam merupakan suatu karakteristik biologi utama dari ikan nila. Pertumbuhan ikan nila berbeda pada kondisi air tawar, payau (estuari) dan laut. Ikan nila tumbuh lebih cepat pada salinitas 6-17 ppt dibandingkan dengan air tawar. Pada salinitas 31-36 ppt dapat mematikan secara total (Mege 1993). Performa reproduksi ikan nila lebih baik pada salinitas 10 ppt (Darwisto 2006), 5-15 ppt dan menurun pada salinitas > 30 ppt (Watanabe dan Kuo 1988).
Reproduksi dan Perkembangan Gonad
kelenjar-kelenjar endokrin dan hormon-hormon yang menghasilkannya. Awal matang gonad ikan nila pada ukuran 20-30 cm (150 g) (Stickney 2006); > 50 g (El-ssayed et al. 2003), tergantung jenis dan strain. Perkembangan gonad ikan nila dipengaruhi oleh beberapa faktor seperti hormon, makanan dan faktor lingkungan. Stickney (2006) mengemukakan bahwa ikan nila pada kondisi budidaya (terkontrol) lebih cepat matang gonad dibandingkan dengan ikan nila yang hidup di perairan alami.
Secara alami ikan nila dapat memijah sepanjang tahun di daerah tropis. Pada umumnya pemijahan ikan nila terjadi 6-7 kali/tahun. Rasio betina : jantan untuk pemijahan adalah 2:1. Fekunditas berkisar antara 243-847 butir telur/ induk (Mendoza et al. 2005), 300-1.500 butir/induk (Kusnadi dan Bani), 300-3.000 butir/induk (Kordi 2000; Stickney 2006). Nilai fekunditas dipengaruhi oleh beberapa faktor, seperti pakan, ukuran ikan, diameter telur, dan lingkungan. Salinitas untuk pemijahan berkisar antara 0-30 ppt (Koda 2003; Ainun 2008). Beberapa spesies ikan dapat memijah dua atau beberapa kali dalam setahun (Rustidja 2005). Pada pemijahan secara alami, ikan yang telah matang gonad dan siap memijah dapat menghasilkan telur yang matang dalam waktu yang singkat apabila kondisi lingkungan baik.
Tingkat kematangan gonad ovarium ikan nila diklasifikasikan menjadi 5 tingkat (Dadzie dan Wangila 1980) sebagai berikut :
Tabel 1. Tingkat kematangan gonad ovarium ikan nila
No TKG Histologi
Ovarium masih kecil, transparan, dan oosit muda hanya terlihat dengan menggunakan mikroskop
Ovarium berwarna kuning terang, dan oosit dapat terlihat dengan mata
Ovarium besar, berwarna gelap, dan ada oosit yang mulai mengandung kuning telur
Ovarium besar, berwarna coklat, banyak oosit berukuran maksimal dan mudah dipisahkan.
Ovarium berwarna kuning terang, ukuranya berkurang karena telur yang sudah matang telah dilepaskan.
lapisan dalam sel (granulosa) dan lapisan luar (sel theca). Oosit berkembang akibat adanya akumulasi kuning telur (vitelogenesis) dalam sitoplasma. Vitelogenesis akan berkembang secara penuh dan kemudian mengalami maturasi dan ovulasi karena adanya pengaruh lingkungan dan hormon. Setelah terjadi ovulasi maka selanjutnya akan terjadi proses pembelahan dan oosit telah menjadi telur secara sempurna dan siap dibuahi (Murua dan Kraus 2003).
Dalam satu tingkat kematangan gonad (TKG), komposisi telur yang dikandung tidak seragam, tetapi terdiri dari berbagai macam telur. Telur merupakan cikal bakal bagi suatu makhluk hidup, yang proses pembentukannya sudah mulai pada fase diferensiasi dan oogenesis yaitu terjadinya akumulasi vitolegenin kedalam folikel (vitelogenesis). Perkembangan diameter telur meningkat dengan semakin meningkatnya TKG.
Tiroid dan Mekanisme Kerjanya
Hormon tiroksin mempunyai reseptor didalam inti sel (hipofisa, hati, jantung dan ginjal). Di dalam sel, tiroksin (T4) mengalami deiodinasi dan
ditransformasi menjadi T3. Transformasi T3 berlangsung di dalam membran
plasma dan retikulum endoplasma, Setelah transformasi berlangsung maka T3
migrasi ke sel inti dan melakukan interaksi dengan reseptor yang terdapat di inti. Akibatnya produksi nuclear RNA (nRNA) dan mocrosmional RNA (mRNA) akan meningkat. Efek dari T3 disamping untuk pertumbuhan, metamorfosis juga
mampu bekerja sama dengan hormon lain, seperti hormon gonadotropin. T3 juga
bekerja sama dengan kortisol untuk merangsang pembentukan hormon melalui mRNA yang terdapat dalam hipofisa. Hormon tiroksin dapat dengan mudah masuk ke dalam sel target melewati dinding sel (membran plasma) dengan cara transport aktif. Hormon tiroid (T3 dan T4) yang masuk kedalam tubuh dibawa ke
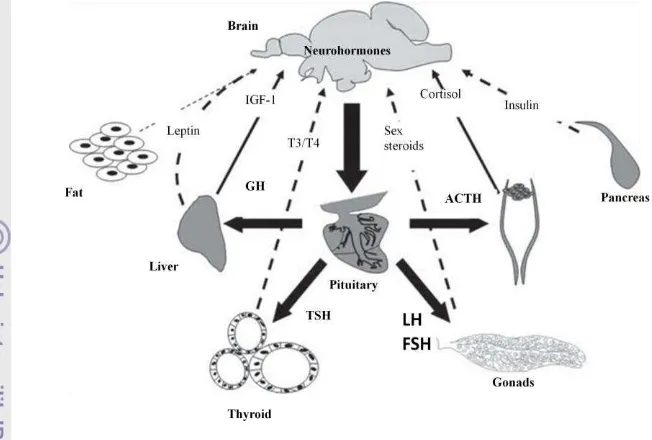
Gambar 1. Kerjasama berbagai jenis hormon dalam tubuh ikan (Bernier et al. 2009).
25
Defisiensi dan Kelebihan Tiroid dalam Tubuh
Pembentukan hormon tumbuh yang berlebihan akan mengakibatkan terjadinya pertumbuhan raksasa (gigantism). Efek hormon tumbuh terlihat jelas pada bagian tulang panjang. Pertumbuhan tulang yang berlebihan dapat mengakibatkan kelainan pada persendian sehingga mekanisme kerja dari persandian tersebut menjadi tidak normal lagi. Produksi hormon tiroid yang berlebihan akan mengakibatkan terjadinya gangguan terhadap konversi keratin menjadi kreatinin. Akibat dihambatnya pembentukan kreatinin tersebut maka pembentukan fosfokreatin juga terhambat yang berakibat diekskresikannya keratin kedalam urin. Kehilangan keratin dari otot-otot menyebabkan kerja otot tidak efisien. Demikian juga, apabila kekurangan produksi hormon tiroid di dalam tubuh maka akan terjadi kelainan-kelainan dalam pertumbuhan (Affandi dan Tang 2003).
Salnilitas, Tiroksin dan Osmoregulasi Ikan
Osmoregulasi merupakan pengaturan tekanan osmotik cairan tubuh yang layak bagi kehidupan sehingga proses-proses fisiologis tubuh dapat berfungsi secara normal. Osmoregulasi erat kaitannya dengan salinitas, yakni upaya untuk mengontrol keseimbangan air dan konsentrasi total dari ion-ion yang terlarut dalam air, seperti Na (natrium), K (kalium), Ca (kalsium), Mg (magnesium), Cl (khlor), SO4 (sulfat), dan HCO3 (asam karbonat) antara tubuh dan lingkungannya
(Effendi 2003). Selama osmoregulasi, hewan air membutuhkan keseimbangan osmotik antara cairan tubuh dan media yang sangat penting terhadap kelangsungan hidupnya. Hormon memainkan peran sebagai pengontrol terhadap proses adaptasi ikan dan transport ion (McCormick dan Bradsaw 2006).
tubuhnya (hiperosmotik) sehingga secara alami air bergerak masuk kedalam tubuh dan ion-ion keluar ke lingkungan secara difusi. Secara rinci proses osmoregulasi pada ikan dijelaskan pada Gambar 2.
Gambar 2. Proses pengeluaran dan penyerapan ion dan air dalam tubuh ikan air tawar dan air laut.
Beberapa organ yang berperan dalam proses pengaturan tersebut antara lain, insang, ginjal dan usus. Organ-organ ini melakukan fungsi adaptasi dibawah kontrol hormon osmoregulasi, terutama hormon-hormon yang disekresikan oleh pituitari, ginjal dan urofisis, diantaranya hormon prolaktin (PRL) dan hormon tiroid (Gambar 3).
Pada insang, sel-sel berperan dalam osmoregulasi adalah sel-sel klorida yang terdapat pada dasar lembaran-lembaran insang, sementara ginjal digunakan untuk membersihkan dan menjernihkan plasma darah dari zat-zat yang tidak diinginkan. Usus aktif mengambil ion-ion monovalen (Na+, K+, Cl-) dan air. Proses-proses tersebut berjalan dibawah pengaruh hormon.
Hormon tiroid mempengaruhi aktivitas enzim Na+/K+ ATP-ase yang terdapat pada membran, sehingga terjadi peningkatan aktivitas transport natrium akibat meningkatnya konsumsi oksigen. Na+,K+-ATPase juga menyediakan energi sebagai tenaga penggerak untuk transport Na+ dalam berbagai epitel osmoregulasi termasuk ginjal. Pengaruh tiroid terhadap aktivitas Na+, K+-ATPase pada adaptasi ikan air laut telah menjadi subjek dalam banyak penelitian. Hormon tiroid dilaporkan dapat mempertahankan keseimbangan osmotik Na+ selama melakukan osmoregulasi (tantangan osmoregulasi), mendorong aktivitas pompa Na+ dan dinamika morfometrik sel klorida, serta membantu kemampuan hiperosmoregulator pada tilapia air tawar (Peter et al. 2000).
Peranan Hormon Tiroid dalam Metabolisme Ikan
Hormon tiroid (T3 dan T4) pada organisme, termasuk hewan terlibat dalam
regulasi atau pengaturan homeostatis dan metabolism energi, protein dan lemak. Pengaruh tiroid terhadap sintesis protein melalui aktivitas RNA. Adanya interaksi hormon tiroid dan reseptor pada inti maka aktivitas enzim polymerase akan meningkat dan pembentukan RNA-pun akan meningkat (Djojosoebagyio 1990). Konsentrasi hormon tiroid tergantung dari beberapa faktor, diantaranya adalah lingkungan dan gizi (Todini 2007).
yang dilakukan pada ikan sidat menunjukkan bahwa pemberian tiroid juga dapat meningkatkan enzim aldolase (enzim yang terlibat dalam glikolisis). Dengan adanya peningkatan metabolisme glukosa maka karbohidrat berperan sebagai sparing action pada penggunaan energi. Jalur katabolisme glukosa ini sangat penting untuk biosintesis asam lemak, karena meningkatnya glikolisis akan menurunkan lemak sebagai sumber energi.
Energi dari asupan pakan yang digunakan untuk reproduksi berasal dari lemak dan protein. Lemak berfungsi pada peran vitelogenesis, fekunditas, penetasan, dan sumber energi untuk larva. Secara umum protein yang dibutuhkan pada tahapan reproduksi adalah untuk gonadogenesis, gametogenesis, vitelogenesis, hormon dan enzim (Finstad et al. 2001). Menurut Sibly dan Calow (1986), kebutuhan energi tertinggi pada makhluk hidup terjadi pada saat pematangan dan reproduksi dimana pakan yang diperoleh diubah menjadi zat-zat yang diperlukan bagi keberhasilan pemijahan. Energi yang dihabiskan untuk reproduksi ada tiga : (a) untuk produk seksual primer yaitu telur dan sperma (gamet); (b) untuk karakteristik seksual sekunder; dan (c) untuk tingkah laku reproduksi (Tytler dan Calow 1985). Aristizabal (2007) mengatakan pada ikan diperoleh dua jenis bentuk penyimpanan energi yaitu untuk pertumbuhan dan reproduksi, dimana proses reproduksi merupakan bentuk penyimpanan energi yang dapat diukur berdasarkan energi yang terdapat pada gonad (ovari) dan testes.
Peranan Hormon Tiroid dalam Reproduksi Ikan
Pada hewan dewasa, tiroid mempengaruhi peningkatan respon hCG (human chorionic gonadotropin) dalam merangsang ovulasi (Frandson 1986), berperan dalam pematangan folikel pada tikus betina dewasa dan peningkatan konsentrasi testosterone pada tikus jantan. Pada manusia tiroid mempengaruhi beberapa aspek reproduksi, seperti metabolisme estrogen, kematangan seksual, ovulasi, kesuburan dan kemampuan menghasilkan anak (Choksi et al. 2003). Pada ikan hormon tiroid juga memainkan peran dalam fungsi dan perkembangan sistem reproduksi.
Oksigen dan Pertumbuhan
Ikan membutuhkan energi untuk memelihara tubuh, aktivitas sehari-hari dan pertumbuhan. Pertumbuhan akan terjadi apabila masih terdapat kelebihan energi setelah kebutuhan untuk pemeliharaan tubuh dan aktivitas terpenuhi. Energi yang diperoleh dari pakan, oleh ikan terlebih dahulu digunakan untuk pemeliharaan dan aktivitas tubuh. Bentuk energi yang dapat digunakan untuk menyokong aktifitas hidup yaitu diperoleh dalam bentuk protein, lemak dan karbohidrat dalam pakan. Semakin tinggi aktivitas fisik atau laju metabolisme yang tinggi, semakin besar energi yang diperlukan. Faktor internal dan eksternal yang mempengaruhi metabolisme dan pertumbuhan disajikan pada Gambar 4.
Gambar 4. Faktor eksternal dan internal yang mempengaruhi metabolisme dan pertumbuhan ikan (Brett 1979).
Glukosa Darah sebagai Indikator Stres
Stres merupakan keadaan dimana ikan tidak mampu mengatur kondisi fisiologis secara normal karena berbagai faktor yang mempengaruhi kondisinya atau dikenal dengan stresor. Sejumlah keadaan yang dapat berperan sebagai stresor antara lain; 1) stresor kimiawi yakni stress yang timbul akibat masalah kualitas air buruk seperti oksigen rendah, pH dan salinitas tidak sesuai, polusi akibat penggunaan bahan kimiawi, komposisi pakan, senyawa nitrogen dan sisa metabolisme; 2) stressor fisika yaitu stres yang timbul akibat suhu lebih tinggi atau lebih rendah dari normal, cahaya berlebih atau kurang, suara, dan gas-gas terlarut; 3) stresor biologi yaitu stress yang disebabkan oleh densitas populasi terlalu tinggi dan penyakit akibat mikroba atau parasit (Marcel et al. 2009).
Pendekatan yang dapat dilakukan untuk mengetahui keadan stress pada ikan adalah perubahan naik turunnya kadar glukosa darah. Mekanisme terjadinya perubahan glukosa darah selama stres dimulai dari diterimanya informasi penyebab stres oleh organ reseptor (neuroendokrin). Selanjutnya informasi tersebut disampaikan ke otak bagian hipothalamus melalui sistem syaraf. Sistem syaraf kemudian menstimulir medulla adrenal untuk melepaskan ACTH (adrenocorticotrophic hormone). ACTH selanjutnya akan memicu sintesis kortisol dan sekresinya dari sel-sel internal di sinyal serta memobilisasi peningkatan glukosa darah (Bernier 2005). Stres dapat mengakibatkan ikan menjadi shok, tidak mau makan, memijah, dan meningkatnya kepekaan terhadap penyakit. Kadar glukosa darah yang tinggi mampu menurunkan bahkan menekan produksi gonadotropin realizing hormone (GnRH) yang diproduksi oleh hipotalamus. Pada akhirnya stress akan menurunkan jumlah sperma pada jantan dan masalah ovulasi pada betina. Selain itu stress juga berpengaruh terhadap aktivitas seksual ikan (Schreck et al. 2000).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Pemeliharaan ikan dilakukan di Laboratorium Sistem dan Teknologi Budidaya, IPB. Histologi gonad dilakukan di Laboratorium Kesehatan Ikan (LKI), uji glukosa dan osmolaritas darah dilakukan di Laboratorium Embriologi Fakultas Kedokteran Hewan IPB. Proksimat protein dan lemak pakan dan ikan di lakukan di Laboratorium Pusat Antar Universitas (PAU), IPB. Pengamatan diameter oosit dilakukan di Laboratorium Reproduksi dan Genetika organisme Akuatik, BDP IPB. Pelaksanaan penelitian dilakukan selama + 4 bulan.
Alat dan Bahan
Wadah dan Media Percobaan
Wadah yang digunakan berupa bak terpal berukuran 65x60x50 cm sebanyak 27 unit (Lampiran 1). Setiap wadah di isi air sebanyak 150 liter, dilengkapi filter dan aerasi. Media percobaan (Lampiran 2) yang digunakan adalah bersalinitas 10 ppt, 20 ppt dan media air tawar (0 ppt). Untuk mempermudah penggunaan atau pergantian air selama pemeliharaan, disiapkan empat buah bak tandon masing-masing untuk menampung air bersalinitas 10 ppt, 20 ppt, 30 ppt dan air tawar yang sudah diencerkan terlebih dulu dan diareasi.
Ikan Uji
Ikan uji yang digunakan dalam penelitian ini adalah induk betina ikan nila merah (Oreochromis sp.) hasil budidaya di Kolam Departemen Budidaya Perairan. Jumlah total induk yang disediakan adalah 200 ekor dan sebanyak 108 ekor dipilih secara selektif dengan bobot yang sama (200-300 g/ekor) untuk digunakan sebagai ikan uji perlakuan. Lima ekor ikan nila diambil sebagai data awal untuk dianalisa tingkat kematangan gonad sebelum diberi perlakuan.
Bahan Uji
menggunakan mortar hingga halus (berbentuk bubuk), kemudian dilarutkan ke dalam 20 ml larutan dimetilsulfoksida (DMSO). Larutan kemudian didiamkan selama 24 jam dalam magnetik spiral agar hormon tiroksin benar-benar larut. Larutan (tiroksin + DMSO) kemudian diambil dengan menggunakan suntikan syringe 1 ml dan siap diinjeksi ke ikan dengan dosis sesuai masing-masing perlakuan.
Pelaksanaan Penelitian
Persiapan Induk
Induk nila yang diambil dari kolam diangkut kedalam wadah pemeliharaan berupa bak beton dan fiber yang telah disiapkan terlebih dulu. Air disiapkan seminggu sebelum ikan diambil, dilengkapi dengan sistem filter dan aerasi. Ikan dipelihara selama + seminggu dengan pemberian pakan secara at satiation. Penyiponan dilakukan dua hari sekali untuk menghindari kotoran mengendap di dasar bak dan dilakukan pergantian air sebanyak 50 %.
Adaptasi Induk
Induk yang telah dipelihara sebelumnya dipindahkan ke masing-masing wadah percobaan dengan kepadatan 4 ekor/bak. Peningkatan salinitas dilakukan setelah tiga hari pemindahan ikan. Untuk menghindari stres, dilakukan peningkatan salinitas secara bertahap dengan perubahan 2-4 ppt setiap harinya hingga mencapai delapan hari.
Teknik Penyuntikan
Pemberian Pakan
Pakan uji yang diberikan adalah pelet komersial dengan kandungan protein sebesar 30-33% dan lemak sebesar 11,6 %. Pemberian dilakukan dua kali sehari yaitu pagi (08: 00) dan sore (06: 00) secara at satiation.
Prosedur Pengambilan Sampel Darah
Pengambilan sampel darah untuk pengukuran kandungan kadar glukosa dan osmolaritas tubuh ikan nila dilakukan dengan mengambil sebanyak 3 ml sampel darah ikan pada bagian pangkal ekor dengan menggunakan spuit 3 ml yang telah diberi antikoagulan (cirate-phosphate-sextrosesolution, Sigma C-7165) agar darah tidak beku. Sampel darah dimasukkan ke dalam tabung polietilen dan disentrifus pada kecepatan 600 rpm selama 5 menit. Plasma darah hasil sentrifus diambil dan dipindahkan ke tabung polietilen baru untuk disimpan dalam freezer (-20oC) sampai dilakukan analisis.
Pengambilan Data dan Pengukuran Kualitas Air
Sampling (pengambilan data) penelitian dilakukan pada awal penelitian yaitu hari ke-0 pemeliharaan, hari ke-14 dan seterusnya hingga hari ke-56; diambil secara teratur dengan interval waktu 14 hari sampai hari akhir penelitian. Sampling ikan meliputi perkembangan gonad, GSI dan HSI, diameter telur, gradient osmotik, glukosa darah, tingkat konsumsi oksigen, dan pertumbuhan. Perkembangan gonad diikuti dengan mengamati histologi gonad (Lampiran 3). Analisis proksimat lemak dan protein daging ikan nila dilakukan pada akhir penelitian. Kualitas air diukur setiap minggu meliputi suhu, pH dan oksigen.
dengan pembesaran 40x. Jumlah telur yang diamati adalah 100 butir per gonad (300 butir/perlakuan).
Rancangan Penelitan
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL dua faktor) dengan pola faktorial 3 x 3. Dosis hormon sebagai faktor pertama dengan level konsentrasi 0 ng/g BW , 50 ng/g BW, 100 ng/g BW dan salinitas sebagai faktor kedua dengan level 0 ppt, 10 ppt dan 20 ppt. Keseluruhan percobaan terdiri atas sembilan kombinasi perlakuan, dan masing-masing perlakuan diulang sebanyak tiga kali sehingga jumlah satuan percobaan sebanyak 27 (Tabel 2).
Tabel 2. Perlakuan percobaan kajian reproduksi ikan nila merah (Oreochromis sp.) setelah pemberian tiroksin dan dipelihara pada beberapa media salinitas Keterangan : BT = Bobot tubuh
Setiap perlakuan menggunakan tiga wadah dan tiap wadah diisi empat ekor ikan sehingga setiap perlakuan terdiri dari 12 ekor ikan. Sebanyak 27 ekor ikan akan diambil setiap 14 hari dengan masing-masing perlakuan sebanyak tiga ekor untuk dilakukan analisa kematangan gonad, diameter telur dan parameter penunjang lainnya.
Model rancangan penelitian yang digunakan adalah :
βj = Pengaruh faktor 2 (salinitas)
(αβ)ij = Komponen interaksi dari faktor 1 dan faktor 2 €ij = Pengaruh acak yang menyebar normal
Parameter Uji yang Diamati
Parameter uji yang diamati dalam penelitian ini terdiri dari parameter utama dan parameter pendukung. Parameter utama berupa diameter oosit, fekunditas, gonad somatik indeks (GSI) dan HSI (hepato somatik indeks). Parameter pendukung berupa pertumbuhan, kadar glukosa darah, gradient osmotik, tingkat konsumsi oksigen (TKO), retensi lemak dan retensi protein.
Parameter Utama
Penentuan Diameter Oosit
Diameter oosit diamati dengan mengambil sampel telur secara acak pada gonad ikan sebanyak 100 butir/ekor. Sampel telur kemudian difiksasi dengan alkohol 70%. Diameter telur diukur menggunakan mikroskop yang dilengkapi dengan mikrometer okuler. Sampel telur yang telah diukur dihitung rataannya dan dibuat distribusi frekuensi panjang total dan diameter telur (mm) dengan menggunakan rumus (Mattjik dan Sumertajaya 2000):
Menentukan nilai maksimum dan minimum dari keseluruhan data
Menghitung jumlah kelas ukuran dengan rumus : K=1+(3,32 log ); K = jumlah kelas ukuran, n = jumlah data pengamatan.
Menghitung rentang data/wilayah (wilayah = data terbesar-data terkecil).
Menghitung lebar kelas (lebar kelas = wilayah dibagi dengan jumlah kelas).
Menentukan limit bawah kelas bagi selang kelas yang pertama dan limit atas kelasnya. Limit atas kelas diperoleh dengan menambahkan lebar kelas pada limit bawah.
Mendaftarkan semua limit kelas untuk setiap selang kelas
Menentukan frekuensi bagi masing-masing kelas
Menjumlahkan frekuensi dan memastikan apakah hasilnya sama dengan banyaknya total pengamatan serta membuat histogram (Lampiran 6).
Fekunditas
Fekunditas merupakan jumlah telur yang akan dikeluarkan oleh induk pada saat memijah. Fekunditas dihitung dengan menggunakan rumus berikut :
F =(G x X) Q x W
Keterangan :
F : Fekunditas (butir telur/kg bobot tubuh) G : Bobot telur individu/gonad (g)
X : Jumlah telur sampel (butir)
Gradien osmotik dihitung berdasarkan formula yang digunakan oleh Anggoro (1992). Pengukuran gradien osmotik disajikan dalam Lampiran 4. Gradien osmotik dinyatakan sebagai tingkat konsumsi oksogen (TKO).
TKO = Osmolaritas darah ikan (mOsm/LH2O) – Osmolaritas media
Tingkat Konsumsi Oksigen (TKO’s)
TKO’s diukur dengan menghitung rasio oksigen terlarut pada awal dan akhir penelitian per satuan waktu. Metode pengukuran dengan menggunakan akuarium bervolume 30x30x25 cm. Air diaerasi selama 1 hari sehingga jenuh oksigen. Sebelum ikan dimasukkan kedalam wadah, kandungan oksigen awal dihitung. Selanjutnya satu ekor ikan yang sebelumnya telah dipuasakan selama satu hari ditimbang kemudian dimasukkan ke dalam wadah. Setelah satu jam, dihitung lagi DO akhirnya. TKO’s diperoleh dengan menggunakan persamaan berikut (Pavlovskii 1964).
TKO’s = {(DO awal – DO akhir)/W x t} x V Keterangan:
TKO’s : Tingkat konsumsi oksigen (mg O2/gr tubuh/jam)
DO awal : Oksigen terlarut pada awal pengamatan (mg/L) DO akhir : Oksigen terlarut pada akhir pengamatan (mg/L) W : Berat ikan uji (gr)
T : Periode pengamatan (jam)
V : Volume air dalam respirometer (L)
Kadar Glukosa Darah
Pemeriksaan kadar glukosa darah digunakan sebagai indikator stress sekunder akibat perlakuan. Prosedur pengukuran kadar glukosa darah disajikan dalam Lampiran 5. Pengukuran dihitung dengan menggunakan rumus :
Retensi Protein (%)
Retensi protein dihitung berdasarkan persamaan (Takeuchi, 1998) RL =F−I
P x 100% Keterangan :
RP = Retensi protein (%)
F = Jumlah lemak tubuh pada awal pemeliharaan P = Jumlah protein yang dikonsumsi ikan
Retensi Lemak (%)
Retensi lemak dihitung berdasarkan persamaan (Takeuchi, 1998) RP =F−I
P x 100% Keterangan :
RL = Retensi lemak (%)
F = Jumlah lemak tubuh pada awal pemeliharaan P = Jumlah protein yang dikonsumsi ikan
Pertumbuhan ikan
Data laju pertumbuhan ikan uji diperoleh dengan melakukan pengambilan ikan uji awal dan akhir penelitian, kemudian ditimbang beratnya. Laju pertumbuhan ikan dianalisa dengan menggunakan rumus berikut :
Analisa Data
HASIL
Parameter Utama
Parameter utama hasil pengamatan pemberian hormon tiroksin terhadap reproduksi ikan nila yang dipelihara pada media bersalinitas terdiri dari hepato somatik indeks (HSI, %), diameter telur (DM, mm), gonad somatik indeks (GSI,%), dan fekunditas (FK, butir/ekor).
Hepato Somatik Indeks (HSI, %)
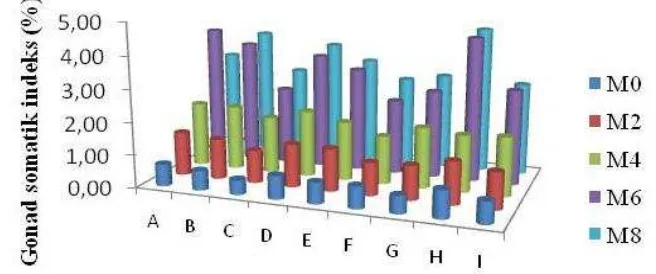
Perubahan nilai HSI terjadi seiring dengan terjadinya proses sintesis vitelogenin selama perkembangan gonad. Sintesis vitelogenin dalam tubuh ikan terjadi di hati, merupakan komponen utama dari oosit yang sedang tumbuh. Dari Gambar 5 dapat dilihat bahwa persentase nilai HSI terus meningkat dari minggu pertama hingga minggu ke-8 pemeliharaan. Sebagian besar perlakuan mencapai persentase nilai tertinggi (optimal) pada minggu ke-6, kemudian pada beberapa perlakuan mulai terlihat menurun pada minggu ke-8 pemeliharaan.
Keterangan: (A) Tiroksin 0 ng/g bobot tubuh, salinitas 0 ppt; (B) 0,10; (C) 0,20; (D) 50,0; (E) 50,10; (F) 50,20; (G) 100,0; (H) 100,10; (I) 100,20
Nilai HSI ikan nila meningkat seiring dengan peningkatan salinitas media pemeliharaan hingga 10 ppt, dan menurun apabila dipelihara pada salinitas 20 ppt (Tabel 3).
Tabel 3. Nilai rataan hepato somatik indeks (HSI, %) ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas
Tiroksin (T4)
(ng/g BT)
Salinitas (ppt)
0 10 20 X
0 0,47+0,106 1,54+0,053 1,33+0,093 1,11+0,084a 50 1,54+0,121 1,60+0,145 1,43+0,065 1,52+0,110a 100 1,47+0,109 1,61+0,226 1,38+0,085 1,49+0,140a
X 1,16+0,112b
1,58+0,141a
1,38+0,081b
Huruf yang berbeda pada kolom dan baris yang sama menunjukan adanya pengaruh perlakuan pada P<0,05. (BT= Bobot tubuh).
Persentase nilai HSI meningkat dengan pemberian tiroksin. Pada perlakuan C (T4 0 ng/g BT, salinitas 0 ppt) mengalami peningkatan dari
1,33+0,093 % menjadi 1,43+0,065 % dengan pemberian T4 50 ng/g BT
(Perlakuan F), namun secara statistik tidak memberikan perbedaan secara nyata antar perlakuan. Hal yang sama terjadi pada kombinasi atau interaksi antara T4
dengan salinitas (P>0,05). Pada Tabel 3 dapat dilihat bahwa nilai HSI ikan nila pada perlakuan C adalah 1,33+ 0,093 % meningkat menjadi 1,54+ 0,053 % pada perlakuan B (T4 0 ng/g BT, salinitas 10 ppt). Secara statistik menunjukkan bahwa
tiap perlakuan dari minggu ke-2 hingga minggu ke-8 terlihat pola yang terus meningkat. Sebagian besar perlakuan mencapai nilai maksimum pada minggu ke-6 dan ke-8 (Gambar ke-6).
Keterangan: (A) tiroksin 0 ng/g bobot tubuh, salinitas 0 ppt; (B) 0,10; (C) 0,20; (D) 50,0; (E) 50,10; (F) 50,20; (G) 100,0; (H) 100,10; (I) 100,20
Gambar 6. Perkembangan diameter telur (DM, mm) ikan nila merah (Oreochromis sp.) pada masing-masing perlakuan selama pemeliharaan (M0-M8= Minggu ke-0 sampai ke-8).
Tabel 4. Nilai rataan diameter telur (DM, mm) ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas
Tiroksin (T4)
(ng/g BT)
Salinitas (ppt)
0 10 20
0 1,51+0,030a 1,51+0,008a 1,47+0,094a 50 1,54+0,073a 1,52+0,018a 1,50+0,047a 100 1,52+0,014a 1,54+0,080a 1,48+0,024a Huruf yang berbeda pada kolom dan baris yang sama menunjukan adanya pengaruh perlakuan pada P<0,05
Gonad Somatik Indeks (GSI, %)
Keterangan: (A) tiroksin 0 ng/g bobot tubuh, salinitas 0 ppt; (B) 0,10; (C) 0,20; (D) 50,0; (E) 50,10; (F) 50,20; (G) 100,0; (H) 100,10; (I) 100,20.
Gambar 7. Perkembangan perkembangan nilai GSI ikan nila merah (Oreochromis sp.) pada masing-masing perlakuan selama pemeliharaan
Nilai GSI tertinggi diperoleh pada perlakuan H (T4 100 ng/g BT, salinitas
10 ppt) dengan nilai rataan optimal mencapai 2,44+0,181 % (Tabel 5). Hal ini menunjukkan bahwa pemberian tiroksin juga dapat meningkatkan nilai GSI, namun tidak berbeda secara statistik.
Tabel 5. Nilai rataan gonad somatik indeks (GSI, %) ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas
Tiroksin (T4)
(ng/g BT)
Salinitas (ppt)
0 10 20 X
0 3,23+0,856 2,46+0,451 1,59+0,193 2,43+1,500a 50 2,28+0,155 2,04+0,102 1,64+0,135 1,98+0,131a 100 1,81+0,181 2,44+0,181 1,87+0,234 2,04+0,305a
X 2,44+0,500a 1,98+0,131a 1,70+1,986b
Huruf yang berbeda pada kolom dan baris yang sama menunjukan adanya pengaruh perlakuan pada P<0,05. (BT= Bobot tubuh).
rataan nilai GSI 2,44+0,500%, tidak berbeda secara signifikan dengan nilai GSI ikan nila yang dipelihara pada salinitas 10 ppt. Pemberian dosis tiroksin meskipun memberikan pengaruh yang berbeda terhadap nilai GSI antar perlakuan namun secara statistik tidak menunjukkan perbedaan signifikan (Lampian 10).
Fekunditas (FK, butir/ekor)
Fekunditas merupakan jumlah telur yang akan dikeluarkan ikan pada saat memijah; dipengaruhi oleh berbagai faktor seperti nutrisi, hormon dan faktor lingkungan. Berdasarkan hasil statistik menunjukkan bahwa interaksi perlakuan tiroksin dengan salinitas media pemeliharaan terhadap nilai fekunditas adalah berbeda nyata antar perlakuan (Tabel 6).
Tabel 6. Nilai rataan fekunditas (FK, butir/ekor) ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas
Tiroksin (T4)
50 1295+55,1bb 1420+36,2ba 949+68,1bc 100 1156+33,7ab 1477+24,2aa 1137+61,9ac
Huruf yang berbeda pada kolom dan baris yang sama menunjukan adanya pengaruh interaksi perlakuan pada P<0,05. (BT = Bobot tubuh).
Pada Tabel 6 terlihat bahwa interaksi perlakuan kombinasi T4 100 ng/g BT
dan pemeliharaan pada media salinitas 10 ppt terhadap fekunditas rataan optimal 1477 butir/ekor (Perlakuan H) adalah sangat berbeda nyata (P<0,05). Nilai rataan tertinggi selanjutnya berada pada perlakuan G (T4 100 ng/g BT,salinitas10 ppt),
diikuti perlakuan E (50, 10), dan fekunditas terendah diperoleh pada perlakuan C (0,20).
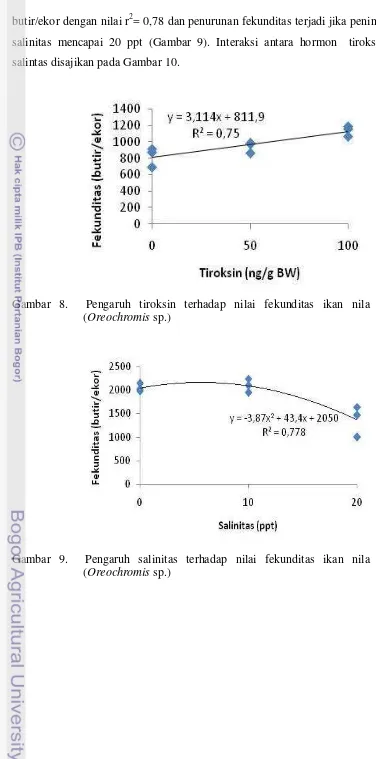
butir/ekor dengan nilai r2= 0,78 dan penurunan fekunditas terjadi jika peningkatan salinitas mencapai 20 ppt (Gambar 9). Interaksi antara hormon tiroksin dan salintas disajikan pada Gambar 10.
Gambar 8. Pengaruh tiroksin terhadap nilai fekunditas ikan nila merah (Oreochromis sp.)
Gambar 10. Pengaruh interaksi antara tiroksin dan salinitas terhadap fekunditas ikan nila merah (Oreochromis sp.)
Perkembangan Gonad Secara Histologi
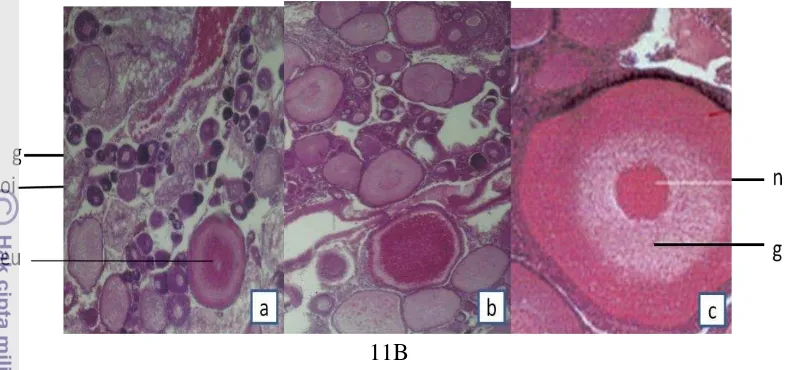
Perkembangan gonad ikan nila terdiri dari beberapa tingkat yang dapat didasarkan atas pengamatan secara makroskopis dan mikroskopis. Struktur histologi perkembangan gonad ikan nila selama pemeliharaan disajikan pada Gambar 11.
11B
Keterangan: a. Oosit TKG II, euvitelin (eu) dengan granular kuning telur b. Oosit TKG III, granular kuning telur (g) dan butir lemak (oi)
c. Oosit TKG IV, inti (n) mulai bergerak ke tepi sel
Gambar 11. Struktur histologi ikan nila merah pada perlakuan H (T4 100 ng/g BT,
salinitas 10 ppt, Gambar 11A) dan kontrol B (T4 0, 10 ppt, Gambar
11B). Klasifikasi berdasarkan Darwisto (2006).
Pada gambar 11Aa dan 11Ba terlihat dimana gonad ikan nila mencapai TKG II (sampling minggu ke-0 dan ke-2) yang ditandai dengan adanya euvitelin; terdapat pada bagian bawah khorion atau luar telur yang belum matang. Pada perlakuan B (Kontrol, T4 0 ng/g BT, salinitas 10 ppt) masih terlihat adanya oosit
kecil (TKG I) yang terdapat dalam lamella. Selanjutnya, pada Gambar 11Ab dan 11Bb tambak oosit mulai membesar dengan butiran lemak yang terlihat jelas serta granula kuning telur yang sudah terbentuk (TKG III); proses vitelogenesis. Pada Gambar 11Ac dan 11Bc telur memasuki tahap akhir (TKG IV); inti sel berada di tepi.
Parameter Pendukung
Parameter pendukung hasil pengamatan pemberian hormon tiroksin terhadap reproduksi ikan nila yang dipelihara pada media bersalinitas terdiri dari gradient osmotik (Osmol/kg), tingkat konsumsi oksigen (TKO’s, mgO2/g tubuh
Gradien Osmotik
Selisih antara nilai osmolaritas tubuh dan osmolaritas media pemeliharaan ikan dapat diartikan sebagai nilai gradien osmotik. Osmolaritas tubuh dan media ikan nila disajikan pada Gambar 12.
Keterangan: (A) tiroksin 0 ng/g bobot tubuh, salinitas 0 ppt; (B) 0,10; (C) 0,20; (D) 50,0; (E) 50,10; (F) 50,20; (G) 100,0; (H) 100,10; (I) 100,20.
Gambar 12. Gradien osmotik tubuh dan media pemeliharaan ikan nila merah (Oreochromis sp.) setelah pemberian hormon tiroksin dan dipelihara pada beberapa media salinitas
Pada gambar 12, dapat dilihat bahwa salinitas 10 ppt merupakan kondisi yang mendekati isoosmotik, dimana konsentrasi tubuh ikan nila mendekati konsentrasi media (Perlakuan B), dengan osmolaritas tubuh 0,365 Osmol/kg, meningkat menjadi 0,401 dengan pemberian tiroksin 100 ng/g bobot tubuh. Pada salinitas 20 ppt, osmolaritas tubuh lebih rendah dengan osmolaritas media (0,298: 0,505). Peningkatan osmolaritas tubuh hingga mencapai 0,401 dengan pemberian tiroksin 100 ng/g BT (Lampiran 7) .
Tingkat Konsmumsi Oksigen
Tabel 7. Nilai rataan tingkat konsumsi oksigen (TKO’s, mgO2/g tubuh/jam) ikan
0 0,300+0,0144 0,304+0,0281 0,280+0,0204 0,884+0,0629a 50 0,269+0,0139 0,312+0,0127 0,298+0,0250 0,879+0,0172a 100 0,288+0,1212 0,317+0,0248 0,300+0,0104 0,453+0,0521a
X 0,286+0,0186b 0,311+0,0218a 0,293+0,0186ab
Huruf yang berbeda pada kolom dan bari yang sama menunjukan adanya pengaruh perlakuan pada P<0,05. (BT= bobot tubuh).
Dari Tabel 7 terlihat bahwa tingkat konsumsi oksigen tidak dipengaruhi oleh dosis tiroksin yang diberikan pada induk ikan nila. Demikian pula tidak ada pengaruh terhadap tingkat konsumsi oksigen dari interaksi antar perlakuan tiroksin dan salinitas. Tingkat konsumsi oksigen ikan nila dipengaruhi oleh salinitas (P<0,05), dengan rataan tertinggi diperoleh pada ikan yang dipelihara pada salinitas 10 ppt yaitu 0,311+0,0218 mgO2/g tubuh/jam, diikuti salinitas 20
dan menurun pada salinitas 0 ppt.
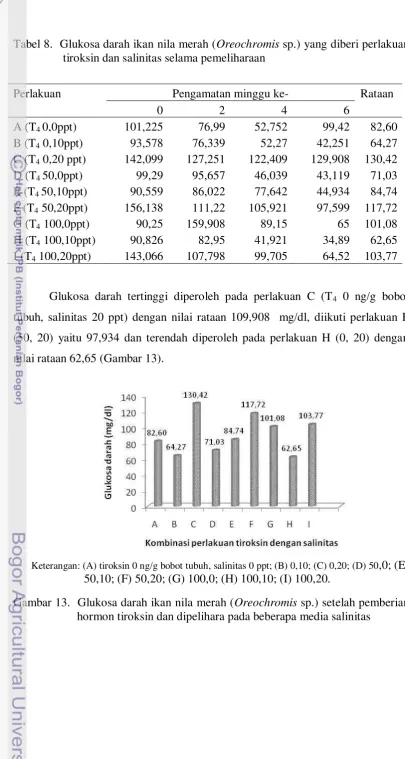
Glukosa Darah
Tabel 8. Glukosa darah ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas selama pemeliharaan
Glukosa darah tertinggi diperoleh pada perlakuan C (T4 0 ng/g bobot
tubuh, salinitas 20 ppt) dengan nilai rataan 109,908 mg/dl, diikuti perlakuan F (50, 20) yaitu 97,934 dan terendah diperoleh pada perlakuan H (0, 20) dengan nilai rataan 62,65 (Gambar 13).
Keterangan: (A) tiroksin 0 ng/g bobot tubuh, salinitas 0 ppt; (B) 0,10; (C) 0,20; (D) 50,0; (E) 50,10; (F) 50,20; (G) 100,0; (H) 100,10; (I) 100,20.
Gambar 13. Glukosa darah ikan nila merah (Oreochromis sp.) setelah pemberian hormon tiroksin dan dipelihara pada beberapa media salinitas
Perlakuan Pengamatan minggu ke- Rataan
0 2 4 6
A (T4 0,0ppt) 101,225 76,99 52,752 99,42 82,60
B (T4 0,10ppt) 93,578 76,339 52,27 42,251 64,27
C (T4 0,20 ppt) 142,099 127,251 122,409 129,908 130,42
D (T4 50,0ppt) 99,29 95,657 46,039 43,119 71,03
E (T4 50,10ppt) 90,559 86,022 77,642 44,934 84,74
F (T4 50,20ppt) 156,138 111,22 105,921 97,599 117,72
G (T4 100,0ppt) 90,25 159,908 89,15 65 101,08
H (T4 100,10ppt) 90,826 82,95 41,921 34,89 62,65
Retensi Protein
Retensi protein menunjukkan kemampuan ikan dalam menyimpan dan menggunakan protein pakan. Hasil statistik menunjukkan bahwa kombinasi atau interaksi antar perlakuan tiroksin dengan salinitas memberikan pengaruh secara signifikan terhadap nilai retensi protein (P<0,05). Kombinasi T4 100 ng/g bobot
tubuh dengan media salinitas 10 ppt (Perlakuan H) merupakan perlakuan yang memberikan nilai retensi protein terbaik yaitu 19,50+0,558 % (Tabel 9; Gambar 16).
Tabel 9. Nilai rataan retensi protein (RP, %) ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas
Tiroksin (ng/g bobot tubuh)
Salinitas (ppt)
0 10 20
0 17,16+0,056ca 17,22+0,021ca 16,99+0,099cb 50 18,26+0,558 ba 18,28+0,615 ba 17,19+0,106bb 100 19,01+0,198aa 19,50+0,558aa 17,82+0,184Ab Huruf yang berbeda pada kolom dan baris yang sama menunjukan adanya pengaruh interaksi perlakuan pada P<0,05
Pengaruh hormon tiroksin terhadap nilai retensi protein ikan nila memberi kurva respon linier dengan persamaan y = 0,107x+17,07 dengan nilar r2 0,99, Artinya nilai retensi protein meningkat seiring dengan meningkatnya konsentrasi tiroksin yang diberikan (Gambar 14).
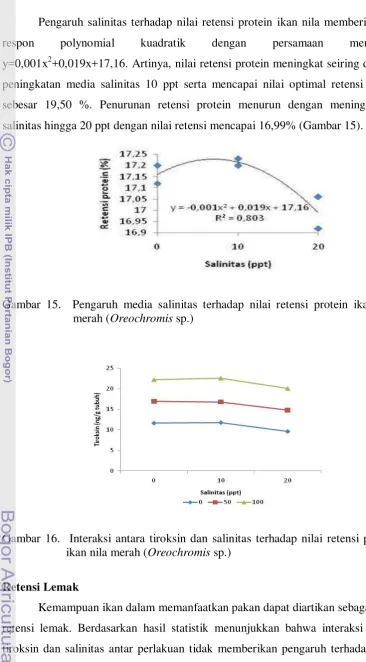
Pengaruh salinitas terhadap nilai retensi protein ikan nila memberi kurva respon polynomial kuadratik dengan persamaan mengikuti y=0,001x2+0,019x+17,16. Artinya, nilai retensi protein meningkat seiring dengan peningkatan media salinitas 10 ppt serta mencapai nilai optimal retensi lemak sebesar 19,50 %. Penurunan retensi protein menurun dengan meningkatnya salinitas hingga 20 ppt dengan nilai retensi mencapai 16,99% (Gambar 15).
Gambar 15. Pengaruh media salinitas terhadap nilai retensi protein ikan nila merah (Oreochromis sp.)
Gambar 16. Interaksi antara tiroksin dan salinitas terhadap nilai retensi protein ikan nila merah (Oreochromis sp.)
Retensi Lemak
lingkungan (salinitas), tetapi berbeda nyata antar perlakuan yang diberi tiroksin (Tabel 10).
Tabel 10. Nilai rataan retensi lemak (RL, %) ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas
Tiroksin (T4)
(ng/g BT)
Salinitas
0 10 20 X
0 11,66+0,869 11,79+1,301 9,64+0,743 11,67c 50 16,99+1,808 16,85+0,869 14,85+0,502 16,83c 100 22,22+3,359 22,57+2,489 20,06+0,183 21,62a
X 16,96+2,012a 17,07+1,553a 14,85+0,476a
Huruf yang berbeda pada kolom dan baris yang sama menunjukan adanya pengaruh perlakuan pada P<0,05. (BT= Bobot tubuh).
Pemberian tiroksin secara signifikan memberikan pengaruh yang nyata dengan mengikuti pola semakin meningkat retensi lemak ikan dengan semakin tingginya konsentrasi dosis tiroksin yang diberikan. Retensi lemak tertinggi diperoleh pada ikan yang diberikan tiroksin 10 ng/g BT dengan persentase nilai mencapai 21,62 %, diikuti perlakuan dengan pemberian tiroksin 50. Nilai retensi terendah diperoleh pada ikan yang tanpa diberikan tiroksin dengan nilai rataan sebesar 11, 67 %.
Pertumbuhan Harian (PH, %)
Selama 56 hari perlakuan pemberian tiroksin dan pemeliharaan pada beberapa media salinitas tidak memberikan pengaruh terhadap pertumbuhan harian ikan nila (Oreochromis sp.) (Tabel 11)
Tabel 11. Nilai rataan pertumbuhan harian ( %) ikan nila merah (Oreochromis sp.) yang diberi perlakuan tiroksin dan salinitas
Tiroksin (T4)
(ng/g BT)
Salinitas
0 10 20
Pertumbuhan harian tertinggi diperoleh pada perlakuan H (pemberian tiroksin 100 ngT4 dan pemeliharaan pada salinitas 10 ppt) dengan nilai
pertumbuhan 0,79% dan terendah diperoleh pada perlakuan C (pemeliharaan salinitas 20 ppt tanpa pemberian tiroksin) (Gambar 17).
Keterangan: (A) Tiroksin 0 ng/g bobot tubuh, salinitas 0 ppt; (B) 0,10; (C) 0,20; (D) 50,0; (E) 50,10; (F) 50,20; (G) 100,0; (H) 100,10; (I) 100,20
PEMBAHASAN
Selama proses reproduksi, sebagian besar aktivitas tertuju pada perkembangan gonad sehingga menyebabkan terjadinya perubahan pada gonad itu sendiri. Hasil pengamatan parameter utama menunjukkan bahwa perbedaan salinitas media dan dosis tiroksin dapat merespon kinerja reproduksi ikan nila merah (Oreochromis sp.). Kombinasi antara tiroksin 100 ng/g bobot tubuh dengan pemeliharaan pada salinitas 10 ppt (perlakuan H) memberikan respon terbaik terhadap nilai fekunditas dengan nilai rataan optimal 1447 butir/ekor, diikuti oleh perlakuan E (T4 0, salinitas 10). Salinitas terendah diperoleh pada perlakuan C (T4
0, salinitas 20 ppt) (Tabel 6).
dalam plasma induk akan ditransfer ke dalam telur dan kemudiat ke dalam kantung kuning telur (yolksac) larva.
Perkembangan gonad terjadi secara makroskopik dan mikroskopik (histologi). Histologi gonad menunjukkan tingkat kematangan gonad dari ikan nila. Pada Gambar 11Aa dan 11Ba merupakan histologi awal sebelum dimulai, yaitu pada TKG II. Pada Gambar tersebut tampak kondisi oosit yang tidak seragam, karena ikan nila termasuk partial spawner yang mengeluarkan telur tidak sekaligus melainkan secara bertahap. Selanjutnya pada gambar 11Ab dan 11Bbb, terlihat jelas oosit mulai tumbuh berkembang dan tampak diameter mulai membesar (TKG III). Pada tahap ini mulai terjadi proses vitelogenesis atau fase akumulasi kuning telur. Fase pembentukan kuning telur dimulai sejak terjadinya penumpukan bahan-bahan kuning telur dalam sel telur dan berakhir setelah sel telur mencapai ukuran tertentu. Pada gambar 11Ac dan 11Bc tampak telur memasuki tahap akhir yang ditandai dengan posisi inti sel yang berada di tepi (TKG IV), yang berarti bahwa ikan siap dipijahkan. Induk yang siap dipijahkan adalah induk yang telah melewati fase pembentukan kuning telur dan masuk ke tahap dorman. Bila mana kondisi lingkungan tidak cocok dan rangsangan tidak tersedia maka telur dorman tersebut akan mengalami degradasi (rusak) lalu diserap kembali oleh lapisan folikel melalui atresia. Matty (1985) menyatakan bahwa penyerapan vitelogenin oleh oosit dibantu oleh hormon gonadotropin dan tiroksin.
Pengaruh tiroksin terhadap pengaturan gradien osmotik tubuh dan media terjadi melalui mekanisme pertukaran ion dalam sel klorida epitel insang. Tiroksin mempengaruhi aktivitas enzim NA+/K+ATP-ase sehingga terjadi peningkatan aktivitas natrium akibat meningkatnya konsumsi oksigen. Dari hasil penelitian (Gambar 11) terlihat bahwa ikan yang dipelihara pada media air tawar, pemberian tiroksin rendah (50 ng/gr bobot tubuh) tidak berpengaruh terhadap pengaturan osmotik tubuh. Hal yang berbeda terjadi pada ikan yang dipelihara pada salinitas 10 dan 20 ppt. Semakin tinggi dosis yang diberikan, ion atau konsentrasi tubuh ikan semakin mendekati konsentrasi media. Pemberian hormon tiroid (T3) dan T4
20, 40 dan 80 ng/gr bobot tubuh mampu meningkatkan aktivitas enzim Na+/K+ATP-ase tetapi menurun pada dosis >120 ng/gr bobot tubuh (Peter et al. 2000). Aktivitas Na+/K+ATP-ase lebih berperan pada ikan yang diadaptasikan ke air laut. Pendapat ini sesuai dengan penelitian Turned and Bagnara (1976), pada usus ikan yang dipelihara di air tawar sedikit peran Na+K+ATP-ase untuk aktivitas transport natrium ke dalam darah dari lumen usus, tetapi aktivitas Na+K+ATP-ase berperan pada ikan yang diadaptasikan ke air laut. Pada ikan air laut, air yang ditelan diangkut secara pasif selanjutnya diikuti dengan pengambilan secara aktif ion-ion oleh usus. Ion masuk ke dalam sel diperantarai oleh reseptor hormon tiroid yang terdapat pada inti sel. Hormon tiroid dapat menyebabkan kebocoran pada membran sel sehingga memudahkan masuknya Na/K+APT-ase yang menyebabkan meningkatnya transport ion ke dalam tubuh.
Dari Gambar 12 tampak bahwa media pemeliharaan salinitas 10 ppt adalah media yang cocok untuk pemeliharaan ikan nila. Hal ini menunjukkan bahwa salinitas 10 ppt merupakan media yang mendekati kondisi isoosmotik untuk kehidupan ikan nila sehingga proses fisiologis tubuh dapat berjalan dengan normal. Penambahan tiroksin berpengaruh terhadap pengaturan konsentrasi ion tubuh oleh ikan. Hal ini terlihat dari kondisi osmolaritas tubuh yang semakin mendekati kondisi osmolaritas media. Hal yang sama juga terjadi pada ikan dengan penambahan tiroksin pada media bersalinitas 20 ppt. Pada salinitas 20 ppt tanpa pemberian hormon tiroksin (Perlakuan C), tingkat kerja osmotik yang rendah yaitu 0,298 Osmol/L H2O, sedangkan osmolaritas medianya tinggi yaitu sebesar 0,505 Osmol/L. Pemberian tiroksin 100 ng/gr bobot tubuh mampu meningkatkan kerja osmotik hingga mencapai 0,401 Osmol/kg atau keadaan mendekati kisaran isoosmotik. Berdasarkan data hasil pengamatan (Tabel 6), fekunditas meningkat jika ikan diberikan tiroksin 100 ng/g bobot tubuh dibandingkan dengan fekunditas ikan yang dipelihara pada media air tawar. Ikan yang dipelihara dalam kondisi isoosmotik akan diuntungkan karena adanya penghematan energi sehingga kebutuhan energi tersedia untuk pertumbuhan dan reproduksi meningkat (Baldisserotto et al. 2007). Saoud et a.l (2007) mengemukakan bahwa aktivitas tertinggi Na+K+-ATPase oleh insang diperoleh pada ikan yang dipelihara pada media salinitas 10 ppt dan secara signifikan menurun pada pemeliharaan salinitas 35 ppt.
oksigen, gradien osmotik juga turut berpengaruh terhadap kadar glukosa darah. Okoth et al. (2011) menyatakan bahwa penggunaan gaeram dapur (Nacl) dapat mengurangi kondisi stress pada ikan. Namun pada tingkat tertentu dapat meningkatkan kadar glukosa darah. Perubahan kadar glukosa darah selama penelitian terus terjadi (Tabel 8). Pada minggu kedua setelah perlakuan penurunan kadar glukosa mulai terlihat pada masing-masing perlakuan. Penurunan tingkat stres kemungkinan disebabkan oleh beberapa faktor, salah satunya adalah karena hewan telah mengalami proses adaptasi sehingga tidak lagi merasakan adanya stres. Adaptasi tersebut terjadi karena ikan telah mengalami suatu proses tanggapan fisiologi akibat stres yang berulang (Clark et al. 1977). Stres juga menurunkan kemampuan imunitas yang akan berdampak buruk pada pertumbuhan dan reproduksi.
Peningkatan salinitas hingga 20 ppt menyebabkan kadar glukosa darah meningkat. Tingginya kadar glukosa darah mengindikasikan tingginya tingkat stres akibat meningkatnya salinitas media. Pada umumnya stres dirangsang oleh sistem neuroendokrin secara bertingkat dengan melibatkan sekresi katekolamin (Zairin 2003). Pendapat yang sama dikemukakan oleh Porchas et al (2009), stres melibatkan sistem endokrin dalam pengaturan sistem tubuh oleh hipotalamus. Pada kondisi stres sel kromafin akan melepaskan hormon katekolamin dan ACTH yang merupakan hormon stres yang berhubungan dengan mobilisasi kortisol dan peningkatan glukosa darah. Respon stres sekunder selain meningkatkan kadar glukosa darah, dapat menghambat sintesis protein, mempengaruhi keseimbangan hidromineral yang menyebabkan kelebihan air pada ikan yang hidup di air tawar dan kehilangan air pada ikan yang hidup di air laut, mengganggu sistem imunitas, berdampak buruk terhadap pertumbuhan dan reproduksi ikan (Mezeaud dan Mazeaud 1981). Peningkatan kadar glukosa darah yang cepat dan tetap berada pada tingkat yang tinggi akan diikuti oleh kematian ikan (Brown 1993).