EKSPRESI GEN G
α
dan PEROKSIDASE PADA KEDELAI
KULTIVAR LUMUT YANG MENDAPAT CEKAMAN
ALUMINIUM
RIZKI AMELIA LUBIS
A351030211
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
Ekspresi Gen Heterotrimerik Gα dan Peroksidase pada Tanaman Kedelai Kultivar Lumut Yang Mendapat Cekaman Aluminium
Adalah benar merupakan hasil karya saya sendiri yang diarahkan oleh Komisi Pembimbing dan belum pernah dipublikasikan untuk kepentingan lain. Semua sumber data dan informasi yang digunakan telah dinyatakan secara benar dan dapat diperiksa kebenarannya.
Bogor, Februari 2008
RINGKASAN
RIZKI AMELIA LUBIS. Ekspresi Gen Heterotrimerik Gα dan PER pada Kedelai Kultivar Lumut yang Mendapat Cekaman Aluminium. Dibimbing oleh DIDY SOPANDIE, SUHARSONO dan UTUT WIDYASTUTI SUHARSONO
Kedelai (Glycine max (L.) Merr.) merupakan salah satu tanaman pangan yang sangat penting di Indonesia. Biji kedelai dapat digunakan sebagai sumber protein nabati dari bahan pangan dan pakan. Produksi kedelai dari tahun ke tahun cenderung meningkat, namun belum dapat mengimbangi laju peningkatan permintaan dalam negeri, sehingga impor kedelai meningkat setiap tahun. Salah satu faktor penyebab rendahnya produktivitas kedelai di Indonesia adalah terbatasnya lahan tanam di pulau Jawa. Untuk mengatasi masalah ini adalah dengan melakukan pembukaan lahan baru di pulau Jawa, sehingga akan terjadi pergeseran penggunaan lahan tanam dari lahan subur ke lahan marginal. Sebagian besar lahan marginal di Indonesia berupa lahan pasang surut, lahan salin, lahan gambut dan lahan podzolik merah kuning. Lahan Podzolik Merah Kuning memiliki pH rendah dan kandungan aluminium yang cukup tinggi dan miskin kandungan zat hara tanah seperti Mg, Ca, dan P.
Aluminium diketahui sebagai salah satu faktor utama penyebab keracunan bagi tanaman yang tumbuh di tanah yang bersifat masam, dengan potensi luasan di dunia sekitar 1 × 109 hektar, mencakup daerah tropis dan subtropis (Van Wambeke 1976; Haug 1984; Moller et al. 1984). Al3+ merupakan bentuk paling toksik bagi tanaman dengan gejala umumnya adalah pertumbuhan akar terhambat, akar menjadi pendek dan menebal khususnya akar utama.
Usaha peningkatan produksi kedelai pada lahan masam telah banyak dilakukan, diantaranya dengan pengapuran (Widjaja Adhi1985). Walaupun tidak dipungkiri bahwa pengapuran mampu memperbaiki kondisi tanah masam, namun dalam pelaksanaannya banyak ditemui hambatan seperti masalah distribusi kapur dan aplikasinya di lapang. Penggunaan kedelai toleran pada lahan asam dengan kelarutan aluminium tinggi merupakan salah satu alternatif dalam peningkatan produksi kedelai.
Protein G merupakan salah satu protein penting yang terlibat dalam penyinalan bagi sel dalam menanggapi perubahan lingkungan. Komponen jalur ini terdiri dari reseptor terkait protein G yang berada pada permukaan membran dan protein heterotrimerik G yang mentransduksi informasi dari reseptor protein G yang teraktifasi ke efektor down stream seperti kanal ion, phospholipase C. Cekaman Al diketahui menginduksi beberapa gen yang juga berhubungan dengan sistem pertahanan terhadap pathogen seperti peroksidase dan GST.
melalui transkriptase balik dengan menggunakan total RNA sebagai template dan oligo dT sebagai primer.
Analisis ekspresi gen dilakukan pada tanaman kedelai yang mendapat perlakuan pH dan perlakuan Al secara terpisah. Perlakuan pH yang diberikan adalah pH 4 dan pH 6 sebagai kontrol. Percobaan dilakukan dengan dua ulangan.
Analisis ekspresi gen Gα dan gen PER dilakukan dengan cara mengamplifikasi gen spesifik tersebut dengan menggunakan cDNA total sebagai cetakannya. Langkah dalam mencampur bahan untuk PCR gen Gα dan gen PER sama dengan PCR aktin, yang membedakan hanya primer yang disesuaikan dengan gen yang dianalisis. Kondisi PCR gen Gα sama dengan kondisi PCR aktin, sedangkan untuk kondisi PCR gen PER yaitu Pra-PCR 94°C 2 menit, denaturasi 92°C selama 30 detik, annealing/penempelan 55°C selama 30 detik, ekstensi 75°C selama 1 menit, siklus diulang sebanya 30 kali, dan pasca PCR 72°C selama 5 menit. Analisis ekspresi dilakukan dengan membandingkan intensitas cahaya pita hasil PCR gen Gα dan PER terhadap kontrol aktin dengan menggunakan perangkat lunak Digi Doc-it.
Hasil penelitian ini menunjukkan bahwa ekspresi gen Gα dan Peroksidase tidak dinduksi oleh cekaman Al, namun meskipun sangat kecil ekspresi gen Peroksidase diinduksi oleh perlakuan pH 4.
ABSTRAK
RIZKI AMELIA LUBIS, The Expression of Gα and Peroksidase Genes in Lumut Cultivar of Soybean Under Aluminium Stress. Under direction of DIDY SOPANDIE, SUHARSONO and UTUT WIDYASTUTI SUHARSONO
Gα protein interacts with molecule reseptor located in the plasma membrane and involves in regulation of various signal transduction. Activity of Peroksidase in Glycine max roots was increasedduring Al treatment. We supposed that the two genes involved in the plant tolerance to Al stress. The objective of this research is to study the expression of Gα and PER genes in Lumut cultivar of soybean under aluminium stress. Stress condition was carried out in a liquid culturesystem. The plant was stressed by planting in the pH 4 and pH 4+1.6 mM. The plants cultivated in pH 6 were used as a control. The experiment was carried out for 3 X 24 hours. The expression of gene was analyzed in the primary root tips at 0, 8, 24, 48 and 72 hours after the treatment. We had successfully isolated total RNA from the root tips. Total cDNA was successfully synthesized by reverse transcription method by using total RNA as a template and oligo dT as the primer. The gene expression analysis was based on the PCR by using specific primer and total cDNA as template. This experiment showed that the expression of Gα and Peroksidase genes were not induced by Al stress, although its very small expression of Peroksidase genes was induced by pH 4.
@ Hak Cipta milik IPB, tahun 2008 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
EKSPRESI GEN G
α
dan PEROKSIDASE PADA KEDELAI
KULTIVAR LUMUT YANG MENDAPAT CEKAMAN
ALUMINIUM
RIZKI AMELIA LUBIS
A351030211
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Ekspresi Gen Gα dan Peroksidase Kedelai Kultivar Lumut yang Mendapat Cekaman Aluminium
Nama Mahasiswa : Rizki Amelia Lubis NIM : A351030211
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Didy Sopandie, M.Agr Ketua
Dr. Ir. Suharsono, DEA Dr. Utut W. Suharsono, MS Anggota Anggota
Diketahui
Ketua Program Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil Anwar Notodiputro, M.Sc
PRAKATA
Alhamdulillah, segala puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan karunia, rahmat dan kemudahan sehingga penelitian dan penulisan tesis ini dapat terselesaikan. Tesis ini ditulis berdasarkan penelitian yang selama dua tahun ini penulis lakukan di laboratorium Biologi Molekuler dan Seluler Tanaman, Rumah Kaca dan Laboratorium Biorin Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, IPB, Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Prof. Dr. Ir. Didy Sopandie, M.Agr, selaku ketua komisi pembimbing, Bapak Dr. Ir. Suharsono, DEA dan Ibu Dr. Ir. Utut W. Suharsono, MS selaku anggota komisi pembimbing, atas segala jerih payah dan waktu yang telah disediakan dalam memberi bimbingan, serta arahan mulai dari pelaksanaan penelitian hingga penulisan hasil penelitian ini.
Ucapan terima kasih juga penulis sampaikan kepada Rektor IPB, Direktur Sekolah Pascasarjana IPB, Ketua Program studi Agronomi dan Bioteknologi SPs-IPB atas kesempatan yang diberikan kepada penulis untuk mengikuti pendidikan Pascasarjana di IPB, Bogor. Terima kasih juga ditujukan kepada proyek Hibah Bersaing Perguruan Tinggi XII Ditjen Dikti Depdiknas a.n. Dr. Utut Widyastuti dan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB, atas bantuannya dalam menyediakan biaya penelitian dan fasilitas penelitian.
Penulis mengucapkan terima kasih secara khusus untuk orang tua tercinta ayahanda H. Ichwan Lubis (Alm) dan Ibunda Hj. Yusrita Nst, yang tanpa mengenal lelah selalu memanjatkan doa untuk keberhasilan penulis. Kepada Keluarga H. Lahum Lubis, SH. MM., Kakak-kakak, Abang, adikku, terima kasih atas segala perhatian, kasih sayang, bantuan serta dorongan semangat yang diberikan kepada penulis selama ini.
Hakim, Bapak R .Atok H, Bapak M. Iqbal Z, Team Business Development serta rekan-rekan PT. Bakrie Sumatera Plantations, Tbk dan yang lain-lain yang tidak dapat penulis sebutkan satu persatu, penulis mengucapkan terima kasih yang sebesar-besarnya atas pengertian, dukungan serta kerjasamanya selama ini.
Akhirnya, penulis berharap semoga tulisan ini bermanfaat dan dapat memberikan sumbangan bagi perkembangan pertanian kedelai di Indonesia
Bogor, Februari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 28 Maret 1978 dari ayah H. Ichwan Lubis (Alm) dan Hj. Yusrita Nasution. Penulis merupakan putri kelima dari enam bersaudara.
DAFTAR ISI Toksisitas dan Toleransi Aluminium pada Tanaman ... 5
Toksisitas Al ... 5
Toleransi Al ... 6
Protein heterotrimerik Gα... 7
Gen yang berhubungan dengan toleransi Al... 10
BAHAN DAN METODE Tempat dan Waktu... 13
Bahan ... 13
Metode Penelitian ... 13
Perlakuan cekaman Al pada kultur cair ... 13
Isolasi RNA total ... 15
Sintesis cDNA Total ... 16
Ekpresi gen Gα dan gen PER ... 16
HASIL DAN PEMBAHASAN Pengaruh pH terhadap reduksi pertambahan panjang akar... 18
Pengaruh Al terhadap reduksi pertambahan panjang akar... 18
Isolasi RNA Total ... 20
Sintesis cDNA Total ... 20
Pengaruh Cekaman Aluminium Terhadap Ekspresi gen Heterotri- merik Gα... 21
Pengaruh Cekaman pH dan Aluminium Terhadap Ekspresi Gen Peroksidase... 23
SIMPULAN ... 25
DAFTAR PUSTAKA ... 26
DAFTAR TABEL
No. Judul Halaman 1. Reduksi panjang akar oleh cekaman pH rendah ... 18 2. Reduksi perpanjangan akar tanaman kedelai kultivar Lumut yang
mendapat perlakuan Al ... 19 3. Ekspresi baku gen Gα pada tanaman kedelai kultivar Lumut dengan
perlakuan pH ... 22 4. Ekspresi baku gen Gα pada tanaman kedelai kultivar Lumut dengan
perlakuan Al... 22 5. Ekspresi baku gen per pada tanaman kedelai kultivar Lumut dengan
perlakuan Al... 23 6. Ekspresi baku gen per pada tanaman kedelai kultivar Lumut dengan
DAFTAR GAMBAR
No. Judul Halaman
1. RNA total akar kedelai cultivar lumut pada perlakuan pH 6, pH 4
dan pH 4 dengan cekaman 1.6 mM Al ... 20 2. Hasil PCR Aktin yang berasal dari cetakan cDNA murni ... 21 3. Hasil PCR Aktin yang cDNAnya terkontaminasi DNA genoma ... 21 4. Ekspresi gen Gα dan aktin pada perlakuan pH 6, pH 4 dan
pH 4+1.6 mM Al... 21 5. Ekspresi gen PER pada tanaman kedelai yang ditanam pada pH 6, pH 4 dan pH 4+1.6 mM Al ... 23
I. PENDAHULUAN
Latar Belakang
Kedelai (Glycine max (L.) Merr.) merupakan salah satu tanaman pangan yang sangat penting di Indonesia. Biji kedelai dapat digunakan sebagai sumber protein nabati dari bahan pangan dan pakan. Produksi kedelai dari tahun ke tahun cenderung meningkat, namun belum dapat mengimbangi laju peningkatan permintaan dalam negeri, sehingga import kedelai meningkat setiap tahun.
Salah satu faktor penyebab rendahnya produktivitas kedelai di Indonesia adalah terbatasnya lahan tanam di pulau Jawa. Untuk mengatasi masalah ini adalah dengan melakukan pembukaan lahan baru di luar pulau Jawa, sehingga akan terjadi pergeseran penggunaan lahan tanam dari lahan subur ke lahan marginal. Sebagian besar lahan marginal di Indonesia berupa lahan pasang surut, lahan salin, lahan gambut dan lahan podzolik merah kuning. Lahan Podzolik Merah Kuning memiliki pH rendah dan kandungan aluminium yang cukup tinggi dan miskin kandungan zat hara tanah seperti Mg, Ca dan P. Jenis tanah tersebut luasnya mencapai 47,6 juta hektar, dan banyak digunakan untuk program ekstensifikasi tanaman pangan termasuk didalamnya tanaman kedelai (Notohadiprawiro 1983; Syarifuddin & Abdurahman 1993).
Aluminium diketahui sebagai salah satu faktor utama penyebab keracunan bagi tanaman yang tumbuh di tanah yang bersifat masam, dengan potensi luasan di dunia sekitar 1 X 109 hektar, mencakup daerah tropis dan sub tropis (Van Wambeke 1976; Haug 1984; Moller et al. 1984). Al3+ merupakan bentuk paling toksik bagi tanaman dengan gejala umumnya adalah pertumbuhan akar terhambat, akar menjadi pendek dan menebal khususnya akar utama (Ryan et al. 1993, 1994; Sasaki et al. 1992, 1994; Prihardi et al. 1995, Kochian 1995). Hal ini karena proses pembelahan dan pemanjangan sel terganggu. Akibatnya, pertumbuhan dan perkembangan akar terhambat, dan dalam jangka panjang akan mempengaruhi pertumbuhan dan perkembangan bagian tajuk tanaman (Yamamoto et al. 1992).
aplikasinya di lapang. Maschner (1986) menyatakan bahwa toleransi yang tinggi terhadap aluminium merupakan faktor kunci adaptasi tanaman pada tanah dengan pH 5.0. Tanaman-tanaman yang toleran terhadap tanah masam mampu meningkatkan pH di daerah perakaran (Galvez & Clark 1991), mampu menyerap nitrat yang lebih besar dan mampu membentuk komplek Al dengan asam organik (Christian-Waniger et al. 1992).
Penggunaan kedelai toleran pada lahan asam dengan kelarutan aluminium tinggi merupakan salah satu alternatif dalam peningkatan produksi kedelai. Penelitian untuk mendapatkan kultivar kedelai yang toleran terhadap tanah asam (Jusuf et al. 1999; Suharsono et al. 2003; 2006; 2007), serta isolasi gen-gen yang diduga diinduksi oleh cekaman Al melalui penapisan differensial terhadap mRNA telah dilakukan (Anwar et al. 2000). Penapisan differensial terhadap mRNA telah mendapatkan enam klon cDNA tanaman kedelai kultivar Lumut yang peka terhadap Al dan satu klon cDNA dari kultivar Slamet yang toleran Al (Anwar et al. 2000; Yuniati 2000). Pembentukan pustaka genom kedelai dari kultivar Slamet (Suharsono 2002) dan kultivar Lumut (Suharsono 2007) telah dilakukan. Penelitian Sopandie et al. (1996) menunjukan bahwa genotipe kedelai yang toleran Al mengakumulasi lebih sedikit Al dalam akar, dan mensintesis lebih banyak asam organik dibandingkan dengan genotipe kedelai yang peka. Mekanisme signal transduksi di dalam sistem ketahanan tanaman terhadap cekaman Al belum diketahui dengan jelas.
Protein G merupakan salah satu protein penting yang terlibat dalam pensinyalan bagi sel dalam menanggapi perubahan lingkungan. Komponen jalur ini terdiri dari reseptor terkait protein G yang berada pada permukaan membran dan protein heterotrimerik G yang mentransduksi informasi dari reseptor protein G yang teraktifasi ke efektor down stream seperti kanal ion, phospholipase C (Krauss 2001). Protein G terlibat dalam jalur sinyal transduksi phosphoinositide pada mamalia dengan melibatkan pemecahan lipid membran plasma phosphatidylinositol 4,5-biphosphate (PtdInsP2) oleh phospholipase C (PLC) sehingga melepaskan inositol
1,4,5-triphosphate (Ins[1,4,5]P3) ke sitoplasma dan DAG (Diacyl Glycerol) ke membran.
Selanjutnya Ins[1,4,5]P3 berasosiasi dengan reseptor membran (kanal Ca2+) untuk
mengeluarkan Ca2+ ke sitoplasma sehingga meningkatkan konsentrasi Ca2+ sitoplasma dan DAG berasosiasi dengan protein kinase C (Krauss 2001; Cote & Crain 1993).
Al3+ dapat merusak metabolisme yang bergantung pada Ca dengan menjaga konsentrasi Ca2+ sitoplasma diatas normal atau menghambat transien Ca2+ yang terjadi secara bersama-sama (Delhaize & Ryan 1995). Menurut Yamamoto et al. (1997) cekaman Al3+ dapat meningkatkan peroksidase phospholipid dan protein yang ada di membran sel sehingga diduga Al dapat menyebabkan perubahan dalam proses pemecahan phosphatidyl inositol 4,5-biphosphate (PIP2) menjadi DAG dan inositol
1,4,5-triphosphate (IP3). Jones & Kochian (1995) menyatakan bahwa cekaman Al
menghambat aktivitas PLC sehingga menghambat pemecahan PIP2 menjadi IP3 yang
akhirnya mempengaruhi influk ion Ca2+ ke dalam sel. Jalur sinyal transduksi berakhir ke pengaturan satu atau lebih aktivitas gen atau pun pengatifan gen spesifik untuk menanggapi sinyal dari luar.
Cekaman Al diketahui menginduksi beberapa gen yang juga berhubungan
dengan sistem pertahanan terhadap pathogen seperti peroksidase dan GST (Richard et al 1998). Ekspresi gen-gen ini juga dipengaruhi oleh aktivitas species
oksigen aktif (ROS) H2O2 yang pertama terjadi pada tanaman pada saat tanaman
mengalami cekaman. H2O2 juga diketahui meningkat akibat aktivitas protein G subunit
alpha pada tanaman kedelai (Legendre et al. 1992).
Oleh karena itu mekanisme sistem pertahanan tanaman terhadap cekaman Al dengan melihat kemungkinan keterlibatan gen penyandi peroksidase (per) dan protein G subunit α (Gα ) sangat penting untuk diketahui.
Tujuan Penelitian
Penelitian ini bertujuan untuk memperoleh informasi tentang ekspresi gen Gα dan PER pada kedelai kultivar Lumut yang mendapat cekaman aluminium.
Hipotesis
Ekspresi Gα dan PER pada kedelai kultivar Lumut meningkat jika mendapat cekaman Al dan pH 4
II. TINJAUAN PUSTAKA Toksisitas dan Toleransi Aluminium pada Tanaman
Toksisitas Al. Aluminium bukanlah unsur esensial bagi pertumbuhan tanaman. Saat kelarutan aluminium meningkat seiring dengan turunnya pH hingga di bawah 5 unsur ini menjadi penting untuk diperhatikan karena menjadi toksik bagi tanaman. Bentuk-bentuk aluminium di dalam tanah dapat berupa ion trivalen yaitu Al(H2O)63+
atau disebut juga Al3+, bentuk hidroksida seperti Al(OH)+2, Al(OH)2+, Al(OH)3,
Al(OH)4-, atau berasosiasi dengan berbagai senyawa organik dan anorganik seperti
PO4-3, SO4-2,F-, asam-asam organik, protein dan lipid (Delhaize & Ryan 1995). Al3+
merupakan bentuk yang paling toksik dan mendominasi di lahan asam di bawah pH 4.5 (Matsumoto 2000).
Tanah masam sendiri terjadi karena adanya pencucian kation-kation basa dari tanah yang dipicu oleh praktek-praktek pertanian dan adanya hujan asam (Kennedy 1992). Oleh karena itu, untuk melihat pengaruh fitotoksik Al sebaiknya digunakan Al dalam bentuk Al3+, pH media 4 dan kekuatan ioniknya rendah (Kinraide 1991)
Aluminium terlarut bereaksi dengan dinding dan membran sel akar serta membatasi perluasan dinding sel sehingga menghentikan pemanjangan akar. Terhentinya pemanjangan akar merupakan ciri utama dari toksisitas aluminium. Jaringan akar merupakan bagian pertama dari tanaman yang mengalami keracunan aluminium, terutama diujung akar sehingga mengalami pemendekan dan menebal. Akar menjadi berwarna kecoklatan terutama pada akar utama serta terjadi pertumbuhan akar lateral yang gemuk dan pendek dengan percabangan yang tidak bagus (Sasaki et al. 1994; Ryan et al. 1993).
Selain itu Al3+ ini juga dapat memasuki sel melalui simplas setelah merusak membran sel akar dan terkadang bereaksi dengan senyawa fosfor dan mengganggu metabolisme fosfor pada tanaman. Akumulasi Al dalam sitoplasma memberi asumsi bahwa toksisitas terjadi karena terbentuknya kompleks Al – ligan (Ryan et al. 1995). Toksisitas aluminium melalui simplas disebabkan karena Al mengikat sangat kuat terhadap senyawa donor O2 seperti Pi, nukleotida RNA, DNA, protein, asam
kuat daripada Mg2+ terhadap ATP, sehingga jumlah Al3+ kurang dari nanomolar sekalipun dapat menghambat Mg2+ pada situs P (Martin 1988). Aluminium juga diduga menghambat proses pembelahan sel dan menghalangi metabolisme asam nukleat (yaitu menghalangi reproduksi bahan genetik) pada tanaman (Helyar 1998). Menurut Matsumoto (1991) Al yang berada dalam bentuk polimer (Al3+) memiliki muatan positif yang besar serta memiliki banyak situs pengikatan. Polimer ini dapat mengikat fosfat pada kedua utas DNA sehingga mengakibatkan gagalnya pemisahan DNA utas ganda saat proses replikasi.
Toleransi Al. Pada prinsipnya ada dua mekanisme toleransi tanaman terhadap cekaman Al menurut Taylor (1991), yaitu : pertama adalah mekanisme eksternal yakni dengan mencegah Al masuk ke dalam simplas dan mencapai daerah metabolik yang peka, sedangkan yang kedua adalah mekanisme internal yakni dengan imobilisasi, kompartementasi atau detoksifikasi saat Al masuk ke dalam simplas Mekanisme toleransi Al pada tanaman bervariasi baik antar maupun intra spesies. Faktor genetik berperan penting dalam menentukan toleransi tersebut. Toleransi Al pada gandum (Triticum aestivum) dikendalikan oleh sejumlah kecil gen dominan mayor dan gen-gen ini telah dimanfaatkan di dalam program pemuliaan untuk merakit kultivar yang toleran terhadap cekaman Al (Johnson et al. 1997).
Ada tiga jenis asam organik yang sering ditemukan dalam tanaman yang toleran terhadap cekaman Al yaitu asam sitrat, asamoksalatdan asam malat. Sebagai contoh respon tanaman terhadap cekaman Al adalah gandum yang mengeluarkan malat, Snapbeans, jagung, Cassia toru dan kedelai yang melepas sitrat, Buckwheat (Fagopyrum esculentum) yang mengeluarkan oksalat dan Triticale, Rapeseed, lobak, oats dan Rye yang mengeluarkan malat dan sitrat. Mekanisme toleransi terhadap cekaman Al dengan menggunakan asam organik ini dibagi ke dalam dua bentuk yaitu detoksifikasi eksternal dan internal bahkan beberapa spesies tanaman menggunakan kedua bentuk mekanisme tersebut.
Beberapa tanaman dapat mengakumulasi Al pada daun dan akarnya tanpa menunjukkan gejala keracunan. Spesies tanaman toleran Al ini mempunyai mekanisme untuk mengubah Al dalam bentuk non toksik di dalam tanaman yaitu sebuah mekanisme yang membiarkan Al masuk ke dalam tanaman dan melewati membran kemudian baru mengubahnya menjadi bentuk non toksik. Teh dan
hydrangea telah dikenal sebagai akumulator Al. Daun teh tua dapat mengakumulasi Al hingga 30000 mg kg-1 berat kering (Matsumoto et al. 1976), dan akumulasi Al di daun hydrangea mencapai di atas 3000 mg kg-1 (Ma et al. 1997). Melastoma malabathricum dan Vaccinium macrocarpon yang beradaptasi baik pada pH rendah mengakumulasi Al dalam level yang tinggi baik di daun maupun di akar (Osaki et al. 1997).
Meskipun banyak bukti yang menunjukkan keterkaitan asam organik dalam mekanisme toleransi Al pada tanaman, ada beberapa spesies yang menunjukkan mekanisme yang sama sekali tidak berkaitan dengan asam organik. Bachiaria decumbans, salah satu jenis yang sangat toleran terhadap cekaman Al, tidak mengeluarkan asam organik dalam merespon Al sehingga diyakini bahwa spesies ini pasti memiliki mekanisme yang berbeda dalam menghadapi Al di level toksik pada larutan tanah (Wenzl et al 2001). Arabidopsis mutan (alr1) meningkatkan pH yang diinduksi oleh Al dengan segera di sekitar ujung akar yang dapat menurunkan aktivitas Al3+ (Dengenhardt et al. 1998). Kultivar gandum yang sangat toleran Al (Atlas) mempunyai mekanisme pelepasan fosfat sebagai mekanisme toleransi Al-nya (Pellet et al. 1996). Berbeda dengan pelepasan malat, pelepasan posfat ini bersifat konstitutif tanpa dipengaruhi adanya induksi Al untuk mengaktifkannya. Mekanisme lainnya adalah sintesis protein spesifik yang diinduksi oleh cekaman oksidatif dan cekaman Al. Cekaman Almenginduksi ekspresi beberapa gen seperti gen penyandi peroxidase, glutathione S-transferase dan blue-copper protein. Overekspresi beberapa protein tersebut pada Arabidopsis telah meningkatkan toleransi tanaman terhadap Al sebagaimana peningkatan toleransi terhadap cekaman oksidatif (Ezaki et al. 2000). Penemuan ini semakin menguatkan adanya mekanisme peningkatan toleransi Al selain dari mekanisme pelepasan asam organik.
Menurut Richard et al. (1998) ekspresi dari gen GST, Peroxidase dan Blue Copper binding protein dipengaruhi oleh aktifitas spesies oksigen aktif (AOS) H2O2
saat tanaman mengalami cekaman. Tanaman yang mampu melepaskan asam organik sebagai mekanisme toleransi terhadap Al ternyata juga resisten terhadap cekaman oksidatif.
Protein Heterotrimerik G sub unit α
membran sel yang berfungsi sebagai mediator penyampai pesan/signal dari luar sel (eksternal) ke molekul efektor sehingga menghasilkan respon intraseluler (Fujisawa et al. 2001). Protein heterotrimerik G terdiri dari subunit α, , (Fujisawa et al. 2001). Masing-masing subunit tersebut terdiri dari 20 α, 6 , 12 yang masing-masing berat molekulnya adalah 42, 35, 10 kilo Dalton (kD) pada mamalia (Hamm 1998). Subunit α memiliki 380 asam amino yang memiliki kesamaan pada tiap Gα (Bischoff et al. 1999).
Protein heterotrimerik G disebut protein G karena mengikat mononucleotide GDP dan GTP. Subunit α merupakan subunit yang mengatur pertukaran GTP-GDP pada mamalia (Fujisawa et al. 2001). Pada hewan/mamalia terdapat 4 famili subunit α yaitu Gs (stimulatory) yang mengaktifkan enzim adenil siklase (cAMP), Gi (inhibitor) yang menghambat adenil siklase, Gq mengaktifkan phospholipase C (PLC ), Gt (bovin transducin) merangsang pembelahan cGMP (Ma 1994). Gα pada tanaman memiliki homologi yang sama dengan mamalia. Ada kemungkinan mempunyai peranan secara langsung dalam meregulasi efektor dan interaksinya dengan reseptor (Ma 1994).
Saat inaktif subunit α berikatan dengan GDP dan berasosiasi dengan membentuk kompleks. Ketika ligan terikat pada permukaan sel reseptor, reseptor menjadi aktif dan mengkatalisis perubahan ikatan GDP pada subunit α menjadi GTP. Hal tersebut menyebabkan terjadinya perubahan komformasi subunit α sehingga akhirnya berpisah dengan (disosiasi). Subunit α akan meregulasi efektor dengan cara berikatan pada efektor dan mengaktifkan signal transduksi seperti pada adenilat siklase. Protein heterotrimerik G kembali tidak aktif ketika GTP diubah menjadi GDP dan subunit α kembali berasosiasi dengan (Ma 1994).
Subunit α dari protein G terdapat pada plasma membran Arabidopsis (Weiss et al. 1997), padi (Iwasaki et al. 1997) dan tembakau (Peskan & Muller 2000). Protein heterotrimerik G sub unit α atau Gα mengaktifkan kanal Ca2+ pada membran plasma tomat (Aharon et al. 1998), meningkatkan level IP3 kedelai (Legendre et al. 1993) dan
meningkatkan spesies oksigen aktif (AOS) H2O2 pada kultur sel kedelai (Legendre et
al. 1992). Protein heterotrimerik G berperan dalam meregulasi ketahanan terhadap pathogen (Aharon et al. 1998; Beffa et al. 1995; Legendre et al. 1993), regulasi
lintasan biosintesis benzo phenathridine alkaloid (Mahady et al. 1998), dan regulasi kanal K+ pada sel mesofil (Fairley-Grenot & Asmann 1991; Li & Asmann 1993). Protein heterotrimerik G meregulasi banyak efektor yang ada dibawahnya seperti adenilat siklase, PLC, dan efektor transducin (Ma 1994). PLC menghidrolisis PIP2 menjadi 2 buah second messengers yaitu IP3 dan DAG. IP3 dapat mengikat
reseptor membran seperti kanal Ca2+, melepas Ca2+ dari reticulum endoplasmik ke dalam sitosol sehingga level Ca2+ meningkat. Peningkatan Ca2+ di sitoplasmik memproduksi protein kinase C (PKC), DAG berperan dalam mengaktifkan protein kinase C (Mc Laughlin et al. 1996; Krauss 2001 ).
Membran plasma sel akar yang kaya akan fosfatase yang berbentuk pospolipid merupakan target utama Al3+ (Matsumoto 2000). Al3+ berinteraksi dengan lipid membran plasma dan dengan enzim yang mengikat metal (Jones & Kochian 1996). Al3+ dapat menyebabkan sitotoksik yang kronik pada tanaman, hewan dan mikroorganisme, sehingga menyebabkan penghambatan perpanjangan akar (elongation). Apex akar (tudung akar, sel meristem dan zone perpanjangan) mengakumulasi lebih banyak Al, serta mengalami kerusakan yang lebih parah dibandingkan dengan jaringan akar yang telah dewasa dan berperan dalam mekanisme respon terhadap Al (Matsumoto 2000; Delhaize & Ryan 1995). Mekanisme toleran terhadap Al pada gandum terjadi dengan cara mengkelat Al3+, imobilisasi Al3+ pada dinding sel, meningkatkan pH disekitar akar dan mengeluarkan Al dari sitoplasma (Taylor 1991). Al menghambat pertumbuhan dan perpanjangan akar squash (Curcubita maxima putch) dengan mengubah metabolisme polisakarida dinding sel di daerah non elongation sama seperti di daerah elongation (Van et al. 1994).
Cekaman aluminium juga diketahui menginduksi beberapa gen yang berhubungan dengan sistem pertahanan terhadap pathogen (defense-response) seperti peroksidase, GST dan blue copper binding protein (AtBCB) pada Arabidopsis thaliana (Richard et al. 1998).
Gen yang berhubungan dengan toleransi Al
Pada kedelai, beberapa gen yang ekspresinya diinduksi oleh Al telah diisolasi. Pada kultivar yang peka terhadap cekaman Al yaitu Lumut, enam klon cDNA yang ekspresinya diinduksi Al telah diisolasi (Anwar et al. 2000). Dari kultivar toleran yaitu Slamet, menggunakan teknik penapisan diferensial terhadap mRNA dari akar tanaman yang mendapat cekaman Al telah diisolasi satu klon (Yuniati 2000).
Untuk menganalisis gen-gen tersebut lebih lanjut, pustaka genom kedelai kultivar Lumut dan Slamet telah dikonstruksi (Suharsono 2002, 2007) dalam fage λ sebagai vektor.
Salah satu gen yang penting dalam sistem toleransi tumbuhan terhadap cekaman Al adalah peroksidase. Peroksidase termasuk ke dalam enzim golongan oksidoreduktase yaitu enzim yang mengkatalis reaksi oksidasi-reduksi. Molekul-molekul toksik seperti superoksida dan radikal hidroksida terkumpul di dalam sel bersamaan dengan adanya oksigen. Molekul-molekul toksik ini merupakan produk intermediate dari respirasi aerobik namun dibatasi jumlahnya di dalam sel oleh sejumlah enzim. Superoksida dipecahkan oleh SOD dimana dalam proses tersebut dihasilkan hidrogen peroksida (H2O2) yang kemudian diuraikan oleh peroksidase.
Peroksidase memecahkan H2O2 menjadi air ketika mengoksidasi sejumlah substrat.
Dengan demikian peroksidase adalah enzim golongan oksidoreduktase yang menggunakan H2O2 sebagai akseptor elektron untuk mengkatalis berbagai reaksi
oksidatif. Peroksidase juga membutuhkan kofaktor untuk melakukan aktivitas enzimatisnya yaitu heme sehingga peroksidase disebut juga heme dependent peroxidase. Heme adalah kompleks antara ion besi dan molekul protoporphyrin IX (Ferriprotoporphyrin IX).
Berdasarkan kemiripan sekuen dan strukturnya, heme dependent peroxidase dibedakan ke dalam 2 famili yaitu : 1) peroksidase hewan dan 2) peroksidase tanaman, fungi dan bakteri. Famili peroksidase tanaman terdiri dari 3 kelas yang dibedakan berdasar struktur dan fungsinya. Kelas I terdiri dari peroksidase intraseluler yang
terdapat pada fungi, tanaman, archaea dan bakteri, disebut peroksidase-katalase yang menunjukkan aktivitas katalase dan peroksidase dalam spektrum yang luas dan tergantung pada konsentrasi hidrogen peroksida yang mantap. Kelas II terdiri dari ligninase dan peroksidase ekstraseluler fungi lainnya, sedangkan kelas III terdiri dari peroksidase ekstraseluler klasik tanaman seperti horseradish peroksidase.
Peroksidase tanaman tersebar dalam jaringan tanaman yang ditemukan pada peroksisom. Enzim peroksidase berkaitan erat dengan sejumlah proses fisiologi yang meliputi lignifikasi, penyembuhan luka, oksidasi fenol, dan pertahanan terhadap patogen.
Lignifikasi berperan sebagai mekanisme pertahanan alami tanaman terhadap cekaman biotik dan abiotik. Lignin merupakan biopolimer fenolik yang sintesisnya diinduksi oleh lingkungan dan serangan patogen (Østergaard et al. 2000). Monomer lignin berasal dari tiga hydroxycinnamyl alkohol atau monolignols yaitu p-coumaryl, coniferil dan sinaphyl. Ketiga monolignol ini menghasilkan monolignin p-hidroksifenil (H), guasil (G) dan syringil (S) yang bergabung membentuk polimer lignin. Polimerisasi dehidrogenase dilakukan dengan bantuan peroksidase tanaman, laccases (oksidoreduktase) atau keduanya. Peroksidase dapat mengoksidasi spektrum fenolik yang luas termasuk proses lignifikasi monomer secara in vitro (Dunford, 1991).
Berdasarkan penelitian yang dilakukan Hiraga et al. (2001) tingginya tingkat aktivitas peroksidase pada tanaman berkaitan erat dengan peningkatan resistensi terhadap cekaman abiotik, termasuk cekaman oksidatif. Cekaman oksidatif disebabkan oleh berbagai faktor lingkungan diantaranya cekaman UV, serangan pathogen (hypersensitive reaction), herbisida dan kekurangan oksigen (Blokhina et al. 2002). Aktivitas kelompok oksigen aktif (ROS) merupakan salah satu mekanisme yang muncul pertama kali pada tanaman untuk mengatasi cekaman oksidatif khususnya untuk reoksigenasi. Pada ROS ini hidrogen peroksida (H2O2) dan superoksida (O2-) di
Peroksidase anionik tembakau (NtPox) dan glutathione S-transferase (parB) merupakan protein intraseluler yang digunakan untuk mendetoksifikasi kelompok oksigen reaktif (Reactive Oxygen Species). Berdasarkan penelitian Cakmak & Horst (1991) ditemukan bahwa aktivitas total peroksidase dan enzim anti-peroksidasi lainnya pada ujung akar tanaman Glycine max meningkat selama perlakuan Al. Penelitian Ezaki et al. (2000) menunjukkan bahwa peroksidase dan glutathione S-transferase tidak bertindak langsung dalam menanggulangi cekaman Al dengan mereduksi kandungan Al di dalam sel tanaman tetapi kemungkinan besar keduanya bertindak memotong lipid peroksidasi di daerah membran sel sehingga membran sel ini dapat menjaga masuknya ion Al ke dalam sitosol pada level rendah.
III. BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilakukan di Laboratorium BIORIN (Biotechnology Research Indonesian - The Netherlands) Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Penelitian dimulai dari bulan Januari 2005 sampai dengan bulan Januari 2007.
Bahan
Bahan tanaman yang digunakan adalah kedelai kultivar Lumut yang peka terhadap cekaman aluminium (Anwar et al. 1999). Cekaman Al menggunakan AlCl3.
Primer forward (F) (5’CCCAAGCTTGGTACCCGCGTCTGTTGACTGGCAGG3’)
dan Primer reverse (R)
(5’CCCTCTAGACTCGAGTGGAGATGGTGCTGTTGGTCC3’) digunakan untuk amplifikasi cDNA dari gen penyandi peroksidase. Primer (F) terletak pada 111 nukleotida sebelum kodon awal (5’GCTTCACACTTCACACTTAACACT3’) dan primer (R) terletak pada 114 nukleotida sesudah kodon akhir (5’ATATTGTTGTATACCTGACCTC3’) yang didesain dari kedelai, yaitu SGAI (nomor aksesi L27418), digunakan untuk amplifikasi cDNA dari gen penyandi Gα. Primer F tepat pada kodon awal dari ekson 1 (5’ATGGCAGATGCCGAGGATAT3’) dan primer R tepat pada daerah ekson 2 (5’CAGTTGTGCGACCACTTGCA3’), didesain dari kedelai (nomor aksesi V00450), digunakan untuk amplifikasi β-aktin
Metode Penelitian
Analisis ekspresi gen Gα dan PER dilakukan melalui beberapa tahapan, yaitu: (1) Perlakuan cekaman pada kultur cair, (2) Isolasi RNA total, (3) Sintesis cDNA total, dan (4) Analisis ekspresi gen Gα dan PER.
(1) Perlakuan cekaman Al pada kultur cair
ukuran 20 cm x 30 cm yang berlubang. Wadah tersebut diletakkan di atas bak plastik ukuran 25 cm x 35 cm x 15 cm yang telah berisi media cair pH 6 sebagai media tanamnya, dan diberi aerasi dengan menempatkan aerator sebanyak 4 buah tiap wadah untuk menjaga ketersediaan oksigen. Kecambah diletakkan sedemikian rupa sehingga ujung akar menyentuh media cair. Komposisi media tanam adalah 0.375 mM Ca(NO3)2. 4H2O, 0.2 µM CuSO4.5H2O, 0.25 mM NH4NO3, 1 µM ZnSO4.7H2O, 0.1
mM Mg SO4 . 7H2O, 5 µM H3BO3, 0.1mM KH2PO4, 1 µM (NH4)6Mo7O24.4H2O, 5
µM MnSO4.H2O, 5 µM Fe-EDTA, dengan pH 6 (Anwar 2000). Kecambah
ditumbuhkan pada media ini selama 2 hari
Tahapan pada hari berikutnya adalah pemberian perlakuan. Perlakuan yang diberikan ada dua macam yaitu perlakuan pH dan perlakuan Al. Bak pertama digunakan untuk pH 6 yang merupakan kontrol perlakuan pH, bak kedua untuk pH 4. Bak kedua yang berisi media dengan pH 4 juga digunakan sebagai kontrol perlakuan Al. Bak ketiga untuk perlakuan pH 4 dengan cekaman 1,2 mM Al dan bak keempat untuk perlakuan pH 4 dengan cekaman 1,6 mM Al. Perlakuan dilakukan selama 3x24 jam, dengan media diganti setiap 24 jam. Pengamatan panjang akar utama dilakukan terhadap 10 sampel yang diambil secara acak, dengan mengukur akar dari pangkal batang sampai dengan ujung akar. Percobaan dilakukan dengan dua ulangan. Pada saat pengamatan, sekitar 0,3 cm ujung akar utama diambil, dibungkus dengan aluminium foil lalu difiksasi di dalam nitrogen cair dan disimpan di freezer suhu -40˚C. Bahan tanaman ini nantinya digunakan untuk isolasi RNA total.
atau
RPA : Reduksi panjang akar
Yti : Panjang akar dari tanaman kontrol pada waktu ti
Yto : Panjang akar dari tanaman kontrol pada waktu to
Xti : Panjang akar dari tanaman yang diperlakukan pada waktu ti
Xto : Panjang akar dari tanaman yang diperlakukan pada waktu to
PPAy : Pertambahan panjang akar tanaman kontrol
PPAx : Pertambahan panjang akar tanaman perlakuan
Nilai RPA positif menunjukkan bahwa perlakuan menyebabkan reduksi pertambahan
panjang akar bila dibandingkan dengan kontrol, yaitu tanaman yang ditumbuhkan pada
pH 4,0. Nilai RPA negatif menunjukkan bahwa perlakuan menyebabkan stimulasi
pertambahan panjang akar dibandingkan dengan kontrol.
(2) Isolasi RNA total
Sekitar 50-100 mg ujung akar kedelai yang telah tersimpan dalam aluminum
foil pada suhu -400C, diberi nitrogen cair langsung digerus dengan menggunakan
mortar sampai halus berbentuk bubuk. Bubuk dicampurkan 800 µl TRIzol. Suspensi
sel dipindahkan ke dalam ependorf dan diinkubasikan pada suhu ruang selama kurang
lebih 5 menit. Ke dalam ependorf, 200 µl kloroform dimasukkan dan suspensi sel
divortex sampai tercampur. Campuran diinkubasikan pada suhu ruang selama 3 menit.
Selanjutnya ependorf tersebut disentrifugasi dengan kecepatan 9000 rpm (Jouan BR4i)
dengan suhu 6˚C selama 15 menit. Cairan bagian atas diambil sebanyak minimal 60%
dari volume TRIzol. Supernatan tersebut dipindahkan ke dalam ependorf baru, dan
ditambahkan isopropil alkohol lalu diinkubasikan dalam suhu ruang selama 10 menit.
Setelah itu ependorf tersebut disentrifugasi dengan kecepatan 9000 rpm selama 10
menit dengan suhu 6˚C. Supernatan dari hasil sentrifugasi dibuang, dan endapannya
diambil. Kemudian ditambah dengan etanol 75% lalu divortex. Ependorf kembali
disentrifugasi dengan kecepatan 5700 rpm selama 5 menit dengan suhu 6˚C. Etanol
75% dibuang, endapan dikeringkan dengan menggunakan vakum. Setelah kering
(3) Sintesis cDNA Total
Sintesis cDNA dilakukan dengan transkripsi balik menggunakan RNA total sebagai cetakan dengan metode Suharsono et al. (2002). Sebanyak 500 ng RNA total dicampur dengan 4 µl buffer (5x), 2 µl 2 mM dNTPmix, 2 µl 0.1 M dTT, 10 pmol primer oligo dT, 1 unit enzim reverse transcriptase (RT) dan DEPC hingga volume akhir reaksi 20 µl. Kondisi reaksi transkripsi balik adalah 10 menit suhu 30˚C, 50 menit suhu 42˚C, 5 menit suhu 95˚C˚.
Evaluasi keberhasilan sintesis cDNA total dilakukan melalui PCR dengan menggunakan primer -aktin. PCR -aktin dilakukan dengan mencampur 2 µl cDNA total, 2 µl buffer (10x), 1 µl 2 mM dNTPmix, 0,8 µl 25 mM MgCl2, 1unit enzim taq
DNA polimerase, 10 pmol primer aktin forward (F), 10 pmol primer aktin reverse (R), 0,4 µl DMSO digenapkan dengan ddH2O hingga 20 µl. Kondisi yang digunakan
adalah Pra-PCR 95˚C 5 menit, denaturasi 94˚C 30 detik, annealing 55˚C 30 detik, ekstensi 72˚C 1 menit 40 detik, siklus diulangi sebanyak 30 kali, pasca-PCR 72˚C 5 menit. Apabila cDNA yang disintesis adalah murni yang tidak terkontaminasi DNA genom, PCR menghasilkan amplifikasi berukuran 450 pb. Apabila terkontaminsi DNA genom, maka hasil PCR berukuran 450 pb dan 550 pb karena cetakan cDNA menghasilkan 450 pb dan cetakan DNA genom menghasilkan 550 pb yang meliputi daerah ekson 1, intron dan ekson 2. Selain untuk melihat keberhasilan sintesis cDNA total dari kontaminasi DNA genom, PCR -aktin juga digunakan untuk menyetarakan konsentrasi cDNA pada berbagai perlakuan. Untuk mengetahui ukuran PCR aktin, dilakukan elektroforesis pada gel agarosa TAE 1x (0,04 M Tris-acetat, 0,001 M EDTA).
(4) Ekspresi gen Gα dan gen PER
Analisis ekspresi gen dilakukan pada tanaman kedelai yang mendapat perlakuan pH dan perlakuan Al secara terpisah. Perlakuan pH yang diberikan adalah pH 4 dan pH 6 sebagai kontrol. Perlakuan Al menggunakan pH 4 tanpa penambahan Al sebagai kontrol. Percobaan dilakukan dengan dua ulangan.
Analisis ekspresi gen Gα dan gen PER dilakukan dengan cara mengamplifikasi gen spesifik tersebut dengan menggunakan cDNA total sebagai cetakannya. Langkah dalam mencampur bahan untuk PCR gen Gα dan gen PER sama dengan PCR aktin,
yang membedakan hanya primer yang disesuaikan dengan gen yang dianalisis. Kondisi PCR gen Gα sama dengan kondisi PCR aktin, sedangkan untuk kondisi PCR gen PER yaitu Pra-PCR 94˚C 2 menit, denaturasi 92˚C selama 30 detik, annealing/penempelan 55˚C selama 30 detik, ekstensi 75˚C selama 1 menit, siklus diulang sebanyak 30 kali, dan pasca PCR 72˚C selama 5 menit. Analisis ekspresi dilakukan dengan membandingkan intensitas cahaya pita hasil PCR gen Gα dan PER terhadap kontrol aktin dengan menggunakan perangkat lunak Digi Doc-it.
Agar dapat diperbandingkan ekspresi gen sasaran tertentu pada waktu yang sama pada berbagai perlakuan, maka ekspresi gen sasaran tertentu harus dibakukan. Pembakuan ekspresi gen sasaran tertentu dilakukan dengan membandingkan ekspresi gen sasaran dengan gen aktin pada waktu dan perlakuan yang sama. Oleh sebab itu ekspresi gen sasaran Gα, dan gen PER dibakukan dengan menggunakan rumus :
IApt IXpt
EBXpt
=
EBXpt : Ekspresi baku gen x pada perlakuan p waktu t
IXpt : Intensitas hasil PCR gen x pada perlakuan p waktu t IApt : Intensitas hasil PCR gen aktin pada perlakuan p waktu t x : Gα dan PER
IV. HASIL DAN PEMBAHASAN
Pengaruh pH terhadap reduksi pertambahan panjang akar
Fenotip reduksi pertambahan panjang akar pada perlakuan pH 4 dibandingkan dengan kontrol (pH6) secara visual tidak terlalu terlihat perbedaan namun pada perlakuan pH 4 + Al baik 1,2 mM maupun 1,6 mM terlihat sangat jelas (Lampiran 3).
Pengaruh pH 4 terhadap reduksi panjang akar menggunakan kontrol pH 6. Hasil analisis reduksi panjang akar disajikan pada Tabel 1.
Tabel 1. Rata-rata Reduksi panjang akar oleh cekaman pH rendah
pH 6 pH 4
Rata-rata reduksi pertambahan panjang akar perlakuan pH 4 adalah berkisar antara 48% dan 49% dibanding kontrol. Hal ini menunjukkan bahwa perlakuan pH 4 menyebabkan penurunan panjang akar sekitar 45%. Bertambahnya waktu perlakuan tidak menambah reduksi pertambahan panjang akar. Menurut Ismail dan Effendi (1993) pH yang paling baik untuk pertumbuhan kedelai adalah pH 6.8, namun pada pH 5.5-6.0 sudah dianggap cukup baik. Perlakuan dengan media tanam pH 6 menghasilkan pertambahan stimulasi perpanjangan akar lebih besar bila dibandingkan pH 4. Tingginya persentase stimulasi perpanjangan pada perlakuan pH 6 menunjukkan bahwa perakaran tanaman tumbuh normal di media kultur air pada pH 6 dibandingkan dengan pH 4.
Pengaruh Al terhadap reduksi pertambahan panjang akar
Penentuan konsentrasi Al untuk melakukan cekaman, didasarkan pada perbedaan pertambahan panjang akar antara kontrol dengan perlakuan cekaman minimal sebesar 50 persen (Ryan et al. 1994). Berdasarkan penelitian Anwar (1999) perlakuan 0,8 – 1,6 mM Al menyebabkan perpanjangan akar primer kedelai kultivar Lumut terhambat lebih dari 50%.
Oleh sebab itu, konsentrasi 1,2 mM Al dan 1,6 mM Al digunakan untuk melakukan cekaman dan pH 4 sebagai kontrol. Hasil reduksi pertambahan panjang akar dari tanaman kedelai kultivar Lumut yang mendapat cekaman Al disajikan pada Tabel 2.
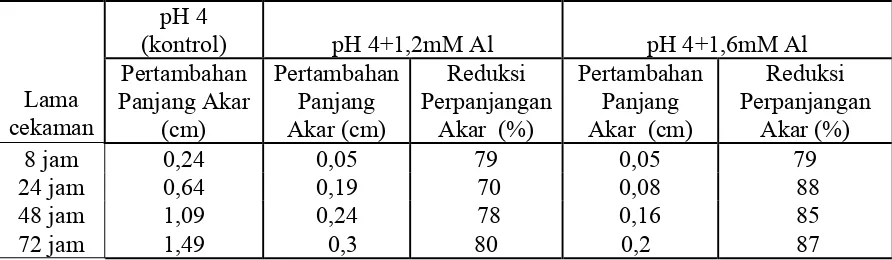
Tabel 2. Rata-rata reduksi perpanjangan akar tanaman kedelai kultivar Lumut yang mendapat perlakuan Al
Perlakuan cekaman 1,2 mM Al menyebabkan rata-rata reduksi pertambahan panjang akar sebesar 70% – 80% dan perlakuan cekaman 1,6 mM Al menyebabkan rata reduksi panjang akar 79% – 88%. Cekaman 1.6 mM Al menyebabkan rata-rata reduksi perpanjangan akar lebih tinggi dibandingkan dengan cekaman 1.2 mM Al.
Agar pengaruh cekaman memberikan hasil yang nyata, maka respon tanaman yang mengalami cekaman harus menampakkan perbedaan yang cukup jelas. Berdasarkan hasil yang didapat, dari cekaman 1.6 mM Al menghasilkan rata-rata reduksi perpanjangan akar (RPA) yang lebih tinggi dibandingkan pada cekaman 1.2 mM Al, sehingga analisis ekspresi gen pada tahap berikutnya hanya menggunakan cekaman Al pada konsentrasi 1.6 mM Al.
Isolasi RNA Total
Isolasi RNA total telah berhasil dilakukan. RNA diisolasi dari ujung akar tanaman kedelai kultivar Lumut yang mendapat perlakuan cekaman pH dan Al. Integritas RNA total yang diisolasi pada penelitian ini adalah baik. Hal ini ditandai oleh dua pita rRNA yang dominan (28S dan 18S) yang utuh (Gambar 1). Karena mRNA terdapat bersama-sama dengan rRNA didalam RNA total, maka bilamana rRNA tersebut utuh maka mRNA juga utuh. RNA total ini kemudian digunakan untuk cetakan dalam sintesis cDNA total.
pH 6 pH 4 pH 4 + 1,6 mM Al
0 J 8 J 24 J 48 J 72 J 8 J 24 J 48 J 72J 8J 24J 48J 72J
28 s 18 s
Gambar 1. RNA total akar kedelai kultivar Lumut pada perlakuan pH 6, pH 4 dan pH 4 dengan cekaman 1,6mM Al.
Síntesis cDNA Total
cDNA total telah berhasil diisolasi dengan menggunakan RNA total sebagai cetakannya. Kemurnian cDNA dianalisis dengan PCR dengan menggunakan primer untuk ekson 1 – ekson 2 dari -aktin. Aktin juga digunakan sebagai kontrol internal karena setiap sel mempunyai aktin dan ekspresinya bersifat konstitutif. PCR dengan primer untuk ekson 1 – ekson 2 dari -aktin menghasilkan satu pita DNA berukuran 450 pb (Gambar 2) yang menunjukkan bahwa cDNA total adalah murni yang tidak terkontaminasi oleh DNA genom. Adanya kontaminasi DNA genom menyebabkan hasil amplifikasi -aktin menghasilkan 2 pita yaitu yang berukuran sekitar 450 pb dan 550 pb (Gambar 3) karena DNA genom mengandung intron diantara ekson 1 dan
ekson 2 yang berukuran sekitar 100 pb. cDNA total yang murni digunakan sebagai cetakan untuk analisis ekspresi gen melalui PCR.
pH 6 pH 4 pH 4 + 1,6 mM Al
0 J 8 J 24 J 48 J 72 J 8 J 24 J 48 J 72J 8J 24J 48J 72J
450 pb
Gambar 2. Hasil PCR Aktin yang berasal dari cetakan cDNA murni.
1 2
450 pb 550 pb
Gambar 3. Hasil PCR -aktin yang cDNAnya terkontaminasi DNA genom (1), dan cDNA murni (2).
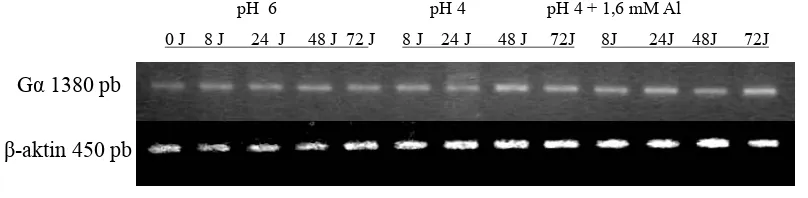
Pengaruh Cekaman Aluminium Terhadap Ekspresi Gen Heterotrimerik Gα. Untuk membedakan pengaruh pH dan pengaruh Al terhadap ekspresi gen, maka kontrol yang digunakan untuk analisis gen pada perlakuan pH berbeda dengan perlakuan Al. Perlakuan pH menggunakan kontrol pH 6 sedangkan perlakuan Al menggunakan kontrol pH 4 karena perlakuan Al tidak dapat dilakukan pada pH 6.
Pita hasil PCR untuk melihat hasil ekspresi gen Gα disajikan pada Gambar 4 dan pengukuran intensitas pita disajikan pada Tabel 3 dan Tabel 4. Dari hasil pengukuran intensitas pita menunjukkan adanya perbedaan tingkat ekspresi gen. Hal ini menunjukkan bahwa adanya perbedaan respon gen terhadap berbagai cekaman yang dicobakan.
pH 6 pH 4 pH 4 + 1,6 mM Al
0 J 8 J 24 J 48 J 72 J 8 J 24 J 48 J 72J 8J 24J 48J 72J
-aktin 450 pb Gα 1380 pb
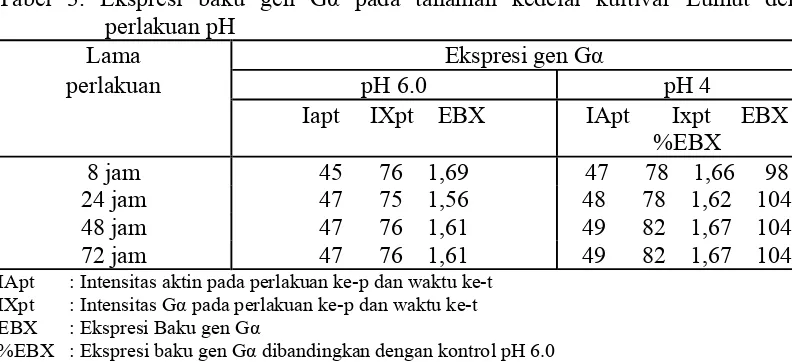
Tabel 3. Ekspresi baku gen Gα pada tanaman kedelai kultivar Lumut dengan IApt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t
IXpt : Intensitas Gα pada perlakuan ke-p dan waktu ke-t EBX : Ekspresi Baku gen Gα
%EBX : Ekspresi baku gen Gα dibandingkan dengan kontrol pH 6.0
Ekspresi gen Gα pada tanaman kedelai kultivar Lumut yang mendapat cekaman pH 4 cenderung lebih tinggi daripada kontrol (pH 6). Pada 8 jam setelah perlakuan, pH tidak menyebabkan kenaikan ekspresi gen Gα, tetapi pada 24 jam sampai 72 jam, perlakuan pH 4 menyebabkan kenaikan ekspresi sekitar 4% dibandingkan dengan kontrol yaitu pH 6 , hal ini mungkin karena pH 4 berpengaruh terhadap ekspresi gen Gα pada cekaman yang lebih lama. Diduga bahwa ekspresi gen Gα akan meningkat dengan bertambahnya lama cekaman.
Analisis ekspresi gen dari tanaman kedelai kultivar Lumut yang diperlakukan dengan Al disajikan pada Tabel 4
Tabel 4. Ekspresi gen Gα dari kedelai kultivar Lumut yang medapat perlakuan Al
Lama IApt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t
IXpt : Intensitas Gα pada perlakuan ke-p dan waktu ke-t EBX : Ekspresi Baku gen Gα
%EBX : Ekspresi baku gen Gα dibandingkan dengan kontrol pH 6.0
Hasil analisis ekspresi gen Gα menunjukkan bahwa ekspresi gen Gα tidak diinduksi oleh Al karena ekspresi baku gen Gα pada perlakuan 1,6 mM Al tidak berbeda dengan perlakuan pH 4. Tidak diinduksinya ekspresi Gα ini kemungkinan
tingginya konsentrasi Al yang diberikan atau waktu perlakuan yang terlalu lama Kemungkinan ekspresi gen Gα dapat terinduksi Al dengan cekaman yang lebih singkat misalnya dengan 5 jam perlakuan, atau pada konsentrasi Al yang lebih rendah. Tistama (2003) menyatakan bahwa ekspresi tertinggi gen gmali50 terjadi pada dosis Al yang lebih rendah yaitu 0.2 mM Al pada kultivar peka (Lumut) daripada kultivar toleran (Slamet) yang terjadi pada dosis 0.4 mM Al.
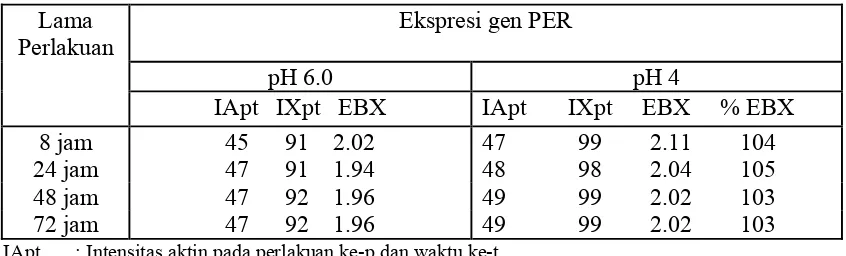
Pengaruh Cekaman pH dan Aluminium Terhadap Ekspresi Gen Peroksidase. Sama seperti analisis ekspresi gen Gα, ekspresi gen PER dianalisis secara terpisah antara tanaman yang diperlakukan dengan pH dan dengan Al. PCR dengan cDNA total sebagai cetakan dan primer spesifik untuk gen peroksidase menghasilkan pita berukuran 1300 pb (Gambar 5).
Ekspresi gen PER pada tanaman yang mendapat perlakuan pH 4 lebih tinggi daripada tanaman yang diperlakukan dengan pH 6. Ekspresi gen PER pada pH 4 berkisar 103% – 105% terhadap pH 6, yang menunjukkan bahwa perlakuan pH 4 cenderung meningkatkan ekspresi gen PER dibandingkan pH 6 (Tabel 5). Ini berarti bahwa ekspresi gen PER cenderung diinduksi oleh cekaman pH 4 pada kedelai kultivar Lumut yang peka terhadap cekaman Al.
pH 6 pH 4 pH 4 + 1,6 mM Al 0 J 8 J 24 J 48 J 72 J 8 J 24 J 48 J 72J 8J 24J 48J 72J
PER 1300 pb
Aktin 450
Gambar 5. Ekspresi gen peroksidase pada tanaman kedelai kultivar Lumut yang ditanam pada pH 6, pH 4 dan pH 4+1,6 mM Al
Tabel 5. Ekspresi per dari kedelai kultivar Lumut yang mendapat perlakuan pH. Lama IApt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t
IXpt : Intensitas Per pada perlakuan ke-p dan waktu ke-t EBX : Ekspresi Baku gen Per
Perlakuan Al cenderung menyebabkan penghambatan ekspresi gen PER. Hal ini dapat dilihat pada hasil analisis ekspresi gen yang disajikan pada Tabel 6. Pada berbagai lama perlakuan, ekspresi gen PER dari tanaman yang mendapat perlakuan pH 4 + 1,6 mM Al lebih rendah atau sama dengan ekspresi gen tersebut pada tanaman yang mendapat perlakuan pH 4. Sama seperti ekspresi gen Gα, terdapat kecenderungan bahwa gen PER diinduksi oleh pH 4 tetapi tidak oleh Al. Cekaman pH 4 dan pH 4+1,6 mM Al juga tidak menginduksi ekspresi gen GST 12 pada kedelai Lumut (Sawitri 2007).
Tabel 6. Ekspresi gen PER dari tanaman kedelai kultivar Lumut yang mendapat perlakuan pH 4 dan Al
Lama Perlakuan
Ekspresi gen PER pada pH 4 dan Al
0 mM Al 1,6 mM Al
Iapt Ixpt EBX IApt IXpt EBX % EBX 8 jam 47 99 2.11 49 98 2.00 99.01 24 jam 48 98 2.04 50 99 1.98 102.06 48 jam 49 99 2.02 49 99 2.02 103.06 72 jam 49 99 2.02 50 99 1.98 101.02 IApt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t
IXpt : Intensitas Per pada perlakuan ke-p dan waktu ke-t EBX : Ekspresi Baku gen Per
%EBX : Ekspresi baku gen Per dibandingkan dengan kontrol pH 6.0
SIMPULAN
Ekspresi gen Gα dan PER pada tanaman kedelai kultivar Lumut cenderung diinduksi oleh cekaman pH 4 tetapi tidak oleh aluminium.
SARAN
DAFTAR PUSTAKA
Aharon GS, Gelli A, Snedden WA, Blumwald E. 1998. Activation of a plant plasma membrane Ca2+ channel by TGα 1, a heterotrimeric G protein α subunit homologue. FEBSlett 424: 17-21.
Anwar S, Suharsono, Jusuf M. 1999. The molecular respone of soybean roots to aluminium stress. One day seminar on biotechnology. IPB. Bogor. April 14.
Anwar S, Jusuf M, Suharsono, Sopandie D. 2000. Pengklonan gen yang diinduksi oleh aluminium pada kedelai. J Bioteknol Indonesia 5 (1): 7-16.
Beffa R et al. 1995. Cholera toxin elevates pathogen resistance and induces pathogenesis-related gene expression in tobacco. EMBO J 23: 5753-5762.
Bischoff F, Molendjik A, Rajendrakumar CSV, Plame K. 1999. GTP-binding protein in plants. Cell Mol Life Sci 55: 233-256.
Blokhina O, Virolainen E, Fagerstedt KV. 2002. Antioxidants damage and oxygen deprivation stress: a review. Ann of Botany 91: 179-194.
Cakmak I, Horst W J. 1991. Effect of aluminum peroxidation, superoxide dismutase, catalase and peroxidase activity in root tips of soybean (Glycine max). Plant Physiol 83: 463-468.
Christiansen-Weniger C, Gronemon AF, Van Veen JA. 1992. Associative N2 fixation
and root exudation of organic acids from wheat cultivars of different aluminum tolerance. Plant Soil 139: 167-174.
Cote GG, Crain RC. 1993. Biochemistry of Phosphoinositides. Annu Rev Plant Physiol 44: 333-356.
Delhaize R, Ryan PR. 1995. Aluminum toxicity and tolerance in plants. Plant Physiol 107: 315-321.
Dengenhardt J, Larsen PB, Howell SH, Kochian LV. 1998. Aluminum resistance in the Arabidopsis mutant alr-104 is caused by an aluminum increase in rhizospHere pH. Plant Physiol. 122: 657-666.
Dunford HB. 1991. Horseradish peroxidase: structure and kinetic properties. In: Everse J, Grisham MB, (ed). Peroxidases in Chemistry and Biology. CRC Press. Boca Raton, Florida. : 1-24.
Ezaki B, Gardner RC, Matsumoto H. 2000. Expression of aluminum-induced genes in transgenic Arabidopsis plants can ameliorate aluminum stress and/or oxidative stress. Plant Physiol 122: 657-666.
Fairley-Grenot K, Assman SM. 1991. Evidence for G protein regulation of inward potassium ion channel current in guard cells of Fava bean. Plant Cell 3: 1037-1044.
Fujisawa Y, Kato H, Iwasaki Y. 2001. Structure and function of heterotrimeric G protein in plants. Plant Cell Physiol 42 (8): 789-794.
Galvez L, Clark RB. 1991. Nitrate and ammonium uptake changes for Al-tolerant and Al-sensitive sorghum (Sorghum bicolor) genotypes grown with and without aluminum. Plant Soil 134: 179-188.
Hamm HE. 1998. The many faces of G protein signaling. J Biol Chem 273(2): 669-672.
Haug, A. 1984. Molecular aspects of aluminum toxicity. CRC Crit Rev Plant Sci 1: 345-373.
Helyar KR. 1998. The symptoms and effect on plants of nutrient disorders in acid soils. In: 25 years of the Riverina Outlook Conference, Wagga Wagga,1973-1998 (online). http://www.regional.org.au/au/roc/1981/roc198147.htm. Tanggal 1 Februari 2006
Hiraga S, Sasaki K, Ito H, Ohashi Y, Matsui H. 2001. A large family pf class III plant peroxidases. Plant Cell Physiol 42: 462-468.
Ismail I G, Effendi S. 1993. Pertanaman Kedelai pada Lahan Kering. Kedelai. Di dalam: Somaatmaja S, Ismunadji M, Sumarno, syam M, Manurung SO, Yuswadi, editor. Kedelai. Bogor: Balai Penelitian dan Pengembangan Pertanian. Pusat Penelitian dan Pengembangan Tanaman Pangan. hlm 103-119.
Iwasaki Y, Kato T, Kaidoh T, Ishikawa A, Asahi T. 1997. Characterization of the putative α subunit of a heterotrimeric G protein in rice. Plant Mol Biol 34: 563-572.
Johnson JP, Cerver BF, Baligar VC. 1997. Expression of aluminum tolerance transferred from Atlas 66 to hard winter wheat. Crop Sci 37: 103-108.
Jones DL, Kochian LV. 1995. Aluminum inhibition of the inositol 1,4,5-triphosphate signal transduction pathway in wheat roots: A role in aluminum toxicity. Plant Cell 7: 1913-1922.
Jusuf M, Suharsono, Sopandie D. 1999. Molecular biology of Soybean tolerance to aluminum stress. Report of Graduate Team Research Grant, URGE Project, Batch II: Directorate General of Higher Education. Jakarta
Kinraide TB. 1991. Identity of the rhizotoxic aluminum species. Plant Soil 134: 167-178.
Kochian LV. 1995. Cellular mechanisms of aluminum toxicity and resistance in plants. Annu Rev Plant PhysiolPlant Mol Biol 46: 237-260.
Krauss 2001. Inositol triphoshate and calsium signaling. Nature 251: 315-325.
Legendre L, Heinstein PF, Low PS. 1992. Evidence for participation of GTP-binding protein in elicitation of the rapid oxidative burst in cultured soybean cells. J Biol Chem 267: 20140-20147.
Legendre L, Henstein PF, Low PS. 1993. Phospholipase C activation during elicitation of the oxcidative burst in cultured plant cell. J Biol Chem 268: 24559-24563.
Li W, Assmann SM. 1993. Characterization of a G protein-regulated outward potassium current in mesophyl cell Vicia faba. Proc Natl Acad Sci USA 90: 262-266.
Ma H. 1994. GTP-binding proteins in plants: a new members of an old family. Plant Mol Biol 26: 1611-1636.
Ma JK, Zheng SJ, Matsumoto H. 1997. Spesific secretion of citric acid induced by Al stress in Cassia tora L. Plant Physiol 38: 1019-1025.
Mahady GB, Liu C, Beecher CWW. 1998. Involvement of protein kinase C and G protein in the signal transduction of benzo phenanthridine alkaloid biosynthesis. Phytochem 48: 93-102.
Marschner H. 1986. Mineral Nutrition of Higher Plant. Academic Press Harcourt Brace and Company. London.
Martin RB. 1986. The chemistry of aluminum as related to biology and medicine. Clin Chem 32: 1797-1806.
Martin RB. 1988. Bioinorganic chemistry of aluminum. 1-57 Di dalam: Sigel H, Sigel A, editors. Metal Ions in Biological Systems: Aluminium and Its Role in Biology 24. New York:Marcel-Dekker.
Mashuda 2006. Ekspresi Gen Gα dan GST pada Kedelai Kultivar Slamet yang Mendapat Cekaman Aluminium [Tesis]. Sekolah Pascasarjana Institut Pertanian Bogor.
Matsumoto H, Hirasawa E, Morimura S, Takahashi E. 1976. Localization of aluminum in tea leaves. Plant Cell Physiol 17: 627-631.
Matsumoto H. 1991. Biochemical mechanism of the toxicity of aluminium and the sequestration of aluminium in plant cell. Plant Cell Physiol 21: 825-838.
Matsumoto H. 2000. Cell biology of aluminum toxicity and tolerance in higher plants. Internat Rev Cyt 200: 1-46.
Mc Laughin S, Carolyn B, Gennady D, Michel G. 1996. The importance of lipid-protein interaction in signal transduction through the calcium-phospholipid second messenger system. NATO ASI Series H Cell Biol 95.
Miyasaka SC, Buta JG, Hawell RK, Foy CD. 1991. Mechanism of aluminum tolerance in snapbean: root exudation of citric acid. Plant Physiol 96: 737-743.
Moller T, Bailar JL, Kleinberg J, Guss CO, Castellion ME and Molz C. 1984. Chemistry with Inorganik Qualitative Analysis Acid Press, Inc Orlando.
Notohadiprawiro T. 1983. Persoalan Tanah Masam dalam Pembangunan Pertanian Indonesia. Bull Faperta 18: 44-47.
Osaki M, Watanabe T, Tadano T. 1997. Beneficial effect of aluminum growth of plant adapted to low pH soil. Soil Sci Plant Nutr 43 (3): 551-563.
∅stergaard L, Teilum K, Mirza O, Mattsson O, Petersen M, Welinde KG, Mundy J, Gajhede M, Henriksen A. 2000. Arabidopsis ATP A2 peroxidase. Expression and high-resolution structure of a plant peroxidase with implications for lignification. Plant Mol Biol 44: 231-243.
Pellet DM, Grunes DL, Kochian LV. 1995. Organic acid exudation as an aluminum-tolerance mechanism in maize (Zea mays L.). Planta 196: 788-795.
Peskan T, Oelmuller R. 2000. Heterotrimeric G-protein – subunit is localized in the plasma membrane and nuclei tobacco leaves. Plant Mol Biol 42: 915-922.
Pineros MA, Jurandir V, Magalhaes, Vera M, Alves C, Kochian LV. 2002. The physiology and biophysics of an aluminum tolerance mechanism based on root citrate exudation in maize. Plant Physiol 129: 1194-1206.
Prihardi DP, ER Shipe, SU Wallace. 1995. Screening selected soybean genotype for aluminum tolerance. Indon J Trop Agric 6(1): 11-12.
Richards KD, Schott EJ, Sharma YK, Davis KR, Gardner RC. 1998. Aluminum induces oxidative stress genes in Arabidopsis thaliana. Plant Physiol 116: 409-418.
Ryan PR, Kinraide TB, Kochian LV. 1994. Al3+Ca2+ interaction in aluminum rhizotoxicity inhibition of root growth is not caused by reduction of calsium uptake. Planta 192: 98-103.
Ryan PR, Delhaize E, Randall PJ. 1995. Malate efflux from root apices: evidence for a general mechanism of Al-tolerance in wheat. Aust J Plant Physiol 22: 531-536.
Sasaki M, Kasai M, Yamamoto Y, Matsumoto H. 1992. Root elongation and ion flux of wheat varieties differing in aluminum tolerance. Plant Cell Wall as Biopolimers with Physiological Function. 401-403.
Sasaki M, Kasai M, Yamamoto Y, Matsumoto H. 1994. Comparation of the early response to aluminum stress between tolerant and sensitive wheat cultivars: Root growth, aluminum content and efflux of K+. J Plant Nutr 17(7): 1275-1288.
Sawitri SM 2007. Ekspresi gen Gα dan GST pada kedelai kultivar Lumut yang mendapat cekaman aluminium. [Tesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Silva IR, Smyth TJ, Rarer CD, Carter TE, Rutty T. 2001. Differential aluminum tolerance in soybean: an evaluation of the role of organic acid. Plant Physiol 112: 200-210.
Sopandie D, Jusuf M, Hamim, Supiatno. 1996. Fisiologi dan Genetik Daya Adaptasi Kedelai terhadap Cekaman Kekeringan dan pH Rendah dengan Al tinggi. Laporan Riset Unggulan Terpadu (RUT I).
Suharsono 2002. Konstruksi pustaka genome kedelai kultivar Slamet. Hayati 9(3): 67-70.
Suharsono 2007. Pembuatan pustaka genom kedelai kultivar Lumut di dalam fage lambda Biosfera (inpress)
Suharsono U et al. 2002. The heterotrimeric G protein α subunit act upstream of the small GTPase Rac in disease resistance of rice. Proc Natl Acad Sci 99 (20): 13307-13312.
Suharsono, Jusuf M, Anwar S, Widyastuti U. 2003. Isolasi dan Karakterisasi Gen-Gen dari Tanaman Kedelai yang Mendapat Cekaman Aluminium. Laporan Riset Unggulan Terpadu VIII Bidang Bioteknologi Jakarta. Kementrian Riset dan Teknologi dan Lembaga Ilmu Pengetahuan Alam.
Suharsono, Jusuf M, Paserang AP. 2006. Analisis ragam heritabilitas dan pendugaan kemajuan seleksi populasi F2 dari persilangan kedelai kultivar Slamet X Nokonsawon. J Tan Tropika 9(2): 86-93.
Suharsono, Jusuf M, Dasumiati. 2007. Analisis ragam dan seleksi populasi F3 dari persilangan kedelai kultivar Slamet X Nokonsawon. J Tan Tropika 10(1): 21-28.
Syarifuddin A, Abdurahman A. 1993. dalam Anwar 1999. Optimasi pemanfaatan sumberdaya lahan berwawasan lingkungan. Prosiding Simposium Penelitian Tanaman Pangan III. Pusat Penelitian dan Pengembangan Tanaman Pangan dan Badan Litbang DEPTAN. Jakarta/Bogor 23-25 Agustus 1993.
Tang Y, Garvin DF, Kochian LV, Sorrells ME, Carver BF. 2002. Physiological genetics of aluminum tolerance in the wheat cultivar atlas 66. Crop Sci 42: 1541-1546.
Taylor GJ. 1991. Current views of the aluminum stress response:The physiological basis of tolerance.Curr.TopPlant Biochem Physiol 10: 57-93.
Tistama R. 2003. Transkripsi gmali14 dan gmali50 pada Kedelai [Glycine max (L) Merryl] yang Mendapat Cekaman Beberapa Logam dan Garam. [Tesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Yamamoto Y, Ono K, Mamatsuka K, Kasai M, Matsumoto H. 1992. Growth inhibiton by aluminum is alleviated by phosphate starvation in cultured tobacco cells. Plant cell walls as biopolymers with physiological function. Yamada Science Foundation. Osaka japan.
Yuniati R 2000. Pengklonan cDNA tanaman kedelai (Glycine max (L.) Merryl) varietas Slamet yang diinduksi cekaman aluminium (tesis) Bogor. Institut Pertanian Bogor.
Van HL, Kuraishi S, Sakurai N. 1994. Aluminum-induced rapid root inhibition and changes in cell-wall components of squash seedling. Plant Physiol 106: 971-976.
Van Wambeke A. 1976. Formation, distributon and consequence of acid soil of agricultured development. in Wright MJ and SA Ferari, eds Plants adaptation to mineral stress in problem soils. Spec Publ Cornell Univ Agric Exp Stn Ithaca, New York. 15-24.
Weiss CA, White E, Huang H, Ma H. 1997. The Gα protein sub unit (G P α 1) is associated with the endoplasmic reticulum and the plasma membrane in meristematic cells of Arabidopsis and Cauliflower. FEBS Lett 407: 361-367. Wenzl P, Platino GM, Chaves AL, Meyer JE, Rao IM. 2001. The high level of
aluminum resistance in signalgrass is not associated with known mechanism of aluminum detoxification in root apices. Plant Physiol 125: 1473-1484.
Lampiran 2
standar deviasi
perlakuan 8 jam 24 jam 48 jam 72 jam
pH 6 0.04 0.06 0.01 0.07 pH 4 0.01 0.01 0.02 0.07 pH 4+1.2 mM
Al 0.01 0.04 0.01 0.02
pH 4+1.6 mM
Al 0.01 0.01 0.00 1.20
rata-rata ulangan
waktu pH 6 pH 4
pH 1.2 mM
Al pH 1.6 mM Al
8 jam 0.41 0.23 0.06 0.04 0.47 0.25 0.04 0.06
rata-rata 0.44 0.24 0.05 0.05
24 jam 1.30 0.63 0.20 0.07 1.21 0.65 0.14 0.09
rata-rata 1.26 0.64 0.17 0.08
48 jam 2.00 1.10 0.25 0.16 1.98 1.07 0.23 0.16
rata-rata 1.99 1.09 0.24 0.16
72 jam 2.80 1.57 0.32 0.21 2.90 1.47 0.29 1.9
0 Jam
Lampiran 3.
Foto tanaman kedelai kultivar Lumut pada berbagai perlakuan
8 Jam 24 Jam 48 Jam 72 Jam