APLIKASI KOMPOS JERAMI YANG DIPERKAYA
MIKROBA ENDOFIT UNTUK MENEKAN INFEKSI
PATOGEN PADA BIBIT TANAMAN PALA
SITI NURUL BENOWATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aplikasi Kompos Jerami yang Diperkaya Mikroba Endofit untuk Menekan Infeksi Patogen pada Bibit Tanaman Pala adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Siti Nurul Benowati
ABSTRAK
SITI NURUL BENOWATI. Aplikasi Kompos Jerami yang Diperkaya Mikroba Endofit untuk Menekan Infeksi Patogen pada Bibit Tanaman Pala. Dibimbing oleh BONNY POERNOMO WAHYU SOEKARNO.
Produktivitas pala di Indonesia menurun setiap tahun. Penyakit tanaman merupakan salah satu faktor yang dapat menyebabkan produksi pala menurun. Penyakit tanaman dapat menginfeksi tanaman dari pembibitan hingga tanaman berbuah. Penelitian ini bertujuan untuk memperoleh informasi awal mengenai potensi penggunaan mikroba endofit pada akar sebagai agens hayati. Penelitian ini dilakukan untuk mengevaluasi potensi menggunakan kompos jerami dengan mikroba endofit dalam menekan infeksi cendawan patogen penyebab hawar daun dan mati ranting pada bibit tanaman pala. Isolat mikroba endofit non patogen berhasil diperoleh sebanyak 17 isolat (9 bakteri dan 8 cendawan). Hasil uji in vitro
menunjukkan persentase tertinggi dalam menekan pertumbuhan patogen CP1 dan CP2 adalah 52.89% dan 51.33% oleh cendawan endofit CEA5. Hasil uji in vivo menunjukkan persentase isolat patogen CP1, insidensi penyakit dan keparahan penyakit CP1 sebagai berikut; kontrol (K): 12.8% dan 2.68%, kompos jerami (KP): 16.64% dan 3.56%, dan kompos jerami-cendawan endofit CEA5 (KPE): 11.61% dan 2.32%. Isolat patogen CP2, insidensi penyakit dan keparahan penyakit CP2 sebagai berikut; kontrol (K): 18.72% dan 4.06%, kompos jerami (KP): 12.03% dan 2.47%, dan kompos jerami-cendawan endofit CEA5 (KPE): 11.45% dan 2.71%. Penambahan kompos jerami yang diperkaya isolat cendawan endofit CEA5 hanya mampu menekan insidensi penyakit dan keparahan penyakit yang disebabkan patogen CP2 pada bibit tanaman pala.
ABSTRACT
SITI NURUL BENOWATI. Application of Straw Compost with Endophytic Microbes Enrichment to Suppress Infection of Pathogen on Seedling of Nutmeg. Supervised by BONNY POERNOMO WAHYU SOEKARNO.
Productivity of nutmeg in Indonesia decreases every year. Plant disease is a limiting factor that may cause the nutmeg production decreasing. Plant disease can infect all the plant stages, from nursery to fruiting stages. This study was aimed to obtain preliminary information about potential uses of endophytic microbes on the root as biocontrol agent. This research was conducted by evaluate the potential uses straw compost with endophytic microbes enrichment to suppress infection of pathogenic fungi cause leaf blight and die back on seedling of nutmeg. The non pathogenic isolates of endophytic microbes has found 17 isolates (9 bacteria and 8 fungi). The result of in vitro test has shown that highest percentage in suppressing growth of pathogens CP1 and CP2 was 52.89% and 51.33% by the endophytic fungus CEA5. The result of in vivo test has shown that percentage for CP1 pathogen isolate, disease incidence and disease severity by CP1 were as follows; control (K): 12.8% and 2.68%, straw compost (KP): 16.64% and 3.56%, and straw compost-endophytic fungus CEA5 (KPE): 11.61% and 2.32%. For CP2 pathogen isolate, disease incidence and disease severity by CP2 were as follows; control (K) 18.72% and 4.06%, straw compost (KP): 12.03% and 2.47%, and straw compost-endophytic fungus CEA5 (KPE): 11.45% and 2.71%. The addition of compost of straw with endophytic fungus CEA5 isolate enrichment only suppressing disease incidence and disease severity caused by pathogen CP2 on seedling of nutmeg.
©Hak Cipta milik IPB, tahun 2015 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
APLIKASI KOMPOS JERAMI YANG DIPERKAYA
MIKROBA ENDOFIT UNTUK MENEKAN INFEKSI
PATOGEN PADA BIBIT TANAMAN PALA
SITI NURUL BENOWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi :..Aplikasi Kompos Jerami yang Diperkaya Mikroba Endofit .untuk Menekan Infeksi Patogen pada Bibit Tanaman Pala Nama Mahasiswa : Siti Nurul Benowati
NIM : A34100038
Disetujui oleh,
Dr Ir Bonny Poernomo Wahyu Soekarno, MS Pembimbing
Diketahui oleh,
Dr Ir Abdjad Asih Nawangsih, MSi Ketua Departemen Proteksi Tanaman
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tugas akhir yang berjudul “Aplikasi Kompos Jerami yang Diperkaya Mikroba Endofit untuk Menekan Infeksi Patogen pada Bibit Tanaman Pala” sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Ir. Bonny Poernomo Wahyu Soekarno, MS. selaku dosen pembimbing skripsi dan pembimbing akademik yang senantiasa memberikan bimbingan, pengetahuan, perhatian, dan arahan sehingga tugas akhir ini dapat terselesaikan dengan baik. Penulis mengucapkan terima kasih kepada dosen penguji skripsi Dr. Ir. Swastiko Priyambodo, MSi. yang telah memberikan saran dan masukan kepada penulis dalam melakukan penulisan skripsi dan Dr. Ir. Gayuh Rahayu yang telah membantu dalam mengidentifikasi cendawan patogen. Penulis juga mengucapkan terima kasih kepada keluarga (Bapak Agus, Ibu Pajinah, Nenek, Ambar, dan Saddam) atas doa yang senantiasa dipanjatkan dan dukungan kepada penulis dalam melakukan penelitian dan penulisan skripsi.
Terima kasih kepada para sahabat Endah Wahyuni, Winar NA Fatimah, Suci Addmas Kalasyank, Titah Nurjannah, Nurul Fatmawati, Rizky M Ardiyanti, Syifa Febrina, Hagia Sophia Khairani, Miranti Sasmita, Rian Andini, Urwatil Wutsqo, Imam Sholikhin, Aby Hapsari, Dila Ratna Sari, Ayustiyan FW, Riana Maharani, Windy Dwiparaswati, teman-teman Proteksi Tanaman 47, rekan-rekan Laboratorium Mikologi, staf-staf Departemen Proteksi Tanaman, dan teman-teman Kost Windy untuk semangat, dukungan, dan bantuan selama penelitian berlangsung, serta pihak lain yang turut membantu dalam tugas akhir ini.
Semoga penelitian ini dapat bermanfaat untuk kita semua.
Bogor, Februari 2015
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Tempat dan Waktu 4
Bahan dan Alat 4
Metode Penelitian 4
Pembuatan Kompos 4
Peremajaan Isolat Patogen CP1 dan CP2 4
Eksplorasi Mikroba Endofit 4
Uji Patogenesitas 5
Uji in Vitro Aktivitas Mikroba Endofit 5 Uji in Vivo Aktifitas Kompos Jerami dan Mikroba Endofit 6
Skoring Penyakit 7
Rancangan Percobaan dan Analisis Data 7
HASIL DAN PEMBAHASAN 8
Eksplorasi Mikroba Endofit 8
Pengujian Patogenesitas Mikroba Endofit 8
Kemampuan Mikroba Endofit dalam Penghambatan Patogen CP1 dan
CP2 secara in Vitro 10
Kemampuan Kompos Jerami dan Mikroba Endofit dalam Penghambatan
Patogen CP1 dan CP2 secara in Vivo 13
Identifikasi Cendawan Patogen CP1 dan CP2 15
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 21
DAFTAR TABEL
1 Perlakuan uji in vivo terhadap patogen CP1 dan CP2 pada bibit tanaman
pala 6
2 Kriteria skor penyakit berdasarkan gejala yang muncul di lapangan
(Soekarno 2014 Desember 4, komunikasi pribadi) 7 3 Hasil uji patogenesitas isolat cendawan endofit akar tanaman pala
berumur 10 tahun (CEA) dan >50 tahun (CEB) terhadap benih padi 8 4 Hasil uji hipersensitif isolat bakteri endofit akar tanaman pala berumur
10 tahun (BEA) dan >50 tahun (BEB) terhadap tanaman tembakau 9 5 Kemampuan antagonis bakteri endofit dan cendawan endofit terhadap
patogen CP1 dan CP2 pada hari ke 4 11
6 Pengaruh perlakuan terhadap insidensi penyakit, keparahan penyakit, pertambahan tinggi tanaman, dan pertambahan jumlah daun yang
diinokulasi patogen CP1 dan CP2 14
DAFTAR GAMBAR
1 Hasil isolasi mikroba endofit pada bagian akar tanaman pala sehat 8 2 Hasil uji patogenesitas: tidak ada gejala nekrotik pada daun tembakau (a),
gejala nekrotik pada daun tembakau (b), benih berkecambah normal (c), gejala nekrotik pada akar dan ruas batang bawah (d), dan pertumbuhan
padi terhambat (e) 10
3 Hasil uji antagonisme in vitro: kontrol CP1 (a), isolat BEB20 - CP1 (terbentuk zona bening 12 mm) (b), isolat CEA5 - CP1(c), kontrol CP2 (d), isolat BEB13 - CP2 (e), dan CP2 - isolat CEA8 (terbentuk zona
bening 4 mm) (f) 12
4 Gejala yang ditemukan di lapangan: gejala pada tulang daun dan hawar daun (a), daun mengering dan menggantung (b), miselium pada akar sekunder dan ujung akar membusuk (c), dan gejala nekrotik di bagian
dalam akar sekunder (d) 13
5 Cendawan patogen CP1: miselium berwarna putih, berubah menjadi coklat hingga hitam (a), hifa hialin dan berseptat (perbesaran 40x10) (b), arthrokonidia yang terbentuk pada media WA berbentuk bulat hialin dan coklat (perbesaran 40x10) (c), dan Scytalidium lignicola (Ellis 1971) 16 6 Cendawan patogen CP2: miselium berwarna putih kekuningan (a),
sporangiofor panjang (perbesaran 10x10) (b), hifa hialin dan tidak berseptat (perbesaran 40x10) (c), kolumela bulat (perbesaran 40x10) (d), Sporangium (perbesaran 40x10), dan sporangiospora berbentuk lonjong
DAFTAR LAMPIRAN
1 Daftar isolat bakteri endofit non patogen hasil eksplorasi pada jaringan akar tanaman pala berumur 10 tahun dan >50 tahun 22 2 Daftar isolat cendawan endofit non patogen hasil eksplorasi pada
jaringan akar tanaman pala berumur 10 tahun dan >50 tahun 23 3 Hasil analisis sidik ragam kemampuan bakteri endofit dan cendawan
endofit terhadap patogen CP1 secara in vitro 25
4 Hasil analisi sidik ragam kemampuan bakteri endofit dan cendawan
endofit terhadap patogen CP2 secara in vitro 25
5 Hasil analisis sidik ragam pengaruh perlakuan terhadap insidensi
penyakit yang diinokulasi patogen CP1 25
6 Hasil analisis sidik ragam pengaruh perlakuan terhadap keparahan
penyakit yang diinokulasi patogen CP1 26
7 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan
tinggi tanaman yang diinokulasi patogen CP1 26
8 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan
jumlah daun yang diinokulasi patogen CP1 26
9 Hasil analisis sidik ragam pengaruh perlakuan terhadap insidensi
penyakit yang diinokulasi patogen CP2 26
10 Hasil analisis sidik ragam pengaruh perlakuan terhadap keparahan
penyakit yang diinokulasi patogen CP2 26
11 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan
tinggi tanaman yang diinokulasi patogen CP2 27
12 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan
PENDAHULUAN
Latar Belakang
Pala (Myristica fragrans Houtt) merupakan tanaman asli Indonesia yang berasal dari Maluku, Banda, dan pulau-pulau di Indonesia Timur. Keragaman tanaman tertinggi ditemukan di Pulau Banda dan Papua (Hadad & Hamid 1990). Pala termasuk komoditas penting dan potensial karena menjadi penyumbang pendapatan utama bagi petani di wilayah Timur Indonesia, khususnya di daerah sentra produksi pala dan mampu mensuplai 60-75% kebutuhan pangsa pasar dunia serta mempunyai banyak manfaat baik dalam bentuk mentah ataupun produk turunannya (Ditjenbun 2012).
Produksi pala di Indonesia pada tahun 2001 sebesar 76 900 ton, sedangkan tahun 2013 sebesar 25 800 ton. Produksi pala pada beberapa tahun belakangan ini mengalami penurunan (BPS 2014). Beberapa faktor penyebab menurunnya produksi pala di Indonesia adalah teknik budidaya yang minimal, tanaman yang sudah tua serta adanya serangan hama dan penyakit yang semakin memperburuk kondisi tanaman. Penyakit tanaman pala menyerang pada pembibitan hingga tanaman berbuah. Penyakit-penyakit yang menyerang tanaman pala diantaranya penyakit akar, penyakit kulit, penyakit layu, busuk buah kering, busuk buah basah, buah pecah, kanker pala, cendawan rumah laba-laba, busuk buah, dan gugur daun (Semangun 2000)
Suatu cendawan akar yang belum dideterminasi pernah dilaporkan menyerang akar-akar tanaman pala, akar-akar tanaman pelindung, dan pohon-pohon hutan (Semangun 2000). Harni et al. (2011) melaporkan bahwa penyebab penyakittanaman pala pada 5 Kecamatan di Kabupaten Aceh Selatan adalah
Rigidoporus dan Ceratocystis, penyakit ini dapat menurunkan hasil sampai 70%. Gejala serangan penyakit akar adalah daun menguning dan layu dari pucuk bagian atas, berlanjut dari satu cabang ke cabang lain kemudian daun gugur seluruhnya dan tanaman mati meranggas. Bila kulit kayu dikelupas terlihat kambium berwarna coklat kehitaman, dan pada pangkal batang terlihat hifa cendawan berwarna putih, bila akar dibongkar terlihat akar dipenuhi oleh hifa cendawan berwarna putih (Harni 2012). Adanya serangan penyakit yang disebabkan R. microporus juga dilaporkan menyerang beberapa daerah pulau Sumatera. Hasil pantauan BBPPTP Medan, gejala yang sama juga ditemukan di Kabupaten Agam dan Kepulauan Mentawai Provinsi Sumatera Barat serta di Kabupaten Tanggamus Provinsi Lampung dengan gejala ranting mengering, daun menggantung, terjadi perubahan warna (diskolorasi) pada pembuluh akar dan batang, serta ditemukan adanya misellium cendawan berwarna putih pada leher akar atau pangkal batang (Darwis et al. 2013)
Bahan organik dapat ditambahkan dengan penggunaan kompos. Kompos adalah bahan-bahan organik yang telah mengalami proses pelapukan karena adanya interaksi antara mikroorganisme yang bekerja di dalamnya. Kelangsungan hidup mikroorganisme tersebut didukung oleh keadaan lingkungan yang basah dan lembab. Salah satu bahan organik yang dapat dimanfaatkan menjadi kompos adalah jerami padi. Manfaat dari penggunaan kompos jerami yaitu menyediakan unsur hara mikro bagi tanaman, menggemburkan tanah, memperbaiki struktur dan tekstur tanah, meningkatkan porositas, aerasi, dan komposisi mikroorganisme, meningkatkan daya ikat tanah terhadap air, memudahkan pertumbuhan akar tanaman, menyimpan air tanah lebih lama, mecegah lapisan kering pada tanah, mencegah beberapa penyakit akar, bersifat multilahan karena bisa digunakan di lahan pertaanian, perkebunan, reklamasi lahan kristis. Kompos terbukti memperbaiki struktur dan kesuburan tanah karena berhasil mengikat unsur organik dalam tanah yang umumnya tersisa sekitar 1% (Murbandono 2001). Kekurangan unsur N menyebabkan produksi menjadi rendah, sebaliknya jika kelebihan unsur N dapat menyebabkan ketahanan tanaman terhadap penyakit menurun terutama pada keadaan kekurangan unsur K. Pemberian unsur K menyebabkan akumulasi fenol yang bersifat racun bagi patogen sehingga dapat meningkatkan ketahanan tanaman terhadap penyakit.
Ketahanan tanaman terhadap patogen dapat ditingkatkan dengan memanfaatkan penggunaan mikroba didalam jaringan tanamanyang dikenal denganmikroba endofit. Sekitar 300 000 jenis tanaman mengandung beberapa mikroba endofit yang terdiri dari bakteri dan cendawan. Mikroba endofit hidup bersimbiosis dengan tanaman di dalam jaringan tanaman, apabila mikroba tersebut mampu menghasilkan suatu agens biologis yang dapat memerangi penyakit tanaman, maka tanaman akan mampu terhindar dari penyakit yang juga disebabkan oleh mikroba lain (Melliawati et al. 2006). Mikroba endofit hidup mendapatkan nutrisi dari hasil metabolisme tanaman dan memproteksi tanaman melawan herbivora, serangga, patogen, sedangkan tanaman mendapat derivat nutrisi dan senyawa aktif yang diperlukan selama hidupnya (Tanaka et al. 1999).
Mekanisme penghambatan cendawan endofit terhadap patogen dapat secara langsung dengan mekanisme antagonis dan secara tidak langsung dengan mekanisme ketahanan terinduksi. Perlindungan tanaman dengan ketahanan terinduksi didasarkan pada rangsangan mekanisme ketahanan oleh adanya perubahan metabolik yang memungkinkan tanaman untuk lebih mengefektifkan ketahanannya. Ketahanan terinduksi dapat berkembang apabila sel-sel tanaman mampu menghasilkan enzim-enzim baru yang mengaktifkan gen tanaman yang bertanggung jawab dalam mekanisme ketahanan tanaman tersebut (Agrios 2005). Ariyanto et al. (2013) menyatakan proses budidaya tanaman memengaruhi keanekaragaman cendawan endofit pada jaringan tanaman.Cendawan endofit terdapat di dalam sistem jaringan tumbuhan, seperti daun, bunga, ranting ataupun akar tumbuhan (Clay 1988 dalam Istikorini 2008). Cendawan endofit yang banyak terdapat pada kakao dan tanaman berkayu diantaranya Mortierella, Arxiella, Acremonium, Stagonospora, dan Glonium. Cendawan endofit yang ditemukan pada daun kakao seperti Colletotrichum, Botryosphaeria, Xylaria,
Phomopsis, dan cendawan endofit akar seperti Clonostachys dan Trichoderma
(Mejia et al. 2008). Cendawan endofit mampu menghasilkan mikotoksin, enzim, serta antibiotik di tanaman sehat pada jaringan tertentu. Mikotoksin yang dihasilkan cendawan endofit seperti alkaloid pada rumput-rumputan melindungi inang dari serangan invetebrata herbivora, nematoda, dan patogen (Feeth 2002). Interaksi antara cendawan endofit dan akar kemungkinan mampu menginduksi ketahanan tanaman terhadap patogen yang berada pada bagian atas tanaman (Yedidia et al. 1999).
Penelitian pemberian kompos jerami dengan mikroba endofit dari akar belum banyak diuji terhadap penyakit tanaman pala. Penelitian ini diharapkan dapat menekan infeksi patogen yang ada di pembibitan tanaman pala dan menjadi alternatif pengendalian yang efektif, efisien, serta ramah lingkungan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan informasi awal potensi mikroba endofit dari akar pala sebagai agens hayati dan pengaruh kompos jerami yang diperkaya mikroba endofit dalam menekan infeksi cendawan patogen penyebab hawar daun dan mati ranting pada bibit tanaman pala
Manfaat Penelitian
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB), dan pekarangan Asrama Putri Tingkat Persiapan Bersama (TPB) IPB pada Februari hingga Desember 2014.
Bahan dan Alat
Alat yang digunakan yaitu laminar air flow, autoklaf, inkubator, labu erlenmeyer, tabung reaksi, cawan petri, timbangan, mortar, pipet mikro, shaker,
suntikan, jarum ose, corkborrer, vortex, segitiga penyebar, kamera, dan polybag. Bahan yang digunakan yaitu tanah, kompos jerami, tanaman pala,tanaman tembakau, benih padi IR64, media MEA (Malt Extract Agar), media PDA (Potato Dextrose Agar), media TSA (Tryptone Soy Agar), media LB (Luria Broth), media WA (Water Agar), alkohol 70%, NaOCl 2% dan 2.5%, KOH 3%, dan air steril.
Metode Penelitian Pembuatan Kompos
Pembuatan kompos menggunakan metode Ekawati (2003) yang telah dimodifikasi. Kompos terbuat dari jerami padi segar (60 kg), kapur pertanian (0.5 kg), dan air. Jerami padi dipotong-potong sepanjang 5-10 cm dan ditumpuk setinggi 1 m. Pemberian kapur pertanian yang telah dicampurkan air diberikan di setiap tumpukan jerami padi setinggi 10 cm. Tumpukan jerami padi ditutup rapat menggunakan terpal dan diinkubasi selama 8 minggu. Pembalikkan tumpukan jerami dilakukan setiap 1 minggu. Kelembaban tumpukan jerami dijaga agar kadar airnya 60-80 % atau apabila jerami diremas maka tidak meneteskan air. Peremajaan Isolat Patogen CP1 dan CP2
Isolat patogen CP1 merupakan koleksi Klinik Tanaman IPB, isolat diduga menyebabkan mati ranting pada tanaman pala di Aceh. Isolat CP2 merupakan isolat dari Tim Pala Aceh Selatan yang diperoleh dari isolasi akar tanaman pala sakit yang diduga terserang mati ranting pada tanaman pala di Aceh Selatan. Eksplorasi Mikroba Endofit
Eksplorasi Bakteri Endofit. Eksplorasi menggunakan metode sterilisasi permukaan bertingkat Hallmann et al. (1997) yang telah dimodifikasi. Sebanyak 1 g akar yang sudah steril permukaannya dihancurkan hingga halus menggunakan mortar steril dan ditambahkan air steril sebanyak 9 ml. Akar yang telah dihaluskan diambil sebanyak 1 ml dengan pipet mikro, dituangkan ke dalam tabung reaksi berisi 9 ml air steril dan dihomogenkan menggunakan vortex, dilakukan pengenceran berseri hingga tingkat pengenceran 10-5. Sebanyak 0.1 ml suspensi dari tingkat pengenceran 10-3, 10-4, dan 10-5 masing-masing dituangkan dan disebar menggunakan segitiga penyebar pada media TSA 10% sebanyak 3 ulangan dan diinkubasi selama 48 jam. Bakteri endofit yang tumbuh masing-masing diremajakan pada media TSA 100% berdasarkan bentuk dan warna koloni hingga mendapatkan isolat murni.
Eksplorasi Cendawan Endofit. Eksplorasi menggunakan metode Rodrigues (1994) yang telah dimodifikasi. Akar tanaman pala yang telah disterilisasi permukaan dipotong 1 cm dan dibelah secara ventral. Sebanyak 5 akar ditanam pada media MEA 10% dengan meletakkan bagian dalam akar menempel pada media dan diinkubasi selama 7 hari. Perlakuan dilakukan sebanyak 5 ulangan. Miselium yang tumbuh diremajakan pada media PDA 100 hingga mendapatkan isolat murni.
Uji Patogenesitas
Uji Patogenesitas Bakteri (Reaksi Hipersensitif). Uji hipersensitif bakteri dilakukan dengan mengambil bakteri 1 ose ditumbuhkan pada 5 ml media LB (Luria Broth) dalam tabung reaksi dan dihomogenkan menggunakan vortex
hingga terbentuk suspensi bakteri. Suspensi bakteri pada media LB diguncangkan dengan shaker kecepatan 100 rpm selama 20 jam. Suspensi bakteri sebanyak 0.5 ml disuntikkan pada permukaan bawah daun tembakau dan diinkubasi selama 24-48 jam. Kontrol menggunakan media LB tanpa bakteri endofit (Sholichah 2011). Pengamatan dilakukan pada reaksi hipersensitif yang terjadi.
Uji Patogenesitas Cendawan pada Benih. Uji patogenesitas cendawan menggunakan metode Nur’asiah (2011) yang telah dimodifikasi. Pengujian menggunakan benih padi varietas IR64. Benih padi disterilisasi permukaan menggunakan NaOCl 2% selama 5 menit, air steril sebanyak 3 kali dan dikeringanginkan menggunakan tisu steril. Sebanyak 15 benih padi ditanamkan pada media PDA yang telah ditumbuhkan isolat cendawan endofit berumur 5 hari sebanyak 3 ulangan dan diinkubasi selama 14 hari. Kontrol dilakukan dengan menanam benih pada media PDA tanda isolat cendawan endofit. Pengamatan dilakukan dengan menghitung persentase daya berkecambah benih dan gejala nekrotik yang muncul.
Uji in Vitro Aktivitas Mikroba Endofit
Daya hambat : d1 - d2 X 100% d1
d1 : diameter miselium cendawan patogen tanpa agens antagonis d2 : diameter miselium cendawan patogen dengan agens antagonis
Uji in Vitro Bakteri Endofit. Isolat bakteri endofit diambil sebanyak 1 ose
dan dilarutkan pad air steril 10 ml serta dihomogenkan menggunakan vortex. Sebanyak 1 ml suspensi bakteri dituangkan ke dalam cawan petri steril dan ditungkan juga media PDA yang hangat. Campur suspensi bakteri endofit dan media PDA dengan menggerakkan cawan petri membentuk angka 8 dan didiamkan hingga mengeras. Sebanyak 0.5 cm isolat cendawan patogen ditumbuhkan pada bagian tengan cawan tersebut dan diinkubasi pada suhu ruang selama 4 hari sebanyak 5 ulangan. Pengamatan dilakukan dengan mengukur pertumbuhan miselium cendawan patogen yang tumbuh .
Uji in Vitro Cendawan Endofit. Sebanyak 0.5 cm isolat cendawan patogen dan isolat cendawan endofit ditumbuhkan pada cawan petri yang sama berisi media PDA dengan masing-masing jarak 3 cm dari tepi cawan yang berlawanan dan diinkubasi pada suhu ruang selama 4 hari sebanyak 5 ulangan. Pengamatan dilakukan dengan mengukur pertumbuhan miselium cendawan patogen yang tumbuh.
Uji in Vivo Aktifitas Kompos Jerami dan Mikroba Endofit
Persiapan Media Tanam. Tanah yang digunakan berasal dari tempat pembelian bibit tanaman pala di daerah Tamansari, Kabupaten Bogor. Tanah yang digunakan dalam perlakuan diinfestasi dengan suspensi spora (konidia) dari isolat patogen (CP1dan CP2) dan diinkubasi selama 2 minggu dengan kerapatan 106 konidia/ml pada setiap polybag berukuran 20 cm x 20 cm.
Penanaman Bibit Pala. Bibit tanaman pala yang digunakan berumur 7 bulan. Pemberian kompos jerami, kombinasi kompos jerami-mikroba endofit, dan pemindahan bibit dilakukan setelah masa inkubasi tanah terinfestasi selesai. Perbandingan tanah dan kompos yang digunakan adalah 1:1. Penyiraman suspensi mikroba endofit dilakukan disekitar perakaran tanaman pala sebanyak 55 ml setiap polybag perlakuan dengan kerapatan 106 konidia/ml.
Tabel 1 Perlakuan uji in vivo terhadap patogen CP1 dan CP2 pada bibit tanaman pala
Percobaan Perlakuan yang diberikan
K Tanah terinfestasi patogen (kontrol)
KP Tanah terinfestasi patogen + kompos jerami
Skoring Penyakit
Pengamatan gejala yang terdapat di lapangan dilakukan dengan menghitung insidensi penyakit (IP) (%) dan keparahan penyakit (KP) (%) setiap minggu sejak munculnya gejala hingga 8 mst. Pengukuraan IP (%) dan KP (%) dihitung menggunakan formula :
Tabel 2 Kriteria skor penyakit berdasarkan gejala yang muncul di lapangan (Soekarno 2014 Desember 4, komunikasi pribadi)
Nilai skor Kategori gejala pada daun
0 tidak ada gejala
Rancangan Percobaan dan Analisis Data
Percobaan in vitro dan in vivo perhitungan pertambahan tinggi tanaman dan pertambahan jumlah daun disusun dalam Rancangan Acak Lengkap (RAL), sedangkan percobaan in vivo untuk menghitung insidensi penyakit dan keparahan penyakit disusun dalam Rancangan Acak Lengkap (RAL) in Time.
Pengujian in vitro dilakukan sebanyak 17 perlakuan dan masing-masing perlakuan dilakukan 5 ulangan. Adapun jenis perlakuan yaitu uji daya hambat 17 isolat mikroba endofit dari kelompok bakteri dan cendawan terhadap cendawan patogen (CP1 dan CP2).Rancangan percobaan uji in vivo sebanyak 3 perlakuan dan 3 ulangan, masing-masing ulangan terdiri dari 5 unit tanaman. Adapun jenis perlakuan yaitu tanah terinfestasi patogen (K), tanah terinfestasi patogen dan kompos jerami (KP), dan tanah terinfestasi patogen, kombinasi kompos jerami-mikroba endofit (KPE).
Data yang diperoleh diolah menggunakan Microsoft Office Excel 2007 dan di analisis sidik ragam (ANOVA) menggunakan program Statistical Analysis System (SAS) versi 9.1.3. Perlakuan yang berpengaruh nyata diuji lanjut dengan uji selang berganda Duncan (DMRT) dengan taraf nyata α = 5%.
IP (%) : n
N x 100%
KP (%) : Σ(ni x vi)
(N x V) x 100%
HASIL DAN PEMBAHASAN
Eksplorasi Mikroba Endofit
Total 62 isolat mikroba endofit yang terdiri dari kelompok bakteri dan cendawan berhasil diperoleh dari isolasi bagian akar tanaman pala sehat berumur 10 tahun dan >50 tahun yang berasal dari Aceh Selatan. Sebanyak 33 isolat dari isolasi akar sehat berumur 10 tahun terdapat 19 isolat bakteri endofit dan 14 isolat cendawan endofit, sedangkan sebanyak 29 isolat dari isolasi akar sehat >50 tahun terdapat 20 isolat bakteri endofit dan 9 isolat cendawan endofit (Gambar 1).
Gambar 1 Hasil isolasi mikroba endofit pada bagian akar tanaman pala sehat ( bakteri endofit; cendawan endofit)
Pengujian Patogenesitas Mikroba Endofit
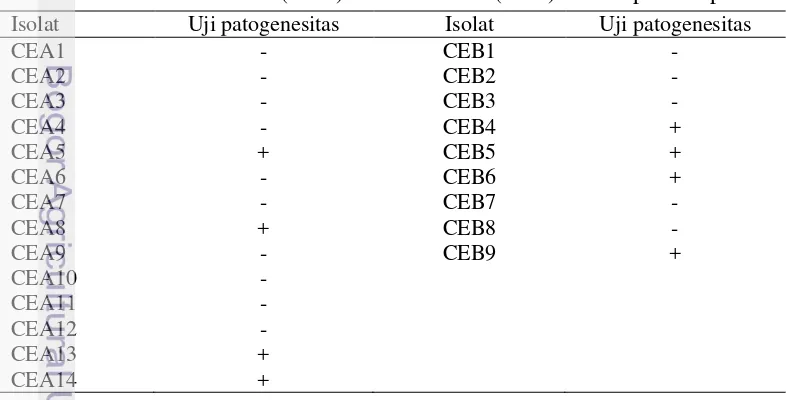
Hasil uji patogenesitas 23 isolat cendawan endofit terhadap benih padi IR64 menunjukkan beberapa isolat tidak mengganggu proses fisiologis tanaman padi. Sebanyak 8 isolat cendawan endofit tidak menimbulkan gejala nekrotik, tidak menghambat pertumbuhan tanaman padi, dan memiliki daya berkecambah lebih tinggi atau sama dengan kontrol, 4 isolat berasal dari akar tanaman pala berumur 10 tahun dan 4 isolat berasal dari akar tanaman pala berumur >50 tahun(Tabel 3). Tabel 3 Hasil uji patogenesitas isolat cendawan endofit akar tanaman pala
berumur 10 tahun (CEA) dan >50 tahun (CEB) terhadap benih padi
Isolat Uji patogenesitas Isolat Uji patogenesitas
CEA1 - CEB1 -
Ket: (-) isolat menimbulkan gejala nekrotik, (+) isolat tidak menimbulkan gejala nekrotik
Reaksi hipersensitif negatif merupakan isolat bakteri endofit menghasilkan gejala nekrotik pada bagian daun yang diinokulasi. Reaksi hipersensitif positif merupakan isolat bakteri endofit tidak menghasilkan gejala nekrotik pada daun tembakau dan isolat diigunakan untuk pengujian lebih lanjut. Hasil uji hipersensitif 39 isolat bakteri endofit menggunakan tanaman tembakau diperoleh sebanyak 9 isolat tidak menimbulkan gejala nekrotik pada daun tembakau, 3 isolat bearasal dari akar tanaman pala berumur 10 tahun dan 6 isolat berasal dari akar tanaman pala berumur >50 tahun (Tabel 4).
Tabel 4 Hasil uji hipersensitif isolat bakteri endofit akar tanaman pala berumur 10 tahun (BEA) dan >50 tahun (BEB) terhadap tanaman tembakau Isolat Uji hipersensitif Isolat Uji hipersensitif
BEA1 - BEB1 -
Ket: (-) isolat menimbulkan gejala nekrotik, (+) isolat tidak menimbulkan gejala nekrotik
Gambar 2 Hasil uji patogenesitas: tidak ada gejala nekrotik pada daun tembakau (a), gejala nekrotik pada daun tembakau (b), benih berkecambah normal (c), gejala nekrotik pada akar dan ruas batang bawah (d), dan pertumbuhan padi terhambat (e)
Kemampuan Mikroba Endofit dalam Penghambatan Patogen CP1 dan CP2 secara in Vitro
Isolat mikroba endofit yang tidak menimbulkan gejala nekrotik pada tanaman indikator dilakukan uji antagonisme dual culture terhadap cendawan patogen (CP1 dan CP2) untuk mengetahui kemampuannya dalam menghambat pertumbuhan patogen. Berdasarkan hasil peremajaan isolat patogen CP1 dan CP2, pertumbuhan kedua cendawan patogen mampu memenuhi cawan petri berdiameter 9 cm selama 3-4 hari, sedangkan pada isolat cendawan endofit non patogen, pertumbuhan isolat mampu memenuhi cawan berdiameter 9 cm rata-rata selama 7-10 hari dan isolat bakteri endofit non patogen mampu tumbuh pada media selama 1-2 hari. Beberapa isolat cendawan endofit dan bakteri endofit yang diperoleh dari akar pala sehat menunjukkan kemampuan antagonis yang tinggi.
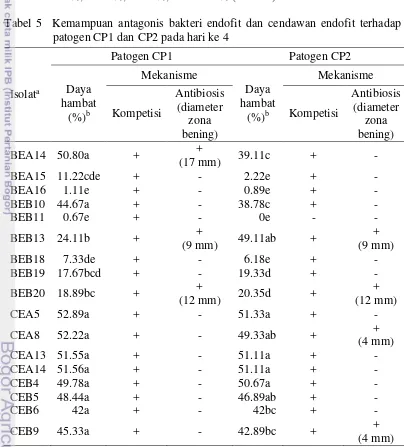
Hasil uji in vitro menunjukkan hampir semua isolat mikroba endofit mampu menghambat pertumbuhan miselium CP1 melalui mekanisme kompetisi ruang dan nutrisi. Sebanyak 4 isolat dari kelompok cendawan dan 1 isolat bakteri mampu menghambat pertumbuhan miselium patogen lebih dari 50%. Isolat dari kelompok cendawan yaitu CEA5, CEA8, CEA14, dan CEA13 dengan persentase penghambatan sebesar 52.89%, 52.22%, 51.56%, dan 51.55%, sedangkan kelompok bakteri yaitu BEA14 mampu menghambat sebesar 50.80%. Beberapa isolat dari kelompok bakteri endofit mampu menghambat pertumbuhan miselium patogen dengan mekanisme antibiosis dan kompetisi ruang dan nutrisi yaitu pada isolat kelompok bakteri BEA14, BEB13, dan BEB20 dengan diameter zona bening yang dihasilkan masing-masing sebesar 17 mm, 9 mm, dan 12 mm, serta masing-masing penghambatan miselium patogen sebesar 50.80%, 24.11%, dan 18.89% (Tabel 5).
a b
Pada penghambatan pertumbuhan miselium CP2, sebanyak 4 isolat dari kelompok cendawan mampu menghambat pertumbuhan miselium patogen lebih dari 50% dan pada isolat bakteri endofit tidak ada isolat yang mampu menghambat pertumbuhan miselium patogen lebih dari 50%. Isolat dari kelompok cendawan yaitu CEA5, CEA13, CEA14, dan CEB4 dengan persentase penghambatan sebesar 51.33%, 51.11%, 51.11%, dan 50.67%. Sebanyak 4 isolat dari kelompok bakteri dan cendawan mampu menghambat pertumbuhan miselium patogen melalui mekanisme antibiosis dan kompetisi ruang dan nutrisi yaitu BEB13, BEB20, CEA8, dan CEB9 dengan diameter zona bening sebesar 9 mm, 12 mm, 4 mm, dan 4 mm, serta masing-masing penghambatan miselium patogen sebesar 49.11%, 20.35%, 49.33%, dan 42.89% (Tabel 5).
Tabel 5 Kemampuan antagonis bakteri endofit dan cendawan endofit terhadap patogen CP1 dan CP2 pada hari ke 4
Isolata
Patogen CP1 Patogen CP2
Daya
Ket: (+) isolat menghasilkan mekanisme, (-) isolat tidak menghasilkan mekanisme, aBEA = bakteri
endofit asal akar tanaman berumur 10 tahun, BEB = bakteri endofit asal akar tanaman berumur >50 tahun, CEA = cendawan endofit asal akar tanaman berumur 10 tahun, CEB = cendawan
endofit asal akar tanaman berumur >50 tahun. bAngka-angka yang diikuti oleh huruf yang sama
Hasil pada tabel 5 menunjukkan besarnya diameter zona bening yang dihasilkan suatu isolat endofit tidak berpengaruh terhadap besarnya daya hambat kemampuan isolat endofit dalam mekanisme kompetisi ruang dan nutrisi. Beberapa isolat endofit menghasilkan mekanisme yang berbeda dalam menghambat pertumbuhan patogen. Hal ini terlihat pada mekanisme isolat BEA14 terhadap CP1 adalah kompetisi dan antibiosis, sedangkan terhadap CP2 hanya kompetisi, isolat CEA8 dan CEB9 terhadap CP1 hanya kompetisi, sedangkan terhadap CP2 kompetisi dan antibiosis. Hal ini disebabkan suatu isolat endofit mampu memproduksi antibiotik dan menghasilkan zona bening dalam menghambat pertumbuhan patogen tertentu karena adanya aktivitas kerja suatu patogen yang mampu merangsang proses produksi atau pembentukan antibiotik isolat endofit dan kemampuan antibiotik isolat endofit rendah atau hanya mampubekerja pada beberapa isolat patogen. Isolat yang menghasilkan zona bening teriindikasi bahwa isolat tersebut memproduksi senyawa antibiotik sebagai antifungi. Menurut Agrios (2005), mekanisme yang digunakan organisme biokontrol dalam melemahkan patogen tanaman diantaranya dengan memarasit patogen secara langsung, memproduksi antibiotik (toksin) terhadap patogen, kemampuan dalam kompetisi ruang dan nutrisi, produksi enzim untuk menyerang komponen sel patogen, menginduksi respon ketahanan tanaman, dan produksi metabolisme tanaman dalam menstimulasi perkecambahan spora patogen.
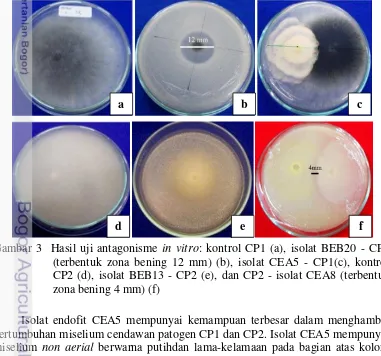
Gambar 3 Hasil uji antagonisme in vitro: kontrol CP1 (a), isolat BEB20 - CP1 (terbentuk zona bening 12 mm) (b), isolat CEA5 - CP1(c), kontrol CP2 (d), isolat BEB13 - CP2 (e), dan CP2 - isolat CEA8 (terbentuk zona bening 4 mm) (f)
Isolat endofit CEA5 mempunyai kemampuan terbesar dalam menghambat pertumbuhan miselium cendawan patogen CP1 dan CP2. Isolat CEA5 mempunyai miselium non aerial berwarna putihdan lama-kelamaan pada bagian atas koloni ada butiran seperti serbuk berwana hitam, pertumbuhan tidak kompak, dan lama-kelamaan menebal (Lampiran 2). Isolat CEA5 digunakan pada uji selanjutnya.
a b c
Kemampuan Kompos Jerami dan Mikroba Endofit dalam Penghambatan Patogen CP1 dan CP2 secara in Vivo
Inokulasi cendawan patogen CP1 dan CP2 dilakukan dengan menginfestasi tanah yang digunakan pada perlakuan sebagai inang awal patogen. Hasil pengamatan di lapangan, gejala mulai terlihat pada 4 minggu setelah perlakuan dangejala banyak ditemukan pada 7 minggu setelah perlakuan pada beberapa tanaman perlakuan. Gejala awal terlihat ditulang daun pada daun muda, membentuk bercak coklat kekuningan yang menyebar, menyebabkan daun mengering dan menggantung, beberapa daun ditemukan gugur. Pengamatan pada bagian akar sedikit ditemukan miselium berwarna putih di beberapa akar sekunder dan bagian ujung akarmengalami busuk. Apabila kulit akar yang terdapat miselium dilepas terlihat tanda kecoklatan di bagian dalam akar. Pada akar primer tidak ditemukan miselium berwarna putih dan tanda kecoklatan pada xilem (Gambar 4).
Gambar 4 Gejala yang ditemukan di lapangan: gejala pada tulang daun dan hawar daun (a), daun mengering dan menggantung (b), miselium pada akar sekunder dan ujung akar membusuk (c), dan gejala nekrotik di bagian dalam akar sekunder (d)
Patogen yang diinfestasikan ke tanah diduga menginokulasi tanaman melalui meristem apikal yang belum dilapisi tudung akar, melakukan penetrasi, dan infeksi spora (konidia) atau hifa ke jaringan pengangkut, patogen menghambat pengangkutan air melalui jaringan xilem dan menyebabkan gejala muncul pada daun muda. Hasil penelitian Surapati (2011), gejala mati ranting yang menyerang tanaman kakao masuk melalui luka baru, menginfeksi inang melalui jaringan xilem, daun menjadi layu, kering, dan mati. Harni (2012) melaporkan serangan penyakit akar pada tanaman pala mengakibatkan daun menguning dan layu dari bagian pucuk, serangan yang parah akan berlanjut dari satu cabang ke cabang lainnya dan tanaman mati meranggas, serta hasil pantauan
a b
0
ranting mengering, daun menggantung, terjadi perubahan warna pada bagian akar dan terdapat miselium pada leher akar atau pangkal batang (Darwis et al. 2013).
Perlakuan uji in vivo terhadap patogen CP1 dan CP2 yaitu tanah terinfestasi patogen (K), tanah terinfestasi patogen dan kompos jerami (KP), dan tanah terinfestasi patogen dan kombinasi kompos jerami-cendawan endofit CEA5 (KPE). Pengamatan insidensi penyakit dan keparahan penyakit dihitung berdasarkan gejala yang muncul pada daun muda bibit tanaman pala dimulai pada 4 minggu setelah perlakuan atau mulai munculnya gejala di lapangan. Pengamatan pertumbuhan bibit tanaman pala dilakukan setiap minggu setelah perlakuan dengan menghitung pertambahan tinggi tanaman dan pertambahan jumlah daun.
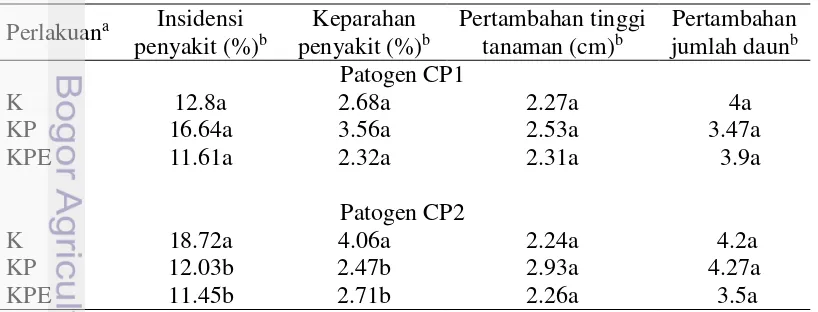
Hasil uji in vivo terhadap patogen CP1, perlakuan KP dan KPE tidak memberikan pengaruh yang nyata terhadap insidensi penyakit dan keparahan penyakit, sedangkan terhadap patogen CP2, perlakuan KP dan KPE mampu menurunkan secara nyata insidensi penyakit dan keparahan penyakit (Tabel 6). Hal ini diduga karena ketahanan inang terhadap suatu patogen berbeda, kemampuan virulensi patogen yang berbeda, kemampuan penetrasi, infeksi, dan invasi patogen berbeda, dan kondisi lingkungan yang mampu mendukung perkembangan patogen. Hasil pengujian inokulasi patogen CP1 terhadap ranting tanaman pala yang pernah dilakukan Klinik Tanaman Departemen Proteksi Tanaman, gejala mulai muncul di ranting tanaman pala pada 10 bulan setelah inokulasi (Tondok 2014 Oktober 8, komunikasi pribadi).
Hasil uji in vivo terhadap patogen CP1 dan CP2, perlakuan KP dan KPE tidak memberikan pengaruh yang nyata terhadap pertumbuhan tanaman pala, baik pada pertambahan tinggi maupun pertambahan jumlah daun (Tabel 6). Hal ini memperlihatkan bahwa pemberian kompos jerami dan cendawan endofit CEA5 belum mampu memacu pertumbuhan tanaman pala selama pengamatan 2 bulan terhadap tanaman tahunan. Akan tetapi, perlakuan KP memiliki pertambahan tinggi yang lebih besar dibandingkan KPE dan K.
Tabel 6 Pengaruh perlakuan terhadap insidensi penyakit, keparahan penyakit, pertambahan tinggi tanaman, dan pertambahan jumlah daun yang diinokulasi patogen CP1 dan CP2
Perlakuan KPE yang diinokulasikan patogen CP1 dan CP2 tetap menunjukkan gejala pada daun. Hal ini diduga cendawan endofit CEA5 yang diberikan setelah infestasi patogen tidak sepenuhnya menekan populasi patogen. Perlakuan KPE memiliki insidensi penyakit terendah dibandingkan K dan KPE terhadap kedua patogen. Hasil penelitian Lubis (2002), pemberian kompos alang-alang dengan inokulasai Trichoderma viridae dapat menekan dan menghilangkan pertumbuhan dan perkembangan infeksi jamur akar putih pada bibit karet, serta berpengaruh nyata pada pertambahan tinggi dan jumlah daun bibit karet yang diinokulasikan jamur akar putih selama pengamatan 23 mst (minggu setelah tanam). Menurut Saraswati et al (2009), mikroba endofit menyediakan sumber hara bagi tanaman, melindungi akar dari gangguan hama dan penyakit, menstimulir sistim perakaran agar berkembang sempurna memperpanjang usia akar, memacu mitosis jaringan meristem pada titik tumbuh pucuk, kuncup bunga, dan stolon, sebagai penawar racun beberapa logam berat, sebagai metabolit pengatur tumbuh, dan bioaktivator perombak bahan organik.
Identifikasi Cendawan Patogen CP1 dan CP2
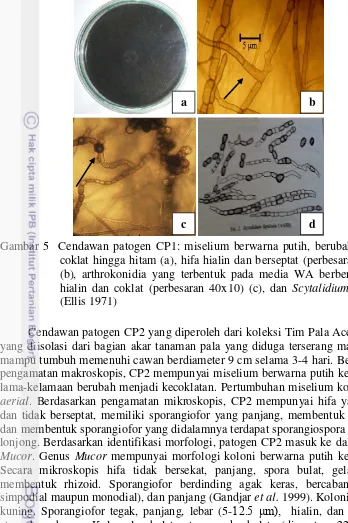
Gambar 5 Cendawan patogen CP1: miselium berwarna putih, berubah menjadi coklat hingga hitam (a), hifa hialin dan berseptat (perbesaran 40x10) (b), arthrokonidia yang terbentuk pada media WA berbentuk bulat hialin dan coklat (perbesaran 40x10) (c), dan Scytalidium lignicola
(Ellis 1971)
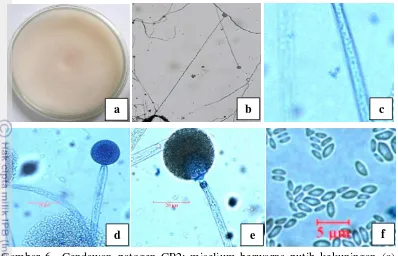
Cendawan patogen CP2 yang diperoleh dari koleksi Tim Pala Aceh Selatan yang diisolasi dari bagian akar tanaman pala yang diduga terserang mati ranting mampu tumbuh memenuhi cawan berdiameter 9 cm selama 3-4 hari. Berdasarkan pengamatan makroskopis, CP2 mempunyai miselium berwarna putih kekuningan, lama-kelamaan berubah menjadi kecoklatan. Pertumbuhan miselium kompak dan
aerial. Berdasarkan pengamatan mikroskopis, CP2 mempunyai hifa yang hialin dan tidak berseptat, memiliki sporangiofor yang panjang, membentuk kolumela, dan membentuk sporangiofor yang didalamnya terdapat sporangiospora berbentuk lonjong. Berdasarkan identifikasi morfologi, patogen CP2 masuk ke dalam genus
Mucor. Genus Mucor mempunyai morfologi koloni berwarna putih kekuningan. Secara mikroskopis hifa tidak bersekat, panjang, spora bulat, gelap. Tidak membentuk rhizoid. Sporangiofor berdinding agak keras, bercabang (secara simpodial maupun monodial), dan panjang (Gandjar et al. 1999). Koloni berwarna kuning. Sporangiofor tegak, panjang, lebar (5-12.5 μm), hialin, dan sederhana atau bercabang. Kolumela bulat atau agak bulat (diameter 22.5-28μm). Sporangiospora berbentuk elips panjang berbagai ukuran ((3.7) 5-6.3 x 2-2.8 (3.5) μm) dan berada di dalam sporangium berbentuk bulat (diameter 57-85 μm) (Watanabe 2002).
a b
Gambar 6 Cendawan patogen CP2: miselium berwarna putih kekuningan (a), sporangiofor panjang (perbesaran 10x10) (b), hifa hialin dan tidak berseptat (perbesaran 40x10) (c), kolumela bulat (perbesaran 40x10) (d), Sporangium (perbesaran 40x10), dan sporangiospora berbentuk lonjong (perbesaran 40x10) (e)
a b c
SIMPULAN DAN SARAN
Simpulan
Sebanyak 9 isolat bakteri dan 8 isolat cendawan dapat diisolasi dari jaringan akar tanaman pala dan memiliki potensi sebagai agens hayati. CEA5 adalah isolat cendawan endofit yang mempunyai daya hambat paling tinggi untuk menekan pertumbuhan patogen Scytalidium sp. (CP1) dan Mucor sp. (CP2) secara in vitro. Penambahan kompos jerami yang diperkaya dengan isolat cendawan endofit CEA5 hanya mampu menekan insidensi penyakit dan keparahan penyakit yang disebabkan patogen Mucor sp. (CP2) pada bibit tanaman pala.
Saran
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. 5th edition. New York (US): Elsevier.
Ariyanto EF, Abadi AL, Djauhari S. 2013. Keanekaragaman Jamur Endofit pada Daun Tanaman Padi (Oryzasativa L.) dengan Sistem Pengolahan Hama Terpadu dan Konvensional di Desa Bayem, Kecamatan Kasembon, Kabupaten Malang. Jurnal HPT. 1(2):37-51.
Backman PA, Sikora RA. 2008. Endophytes:an emerging tool for biological control. Biol Contr. 46(1):1-3. doi:10.1016/j.bio control.2008.03.009.
Bacon CW, Hinton DM. 2006. Bacterial endophytes: the endophytic niche, its occupants, and its utility. Di dalam: Gnanamanickam SS, editor. Plant-Associated Bacteria. AA Dordrecht (NL): Springer.
Benhamou N, Kloepper JW, Quadt-Hallmann A, Tuzun S. 1996. Induction of defense-related ultrastructural modification in pea toot tissue inoculated with endophytic bacteria. Plant Physiol. 112(3):919-929.
[BPS] Badan Pusat Statistik. 2014. Produksi perkebunan rakyat menurut jenis tanaman (ribu ton) [Internet]. [diunduh 2014 Sept 18]. Tersedia pada: http://www.bps.go.id.
Darwis HS, Wahyunita, Syahnen. 2013. Waspada pada penyakit akar tanaman pala [Internet]. Medan (ID): Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBPPTP) Medan; [diunduh 2013 Des 18]. Tersedia pada: http://ditjenbun.pertanian.go.id/bbpptpmedan/berita-267-waspadai-penyakit-pada-akar-tanaman-pala.html.
[Ditjenbun] Direktorat Jendral Perkebunan. 2012. Pedoman Teknis Perluasan Tanaman Pala Tahun 2012. Jakarta (ID): Direktorat Jenderal Perkebunan, Kementerian Pertanian. Jakarta.
Ekawati I. 2003. Pengaruh pemberian inokulum terhadap kecepatan pengomposan jerami padi. J. Trop. 11(2):144-152.
Ellis MB. 1971. Dematiaceous Hyphomycetes. Surrey (GB): Commonwealth Mycological Institute.
Faeth SH. 2002. Are endophytic fungi defensive plant mutualists?. Oikos.
98(1):25-36.
Gandjar I, Samson RA, Tweelvermeulen K, Oetari A, SantosoI. 1999. Pengenalan Kapang Tropik Umum. Jakarta (ID): Yayasan Obor Indonesia.
Istikorini Y. 2008. Potensi cendawan endofit untuk mengendalikan penyakit antraknosa pada cabai (Capsicum annum L.) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Lubis IF. 2002. Pengaruh pemberian kompos alang-alang (Imperata cylindrica) dengan inokulasi Trichoderma viridae terhadap perkembangan infeksi jamur akar putih (Rigidoporus lignosus) dan pertumbuhan bibit karet (Havea brasiliensis Muell Arg.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Mejia LC, Rojas EI, Maynard Z, Bael SV, Arnold AE, Hebbar P, Samuels GJ, Robbins N, Herre EA. 2008. Endophytic fungi as biocontrol agens of
Theobroma cacao pathogens. Biol Contr. 46(1):4-14. doi:10.1016/j.bio control.2008.01.012.
Melliawati R, Widyaningrum DN, Djohan AC, Sukiman H. 2006. Pengkajian bakteri endofit penghasil senyawa bioaktif untuk proteksi tanaman.
Biodiversitas. 7(3):221-224.
Murbandono L. 2001.Membuat Kompos. Jakarta (ID): Penebar Swadaya.
Nur’asiah. 2011. Keanekaragaman dan kelimpahan cendawan endofit pada batang padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Praptosuwiryo et al. 2001. Tantangan Pengembangan dan Fakta Jenis Tanaman Rempah. Bogor (ID): Prosea Indonesia.
Rodrigues KF. 1994. The foliar fungal endophytes of the Amazonian palm
Euterpe oleracea. Mycologia. 86(1):376-385.
Saraswati R, Prihatini T, Hastuti RD. 2009. Lahan Sawah dan Teknologi Pengelolaannya. Bogor (ID): Pusat Penelitian dan Pengembangan Tanah dan Agroklimat, Badan Penelitian dan Pengembangan Pertanian, Deptan. Semangun H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia.
Yogyakarta (ID): Gadjah Mada University Press.
Solichah YR. 2011. Eksplorasi bakteri dan cendawan yang berasosiasi dengan busuk buah pepaya (Carica papaya L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Surapati U. 2011. Ceratocystis sp.: Penyebab penyakit baru pada tanaman kakao (Theobroma cacao L.) di Indonesia. Prosiding Seminar dan Pertemuan Tahunan XXI PEI, PFI Komda Sulawesi Selatan dan Dinas Perkebunan; 2011 Juni 7; Hotel Singgasana Makassar. Makassar (ID). hlm 157-162. Tanaka M, Sukiman H, Takebayashi M, Saito K, Suto M, Prana TK, Prana MS,
Fusao T. 1999. Isolation, screening and phylogenetic identification of endophytes from plants in hokkaido japan and java indonesia. Microb Environ. 14(4):237-241.
Watanabe T. 2002. Pictorial Atlas of Soil and Seed Fungi Morphologies of Cultured Fungi and Key to Species. 2nd ed. Boca Raton (US): CRC Press. Wilia W, Alia Y, Novita T. 2011. Eksplorasi cendawan endofit dari beberapa
varietas kedelai sebagai agens pemacu pertumbuhan tanaman. J. Penelitian Univ. Jambi Seri Sains. 13(1):33-38
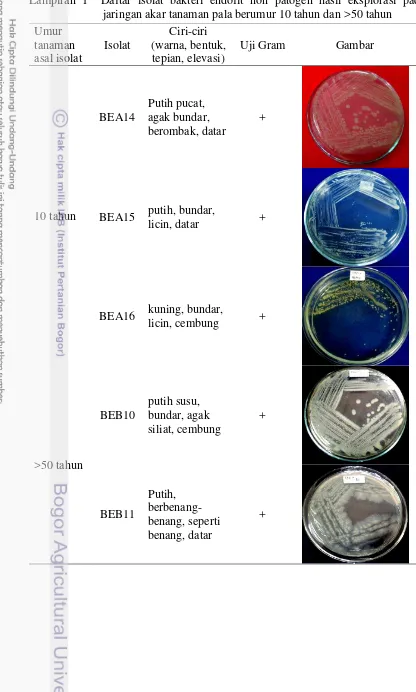
Lampiran 1 Daftar isolat bakteri endofit non patogen hasil eksplorasi pada jaringan akar tanaman pala berumur 10 tahun dan >50 tahun
Umur tanaman asal isolat
Isolat
Ciri-ciri (warna, bentuk, tepian, elevasi)
Uji Gram Gambar
10 tahun
BEA14
Putih pucat, agak bundar, berombak, datar
+
BEA15 putih, bundar,
licin, datar +
BEA16 kuning, bundar,
licin, cembung +
>50 tahun
BEB10
putih susu, bundar, agak siliat, cembung
+
BEB11
Putih, berbenang-benang, seperti benang, datar
Umur jaringan akar tanaman pala berumur 10 tahun dan >50 tahun
Umur tanaman asal isolat
Isolat Ciri morfologi cendawan
endofit pada media agar Gambar
10 tahun CEA5
Pada bagian atas dan bawah media, miselium non aerial
Umur tanaman asal isolat
Isolat Ciri morfologi cendawan
endofit pada media agar Gambar
10 tahun
CEA8
Pada bagian atas dan bawah medai, miselium non aerial
berwarna putih kekuningan dan transparan, pertumbuhan kompak, tipis, dan teksturnya halus.
CEA13
Pada bagian atas dan bawah media, miselium non aerial
berwarna putih, pada bagian
Pada bagian atas dan bawah media, miselium non aerial
berwarna putih, lama
Pada bagian atas dan bawah media, miselium non aerial
Umur tanaman asal isolat
Isolat Ciri morfologi cendawan
endofit pada media agar Gambar
>50 tahun
CEB6
Pada bagian atas dan bawah media, miselium non aerial
berwarna putih, lama
Pada bagian atas dan bawah media, miselium non aerial
berwarna putih keunguan, pertumbuhan tidak seperti kapas, kompak, dan menebal.
Lampiran 3 Hasil analisis sidik ragam kemampuan bakteri endofit dan cendawan endofit terhadap patogen CP1 secara in vitro
Sumber Perlakuan 16 31816.37104 1988.52319 29.92 <.0001 Galat 68 04519.98060 0066.47030
Total 84 36336.35164
R-Square = 0.876; CV = 24.306
Lampiran 4 Hasil analisi sidik ragam kemampuan bakteri endofit dan cendawan endofit terhadap patogen CP2 secara in vitro
Sumber
Perlakuan 16 32033.85760 2002.11610 66.45 <.0001 Galat 68 02048.69064 0030.12780
Total 84 34082.54824
R-Square = 0.940; CV = 16.624
Lampiran 5 Hasil analisis sidik ragam pengaruh perlakuan terhadap insidensi penyakit yang diinokulasi patogen CP1
Lampiran 6 Hasil analisis sidik ragam pengaruh perlakuan terhadap keparahan penyakit yang diinokulasi patogen CP1
Sumber
Galat 42 111.5012267 2.6547911
Total 44 123.5998800
R-Square = 0.098; CV = 57.117
Lampiran 7 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan tinggi tanaman yang diinokulasi patogen CP1
Sumber Perlakuan 2 0.12168889 0.06084444 0.28 0.7643
Galat 6 1.29840000 0.21640000
Total 8 1.42008889
R-Square = 0.086; CV = 19.619
Lampiran 8 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan jumlah daun yang diinokulasi patogen CP1
Sumber Perlakuan 2 0.50666667 0.25333333 0.24 0.7904
Galat 6 6.21333333 1.03555556
Total 8 6.72000000
R-Square = 0.075; CV = 26.780
Lampiran 9 Hasil analisis sidik ragam pengaruh perlakuan terhadap insidensi penyakit yang diinokulasi patogen CP2
Sumber
Lampiran 10 Hasil analisis sidik ragam pengaruh perlakuan terhadap keparahan penyakit yang diinokulasi patogen CP2
Lampiran 11 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan tinggi tanaman yang diinokulasi patogen CP2 Sumber
keragaman
Derajat bebas
Jumlah kuadrat
Kuadrat tengah
F-hitung Pr>F Perlakuan 2 0.97128889 0.48564444 3.87 0.0831
Galat 6 0.75226667 0.12537778
Total 8 1.72355556
R-Square = 0.564; CV = 14.265
Lampiran 12 Hasil analisis sidik ragam pengaruh perlakuan terhadap pertambahan jumlah daun yang diinokulasi patogen CP2 Sumber
keragaman
Derajat bebas
Jumlah kuadrat
Kuadrat tengah
F-hitung Pr>F Perlakuan 2 0.98666667 0.49333333 1.04 0.4103
Galat 6 2.85333333 0.47555556
Total 8 3.84000000
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada 16 September 1992 dari pasangan Agus Junaedi dan Pajinah. Penulis adalah putri pertama dari 2 bersaudara. Penulis menamatkan pendidikan di TK Al-Muhadjirin I Bekasi tahun 1998, di SDN Aren Jaya XI Bekasi tahun 2004, di SMPN 11 Bekasi tahun 2007, dan di SMA PGRI 1 Bekasi tahun 2010. Pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor, Fakultas Pertanian, Departemen Proteksi Tanaman melalui jalur USMI (Undangan Saringan Masuk IPB).
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Dasar-Dasar Proteksi Tanaman tahun 2013, asisten praktikum Ilmu Hama Tumbuhan Dasar tahun 2013, asisten praktikum Pengendalian Hayati dan Pengelolaan Habitat tahun 2014, asisten praktikum Penyakit Benih dan Pasca Panen tahun 2014, dan asisten praktikum Dasar Perlindungan Tanaman Diploma IPB tahun 2014. Penulis juga aktif sebagai staf Divisi Keprofesian Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) tahun 2013, staf Departemen Fasilitas dan Properti UKM Lises Gentra Kaheman tahun 2012, anggota Entomologi Club, dan beberapa kepanitiaan. Penulis pernah lolos seleksi IPB dalam Pekan Kreativitas Mahasiswa di bidang PKM-K tahun 2012 dan 2013 dengan judul “Arthropode T-Shirt Kaos Edukasi Unik Dunia Arthropoda” dan “DOKAR, Donat Bakar Berbahan Dasar Singkong Upaya Peningkatan Gengsi Singkong sebagai Alternatif Pangan”. Penulis juga pernah mengikuti kegiatan yang diadakan LPPM IPB yaitu IGTF (IPB Goes To Field) 2012 dengan tema “Pengendalian Hama
Terpadu di Kabupaten Klaten”, dan Kuliah Kerja Profesi Faperta Fema tahun