VALIDASI SEKUNDER METODE UJI
STAPHYLOCOCCUS AUREUS PADA PRODUK SUSU CAIR
KARINA PUTRI WARDANI
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Validasi Sekunder Metode Uji Staphylococcus aureus pada Produk Susu Cair adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Karina Putri Wardani
ABSTRAK
KARINA PUTRI WARDANI. Validasi Sekunder Metode Uji
Staphylococcus aureus pada Produk Susu Cair. Dibimbing oleh HARSI DEWANTARI KUSUMANINGRUM.
Staphylococcus aureus adalah sekumpulan bakteri penghasil enterotoksin yang berbentuk bulat seperti anggur, non motil, pembentuk spora dan bersifat Gram positif. Bakteri ini biasa digunakan untuk mengidentifikasi tingkat sanitasi dalam berbagai produk makanan dan minuman. Tujuan dari penelitian ini adalah untuk memverifikasi metode uji analisis Staphylococcus aureus secara kuantitatif pada susu cair. Metode uji pada penelitian ini mengacu pada SNI 2332.9:2011. Karakteristik kinerja yang dilakukan meliputi parameter akurasi (derajat keterulangan kembali) dan presisi (RSD). Hasil menunjukkan nilai derajat keterulangan kembali dari metode ini sebesar 106.23 - 124.30 % (inokulum 101) dan 84.55 - 115.57 % (inokulum 102), serta nilai RSD sebesar 0.00173 % (inokulum 101) dan 0.0422 % (inokulum 102). Dapat disimpulkan bahwa hasil metode pengujian bakteri Staphylococcus aureus pada susu cair memiliki karakteristik kinerja yang baik. Serangkaian uji tambahan seperti uji koagulase menggunakan plasma kelinci dan staphylase test kit juga dilakukan, dan hasil menunjukkan bakteri yang tumbuh setelah dilakukan spiking pada susu cair adalah bakteri Staphylococcus aureus.
ABSTRACT
KARINA PUTRI WARDANI. Secondary Validation for Staphylococcus Aureus Analysis Test Method in Liquid Milk. Supervised by HARSI DEWANTARI KUSUMANINGRUM.
Staphylococcus aureus is an enterotoxin bacteria which have coccus form, non-motil, spore and Gram positive. These bacteria are used to identify sanitation level in food and beverages products. This study aimed to validate quantitative test method for enumeration of Staphylococcus aureus in liquid milk. The test method used the reference from SNI 2332.9:2011. Several performance characteristics such as accuration (percent recovery) and precision (RSD) were evaluated. The results showed that percent recovery of the analysis method was valued 106.23 - 124.30 % (inoculum 101), 84.55 - 115.57 % (inoculum 102), with RSD valued 0.00173 (inoculum 101) and 0.0422 (inoculum 102). It can be concluded that the results of test method Staphylococcus aureus bacteria in liquid milk has good performance characteristics. Additional tests to confirm the Staphylococcus aureus bacteria was also performed, such as coagulase test using rabbit plasma and staphylase test kit. The results showed that the bacteria which grow after spiking in the liquid milk was Staphylococcus aureus.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
VALIDASI SEKUNDER METODE UJI
STAPHYLOCOCCUS AUREUS PADA PRODUK SUSU CAIR
KARINA PUTRI WARDANI
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas karunia dan keberkahanNya sehingga penulis dapat menyelesaikan skripsi yang berjudul Validasi Sekunder Metode Uji Staphylococcus aureus pada Produk Susu Cair dengan baik.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Harsi D. Kusumaningrum selaku pembimbing utama yang telah memberikan masukan, kritik serta perhatian kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Dr. Ir. Hanifah Nuryani Lioe, Msi serta pihak Laboratorium Departemen Ilmu dan Teknologi Pangan (LDITP) Fakultas Teknologi Pertanian, Institut Pertanian Bogor yang telah berkenan membantu penulis selama penelitian.
Ucapan terima kasih sebesar-besarnya kepada Papa Drs. Imran Subekti Soeriadinata dan Mama Rochmadina Siregar, SE yang selalu sabar, baik, lucu dan tidak bosan memberikan motivasi, saran serta kasih sayang kepada penulis. Terima kasih kepada kakak Randi Aditya, MSi atas segala bantuan, baik moril maupun non moril, serta masukan yang sangat berguna bagi penulis. Terima kasih juga kepada keluarga besar almarhum Opung Ibrahim Siregar atas perhatian dan dukungan yang selalu tercurah untuk penulis.
Terima kasih kepada para teknisi di Laboratorium Mikrobiologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor terutama Teh Nurul dan Mas Edi yang telah membantu penulis selama pelaksanaan penelitian. Terima kasih juga kepada Mbak Arie dan Mbak Lira atas bantuan selama penelitian penulis berlangsung. Ucapan terima kasih juga penulis sampaikan kepada rekan-rekan ITP 46 atas segala bantuan selama penulis berkuliah dan penelitian, serta pengalaman hidup yang tidak akan pernah penulis dapatkan di tempat lain.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR ISI iv
DAFTAR TABEL v
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 4
Manfaat Penelitian 4
METODOLOGI PENELITIAN 4
Waktu dan Tempat 4
Bahan dan Alat 4
Metode Penelitian 5
HASIL DAN PEMBAHASAN 12
Kemurnian Kultur Uji 12
Jumlah Koloni Staphylococcus aureus pada Media BPA (Baird Parker Agar) 12 Keberadaan Enzim Katalase pada Kultur Awal Bakteri Staphylococcus
aureus 13
Keberadaan Enzim Koagulase pada Kultur Awal Bakteri Staphylococcus
aureus 14
Jumlah Kultur Awal Bakteri Staphylococcus aureus setelah Inkubasi 24 Jam
di BHI Broth 15
Verifikasi Metode Uji Bakteri Staphylococcus aureus pada Produk Susu Cair 15
SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 25
DAFTAR TABEL
1 Cemaran mikroba maksimum pada susu (SNI 7388:2009) 1 2 Parameter verifikasi untuk uji Mikrobiologi (USP 2007 dalam Ismail
2009) 3
3 Desain penelitian 8
4 Jumlah kultur awal pada BHI broth setelah inkubasi 24 jam pada suhu (35±1) °C, dihitung pada media BPA yang diinkubasi secara aerob 15 5 Jumlah koloni pada kultur murni dan yang telah dilakukan spiking pada
susu cair yang ditambahkan pada media BPA 16
6 Jumlah perolehan kembali Staphylococcus aureus dengan perhitungan mengacu pada SNI 2332.9:2011 (20 - 200 koloni) dengan 2 tingkat
inokulum yang dilakukan 6 kali ulangan 17
7 Nilai RSD dan % CV dari 6 kali ulangan 17
8 Hasil uji koagulase menggunakan plasma kelinci dan staphylase test
OXOID pada sampel kultur murni dan susu cair 19
9 Hasil uji katalase menggunakan H2O2 19
10 Hasil uji fermentasi manitol secara anaerob 20
11 Hasil uji Staphylococcus aureus pada susu cair (Sampel Susu
Pasteurisasi dan UHT) 21
DAFTAR GAMBAR
1 Diagram persiapan media BPA (Baird Parker Agar) 5
2 Persiapan kultur kerja Staphylococcus aureus 6
3 Cara kerja perhitungan jumlah koloni Staphylococcus aureus 8 4 Diagram verifikasi jumlah koloni Staphylococcus aureus pada susu cair 11 5 Kultur murni bakteri Staphylococcus aureus perbesaran 1000 kali 12 6 Hasil penambahan kultur awal bakteri Staphylococcus aureus pada
tingkat pengenceran 10-5 sampai 10-7 13
7 Hasil uji katalase kultur awal bakteri Staphylococcus aureus 13 8 Tipe reaksi uji koagulase menggunakan staphylase test OXOID 14 9 Hasil uji koagulase kultur awal bakteri Staphylococcus aureus
menggunakan staphylase test OXOID 15
10 Tipe reaksi uji koagulase menggunakan plasma kelinci (SNI
2332.9:2011) 18
11 Hasil uji fermentasi manitol secara anaerob 21
DAFTAR LAMPIRAN
1 Jumlah awal kultur Staphylococcus aureus 26
2 Perhitungan RSD kultur dengan inokulum 101 27
PENDAHULUAN
Latar Belakang
Susu merupakan suatu hasil sekresi dari kelenjar susu hewan mammalia. Susu dihasilkan dari beberapa hewan mammalia, seperti sapi, kerbau, kambing serta domba, biasa diolah lebih lanjut untuk dikonsumsi oleh manusia (Walstra et. al. 2006).
Susu disebut sebagai makanan yang hampir sempurna karena kandungan zat gizinya yang lengkap. Selain air, susu mengandung protein, karbohidrat, lemak, mineral, enzim-enzim, gas serta vitamin A, C dan D dalam jumlah memadai (Astawan 2005). Meskipun susu memiliki potensi besar dalam penyediaan nutrisi, tetapi ada batasan konsumsi susu dengan proporsi yang besar dimana terdapat beberapa orang dewasa yang tidak memiliki daya tahan terhadap laktosa (lactose intolerance) (Schmidt 1988). Susu yang pada umumnya dikonsumsi masyarakat adalah susu olahan baik dalam bentuk cair (susu pasteurisasi, susu UHT) maupun susu bubuk. Susu yang akan dikonsumsi harus memenuhi beberapa persyaratan mutu, seperti batas cemaran mikroba maksimum. Hal ini dapat dilihat pada SNI 7388:2009 tentang batas cemaran mikroba maksimum pada susu.
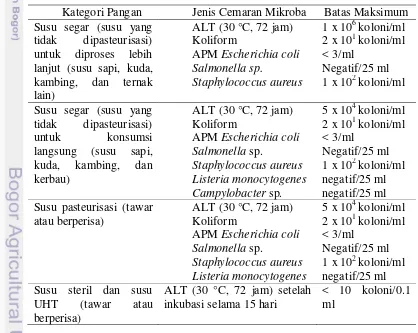
Tabel 1. Cemaran mikroba maksimum pada susu (SNI 7388:2009)
Kategori Pangan Jenis Cemaran Mikroba Batas Maksimum Susu segar (susu yang APM Escherichia coli < 3/ml
Salmonellasp. Negatif/25 ml
Staphylococcus aureus 1 x 102 koloni/ml Susu segar (susu yang APM Escherichia coli < 3/ml
Salmonella sp. Negatif/25 ml
Staphylococcus aureus 1 x 102 koloni/ml
Listeria monocytogenes negatif/25 ml
Campylobacter sp. negatif/25 ml Susu pasteurisasi (tawar
atau berperisa)
ALT (30 °C, 72 jam) 5 x 104 koloni/ml Koliform 2 x 101 koloni/ml APM Escherichia coli < 3/ml
Salmonella sp. Negatif/25 ml
Staphylococcus aureus 1 x 102 koloni/ml
2
Untuk mengetahui kesesuaian suatu metode pengujian dengan persyaratan mutunya, produk susu cair perlu diuji dengan metode yang valid dan metode pengujian yang dilakukan perlu divalidasi. Validasi diperlukan untuk mendapatkan hasil analisis yang valid/absah, dapat dipercaya, dapat dipertanggungjawabkan secara ilmiah, dan kesesuaian dengan tujuan (Sukarno 2005).
Validasi adalah konfirmasi dengan pengujian dan penyediaan bukti objektif bahwa persyaratan tertentu untuk suatu maksud khusus dipenuhi (ISO 2008). Suatu laboratorium harus memvalidasi:
a. Metode tidak baku, misalnya dari diktat, textbook atau jurnal yang belum diakui secara luas.
b. Metode yang didesain atau dikembangkan oleh laboratorium untuk keperluan sendiri yang merupakan suatu kegiatan yang terencana dan ditugaskan kepada personil yang cakap, dilengkapi dengan sumber daya yang memadai.
c. Metode baku yang digunakan di luar lingkup yang dimaksudkan. d. Metode baku yang dimodifikasi.
e. Metode baku untuk menegaskan dan mengonfirmasi bahwa metode itu sesuai untuk penggunaan yang dimaksudkan.
(ISO 2008).
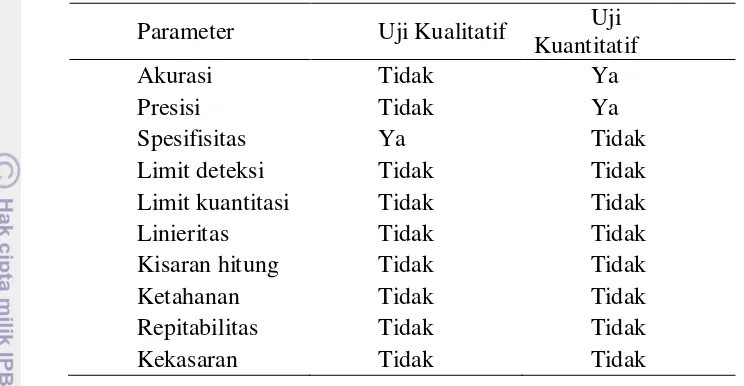
Validasi metode bermanfaat untuk mengevaluasi unjuk kerja suatu metode analisis, menjamin prosedur analisis yang akurat, dan menekan sekecil-kecilnya resiko penyimpangan yang timbul. Suatu metode analisis dikatakan absah jika telah memenuhi syarat keberterimaan parameter validasi. Menurut Sac (2002), karakteristik kinerja (performance characteristics) yang dilakukan dalam memvalidasi metode adalah (1) akurasi, (2) presisi (repitabilitas, reproduktivitas, presisi menengah), (3) sensitivitas, (4) spesifisitas (angka positif palsu dan angka negatif palsu), (5) penetapan batas terendah dari kisaran hitung (limit deteksi), (6) limit kuantitasi, (7) ketahanan, (8) kekasaran dan (9) linearitas.
3 Tabel 2. Parameter Verifikasi untuk Uji Mikrobiologi (USP 2007 dalam Ismail 2009)
Parameter Uji Kualitatif Uji
Kuantitatif
Akurasi Tidak Ya
Presisi Tidak Ya
Spesifisitas Ya Tidak
Limit deteksi Tidak Tidak
Limit kuantitasi Tidak Tidak
Linieritas Tidak Tidak
Kisaran hitung Tidak Tidak
Ketahanan Tidak Tidak
Repitabilitas Tidak Tidak
Kekasaran Tidak Tidak
4
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Melakukan validasi sekunder atau verifikasi metode uji bakteri
Staphylococcus aureus berdasarkan SNI 2332.9:2011.
2. Memverifikasi metode standar pengujian dengan mengevaluasi karakteristik kinerja, meliputi presisi dan akurasi sebagai pembuktian kinerja metode uji bakteri Staphylococcus aureus pada produk susu cair.
Manfaat Penelitian
Dengan dilakukan penelitian ini, diharapkan dapat memperoleh keabsahan (validitas) metode analisis Staphylococcus aureus sehingga selanjutnya dapat diterapkan dalam produk susu cair.
METODOLOGI PENELITIAN
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Februari 2013 sampai September 2013 di Laboratorium Mikrobiologi Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah susu pasteurisasi, susu UHT dan susu sterilisasi tanpa rasa. Media yang digunakan untuk pengujian adalah Baird Parker Agar (BPA OXOID), Plate Count Agar (PCA OXOID), egg yolk tellurite OXOID, Trypticase Soy Agar (TSA OXOID), Brain Heart Infusion Broth (BHI DIFCO), Mannitol Salt Agar (MSA OXOID). Pereaksi yang digunakan untuk pengujian adalah plasma kelinci dengan EDTA, staphylase test kit OXOID, minyak paraffin steril, pereaksi pewarnaan gram, minyak imersi, hidrogen peroksida (H2O2) 3 %. Larutan pengencer yang digunakan adalah
Butterfields Phosphate-Buffered Dilution Water (BPB) (90 ± 1) ml. Kultur yang digunakan adalah Staphylococcus auerus (ATCC 25923).
5 Metode Penelitian
Penelitian ini terdiri atas beberapa tahap, yaitu persiapan media dan bahan, persiapan pengencer, persiapan kultur kerja, dan uji verifikasi jumlah koloni
Staphylococcus aureus pada susu cair. Persiapan Media dan Bahan
Media BHI broth ditimbang sebanyak 3.7 gram dicampur dengan 100 ml akuades. Media dipanaskan diatas hotplate dan diaduk hingga larut menggunakan batang pengaduk, lalu dimasukkan ke dalam tabung bertutup masing-masing 2 - 3 ml. Tabung yang telah berisi media disterilisasi ke dalam otoklaf selama 15 menit pada suhu 121 °C, kemudian didinginkan pada suhu 50 °C.
Media BPA (Baird Parker Agar) ditimbang sebanyak 6.3 gram dicampur dengan 100 ml akuades. Media disterilisasi ke dalam otoklaf selama 15 menit menit pada suhu 121 °C, kemudian didinginkan pada suhu 50 °C dan ditambahkan dengan 5 ml egg yolk tellurite. Kemudian media dituangkan ke dalam masing-masing cawan petri sebanyal 15 - 20 ml. Cawan yang berisi media dibiarkan memadat dan disimpan di dalam oven pengering pada suhu 30 oC selama 24 jam dengan posisi terbalik hingga permukaan media kering dan siap untuk dilakukan
spread. Tahap persiapan media BPA dapat dilihat pada Gambar 1.
Gambar 1. Diagram persiapan media BPA
Media PCA (Plate Count Agar) miring ditimbang sebanyak 1.75 gram dicampur dengan 100 ml akuades. Media dipanaskan diatas hotplate dan diaduk hingga larut menggunakan batang pengaduk, lalu dimasukkan ke dalam tabung bertutup masing-masing 7 ml. Tabung yang telah berisi media disterilisasi ke
BPA + akuades
dipanaskan + diaduk hingga larut
disterilisasi 121 °C, 15 menit
didinginkan hingga suhu 50 °C,
ditambahkan egg yolk + tellurite
dituangkan ke dalam cawan petri 15 - 20 ml
disimpan pada oven pengering suhu 30 °C selama 24 jam dengan posisi
6
dalam otoklaf selama 15 menit pada suhu 121°C, kemudian didinginkan pada suhu 50 °C. Tabung yang telah berisi PCA miring steril kemudian dibiarkan memadat.
Persiapan Pengencer
Pengencer dibuat dengan cara melarutkan Butterfields Phosphate-Buffered Dilution Water (BPB) atau KH2PO4 sebanyak 34 gram ke dalam 500 ml akuades dan telah diatur pH nya (±7.2) menggunakan NaOH atau HCl 1 N. Kemudian diencerkan lagi ke dalam labu takar 1 L, disterilisasi selama 15 menit dengan suhu 121 °C. Larutan ini digunakan sebagai stok pengencer. Dari larutan stok ini kemudian diambil sebanyak 1.25 ml untuk diencerkan ke dalam labu takar hingga 1 L. Pengencer ditempatkan di dalam tabung reaksi sebanyak 9 ml untuk membuat pengenceran 1:10 (1 ml atau 1 gr contoh dalam 9 ml).
Persiapan Kultur Kerja
Sebelum melakukan penelitian terlebih dahulu harus dilakukan persiapan kultur kerja. Kultur murni larutan stok acuan merupakan faktor penting yang harus diperhatikan dalam melakukan validasi sekunder metode analisis. Dalam penelitian ini kultur murni yang digunakan adalah bakteri Staphylococcus aureus
ATCC 25923.
Mula-mula kultur murni Staphylococcus aureus ATCC 25923 dari media PCA
(Plate Count Agar) miring disegarkan ke dalam 2 - 3 ml BHI (Brain Heart Infusion) broth sebanyak 1 ose secara aseptis. Kemudian kultur Staphylococcus aureus yang telah dipidahkan ke BHI broth diinkubasikan ke dalam inkubator bersuhu (35±1) oC selama 24 jam. Adanya pertumbuhan bakteri Staphylococcus aureus pada BHI broth ditandai dengan adanya kekeruhan. Tahap persiapan kultur kerja Staphylococcus aureus dapat dilihat pada Gambar 2.
1 ose
Gambar 2. Persiapan kultur kerja Staphylococcus aureus
7 Uji Kemurnian Kultur
Untuk memastikan kemurnian kultur stok acuan diperlukan konfirmasi melalui serangkaian tahap analisis. Kultur yang diperoleh dari Laboratorium Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor diperiksa kemurniannya di bawah mikroskop. Biakan yang telah diperiksa kemurniannya dapat digunakan sebagai kultur stok dan kultur kerja.
Analisis Jumlah Kultur
Kultur kerja yang akan digunakan diencerkan ke dalam pengencer
Butterfields Phosphate-Buffered Dilution Water sebanyak 9 ml dengan tingkat pengenceran 10-5 hingga 10-7 agar diketahui jumlah Staphylococcus aureus yang tumbuh dalam kultur kerja. Kemudian kultur dimasukkan ke dalam cawan petri yang telah berisi media padat BPA sebanyak 0,1 ml dan disebar menggunakan batang penyebar (hockey stick). Jumlah koloni yang tumbuh pada masing-masing cawan akan diakumulasikan dan dihitung sebagai jumlah colony forming unit per milliliter (cfu/ml). Cara kerja perhitungan koloni secara ringkas dapat dilihat pada Gambar 3.
Analisis jumlah koloni bakteri dilakukan untuk mengetahui jumlah kultur. Kultur kerja yang akan digunakan terlebih dahulu dihitung jumlahnya sehingga penambahan kultur kerja pada sampel susu cair dapat diatur sesuai dengan jumlah yang diinginkan. Jumlah koloni Staphylococcus aureus dalam cawan yang masuk ke dalam perhitungan menurut SNI 2332.9:2011 adalah 20 - 200 koloni. Bila terdapat beberapa jenis koloni yang terlihat seperti Staphylococcus aureus pada cawan petri, masing-masing jenis koloni tersebut dihitung dan dicatat hasil perhitungannya secara terpisah. Jika cawan petri pada pengenceran terendah berisi kurang dari 20 koloni, data koloni dapat digunakan. Bila terdapat cawan petri yang berisi lebih dari 200 koloni dengan ciri-ciri Staphylococcus aureus dan pada pengenceran yang lebih tinggi tidak ditemukan koloni, maka gunakan cawan tersebut untuk menghitung koloni Staphylococcus aureus. Rumus perhitungan koloni adalah sebagai berikut :
N = Σ C/ [(1 x n1) + (0,1 x n2) x d] Dimana :
N = jumlah koloni per ml atau gram Σ C = jumlah koloni dari tiap-tiap cawan
n1 = jumlah cawan petri dari pengenceran koloni yang bisa dihitung n2 = jumlah cawan petri dari pengenceran kedua
8
1 ml 1 ml 1 ml
Kultur kerja 10-1 10-2 10-3 1 ml 1 ml 1 ml 1 ml
10-6 10-5 10-4
0.1 ml 0.1 ml 0.1 ml
10-7 10-6 10-5 Gambar 3. Cara kerja perhitungan jumlah koloni Staphylococcus aureus
Uji Verifikasi
Uji Akurasi dan Presisi
Sampel susu cair sebanyak 25 ml di spike dengan 3 tingkat konsentrasi dan masing-masing dilakukan sebanyak 6 kali ulangan. Desain penelitian dapat dilihat pada Tabel 3.
Tabel 3. Desain Penelitian
Perlakuan Ulangan
Inokulum
(koloni/ml) Kode 1 2 3 4 5 6
0 A A1 A2 A3 A4 A5 A6
101 B B1 B2 B3 B4 B5 B6
102 C C1 C2 C3 C4 C5 C6
Masing-masing sampel selanjutnya diencerkan dengan pengencer BPB (Butterfields Phosphate-Buffered Dilution Water) sehingga diperoleh cawan yang memenuhi ketentuan perhitungan jumlah koloni
9 diadopsi jika hasil verifikasi memperoleh nilai recovery sebesar 48 - 291% (EPA 2005).
% recovery (R) = [(A-B)/C] x 100
Keterangan :
A = sampel dengan inokulum (sampel positif) B = sampel tanpa inokulum (sampel negatif) C = inokulum tanpa sampel (kontrol positif)
Presisi dapat ditentukan dengan perhitungan simpangan baku relatif (RSD).
RSD = (log ai - log bi)/xi = perbedaan relatif antara hasil logaritma duplo i = 1, 2, 3, ... n
p = jumlah penentuan duplo (jumlah sampel yang diuji) RSD harus diperkirakan pada tingkat analit yang berbeda dalam kisaran penghitungan yang direkomendasikan oleh metode standar, yaitu pada tingkat kisaran yang rendah, sedang, dan tinggi. Pada penelitian ini digunakan analit dengan konsentrasi 100 (tanpa spiking), 101 dan 102 koloni/ml, sebagaimana tercantum pada Tabel 2.
Sensitifitas adalah kemampuan metode untuk mendeteksi atau mengukur mikroorganisme target dalam jumlah sekecil mungkin. Selektifitas atau spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu secara akurat dan presisi walaupun terdapat komponen lain yang mungkin ada dalam matriks sampel (Harmita 2004).
Spesifisitas dinyatakan sebagai derajat penyimpangan metode terhadap sampel yang mengandung cemaran seperti hasil urai atau senyawa sejenis atau senyawa asing lainnya, kemudian dibandingkan terhadap hasil analisis sampel yang tidak mengandung cemaran. Spesifisitas dapat dihitung menggunakan jumlah sampel positif yang menunjukkan hasil pengujian positif terhadap kontrol positif dibagi dengan hasil pengujian positif terhadap kontrol positif dikalikan 100 %. Hasil perhitungan menunjukkan nilai recovery dari hasil validasi atau verifikasi metode analisis (USP 2007).
10
tidak berpasangan, angka negatif palsu contoh merupakan hasil uji negatif yang menggunakan metode alternatif, tetapi tidak mengonfirmasi secara khas. Untuk contoh berpasangan, angka positif palsu sampel merupakan hasil uji negatif yang menggunakan metode alternatif, tetapi dikonfirmasi secara negatif oleh metode pustaka (MMC 2011). Dalam validasi primer, semua biakan positif terduga dan negatif terduga harus diverifikasi. Validasi harus meliputi sampel alami yang dipelajari sepanjang waktu. Sementara itu, dalam validasi sekunder hanya koloni positif terduga yang diisolasi dan diverifikasi (Sac 2002).
Persiapan Uji Koagulase Staphylococcus aureus menggunakan Plasma Kelinci
Koloni terduga Staphylococcus aureus diinokulasikan ke dalam 2 ml BHI broth dan diinkubasi 18 - 24 jam pada suhu (35±1) °C. Inokulum tersebut kemudian dipindahkan sebanyak 0.2 - 0.3 ml ke dalam tabung steril dan sebanyak 0.5 ml koagulase plasma kelinci ditambahkan ke dalamnya. Kemudian inokulum diinkubasikan pada suhu (35±1) °C. Pengamatan dilakukan tiap jam untuk 4 jam pertama dan dilanjutkan hingga 24 jam untuk melihat terbentuknya koagulan. Koagulan yang terbentuk secara padat/solid dan tidak jatuh apabila tabung dibalik dinyatakan positif (reaksi 4+) Staphylococcus aureus. Koagulan yang menunjukkan tipe reaksi 2+ dan 3+ harus dilakukan uji tambahan, yaitu uji katalase dan fermentasi manitol secara anaerob.
Persiapan Uji Koagulase Staphylococcus aureus menggunakan
Staphylase test kit
Koloni terduga Staphylococcus aureus dari media Baird Parker Agar (BPA) sebanyak 1 - 3 koloni dioleskan secara steril ke lingkaran yang terdapat pada kartu uji staphylase test kit OXOID. Kemudian tambahkan 1 tetes reagen uji staphylase test kit OXOID yang telah diaduk ke dalam lingkaran uji staphylase test kit OXOID. Panaskan jarum inokulasi, lalu campurkan koloni terduga Staphylococcus aureus dengan reagen uji staphylase test kit OXOID yang terdapat pada lingkaran uji
staphylase test kit OXOID secara merata. Kemudian amati terbentuknya penggumpalan pada lingkaran uji staphylase test kit OXOID saat sedang dicampurkan. Gunakan bakteri Eschericia coli yang dicampurkan dengan reagen uji staphylase test kit OXOID sebagai kontrol untuk melihat perbedaan terjadinya penggumpalan. Hasil positif ditunjukkan dengan adanya penggumpalan pada kultur uji selama pencampuran dengan reagen uji staphylase test kit OXOID.
Persiapan Uji Katalase dan Fermentasi Manitol secara Anaerob Sebanyak 1 ose inokulum Staphylococcus aureus diambil dari BHI
11 Untuk uji fermentasi manitol secara anaerob, sebanyak 1 ose inokulum Staphylococcus aureus diambil dari BHI broth. Kemudian dipindahkan ke dalam tabung reaksi yang berisi media karbohidrat mengandung 0.5 % manitol (Mannitol Salt Agar). Lapisan atas media manitol tersebut kemudian ditutup dengan minyak parafin steril setebal 25 mm dan diinkubasikan selama 5 hari pada suhu (35±1) °C. Kondisi asam dihasilkan secara anaerob jika terjadi perubahan warna media dari ungu menjadi kuning, ini menunjukkan adanya Staphylococcus aureus.
Verifikasi Jumlah Koloni Staphylococcus aureus pada Susu Cair Verifikasi dilakukan untuk mengetahui ada koloni bakteri
Staphylococcus aureus pada susu cair. Sampel susu cair dengan berbagai merk (susu UHT dan susu pasteurisasi) diperiksa jumlah koloni bakteri
Staphylococcus aureus nya. Susu cair sebanyak 25 ml dilarutkan ke dalam 225 ml pengencer BPB kemudian dipipet dan dimasukkan ke dalam 3 cawan petri yang berisi media padat BPA sebanyak 0.3, 0.3 ml dan 0.4 ml. Prosedur verifikasi jumlah koloni Staphylococcus aureus pada susu cair ini dapat dilihat pada Gambar 4.
25 ml susu cair
BPA 225 ml pengencer BPB 0.3 ml 0.3 ml 0.4 ml
12
HASIL DAN PEMBAHASAN
Kemurnian Kultur Uji
Kemurnian kultur uji merupakan faktor penting yang harus diperhatikan dalam validasi metode analisis karena dapat memengaruhi hasil uji (Sac 2002). Konfirmasi kemurnian kultur dilakukan dengan melihat pertumbuhan kultur murni di bawah mikroskop. Pertumbuhan kultur murni bakteri Staphylococcus aureus ATCC 25923 yang telah ditumbuhkan pada media BPA (Baird Parker Agar) dapat dilihat pada Gambar 5.
Gambar 5. Kultur Murni Bakteri Staphylococcus aureus Perbesaran 1000 Kali
Staphylococcus aureus merupakan bakteri gram positif, dibawah mikroskop mereka tampak seperti lingkaran (cocci) dan terlihat seperti seikat anggur. Secara morfologi Staphylococcus aureus berbentuk bundar (kokus) atau agak lonjong dengan diameter 0.5 - 1.5 µm. Mikroba ini digolongkan sebagai bakteri gram positif, bersifat aerobik dan anaerobik fakultatif, tidak motil, dan membentuk spora (Jay 2000). Menurut Pratama (2005) Staphylococcus aureus
tumbuh optimum pada suhu 35 - 40 °C tetapi dapat tumbuh pada kisaran suhu 6.5 - 46 °C. Sedangkan pH optimum untuk pertumbuhannya adalah 7.0 - 7.5 dengan kisaran pH yang memungkinkan pertumbuhan antara 4.2 - 9.3. Pada Gambar 4, ciri-ciri koloni bakteri Staphylococcus aureus ATCC 25923 yang telah ditumbuhkan di media BPA terlihat jelas setelah dilakukan pewarnaan gram. Bakteri Staphylococcus aureus memiliki warna ungu dan berbentuk bundar. Tidak ada koloni dengan bentuk selain bundar dari kultur murni bakteri Staphylococcus aureus ATCC 25923 yang digunakan (Gambar 5).
Jumlah Koloni Staphylococcus aureus pada Media BPA (Baird Parker Agar)
Pencawanan kultur awal bakteri Staphylococcus aureus ATCC 25923 yang sebelumnya telah diinkubasi dalam media BHI broth tepat 24 jam pada suhu (35±1) °C dilakukan secara duplo di dalam complete media BPA menggunakan metode cawan sebar dengan tingkat pengenceran 10-5 sampai 10-7, kemudian diinkubasi selama 45 - 48 jam pada suhu (35±1) °C. Ciri-ciri koloni
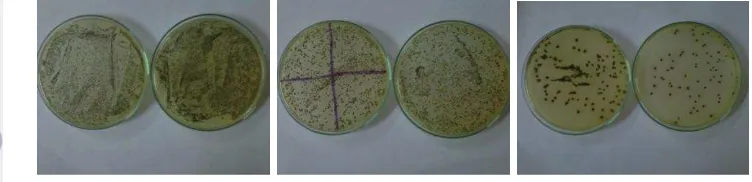
13 bening (terbentuk halo), serta mempunyai konsistensi berlemak dan lengket bila diambil dengan jarum inokulasi. Hasil pencawanan kultur uji pada media BPA dengan tingkat pengenceran 10-5 sampai 10-7 dapat dilihat pada Gambar 6.
Gambar 6. Hasil Pertumbuhan Kultur Awal Bakteri Staphylococcus aureus pada Tingkat Pengenceran 10-5 sampai 10-7
Pada tingkat pengenceran 10-5 koloni Staphylococcus aureus ATCC 25923 yang tumbuh dari kedua cawan sama-sama berjumlah TBUD. Kemudian pada tingkat pengenceran 10-6 koloni Staphylococcus aureus ATCC 25923 yang tumbuh berjumlah 628 dan 940 koloni sehingga tidak dapat digunakan sebagai perhitungan jumlah koloni/ml (sebagai syarat yang dapat digunakan berjumlah 20 - 200 koloni). Pada tingkat pengenceran 10-7 koloni Staphylococcus aureus ATCC 25923 yang tumbuh berjumlah 74 dan 107 koloni sehingga dapat digunakan untuk perhitungan jumlah koloni/ml Staphylococcus aureus (20 - 200 koloni).
Keberadaan Enzim Katalase pada Kultur Awal Bakteri Staphylococcus aureus
Keberadaan enzim katalase pada koloni bakteri Staphylococcus aureus
yang tumbuh di media BPA dapat dilakukan dengan uji katalase. Uji katalase dilakukan sebagai salah satu konfirmasi sifat bakteri Staphylococcus aureus yang telah ditumbuhkan di media BPA. Uji katalase untuk bakteri Staphylococcus aureus dapat memiliki sensitivitas dan spesifisitas masing-masing sebesar 100 % (Anyanwu, John 2013).
Sebanyak 1 ose inokulum koloni Staphylococcus aureus dari media BPA diletakkan di atas kaca preparat, kemudian ditetesi dengan H2O2 3 % sebanyak 2 - 3 tetes. Uji positif ditandai dengan adanya pembentukan gelembung-gelembung gas. Pada koloni dari kultur awal bakteri Staphylococcus aureus ATCC 25923 yang telah ditumbuhkan pada media BPA, semua menunjukkan hasil positif (terbentuk gelembung gas). Salah satu contohnya dapat dilihat pada Gambar 7.
14
Pengujian keberadaan enzim katalase pada kultur awal bakteri
Staphylococcus aureus ATCC 25923 menunjukkan hasil yang positif. Kultur awal bakteri Staphylococcus aureus ATCC 25923 yang telah ditumbuhkan dan akan digunakan sebagai spike ke dalam susu cair sebanyak 6 kali pengulangan dalam kondisi yang baik.
Keberadaan Enzim Koagulase pada Kultur Awal Bakteri Staphylococcus aureus
Uji koagulase merupakan uji yang paling dapat diandalkan untuk pengujian bakteri Staphylococcus aureus. Produksi enzim koagulase dapat dideteksi baik dengan Slide Coagulase Test (SCT) maupun dengan Tube Coagulase Test (TCT). Meskipun uji koagulase memiliki efisiensi yang tinggi untuk mengidentifikasi bakteri Staphylococcus aureus, namun kinerjanya perlu pengaturan dan pengembangan lebih lanjut (Kateete et al. 2010). Sebuah studi menyatakan bahwa uji koagulase pada bakteri Staphylococcus aureus memiliki sensitivitas sebesar 100 % dan spesifisitas sebesar 94.92 % (Anyanwu dan John 2013).
Uji koagulase kultur awal bakteri Staphylococcus aureus ATCC 25923 pada penelitian ini menggunakan staphylase test OXOID, dimana uji positif ditandai dengan terbentuknya gumpalan (aglutinasi) setelah 1 ose Staphylococcus aureus ATCC 25923 dari media BPA yang disegarkan di dalam BHI broth
dicampur dengan 1 tetes staphylase test OXOID.
Gambar 8. Tipe Reaksi Uji Koagulase menggunakan staphylase test OXOID (Igarashi et al. 1984)
Pada penelitian ini, keberadaan enzim koagulase pada kultur awal bakteri
15
Gambar 9. Hasil Uji Koagulase Kultur Awal Bakteri Staphylococcus aureus
menggunakan staphylase test OXOID
Jumlah Kultur Awal Bakteri Staphylococcus aureus setelah Inkubasi 24 Jam di BHI Broth
Tabel 4. Jumlah kultur awal bakteri Staphylococcus aureus pada BHI
broth setelah inkubasi 24 jam pada suhu (35±1) °C, dihitung pada media BPA yang diinkubasi secara aerob
Ulangan Jumlah Staphylococcus aureus (koloni/ml)
1 9.0 x 108
2 9.0 x 108
3 1.3 x 109
4 8.2 x 108
5 1.7 x 109
6 1.4 x 109
Rata-rata 1.2 x 109
RSD 0.30 %
Berdasarkan perhitungan kultur Staphylococcus aureus ATCC 25923 pada BHI broth yang digunakan untuk spike, diketahui bahwa jumlah awal koloni bakteri Staphylococcus aureus ATCC 25923 yang diinkubasi secara aerob adalah 1.2 x 109 koloni/ml (Tabel 4). Jumlah koloni bakteri Staphylococcus aureus
ATCC 25923 yang akan digunakan untuk spike ini sulit dijaga konstan meskipun ditumbuhkan pada kondisi yang sama. Hasil perhitungan jumlah kultur awal bakteri Staphylococcus aureus ATCC 25923 secara aerob memiliki nilai RSD sebesar 0.30 %. Nilai RSD ini dapat diterima karena kurang dari 10 % dan memiliki hasil yang baik (Sac 2002). Cara perhitungan jumlah awal koloni bakteri
Staphylococcus aureus dapat dilihat pada Lampiran 1.
Verifikasi Metode Uji Bakteri Staphylococcus aureus pada Susu Cair
16
menyebutkan bahwa pengujian bakteri Staphylococcus aureus menggunakan media BPA yang diinkubasi pada suhu (35±1) °C selama 45 - 48 jam. Metode ini dikonfirmasi dengan parameter akurasi dan presisi.
Jumlah Inokulum pada Susu Cair
Hasil perhitungan koloni Staphylococcus aureus setelah digunakan untuk
spike kemudian ditampilkan pada Tabel 5. Spiking dilakukan sebanyak 6 kali ulangan dengan 3 tingkat inokulum, yaitu 100, 101 dan 103 koloni/ml.
Tabel 5. Jumlah koloni pada kultur murni dan yang telah dilakukan spiking pada susu cair yang ditambahkan pada media BPA
Inokulum sampel tersebut tidak dilakukan spiking kultur murni Staphylococcus aureus. Jumlah koloni Staphylococccus aureus yang telah dispiking dengan tingkat inokulum kultur murni sebanyak 102 ke dalam sampel matriks pada ulangan ke-1 menunjukkan hasil yang berbeda, dimana jumlah koloni Staphylococcus aureus
yang tumbuh pada sampel matriks lebih sedikit dibandingkan dengan jumlah koloni yang tumbuh pada sampel kontrol. Hal ini dapat disebabkan oleh kondisi pada media atau lingkungan, seperti terjadi perubahan pH optimum pertumbuhan bakteri atau terdapat timbunan kotoran hasil ekskresi dari bakteri tersebut sehingga terdapat sejumlah koloni yang tidak dapat tumbuh atau terganggu pertumbuhannya (Waluyo 2004).
Akurasi
17 Tabel 6. Jumlah perolehan kembali Staphylococcus aureus ATCC 25923 dengan perhitungan mengacu pada SNI 2332.9:2011 (20 - 200 koloni) dengan 2 tingkat inokulum yang dilakukan 6 kali ulangan.
Inokulum (koloni/ml)
Derajat keterulangan kembali (% recovery) Rata-rata %
recovery penelitian ini dapat diterima karena rata-rata persen recovery yang diperoleh dari dua tingkat inokulum (116.33 % dan 107.29 %) masuk ke dalam kisaran 48 - 291 % sehingga metode ini dapat diadopsi untuk keperluan analisis (EPA 2005). Presisi
Presisi adalah tingkat kesamaan antara hasil uji individual ketika metode tersebut diterapkan secara berulang sampai dengan penggandaan sampling dari suatu sampel yang homogen. Presisi dari suatu metode biasanya ditunjukkan dengan simpangan baku relatif (relative standard deviation) dari suatu seri pengukuran. Presisi dapat diukur dari tingkat repitabilitas atau tingkat reproduksibilitas dari metode analisis yang dilakukan pada kondisi normal. Repitabilitas adalah mengukur variasi dalam hasil uji independen yang diperoleh dengan metode yang sama terhadap sampel uji yang identik dalam laboratorium yang sama oleh analis yang sama dengan menggunakan peralatan yang sama dalam interval waktu singkat. Prosedur yang direkomendasikan untuk memperkirakan presisi dari standar deviasi relatif (RSD) laboratorium adalah melakukan sekurang-kurangnya 15 penentuan dalam waktu dan tanggal yang berbeda menggunakan analis yang berbeda. RSD harus diperkirakan pada tingkat analit yang berbeda dalam kisaran perhitungan yang direkomendasikan oleh metode standar, sebagai contoh pada tingkat kisaran yang rendah, sedang, dan diperoleh dapat diterima karena kurang dari 10 %. Semakin kecil nilai RSD yang dihasilkan maka keterulangan penelitian tersebut semakin baik. Hasil ini dapat dilihat pada Tabel 7.
Tabel 7. Nilai RSD dan % CV dari 6 Kali Ulangan Inokulum RSD % CV
18
Nilai koefisien variasi (% CV) dapat ditentukan dari nilai RSD masing-masing inokulum dikalikan 100.
% CV = 100 x RSD Keterangan :
CV = koefisien variasi (coefficient of variation)
RSD = standar deviasi relatif (relative standard deviation)
Berdasarkan hasil penelitian yang dilakukan, nilai keterulangan kembali dengan tingkat inokulum 102 lebih baik dibandingkan nilai keterulangan kembali dengan tingkat inokulum 101.
Penggunaan Staphylase test kit sebagai Alternatif Plasma Kelinci pada Uji Koagulase
Uji koagulase dilakukan untuk melihat aktivitas koagulasi (penggumpalan) yang terbentuk antara plasma kelinci dengan bakteri Staphylococcus aureus
ATCC 25923. Gambar 9 dan 10 menunjukkan tipe reaksi uji koagulase bakteri
Staphylococcus aureus ATCC 25923 menggunakan plasma kelinci yang mengacu pada SNI 2332.9:2011 dan staphylase test OXOID mengacu pada Igarashi et al
1984.
Gambar 10. Tipe Reaksi Uji Koagulase menggunakan Plasma Kelinci (SNI 2332.9:2011)
Keterangan:
Negatif : jika koagulan tidak terbentuk
1+ positif : jika koagulan tidak terkumpul dan sedikit
2+ positif : jika koagulan terkumpul di bagian atas dan sedikit 3+ positif : jika koagulan terkumpul di bagian bawah dan banyak 4+ positif : jika koagulan pada tabung dibalik tidak jatuh
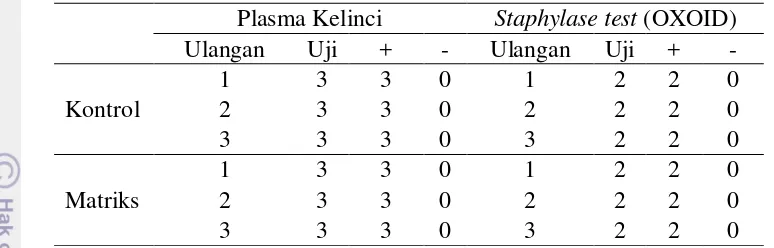
19 Tabel 8. Hasil Uji Koagulase menggunakan Plasma Kelinci dan staphylase test
OXOID pada Sampel Kultur Murni dan Susu Cair
Plasma Kelinci Staphylase test (OXOID) Ulangan Uji + - Ulangan Uji + -
Tabel 8 menunjukkan tipe reaksi hasil uji koagulase menggunakan plasma kelinci dan staphylase test OXOID pada sampel kultur murni sebagai kontrol dan sampel susu cair sebagai matriks. Dari 3 kali ulangan yang dilakukan, diperoleh hasil +3 dan +2. Hasil uji koagulase pada penelitian ini memerlukan uji tambahan, baik menggunakan plasma kelinci maupun staphylase test OXOID. Meski diperlukan uji tambahan, hasil uji koagulase menggunakan plasma kelinci dan
staphylase test OXOID pada penelitian ini menunjukkan hasil yang positif. Uji Katalase
Uji katalase dilakukan sebagai uji lanjut tambahan dari hasil uji koagulase yang menunjukkan tipe reaksi +2 dan +3 dengan cara meneteskan H2O2 pada koloni terduga Staphylococcus aureus. Jika terbentuk gelembung gas (gas oksigen), maka dapat dikatakan katalase positif. Staphylococcus aureus
merupakan bakteri katalase positif karena bakteri tersebut mampu memproduksi enzim katalase yang dapat mengkatalisis reaksi pemecahan H2O2 menjadi gas oksigen dan air. Hidrogen peroksida (H2O2) dan superoksida biasanya dihasilkan oleh beberapa bakteri dari reaksi reduksi senyawaan oksigen (Ismail 2009).
Uji katalase bakteri Staphylococcus aureus ATCC 25923 pada sampel kultur murni sebagai kontrol dan susu cair sebagai matriks masing-masing dilakukan sebanyak 3 kali ulangan. Dari keseluruhan ulangan yang dilakukan, uji katalase pada sampel kultur murni dan susu cair menunjukkan hasil yang positif. Hasil uji katalase pada penelitian ini dapat dilihat pada Tabel 9.
Tabel 9. Hasil Uji Katalase menggunakan H2O2
20
Uji Fermentasi Manitol Secara Anaerob
Uji fermentasi manitol secara anaerob dilakukan sebagai uji lanjut tambahan yang terakhir dilakukan untuk menguji koloni terduga Staphylococcus aureus. Koloni Staphylococcus aureus mampu mengubah kondisi media karbohidrat yang mengandung 0.5 % manitol menjadi asam. Hal ini ditunjukkan dengan adanya perubahan warna media manitol dari merah menjadi kuning. Pertumbuhan serta produksi koloni berwarna kuning pada media Mannitol Salt Agar (MSA) disebabkan oleh tingginya kadar garam pada media dan fermentasi manitol yang terjadi. Hal ini dianggap sebagai alat penduga untuk identifikasi bakteri Staphylococcus aureus. Hal ini juga menggambarkan karakteristik untuk membedakan antara hasil koagulase positif staphylococci dengan hasil koagulase negatif staphylococci (CoNS). Artinya, uji ini menggunakan metode cawan sebar dalam penggunaanya. Namun, kombinasi uji menggunakan MSA dan DNase telah berkembang menjadi uji koagulase menggunakan tabung (tube coagulase test, TCT). Perubahan kondisi media menjadi asam juga dapat terjadi dengan media yang mengandung glukosa, laktosa dan sukrosa (El-Hadedy dan El-Nour 2012).
Uji fermentasi manitol secara anaerob pada penelitian ini merupakan uji lanjut terakhir yang dilakukan untuk memverifikasi kemurnian kultur bakteri
Staphylococcus aureus ATCC 25923. Hasil uji fermentasi manitol secara anaerob pada penelitian ini dilakukan sebanyak 3 kali ulangan dari sampel kultur murni dan susu cair. Tabel 12 menunjukkan bahwa 1 ose koloni terduga yang ditumbuhkan pada kedua jenis sampel merupakan bakteri Staphylococcus aureus
ATCC 25923. Adapun 1 hasil uji pada sampel kultur murni ulangan ke-2 menunjukkan hasil negatif. Hal ini dapat terjadi karena kemungkinan terdapat inokulum yang mati saat ditambahkan ke dalam sampel.
Tabel 10. Hasil Uji Fermentasi Manitol Secara Anaerob
21
Gambar 11. Hasil Uji Fermentasi Manitol Secara Anaerob Hasil Uji Staphylococcus aureus pada Susu Cair
Pengujian ini dilakukan untuk mengetahui keberadaan bakteri
Staphylococcus aureus pada susu cair tanpa dilakukan spiking. Metode pengujian bakteri Staphylococcus aureus pada penelitian ini dilakukan dengan menggunakan 2 jenis produk susu cair yang berbeda, yaitu susu UHT dan susu pasteurisasi. Tabel 11. Hasil Uji Staphylococcus aureus pada Susu Cair (Sampel Susu Pasteurisasi dan UHT)
No Jenis Susu Σ Bakteri Staphylococcus aureus pada BPA Seri Cawan 1 Seri Cawan 2
1 Pasteurisasi 0 0
2 Pasteurisasi 2 1
3 UHT 0 0
4 UHT 0 0
5 UHT 0 0
6 UHT 0 0
Seperti yang dapat dilihat dalam Tabel 11, hasil inkubasi 3 cawan yang telah digoreskan oleh 1 ml (0.3 ml, 0.3 ml dan 0.4 ml) sampel susu cair adalah tidak terdapat koloni bakteri Staphylococcus aureus ATCC 25923. Hasil ini sesuai dengan persyaratan SNI 7388:2009 yang menyatakan susu cair jenis UHT tidak mengandung bakteri Staphylococcus aureus dan hanya sedikit koloni bakteri
22
SIMPULAN DAN SARAN
Simpulan
Hasil verifikasi metode uji Staphylococcus aureus pada susu cair menggunakan metode SNI 2332.9:2011 memiliki presisi yang tinggi ditandai dengan nilai RSD yang lebih kecil dari 10 %, yaitu sebesar 0.0422 dan 0.00173. Bakteri Staphylococcus aureus yang diinokulasikan atau dilakukan spiking dalam 6 kali ulangan dapat diisolasi kembali dengan baik sehingga memiliki derajat keterulangan kembali (persen recovery) berkisar antara 106.23 - 124.30 % (inokulum 10 koloni/ml) dan 84.55 - 115.57 % (inokulum 100 koloni/ml).
Hasil uji bakteri Staphylococcus aureus yang meliputi uji koagulase menggunakan plasma kelinci dan staphylase test OXOID, uji katalase, serta uji fermentasi manitol secara anaerob menunjukkan bahwa bakteri yang tumbuh yang digunakan untuk spiking pada sampel susu cair adalah spesifik bakteri
Staphylococcus aureus. Hasil uji sampel negatif pada sampel susu cair menunjukkan pada sampel susu UHT tidak mengandung bakteri Staphylococcus aureus dan hanya terdapat sedikit koloni spesifik bakteri Staphylococcus aureus
yang tumbuh pada sampel susu pasteurisasi (kurang dari 1 x 102 koloni/ml). Hasil uji sampel negatif ini sesuai yang ditetapkan oleh SNI 7388:2009 mengenai batasan cemaran bakteri Staphylococcus aureus pada produk susu cair.
Saran
23
DAFTAR PUSTAKA
Anyanwu NCJ, John WC. 2013. Conventional and rapid methods for identification of Staphylococcus aureus from clinical specimens. American Journal of Biomedical and Life Sciences (2013) 1(3): 41-43.
Astawan, Made. 2005. Proses UHT: Upaya Penyelamatan Gizi Pada Susu (terhubung berkala) http://mamabumi.blog.com/349273/?page=2 [1 Oktober 2012].
[BAM] Bacteriological Analytical Manual. 2001. Staphylococcus aureus. United States of America: FDA.
[BSN] Badan Standardisasi Nasional. 2009. SNI 7388:2009: Batas Maksimum Cemaran Mikroba dalam Pangan. Jakarta: Badan Standardisasi Nasional. [BSN] Badan Standardisasi Nasional. 2000. SNI 01-6366-2000: Batas Maksimum
Cemaran Mikroba dan Batas Maksimum Residu dalam Bahan Makanan Asal Hewan. Jakarta: Badan Standardisasi Nasional.
[BSN] Badan Standardisasi Nasional. 2011. SNI 2332.9:2011: Cara Uji Mikrobiologi – Bagian 9: Penentuan Staphylococcus aureus pada Produk Perikanan. Jakarta: Badan Standardisasi Nasional.
[EPA] Environmental Protection Agency. 2005. Manual for the Certification of Laboratories Analyzing Drinking Water: Criteria and Procedurer Quality Assurance. Edke-5. Ohio: US International Protection Agency Office of Water.
Igarashi, H., Fujkawa, H., Usami, H., Kawabata S. and Morita, T. 1984. Infection and Immunity.44:175.
Ismail T. 2009. Validasi sekunder metode analisa Campylobacter jejuni pada daging ayam [tesis]. Bogor: Sekolah Pasca Sarjana, Institut Pertanian Bogor.
[ISO] International Organization for Standardization. 2008. Persyaratan umum kompetensi laboratorium pengujian dan laboratorium kalibrasi. Jakarta: ISO; (SNI ISO/IEC 17025:2008 (klausul 5.4.5.1 dan 5.4.5.2).
Jay JM. 2000. Modern Food Microbiology. 6th edition. Maryland: Aspen Publication Inc.
Kateete et al. 2010. Identification of Staphylococcus aureus: DNase and Mannitol salt agar improve the efficiency of the tube coagulase test. Annals of Clinical Microbiology and Antimicrobials (2010) 9 (23): 1 - 7.
[MMC] Microbiological Method Committee. 2011. Procedure for the development and management of food microbiological methods. Part 4: Guidelines for the Relative Validation of Indirect Qualitative Food Microbiological Methods. Canada.
Pratama MR. 2005. Pengaruh ekstrak serbuk kayu siwak (Salvadora persica) terhadap bakteri Streptococcus mutans dan Staphylococcus aureus
dengan metode difusi agar [Skripsi]. Program Studi Biologi, FMIPA ITS. Surabaya.
Sac-Singlas. 2002. Validasi metode dari metode-metode mikrobiologi. Guidance Note : C & B and ENV 002.
24
Sukarno S. 2005. Validasi dan verifikasi metode analisa. Disampaikan pada Pertemuan Manajer Mutu dan Manajer Teknis Laboratorium Badan POM RI di Medan. Jakarta: Pusat Pengujian Obat dan Makanan Nasional Badan POM RI.
[USP] The United States Pharmacopedia. 2007. 30 NF 25 Volume 1. The United States Pharmacopeial Convection 12601 Twinbrook Parkway. MD 20852. Walstra P, Jan TM Wouters, Tom J Geurts. 2006. Dairy Science and Technology.
2nd Edition. Boca Raton: CRC Press.
25
26
Lampiran 1. Jumlah awal kultur Staphylococcus aureus
Perhitungan :
N = Σ C/ [(1 x n1) + (0,1 x n2) x d] N = (74 + 107) / [(1 x 2) x 107] = 9.0 x 108 koloni/ml
Keterangan :
N : jumlah koloni per ml atau gram Σ C : jumlah koloni dari tiap-tiap cawan
n1 : jumlah cawan petri dari pengenceran koloni yang bisa dihitung n2 : jumlah cawan petri dari pengenceran kedua
27 Lampiran 2. Perhitungan RSD kultur dengan inokulum 101
Perhitungan :
RSD =
=
=
28
Lampiran 3. Perhitungan RSD kultur dengan inokulum 102
Perhitungan :
RSD =
=
=
29
RIWAYAT HIDUP
Karina Putri Wardani lahir di Jakarta pada tanggal 3 Maret 1991 dan merupakan anak kedua dari pasangan Imran Subekti Soeriadinata dan Rochmadina Siregar. Pendidikan yang ditempuh penulis yaitu SD Islam Al-Azhar Kelapa Gading Jakarta (1997-2003), SMP Islam Al-Azhar Kelapa Gading Jakarta (2003-2006), dan SMA Negeri 72 Jakarta (2006-2009). Penulis diterima di Institut Pertanian Bogor pada tahun 2009 melalui jalur masuk USMI dengan program studi Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian.
Selama menempuh pendidikan di IPB, penulis mengikuti beberapa kegiatan sebagai panitia Masa Perkenalan Departemen Ilmu dan Teknologi Pangan (BAUR) pada tahun 2011 dan Lomba Cepat Tepat Imu Pangan (LCTIP) pada tahun 2010 dan 2011. Penulis juga pernah mengikuti seminar Pelatihan Sistem Manajemen Halal (PLASMA) dan seminar Hazard Analysis Critical Control Point (HACCP). Penulis telah mendapatkan sertifikat Good Laboratory Practices dalam pelatihan GLP 2012.
Untuk menyelesaikan pendidikan di Departemen Ilmu dan Teknologi Pangan, penulis melakukan penelitian di bidang Mikrobiologi Pangan yang didanai oleh Laboratorium Departemen Ilmu dan Teknologi Pangan (LDITP) berjudul “Validasi Sekunder Metode Uji Staphylococcus aureus pada Produk