PEMANFAATAN METABOLIT
Nodulisporium
sp
.
KT29
UNTUK PENCEGAHAN INFEKSI
Vibrio harveyi
PADA
UDANG VANAME YANG DIBUDIDAYAKAN DI LAUT
FAZRIL SAPUTRA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pemanfaatan Metabolit
Nodulisporium sp. KT29 untuk Pencegahan Infeksi Vibrio harveyi pada Udang Vaname yang Dibudidayakan di Laut adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Fazril Saputra
RINGKASAN
FAZRIL SAPUTRA. Pemanfaatan Metabolit Nodulisporium sp. KT29 untuk
Pencegahan Infeksi Vibrio harveyi pada Udang Vaname yang Dibudidayakan di Laut. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan KUSTIARIYAH TARMAN.
Budidaya udang di laut sangat dipengaruhi oleh kondisi lingkungan laut yang fluktuatif. Kondisi tersebut membuat udang menjadi stres. Ketika mengalami stres udang mudah terserang oleh penyakit. Vibrio harveyi adalah bakteri yang sering menyerang udang vaname dan banyak terdapat pada lingkungan laut. Pencegahan penyakit pada udang vaname umumnya menggunakan antibiotik. Seiring dengan pelarangan penggunaan antibiotik pada budidaya udang vaname, maka upaya pencegahan penyakit yang banyak dilakukan adalah dengan menggunaan obat-obatan yang berasal dari bahan alami salah satunya adalah dari golongan fungi. Fungi Nodulisporium sp. KT29 merupakan fungi endofit yang mengandung β
-glukan, saponin, polifenol, fitosterol dan lain-lain yang berpotensi meningkatkan respons imun udang vaname. Penelitian ini bertujuan untuk menentukan dosis metabolit Nodulisporium sp. KT29 dalam pakan untuk pencegahan infeksi V. harveyi pada udang vaname yang dibudidayakan di laut.
Percobaan ini dibagi menjadi 2 tahapan yaitu tahap in vitro dan tahap in vivo. Percobaan secara in vitro dilakukan untuk mengevaluasi pengaruh penghambatan
metabolit Nodulisporium sp. KT29 terhadap bakteri V. harveyi. Perlakuan yang
digunakan pada uji in vitro adalah 10 µL dan 20 µL. Desain eksperimen uji in vivo yang digunakan adalah rancangan acak lengkap (RAL) yang dibagi menjadi 2
yaitu desain eksperimen uji in vivo di lapangan yang terdiri dari 3 perlakuan
dengan 3 ulangan dan desain eksperimen uji in vivo di laboratorium yang terdiri dari 4 perlakuan dengan 3 ulangan. Pemberian pakan di lapangan dilakukan selama 21 hari dengan feeding rate 50 - 35 % di keramba jaring apung (KJA).
Udang yang dipelihara di keramba jaring apung (KJA) diberi pakan yang mengandung metabolit Nodulisporium sp. KT29 dengan dosis 20 mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2) serta tanpa penambahan metabolit
Nodulisporium sp. KT29 yaitu kontrol (K). Pemberian pakan di laboratorium
dilakukan selama 10 hari dengan feeding rate 10 % di akuarium. Udang yang dipelihara di akuarium diberi pakan yang mengandung metabolit Nodulisporium
sp.KT29 dengan dosis 20 mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2) serta tanpa penambahan metabolit Nodulisporium sp. KT29 meliputi kontrol positif (KP) dan kontrol negatif (KN). Udang diuji tantang dengan cara direndam dengan
V. harveyi kepadatan 106 cfu/mL yang diperoleh dari nilai LC50 (Lethal
Concentration 50). Parameter pengamatan yaitu respons stres meliputi kadar
glukosa, respons imun meliputi aktivitas phenoloxidase (PO) dan aktivitas
respiratory burst (RB) dan kinerja produksi meliputi kelangsungan hidup (KH),
laju pertumbuhan harian (LPH) dan rasio konversi pakan (RKP).
Hasil menunjukkan bahwa perlakuan 20 µL metabolit Nodulisporium sp. KT29 memberikan efek penghambatan yang lebih tinggi dari perlakuan 10 µL terhadap V. harveyi dengan zona hambat yang terbentuk sebesar 23 ± 1 mm.
pra uji tantang lebih tinggi dibandingkan kontrol positif dengan hasil terbaik terdapat pada perlakuan P1 yaitu sebesar 66,61 ± 6,94 % dan 20,18 ± 0,39 %. Rasio konversi pakan (RKP) udang vaname yang diberikan metabolit
Nodulisporium sp. KT29 setelah perlakuan dan pra uji tantang mengalami penurunan dibandingkan kontrol positif dengan hasil terbaik terdapat pada perlakuan P1 yaitu sebesar 3,19 ± 0,22. Kelangsungan hidup (KH) udang vaname yang diberikan metabolit Nodulisporium sp. KT29 pascauji tantang lebih tinggi
dibandingkan kontrol positif dengan hasil terbaik terdapat pada perlakuan P1 yaitu sebesar 95,00 ± 5,0 %. Kadar glukosa pascauji tantang pada udang yang diberikan pakan yang mengandung dosis metabolit Nodulisporium sp. KT29 menunjukkan
penurunan aktivitas dibanding perlakuan kontrol positif. Hasil tersebut menunjukkan bahwa pemberian metabolit Nodulisporium sp.KT29 melalui pakan dapat menurunkan respons stres pada udang vaname. Hasil parameter respons imun (aktivitas phenoloxidase (PO) dan aktivitas respiratory burst (RB)) pascauji tantang pada udang yang diberikan pakan yang mengandung metabolit
Nodulisporium sp.KT29 menunjukkan peningkatan aktivitas dibanding perlakuan
kontrol positif. Hasil tersebut menunjukkan bahwa pemberian metabolit
Nodulisporium sp. KT29 melalui pakan dapat meningkatkan sistem kekebalan tubuh dan status kesehatan pada udang vaname. Untuk itu dapat disimpulkan bahwa pemberian pakan yang mengandung metabolit Nodulisporium sp. KT29
dengan dosis 20 mL/kg pakan selama 21 hari mampu mencegah infeksi bakteri V. harveyi pada udang vaname PL-12 yang dipelihara di laut.
Kata kunci: antibakterial, imunostimulan, Litopenaeus vannamei, Nodulisporium
SUMMARY
FAZRIL SAPUTRA. Utilization of Nodulisporium sp. KT29 metabolites for preventing the infection of Vibrio harveyi on vaname shrimp marine culture. Supervised by DINAMELLA WAHJUNINGRUM and KUSTIARIYAH TARMAN.
Shrimp farming in the sea is strongly influenced by environmental conditions of sea fluctuating. These conditions make the shrimp become stressed. By this condition it is susceptible to disease. Vibrio harveyi is a bacteria that often
infects vaname shrimp and abundant in the marine environment. Antibiotics are commonly used in order to prevent the disease in vaname shrimp. Along with the ban on the use of antibiotics in vaname shrimp farming, the prevention of disease is mostly done by the use of medicines derived from natural ingredients one of which is from the class of fungi. Fungus Nodulisporium sp. KT29 is an endophytic fungus that containing β-glucan, saponins, polyphenols, phytosterols and other potentially enhance the immune response of vaname shrimp. This study aims to determine the dose of Nodulisporium sp. KT29 metabolites in feed for the prevention of infection by V. harveyi in vaname shrimp farmed in the sea.
This experiment was divided into two stages: in vitro and in vivo. In vitro
experiments were conducted to evaluate the effect of inhibitory metabolites
Nodulisporium sp. KT29 against V. harveyi. The treatment that used in in vitro
was 10 µL and 20 µL. Design of experiments in vivo test used was a completely
randomized design (RAL), which was divided into 2 experimental design in vivo
tests in the field that consists of 3 treatments with 3 replications and design of experiments in vivo tests in the laboratory that consists of 4 treatments with 3
replications. Feeding on the ground carried out for 21 days with the feeding rate of 50 – 35 % in floating net cages (KJA). The shrimps were reared in floating net cages (KJA) given feed containing metabolites Nodulisporium sp. KT29 at a dose of 20 mL/kg of feed (P1) and a dose of 40 mL/kg of feed (P2). The control (K)
LC50 (Lethal Concentration50). Parameters for observation include stress response
(glucose), immune response (the activity of phenoloxidase (PO) and respiratory burst activity (RB)) and production performance (survival rate (KH), specific growth rate (LPH) and feed convertion ratio (RKP)).
Results showed that 20 µL metabolites of Nodulisporium sp. KT 29 provide a higher inhibitory effect than that of 10 µL against V. harveyi. Inhibition zone
pre-challenge test was higher than the positive control with the best results found in treatment P1 was equal to 66.61 ± 6.94% and 20.18 ± 0.39%. Feed conversion ratio (RKP) vaname shrimp given metabolite Nodulisporium sp. KT29 after
treatment and pre-challenge test decreased compared to the positive control with the best results found in treatment P1 was equal to 3.19 ± 0.22. Survival rate (KH) vaname shrimp given metabolite Nodulisporium sp. KT29 post-test challenge
higher than the positive control with the best results found in treatment P1 was equal to 95.00 ± 5.0 %. Glucose for the post treatment levels of challenge on a given shrimp feed containing Nodulisporium sp. KT29 dose showed a decrease in
activity compared to the positive control treatment. These results indicated that administration of Nodulisporium sp. KT29 metabolites through the diet can reduce the stress response in vaname shrimp. The result of the immune response (the activity phenoloxidase (PO) and respiratory burst activity (RB)) after the challenge test on shrimp feeding with containing metabolite of Nodulisporium sp. KT29 showed increased activity compared to the positive control treatment. These results indicate that administration of Nodulisporium sp. KT29 metabolites
through the diet can boost the immune system and the health status of the vaname shrimp. Therefore it concluded that the administration of feed containing
Nodulisporium sp. KT29 metabolites with a dose of 20 mL/kg of feed for 21 days
prevented bacterial infections V. harveyi in vaname shrimp PL-12 which cultured
at the sea.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PEMANFAATAN METABOLIT
Nodulisporium
sp
.
KT29
UNTUK PENCEGAHAN INFEKSI
Vibrio harveyi
PADA
UDANG VANAME YANG DIBUDIDAYAKAN DI LAUT
FAZRIL SAPUTRA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan hidayah-Nya serta salawat dan salam kepada Nabi Besar Muhammad SAW. Penulis akhirnya dapat menyelesaikan karya ilmiah yang berjudul Pemanfaatan Metabolit Nodulisporium sp. KT29 untuk Pencegahan Infeksi Vibrio harveyi pada
Udang Vaname yang Dibudidayakan di Laut pada Program Studi Ilmu Akuakultur, Program Pascasarjana, Institut Pertanian Bogor.
Banyak pengetahuan yang didapat selama mengerjakan karya ilmiah ini. Untuk itu penulis mengucapkan banyak terima kasih kepada Dr Dinamella Wahjuningrum, SSi MSi dan Dr Kustiariyah Tarman, SPi MSi selaku pembimbing atas masukan, saran, nasehat dan kesabarannya sehingga karya ilmiah ini dapat terselesaikan. Penulis juga mengucapkan terima kasih kepada Ir Irzal Effendi MSi sebagai pembimbing lapangan atas masukan, saran, nasehat serta motivasi kepada penulis. Penulis juga mengucapkan terima kasih kepada Dr Sri Nuryati, SPi MSi sebagai dosen penguji luar komisi dan Dr Ir Widanarni, MSi sebagai komisi program studi yang telah memberikan saran dalam ujian sidang tesis ini.
Penulis juga mengucapkan terima kasih kepada kedua orang tua (Drs Syukri Hasan dan Maphilinda, Amd) dan saudara-saudari (drg Bunga Prihatna, Tria Mairizka dan Fahni Mauludi, MT) dan teman-teman (Rizki Ardiansyah, SP, Farhan Hamid, SE, Mirza Sahputra, MH, Ilham Suandi, SE, dr Mira Ulfa, Varihanna, SPdi SSi, Myna Agustina, MURP dan Zuhrina, ST) yang telah mendoakan, memberi semangat dan perhatian selama masa penyelesaian studi.
Terima kasih kepada rekan-rekan mahasiswa Program Studi Ilmu Akuakultur Angkatan 2013 (Wiwik Hildayanti, MSi, Sopian, MSi, Shavika Miranti, MSi, Abung Maruli Simajuntak, MSi, Hilma Putri, MSi, Putri Pratamaningrum A, MSi, Dwi Mulyasih, MSi, Noviati R Hasanah, SPi, Kurnia Faturrahman, SPi, Andre Rahmat Scabra, MSi dan Wildan Nurussalam, SPi), yang telah membantu serta memberikan masukan dan ide yang membangun.
Terima kasih juga kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) Kementrian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) sehingga penulis dapat menempuh program magister di Sekolah Pascasarjana Institut Pertanian Bogor serta semua pihak yang tidak dapat disebut satu persatu yang telah memberikan segala doa dan bantuan baik moril maupun materil.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 2
Perumusan Masalah 2
Tujuan Penelitian 3
Hipotesis Penelitian 3
2 METODE 3
Waktu dan Tempat 3
Materi Uji 3
Prosedur Penelitian 3
Penyiapan Metabolit Nodulisporium sp. KT29 4
Karakterisasi Bakteri 4
Penentuan Nilai LC50 (Lethal Concentration50) 4
Uji In Vitro 5
Pembuatan Pakan Perlakuan 5
Persiapan Wadah dan Udang Uji di Lapangan 5
Uji In Vivo 6
Parameter Penelitian 7
Analisis Data 9
3 HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 12
4 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1 Hasil analisis kandungan pakan komersil dan pakan uji. 5 2 Hasil pengukuran kualitas air selama pemeliharaan udang vaname di
lapangan. 7
3 Kelangsungan hidup (KH), laju pertumbuhan harian (LPH) dan rasio konversi pakan (RKP) udang vaname setelah perlakuan dan pra uji
tantang. 11
4 Kelangsungan hidup (KH) udang vaname pasca uji tantang. 11
DAFTAR GAMBAR
1 Skema uji in vivo di lapangan dan uji in vivo di laboratorium 6
2 Zona bening yang terbentuk ketika uji in vitro dilakukan antara ekstrak metabolit Nodulisporium sp.KT29 dengan bakteri V. harveyi 10 3 Udang vaname selama pemeliharaan di keramba jaring apung (KJA) 10 4 Kadar glukosa udang vaname yang diberi perlakuan pakan metabolit
Nodulisporium sp. KT29 sebelum uji tantang (hari ke-25), uji tantang hari ke-26 (
↓
) dan pascauji tantang (hari ke-27, ke-29 dan ke-31) 11 5 Aktivitas phenoloksidase (PO) udang vaname yang diberi perlakuan1 Pengujian LC50Vibrio harveyi pada benur udang vaname (Litopenaeus
vannamei) 20
2 Penentuan nilai LC50 Vibrio harveyi pada udang vaname (Litopenaeus
vannamei) 21
3 Penyetaraan hasil evaporasi metabolit Nodulisporium sp.KT29 dengan hasil ekstrak metabolit Nodulisporium sp.KT29 22
4 Prosedur pengukuran kadar glukosa hemolimph 23
5 Prosedur pengukuran aktivitas phenoloxidase (PO) 23 6 Prosedur pengukuran aktivitas respiratory burst (RB) 23
7 Analisis statistik kelangsungan hidup (KH) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang pada kontrol (K), dosis 20 mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2) 24 8 Analisis statistik laju pertumbuhan harian (LPH) udang vaname
9 Analisis statistik rasio konversi pakan (RKP) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang pada kontrol (K), dosis 20 mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2) 25 10 Analisis statistik kelangsungan hidup (KH) udang vaname (Litopenaeus
vanname) pasca uji tantang pada kontrol (K), dosis 20 mL/kg pakan
(P1) dan dosis 40 mL/kg pakan (P2) 25
11 Analisis statistik aktivitas phenoloksidase (PO) udang vaname
(Litopenaeus vanname) pra uji tantang (hari ke-25) dan pasca uji
tantang (hari ke-27, ke-29 dan ke-31) 26
12 Analisis statistik aktivitas respiratory burst (RB) udang vaname
(Litopenaeus vanname) pra uji tantang (hari ke-25) dan pascauji tantang
(hari ke-27, ke-29 dan ke-31) 28
1
PENDAHULUAN
Indonesia memiliki luas wilayah perikanan laut sebesar 5,8 juta km2 yang terdiri dari luas perairan nusantara (archipelagic waters) sebesar 2,8 juta km2, luas perairan teritorial laut sebesar 0,3 juta km2 dan luas zona ekonomi eksklusif (ZEE) sebesar 2,7 juta km2 (Dirhamsyah 2007). Luasnya perairan Indonesia ini berbanding terbalik dengan pemanfaatannya. Pemanfaatkan luas wilayah perikanan laut Indonesia hanya sekitar 0,9% saja (kurang dari 1%) (KKP 2011).
Saat ini tumpuan hasil perikanan budidaya Indonesia masih berada di wilayah daratan, padahal wilayah laut Indonesia merupakan wilayah open access yang belum dimanfaatkan. Salah satu upaya pemanfaatan laut tersebut adalah dengan membudidayakan salah satu komoditas pangan yang potensial yaitu udang vaname (Litopenaeus vannamei) di laut dengan menggunakan keramba jaring apung (KJA). Namun kendala dalam melakukan kegiatan budidaya udang vaname dengan sistem KJA di laut adalah sifat air laut yang dinamis dan sangat dipengaruhi oleh faktor lingkungan seperti gelombang, arus, kecerahan dan pasang surut (Azis 2006). Sifat air laut ini merupakan salah satu faktor penyebab terserangnya penyakit pada udang. Penyakit dapat muncul sebagai proses dinamis akibat tidak seimbangnya hubungan antara inang (host), jasad penyakit (patogen), serta lingkungan.
Pada budidaya udang vaname di keramba jaring apung (KJA) Pulau Semak Daun, Kepulauan Seribu, Jakarta ditemukan necrosis pada tubuh udang vaname. Munculnya necrosis di tubuh udang vaname diduga disebabkan oleh stres. Stres
menyebabkan daya tahan udang vaname melemah sehingga mudah terserang oleh penyakit. Rendahnya tingkat kelangsungan hidup (KH) pada budidaya udang vaname di KJA Pulau Semak Daun yaitu antara 20 % hingga 50 % juga diduga diakibatkan oleh penyakit (Effendi I 14 Desember 2015, komunikasi pribadi).
Kehadiran penyakit ini mempengaruhi dan membatasi produksi udang yang disebabkan oleh bakteri, virus, parasit dan cendawan (Reed et al. 2004). Penyakit bakterial merupakan masalah yang sering timbul dalam budidaya udang vaname. Salah satu penyakit yang disebabkan oleh bakteri dalam budidaya udang vaname dan penyakit udang yang paling sering muncul di perairan adalah vibriosis (Nasi et al. 2007). Vibriosis atau penyakit udang berpendar disebabkan oleh infeksi dari
bakteri Vibrio harveyi (Widanarni et al. 2012). Jika kondisi tubuh udang menurun
maka bakteri ini akan bersifat patogen (Austin dan Austin 1999). Bakteri ini sangat patogen bagi larva udang, pada saat mewabah populasi bakteri ini dapat meningkat menjadi ribuan kali sehingga tingkat mortalitasnya bisa mencapai 100 % (Manefield et al. 2000). Pencegahan penyakit vibriosis pada udang umumnya menggunakan antibiotik seperti norfloksasin, oxytetracycline, enrofloxacin dan
sulfonamide (HolmstrÖm 2003). Namun saat ini penggunaan antibiotik sudah
dibatasi karena penggunaan antibiotik mengakibatkan munculnya patogen yang resisten terhadap antibiotik (Tendencia dan Pena 2001) dan residunya membahayakan bagi kesehatan konsumen (Reed et al. 2004). Salah satu alternatif
yang dapat dilakukan untuk pencegahan penyakit vibriosis adalah melalui
2
Fungi laut merupakan sumber kekayaan alam yang kaya akan produk senyawa aktif alami. Beberapa fungi laut telah diisolasi memiliki kemampuan sebagai bahan antimikrobial, anti kanker dan anti penyakit menular. Selain itu fungi juga dikenal memiliki senyawa β-glukan yang dapat menjadi imunomodulator yaitu senyawa yang dapat meningkatkan sistem pertahanan tubuh (Meena et al. 2012).
Nodulisporium sp. KT29 merupakan fungi endofit yang tidak bersifat toksik bagi
organisme lain sehingga aman untuk digunakan dan mengandung bahan aktif yang bersifat antibakterial. Metabolit Nodulisporium sp.KT29 memberikan zona hambat pada uji in vitro terhadap bakteri Vibrio aguillarium. Zona hambat yang dibentuk
oleh metabolit Nodulisporium sp. KT29 setara dengan zona hambat yang dibentuk
oleh antibiotik oxytetracycline (Tarman et al. 2011). Berdasarkan hasil analisis metabolit Nodulisporium sp. KT29 mengandung β-glukan sebanyak 0,54 % dan bahan aktif fitosterol sebanyak 121 ppm, saponin sebanyak 23 ppm dan polifenol sebanyak 31 ppm. Mengingat besarnya potensi dan belum adanya penelitian mengenai dosis yang tepat untuk pemanfaatan metabolit Nodulisporium sp. KT29 sebagai pencegahan infeksi Vibrio harveyi pada udang vaname, maka dilakukanlah
penelitian ini.
Perumusan Masalah
Kendala umum yang dihadapi dalam budidaya udang vaname dengan sistem Keramba Jaring Apung (KJA) di laut adalah sifat air laut yang dinamis dan sangat dipengaruhi oleh faktor lingkungan. Sifat air laut ini merupakan faktor stresor pada budidaya udang di laut yang menyebabkan munculnya serangan penyakit pada budidaya udang. Pada budidaya udang vaname di KJA Pulau Semak Daun ditemukan undergo necrosis pada tubuh udang vaname. Munculnya undergo necrosis di tubuh udang vaname disebabkan oleh stres. Stres menyebabkan daya tahan udang vaname melemah sehingga mudah terserang oleh penyakit. Rendahnya kelangsungan hidup (KH) pada budidaya udang vaname KJA Pulau Semak Daun yaitu antara 20 % hingga 50 % juga diduga diakibatkan oleh penyakit.
Penyakit vibriosis merupakan penyakit yang paling sering muncul di perairan dan menyerang budidaya udang vaname. Penyakit bakterial ini disebabkan oleh bakteri V. harveyi. Pencegahan serangan penyakit vibriosis umumnya
menggunakan antibiotik. Namun penggunaan antibiotik tidak menuntaskan masalah tetapi menimbulkan masalah baru terkait dengan masalah resistensi, keamanan pangan dan dampak negatif pada lingkungan. Salah satu alternatif pengganti antibiotik adalah penggunaan bahan obat-obatan yang berasal dari bahan alami.
Nodulisporium sp. KT29 merupakan fungi laut yang memiliki zat antibakterial setara dengan antibiotik oxytetracycline yang dapat membunuh bakteri Vibrio sp.
serta mengandung senyawa β-glukan yang berfungsi sebagai imunostimulan. Penelitian pemanfaatan metabolit Nodulisporium sp. KT29 untuk pencegahan infeksi Vibrio harveyi pada udang vaname perlu dilakukan dengan harapan dapat
3 Tujuan Penelitian
Tujuan penelitian ini adalah untuk menentukan dosis metabolit
Nodulisporium sp. KT29 dalam pakan untuk pencegahan infeksi V. harveyi pada udang vaname yang dibudidayakan di laut.
Hipotesis Penelitian
Hipotesis penelitian ini adalah pemberian metabolit Nodulisporium sp.
KT29 melalui pakan pada udang vaname dapat mencegah infeksi bakteri V. harveyi.
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan selama enam bulan dari bulan Januari 2015 sampai dengan Juni 2015. Penelitian ini meliputi uji in vitro yang dilakukan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan (BDP) dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perarian (THP), Fakultas Perikanan dan Ilmu Kelautan (FPIK), Institut Pertanian Bogor (IPB) dan uji in vivo yang dilakukan di KJA Balai Sea Farming, Pusat Kajian Sumberdaya Pesisir dan Lautan (PKSPL), Lembaga Penelitian dan Pengabdian Kepada Masyarakat (LPPM)–Institut Pertanian Bogor (IPB), Pulau Semak Daun, Kepulauan Seribu.
Materi Uji
Isolat fungi laut yang digunakan pada penelitian ini adalah Nodulisporium sp. KT29 yang diperoleh dari koleksi fungi laut yang terdapat di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan (THP), FPIK, IPB. Fungi ini awalnya diisolasi dari alga merah (Eucheuma edule) yang berasal dari Takalar, Sulawesi Selatan (Tarman et al. 2011).
Udang yang digunakan pada penelitian ini adalah benur udang vaname (L. vannamei) PL-12 yang berasal dari hatchery di Anyer, Jawa Barat. Benur udang
vaname PL-12 ini dibudidayakan di laut dengan sistem pendederan. Sistem pendederan berfungsi untuk mengadaptasikan benih udang vaname dengan kondisi di laut.
Isolat bakteri uji yang digunakan pada penelitian ini adalah bakteri V. harveyi. Bakteri ini diperoleh dari koleksi bakteri V. harveyi yang terdapat di Laboratorium Kesehatan Ikan , Departemen Budidaya Perairan (BDP), FPIK, IPB.
Prosedur Penelitian
Penyiapan metabolit Nodulisporium sp. KT29, karakterisasi bakteri V. harveyi dan penentuan nilai LC50 (Lethal Concentration 50) dilakukan sebelum uji
in vitro. Pada uji in vitro dilakukan penentuan dosis metabolit Nodulisporium sp. KT29 terbaik daya antibakterinya terhadap V. harveyi dan dosis ini yang akan
digunakan untuk pembuatan pakan uji. Pada uji in vivo dilakukan pemeliharaan
4
pakan uji dan uji tantang dilakukan pada skala laboratorium di akuarium dengan lama pemeliharaan 10 hari.
Penyiapan Metabolit Nodulisporium sp.KT29
Peremajaan Nodulisporium sp. KT29 dilakukan pada media Potato Dextrose Agar (PDA) selama tujuh hari. Hasil peremajaan pada media PDA ini kemudian
dipotong kecil dalam bentuk kubus untuk di preculture di labu Erlenmeyer 250 mL
yang telah diisikan media Potato Dextrose Broth (PDB) sebanyak 100 mL. Media PDB ini dikultur selama tujuh hari, setelah itu sebanyak 12,5 mL hasil kultur
Nodulisporium sp. KT29 sebelumnya diambil dan dipindahkan pada labu
Erlenmeyer 500 mL yang telah diisikan media PDB sebanyak 250 mL. Media PDB ini dikultur selama 14 hari. Hasil kultur ini dipanen dan bagian yang dipergunakan untuk penelitian adalah metabolit dari Nodulisporium sp.KT29. Metabolit tersebut
akan digunakan pada uji in vitro yang sebelumnya dievaporasi untuk memisahkan air yang ada didalamnya. Hasil evaporasi ini yang ditambahkan pada pakan uji. Berdasarkan hasil analisis β-glukan menggunakan metode spektrofotometer dan analisis fitokimia menggunakan metode high performance liquid chromatography
(HPLC) pada metabolit Nodulisporium sp. KT29, terdapat kandungan β-glukan sebesar 0,54 % dan kandungan fitokimia yaitu fitosterol sebesar 121 ppm, saponin sebesar 23 ppm dan polifenol sebesar 31 ppm.
Karakterisasi Bakteri
Isolat bakteri dikultur dalam tabung reaksi berisikan lima mL media agar miring sea water complete (SWC) lalu diinkubasi pada suhu 28 °C selama 24 jam
untuk diidentifikasi. Identifikasi bakteri meliputi uji karakterisasi fisiologi dan biokimia bakteri yang terdiri dari pewarnaan Gram, uji oksidatif/fermentatif, uji motilitas, uji katalase dan uji oksidase. Berdasarkan uji biokimia diperoleh spesies
Vibrio harveyi (Holt et al. 1994). Selanjutnya spesies Vibrio harveyi yang diperoleh ditingkatkan virulensinya melalui penyuntikan yang berulang pada udang sebelum digunakan pada uji tantang.
Penentuan Nilai LC50 (Lethal Concentration50)
Uji LC50 merupakan penentuan konsentrasi suatu bakteri yang dapat mematikan
sekitar 50% populasi dalam suatu media (RSC 2007). Penentuan nilai LC50 ini
penting dilakukan untuk mengetahui konsentrasi bakteri V. harveyi yang akan digunakan pada uji tantang, yang dapat menyebabkan kematian hingga setengah dari populasi udang uji. Uji LC50 ini menggunakan akuarium untuk 4 perlakuan
dengan 4 ulangan. Akuarium diisi air sebanyak satu liter dengan kepadatan udang 10 ekor/akuarium. Bakteri V. harveyi yang diujikan dimulai dari kepadatan 104 sampai 107 cfu/mL. Pengujian LC50 pada benur udang vaname (Litopenaeus
vannamei) dapat dilihat pada Lampiran 1. Uji LC50 dilakukan dengan cara
perendaman V. harveyi pada udang vaname selama satu jam sesuai dengan label kepadatan bakteri di setiap akuarium. Pengamatan terhadap penghitungan jumlah udang vaname yang mati dimulai di hari pertama setelah perendaman hingga hari ke tujuh. Penentuan nilai LC50 Vibrio harveyi pada udang vaname (Litopenaeus
5 Uji In Vitro
Sebanyak 50 µL suspensi bakteri V. harveyi disebar diatas permukaan media agar thiosulphate citrate bile-salts sucrose (TCBS) secara merata. Media tersebut didiamkan selama lima menit hingga permukaan media kering. Pengujian dilakukan dengan meletakan kertas cakram berdiameter enam mm yang telah diresapi metabolit Nodulisporium sp. KT29 dengan perlakuan 10 µL dan 20 µL di atas
cawan agar yang telah disebari bakteri V. harveyi. Metabolit ini diperoleh dari hasil
evaporasi dan perendaman dengan senyawa etil asetat dengan perbandingan (2:1). Biakan bakteri V. harveyi kemudian diinkubasi pada suhu kamar selama 24 jam.
Sifat anti bakteri ditentukan dengan mengukur zona hambat disekeliling kertas cakram dan diukur diameter daerah hambatnya (Tarman 2011).
Pembuatan Pakan Perlakuan
Pakan perlakuan yang digunakan pada penelitian ini ada dua, yaitu pakan komersil dan pakan uji. Pakan komersil merupakan pakan biasa yang digunakan pada budidaya udang. Pakan komersil (kandungan protein 35,97 %) pada penelitian ini direpelleting kembali dan ditambahan vitamin C sebesar 0,1 % serta carboxyl methyl cellulose (CMC) sebagai binder sebesar 30 gram/kg pakan. Sedangkan pakan uji merupakan pakan komersil di repelleting kembali dan mendapat
tambahan vitamin C sebesar 0,1 %, carboxyl methyl cellulose (CMC) sebagai
binder sebesar 30 gram/kg pakan serta ditambahkan metabolit Nodulisporium sp. KT29. Pakan hasil repelleting akan di oven pada suhu 35 ᴼC selama 24 jam, setelah itu barulah pakan ini dapat diberikan kepada udang.
Berdasarkan hasil uji in vitro, daya hambat lebih tinggi terdapat pada ekstrak
metabolit Nodulisporium sp. KT29 dengan perlakuan 20 µL. Ekstrak metabolit
Nodulisporium sp. KT29 ini ketika disetarakan dalam bentuk sebelum di ekstrak
(hasil evaporasi) menjadi 20 mL. Penyetaraan hasil evaporasi metabolit
Nodulisporium sp. KT29 dengan hasil ekstrak metabolit Nodulisporium sp. KT29 dapat dilihat pada Lampiran 3.
Ada dua dosis metabolit Nodulisporium sp.KT29 yang digunakan pada pakan
uji yaitu dosis 20 mL/kg pakan (P1) dan 40 mL/kg pakan (P2). Pakan perlakuan yang telah dicetak kemudian akan dihaluskan menjadi crumble (remah). Hasil
analisis proksimat kandungan pakan komersil dan pakan uji dapat dilihat pada Tabel 1.
Tabel 1. Hasil analisis kandungan pakan komersil dan pakan uji.
Perlakuan Nilai kandungan proksimat pakan (%)
Air Abu Lemak Protein Serat
Kontrol (K) 9.47 11.67 5.91 35.97 1.12
20 mL/kg (P1) 10.36 12.11 8.02 36.55 0.89
40 mL/kg (P2) 10,40 12,17 8,80 36,39 1,07
Persiapan Wadah dan Udang Uji di Lapangan
6
perlakuan. Udang diadaptasikan selama satu hari sesudah ditebar ke KJA. Padat penebaran benur di KJA adalah 700 ekor/m3.
Uji In Vivo
Desain eksperimen uji in vivo yang digunakan pada penelitian ini adalah rancangan acak lengkap (RAL) yang dibagi menjadi 2 yaitu desain eksperimen uji
in vivo di lapangan dan uji in vivo di laboratorium. Desain eksperimen uji in vivo di
lapangan terdiri dari 3 perlakuan dengan 3 ulangan yaitu kontrol (K), pemberian pakan uji metabolit Nodulisporium sp. KT29 20 mL/kg pakan (P1) dan pemberian
pakan uji metabolit Nodulisporium sp. KT29 40 mL/kg pakan (P2). Desain
eksperimen uji in vivo di laboratorium terdiri dari 4 perlakuan dengan 3 ulangan yaitu kontrol positif (KP), kontrol negatif (KN), pemberian pakan uji metabolit
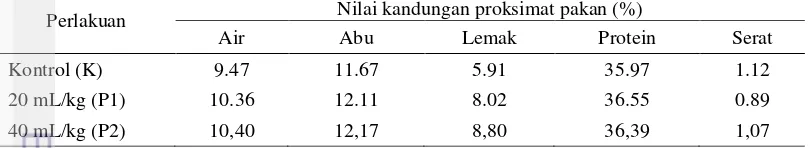
Nodulisporium sp.KT29 20 mL/kg pakan (P1) dan pemberian pakan uji metabolit Nodulisporium sp.KT29 40 mL/kg pakan (P2). Skema uji in vivo di lapangan dan uji in vivo di laboratorium disajikan dalam Gambar 1.
Gambar 1. Skema uji in vivo di lapangan dan uji in vivo di laboratorium
Keterangan:
K : Pakan komersil diberikan selama 21 pada masa pemeliharaan udang di lapangan KP : Udang diuji tantang melalui perendaman bakteri V. harveyi di laboratorium. Pakan komersil diberikan selama 10 hari pada masa pemeliharaan di laboratorium
KN : Udang direndam tanpa bakteri V. harveyi di laboratorium. Pakan komersil diberikan selama 10 hari pada masa pemeliharaan di laboratorium
Perendaman bakteri V. harveyi
K Perendaman tanpa bakteri V. harveyi
7 P1 : Pakan uji P1 diberikan selama 21 pada masa pemeliharaan udang di lapangan. Selanjutnya udang diuji tantang melalui perendaman bakteri V. harveyi dan diberikan pakan komersil selama 10 hari pada masa pemeliharan di laboratorium P2 : Pakan uji P2 diberikan selama 21 hari masa pemeliharaan udang di lapangan.
Selanjutnya udang diuji tantang melalui perendaman bakteri V. harveyi dan diberikan pakan komersil selama 10 hari masa pemeliharan di laboratorium
Pemberian pakan dengan feeding rate 50 – 35 % dan feeding frequency tiga kali sehari yaitu pagi, siang dan sore hari. Selama uji in vivo berlangsung dilakukan
pengamatan parameter penelitian dan pengukuran kualitas air dari masing-masing perlakuan. Kualitas air yang diukur adalah oksigen terlarut, salinitas, pH dan suhu. Titik pengambilan sampel di permukaan, tengah dan dasar keramba jaring apung. Hasil pengukuran kualitas air selama pemeliharaan udang vaname di lapangan dapat dilihat pada Tabel 2.
Tabel 2. Hasil pengukuran kualitas air selama pemeliharaan udang vaname di lapangan.
Parameter Perlakuan Kisaran Optimal
Kontrol (K) 20 mL/kg
Wadah yang digunakan untuk uji tantang di laboratorium adalah akuarium berukuran 30 x 20 x 20 cm3 yang ada di laboratorium kesehatan ikan, BDP, FPIK, IPB. Udang diadaptasikan dalam akuarium selama tiga hari sebelum diuji tantang. Padat penebaran udang di dalam akuarium adalah 20 ekor dengan ukuran udang pada saat uji tantang adalah PL-38.
Uji tantang dilakukan dengan metode perendaman. Kepadatan bakteri yang digunakan untuk uji tantang adalah 106 cfu/mL. Kepadatan yang digunakan ini diperoleh dari hasil LC50. Udang vaname direndam dalam akuarium yang berisikan
bakteri Vibrio harveyi selama 1 jam. Kemudian udang akan dipindahkan ke dalam akuarium pemeliharaan. Selanjutnya udang akan dipelihara selama lima hari dan diukur parameter-parameter penelitian. Pemberian pakan di laboratorium dengan
Feeding Rate 10 % dan Feeding Frequency tiga kali sehari yaitu pagi, siang dan
sore hari.
Parameter Penelitian
Penelitian ini mengamati beberapa parameter antara lain: parameter respons stres, parameter respons imun dan parameter kinerja produksi.
Parameter respons stres Kadar glukosa
8
dilihat pada Lampiran 4. Kadar glukosa hemolimph dihitung dengan rumus (Wedemeyer dan Yasutake, 1977).
[GD] =
Keterangan :
[GD] = Konsentrasi glukosa hemolimph (mg/dl) AbsSp = Absorbansi sampel
AbsSt = Absorbansi standar
[GSt] = Konsentrasi glukosa standar (mg/dl) Parameter respons imun
1. Aktivitas phenoloxidase (PO)
Aktivitas phenoloxidase diukur dengan menggunakan spektrofotometrik yakni dengan mencatat perubahan bentuk dopachrome yang dihasilkan dari L-dihidroxyphenylalanine (L-DOPA). Optical density aktivitas phenoloxidase udang
yang diuji diekpresikan oleh bentuk dopachrome 100 μL hemolimph (Hsieh et al. 2008). Optical density diatur pada 490 nm menggunakan microplate reader.
Prosedur pengukuran aktivitas phenoloxidase (PO) dapat dilihat pada Lampiran 5.
2. Aktivitas respiratory burst (RB)
Aktivitas respiratory burst hemosit dihitung dengan menggunakan prinsip
dari reduksi nitroblue tetrazolium (NBT) membentuk formazon sebagai ukuran
jumlah anion superoksida (Cheng et al. 2004). Optical density diatur pada 630 nm menggunakan microplate reader. Respiratory burst diekspresikan sebagai NBT-reduction dalam 10 μL hemolimph. Prosedur pengukuran aktivitas respiratory burst (RB) dapat dilihat pada Lampiran 6.
Parameter kinerja produksi 1. Kelangsungan hidup (KH)
Kelangsungan hidup udang vaname diamati setiap hari hingga akhir perlakuan. Perhitungan kelangsungan hidup dilakukan di akhir perlakuan dengan rumus sebagai berikut:
Laju pertumbuhan harian (LPH) dapat dihitung dengan menggunakan rumus sebagai berikut:
Keterangan:
LPH : laju pertumbuhan harian (%/hari)
9 wo : bobot rata – rata udang pada awal penelitian (gram)
t : periode pemeliharaan (hari) 3. Rasio konversi pakan (RKP)
Untuk rasio konversi pakan (RKP) dapat dihitung dengan menggunakan rumus menurut Zonneveld et al, 1991, yaitu :
Keterangan:
RKP : rasio konversi pakan F : jumlah pakan (gram)
Bt : biomassa udang pada saat akhir perlakuan (gram) Bm : biomassa udang yang mati saat perlakuan (gram) Bo : biomassa udang pada saat awal perlakuan (gram)
Analisis data
Data yang diperoleh ditabulasi dengan program MS. Office Excel 2010 dan untuk uji ANOVA dianalisis menggunakan program SPSS 16.0 dengan selang kepercayaan 95 %. Perlakuan yang berbeda nyata akan diuji lanjut dengan uji Duncan untuk mengetahui perlakuan terbaik. Parameter respons stres (kadar glukosa), parameter respons imun (aktivitas phenoloksidase (PO) dan aktivitas
respiratory burst (RB)) dan parameter kinerja produksi (kelangsungan hidup (KH),
laju pertumbuhan harian (LPH) dan rasio konversi pakan (LPH)) disajikan dalam bentuk tabel ataupun grafik.
3
HASIL DAN PEMBAHASAN
Hasil
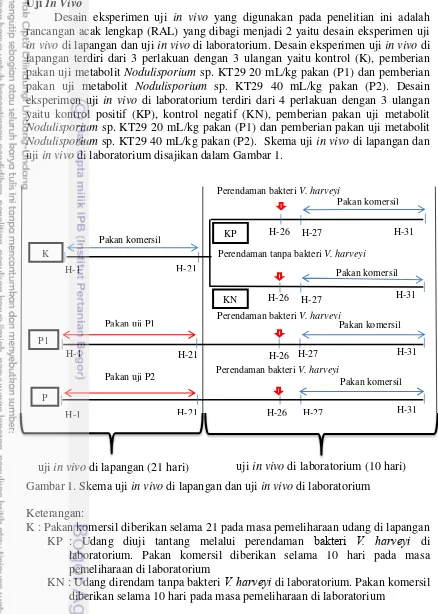
Berdasarkan hasil uji in vitro antara ekstrak metabolit Nodulisporium sp. KT29 dengan bakteri V. harveyi terbentuk zona bening disekitar kertas cakram.
Rata-rata zona bening yang terbentuk pada ekstrak metabolit Nodulisporium sp.
KT29 dengan perlakuan 10 µL dan perlakuan 20 µL yaitu 13 ± 1 mm dan 23 ± 1 mm (disajikan pada Gambar 2).
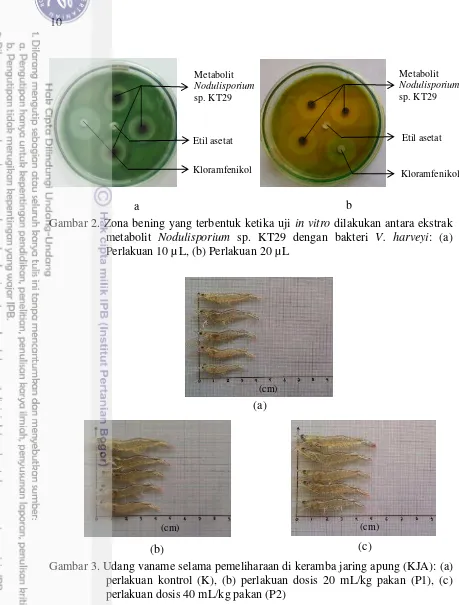
Selama pemeliharaan udang vaname 21 hari di keramba jaring apung (KJA) terjadi penambahan panjang dan berat udang. Pada akhir pemeliharaan rata-rata panjang dan berat udang pada perlakuan kontrol (K) masing-masing adalah 3,96 cm dan 0,35 gram, rata-rata panjang dan berat udang pada perlakuan dosis 20 mL/kg pakan (P1) masing-masing adalah 5 cm dan 0,67 gram dan rata-rata panjang dan berat udang pada perlakuan 40 mL/kg pakan (P2) masing-masing adalah 4,7 cm dan 0,66 gram (disajikan pada Gambar 3).
RKP = �
10
Gambar 2. Zona bening yang terbentuk ketika uji in vitro dilakukan antara ekstrak metabolit Nodulisporium sp. KT29 dengan bakteri V. harveyi: (a) Perlakuan 10 µL, (b) Perlakuan 20 µL
Gambar 3. Udang vaname selama pemeliharaan di keramba jaring apung (KJA): (a) perlakuan kontrol (K), (b) perlakuan dosis 20 mL/kg pakan (P1), (c) perlakuan dosis 40 mL/kg pakan (P2)
Data kelangsungan hidup (KH), laju pertumbuhan harian (LPH) dan rasio konversi pakan (RKP) udang vaname setelah perlakuan dan pra uji tantang disajikan pada Tabel 3. KH setelah perlakuan dan pra uji tantang menunjukkan bahwa KH pada perlakuan K berbeda nyata (p<0,05) terhadap perlakuan P1 (Lampiran 7). LPH setelah perlakuan dan pra uji tantang menunjukkan bahwa perlakuan K berbeda nyata (p<0,05) terhadap perlakuan P1 dan perlakuan P2
a b
(a)
(c) (b)
Etil asetat Metabolit Nodulisporium
sp.KT29
Kloramfenikol
Metabolit Nodulisporium
sp.KT29
Etil asetat
Kloramfenikol
(cm)
11 (Lampiran 8). RKP pada akhir pemeliharaan menunjukkan bahwa perlakuan K berbeda nyata (p<0,05) terhadap perlakuan P1 dan perlakuan P2 (Lampiran 9).
Data kelangsungan hidup (KH) udang vaname pascauji tantang disajikan pada Tabel 4. KH pascauji tantang menunjukkan bahwa perlakuan KP berbeda nyata (p<0,05) terhadap KN, P1 dan P2 (Lampiran 10).
Tabel 3. Kelangsungan hidup (KH), laju pertumbuhan harian (LPH) dan rasio konversi pakan (RKP) udang vaname setelah perlakuan dan pra uji tantang.
No Performa pertumbuhan Perlakuan
Kontrol (K) 20 mL/kg (P1) 40 mL/kg (P2)
Tabel 4. Kelangsungan hidup (KH) udang vaname pasca uji tantang.
No Performa
Kadar glukosa untuk semua perlakuan hingga akhir penelitian disajikan pada Gambar 4. Kadar glukosa pra uji tantang tidak menunjukkan aktivitas yang terlalu berbeda antar perlakuan, namun aktivitas kadar glukosa pascauji tantang mengalami peningkatan pada perlakuan KP, perlakuan P1 dan perlakuan P2 sedangkan kadar glukosa pada perlakuan KN tetap konstan.
Gambar 4. Kadar glukosa udang vaname yang diberi perlakuan pakan metabolit
Nodulisporium sp.KT29 sebelum uji tantang (hari ke-25), uji tantang
hari ke-26 (
↓
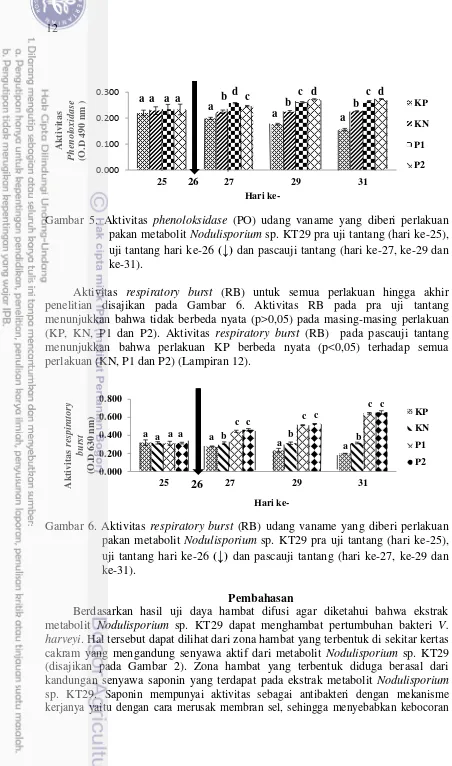
) dan pascauji tantang (hari ke-27, ke-29 dan ke-31). Aktivitas phenoloksidase (PO) untuk semua perlakuan pra dan pascaujitantang disajikan pada Gambar 5. Aktivitas PO pada pra uji tantang menunjukkan bahwa tidak berbeda nyata (p>0,05) pada masing-masing perlakuan (KP, KN, P1 dan P2). Aktivitas PO pada pascauji tantang menunjukkan bahwa perlakuan KP berbeda nyata (p<0,05) terhadap semua perlakuan (KN, P1 dan P2) (Lampiran 11).
12
Gambar 5. Aktivitas phenoloksidase (PO) udang vaname yang diberi perlakuan
pakan metabolit Nodulisporium sp.KT29 pra uji tantang (hari ke-25), uji tantang hari ke-26 (
↓
) dan pascauji tantang (hari ke-27, ke-29 dan ke-31).Aktivitas respiratory burst (RB) untuk semua perlakuan hingga akhir
penelitian disajikan pada Gambar 6. Aktivitas RB pada pra uji tantang menunjukkan bahwa tidak berbeda nyata (p>0,05) pada masing-masing perlakuan (KP, KN, P1 dan P2). Aktivitas respiratory burst (RB) pada pascauji tantang
menunjukkan bahwa perlakuan KP berbeda nyata (p<0,05) terhadap semua perlakuan (KN, P1 dan P2) (Lampiran 12).
Gambar 6. Aktivitas respiratory burst (RB) udang vaname yang diberi perlakuan
pakan metabolit Nodulisporium sp. KT29 pra uji tantang (hari ke-25), uji tantang hari ke-26 (
↓
) dan pascauji tantang (hari ke-27, ke-29 dan ke-31).Pembahasan
Berdasarkan hasil uji daya hambat difusi agar diketahui bahwa ekstrak metabolit Nodulisporium sp. KT29 dapat menghambat pertumbuhan bakteri V. harveyi. Hal tersebut dapat dilihat dari zona hambat yang terbentuk di sekitar kertas
cakram yang mengandung senyawa aktif dari metabolit Nodulisporium sp. KT29 (disajikan pada Gambar 2). Zona hambat yang terbentuk diduga berasal dari kandungan senyawa saponin yang terdapat pada ekstrak metabolit Nodulisporium
sp. KT29. Saponin mempunyai aktivitas sebagai antibakteri dengan mekanisme kerjanya yaitu dengan cara merusak membran sel, sehingga menyebabkan kebocoran
13
sel berupa keluarnya berbagai komponen penting dari dalam sel bakteri yaitu protein, asam nukleat dan nukleotida yang akhirnya memacu kematian sel (Suciati et al 2012).
Kadar glukosa merupakan respons sekunder yang menggambarkan respons stres, yaitu respons fisiologis yang terjadi pada saat hewan berusaha mempertahankan kondisi homeostasisnya yang secara aktif melakukan perubahan (Wedemeyer 1996). Menurut Porchase et al.(2009) kondisi stres atau suboptimum (internal atau eksternal) dapat menyebabkan sel kromafin akan melepaskan hormon katekolamin yang merupakan hormon stres yang berhubungan dengan mobilisasi kortisol dan peningkatan kadar glukosa. Stres menyebabkan peningkatan kadar glukosa melalui beberapa mekanisme yaitu glikogenolisis, glukoneogenesis dan inaktifasi insulin. Glikogenolisis merupakan efek metabolisme katekolamin yang memicu terjadinya pemecahan glikogen hati dan otot yang menghasilkan glukosa; glukoneogenesis merupakan efek metabolisme kortisol yang menyebabkan terbentuknya glukosa baru dari sumber selain karbohidrat yaitu protein dan lipid; inaktifasi insulin dari kelenjar pangkreas merupakan efek metabolisme hormon stres yang menyebabkan terhambatnya produksi hormon insulin yang berperan dalam proses pemanfaatan glukosa sebagai sumber energi (Hastuti et al. 2003).
Pada akhir pemeliharaan dan pra uji tantang tidak terjadi peningkatan kadar glukosa pada masing-masing perlakuan (KP, KN, P1 dan P2). Pascauji tantang terjadi peningkatan kadar glukosa pada perlakuan P1, perlakuan P2 dan perlakuan KP namun pada perlakuan KN kadar glukosa tetap konstan (disajikan pada Gambar 4). Peningkatan kadar glukosa setelah uji tantang mengindikasikan bahwa udang membutuhkan energi yang besar akibat masuknya patogen ke dalam tubuh. Menurut Lorenzon et al. (2007), konsentrasi glukosa dalam hemolimph meningkat
sebagai respons stres yang diakibatkan oleh penyakit. Jika glukosa terus meningkat dan tidak mengalami penurunan maka dapat menyebabkan respons imun dari udang akan menurun. Menurut Verghese et al. (2007), stres dapat menyebabkan turunnya
kemampuan imunologi terhadap penyakit. Pada level stres yang sangat tinggi yaitu kadar glukosa yang berlebih dalam jangka waktu yang panjang dapat berdampak terhadap kematian (Brown 1993). Pada perlakuan P1 dan perlakuan P2 juga mengalami kenaikan kadar glukosa pascauji tantang namun tidak setinggi kenaikan kadar glukosa pada perlakuan KP pascauji tantang hari ke-29 dan ke-31. Ini diduga karena pemberian pakan yang mengandung metabolit Nodulisporium sp. KT29
dapat menurunkan respons stres pada udang vaname namun mekanismenya belum diketahui secara pasti. Pengaruh stres pada udang dapat mempengaruhi respons imun dan kinerja produksi. Respons imun yang dapat dianalisis ketika udang mengalami stres adalah aktivitas phenoloxidase dan aktivitas respiratory burst
(RB) sedangkan kinerja produksi dapat diketahui dari kelangsungan hidup.
Aktivitas phenoloxidase (PO) adalah salah satu bentuk respons imun udang yang dapat dikuantifikasi untuk melihat pengaruh metabolit Nodulisporium sp.
14
Pada akhir pemeliharaan dan pra uji tantang tidak terjadi peningkatan aktivitas PO pada masing-masing perlakuan (KP, KN, P1 dan P2). Pascauji tantang terjadi peningkatan aktivitas PO pada perlakuan P1 dan perlakuan P2, pada perlakuan KP terjadi penurunan aktivitas PO sedangkan pada perlakuan KN aktivitas PO tetap konstan (disajikan pada Gambar 5). Pemberian metabolit
Nodulisporium sp. KT29 yang mengandung β-glukan pada udang diduga
meningkatkan aktivitas PO. Meningkatnya aktivitas PO pada perlakuan P1 dan perlakuan P2 menyebabkan kemampuan udang vaname untuk merespon benda asing yang masuk ke dalam tubuh menjadi semakin baik. PO yang aktif akan membentuk melanin. Melanin merupakan senyawa reaktif yang berperan diantaranya dalam inaktivasi dan mencegah penyebaran benda asing dalam tubuh melalui penghambatan produk ekstraseluler mikroorganisme (proteinase dan khitinase). Menurut Amparyup et al. (2013) melanin merupakan pigmen berwarna
coklat kehitaman yang berfungsi dalam memerangkap dan mencegah kontak antara patogen dengan inang. Proses ini akan mengurangi benda asing yang masuk ke dalam tubuh sehingga daya tahan udang akan meningkat (Cook et al. 2003).
Aktivitas respiratory burst (RB) berkaitan dengan reaksi fagositosis yang
merupakan reaksi yang paling umum dalam pertahanan selular udang. Proses fagositosis di mulai dengan pelekatan (attachment) dan penelanan (ingestion)
partikel mikroba ke dalam sel fagosit. Sel fagosit kemudian membentuk vakuola pencernaan (digestive vacuola) yang disebut fagosom. Lisosom (granula dalam sitoplasma fagosit) kemudian menyatu dengan fagosom membentuk fagolisosom. Mikroorganisme selanjutnya dihancurkan dan debris mikroba dikeluarkan dari dalam sel melalui proses egestion. Pemusnahan partikel mikroba yang difagosit
melibatkan pelepasan enzim ke dalam fagosom dan produksi ROI (reactive oxygen intermediate) yang kini disebut respiratory burst (Rodriguez dan Moullac 2000).
Pada akhir pemeliharaan dan pra uji tantang tidak terjadi peningkatan aktivitas RB pada masing-masing perlakuan (KP, KN, P1 dan P2). Pascauji tantang terjadi peningkatan aktivitas RB pada perlakuan P1 dan perlakuan P2, pada perlakuan KP terjadi penurunan aktivitas RB, sedangkan pada perlakuan KN aktivitas RB tetap konstan (disajikan pada Gambar 6). Tingginya nilai aktivitas RB pascauji tantang mengindikasikan bahwa perlakuan pemberian pakan yang mengandung metabolit Nodulisporium sp. KT29 dapat meningkatkan sistem imun
atau kekebalan udang vaname. Respiratory burst berkaitan dengan mekanisme fagositosis, sehingga semakin tinggi nilai RB maka sistem imun udang diduga menjadi semakin baik (Rodriguez dan Moullac 2000). Tingginya nilai aktivitas RB pada perlakuan P1 dan perlakuan P2 pascauji tantang diduga mengindikasikan sedang berkerjanya sistem imun dalam pemusnahan patogen yang masuk ke dalam tubuh udang. Hal ini di dukung oleh tingginya nilai aktivitas PO pascauji tantang pada perlakuan P1 dan perlakuan P2. Rendahnya nilai aktivitas RB pada perlakuan KP pascauji tantang diduga mengindikasikan menurunnya sistem imun dalam pemusnahan patogen yang masuk ke dalam tubuh udang. Hal ini didukung oleh rendahnya nilai aktivitas PO pascauji tantang pada perlakuan KP. Meningkatnya aktivitas RB pada perlakuan dikarenakan adanya kandungan β-glukan dalam metabolit Nodulisporium
sp.KT29 yang ditambahkan pada pakan. Hasil penelitian Sarlin dan Philip (2011), pemberian ragi laut dapat meningkatkan aktivitas RB pada Fenneropenaeus indicus
15 udang. Pemberian β-glukan dapat meningkatkan aktivitas RB ketika terserang oleh patogen.
Berdasarkan hasil penelitian setelah perlakuan dan pra uji tantang pada udang vaname yang dipelihara di laut terjadi peningkatan kelangsungan hidup (KH) pada perlakuan P1 (66,61 ± 6,94 %) dibandingkan perlakuan K (55,88 ± 1,41 %) (disajikan pada Tabel 3). Sedangkan pascauji tantang juga terjadi peningkatan pada perlakuan P1 (95,00 ± 5.0 %) dan perlakuan P2 (91,66 ± 7.64 %) dibandingkan perlakuan KP (43,33 ± 2,88 %) (disajikan pada Tabel 4). Hal ini menunjukkan bahwa pemberian metabolit Nodulisporium sp. KT29 selama pemeliharaan dapat
meningkatkan KH udang vaname dan juga mampu mencegah serangan V. harveyi
pascauji tantang. Hal ini diduga karena metabolit Nodulisporium sp. KT29 mengandung sifat antibakterial yaitu senyawa saponin dan imunostimulan yaitu β -glukan yang mampu memberikan proteksi pada udang vaname.
Laju pertumbuhan harian (LPH) adalah pertambahan berat hewan akuatik setiap harinya selama pemeliharaan yang ditunjukan dalam satuan persentase (%). Laju pertumbuhan harian (LPH) setelah perlakuan dan pra uji tantang untuk perlakuan P1 (20,18 ± 0,39 %) dan perlakuan P2 (20,14 ± 0,53 %) juga mengalami peningkatan dibandingkan perlakuan K (16,51 ± 0,47 %) (disajikan pada Tabel 3). Perbedaan pertumbuhan perlakuan udang antara perlakuan K, perlakuan P1 dan perlakuan P2 dapat dilihat pada Gambar 3. Pertumbuhan udang pada perlakuan P1 dan perlakuan P2 lebih baik dibandingakan perlakuan K. Hal ini diduga karena pemberian metabolit Nodulisporium sp. KT29 yang mengandung β-glukan dapat memperluas struktur permukaan usus udang sehingga penyerapan nutrisi lebih baik. Menurut Hai et al. (2009) pemberian β-glucan pada udang menyebabkan struktur
permukaan usus menjadi lebih luas sehingga penyerapan nutrisi menjadi lebih baik. Rasio konversi pakan (RKP) setelah perlakuan dan pra uji tantang untuk perlakuan P1 (3,20 ± 0.22) dan perlakuan P2 (3,23 ± 0,30) mengalami penurunan dibandingkan perlakuan K (6,27 ± 0,58) (disajikan pada Tabel 3). Hal ini diduga karena kandungan fitokimia dari metabolit Nodulisporium sp.KT29 yaitu fitosterol
dan saponin yang membuat pakan menjadi lebih efisien. Couto et al. (2014),
pemberian fitosterol dan saponin baik terpisah maupun tergabung pada juvenil ikan
gilthead sea bream (Sparus aurata) dapat meningkatkan pemanfaatan pakan.
Diduga pemberian fitosterol dan saponin pada jumlah yang cukup dapat mempengaruhi usus atau pyloric caeca namun mekanismenya belum diketahui secara pasti.
4
SIMPULAN DAN SARAN
Simpulan
16
Saran
1. Metabolit Nodulisporium sp. KT29 dapat digunakan sebagai pencegahan penyakit vibriosis pada budidaya udang vaname yang dipelihara di laut dengan
dosis 20 mL/kg pakan dan pemberian selama 21 hari.
2. Perlu dilakukan penelitian lebih lanjut mengenai frekuensi dan lama pemberian metabolit Nodulisporium sp. KT29 melalui media pemeliharaan untuk
menghambat pertumbuhan bakteri patogen Vibrio harveyi.
DAFTAR PUSTAKA
Amparyup P, Charoensapsri W, Tassanakajon A. 2013. Prophenoloxidase system and its role in shrimp immune responses against major pathogens. Fish & Shellfish Immunology. 34: 990-1001.
Austin B, Austin DA. 1999. Bacterial Fish Pathogens, Diseases of Farmed and Wild Fish, 3rd (revised) ed. Germany (DE). Springer-Praxis, Godalming.
Azis MF. 2006. Gerak air di laut. Oseana. 31(4):9-21.
Brown JA. 1993. Endocrine Responses to Environmental Pollutions. London
(UK): Chapman & Hall.
Cheng W, Hsiao I, Hsu C, Chen J. 2004. Change in water temperature on the immune response of Taiwan abalone Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus. Fish and Shellfish Immunology.
17: 235-243.
Cook MT, Hayball PJ, Hutchinson W, Nowak BF, Hayball JD. 2003. Administration of a commercial immunostimulant preparation, EcoActiva™ as a feed supplement enhances macrophage respiratory burst and the growth rate of snapper (Pagrus auratus, Sparidae (Bloch and Schneider)) in winter.
Fish and Shellfish Imunology. 14: 333-345.
Couto A, Kortner TM, Penn M, Bakke AM, Krogdahl A°, Oliva-Teles A. 2014. Effects of dietary phytosterols and soy saponins on growth, feed utilisation efficiency and intestinal integrity of gilthead sea bream (Sparus aurata) juveniles. Animal Feed Science and Technology. 198:203-214.
Dirhamsyah. 2007. Penegakan hukum laut di Indonesia. Oseana. 32(1):1-13.
Gunarto dan Mansyur A. 2010. Penambahan Tepung Tapioka pada Budidaya Udang Penaid di Tambak. Prosiding Forum Inovasi Teknologi Akuakultur.
Hlm 729-736.
Hai NV, Fotedar R. 2009. Comparison of the effects of the prebiotics (bio-mos® and β-1,3-D-glucan) and the customised probiotics (Pseudomonas synxantha
and P. aeruginosa) on the culture of juvenile western king prawns (Penaeus latisulcatus Kishinouye, 1896). Aquaculture. 289:310-316.
Hastuti S, Supriyono E, Mokoginta I, Subandiyono. 2003. Respon glukosa darah ikan gurami (Osphronemus gouramy, LAC.) terhadap stres perubahan suhu
lingkungan. Jurnal Akuakultur Indonesia. 2(2):73-77.
17 environmental impacts and human health. International Journal of Food Science and Technology. 38:255-266.
Holt JK, Kreig NR, Sneath PHA, Staley JT, Williams ST. 1994. Bergey’s manual
of determinative bacteriology. New York (US). The Williams and Wilkins Company.
Hsieh S, Ruan Y, Li Y, Hsieh P, Hu C, Kuo C. 2008. Immune and physiological responses in Pacific white shrimp (Penaeus vannamei) to Vibrio alginolyticus. Aquaculture 275: 335-341.
Kementrian Kelautan dan Perikanan (KKP). 2011. Kelautan dan perikanan dalam angka. Jakarta: KKP.
Lorenzon S, Giulianini PG, Martinis M, Ferrero EA. 2007. Stress effect of different temperatures and air exposure during transport on physiological profiles in the american lobster Homarus americanus. Journal of Comparative Biochemistry and Physiology. 147:94-102.
Manefield M, Harris L, Rice SA, Nys RD, Kjelleberg. 2000. Inhibition of luminescence and virulence in the black tiger prawn (Penaeus monodon)
pathogen Vibrio harveyi by intercellular signal antagonists. Applied and Environmental Microbiology. 66(5):2079-2084.
Meena DK, Das P, Kumar S, Mandal SC, Prusty AK, Singh SK, Akhtar MS, Behera BK, Kumar K, Pal AK, Mukherjee. 2012. Beta-glucan: an ideal immunostimulant in aquaculture (a review). Fish Physiol Biochem. doi 10.1007/s10695-012-9710-5.
Nasi L, Prayitno SB, Sarjito. 2007. Kajian bakteri penyebab vibriosis pada udang secara biomolekuler. Jurnal managemen sumberdaya pantai. 3(1):1-22.
Porchase MM, Luis R, Martines C, Ramos R. 2009. Cortisol and glucose reliable indicator of fish. Pan-American Journal of Aquatic Sciences. 4 (2):157-178.
Reed LA, Siewicki TC, Syah JC. 2004. Pharmakokinetic of oxytetracycline in the white shrimp, Litopenaeus setiferus. Aquaculture. 232:11-28.
Rodriguez J, Moullac GL. 2000. State of the art of immunological tools and health control of penaeid shrimp. Aquaculture.191:109-119.
RSC (Royal Society of Chemistry). 2007. Environment, health and safety committee note on: “LD50” [lethal dose 50%]”. www.rsc.org [30 September
2014].
Sarlin PJ, Philip R. 2011. Efficacy of marine yeasts and baker's yeast as immunostimulants in Fenneropenaeus indicus: a comparative study.
Aquaculture. 321:173-178.
Smith VJ, Brown JH, Hauton C. 2003. Immunostimulation in crustaceas: dose it really protect against infection. Fish and Shellfih Immunology.15:71-90. Standar Nasional Indonesia (SNI). 2009. Produksi benih udang vaname
(Litopenaeus vannamei) kelas benih sebar. Badan Standarilisasi Nasional.
Suciati A, Wardiyanto, Sumino. 2012. Efektifitas Ekstrak Daun Rhizophora mucronata dalam Menghambat Pertumbuhan Aeromonas salmonicida dan Vibrio harveyi. e-Jurnal Rekayasa dan Teknologi Budidaya Perairan.
1(1):1-8.
18
Tarman K. 2011. Biological and Chemical Investigations of Indonesian Marine-Derived Fungi and their Secondary Metabolites [Disertasi]. Germany (DE): Greifswald University.
Tarman K, Lindequist U, Wende K, Porzel A, Arnold N, Wessjohann LA. 2011. Isolation of a new product and cytotoxic and antimicrobial activities of extracts from fungi of Indonesian marine habitats. Marine Drugs. 9:294-306.
Tendencia EA, De la Pena LD. 2001. Antibiotic resistance of bacteria from shrimp ponds. Aquaculture. 195:193-204.
Verghese B, Radhakrishnan EV, Padhi A. 2007. Effect of environmental parameters on immune response of the indian spiny lobster, Panulirus homarus (Linnaeus, 1758). Journal of Fish & Shellfish Immunology 23:928-936.
Wedemeyer GA. 1996. Physiology of Fish in Intensive Culture System. New York
(US): Chapman & Hall.
Wedemeyer GA, Yasutake WT. 1977. Clinical Methods for the Assessment of the Effects of Environmental Stress on Fish Health. Washington (US). Technical
Paper of the US. Fish and Wildlife Service.
Widanarni, Widagdo P, Wahjuningrum D. 2012. Aplikasi probiotik, prebiotik dan sinbiotik melalui pakan pada udang vaname (Litopenaeus vannamei) yang di
infeksi bakteri Vibrio harveyi. Jurnal Akuakultur Indonesia. 11(1):54-63.
19
20
Lampiran 1 Pengujian LC50Vibrio harveyi pada benur udang vaname (Litopenaeus
vannamei)
Kultur bakteri Vibrio harveyi pada media SWC sebanyak 25 mL dalam Erlenmeyer 50 mL
Dishaker selama 16
jam
Hasil shaker dipanen
dan dipindahkan ke Erlenmeyer 500 mL
Dishaker selama 24 jam
Kultur bakteri Vibrio harveyi dipanen
Kultur bakteri Vibrio harveyi sebanyak 100 mL ditambahkan air laut sebanyak 900 mL
108
107 106 10
5 104
107 106 105 104
21 Lampiran 2 Penentuan nilai LC50 Vibrio harveyi pada udang vaname (Litopenaeus
vannamei). Konsentrasi
bakteri
Mati (ekor)
Hidup (ekor)
Rasio Kematian
Nilai akumulasi Mati
(ekor)
Hidup (ekor)
Rasio Kematian
Persentase (%)
107 18 22 1.22 51 22 0.70 69.86
106 22 18 0.82 33 40 0.45 45.21
105 7 33 4.71 11 73 0.13 13.10
104 4 36 9.00 4 109 0.04 3.54
Selang proporsi =
=
= 0,80
Log negatif LC50 = log negatif konsentrasi diatas 50% + selang proporsi
= -log 107 + 0,80 = -7 + 0,80 = -6,2
LD50 = 106,2
LD50 = 106
22
Lampiran 3 Penyetaraan hasil evaporasi metabolit Nodulisporium sp.KT29 dengan
hasil ekstrak metabolit Nodulisporium sp.KT29
Metabolit Nodulisporium sp. KT29 yang digunakan pada penelitian ini
merupakan metabolit Nodulisporium sp. KT29 yang berasal dari hasil saringan
ketika fungi Nodulisporium sp. KT29 dipanen. Selanjutnya metabolit ini di
evaporasi dengan membuang kandungan kadar air sebesar 80 %. Hasil evaporasi ini yang akan digunakan pada perlakuan.
Hasil uji in vitro menunjukan perlakuan 20 µL metabolit Nodulisporium sp.
KT29 lebih tinggi dari pada perlakuan 10 µL, sehingga perlakuan 20 µL adalah perlakuan yang digunakan pada penelitian ini. Hasil perlakuan 20 µL metabolit
Nodulisporium sp. KT29 setara dengan 20 mL hasil evaporasi. Penyetaraan perlakuan dapat dilihat di bawah ini.
Dipekatkan dengan cara
Nodulisporium sp.KT29 100 μL
0,01 mL 1 mL kultur
Nodulisporium sp.KT29 10 μL
23 Lampiran 4 Prosedur pengukuran kadar glukosa hemolimph.
Dipersiapkan larutan blanko (larutan yang berfungsi untuk kalibrasi), laruran standar (larutan yang konsentrasinya telah diketahui) dan sampel hemolimph pascalarva (PL) udang vaname dengan menambahkan akuades atau reagen. Dihomogenkan dengan bantuan vorteks. Selanjutnya diinkubasi selama 20 menit pada suhu 20 - 25 ᴼC, atau selama 10 menit pada suhu 37 ᴼC. Pembacaan absorbansi dilakukan dalam 60 menit dan dibandingkan dengan larutan blanko. Pengukuran dilakukan pada panjang gelombang 546 nm.
Lampiran 5 Prosedur pengukuran aktivitas phenoloxidase (PO).
Sebanyak satu mL campuran hemolimph dan antikoagulan disentrifugasi 3500 rpm selama 10 menit 4 ᴼC kemudian supernatant dibuang. Pelet disuspensi kembali dengan menambahkan satu mL larutan cacodylate-citrate buffer (0.01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate pH 7). Disentrifugasi kembali 3500 rpm selama 10 menit 4 ᴼC. Supernatan dibuang kemudian ditambahkan 200 µL cacodylate buffer. Suspensi sel sebanyak 100 µL kemudian diinkubasi dengan 50 µL trypsin (satu mg/mL cacodylate buffer) sebagai aktivator selama 10 menit pada suhu 25 - 26 ᴼC. Ditambahkan 50 µL L-DOPA (tiga mg/mL cacodylate buffer) dan didiamkan selama lima menit kemudian ditambahkan cacodylate buffer sebanyak 800 µL. Densitas optikal (OD) diukur menggunakan microplate reader dengan panjang gelombang 490 nm.
Lampiran 6 Prosedur pengukuran aktivitas respiratory burst (RB).
24
Lampiran 7 Analisis statistik kelangsungan hidup (KH) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang pada kontrol (K), dosis 20 mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2).
Hasil uji lanjutan Duncan pada kelangsungan hidup (KH) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang.
Perlakuan N Subset for alpha = 0.05
a b
Kontrol (K) 3 55.8833
20 mL/kg pakan (P1) 3 66.6200
40 mL/kg pakan (P2) 3 63.6200 63.6200
Sig. .067 .419
Lampiran 8 Analisis statistik laju pertumbuhan harian (LPH) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang pada
kontrol (K), dosis 20 mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2).
Hasil uji lanjutan Duncan pada laju pertumbuhan harian (LPH) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang.
Perlakuan N Subset for alpha = 0.05
a b
Kontrol (K) 3 16.5133
20 mL/kg pakan (P1) 3 20.1867
40 mL/kg pakan (P2) 3 20.1400
25 Lampiran 9 Analisis statistik rasio konversi pakan (RKP) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang pada kontrol (K), dosis 20 mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2).
Hasil uji lanjutan Duncan pada rasio konversi pakan (RKP) udang vaname (Litopenaeus vanname) setelah perlakuan dan pra uji tantang.
Perlakuan N Subset for alpha = 0.05
a b
Kontrol (K) 3 6.2707
20 mL/kg pakan (P1) 3 3.1959
40 mL/kg pakan (P2) 3 3.2267
Sig. .900 1.000
Lampiran 10 Analisis statistik kelangsungan hidup (KH) udang vaname (Litopenaeus vanname) pasca uji tantang pada kontrol (K), dosis 20
mL/kg pakan (P1) dan dosis 40 mL/kg pakan (P2).
Hasil uji lanjutan Duncan pada kelangsungan hidup (KH) udang vaname (Litopenaeus vanname) pasca uji tantang.
Perlakuan N Subset for alpha = 0.05
a b
Kontrol positif (KP) 3 43.3333
Kontrol negatif (KN) 3 100.0000
20 mL/kg pakan (P1) 3 95.0000
40 mL/kg pakan (P2) 3 91.6667