PENGARUH PEMBERIAN CAMPURAN UBI JALAR DAN
RAGI TAPE TERHADAP KARAKTERISTIK FISIK DAN
MIKROFLORA SALURAN PENCERNAAN BROILER
PADA PERIODE YANG BERBEDA
SUSI EKA SURYANI
ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Pemberian Campuran Ubi Jalar dan Ragi Tape terhadap Karakteristik Fisik dan Mikroflora Saluran Pencernaan Broiler pada Periode yang Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
ABSTRAK
SUSI EKA SURYANI. Pengaruh Pemberian Campuran Ubi Jalar dan Ragi Tape terhadap Karakteristik Fisik dan Mikroflora Saluran Pencernaan Broiler pada Periode yang Berbeda. Dibimbing oleh ASEP SUDARMAN dan WIDYA HERMANA.
Penelitian ini bertujuan mengkaji pengaruh pemberian ubi jalar merah dan ragi tape sebagai sinbiotik terhadap karakteristik fisik dan mikroflora saluran pencernaan ayam broiler pada periode berbeda. Penelitian ini menggunakan 200 ekor DOC dengan 5 perlakuan dan 4 ulangan (10 ekor per ulangan), yang dipelihara selama 42 hari. Perlakuan ransum yaitu: P1 = Ransum komersial, P2 = Ransum basal, P3 = P2 + 3% tepung ubi jalar merah + 0.75% ragi tape (starter-finisher), P4 = P2 + 3% tepung ubi jalar merah + 0.75% ragi tape (starter), dan P5 = P2 + 3% tepung ubi jalar merah + 0.75% ragi tape (finisher). Penelitian dengan rancangan acak lengkap dan dianalisis ANOVA serta uji lanjut Duncan. Peubah yang diamati adalah bobot, panjang, dan tebal usus halus, kolon, dan sekum, serta jumlah bakteri saluran pencernaan. Penambahan sinbiotik sangat nyata (P<0.01) meningkatkan panjang duodenum, panjang jejunum, serta bobot dan panjang ileum. Penambahan sinbiotik juga nyata (P<0.05) meningkatkan bobot jejunum dan panjang sekum. Pemberian sinbiotik pada periode starter saja menghasilkan bakteri Lactobacillus sp. dan Bifidobacterium sp. yang ebih banyak.
Kata kunci: mikroflora, performa, ragi tape, saluran pencernaan, ubi jalar merah
ABSTRACT
SUSI EKA SURYANI. Effect of Red Sweet Potato Meal and Tape Yeast Addition on Physical Characteristics and Microflora of Gastrointestinal of Broiler at Different Productive Periods. Supervised by ASEP SUDARMAN and WIDYA HERMANA.
This research aimed to assess the effect of red sweet potato meal and tape yeast as a mixed synbiotic on physical characteristics and microflora of gastrointestinal of broiler in different periods. This experiment used 200 day old chicks (DOC) with five treatments and four replication consisted of 10 broilers replicates, broiler reared for 42 days.. The treatment diets were P1 = commercial feed, P2 = basal feed, P3 = P2 + 3% sweet potato meal + 0.75% tape yeast (starter-finisher), P4 = P2 + 3% sweet potato meal + 0.75% tape yeast (starter), P5 = P2 + 3% sweet potato meal + 0.75% tape yeast (finisher). Research using a completely randomized design and analyzed by ANOVA and Duncan's test further. Variables observed were weight, length, and thickness of the small intestine, colon, and cecum, and bacterial population of the gastrointestinal. The results showed that there were very significant effect (P<0.01) increase on the length of the duodenum, length of the jejunum, and weight and length of the ileum. Addition sinbiotik also showed that there were significant effect (P<0.05) increase the percentage weight of the jejunum and length of the secum. The population of non-pathogenic bacteria Lactobacillus sp. and Bifidobacterium sp. was higher in the provision of treatment at starter period.
SUSI EKA SURYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada
Departemen Ilmu Nutrisi dan Teknologi Pakan
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
PENGARUH PEMBERIAN CAMPURAN UBI JALAR DAN
RAGI TAPE TERHADAP KARAKTERISTIK FISIK DAN
Judul Skripsi : Pengaruh Pemberian Campuran Ubi Jalar dan Ragi Tape terhadap Karakteristik Fisik dan Mikroflora Saluran Pencernaan Broiler pada Periode yang Berbeda
Nama : Susi Eka Suryani NIM : D24100050
Disetujui oleh
Dr. Ir. Asep Sudarman, M.Rur.Sc Pembimbing I
Dr. Ir. Widya Hermana, M.Si Pembimbing II
Diketahui oleh
Prof. Dr. Ir. Panca Dewi MHKS, M.Si Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2013 ini adalah Pengaruh Pemberian Campuran Ubi Jalar dan Ragi Tape terhadap Karakteristik Fisik dan Mikroflora Saluran Pencernaan Broiler pada Periode yang Berbeda.
Penggunaan antibiotik semakin ditinggalkan sejak adanya larangan penggunaan antibiotik untuk ternak oleh Uni Eropa tepatnya pada 1 Januari 2006. Hal ini disebabkan, antibiotik dapat menimbulkan residu terutama dalam produk ternak. Sinbiotik dari campuran tepung ubi jalar merah dan ragi tape dipilih sebagai bahan penelitian karena sinbiotik dapat menggantikan peran antibiotik. Penggunaan sinbiotik ini telah terbukti dapat meningkatkan performa ayam broiler, tetapi metode pemberian ransum bersinbiotik ini belum dilakukan. Oleh karena itu, penelitian ini dilakukan untuk mengetahui metode pemberian ransum bersinbiotik tersebut.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan. Kritik, saran, dan masukan yang membangun sangat penulis harapkan demi penyempurnaan. Penulis berharap semoga skripsi ini dapat memberikan informasi baru dalam dunia peternakan dan dapat bermanfaat bagi pembaca dan penulis khususnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
METODE 2
Bahan 2
Ternak 2
Tepung Ubi Jalar Merah 2
Ragi Tape 2
Ransum 2
Alat 2
Lokasi dan Waktu 2
Prosedur Penelitian 3
Pembuatan ransum penelitian 3
Perbanyakan ragi tape 3
Pemeliharaan ayam 4
Pengukuran organ pencernaan 4
Prosedur pengambilan mikroflora usus halus 4
Pembuatan media selektif agar 5
Penghitungan jumlah koloni bakteri saluran pencernaan 5
Rancangan dan Analisis Data 5
Perlakuan 5
Rancangan percobaan 5
Peubah yang diamati 6
HASIL DAN PEMBAHASAN 6
Karakteristik fisik saluran pencernaan ayam broiler 6
Duodenum 7
Jejunum 8
Ileum 9
Kolon 10
Sekum 11
Koloni bakteri dalam usus halus ayam broiler 12
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 16
DAFTAR TABEL
1 Susunan ransum basal dalam penelitian 3
2 Kandungan nutrien ransum komersial dan ransum perlakuan 3 3 Persentase bobot dan panjang relatif duodenum ayam broiler umur 6
minggu 7
4 Persentase bobot, panjang relatif, dan tebal jejunum ayam broiler umur
6 minggu 8
5 Persentase bobot dan panjang relatif ileum ayam broiler umur 6 minggu 9 6 Persentase bobot dan panjang relatif kolon ayam broiler umur 6 minggu 10 7 Persentase bobot, panjang relatif, dan tebal sekum ayam broiler umur 6
minggu 11
8 Jumlah koloni bakteri dalam usus halus ayam broiler umur 6 minggu 12
DAFTAR LAMPIRAN
1 ANOVA bobot duodenum ayam broiler umur 6 minggu 16 2 ANOVA panjang duodenum ayam broiler umur 6 minggu 16 3 Uji lanjut Duncan panjang duodenum ayam broiler umur 6 minggu 16 4 ANOVA bobot jejunum ayam broiler umur 6 minggu 16 5 Uji lanjut Duncan bobot jejunum ayam broiler umur 6 minggu 16 6 ANOVA panjang jejunum ayam broiler umur 6 minggu 17 7 Uji lanjut Duncan panjang jejunum ayam broiler umur 6 minggu 17 8 ANOVA tebal jejunum ayam broiler umur 6 minggu 17
9 ANOVA bobot ileum ayam broiler umur 6 minggu 17
10 Uji lanjut Duncan bobot ileum ayam broiler umur 6 minggu 17 11 ANOVA panjang ileum ayam broiler umur 6 minggu 18 12 Uji lanjut Duncan panjang ileum ayam broiler umur 6 minggu 18
13 ANOVA bobot kolon ayam broiler umur 6 minggu 18
14 ANOVA panjang kolon ayam broiler umur 6 minggu 18
15 ANOVA bobot sekum ayam broiler umur 6 minggu 18
16 ANOVA panjang sekum ayam broiler umur 6 minggu 19 17 Uji lanjut Duncan panjang sekum ayam broiler umur 6 minggu 19
18 ANOVA tebal sekum ayam broiler umur 6 minggu 19
19 Organ pencernaan ayam broiler umur 6 minggu 19
20 Bahan media selektif agar 20
1
PENDAHULUAN
Kebutuhan masyarakat akan protein hewani mengalami peningkatan seiring dengan bertambahnya jumlah penduduk dan tingginya kesadaran akan pemenuhan gizi. Upaya pemenuhan kebutuhan masyarakat akan protein, dapat dilakukan melalui peningkatan produktivitas ternak khususnya unggas sebagai sumber protein hewani. Salah satu unggas yang paling berpotensi untuk memenuhi kebutuhan tersebut adalah ayam broiler. Ayam broiler memiliki pertumbuhan yang cepat sebagai penghasil daging, konversi ransum rendah, dan dapat dipotong dalam usia relatif muda (Bell dan Weaver 2002). Keunggulan tersebut juga harus didukung oleh kuantitas dan kualitas ransum yang baik, yaitu mengandung zat–zat makanan yang dibutuhkan oleh ternak dalam jumlah cukup dan seimbang baik ditinjau dari segi ekonomi maupun dari segi peranannya.
Penambahan feed additive dalam bentuk antibiotik merupakan salah satu upaya meningkatkan pertumbuhan dan pencegahan terhadap penyakit akibat adanya bakteri patogen. Penambahan antibiotik telah berlangsung sejak tahun 1950, namun penggunaannya semakin ditinggalkan sejak adanya larangan penggunaan antibiotik untuk ternak oleh Uni Eropa tepatnya pada 1 Januari 2006. Hal ini disebabkan, adanya residu antibiotik dalam telur maupun daging unggas yang dapat berdampak negatif bagi kesehatan manusia (Sofyan et al. 2004)
Adanya residu antibiotik tersebut dapat menyebabkan resistensi bakteri pada manusia dan hewan. Alternatif lain sebagai pengganti antibiotik, yaitu penambahan feed additive berupa probiotik dan prebiotik. Probiotik merupakan bahan yang mengandung koloni mikroba tertentu untuk membantu proses pencernaan nutrien dalam usus halus dan menurunkan populasi bakteri patogen (Diaz 2008). Di sisi lain, prebiotik adalah bahan makanan untuk probiotik yang berfungsi merangsang pertumbuhan aktivitas mikroorganisme probiotik. Kombinasi probiotik dan prebiotik yang diberikan secara bersamaan disebut sinbiotik. Penggunaan kombinasi tersebut difokuskan pada peningkatan status ekologi sistem pencernaan, sehingga menguntungkan, diantaranya dapat meningkatkan produktivitas, kesehatan, dan perkembangan sistem pencernaan (Candinegara 2006).
Sumber probiotik yang dapat digunakan dalam pakan ternak, salah satunya adalah ragi tape. Ragi tape mengandung Saccharomyces cereviceae yang dapat menghidrolisis pati sehingga terjadi keseimbangan mikroorganisme pada saluran pencernaan dan membantu penyerapan nutrien (Fuller 1992). Ubi jalar dapat digunakan sebagai sumber prebiotik karena adanya senyawa oligosakarida berupa rafinosa dan maltotriosa yang dapat digunakan untuk pertumbuhan bakteri asam laktat (BAL) (Hasyim dan Yusuf 2008). Berdasarkan penelitian sebelumnya, level pemberian tepung ubi jalar sebanyak 3% dan ragi tape 0.75% dari jumlah ransum merupakan level terbaik terhadap sistem pencernaan dan performa ayam broiler (Arista 2012; Paramesuwari 2012). Namun belum diketahui pengaruh metode pemberian ransum sinbiotik tepung ubi jalar dan ragi tape pada periode pertumbuhan ayam broiler yang berbeda, sehingga perlu adanya penelitian lebih lanjut.
2
METODE
Bahan
Ternak
Ayam broiler yang dipelihara sebanyak 200 ekor DOC pedaging galur CP-707 yang berasal dari PT. Charoen Pokphand Jaya Farm. Setiap unit percobaan menggunakan satu ekor ayam sebagai sampel dalam pengukuran peubah.
Tepung Ubi Jalar Merah
Ubi jalar merah yang digunakan diperoleh dari petani ubi di sekitar kampus Dramaga. Ubi jalar dikeringkan dengan oven pada suhu 60 °C kemudian digiling hingga menjadi tepung. Pemberian tepung ubi jalar merah sebanyak 3% dari jumlah ransum.
Ragi Tape
Ragi tape dalam penelitian diperbanyak dan dibuat berdasarkan metode yang dilakukan oleh Pusat Penelitian dan Pengembangan Teknologi Pangan (1981). Pemberian ragi tape sebanyak 0.75% dari jumlah ransum yang diberikan.
Ransum
Ransum yang digunakan berupa ransum komersial, ransum perlakuan yang diformulasikan sendiri, dan ransum perlakuan dengan penambahan campuran tepung ubi jalar merah dan ragi tape. Ransum komersial yang digunakan berasal dari PT. Sinta Prima Feedmill. Pembuatan ransum perlakuan dilakukan di PT. Indofeed Bogor dengan formulasi mengacu pada kebutuhan ayam broiler berdasarkan Leeson dan Summer (2001). Bahan pakan yang digunakan terdiri dari jagung, dedak padi, minyak, tepung ikan, bungkil kedelai, CGM, CaCO3, DCP, premiks, NaCl, DL-Met, dan L-Lysin.
Alat
Peralatan yang digunakan adalah kandang sistem litter berukuran 20 m2 yang disekat menjadi 20 petak dengan ukuran 1 m x 1 m x 1 m dan setiap petak terdiri dari 10 ekor ayam. Peralatan kandang yang digunakan adalah tempat pakan, tempat air minum, plastik, alat penerangan, termometer, sekat dari kawat berjaring, timbangan, gelas ukur, serta alat kebersihan. Alat laboratorium yang digunakan yaitu oven 60 oC, pinset, gunting, penggaris, jangka sorong dengan ketelitian 0.01 mm, timbangan digital dengan akurasi 0.01 g dan alat laboratorium lainnya.
Lokasi dan Waktu
3 Prosedur Penelitian
Pembuatan Ransum Penelitian
Ransum yang digunakan berupa ransum komersial, ransum perlakuan yang diformulasikan sendiri, dan ransum perlakuan dengan penambahan campuran tepung ubi jalar merah dan ragi tape. Susunan ransum perlakuan yang digunakan dapat dilihat pada Tabel 1 dan kandungan nutrien ransum penelitian dapat dilihat pada Tabel 2.
Tabel 1. Susunan ransum basal dalam penelitian
Bahan Pakan Jumlah
*) Sumber: Kebutuhan ransum ayam broiler disusun berdasarkan Leeson dan Summer (2001); BK: bahan kering, EM: energi metabolis, PK: protein kasar, LK: lemak kasar, Ca: calcium, P: phosphor, Tepung ikan (PK 55%), Bungkil kedelai (PK 48%)
Tabel 2. Kandungan nutrien ransum komersial dan ransum perlakuan Nutrien
Ransum
Komersial* Komersial** Perlakuan** Perlakuan + Ubi
Jalar + Ragi**
Bahan lain Coccidiostat, Antibiotika
*) Label ransum PT. Sinta Prima Feedmill, **) Laboratorium Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Lembaga Penelitian dan Pemberdayaan Masyarakat, Institut Pertanian Bogor (2013)
Perbanyakan Ragi Tape
4
bagian-bagian yang tidak berguna dari jeruk nipis, bawang putih, lengkuas, dan ubi kayu. Bahan-bahan yang sudah dikupas kemudian diblender hingga halus. Selanjutnya dicampur dengan tepung beras dan ragi pasar (2 keping setiap kg tepung beras), lalu ditambahkan sedikit demi sedikit air hingga menjadi adonan yang kental. Adonan dibiarkan selama 3 hari pada suhu kamar dalam keadaan terbuka. Setelah 3 hari semua kotoran-kotoran dibuang, dan adonan tersebut diperas hingga airnya berkurang. Adonan dijemur hingga kering (PPPTP 1981).
Pemeliharaan Ayam
Pemeliharaan selama enam minggu, terdiri dari tiga minggu untuk masing-masing periode starter dan finisher. Tahap awal pelaksanaan pemeliharaan yaitu membersihkan kandang dan alat-alat dengan desinfektan. Ransum diberikan dua kali dalam sehari, yaitu pukul 06.00 dan 16.00 WIB. Ransum perlakuan yang ditambahkan sinbiotik diberikan pada periode yang telah ditentukan, di luar periode tersebut diberikan ransum perlakuan tanpa sinbiotik. Air minum diberikan ad libitum dan dilakukan penambahan vitamin tanpa antibiotik satu hari sebelum dan sesudah penimbangan untuk mengurangi stres pada ternak.
Pengukuran Organ Pencernaan
Akhir pemeliharaan pada minggu keenam, ayam dipotong sebanyak 20 ekor, masing-masing satu ekor pada setiap ulangan. Ayam diproses menjadi karkas, dipisahkan antara duodenum, jejunum, ileum, kolon, dan sekum untuk dilakukan pengukuran bobot dengan timbangan digital, panjang dengan penggaris, dan tebal dengan menggunakan jangka sorong.
Prosedur Pengambilan Mikroflora Usus Halus
5 sebagai pengawet, lalu disimpan dalam freezer. Proses pengambilan sampel dilakukan secara aseptik di dekat api bunsen. Selanjutnya dilakukan pengenceran untuk menghitung koloni bakteri saluran pencernaan.
Pembuatan Media Selektif Agar
Media ini mengandung nutrien yang dibutuhkan untuk pertumbuhan bakteri. Media ini dibuat dengan melarutkan masing-masing media selektif Eosin Methilene Blue Agar (EMBA) sebanyak 19 g untuk bakteri E. coli, Salmonella Shigella Agar (SSA) sebanyak 30 g untuk bakteri Salmonella sp., Dman Rugosa Sharp Agar (MRSA) sebanyak 26 g MRSB dan 8 g agar untuk bakteri Lactobacillus sp., sedangkan untuk Bifidobacterium Medium (BM) sebanyak 11. 5 g peptone, 7.5 g agar, 2.5 g NaCl, 2.5 g glukosa, 0.5 g starch soluble, dan 0.15 g L-Cysteine HCl untuk bakteri Bifidobacterium sp. Setiap media selektif tersebut, masing-masing dilarutkan ke dalam 500 ml akuades. Larutan tersebut lalu dipanaskan dan diaduk hingga homogen. Selanjutnya media tersebut disterilkan menggunakan autoclave pada tekanan 1.5 atm, suhu 121 ºC selama 15 menit. Setelah disterilkan, media disimpan dalam water bath untuk dituangkan ke dalam cawan petri.
Penghitungan Jumlah Koloni Bakteri Saluran Pencernaan
Suspensi mikroflora usus yang telah disiapkan dipipet sebanyak 1 ml dan dimasukkan ke dalam 10 ml larutan pengencer NaCl fisiologis sehingga diperoleh pengenceran 10⁻¹ dan dengan cara yang sama dibuat pengenceran hingga 10⁻ . Pada tingkat pengenceran 10⁻³, 10⁻ , dan 10⁻ digunakan untuk menghitung Lactobacillus sp. dan Bifidobacterium sp. Selanjutnya tingkat pengenceran 10⁻ , 10⁻ , dan 10⁻ digunakan untuk menghitung E. coli dan Salmonella sp. Suspensi pengenceran tersebut masing-masing dipipet secara aseptik sebanyak 1 ml ke dalam cawan petri. Selanjutnya dituangkan media selektif, digoyangkan, dan setelah beku diinkubasi pada suhu 37 ºC selama 24 jam.
Koloni yang tumbuh dihitung sebagai bakteri saluran pencernaan. dengan ciri spesifik Lactobacillus sp. berwarna kekuningan, Bifidobacterium sp. berwarna putih, E. coli berwarna hijau metalik, serta Salmonella sp. berwarna hitam dan berbentuk bulat.
Rancangan dan Analisis Data
Rancangan percobaan yang digunakan dalam penelitian yaitu Rancangan Acak Lengkap (RAL) dengan 5 perlakuan dan 4 ulangan yang masing-masing ulangan terdiri dari 10 ekor ayam. Perlakuan dalam penelitian, sebagai berikut :
P1 : Ransum komersial P2 : Ransum perlakuan
6 perbandingan bobot organ pencernaan dengan bobot hidup.
Panjang Relatif Organ Pencernaan (cm 100g⁻¹ bobot hidup). Panjang relatif organ pencernaan diperoleh dari perbandingan panjang organ yang diukur (cm) dengan 100 g bobot hidup.
Tebal Organ Pencernaan (mm). Tebal organ pencernaan diperoleh dari pengukuran tebal organ pencernaan (mm).
Koloni Bakteri Saluran Pencernaan (CFU ml⁻¹). Jumlah koloni bakteri saluran pencernaan dihitung dengan menggunakan metode cawan tuang (pour plate). Cara penghitungan diperoleh dari pengembangan Hadioetomo (1993), dihitung dengan rumus:
Koloni bakteri (CFU mlˉ¹) = Jumlah koloni 1 × 10−x ×10
c : Volume penambahan gliserol sebagai pengawet sampel (ml)
b
(b+c) : Dinyatakan sebagai faktor koreksi (FK)
Data koloni bakteri saluran pencernaan dalam CFU ml⁻¹ dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Karakteristik Fisik Saluran Pencernaan Ayam Broiler
7 makrovili, kemampuan pencernaan dan penyerapan juga dapat dipengaruhi oleh luas penampang usus (Yao et al. 2006). Luas penampang usus meliputi bobot, panjang, dan tebal usus.
Duodenum
Hasil analisis ragam menunjukkan pemberian tepung ubi jalar dan ragi tape sebagai sinbiotik dalam ransum pada periode berbeda tidak berpengaruh nyata terhadap persentase bobot duodenum, namun berpengaruh sangat nyata (P<0.01) meningkatkan panjang duodenum. Persentase bobot dan panjang relatif duodenum ayam broiler umur enam minggu, dapat dilihat pada Tabel 3.
Tabel 3. Persentase bobot dan panjang relatif duodenum ayam broiler umur 6
1.71±0.33A 2.43±0.20AB 2.58±0.17B 2.50±0.23AB 2.91±0.67B
Angka dengan huruf besar pada baris yang sama menunjukkan sangat berbeda nyata (P<0.01). P1= Ransum komersial, P2= Ransum basal, P3= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter-finisher), P4= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter saja), P5= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode finisher saja)
Perbedaan nilai pada pengukuran bobot dan panjang duodenum dapat dipengaruhi oleh kandungan serat kasar dalam ransum. Secara berturut-turut kandungan serat kasar dalam ransum komersial (P1), ransum basal (P2), dan ransum sinbiotik (P3, P4, dan P5) adalah 2.68%, 3.33%, dan 3.40%. Penambahan fraksi serat, selulosa, pada pakan dapat meningkatkan retention time sehingga digesta akan lebih lama dalam saluran pencernaan yang akan berdampak pada membesarnya organ atau saluran pencernaan (Cao et al. 2003; Yang et al. 2003). Pernyataan tersebut mendukung hasil penelitian ini yang menunjukkan tingginya nilai bobot dan panjang duodenum pada pemberian ransum basal (P2) dan ransum sinbiotik (P3, P4, dan P5) dibandingkan dengan pemberian ransum komersial (P1). Selain itu, keberadaan antibiotik di dalam ransum komersial yang bertujuan untuk membantu sistem pencernaan dengan cara membunuh mikroorganisme patogen dalam saluran pencernaan ataupun di tempat sel mukosa usus (Widodo 2002), sehingga antibiotik akan mengikis sel mukosa usus dan perkembangan saluran pencernaan pada ransum komersial akan lebih rendah. Meskipun demikian, panjang duodenum yang dihasilkan masih dalam kisaran normal yaitu 1.71-2.91 cm 100g⁻¹ bobot hidup atau 29.25-32.25 cm. Achmanu dan Muharlien (2011) menyatakan, panjang duodenum normal pada ayam broiler berkisar antara 30 cm.
8
Selain serat kasar, kandungan lemak kasar dalam ransum basal (P2) dan ransum sinbiotik (P3, P4, dan P5) relatif sama, yaitu 5.18% dan 6.27%. Hal ini meyebabkan perkembangan duodenum yang diberikan ransum basal dan ransum sinbiotik tidak berbeda jauh. Pemberian sinbiotik pada perlakuan P3 dan P5 menunjukkan nilai yang tinggi, dibanding perlakuan P4. Hal ini dikarenakan pada periode finisher, saluran pencernaan akan semakin berkembang sehingga pemberian ransum sinbiotik mengandung serat kasar dan lemak kasar tinggi pada periode starter-finisher (P3) dan finisher saja (P5) akan meningkatkan kerja dan perkembangan duodenum.
Jejunum
Hasil analisis ragam menunjukkan pemberian tepung ubi jalar dan ragi tape dalam ransum berpengaruh nyata (P<0.05) meningkatkan persentase bobot jejunum dan berpengaruh sangat nyata (P<0.01) meningkatkan panjang jejunum. Persentase bobot jejunum, panjang relatif jejunum, dan tebal jejunum ayam broiler umur enam minggu, dapat dilihat pada Tabel 4.
Tabel 4. Persentase bobot, panjang relatif, dan tebal jejunum ayam broiler umur 6 minggu
Peubah Perlakuan
P1 P2 P3 P4 P5
Bobot (%) 1.11±0.42a 1.91±0.20b 2.04±0.55b 1.66±0.30ab 1.98±0.38b
Panjang (cm 100g⁻¹ bobot hidup)
4.62±1.33A 6.55±0.27AB 8.17±1.85B 6.33±0.53AB 7.20±1.19AB
Tebal (mm) 0.13±0.01 0.11±0.03 0.13±0.04 0.10±0.03 0.11±0.05
Angka dengan huruf besar pada baris yang sama menunjukkan sangat berbeda nyata (P<0.01) dan angka dengan huruf kecil pada baris yang sama menunjukkan berbeda nyata (P<0.05). P1= Ransum komersial, P2= Ransum basal, P3= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter-finisher), P4= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter saja), P5= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode finisher saja)
Penelitian ini menghasilkan bobot jejunum dalam kisaran normal, yaitu 1.11%–2.04%. Putnam (1991) menyatakan, bobot jejunum pada ayam broiler yang sehat mencapai lebih dari 1.01%. Penelitian ini juga menghasilkan panjang jejunum dalam kisaran normal, yaitu 4.62–8.17 cm 100g⁻¹ bobot hidup atau 78.00-94.50 cm. Achmanu dan Muharlien (2011) menyatakan, panjang jejunum normal pada ayam broiler berkisar antara 68–120 cm. Pemberian ransum komersial (P1) menghasilkan bobot dan panjang jejunum yang lebih rendah dibanding perlakuan lainnya (P2, P3, P4, dan P5). Hal ini disebabkan, adanya kemampuan usus untuk meregang dan mencerna ransum yang mengandung serat kasar tinggi sehingga ukuran jejunum menjadi lebih besar.
9 ekstraseluler dengan pH asam yaitu 3 dan pH netral yaitu 7. Adanya peningkatan aktivitas protease tersebut dapat mempengaruhi panjang organ pencernaan (Suthama dan Ardiningsasi 2006). Keberadaan probiotik di dalam saluran pencernaan akan meningkatkan aktivitas enzim sehingga meningkatkan pula pemecahan zat-zat makanan menjadi bentuk yang lebih sederhana dan mudah diserap oleh saluran pencernaan (Mulyono et al. 2009). Oleh sebab itu, adanya pemberian ransum sinbiotik menghasilkan perkembangan jejunum yang relatif lebih tinggi dibanding dengan ransum basal. Penambahan sinbiotik dapat memperbaiki saluran pencernaan pada periode awal pertumbuhan. Keberadaan probiotik dalam ransum bersinbiotik pada periode starter (P4) menyebabkan jejunum dapat lebih mudah mencerna zat makanan tanpa perlu meningkatkan kerja dan ukuran organ pencernaanya dibandingkan dengan perlakuan ransum sinbiotik lainnya (P3 dan P5).
Pemberian tepung ubi jalar dan ragi tape dalam ransum tidak berpengaruh nyata terhadap tebal jejunum. Penebalan jejunum dapat menyebabkan pertumbuhan ternak unggas terganggu sebagai akibat berkurangnya jumlah nutrien yang diabsorpsi (Wiradisastra 2000). Pemberian perlakuan sinbiotik pada periode starter menghasilkan ketebalan jejunum yang rendah, artinya penyerapan pada perlakuan ini lebih baik dibanding dengan perlakuan lainnya. Penyerapan zat-zat makanan yang baik akan mempengaruhi bobot badan ternak. Hal ini juga sejalan dengan pengukuran bobot badan akhir ternak, dimana bobot badan ayam pada perlakuan sinbiotik periode starter (P4) memiliki nilai yang lebih tinggi dibandingkan dengan perlakuan sinbiotik lainnya (P3 dan P5). Bobot badan akhir ternak pada perlakuan P1, P2, P3, P4, dan P5 secara berturut-turut, yaitu 1757.88, 1289.38, 1163.37, 1299.90, dan 1151.66 g ekor-1 (Sukmawati 2014).
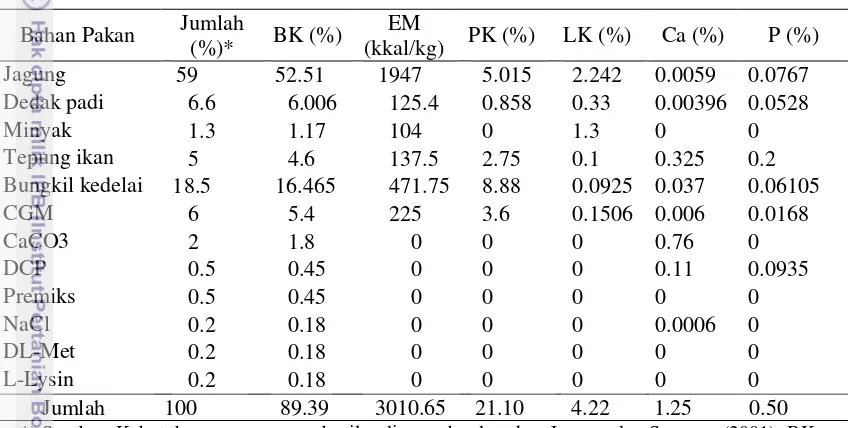
Ileum
Hasil analisis ragam menunjukkan pemberian tepung ubi jalar dan ragi tape dalam ransum berpengaruh sangat nyata (P<0.01) meningkatkan persentase bobot dan panjang ileum. Persentase bobot dan panjang relatif ileum ayam broiler umur enam minggu, dapat dilihat pada Tabel 5.
Tabel 5. Persentase bobot dan panjang relatif ileum ayam broiler umur 6 minggu
Peubah Perlakuan
P1 P2 P3 P4 P5
Bobot(%) 0.78±0.11A 1.61±0.26B 1.96±0.49B 1.80±0.30B 1.44±0.34AB
Panjang (cm 100g⁻¹ bobot hidup)
4.37±1.17A 6.61±0.26B 6.44±1.00B 6.90±0.57B 6.37±1.14B
Angka dengan huruf besar pada baris yang sama menunjukkan sangat berbeda nyata (P<0.01). P1= Ransum komersial, P2= Ransum basal, P3= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter-finisher), P4= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter saja), P5= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode finisher saja)
10
Secara umum, bobot dan panjang ileum yang dihasilkan pada pemberian ransum basal (P2) tidak jauh berbeda dengan ransum sinbiotik (P3, P4, dan P5). Hal ini disebabkan adanya kandungan nutrien pada ransum basal dan ransum sinbiotik yang relatif sama. Hasil penelitian ini tidak jauh berbeda dengan penelitian Wijaya (2010) yang menguji probiotik asal cassabio dengan menghasilkan panjang ileum pada kisaran 5.24-6.67 cm 100g⁻¹ bobot hidup. Putnam (1991) menyatakan, panjang ileum pada ayam broiler yang sehat mencapai lebih dari 4.00 cm 100g⁻¹ bobot hidup.
Berdasarkan penelitian Sofyan et al. (2004) yang mengkaji respon pertumbuhan dan perkembangan alat pencernaan ayam, bahwa ileum pada periode starter lebih cepat berkembang dibanding duodenum dan jejunum. Oleh karena itu, pemberian sinbiotik pada periode starter (P4) menghasilkan ileum yang relatif lebih panjang dari perlakuan sinbiotik lainnya (P3 dan P5). Dengan demikian, keberadaan sinbiotik pada periode starter dapat berinteraksi lebih cepat dalam mempengaruhi perkembangan ileum.
Kolon
Secara statistik pemberian tepung ubi jalar dan ragi tape dalam ransum tidak berpengaruh nyata terhadap bobot dan panjang kolon, artinya bobot dan panjang kolon ayam broiler yang dihasilkan tidak dipengaruhi oleh pemberian tepung ubi jalar dan ragi tape. Persentase bobot dan panjang relatif kolon ayam broiler umur enam minggu, dapat dilihat pada Tabel 6.
Tabel 6. Persentase bobot dan panjang relatif kolon ayam broiler umur 6 minggu
Peubah Perlakuan
0.60±0.15 0.66±0.06 0.85±0.20 0.61±0.11 0.84±0.15
P1= Ransum komersial, P2= Ransum basal, P3= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter-finisher), P4= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter saja), P5= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode finisher saja)
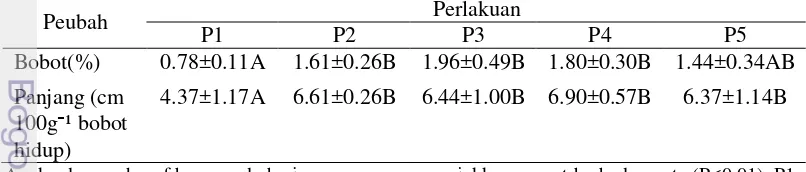
11 Sekum
Hasil analisis ragam menunjukkan pemberian tepung ubi jalar dan ragi tape dalam ransum berpengaruh nyata (P<0.05) meningkatkan panjang sekum, namun tidak berpengaruh nyata terhadap bobot dan tebal sekum. Persentase bobot sekum, panjang relatif sekum, dan tebal sekum ayam broiler umur enam minggu, dapat
1.01±0.28a 1.41±0.24b 1.59±0.09b 1.36±0.18b 1.43±0.20b
Tebal (mm) 0.14±0.03 0.11±0.04 0.10±0.04 0.10±0.03 0.13±0.04
Angka dengan huruf kecil pada baris yang sama menunjukkan berbeda nyata (P<0.05). P1= Ransum komersial, P2= Ransum basal, P3= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter-finisher), P4= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter saja), P5= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode finisher saja)
Penelitian ini menghasilkan panjang sekum antara 1.01-1.59 cm 100g⁻¹ bobot hidup atau 16.25-18.12 cm, artinya sekum berada dalam kisaran normal. Achmanu dan Muharlien (2011) menyatakan bahwa panjang sekum unggas normal berkisar antara 15-25 cm. Perbedaan bobot dan panjang sekum dipengaruhi oleh ukuran tubuh ayam, umur, dan pakan yang dikonsumsi (Yuwanta 2004). Pemberian ransum komersial (P1) menghasilkan panjang sekum paling rendah dibandingkan pemberian ransum lainnya (P2, P3, P4, dan P5). Hal ini diduga karena rendahnya kandungan serat dalam ransum komersial, menyebabkan aktivitas kerja sekum menurun dan panjang sekum menjadi lebih rendah.
Pemberian ransum basal (P2) dan ransum komersial (P3, P4, dan P5) menunjukkan nilai yang relatif sama. Menurut Pond et al. (1995) terdapat banyak bakteri fermentasi dalam sekum untuk mencerna sebagian serat, artinya mikroorganisme berperan sangat penting dalam mempengaruhi perkembangan organ ini. Dengan demikian, pemberian ransum bersinbiotik yang mengandung Saccharomyces cereviceae dapat lebih mengoptimalkan perkembangan sekum dibanding pemberian ransum basal.
12
sekum, karena mikroorganisme saluran pencernaan paling banyak terbentuk pada kedua organ ini sehingga mempengaruhi perkembangan organ termasuk tebal.
Koloni Bakteri dalam Usus Halus Ayam Broiler
Keberadaan bakteri usus sangat berperan penting terhadap status kesehatan ternak. Adapun bakteri yang paling berperan, diantaranya bakteri menguntungkan Lactobacillus sp. dan Bifidobacterium sp., serta bakteri merugikan E. coli dan Salmonella sp. Jumlah koloni bakteri saluran pencernaan ayam broiler umur enam minggu dalam CFU mlˉ¹, dapat dilihat pada Tabel 8.
Tabel 8. Jumlah koloni bakteri dalam usus halus ayam broiler umur 6 minggu
Bakteri Perlakuan P1= Ransum komersial, P2= Ransum basal, P3= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter-finisher), P4= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode starter saja), P5= P2 + 3% tepung ubi jalar dan 0.75% ragi (periode finisher saja)
Komposisi bakteri saluran pencernaan dipengaruhi oleh ransum dan lingkungan (Apajalahti et al. 2004). Jenis feed additive yang ditambahkan dalam ransum perlakuan yaitu antibiotik dari ransum komersial dan probiotik dari ragi tape (yeast). Kisaran mikroflora normal ayam sehat untuk jenis bakteri Salmonella sp., E. coli, dan Lactobacillus sp. adalah 10 -10 CFU mlˉ¹ (Garigga et al. 1998). Hasil penelitian menunjukkan jumlah koloni bakteri perlakuan masih berada pada kisaran normal pada ayam yang sehat. Pemberian ransum komersial (P1) menghasilkan jumlah Lactobacillus sp., Bifidobacterium sp., E. coli, dan Salmonella sp. lebih rendah dibanding ransum basal dan ransum sinbiotik (P2, P3, P4, dan P5). Semakin rendahnya keberadaan bakteri patogen dalam saluran pencernaan dapat menyebabkan bobot badan akhir meningkat, secara berturut-turut bobot badan akhir pada perlakuan P1, P2, P3, P4, dan P5 yaitu 1757.88, 1289.38, 1163.37, 1299.90, dan 1151.66 g ekor-1 (Sukmawati 2014). Selain itu pemberian ransum basal (P2) menghasilkan jumlah Lactobacillus sp. dan Bifidobacterium sp. yang rendah dibanding perlakuan sinbiotik (P3, P4, dan P5). Diantara ketiga ransum bersinbiotik, Lactobacillus sp. dan Bifidobacterium sp. tertinggi ada pada pemberian perlakuan periode starter saja (P4). Selain itu, perlakuan ini juga menghasilkan bobot badan akhir yang tinggi setelah perlakuan pemberian ransum komersial (P1). Hal ini dikarenakan bakteri baik secara alami sudah berkembang dalam saluran usus hingga kisaran 10 -10¹⁰ CFU mlˉ¹ (Garigga et al. 1998). Selain itu, penggunaan ubi jalar merah sebagai prebiotik memiliki komponen oligosakarida yang bermanfaat bagi keseimbangan kehidupan flora usus sehingga penyerapan nutrisi menjadi lebih baik dan usus lebih bersih (Hasyim dan Yusuf 2008).
13 menguntungkan yang dihasilkan. Juariah (2008) yang menguji pengaruh penambahan tepung daun jarak 10% dan penggunaan antibiotik tetrasiklin 0.02% menghasilkan jumlah bakteri E. coli pada kisaran 3.1 x 10 sampai 4.1 x 10 CFU mlˉ¹, sedangkan bakteri E. coli pada periode starter pada penambahan tepung daun jarak 10% dan penggunaan antibiotik tetrasiklin 0.02% secara berturut-turut sebesar 3.6 x 10 dan 3.3 x 10 CFU mlˉ¹. Dengan demikian, mekanisme kerja probiotik dalam ransum pada periode starter dapat menghasilkan jumlah bakteri patogen yang lebih rendah dalam usus. Mekanisme kerja probiotik dijelaskan oleh Soeharsono (1998) yang menyatakan bahwa probiotik merupakan mikroba hidup yang apatogen, yang mekanisme kerjanya mendesak mikroba non indigenous keluar dari ekosistem saluran pencernaan menggantikan posisi mikroba patogen. Probiotik sendiri berasal dari mikroba indigenous, sehingga proses translokasi yang terjadi berjalan secara alamiah. Mikroba patogen non indigenous merupakan benda asing, oleh karena itu harus didesak keluar dari saluran pencernaan. Faktor yang mempengaruhi kolonisasi mikroorganisme, berkaitan erat dengan inang, nutrisi, dan lingkungan.
SIMPULAN DAN SARAN
Simpulan
Pemberian sinbiotik pada periode starter saja (P4) dapat menghasilkan panjang duodenum, bobot dan panjang jejunum, serta panjang sekum yang lebih rendah dibanding pemberian sinbiotik pada periode starter sampai finisher (P3) dan pemberian sinbiotik pada periode finisher saja (P5). Selain itu pemberian sinbiotik pada periode starter saja menghasilkan koloni bakteri menguntungkan Lactobacillus sp. dan Bifidobacterium sp. lebih tinggi dibanding perlakuan sinbiotik lainnya, bahkan juga lebih tinggi dibandingkan jumlah bakteri pada perlakuan ransum komersial yang menggunakan antibiotik.
Saran
Perlu penelitian lebih lanjut terhadap penghitungan mikroflora usus yang dilakukan dengan pengambilan sampel pada dua periode berbeda, agar dapat dilihat lebih jelas perkembangan mikroflora usus yang baik diantara kedua periode tersebut.
DAFTAR PUSTAKA
Achmanu, Muharlien. 2011. Ilmu Ternak Unggas. Malang (ID): UB Press Anggorodi R. 1985. Ilmu Makanan Ternak Umum. Jakarta (ID): Gramedia.
14
Arista D. 2012. Pengaruh pemberian tepung ubi jalar merah ditambah ragi tape terhadap performa dan organ pencernaan ayam broiler [skripsi]. Bogor (ID): Fakutas Peternakan. Institut Pertanian Bogor.
Bell DD, Weaver WD. 2002. Commercial Chicken Meat and Egg Production. 5th ed. New York (US). Springer Science and Bussiness Media Inc.
Candinegara T. 2006. Pemanfaatan Feed Additive dan Feed Supplement Terkini. Disampaikan pada Pertemuan Civitas Akademika Jurusan Nutrisi dan Makanan Ternak Fakultas Peternakan Universitas Hasanuddin, Makassar. Cao BH, Zhang XP, Guo YM, Karasawa Y, Kumao T. 2003. Effect of dietary
cellulose levels on growth, nitrogen, utilization, retention, time of diets in digestive tract and caecal microflora of chickens. Asian-Aust J Anim Sci. 16: 863- 866.
Diaz D. 2008. Safety and efficacy of ecobiol as feed additive for chickens for fattening. The EFSA Journal. 773 : 2-13.
Ensminger ME, Oldfield JE, Heinemann WW. 1992. Feeds dan Nutrition. 2nd ed. Ensminger Publishing Company. California, USA.
Fuller R. 1992. Probiotics the Scientific Basis. Madras (IN): Chapman dan Hall. Garigga M, Pascual M, Monfort JM, Hugas M. 1998. Selection of lactobacilli for
chicken probiotic adjuntcs. J Applied Microbiol 84 (1): 125-132.
Hadioetomo R. 1993. Mikrobiologi Dasar-Dasar dalam Praktek. Jakarta (ID): Gramedia.
Hasyim A, Yusuf M. 2008. Diversifikasi produk ubi jalar sebagai bahan pangan substitusi beras. Sinar Tani, 30 Juli 2008. [Internet]. [diunduh pada 2014 Agustus 10]. Tersedia pada: Badan Litbang Pertanian. http:// litbang.deptan.go.id/artikel/one/215/
Juariah D. 2008. Pemanfaatan daun jarak (Jatropha Curcas L.) sebagai antibakteri alami dan pengaruhnya terhadap performa serta keseimbangan mikroflora saluran pencernaan ayam pedaging [skripsi]. Bogor (ID): Fakultas Peternakan, IPB.
Khosravi A, Boldaji F, Dastar B, Hasani S. 2008. The use of some feed additives as growth promoter in broiler nutrition. Int J Poult Sci. 7(11): 1095-1099. Leeson S, Summer JD. 2001. Nutrition of the Chicken. 4th ed. Canada (US).
University Books, Geulph, Ontarion.
Lindberg RA, Rhodes WG, Eirich LD, Drucker H. 1982. Extracelluler acid proteases from Neuspora crassa. J Bacteriol. 150: 1103-1108.
Mattjik AA, Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Ed ke-1. Bogor (ID): IPB Press.
Mulyono, Murwani R, Wahyono F. 2009. Kajian penggunaan probiotik Saccharomyces cereviceae sebagai alternatif aditif antibiotik terhadap kegunaan protein dan energi pada ayam broiler. J Indon Trop Anim Agric. 34(2): 145-151.
Ng SC, Hart AL, Kamm MA, Stagg AJ, Knight SC. 2009. Mechanisms of action of probiotics: recent advance. Inflamm Bowel Dis. 15(2): 300-310.
Nickle RA, Schummer E, Seifrle WG, Siller, Wight PHL. 1977. Anatomy of Domestic Bird. Berlin (US). Verlag Paul Parey.
15 Paramesuwari F. 2012. Pengaruh pemberian campuran tepung ubi jalar merah dengan ragi tape sebagai sinbiotik terhadap performa dan usus ayam broiler [skripsi]. Bogor (ID): Fakultas Peternakan. Institut Pertanian Bogor.
Pond WG, Church DC, Pond KR. 1995.Basic Animal Nutrition and Feeding. 4th ed. New York (US). John Wiley and Sons.
[PPPTP] Pusat Penelitian dan Pengembangan Teknologi Pangan. 1981. Paket Industri Pangan untuk Daerah Pedesaan. Bogor (ID): Institut Pertanian Bogor. Putnam PA. 1991. Handbook of Animal Science. San Diego (US). Academy Press. Santoso U, Tanaka K, Ohtani S. Saksida M. 2001. Effect of fermented product
from Bacillus subtilis on feed efficiency, lipid accumulation and ammonia production in broiler chicks. Asian-Aust J Anim Sci. 14: 333-337.
Soeharsono. 1998. Probiotik. Alternatif Pengganti Antibiotik dalam Bidang Peternakan. Bandung (ID): Fakultas Peternakan. Universitas Padjajaran. Sofyan A, Julendra H, Damayanti E, Sutrisno B, Wibowo MH. 2004. Performa
dan histologi pertumbuhan dan perkembangan alat pencernaan ayam broiler yang diinfeksi dengan Salmonella pullorum setelah pemberian imbuhan ransum mengandung tepung cacing tanah (Lumbricus rubellus). Med Pet. 33(1): 31-35.
Sturkie PD. 2000. Avian Physiology. 4th ed. New York (US). Springer-Verlag.
Sukmawati FM. 2014. Performa ayam broiler yang diberi sinbiotik campuran tepung ubi jalar merah dan ragi tape pada periode yang berbeda. [skripsi]. Bogor (ID): Fakultas Peternakan. Institut Pertanian Bogor.
Suthama N, Ardiningsasi SM. 2006. Perkembangan fungsi fisiologis saluran pencernaan ayam kedu periode starter. J Ilmiah Petern. 9 (2): 8-20.
Yang CJ, Yang IY, Oh DH, Bae IH, Kong IG, Uuganbayar D, Nou IS, Choi K. 2003. Effect of green tea by-product on performance and body composition in broiler chickens. Asian-Aust J Anim Sci. 18: 867-872.
Yao Y, Xiaoyan T, Haibo X. 2006. Effect of choice feeding on performance gastrointestinal development and feed utilization of broilers. Asian-Aust J Anim Sci. 19: 91-96.
Yuwanta T. 2004. Ilmu Ternak Unggas. Yogyakarta [ID]. Kanisius.
Wardhani W. 2011. Persentase karkas dan karakteristik organ dalam ayam broiler hasil penambahan zeolit dalam ransum dan litternya. [skripsi]. Bogor (ID): broiler yang diberi ransum dengan penambahan cassabio [skripsi]. Bogor (ID): Fakultas Peternakan. Institut Pertanian Bogor.
Winarno FG. 2010. Enzim Pangan. Bogor [ID]. Mbrio Press.
16
Lampiran 1. ANOVA Bobot duodenum ayam broiler umur 6 minggu SK db JK KT Fhit F0.05 F0.01 Perlakuan 4 0.269 0.067 1.130 3.056 4.893 Error 15 0.893 0.060
Total 19 1.162
SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Lampiran 2. ANOVA Panjang duodenum ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 3.104 0.776 5.763** 3.056 4.893
Error 15 2.020 0.135
Total 19 5.123 0.270
**) Sangat berbeda nyata (P<0.01), SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Duncan. Subset superskrip panjang duodenum ayam broiler umur 6 minggu
Perlakuan N α = 0.01
1 2
1 4 1.710
2 4 2.429 2.429
4 4 2.501 2.501
3 4 2.584
5 4 2.909
Sig. 1.000 .108
Lampiran 3. ANOVA Bobot jejunum ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 2.325 0.581 3.870* 3.056 4.893
Error 15 2.253 0.150
Total 19 4.578
*) Berbeda nyata (P<0.05), SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Duncan. Subset superskrip bobot jejunum ayam broiler umur 6 minggu
Perlakuan N α = 0.05
1 2
1 4 1.111
4 4 1.664 1.664
2 4 1.913
5 4 1.982
3 4 2.041
Sig. .062 .224
17 Lampiran 4. ANOVA Panjang jejunum ayam broiler umur 6 minggu
SK Db JK KT Fhit F0.05 F0.01
Perlakuan 4 27.301 6.825 4.909** 3.056 4.893
Error 15 20.856 1.390
Total 19 48.158
**) Sangat berbeda nyata (P<0.01), SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Duncan. Subset superskrip panjang jejunum ayam broiler umur 6 minggu
Perlakuan N α = 0.01
1 2
1 4 4.616
4 4 6.328 6.328
2 4 6.550 6.550
5 4 7.203 7.203
3 4 8.166
Sig. .058 .059
Lampiran 5. ANOVA Tebal jejunum ayam broiler umur 6 minggu
SK Db JK KT Fhit F0.05 F0.01
Perlakuan 4 0.002770 0.000692 0.543137 3.055568 4.893210 Error 15 0.019125 0.001275
Total 19 0.021895
SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Lampiran 6. ANOVA Bobot ileum ayam broiler umur 6 minggu
SK Db JK KT Fhit F0.05 F0.01
Perlakuan 4 3.311 0.828 8.001** 3.056 4.893
Error 15 1.552 0.103
Total 19 4.863
**) Sangat berbeda nyata (P<0.01), SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Duncan. Subset superskrip bobot ileum ayam broiler umur 6 minggu
Perlakuan N α = 0.01
1 2
1 4 .781
5 4 1.444 1.444
2 4 1.609
4 4 1.795
3 4 1.960
18
Lampiran 7. ANOVA Panjang ileum ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 16.393 4.098 5.050** 3.056 4.893
Error 15 12.172 0.811
Total 19 28.565
**) Sangat berbeda nyata (P<0.01), SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Duncan. Subset superskrip panjang ileum ayam broiler umur 6 minggu
Perlakuan N α = 0.01
1 2
1 4 4.365
5 4 6.374
3 4 6.439
2 4 6.610
4 4 6.902
Sig. 1.000 .457
Lampiran 8. ANOVA Bobot kolon ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 0.012 0.003 1.337 3.056 4.893
Error 15 0.034 0.002
Total 19 0.046
SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Lampiran 9. ANOVA Panjang kolon ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 0.239 0.060 2.979 3.056 4.893
Error 15 0.301 0.020
Total 19 0.540
SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Lampiran 10. ANOVA Bobot sekum ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 0.219 0.055 1.381 3.056 4.893
Error 15 0.596 0.040
Total 19 0.815
SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
19 Lampiran 11. ANOVA Panjang sekum ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 0.742 0.186 4.221* 3.056 4.893
Error 15 0.659 0.044
Total 19 1.402
*) Berbeda nyata (P<0.05), SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Duncan. Subset superskrip panjang sekum ayam broiler umur 6 minggu
Perlakuan N α = 0.05
1 2
1 4 1.005
4 4 1.361
2 4 1.412
5 4 1.428
3 4 1.588
Sig. 1.000 .177
Lampiran 12. ANOVA Tebal sekum ayam broiler umur 6 minggu
SK db JK KT Fhit F0.05 F0.01
Perlakuan 4 0.004780 0.001195 0.857912 3.055568 4.893210 Error 15 0.020894 0.001393
Total 19 0.025674
SK = sumber keragaman, db= derajat bebas, JK= jumlah kuadrat, KT= kuadrat kontrol
Lampiran 13. Organ pencernaan ayam broiler umur 6 minggu
Duodenum Jejunum Ileum Kolon Sekum
20
Lampiran 14. Bahan media selektif agar
Lampiran 15. Koloni bakteri Lactobacillus sp. pada cawan petri
Lampiran 16. Koloni bakteri Bifidobacterium sp. pada cawan petri
Lampiran 17. Koloni bakteri Escherichia coli pada cawan petri
21
RIWAYAT HIDUP
Penulis dilahirkan tanggal 27 Maret 1992 di Jakarta. Penulis merupakan anak tunggal dari pasangan Bapak Supadmo dan Ibu Utami. Penulis menempuh pendidikan dasar di SDN 05 Cempaka Putih Barat pada tahun 1998 sampai 2004. Pendidikan dilanjutkan di SMP Negeri 28 Mardani Jakarta Pusat hingga tahun 2007 dan pendidikan lanjutan menengah atas diselesaikan pada tahun 2010 di SMA Negeri 27 Mardani Jakarta Pusat.
Penulis diterima di IPB pada tahun 2010 melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. Penulis aktif di Himpunan Mahasiswa Nutrisi dan Makanan Ternak (Himasiter) pada tahun 2012-2013. Penulis pernah mengikuti kegiatan magang di Koperasi Peternak Sapi Bandung Utara (KPSBU), Lembang selama satu bulan pada tahun 2013.
UCAPAN TERIMA KASIH
Puji syukur Penulis panjatkan kepada Allah SWT atas nikmat yang tidak terhitung, kasih sayang dan hidayah-Nya sehingga Penulis dapat menyelesaikan kuliah, penelitian, seminar, dan skripsi. Shalawat serta salam selalu tercurahkan kepada Nabi besar Muhammad SAW yang dengan ajarannya mampu mengantarkan Penulis ke dunia yang semakin baik.
Penulis mengucapkan terimakasih yang sebesar-besarnya kepada Bapak Dr. Ir. Asep Sudarman, M.Rur.Sc selaku pembimbing akademik, pembimbing skripsi utama, sekaligus penyandang dana penelitian, dan Ibu Dr. Ir. Widya Hermana, M.Si selaku dosen pembimbing skripsi anggota sekaligus panitia dalam sidang yang telah meluangkan waktu untuk membimbing dan memberikan motivasi dengan penuh kesabaran. Penulis mengucapkan terimakasih pula kepada Ibu Ir. Anita Tjakradidjaja, M.Rur.Sc selaku dosen penguji seminar pada tanggal 22 Mei 2014. Penulis juga mengucapkan terimakasih atas penilaian dan saran yang diberikan oleh Ibu Dr. Sri Suharti, S.Pt. M.Si dan Ibu Dr. Ir. Niken Ulupi. MS selaku dosen penguji sidang pada tanggal 29 Agustus 2014.
Ucapan terimakasih juga penulis sampaikan kepada seluruh civitas akademika FAPET IPB, Ibu Lanjarsih S.Pt dan Ibu Yani atas bantuannya selama di Laboratorium. Kak Fitri Mulia dan Haryono sebagai teman satu kelompok penelitian yang saling membantu satu sama lain. Teman-teman INTP 47 (D.Net) yang sudah seperti keluarga dan telah memberikan bantuan dan kebersamaan selama menuntut ilmu di IPB.