KAUDA EPIDIDIMIS DAN EJAKULAT
FITRA AJI PAMUNGKAS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Karakteristik dan Kemampuan Fertilisasi In Vitro Spermatozoa Domba yang Berasal dari Kauda Epididimis dan Ejakulat adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2012
Fitra Aji Pamungkas
ABSTRACT
FITRA AJI PAMUNGKAS. Characteristics and in vitro fertilization ability of cauda epididymal and ejaculated ram sperm. Under direction of MOHAMAD AGUS SETIADI and NI WAYAN KURNIANI KARJA.
The characteristic and in vitro fertilization ability of ram spermatozoa collected from cauda epididymides was axamined. Ejaculated spermatozoa was used as control group in this experiment. Characteristic of spermatozoa including of percentage of progressive motility, viability, abnormalities and membrane integrity were evaluated before and after freezing. Fertilization ability of post-thawed of the spermatozoa in both group was examined based on the pronucleus formation after in vitro fertilization of in vitro matured (IVM) oocytes. Results from these study showed that there were no significant differences in the characteristics between cauda epididymal and ejaculated spermatozoa before freezing (P>0.05). After freezing, motility of ejaculated spermatozoa was higher than epididymal spermatozoa (54.00±2.24% vs 48.00±4.47%), however the membrane integrity of epididymal spermatozoa was higher than ejaculated spermatozoa (75.38±9.32% vs 65.54±11.88%) (P<0.05). In vitro fertilization experiment revealed that the ability of post-thawed epididymal spermatozoa to fertilize oocytes (61.40%, 42.98%, 18.42% for total, normal and polysperm, respectively) did not differ from that of ejaculated spermatozoa (66.67%, 48.78%, 17.89% for total, normal and polysperm, respectively) (P>0.05). These results indicate that ram spermatozoa collected from cauda epididymal and then frozen have the ability to fertilize ram ooctyes in vitro in the similar rate with ejaculated spermatozoa. The new cryopreservation protocol and reproductive technology describe here can enhance conservation of ram genetic resources.
RINGKASAN
FITRA AJI PAMUNGKAS. Karakteristik dan Kemampuan Fertilisasi In Vitro
Spermatozoa Domba yang Berasal dari Kauda Epididimis dan Ejakulat. Dibimbing oleh MOHAMAD AGUS SETIADI dan NI WAYAN KURNIANI KARJA.
Materi genetik baik dari hewan yang mempunyai nilai ekonomis, terancam punah atau populasinya yang semakin sedikit maupun satwa liar bisa hilang kapan saja oleh kematian hewan secara tak terduga, libido yang rendah maupun gangguan saluran reproduksi. Upaya yang dapat dilakukan untuk menghindari hilangnya materi genetik hewan secara keseluruhan adalah dengan cara menyelamatkan materi genetik tersebut untuk dapat digunakan kembali melalui aplikasi teknologi. Salah satu kemungkinan yang dapat dilakukan dalam rangka pelestarian plasma nutfah dari gamet jantan yaitu melalui penyelamatan dan pemanfaatan spermatozoa dari kauda epididimis setelah kematian hewan (postmortem). Bertolak dari hal tersebut maka penelitian ini dilakukan untuk mengetahui karakteristik spermatozoa dari kauda epididimis domba dan kemampuannya untuk memfertilisasi oosit secara in vitro setelah dibekukan. Spermatozoa dari ejakulat digunakan sebagai kelompok kontrol.
Pada penelitian tahap I, proses kriopreservasi spermatozoa dari kauda epididimis dan ejakulat menggunakan medium Niwa dan Sasaki Freezing (NSF) sebagai bahan pengencer dilakukan dengan metode two-step freezing. Komposisi medium freezing I (NSF I) terdiri dari 20% (v/v) kuning telur, 8,8% (w/v) laktosa dan 200 μg/ml ampicillin, sedangkan medium freezing II (NSF II) terdiri dari 92,52% (v/v) medium freezing I, 1,48% (v/v) Orvus ES Paste dan 6% (v/v) gliserol. Karakteristik spermatozoa yang diamati meliputi persentase motilitas, viabilitas, abnormalitas dan integritas membran dari kauda epididimis dan ejakulat yang dievaluasi sebelum dan setelah dibekukan. Pada penelitian tahap II, oosit hasil seleksi dimaturasi dalam Tissue Culture Medium (TCM) 199 ditambahkan 5% Fetal Bovine Serum (FBS), 2 IU/ml Pregnant Mare Serum Gonadotrophin
(PMSG), 2 IU/ml human Chorionic Gonadotrophin (hCG), 0,06 g/l penicillin dan 0,1 g/l streptomycin. Oosit matang selanjutnya di fertilisasi in vitro menggunakan spermatozoa dari kauda epididimis domba dan ejakulat setelah pembekuan. Penentuan tingkat kemampuan fertilisasi in vitro spermatozoa domba setelah pembekuan dilakukan berdasarkan pembentukan dan jumlah pronukleus (PN). Oosit yang telah mengalami fertilisasi ditandai dengan terbentuknya dua pronukleus (jantan dan betina, 2PN) atau lebih (>2PN) dalam sitoplasma oosit. Tingkat fertilisasi merupakan perbandingan antara jumlah oosit yang dibuahi (membentuk dua atau lebih pronukleus) dengan jumlah keseluruhan oosit yang difertilisasi.
epididimis mempunyai integritas membran yang lebih tinggi pada tahap post-thawing dari spermatozoa ejakulat (75,38±9,32% vs 65,54±11,88%) (P<0,05). Sedangkan pada penelitian tahap II, berdasarkan pembentukan pronukleus setelah fertilisasi in vitro didapatkan hasil bahwa tingkat fertilisasi spermatozoa dari kauda epididimis (61,40%, 42,98%, 18,42%, berturut-turut untuk total, normal, dan polispermia) tidak berbeda dengan spermatozoa ejakulat (66,67%, 48,78%, 17,89%, berturut-turut untuk total, normal, dan polispermia) (P>0,05). Dari data di atas, dapat disimpulkan bahwa segera setelah dikoleksi, spermatozoa dari kauda epididimis mempunyai karakteristik yang sama dengan spermatozoa dari ejakulat. Walaupun setelah pembekuan motilitas spermatozoa kauda epididimis lebih rendah dari spermatozoa ejakulat, spermatozoa kauda epididimis mempunyai kemampuan memfertilisasi oosit yang sama dengan spermatozoa ejakulat.
© Hak cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB
KARAKTERISTIK DAN KEMAMPUAN FERTILISASI IN
VITRO SPERMATOZOA DOMBA YANG BERASAL DARI
KAUDA EPIDIDIMIS DAN EJAKULAT
FITRA AJI PAMUNGKAS
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakteristik dan Kemampuan Fertilisasi In Vitro
Spermatozoa Domba yang Berasal dari Kauda Epididimis dan Ejakulat
Nama : Fitra Aji Pamungkas
NIM : B 352090031
Disetujui Komisi Pembimbing
Dr. drh. Mohamad Agus Setiadi drh. Ni Wayan Kurniani Karja, M.P., Ph.D Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Biologi Reproduksi
Dr. drh. Mohamad Agus Setiadi Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala berkat rahmat dan karunia-Nya sehingga penelitian dan penulisan tesis yang berjudul Karakteristik dan Kemampuan Fertilisasi In Vitro Spermatozoa Domba yang Berasal dari Kauda Epididimis dan Ejakulat dapat diselesaikan dengan baik.
Penulis mengucapkan terima kasih dan penghargaan yang tinggi kepada Bapak Dr. drh. Mohamad Agus Setiadi selaku ketua komisi pembimbing sekaligus ketua Program Studi Biologi Reproduksi dan Ibu Drh. Ni Wayan Kurniani Karja, M.P., Ph.D selaku anggota komisi pembimbing yang telah meluangkan waktu untuk memberikan arahan, bimbingan dan dorongan semangat mulai dari proses perancangan dan pelaksanaan penelitian hingga penulisan tesis. Penulis juga mengucapkan terima kasih kepada Prof. Dr. drh. Iman Supriatna selaku penguji luar komisi atas segala saran, kritik dan masukan yang diberikan untuk kesempurnaan tesis ini.
Ucapan terima kasih juga penulis sampaikan kepada Kepala Badan Litbang Pertanian Departemen Pertanian, Ketua Komisi Pembinaan Tenaga Badan Litbang Pertanian, Kepala Puslitbang Peternakan dan Kepala Loka Penelitian Kambing Potong atas kesempatan dan beasiswa untuk melanjutkan studi Program Magister di Program Pascasarjana, Fakultas Kedokteran Hewan IPB.
Penulis juga menyampaikan rasa terimakasih yang mendalam kepada Rektor, Dekan Sekolah Pascasarjana, Dosen-dosen Departemen Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan IPB beserta staf yang telah memberikan pengajaran, pendidikan, arahan dan bimbingan, serta membantu kelancaran sehingga penulis dapat menyelesaikan penelitian dan pendidikan.
Cikanyong Desa Citaringgul Kecamatan Babakan Madang Kabupaten Bogor dan dan Rumah Aqiqah Al-An’am, penulis mengucapkan terimakasih atas penyediaan materi untuk penelitian ini serta berbagai pihak yang tidak dapat disebutkan satu-persatu.
Kepada istriku tercinta Anita Fitriyani, S.E. dan kedua anugerah terindahku Adzkia Keisha Aji dan Adzka Ghaisan Aji yang telah bersabar, tabah dan rela untuk berpisah sementara, selalu berdoa dan memberikan semangat yang tak pernah putus. Kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Akhirnya penulis berharap semoga apa yang telah dihasilkan ini dapat memberikan manfaat bagi pengembangan ilmu pengetahuan dan peternakan Indonesia.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Karawang Jawa Barat pada tanggal 29 September 1978 sebagai anak keempat dari enam bersaudara yang merupakan putera dari pasangan H. Engkos Kosasih, B.A. (ayah) dan Hj. Enung Hartini (ibu).
Pada tahun 1996 penulis lulus dari Sekolah Menengah Umum (SMU) Negeri 1 Karawang dan pada tahun yang sama lolos seleksi Ujian Masuk Perguruan Tinggi Negeri (UMPTN) pada Program Studi Ilmu Peternakan, Fakultas Peternakan Universitas Padjadjaran hingga memperoleh Gelar Sarjana Strata S1 pada tahun 2001. Penulis bekerja sejak tahun 2004 sebagai staf peneliti bidang Fisiologi dan Reproduksi Ternak di Loka Penelitian Kambing Potong Sei Putih, Sumatera Utara.
DAFTAR ISI
Transportasi dan Pematangan Spermatozoa ... 5
Kriopreservasi Spermatozoa ... 6
Komposisi Bahan Pengencer Spermatozoa ... 7
Kriopreservasi Spermatozoa dari Kauda Epididimis ... 12
Fertilisasi In Vitro ... 14
Aplikasi Spermatozoa dari Kauda Epididimis untuk FIV ... 17
BAHAN DAN METODE ... 19
Tempat dan Waktu Penelitian ... 19
Metode Penelitian ... 19
Tahap I. Karakteristik Spermatozoa Domba Sebelum dan Setelah Pembekuan... 19
Tahap II. Kemampuan Fertilisasi In Vitro Spermatozoa Domba Setelah Pembekuan ... 23
Analisis Data... 26
HASIL DAN PEMBAHASAN ... 27
Tahap I. Karakteristik Spermatozoa Domba Sebelum dan Setelah Pembekuan... 27
Tahap II. Kemampuan Fertilisasi In Vitro Spermatozoa Domba Setelah Pembekuan... 41
KESIMPULAN ... 45
SARAN ... 45
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
Halaman 1 Karakteristik spermatozoa domba dari kauda epididimis dan ejakulat
sebelum pembekuan ... 27 2 Kemampuan fertilisasi in vitro spermatozoa domba setelah pembekuan
yang berasal dari kauda epididimis dengan ejakulat ... 42
DAFTAR GAMBAR
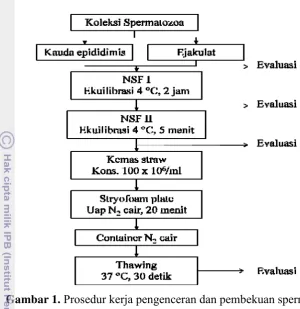
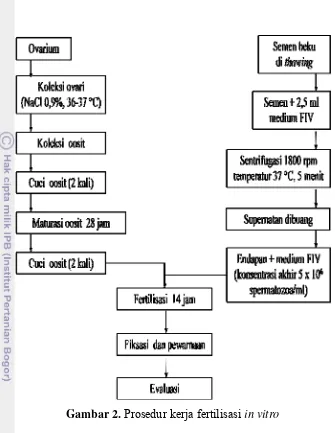
Halaman 1 Prosedur kerja pengenceran dan pembekuan spermatozoa ... 20 2 Prosedur kerja fertilisasi in vitro ... 24 3 Persentase motilitas spermatozoa dari kauda epididimis dan ejakulat
selama proses kriopreservasi ... 32 4 Gambaran integritas membran spermatozoa domba ... 34 5 Persentase integritas membran spermatozoa dari kauda epididimis dan
ejakulat selama proses kriopreservasi ... 35 6 Gambaran viabilitas spermatozoa domba ... 37 7 Persentase viabilitas spermatozoa dari kauda epididimis dan ejakulat
selama proses kriopreservasi ... 37 8 Gambaran abnormalitas spermatozoa domba ... 39 9 Persentase abnormalitas spermatozoa dari kauda epididimis dan ejakulat
DAFTAR LAMPIRAN
Halaman 1 Komposisi medium Niwa dan Sasaki Freezing (NSF) untuk kriopreservasi
spermatozoa ... 60 2 Komposisi medium koleksi oosit (modified Phosphate Buffered Saline,
PENDAHULUAN
Latar Belakang
Materi genetik baik dari hewan yang mempunyai nilai ekonomis, terancam punah atau populasinya yang semakin sedikit maupun satwa liar bisa hilang kapan saja oleh kematian hewan secara tak terduga, libido yang rendah maupun gangguan saluran reproduksi (Drouineaud et al. 2003; Kaabi et al. 2003). Upaya yang dapat dilakukan untuk menghindari hilangnya materi genetik hewan secara keseluruhan adalah dengan cara menyelamatkan materi genetik tersebut untuk dapat digunakan kembali melalui aplikasi teknologi.
Salah satu kemungkinan yang dapat dilakukan dalam rangka pelestarian plasma nutfah dari gamet jantan yaitu melalui penyelamatan dan pemanfaatan spermatozoa dari epididimis setelah kematian hewan (postmortem) (Ehling et al. 2006). Spermatozoa yang berada pada testis atau kaput epididimis adalah immotile
dan immature, sedangkan spermatozoa yang mencapai kauda epididimis umumnya motil dan mature serta mempunyai kemampuan fertilisasi (Toshimori 2003). Spermatozoa dari kauda epididimis tetap hidup dengan kualitas yang masih baik untuk jangka waktu antara 10-20 jam postmortem (Martinez-Pastor et al. 2005) dan masih menunjukkan kemampuan untuk memfertilisasi oosit secara in vitro serta dapat menghasilkan keturunan (Jishage et al. 1997; Songsasen et al. 1998). Berdasarkan alasan tersebut, kriopreservasi spermatozoa dari kauda epididimis merupakan metode yang dapat digunakan untuk konservasi materi genetik ternak dikarenakan pemanfaatannya dalam jangka panjang tanpa dibatasi waktu dan jarak (Martins et al. 2007). Kriopreservasi spermatozoa dari kauda epididimis telah dilakukan pada berbagai spesies termasuk babi (Rath & Niemann 1997), anjing (Stilley et al. 1999), kambing (Blash et al. 2000), tikus (Koshimoto
et al. 2000), manusia (Patrizio 2000) dan kuda (Tiplady et al. 2002), dengan hasil yang bervariasi.
kemampuan fertilisasi dari spermatozoa yang dikriopreservasi, telah dilakukan modifikasi serta penambahan berbagai komponen pada bahan pengencer (Marti et al. 2003; Riha et al. 2006; Sarlos et al. 2002).
Komposisi bahan pengencer baik krioprotektan, gula, buffer dan bahan aditif lainnya akan berinteraksi selama proses kriopreservasi dengan cara yang spesifik untuk melindungi spermatozoa, menyediakan substrat energi serta mencegah efek negatif dari perubahan pH dan osmolalitas (Salamon & Maxwell 2000; Yoshida et al. 2000). Penggunaan kuning telur umumnya digunakan sebagai agen yang efektif untuk melindungi membran plasma dan akrosom spermatozoa dari efek kejutan dingin karena kandungan fosfolipid, low density lipoproteins dan kandungan kolesterolnya (Aboagla & Terada 2004; Amirat et al. 2004). Namun demikian, penurunan kualitas spermatozoa setelah kriopreservasi masih menjadi masalah yang belum teratasi. Penggunaan Orvus ES Paste dalam medium pengencer dilaporkan memberikan efek positif terhadap kualitas spermatozoa setelah kriopreservasi (Kikuchi et al. 1999; Cheng et al. 2004). Orvus ES Paste adalah bahan yang mengandung sodium dodecyl sulphate yang berfungsi sebagai surfaktan untuk menstabilkan membran akrosom dan melindungi spermatozoa dari efek toksik gliserol selama proses pembekuan (Ponglowhapan & Chatdarong 2008). Oleh karenanya pemanfaatan bahan pengencer dengan kombinasi kuning telur dan Orvus ES Paste diharapkan dapat meningkatkan kualitas spermatozoa setelah pembekuan.
kriopreservasi, daya penetrasi spermatozoa dari kauda epididimis setelah pembekuan dievaluasi menggunakan teknik fertilisasi in vitro.
Tujuan Penelitian
1. Mengevaluasi karakteristik spermatozoa dari kauda epididimis, kemudian dibandingkan dengan spermatozoa dari ejakulat pada domba.
2. Mengevaluasi karakteristik spermatozoa domba dari kauda epididimis dan ejakulat setelah di kriopreservasi dengan bahan pengencer yang mengandung Orvus ES Paste.
3. Mengevaluasi kemampuan fertilisasi in vitro spermatozoa dari kauda epididimis domba setelah pembekuan.
Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan informasi mengenai suatu sistem atau metode kriopreservasi dengan bahan pengencer yang sesuai untuk spermatozoa domba dari kauda epididimis serta kemampuan fertilisasi in vitro
untuk produksi embrio in vitro dengan spermatozoa hasil kriopreservasi. Hasil yang diperoleh dapat digunakan sebagai model dalam upaya penyelamatan materi genetik ternak yang berakhir di rumah potong, terancam punah atau populasi yang semakin sedikit.
Hipotesis
TINJAUAN PUSTAKA
Transportasi dan Pematangan Spermatozoa
Produksi spermatozoa terjadi pada saluran reproduksi jantan yang dinamakan testis. Setiap testis tersusun atas tubuli seminiferi yang mengandung spermatogonium dan bertanggung jawab dalam proses spermatogenesis untuk produksi dan diferensiasi spermatosit menjadi spermatid yang pada akhirnya menjadi spermatozoa. Setelah pembentukan, spermatozoa diangkut ke dalam tubulus yang lebih besar berupa rete testis untuk selanjutnya di transportasikan ke epididimis melalui vasa efferentia. Setelah mencapai epididimis, sel epithel menyerap cairan rete testis dan mengeluarkan cairan epididimis, lalu berkonsentrasi dengan menyiapkan tempat bagi spermatozoa sebelum di ejakulasikan. Pada saat ejakulasi, spermatozoa akan meninggalkan epididimis melalui vas deferens atau ductus deferens menuju urethra dan akhirnya keluar melalui penis (Setchell 1998).
Spermatozoa yang meninggalkan testis belum memiliki kemampuan untuk membuahi oosit (Moore & Akhondi 1996). Untuk memperoleh kemampuan tersebut, spermatozoa harus mengalami banyak perubahan selama berada di epididimis meliputi perubahan morfologi (berpindahnya cytoplasmic droplet dari pangkal kepala ke ujung bawah bagian tengah spermatozoa), stabilisasi kromatin oleh ikatan disulfida, perubahan komposisi membran, peningkatan kerentanan terhadap kerusakan kejutan dingin, perkembangan pergerakan dan akuisisi kemampuan fertilisasi (Bedford & Hoskins 1990). Amann et al. (1993) melaporkan bahwa perubahan yang terkait dengan pematangan spermatozoa yaitu (1) modifikasi protein DNA kompleks pada inti untuk meminimalkan kemungkinan kerusakan akibat lingkungan atau degradasi prematur dan (2) modifikasi membran plasma, mitokondria dan komponen mikrotubular yang berperan dalam mengaktifkan transduksi energi untuk koordinasi kontraksi ekor dan motilitas serta stabilisasi plasma dan membran akrosom dalam mengikat protein dalam rangka penetrasinya terhadap oosit.
bergerak. Hal ini dapat disebabkan oleh perubahan biokimia dan fisik dari membran plasma spermatozoa kaitannya dengan peningkatan konsentrasi cAMP, penurunan pH intraselular, perubahan ion bebas Ca2+ dan kecepatan transportasi glukosa dalam spermatozoa (Amann et al. 1993).
Spermatozoa secara fungsional matang dalam kauda epididimis akan tetapi kehadiran plasma semen pada saat ejakulasi dapat memodifikasi fungsi spermatozoa sehingga mengubah sifat dan respon dari membran spermatozoa (White 1993). Komponen plasma semen berupa enzim, hormon, protein, maupun metabolit berkontribusi terhadap kompetisi spermatozoa melewati barrier, menyediakan nutrisi bagi spermatozoa, merangsang kapasitasi dengan memfasilitasi kolesterol efflux dari membran plasma, membantu pengaturan reaksi akrosom, mendukung fertilisasi dengan mempertahankan pH, serta memainkan peranan dalam motilitas spermatozoa dan kontraksi saluran reproduksi betina (Poiani 2006; Green et al. 1996). Berbeda halnya dengan yang dilaporkan Bergeron et al. (2005) bahwa plasma semen mengandung faktor dekapasitasi (spermadhesins) yang terdiri dari struktur biokimia diantaranya peptida dengan berat molekul yang rendah, glikoprotein, steroid dan kolesterol yang reversibel dalam mengikat spermatozoa dan menghambat kapasitasi. Spermadhesins
merupakan molekul pada lapisan spermatozoa yang berfungsi menstabilkan membran plasma akrosom yang dilepaskan selama kapasitasi. Spermadhesins
disekresikan oleh kelenjar aksesori seksual, namun ada juga yang berasal dari epididimis. Spermadhesins merupakan protein utama dalam plasma semen domba yang bersama-sama dengan protein lain yang mengandung fibronektin type II
memberikan dampak negatif pada spermatozoa dimana interaksinya dengan spermatozoa mengarah pada penurunan fosfolipid kolin dan kolesterol dari membran plasma spermatozoa yang berperan dalam proses kapasitasi.
Kriopreservasi Spermatozoa
pengetahuan mengenai fisiologi spermatozoa dari suatu spesies ternak (Purdy 2006). Prinsip yang terpenting dari kriopreservasi spermatozoa adalah pengeluaran air dari dalam spermatozoa (dehidrasi) sebelum membeku intraseluler. Bila tidak terjadi dehidrasi akan terbentuk kristal es yang dapat merusak spermatozoa dan bila terjadi dehidrasi yang sangat hebat maka spermatozoa akan mengalami kekeringan sehingga spermatozoa mati (Supriatna & Pasaribu 1992). Spermatozoa yang di kriopreservasi sangat sensitif terhadap penurunan suhu yang cepat karena dapat mengakibatkan kejutan dingin dan fase transisi membran. Kejutan dingin menyebabkan hilangnya permeabilitas yang selektif dan integritas membran plasma, pelepasan enzim intraseluler dan lipid, redistribusi ion, perubahan membran akrosom dan mitokondria, penurunan motilitas dan metabolisme (Watson 1995). Proses freezing dan thawing dapat mengakibatkan tingginya persentase kerusakan membran akrosom yang dapat mengganggu kemampuan spermatozoa pada saat proses fertilisasi. Selain itu, struktur dan integritas sel spermatozoa yang normal merupakan faktor penting untuk memprediksi kelangsungan hidup spermatozoa setelah kriopreservasi (Watson 2000).
Komposisi Bahan Pengencer Spermatozoa
Komposisi bahan pengencer baik krioprotektan, gula, buffer dan bahan aditif lainnya akan berinteraksi selama proses kriopreservasi dengan cara yang spesifik untuk melindungi spermatozoa, menyediakan substrat energi serta mencegah efek negatif dari perubahan pH dan osmolalitas (Salamon & Maxwell 2000; Yoshida et al. 2000). Upaya untuk meningkatkan preservasi spermatozoa domba telah difokuskan pada modifikasi bahan pengencer (Marti et al. 2003) serta pada penambahan berbagai komponen untuk mempertahankan motilitas, integritas membran dan kemampuan fertilisasi dari spermatozoa (Riha et al. 2006).
Kuning telur
kolesterolnya (Watson 2000). Di dalam kuning telur terdapat lesitin yang dapat mempertahankan motilitas spermatozoa dari kejutan dingin karena kandungan
phosphatidylcholine (Kikuchi et al. 1998).
Kuning telur terdiri dari 33% lipid dan antioksidan yang penting untuk perkembangan embrio. Kandungan phovitin, ceruloplasmin, ovalbumin dan
ovotransferrin yang terdapat pada kuning telur dapat menghilangkan ion logam bebas yang dapat mengkatalisis produksi reactive oxygen species (ROS). Selain itu, protein yang mirip dengan ekstraselular superoksida dismutase dan plasma glutathione peroksidase pada kuning telur dapat berkontribusi dalam meningkatkan kapasitas antioksidan (Mann & Mann 2008).
Penggunaan kuning telur dengan konsentrasi yang berbeda berkisar antara 0-20% telah dilaporkan oleh England (1993), dimana motilitas setelah pencairan kembali dan persentase spermatozoa hidup terbaik dihasilkan dari semen beku dengan konsentrasi kuning telur sebesar 10%. Namun, sebagian besar melaporkan kesuksesan aplikasi teknologi inseminasi buatan menggunakan semen beku dengan konsentrasi kuning telur sebesar 20% pada komposisi bahan pengencer (Fontbonne & Badinand 1993).
Laktosa
Laktosa sebagai salah satu karbohidrat golongan disakarida terdiri atas dua unit monosakarida yaitu satu unit glukosa dan satu unit galaktosa yang keduanya dapat dimetabolisir oleh spermatozoa melalui glikolisis dan siklus Krebs untuk menghasilkan energi berupa adenosin trifosfat (ATP) (Lehninger 1994). Adenosin trifosfat dimanfaatkan oleh spermatozoa sebagai sumber energi dalam proses pergerakan sehingga dapat tetap motil dan sekaligus untuk mempertahankan daya hidupnya. Laktosa dengan berat molekul yang tinggi berperan sebagai senyawa krioprotektan ekstrasellular untuk menjaga tekanan osmotik dari pengencer dan melindungi integritas membran spermatozoa akibat pengaruh kejutan dingin selama penyimpanan pada suhu rendah (3–5 °C) (Salomon & Maxwell 2000; Rizal 2009).
memiliki fungsi yang mirip dengan senyawa antioksidan karena mampu meredam senyawa-senyawa pengoksidasi, sehingga juga berperan dalam meminimumkan terjadinya reaksi oksidasi. Reaksi oksidasi bersifat merugikan karena menghasilkan produk yang dapat merusak integritas membran plasma spermatozoa. Sebagai senyawa yang stabil, laktosa tidak mudah mengalami perubahan struktur menjadi bentuk ion yang dapat mengubah tekanan osmotik larutan pengencer semen.
Penambahan laktosa sebagai krioprotektan yang non-permeabel dapat menciptakan tekanan osmotik yang menginduksi dehidrasi sel sebelum pembekuan dan interaksinya dengan fosfolipid membran plasma dapat mereorganisasi dan meningkatkan fluiditas membran spermatozoa sehingga menurunkan kerusakan sel akibat pembentukan kristal es intraseluler pada fase transisi dari perubahan temperatur (Molinia et al. 1994; Eiman & Terada 2003).
Laktosa sebagai senyawa krioprotektan golongan karbohidrat memiliki kemampuan menggantikan posisi air pada permukaan membran plasma spermatozoa selama masa transisi melewati zona suhu yang kritis, serta mengubah sifat mekanik pengencer melalui peningkatan viskositas sehingga membantu menstabilkan membran plasma spermatozoa (Viswanath & Shannon 2000; Aisen
et al. 2002). Efek yang menguntungkan dari laktosa dalam bahan pengencer terhadap viabilitas spermatozoa setelah pencairan kembali telah dilaporkan dalam beberapa penelitian (Molinia et al. 1994; Garde et al. 2008).
Gliserol
air untuk keluar dari sel sebelum pembekuan dan pembentukan kristal es yang dapat merusak organel intraseluler (Watson 1995).
Selama proses pembekuan berlangsung, spermatozoa mudah mengalami peroksidasi lipid yang akan merusak sel spermatozoa. Akrosom merupakan bagian sel spermatozoa yang paling peka terhadap kerusakan peroksidasi. Dengan adanya gliserol yang berfungsi sebagai agen protektif akan menjaga keseimbangan konsentrasi fisiologik intra dan ekstraseluler sehingga tudung akrosom tetap utuh. Gliserol akan berinteraksi dengan membran plasma sehingga akan mengurangi kerusakan dari membran plasma dan tudung akrosom pada saat terjadi perubahan struktur selama proses pembekuan dan thawing (Feradis 1999). Namun gliserol memiliki efek toksisitas yaitu memodifikasi struktur membran plasma dan pada konsentrasi yang tinggi dapat menghambat metabolisme energi (Mclaughlin et al. 1992) serta mengubah osmolaritas pengencer (Farstad 1996).
Beberapa penelitian melaporkan bahwa kriopreservasi spermatozoa dari kauda epididimis maupun ejakulat telah berhasil dilakukan dengan konsentrasi gliserol berkisar antara 4-10% (Asher et al. 1999; Soler et al. 2003). Cheng et al. (2004) melaporkan penelitiannya mengenai kriopreservasi spermatozoa dari kauda epididimis dan ejakulat rusa dengan konsentrasi gliserol pada pengencer berkisar antara 5-8% serta menyimpulkan bahwa peranan masing-masing pengencer lebih dikarenakan adanya interaksi gliserol dengan komponen pengencer lain dibanding efek dari konsentrasi gliserol itu sendiri.
Orvus ES Paste
Penggunaan Orvus ES Paste sebagai bahan pengencer sangat bermanfaat dalam kriopreservasi spermatozoa. Komponen aktif Orvus ES Paste adalah
sodium dodecyl sulphate (SDS) yang merupakan cairan deterjen anionik terlarut.
membran sel terutama membran akrosom dan untuk melindungi spermatozoa dari efek toksik dari gliserol selama proses pembekuan (Ponglowhapan & Chatdarong 2008). Penggunaan SDS bersamaan dengan kuning telur berfungsi mengubah struktur tersier lipoprotein kuning telur dalam media ekstraseluler (Pena & Linde 2000).
Penggunaan Orvus ES Paste untuk kriopreservasi spermatozoa kambing dapat meningkatkan motilitas spermatozoa setelah pencairan kembali, meskipun tidak berpengaruh terhadap integritas akrosom (Morton et al. 2010). Sedangkan pada anjing, penambahan Orvus ES Paste pada pengencer Tris dapat meningkatkan viabilitas, motilitas dan integritas akrosom spermatozoa setelah pencairan kembali (Pena & Linde 2000). Pena et al. (2003) melaporkan bahwa Orvus ES Paste kemungkinan berperan dalam mencegah atau mengurangi perubahan pada proses kapasitasi serta menyebabkan pemasukan kalsium dengan konsentrasi tinggi selama kapasitasi pada spermatozoa anjing setelah pencairan kembali.
Antibiotik
Pengendalian pertumbuhan mikroba merupakan langkah penting dalam mencegah penyebaran penyakit reproduksi melalui penggunaan spermatozoa dan untuk meningkatkan efisiensi reproduksi ternak. Antibiotik perlu ditambahkan sebagai komponen bahan pengencer untuk menekan pertumbuhan bakteri gram negatif seperti Escherichia Coli dan Salmonella yang dapat mengakibatkan penurunan motilitas spermatozoa, aglutinasi, peningkatan perubahan akrosom dan penurunan pH ke level asam (5,7-6,4) (Althouse et al. 2004). Selain itu, komponen bahan pengencer seperti kuning telur dapat meningkatkan pertumbuhan mikroba, sehingga penambahan antibiotik pada komposisi bahan pengencer efektif untuk mengontrol pertumbuhan mikrobiologis (Mitchell & Doak 2004).
antibiotik kelompok aminoglycoside yang bekerja dengan cara mematikan bakteri sensitif, dengan menghentikan pemroduksian protein esensial yang dibutuhkan bakteri untuk bertahan hidup. Kedua jenis antibiotik ini sangat efektif dalam mengendalikan pertumbuhan berlebih dari bakteri pada spermatozoa (Althouse 1997). Selain itu, penggunaan Ampicillin sebagai antibiotik dalam komposisi bahan pengencer juga telah banyak digunakan. Ampicillin merupakan salah satu antibiotik semi sintetik golongan penicillin yang cukup murah. Ampicillin
termasuk dalam agen bakterisidal yang mempunyai spektrum aktivitas luas pada bakteri Gram positif dan negatif yang bekerja menghambat sintesis dinding sel (Brander et al. 1991).
Kriopreservasi Spermatozoa dari Kauda Epididimis
Penyelamatan dan pemanfaatan materi genetik baik dari hewan yang mempunyai nilai ekonomis, terancam punah atau populasinya yang semakin sedikit maupun satwa liar dikarenakan kematian hewan secara tak terduga telah banyak mendapat perhatian (Kaabi et al. 2003; Ehling et al. 2006). Salah satu kemungkinan untuk melestarikan plasma nutfah dari hewan jantan yang sudah mati adalah kriopreservasi spermatozoa dari kauda epididimis agar bisa disimpan untuk jangka waktu yang tidak terbatas di bank spermatozoa sebagai cadangan keragaman materi genetik hewan (Roldan & Gomendio 2009).
Spermatozoa yang berasal dari kauda epididimis memiliki motilitas, integritas membran plasma dan morfologi yang tidak berbeda dengan spermatozoa dari ejakulat baik sebelum atau setelah kriopreservasi (Tebet et al. 2006; Hermansson & Axner 2007). Spermatozoa yang berasal dari bagian kauda epididimis memiliki kemampuan membuahi oosit yang sama baiknya dengan spermatozoa dari ejakulat (Hafez & Hafez 2000). Hal ini karena spermatozoa yang terdapat di bagian kauda telah melewati proses pematangan di bagian kaput dan korpus epididimis, serta sudah memiliki kemampuan bergerak (motil) yang sama dengan spermatozoa dari ejakulat (Axner et al. 1998).
yang di kriopreservasi menggunakan bahan pengencer Biladyl (Minitube, Germany) yang ditambah 20% kuning telur. Sampel diencerkan dengan Biladyl fraksi A pada temperatur 30 °C dan di ekuilibrasi pada temperatur 5 °C selama 2 jam, lalu diencerkan kembali dengan Biladyl fraksi B dan di ekuilibrasi kembali pada temperatur 5 °C selama 2 jam, kemudian dikemas pada straw. Proses pembekuan menggunakan Biofreezer yang di program pada 20 °C/menit untuk -100 °C dan 10 °C/menit untuk --100 °C sampai dengan -140 °C, kemudian dimasukkan ke dalam container N2 cair. Thawing dilakukan dengan cara mencelupkan straw semen beku ke dalam water bath pada temperatur 37 °C selama 20 detik. Hasil yang diperoleh menunjukkan bahwa kualitas spermatozoa dari kauda epididimis setelah pembekuan lebih tinggi dibandingkan spermatozoa dari ejakulat.
Tebet et al. (2006) membandingkan pengaruh freezing dan thawing
terhadap kualitas spermatozoa kucing dari kauda epididimis dan ejakulat. Metode kriopreservasi yang digunakan adalah sampel yang diperoleh di sentrifugasi (300 x g selama 10 menit), lalu supernatan dibuang dan pelet spermatozoa yang diperoleh diencerkan dengan bahan pengencer EYT (Ext2A) yang ditambah 7% gliserol, lalu dikemas pada straw dan diekuilibrasi pada temperatur 5 °C selama 60 menit, kemudian diletakkan pada uap nitrogen cair selama 20 menit (kurang lebih 6 cm dari permukaan nitrogen cair) dan kemudian segera dimasukkan dalam kontainer nitrogen cair. Thawing dilakukan dengan cara mencelupkan straw semen beku ke dalam water bath pada temperatur 42 °C selama 15 detik. Hasil yang diperoleh menunjukkan bahwa tidak terdapat perbedaan pada persentase motilitas, integritas membran plasma dan morfologi antara spermatozoa dari kauda epididimis dan ejakulat baik dalam keadaan segar maupun setelah pembekuan.
dasar kuning telur (Botu-Crio TM, Botupharma, Brazil), kemudian dikemas dalam 0,5 ml straw. Untuk selanjutnya straw disimpan dalam refrigerator temperatur 5 °C selama 20 menit, kemudian diletakkan pada uap nitrogen cair selama 20 menit (kurang lebih 6 cm dari permukaan nitrogen cair) dan kemudian segera dimasukkan dalam kontainer nitrogen cair. Thawing dilakukan dengan cara mencelupkan straw semen beku ke dalam water bath pada temperatur 46 °C selama 20 detik. Hasil yang diperoleh menunjukkan bahwa viabilitas dan fertilisasi spermatozoa dari kauda epididimis sama dengan spermatozoa dari ejakulat.
Fertilisasi In Vitro
Fertilisasi in vitro (FIV) dapat digunakan untuk mengetahui kemampuan hidup spermatozoa, memudahkan pengamatan proses kapasitasi, penetrasi oosit dan perkembangan embrio awal, sekaligus meningkatkan pemahaman tentang fisiologi spermatozoa dari spesies tertentu. Selain itu, FIV dapat digunakan untuk mengetahui kemampuan fertilisasi dari spermatozoa pada kondisi in vitro karena dapat mengevaluasi interaksi spermatozoa dengan oosit yang terjadi seperti halnya pada fertilisasi in vivo (Papadopoulos et al. 2005).
Pematangan Oosit secara In Vitro
Proses pematangan oosit merupakan transformasi oosit primer menjadi oosit sekunder matang yang ditandai dengan perubahan inti dari profase pada pembelahan meiosis pertama ke metaphase II (MII) dan disertai dengan perubahan yang kompleks dalam proses fosforilasi protein. Pematangan oosit meliputi pematangan sitoplasma dan inti yang merupakan proses yang sangat penting dalam mendukung keberhasilan fertilisasi dan kompetensinya dalam mendukung perkembangan embrio selanjutnya (Dai et al. 1998).
hormon gonadotrophin yang berguna dalam memfasilitasi pelepasan Cumulus Oocyte Complex (COC) dari dinding folikel, mempercepat terjadinya reaksi akrosom spermatozoa, meningkatkan kemampuan fertilisasi dan perkembangan embrio selanjutnya sehingga dijadikan sebagai kriteria pemilihan oosit yang akan digunakan untuk FIV (Gordon 2003).
Selama pematangan oosit secara in vitro, GVBD terjadi selama 3-12 jam dalam medium kultur. Meskipun terdapat adanya beberapa perbedaan dalam pembentukan PBI, proses pematangan oosit secara in vitro biasanya dilakukan selama 18-24 jam (Gordon 2003). Ward et al. (2002) melaporkan pada sapi bahwa setelah fertilisasi tahapan pematangan inti mempengaruhi perkembangan embrio selanjutnya dan persentase yang tinggi dari pembentukan pronukleus masih dapat diperoleh dengan lamanya waktu pematangan oosit 28 jam sebelum fertilisasi.
Medium dengan komposisi Tissue Culture Medium 199 (TCM-199), serum, yang ditambah dengan hormon gonadotrophin dan steroid (estradiol-17β) serta antibotik telah banyak digunakan dalam rangka memaksimalkan pematangan oosit (Goto & Iritani 1992). Penambahan serum ke dalam medium maturasi dapat meningkatkan pematangan inti dan pembentukan pronukleus. Medium maturasi tanpa penambahan serum hanya mampu mendukung terjadinya pematangan inti sedangkan pematangan sitoplasma tidak sepenuhnya teraktivasi (Setiadi 1999). Kombinasi penambahan hormon gonadotrophin dan steroid dalam medium maturasi dapat menyebabkan peningkatan persentase pematangan oosit (Accardo
et al. 2004). Sedangkan antibiotik yang ideal untuk kultur oosit harus memiliki aktivitas antibakteri spektrum luas, terbebas dari toksisitas serta berfungsi mencegah pertumbuhan dan proliferasi mikroorganisme selama periode kultur (Gordon 2003).
Fertilisasi In Vitro
menghasilkan penggabungan dua gamet, restorasi jumlah kromosom kromatik dan mulainya perkembangan suatu individu baru (Gordon 2003).
Prosedur fertilisasi in vitro (FIV) dilakukan pada medium yang diformulasikan menyerupai kondisi yang sebenarnya dari uterus untuk proses kapasitasi spermatozoa dan oviduk untuk pematangan oosit dan akuisisi kompetensi perkembangannya untuk fertilisasi (Elder & Dale 2003). Fertilisasi in vitro hanya dapat terjadi setelah didahului oleh proses kapasitasi spermatozoa. Penetrasi spermatozoa ke dalam oosit akan menyebabkan oosit kembali mengalami pembelahan meiosis II yang ditandai dengan terbentuknya badan kutub II. Selanjutnya kromosom oosit akan membentuk pronukleus betina, sedangkan kromatin yang terdapat pada kepala spermatozoa akan mengalami dekondensasi dan kemudian membentuk pronukleus jantan (Cleine 1996). Fertilisasi yang normal ditandai dengan terbentuknya dua pronukleus, dua badan kutub, bentuk sel telur yang teratur dengan zona pelusida utuh dan sitoplasma jelas terlihat (Elder & Dale 2003).
Selama proses fertilisasi, spermatozoa mengalami perubahan fisiologis dan struktural termasuk perubahan motilitas, kapasitasi, reaksi akrosom, penetrasi serta kemampuan mengikat dan fusi dengan oosit (Elder & Dale 2003). Kapasitasi dan fusi dengan oosit melibatkan banyak perubahan morfologi, metabolisme dan fungsi spermatozoa kaitannya dengan kemampuan spermatozoa baik motilitas dan integritas membran untuk menembus zona bebas dari oosit sebagai faktor penentu dalam fertilisasi (Martinez et al. 1993).
melakukan fusi dengan membran oosit sehingga mendorong aktivasi oosit. Kegagalan fertilisasi terjadi karena rendahnya penetrasi spermatozoa untuk menembus zona pelusida (Plachot 2000).
Meskipun metode FIV memerlukan pengembangan kondisi medium kultur untuk mempertahankan motilitas dan viabilitas spermatozoa serta dukungan interaksi antar gamet, tetapi penggunaan metode ini sangatlah penting dengan keterbatasan jumlah straw yang dihasilkan dalam setiap koleksi spermatozoa yang berasal dari kauda epididimis. Dengan metode FIV, di dalam satu straw semen beku memiliki kemampuan untuk membuahi ratusan oosit sehingga meningkatkan kemungkinan penyebaran materi genetik (Blash et al. 2000). Konsentrasi spermatozoa yang digunakan dalam metode FIV berkisar antara 0,5-5 x 106 spermatozoa/ml (Gordon 2003).
Aplikasi Spermatozoa dari Kauda Epididimis untuk FIV
Pemanfaatan spermatozoa dari kauda epididimis dalam aplikasi teknologi FIV telah banyak dilaporkan dan menghasilkan keturunan pada beberapa spesies. Graff et al. (1996) melaporkan kebuntingan diperoleh melalui FIV menggunakan spermatozoa dari kauda epididimis sapi tanpa proses kapasitasi. Herrick et al. (2004) melaporkan adanya penetrasi zona pelusida pada oosit setelah FIV menggunakan spermatozoa dari kauda epididimis kerbau yang diekstraksi setelah 4 jam kematian hewan dan dibekukan. Shaw et al. (1995) melaporkan tingkat pembelahan pada oosit kerbau setelah FIV menggunakan spermatozoa dari kauda epididimis yang disimpan pada suhu 4 °C selama 24 jam.
Jiang et al. (1991) melaporkan kelahiran anak babi melalui aplikasi teknologi transfer embrio menggunakan embrio yang diproduksi secara in vitro
pengaruh musim dan efisiensi dari status ovarium untuk menghasilkan embrio. Blash et al. (2000) melaporkan bahwa terjadi tingkat pembelahan dan perkembangan blastosis menggunakan spermatozoa dari epididimis dan ejakulat kambing yang dibekukan.
Kikuchi et al. (1998) mempelajari kriopreservasi dan kemampuan fertilisasi in vitro spermatozoa dari kauda epididimis babi yang disimpan pada temperatur 4 °C, diperoleh bahwa kriopreservasi spermatozoa dari kauda epididimis yang disimpan pada temperatur 4 °C selama 1-2 hari dapat digunakan untuk konservasi gamet jantan ketika spermatozoa dari kauda epididimis tidak dapat segera di kriopreservasi. Selanjutnya Kikuchi et al. (1999) mempelajari kemampuan kriopreservasi spermatozoa dari kauda epididimis babi yang disimpan pada temperatur 4 °C selama 1 hari melalui aplikasi teknologi inseminasi buatan dan fertilisasi in vitro, diperoleh bahwa dari 6 ekor induk yang di inseminasi, 3 ekor induk menunjukkan kebuntingan dan salah satu diantaranya melahirkan 2 ekor anak babi dalam kondisi normal. Sedangkan dari oosit matang yang sudah di fertilisasi in vitro kemudian di transferkan kepada 3 ekor induk resipien (200 oosit per resipien) menunjukkan 1 ekor induk terdeteksi bunting dan melahirkan 5 ekor anak babi dalam kondisi normal.
Kelahiran anak tikus melalui FIV juga telah dilaporkan menggunakan spermatozoa dari kauda epididimis dalam bentuk segar maupun yang dibekukan (Songsasen et al. 1997). Lacham & Trounson (1994) menunjukkan bahwa kemampuan fertilisasi in vitro spermatozoa dari epididimis tikus menurun secara signifikan dari caput, corpus dan kauda epididimis. Dilaporkan pula bahwa spermatozoa dari kauda epididimis tikus yang disimpan pada suhu kamar selama 15 dan 24 jam setelah kematian hewan dapat membuahi oosit secara in vitro
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Fertilisasi In Vitro, Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian berlangsung selama 4 bulan yang dimulai sejak Mei – Agustus 2011.
Metode Penelitian
Tahap I. Karakteristik Spermatozoa Domba Sebelum dan Setelah Pembekuan
Testis dengan epididimis domba untuk mendapatkan spermatozoa dari
kauda epididimis diperoleh dari tempat pemotongan domba yang berlokasi di
sekitar Kabupaten Bogor yaitu domba Lokal jantan berumur antara 1-2 tahun yang
diduga berdasarkan jumlah gigi seri tetap sebanyak 1 pasang, dengan bobot badan
berkisar antara 25-30 Kg. Spermatozoa dari ejakulat diperoleh dari domba Lokal
jantan berjumlah 5 ekor yang berumur antara 1-2 tahun dengan bobot badan
berkisar antara 25-30 Kg dan dipelihara secara intensif dalam kandang individual
yang berada di Unit Rehabilitasi Reproduksi, Departemen Klinik Reproduksi dan
Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pakan hijauan
sebagai sumber makanan pokok bagi domba diambil dari lapangan dalam bentuk
potong angkut, sedangkan air minum diberikan secara ad libitum. Prosedur kerja
pengenceran dan kriopreservasi spermatozoa secara garis besar tercantum pada
Gambar 1. Prosedur kerja pengenceran dan pembekuan spermatozoa
Persiapan Bahan Pengencer
Komposisi bahan pengencer yang digunakan dalam penelitian ini adalah medium Niwa dan Sasaki Freezing (NSF) yang digunakan oleh Kikuchi et al. (1999) untuk kriopreservasi spermatozoa dari kauda epididimis. Pada proses kriopreservasi, penambahan bahan pengencer dilakukan dengan metode two-step freezing. Komposisi medium freezing I (NSF I) terdiri dari 20% (v/v) kuning telur, 8,8% (w/v) laktosa (Merck, Germany) dan 200 μg/ml ampicillin (PT. Meiji Indonesian, Batch no. PAL. 09654), sedangkan medium freezing II (NSF II) terdiri dari 92,52% (v/v) medium freezing I, 1,48% (v/v) Orvus ES Paste dan 6% (v/v) gliserol (Merck, Germany).
Koleksi Spermatozoa dari Kauda Epididimis
Testis dan epididimis dibersihkan dengan larutan 0,9% NaCl ditambah dengan 0,06 g/l penicillin (Sigma-Aldrich. Inc, P-4687) dan 0,1 g/l streptomycin
dari testis dan jaringan ikat lainnya. Untuk menghindari kontaminasi darah, pembuluh darah di potong dan dikeluarkan. Koleksi spermatozoa dilakukan dengan membuat beberapa sayatan pada kauda epididimis menggunakan pisau
scalpel dan meletakkannya pada petri dish yang berisi medium NSF I selama 3 menit, lalu memasukkannya ke dalam tube 15 ml untuk proses kriopreservasi.
Koleksi Spermatozoa dari Ejakulat
Penampungan spermatozoa dilakukan dengan menggunakan vagina buatan dengan inner liner pada bagian dalamnya untuk selanjutnya diberi air bertemperatur 40-42 °C dan udara melalui katup, diberi pelumas dengan kedalaman tidak lebih dari 3 cm sehingga vagina buatan menyerupai kondisi sebenarnya, kemudian pada salah satu bagian ujung vagina buatan dipasang tabung penampung spermatozoa. Segera setelah koleksi, spermatozoa dibawa ke laboratorium untuk proses kriopreservasi.
Kriopreservasi Spermatozoa
dalam water bath pada temperatur 37 °C selama 30 detik, untuk selanjutnya dievaluasi karakteristik spermatozoa setelah thawing (post-thawing).
Parameter Evaluasi Karakteristik Spermatozoa
Sampel spermatozoa dari kauda epididimis dan ejakulat domba dievaluasi karakteristiknya baik sebelum pembekuan, setelah ekuilibrasi I dan II, maupun setelah pembekuan yang meliputi motilitas progresif spermatozoa, integritas fungsional dari membran plasma spermatozoa dengan Hypoosmotic Swelling Test
(HOS-Test), serta viabilitas dan abnormalitas spermatozoa yang ditentukan dengan pewarnaan eosin-negrosin.
Penilaian motilitas spermatozoa
Penilaian persentase motilitas spermatozoa ditentukan dengan cara menempatkan satu tetes spermatozoa yang telah diencerkan dengan larutan 0,9%
NaCl pada gelas objek dan ditutup dengan gelas penutup. Pengamatan terhadap
spermatozoa yang bergerak progresif dilakukan secara subjektif pada enam lapang
pandang yang berbeda di bawah mikroskop dengan pembesaran 400x. Penilaian yang diberikan mulai nol persen (tidak ada spermatozoa yang bergerak ke depan) sampai 100 persen (semua spermatozoa bergerak ke depan).
Penilaian integritas membran spermatozoa
Penilaian persentase integritas membran spermatozoa diperiksa menggunakan Hypoosmotic Swelling Test (HOS-Test) dengan komposisi larutan HOS untuk 10 ml air mili-Q ditambah dengan 0,135 g fruktosa (Merck, Germany) dan 0,0735 g trisodium citrate 2H2O. Sampel semen sebanyak 20 µl diencerkan dengan 80 µl larutan HOS dan dibiarkan selama 10 menit pada suhu kamar. Untuk keperluan pengamatan, diteteskan 10 μl sampel semen pada gelas objek yang
ditutup dengan gelas penutup dan evaluasi dilakukan di bawah mikroskop dengan
Penilaian viabilitas dan abnormalitas spermatozoa
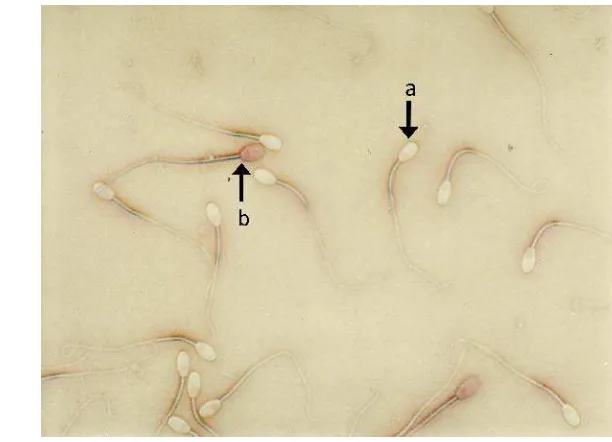
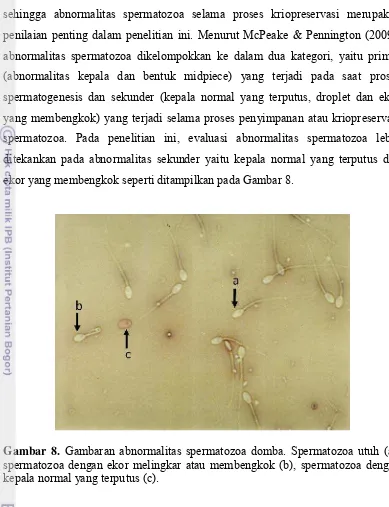
Penentuan persentase viabilitas dari spermatozoa dilakukan dengan menggunakan metode pewarnaan eosin-negrosin dengan komposisi pewarna eosin-negrosin untuk 300 ml air mili-Q terdiri dari 3,3 g eosin yellow (Wako Pure chemical Industries, 058-00062), 20 g nigrosin (Sigma-Aldrich, 198285) dan 1,5 g sodium sitrat, menurut prosedur Barth & Oko (1989). Sebanyak 10 μl sampel semen dan 40 μl eosin-negrosin dicampur di atas gelas obyek kemudian dibuat preparat ulas dan dikeringkan menggunakan bunsen selama 15 detik sebelum dilakukan pengamatan di bawah mikroskop dengan pembesaran 400x. Spermatozoa yang dikategorikan hidup adalah spermatozoa yang tidak menyerap zat warna sehingga pada bagian kepala spermatozoa tidak terwarnai (putih), sedangkan spermatozoa yang dikategorikan mati adalah spermatozoa yang menyerap zat warna sehingga pada bagian kepalanya akan berwarna merah. Persentase viabilitas spermatozoa ditentukan berdasarkan perbandingan antara jumlah spermatozoa hidup dengan jumlah total spermatozoa. Jumlah total spermatozoa yang dihitung adalah 200 spermatozoa. Sedangkan pengamatan abnormalitas menurut McPeake & Pennington (2009) yaitu terhadap abnormalitas spermatozoa sekunder (kepala normal yang terputus dan ekor yang membengkok) yang terjadi selama proses penyimpanan atau kriopreservasi spermatozoa. Pengamatan di bawah mikroskop dengan pembesaran 400x dilakukan pada 200 spermatozoa.
Tahap II. Kemampuan Fertilisasi In Vitro Spermatozoa Domba Setelah Pembekuan
Gambar 2. Prosedur kerja fertilisasi in vitro
Koleksi dan Maturasi Oosit Domba
Ovarium domba dikumpulkan dari rumah potong hewan dan dimasukkan dalam thermos berisi larutan 0,9 % NaCl ditambah 0,06 g/l penicillin (Sigma-Aldrich. Inc, P-4687) dan 0,1 g/l streptomycin (Sigma-Aldrich. Inc, S-9137) pada suhu 36-37 °C, lalu dibawa ke laboratorium dalam wadah polystyrene. Setelah sampai di laboratorium, ovarium dicacah menggunakan pisau scalpel untuk melepaskan oosit dari folikel dalam kultur dish yang berisi medium Phosphate Buffered Saline (PBS) ditambah 0,3% Bovine Serum Albumin (BSA) (Sigma-Aldrich. Inc, A-7030), 0,06 g/l penicillin (Sigma-Aldrich. Inc, P-4687) dan 0,1 g/l
yang homogen dan komponen dari korona radiata yang lengkap dengan dikelilingi oleh lima lapisan atau lebih sel kumulus) dan grade B (sel-sel kumulus seragam, sitoplasma yang homogen dan komponen dari korona radiata yang lengkap tetapi dikelilingi tidak lebih dari lima lapisan sel kumulus). Oosit hasil seleksi dicuci dalam medium maturasi sebanyak dua kali untuk kemudian dimaturasi dalam
Tissue Culture Medium (TCM) 199 (Sigma, USA) ditambahkan 5% Fetal Bovine Serum (FBS), 2 IU/ml Pregnant Mare Serum Gonadotrophin (PMSG) (Intergonan, Intervet Deutschland GmbH), 2 IU/ml human Chorionic Gonadotrophin (hCG) (Chorulon, intervet international B.V. Boxmeer-Holland), 0,06 g/l penicillin
(Sigma-Aldrich. Inc, P-4687) dan 0,1 g/l streptomycin (Sigma-Aldrich. Inc, S-9137). Oosit dimasukkan ke dalam petri dish (Nunclon, Denmark) dalam bentuk drop masing-masing 100 μl untuk 10-15 oosit dan ditutup dengan mineral oil (Sigma-Aldrich. Inc, M-8410) kemudian dimaturasi dalam inkubator 5% CO2 temperatur 38,5 °C selama 28 jam menurut prosedur Ward et al. (2002).
Fertilisasi In Vitro
Evaluasi Kemampuan Fertilisasi In Vitro
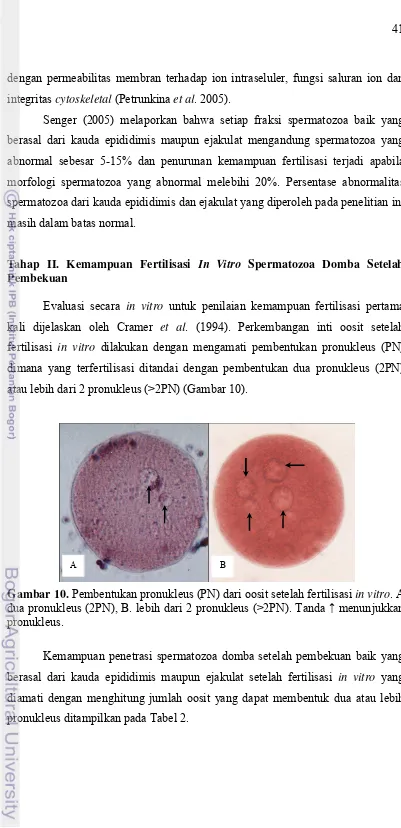
Setelah oosit di inkubasi dengan spermatozoa, pembentukan dan jumlah pronukleus (PN) dievaluasi dengan cara melepaskan sel-sel kumulus yang mengelilingi oosit dengan bantuan 0,25 % enzim hyaluronidase dan dilanjutkan dengan cara dipipet berulang-ulang. Selanjutnya oosit diletakkan pada drop 0,7 % KCl di atas gelas obyek, lalu difiksir dengan cara ditutup dengan cover glass yang memiliki bantalan paraffin dan vaselin (1:9) di keempat sudutnya. Preparat tersebut dimasukkan dalam larutan fiksasi yang mengandung asam asetat dan
ethanol (1:3) selama 3 hari, lalu diwarnai dengan pewarna 2 % aceto-orcein
selama ±10 menit, kemudian zat pewarna dibersihkan dengan 25 % asam asetat dan keempat sisi cover glass diberi larutan kuteks bening untuk selanjutnya dilakukan pengamatan morfologi dengan mikroskop fase kontras (Olympus IX 70, Japan).
Penentuan tingkat kemampuan fertilisasi in vitro spermatozoa domba setelah thawing dilakukan berdasarkan pembentukan dan jumlah pronukleus (PN). Oosit yang telah mengalami fertilisasi ditandai dengan terbentuknya dua pronukleus (jantan dan betina, 2PN) atau lebih (>2PN) dalam sitoplasma oosit. Tingkat fertilisasi merupakan perbandingan antara jumlah oosit yang dibuahi (membentuk dua atau lebih pronukleus) dengan jumlah keseluruhan oosit yang difertilisasi.
Analisis Data
HASIL DAN PEMBAHASAN
Tahap I. Karakteristik Spermatozoa Domba Sebelum dan Setelah Pembekuan
Karakteristik Spermatozoa Domba Sebelum Pembekuan
Karakteristik spermatozoa domba dari kauda epididimis dan ejakulat sebelum pembekuan untuk penelitian ini ditampilkan pada Tabel 1.
Tabel 1. Karakteristik spermatozoa domba dari kauda epididimis dan ejakulat sebelum pembekuan
Kauda epididimis 5 74,00±4,18 88,06±5,79 94,05±2,79 1,62±0,59
Ejakulat 5 78,00±2,74 84,07±2,18 91,19±0,93 1,77±0,50
Persamaan karakteristik spermatozoa pada penelitian ini berkaitan dengan keberadaan spermatozoa sebelum diejakulasikan berada di kauda epididimis yang berfungsi sebagai tempat penyimpanan dan pematangan spermatozoa, mempertahankan metabolisme dan mencegah terjadinya aktivasi dini dari spermatozoa sebelum diejakulasikan (Sostaric et al. 2008). Kondisi lingkungan di kauda epididimis yang spesifik memungkinkan spermatozoa bertahan hidup selama beberapa minggu sampai diejakulasikan (Moore 1995). Selain itu, persamaan karakteristik spermatozoa yang berasal dari kauda epididimis dengan ejakulat dikarenakan kesamaan dalam aktivitas translokasi dan distribusi fosfolipid yang merupakan sifat mendasar bagi membran plasma spermatozoa dalam rangka persiapan untuk proses fertilisasi (Muller et al. 1994). Menurut Cooper (1999), selama pematangan spermatozoa di kauda epididimis, banyak glikoprotein dan peptida yang dikeluarkan oleh kelenjar kelamin pelengkap menempel pada permukaan spermatozoa dengan berbagai afinitas dan akan memberikan pengaruh yang sama pada fungsi membran seperti halnya spermatozoa dari ejakulat.
Berbeda halnya dengan yang dilaporkan Garner et al. (2000) bahwa kehadiran immobilin pada kaudaepididimis dapat meningkatkan viskositas cairan epididimis dan mengurangi motilitas spermatozoa. Immobilin merupakan suatu protein yang disekresikan oleh sel-sel utama antara daerah distal dan kaput epididimis pada hewan yang telah mencapai dewasa kelamin dan berfungsi membuat spermatozoa berkurang motilitasnya dengan menciptakan kondisi lingkungan epididimis yang visko elastis ketika spermatozoa berada pada kauda epididimis (Hermo et al. 1994).
Karakteristik Spermatozoa Domba selama Proses Kriopreservasi
Persentase motilitas, viabilitas dan integritas membran spermatozoa baik dari kauda epididimis maupun ejakulat sebelum pembekuan, setelah ekuilibrasi I dan II, maupun setelah pembekuan mengalami penurunan (Gambar 3, 5 dan 7), berbeda halnya dengan persentase abnormalitas yang mengalami peningkatan (Gambar 9). Hasil ini menunjukkan bahwa baik spermatozoa dari kauda epididimis dan ejakulat tidak rentan terhadap kejutan dingin akibat penurunan suhu selama proses kriopreservasi. Spermatozoa mengalami perubahan seluler, biokimia dan osmotik selama pematangan di epididimis dan setelah penambahan plasma semen saat ejakulasi. Perubahan ini termasuk penurunan dramatis dalam komposisi membran lipid yang kemudian dapat mempengaruhi karakteristik biologi spermatozoa saat kriopreservasi, permeabilitas krioprotektan dan perubahan fase membran plasma selama pendinginan (Yeung et al. 2006). Kriopreservasi dapat mengakibatkan kerusakan fungsional membran mencakup peningkatan fluiditas membran yang diperburuk oleh kejutan osmotik pada membran yang terjadi ketika sel mengalami dehidrasi ekstrim selama proses pendinginan (Cross 1998). Proses kriopreservasi menyebabkan berkurangnya integritas akrosom, kerusakan fungsi spermatozoa dan perubahan dalam fluiditas membran, agregasi fosfolipid dan protein, yang berkaitan dengan penurunan aktivitas enzim, motilitas, viabilitas dan kemampuan fertilisasi spermatozoa (Watson 1995; Thundathil et al. 1999). Lengwinat & Blottner (1994) melaporkan penurunan motilitas dan integritas akrosom setelah thawing. Proses cooling pada kriopreservasi spermatozoa dapat menekan aktivitas metabolisme sel spermatozoa sehingga menyebabkan konsumsi energi secara signifikan berkurang dan sensitivitas kejutan dingin ditandai oleh hilangnya permeabilitas dan integritas membran plasma spermatozoa secara ireversibel yang mengarah kepada gangguan dan kematian spermatozoa (Robertson et al. 1990).
kristal es. Pembentukan kristal es selama proses kriopreservasi sel spermatozoa menyebabkan terjadinya penumpukan elektrolit di dalam sel yang mengakibatkan terjadi kerusakan sel secara mekanik. Elektrolit yang menumpuk akan merusak dinding sel spermatozoa, sehingga pada waktu thawing permeabilitas membran plasma utuh akan menurun dan spermatozoa mengalami kematian. Pembentukan kristal es kemungkinan berkaitan dengan perubahan tekanan osmotik dalam fraksi yang tidak mengalami pembekuan (Watson 2000).
Selain itu, pada saat koleksi dan pengolahan spermatozoa sebelum dikemas di dalam straw, terjadi kontak antara spermatozoa dan udara luar yang mengandung oksigen. Hal ini mengakibatkan meningkatnya aktivitas metabolisme oksidatif yang juga berarti meningkatnya konsentrasi radikal bebas sebagai salah satu produk metabolisme. Radikal bebas sangat berbahaya bagi kelangsungan hidup spermatozoa, karena radikal bebas memiliki sifat yang sangat reaktif untuk memperoleh elektron melalui reaksi peroksidasi lipid. Radikal bebas mengambil elektron dari asam lemak tak jenuh fosfolipid membran plasma sel, dapat mengakibatkan reaksi rantai peroksidasi lipid yang berlangsung terus menerus (autokatalitik) hingga akhirnya merusak seluruh membran plasma sel spermatozoa (Holt 2000).
Hasil yang diperoleh pada penelitian ini menunjukkan persentase motilitas, integritas membran dan viabilitas spermatozoa dari kauda epididimis dan ejakulat setelah thawing masih cukup tinggi dan dapat dipertahankan sampai tahap ekuilibrasi 2 meskipun mengalami penurunan setelah pembekuan dan thawing. Penggunaan medium NSF I dan NSF II dengan kandungan kuning telur dan Orvus ES Paste diduga dapat melindungi spermatozoa terhadap kejutan dingin. Di dalam kuning telur terdapat lesitin yang dapat mempertahankan motilitas spermatozoa dari kejutan dingin karena kandungan phosphatidylcholine (Kikuchi et al. 1998). Kandungan phovitin, ceruloplasmin, ovalbumin dan ovotransferrin yang terdapat pada kuning telur dapat menghilangkan ion logam bebas yang dapat mengkatalisis produksi Reactive Oxygen Species (ROS). Begitu pula protein yang mirip dengan
Penggunaan Orvus ES Paste bersamaan dengan kuning telur berfungsi mengubah struktur tersier lipoprotein kuning telur dalam media ekstraseluler yang berperan untuk melindungi membran spermatozoa (Pena & Linde 2000). Morton
et al. (2010) melaporkan bahwa penggunaan Orvus ES Paste dapat meningkatkan persentase motilitas spermatozoa setelah thawing. Penggunaan Orvus ES Paste pada penelitian ini dengan komponen aktif berupa sodium dodecyl sulphate (SDS) diduga dapat meningkatkan integritas membran spermatozoa setelah thawing. Penggunaan Orvus ES Paste dapat melindungi membran spermatozoa dalam menjalankan fungsinya untuk mengatur transportasi Ca2+ ektrasellular kedalam sel dan mengurangi perubahan pada proses kapasitasi serta menyebabkan pemasukan kalsium dengan konsentrasi tinggi setelah thawing (Pena et al. 2003). Storm et al. (2000) melaporkan bahwa penggunan Orvus ES Paste dapat memperpanjang daya hidup spermatozoa, meningkatkan kemampuan spermatozoa dalam mengikat zona dan menstabilkan mekanisme membran spermatozoa didalam mencegah proses kapasitasi dini. Selain itu, Pena & Linde (2000) melaporkan bahwa komponen aktif pada Orvus ES Paste yaitu sodium dodecyl sulphate (SDS) dalam bahan pengencer dapat meningkatkan viabilitas dan fluiditas membran plasma spermatozoa setelah thawing. Efisiensi penggunaan Orvus ES paste dalam meningkatkan viabilitas spermatozoa dikarenakan efek stabilitas dari membran lipid spermatozoa untuk meminimalkan proses kapasitasi dini dan kerusakan spermatozoa sebagai akibat dari kriopreservasi (Watson 1995).
Motilitas Spermatozoa Domba selama Proses Kriopreservasi
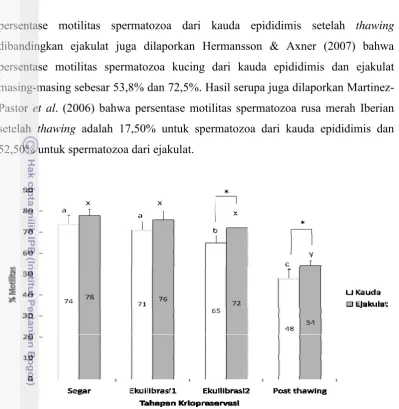
Motilitas spermatozoa telah lama dianggap sebagai kriteria utama dalam penilaian kualitas spermatozoa dan kemampuan fertilisasi dari hewan jantan. Persentase motilitas spermatozoa dari kauda epididimis dan ejakulat selama proses kriopreservasi ditampilkan pada Gambar 3.
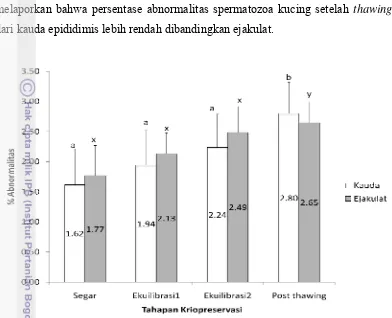
Hasil penelitian menunjukkan bahwa terdapat perbedaan yang nyata (P<0,05) pada persentase motilitas spermatozoa dari kauda epididimis dan ejakulat saat ekuilibrasi ke-2 (65,00±3,54% vs 72,00±4,47%) dan setelah thawing
persentase motilitas spermatozoa dari kauda epididimis setelah thawing
dibandingkan ejakulat juga dilaporkan Hermansson & Axner (2007) bahwa persentase motilitas spermatozoa kucing dari kauda epididimis dan ejakulat masing-masing sebesar 53,8% dan 72,5%. Hasil serupa juga dilaporkan Martinez-Pastor et al. (2006) bahwa persentase motilitas spermatozoa rusa merah Iberian setelah thawing adalah 17,50% untuk spermatozoa dari kauda epididimis dan 52,50% untuk spermatozoa dari ejakulat.
Gambar 3. Persentase motilitas spermatozoa domba dari kauda epididimis dan ejakulat selama proses kriopreservasi. Dalam setiap tahapan kriopreservasi, bar dengan huruf yang berbeda (a,b,c; x,y) menunjukkan perbedaan yang nyata untuk spermatozoa dari kauda epididimis dan ejakulat (P<0,05). (*) menunjukkan perbedaan yang nyata (P<0,05) pada persentase motilitas diantara sumber spermatozoa.
Persentase motilitas spermatozoa dari ejakulat yang lebih tinggi dikarenakan keberadaan plasma semen yang memberikan pengaruh terhadap motilitas spermatozoa (Goovaerts et al. 2006). Motilitas spermatozoa terjadi karena adanya protein khusus yang disebut dynein di mikrofibril eksternal pada ekor spermatozoa. Protein ini berfungsi sebagai enzim ATP-ase untuk mengkonversi adenosin triphosphate (ATP) menjadi adenosin monophosphate
(Rizal et al. 2003). Komponen dari plasma semen berupa fruktosa, sorbitol, asam sitrat, inositol, gliseril fosforil kolin (GPC), ergothionine, natrium, kalium, kalsium, magnesium, dan klorida merupakan zat penting untuk membran dan sebagai sumber energi untuk menghasilkan ATP (Hafez & Hafez 2000).
Mackenna (1995) melaporkan bahwa persentase motilitas progresif dari spermatozoa ejakulat berhubungan erat dengan aktivitas mitokondria terutama dalam hal pengaturan energi untuk motilitas spermatozoa sebagai salah satu penentu utama kemampuan fertilisasi. Respirasi spermatozoa dari ejakulat lebih cepat dibandingkan spermatozoa dari kauda epididimis, sehingga mendorong aktivitas mitokondria yang lebih cepat dalam pemanfaatan energi yang dipakai (Cooper 2005). Adenosine triphosphate (ATP) dari mitokondria memberikan kontribusi untuk motilitas spermatozoa tetapi tidak selalu menjadi penentu utama dalam hal viabilitas spermatozoa (Hung et al. 2008).
Hasil penelitian ini berbeda dengan yang dilaporkan oleh Tebet et al. (2006) bahwa tidak ada perbedaan yang signifikan pada persentase motilitas spermatozoa kucing setelah thawing baik yang berasal dari kauda epididimis dengan ejakulat. Hasil serupa juga dilaporkan oleh Monteiro et al. (2011) bahwa persentase motilitas spermatozoa kuda setelah thawing adalah 36,2% untuk spermatozoa dari kauda epididimis dan 33% untuk spermatozoa dari ejakulat. Berbeda halnya dengan yang dilaporkan Alvarez et al. (2009) dengan penggunaan Biladyl (Minitube, Tiefenbach, Germany) sebagai bahan pengencer untuk kriopreservasi spermatozoa domba Black Manchega, dimana persentase motilitas spermatozoa dari kauda epididimis lebih tinggi dibandingkan dari ejakulat yang dikoleksi dengan elektroejakulator (57,50% vs 36,67%).
Integritas Membran Spermatozoa Domba selama Proses Kriopreservasi
dengan spermatozoa yang melingkar (Gambar 4.a). Hal ini tidak muncul pada spermatozoa yang membran plasmanya tidak utuh ditandai dengan ekor lurus (Gambar 4.b). Spermatozoa dengan ekor melingkar ketika berada pada kondisi hipoosmotik menandakan bahwa transportasi air melintasi membran berjalan normal dan membran memiliki fungsi yang normal (Tartaglion & Ritta 2004). Spermatozoa dengan ekor lurus menunjukkan efek perubahan suhu atau kejutan osmotik dan kerusakan midpiece spermatozoa yang disebabkan pemaparan kejutan dingin atau lingkungan yang hipotonik (Bissett & Bernard 2005).
Gambar 4. Gambaran integritas membran spermatozoa domba. Spermatozoa dengan membran plasma utuh (ekor melingkar, a) dan spermatozoa dengan membran plasma tidak utuh (ekor lurus, b).
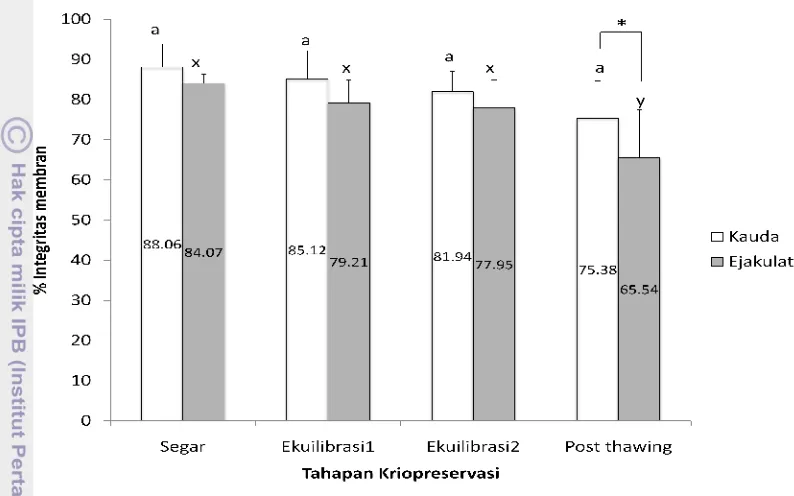
spermatozoa kuda setelah thawing dari kauda epididimis tidak menunjukkan perbedaan dengan spermatozoa dari ejakulat.
Gambar 5. Persentase integritas membran spermatozoa domba dari kauda epididimis dan ejakulat selama proses kriopreservasi. Dalam setiap tahapan kriopreservasi, bar dengan huruf yang berbeda (a,b; x,y) menunjukkan perbedaan yang nyata untuk spermatozoa dari kauda epididimis dan ejakulat (P<0,05). (*) menunjukkan perbedaan yang nyata (P<0,05) pada persentase integritas membran diantara sumber spermatozoa.
Persentase integritas membran spermatozoa setelah thawing dari kauda epididimis lebih tinggi dibandingkan ejakulat disebabkan karena spermatozoa yang berasal dari kauda epididimis belum terkena sekresi kompleks dari kelenjar kelamin pelengkap, dimana sekresi ini dapat mengubah sensitivitas pada saat pendinginan dan resistensi pembekuan seperti pada spermatozoa dari ejakulat (Yu
et al. 2002). Spermatozoa yang didinginkan pada temperatur di bawah titik beku air akan mengalami kerusakan membran plasma secara ireversibel. Kandungan kolesterol yang tinggi selama pematangan spermatozoa di kauda epididimis dapat menstabilkan membran spermatozoa dari efek kejutan dingin selama proses
dan respon dari membran spermatozoa terhadap perlakuan yang berbeda (White 1993). Membran plasma spermatozoa mengandung asam lemak tak jenuh yang rentan terhadap kerusakan peroksidasi dikarenakan perubahan pH yang dihasilkan dari reactive oxygen species selama inkubasi aerobik sehingga mengakibatkan hilangnya integritas membran dan akhirnya berdampak pula pada penurunan fertilitas (Yaniz et al. 2008).
Plummer & Watson (1985) melaporkan bahwa kejutan dingin berakibat pada berkurangnya integritas akrosom dan membran plasma pada spermatozoa domba dari ejakulat. Telah dilaporkan juga oleh Rath & Niemann (1997) bahwa spermatozoa dari kauda epididimis babi lebih resisten terhadap kejutan dingin dibandingkan dari ejakulat. Menariknya, Gilmore et al. (1998) meneliti sensitivitas kejutan dingin spermatozoa dari beberapa spesies satwa liar dan juga menemukan bahwa spermatozoa dari babi, impala dan gajah yang diperoleh dengan teknik elektroejakulator lebih sensitif terhadap proses cooling
dibandingkan spermatozoa dari kauda epididimis.
Viabilitas Spermatozoa Domba selama Proses Kriopreservasi
Gambar 6. Gambaran viabilitas spermatozoa domba. Spermatozoa yang ditandai dengan kepala berwarna putih menunjukkan spermatozoa hidup (a) dan kepala berwarna merah menunjukkan spermatozoa mati (b).
Persentase viabilitas spermatozoa domba dari kauda epididimis dan ejakulat selama proses kriopreservasi ditampilkan pada Gambar 7. Hasil yang diperoleh pada penelitian ini menunjukkan bahwa tidak adanya perbedaan yang nyata (P>0,05) pada viabilitas spermatozoa baik yang berasal dari kauda epididimis maupun ejakulat selama proses kriopreservasi. Hasil yang diperoleh pada penelitian sama dengan yang dilaporkan Yulnawati et al. (2008) yang membandingkan kualitas spermatozoa dari kauda epididimis maupun ejakulat pada kerbau belang dengan penggunaan bahan pengencer Andromed untuk kriopreservasi, dimana persentase viabilitas spermatozoa setelah thawing dari kauda epididimis tidak menunjukkan perbedaan dengan spermatozoa dari ejakulat. Persamaan persentase viabilitas spermatozoa dari kauda epididimis dengan ejakulat dikarenakan pada sekresi cairan kauda epididimis dan plasma semen terdapat nucleobindin dan protein lipocalin-type prostaglandin D synthase
(PGDS) yang menempel pada akrosom spermatozoa dari kauda epididimis dan ejakulat dan berperan sebagai protein multifungsi dalam mengikat kalsium, berpartisipasi dalam aktivasi sinyal intraselular, interaksi sel-sel, apoptosis, serta dapat mempengaruhi viabilitas spermatozoa tidak hanya ketika berada di kauda epididimis tetapi juga setelah diejakulasikan (Moura et al. 2007).
Hasil penelitian ini berbeda dengan yang dilaporkan Martinez-Pastor et al. (2006) dimana untuk kriopreservasi spermatozoa rusa merah Iberian menggunakan bahan dasar pengencer Tes-Tris buffering system dengan 15% kuning telur diperoleh persentase viabilitas spermatozoa setelah thawing dari kauda epididimis lebih tinggi dibandingkan ejakulat. Begitu pula dengan yang dilaporkan Alvarez et al. (2009) dengan penggunaan bahan pengencer Biladyl (Minitube, Tiefenbach, Germany) dengan 20% kuning telur untuk kriopreservasi spermatozoa domba Black Manchega, dimana diperoleh persentase viabilitas spermatozoa setelah thawing dari kauda epididimis lebih tinggi dibandingkan ejakulat.
Abnormalitas Spermatozoa Domba selama Proses Kriopreservasi