i
UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH PEMBERIAN EKSTRAK ETANOL 96%
HERBA KUMIS KUCING (
Orthosiphon stamineus
Benth) TERHADAP PENURUNAN KADAR
KOLESTEROL TOTAL PADA TIKUS JANTAN YANG
DIINDUKSI PAKAN HIPERKOLESTEROL
SKRIPSI
DINI FAUZANA M
1111102000070
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
ii
UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH PEMBERIAN EKSTRAK ETANOL 96%
HERBA KUMIS KUCING (
Orthosiphon stamineus
Benth) TERHADAP PENURUNAN KADAR
KOLESTEROL TOTAL PADA TIKUS JANTAN YANG
DIINDUKSI PAKAN HIPERKOLESTEROL
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi
DINI FAUZANA M
1111102000070
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
vi ABSTRAK
Nama : Dini Fauzana M
Program Studi : Farmasi
Judul : Pengaruh Pemberian Ekstrak Etanol 96% Herba Kumis Kucing (Orthosiphon stamineus Benth) Terhadap Penurunan Kadar Kolesterol Total Pada Tikus Jantan Yang Diinduksi Pakan Hiperkolesterol
Penelitian ini dilakukan untuk menguji pengaruh pemberian ekstrak etanol 96% herba kumis kucing (Orthosiphon stamineus Benth) terhadap penurunan kadar kolesterol total pada tikus jantan yang diinduksi pakan hiperkolesterol. Metode yang digunakan adalah dengan cara tikus diinduksi pakan hiperkolesterol (kuning telur ayam, sukrosa 65% dan lemak hewan) selama 14 hari terhadap semua kelompok perlakuan kecuali kontrol normal.Kemudian tikus diberi ekstrak herba kumis kucing (kelompok uji dosis 250, 500, dan 1000 mg/kgBB) dan simvastatin (kelompok kontrol positif) selama 14 hari. Kadar kolesterol darah tikus diukur sebanyak tiga kali, kadar kolesterol sebelum pemberian pakan hiperkolesterol (hari ke-0), kadar kolesterol setelah pemberian pakan hiperkolesterol (hari ke-15), dan kadar kolesterol setelah pemberian ekstrak uji (hari ke-29). Kadar kolesterol darah tikus diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang 500 nm. Hasil penelitian menunjukkan penurunan kadar kolesterol total pada kelompok kontrol positif dan uji dosis 250, 500, dan 1000 mg/kgBB berbeda secara bermakna terhadap kelompok kontrol normal dan kontrol negatif
(p ≤ 0,05).
vii ABSTRACT
Name : Dini Fauzana M
Study program : Pharmacy
Title : Effect of Ethanol Extract 96% Of Cats Whisker (Orthosiphon stamineus Benth) Herb Against ADecrease Total Cholesterol Levels On Male Rats Induced Hypercholesterolemia Feed.
This study was conducted to examine the effect of ethanol extract 96% of Cats Whisker (Orthosiphon Stamineus Benth)herbagainst a decrease total cholesterol levels on male rats induced hypercholesterolemia feed. The Method used is by rats were induced hypercholesterolemia feed (chicken yolk, sucrose 65% and animal fat) for 14 days to all treatment groups except normal control. Then, the rats were given extractsof Orthosiphon Stamineus Benth (test group dose of 250, 500, and 1000 mg / kg body weight) and simvastatin (positive control group) for 14 days. Blood cholesterol levels were measured three times, cholesterol levels before given hypercholesterolemia feed (day 0), cholesterol levels after given hypercholesterolemia feed (day 15), and cholesterol levels after given test extract (day 29). Blood cholesterol levels were measured using a spectrophotometer UV-Vis at 500 nm. The results showed a decrease total cholesterol levels on the positive control group and test dose of 250, 500, and 1000 mg / kg body weight was significantly different against normal control group and negative control group (p ≤ 0.05).
viii
KATA PENGANTAR
Assalamu ‘alaikum warahmatullahi wabarakatuh
Alhamdulillahirabbil’alamin, puji syukur selalu terpanjatkan atas kehadirat Allah subhanahu wa ta’ala atas segala berkah dan kasih sayang-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Shalawat serta salam senantiasa tercurahkan kepada keharibaan junjungan Nabi Besar Muhammad SAW, beserta keluarga, sahabat, dan para pengikutnya hingga hari akhir nanti semoga kita mendapatkan syafaat dari beliau. Aamiin yaa rabbal
‘alamin.
Skripsi dengan judul “Pengaruh Pemberian Ekstrak Etanol 96% Herba Kumis Kucing (Orthosiphon stamineus Benth) Terhadap Penurunan Kadar
Kolesterol Total Tikus Jantan Yang Diinduksi Pakan Hiperkolesterol” ini disusun
dalam rangka memenuhi salah satu syarat menempuh ujian akhir guna mendapatkan gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Selama proses penelitian dan penyusunan skripsi ini, penulis menyadari begitu banyak bantuan dari berbagai pihak yang telah meluangkan waktunya, mendidik dan membimbing, memberikan secercah harapan, dan mendoakan yang terbaik kepada penulis. Maka pada kesempatan ini, penulis menyampaikan penghargaan setinggi-tingginya dan rasa terima kasih yang sebesar-besarnya kepada :
ix
3. Prof. Dr. Atiek Soemiati, M.Si., Apt dan ibu Nurmeilis, M.Si., Apt sebagai Pembimbing I dan Pembimbing II serta Dr.Azrifitria, M.Si., Apt dan Ibu Eka Putri, M.Si., Apt yang dengan sabar senantiasa meluangkan waktu dan pikirannya untuk membimbing dan mendidik penulis.
4. Bapak dan Ibu Dosen Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta yang telah memberikan ilmunya kepada penulis, semoga ilmu yang diberikan berberkah dan menjadi ilmu yang bermanfaat bagi kita semua.
5. Papa tercinta Drs.Muhardis, M.M. dan Ibunda tercinta Wendra Wartis, Adikku Fajri Fauzan M dan Fakhrul Fauzan M serta keluarga besar yang
selalu memberikan do’a, kasih sayang, semangat, dan motivasi kepada
penulis. Semoga segala amalan dan jerih payah semuanya mendapat balasan yang jauh lebih baik dari-Nya.
6. Sahabat-sahabatku Fitri Rahmadani, Firda Khanifah, Novila Tari, Mazaya Fadhila, Nurul Hikmah Tanjung, dan Resky Yuliandari yang selalu ada disisi penulis dan memberikan motivasi, semangat, bantuan kepada penulis, serta telah memberi pelajaran dan pengalaman baru dan persahabatan yang hangat.
7. Sahabat-sahabatku “SG-X” Silvia Elzadinita, Asmaul Husna Sholatia, Bela Islami Putri, Nadia Ibrahim dan Yuni Rafika Rahmi yang selalu memberi motivasi dan semangat kepada penulis. Mudah-mudahan persahabatan kita takkan pernah lekang oleh keadaan apapun.
8. Teman seperjuangan penelitian Rizki Hidayanti Rambe yang selalu bekerja keras saat penelitian dan memberi banyak bantuan kepada penulis. 9. Teman-teman seperjuangan Farmasi Angkatan 2011 yang telah
memberikan pelajaran dan pengalaman baru kepada penulis.
10.Kak Lisna, Kak Tiwi, Kak Eris, Mba Rani, dan Kak Rahmadi yang telah membantu keseharian penulis selama penelitian di laboratorium.
11.Serta semua pihak yang telah membantu penulis selama ini yang tidak dapat penulis sebutkan satu per satu.
x
penulisan skripsi ini masih banyak kelemahan dan kekurangan.Maka dari itu, dengan segala kerendahan hati penulis sangat mengharapkan kritik dan saran pembaca agar lebih sempurnanya skripsi ini.
Jakarta, 5 Juni 2015
xii DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... ix
DAFTAR ISI ... x
2.1.5. Ekologi dan Penyebaran Tanaman ... 7
2.2. Simplisia, Ekstrak dan Ekstraksi ... 7
2.2.1. Pengertian Simplisia, Ekstrak dan Ekstraksi... 7
2.2.2. Metode Ekstraksi ... 8
2.3. Kolesterol ... 9
2.3.1. Definisi dan Biosintesis Kolesterol ... 9
2.3.2. Pengangkutan Kolesterol ... 10
xiii
2.4. Simvastatin ... 15
2.4.1. Definisi ... 15
2.4.2. Farmakodinamik ... 15
2.4.3. Farmakikinetik ... 16
2.4.4. Efek Samping ... 16
2.5. Hewan Uji ... 16
BAB III METODE PENELITIAN ... 20
3.1. Tempat dan Waktu Penellitian ... 20
3.2. Alat dan Bahan ... 20
3.2.1. Alat ... 20
3.2.2. Bahan ... 20
3.3. Prosedur kerja ... 21
3.3.1. Pembuatan Ekstrak ... 21
3.3.2.Penapisan Fitokimia ... 21
3.3.3.Pengujian Parameter Ekstrak ... 24
3.3.4.Penyiapan Hewan Uji ... 24
3.3.5.Rancangan Penelitian ... 24
3.3.6. Perhitungan Dosis dan Pembuatan Larutan Uji ... 25
3.3.7. Uji Efek Antihiperkolesterol ... 26
3.3.8. Cara Pengambilan Darah ... 27
3.3.9.PengukuranKadar Kolesterol Total Darah ... 27
3.3.10.Uji Statistik ... . 28
BAB IV HASIL DAN PEMBAHASAN ... 29
4.1. Determinasi Tanaman ... 29
4.2. Hasil Ekstraksi Herba Kumis Kucing ... 29
4.3. Hasil Pengujian Parameter Ekstrak ... 30
4.4. Hasil Uji Penapisan Fitokimia ... 32
4.5. Hasil Uji Pengukuran Kadar Kolesterol... 34
BAB V PENUTUP ... 40
5.1. Kesimpulan ... 40
5.2. Saran ... 40
DAFTAR PUSTAKA ... 41
xiv
DAFTAR TABEL
Halaman
Tabel 2.1. Kandungan Kimia Kumis Kucing ... 5
Tabel 2.2. Klasifikasi Kolesterol Total, HDL ,LDL dan Trigliserida ... 14
Tabel 2.3. Nilai Fsiologis Tikus ... 17
Tabel 3.1. Pembagian Kelompok Hewan Uji Berdasarkan Perlakuan ... 25
Tabel 3.2. Analisa Kadar Kolesterol Total ... 27
Tabel 4.1. Hasil Pengujian Parameter Ekstrak ... 30
Tabel 4.2 Hasil Penapisan Fitokimia Ekstrak Herba Kumis Kucing ... 32
Tabel 4.3. Rata-Rata Kadar Kolesterol ... 37
Tabel 4.4. Persentase Penurunan Kadar Kolesterol ... 37
Tabel 6.1. Hasil Penapisan Fitokimia Ekstrak ... 51
Tabel 11.1. Conversion Animal Doses to HED on BSA ... 59
Tabel 12.1. Hasil Absorbansi Spektrofotometer Hari Ke-0 ... 61
Tabel 12.2. Hasil Absorbansi Spektrofotometer Hari Ke-15 ... 62
Tabel 12.3. Hasil Absorbansi Spektrofotometer Hari Ke-29 ... 63
Tabel 12.4. Hasil Perhitungan Kadar Kolesterol ... 64
Tabel 15.1. Hasil Uji Normalitas Kadar Kolesterol ... 67
Tabel 15.2. Hasil Uji Homogenitas Kadar Kolesterol ... 68
Tabel 15.3. Hasil Uji ANOVA Kadar Kolesterol ... 69
Tabel 15.4. Hasil Uji Post Hoc Kadar Kolesterol ... 70
Tabel 16.1. Hasil Uji Normalitas Berat Badan Tikus ... 74
Tabel 16.2. Hasil Uji Homogenitas Berat Badan Tikus ... 75
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Orthosiphon stamineus Benth ... 4
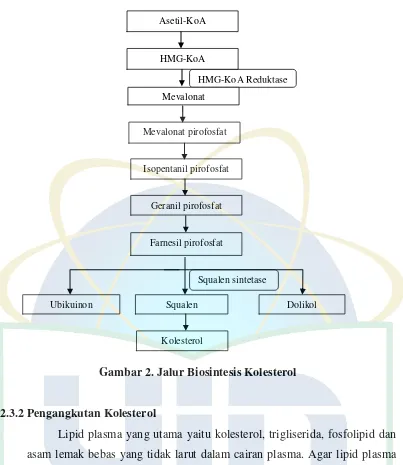
Gambar 2. Jalur Biosintesis Kolesterol ... 10
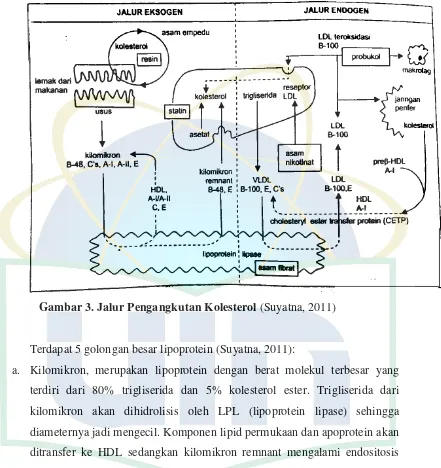
Gambar 3. Jalur Pengangkutan Kolesterol ... 12
Gambar 4. Simplisia herba kumis kucing (Orthosiphon stamineus Benth.) .. 45
Gambar 5. Pelarut Etanol 96% ... 45
Gambar 6. Bejana Maserasi ... 45
Gambar 7. Rotary evaporator ... 45
Gambar 8. Ekstrak etanol 96% herba kumis kucing (Orthosiphon stamineus Benth) ... 45
Gambar 9. Sample tube ... 45
Gambar 10. Reagen dan standar kolesterol ... 45
Gambar 11. Tube EDTA ... 45
Gambar 12. Sentrifugasi ... 45
Gambar 13. Spektrofotometer UV-Vis ... 46
Gambar 14. Tikus putih jantan galur Sprague-dawley ... 46
Gambar 15. Proses maserasi ... 46
Gambar 16.. Proses pengentalan ekstrak ... 46
Gambar 17. Penimbangan berat badan tikus ... 46
Gambar 18. Pengambilan darah ... 46
Gambar 19. Pemberian larutan melalui oral ... 46
Gambar 20. TLC-Scanner ... 46
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bahan dan Alat Penelitian ... 45
Lampiran 2. Determinasi Herba Kumis Kucing (Orthosiphon stamineus Benth) ... 47
Lampiran 3. Sertifikat Hewan Uji ... 48
Lampiran 4. Alur Penelitian ... 49
Lampiran 5. Skema Kerja Pembuatan Ekstrak Etanol 96% Herba Kumis Kucing (Orthosiphon stamineus Benth) ... 50
Lampiran 6. Hasil Penapisan Fitokimia ... 51
Lampiran 7. Pemeriksaan Parameter ekstrak ... 52
Lampiran 8. Perhitungan kadar sinensetin ... 54
Lampiran 9. Skema Kerja Uji Antihiperkolesterolemia ... 56
Lampiran 10. Perhitungan Dosis Uji Ekstrak Herba Kumis Kucing ... 57
Lampiran 11. Perhitungan Dosis Simvastatin ... 59
Lampiran 12. Hasil Spektrofotometer plasma uji ... 61
Lampiran 13. Grafik Rata-Rata Kadar Kolesterol ... 65
Lampiran 14. Grafik Rata-Rata Kenaikan Berat Badan Tikus ... 66
Lampiran 15. Hasil Statistik Uji Antikolesterol ... 67
xvii
DAFTAR SINGKATAN
WHO : World Health Organization
USDA : United States Department of Agriculture
LDL : Low Density Lipoprotein
VLDL : Very Low Density Lipoprotein
HDL : High Density Lipoprotein
IDL : Intermediate Density Lipoprotein
LPL : Lipoprotein lipase
HED : Human Equivalent Dose
VAO : Volume Administrasi Obat
EDTA : Ethylene Diamine Tetraacetic Acid
CYP450 : Cytochrome P450
HMG-Koa : Hidroksi Metil Glutamil Koenzim A
cAMP : Cyclic Adenosine Monophosphate
SREBP : Sterol Regulatory Element Binding Protein
NaCMC : Natrium Carboxy Methyl Cellulose
UV : Ultra Violet
KLT : Kromatografi Lapis Tipis
1
UIN Syarif Hidayatullah Jakarta BAB I
PENDAHULUAN 1.1 Latar Belakang
Penyakit jantung dan stroke merupakan penyebab kematian tertinggi di Indonesia yang mengakibatkan kematian 328.500 orang di tahun 2012 (WHO, 2012).
World Health Organization (2008) melaporkan bahwa kolesterol darah yang tinggi diperkirakan menjadi penyebab 2,6 juta kematian dan merupakan faktor risiko utama timbulnya penyakit jantung dan stroke di negara maju dan negara berkembang. Menurut Dipiro et al. (2009) kadar
kolesterol total darah ≥ 200 mg/dl dinyatakan kondisi kolesterol total darah yang melebihi normal atau sering disebut juga dengan hiperkolesterolemia.
Davison and Bonnie (2012) mengungkapkan bahwa kadar kolesterol dipengaruhi oleh asupan serat, sayuran, buah, lemak jenuh, karbohidrat, dan protein. Sedangkan menurut Waloya, Rimbawan dan Nuri (2013) asupan serat pangan, asupan lemak, aktivitas fisik dan perbedaan jenis kelamin berpengaruh terhadap kadar kolesterol darah.
Indonesia dan beberapa negara lain, telah menggunakan tanaman obat secara luas dalam mengatasi berbagai penyakit. Salah satu tanaman yang sering digunakan sebagai obat adalah tanaman kumis kucing (Orthosiphon stamineus Benth). Beberapa penelitian telah menyebutkan tentang manfaat tanaman kumis kucing sebagai agen hipoglikemik (Sriplang et al., 2007), antihiperlipid (Umbare et al., 2009) anti-angina (Sahib et al., 2009), hepatoprotektif (Maheswari et al., 2008), hipertensi dan diuretik (Himani et al., 2013) serta penyakit lainnya.
Menurut Himani et al. (2013) ekstrak daun kumis kucing banyak mengandung senyawa flavon, polifenol, protein aktif, glikosida, minyak atsiri dan kalium serta sedikit senyawa terpenoid. Wulandari (2011) juga menyatakan bahwa kandungan kimia ekstrak daun kumis kucing adalah saponin, flavonoid, dan polifenol. Rajasekaran, Anandan, and Nishad (2013) menyebutkan bahwa flavonoid dan polifenol dapat menurunkan kadar kolesterol LDL dan VLDL, trigliserida serta meningkatkan kadar kolesterol
2
UIN Syarif Hidayatullah Jakarta
HDL serum. Utama-ang (2006) juga menyebutkan bahwa saponin memiliki aktivitas dalam mereduksi kolesterol.
Penelitian yang dilakukan oleh Umbare et a.l (2009) menyatakan bahwa ekstrak alkohol-air kulit batang kumis kucing dengan dosis 500 dan 750 mg/kgBB menunjukkan aktivitas antihiperlipidemia secara signifikan pada tikus yang diinduksi diet tinggi lemak. Senyawa utama dari ekstrak alkohol-air kulit batang kumis kucing adalah senyawa flavonoid yang diduga memberikan efek antihiperlipidemia.
Pelarut ideal yang sering digunakan dalam mengekstraksi senyawa-senyawa yang memiliki aktivitas farmakologi adalah alkohol atau campurannya dengan air, karena merupakan pelarut pengekstraksi yang terbaik untuk hampir semua senyawa dengan berat molekul rendah seperti saponin dan flavonoid (Wijasekera,1991 dikutip dari Arifianti et al. 2014). Arifianti et al. (2014) menyimpulkan dalam penelitiannya bahwa ekstrak alkohol 96% daun kumis kucing menghasilkan ekstrak dengan kadar sinensetin tertinggi dibandingkan ekstrak alkohol 50% dan 70%. Sinensetin merupakan salah satu senyawa golongan flavonoid yang menjadi senyawa marker karena ditemukan dengan kadar tertinggi pada ekstrak daun kumis kucing (Himani et al., 2013), selain itu sinensetin juga berperan dalam metabolisme lipid dalam jaringan adiposa. Penelitian yang dilakukan oleh Kang S.I., Shin H.S., and Kim S.J. (2015) menyatakan bahwa sinensetin dapat meningkatkan adipogenesis dan lipolisis dengan meningkatkan kadar cAMP dalam jaringan adiposa.
3
UIN Syarif Hidayatullah Jakarta 1.2 Perumusan Masalah
Apakah pemberian ekstrak etanol 96% herba kumis kucing (Orthosiphon stamineus Benth.) dapat menurunkan kadar kolesterol total pada tikus jantan yang diinduksi pakan hiperkolesterol?
1.3 Tujuan Penelitian
Untuk menguji aktivitas ekstrak etanol 96% herba kumis kucing (Orthosiphon stamineus Benth.) terhadap penurunan kadar kolesterol total pada tikus jantan yang diinduksi pakan hiperkolesterol.
1.4 Manfaat Penelitian
a. Manfaat umum : Penelitian ini diharapkan dapat memperkaya pengetahuan di bidang fitofarmaka dan ilmu-ilmu lain yang terkait dalam penggunaan tanaman obat sebagai terapi, dan sebagai bahan acuan untuk penelitian selanjutnya dalam rangka mencari dosis yang tepat, aman, dan efektif bagi manusia serta pengembangan formulasinya.
4
UIN Syarif Hidayatullah Jakarta BAB II
TINJAUAN PUSTAKA 2.1 Tanaman Kumis Kucing
2.1.1Klasifikasi Tanaman
Sinonim : Orthosiphon aristatus Miq., Orthosiphon spicatus B.B.S., dll
Divisi : Spermathophyta
Kelas : Dicotyledonae
Bangsa : Tubiflorae
Suku : Labiatae / Lamiaceae
Marga : Orthosipon
Jenis : Orthosipon stamineus Benth.
Nama umum : Kumis Kucing
Nama daerah : Kumis kucing (Melayu – Sumatra), kumis kucing (Sunda), remujung (Jawa), songkot koceng (Madura) (Depkes, 1980; USDA, 2015).
2.1.2 Deskripsi Tanaman
Tanaman terna yang tumbuh tegak, pada buku-bukunya berakar tetapi tidak tampak nyata, tinggi tanaman sampai 2 m. Batang bersegi empat agak beralur. Helai daun berbentuk bundar telur lonjong, lanset, lancip atau tumpul pada bagian ujungnya, ukuran daun panjang 1-10 cm dan lebarnya 7,5 mm-1,5 cm, urat daun sepanjang pinggir berbulu tipis atau gundul, dimana kedua permukaan berbintik-bintik karena adanya kelenjar yang jumlahnya sangat banyak, panjang tangkai daun 7-29 mm. Kelopak bunga berkelenjar, urat dan pangkal berbulu pendek dan jarang sedangkan di bagian yang paling atas gundul. Bunga, mahkota berwarna ungu pucat atau putih, dengan ukuran panjang 13-27 mm, di bagian atas ditutupi oleh bulu pendek yang berwarna ungu atau putih, panjang tabung 10-18 mm, panjang bibir 4,5-10 mm, helai bunga tumpul, bundar. Benang sari ukurannya lebih panjang dari tabung bunga dan melebihi bibir bunga bagian atas. Buah geluk berwarna coklat gelap, panjang 1,75-2 mm (Depkes, 1980).
4
5
UIN Syarif Hidayatullah Jakarta 2.1.3 Kandungan Kimia Tanaman
Himani et al., (2013) melaporkan tentang beberapa studi yang menjelaskan tentang kandungan kimia tanaman kumis kucing. Kumis kucing banyak mengandung flavon, polifenol, protein aktif, glikosida, minyak atsiri dan kalium. Lebih dari 12 senyawa fenolik yang telah diisolasi dari tanaman kumis kucing seperti : flavon lipofilik, glikosida flavonol, turunan asam kafeat (asam rosmarinat dan 2,3-dicaffeoyltartaric acid), asam oleanolat, asam ursolat dan β-sitosterol. Sinensetin merupakan senyawa fitokimia paling penting dan menjadi senyawa marker dari tanaman kumis kucing.
Tabel 2.1.Kandungan kimia kumis kucing (Orthosiphon stamineus Benth.) (Himani et al., 2013).
Senyawa Flavonoid
Sinensetin, Tetramethylscutellarein,
Eupatorin, Salvigenin, Cirsimaritin, Pilloin, Rhamnazin, Trimethylapigenin,
Neoorthosiphols-A, Staminol-A.
Benzochromenes Orthochromene-A, Methylripariochromene-A, Acetovaillochromene
Essential oils
β-elemene, β-caryophyllene, α-humulene, β -caryophyllene oxide, Can-2-one, Palmitic
acid
2.1.4 Khasiat Tanaman
Beberapa penelitian pra klinik tentang manfaat tanaman kumis kucing dalam pengobatan beberapa penyakit, seperti berikut :
a. Sebagai antihiperlipidemia (Umbare et al., 2009)
6
UIN Syarif Hidayatullah Jakarta
d. Sebagai penyeimbang level nitrat oksida (Basheer and Abdil, 2010). e. Sebagai antipiretik dan analgesik (Basheer and Abdil, 2010).
f. Sebagai pengatur gula darah sehingga digunakan untuk pengobatan alternatif diabetes (Himani et al., 2013).
g. Memiliki aktivitas dalam menghambat penempelan platelet-platelet darah dan memiliki sifat hemolitik kuat yang dapat menurunkan tekanan darah sehingga dapat menjadi alternatif pengobatan untuk tekanan darah tinggi serta untuk mengurangi kolesterol, yang sering digunakan dalam obat tradisional (Himani et al., 2013).
h. Berguna untuk membersihkan racun dalam darah sehingga telah digunakan sebagai obat herbal tradisional dalam proses detoksifikasi dan juga dapat menghapus sisa metabolisme di dalam tubuh sehingga berguna dalam upaya penurunan berat badan (Himani et al., 2013).
i. Sebagai diuretik sehingga bermanfaat dalam pengobatan batu ginjal dan pembilasan ginjal serta saluran kemih (Himani et al., 2013).
j. Sebagai penghambat produksi asam urat yang dapat digunakan dalam membantu kondisi seperti gout dan radang sendi karena tingginya kadar asam urat dalam tubuh (Himani et al., 2013).
k. Sebagai anti-inflamasi yang dapat digunakan dalam pengobatan herbal untuk arthritis dan rematik (Himani et al., 2013).
Penelitian yang dilakukan oleh Yam et al. (2013) menyatakan bahwa ekstrak metanol 50% daun kumis kucing tidak menimbulkan kematian dan tidak memperlihatkan efek samping terhadap kondisi umum, seperti pertumbuhan, berat badan dan berat organ, hematologi dan nilai biokimia lain pada dosis 1250, 2500 dan 5000 mg/kg pada tikus jantan dan betina galur Sprague Dawley. Dosis oral yang dapat menyebabkan kematian pada tikus jantan dan betina yaitu pada dosis lebih dari 5000 mg/kg.
7
UIN Syarif Hidayatullah Jakarta
meningkatkan eliminasi urea dan klorida pada 14 pasien dengan kondisi
azotaemic ureamia. Ekstrak daun kumis kucing juga dapat meningkatkan produksi empedu dan eliminasi asam empedu dari kandung empedu pada sukarelawan sehat.
Kumis kucing telah banyak digunakan dalam pengobatan tradisional sebagai antihipertensi, hipolipidemik, hipoglikemik rematik, antiinflamasi, antibakteri, dan antijamur, tetapi belum ada studi farmakologi atau studi klinis yang mendukung tentang manfaat kumis kucing tersebut (Committee on Herbal Medicinal Products, 2010).
2.1.5Ekologi dan Penyebaran Tanaman
Tumbuh di dataran rendah dan daerah ketinggian sedang. Ditemukan di Indonesia, Asia tengah, Cina, Kepulauan pasifik dan Australia (Depkes. 1980).
2.2 Simplisia, Ekstrak dan Ekstraksi
2.2.1 Pengertian Simplisia, Ekstrak dan Ekstraksi
Simplisia atau herbal adalah bahan alam yang telah dikeringkan yang digunakan untuk pengobatan dan belum mengalami pengolahan. Simplisia segar adalah bahan alam segar yang belum dikeringkan. Simplisia nabati adalah simplisia yang berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan (Depkes, 2008).
Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang cocok, di luar pengaruh cahaya matahari langsung (Depkes, 2008).
8
UIN Syarif Hidayatullah Jakarta 2.2.2Metode Ekstraksi
Menurut Depkes (2000), metode ekstraksi menggunakan pelarut dibagi menjadi dua cara yaitu cara dingin dan cara panas.
1) Cara Dingin a. Maserasi
Maserasi adalah proses ekstraksi simplisia menggunakan pelarut dengan beberapa kali pengadukan atau pengocokan pada temperatur ruang (kamar). Maserasi kinetik merupakan maserasi yang dilakukan dengan cara pengadukan secara kontinu (terus menerus). Remaserasi berarti dilakukannya pengulangan penambahan pelarut setelah dilakukan penyaringan maserat. Prinsip maserasi penyarian zat aktif yang dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari yang sesuai selama tiga hari pada temperatur kamar, terlindung dari cahaya, cairan penyari akan masuk ke dalam sel melewati dinding sel. Isi sel akan larut karena adanya perbedaan konsentrasi antara larutan di dalam sel dengan di luar sel. Larutan yang konsentrasinya tinggi akan terdesak keluar dan diganti oleh cairan penyari dengan konsentrasi rendah (proses difusi). Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Selama proses maserasi dilakukan pengadukan dan penggantian cairan penyari setiap tiga hari sekali. Endapan yang diperoleh dipisahkan dan filtratnya dipekatkan.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Prosesnya terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap maserasi sebenarnya (penetesan atau penampungan ekstrak), yang dilakukan terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
2) Cara Panas a. Refluks
9
UIN Syarif Hidayatullah Jakarta
konstan dengan adanya pendinginan balik. Umumnya dilakukan pengulangan proses residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
b. Soxhletasi
Soxhletasi adalah ekstraksi menggunakan pelarut yang selalu baru umumnya dilakukan dengan alat khusus (seperangkat alat soxhlet) sehingga terjadi ekstraksi kontinu dengan jumlah pelarut yang relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur 40-50oC.
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih), temperatur terukur 96-98oC selama 15-20 menit.
e. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur
sampai titik didih air (≥ 30o
C).
2.3 Kolesterol
2.3.1 Definisi dan Biosintesis Kolesterol
Kolesterol adalah suatu zat lemak yang dibentuk oleh hati dan digunakan dalam pencernaan lemak. Selama pencernaan, kolesterol bergabung dengan garam empedu, fosfolipid dan trigliserida menjadi suspensi kecil yang disebut misel (Corwin, 2009).
10
UIN Syarif Hidayatullah Jakarta Gambar 2. Jalur Biosintesis Kolesterol
2.3.2 Pengangkutan Kolesterol
Lipid plasma yang utama yaitu kolesterol, trigliserida, fosfolipid dan asam lemak bebas yang tidak larut dalam cairan plasma. Agar lipid plasma dapat diangkut dalam sirkulasi, maka susunan molekul lipid tersebut dimodifikasi dalam bentuk lipoprotein yang bersifat larut dalam plasma. Lipoprotein ini bertugas mengangkut lipid dari tempat sintesisnya ke tempat penggunaannya (Suyatna, 2011).
Pemeliharaan penyaluran kolesterol darah ke sel melibatkan interaksi antara kolesterol dari makanan dan sintesis kolesterol oleh hati. Apabila jumlah kolesterol dari makanan meningkat, sintesis kolesterol oleh hati dihentikan karena kolesterol dalam darah secara langsung menghambat suatu enzim hati yang penting untuk sintesis kolesterol. Dengan demikian, semakin banyak kolesterol yang dimakan, semakin sedikit kolesterol yang
Squalen sintetase HMG-KoA Reduktase Asetil-KoA
HMG-KoA
Isopentanil pirofosfat Mevalonat
Mevalonat pirofosfat
Geranil pirofosfat
Farnesil pirofosfat
Squalen Dolikol
Ubikuinon
11
UIN Syarif Hidayatullah Jakarta
dibentuk oleh hati. Sebaliknya, apabila asupan kolesterol melalui makanan berkurang, hati mensintesis lebih banyak kolesterol karena efek inhibisi kolesterol pada enzim hati tersebut tidak ada (Sherwood, 2003).
Lipid darah diangkut dengan 2 cara yaitu jalur eksogen dan jalur endogen (Suyatna, 2011):
a. Jalur eksogen
Trigliserida dan kolesterol yang berasal dari makanan dalam usus dikemas sebagai kilomikron. Kilomikron ini diangkut ke dalam saluran limfe lalu ke dalam darah via duktus torasikus. Di dalam jaringan lemak, trigliserida dalam kilomikron mengalami hidrolisis oleh lipoprotein lipase yang terdapat di permukaan sel endotel. Akibat hidrolisis ini maka akan terbentuk asam lemak dan kilomikron remnant. Asam lemak bebas akan menembus endotel dan masuk ke dalam jaringan lemak atau sel otot untuk diubah menjadi trigliserida kembali (sebagai cadangan) atau dioksidasi (sebagai energi).
Kilomikron remnant adalah kilomikron yang telah dihilangkan sebagian besar trigliseridanya sehingga ukurannya mengecil tapi jumlah ester kolesterolnya tetap. Kilomikron remnant ini akan dibersihkan oleh hati dari sirkulasi dengan mekanisme endositosis oleh lisosom. Hasil metabolisme ini berupa kolesterol bebas yang akan digunakan untuk sintesis berbagai struktur (membran plasma, mielin, hormon steroid dsb.), disimpan dalam hati sebagai kolesterol ester lagi, diekskresi ke dalam empedu atau diubah menjadi lipoprotein endogen yang dikeluarkan ke dalam plasma. Kolesterol juga dapat disintesis dari asetat dengan pengaruh enzim HMG-KoA reduktase yang menjadi aktif jika terdapat kekurangan kolesterol endogen. Asupan kolesterol dari darah juga diatur oleh jumlah reseptor LDL yang terdapat pada permukaan sel hati.
b. Jalur endogen
12
UIN Syarif Hidayatullah Jakarta
LDL mengalami katabolisme melalui jalur reseptor dan non reseptor. Jalur katabolisme reseptor dapat ditekan oleh produksi kolesterol endogen.
Gambar 3. Jalur Pengangkutan Kolesterol (Suyatna, 2011)
Terdapat 5 golongan besar lipoprotein (Suyatna, 2011):
a. Kilomikron, merupakan lipoprotein dengan berat molekul terbesar yang terdiri dari 80% trigliserida dan 5% kolesterol ester. Trigliserida dari kilomikron akan dihidrolisis oleh LPL (lipoprotein lipase) sehingga diameternya jadi mengecil. Komponen lipid permukaan dan apoprotein akan ditransfer ke HDL sedangkan kilomikron remnant mengalami endositosis lewat reseptor di hepatosit. Adanya kilomikron dalam plasma sewaktu puasa dianggap kondisi abnormal.
13
UIN Syarif Hidayatullah Jakarta
dimetabolisme di hati dan menghambat modifikasi oksidatif LDL melalui paraoksonase (suatu protein antioksidan yang berasosiasi dengan HDL). c. Lipoprotein berdensitas rendah (low-density lipoprotein, LDL), memiliki
protein lebih sedikit dan kolesterol lebih banyak. LDL merupakan lipoprotein yang mengangkut kolesterol terbesar pada manusia (70% total). Partikel LDL mengandung trigliserida sebanyak 10% dan kolesterol 50%. Jalur utama katabolisme LDL berlangsung lewat receptor mediated endocytosis di hati dan sel lain. Ester kolesterol dari LDL dihidrolisis menjadi kolesterol bebas untuk sintesis membran dan hormon steroid. Produksi enzim HMG-KoA reduktase dan reseptor LDL diatur lewat transkripsi genetik berdasarkan tinggi rendahnya kadar kolesterol dalam sel. d. Lipoprotein berdensitas sangat rendah (very low-density lipoprotein, VLDL),
mengandung 60% trigliserida dan 10-15% kolesterol. VLDL disekresi hati untuk mengangkut trigliserida ke jaringan perifer. Trigliserida VLDL dihidrolisis oleh LPL menghasilkan asam lemak bebas untuk disimpan dalam jaringan adiposa serta bahan oksidasi di jantung dan otot skelet. Karena asam lemak bebas dan gliserol dapat disintesis dari karbohidrat, maka makanan kaya karbohidrat akan meningkatkan jumlah VLDL. Hipertrigliseridemia merupakan tanda bahwa kadar HDL kolesterol rendah dan sering dikaitkan dengan kegemukan, intoleransi glukosa dan hiperurisemia.
e. Lipoprotein densitas sedang (IDL, Intermediate Density Lipoprotein). IDL mengandung trigliserida 30% dan kolesterol 20%. IDL adalah zat perantara yang terbentuk sewaktu VLDL dikatabolisme menjadi LDL. Kadar tidak terlalu besar kecuali jika terdapat hambatan konversi lebih lanjut.
14
UIN Syarif Hidayatullah Jakarta Tabel 2.2. Klasifikasi Kolesterol Total, HDL, LDL dan Trigliserida (Dipiro et al., 2009).
2.3.3 Hiperlipidemia dan Hiperkolesterolemia
Hiperlipidemia adalah kondisi dimana terjadi akumulasi berlebih salah satu atau lebih lipid utama dalam plasma, sebagai manifestasi kelainan metabolisme atau transportasi lipid. Dalam klinis, hiperlipidemia dinyatakan sebagai hiperkolesterolemia, hipertrigliseridemia, atau kombinasi keduanya. Hiperlipidemia dapat terjadi karena efek transportasi lipid atau karena produksi lipid endogen yang berlebihan. Kelainan ini dapat terjadi secara primer maupun sekunder akibat penyakit lain (Sherwood, 2003).
Hiperkolesterolemia merupakan kondisi saat konsentrasi kolesterol di dalam darah melebihi batas normal. Kadar kolesterol serum yang tinggi dapat menyebabkan pembentukan aterosklerosis. Hal ini diawali dengan oksidasi kolesterol-LDL pada lapisan subendotel arteri kemudian dilanjutkan dengan berbagai reaksi inflamasi hingga pembentukan lesi (Corwin, 2009).
15
UIN Syarif Hidayatullah Jakarta
Hiperkolesterolemia juga dapat disebabkan oleh penghambatan aktivitas enzim HMG-KoA reduktase. Peningkatan jumlah kolesterol intraseluler dari katabolisme kolesterol LDL dapat menghambat aktivitas enzim HMG-KoA reduktase sebagai pembatas biosintesis kolesterol, sehingga dapat menyebabkan biosintesis kolesterol berlebih dan terjadi peningkatan kadar kolesterol dalam darah (hiperkolesterolemia) (Dipiro et al., 2005).
Hiperkolesterolemia juga dapat disebabkan oleh kombinasi faktor lingkungan dan genetik. Faktor lingkungan termasuk obesitas dan pengaturan diet. Kontribusi genetik biasanya karena efek aditif dari beberapa gen, meskipun dapat pula karena cacat gen tunggal seperti dalam kasus hiperkolesterolemia familial. Sejumlah penyebab sekunder adalah Diabetes melitus tipe 2, obesitas, alkohol, dialisis, sindrom nefrotik, ikterus obstruktif, hipotiroid, anoreksia nervosa, obat-obatan (diuretik tiazid, siklosporin, glukokortikoid, beta bloker, asam retinoat) (Bhatnagar et al., 2008).
2.4 Simvastatin 2.4.1 Definisi
Simvastatin merupakan obat golongan statin, yang digunakan untuk menurunkan kolesterol (agen hipolipidemik) dan pada dosis tinggi juga dapat menurunkan trigliserida yang disebabkan oleh peninggian VLDL. Statin saat ini merupakan hipolipidemik yang paling efektif dan aman (Suyatna, 2011). Dosis simvastatin yang lazim diberikan dalam kisaran 5-80 mg/hari (Sweetman, 2009).
2.4.2 Farmakodinamik
16
UIN Syarif Hidayatullah Jakarta
akan berikatan dengan gen reseptor LDL, sehingga terjadi peningkatan sintesis reseptor LDL. Peningkatan jumlah reseptor LDL pada membran sel hepatosit akan menurunkan kadar kolesterol darah lebih besar lagi. Selain LDL, VLDL dan IDL juga menurun, sedangkan HDL meningkat (Suyatna, 2011). Obat ini diekstraksi paling banyak di dalam hati sehingga efek utama obat ini adalah pada hati (Katzung, 1997).
2.4.3 Farmakokinetik
Semua statin, kecuali lovastatin dan simvastatin berada dalam bentuk
asam β-hidroksi. Kedua statin tersebut merupakan prodrug dalam bentuk lakton dan harus dihidrolisis lebih dahulu menjadi bentuk aktifnya yaitu
asam β-hidroksi. Statin diabsorpsi sekitar 40-75%, kecuali fluvastatin yang diabsorpsi hampir sempurna (Suyatna, 2011). Semua obat mengalami metabolisme lintas pertama di hati oleh CYP450 isoenzim CYP3A4. Obat-obat ini sebagian besar terikat protein plasma. Sebagian besar produk degradasi dieksresi melalui feses, via empedu dan kurang dari 10-15% dalam urin dalam bentuk tidak aktif. Sebesar 95% metabolit simvastatin terikat protein plasma. Waktu paruh simvastatin adalah 1,9 jam (Sweetman, 2009).
2.4.4 Efek Samping
Efek samping simvastatin meliputi sakit kepala, penglihatan kabur, insomnia, lemah otot. Reaksi hipersensitivitas, kerusakan hati dan pankreatitis juga telah dilaporkan. Efek samping statin secara umum lainnya adalah trombositopenia, proteinuria, gagal ginjal serta disfungsi ereksi (Sweetman, 2009).
2.5 Hewan Uji
17
UIN Syarif Hidayatullah Jakarta
Tingginya kadar estrogen pada tikus betina daripada tikus jantan dapat mempengaruhi metabolisme kolesterol plasma. Tikus putih jantan mempunyai metabolisme obat yang lebih cepat dan kondisi biologis tubuh yang lebih stabil dibanding tikus betina. Terdapat beberapa galur tikus yang memiliki kekhususan tertentu, salah satunya yaitu Sprague Dawley bewarna putih, berkepala kecil dan ekornya lebih panjang daripada badannya, serta memiliki sifat yang lebih tenang dibandingkan jenis Wistar. (Malole & Sri, 1989).
Tikus jantan jarang berkelahi seperti mencit jantan. Tikus putih dapat tinggal sendirian dalam kandang dan hewan ini lebih besar dibandingkan dengan mencit, sehingga untuk percobaan laboratorium, tikus putih lebih menguntungkan daripada mencit. Tikus putih sebagai hewan percobaan relatif resisten terhadap infeksi dan sangat cerdas. Tikus putih memiliki sifat tenang dan tidak begitu bersifat fotofobik seperti halnya mencit (Harmita & Maksum, 2004).
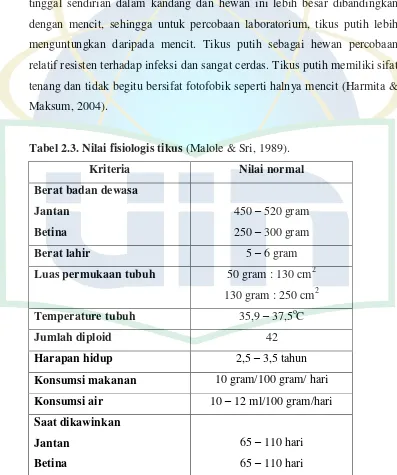
Tabel 2.3. Nilai fisiologis tikus (Malole & Sri, 1989).
Kriteria Nilai normal
Berat badan dewasa
Jumlah diploid 42
Harapan hidup 2,5 – 3,5 tahun
Konsumsi makanan 10 gram/100 gram/ hari
18
UIN Syarif Hidayatullah Jakarta
(Sambungan)
Lama kehamilan 21 – 23 hari
Lama siklus birahi 4-5 hari
Oestrus postpartum Fertil
Jumlah anak/kelahiran 6 – 12
Umur sapih 21 hari
Waktu pemeliharaan
komersial
4 – 5 bulan
Komposisi air susu Lemak 13%
Protein 9,7% Laktosa 3,2 %
Jumlah pernapasan 70 – 115/menit
Volume tidal 0,6 – 2 ml
Penggunaan oksigen 0,68 – 1,1 ml/g/hari
Detak jantung 250 – 450/menit
Volume darah 54 – 70 ml/kg
Tekanan darah 84 – 134/60 mmHg
Butir darah merah 7 – 10 x 106/mm
Hematokrit 36 – 48%
Hemoglobin 11 – 18 mg/dl
Leukosit 6 – 17 x 103/mm
Neutrofil 9 – 34%
Limfosit 65 – 85%
Eosinofil 0 – 6%
Monosit 0 – 5%
Basofil 0 – 1,5%
Platelet 500 – 1300 x 103/mm
Protein serum 5,6 – 7,6 g/dl
Globulin 1,8 – 3,0 mg/dl
Kreatinin 0,2 – 0,8 mg/dl
19
UIN Syarif Hidayatullah Jakarta
(Sambungan)
Nitrogen urea darah 15 – 21 mg/dl
Lemak serum 70 – 415 mg/dl
Fosfolipid 36 – 130 mg/dl
Trigliserida 26 – 145 mg/dl
Kolesterol 40 – 130 mg/dl
Kalsium serum 5,3 – 13 mg/dl
20
UIN Syarif Hidayatullah Jakarta BAB III
METODOLOGI PENELITIAN 3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Penelitian I, Laboratorium Biokimia/Patologi Klinik dan Animal House Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta pada bulan Februari hingga Mei 2015.
3.2 Alat dan Bahan Penelitian 3.2.1Alat
Alat-alat yang digunakan dalam penelitian ini antara lain : blender, timbangan, rotary evaporator, oven, timbangan analitik, waterbath, hot plate, bejana maserasi, cawan porselen/penguap, pipet tetes, kertas label, kapas, kertas saring, aluminium foil, batang pengaduk, spatula, corong, penjepit kayu, gelas piala, tabung reaksi, erlenmeyer, spatula, gelas ukur, labu ukur, rak tabung reaksi, sonde, sample tube, tabung EDTA, pipa kapiler, spuit 3 ml, sentrifugasi, spektrofotometer UV, TLC-Scanner
(Camag), Plat KLT, masker, sarung tangan, kandang tikus, tempat makan dan botol minum tikus.
3.2.2Bahan
Bahan Uji : Simplisia herba kumis kucing (Orthosiphon stamineus Benth) yang diperoleh dari Pusat Pengembangan Tanaman Obat Karyasari.
Hewan Uji : 36 ekor tikus putih galur Sprague-Dawley yang berumur ± 3 bulan dengan berat badan sekitar 150-250 gram.
Bahan Kimia : Reagen Kit Cholesterol PAP SL dari Elitech Clinical Systems, etanol 96%, toluen, metanol, etil asetat, NaCMC 1%, eter, pereaksi Libermann-Burchard (2 tetes asam asetat anhidrat dan 1 tetes H2SO4 pekat),
FeCl3, HCl pekat, kloroform, amilalkohol, tablet simvastatin 10 mg dari
Kimia Farma.
21
UIN Syarif Hidayatullah Jakarta
Bahan penginduksi hiperkolesterol : Makanan tinggi kolesterol dibuat dengan komposisi kuning telur (80%), larutan sukrosa 65% dalam air (15%), dan lemak hewan (5%) (Purwanti, 2012).
Bahan lainnya : aquadest dan makanan tikus G511
3.3 Prosedur Kerja 3.3.1Pembuatan Ekstrak
Metode pembuatan ekstrak herba kumis kucing adalah dengan cara maserasi dalam pelarut etanol 96%. Sebelum melakukan proses maserasi, simplisia herba kumis kucing yang telah di sortasi kering, dihaluskan terlebih dahulu dengan blender. Serbuk yang diperoleh ditimbang sebanyak 1500 gram dan dimasukkan kedalam bejana maserasi, kemudian ditambahkan etanol 96% kedalam bejana tersebut kurang lebih hingga 2 cm di atas permukaan serbuk. Maserat diaduk rata dan kemudian mulut bejana maserasi ditutup dengan aluminium foil. Perendaman dilakukan selama 3 hari pada suhu kamar dan pengadukan dilakukan setiap harinya 2-3 kali/hari. Setelah 3 hari, maserat disaring dengan kertas saring dan kapas. Ampas hasil maserasi direndam lagi dengan etanol 96% selama 3 hari selanjutnya (perlakuan sama dengan maserasi pertama). Filtrat yang diperoleh dari hasil penyaringan maserat kentalkan dengan vakum rotary evaporator. Ekstrak yang didapatkan berupa ekstrak kental. Selanjutnya ekstrak kental dikeringkan dengan oven vakum di laboratorium fitokimia Universitas Indonesia selama 5 hari hingga didapatkan ekstrak kering.
3.3.2Penapisan Fitokimia
1. Identifikasi golongan alkaloid
22
UIN Syarif Hidayatullah Jakarta
ditambahkan reagen Dragendorff. Terbentuk warna krem dengan reagen Mayer dan endapan coklat kemerahan dengan reagen Dragendorff menunjukkan adanya senyawa golongan alkaloid (Ayoola et al., 2008)
2. Identifikasi golongan flavonoid
0,5 gram ekstrak ditambah 50 ml air panas, dididihkan selama 5 menit dan disaring, filtrat digunakan sebagai larutan percobaan. 5 ml larutan percobaan ditambahkan sedikit serbuk magnesium, 1 ml asam klorida pekat dan 2 ml amilalkohol, dikocok dengan kuat dan dibiarkan memisah, terbentuknya warna orange, merah, kuning pada lapisan amilalkohol menunjukkan adanya senyawa flavonoid (Wijono, 2003).
3. Identifikasi golongan saponin
0,5 gram ekstrak dimasukkan kedalam tabung reaksi dan ditambahkan aquadest, larutan dikocok secara vertikal selama 3-5 menit. Terbentuknya busa yang stabil selama 30 menit menunjukkan adanya senyawa golongan saponin (Farnsworth, 1966)
4. Identifikasi golongan tanin
0,5 gram ekstrak dididihkan dalam 10 ml aquadest dalam tabung reaksi, lalu disaring. Kemudian kedalam filtrat ditambahkan 3 tetes larutan FeCl3. Terbentuk warna hijau kecoklatan atau biru kehitaman menunjukkan
adanya tanin (Ayoola et al., 2008)
5. Identifikasi golongan steroid dan triterpenoid
23
UIN Syarif Hidayatullah Jakarta 3.3.3Pengujian Parameter Ekstrak
1. Parameter Spesifik
a. Identitas
Diidentifikasi dengan tata nama yang meliputi nama ekstrak, nama latin tumbuhan, bagian tumbuhan yang digunakan, dan nama Indonesia tumbuhan (Depkes, 2000).
b. Organoleptik
Diidentifikasi menggunakan panca indera untuk mengetahui bentuk, warna, bau, dan rasa (Depkes, 2000).
c. Pengukuran Kadar Sinensetin
Ekstrak ditimbang sebanyak 0,2 gram dilarutkan dalam etanol 96% dalam labu ukur 10 ml (larutan ekstrak 2%). Selanjutnya standar sinensetin 10 ppm ditotolkan pada plat KLT (ukuran 6x10 cm) dengan seri volume 10 µL; 30 µL;50µ L; dan 70 µL. Masing-masing ditotolkan pada titik totolan 1-4 secara berurutan dan sampel ekstrak 2% ditotolkan pada titik ke-5 dengan volume 20 µl. Plat KLT dieluasi dengan eluen metanol : etil asetat : toluen (5:40:55) yang telah jenuh didalam wadah yang tertutup rapat. Plat KLT kemudian dikeringkan dan dilihat bercak hasil elusi pada lampu UV dengan panjang gelombang 365 nm (British Pharmacopoeia Commission, 2009).
Plat KLT dimasukkan ke dalam alat TLC-Scanner (Camag) dan ditentukan luas area puncak bercak standar dan sampel pada panjang gelombang maksimum yang dikontrol melalui komputer dengan program software winCATS. Selanjutnya dibuat kurva kalibrasi dari perbandingan volume penotolan terhadap luas area puncak dan ditentukan persamaan regresinya. Persamaan regresi yang diperoleh digunakan untuk menentukan kadar sinensetin pada sampel ekstrak.
2. Parameter Non-Spesifik
a. Susut Pengeringan
24
UIN Syarif Hidayatullah Jakarta
diratakan dalam botol timbang dengan bantuan batang pengaduk, kemudian dimasukkan kedalam oven. Sebelumnya tutup botol timbang dibuka dan dikeringkan pada suhu 105oC hingga bobot tetap. Sebelum pengeringan, biarkan botol dalam keadaan tertutup dalam desikator pada suhu kamar (Depkes, 2000).
b. Kadar Abu Total
1 gram ekstrak yang telah digerus dan ditimbang, dimasukkan kedalam krus silikat yang telah dipijarkan dan ditara, kemudian diratakan. Pijarkan perlahan-lahan hingga arang habis, dinginkan, timbang (Depkes, 2000).
3.3.4Penyiapan Hewan Uji
Sebelum digunakan untuk penelitian, 36 tikus diaklitimasi selama 4 minggu agar dapat menyesuaikan diri dengan lingkungan baru. Selama aklitimasi, tikus diberi minum dan makanan standar G511 serta mengontrol kesehatan dan berat badan tikus.
3.3.5Rancangan Penelitian
Pada penelitian ini digunakan hewan uji tikus putih jantan yang dipilih secara acak sebanyak 36 ekor untuk dibagi menjadi 6 kelompok. Penentuan jumlah tikus dalam tiap kelompok dihitung berdasarkan rumus federer :
(n-1)(t-1) ≥ 15 Dimana :
(n-1)(6-1) ≥ 15 n = jumlah hewan uji
5n-5 ≥ 15 t = jumlah kelompok
5n ≥ 20 n≥ 4 ekor
25
UIN Syarif Hidayatullah Jakarta Tabel 3.1. Pembagian Kelompok Hewan Uji Berdasarkan Perlakuan (Raj C.D. et al., 2012)
Kelompok Jumlah Tikus Perlakuan
I 6 Kontrol normal, diberi minum dan
makanan standar selama 14 hari dan diberi NaCMC 1% selama 14 hari berikutnya.
II 6 Kontrol negatif, diberi pakan
hiperkolesterol selama 14 hari dan hanya diberikan minum dan makanan standar 14 hari berikutnya.
III 6 Kontrol positif, diberi pakan
hiperkolesterol selama 14 hari dan diberi suspensi simvastatin selama 14 hari berikutnya.
VI 6 Uji dosis 250 mg/kgBB, diberi pakan
hiperkolesterol selama 14 hari dan diberi suspensi ekstrak herba kumis kucing dosis 250 mg/kgBB tikus selama 14 hari berikutnya.
V 6 Uji dosis 500 mg/kgBB, diberi pakan
hiperkolesterol selama 14 hari dan diberi suspensi ekstrak herba kumis kucing dosis 500 mg/kgBB tikus selama 14 hari berikutnya.
VI 6 Uji dosis 1000 mg/kgBB, diberi pakan
hiperkolesterol selama 14 hari dan diberi suspensi ekstrak herba kumis kucing dosis 1000 mg/kgBB tikus selama 14 hari berikutnya.
3.3.6Perhitungan Dosis dan Pembuatan Larutan Uji 1. Dosis ekstrak etanol 96% herba kumis kucing
26
UIN Syarif Hidayatullah Jakarta 2. Pembuatan suspensi NaCMC 1%
NaCMC 1 g didispersikan dalam aquadest hangat sebanyak 20 ml hingga homogen di dalam lumpang, kemudian di tambahkan aquadest hingga 100 ml.
3. Dosis simvastatin sebagai kontrol positif
Dosis simvastatin yang digunakan untuk manusia adalah 5-10 mg/hari. Dosis yang digunakan untuk penelitian yaitu 10 mg/hari. Konversi dosis manusia ke dosis tikus ditentukan berdasarkan rumus HED adalah 1,03 mg/kgBB (Lampiran 11). Simvastatin diberikan melalui oral dalam bentuk suspensi.
4. Pembuatan makanan hiperkolesterol
Kuning telur 80%
Larutan sukrosa 65% 15%
Lemak hewan 5%
Makanan hiperkolesterol dibuat dalam bentuk emulsi, semua bahan dicampur dan diaduk hingga homogen. Makanan dibuat baru setiap hari. Volume administrasi oral yang diberikan adalah 2 ml/200gramBB tikus. Pakan dibuat dengan total volume 100 ml, perhitungan komposisi pakan sebagai berikut :
Kuning telur : 80 g / 100 ml x 100 ml = 80 g Larutan sukrosa 65% : 15 g / 100 ml x 100 ml = 15 g Lemak hewan : 5 g / 100 ml x 100 ml = 5 g
3.3.7Uji Efek Antihiperkolesterolemia
1. Semua tikus setiap hari diberikan makanan standar 20 g/tikus dan aquadest. 2. Sebelum pemberian pakan hiperkolesterol, diambil darah masing-masing
tikus dan dilakukan pengukuran kadar kolesterol total.
27
UIN Syarif Hidayatullah Jakarta
4. Pada hari ke-15, semua tikus yang telah hiperkolesterolemik diambil darahnya untuk pemeriksaan kadar kolesterol total darah setelah pemberian pakan hiperkolesterol.
5. Pada hari selanjutnya semua kelompok diberi perlakuan sesuai dengan pembagian kelompok hewan uji (Tabel 3.1)
6. Pada hari ke-29, diambil darah masing-masing tikus untuk pemeriksaan kadar kolesterol total darah setelah pemberian ekstrak.
3.3.8Cara Pengambilan Darah
Tikus dipuasakan ± 12 jam sebelum pengambilan darah. Pengambilan darah dilakukan sebanyak 3 kali, yaitu sebelum pemberian pakan hiperkolesterol (hari 0), setelah pemberian pakan hiperkolesterol (hari ke-15) dan setelah pemberian ekstrak (hari ke-29).
Darah tikus diambil dengan cara tikus di anastesi menggunakan eter didalam tempat khusus, kemudian diambil darah tikus pada bagian pleksus retro-orbital menggunakan mikrohematokrit bersih (Raj C.D. et al., 2012). Darah yang mengalir melalui mikrohematokrit ditampung dengan tabung EDTA 3 ml. Darah didiamkan 15 menit dalam suhu ruangan. Kemudian darah di sentrifugasi pada kecepatan 3000 rpm selama 15 menit untuk mendapatkan plasma darah. Plasma darah dipindahkan ke dalam sample tube 1,5 ml dan disimpan dalam lemari pendingin suhu -20oC.
3.3.9Pengukuran Kadar Kolesterol Total Darah
Kadar kolesterol total tikus diukur menggunakan spektrofotometer UV-Vis pada panjang gelombang 500 nm.
Tabel 3.2. Analisa kadar kolesterol total (Elitech, 2014):
Blanko Standar Uji
Reagen 1000 µl 1000 µl 1000 µl
Aquadest 10 µl - -
Standar - 10 µl -
28
UIN Syarif Hidayatullah Jakarta
Kadar kolesterol total tikus ditentukan dengan rumus :
Keterangan : A = Absorbansi
3.3.10Uji Statistik
Data yang diperoleh dianalisis secara deskriptif, uji statistik homogenitas menggunakan Levene dan uji normalitas menggunakan
Kolmogorov-Smirnov test. Apabila hasil sebaran data normal, maka untuk melihat perbedaan kadar dari masing-masing kelompok perlakuan dianalisis dengan uji statistik One way ANOVA.
Hipotesis :
Ho : tidak ada perbedaan yang bermakna antara setiap kelompok Ha : terdapat perbedaan yang bermakna antara setiap kelompok Pengambilan keputusan :
Bila nilai signifikansi ≤ 0,05 Ho ditolak, berarti terdapat perbedaan
Bila nilai signifikansi ≥ 0,05 Ho diterima, berarti tidak terdapat perbedaan (Santoso, 2009).
A sampel
A standar
29
UIN Syarif Hidayatullah Jakarta BAB IV
HASIL DAN PEMBAHASAN 4.1 Determinasi Tanaman
Berdasarkan hasil determinasi yang dilakukan di Pusat Konservasi Tumbuhan Kebun Raya Bogor – LIPI (Lembaga Ilmu Pengetahuan Indonesia) menunjukkan bahwa jenis simplisia yang digunakan pada penelitian adalah Orthosiphon stamineus Benth suku Lamiaceae (Lampiran 2). Determinasi dilakukan dengan tujuan untuk memastikan jenis simplisia yang digunakan dalam penelitian.
4.2 Hasil Ekstraksi Herba Kumis Kucing (Orthosiphon stamineus Benth.)
Dari 1500 gram serbuk herba kumis kucing yang diekstraksi, diperoleh ekstrak kental sebanyak 133 gram dari hasil remaserasi sebanyak 11 kali. Berdasarkan hasil perhitungan, rendemen yang diperoleh yaitu sebesar 8,87% (lampiran 7).
Metode ekstraksi yang digunakan adalah metode maserasi yang dipilih karena metode maserasi lebih sederhana dalam preparasi dan pengerjaannya dibandingkan metode lain. Metode ini juga baik digunakan untuk mengekstraksi senyawa-senyawa yang tidak tahan dengan pemanasan.
Etanol 96% dipilih sebagai pelarut untuk ekstraksi karena etanol merupakan pelarut semipolar yang dapat menarik senyawa polar dan non-polar yang terkandung dalam simplisia serta dapat menarik senyawa-senyawa dengan bobot molekul rendah seperti saponin dan flavonoid (Wijasekera, 1991 dikutip dari Arifianti et al. 2014). Selain itu, etanol 96% dapat menghasilkan ekstrak dengan kadar sinensetin tertinggi dibanding alkohol 50% dan 70% (Arifianti et al., 2014). Sinensetin merupakan salah satu senyawa golongan flavonoid yang menjadi senyawa marker dalam tanaman kumis kucing (Himani et al., 2013) dan juga memiliki peran dalam metabolisme lipid dalam jaringan adiposa (Kang S.I., Shin H.S., and Kim S.J., 2015).
30
UIN Syarif Hidayatullah Jakarta 4.3 Hasil Pengujian Parameter Ekstrak
Tabel 4.1. Hasil pengujian parameter ekstrak
No Parameter Ekstrak
1 Spesifik
Orthosiphon stamineus Benth Herba
Pengujian parameter spesifik ekstrak yang dilakukan adalah penentuan identitas, identifikasi organoleptik dan pengukuran kadar sinensetin ekstrak. Identitas ekstrak dapat diketahui dari hasil determinasi tanaman. Ekstrak dibuat dari herba kumis kucing yang terdiri dari seluruh bagian tanaman yang tumbuh diatas tanah. Organoleptis ekstrak diidentifikasi menggunakan panca indera.
31
UIN Syarif Hidayatullah Jakarta
ekstrak herba kumis kucing yang terdiri dari semua bagian tanaman yang berada diatas tanah, sedangkan sinensetin lebih banyak terdapat dalam ekstrak daun (Olah et al., 2003). Beberapa faktor lain seperti bagian tanaman yang diambil, umur tanaman, kondisi tempat tumbuh, waktu pemanenan dan proses pengeringan simplisia juga dapat mempengaruhi kadar senyawa kimia dalam tanaman (Wulandari, 2011).
Secara kualitatif dapat dilihat bercak yang berfluororesensi biru pada sinar UV panjang gelombang 365 nm. Bercak sinensetin dalam ekstrak terletak pada Rf 0,53 dan bercak standar 1, 2, 3 dan 4 sinensetin secara berurutan terletak pada Rf 0,53; 0,49; 0,49; dan 0,50. Perhitungan kadar sinensetin dan kurva kalibrasi standar dapat dilihat pada lampiran 8.
Pengujian parameter non-spesifik ekstrak meliputi susut pengeringan dan kadar abu total. Pengukuran susut pengeringan ekstrak dilakukan untuk memastikan batasan maksimal (rentang) tentang besarnya senyawa yang hilang pada proses pengeringan simplisia dan proses pengentalan ekstrak. Pengukuran kadar abu total bertujuan untuk memberikan gambaran kandungan mineral internal dan eksternal didalam ekstrak.
Hasil susut pengeringan adalah sebesar 0,948% dan kadar abu total sebesar 12,587%. Standar susut pengeringan ekstrak kumis kucing adalah tidak lebih dari 10% dan kadar abu total tidak lebih dari 9% (Depkes, 2008). Rendahnya nilai susut pengeringan pada ekstrak menjelaskan bahwa senyawa yang hilang pada proses pengeringan simplisia dan proses pengentalan ekstrak sangat kecil. Tingginya kadar abu ekstrak dapat dikarenakan tingginya kandungan mineral internal (seperti kalium) pada tanaman kumis kucing (Himani et al., 2014), ataupun mineral eksternal yang bisa saja bercampur dengan ekstrak saat proses pengerjaan pengujian kadar abu ekstrak. Faktor lain yang dapat mempengaruhi kadar mineral dalam ekstrak seperti perbedaan genetik, tempat tumbuh, proses sortasi basah dan sortasi kering. Perhitungan uji parameter ekstrak dapat dilihat pada lampiran 7.
32
UIN Syarif Hidayatullah Jakarta 4.4 Hasil Uji Penapisan Fitokimia
Penapisan fitokimia dilakukan terhadap ekstrak herba kumis kucing dengan tujuan untuk mengetahui kandungan senyawa yang ada dalam ekstrak herba kumis kucing. (Lampiran 6)
Tabel 4.2. Hasil Penapisan Fitokimia Ekstrak Herba Kumis Kucing
Golongan Hasil
Alkaloid -
Flavonoid +
Saponin +
Tanin +
Steroid +
Dari hasil pengujian penapisan fitokimia diketahui bahwa ekstrak herba kumis kucing mengandung senyawa, flavonoid, saponin, steroid, terpenoid dan tanin. Menurut Himani et al., (2013) tanaman kumis kucing banyak mengandung flavon, polifenol, protein aktif, glikosida, minyak atsiri dan kalium serta sedikit senyawa terpenoid. Sedangkan Wulandari (2011) dalam penelitiannya menyatakan bahwa kandungan kimia ekstrak daun kumis kucing adalah saponin, flavonoid dan polifenol.
Senyawa golongan flavonoid yang terkandung dalam ekstrak herba kumis kucing diduga merupakan senyawa utama yang berperan aktif dalam menurunkan kadar kolesterol. Umbare et al. (2009) menyebutkan bahwa senyawa utama dari ekstrak hidro-alkohol kumis kucing adalah senyawa golongan flavonoid yang memberikan efek antihiperlipidemia. Rajasekaran, Anandan, and Nishad (2013) juga menjelaskan bahwa flavonoid dan polifenol dapat menurunkan kadar kolesterol LDL dan VLDL, trigliserida serta meningkatkan kadar kolesterol HDL serum. Faizah et al. (2009) menyatakan bahwa Trimethylapigenin, Eupatorin dan Tetramethylluteolin
33
UIN Syarif Hidayatullah Jakarta
Menurut Nijveldt et al. (2001) reaktivitas yang tinggi dari kelompok hidroksil flavonoid dapat mengikat radikal dan membuat radikal reaktif menjadi tidak aktif. Kemampuan flavonoid dalam mengikat radikal dapat mencegah oksidasi LDL secara invitro dan secara teoritis flavonoid mungkin memiliki kemampuan preventif terhadap aterosklerosis. Luteolin dapat menginduksi sekresi kolesterol dan mereduksi kadar kolesterol. Mekanisme efek secara tidak langsung dari flavonoid diduga mengatur jaringan kompleks dari aktivitas HMG-Koa reduktase.
Reaksi yang terjadi antara flavonoid dan radikal sebagai berikut (Nijveldt et al., 2001) :
Flavonoid (OH) + R+> Flavonoid (O+) + RH
Senyawa golongan polifenol dan saponin juga diketahui dapat menurunkan kadar kolesterol. Menurut Umarudin dkk. (2012) Tanin merupakan golongan senyawa polifenol yang berperan sebagai antioksidan. Polifenol dilaporkan mampu menurunkan kadar kolesterol total dan menghambat pembentukan aterosklerosis melalui efek antioksidannya terhadap oksidasi kolesterol LDL serta dapat meningkatkan produksi nitrat oksida (NO). Nitrat oksida merupakan vasodilator endogen yang mempunyai kemampuan sebagai antiaterosklerosis. Menurut Chang et al. (2001), beberapa turunan tanin dari herbal tradisional diketahui efektif dalam penghambatan HMG-Koa reduktase yang mungkin dapat menjadi agen hipolipidemia.
34
UIN Syarif Hidayatullah Jakarta
asam empedu dan menyebabkan kehilangan asam empedu yang diimbangi oleh peningkatan konversi kolesterol menjadi asam empedu dalam hati.
4.5 Hasil Uji Pengukuran Kadar Kolesterol
Pada penelitian ini digunakan tikus putih jantan sebagai hewan uji karena mudah dipelihara, relatif sehat dan cocok untuk berbagai macam penelitian (Malole & Sri, 1989) dan tidak begitu fotofobik seperti halnya mencit (Harmita & Maksum, 2004).
Tikus diaklitimasi selama dua minggu agar dapat menyesuaikan diri dengan lingkungan tempat penelitian. Tikus diberikan makanan standar G511 20 gram/tikus/hari dan aquadest 25 ml/tikus/hari. Selama proses aklitimasi, dilakukan pemantauan aktivitas dan kondisi fisik tikus, menimbang berat badan serta membersihkan kandang tikus. Penimbangan berat badan tikus dilakukan setiap 3 hari sekali selama masa aklitimasi hingga perlakuan akhir. Selama masa penelitian, berat badan tikus menunjukkan kenaikan setiap harinya. Grafik kenaikan berat badan tikus dapat dilihat pada lampiran 14. Kenaikan berat badan tikus setelah diberi induksi pakan hiperkolesterol dan setelah masa pemberian ekstrak tidak menunjukkan perbedaan yang bermakna berdasarkan hasil uji statistik (Lampiran 16). Hal ini menunjukkan bahwa pemberian pakan hiperkolesterol dan ekstrak uji yang digunakan dalam penelitian, tidak mempengaruhi kenaikan berat badan tikus.
Setelah masa aklitimasi, tikus dikelompokkan menjadi 6 kelompok yang terdiri dari kelompok kontrol normal, kontrol negatif, kontrol positif, uji dosis 250 mg/kgBB, uji dosis 500 mg/kgBB, dan uji dosis 1000 mg/kgBB. Masing-masing kelompok terdiri dari 6 ekor tikus.
35
UIN Syarif Hidayatullah Jakarta
pensuspensi dalam menurunkan kadar kolesterol total tikus. Larutan pensuspensi simvastatin dan ekstrak yang digunakan dalam penelitian ini adalah suspensi NaCMC 1%. Kelompok kontrol negatif berguna untuk membandingkan penurunan kadar kolesterol total tikus setelah pemberian pakan hiperkolesterol dihentikan pada semua kelompok tikus. Sedangkan kontrol positif berguna untuk membandingkan efektivitas penurunan kadar kolesterol oleh simvastatin dengan ekstrak uji. Dosis simvastatin yang digunakan adalah 10 mg untuk manusia. Dosis ini kemudian dikonversi ke dosis hewan menggunakan rumus HED (Lampiran 11).
Metode yang digunakan untuk uji penurunan kadar kolesterol darah tikus yaitu dengan cara tikus dibuat hiperkolesterol yang diinduksi dengan pemberian makanan hiperkolesterol dengan komposisi makanan yang terdiri dari kuning telur (80%), larutan sukrosa 65% dalam air (15%), dan lemak hewan (5%) (Purwanti, 2012). Komposisi makanan hiperkolesterol tersebut dipilih karena mengandung lemak yang tinggi sehingga dapat meningkatkan kadar kolesterol dan trigliserida. Ayuningtyas dan Arifah (2012) menyebutkan pada penelitian sebelumnya, bahwa penambahan lemak dalam pakan dapat meningkatkan kadar kolesterol total dan trigliserida tikus. Tikus diinduksi dengan makanan hiperkolesterol selama 14 hari terhadap semua kelompok perlakuan kecuali kelompok normal. Selanjutnya tikus diberikan suspensi ekstrak uji dalam berbagai dosis. Metode ini digunakan karena merupakan metode yang mudah dan umum digunakan pada uji efek penurunan kadar kolesterol total darah tikus.
Pengukuran kadar kolesterol total darah tikus dilakukan dengan metode enzimatis menggunakan spektrofotometer. Plasma darah yang diperoleh setelah disentrifugasi kemudian ditambahkan larutan pereaksi kolesterol sehingga terjadi reaksi seperti berikut :
Cholesterol ester + H2O
Cholesterol esterase
Cholesterol ester + Fatty acids
Cholesterol ester + O2
Cholesterol oxidase
Cholest-4-en-3-one + H2O2
2H2O2+ Phenol + 4-Aminoantipyrine
Poroxidase
36
UIN Syarif Hidayatullah Jakarta
Warna merah muda yang terbentuk dalam larutan adalah hasil dari pembetukan kompleks Quinoneimine yang kemudian diukur serapannya dengan spektrofotometer UV pada panjang gelombang 500 nm (Elitech, 2014).
Pengukuran kadar kolesterol total darah tikus dilakukan sebanyak tiga kali yaitu kadar kolesterol total sebelum pemberian makanan hiperkolesterol (hari ke-0), kadar kolesterol total setelah pemberian makanan hiperkolesterol (hari ke-15), dan kadar kolesterol total setelah pemberian ekstrak uji (hari ke-29).
Pengukuran kadar kolesterol total darah hari ke-0 dilakukan untuk membandingkan kadar kolesterol total tikus sebelum diberikan makanan hiperkolesterol dengan kadar kolesterol total tikus setelah diberikan makanan hiperkolesterol. Data ini digunakan untuk mengetahui efektivitas makanan hiperkolesterol yang diberikan kepada tikus dalam menaikkan kadar kolesterol total tikus yang diberikan makanan hiperkolesterol. Sedangkan data kadar kolesterol total setelah pemberian makanan hiperkolesterol digunakan untuk membandingkan penurunan kadar kolesterol total tikus yang telah hiperkolesterolemik dengan kadar kolesterol total tikus setelah diberikan ekstrak uji.
Hasil uji normalitas (one-sample Kolmogorov-smirnov Test) menunjukkan kadar kolesterol total darah tikus terdistribusi normal (p≥0,05) dan pada uji homogenitas (Levene) menunjukkan kadar kolesterol total
darah bervariasi homogen (p≥0,05), karena syarat normalitas dan homogenitas sudah terpenuhi maka analisa statistik dilanjutkan dengan uji
One-way ANOVA. Hasil uji statistik One-way ANOVA menunjukkan terdapat perbedaan yang bermakna (signifikan) pada semua kelompok uji
37
UIN Syarif Hidayatullah Jakarta Tabel 4.3. Rata-rata kadar kolesterol
Kelompok Perlakuan Rata-Rata Kadar Kolesterol (mg/dl) ± SD
Hari Ke-0 Hari Ke-15 Hari Ke-29
Tabel 4.4. Persentase penurunan kadar kolesterol (%)
Kelompok Perlakuan
Positif 147,755% 45,181%
Dosis 250 mg/kgBB 63,365% 37,701%
Dosis 500 mg/kgBB 129,652% 48,042%
Dosis 1000 mg/kgBB 89,694% 31,662%