SKRIPSI
MEMPELAJARI TOKSISITAS MINUMAN SEDUHAN
BUBUK DAUN KUMIS KUCING (Orthosiphon stamineus Benth.) TERHADAP TIKUS PERCOBAAN SECARA IN VIVO
Oleh
INGGRID KUSUMANINGRUM
F24101114
2005
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Inggrid Kusumaningrum. F24101114. Mempelajari Toksisitas Minuman Seduhan Bubuk Daun Kumis Kucing (Orthosiphon stamineus Benth.) terhadap Tikus Percobaan Secara In Vivo. Di bawah bimbingan : Ir. Didah Nur Faridah, MSi. 2005
RINGKASAN
Kesadaran akan arti penting kesehatan yang telah dimiliki masyarakat Indonesia, dapat membantu dalam pengembangan produk-produk kesehatan. Kumis kucing merupakan salah satu jenis tanaman obat dan dapat dimanfaatkan sebagai minuman fungsional, karena di dalam tanaman kumis kucing mengandung senyawa polyphenol dan flavonoid yang dapat berfungsi sebagai antioksidan.
Tujuan dari penelitian ini adalah untuk mengetahui toksisitas minuman seduhan bubuk daun kumis kucing (Orthosiphon stamineus Benth.) dengan beberapa pengujian terhadap organ hati tikus percobaan secara in vivo, yaitu pengujian terhadap berat organ, berat tikus, kadar sitokrom P-420 dalam fraksi mikrosom serta aktivitas glutation S-transferase (GST) dalam fraksi sitosol hati tikus percobaan.
Penelitian ini dibagi menjadi tiga tahap, yaitu pembuatan bubuk daun kumis kucing dengan proses pengeringan menggunakan sinar matahari dan oven. Analisa kimia yang dilakukan pada bubuk daun kumis kucing yaitu analisa proksimat yang terdiri dari analisa kadar air, abu, protein, lemak dan karbohidrat. Tahap dua, yaitu pembuatan minuman seduhan bubuk daun kumis kucing dengan parameter yang diamati adalah total fenol dan aktivitas antioksidan. Tahap tiga adalah tahap pemberian minuman bubuk daun kumis kucing terhadap tikus percobaan.
Pada tahap perlakuan tikus percobaan, tikus dibagi menjadi tiga kelompok, yaitu kelompok kontrol, kelompok kumis kucing 1 (0.3 g/hari/200 berat tikus atau 0.012 g/ml) dan kelompok kumis kucing 2 (0.6 g/hari/200 berat tikus atau 0.024 g/ml). Tikus percobaan diberi perlakuan selama 28 hari. Sisa minuman diukur setiap hari, dan ransum standar yang diberikan diganti setiap hari. Sedangkan berat badan tikus ditimbang setiap dua hari sekali.
Dari hasil penelitian diperoleh kadar air bubuk daun kumis kucing kering matahari sebesar 7.00%, kadar abu sebesar 7.89%, kadar lemak, protein dan karbohidrat berturut-turut sebesar 17.41%, 5.09% dan 62.61%. Pada penelitian diketahui bahwa minuman seduhan bubuk daun kumis kucing dengan pengeringan matahari lebih baik dibandingkan dengan oven. Hal ini dapat dilihat dari aktivitas antioksidan bubuk daun kumis kucing kering matahari sebesar 1346.528 mM/gr bk sampel dengan total fenol sebesar 87.62 µg/gr bk sampel. Sedangkan aktivitas antioksidan dan total fenol dari bubuk daun kumis kucing kering oven berturut-turut sebesar 406.356 mM/gr bk sampel dan 14.085 µg/gr bk sampel.
Pemberian minuman seduhan bubuk daun kumis kucing pada tikus percobaan dapat meningkatkan aktivitas GST dalam hati. Aktivitas GST kelompok kontrol, Kk1 dan Kk2 berturut-turut sebesar 0.0491 nmol/min/mg protein, 0.0627 nmol/min/mg protein dan 0.053 nmol/min/mg protein.
MEMPELAJARI TOKSISITAS MINUMAN SEDUHAN
BUBUK DAUN KUMIS KUCING (Orthosiphonstamineus Benth.)
TERHADAP TIKUS PERCOBAAN SECARA IN VIVO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
INGGRID KUSUMANINGRUM
F24101114
2005
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI TOKSISITAS MINUMAN SEDUHAN
BUBUK DAUN KUMIS KUCING (Orthosiphon stamineus Benth.)
TERHADAP TIKUS PERCOBAAN SECARA IN VIVO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
INGGRID KUSUMANINGRUM
F24101114
Dilahirkan di Purwokerto pada tanggal 12 Agustus 1983 Tanggal lulus : 30 November 2005
Menyetujui, Bogor, Desember 2005
Ir. Didah Nur Faridah, MSi. Dosen Pembimbing
Mengetahui,
RIWAYAT HIDUP
Penulis bernama Inggrid Kusumaningrum, dilahirkan di Purwokerto pada tanggal 12 Agustus 1983 dari keluarga pasangan Bambang Prapto Wismono dan Ariati Arsyad. Penulis merupakan anak pertama dari tiga bersaudara. Pendidikan dasar penulis ditempuh pada tahun 1989-1995 di SDN Polisi V Bogor. Tahun 1995 penulis melanjutkan pendidikan di SLTP N 4 Bogor dan lulus pada tahun 1998. Kemudian pada tahun 1998-2001 penulis menempuh pendidikan di SMU N 2 Bogor.
Penulis diterima sebagai mahasiswa di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN) pada tahun 2001. Semasa kuliah penulis aktif dalam berbagai kegiatan akademis dan non akademis. Penulis pernah menjadi asisten praktikum Pengawasan Mutu tahun ajaran 2004/2005 dan asisten praktikum Teknologi Bumbu dan Rempah tahun ajaran 2004/2005.
Seminar/pelatihan yang pernah diikuti adalah Seminar Nasional Pangan dan Gizi “Aspek Gizi dan Keamanan Makanan Siap Saji” tahun 2004 dan Pelatihan Hazard Analysis Critical Control Point (HACCP) tahun 2005. Sedangkan kegiatan non akademis yang pernah diikuti adalah kepanitiaan Lomba Cepat Tepat Ilmu Pangan tingkat Nasional pada tahun 2003, Lepas landas Sarjana Fakultas Teknologi Pertanian IPB tahun 2003, penyambutan mahasiswa baru IPB tahun ajaran 2002/2003 dan Panitia penyambutan mahasiswa baru Fakultas Teknologi Pertanian tahun ajaran 2003/2004
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kepada Allah SWT yang senantiasa memberikan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini merupakan laporan hasil penelitian yang dilakukan selama kurang lebih lima bulan di Laboratorium Departemen Ilmu dan Teknologi Pangan.
Penyusunan skripsi ini tidak terlepas dari dukungan dan bantuan dari berbagai pihak. Oleh karena itu, pada kesempatan kali ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Ir. Didah Nur Faridah, MSi., selaku dosen pembimbing yang telah memberikan bimbingan, motivasi, pengarahan, dan saran selama penelitian, penyusunan dan penyelesaian skripsi penulis.
2. Research Grand dari Hibah Program B Departemen Ilmu dan Teknologi Pangan yang telah mendanai penelitian ini.
3. Dr. Ir. Nurheni Sri Palupi, MSi. dan Dr. Ir. Yadi Haryadi, MSc. selaku dosen penguji yang telah meluangkan waktu dan memberikan kritik serta saran demi kesempurnaan skripsi ini.
4. Mama atas kasih sayang, bimbingan dan kesabarannya dalam memberikan dukungan moril dan materil sehingga penulis dapat menyelesaikan skripsi ini.
5. Tito dan Farah yang selalu memberikan dukungan dan keceriaan (semoga kalian bisa cepat menjadi orang yang sukses).
6. Pande yang selalu membantu serta mendukung disaat senang dan susah (terimakasih banyak atas kebersamaannya yang tidak bisa dibalas dengan apapun).
7. Endi, Pande, Fanny, Fajar, Octa, Tantri, Wulan, Yuanita, Nia, Darta, Boby, Dery, Ale, Manda, Novi, Astri, Sigit, Sanjung, Mimi, Lukman, Vivin, Cristina dan semua teman-teman yang telah membantu selama penelitian.
9. Fanny, Irus, Pande, Endi, Lukman, atas kebersamaanya selama ini. Kalian adalah orang-orang yang tidak mungkin dilupakan (terimakasih teman-temanku).
10. Seluruh anak-anak golongan D TPG 38, terimakasih atas semangat yang telah diberikan selama beberapa tahun ini.
11. Iko, Yogi, Adit, Pikri, Nisa, Lena dan Lusi atas persahabatan kalian dari jaman kita SMA sampai sekarang.
12. Rekan-rekan seperjuangan : Mbak Nora dan Mbak Bembi atas kerjasama dan pengertiannya.
13. Kak Gede yang telah membantu dan memberi masukan selama penelitian berlangsung.
14. Mbak Cut, Mbak Reni, Bang Pandy, Mbak Rina, Mbak Uni dan Mbak Yun atas saran dan bantuannya.
15. Bu Rubiah, Teh Ida, Pak Wahid, Pak Adi, Pak Yahya, Pak Gatot, Pak Rojak, Pak Sobirin, Pak Koko, Pak Taufik, Mbak Yane, Pak Ganda, pak Mulya, Mbak Ratni dan semua pihak yang telah membantu selama penelitian.
16. Teman-teman TPG 38 atas kerjasama dan kebersamaannya.
17. Semua pihak yang tidak dapat disebutkan satu persatu yang terlibat dalam penelitian dan penyusunan skripsi ini.
Penulis memohon maaf apabila terdapat kesalahan yang penulis lakukan. Akhir kata, semoga karya kecil ini dapat bermanfaat bagi ilmu pengetahuan dan semua pihak yang membutuhkan. Semoga Tuhan selalu memberkati kita semua.
Bogor, November 2005
DAFTAR ISI
Halaman
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
I. PENDAHULUAN... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN... 2
II. TINJAUAN PUSTAKA ... 3
A. BOTANI DAN MANFAAT TANAMAN... 3
B. PENGERINGAN... 4
C. MEKANISME DETOKSIFIKASI SENYAWA BERACUN... 4
1. Absorpsi Toksikan ... 5
2. Distribusi Toksikan... 6
3. Metabolisme Toksikan... 6
a. Reaksi Fase Satu ... 7
b. Sitokrom P-420 ... 8
c. Reaksi Fase Dua... 9
d. Glutation S-Transferase... 10
4. Ekskresi Toksikan... 10
III. METODOLOGI PENELITIAN... 12
A. BAHAN DAN ALAT... 12
1. Bahan ... 12
2. Alat... 12
B. METODE PENELITIAN... 13
1. Pembuatan Bubuk Daun Kumis Kucing ... 13
2. Pembuatan Minuman Seduhan Bubuk Daun Kumis Kucing ... 13
3. Perlakuan Terhadap Tikus Percobaan ... 14
a. Pembuatan Ransum ... 14
c. Konsenterasi Minuman Seduhan untuk Tikus Percobaan .... 15
d. Terminasi Tikus Percobaan ... 15
C. PENGAMATAN ... 16
1. Analisia Kimia (Proksimat) Bubuk Daun Kumis kucing ... 17
a. Analisis Kadar Air ... 17
b. Analisis Kadar Abu... 17
c. Analisis Kadar Protein... 17
d. Analisis Kadar Lemak... 18
e. Analisis Kadar Karbohidrat ... 19
2. Analisis kimia Minuman Seduhan Bubuk Daun Kumis Kucing... 19
a. Analisis Total Fenol ... 19
b. Analisis Antioksidan ... 19
3. Analisis Organ Tikus Percobaan ... 20
a. Fraksinasi Sel ... 20
b. Pengukuran Kadar Protein... 21
c. Determinasi Kadar Sitokrom P-420 ... 22
d. Pengukuran Aktivitas Glutation S-Transferase ... 23
IV. HASIL DAN PEMBAHASAN... 25
A. BUBUK DAUN KUMIS KUCING ... 25
1. Pembuatan Bubuk Daun Kumis Kucing ... 25
2. Hasil Analisis Proksimat Bubuk Daun Kumis Kucing ... 26
B. MINUMAN SEDUHAN BUBUK DAUN KUMIS KUCING ... 28
1. Hasil Analisis Aktivitas Antioksidan ... 28
2. Hasil Analisis Total Fenol ... 30
C. PENGARUH PEMBERIAN MINUMAN SEDUHAN BUBUK DAUN KUMIS KUCING TERHADAP TIKUS PERCOBAAN ... 33
1. Berat Tikus Percobaan ... 34
2. Berat Relatif Organ ... 35
3. Kadar Protein Hati Tikus Percobaan ... 36
SKRIPSI
MEMPELAJARI TOKSISITAS MINUMAN SEDUHAN
BUBUK DAUN KUMIS KUCING (Orthosiphon stamineus Benth.) TERHADAP TIKUS PERCOBAAN SECARA IN VIVO
Oleh
INGGRID KUSUMANINGRUM
F24101114
2005
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Inggrid Kusumaningrum. F24101114. Mempelajari Toksisitas Minuman Seduhan Bubuk Daun Kumis Kucing (Orthosiphon stamineus Benth.) terhadap Tikus Percobaan Secara In Vivo. Di bawah bimbingan : Ir. Didah Nur Faridah, MSi. 2005
RINGKASAN
Kesadaran akan arti penting kesehatan yang telah dimiliki masyarakat Indonesia, dapat membantu dalam pengembangan produk-produk kesehatan. Kumis kucing merupakan salah satu jenis tanaman obat dan dapat dimanfaatkan sebagai minuman fungsional, karena di dalam tanaman kumis kucing mengandung senyawa polyphenol dan flavonoid yang dapat berfungsi sebagai antioksidan.
Tujuan dari penelitian ini adalah untuk mengetahui toksisitas minuman seduhan bubuk daun kumis kucing (Orthosiphon stamineus Benth.) dengan beberapa pengujian terhadap organ hati tikus percobaan secara in vivo, yaitu pengujian terhadap berat organ, berat tikus, kadar sitokrom P-420 dalam fraksi mikrosom serta aktivitas glutation S-transferase (GST) dalam fraksi sitosol hati tikus percobaan.
Penelitian ini dibagi menjadi tiga tahap, yaitu pembuatan bubuk daun kumis kucing dengan proses pengeringan menggunakan sinar matahari dan oven. Analisa kimia yang dilakukan pada bubuk daun kumis kucing yaitu analisa proksimat yang terdiri dari analisa kadar air, abu, protein, lemak dan karbohidrat. Tahap dua, yaitu pembuatan minuman seduhan bubuk daun kumis kucing dengan parameter yang diamati adalah total fenol dan aktivitas antioksidan. Tahap tiga adalah tahap pemberian minuman bubuk daun kumis kucing terhadap tikus percobaan.
Pada tahap perlakuan tikus percobaan, tikus dibagi menjadi tiga kelompok, yaitu kelompok kontrol, kelompok kumis kucing 1 (0.3 g/hari/200 berat tikus atau 0.012 g/ml) dan kelompok kumis kucing 2 (0.6 g/hari/200 berat tikus atau 0.024 g/ml). Tikus percobaan diberi perlakuan selama 28 hari. Sisa minuman diukur setiap hari, dan ransum standar yang diberikan diganti setiap hari. Sedangkan berat badan tikus ditimbang setiap dua hari sekali.
Dari hasil penelitian diperoleh kadar air bubuk daun kumis kucing kering matahari sebesar 7.00%, kadar abu sebesar 7.89%, kadar lemak, protein dan karbohidrat berturut-turut sebesar 17.41%, 5.09% dan 62.61%. Pada penelitian diketahui bahwa minuman seduhan bubuk daun kumis kucing dengan pengeringan matahari lebih baik dibandingkan dengan oven. Hal ini dapat dilihat dari aktivitas antioksidan bubuk daun kumis kucing kering matahari sebesar 1346.528 mM/gr bk sampel dengan total fenol sebesar 87.62 µg/gr bk sampel. Sedangkan aktivitas antioksidan dan total fenol dari bubuk daun kumis kucing kering oven berturut-turut sebesar 406.356 mM/gr bk sampel dan 14.085 µg/gr bk sampel.
Pemberian minuman seduhan bubuk daun kumis kucing pada tikus percobaan dapat meningkatkan aktivitas GST dalam hati. Aktivitas GST kelompok kontrol, Kk1 dan Kk2 berturut-turut sebesar 0.0491 nmol/min/mg protein, 0.0627 nmol/min/mg protein dan 0.053 nmol/min/mg protein.
MEMPELAJARI TOKSISITAS MINUMAN SEDUHAN
BUBUK DAUN KUMIS KUCING (Orthosiphonstamineus Benth.)
TERHADAP TIKUS PERCOBAAN SECARA IN VIVO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
INGGRID KUSUMANINGRUM
F24101114
2005
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI TOKSISITAS MINUMAN SEDUHAN
BUBUK DAUN KUMIS KUCING (Orthosiphon stamineus Benth.)
TERHADAP TIKUS PERCOBAAN SECARA IN VIVO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
INGGRID KUSUMANINGRUM
F24101114
Dilahirkan di Purwokerto pada tanggal 12 Agustus 1983 Tanggal lulus : 30 November 2005
Menyetujui, Bogor, Desember 2005
Ir. Didah Nur Faridah, MSi. Dosen Pembimbing
Mengetahui,
RIWAYAT HIDUP
Penulis bernama Inggrid Kusumaningrum, dilahirkan di Purwokerto pada tanggal 12 Agustus 1983 dari keluarga pasangan Bambang Prapto Wismono dan Ariati Arsyad. Penulis merupakan anak pertama dari tiga bersaudara. Pendidikan dasar penulis ditempuh pada tahun 1989-1995 di SDN Polisi V Bogor. Tahun 1995 penulis melanjutkan pendidikan di SLTP N 4 Bogor dan lulus pada tahun 1998. Kemudian pada tahun 1998-2001 penulis menempuh pendidikan di SMU N 2 Bogor.
Penulis diterima sebagai mahasiswa di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN) pada tahun 2001. Semasa kuliah penulis aktif dalam berbagai kegiatan akademis dan non akademis. Penulis pernah menjadi asisten praktikum Pengawasan Mutu tahun ajaran 2004/2005 dan asisten praktikum Teknologi Bumbu dan Rempah tahun ajaran 2004/2005.
Seminar/pelatihan yang pernah diikuti adalah Seminar Nasional Pangan dan Gizi “Aspek Gizi dan Keamanan Makanan Siap Saji” tahun 2004 dan Pelatihan Hazard Analysis Critical Control Point (HACCP) tahun 2005. Sedangkan kegiatan non akademis yang pernah diikuti adalah kepanitiaan Lomba Cepat Tepat Ilmu Pangan tingkat Nasional pada tahun 2003, Lepas landas Sarjana Fakultas Teknologi Pertanian IPB tahun 2003, penyambutan mahasiswa baru IPB tahun ajaran 2002/2003 dan Panitia penyambutan mahasiswa baru Fakultas Teknologi Pertanian tahun ajaran 2003/2004
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kepada Allah SWT yang senantiasa memberikan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini merupakan laporan hasil penelitian yang dilakukan selama kurang lebih lima bulan di Laboratorium Departemen Ilmu dan Teknologi Pangan.
Penyusunan skripsi ini tidak terlepas dari dukungan dan bantuan dari berbagai pihak. Oleh karena itu, pada kesempatan kali ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Ir. Didah Nur Faridah, MSi., selaku dosen pembimbing yang telah memberikan bimbingan, motivasi, pengarahan, dan saran selama penelitian, penyusunan dan penyelesaian skripsi penulis.
2. Research Grand dari Hibah Program B Departemen Ilmu dan Teknologi Pangan yang telah mendanai penelitian ini.
3. Dr. Ir. Nurheni Sri Palupi, MSi. dan Dr. Ir. Yadi Haryadi, MSc. selaku dosen penguji yang telah meluangkan waktu dan memberikan kritik serta saran demi kesempurnaan skripsi ini.
4. Mama atas kasih sayang, bimbingan dan kesabarannya dalam memberikan dukungan moril dan materil sehingga penulis dapat menyelesaikan skripsi ini.
5. Tito dan Farah yang selalu memberikan dukungan dan keceriaan (semoga kalian bisa cepat menjadi orang yang sukses).
6. Pande yang selalu membantu serta mendukung disaat senang dan susah (terimakasih banyak atas kebersamaannya yang tidak bisa dibalas dengan apapun).
7. Endi, Pande, Fanny, Fajar, Octa, Tantri, Wulan, Yuanita, Nia, Darta, Boby, Dery, Ale, Manda, Novi, Astri, Sigit, Sanjung, Mimi, Lukman, Vivin, Cristina dan semua teman-teman yang telah membantu selama penelitian.
9. Fanny, Irus, Pande, Endi, Lukman, atas kebersamaanya selama ini. Kalian adalah orang-orang yang tidak mungkin dilupakan (terimakasih teman-temanku).
10. Seluruh anak-anak golongan D TPG 38, terimakasih atas semangat yang telah diberikan selama beberapa tahun ini.
11. Iko, Yogi, Adit, Pikri, Nisa, Lena dan Lusi atas persahabatan kalian dari jaman kita SMA sampai sekarang.
12. Rekan-rekan seperjuangan : Mbak Nora dan Mbak Bembi atas kerjasama dan pengertiannya.
13. Kak Gede yang telah membantu dan memberi masukan selama penelitian berlangsung.
14. Mbak Cut, Mbak Reni, Bang Pandy, Mbak Rina, Mbak Uni dan Mbak Yun atas saran dan bantuannya.
15. Bu Rubiah, Teh Ida, Pak Wahid, Pak Adi, Pak Yahya, Pak Gatot, Pak Rojak, Pak Sobirin, Pak Koko, Pak Taufik, Mbak Yane, Pak Ganda, pak Mulya, Mbak Ratni dan semua pihak yang telah membantu selama penelitian.
16. Teman-teman TPG 38 atas kerjasama dan kebersamaannya.
17. Semua pihak yang tidak dapat disebutkan satu persatu yang terlibat dalam penelitian dan penyusunan skripsi ini.
Penulis memohon maaf apabila terdapat kesalahan yang penulis lakukan. Akhir kata, semoga karya kecil ini dapat bermanfaat bagi ilmu pengetahuan dan semua pihak yang membutuhkan. Semoga Tuhan selalu memberkati kita semua.
Bogor, November 2005
DAFTAR ISI
Halaman
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
I. PENDAHULUAN... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN... 2
II. TINJAUAN PUSTAKA ... 3
A. BOTANI DAN MANFAAT TANAMAN... 3
B. PENGERINGAN... 4
C. MEKANISME DETOKSIFIKASI SENYAWA BERACUN... 4
1. Absorpsi Toksikan ... 5
2. Distribusi Toksikan... 6
3. Metabolisme Toksikan... 6
a. Reaksi Fase Satu ... 7
b. Sitokrom P-420 ... 8
c. Reaksi Fase Dua... 9
d. Glutation S-Transferase... 10
4. Ekskresi Toksikan... 10
III. METODOLOGI PENELITIAN... 12
A. BAHAN DAN ALAT... 12
1. Bahan ... 12
2. Alat... 12
B. METODE PENELITIAN... 13
1. Pembuatan Bubuk Daun Kumis Kucing ... 13
2. Pembuatan Minuman Seduhan Bubuk Daun Kumis Kucing ... 13
3. Perlakuan Terhadap Tikus Percobaan ... 14
a. Pembuatan Ransum ... 14
c. Konsenterasi Minuman Seduhan untuk Tikus Percobaan .... 15
d. Terminasi Tikus Percobaan ... 15
C. PENGAMATAN ... 16
1. Analisia Kimia (Proksimat) Bubuk Daun Kumis kucing ... 17
a. Analisis Kadar Air ... 17
b. Analisis Kadar Abu... 17
c. Analisis Kadar Protein... 17
d. Analisis Kadar Lemak... 18
e. Analisis Kadar Karbohidrat ... 19
2. Analisis kimia Minuman Seduhan Bubuk Daun Kumis Kucing... 19
a. Analisis Total Fenol ... 19
b. Analisis Antioksidan ... 19
3. Analisis Organ Tikus Percobaan ... 20
a. Fraksinasi Sel ... 20
b. Pengukuran Kadar Protein... 21
c. Determinasi Kadar Sitokrom P-420 ... 22
d. Pengukuran Aktivitas Glutation S-Transferase ... 23
IV. HASIL DAN PEMBAHASAN... 25
A. BUBUK DAUN KUMIS KUCING ... 25
1. Pembuatan Bubuk Daun Kumis Kucing ... 25
2. Hasil Analisis Proksimat Bubuk Daun Kumis Kucing ... 26
B. MINUMAN SEDUHAN BUBUK DAUN KUMIS KUCING ... 28
1. Hasil Analisis Aktivitas Antioksidan ... 28
2. Hasil Analisis Total Fenol ... 30
C. PENGARUH PEMBERIAN MINUMAN SEDUHAN BUBUK DAUN KUMIS KUCING TERHADAP TIKUS PERCOBAAN ... 33
1. Berat Tikus Percobaan ... 34
2. Berat Relatif Organ ... 35
3. Kadar Protein Hati Tikus Percobaan ... 36
5. Aktivitas Glutation S-Transferase ... 40
V. KESIMPULAN DAN SARAN... 43
A. KESIMPULAN ... 43
B. SARAN ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
DAFTAR GAMBAR
Halaman Gambar 1. Orthosiphon stamineus Benth. ... 3 Gambar 2. Persamaan reaksi monooksigenase... 9 Gambar 3. Siklus toksikan dalam tubuh... 11 Gambar 4. Pengambilan organ tikus percobaan ... 17 Gambar 5. Diagram alir fraksinasi sel... 21 Gambar 6. Diagram alir pengukuran kadar protein ... 23 Gambar 7. Diagram alir determinasi kadar sitokrom P-420... 24 Gambar 8. Diagram alir pengukuran aktivitas Glutation S-Transferase... 25 Gambar 9. Bubuk daun kumis kucing (Orthosiphon stamineus Benth.) ... 26 Gambar 10. Grafik aktivitas antioksidan air seduhan daun kumis kucing
segar, bubuk daun kumis kucing kering matahari dan kering
oven... 29 Gambar 11. Grafik total fenol air seduhan daun kumis kucing segar,
bubuk daun kumis kucing kering matahari dan kering oven ... 31 Gambar 12. Perbandingan minuman seduhan bubuk daun kumis kucing dosis rendah (Kk 1) dan dosis tinggi (Kk 2) ... 32 Gambar 13. Tikus galur Sprague Dowley... 34 Gambar 14. Kurva peningkatan berat tikus selama perlakuan pada kelompok kontrol, kelompok konsenterasi rendah dan kelompok konsenterasi
tinggi ... . 35 Gambar 15. Berat relatif organ hati dan ginjal pada kelompok kontrol, kelompok
konsenterasi rendah dan kelompok konsenterasi tinggi... 36 Gambar 16. Grafik kadar sitokrom P420 pada kelompok kontrol, kelompok konsenterasi rendah dan kelompok konsenterasi tinggi... 39
Gambar 17. Grafik aktivitas GST pada kelompok kontrol, kelompok konsenterasi rendah dan kelompok konsenterasi tinggi... 41
DAFTAR LAMPIRAN
Halaman Lampiran 1. Pembuatan larutan ... 49 Lampiran 2. Komposisi kasein ... 51 Lampiran 3. Konversi pembuatan ransum tikus percobaan ... 51 Lampiran 4. Konversi dosis antar spesies untuk penetapan dosis pada
suatu spesies hewan/manusia ... 53 Lampiran 5. Dosis dasar jumlah penggunaan bubuk daun kumis kucing
untuk membuat seduhan ... 54 Lampiran 6. Konversi pembuatan minuman seduhan bubuk daun kumis kucing sebagai perlakuan pada tikus percobaan ... 55 Lampiran 7. Berat badan tikus percobaan ... 57 Lampiran 8. Minuman seduhan yang tersisa ... 59 Lampiran 9. Berat relatif organ tikus percobaan ... 62 Lampiran 10. Hasil absorbansi aktivitas antioksidan daun kumis kucing ... 63 Lampiran 11. Kurva standar (uji aktivitas antioksidan)... 64 Lampiran 12. Hasil analisis antioksidan air seduhan Orthosiphon stamineus
Benth. ... 64 Lampiran 13. Kurva standar (uji total fenol)... 65 Lampiran 14. Hasil analisis total fenol air seduhan Orthosiphon stamineus
Benth. ... 65
Lampiran 15. Kurva standar BSA... 66 Lampiran 16. Nilai absorbansi kurva standar BSA ... 66 Lampiran 17. Hasil absorbansi serapan P-420 dan protein dari fraksi
I. PENDAHULUAN
A. Latar Balakang
Sumber daya alam hayati Indonesia terutama tumbuhan sangat melimpah. Keanekaragaman hayati ini dapat dimanfaatkan untuk keperluan manusia, baik sebagai sumber pangan, obat, maupun pestisida. Indonesia merupakan negara yang mempunyai sumber kekayaan hayati nomor 2 di dunia setelah Brazil. Tercatat kurang lebih 30.000 jenis tanaman berbunga dan 2.500 diantaranya merupakan tanaman obat (Anonim 2000). Salah satu tanaman obat yang sudah sejak lama dimanfaatkan oleh masyarakat Indonesia salah satunya adalah tanaman kumis kucing (Orthosiphon stamineus Benth.).
Tanaman kumis kucing memiliki kadar air yang tinggi, hal ini menyebabkan komoditi tersebut tidak dapat disimpan dalam waktu yang lama. Agar komoditi tersebut memiliki daya simpan yang lama maka dapat diolah ke dalam bentuk bubuk dan dapat diaplikasikan dalam bentuk minuman seduhan yang bermanfaat untuk kesehatan.
Produk-produk kesehatan yang beredar di pasaran memiliki keunggulan masing-masing. Kesadaran akan arti penting kesehatan yang telah dimiliki masyarakat Indonesia, dapat membantu dalam pengembangan produk-produk kesehatan. Namun khasiat dari tanaman kumis kucing harus diuji lebih lanjut, seperti pengujian keamanan pangan sehingga diketahui aman atau tidak untuk dikonsumsi.
Konsumsi bahan pangan merupakan salah satu kebutuhan utama manusia dalam upaya mempertahankan dan menjalankan hidup serta kehidupan. Semua yang dikonsumsi manusia, baik yang berasal dari bahan pangan nabati maupun hewani, mengandung aneka ragam zat yang sungguh bermanfaat dan sangat diperlukan tubuh untuk menjalankan semua kegiatan. Tetapi terkadang dapat menimbulkan keadaan yang tidak diinginkan, seperti gejala sakit hingga kematian (Donatus, 2001).
metabolit yang berbeda dengan senyawa asalnya. Metabolisme xenobiotik melibatkan enzim fase I (sitokrom P450) dan enzim fase II (glutation S-transferase). Pada fase I terjadi reaksi reduksi, oksidasi dan hidrolisis kemudian dilanjutkan ke dalam reaksi fase II, yaitu reaksi konjugasi sehingga senyawa asing tersebut tidak berbahaya untuk kesehatan dan dapat diekskresikan.
Salah satu pengujian keamanan pangan yang cukup sensitif adalah pengukuran kadar sitokrom (fase I) dan aktivitas glutation S-transferase (fase II) yang terdapat pada organ hati. Kedua enzim tersebut sangat berperan dalam metabolisme senyawa asing (xenobiotik).
B. Tujuan
II. TINJAUAN PUSTAKA
A. BOTANI DAN MANFAAT TANAMAN KUMIS KUCING (Orthosiphon stamineus Benth.).
Tanaman kumis kucing berasal dari Afrika tropik kemudian menyebar ke wilayah Georgia, Kuba, Asia dan Australia tropik. Kumis kucing merupakan salah satu jenis tanaman obat.
Berdasarkan ilmu taksonomi, tata nama kumis kucing adalah sebagai berikut (Mahendra dan Kusuma, 2005) :
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Subkelas : Sympetalae Famili : Laminaceae Genus : Orthosiphon
Gambar 1. Orthosiphon stamineus Benth. (Anonim, 2005)
tabung bunga. Buah berupa buah kotak, bulat telur, masih muda berwarna hijau, setelah tua berwarna cokelat. Biji kecil, masih muda berwarna hijau, setelah tua berwarna hitam (Dalimartha, 2000).
Secara tradisional kumis kucing dapat digunakan sebagai obat untuk mengobati penyakit radang, peluruh kencing (diuretik), menghilangkan panas serta menghancurkan batu saluran ginjal. Kandungan kimia yang terdapat pada tanaman kumis kucing adalah orthosiphon, polyphenol, saponin, sapofonin, flavonoid, mioinositol, garam kalium (Dalimartha, 2000).
B. PENGERINGAN
Menurut Parker (2003), pengeringan produk pangan adalah suatu proses menghilangkan kandungan air pada produk tersebut. Proses pengeringan dapat menurunkan kelembaban dan mencegah berkembangnya mikroba. Pengeringan dapat dilakukan dengan beberapa metode, yaitu metode modern dan tradisional. Metode modern biasanya digunakan alat-alat tertentu seperti oven, drum drying, freeze drying, vacuum drying. Sedangkan pengeringan secara tradisional dapat dilakukan dengan menggunakan sinar matahari.
Menurut Fellow (1990), ketika udara panas berada di atas suatu produk pangan, panas akan langsung ditransfer pada permukaan produk. Pengeringan makanan merupakan suatu proses yang lambat. Waktu yang dibutuhkan untuk proses pengeringan dapat mencapai 6 sampai 8 jam bahkan lebih dan juga ditentukan oleh jenis produk (Parker, 2003).
C. MEKANISME DETOKSIFIKASI SENYAWA BERACUN
Toksikologi adalah ilmu yang mempelajari suatu kejadian yang dapat berpengaruh dan merugikan terhadap kesehatan mahluk hidup. Toksikologi merupakan kajian tentang pendeteksian yang memungkinkan adanya efek yang merugikan secara biologis, disebabkan oleh adanya toksikan di berbagai segmen siklus kehidupan manusia (Derelanko dan Hollinger, 1995).
sederhana dan ringkas, toksikologi didefinisikan sebagai kajian tentang hakikat dan mekanisme efek toksik berbagai bahan terhadap mahluk hidup dan sistem biologik lainnya.
Donatus (2001) menjelaskan bahwa toksikologi adalah ilmu yang mempelajari aksi berbahaya zat kimia atas sistem biologi. Hal ini menunjukkan bahwa obyek yang dipelajari dalam toksikologi adalah antaraksi zat kimia atau senyawa asing dengan sistem biologi atau mahluk hidup, dengan pusat perhatiannya terletak pada pengaruh berbahaya racun itu atas kehidupan mahluk hidup.
Mekanisme detoksifikasi adalah sistem pertahanan tubuh terhadap masuknya senyawa kimia asing (xenobiotik). Metabolisme senyawa asing/racun dapat diartikan sebagai perubahan hayati (biotransformasi) zat kimia toksik menjadi suatu metabolit yang secara nyata berbeda dengan zat kimia induknya (Donatus, 2001).
Menurut Donatus (2001), pertama kali mahluk hidup mengalami paparan dengan toksikan. Berikutnya, setelah mengalami absorpsi dari tempat paparannya maka toksikan atau metabolitnya akan terdistribusi ke tempat aksi tertentu yang ada di dalam mahluk hidup. Di tempat aksi ini kemudian terjadi interaksi antara toksikan atau metabolitnya dengan komponen penyusun sel sasaran atau reseptor sehingga timbul pengaruh berbahaya atau efek toksik dengan sifat tertentu.
Menurut Donatus (2001), toksisitas racun ditentukan oleh keberadaan racun di tempat aksi dan keadaan ini tergantung pada keefektifan absorpsi, distribusi serta eliminasi racun itu.
1. Absorpsi Toksikan
Mekanisme absorpsi suatu toksikan dapat digolongkan menjadi empat jenis, yaitu transpor pasif, filtrasi membran, transpor aktif serta endositosis (Hodgson dan Levi, 2000). Filtrasi biasanya terjadi untuk racun yang bermolekul kecil. Transport pasif merupakan mekanisme absorpsi yang paling penting bagi racun. Mekanisme ini berlangsung jika senyawa racun bersifat larut lipid dan dalam bentuk tidak terion. Sedangkan transpor aktif melibatkan karier (suatu protein) untuk memindahkan molekul melewati membran melawan perbedaan muatan. Selain filtrasi, transport pasif dan aktif, terdapat juga mekanisme endositosis. Pada mekanisme ini partikel-partikel dapat ditelan oleh sel. Bila partikel itu benda padat, prosesnya disebut fagositosis dan bila cairan disebut pinositosis (Lu, 1995).
2. Distribusi Toksikan
Setelah toksikan masuk ke dalam sirkulasi darah, maka toksikan tersebut akan didistribusikan atau disebar ke seluruh jaringan tubuh manusia (Donatus, 2001). Menurut Hodgson dan Levi (2000), cairan tubuh memegang peranan penting dalam pendistribusian toksikan dalam tubuh yang telah diabsorpsi.
Pada umumnya, biofase (tempat antara racun dan tempat aksi) tidak terdapat di dalam sirkulasi darah, melainkan berada di jaringan tertentu. Karena itu untuk memberikan pengaruh berbahaya atau efek toksiknya, suatu racun harus melintas banyak membran (Donatus, 2001).
3. Metabolisme Toksikan
Berlangsungnya metabolisme toksikan di dalam tubuh dapat terjadi di hati, ginjal, usus, kulit, kelenjar kelamin dan plasenta. Meskipun demikian, hati merupakan tempat metabolisme yang utama karena fungsi hati diantaranya mengelola sistem pembuluh darah dan sistem parenkim hati (Donatus, 2001).
menjadi organ utama yang terlibat. Sekitar 30 jenis enzim yang berbeda akan mengkatalisis berbagai reaksi yang terlibat dalam metabolisme xenobiotik.
Transformasi metabolik (biotranformasi) adalah suatu proses yang umumnya mengubah senyawa asal menjadi metabolit, kemudian membentuk konjugat. Metabolit dan konjugat lebih larut dalam air dan lebih polar, karenanya lebih mudah diekskresi. Dalam keadaan tertentu, metabolit dapat lebih toksik daripada senyawa asalnya. Laju dan jenis biotranformasi suatu toksikan berbeda antar spesies, bahkan berbeda dari satu strain ke strain lainnya (Lu, 1995).
Metabolisme xenobiotik terdiri dari dua fase. Pada fase satu, toksikan bersifat lipofilik akan ditransformasikan oleh enzim-enzim fase satu menjadi metabolit yang bersifat polar-reaktif grup. Pada fase dua, metabolit yang terbentuk akan dikonjugasi oleh enzim-enzim fase dua sehingga dihasilkan senyawa yang bersifat hidrofilik dan mudah diekskresikan ke luar tubuh (Hodgson dan Levi, 2000).
a. Reaksi Fase Satu
Reaksi fase satu meliputi oksidasi, reduksi, dan hidrolisis (Donatus, 2001). Semua reaksi fase satu menghasilkan metabolit atau merubah bentuk toksikan menjadi lebih polar sehingga dapat dikonjugasi dalam reaksi-reaksi fase dua (Hodgson dan Levi, 2000) dan mudah diekskresi baik secara langsung atau tidak langsung setelah mengalami reaksi fase satu. Menurut Donatus (2001), fungsi utama reaksi metabolisme fase I ialah mengubah struktur senyawa asing melalui proses oksidasi, reduksi atau hidrolisis, guna memasukkan gugus fungsional yang sesuai bagi reaksi konjugasi fase II.
dikatalisir oleh sistem enzim tersebut. Reaksi hidrolisis fase I pada jaringan mamalia mengandung sejumlah sitosolik enzim esterase dan amidase yang mampu menghidrolisis berturut-turut senyawa ester dan amida. (Donatus, 2001).
b. Sitokrom P-450
Enzim monooksigenase yang utama dalam retikulum endoplasma adalah sitokrom P-450. Diberi nama demikian karena enzim tersebut ditemukan ketika preparat mikrosom yang telah mengalami reduksi kimiawi dan kemudian terkompleks dengan karbon monoksida memperlihatkan suatu puncak yang khas pada 450 nm (Murray et al., 1999; Hodgson dan Levi, 2000).
Menurut Lu (1995), monooksigenase yang berkaitan dengan sistem sitokrom berada dalam retikulum endoplasma. Pada homogenat sel, retikulum endoplasma pecah menjadi vesikel kecil yang dikenal sebagai mikrosom. Di samping itu, oksidasi sejumlah toksikan dikatalisis oleh oksidoreduktase nonmikrosom yang berada dalam fraksi mitokondria.
Komponen penyusun sistem sitokrom P-450 mikrosomal meliputi sitokrom P-450, NADPH-sitokrom P-450 reduktase dan lipid yang terikat pada retikulum endoplasma halus (Donatus, 2001). Sitokrom P-450 merupakan hemoprotein, enzim ini terdapat secara luas pada semua spesies. Menurut Scenkman et al. (1991), salah satu karakteristik penting dari sitokrom P-450 adalah kemampuan merespon dengan cara menolak senyawa asing (xenobiotik).
Sitokrom P-450 terdapat dengan kadar yang tinggi di dalam hati terutama terdapat dalam membran retikulum endoplasma halus yang merupakan bagian fraksi mikrosomal. Dalam mikrosomal sel hati sitokrom P-450 bisa menyusun sampai 20% total protein (Murray et al., 1999).
Sitokrom P-450 juga dikenal dengan istilah monooksigenase atau Mix-Function Oxidase (MFO). Istilah ini berasal dari hasil reaksi oksidasi
bergabung dengan substrat (Lu, 1995; Murray et al., 1999; Hodgson dan Levi, 2000; Donatus, 2001).
RH + O2 +NADPH + H+ R OH + H2O + NADP Gambar 2. Persamaan reaksi monooksigenase (Jakoby et al, 1982;
Murray et al., 1999)
NADPH terlibat dalam mekanisme reaksi sitokrom P-450. Enzim yang menggunakan NADPH untuk menghasilkan bentuk tereduksi sitokrom P-450 dan terlihat dalam sisi sebelah kiri (penyumbang elektron) persamaan diatas (Gambar 2) dinamakan NADPH-sitokrom P-450 reduktase. (Murray et al., 1999; Hodgson dan Levi, 2000).
c. Reaksi Fase Dua
Dalam reaksi fase dua, senyawa yang terhidroksilasi atau senyawa lainnya yang diproduksi dalam fase satu, diubah oleh enzim yang spesifik menjadi berbagai metabolit polar lewat konjugasi dengan asam glukuronat, sulfat, asetat, glutation atau asam amino tertentu atau lewat metilasi. Reaksi konjugasi ini membuat molekul lebih bersifat dapat larut dalam air sehingga akhirnya dapat diekresikan ke dalam urin dan empedu (Murray et al., 1999). Reaksi fase II melibatkan aneka ragam enzim yang umumnya merupakan enzim sitosolik. Reaksi ini dikenal pula sebagai reaksi konjugasi, menyangkut penambahan gugus polar ke senyawa asing. Reaksi-reaksi pada fase dua merupakan reaksi biosintetik sehingga diperlukan energi. Hal ini berbeda dengan reaksi-reaksi pada fase satu yang tidak memerlukan energi (Donatus, 2001).
d. Glutation S-Transferase
Sejumlah xenobiotik elektrofilik yang potensial beracun (seperti karsinogen tertentu) akan terkonjugasi dengan glutation (GSH) nukleofilik dalam reaksi berikut, R + GSHO → R S G. Dimana R adalah xenobiotik elektrofilik. Enzim yang mengkatalisis reaksi ini disebut Glutation S-Transferase (GST) dan terdapat dalam sitosol sel hati dalam jumlah yang tinggi (Murray et al., 1999). Menurut Donatus (2001), pengikatan karbon elektrofil oleh gugus sulfhidril nukleofilik yang ada pada glutation dinamakan reaksi anion tiolat glutation (GT).
Reaksi tersebut membentuk ikatan tioeter antara atom karbon dan gugus sulfhidril glutation. Konjugat glutation yang terbentuk, selanjutnya oleh enzim yang terutama ada di ginjal, dipecah menjadi turunan sisteina. Berikutnya turunan sisteina itu terasetilkan menjadi N-asetil-sisteina (asam merkapturat), yang segera diekskresikan ke dalam urin (Donatus, 2001).
Menurut Murray et al (1999), sejumlah enzim GST terdapat dalam jaringan tubuh manusia. Enzim ini memperlihatkan spesifisitas substrat yang berbeda-beda dan dapat dipisahkan lewat elektroforesis serta teknik pemeriksaan lainnya. Jika xenobiotik yang potensial beracun itu tidak terkonjugasi, maka molekulnya akan berada dalam keadaan bebas yang membentuk ikatan kovalen dengan DNA, RNA atau protein sel dengan demikian dapat mengakibatkan kerusakan sel yang serius.
4. Ekskresi Toksikan
Setelah tahapan absorpsi dan distribusi dalam tubuh, toksikan dapat dikeluarkan dari tubuh (ekskresi) dengan cepat atau perlahan (Lu, 1995). Donatus (2001) menyatakan, ekskresi adalah perpindahan xenobiotik dari sirkulasi darah ke organ ekskresi.
Jalur utama ekskresi adalah melalui ginjal ke dalam urin, hati dan paru-paru (merupakan alat ekskresi penting untuk zat kimia jenis tertentu), empedu, air susu dan sejumlah jalur ekskresi lainnya (Lu, 1995; Donatus, 2001).
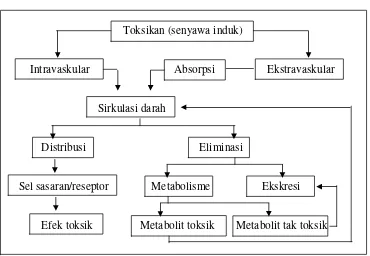
Toksikan (senyawa induk)
Intravaskular Absorpsi Ekstravaskular
Sirkulasi darah
Distribusi Eliminasi
Sel sasaran/reseptor Metabolisme Ekskresi
[image:35.612.137.507.154.410.2]Efek toksik Metabolit toksik Metabolit tak toksik
III. BAHAN DAN METODE
A. BAHAN DAN ALAT
1. Bahan
Bahan utama yang digunakan pada penelitian ini adalah tanaman kumis kucing (Orthosiphon stamineus Benth.) yang diperoleh dari Dramaga, Bogor, Jawa Barat.
Bahan-bahan yang digunakan pada analisis kimia bubuk daun kumis kucing adalah NaOH, HCl, H2SO4, HgO, K2SO4, larutan NaOH-Na2S2O3, H3BO3, heksan, indikator merah metil, etanol 95%, air bebas ion, folin, Na2CO3, asam tanat, buffer asetat 100 mM, DPPH, Trolox, metanol.
Bahan-bahan yang digunakan pada pembuatan ransum perlakuan tikus adalah kasein teknis, mineral mix, air, minyak nabati, tepung maizena, vitamin dan selulosa teknis. Bahan yang digunakan dalam pengambilan organ tikus adalah alkohol dan PBS (Phospat Buffer Saline).
Bahan-bahan kimia yang digunakan pada persiapan sampel/fraksinasi sel antara lain Tris, HCl, sukrosa dan EDTA. Dalam pengukuran kadar protein dari fraksi sitosol dan mikrosomal hati tikus digunakan BSA standar, larutan folin, CuSO4, NaK-Tartarat dan Na2CO3.10H2O. Untuk analisa kadar sitokrom P-450 digunakan gas karbon monooksida (CO), K2HPO4, dan natrium dithionate (Na2S2O4). Sedangkan untuk analisis aktivitas glutation S-transferase diperlukan 1-cloro-2,4-dinitrobenzen (CDNB), glutation tereduksi, etanol 90%, K2HPO4, dan KH2PO4.
2. Alat
serta analisa glutation S-transferase adalah mikropipet dan spektrofotometer UV-VIS double beam (Shimadzu UV 160).
B. METODE PENELITIAN
1. Pembuatan Bubuk Daun Kumis Kucing
Daun kumis kucing disortasi lalu ditimbang dan dicuci. Setelah itu dikeringkan dengan 2 metode, yaitu menggunakan sinar matahari dan oven (500C) hingga kadar air mencapai 7%. Kemudian daun kumis kucing yang telah kering dihancurkan menjadi serbuk dengan menggunakan blender.
2. Pembuatan Minuman Seduhan Bubuk Daun Kumis Kucing (Anonim, 2005; Aquarini, 2005).
Konsenterasi dasar yang digunakan berdasarkan konsenterasi bubuk daun kumis kucing untuk pencegahan infeksi kandung kemih, kencing batu dan infeksi saluran kemih, yaitu 3-10 gram/hari diseduh dengan 3.5 gelas air mendidih (770 ml). Berdasarkan Aquarini (2005), untuk konsumsi sehari-hari bubuk yang digunakan untuk pembuatan seduhan adalah 5.992525 g/hari/50 kg BB manusia (Lampiran 5). Hasil tersebut dikonversikan ke dalam 70 kg BB manusia berdasarkan pada tabel Lampiran 4 kemudian dikonversikan untuk kebutuhan tikus percobaan. Konsenterasi minuman seduhan dihitung berdasarkan berat badan tikus yang ditimbang setiap dua hari sekali.
Minuman perlakuan yang digunakan adalah minuman hasil seduhan dari bubuk daun kumis kucing. Proses pembuatan minuman perlakuan diawali dengan penimbangan sampel bubuk daun kumis kucing, jumlah bubuk daun kumis kucing dihitung berdasarkan berat badan tikus percobaan yang telah ditimbang sebelumnya (Lampiran 6).
3. Perlakuan Terhadap Tikus Percobaan
a. Pembuatan Ransum
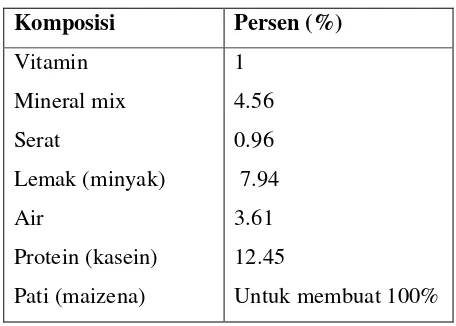
Ransum yang digunakan memiliki komposisi karbohidrat (maizena), lemak (minyak jagung), vitamin, protein (kasein), mineral mix, serat dan air dengan jumlah komposisi bahan-bahan tersebut di atas per seratus gram sebagaimana tertera pada Tabel 1.
Proses pembuatan ransum dimulai dengan menuangkan vitamin, mineral, selulosa, air dan sedikit pati dalam satu wadah, sedangkan dalam wadah lain dicampurkan minyak, kasein dan sisa pati. Setelah itu kedua campuran tersebut disatukan dalam wadah besar, lalu diaduk rata.
[image:38.612.182.410.401.564.2]Ransum perlakuan yang telah siap kemudian dimasukkan ke dalam LDPE yang telah diberi kode sesuai dengan kode perlakuan. Jumlah ransum per plastik adalah 21 gram dan siap diberikan kepada tikus percobaan.
Tabel 1.Komposisi ransum tikus.
Komposisi Persen (%)
Vitamin Mineral mix Serat
Lemak (minyak) Air
Protein (kasein) Pati (maizena)
1 4.56 0.96 7.94 3.61 12.45
Untuk membuat 100%
b. Penanganan Tikus Percobaan
dibedakan atas jumlah bubuk daun kumis kucing (dosis rendah dan dosis tinggi) yang diekstrak dan dijadikan minuman tikus percobaan setiap hari. Perlakuan yang dicobakan adalah sebagai berikut :
- Pemberian minuman kontrol (air putih biasa)
- Pemberian minuman ekstrak bubuk kumis kucing kadar rendah
- Pemberian minuman ekstrak bubuk kumis kucing kadar tinggi
Sebelum diberi perlakuan, tikus percobaan diadaptasikan terlebih dahulu selama 15 hari. Pada saat itu semua tikus diberi perlakuan ransum dan minuman sama yaitu ransum dan minuman kontrol (air putih). Setelah 15 hari, tikus percobaan mulai diberi perlakuan sesuai dengan kelompok yang telah ditentukan selama 28 hari. Pemberian ransum dilakukan secara ad libitum minimum sepersepuluh dari berat tikus. Pemberian perlakuan minuman dilakukan secara ad libitum sebanyak 40 ml berdasarkan hasil rata-rata sisa minum tikus percobaan selama masa adaptasi. Tikus ditimbang setiap dua hari sekali, sisa ransum ditimbang setiap hari dan sisa minuman diukur setiap hari.
c. Konsenterasi Minuman Seduhan untuk Tikus Percobaan
Konsenterasi minuman seduhan yang diberikan pada tikus percobaan terdiri dari konsenterasi rendah (Kk1) dan konsenterasi tinggi (Kk2). Kelompok Kk1 diberikan minuman seduhan dengan konsenterasi 2 kali konsenterasi normal, yaitu 0.3 g bubuk daun kumis kucing/hari/200 g berat tikus yang didapat dari perhitungan Lampiran 6. Sedangkan untuk kelompok Kk2 diberikan minuman seduhan dengan konsenterasi 4 kali konsenterasi normal, yaitu 0.6 g bubuk daun kumis kucing/hari/200 g berat tikus.
d. Terminasi Tikus Percobaan (Arisudana, 2003)
dibersihkan dengan alkohol. Selanjutnya lapisan peritonealnya dibuka untuk mengambil organ-organ dalam tikus, terlebih dahulu dilakukan pengambilan organ hati dan ginjal. Organ yang telah diambil kemudian dicuci dalam larutan PBS (Phosfat Buffer Saline), ditiriskan dan ditimbang. Organ-organ tersebut kemudian dibungkus dengan alumunium foil dan disimpan pada freezer –200C.
Gambar 4. Pengambilan organ tikus percobaan
C. PENGAMATAN
Pada penelitian pengamatan yang akan dilakukan dibagi menjadi tiga tahap, yaitu analisis proksimat bubuk daun kumis kucing, analisis kimia minuman seduhan bubuk daun kumis kucing dan analisis organ tikus percobaan. Pengamatan terhadap bubuk daun kumis kucing adalah pengamatan proksimat yang meliputi kadar air, kadar abu, kadar protein, lemak dan karbohidrat. Selain itu dilakukan juga pengamatan pada minuman seduhan bubuk daun kumis kucing, yaitu aktivitas antioksidan dan total fenol. Pengamatan terakhir yang dilakukan adalah pengamatan terhadap organ tikus percobaan yang meliputi analisis fraksinasi sel, pengukuran kadar protein, determinasi kadar sitokrom P-420 dan pengukuran aktivitas glutation S-transferase.
1. Analisis kimia (Proksimat) Bubuk Daun Kumis Kucing
a. Analisis Kadar Air, Metode Oven (AOAC, 1995)
Mula-mula cawan kosong dikeringkan dengan oven selama 15 menit dan didinginkan dalam desikator, kemudian ditimbang. Sebanyak 4-5 gram contoh dimasukkan dalam cawan yang telah ditimbang dan selanjutnya dikeringkan dalam oven bersuhu 100-105oC selama 6 jam. Cawan yang telah berisi contoh tersebut dipindahkan ke desikator, didinginkan, dan ditimbang. Pengeringan dilakukan kembali sampai diperoleh berat konstan. Kadar air dihitung berdasarkan kehilangan berat yaitu selisih berat awal dengan berat akhir.
Kadar air = (berat awal – berat akhir) x 100 % berat akhir
b. Analisis Kadar Abu, Metode Tanur (AOAC, 1995)
Pengukuran kadar abu ditentukan dengan alat tanur. Cawan porselin dipanaskan dahulu dalam oven, kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 3-5 g sampel dimasukkan dalam cawan porselin lalu dibakar sampai tidak berasap lagi dan diabukan dalam tanur suhu 550oC sampai berwarna putih (semua contoh menjadi abu) dan berat konstan. Setelah itu didinginkan dalam desikator dan ditimbang.
Kadar abu = berat abu x 100 % berat sampel
c. Analisis Kadar Protein, Metode Mikro-Kjeldahl (Apryantono, et al., 1989).
dididihkan selama 1-1,5 jam sampai cairan menjadi jernih. Dilakukan pendinginan cairan yang dihasilkan untuk kemudian ditambahkan 8-10 ml NaOH-Na2S2O3 dan dimasukan ke alat destilasi. Di bawah kondensor alat destilasi diletakkan erlenmeyer yang berisi 5 ml larutan H3BO3 dan beberapa tetes indikator merah metil. Ujung selang kondensor harus terendam larutan tersebut untuk menampung hasil destilasi sekitar 15 ml. Hasil destilasi kemudian dititrasi oleh HCl 0,02 M sampai terjadi warna abu-abu. Prosedur yang sama juga dilakukan terhadap blanko (yang tidak mengandung sampel).
Kadar N (%) = (a – b) x N HCl x 14,007 x 100 % mg sampel
Kadar Protein (%) = % N x 6,25 Keterangan :
a = ml titrasi HCl pada sampel b = ml titrasi HCl pada blanko
d. Analisis Kadar Lemak, Metode Soxhlet (AOAC, 1995)
Penetuan kadar lemak dilakukan berdasarkan metode ekstraksi Soxhlet. Labu takar dikeringkan dalam oven. Sampel ditimbang sebanyak 5 g dalam bentuk tepung dibungkus dengan kertas saring dan ditutup dangan kapas bebas lemak. Kertas saring berisi sampel diletakkan dalam alat ekstraksi sokhlet yang dirangkai dengan kondensor. Pelarut dietil/petroleum eter dimasukan ke dalam labu secukupnya kemudian dilakukan refluks selama minimal 5 jam (sampai bening). Labu takar akan berisi lemak hasil ekstraksi dan kemudian dipanaskan untuk menguapkan pelarut yang tercampur dengan lemak sampel.
e. Analisis Kadar Karbohidrat
Kadar karbohidrat pada bubuk daun kumis kucing yang diamati dihitung dengan by different, yaitu diketahui dengan cara 100% dikurangkan dengan nilai total dari kadar air, kadar abu, kadar protein dan lemak.
Karbohidrat = 100% - (kadar air + kadar abu + kadar protein + kadar lemak)
2. Analisis Kimia Minuman Seduhan Bubuk Daun Kumis Kucing
a. Pengukuran Total Fenol dengan Metode Chandler dan Dodds yang Dimodifikasi (Shetty et al., 1995)
Sebanyak 1 ml larutan minuman bubuk daun kumis kucing (penyimpanan 0 dan 24 jam) ditempatkan ke dalam tabung reaksi yang sudah berisi 1 ml etanol 95%, selanjutnya 5 ml air bebas ion ditambahkan ke dalam tabung tersebut, kemudian 0.5 ml folin-ciocalteu reagent 50% ditambahkan pada setiap sampel. Setelah 5 menit, ditambahkan 1 ml dari 5% Na2CO3 ke dalam tabung, lalu divorteks dan kemudian disimpan selama 60 menit di dalam ruang gelap. Sampel tersebut diambil serta divorteks kembali dan diukur absorbansinya pada λ 725 nm. Kurva standar dipersiapkan dengan menggunakan asam tanat di dalam 95% etanol. Larutan asam tanat dibuat dengan konsentrasi 5, 10, 25, 50, 100, 150 dan 200 mg/ml air bebas ion.
b. Pengujian Aktivitas Antioksidan (Kubo et al., 2002)
Trolox, sehingga satuannya dinyatakan dalam TEAC (Trolox Equivalent
Antioxidant Capacity). Pembuatan blanko alat sama dengan di atas tetapi
tanpa sampel dan DPPH. Sedangkan pembuatan blanko adalah sama seperti diatas tetapi tanpa sampel dan diganti dengan metanol.
3. Analisis Organ Tikus Percobaan
a. Fraksinasi Sel
Hati ditambahkan 0.25 M sukrosa-larutan 10 mM buffer Tris HCL (pH 7.5) dengan perbandingan 4 kali lipat berat hati lalu dihomogenasi dengan menggunakan mortar. Kemudian disentrifuse pada 11.000 x g selama 30 menit. Dihasilkan supernatan dan endapan.
Supernatan yang terbentuk disentrifuse kembali pada 105.000 x g selama 60 menit, dihasilkan supernatan ke dua (sitosol) dan endapan yang terbentuk dilarutkan dalam 0.25 sukrosa-10 mM buffer Tris-HCl-0.1 mM buffer EDTA (pH 7.5) (mikrosomal). Fraksi sitosol dan mikrosomal dianalisis kadar proteinnya dengan menggunakan metode Lowry.
Hati + 0.25 M sukrosa-larutan 10 mM buffer Tris- HCl (pH 7.5) (1 : 4)
Dihomogenisasi dengan menggunakan mortar
Disentrifuse dengan kecepatan 11000 x g selama 30 menit
Endapan Supernatan
Disentrifuse dengan kecepatan 105.000x g selama 60 menit
@ @
Supernatan Endapan
Dilarutkan dalam 0.25 sukrosa-10mM buffer Tris-HCl-0.1 mM buffer EDTA
[image:45.612.191.515.80.240.2]Sitosol Fraksi mikrosomal Gambar 5. Diagram alir fraksinasi sel
b. Pengukuran Kadar Protein, Metode Lowry (Apriyantono, et al., 1989)
Pada pengukuran protein dengan metode Lowry dibutuhkan pereaksi Natrium karbonat 2% dalam larutan NaOH 0.1N (1), tembaga sulfat 0.5% dalam larutan NaK-Tartarat 1% (2) (dibuat hanya pada waktu akan digunakan). Kemudian dicampurkan 50 ml pereaksi pertama dan 1 ml pereaksi ke dua (3) (hanya stabil 1 hari). Dibutuhkan juga pereaksi folin (dilarutkan dengan air 1 : 1), dan larutan protein standar 0.25 mg/ml BSA (Bovine Serum Albumin).
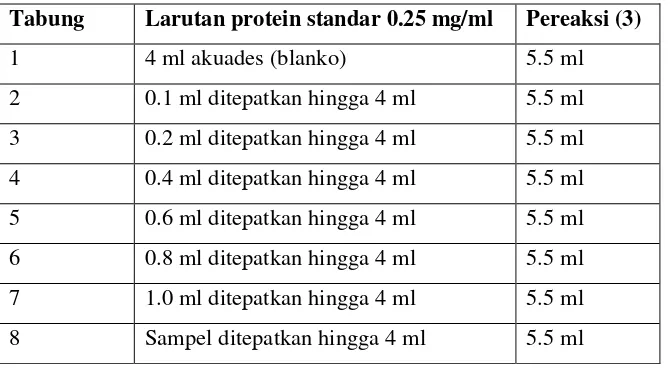
Tabel 2.Persiapan analisa pengukuran kadar protein
Tabung Larutan protein standar 0.25 mg/ml Pereaksi (3)
1 4 ml akuades (blanko) 5.5 ml
[image:45.612.176.512.507.691.2]Analisis diawali dengan pembuatan larutan standar, disiapkan 8 tabung reaksi. Persiapan dapat dilihat pada Tabel 2. Setelah dibiarkan selama 10 menit pada suhu kamar, kemudian ditambahkan pereaksi folin 0.5 ml ke dalam masing-masing tabung, kocok merata dengan cepat dan dibiarkan 30 menit. Pengukuran absorbansi dilakukan pada panjang gelombang 650 nm dan dibuat kurva standar sehingga konsentrasi larutan protein sampel dapat ditentukan.
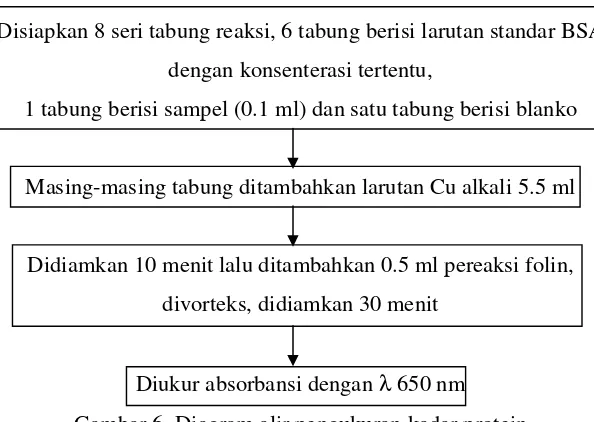
Disiapkan 8 seri tabung reaksi, 6 tabung berisi larutan standar BSA dengan konsenterasi tertentu,
1 tabung berisi sampel (0.1 ml) dan satu tabung berisi blanko
Masing-masing tabung ditambahkan larutan Cu alkali 5.5 ml
Didiamkan 10 menit lalu ditambahkan 0.5 ml pereaksi folin, divorteks, didiamkan 30 menit
[image:46.612.178.475.227.438.2]Diukur absorbansi dengan λ 650 nm Gambar 6. Diagram alir pengukuran kadar protein
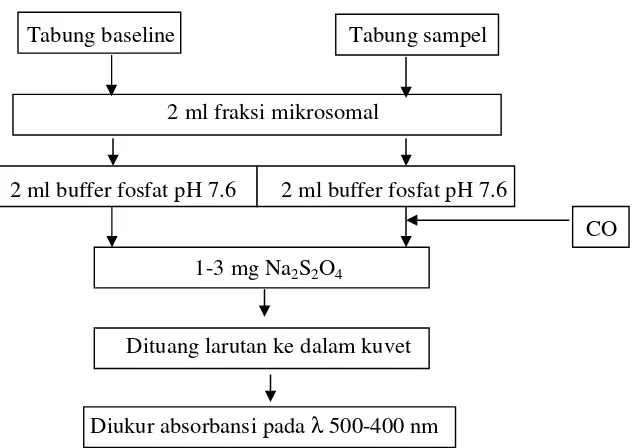
c. Determinasi Kadar Sitokrom P-420 (Omura dan Sato, 1964;
Opdycke, et al., 1982)
Tabung baseline Tabung sampel
2 ml fraksi mikrosomal
2 ml buffer fosfat pH 7.6 2 ml buffer fosfat pH 7.6
CO 1-3 mg Na2S2O4
Dituang larutan ke dalam kuvet
[image:47.612.196.512.89.313.2]Diukur absorbansi pada λ 500-400 nm
Gambar 7. Diagram alir determinasi Kadar Sitokrom P-420
Perhitungan :
Kadar sitokrom P-420 = A420 111 cm –1 mM –1 Kadar sitokrom = kadar sitokrom (mmol/ml) kadar protein (mg/ml)
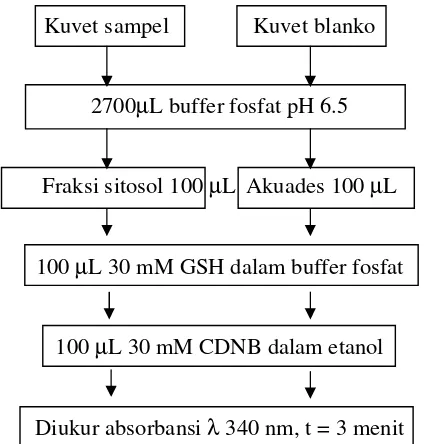
d. Pengukuran Aktivitas Glutation S-Transferase (Arisudana, 2003)
Aktivitas Glutation S-Transferase (GST) diukur dari fraksi sitosol hati tikus dengan menggunakan 2 substrat yakni 1-chloro-2,4-dinitrobenzen (CDNB) dan glutation dalam bentuk tereduksi (GSH). CDNB yang dibutuhkan mempunyai konsentrasi 1 mM dan GSH yang dibutuhkan 1 mM dalam 0.1 M buffer fosfat (pH 6.5).
fosfat. Sebelum diukur, ditambahkan 100 µL 30 mM CDNB dalam etanol. Total volume akhir dalam kuvet sebesar 3 ml. Aktivitas GST diukur pada panjang gelombang 340 nm selama 3 menit.
Kuvet sampel Kuvet blanko
2700µL buffer fosfat pH 6.5
Fraksi sitosol 100 µL Akuades 100 µL
100 µL 30 mM GSH dalam buffer fosfat
100 µL 30 mM CDNB dalam etanol
[image:48.612.210.423.153.375.2]Diukur absorbansi λ 340 nm, t = 3 menit Gambar 8. Diagram alir pengukuran aktivitas GST
Perhitungan :
Aktivitas GST = (♠ Absorbansi/menit)
εGS-DBN x kadar protein saat pengujian εGS-DBN = 9.6 cm –1 mM –1 *
IV. HASIL DAN PEMBAHASAN
A. BUBUK DAUN KUMIS KUCING
1. Pembuatan Bubuk Daun Kumis Kucing
Bubuk daun kumis kucing merupakan produk yang dapat dijadikan minuman seduhan. Produk ini dibuat sebagai alternatif minuman seduhan yang lazim dikonsumsi masyarakat (seperti seduhan daun teh) sebagai minuman fungsional. Bubuk daun kumis kucing ini dibuat dengan cara pengeringan daun segar dengan menggunakan sinar matahari dan oven, hingga kadar air mencapai 7%. Dari hasil perhitungan didapat bahwa rendemen hasil pengeringan daun kumis kucing segar menjadi bubuk daun kumis kucing adalah sebesar 20.43%.
Dalam penelitian ini, daun kumis kucing dikeringkan hingga kadar air mencapai 7%, hal ini bertumpu pada kadar air bubuk seduhan pada umumnya seperti teh seduh. Berdasarkan SNI 01-3836-2000, kadar air teh kering dalam kemasan adalah maksimal 8%. Demikian juga produk-produk bubuk/tepung lainnya, maksimal memiliki kadar air sekitar 10%.
Metode pengeringan yang digunakan, yaitu dengan sinar matahari dan oven bertujuan untuk meningkatkan daya simpan produk. Pengeringan dilakukan setelah satu hari sebelumnya daun kumis kucing diangin-anginkan, hal ini dimaksudkan untuk menutup stomata daunnya sehingga tidak terjadi penguapan zat-zat yang terkandung di dalamnya (Mahendra dan Kusuma, 2005). Pada hari selanjutnya, daun kumis kucing bisa dijemur di bawah sinar matahari langsung dan untuk pengeringan oven dilakukan pada suhu 40-500C. Daun kumis kucing dihamparkan pada suatu wadah secara merata dan tidak saling menumpuk. Selama proses pengeringan sebaiknya daun dibolak-balik agar pengeringan yang didapat lebih merata. Setelah kering kemudian dihancurkan dengan blender, sehingga dihasilkan bubuk daun kumis kucing yang siap diseduh. Warna bubuk yang dihasilkan adalah hijau kecoklatan.
segi khasiat tanaman kumis kucing baik dalam bentuk simplisia maupun bubuk/kapsul sudah banyak diketahui secara tradisional oleh masyarakat Indonesia. Namun belum ada pengujian terhadap toksisitas minuman seduhan yang berasal dari bubuk daun kumis kucing terhadap suatu organ dalam tubuh (seperti hati).
Kering matahari Kering oven
Gambar 9. Bubuk daun kumis kucing (Orthosiphon stamineus Benth.)
2. Hasil Analisis Proksimat Bubuk Daun Kumis Kucing
[image:50.612.172.507.216.401.2]Analisa proksimat bubuk daun kumis kucing dilakukan dengan mengukur kadar air, kadar abu, kadar protein dan lemak. Hasil analisa disajikan pada Tabel 3 sebagai berikut :
Tabel 3. Hasil analisis kimia bubuk daun kumis kucing kering matahari
Komposisi Kandungan (%)
Air bubuk kumis kucing 7.00
Abu 7.89
Protein 17.41
Lemak 5.09
Pada penelitian dilakukan pengukuran kadar air dengan metode oven, metode ini dapat digunakan untuk seluruh produk makanan, kecuali jika produk tersebut mengandung komponen-komponen yang mudah menguap atau jika produk tersebut mengalami dekomposisi pada pemanasan 1000C (Apriyatono et al, 1989).
Hasil pengukuran kadar air daun kumis kucing segar diperoleh sebesar 81.42% dan setelah dikeringkan dengan sinar matahari atau oven, kadar air bubuk daun kumis kucing adalah sebesar 7%. Kadar air ini sesuai dengan ketentuan SNI yang menyebutkan bahwa untuk produk teh dalam kemasan memiliki kadar air maksimal sebesar 8%.
Kadar abu ditentukan untuk mengetahui kandungan mineral dalam makanan. Pengukuran kadar abu dapat dilakukan dengan cara pengabuan basah (wet digestion) dan pengabuan kering (dry ashing). Pada penelitian dilakukan pengabuan kering dengan metode tanur. Prinsipnya adalah penetapan abu dalam bahan pangan dengan menimbang sisa mineral hasil pembakaran bahan organik pada suhu sekitar 5500C (Apriyantono et al, 1989). Hasil pengukuran kadar abu menunjukkan bahwa bubuk daun kumis kucing memiliki kadar abu sebesar 7.89%. Berdasarkan ketentuan SNI untuk produk teh kering memiliki kadar abu sebesar 8%.
Metode yang digunakan untuk pengukuran kadar lemak pada penelitian adalah metode soxhlet, pada prinsipnya adalah lemak diekstrak dengan pelarut dietil eter. Setelah pelarutnya diuapkan, lemaknya dapat ditimbang dan dihitung persentasenya (Apriyantono et al, 1989). Dari hasil pengukuran kadar lemak dengan metode ekstraksi soxhlet pada bubuk daun kumis kucing didapat hasil sebesar 5.09% lemak.
menjadi basa, dan amonia diuapkan untuk kemudian diserap dalam larutan asam borat.
Hasil penelitian menunjukkan bahwa kandungan protein sebesar 17.41%. Pada produk sejenis seperti produk teh diketahui bahwa kandungan proteinnya adalah sebesar 16% (Nasution dan T, Wachyuddin., 1975). Nilai ini tidak terlalu jauh jika dibandingkan dengan hasil penelitian. Kandungan protein bubuk daun kumis kucing sedikit lebih tinggi jika dibandingkan pada produk teh.
Karbohidrat adalah kelompok nutrien yang penting dalam susunan makanan, sebagai sumber energi. Senyawa-senyawa ini mengandung unsur karbon, hidrogen, oksigen dan dihasilkan oleh tanaman dengan proses fotosintesis (Sherrington dan Gaman, 1994).
Kadar karbohidrat pada bubuk kumis kucing yang diamati dihitung dengan by different. Kadar karbohidrat adalah kadar tertinggi dalam bubuk daun kumis kucing, yaitu sebesar 62.61% dan kandungan terkecil dari bubuk daun kumis kucing adalah kadar lemak sebesar 5.09%.
B. MINUMAN SEDUHAN BUBUK DAUN KUMIS KUCING
Bubuk daun kumis kucing diproses lebih lanjut untuk menghasilkan minuman seduhan daun kumis kucing. Bubuk daun kumis kucing yang telah diseduh dengan air panas, kemudian didiamkan 5 menit dengan tujuan agar kandungan komponen bioaktif bubuk daun kumis kucing tersebut terekstrak secara sempurna. Hasil ekstraksi minuman seduhan baik yang berasal dari bubuk daun kumis kucing kering matahari maupun oven kemudian dianalisis aktivitas antioksidan dan total fenol. Kedua pengujian ini digunakan untuk menentukan perlakuan minuman seduhan yang akan diberikan kepada tikus percobaan berdasarkan nilai total fenol dan aktivitas antioksidan tertinggi.
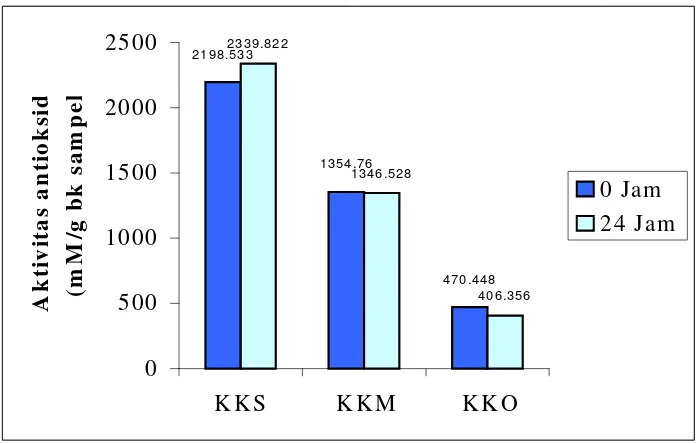
1. Hasil Analisis Aktivitas Antioksidan.
aktivitas antioksidan untuk air seduhan daun kumis kucing segar pada saat 0 jam sebesar 2198.533 mM/g b.k sampel, sedangkan aktivitas antioksidan air seduhan bubuk daun kumis kucing kering oven sebesar 470.448 mM/g b.k sampel dan air seduhan bubuk daun kumis kucing kering matahari adalah 1354.76 mM/g b.k sampel.
Minuman seduhan kumis kucing disimpan pada suhu ruang selama 24 jam untuk melihat stabilitas aktivitas antioksidan. Hal ini dikarenakan minuman seduhan diberikan kepada tikus percobaan secara ad libitum selama 24 jam dan diganti dengan minuman seduhan yang baru.
[image:53.612.163.511.378.600.2]Setelah 24 jam penyimpanan pada suhu ruang dapat dilihat bahwa aktivitas antioksidan pada semua perlakuan relatif stabil. Nilai aktivitas antioksidan setelah penyimpanan 24 jam suhu ruang pada air seduhan daun kumis kucing segar, kering matahari dan kering oven berturut-turut adalah 2339.822 mM/g b.k sampel, 1346.528 mM/g b.k sampel dan 406.356 mM/g b.k sampel.
Gambar 10. Grafik akivitas antioksidan air seduhan daun kumis kucing segar, bubuk daun kumis kucing kering kering matahari dan kering oven
Menurut Bauzaite at al. (2003), beberapa senyawa yang terkandung dalam suatu ekstrak dapat bersifat tidak stabil pada suhu tinggi dan proses pemanasan dapat menurunkan aktivitas antioksidan. Hal ini dapat dilihat
2198.533 1354.76 470.448 2339.822 1346.528 406.356 0 500 1000 1500 2000 2500
K K S K K M K K O
pada hasil penelitian, nilai aktivitas antioksidan minuman seduhan bubuk daun kumis kucing kering matahari dan oven memiliki aktivitas antioksidan lebih rendah dibandingkan dengan nilai aktivitas antioksidan minuman seduhan daun kumis kucing segar.
Nilai aktivitas antioksidan tertinggi pada perlakuan pengeringan diperoleh dari minuman seduhan bubuk daun kumis kucing kering matahari, yaitu sebesar 1346.528 mM/g bk sampel. Sedangkan nilai aktivitas antioksidan minuman seduhan dari bubuk daun kumis kucing kering oven memiliki nilai sebesar 406.356 mM/g bk sampel. Sehingga pada penelitian ini selanjutnya digunakan sampel bubuk daun yang berasal dari daun kumis kucing kering matahari.
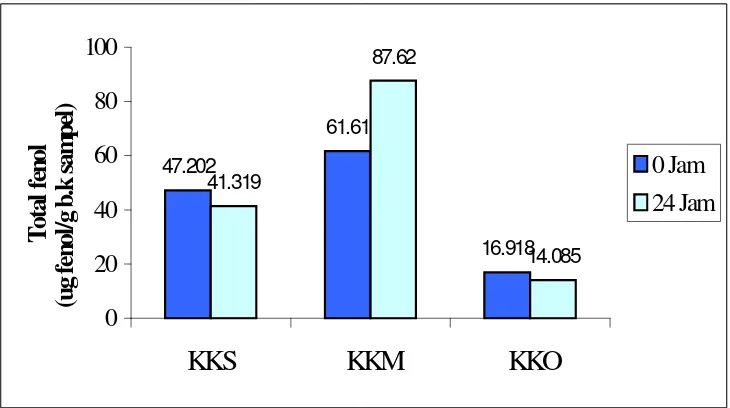
2. Hasil Analisis Total Fenol
Pengujian total fenol bertujuan untuk menentukan total senyawa fenolik yang terkandung di dalam sampel, sehingga diduga bila kandungan senyawa fenolik di dalam sampel tinggi maka aktivitas antioksidan akan tinggi (Marinova dan Yanishlieva, 2003). Keefektifan fenol sebagai antioksidan memiliki rentang tertentu sehingga dapat terjadi pada konsenterasi rendah fenol menjadi kurang efektif berperan sebagai antioksidan dan pada konsenterasi tinggi fenol dapat bersifat sebagai prooksidan (Fardiaz, 1996).
Total fenol tertinggi yang diperoleh pada penelitian ini adalah minuman seduhan bubuk daun kumis kucing kering matahari. Nilai ini lebih besar jika dibandingkan dengan nilai total fenol minuman seduhan daun kumis kucing segar. Berbeda halnya dengan aktivitas antioksidan yang didapat pada hasil penelitian, yaitu aktivitas pada minuman seduhan daun kumis kucing segar lebih tinggi dibandingan dengan minuman seduhan bubuk daun kumis kucing kering matahari.
minuman seduhan daun kumis kucing segar memiliki nilai total fenol yang rendah, hal ini menunjukkan bahwa senyawa yang berperan sebagai antioksidan pada minuman seduhan daun kumis kucing segar adalah senyawa lain selain fenol yang terkandung di dalam sampel tersebut.
Gambar 11. Grafik total fenol air seduhan daun kumis kucing segar, bubuk daunkumis kucing kering kering matahari dan kering oven. Total fenol untuk air seduhan daun kumis kucing segar pada 0 jam sebesar 47.202 µg fenol/g b.k sampel, sedangkan nilai total fenol air seduhan bubuk daun kumis kucing kering matahari dan oven berturut-turut adalah 61.61 µg fenol/g b.k sampel dan 16.918 µg fenol/g b.k sampel. Setelah pengamatan selama 24 jam, untuk total fenol air seduhan daun kumis kucing segar, bubuk daun kumis kucing kering matahari dan kering oven berturut-turut adalah 41.319, 87.62 dan 14.085 µg fenol/g bk sampel.
Hasil penelitian menunjukkan bahwa aktivitas antioksidan tertinggi dalam minuman seduhan diperoleh dari bubuk daun kumis kucing kering matahari, dengan demikian sampel minuman seduhan yang digunakan sebagai perlakuan kepada tikus percobaan adalah minuman seduhan dari bubuk daun kumis kucing kering matahari.
Minuman yang diberikan pada tikus percobaan dibedakan atas tiga macam minuman sesuai dengan perlakuan yang diberikan, yaitu kontrol (air putih), Kk 1 (0.3 g bubuk/hari/200 g berat tikus atau 0.012 g/ml) dan Kk 2
47.202 61.61 16.918 41.319 87.62 14.085
0
20
40
60
80
100
KKS
KKM
KKO
(0.6 g bubuk/hari/200 g berat tikus atau 0.024 g/ml). Minuman seduhan dibuat sesuai dengan Lampiran 6., perbedaan antara kelompok Kk 1 dan Kk 2 adalah konsenterasi yang diberikan, sedangkan untuk kontrol hanya diberi perlakuan minuman air putih setiap hari.
[image:56.612.162.492.174.412.2]
Gambar 12. Perbandingan minuman seduhan bubuk daun kumis kucing konsenterasi rendah (Kk 1) dan konsenterasi tinggi (Kk 2)
Dari hasil pengamatan setiap hari selama perlakuan (28 hari), diketahui bahwa rata-rata minum tikus kelompok kontrol adalah sebesar 21.17 ml/hari, untuk kelompok Kk1 dan Kk2 berturut-turut sebesar 24.64 ml/hari dan 25.48 ml/hari (Lampiran 8). Hasil yang didapatkan dapat digunakan untuk mengetahui jumlah ekstrak bubuk daun kumis kucing yang terminum oleh tikus percobaan.
C. PENGARUH PEMBERIAN MINUMAN SEDUHAN BUBUK DAUN
KUMIS KUCING TERHADAP TIKUS PERCOBAAN
Tikus percobaan yang digunakan adalah jenis tikus Sprague Dowley berkelamin jantan. Tikus ini dibeli dari PUSLIT (Pusat Penelitian) GIZI Bogor. Umur tikus percobaan adalah 1.5 bulan. Sebelum tikus percobaan dikelompokkan, terlebih dahulu dilakukan seleksi berdasarkan berat badan, sehingga rata-rata variasi berat badan didapat antar kelompok 5 gram dan variasi berat antar tikus dalam satu kelompok adalah 10 gram.
Tikus-tikus percobaan dikelompokkan ke dalam 3 kelompok, yaitu kelompok kontrol, Kk 1 dan Kk 2, dengan jumlah per kelompok masing-masing adalah 7 ekor. Tikus percobaan dikandangkan secara individu dengan ukuran kandang 34 x 26 x 12 cm. Bagian atas kandang ditutup dengan menggunakan kawat penutup. Dua minggu pertama dilakukan adaptasi terhadap tikus percobaan, adaptasi dilakukan dengan pemberian ransum standar dan minuman kontrol (air putih). Masa adaptasi ini dimaksudkan agar tikus terbiasa dengan ransum dan minuman perlakuan yang akan diberikan selama masa perlakuan.
Tikus percobaan diberikan ransum dan minum secara ad libitum. Ransum standar yang diberikan kepada tikus sebanyak 19.5 gram pada masa adaptasi. Tetapi selama masa adapatasi ada beberapa tikus yang menghabiskan ransum 19.5 gram, selanjutnya untuk masa perlakuan diberikan ransum standar sebanyak 21 gram. Sedangkan minuman yang diberikan kepada tikus selama masa adaptasi adalah 50 ml air. Karena minum tikus per hari rata-rata sebanyak 20-25 ml, maka pada masa perlakuan minuman hanya diberikan sebanyak 40 ml.
Selain dari makanan dan minuman, kondisi tikus juga dapat ditentukan dari kandang yang digunakan. Kandang harus dibersihkan setiap 2-3 hari sekali, hal ini bertujuan untuk menjaga kelembaban lingkungan tikus percobaan. Penempatan tikus percobaan pada rak-rak kayu harus dirotasi agar udara panas pada siang hari dan udara malam dapat dirasakan tikus percobaan secara merata. Udara yang tidak mendukung seperti kelembaban dapat menyebabkan tikus terserang kutu/penyakit atau mengalami stres. Hal ini dapat mempengaruhi pola makan atau minum tikus.
[image:58.612.167.487.272.459.2]
Gambar 13. Tikus galur Sprague Dowley
1. Berat Tikus Percobaan
Berat tikus percobaan diukur setiap dua hari sekali, penimbangan dilakukan sejak tikus berada pada masa adaptasi sampai masa perlakuan sebelum dilakukan terminasi. Penimbangan berat tikus dilakukan untuk mengetahui peningkatan berat selama masa perlakuan dan untuk perhitungan berat relatif organ, yaitu hati dan ginjal.
Berdasarkan perhitungan yang telah dilakukan, diketahui adanya