DAFTAR PUSTAKA
Abdullah, Mikrajuddin dan Khairurrijal. 2008. Karakterisasi Nanomaterial. Jurnal Nano Sains dan Teknologi, Vol. 2, No. 1, ISSN 1979-0880
Andriayani, 2012. Sintesis Material Mesopori Silika dari Tetraetilortosilikat (TEOS) Menggunakan Natrium Risinoleat sebagai template dan 3-Aminopropilmetoksisilana (APMS) sebagai Co-Structure Directing Agent (CSDA). [Disertasi] Medan: Universitas Sumatera Utara
Bahadur, D., Lahl, N., Singh, K., Singheiser, L., and Hilpert, K., 2004. Influence of Nucleating Agents on the Chemical Interaction of MgO-Al2O3-SiO2-B2O3
Glass Sealants with Components of SOFCs. Journal of The Electrochemical Society, 151. A558-A562
Bakri, R., 2008. Kaolin sebagai Sumber SiO2 untuk Pembuatan Katalis Ni/SiO2:
Karakterisasi dan Uji Katalis Pada Hidrogenasi Benzene Menjadi Sikloheksana. Jurnal Sains. 12:37-42
Bangun, N., Sembiring, S.B., Putri., N.K., and Karo-karo, J.A., 2015. Extraction of carotenoids from Crude palm oil using M-silicate M-polystirene sulfonate (M= Mg, Ca) and a Collector. International Conference on Chemical Engineering Yogyakarta, Indonesia, October 27-28
Basset, J., Mendham, J., and Denney, R. C., 1989. Quantitative chemical analysis. Fifth Edition. New York. Longman Scientific & Technical.
Brindley, G. W. and Brown, G., 1980. Crystal Structures of Clay Minerals and their X-ray Identification. Mineralogical Society, 41 Queen's Gate, London SW7 5HR
Bird,T., 1993. Kimia Fisik untuk Universitas. Jakarta : PT Gramedia Pustaka Utama. Chreswell, M. A., 1972. Analisis spekturm senyawa organik. Edisi kedua. Penerbit
ITB. Bandung.
Cotton, F.A., and Wilkinson, G., 1976. Basic Inorganic Chemistry. Canada: John wiley and sons, inc.
Cullity, B.D., 1978, Elements of X-Ray Diffraction. Second edition. Addison-wesley publishing company inc. Canada.
Giddel M.R., and Jivan A.P., 2007. Waste to Wealth Potential of Rice Husk in India. a Literature Review. International Conference on Cleaner Technologies and Environmental Management PEC, Pondicherry, India. January 4-6
Habeeb, G.A., and Mahmud, H., 2010. Study on properties of rice husk ash and its use as cement replacement material. Journal of Materials. 13:185-190.
Hartomo, J. A., 1986. Penyidikan Spektrometrik Senyawa Organik. Edisi keempat. Erlangga. Jakarta.
Haslinawati, M.M., K.A. Matori., Z.A. Wahab., H.A. Sidek., and A. T. Zainal. 2011. Effect of Temperature on Ceramic from Rice Husk Ash. International Journal of Basic and Applied Science. Vol. 9, No. 9, pp. 22-25
Hwang, C.L., and Wu, D.S., 2002. Properties of cement paste containing rice husk ash. ACI Third International Conference Proceedings.
Iler, R.K., 1979. Silica Gel and Powders. The Chemistry of Silica. New York.
Johnson, C. K., 1971. A Fortran thermal-ellipsoid plot program for crystal structure illustrations. Oak Ridge National Laboratory Report ORNL-3794, second revision.
Kalapathy, U., Proctor, A., and Shultz, J., 2000. A simple method for production of pure silica from rice hull ash. Bioresource Technology. 73:257-162
Kanellopoulos, N., 2011. Nanoporous Materials: Advanced Techniques for Characterization, Modelling, and Processing. CRC Press Taylor & Francis Group. New York
Kharaziha, M., and Fathi, M.H., 2010. Improvement of mechanical Properties and Biocompatilibility Of Forsterite Bioceramic Addressed To Bone Tissue Engineering Materials. Journal Of The Mechanical Behavior Of Biomedical Material S3, 530-537
Khopkar., 2008. Konsep dasar kimia analitik. Universitas Indonesia. Jakarta.
Koteswara R.D., and Pranav., 2006. Stabilization of expansive soil with rice husk ash, lime and gypsum. An experimental study International Journal of Engineering Science and Technology (IJEST)
high-Mantell, C.L., 1958. Engineering material handbook. McGraw-Hill Book Company. New York.
Merck index., 2001. An Encyclopedia of Chemicals, Drugs, and Biologicals. Thirteenth edition. Merck and co., inc.
Mohanraj, V.J., 2006. Nanoparticle. Tropical Journal of Pharmaceutical Research, June 2006; 5 (1): 561-573
Muthadhi, A., and Kothandaraman, S., 2007. Rice Husk Ash -Properties and its Uses. A Review Rice Husk Ash May 2007 IE (I) Journal Vol. 88
Ni, Siyu., Chou. L., and Chang. J., 2007. Preparation and characterization of forsterite Mg2SiO4 bioceramics. Ceramics International 33, 83-88
Pahlepi, R., Sembiring, S., dan Pandiangan, D., 2013. Pengaruh penambahan MgO pada SiO2 berbasis silika sekam padi terhadap karakteristik komposit
MgO-SiO2 dan kesesuaiannya sebagai bahan pendukung katalis Jurnal Teori dan
Aplikasi Fisika. Vol. 01, No 02
Pine, S., 1998. Kimia organik. Terbitan Keempat. Penerbit ITB. Bandung
Rouque-Malherbe, R.M.A., 2007. Adsorption and Diffussion in Nanoporous Material. CRC Press Taylor & Francis Group.
Silverstein, R.M., Bassler, G.C., and Morrill, T.C., 1981. Spectrometric Identification of Organic Compound. 4th Edition. New York. John Wiley & Sons.
Singh, R. and Dhindaw, B. K., 1978. Production of high purity silicon for use in solar cells. Materials Science and Engineering. 776-781.
Sriyanti, Taslimah, Nuryono, dan Narsito., 2005. Sintesis Bahan Hibrida Amino-Silika Dari Abu Sekam Padi Melalui Proses Sol-Gel. Jurusan Kimia FMIPA Universitas Diponegoro. Semarang.Vol: 8. No: JKSA
Smallman, R. E., and Bishop, R. J., 2000. Metalurgi Fisik Modern dan Rekayasa Material. Edisi keenam. Terjemahan Sriati Djaprie. Erlangga. Jakarta.
Sumarnadi, E.T., Zulkarnain, I., dan Riyanto, A., 1998. Pembuatan Bata Tahan Api Forsterit: Forsterisasi Serpentinit Pomala Dan Magnesit Pulau Padamarang. Prosiding.
Thuadaij, N., and Nuntiya, A., 2008. Preparation of nanosilica powder from rice husk ash by preparation method. Journal Science. 35:206-211
Xu, M.,n Wang, Z., Xu, Q., Song , Q., You, J., and Zhai, Y., 2014. An in situ spectroscopic study on decomposition of MgSiO3 during the alkali fusion
BAB 3
METODE PENELITIAN
3.1 Alat
− Furnace Control Fisher
− Hotplate Stirrer Thermilyte
− Difraktometer Sinar-X Rigaku 600 Miniflex
− Fourier Transform Infrared
− Brunauer-Emmett-Teller adsorpmeter
− Neraca Digital AS 220/C/2 Radwag
− Peralatan Gelas Pyrex
− Kertas Saring
− Oven
3.2 Bahan
− Sekam padi
− NaOH 10% p.a. Merck
− HCl 11% p.a. Merck
− MgO p.a. Merck
− Asam oleat p.a
3.3 Prosedur Penelitian
3.3.1 Pembuatan larutan natrium silikat
Sekam padi sebanyak 100 gram dicuci lalu dikeringkan, kemudian direndam dalam 1L NaOH 10% sambil dipanaskan hingga mendidih selama 6 jam lalu disaring. Ke dalam filtrat ditambahkan HCl 11% hingga pH=7 sehingga terbentuk gel lalu di diamkan selama satu malam pada suhu kamar kemudian di saring. Gel silika kemudian di cuci dengan aquadest panas hingga gel berubah warna dari warna coklat menjadi warna putih. Gel silika kemudian dikeringkan dalam oven pada suhu 110oC lalu dihaluskan hingga berbentuk serbuk. 5 gram serbuk silika di masukkan ke dalam 150 mL NaOH 10%, di panaskan pada suhu 160oC sambil diaduk menggunakan hotplate
stirrer selama 3 jam membentuk larutan natrium silikat.
3.3.2 Pembuatan suspensi Mg(OH)2
Dilarutkan 5 gram MgO di dalam 30 mL aquadest, dipanaskan pada suhu 160oC sambil di aduk menggunakan hotplate stirrer selama 3 jam hingga terbentuk sol MgO.
3.3.3 Pembuatan Magnesium Silikat
Suspensi Mg(OH)2 dimasukkan kedalam larutan natrium silikat sambil diaduk
dan dipanaskan menggunakan hotplate stirrer pada suhu 160oC selama 10 jam hingga terbentuk suspensi putih, lalu didiamkan (aging) selama satu malam kemudian di saring. Padatan yang berwarna putih dicuci dengan akuades hingga pH netral lalu dikeringkan di dalam oven pada suhu 110 oC. Padatan yang diperoleh lalu dibagi 2, bagian yang pertama di kalsinasi pada suhu 900oC selama 4 jam lalu dikarakterisasi FT-IR, XRD dan BET dan bagian yang kedua digunakan untuk pembuatan Magnesium silikat nanopartikel.
3.3.4 Pembuatan Magnesium SilikatNanopartikel
3.4 Bagan Penelitian
3.4.1 Pembuatan larutan natrium silikat
100 gram sekam padi utuh
dicuci dengan aquadest
dikeringkan
direndam dalam 1L NaOH 10% sambil dipanaskan selama 6 jam
disaring
Filtrat Residu
ditambahkan HCl 11% hingga pH=7 hingga terbentuk gel berwarna coklat
didiamkan selama satu malam pada suhu kamar disaring
gel silika Residu
dicuci dengan menggunakan aquadest panas hingga berubah warna dari coklat menjadi putih
dikeringkan di dalam oven pada suhu 110oC dihaluskan
serbuk silika
dimasukkan 5 gram ke dalam 150mL NaOH 10%
di aduk sambil dipanaskan pada suhu 160oC menggunakan hotplate stirrer selama 3 jam
3.4.2 Pembuatan Suspensi Mg(OH)2
5 gram MgO
dilarutkan dalam 30 ml aquadest
dipanaskan pada suhu 160oC sambil diaduk menggunakan hotplate stirrer selama 3 jam
Suspensi Mg(OH)2
3.4.3 Pembuatan Magnesium Silikat
larutan natrium silikat Suspensi Mg(OH)2
diaduk dan dipanaskan menggunakan hotplate stirrer pada suhu 160oC selama 10 jam
Suspensi Putih
didiamkan selama satu malam disaring
filtrat Padatan Putih
dikeringkan di dalam oven pada suhu 110oC dibagi ke dalam 2 bagian
3.4.4 Pembuatan Magnesium Silikat Nanopartikel
5 gram Padatan Putih
Ditambahkan 3 mL asam oleat
Diaduk hingga merata
Ditanur pada suhu 900oC selama 4 jam
Dikarakterisasi dengan FT-IR, XRD, dan BET
BAB 4
HASIL DAN PEMBAHASAN
4.1 Pembuatan Magnesium Silikat
Pembuatan Magnesium Silikat menggunakan bahan baku yaitu silika dari sekam padi dan MgO sebagai sumber logam Mg. Silika dari sekam padi ini diperoleh dengan cara memanaskan 100 gram sekam padi dalam 1 L NaOH 10% selama 6 jam. Hal ini dilakukan untuk mengekstraksi silika dari sekam padi, karena silika larut dalam larutan NaOH. Hal ini sesuai dengan reaksi:
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l) (Basset, et al., 1989)
Setelah itu dilakukan pendiaman selama 1 malam kemudian di saring. Ke dalam filtrat yang mengandung silika ini ditambahkan HCl 11% hingga pH 7 sehingga membentuk gel silika.
Hal ini sesuai dengan reaksi:
Na2SiO3(aq) + 2HCl(aq) H2SiO3(l) + 2NaCl(aq)
H2SiO3(s) SiO2.H2O(s) (Bakri, 2008)
Gel silika ini diambil lalu di cuci menggunakan akuades panas untuk menghilangkan lignin dan selulosa kemudian dikeringkan di dalam oven pada suhu 110oC. Diperoleh silika hasil ekstraksi sebanyak 20,7 gram (yield=20,7%).
Silika hasil ekstraksi ini diambil 5 gram lalu dilarutkan kembali dalam 150 mL NaOH 10% untuk membentuk larutan natrium silikat sesuai dengan reaksi berikut: SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l) (Basset, et al., 1989)
Kemudian dicampur dengan larutan Mg(OH)2 yang diperoleh dengan cara melarutkan
5 gram MgO dalam 30 mL akuades. Campuran ini diaduk sambil dipanaskan pada suhu 160oC sampai membentuk suspensi putih MgSiO3, hal ini sesuai dengan reaksi:
Na2SiO3(aq) + Mg(OH)2(aq) MgSiO3 (s) + 2NaOH(aq)
Diperoleh hasil berupa padatan berwarna putih yang butirannya kasar. Bagian kedua digunakan untuk pembuatan Magnesium silikat nanopartikel.
4.1.1 Karakterisasi Magnesium Silikat
4.1.1.1 Spekturm FT-IR
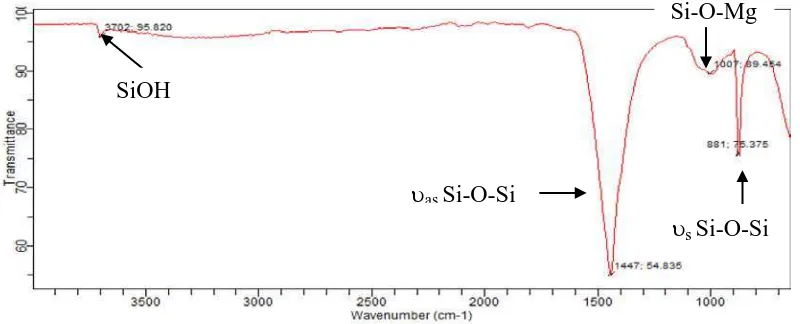
Magnesium silikat yang diperoleh dianalisis menggunakan FT-IR untuk mengetahui adanya gugus fungsi. Hasil FT-IR pada magnesium silikat yang diperoleh ditunjukkan pada Gambar 4.1 berikut ini:
Gambar 4.1 Spekturm FT-IR Magnesium Silikat
Spekturm FT-IR yang ditunjukkan pada Gambar 4.1 menunjukkan karakter dari magnesium silikat. Puncak serapan pada bilangan gelombang 3702 cm-1 menunjukkan adanya gugus Si-OH, puncak serapan pada bilangan gelombang 1447 cm-1 menunjukkan adanya gugus Si-O-Si asimetri dan pada bilangan gelombang 881 cm-1 menunjukkan adanya gugus Si-O-Si simetri serta puncak serapan yang terjadi pada bilangan gelombang 1007 cm-1 menunjukkan adanya gugus Si-O-Mg (Silverstein, et
al., 1981).
4.1.1.2 Difraksi sinar-X (XRD)
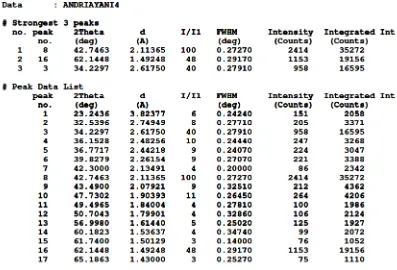
XRD digunakan untuk menganalisa komposisi kristal dalam suatu sampel. Hasil analisis XRD produk diperlihatkan pada Gambar 4.2 berikut ini:
SiOH
υs Si-O-Si
υas Si-O-Si
Gambar 4.2 Difraktogram XRD Magnesium Silikat
Gambar 4.3 Daftar Peak XRD Magnesium Silikat
Difraktogram XRD yang ditunjukkan oleh Gambar 4.3 pada sudut 2θ menunjukkan beberapa peak yang berbeda yaitu, ada 17 peak yang terbaca dan ada 3 peak yang intensitasnya cukup tajam. Adapun daftar peak- peak ini mengindikasikan adanya
Mg2SiO
MgSiO3 MgO
MgO
MgSiO
ditunjukkan ini sesuai dengan peak XRD yang dikerjakan oleh Bahadur, et al., 2004; Xu, et al., 2014.
4.1.1.3 Adsorpsi-desorpsi Nitrogen
Untuk mengukur porositas, volume dan distribusi pori, serta ukuran partikel magnesium silikat maka dilakukan adsorpsi desorpsi terhadap nitrogen secara isoterm pada suhu -195,850oC hasilnya terlihat pada Tabel 4.1 berikut ini:
Tabel 4.1 Hasil Analisa Adsorpsi Desorpsi Gas Nitrogen Untuk Magnesium Silikat
Hasil Analisa Adsorpsi Desorpsi Magnesium Silikat Luas permukaan 3,3330 m2/g
Volume pori 0,001240 cm3/g Ukuran pori 2,1106 nm Ukuran nanopartikel 1.800, 2003 nm
4.2 Pembuatan Magnesium Silikat Nanopartikel
Pembuatan magnesium silikat nanopartikel dilakukan dengan cara menambahkan 3 mL asam oleat pada 5 gram padatan magnesium silikat yang diperoleh dari hasil penambahan MgO pada silika dari sekam padi. Kemudian ditanur pada suhu 900oC selama 4 jam. Diperoleh hasil berupa padatan berwarna putih yang memiliki butiran-butiran yang halus.
4.2.1 Karakterisasi Magnesium Silikat Nanopartikel
4.2.1.1 Spekturm FT-IR
Gambar 4.4 Spektrum FT-IR Magnesium Silikat Nanopartikel
Spekturm FT-IR magnesium silikat nanopartikel yang ditunjukkan pada Gambar 4.3 menunjukkan karakter dari magnesium silikat nanopartikel. Puncak serapan pada bilangan gelombang 3374 cm-1 menunjukkan adanya gugus Si-OH, puncak serapan pada bilangan gelombang 1447 cm-1 menunjukkan adanya gugus Si-O-Si asimetri dan pada bilangan gelombang 918 cm-1 menunjukkan adanya gugus Si-O-Si simetri serta puncak serapan yang terjadi pada bilangan gelombang 1030 cm-1 menunjukkan adanya gugus Si-O-Mg (Silverstein, et al., 1981).
4.2.1.2 Difraksi sinar X (XRD)
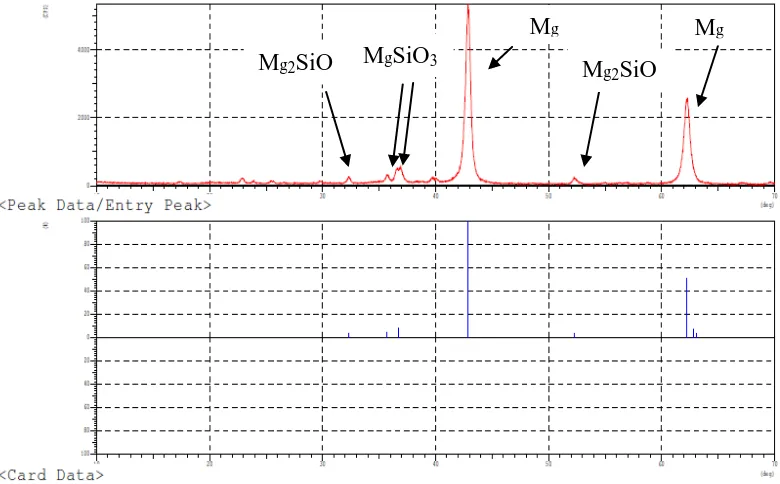
XRD digunakan untuk menganalisa komposisi kristal dalam suatu sampel. Hasil analisis XRD produk diperlihatkan pada Gambar 4.5 berikut ini:
υas Si-OH
υas Si-O-Si
υs Si-O-Si
Si-O-Mg
Mg2SiO MgSiO3
Mg2SiO
Gambar 4.5 Difraktogram XRD Magnesium Silikat Nanopartikel
Gambar 4.6 Daftar Peak XRD Magnesium Silikat Nanopartikel
Difraktogram XRD yang ditunjukkan pada Gambar 4.5 pada sudut 2θ menunjukkan ada 8 peak yang terbaca dan ada 2 peak yang intensitasnya cukup tajam. Adapun daftar peak- peak ini mengindikasikan adanya MgO pada daerah 42,83o dan 62,18o; MgSiO3 pada daerah 35,69o dan 36,72o; Mg2SiO4 pada daerah 32,29o dan 52,26o.Peak
yang ditunjukkan ini sesuai dengan peak XRD yang dikerjakan oleh Bahadur, et al.,
2004; Xu, et al., 2014.
Dalam difraktogram XRD suatu sampel yang berupa padatan (powder), peak yang diperoleh bisa menunjukkkan lebih dari satu jenis komposisi kristal (berupa campuran). Dari hasil difraktogram XRD yang diperoleh terdapat dua jenis mineral magnesium silikat yaitu, MgSiO3 (enstatite) dan Mg2SiO4 (forsterite). Hal ini sesuai
4.2.1.3 Adsorpsi-desorpsi Gas Nitrogen
Untuk mengukur porositas, volume dan distribusi pori, serta ukuran partikel magnesium silikat nanopartikelmaka dilakukan adsorpsi desorpsi terhadap gas nitrogen pada suhu -195,850oC hasilnya terlihat pada Tabel 4.2 berikut ini:
Tabel 4.2 Hasil Analisa Adsorpsi Desorpsi Gas Nitrogen Untuk Magnesium Silikat Nanopartikel
Hasil Analisa Adsorpsi Desorpsi Magnesium Silikat Nanopartikel Luas permukaan 62,1099 m2/g
Volume pori 0,017450 cm3/g Ukuran pori 2,1048 nm Ukuran nanopartikel 96,6030 nm
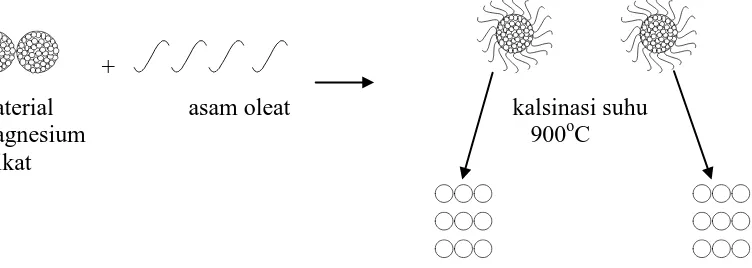
Adanya penambahan asam oleat menyebabkan ukuran partikel magnesium silikat berubah dari 1.800,2003 nm (Tabel 4.1) menjadi 96,6030 nm (Tabel 4.2). Hal ini terjadi karena adanya interaksi antara magnesium silikat dengan asam oleat dan pada saat di kalsinasi pada suhu 900oC asam oleat terbakar dan memecah material magnesium silikat membentuk partikel yang lebih kecil yang berukuran nano. Gambar 4.7 berikut ini menunjukkan ilustrasi skematis interaksi anata magnesium silikat dan asam oleat.
Material Magnesium silikat nanopartikel
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Penambahan MgO pada silika dari sekam padi yang diekstraksi alkalis menggunakan NaOH 10% dapat dilakukan untuk memperoleh magnesium silikat. Hal ini terbukti dari karakterisasi yang telah dilakukan dengan FT-IR, XRD, dan adsorpsi desorpsi gas nitrogen yang menunjukkan karakter dari Magnesium silikat. 2. Penggunaan asam oleat sebagai template sangat berpengaruh pada perubahan
ukuran partikel, pori dan luas permukaan dari magnesium silikat sebelum dan sesudah penambahan asam oleat yang dianalisa adsorpsi desorpsi gas nitrogen yang ditunjukkan oleh data berikut, yaitu: perubahan ukuran partikelnya dari 1.800,2003 nm menjadi 96,6030 nm, ukuran pori 2,1106 nm menjadi 2,1048 nm, dan luas permukaan dari 3,3330 m2/g menjadi 62,164 m2/g. Hal ini disebabkan adanya interaksi antara magnesium silikat dengan asam oleat yang membuat adanya perubahan ketika dikalsinasi.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1Sekam Padi
Sekam padi merupakan salah satu limbah pertanian yang paling banyak ditemukan di seluruh negara penghasil beras. Sekitar 600 juta ton padi dihasilkan setiap tahun dan 20% di dalamnya adalah sekam padi yaitu sekitar 120 juta ton (Giddel, et al., 2007).
Komposisi kimia sekam padi sangat bervariasi, hal ini disebabkan karena perbedaan jenis padi, iklim dan kondisi geografis pada tempat padi diperoleh. Namun secara umum komposisi kimia sekam padi yaitu, silikon terhidrasi dan material-material organik seperti selulosa (sebanyak 55-60%, termasuk selulosa dan hemiselulosa), dan 22% lignin (Muthadi, et al., 2007). Menurut Muthadi et al., (2007), komposisi kimia dari dari sekam padi setelah dianalisis dapat dilihat pada Tabel 2.1 dibawah ini:
Tabel 2.1. Komposisi Kimia Hasil Analisis Sekam Padi (Muthadi, et al., 2007) Komposisi dan sifat sekam padi % massa
Sekam padi biasanya dibakar atau dibiarkan sebagai limbah buangan. Dengan membakar sekam padi akan menghasilkan residu berupa abu sekam padi (Koteswara,
et al., 2006). Abu ini sangat kaya akan silika amorf karena dapat mencapai 88.32%
(Habeeb, et al., 2010). Tanaman padi banyak mengandung silika amorf karena secara alami tanaman padi menyerap dan mengangkut silikon dalam bentuk asam silikat pada epidermis tanaman padi (Singh, et al., 1978). Menurut Habeeb, et al., (2010), komposisi kimia dari abu sekam padi dapat dilihat pada Tabel 2.2 dibawah ini:
Table 2.2. Komposisi Kimia Dari Abu Sekam Padi (Habeeb, et al., 2010) Komposisi oksida (% massa) Abu sekam padi
SiO2
Tingginya kadar silika dalam abu sekam padi memungkinkan untuk memisahkannya dengan cara ekstraksi pada temperatur rendah dan energi yang kecil (Thuadaij, et al., 2008). Proses pengarangan sekam padi juga mempengaruhi silika yang diperoleh, dimana semakin tinggi temperatur pada proses pengarangan sekam dalam oven maka akan diperoleh kemurnian SiO2 yang makin tinggi (Hwang, et al.,
1989).
2.2 Silika (SiO2)
Silika (silicon dioxide) merupakan senyawa kimia dengan rumus molekul SiO2 yang
dapat diperoleh dari silika mineral, nabati dan sintesis Kristal. Silika mineral adalah senyawa yang banyak mengandung SiO2 yang ditemukan dalam bahan tambang dan
Silika yang terdapat dalam tanaman ditemui pada sekam padi dan tongkol jagung. Silika yang berasal dari tumbuhan yang umumnya digunakan saat ini adalah silika sekam padi Silika juga dapat dibentuk dengan cara mereaksikan silikon dengan oksigen atau udara pada suhu tinggi (Iler, 1979).
Dalam mendapatkan silika dari sekam padi dapat dilakukan menggunakan metode ekstraksi alkalis (Kalapathy et al, 2000) dan metode pengabuan. Silika yang diperoleh melalui metode ekstraksi alkalis adalah berupa larutan sol dimana silika pada fase larutan adalah fase amorf. Sedangkan pada metode pengabuan, sekam padi dibakar pada suhu diatas 200°C selama 1 jam untuk mendapatkan arang sekam padi yang berwarna hitam (Haslinawati et al., 2011).
Pada umumnya silka adalah dalam bentuk amorf terhidrat, namun bila pembakaran berlangsung terus-menerus pada suhu diatas 650°C maka tingkat kristalinitasnya akan cenderung naik dengan terbentuknya fasa quartz, crystobalite, dan tridymite. Bentuk struktur quartz, crystobalite, dan tridymite yang merupakan jenis kristal utama silika memiliki stabilitas dan kerapatan yang berbeda (Brindley dan Brown, 1980). Struktur Kristal quartz, crystobalite, dan tridymite memiliki nilai densitas masing-masing sebesar 2,65×103 kg/m3, 2,27×103 kg/m3, dan 2,23×103 kg/m3. Berdasarkan perlakuan termal, pada suhu < 570°C terbentuk low quartz, untuk suhu 570-870°C terbentuk high quartz yang mengalami perubahan struktur menjadi
crystobalite dan tridymite, sedangkan pada suhu 870-1470°C terbentuk high tridymite,
pada suhu ˃ 1470°C terbentuk high crystobalite, dan pada suhu 1723°C terbentuk
silika cair (Smallman and Bishop 2000).
2.2.1 Sifat fisika dan kimia silika
2.2.1.1 Sifat fisika silika
2.2.1.2 Sifat Kimia Silika
Silika cenderung tidak reaktif terhadap Cl2, H2, asam, dan kebanyakan logam pada
kondisi normal atau suhu normal, tetapi mudah bereaksi dengan fluorin, HF encer, alkali hidroksida, dan karbonat (Cotton, et al., 1976). Berikut ini dapat diketahui sifat kimianya melalui reaksi dengan asam dan basa.
2.2.1.2.1 Reaksi dengan Asam
Silika relatif tidak reaktif terhadap asam kecuali asam hidrofluorida seperti reaksi berikut:
SiO2(s) + 4HF(aq) SiF4(aq) + 2H2O(l)
Dalam asam hidrofluorida berlebih reaksinya menjadi:
SiO2(s) + 6HF(aq) H2[SiF6](aq) + 2H2O(l) (Basset, et al., 1989)
2.2.1.2.2 Reaksi dengan Basa
Silika dapat bereaksi dengan basa, terutama dengan basa kuat, seperti hidroksida alkali.
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l) (Basset, et al., 1989)
Secara komersial, silika dibuat dengan mencampurkan larutan natrium silikat dengan suatu asam mineral. Reaksi ini menghasilkan suatu dispers peka yang akhirnya memisahkan partikel dari silikat terhidrat, yang dikenal dengan silika hidrosol atau asam silikat yang kemudian dikeringkan pada suhu 110oC agar terbentuk silika gel. Reaksi yang terjadi sebagai berikut:
Na2SiO3(aq) + 2 HCl(aq) H2SiO3(l) + NaCl(aq)
2.3 Magnesium Silikat
Magnesium silikat terdiri dari dua bahan baku utama yaitu magnesium oksida (MgO) dan silika (SiO2) yang berbentuk bubuk (powder) putih, amorf, tidak berbau
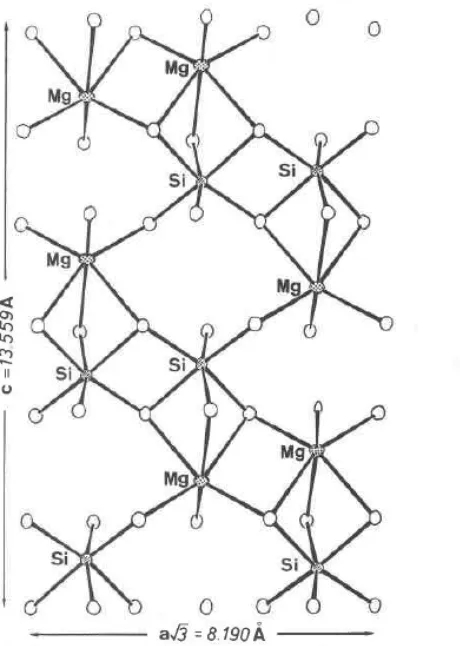
dan tidak larut dalam air namun sangat mudah larut dalam HF (merck index, 2001). Berikut Gambar 2.1 adalah struktur perspektif mineral magnesium silikat:
Gambar 2.1 Struktur Perspektif Magnesium Silikat (Johnson, l97l).
Magnesium silikat terdapat di alam sebagai mineral, Seperti clonoenstantite,
enstantite dan protoenstantite (merck index, 2001). Rasio molekul magnesium silikat
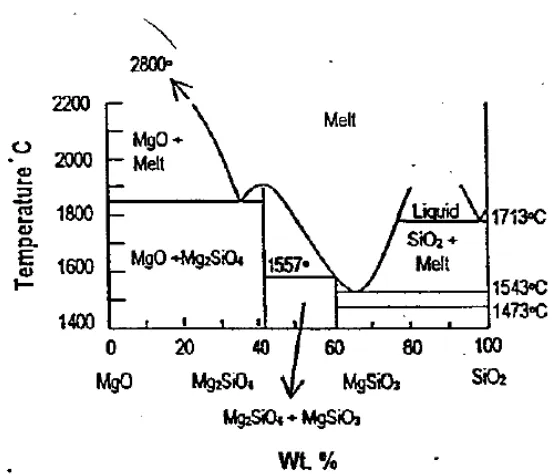
Gambar 2.2 Diagram Fasa Komposit Magnesium Silikat (Sumarnadi, 1998)
Pada Gambar 2.2 menunjukkan bahwa MgO dan SiO2 hanya akan membentuk anhydrous silicate yaitu forsterite (Mg2SiO4) dan enstantie (MgSiO3). Kedua anhydrous silicate tersebut adalah fasa yang stabil dalam sistem MgSiO3. Selama
berlangsungnya proses sintering/kalsinasi, fosteritisasi berlangsung melalui tahap dehidrasi, reorganisasi kation, pembentukan forsterite dan enstantite. Pada tahap dehidrasi, terjadi pelepasan gugus hidroksil dan pembentukan fasa oksida dimana serpentinit dan magnesit terurai menjadi MgO dan SiO2. Pada tahap reorganisasi
kation, terjadi pemisahan kation seiring meningkatnya suhu sintering dan pada fasa stabil MgSiO3 membentuk forsterite dan sedikit enstantite sedangkan MgO yang
berlebih akan membentuk periclase (Sumarnadi, dkk., 1998).
Magnesium silikat memiliki konduktivitas termal 2,6 Wm-1K-1 dan ekspansi termal 7,8×10-6 K-1 artinya memiliki ketahanan terhadap suhu tinggi sehingga dapat digunakan sebagai isolator suhu tinggi. Magnesium silikat juga memiliki luas permukaan 612 m2/g dan densitas 2,90 g/cm3 (Sumarnadi, dkk., 1998) yang dapat diaplikasikan sebagai bahan katalis. MgSiO3 dapat dibuat dengan metode sol-gel.
2.4 Asam Oleat
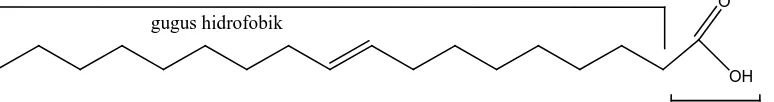
Asam oleat merupakan senyawa organik jenis asam lemak bebas yang tidak jenuh yang disebabkan oleh adanya satu ikatan rangkap pada atom C-9. Dapat dibuat dengan menghidrolisa lemak atau minyak lemak yang dipisahkan dengan cara pemerasan.
Asam oleat ini sukar larut dalam air namun mudah larut dalam eter dan alkohol, titik leburnya 15,3oC dan titik didihnya 360oC. Gambar 2.2 berikut adalah struktur dari asam oleat.
OH O
gugus hidrofobik
gugus hidrofilik
Gambar 2.2 Struktur Asam Oleat.
2.5 Material nanopartikel
Material nanopartikel dapat didefenisikan sebagai dispersi partikulat atau partikel padat yang memiliki ukuran partikel antara 10-100 nm (Mohanraj, et al., 2006). Material nanopartikel telah banyak menarik peneliti karena material nanopartikel menunjukkan sifat fisika dan kimia yang sangat berbeda dari bulk materialnya, seperti kekuatan mekanik, elektronik, magnetik, kestabilan termal, katalitik dan optik.
Material nanopartikel ini telah banyak digunakan dalam berbagai bidang. Tetapi dewasa ini material nanopartikel telah banyak digunakan dalam bidang medis yang berperan sebagai sistem drug delivery. Keuntungan dari menggunakan material nanopartikel sebagai sistem drug delivery adalah: pertama, Ukuran partikel dan karakteristik permukaannya dapat dengan mudah dimanipulasi untuk mendapatkan kedua target sistem drug baik yang pasif maupun yang aktif. Kedua, material nanopartikel ini dapat mengontrol pelepasan drug pada saat penghantaran maupun pada saat penempatannya. Ketiga, pelepasan yang terjadi dan karakteristik degradasi dapat dengan mudah dimodulasikan melalui pemilihan konstituen matriksnya (Mohanraj, et al., 2006).
2.6. Karakterisasi Material
2.6.1. Metode Adsorpsi Brunauer-Emmet-Teller (BET)
Teori BET adsorpsi multilayer untuk menentukan luas permukaan (S) dikembangkan oleh Brunauer, Emmet dan Teller. Proses adsorpsi digambarkan sebagai proses lapisan dengan lapisan (Layer-by-layer), permukaan secara energetik dianggap homogen, medan adsorpsi sama dalam setiap tempat permukaan, serta proses adsorpsi dianggap tidak bergerak (setiap molekul yang diadsorpsi pada sisi dasar permukaan). Lapisan pertama molekul yang diadsorpsi memiliki energi interaksi dengan medan adsorps (Ea0) dan interaksi vertikal antara molekul setelah lapisan pertama (EL0) sama terhadap
panas liqufaksi adsorbat dan molekul yang diadsorpsi tidak berinteraksi secara menyamping (Roque-Malherbe, 2007).
Untuk menentukan luas permukaan, didasarkan dari data isoterm physorption, menggunakan persamaan BET berikut ini:
�
Dimana na adalah jumlah adsorbat pada tekanan relatif P/Po, dan ��� adalah kapasitas
monolayer dan C adalah konstanta tergantung bentuk isoterm. Karena kapasitas
monolayer ��� dapat ditentukan maka luas permukaan S dapat dihitung dengan persamaan:
S= ��� .�.��
Dimana L (bilangan avogadro) dan �� adalah luas rata-rata yang dilewati molekul adsorbat pada monolayer, untuk N2= 0,162 nm2 pada 77K.
2.6.2. Metode Barret-Joyner-Halenda (BJH)
Metode BJH digunakan untuk menentukan distribusi ukuran pori / particle size
distribution (PSD). Tekanan relatif awal proses desorpsi dalam metode
Barret-Joyner-Halenda (BJH) berlangsung pada range 0,9 < P/Po < 0,95 dan semua pori telah diisi fluida adsorbat. Pada tahap pertama (j=1) dalam proses desorpsi hanya melibatkan pemindahan kondensasi kapiler. Tahap berikutnya melibatkan pemindahan kondensat dari inti pori dan penipisan multilayer dalam pori yang lebih besar (misalnya pori telah siap dikosongkan dari kondesat).
Distribusi ukuran pori Barret-Joyner-Halenda (BJH-PSD) dapat dihitung menggunakan persamaan berikut ini.
Keterangan :
Vpn : volume pori pada berbagai tekanan relatif rp : jari-jari pori
rk : jari-jari inti
∆� : perubahan volume pada berbagai tekanan relatif
∆� : ketebalan lapisan yang diserap
Ac : area terbuka pori yang kosong (Roque-Malherbe, 2007).
2.6.3 Spektroskopi Difraksi Sinar-X (XRD)
Spektroskopi difraksi sinar-x (X-Ray diffraction / XRD) merupakan salah satu metode karakterisasi material. Teknik ini digunakan untuk mengidentifikasi fasa kristalin dalam material dengan cara menentukan parameter struktur kisi serta untuk mendapatkaan ukuran partikel. Difraksi sinar-x terjadi pada hamburan elastis foton-foton sinar-x oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar x dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar penggunaan difraksi sinar-x untuk mempelajari kisi Kristal adalah berdasarkan persamaan Bragg (Cullity, 1978):
n.λ = 2.d.sin θ ; n =1,2,…
dengan; λ adalah panjang gelombang sinar-x yang digunakan, d adalah jarak antara dua bidang kisi, θ adalah sudut antara sinar datang dengan bidang normal, n adalah bilangan bulat yang disebut sebagai orde pembiasan.
2.6.4 Fourier Transform Infra-Red (FTIR)
Fourier Transform Infra-Red (FTIR) Spectroscopy merupakan alat yang dipergunakan
untuk menganalisis secara kuantitatif maupun kualitatif berdasarkan gugus fungsi yang ada dengan menggunakan standar.
Prinsip dasar spektroskopi inframerah yaitu interaksi antara vibrasi atom-atom yang berikatan/gugus fungsi dalam molekul yang mengadsorbsi radiasi gelombang elektromagnetik inframerah. Adsorbsi terhadap radiasi inframerah dapat menyebabkan eksitasi energi vibrasi molekul ke tingkat energi vibrasi yang lebih tinggi. Untuk dapat mengadsorbsi, molekul harus mempunyai perubahan momen dipole sebagai akibat dari vibrasi. Daerah radiasi spektroskopi inframerah berkisar pada bilangan gelombang 12800-10 cm-1. Umumnya daerah radiasi inframerah terbagi dalam daerah inframerah dekat (12800-4000 cm-1), daerah inframerah tengah (4000-200 cm-1), daerah inframerah jauh (200-10 cm-1). Daerah yang paling banyak digunakan adalah daerah inframerah tengah 4000-690 cm-1 (Khopkar, 2008).
Instrumen yang digunakan untuk mengukur serapan radiasi inframerah pada pelbagai panjang gelombang disebut spektrometer inframerah. Pancaran inframerah umumnya mengacu pada bagian spekturm elektromagnet yang terletak diantara daerah tampak dan daerah gelombang mikro. Pancaran inframerah yang kerapatannya kurang daripada 100 cm-1 (panjang gelombang lebih dari 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi energi putaran molekul. Penyerapan itu tercatat dan demikian spekturm rotasi molekul terdiri dari garis-garis tersendiri (Hartomo, 1986).
BAB 1
PENDAHULUAN
1.1Latar Belakang
Sekam padi merupakan salah satu limbah pertanian yang paling banyak ditemukan di seluruh negara penghasil beras. Sekitar 600 juta ton padi dihasilkan setiap tahun dan 20% di dalamnya adalah sekam padi yaitu sekitar 120 juta ton. Sekam padi memiliki kandungan berupa silika dan senyawa organik lainnya seperti selulosa, lignin dan lain-lain. Silika memiliki banyak kegunaan biasanya digunakan sebagai adsorben, komponen katalis, filler dan lain-lain (Giddel, et al., 2007).
Mineral-mineral dari silika ini juga banyak didapati di alam secara alami. Salah satu mineral dari silika adalah magnesium silikat. Magnesium silikat terdiri dari dua bahan baku utama yaitu magnesium oksida (MgO) dan silika (SiO2) yang berbentuk
bubuk (powder) putih, amorf, tidak berbau dan tidak larut dalam air. Magnesium silikat memiliki konduktivitas termal 2,6 Wm-1K-1 dan ekspansi termal 7,8×10-6 K-1 artinya memiliki ketahanan terhadap suhu tinggi sehingga dapat digunakan sebagai isolator suhu tinggi. Magnesium silikat juga memiliki luas permukaan 612 m2/g dan densitas 2,90 g/cm3 yang dapat diaplikasikan sebagai bahan katalis (Sumarnadi, dkk. 1998).
Penelitian tentang magnesium sillikat ini telah banyak dilakukan. Pahlepi, dkk., (2013) telah mensintesis MgSiO3 menggunakan metode sol-gel dengan
menambahkan Mg(NO3)2.6H2Opada silika dari sekam padi, dengan fokus pada variasi
perbandingan massa Mg(NO3)2.6H2O dan SiO2 yaitu, 1:1, 1:2, 1:3, 1:4, 1:5 dan 1:10
yang kemudian digunakan sebagai katalis pada reaksi transesterifikasi minyak kelapa. Dimana MgSiO3 ini dikalsinasi pada suhu 700oC. Dihasilkan bahwa pada proses
transesterifikasi yang dilakukan pada suhu 90oC dengan menggunakan MgSiO3 hasil
Bangun, et al., (2015) telah mengekstraksi karotenoid dari minyak CPO menggunakan M-silikat, M-polistirena sulfonat, dimana M merupakan logam Mg dan Ca. Diperoleh hasil bahwa adsorpsi karotenoid menggunakan Mg silikat lebih rendah dibandingkan dengan Ca silikat. Hal ini disebabkan oleh ukuran pori dari Mg silikat (11.696 nm) lebih besar dibanding Ca Silikat (5.585 nm).
Suatu senyawa dapat dimodifikasi pori maupun ukuran partikelnya dengan menggabungkan komponen anorganik dengan komponen organik yang dapat berupa supramolekul seperti surfaktan atau biomakromolekul, seperti poliamido amin dendrimer (Larsen, et al., 2000) yang berfungsi sebagai template. Dimana template ini dapat dengan mudah dihilangkan dengan cara kalsinasi atau pemanasan pada suhu tinggi (Andriayani, 2012).
Andriayani, (2012) telah mensintesis material mesopori silika dari Tetraetilortosilikat (TEOS) menggunakan natrium risinoleat sebagai template dan 3-aminopropiltrimetilsilana (APMS) sebagai co-structure directing agent (CSDA) dan dilakukan beberapa variasi perlakuan sebagai hasilnya diperoleh silika mesopori yang bersifat amorf dan ukuran partikelnya bervariasi tergantung kondisi reaksi yang dilakukan.
Suteewong, et al., (2010) telah meneliti evolusi struktur pada suhu ruang selama sintesis heksagonal mesopori silika nanopartikel dengan dan tanpa penambahan oksida besi. Metode liquid-phase saat mensintesis mesopori silika nanopartikel (MSNs), ditambahkan nanopartikel magnetik dengan cara melarutkan
cetyltrimethylammonium bromide (CTAB) yang merupakan salah satu jenis surfaktan
kemudian distabilkan dengan larutan magnetik nanopartikel dalam air, diikuti dengan penambahan etil asetat, TEOS, NH4OH. Ukuran partikel mesopori silika nanopartikel yang diperoleh adalah 62 ± 10 nm
misel-Asam oleat disini yang terdiri dari gugus hidrofilik (bersifat polar) dan hidrofobik (bersifat non polar) akan masuk ke jaringan magnesium silikat dan membentuk interaksi van der waals yang ikatannya lemah. Sehingga ketika dilakukan kalsinasi asam oleat akan memecah jaringan magnesium silikat menjadi partikel-partikel yang lebih kecil.
Selain dari adanya gugus hidrofilik dan hidrofobik ini, asam oleat digunakan karena harganya yang lebih murah (dibanding dengan asam risinoleat, asam linoleat, asam linolenat, dll), dan juga dibandingkan dengan asam lemak jenuh seperti asam palmitat prosedurnya lebih sederhana karena tidak memerlukan pelarut tambahan untuk melarutkan asam lemaknya.
Penelitian tentang sintesis magnesium silikat nanopartikel menggunakan senyawa organik sebagai pengubah ukuran partikel masih sedikit dilaporkan. Hal ini menjadi ketertarikan bagi penulis untuk melakukan penelitian ini. Dimana magnesium silikat yang diperoleh dari hasil penambahan MgO pada silika sekam padi hasil ekstraksi secara alkalis kemudian dicampurkan dengan asam oleat kemudian campuran keduanya ini dikalsinasi pada suhu 900oC selama 4 jam.
1.2 Permasalahan
1. Apakah magnesium silikat dapat di sintesis dengan cara penambahan MgO pada silika
sekam padi
2. Bagaimana pengaruh penambahan asam oleat terhadap ukuran partikel, pori dan luas
permukaan dari magnesium silikat
1.3 Tujuan Penelitian
1. Untuk mengetahui apakah magnesium silikat dapat disintesis dengan cara penambahan
MgO pada silika sekam padi
2. Untuk mengetahui pengaruh penambahan asam oleat terhadap ukuran partikel, pori dan
1.4 Manfaat penelitian
Dapat memberikan informasi mengenai sintesis magnesium silikat dari hasil penambahan MgO pada silika sekam padi dan dengan adanya penambahan asam oleat yang dapat mempengaruhi ukuran partikel, ukuran pori dan luas permukaan dari magnesium silikat.
1.5 Lokasi penelitian
Penelitian ini dilakukan di laboratorium kimia anorganik FMIPA USU, Medan. Analisa FT-IR di lakukan di PT SOCI MAS Medan, analisa adsorpsi desorpsi isoterm nitrogen dilakukan di puslit KIMIA LIPI, analisa XRD dilakukan di laboratorium fisika UNIMED, Medan.
1.6 Metodologi Penelitian
Silika dari sekam padi diekstraksi alkalis dengan menggunakan NaOH 10% lalu dibuat dalam bentuk larutan natrium silikat kemudian ditambahkan suspensi Mg(OH)2 dari
PENGARUH PENAMBAHAN ASAM OLEAT DALAM SINTESIS
MAGNESIUM SILIKAT NANOPARTIKEL DARI
SILIKA SEKAM PADI
ABSTRAK
Telah dilakukan sintesis magnesium silikat nanopartikel dari silika sekam padi dengan menggunakan asam oleat. Sintesis ini dilakukan dengan mengekstraksi silika dari sekam padi dengan metode alkalis menggunakan NaOH 10% kemudian ditambahkan MgO. Magnesium silikat yang diperoleh kemudian di tambahkan dengan asam oleat dan dikalsinasi pada suhu 900oC selama 4 jam lalu ditentukan karakternya. Karakterisasi menggunakan XRD menunjukkan puncak difraksi kristal MgO, MgSiO3
dan Mg2SiO4. Spekturm FT-IR menunjukkan adanya gugus Si-O-Si dan Si-OH yang
mengindikasikan material magnesium silikat. Hasil adsorpsi desorpsi gas nitrogen magnesium silikat dengan menggunakan asam oleat menunjukkan ukuran pori, volume pori, luas permukaan dan ukuran partikel masing-masing adalah: 2,1048 nm, 0,017450 cm3/g, 62,1099m2/g dan 96,6030 nm. Hasil adsorpsi desorpsi nitrogen yang diperoleh ini berbeda dengan hasil adsorpsi desorpsi nitrogen magnesium silikat tanpa menggunakan asam oleat yang masing-masing adalah: 2,1106 nm, 0,001240 cm3/g, 3,3330 m2/g dan 1.800,2003 nm. Dari penelitian ini diperoleh bahwa dengan menggunakan asam oleat dapat menghasilkan material magnesium silikat nanopartikel.
THE INFLUENCE OF OLEIC ACID IN SYNTHESIS OF
MAGNESIUM SILICATE NANOPARTICLE
FROM RICE HUSK
ABSTRACT
Nanoparticle of magnesium silicate from silica rice husk use oleic acid has been synthesized. This synthesis is carried out by extracting silica from rice husk with alkalis method using NaOH 10% and then added MgO. Magnesium silicateobtained then addedthe oleic acid which acts as a template and calcined at a temperature of 900oC for 4 hours then defined that character. Characterization using XRD showed crystal diffraction peaks of MgO, MgSiO3 and Mg2SiO4. Spekturm FT-IR showed a
group of Si-O-Si and Si-OH indicating magnesium silicate material. The results of nitrogen adsorption desorption of magnesium silicate using oleic acid shows the pore size, pore volume, surface area and particle size, respectively: 2,1048 nm, 0,017450 cm3/g, 62,1099m2/g and 96,6030 nm. This result is in contrast to the results of nitrogen adsorption desorption magnesium silicate without using oleic acid, the results is: 2,1106 nm, 0,001240 cm3/g, 3,3330 m2/g and 1.800,2003 nm. From this research it was found that by using oleic acid as a template material can produce nanoparticles of magnesium silicate.
PENGARUH PENAMBAHAN ASAM OLEAT DALAM SINTESIS
MAGNESIUM SILIKAT NANOPARTIKEL DARI
SILIKA SEKAM PADI
SKRIPSI
SURYATI SIMAMORA
120802026
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGARUH PENAMBAHAN ASAM OLEAT DALAM SINTESIS
MAGNESIUM SILIKAT NANOPARTIKEL DARI
SILIKA SEKAM PADI
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SURYATI SIMAMORA
120802026
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul :Pengaruh Penambahan Asam Oleat dalam Sintesis Magnesium Silikat Nanopartikel dari Silika Sekam Padi Kategori : Skripsi
Nama : Suryati Simamora Nomor Induk Mahasiswa : 120802026
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, Januari 2017
Komisi Pembimbing:
Pembimbing 2 Pembimbing 1
Dr. Andriayani, M.Si Dra. Saur Lumbanraja, M.Si NIP. 195012221980031002 NIP. 195506231986012002
Disetujui oleh:
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENGARUH PENAMBAHAN ASAM OLEAT DALAM SINTESIS
MAGNESIUM SILIKAT NANOPARTIKEL DARI
SILIKA SEKAM PADI
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri, Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2017
PENGHARGAAN
Segala pujian hormat dan kemuliaan hanya bagi Allah yang telah menganugerahkan Keselamatan melalui Yesus Kristus yang tetap menguatkan penulis bahkan menjadi sumber pengharapan penulis dalam penyusunan skripsi ini.
Dengan rasa hormat, penulis menyampaikan terima kasih kepada Ibu Dra. Saur Lumban Raja, M.Si selaku pembimbing 1 dan Ibu Dr. Andriayani, M.Sc selaku pembimbing 2 yang telah banyak membimbing dan memberi arahan selama penyusunan skripsi ini. Terimakasih juga kepada Bapak Prof. Dr. Seri Bima Sembring selaku Ketua Bidang Kimia Anorganik FMIPA USU dan Bapak Dr. Nimpan Bangun, M.Sc selaku Kepala Laboratorium Kimia Anorganik FMIPA USU yang telah memberikan saran – saran kepada penulis. Terima kasih kepada Ibu Dr. Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu selaku Ketua Departemen dan Sekretaris Departemen Kimia S1 FMIPA-USU Medan serta seluruh dosen kimia yang telah banyak memberikan ilmu kepada penulis selama perkuliahan.
Ucapan terimakasih penulis sampaikan kepada orangtua tercinta, P. Simamora dan N. Br silaban yang selalu mendoakan dan mendukung penulis dalam doa maupun materil. Terimakasih juga buat ito dan eda Master, ito dan eda Dhika, ito dan eda Grace, abang Boima, kak Keke, kak Astry, adekku Andreas yang selalu menyemangati penulis.
Terimakasih kepada rekan-rekan asisten anorganik bang Hamdan, kak nabila, bang Mars, kak rahel, bang Daniel, kak anita, Juwita, Lince, Claresta, Rendi, Freddy, Baron, Slamet, Andini, Irma, Jefry, Jessica yang selalu menyemangati penulis dan membantu dalam penyelesaian skripsi penulis. Terimakasih kepada kak Rimenda sinulingga, kak Tiara lumban tobing, untuk Shema Iruel, Marlina, Fahmi, Julfi yang selalu menjadi tim doa dan menjadi keluarga kecil bagi penulis. Terimakasih juga buat sahabatku Cita, Elfrida, Kak Belinda, Rohani untuk kebersamaan kita selama ini. Untuk adekku Herman, Hernan, Jonathan, Yohana dan Rizki Yohanes, Indah, Putri yang menjadi bagian dari sukacitaku dan semoga kita semakin bertumbuh dalam Kristus.
Penulis menyadari bahwa isi skripsi ini masih jauh dari kata sempurna, namun kiranya dapat memberikan manfaat bagi ilmu pengetahuan khususnya di bidang kimia.
PENGARUH PENAMBAHAN ASAM OLEAT DALAM SINTESIS
MAGNESIUM SILIKAT NANOPARTIKEL DARI
SILIKA SEKAM PADI
ABSTRAK
Telah dilakukan sintesis magnesium silikat nanopartikel dari silika sekam padi dengan menggunakan asam oleat. Sintesis ini dilakukan dengan mengekstraksi silika dari sekam padi dengan metode alkalis menggunakan NaOH 10% kemudian ditambahkan MgO. Magnesium silikat yang diperoleh kemudian di tambahkan dengan asam oleat dan dikalsinasi pada suhu 900oC selama 4 jam lalu ditentukan karakternya. Karakterisasi menggunakan XRD menunjukkan puncak difraksi kristal MgO, MgSiO3
dan Mg2SiO4. Spekturm FT-IR menunjukkan adanya gugus Si-O-Si dan Si-OH yang
mengindikasikan material magnesium silikat. Hasil adsorpsi desorpsi gas nitrogen magnesium silikat dengan menggunakan asam oleat menunjukkan ukuran pori, volume pori, luas permukaan dan ukuran partikel masing-masing adalah: 2,1048 nm, 0,017450 cm3/g, 62,1099m2/g dan 96,6030 nm. Hasil adsorpsi desorpsi nitrogen yang diperoleh ini berbeda dengan hasil adsorpsi desorpsi nitrogen magnesium silikat tanpa menggunakan asam oleat yang masing-masing adalah: 2,1106 nm, 0,001240 cm3/g, 3,3330 m2/g dan 1.800,2003 nm. Dari penelitian ini diperoleh bahwa dengan menggunakan asam oleat dapat menghasilkan material magnesium silikat nanopartikel.
THE INFLUENCE OF OLEIC ACID IN SYNTHESIS OF
MAGNESIUM SILICATE NANOPARTICLE
FROM RICE HUSK
ABSTRACT
Nanoparticle of magnesium silicate from silica rice husk use oleic acid has been synthesized. This synthesis is carried out by extracting silica from rice husk with alkalis method using NaOH 10% and then added MgO. Magnesium silicateobtained then addedthe oleic acid which acts as a template and calcined at a temperature of 900oC for 4 hours then defined that character. Characterization using XRD showed crystal diffraction peaks of MgO, MgSiO3 and Mg2SiO4. Spekturm FT-IR showed a
group of Si-O-Si and Si-OH indicating magnesium silicate material. The results of nitrogen adsorption desorption of magnesium silicate using oleic acid shows the pore size, pore volume, surface area and particle size, respectively: 2,1048 nm, 0,017450 cm3/g, 62,1099m2/g and 96,6030 nm. This result is in contrast to the results of nitrogen adsorption desorption magnesium silicate without using oleic acid, the results is: 2,1106 nm, 0,001240 cm3/g, 3,3330 m2/g and 1.800,2003 nm. From this research it was found that by using oleic acid as a template material can produce nanoparticles of magnesium silicate.
DAFTAR ISI
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
BAB 1 PENDAHULUAN
1.1. Latar Belakang 1
BAB 2 TINJAUAN PUSTAKA
2.1. Sekam Padi 5
2.2. Silika 7
2.2.1. Sifat Fisika dan Kimia Silika 9 2.2.1.1. Sifat Fisika Silika 9 2.2.1.2. Sifat Kimia Silika 9 2.3. Magnesium Silikat
2.4. Asam oleat
2.5. Material nanopartikel
BAB 3 METODE PENELITIAN
3.1. Alat 19
3.2. Bahan 19
3.3. Prosedur Penelitian 20
3.3.1. Pembuatan larutan natrium silikat 20 3.3.2. Pembuatan suspensi Mg(OH)2 20
3.3.3. Pembuatan Magnesium silikat
3.3.4. Pembuatan Magnesium silikat nanopartikel
20 21
3.4. Bagan Penelitian 22
3.4.1. Pembuatan larutan natrium silikat 22 3.4.2. Pembuatan suspensi Mg(OH)2 23
3.4.3. Pembuatan Magnesium silikat
3.4.4. Pembuatan Magnesium silikat nanopartikel
23 24
BAB 4 HASIL DAN PEMBAHASAN 4.1. Pembuatan Magnesium silikat
4.1.1. Karakterisasi Magnesium silikat 4.1.1.1. Spekturm FT-IR
4.1.1.2. Difraksi sinar X (XRD)
4.1.1.3. Adsorpsi-desorpsi isoterm nitrogen
25 26 26 27 28 4.2. Pembuatan MgSiO3 nanopartikel
4.2.1. Karakterisasi Magnesium silikat nanopartikel 4.2.1.1. Spekturm FT-IR
4.2.1.2. Difraksi sinar X (XRD)
4.2.1.3. Adsorpsi-desorpsi isoterm nitrogen
29 29 29 30 32
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 34
5.2. Saran 34
DAFTAR PUSTAKA 35
DAFTAR TABEL
Nomor Judul Halaman Tabel
2.1. Komposisi kimia hasil analisis sekam padi 6 2.2.
4.1.
4.2.
Komposisi kimia dari abu sekam padi
Hasil analisa adsorpsi desorpsi gas nitrogen untuk Magnesium silikat
Hasil analisa adsorpsi desorpsi gas nitrogen untuk Magnesium silikat nanopartikel
7 29
DAFTAR GAMBAR
Nomor Judul Halaman Gambar
2.1. Struktur Perspektif Magnesium Silikat Diagram fasa komposit Magnesium silikat
10 11
2.2. Struktur asam oleat 12
4.1. Spektrum FT-IR Magnesium silikat 26 4.2. Difragtogram XRD Magnesium silikat 27 4.3. Daftar peak XRD Magnesium silikat 28 4.4.
4.5. 4.6. 4.7.
Spektrum FT-IR Magnesium silikat nanopartikel Difragtogram XRD Magnesium silikat nanopartikel Daftar peak XRD Magnesium silikat nanopartikel
Ilustrasi skematis interaksi antara magnesium silikat dan asam oleat
DAFTAR LAMPIRAN
Nomor Judul Halaman Lampiran
1. Difragtogram dan daftar peak XRD magnesium silikat 40 2.
3. 4.
Difragtogram dan daftar peak XRD magnesium silikat nanopartikel
Difraktogram XRD oleh Xu, et al., 2014 Difraktogram XRD oleh Bahadur, et al., 2004
43
Data Adsorpsi Desorpsi Nitrogen Magnesium silikat Data Adsorpsi Desorpsi Nitrogen Magnesium silikat nanopartikel
Spekturm FT-IR Magnesium silikat
Spekturm FT-IR Magnesium silikat nanopartikel
46 47