DAN PENGARUH PEMBERIAN AIR BEROKSIGEN
TERHADAP VIABILITAS BAKTERI PROBIOTIK
SECARA
IN VIVO
ENOK SOBARIAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Viabilitas Bakteri Probiotik
in vitro
dan
Pengaruh Pemberian Air Beroksigen terhadap Viabilitas Bakteri Probiotik secara
in vivo
,
adalah karya saya sendiri dan belum diajukan dalam bentuk apapun pada Perguruan
Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan
dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2007
@ Hak cipta milik IPB, tahun 2007 Hak cipta dilindungi
ENOK SOBARIAH.
Viability of Probiotic bacteria
in vitro
and the effect of oksigennated
water on viability of probiotik bacteria
in vivo.
Under direction of ALI KHOMSAN and
INGRID SURONO.
The aim of this study were to identify the
in vitro
tolerance of pro-biotic bacteria
to acid and bile salt condition; and to prove a hypothesis that the supplementation of
oxygenated water has a positive effecte on the body weight of rat and on viability of
pro-biotic bacteria. The first study was carried out in PAU Laboratory of IPB, while the
second study was conducted in FEMA Animal Laboratory of IPB and Micro-biology
Laboratory of Indonesia Institute of Technology. Fourty five rats aged 6 weeks were
devided into three groups, i.e., control group without probiotic (a0),
Lactobacillus casei
Shirota (a1), and
Lactobacillus
IS- 7257 (a2). Each group (consisting of 5 rats each) has
three different treatments, namely, control without oxygenated water (b0), 50 ppm
oxygenated water (b2), and 80 ppm oxygenated water (b2). Oxygenated water was
administered to the rats twice a day in the morning (3.25 ml) and afternoon (3.00 ml).
Observation was carried out on the body weight of the rats,, fecal lactic acid bacteria,
coliform, and anaerob bacteria by plate counting, for 4 periods, i.e, prior to the treatment
(c0), after three-day treatment (c1), seven-day treatment (c2), and on the 10
thday
treatment or three days after washed out period. The results indicated that probiotic
bacteria are resistant to acid and bile acid condition and. Oxygen concentration in water
has a significant positive influence on the body weight of rats towards viability of
probiotic bacteria (p-level < 0.05). The supplementation of oxygenated water 50 ppm
significantly increase the population of viable fecal lactic acid bacteria in
Lactobacillus.
casei
Shirota and
Lactobacillus IS-7257
groups after 3 and 7 days of treatment.
Lactobacillus
IS 7257 gave better response than
Lactobacillus casei
Shirota. The
supplementation of oxygenated water 80 ppm significantly reduce the fecal
coliform
and
anaerob bacteria
in-vivo
in both
Lactobacillus. casei
Shirota and
Lactobacillus
IS-7257
groups (p-level < 0.05).
ENOK SOBARIAH. Viabilitas Bakteri Probiotik
in vitro
dan Pengaruh Pemberian Air
Beroksigen terhadap Viabilitas Bakteri Probiotik secara
in vivo.
Dibimbing oleh ALI
KHOMSAN dan INGRID S. SURONO.
Penelitian ini bertujuan untuk mengetahui toleransi bakteri probiotik terhadap
kondisi asam dan garam empedu dan untuk membuktikan hipotesis bahwa air beroksigen
berpengaruh positif terhadap pertumbuhan berat badan tikus dan pertumbuhan bakteri
probiotik.
Penelitian ini menggunakan tikus putih
Spraque Douley
sebanyak 45 ekor yang
dibagi menjadi 3 kelompok, yaitu kelompok kontrol tanpa probiotik (A0), kelompok
Lactobacillus casei
Shirota (A1), dan
Lactobacillus
IS-7257
(A2) serta tiap kelompok
mendapat 3 variabel perlakuan yaitu tanpa air beroksigen (B0), air beroksigen konsentrasi
50 ppm (B1), dan air beroksigen konsentrasi 80 ppm (B2). Pemberian air beroksigen
dengan pencekokan dua kali sehari yaitu pagi dan sore masing-masing 3,25 dan 3,0 ml.
Pengamatan terhadap berat badan tikus, fekal bakteri asam laktat,
coliform
dan bakteri
anaerob dilakukan dalam 4 periode pengamatan yaitu sebelum perlakuan (C0), 3 hari
perlakuan (C1), 7 hari perlakuan (C2) dan setelah pemberian diet normal selama 3 hari
(C3).
Hasil penelitian menunjukkan bahwa bakteri probiotik tahan terhadap asam dan
garam empedu. Kombinasi air beroksigen dengan
Lactobacillus casei
Shirota dan
Lactobacillus
IS-7257
menghasilkan perubahan berat badan tikus (p< 0.05). Hasil
penelitian menunjukkan bahwa kombinasi air beroksigen 50 ppm dengan
Lactobacillus
IS-7257 (A2B1) meningkatkan secara nyata populasi bakteri asam laktat pada berbagai
periode pengamatan. Jumlah bakteri asam laktat pada pengamatan 3 hari lebih tinggi
bibandingkan dengan 0 hari dan 7 hari. Bakteri
coliform
dapat
ditekan pada perlakuan air
beroksigen 80 ppm dengan
Lactobacillus casei
Shirota (A1B2).
Dari hasil penelitian ini dapat disimpulkan bahwa konsentrasi air beroksigen 50
ppm dan 80 ppm masing-masing mempunyai manfaat meningkatkan bakteri probiotik
dan menurunkan bakteri
coliform
secara
in vivo
, sehingga diharapkan akan membantu
meningkatkan kesehatan saluran pencernaan dan penyerapan gizi menjadi lebih baik.
DAN PENGARUH PEMBERIAN AIR BEROKSIGEN
TERHADAP VIABILITAS BAKTERI PROBIOTIK
SECARA
IN VIVO
ENOK SOBARIAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Gizi Masyarakat dan Sumberdaya Keluarga
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama
: Enok Sobariah
NRP : A551050041
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. Ali Khomsan, MS Dr. Ir. Ingrid S Surono, MSc
Ketua Anggota
Diketahui,
Ketua Program Studi Gizi Masyarakat Dekan Sekolah Pascasarjana IPB
dan Sumberdaya Keluarga
Prof. Dr. Ir. Ali Khomsan, MS Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
karena atas rahmat dan karunia-Nya sehingga penulisan tesis berjudul Viabilitas
Bakteri Probiotik in vitro dan Pengaruh Pemberian Air beroksigen terhadap Viabilitas Bakteri Probiotik secara in vivo dapat diselesaikan tepat pada waktunya.
Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Program Studi Gizi Masyarakat dan Sumberdaya Keluarga,
Sekolah Pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan
terima kasih kepada:
1. Prof. Dr. Ir. Ali Khomsan, MS selaku ketua komisi pembimbing juga
sebagai Ketua Program Studi Gizi Masyarakat dan Sumberdaya
Keluarga dan Dr. Ir. Ingrid S. Surono, MSc. selaku anggota komisi
pembimbing yang telah banyak meluangkan waktu, tenaga, dan pikiran
sehingga tesis ini dapat diselesaikan.
2. Prof. Dr. Ir. Faisal Anwar selaku dosen penguji yang telah
memberikan arahan dan masukan untuk perbaikan tesis ini.
3. Staf pengajar Program Studi Gizi Masyarakat dan Sumberdaya
Keluarga.
4. Direktur RSU Cibabat Cimahi dr.H.Hanny Rono S, MSc beserta staf.
5. Kepala Dinas Kesehatan kota Cimahi dr. Hj. Endang, MSc beserta staf.
6. PT. Tirta Alam Semesta terima kasih atas bantuan dan kerjasamanya.
7. Dr. Ir. Aswi Rudito, MSi (Didit), Dr. Drs. Muhamad Royani MSc,
Unggul S.Kom, MSi, dan rekan mahasiswa Program Studi Gizi
Masyarakat dan Sumberdaya Keluarga Eli Walimah, Anita, Wiwik
Widayati.
8. Suamiku tercinta Asmara Hadi, ananda Febby Habibie Hadi Wijaya,
dan Vitha Fitriyani Hadi Wijaya, terima kasih atas doa restunya.
Penulis menyadari masih banyak kekurangan dalam penyajian tesis ini,
meskipun demikian, penulis berharap semoga tesis ini dapat bermanfaat.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang, Jawa Barat pada tanggal 4 Mei 1966 dari
ayah H. Tjetje Tjentasa dan ibu Hj Epong Warnaga. Penulis merupakan anak
ke-empat dari enam bersaudara.
Pada tahun 1984 penulis lulus dari SMA Negeri Situraja Sumedang, Jawa
barat dan pada tahun 1987 penulis berhasil menyelesaikan pendidikan Diploma
dari Akademi Gizi Jakarta.
Penulis diterima sebagai karyawan Rumah Sakit Swasta Muhammad
Husni Thamrin Jalan Salemba Jakarta pada tahun 1988, kemudian beralih dinas ke
PT Nestle Indonesia sebagai Medical Representatif pada tahun 1989. Penulis
diangkat sebagai Pegawai Negeri Sipil pada tahun 1991 bertempat di Rumah Sakit
Umum Swadana Daerah Cibabat Cimahi. Alhamdulillah penulis dapat
menyelesaikan pendidikan S1 bidang studi Gizi Masyarakat dan Sumberdaya
DAN PENGARUH PEMBERIAN AIR BEROKSIGEN
TERHADAP VIABILITAS BAKTERI PROBIOTIK
SECARA
IN VIVO
ENOK SOBARIAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Viabilitas Bakteri Probiotik
in vitro
dan
Pengaruh Pemberian Air Beroksigen terhadap Viabilitas Bakteri Probiotik secara
in vivo
,
adalah karya saya sendiri dan belum diajukan dalam bentuk apapun pada Perguruan
Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan
dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2007
@ Hak cipta milik IPB, tahun 2007 Hak cipta dilindungi
ENOK SOBARIAH.
Viability of Probiotic bacteria
in vitro
and the effect of oksigennated
water on viability of probiotik bacteria
in vivo.
Under direction of ALI KHOMSAN and
INGRID SURONO.
The aim of this study were to identify the
in vitro
tolerance of pro-biotic bacteria
to acid and bile salt condition; and to prove a hypothesis that the supplementation of
oxygenated water has a positive effecte on the body weight of rat and on viability of
pro-biotic bacteria. The first study was carried out in PAU Laboratory of IPB, while the
second study was conducted in FEMA Animal Laboratory of IPB and Micro-biology
Laboratory of Indonesia Institute of Technology. Fourty five rats aged 6 weeks were
devided into three groups, i.e., control group without probiotic (a0),
Lactobacillus casei
Shirota (a1), and
Lactobacillus
IS- 7257 (a2). Each group (consisting of 5 rats each) has
three different treatments, namely, control without oxygenated water (b0), 50 ppm
oxygenated water (b2), and 80 ppm oxygenated water (b2). Oxygenated water was
administered to the rats twice a day in the morning (3.25 ml) and afternoon (3.00 ml).
Observation was carried out on the body weight of the rats,, fecal lactic acid bacteria,
coliform, and anaerob bacteria by plate counting, for 4 periods, i.e, prior to the treatment
(c0), after three-day treatment (c1), seven-day treatment (c2), and on the 10
thday
treatment or three days after washed out period. The results indicated that probiotic
bacteria are resistant to acid and bile acid condition and. Oxygen concentration in water
has a significant positive influence on the body weight of rats towards viability of
probiotic bacteria (p-level < 0.05). The supplementation of oxygenated water 50 ppm
significantly increase the population of viable fecal lactic acid bacteria in
Lactobacillus.
casei
Shirota and
Lactobacillus IS-7257
groups after 3 and 7 days of treatment.
Lactobacillus
IS 7257 gave better response than
Lactobacillus casei
Shirota. The
supplementation of oxygenated water 80 ppm significantly reduce the fecal
coliform
and
anaerob bacteria
in-vivo
in both
Lactobacillus. casei
Shirota and
Lactobacillus
IS-7257
groups (p-level < 0.05).
ENOK SOBARIAH. Viabilitas Bakteri Probiotik
in vitro
dan Pengaruh Pemberian Air
Beroksigen terhadap Viabilitas Bakteri Probiotik secara
in vivo.
Dibimbing oleh ALI
KHOMSAN dan INGRID S. SURONO.
Penelitian ini bertujuan untuk mengetahui toleransi bakteri probiotik terhadap
kondisi asam dan garam empedu dan untuk membuktikan hipotesis bahwa air beroksigen
berpengaruh positif terhadap pertumbuhan berat badan tikus dan pertumbuhan bakteri
probiotik.
Penelitian ini menggunakan tikus putih
Spraque Douley
sebanyak 45 ekor yang
dibagi menjadi 3 kelompok, yaitu kelompok kontrol tanpa probiotik (A0), kelompok
Lactobacillus casei
Shirota (A1), dan
Lactobacillus
IS-7257
(A2) serta tiap kelompok
mendapat 3 variabel perlakuan yaitu tanpa air beroksigen (B0), air beroksigen konsentrasi
50 ppm (B1), dan air beroksigen konsentrasi 80 ppm (B2). Pemberian air beroksigen
dengan pencekokan dua kali sehari yaitu pagi dan sore masing-masing 3,25 dan 3,0 ml.
Pengamatan terhadap berat badan tikus, fekal bakteri asam laktat,
coliform
dan bakteri
anaerob dilakukan dalam 4 periode pengamatan yaitu sebelum perlakuan (C0), 3 hari
perlakuan (C1), 7 hari perlakuan (C2) dan setelah pemberian diet normal selama 3 hari
(C3).
Hasil penelitian menunjukkan bahwa bakteri probiotik tahan terhadap asam dan
garam empedu. Kombinasi air beroksigen dengan
Lactobacillus casei
Shirota dan
Lactobacillus
IS-7257
menghasilkan perubahan berat badan tikus (p< 0.05). Hasil
penelitian menunjukkan bahwa kombinasi air beroksigen 50 ppm dengan
Lactobacillus
IS-7257 (A2B1) meningkatkan secara nyata populasi bakteri asam laktat pada berbagai
periode pengamatan. Jumlah bakteri asam laktat pada pengamatan 3 hari lebih tinggi
bibandingkan dengan 0 hari dan 7 hari. Bakteri
coliform
dapat
ditekan pada perlakuan air
beroksigen 80 ppm dengan
Lactobacillus casei
Shirota (A1B2).
Dari hasil penelitian ini dapat disimpulkan bahwa konsentrasi air beroksigen 50
ppm dan 80 ppm masing-masing mempunyai manfaat meningkatkan bakteri probiotik
dan menurunkan bakteri
coliform
secara
in vivo
, sehingga diharapkan akan membantu
meningkatkan kesehatan saluran pencernaan dan penyerapan gizi menjadi lebih baik.
DAN PENGARUH PEMBERIAN AIR BEROKSIGEN
TERHADAP VIABILITAS BAKTERI PROBIOTIK
SECARA
IN VIVO
ENOK SOBARIAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Gizi Masyarakat dan Sumberdaya Keluarga
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama
: Enok Sobariah
NRP : A551050041
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. Ali Khomsan, MS Dr. Ir. Ingrid S Surono, MSc
Ketua Anggota
Diketahui,
Ketua Program Studi Gizi Masyarakat Dekan Sekolah Pascasarjana IPB
dan Sumberdaya Keluarga
Prof. Dr. Ir. Ali Khomsan, MS Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
karena atas rahmat dan karunia-Nya sehingga penulisan tesis berjudul Viabilitas
Bakteri Probiotik in vitro dan Pengaruh Pemberian Air beroksigen terhadap Viabilitas Bakteri Probiotik secara in vivo dapat diselesaikan tepat pada waktunya.
Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Program Studi Gizi Masyarakat dan Sumberdaya Keluarga,
Sekolah Pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan
terima kasih kepada:
1. Prof. Dr. Ir. Ali Khomsan, MS selaku ketua komisi pembimbing juga
sebagai Ketua Program Studi Gizi Masyarakat dan Sumberdaya
Keluarga dan Dr. Ir. Ingrid S. Surono, MSc. selaku anggota komisi
pembimbing yang telah banyak meluangkan waktu, tenaga, dan pikiran
sehingga tesis ini dapat diselesaikan.
2. Prof. Dr. Ir. Faisal Anwar selaku dosen penguji yang telah
memberikan arahan dan masukan untuk perbaikan tesis ini.
3. Staf pengajar Program Studi Gizi Masyarakat dan Sumberdaya
Keluarga.
4. Direktur RSU Cibabat Cimahi dr.H.Hanny Rono S, MSc beserta staf.
5. Kepala Dinas Kesehatan kota Cimahi dr. Hj. Endang, MSc beserta staf.
6. PT. Tirta Alam Semesta terima kasih atas bantuan dan kerjasamanya.
7. Dr. Ir. Aswi Rudito, MSi (Didit), Dr. Drs. Muhamad Royani MSc,
Unggul S.Kom, MSi, dan rekan mahasiswa Program Studi Gizi
Masyarakat dan Sumberdaya Keluarga Eli Walimah, Anita, Wiwik
Widayati.
8. Suamiku tercinta Asmara Hadi, ananda Febby Habibie Hadi Wijaya,
dan Vitha Fitriyani Hadi Wijaya, terima kasih atas doa restunya.
Penulis menyadari masih banyak kekurangan dalam penyajian tesis ini,
meskipun demikian, penulis berharap semoga tesis ini dapat bermanfaat.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang, Jawa Barat pada tanggal 4 Mei 1966 dari
ayah H. Tjetje Tjentasa dan ibu Hj Epong Warnaga. Penulis merupakan anak
ke-empat dari enam bersaudara.
Pada tahun 1984 penulis lulus dari SMA Negeri Situraja Sumedang, Jawa
barat dan pada tahun 1987 penulis berhasil menyelesaikan pendidikan Diploma
dari Akademi Gizi Jakarta.
Penulis diterima sebagai karyawan Rumah Sakit Swasta Muhammad
Husni Thamrin Jalan Salemba Jakarta pada tahun 1988, kemudian beralih dinas ke
PT Nestle Indonesia sebagai Medical Representatif pada tahun 1989. Penulis
diangkat sebagai Pegawai Negeri Sipil pada tahun 1991 bertempat di Rumah Sakit
Umum Swadana Daerah Cibabat Cimahi. Alhamdulillah penulis dapat
menyelesaikan pendidikan S1 bidang studi Gizi Masyarakat dan Sumberdaya
Halaman DAFTAR TABEL X
DAFTAR GAMBAR XI
DAFTAR LAMPIRAN XII
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesis ... 3
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Air Beroksigen ... 5
Bakteri Asam Laktat ... 8
Bakteri Probiotik ... 8
Lactobacillus casei Shirota ... 10
Lactobacillus IS-7257... 11
Viabilitas Bakteri Probiotik ... 12
Ketahanan terhadap Asam Lambung ... 12
Ketahanan terhadap Garam Empedu ... 14
Analisis Mikrobiologi ... 14
Hewan Percobaan ... 16
BAHAN DAN METODE ... 19
Waktu dan Tempat ... 19
Metode Penelitian ... 20
Persiapan Kultur ... 20
Persiapan dan Perlakuan Hewan Percobaan ... 20
Uji Viabilitas ... 20
Analisis Mikrobiologi ... 22
Persiapan Sampel Feses Tikus ... 23
Persiapan Analisis Mikrobiologi ... 23
Analisis Total Bakteri Asam Laktat Metode SPC ... 23
Analisis Bakteri Total Coliform Metode SPC ... 24
Analisis Total Bakteri Anaerob Metode SPC ... 24
Rancangan Percobaan dan Analisis Data ... 24
Rancangan Percobaan ... 24
Analisis Data ... 26
HASIL DAN PEMBAHASAN ... 27
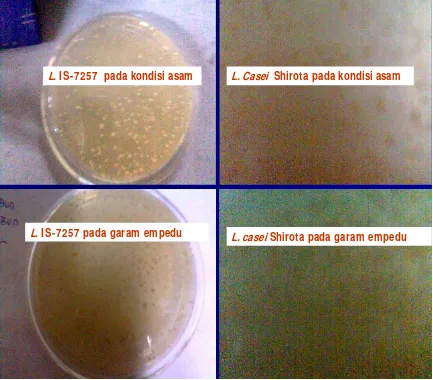
Ketahanan terhadap Asam dan Garam Empedu ... 27
Pengaruh Pemberian Air Beroksigen dan Probiotik ... 30
Pertambahan Berat Badan Tikus ... 30
Total Fekal Bakteri Asam Laktat ... 37
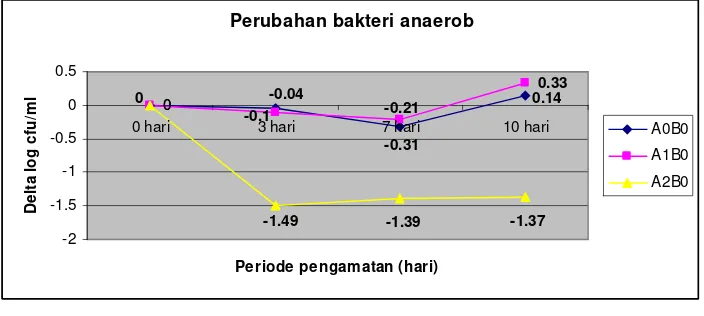
Total Fekal Bakteri Coliform ... 43
SIMPULAN DAN SARAN ... 55 Simpulan ... 55 Saran ... 55
DAFTAR PUSTAKA ... 56
Judul Tesis : Viabilitas Bakteri Probiotik in vitro dan Pengaruh Pemberian Air Beroksigen terhadap Viabilitas Bakteri Probiotik secara in vivo. Nama : Enok Sobariah
NRP : A551050041
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. Ali Khomsan, MS Dr. Ir. Ingrid S Surono, MSc Ketua Anggota
Diketahui,
Ketua Program Studi Gizi Masyarakat Dekan Sekolah Pascasarjana IPB dan Sumberdaya Keluarga
Prof. Dr. Ir. Ali Khomsan, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
Tanggal ujian : 1 Agustus 2007 Tanggal lulus :
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Kuasa
karena atas rahmat dan karunia-Nya sehingga penulisan tesis berjudul Viabilitas
Bakteri Probiotik in vitro dan Pengaruh Pemberian Air berksigen terhadap Viabilitas Bakteri Probiotik secara in vivo dapat diselesaikan tepat pada waktunya.
Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Program Studi Gizi Masyarakat dan Sumberdaya Keluarga,
Sekolah Pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan
terima kasih kepada:
1. Prof. Dr. Ir. Ali Khomsan, MS selaku ketua komisi pembimbing juga
sebagai Ketua Program Studi Gizi Masyarakat dan Sumberdaya
Keluarga dan Dr. Ir. Ingrid S. Surono, MSc. selaku anggota komisi
pembimbing yang telah banyak meluangkan waktu, tenaga, dan pikiran
sehingga tesis ini dapat diselesaikan.
2. Prof. Dr. Ir. Faisal Anwar selaku dosen penguji yang telah
memberikan arahan dan masukan untuk perbaikan tesis ini.
3. Staf pengajar Program Studi Gizi Masyarakat dan Sumberdaya
Keluarga.
4. Direktur RSU Cibabat Cimahi dr.H.Hanny Rono S, MSc beserta staf
5. Kepala Dinas Kesehatan kota Cimahi dr. Hj. Endang, MSc beserta staf
6. PT. Tirta Alam Semesta terima kasih atas bantuan dan kerjasamanya.
7. Dr. Ir. Aswi Rudito, MSi (Didit), Dr.Drs. Muhamad Royani MSc,
Unggul S.Kom, MSi, dan rekan mahasiswa Program Studi Gizi
Masyarakat dan Sumberdaya Keluarga Eli Walimah, Anita, Wiwik
Widayati.
8. Suamiku tercinta Asmara Hadi, ananda Febby Habibie Hadi Wijaya,
dan Vitha Fitriyani Hadi Wijaya, terima kasih atas doa restunya
Penulis menyadari masih banyak kekurangan dalam penyajian tesis ini,
meskipun demikian, penulis berharap semoga tesis ini dapat bermanfaat.
Bogor, Juli 2007
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang, Jawa Barat pada tangga 4 Mei 1966 dari
ayah H. Tjetje Tjentasa dan ibu Hj Epong Warnaga. Penulis merupakan anak
ke-empat dari enam bersaudara.
Pada tahun 1984 penulis lulus dari SMA Negeri Situraja Sumedang, dan
pada tahun 1987 penulis berhasil menyelesaikan pendidikan Diploma dari
Akademi Gizi Jakarta.
Penulis diterima sebagai karyawan Rumah Sakit Swasta Muhammad
Husni Thamrin Jalan Salemba Jakarta pada tahun 1988, kemudian beralih dinas ke
PT Nestle Indonesia sebagai Medical Representatif pada tahun 1989. Penulis
diangkat sebagai Pegawai Negeri Sipil pada tahun 1991 bertempat di Rumah Sakit
Umum Swadana Daerah Cibabat Cimahi. Alhamdulillah penulis dapat
menyelesaikan pendidikan S1 bidang studi Gizi Masyarakat dan Sumberdaya
Halaman
1 Alat bantu penelitian ... 19
2 Tahapan perlakuan pada tikus ... 22
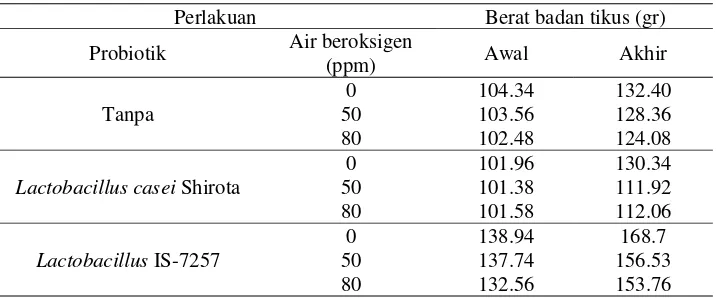
3 Rata-rata berat badan tikus pada awal dan akhir penelitian ... 31
4 Pengaruh perlakuan pemberian air beroksigen tanpa penambahan
probiotik terhadap pertambahan berat badan tikus secara in vivo ... 31 5 Pengaruh perlakuan pemberian air beroksigen dan bakteri Lactobacillus casei Shirota terhadap pertambahan berat badan tikus secara in vivo ... 32 6 Pengaruh perlakuan pemberian air beroksigen dan Lactobacillus
IS-7257 terhadap pertambahan berat badan tikus secara in vivo ... 33 7 Pengaruh perlakuan bakteri Lactobacillus casei Shirota dan L. IS-7257
terhadap pertambahan berat badan tikus secara in vivo ... 34 8 Pertambahan berat badan tikus ... 36
9 Pengaruh perlakuan tanpa bakteri probiotik dengan air beroksigen terhadap total fekal bakteri asam laktat secara in vivo ... 38 10 Pengaruh perlakuan pemberian air beroksigen dan bakteri Lactobacillus casei Shirota terhadap total fekal bakteri asam laktat secara in vivo ... 39 11 Pengaruh perlakuan pemberian air beroksigen dan Lactobacillus
IS-7257 terhadap total fekal bakteri asam laktat secara in vivo ... 40
12 Delta perubahan jumlah bakteri asam laktat ... 42
13 Pengaruh perlakuan tanpa bakteri probiotik dengan air beroksigen
(kontrol) terhadap total fekal bakteri coliform secara in vivo ... 44 14 Pengaruh perlakuan pemberian air beroksigen dan bakteri Lactobacillus casei Shirota terhadap total fekal bakteri coliformin vivo ... 45 15 Pengaruh perlakuan pemberian air beroksigen dan Lactobacillus
IS-7257 terhadap total fekal bakteri coliform secara in vivo ... 46
16 Delta perubahan bakteri coliform (log cfu/g) ... 48
17 Pengaruh perlakuan tanpa bakteri probiotik dan tanpa air beroksigen
(kontrol) terhadap total fekal bakteri anaerob secara in vivo ... 49 18 Pengaruh perlakuan pemberian air beroksigen dan bakteri Lactobacillus casei Shirota terhadap total fekal bakteri anaerob in vivo ... 50 19 Pengaruh perlakuan pemberian air beroksigen dan Lactobacillus
Halaman
1 Skema uji ketahanan bakteri asam laktat terhadap pH rendah
(modifikasi dari Zavaglia et al. 1998)... 21 2 Skema uji ketahanan bakteri probiotik terhadap garam empedu
(Zavaglia et al. 1998) ... 22 3 Ketahanan bakteri Lactobacillus casei Shirota terhadap asam lambung ... 27 4 Ketahanan bakteri Lactobacillus IS-7257 terhadap asam lambung ... 28 5 Ketahanan bakteri Lactobacillus casei Shirota dan Lactobacillus
IS- 7257 terhadap garam empedu ... .30
6 Pengaruh perlakuan pemberian bakteri probiotik tanpa air beroksigen
terhadap fekal bakteri asam laktat ... 41
7 Pengaruh penambahan probiotik terhadap jumlah bakteri coliform
secara in vivo ... 46 8 Pengaruh penambahan probiotik terhadap jumlah bakteri anaerob
Halaman
1 Ketahanan bakteri Lactobacillus casei Shirota terhadap asam lambung .... . 60 2 Ketahanan bakteri Lactobacillus IS- 7257 terhadap asam lambung ... 59 3 Ketahanan bakteri Lactobacillus casei Shirota dan IS- 7257 terhadap
garam empedu ... . 59
4 Data berat badan tikus selama periode pengamatan ... 61
5. Pengaruh pemberian air beroksigen dan probiotik terhadap fekal bakteri asam laktat secara invivo (kontrol) ... 62 6 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal bakteri
asam laktat secara invivo (Lactobacillus casei Shirota) ... 63 7 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal bakteri
asam laktat secara invivo (Lactobacillus IS-7257) ... 64 8 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal
coliform secara in vivo (kontrol) ... 65 9 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal coliform secara invivo (Lactobacillus casei shirota) ... 66 10 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal
coliform secara in vivo (Lactobacillus IS-7257) ... 67 11 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal bakteri anaerob secara invivo (kontrol) ... 68 12 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal
bakteri anaerob secara invivo (Lactobacillus casei Shirota) ... 69 13 Pengaruh pemberian air beroksigen dan probiotik terhadap fekal bakteri anaerob secara invivo (Lactobacillus IS-7257) ... 70 14 Hasil analisis ragam pengaruh probiotik dan air beroksigen terhadap berat
badan tikus ... 71
15 Hasil uji lanjut pengaruh probiotik dan air beroksigen terhadap berat badan tikus ... 71
16 Hasil uji lanjut periode pengamatan terhadap berat badan tikus ... 71
17 Hasil analisis ragam pengaruh probiotik dan air beroksigen terhadap jumlah bakteri asam laktat ... 71
18 Hasil uji lanjut pengaruh probiotik dan air beroksigen terhadap jumlah bakteri asam laktat ... 72
21 Hasil uji lanjut pengaruh probiotik dan air beroksigen terhadap jumlah
bakteri coliform ... 73
22 Hasil uji lanjut periode pengamatan terhadap jumlah bakteri coliform ... 73 23 Hasil analisis ragam pengaruh probiotik dan air beroksigen terhadap
jumlah bakteri anaerob ... 73
24 Hasil uji lanjut pengaruh probiotik dan air beroksigen terhadap jumlah
bakteri anaerob ... 73
Latar Belakang
Air merupakan unsur yang sangat penting dalam semua kehidupan, baik
kehidupan manusia, hewan maupun tumbuhan. Hampir semua metabolisme zat
gizi di dalam tubuh memerlukan air. Air berfungsi untuk transportasi zat gizi,
seperti protein, mineral, vitamin, dan zat gizi yang lainya ke seluruh tubuh,
bermanfaat untuk pengeluaran zat-zat racun atau sisa hasil pencernaan. Selain itu
juga berfungsi untuk keseimbangan fungsi tubuh dan mengatur suhu tubuh.
Mengonsumsi air yang cukup dapat meningkatkan fungsi hormon,
memperbaiki kemampuan hati, untuk memecah dan melepaskan lemak serta
mengurangi rasa haus dan lapar. Sebaliknya apabila kekurangan air dapat
menyebabkan konstipasi, infeksi saluran kemih, terbentuknya batu ginjal,
kelelahan dan masalah-masalah seputar kulit, rambut dan kuku (Khomsan 2005).
Selain air, unsur yang tidak kalah pentingnya dalam kehidupan adalah
oksigen. Oksigen diperlukan untuk proses pembakaran dalam tubuh, yaitu
mengubah zat-zat gizi sumber energi seperti karbohidrat, protein, dan lemak
menjadi energi yang diperlukan oleh tubuh untuk melakukan aktivitas sehari-hari.
Ciri utama orang yang mengalami kekurangan oksigen adalah merasa lelah,
mengantuk dan kurang waspada. Oksigen juga merupakan unsur vital dalam
regenerasi sel, tanpa oksigen akan terjadi proses degenerasi atau peluruhan.
Ketiadaan oksigen akan membawa kematian cepat pada mahluk hidup.
Pada tahun 2004 Rumawas dkk. meneliti air beroksigen dan
menghasilkan temuan yang menarik dari sisi ilmiah. Hipotesis bahwa oksigen
dalam air beroksigen akan mempengaruhi pertumbuhan ataupun akan meracuni
mikroba yang bermanfaat/probiotik tidak terbukti. Pada kultur Lactobacillus casei strain Shirota, penambahan O2 30-35 ppm menghasilkan kultur dengan populasi
bekteri asam laktat yang jauh lebih tinggi dibandingkan kontrol. Dengan demikian
kekhawatiran jika mengkonsumsi air beroksigen akan menurunkan jumlah
populasi bakteri baik di usus tidak terbukti.
Probiotik adalah bakteri ”baik” yang harus dikonsumsi dalam keadaan
yang cukup guna menghasilkan efek kesehatan yang positif. Probiotik
menghasilkan metabolit yaitu asam organik, hidrogen peroksida, karbondioksida
dan acidolin yang bersifat antimikroba terhadap bakteri patogen. Bakteri ini
mampu mengikat senyawa racun hasil metabolisma protein dan lemak, serta hasil
pemecahan enzim tertentu, sehingga meringankan tugas organ hati (Salminen
1999).
Probiotik merupakan mikroorganisma hidup, yang mempunyai pengaruh
menguntungkan pada kesehatan inang (manusia) dengan memperbaiki
keseimbangan mikrobiota intestinal. Efektifitas probiotik ditentukan oleh
kemampuannya dalam memberikan efek menguntungkan dalam sel inang,
sifatnya yang tidak patogenik dan tidak toksik dan juga kemampuanya bertahan
dan melakukan kegiatan metabolisma dalam usus (Gibson dan Fuller 2000)
Karena itu bakteri probiotik harus dapat menaklukan berbagai hambatan
fisiologis seperti asam lambung dan cairan empedu sehingga dapat mencapai dan
bertahan hidup dalam usus manusia. Dari dalam usus, bakteri ini membantu
meningkatkan kesehatan kita dengan cara mengaktifkan sel-sel kekebalan,
meningkatkan jumlah bakteri berguna, dan mengurangi jumlah bakteri yang
merugikan.
Probiotik dapat diberikan sebagai suplemen makanan, pemberian probiotik
dapat berpengaruh menguntungkan bagi kesehatan karena probiotik dapat
menghasilkan asam lemak rantai pendek dan menyebabkan suasana usus menjadi
asam sehingga menekan pertumbuhan bakteri patogen serta memperbaiki
keseimbangan mikrobiota usus. Mikroflora yang digolongkan sebagai probiotik
terutama adalah dari golongan Lactobacillus dan Bifidocterium.
Pengendalian penyakit pada manusia dan ternak menggunakan probiotik
telah dilakukan sejak lama dan terdokumentasi dengan baik (Fuller 1987). Tikus
merupakan hewan menyusui yang mempunyai peranan penting dalam kehidupan
manusia, baik bersifat menguntungkan maupun merugikan. Sifat menguntungkan
terutama dalam hal penggunaanya sebagai hewan percobaan di laboratorium,
hewan percobaan untuk menguji obat dan tingkat toksisitas racun hama terhadap
manusia (Priyambodo 2003).
Tikus sebagai hewan omnivora (pemakan segala) biasanya mau mengonsumsi semua makanan yang dapat dimakan oleh manusia, baik yang
berasal dari tumbuhan maupun dari hewan. Selain itu tikus akan memilih pakan
yang berkadar gizi seimbang dari beberapa pakan yang ada. Tikus memiliki
kesamaan saluran pencernaan dan proses metabolisme dengan manusia
(Priyambodo 2003).
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui pengaruh in vivo pemberian air beroksigen terhadap pertumbuhan bakteri probiotik dalam tubuh.
Secara khusus, tujuan penelitian ini dapat dirumuskan sebagai berikut:
1. Mengetahui toleransi bakteri probiotik terhadap kondisi asam dan garam
empedu.
2. Mengetahui pengaruh air oksigen dengan konsentrasi oksigen 50 ppm dan 80
ppm terhadap pertumbuhan berat badan tikus..
3. Mengetahui pengaruh air oksigen dengan konsentrasir oksigen 50 ppm dan 80
ppm terhadap pertumbuhan bakteri asam laktat.
4. Mengetahui pengaruh air oksigen dengan konsentrasir oksigen 50 ppm dan 80
ppm terhadap perubahan bakteri coliform.
5. Mengetahui pengaruh air oksigen dengan konsentrasi oksigen 50 ppm dan 80
ppm terhadap perubahan bakteri anaerob.
Hipotesis
Penelitian ini dimaksudkan untuk menguji hipotesa berikut:
a. Bakteri probiotik tahan terhadap kondisi asam dan garam empedu
b. Konsentrasi air beroksigen 50 dan 80 ppm berpengaruh nyata terhadap
pertumbuhan berat badan tikus.
c. Konsentrasi air beroksigen 50 dan 80 ppm berpengaruh nyata terhadap
pertambahan bakteri asam laktat secara in vivo.
d. Konsentrasi air beroksigen 50 dan 80 ppm berpengaruh nyata terhadap
e. Konsentrasi air beroksigen 50 dan 80 ppm berpengaruh terhadap perubahan
bakteri anaerob secara in vivo..
Manfaat Penelitian
Dari penelitian ini diharapkan akan diperoleh informasi tentang pengaruh
berbagai kadar oksigen dalam air terhadap pertumbuhan bakteri probiotik yang
akan memberikan dampak positif terhadap kesehatan dengan cara memperbaiki
keseimbangan mikrobiota dalam saluran pencernaan.
Air Beroksigen
Air merupakan bahan yang sangat penting bagi kehidupan umat manusia
dan fungsinya tidak pernah dapat digantikan dengan senyawa lain. Air juga
merupakan komponen penting dalam bahan makanan karena air dapat
mempengaruhi penampakan, tekstur serta cita rasa makanan kita. Bahkan dalam
bahan makanan sekalipun, seperti buah kering, tepung, serta biji-bijian,
terkandung air dalam jumlah tertentu. Semua bahan makanan mengandung air
dalam jumlah yang berbeda-beda, baik itu bahan makanan hewani maupun nabati.
Air berperan sebagai pembawa zat-zat makanan dan sisa-sisa metabolisme,
sebagai media reaksi yang menstabilkan pembentukan biopolymer, dan
sebagainya (Winarno 1997).
Bila tubuh manusia hidup dianalisis komposisi kimianya, maka akan
diketahui kandungan airnya rata-rata 65% atau sekitar 47 liter per orang dewasa.
Setiap hari sekitar 2,5 liter harus diganti dengan air yang baru. Diperkirakan dari
sejumlah air yang harus diganti tersebut 1,5 liter berasal dari air minum dan
sekitar 1,0 liter berasal dari bahan makanan yang dikonsumsi. Air sangat esensial
bagi kehidupan manusia, pada anak-anak kandungan airnya mencapai 75 % dari
berat badanya, orang dewasa kandungan airnya 59 % dari berat badan, dan lanjut
usia sebesar 50 % dari Berat badannya (Winarno 1997).
Air untuk dijadikan air minum harus memenuhi persyaratan fisika, kimia,
biologi dan radioaktif. Standar mutu air minum atau air untuk kebutuhan rumah
tangga ditetapkan berdasarkan Peraturan Menteri Kesehatan Republik Indonesia
Nomor : 01/Birhukmas/I/1975 tentang Syarat-syarat dan Pengawasan kualitas Air
Minum. Standar baku air minum tersebut disesuaikan dengan Standar
Internasional yang dikeluarkan WHO (Kusnaedi 2004). Air yang berkualitas baik
harus memenuhi persyaratan fisik, yaitu tampak jernih, tidak berwarna, rasanya
tawar, tidak berbau busuk, temperatur 20-26°C, tidak mengandung zat padatan,
juga harus memenuhi persyaratan kimia ; pH netral tidak terlalu asam dan tidak
terlalu basa, tidak mengandung bahan kimia beracun, garam atau ion logam, dan
Selain air, unsur yang tidak kalah pentingnya dalam kehidupan adalah
oksigen. Oksigen diperlukan untuk proses pembakaran dalam tubuh, yaitu
mengubah zat-zat gizi sumber energi seperti karbohidrat, protein, dan lemak
menjadi energi yang diperlukan oleh tubuh untuk melakukan aktivitas sehari-hari.
Ciri utama orang yang mengalami kekurangan oksigen adalah merasa lelah,
mengantuk dan kurang waspada. Oksigen merupakan unsur vital dalam
regenerasi sel, tanpa oksigen akan terjadi proses degenerasi atau peluruhan.
Ketiadaan oksigen akan membawa kematian cepat pada mahluk hidup. Air
beroksigen mempunyai kemampuan untuk menembus sel atau jaringan serta
membantu proses hidrasi tubuh. Selain itu air beroksigen dapat memperbaiki
fungsi sel tubuh, meningkatkan energi, membuat rasa nyaman, tidur lebih nyenyak
dan menyingkirkan racun tubuh (detoksifikasi) (Khomsan 2005).
Sebagian ilmuwan menyakini bahwa infeksi dan munculnya penyakit
terjadi karena kondisi lapar oksigen di tingkat sel. Sel kanker dapat berpoliferasi
ketika sel-sel tubuh mengalami defisiensi oksigen. Ketika konsentrasi oksigen
dalam tubuh turun sampai tingkat ekstrem dan berlangsung lama maka tubuh kita
menjadi sarang berkembang biaknya agen-agen infeksi seperti bakteri, virus, dan
jamur (Khomsan 2005).
Sebuah molekul air terdiri dari sebuah atom oksigen yang berikatan
kovalen dengan dua atom hidrogen. Hidrogen dan oksigen mempunyai daya padu
yang sangat besar antara keduanya. Keunikan air terjadi berkat ikatan pemadu
kedua unsurnya. Perangkaian jarak atom-atomnya mirip kunci yang masuk
lubangnya, kecocokannya begitu sempurna, sehingga air tergolong senyawa alam
yang paling mantap. Semua atom dalam molekul air terjalin menjadi satu oleh
ikatan kuat yang hanya dapat dipecahkan oleh perantara yang paling agresif,
misalnya energi listrik atau zat kimia seperti logam kalium (Winarno 1997).
Dalam pelaksanaanya di dalam tubuh air bekerja dengan elektrolit, yaitu
Natrium sebagai kation dominant di luar sel, mempertahankan volume cairan
ekstraseluler, keseimbangan asam basa, mengatur tekanan darah, dan untuk
metabolisma glukosa. Kalium sebagai kation utama dalam sel, mempertahankan
sebagai anion di seluruh tubuh, menjaga keasaman lambung, dan aktifitas enzim
dalam lambung. (Proboprastowo 1988)
Kehidupan kini semakin termanjakan dengan adanya air minum kemasan
yang praktis, tanpa perlu dimasak, dan harganya terjangkau. Selain itu, di pasaran
saat ini mulai bermunculan produk air kemasan baru yaitu air beroksigen.
Sesungguhnya air, dari manapun sumbernya, yang sering diminum kebanyakan
orang telah mengandung oksigen yang kadarnya sekitar 7 ppm. Air beroksigen
telah diperkaya dengan oksigen melalui rekayasa teknologi sehingga mengandung
O2 45 ppm – 80 ppm. Oksigen dimasukkan ke dalam air lewat suatu proses
dengan menggunakan tekanan, seperti halnya ketika membuat minuman
berkarbonasi (minuman ringan) yaitu dengan memompakan CO2 ke dalam air
(Khomsan 2005).
Oksigen yang diserap melalui membran intestinal diklaim dapat
meningkatkan imunitas dan memperbaiki sistem sirkulasi dalam tubuh. Oksigen
juga akan melekat di butir-butir darah merah yang kemudian masuk ke dalam
sel-sel tubuh manusia. Sebuah studi yang melibatkan 25 atlet pelari yang
mengkonsumsi air beroksigen menunjukkan hasil positif. Sejumlah 83% dari
pelari tersebut mempunyai performans prestasi yang lebih baik. Mereka
menghemat waktu 31 detik dalam suatu lomba lari (Khomsan 2005).
Rumawas dkk. (2004) yang meneliti air beroksigen menghasilkan temuan yang menarik dari sisi ilmiah. Hipotesis bahwa oksigen dalam air beroksigen
akan mempengaruhi pertumbuhan ataupun akan meracuni pertumbuhan mikroba
yang bermanfaat/probiotik tidak terbukti. Pada kultur bakteri probiotik
Lactobacillus casei strain Shirota, penambahan oksigen 30-35 ppm menghasilkan kultur dengan populasi bakteri probiotik asam laktat yang jauh lebih tinggi
dibandingkan kontrol. Dengan demikian kekhawatiran jika mengkonsumsi air
beroksigen akan menurunkan jumlah populasi probiotik pada mikroflora usus,
tidak terbukti. Probiotik adalah bakteri yang hidup diusus yang bermanfaat dan
Bakteri Asam Laktat
Bakteri asam laktat pertama kali ditemukan oleh Pasteur, seorang profesor
kimia di University of Lille, pada tahun 1878, Lister melaporkan isolasi bakteri
asam laktat asal susu yang tengik. Beberapa bakteri laktat dapat ditemukan juga
pada saluran pencernaan manusia maupun hewan (Surono 2004).
Bakteri asam laktat dan bifidobacteria termasuk dalam kelompok bakteri
baik bagi manusia dan umumnya memenuhi status GRAS (Generally Recognized As Safe), yaitu aman bagi manusia. Kelompok bakteri ini tidak membusukkan protein, dan dapat memetabolisme berbagai jenis karbohidrat secara fermentatif
menjadi asam laktat sehingga disebut bakteri asam laktat. Jadi makanan yang
tercemar oleh bakteri asam laktat menjadi rusak karena asam, dan akan menjadi
busuk kalau kemudian dicemari oleh bakteri pembusuk. (Surono 2004).
Bakteri asam laktat didefinisikan sebagai suatu kelompok bakteri gram
positif, tidak menghasilkan spora, berbentuk bulat atau batang yang memproduksi
asam laktat sebagai produk akhir metabolik utama selama fermentasi karbohidrat.
Bal dikelompokan ke dalam beberapa jenis antara lain Streptococcus (termasuk laktococcus), Leuconostoc, pediacoccus, Lactobacillus (Surono 2003). Lactobacillus casei Shirota dan Lactobacillus acidophilus dan Lactobacillus IS 7257 termasuk ke dalam bakteri asam laktat.
Bakteri Probiotik
Perhatian terhadap bakteri probiotik dimulai sejak tahun 1908, ketika Ellie
Metchnikoff seorang ahli mikrobiologi dari Institut Pasteur di Perancis, juga
seorang pemenang hadiah Nobel dibidang kedokteran, menyarankan untuk
mengkonsumsi susu fermentasi agar berumur panjang. Kemudian pada tahun
1965 konsep probiotik sudah mulai dikenal pertama kali digunakan oleh Lily dan
Stillwell. Probiotic dalam bahasa Yunani dari kata yang berarti untuk kehidupan.
Kemudian Fuller pada tahun 1989 mencoba memperbaiki definisi probiotik yang
berasal dari kata probios yang berarti kehidupan, adalah suplemen mikroba hidup yang memberikan efek positif kepada manusia dan hewan dengan memperbaiki
keseimbangan mikroflora usus. Hingga tahun 1990, masih diperdebatkan apakah
konsep probiotik itu fakta, fiksi, mitos atau suatu relitas. Pada tahun 1995 diakui
Salminen et al.(2004), juga menguatkan definisi probiotik yaitu preparasi mikroba hidup yang bermanfaat bagi kesehatan, dan efek menyehatkan dan
keamananya harus secara ilmiah teruji pada manusia melalui uji klinis. Hingga
saat ini tercatat sebanyak 8.000 subjek yang digunakan dan lebih dari 200 uji
klinis probiotik tanpa mengalami efek negatif dan membahayakan.
Dr. Stephen Bymes, ND seorang ahli gizi klinis dan ahli naturopati dalam
Health and Natural Journal menyebutkan bahwa dalam tubuh manusia normal kurang lebih terdapat 1800 gram bakteri. Sebagian bakteri tersebut hidup di usus
tetapi banyak pula yang hidup di kulit, mulut, tenggorokan dan lapisan bagian
dalam vagina. Jenis speciesnya mencapai lebih dari 400 macam (Surono 2004).
Bakteri tersebut hidup dalam tubuh manusia dengan berbagai macam kegunaan
bagi pencernaan, tulang, maupun sistem kekebalan. Semua bakteri tersebut
termasuk menguntungkan dan merupakan dasar dari kesehatan yang baik. Yang
disebut probiotik artinya untuk kehidupan.
Dalam memilih strain probiotik harus mempertimbangkan beberapa
kriteria penting, yang meliputi aspek keamanan, fungsional dan teknologi (Saarela
et al. 2000). Beberapa kriteria yang harus dimiliki oleh bakteri probiotik adalah : 1. Berasal dari manusia, 2. tahan terhadap asam lambung, 3. tahan terhadap garam
empedu, 4. bersifat antagonis terhadap bakteri pathogen dan karsinogenik, 5.
memproduksi senyawa antibakteri, 6. Mempunyai sifat penempelan pada sel usu
manusia, 7. Berkolonisasi dalam saluran usus manusia, , 8. Aman dalam makanan
dan pada penggunaan klinis serta 10. telah validasi secara klinis dan
didokumentasi efeknya terhadap kesehatan.
Manfaat kesehatan yang dapat diperoleh dari probiotik antara lain:
memelihara keseimbangan mikroflora normal usus, menghambat bakteri patogen,
merangsang sistem imun, aktivitas antikarsinogenik dan anti mutagenik,
mengurangi gejala lactose intolerance, dan penurunan kolesterol dalam serum
darah.
Permasalahan yang dihadapi oleh kultur probiotik adalah pertumbuhannya
yang lambat dan sifat sensori seperti flavour yang kurang baik. Permasalahan ini
dapat diatasi dengan penggunaan kultur strarter campuran sehingga menghasilkan
Selain manfaat di atas probiotik juga dapat membersihkan saluran cerna
dan dapat memproduksi vitamin berbagai jenis vitamin yaitu vitamin B3, B5, B6,
B9, dan B12, juga dapat menjaga fungsi hati sebagai penyerap racun dan toksin
yang dihasilkan oleh bakteri pathogen. Juga dapat mengaktifkan sel darah putih
serta limpa yang bertanggung jawab terhadap sistem pertahanan tubuh (Nur dkk.
2006).
Gibson dan Fuller (2000) juga menyatakan probiotik yang efektif harus
memenuhi beberapa kriteria, yaitu memberikan efek menguntungkan pada sel
inang, tidak patogenik dan tidak toksik, mengandung sejumlah besar sel hidup,
mampu bertahan dan melakukan kegiatan metabolisme dalam usus, tetap hidup
selama dalam penyimpanan dan waktu yang digunakan, mempunyai sifat sensorik
yang baik dan diisolasi dari sel inang sehingga tidak semua BAL merupakan
probiotik.
Klein dkk. (1998) melaporkan taksonomik dan fisiologi spesies
Lactobacillus probiotik termasuk ke dalam kelompok a). Lactobacillus acidophilus, b) Lactobacillus casei dan c) Lactobacillus reuteri / Lactobacillus fermentum. Kebanyakan strain Lactobacillus acidophillus yang digunakan dalam produksi susu fermentasi probiotik diidentifikasi sebagai Lactobacillus johnsonii atau Lactobacillus gasseri. Keduanya termasuk dalam group Lactobacillus acidophillus. Dalam penelitian ini bakteri asam laktat yang yang digunakan yaitu Lactobacillus IS-7257 dan Lactobacillus casei Shirota.
Lactobacillus casei Shirota
Lactobacillus casei Shirota mempunyai peranan penting dalam saluran pencernaan manusia. Bersama dengan species lain dari galur lactobacilli, bakteri
ini banyak ditemukan dalam usus kecil. Lactobacillus casei Shirota pertama kali diisolasi oleh Dr. Minori Shirota pada tahun 1935 dan telah dimanfaatkan secara
komersial oleh perusahaan Jepang Yakult Honsha sejak tahun 1955 untuk
menghasilkan produk yakult yang diklaim mengandung 6,5 milyar bakteri hidup
untuk setiap kemasan 65 ml.
lebar 0,6 – 0,7 µm, gram positif katalase negatif tidak membentuk endospora dan
kapsul, tidak mempunyai flagela, bersifat anaerobic fakultatif, tumbuh pada suhu
optimum 3,5 atau lebih (Selamat 1992).
Lactobacillus casei Shirota bersifat homofermentatif yaitu memecah glukosa terutama menjadi asam laktat (kira-kira 90%), selain itu juga
menghasilkan asam sitrat, malat, asetat, suksinat, asetal dehid, diasetil dan aseton
yang berperan dalam pembentukan flavor.
Mitsuoka (1990) mengelompokkan bakteri asam laktat berdasarkan
kemampuanya untuk tumbuh dalam usus manusia yaitu :
a. Kelompok yang dapat mencapai usus dalam keadaan hidup dan paling sering
ditemukan dalam kotoram manusia, contoh Bifidobacterium (B. Bifidum, B. Breve, B. Longum, B infantis, B adolescentis).
b. Kelompok yang dapat mencapai usus dalam keadaan hidup dan cukup sering
ditemukan dalam kotoran manusia, contoh Lactobacillus (Lactobacillus acidophilus dan Lactobacillus reuteri)
c. Kelompok yang dapat mencapai usus dalam keadaan hidup dan terkadang ditemukan dalam kotoran manusia, contoh Lactobacillus (Lactobacillus casei dan Lactobacillus brevis)
d. Kelompok yang bisa dipakai oleh industri susu dan tidak ditemukan dalam
kotoran manusia contoh, Lactobacillus (L.bulgaricus)
Lactobacillus IS -7257
Lactobacillus IS-7257 memiliki ciri-ciri, bakteri berbentuk batang pendek, gram positif, katalase negatif bersifat homo fermentatif. Bakteri ini dapat tumbuh
dengan baik pada suhu 37ºC, makroaerofilik. Lactobacillus IS-7257diisolasi dari dadih, susu fermentasi asal Sumatra Barat (Akuzawa dan Surono 2002) dan
bersifat probiotik (Surono 2003), serta dapat menempel pada mukus manusia
(Dharmawan et al. 2006). Akuzawa dan Surono (2002). Lactobacillus IS-7257 mempunyai kemampuan mengeliminasi cyanotoxin, yaitu suatu toksin yang
dihasilkan oleh cyanobacteria dalam air (Surono dkk. 2005).
Sebagai makanan fermentasi tradisional mikroba utama yang terlibat
beberapa jenis bakteri asam laktat meliputi genus Lactobacillus, Streptococcus, Lactococcus (Hapsono dkk. 1989 ; Surono dan Nuraeni 2001).
Viabilitas Bakteri Probiotik Ketahanan terhadap Asam Lambung
Sekresi asam lambung setiap hari sebanyak 2.000-3.000 ml berupa asam
hidrokhlorat, mukus dan enzim-enzim pencernaan, seperti enzim pepsin suatu
enzim penghidrolisis protein yang optimum pada pH 1,5-2,5. Alkohol dan kafein
menstimulir mukosa lambung dan memacu sekresi asam lambung. Semua bakteri
yang bisa hidup dalam tubuh manusia akan mati pada pH di bawah 3,0 . Drasar et al. (1969) menemukan bahwa pada pH rendah di bawah 2 pada saat lambung dalam keadaan istirahat, asam lambung steril, sedangkan pada pH di atas 4-5
bakteri dapat bertahan dan berkembang biak, dan bisa berkoloni sehingga
bermanfaat bagi kesehatan..
Sistem pencernaan manusia diawali dari mulut hingga usus, dan saluran
pencernaan dari esopagus atau kerongkongan hingga rektum atau anus. Waktu
yang dibutuhkan (transit time) makanan dari mulut sampai rektum kurang lebih satu setengah jam. Dengan demikian, strain probiotik juga harus bisa bertahan
pada kondisi asam setidaknya selama 90 menit (Surono 2004).
Apabila bakteri lolos dari lanbung dengan pH 1,5 maka akan masuk se
saluran usus bagian atas dimana garam empedu disekresikan ke dalam saluran
pencernaan. Konsentrasi garam empedu manusia bervariasi dan sulit diduga.
Selanjutnya bakteri yang lolos pada tahap ini akan berkolonisasi pada epitelium
saluran usus bagian bawah (Surono 2004). Dengan demikian, bakteri probiotik
harus dapat bertahan pada kondisi asam, harus tahan asam empedu, dan tumbuh
dalam saluran usus bagian bawah sebelum memulai aktivitasnya dalam
memberikan manfaat bagi kesehatan.
Definisi Salminen dkk. (1998) juga menguatkan pentingnya viabilitas
probiotik, yaitu preparasi mikroba hidup yang bermanfaat bagi kesehatan, dan
efek menyehatkan dan keamanannya harus secara ilmiah teruji pada manusia
melalui uji klinis. Saat ini definisi probiotik adalah adanya penekanan perlunya
jumlah mikroba yang cukup agar memberikan efek positif bagi kesehatan, bisa
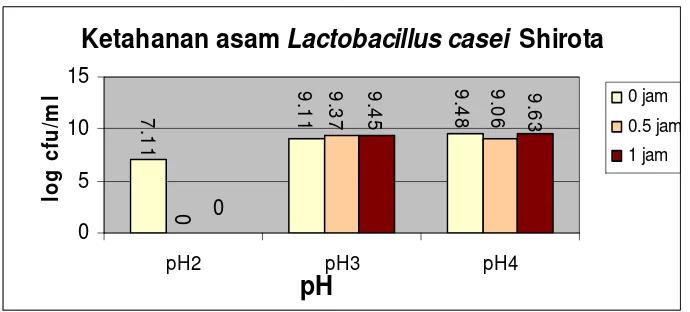
Untuk mengetahui tingkat ketahanan bakteri probiotik terhadap asam dan
garam empedu harus dilakukan uji viabilitas. Uji ketahanan asam lambug ini
berkaitan dengan sifat probiotik yaitu dapat bertahan hidup di dalam lambung
manusia. Hasil sekresi lambung dikenal dengan getah lambung yang merupakan
cairan jernih berwarna kuning pucat yang mengandung HCl 0,2 – 0,5% dengan
pH sekitar 1,7 (bila lambung dalam kondisi benar-benar kosong). Getah lambung
terdiri dari air 97-99%, musin (lendir), serta garam organik, enzim pencernaan
pepsin serta renin) dan lipase (Mayes 1996).
Bakteri asam laktat adalah mikroorganisme yang dapat hidup pada kisaran
pH yang sangat luas dan memiliki toleransi terhadap asam yang merupakan salah
satu syarat penting untuk dapat menjadi probiotik. Apabila bakteri tersebut masuk
ke dalam saluran pencernaan manusia maka harus mampu bertahan pada pH asam
lambung yaitu sekitar 3,5 (Kimoto dkk. 1999). Dalam kondisi yang sangat asam
membran sel bakteri akan mengalami kerusakan yang mengakibatkan hilangnya
komponen-komponen intraseluler, seperti Mg, K dan lemak dari sel, kerusakan ini
akam menyebabkan kematian pada sel (Bender dan Marquis 1987; In Hong
dkk.1999).
Bender dan Marquis (1987) melaporkan bahwa actobacillus casei yang berada pada medium dengan pH 3 ternyata tidak segera melepaskan Mg, tetapi
terjadi pada pada pH yang sama setelah 4 jam. Hal ini yang menyebabkan
Lactobacillus casei lebih tahan pada kondisi asam. Ketahan Lactobasillus pada pH rendah terjadi karena (1) kemampuannya dalam mempertahankan pH internal
lebih alkali daripada pH eksternal (2) mempunyai membran sel yang lebih tahan
terhadap kebocoran sel akibat terpapar pH rendah (Bender dan Marquis 1986).
Zavaglia dkk. (1998) menguji daya tahan isolat klinis Bifidobacteria pada pH 3 selama 1 jam. Hasilnya menunjukkan bahwa sebanyak 11 dari 25 isolat
bifidobacteria masih hidup dalam kondisi pH rendah, dengan ketahanan lebih
besar dari 1%). Isolat bakteri asal laktat dari dadih yang berhasil diisolasi oleh
Elida (2002) ternyata menunjukkan daya tahan tinggi pada pH 3,5 selama 24 jam.
Bakteri asam laktat dari dadih tersebut (L. brevis ae4, S. lactis subsp. diacetylactis abkl, Ln. mesenteroides abkl dan Ln. paramesenteroides dk7) memiliki ketahanan terhadap asam berkisar antara 70-90% dengan penurunan sebesar 1 log dari
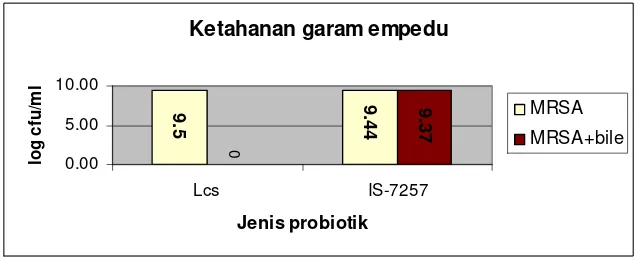
Ketahanan terhadap Garam Empedu
Lactobacillus adalah mikroflora normal yang terdapat pada saluran pencernaan manusia dan mempunyai daya tahan yang bervariasi terhadap garam
empedu/bile. Ketahanan terhadap garam empedu juga merupakan syarat penting untuk probiotik seperti ketahanan terhadap asam, menurut Kimono dkk. (1999),
Zavaglia dkk. (1998) dan Jacobsen dkk. (1999), semua mikroba yang berhasil hidup setelah ditumbuhkan dalam MRSA yang ditambah 0,5% oxgall, dinyatakan
bersifat tahan terhadap garam empedu.
Lactobaillus yang paling resisten terhadap garam empedu, terdapat pada bagian atas usus halus (jejenum) (Gilliland dkk. 1984). Bakteri asam laktat yang
terdapat pada jejenum jumlahnya lebih rendah dibandingkan pada ileum,rectum dan kolon (Yu dan Tsen 1983) dan Drouault at al. (1999). Hal ini disebabkan karena konsentrasi garam empedu di daerah jejenum lebih tinggi daripada ileum,
karena lokasinya paling dekat bila garam empedu masuk ke saluran usus.
Kemampuan Lactobacillus acidophilus untuk meningkatkan jumlah Laktobasillus pada bagian atas usus halus merupakan hal yang penting untuk mengontrol pertumbuhan patogen yang memasuki saluran pencernaan. Jumlah
lactobasili pada usus besar dan dalam feses dapat dijadikan indikator jumlah yang
kurang lebih sama dengan yang berada dalam saluran usus bagian atas (Gilliland
dkk. 1984)
Menurut Booth dan Kroll (1989) bakteri asam laktat mempunyai
ketahanan yang berbeda terhadap garam empedu yang berhubungan dengan
kerusakan terhadap membran luar sel bakteri. Semakin tinggi konsentrasi garam
empedu, maka jumlah sel laktobasili yang mati juga akan meningkat (Ngatirah
dkk. 2000 dan Kusumawati 2002).
Analisis Mikrobiologi
Analisis mikrobiologi dilakukan untuk mengetahui dan menghitung jumlah
jasad renik pada suspensi atau bahan. Ada beberapa cara yang dapat digunakan
untuk menghitung atau mengukur jumlah jasad renik yang umum digunakan
dan kelebihan. Pada penelitian ini menggunakan metoda hitung cawan (Total Plate Counts) (Fardiaz 1992).
Menurut Fardiaz (1992) prinsip dari metoda hitung cawan adalah jika sel
jasad renik yang masih hidup ditumbuhkan pada medium agar, maka sel jasad
renik tersebut akan berkembang biak dan membentuk koloni yang dapat dilihat
langsung dan dihitung dengan mata tanpa menggunakan mikroskop. Metode
hitung cawan merupakan metode yang paling sensitif untuk menentukan jumlah
jasad renik karena beberapa hal, yaitu : Hanya sel yang masih hidup yang
dihitung, beberapa jenis jasad renik dapat dihitung sekaligus, dan dapat digunakan
untuk isolasi dan identifikasi jasad renik karena koloni yang terbentuk mungkin
berasal dari satu jasad renik yang mempunyai penampakan pertumbuhan spesifik.
Walaupun metode hitung cawan ini mempunyai kelemahan-kelemahan juga.
dalam metoda hitung cawan bahan diperkirakan mengandung 300 sel jasad renik
permili atau pergram atau per cm jika pengambilan contoh dilakukan pada
permukaan, memerlukan pengenceran sebelum ditumbuhkan pada medium agar
di dalam cawan petri. Setelah inkubasi akan terbentuk koloni pada cawan tersebut
dalam jumlah yang dapat dihitung dimana jumlah yang terbaik adalah diantara 30
sampai 300 koloni. Pengenceran basanya dilakukan secara desimal yaitu 1:10,
1:100, 1:1000 dan seterusnya, atau 1:100, 1:10.000, 1:1.000.000 dan seterusnya.
Larutan yang digunakan untuk pengenceran dapat berupa larutan buffer fospan
0,85 % NaCL atau larutan ringer.
Cara pemupukan dalam metode hitung cawan dibedakan atas dua cara yaitu
metoda tuang (pour plate) dan metode permukaan (surface spread plate). Dalam metode tuang contoh dari pengenceran yang dikehendaki dimasukkan ke dalam
cawan petri, kemudian ditambah agar cair steril yang sudah didinginkan (47-50
ºC) sebanyak 15-20 ml dan digoyangkan supaya contoh menyebar rata. Pada
pemupukan dengan metoda permukaan terlebih dahulu dibuat agar cawan
kemudian 0,1 ml contoh yang telah diencerkan dipipet pada permukaan agar
tersebut, dan diratakan dengan batang gelas melengkung yang steril. Jumlah
koloni dalam contoh dihitung : Koloni per ml atau pergram sama dengan jumlah
Untuk melaporkan hasil analisis mikrobiologi dengan cara hitung cawan
digunakan suatu standar yang disebut Standart Plate Count (SPC) sebagai berikut: :Cawan yang dipilih atau yang dihitung adalah yang mengandung jumlah
koloni antara 30 sampai 300, beberapa koloni yang bergabung menjadi satu
merupakan satu kumpulan koloni yang besar dimana jumlah koloninya diragukan
dapat dihitung satu koloni., satu deretan rantai koloni yang terlihat sebagai suatu
garis tebal dihitung sebagai satu koloni.
Hewan Percobaan
Hewan percobaan adalah hewan yang sengaja dipelihara dan diternakkan
untuk dipakai sebagai hewan model guna mempelajari berbagai macam bidang
ilmu dalam skala penelitian atau pengamatan laboratorium. Pemanfaatan hewan
percobaan menurut pengertian secara umum ialah untuk penelitian yang
mendasarkan pengamatan aktivitas biologi tergantung pada bidang ilmu yang
dibina dan lingkungan apa suatu laboratorium bernaung sehingga pemanfaatan
hewan percobaan ini akan mengarah ke suatu tujuan khusus (Malole dan Pramono
1989).
Penggunaan hewan percobaan dilakukan untuk menguji keamanan atau
efek samping dari suatu bahan kimia atau alami yang sering dibubuhkan pada
bahan makanan hewan serta manusia dengan tujuan memberi warna yang
menarik, aroma, obat, pencegahan penyakit, dan pengawet. Karena tujuan akhir
dari pengujian adalah untuk keselamatan manusia maka hewan percobaan yang
digunakan adalah hewan-hewan yang mempunyai sifat-sifat respon biologi dan
adaptasi mendekati manusia. Kesamaan filogeni antara manusia dengan primata
mendorong para ilmuwan memilih hewan primate sebagai model untuk maksud
ini. Akan tetapi karena dari segi pengadaannya tidak selalu lancar sedangkan dari
pemeliharaannya juga memerlukan biaya yang besar maka tikus putih dapat
dipilih sebagai alternative (Malole dan Pramono 1989).
Tikus putih bila diperlakukan dengan halus akan mudah dikendalikan,
sebaliknya bila diperlakukan dengan kasar mereka akan menggigit. Tikus putih
dalam berbagai galur tikus putih terutama karena perbedaan dalam kepekaan
terhadap penyakit (Malole dan Pramono 1989).
Tikus putih liar aktif pada malam hari (nocturnal), sedangkan tikus putih
percobaan biasanya aktif pada siang hari. Tikus putih yang digunakan di
laboratium umumnya ditempatkan di kotak yang terbuat dari plastik dan diberi
alas kandang secukupnya, kotak tersebut diberi tutup berupa kawat (Harkness dan
Wagner 1989). Alas kandang yang baik, dapat berupa sekam padi atau serbuk
gergaji, bila digunakan serbuk gergaji harus bebas debu, bila digunakan sekam
padi harus diperhatikan kebersihannya agar tidak terkontaminasi urin dan feses
(Smith dan Mangkoewijoyo 1987).
Tikus putih yang dipelihara sebagai hewan percobaan biasanya diberikan
makanan berupa pellet dalam jumlah tanpa batas. Minuman harus selalu tersedia
pada kandang tikus putih, tempat minum biasanya menggunakan botol yang
terbuat dari kaca, dari botol tersebut tikus putih dapat minum melalui pipa gelas.
Botol dan selang harus dibersihkan minimal satu atau dua kali dalam seminggu
(Smith dan Mangkoewijoyo 1987).
Penggunaan tikus sebagai hewan percobaan dalam suatu penelitian karena
saluran pencernaannya menyerupai saluran pencernaan manusia sehingga apa
yang dimakan oleh manusia dapat juga dimakan dan dicerna oleh tikus
(Priambodo 2003). Banyak makanan untuk tikus tersusun dari komposisi alami
dan mudah diperoleh dari sumberdaya komersial. Namun, pakan yang diberikan
pada tikus sebaiknya mengandung nutrient pada komposisi yang tepat. Protein
pakan harus mengandung asam amino esensial yang dibutuhkan tikus yaitu :
arginin, histidin, isoleusin, leusin, lisin, metionin, fenilalanin, treonin, triptofan,
dan valin (Mc Donald et al. 1973). Pakan juga harus mengandung vitamin seperti
vitamin A, D, B12, alpa-tokoferol, asam linoleat, tiamin, riboflavin, pantotenat,
biotin, piridoksin, dan kolin.
Jika tikus laboratorium mengalami kekurangan nutrient maka tikus akan
secara sendirinya memilih nutrient yang dibutuhkan jika diberi hubungan kepakan
tersedia (Hainsworth 1981). Weih (1989) menyatakan bahwa pada kondisi dimana
pakan diberikan dalam jumlah yang sangat terbatas maka tikus akan mengurangi
meningkatkan penggantian energi. Pemberian pakan dalam jumlah yang terbatas
dan adanya ketidakseimbangan dalam diet dapat menyebabkan gangguan dalam
tubuh hewan misalnya malnutrisis, undernutrisi.
Adapun kriteria yang umum yang digunakan dalam menaksir kecukupan
nutrisi makanan antara lain pertumbuhan, reproduksi, pola tingkah laku,
persediaan nutrisi, aktivitas enzim, histology jaringan asam amino dan kandungan
asam amino dan protein pada jaringan (National Research Council 1978).
Amstrong dan Heistad (1990) melakukan pengamatan dari waktu ke waktu
yang menunjukkan kemampuan tikus untuk digunakan sebagai hewan percobaan.
Penggunaan tikus jantan untuk menghindari adanya pengaruh hormonal terhadap
hewan percobaan yang digunakan, misalnya hormon estrogen (Grundy 1991).
Sebelum masa perlakuan, semua tikus perlu diadaptasikan agar seragam. Masa
adaptasi ini perlu untuk menciptakan kondisi yang relatif homogen sehingga tepat
untuk perancangan percobaan Rancangan Acak Lengkap (Mattjik & Sumertajaya
2002). Penyeragaman pola makan dan minum, kondisi kandang dan lingkungan,
dan kondisi tikus yang bersangkutan (galur, jenis kelamin, usia, bobot badan)
merupakan usaha untuk mencapai kehomogenan.
Satu pertiga dari komposisi fekal adalah bakteri yang masih hidup maupun
yang sudah mati. Sekitar 99% bakteri tersebut bersifat anaerob. Usus besar atau
kolon ditempati sekitar 400-500 jenis bakteri yang jumlahnya triliunan bakteri,
dan bakteri laktat jumlahnya sekitar 104-109 bakteri (Surono 2004) sehingga fekal
Waktu dan Tempat
Penelitian dilaksanakan selama satu bulan dan bertempat di laboratorium
hewan untuk memelihara hewan percobaan Departemen Gizi Masyarat Institut
Pertanian Bogor. Analisis mikrobiologi dilakukan di laboratorium mikrobiologi
ITI (Institut Teknologi Indonesia), Serpong.
Bahan dan Alat
Penelitian ini menggunakan hewan percobaan tikus putih Spraque Dauley (SD), kultur bakteri asam laktat yaitu Lactobacillus casei Shirota dan Lactobacillus IS-7257serta air oksigen konsentrasi 50 ppm konsentrasi 80 ppm. Bahan makanan yang diberikan pada hewan percobaan terdiri dari tepung
maizena, casein, CMC, vitamin, mineral, dan minyak jagung mazola.
Analisis uji viabilitas in vitro menggunakan bahan-bahan MRSA, MRSB, larutan HCl 10%dan 0,5% garam empedu. Untuk analisis mikrobiologi (in-vivo) digunakan bahan kultur Lactobacillus casei Shirota, Lactobacillus IS-7257 serta air beroksigen konsentrasi 50 ppm dan konsentrasi 80 ppm, media MRSA (untuk
bakteri asam laktat), media VRBA (untuk bakteri coliform) dan untuk bakteri total anaerob menggunakan media PCA (Plate Count Agar). Alat-alat yang digunakan
dalam penelitian ini tersaji pada Tabel 1.
Tabel 1 Alat bantu penelitian
No Tempat Alat Fungsi
1. Laboratorium Departemen Gizi Masyarakat IPB
Kandang metabolik Tempat tikus (makan, minum, istirahat)
Timbangan analitik - Menimbang berat tikus - Menimbang feses - Menimbang pakan
Anaerob jar Alat penyimpan dan membawa sampel steril bersifat anaerob
Seperangkat incubator
Tempat inkubasi
Seperangkat lamina Tempat perlakuan steril
Seperangkat oven Untuk persiapan media tumbuh bakteri VRBA, MRNA,PCA.
2. Laboratorium Mikrobiologi ITI
Aotoclaf Cawan petri
Metode Penelitian
Persiapan Kultur
Kultur bakteri Lactobacillus casei Shirota dan Lactobacillus IS-7257 diberikan dalam bentuk kultur kering beku.
Persiapan dan Perlakuan Hewan Percobaan
Hewan percobaan menggunakan tikus putih Spraque Dauley (SD), dengan persyaratan, usia 6 minggu dengan berat tubuh berkisar antara 74,8 gram hingga
153,4 gram sebanyak 45 ekor. Hewan percobaan tikus ini diperoleh dari Balai
Penelitian Veteriner, Bogor.
Setelah siap sejumlah tikus dengan kriteria yang diinginkan kemudian
ditempatkan pada kandang metabolik perindividu, dan diberikan diet normal
dengan komposisi rangsum sesuai dengan standar, tepung maizena 75 %, casein
10 %, CMC 1 %, vitamin 1 %, mix mineral 5 %, dan minyak jagung mazola 8 %.
Setelah 5 hari adaptasi, tikus kemudian ditimbang dan disusun menurut berat
badan, dan diurutkan dari yang paling kecil ke yang paling besar.
Hari ke 6 mulai diberikan perlakuan khusus, selain diberikan diet standar
juga diberikan kultur dengan dosis 1010 cfu/hari sebanyak 10 mg dicampur dengan
1 gram ransum untuk memastikan dikonsumsi habis, perlakuan berlangsung
selama 7 hari dan hari ke 8 sampai ke-10 kembali diberikan diet standar seperti
masa adaptasi. Minuman yang diberikan selain aqua adalah air beroksigen 50
ppm dan 80 ppm sebagai variabel bebas sebanyak 6,25 ml, diberikan sehari dua
kali, pagi sebanyak 3,25 ml dan sore sebanyak 3 ml. Proses pemberian air
beroksigen dengan cara dicekokan secara langsungagar dapat dipastikan diminum
habis.Tikus ditimbang setiap 2 hari sekali.
Uji Viabilitas
Uji viabilitas ini bertujuan untuk menguji ketahanan bakteri probiotik
terhadap pH rendah dan ketahanan terhadap garam empedu. Nilai pH yang dipilih
adalah pH 2, pH 3 dan pH 4, yang disesuaikan deng