ANALISIS FISIOLOGIS DAN MOLEKULER FENOMENA
TANDAN BUAH KERAS PADA KELAPA SAWIT
(
Elaeis guineensis
Jacq.)
ROBERDI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul “Analisis Fisiologis dan Molekuler Fenomena Tandan Buah Keras pada Kelapa Sawit (Elaeis guineensis Jacq.)” adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2014
Roberdi
RINGKASAN
ROBERDI. Analisis Fisiologis dan Molekuler Fenomena Tandan Buah Keras pada Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh SOBIR,
SUDIRMAN YAHYA dan NURITA TORUAN-MATHIUS.
Permintaan terhadap produk turunan kelapa sawit yang tinggi menyebabkan perluasan perkebunan kelapa sawit meningkat sekitar 10% per tahun. Ketersediaan lahan yang sesuai untuk perkebunan kelapa sawit sudah terbatas. Hal ini menyebabkan perluasan kebun kelapa sawit harus menggunakan lahan marginal beriklim kering yang kurang sesuai untuk pertumbuhan dan produksinya. Khusus di Lampung, iklim yang tidak sesuai mengakibatkan terbentuknya tandan buah keras. Fenomena ini mencapai 30% dari produksi tandan buah segar.
Tujuan umum penelitian ini adalah mendapatkan perbedaan karakter fisik dan komposisi biokimia antara tandan buah normal dan tandan buah keras serta mendapatkan peranan faktor genetik dan lingkungan terhadap pembentukan tandan buah keras di lapangan. Tujuan khususnya adalah mendapatkan 1) pembeda antara tandan buah keras dan tandan buah normal untuk karakter fisik dan komposisi biokimia, 2) unsur iklim yang paling berperan dalam pembentukan tandan buah keras; 3) kombinasi marka AFLP yang dapat membedakan, dan 4) sekuen pita spesifik tandan buah keras hasil cDNA-AFLP.
Bahan tanam yang digunakan adalah tanaman kelapa sawit Tenera (D x P) berumur sekitar 20 tahun yang memiliki tandan buah normal dan tandan buah keras dari kebun di Lampung. Analisis korelasi serta analisis lintas dilakukan antara unsur-unsur iklim berdasarkan data yang diamati selama 6 tahun dengan pembentukan tandan buah keras. Selain itu dilakukan juga analisis sifat fisik dan komposisi biokimia tandan buah. Sedangkan untuk mengetahui faktor genetik yang terlibat dalam pembentukan tandan buah keras dilakukan analisis molekuler menggunakan marka AFLP dan teknik cDNA-AFLP.
Hasil yang diperoleh menunjukkan bahwa tandan buah keras terbentuk disebabkan terjadi cekaman kekeringan pada tanaman kelapa sawit dalam periode enam sampai sembilan bulan sebelum tandan buah dipanen. Cekaman air dipicu oleh rendahnya curah hujan dan didukung oleh unsur iklim lain diantaranya kelembaban relatif udara yang rendah, kecepatan angin yang tinggi serta lama penyinaran matahari yang panjang dan menyebabkan laju transpirasi tanaman meningkat.
Pengamatan di lapangan menunjukkan bahwa dalam satu tanaman ditemukan tandan buah keras dan tandan buah normal. Pada periode waktu tertentu tanaman dengan tandan buah keras dapat mengalami penyembuhan, menghasilkan tandan buah normal. Tanaman yang tumbuh berdekatan masing-masing menunjukkan tandan buah keras dan tandan buah normal.
Satu kombinasi primer E-ACC/M-CTG marka AFLP dapat membedakan antara pohon tandan buah keras dan pohon tandan buah normal. Hasil penyejajaran pita spesifik diperoleh bahwa urutan nukleotida pita spesifik mempunyai kemiripan dengan Ty-1 copia retrotransposon, urutan nukleotida ini
tersebar dalam seluruh genom tanaman kelapa sawit. Selain itu berdasarkan analisis cDNA-AFLP diperoleh beberapa putatif gen diantaranya faktor depolimerisasi aktin kelapa sawit, enzim peroksidase, glutamin sintetase, dan faktor transkripsi WRKY.
Hasil yang diperoleh menunjukkan bahwa terdapat interaksi antar unsur iklim yang berhubungan dengan cekaman kekeringan dengan semua variabel fenotipik serta keterlibatan faktor genetik tanaman dalam pembentukan tandan buah keras. Dapat disimpulkan bahwa fenotipik tandan buah keras terjadi sebagai akibat cekaman beberapa faktor iklim yang berkorelasi dengan cekaman kekeringan. Hal ini dibuktikan juga dengan ditemukannya Ty-1 copia retrotransposon pada tandan buah keras.
SUMMARY
ROBERDI. Physiological and Molecular Analysis of Hard Bunch Phenomenon in Oil Palm (Elaeis guineensis Jacq.) Fruits. Supervised by SOBIR, SUDIRMAN
YAHYA and NURITA TORUAN-MATHIUS.
In response to rising demand for palm oil and many other products generated by the oil palm has led a rapid and continuously expansion of oil palm plantation in Indonesia. However, the oil palm plantation expansion has not been followed by the availability of sutable land for this crop, such as lack of water which constrains plant growth. As a result, oil palm planted in unsuitable area resulting in greatly reduced yields and some abnormalities phenomenon such as hard bunch were found.
The general aims of this study were to identify differences in physical and biochemical components between hard and normal bunch, and investigate the role of genetics and environmental factors causing hard bunch phenomenon. Specifically, this study was aimed 1) to identify the differences in physical and some biochemical components between normal and hard bunches, 2) to identify the climatic elements that play important roles in hard bunch phenomenon, 3) to obtain the AFLP primer combinations that can distinguish normal and hard bunch palms and 4) to obtain the putative genes involving in hard bunch phenomenon.
In present study, several assays were conducted in order to elucidate the biological mechanism of hard bunch phenomenon including the analysis of both correlation and multivariate analyses between climatic elements and hard bunch, analyses of physical and biochemical traits in both hard and normal bunches, and molecular analysis using AFLP and cDNA-AFLP techniques. Analysis were done on 20 years D x P palms.
The result showed that the phenomenon in hard bunch occurred when the plants were exposed to water deficit severely during six to nine months before harvesting fruit bunches. Water deficit was triggered by low rainfall and supported by other climatic elements that cause the increase of the plant transpiration rate, such as the relative humidity, the wind speed and the distribution of sunshine hours.
Based on physical and biochemical components analysis, the normal and hard bunches palms showed the differences in several traits and compounds such as weight of fresh fruit bunches, number of spikelet, total carotene, 4-hydroxybenzoic acid, chlorogenic acid, ferulic acid, and lignin of fruit abscission zone. High lignin compound observed in hard bunches fruit abscission zone caused failure in performing abscission process of ripe oil palm fruits, making the ripe of oil palm fruit non shedding.
In regards to molecular analysis using AFLP markers, of the total primer combinations, one primer combination of E-ACC/M-CTG primers could suscessfully distinguish between palms bearing hard and normal bunches. Based on sequence alignment analysis, the sequences were found to have similarity with
Ty-1 copia retrotransposon, which distributed in all oil palm genome linkage
In addition, through cDNA-AFLP technique analysis, some putative genes including actin depolymerizing factor of oil palm, peroxidase enzyme, WRKY transcription factor, and glutamine synthetase were identified. Overall, the results of present study showed that the hard bunch phenomenon resulted from interaction between climatic elements related to water availabilty and genetics factors.
Results obtained indicate that there are interactions between climate elements related to drought stress and with all phenotypic variables as well as the involvement of genetic factors in the development of hard bunches in oil palm. It can be concluded that the hard bunches occurred as a result of stress of some climatic elements that correlated with drought stress. This is evidenced by the discovery of Ty-1 copia retrotransposon in hard bunch.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
ANALISIS FISIOLOGIS DAN MOLEKULER FENOMENA
TANDAN BUAH KERAS PADA KELAPA SAWIT
(
Elaeis guineensis
Jacq.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Penguji pada Ujian Tertutup: Prof Dr Ir Didy Sopandie, MAgr Dr Sintho Wahyuning Ardie, SP MSi
Judul Disertasi : Analisis Fisiologis dan Molekuler Fenomena Tandan Buah Keras pada Kelapa Sawit (Elaeis guineensis Jacq.).
Nama : Roberdi NIM : A263100101
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Sobir, MS Ketua
Prof Dr Ir Sudirman Yahya, MSc
Anggota Dr Nurita Toruan-Mathius, MS Anggota
Diketahui oleh
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti Wahyu EK, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Syukur Alhamdulillah, penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulisan Disertasi ini dapat diselesaikan. Topik penelitian yang dipilih merupakan salah satu masalah pada perkebunan kelapa sawit di wilayah provinsi Lampung, yaitu terbentuknya buah yang tidak rontok (memberondol) walaupun buah kelapa sawit telah masak.
Penulisan disertasi ini tidak mungkin diselesaikan sendiri oleh penulis tanpa bantuan dari berbagai pihak. Oleh karena itu penulis menyampaikan rasa terima kasih dan penghargaan yang setulus-tulusnya kepada:
1. Prof Dr Ir Sobir, MS sebagai ketua komisi pembimbing yang banyak memberikan arahan dan bimbingan mulai dari penyusunan rencana penelitian sampai penulisan disertasi.
2. Prof Dr Ir Sudirman Yahya, MSc dan Dr Nurita Toruan-Mathius, MS sebagai anggota komisi pembimbing atas semua saran, arahan dan bimbingan dalam penyusunan konsep penelitian sampai selesainya penulisan disertasi.
3. Pimpinan PT. SMART Tbk, terutama kepada bapak Jo Daud Dharsono, Dr Tony Liwang dan Dr Nurita Toruan-Mathius MS, atas rekomendasi yang diberikan sehingga penulis mendapat beasiswa dan izin untuk melanjutkan sekolah ke jenjang S3 di IPB, kesempatan ini merupakan sebuah kesempatan langka bagi karyawan perusahaan swasta.
4. Manajemen PSM II Region Lampung, Bapak Mulyanto dan Bapak Kumala Sinaga (RC), Bapak Adi Aryanto (Estate Manager) dan peneliti Bapak Erwin Ahdi
Putranto SP, Bapak Dira dan Syaiful Huda, beserta seluruh tim yang mendukung pelaksanaan penelitian dan izin yang diberikan untuk melakukan penelitian, bantuan pengamatan serta pengambilan sampel di lapangan.
5. Prof Dr Ir Sudarsono, MSc, dan Dr Sintho Wahyuning Ardie, SP MSi, sebagai penguji luar pada ujian prakualifikasi; Prof Dr Ir Didy Sopandie, MAgr dan Dr Sintho Wahyuning Ardie, SP MSi sebagai penguji luar ujian tertutup. Dr Ir Sudradjat, MS. dan Dr. Tony Liwang sebagai penguji ujian terbuka, atas semua saran dan masukan untuk kesempurnaan penulisan disertasi ini.
6. Dr Ir Trikoesoemaningtyas, MSc dan Dr Ir Yudiwanti Wahyu EK, MS selaku Ketua Mayor Pemuliaan dan Bioteknologi Tanaman beserta staf atas semua pelayanan yang telah diberikan.
7. Pimpinan Sekolah Pascasarjana IPB beserta seluruh jajaran, atas semua pelayanan yang diberikan selama mengikuti pendidikan di jenjang S3 SPS IPB. 8. Semua rekan peneliti dan staf di Plant Production and Biotechnology Division
PT. SMART Tbk yang tidak bisa disebutkan satu persatu atas segala bantuan, doa dan kebersamaan yang hangat, sehingga membantu kelancaran penelitian dan penulisan disertasi.
9. Teknisi di laboratorium Bioteknologi PT.SMART Tbk yang telah banyak membantu dalam pelaksanaan penelitian.
11. Teman-teman seperjuangan mahasiswa pascasarjana IPB PBT 2010 (Parli H Sinaga, MP, Laela Sari, MSi, Azri Kusuma Dewi, MSi, Ismail Maskromo, MSi, Dr. Mia Kosmiatin, Meynarti Sari Dewi Ibrahim, MSi, Dyah Retno W, MSi, Sri Suhesti, MP, Arvitta Netty S, MP , Nur Ajijah, MSi, Redy Gaswanto, MP, Jollanda Effendi, MSc. Kawan-kawan AGH 2010 (Dr. Muhammad Thamrin, Dr. Siti Maryam H, Aris Akhsarah, MP, Odit Ferry, MSi dan Dewi Erika MP. Serta ITB 2010 (Dr. Pepi Nur Susilawati). Teman-teman Pascasarjana PS AGH, PBT dan ITB 2011 dan 2012 atas semangat kebersamaan, pertemanan dan saling berbagi demi kemajuan studi. Semoga persahabatan yang terjalin selama menempuh pendidikan di Sekolah Pascasarjana IPB tetap terjalin dengan baik sampai masa datang.
12. Dr Reflinur, SP MSi dan istri Dr Nur Kholilatul Izzah, SP MP atas segala saran, masukan dan revisi draf artikel dan disertasi.
13. Ayahanda Mudasin (Alm) dan Ibunda Sidaria, terima kasih atas semua doa yang dipanjatkan dengan tulus, pengorbanan, jerih payah dan usaha dalam membesarkan, mendidik dan mengizinkan penulis untuk berkarir jauh dari kampung halaman. Penulis berdoa semoga seluruh kegiatan dan usaha diberkahi Allah SWT dan diampuni segala salah dan khilaf.
14. Saudara tercinta Helmi, Nelly, Ita dan Imbun beserta seluruh keponakan, terima kasih atas doa-doa yang sudah dipanjatkan, kesabaran dan kerelaan berbagi walaupun dalam suasana kekurangan dan mengalah demi keberlangsungan sekolah penulis.
15. Kepada ayahanda mertua Dr Nasuka, SIP MM dan Yuliastuty Nasuka, SSi, disampaikan ucapan terima kasih atas doa-doa yang tulus, bimbingan dan bantuan dana dalam melanjutkan pendidikan ini.
16. Kepada saudara ipar Dodi Saptadi dan Siti Halimah, terima kasih atas kebersamaan dan doa yang diberikan demi kelancaran sekolah penulis.
17. Terima kasih yang sebesar-besarnya untuk istri tersayang Dr Wening Enggarini, SSi MSi dan ananda Innayati Cahaya Althafunnisa (6 tahun) serta si kecil Sharifah Reina Anis Farhana (1 tahun) atas kesabaran, diskusi dan kerelaan waktu yang tersita untuk studi dan penelitian.
Akhir kata penulis menaruh harapan semoga karya ilmiah ini bermanfaat.
Bogor, November 2014
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xv
PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 3
Tujuan 4
TINJAUAN PUSTAKA 6 Tanaman Kelapa Sawit 6
Faktor Lingkungan yang Mempengaruhi Produktivitas Tanaman Kelapa Sawit 6
Infloresen Kelapa Sawit 8
Buah Kelapa Sawit 10
Absisi pada Buah Kelapa Sawit 11
Marka AFLP 12
cDNA-AFLP 13
Transposon (Elemen Loncat) 14
KARAKTERISASI SIFAT FISIK DAN BIOKIMIA FENOMENA TANDAN BUAH KERAS PADA KELAPA SAWIT Abstract 15 Pendahuluan 16 Tujuan 17
Bahan dan Metode 17
Hasil dan Pembahasan 20 Simpulan 24
ANALISIS PENGARUH FAKTOR IKLIM TERHADAP PEMBENTUKAN TANDAN BUAH KERAS PADA TANAMAN KELAPA SAWIT Abstract 25
Pendahuluan 26 Tujuan 27
Bahan dan Metode 27
Hasil dan Pembahasan 27
IDENTIFIKASI GEN TERKAIT FENOMENA TANDAN BUAH KERAS PADA TANAMAN KELAPA SAWIT
Abstract 36
Pendahuluan 37
Tujuan 38
Bahan dan Metode 38
Hasil dan Pembahasan 41
Simpulan 45
ANALISIS DIFERENSIAL FENOMENA TANDAN BUAH KERAS
PADA TANAMAN KELAPA SAWIT
Abstract 45
Pendahuluan 46
Tujuan 47
Bahan dan Metode 47
Hasil dan Pembahasan 50
Simpulan 54
PEMBAHASAN UMUM 54
SIMPULAN UMUM 57
DAFTAR PUSTAKA 58
LAMPIRAN 69
DAFTAR TABEL
1 Karakter fisik pada tandan buah keras dan tandan buah normal 20 2 Karakter biokimia buah tandan buah keras dan tandan buah normal 22 3 Data iklim di lokasi penelitian tahun 2007-2012 27 4 Koefisien korelasi antara unsur iklim dan pembentukan tandan buah
keras dari tahun 2007-2012 31
5 Hasil analisis lintasan antara unsur iklim dan pembentukan tandan
buah keras 34
6 Profil kombinasi primer AFLP pada genom tanaman kelapa sawit 43 7 Sebaran kemiripan sekuen dengan genom tanaman kelapa sawit 45
8 Hasil analisis sekuen spesifik cDNA-AFLP 52
9 Rekapitulasi hasil analisis sekuen menggunakan program Blas2Go 53
DAFTAR GAMBAR
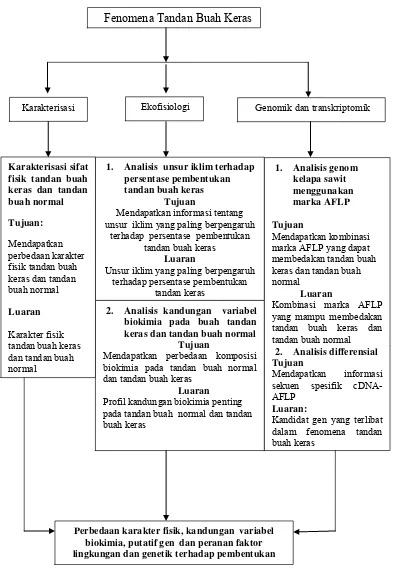
1 Diagram alir penelitian 5
2 Skema waktu yang dibutuhkan pada setiap fase perkembangan bunga
kelapa sawit 8
3 Komposisi infloresen betina 9
4 Komposisi infloresen jantan 9
5 Representasi pemotongan longitudinal daerah absisi buah kelapa sawit 12 6 Penampakan tandan buah keras dan tandan buah normal 21 7 Profil zona absisi tandan buah keras dan tandan buah normal 23 8 Profil penampang melintang dan longitudinal buah kelapa sawit 24 9 Distribusi curah hujan dan hari hujan selama tahun 2007-2012 29 10 Pola sebaran curah hujan dan persentase pembentukan tandan buah
keras selama tahun 2007-2012 32
11 Profil DNA genom tanaman kelapa sawit yang diamplifikasi
menggunakan beberapa primer AFLP 42
12 Pola pita DNA individual menggunakan primer E-ACC/M-CTG 44 13 Pola pita cDNA-AFLP menggunakan beberapa kombinasi primer 51
DAFTAR LAMPIRAN
1 Kondisi beberapa unsur iklim di lokasi penelitian dari tahun
1
PENDAHULUAN
Latar Belakang
Perkebunan kelapa sawit telah tersebar di seluruh wilayah Indonesia dengan luasan mencapai lebih dari 9.1 juta ha sampai akhir tahun 2013 (Ditjenbun 2013). Sebagian besar wilayah Indonesia mempunyai faktor pembatas untuk pertanaman kelapa sawit. Faktor penghambat tersebut diantaranya curah hujan, periode bulan kering, lama penyinaran matahari, kelembaban dan suhu udara (Adiwiganda et al.
1999) serta kondisi tanah.
Wilayah Indonesia terbagi ke dalam 11 kelompok berdasarkan kesesuaian agroklimat untuk perkebunan kelapa sawit (Adiwiganda et al. 1999). Berdasarkan
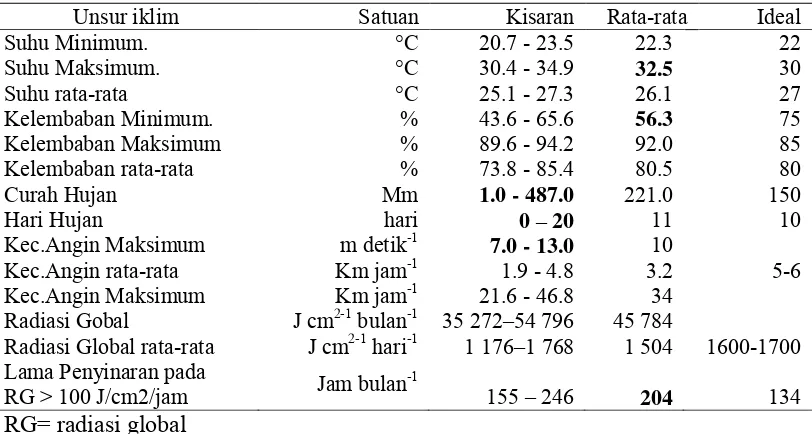
kesesuaian agroklimat, wilayah Lampung diklasifikasikan sebagai wilayah yang mempunyai faktor pembatas berupa curah hujan, periode bulan kering dan lama penyinaran dengan intensitas sedang. Kondisi iklim di Lampung secara umum mempunyai kisaran curah hujan dari 1 450 sampai 3 000 mm tahun-1, periode bulan kering selama 2 sampai 3 bulan dan lama penyinaran matahari antara 5 sampai 6 jam hari-1.
Unsur-unsur iklim yang ideal untuk pertumbuhan dan produksi tanaman kelapa sawit pada tanah yang sesuai antara lain adalah tersedianya curah hujan yang tersebar merata sepanjang tahun dengan kisaran antara 2 000 sampai 2 500 mm tahun-1, suhu optimum antara 22 0C sampai 30 0C, lama penyinaran 5 sampai 7 jam hari-1, radiasi matahari 16 sampai 17 MJ m2-1 hari-1, kelembaban relatif di atas 85%, dan tidak terdapat suhu udara dan kecepatan angin yang ekstrim (Hartley 1988; Goh 2000).
Adanya faktor pembatas tersebut menyebabkan tanaman kelapa sawit rentan terhadap kekurangan air karena mempunyai struktur akar serabut terutama pada periode bulan kering. Kondisi ini menyebabkan terganggunya berbagai proses metabolisme pada tanaman kelapa sawit. Perubahan tersebut menyebabkan gangguan pertumbuhan pada organ vegetatif maupun generatif.
Pengaruh kekurangan air terhadap organ vegetatif tanaman kelapa sawit berupa lambatnya pembukaan daun muda dan pelepah daun banyak yang terkulai (sengkleh). Sedangkan pengaruh terhadap organ generatif berupa primordia bunga gagal berkembang, gugurnya buah muda dan nisbah seks bunga yang rendah. Seluruh respons tanaman pada akhirnya akan menurunkan hasil panen (Corley & Tinker 2003; Legros et al. 2009a). Di samping itu di wilayah Lampung pengaruh
kekurangan air ditemukan fenomena buah abnormal.
Buah abnormal yang terjadi dikenal dengan istilah tandan buah keras (hard bunch). Fenomena tersebut adalah buah tidak memberondol (tidak lepas dari
Masalah lain yang dihadapi akibat tidak memberondolnya buah yang telah masak adalah seringnya buah terlambat dipanen. Hal tersebut menyebabkan tingginya kadar asam lemak bebas (3.84 sampai 4.36%) dalam CPO yang dihasilkan. Hal ini mengakibatkan nilai jual CPO lebih rendah. Fenomena tandan buah keras dapat mencapai 30% dari produksi tandan buah segar (RC Lampung, komunikasi pribadi).
Informasi tentang fenomena tandan buah keras belum banyak dilaporkan. Tanaman yang memiliki tandan buah keras di perkebunan kelapa sawit tumbuh berdekatan dengan tanaman yang mempunyai tandan buah normal. Lebih jauh, dalam satu pohon, dapat mempunyai tandan buah normal dan tandan buah keras. Hal ini mengindikasikan adanya pengaruh faktor genetik dan lingkungan terhadap fenomena ini. Salah satu faktor lingkungan yang paling berperan dalam pertumbuhan tanaman kelapa sawit adalah cekaman kekeringan.
Cekaman kekeringan dilaporkan mengakibatkan laju fotosintesis menurun akibat menutupnya stomata untuk mengurangi terjadinya kehilangan air yang berlebihan. Akan tetapi penutupan stomata mengakibatkan tidak dapat masuknya CO2 ke dalam sel tanaman, yang pada akhirnya menyebabkan berkurangnya laju fotosintesis. Fotosintesis merupakan sumber karbohidrat utama untuk metabolisme tanaman. Dilaporkan bahwa pertumbuhan tanaman berkorelasi dengan penerimaan cahaya dan konversi energi melalui proses fotosintesis (Muller et al. 2011). Pada saat mengalami cekaman kekeringan tanaman kelapa
sawit menggunakan karbohidrat non struktural yang terdapat pada batang untuk keperluan metabolisme (Legros et al. 2009b; Pallas et al. 2013).
Tanaman merespons dan beradaptasi terhadap cekaman kekeringan dengan mengubah metabolisme seluler dan molekulernya untuk mengaktifkan berbagai sistem pertahanan. Tanaman akan mengaktivasi protein dan enzim yang terlibat dalam proses transkripsi dan replikasi gen, molekul penerima dan penghantaran sinyal, akumulasi metabolit untuk sistem pertahanan dan perubahan struktur kromatin saat mengalami cekaman (Pandey et al. 2008). Perubahan struktur
kromatin biasanya berhubungan dengan regulasi transkripsi. Pada umumnya perubahan hanya terjadi saat tanaman terpapar cekaman, namun dapat juga terjadi perubahan ekspresi gen dalam jangka waktu yang lama (Pecinka & Scheid 2012).
Cekaman kekeringan dapat menyebabkan perubahan fisiologis, biokimia dan seluler dalam tanaman (Anjum et al. 2011). Salah satu mekanisme tanaman
dalam menjaga pengangkutan air selama cekaman kekeringan adalah dengan cara dekomposisi lignin. Pembentukan lignin dapat diinduksi oleh cekaman abiotik maupun biotik (Moura et al. 2010). Di samping itu, akumulasi metabolit yang
mempunyai fungsi sebagai antioksidan dilaporkan meningkat selama tanaman mengalami cekaman. Bahkan cekaman lingkungan dapat mempengaruhi komposisi biokimia produk pertanian (DaMatta et al. 2009).
Oleh sebab itu, sebagai langkah awal dalam menentukan mekanisme terjadinya ketidaknormalan pada buah kelapa sawit di Lampung, maka analisis sifat fisik dan komposisi karakter biokimia pada tandan buah keras perlu dilakukan. Analisis karakter biokimia sudah dilakukan pada buah kelapa sawit normal (Neo et al. 2010; Tan et al. 2009). Selain itu Tranbarger et al (2011)
pemasakan buah kelapa sawit. Namun belum ada laporan tentang hal tersebut pada tandan buah keras.
Selain faktor lingkungan, pertumbuhan tanaman dikendalikan oleh faktor genetik. Terdapatnya perbedaan fenotipe tandan dalam satu pohon merupakan bentuk terjadinya interaksi antara faktor genetik dan lingkungan. Faktor lingkungan yang kurang sesuai pada periode perkembangan tertentu pada tanaman dapat menyebabkan terjadinya abnormalitas. Selain itu, tidak stabilnya fenotipe tanaman biasanya juga dapat disebabkan adanya mutasi pada gen tertentu, penyisipan atau perpindahan elemen loncat (transposon).
Elemen loncat dapat mempengaruhi ekspresi gen dan merubah bentuk pengaturan ekspresi (Bui & Granbastien 2012). Elemen loncat dapat teraktivasi dalam genom tanaman oleh cekaman dan perubahan kondisi lingkungan maupun akibat kondisi dalam proses kultur jaringan (Hirochika 1997; Pecinka et al. 2010,
Bui & Grandbastien 2012). Aktivasi transposon dalam genom tanaman akan menyebabkan mutasi yang dapat merugikan atau menguntungkan bagi tanaman tergantung pada lokasi transposon tersebut menyisip (Fescotte 2008). Aktivasi transposon dilaporkan dapat meningkatkan respons terhadap cekaman lingkungan (Casacuberta & Gonzalez 2012).
Analisis transposon pada tanaman kelapa sawit telah dilakukan untuk melihat pengaruhnya terhadap abnormalitas (mantle) yang terjadi pada tanaman
kelapa sawit yang diperbanyak melalui teknik kultur jaringan. Hasil analisis menunjukkan bahwa fenotipe mantle tidak disebabkan oleh perpindahan
transposon tetapi mungkin terkait dengan perubahan bentuk metilasi dari komponen genom yang lain (Kubis et al. 2003).
Berdasarkan hasil analisis genom kelapa sawit yang dilakukan oleh Castilho
et al (2000), transposon tipe copia-like retroelement merupakan komponen
terbanyak yang ditemui dalam genom kelapa sawit. Elemen ini dapat dimanfaatkan sebagai marka genetik dalam analisis genom kelapa sawit (Prize et al. 2002).
Selain itu unsur iklim diantaranya curah hujan, periode bulan kering, suhu udara, kelembaban udara dan lama penyinaran juga dilaporkan berpengaruh terhadap produksi buah kelapa sawit (Corley & Tinker 2003) dan diduga berpengaruh terhadap persentase pembentukan tandan buah keras yang terjadi di perkebunan.
Kerangka Pemikiran
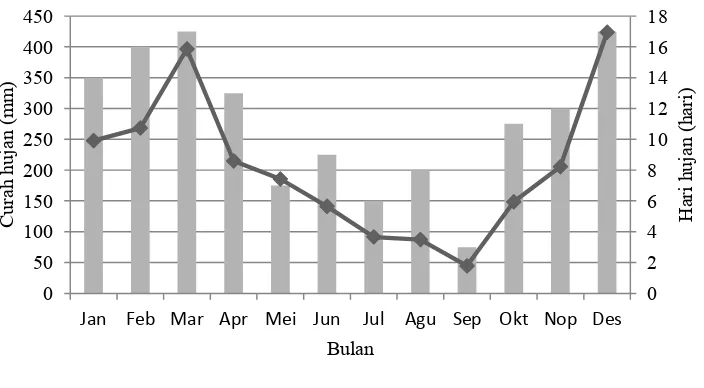
Fenomena tandan buah keras terjadi salah satunya di perkebunan wilayah Lampung. Dilaporkan bahwa persentase tandan buah keras dapat mencapai 30% (RC Lampung, komunikasi pribadi). Wilayah Lampung memiliki curah hujan sebanyak 1 450 sampai 3 000 mm tahun-1 dengan bulan kering selama 2 sampai 3 bulan per tahun (Adiwiganda et al. 1999).
sekitar pokok (pangkal batang) merupakan indikasi tandan buah dapat dipanen. Hal ini menyebabkan turunnya produktivitas tanaman kelapa sawit.
Pada proses pengolahan buah di pabrik, setelah perebusan tidak semua buah dari tandan buah keras terlepas dari tandan buah, sehingga menurunkan rendemen minyak yang dihasilkan. Di samping itu, keterlambatan panen buah dapat menyebabkan meningkatnya kandungan asam lemak bebas (FFA) minyak sawit. Pembentukan tandan buah keras masih belum banyak diketahui dan respons individu tanaman sangat beragam. Hal ini menunjukkan bahwa fenomena terbentuknya tandan buah keras cukup kompleks.
Pertumbuhan dan perkembangan buah pada suatu tanaman merupakan rangkaian panjang proses metabolisme. Proses dimulai dari terbentuknya bunga sampai pada proses pematangan dan absisi buah. Pertumbuhan dan perkembangan tanaman kelapa sawit juga dipengaruhi oleh unsur-unsur iklim diantaranya curah hujan, lamanya penyinaran efektif, kecepatan angin, suhu udara dan kelembaban (Corley & Tinker 2003). Pengaruh unsur iklim tersebut terhadap produksi kelapa sawit telah diketahui. Namun, pengaruhnya terhadap fenomena terbentuknya tandan buah keras belum banyak dipelajari. Oleh karena itu dilakukan uji korelasi dan analisis lintas antar unsur iklim penting pada kelapa sawit dengan fenomena terbentuknya tandan buah keras.
Di samping itu juga dilakukan penelitian karakterisasi tandan, kandungan biokimia minyak, serta pendekatan genetik dan molekuler melalui analisis cDNA-AFLP. Hal ini bertujuan untuk menetapkan peranan faktor genetik dan lingkungan terhadap pembentukan tandan buah keras.
Pada waktu terjadi cekaman kekeringan, tanaman akan mengaktifkan beberapa enzim dan molekul penghantar sinyal untuk mengatasi cekaman. Selain itu karena adanya kondisi lingkungan yang kurang sesuai dapat menyebabkan aktifnya elemen loncat. Oleh karena itu diduga terjadinya fenomena tandan buah keras juga dapat disebabkan oleh aktifnya elemen loncat karena adanya periode bulan kering di perkebunan kelapa sawit di Lampung. Dugaan ini didasarkan pada tidak stabilnya pembentukan tandan buah keras dalam satu pohon. (Diagram alir penelitian disajikan pada Gambar 1).
Tujuan Penelitian
Tujuan umum penelitian ini adalah mendapatkan perbedaan karakter fisik dan kandungan biokimia antara tandan buah normal dan tandan buah keras serta mendapatkan peranan faktor genetik dan lingkungan terhadap pembentukan tandan buah keras di perkebunan kelapa sawit.
Tujuan khusus penelitian ini adalah mendapatkan:
1. perbedaan karakter fisik dan kandungan biokimia pada tandan buah normal dan tandan buah keras pada kelapa sawit
2. informasi tentang unsur-unsur iklim yang paling berpengaruh terhadap terbentuknya tandan buah keras
3. kombinasi marka AFLP yang dapat membedakan antara tandan buah keras dan tandan buah normal
Gambar 1 Diagram alir penelitian pada tandan buah normal dan tandan buah keras biokimia, putatif gen dan peranan faktor lingkungan dan genetik terhadap pembentukan
2
TINJAUAN PUSTAKA
Tanaman Kelapa Sawit
Tanaman kelapa sawit ( Elaeis guineensis Jacq. ) termasuk dalam keluarga
monokotil yang berasal dari Afrika Barat. Pendapat ini didasari oleh temuan sedimen polen di Nigeria yang mirip dengan polen kelapa sawit saat ini (Zeven 1964). Tanaman kelapa sawit mempunyai meristem apikal tunas tunggal dan menghasilkan bunga jantan dan betina secara bergantian pada tanaman yang sama (Hartley 1988). Tanaman kelapa sawit dapat tumbuh sampai ratusan tahun, tetapi karena pertimbangan efisiensi dan nilai ekonomi untuk usaha perkebunan hanya dipertahankan sampai umur 25 tahun. Habitat alami kelapa sawit adalah tepi rawa, sungai dan danau. Jenis lain kelapa sawit (E. oleifera) berasal dari Amerika
Selatan (Hartley 1988).
Kelapa sawit ditanam secara ekstensif di Asia Tenggara, daerah khatulistiwa di Afrika, dan Amerika Selatan. Tanaman kelapa sawit diintroduksi ke Indonesia pada tahun 1848 dari Mauritius dan ditanam di Kebun Raya Bogor (Purseglove 1975). Benih dari empat tanaman di Bogor didistribusikan ke seluruh kepulauan Indonesia dan ditanam sebagai tanaman hias pinggir jalan. Benih dari tanaman di perkebunan tembakau di Deli Sumatera Utara sekarang dikenal sebagai Deli Dura, kemudian digunakan untuk mendirikan perkebunan komersial pertama di Sumatera Utara pada tahun 1911. Turunan dari Deli Dura selanjutnya digunakan untuk mendirikan perkebunan kelapa sawit pertama di perkebunan Ulu Remis, Malaysia pada tahun 1929 (Hartley 1988).
Tanaman kelapa sawit dibedakan berdasarkan tebalnya cangkang yang dimiliki menjadi tipe Dura, Pisifera dan Tenera. Tipe Dura memiliki ketebalan cangkang 2 sampai 8 mm, kandungan mesokarp tergolong rendah sampai sedang (35 sampai 55 %). Pada persilangan umumnya digunakan sebagai tetua betina. Pisifera memiliki cangkang sangat tipis bahkan tidak ada cangkang. Pada persilangan umumnya digunakan sebagai tetua jantan. Sementara Tenera memiliki tebal cangkang 0.5 sampai 4 mm, dengan kandungan mesokarp sebesar 60 sampai 96%, merupakan hibrida dari Dura dan Pisifera (Hartley 1988). Perbedaan ketebalan cangkang akan mempengaruhi rendemen minyak yang dikandung buah. Ketebalan cangkang dikendalikan oleh gen tunggal. Tipe Dura memiliki gen ShSh, Pisifera shsh dan Tenera yang merupakan hibrida dari Dura dan Pisifera memiliki tipe Shsh.
Faktor Lingkungan yang Mempengaruhi Produktivitas Tanaman Kelapa Sawit
vegetatif lebih dominan dibandingkan dengan pertumbuhan generatif, sehingga mengurangi pembentukan tandan bunga. Curah hujan dengan intensitas tinggi juga menyebabkan penyerbukan kurang sempurna. Penyebaran curah hujan merupakan faktor penting dalam perkembangan bunga. Curah hujan yang rendah akan menyebabkan kekurangan air sehingga akan mempengaruhi produksi pelepah daun, jumlah tandan buah, diferensiasi seks, rontoknya bunga dan buah muda.
Radiasi matahari. Produksi tanaman kelapa sawit juga dipengaruhi oleh lama penyinaran efektif. Penyinaran efektif didefenisikan sebagai total jumlah jam penyinaran yang diterima sepanjang periode kelembaban air tanah yang mencukupi ditambah selama periode cekaman air dan dikurangi dengan lamanya cekaman air tanah yang terjadi Sparnaaij et al. 1963).
Penyinaran radiasi matahari yang cukup untuk tanaman kelapa sawit adalah lebih dari 1 600 jam tahun-1 dengan rata-rata 5 sampai 7 jam hari-1 (Corley & Tinker 2003) dan kelembaban udara 85%. Penyinaran efektif akan berpengaruh terhadap nisbah seks bunga dua tahun berikutnya, dan terhadap hasil sekitar 28 bulan berikutnya. Lama penyinaran per hari lebih berpengaruh terhadap produktivitas tanaman kelapa sawit dibandingkan dengan rata-rata radiasi harian. Selain itu nisbah seks juga akan dipengaruhi oleh kombinasi dari jumlah hari kering, lamanya penyinaran harian dan curah hujan.
Suhu udara. Tanaman kelapa sawit dapat tumbuh dan berkembang dengan baik pada daerah yang mempunyai suhu udara siang hari rata-rata 29 0C sampai 33 0C dan suhu udara malam rata-rata 22 0C sampai 24 0C (Corley & Tinker 2003). Tanaman kelapa sawit dibudidayakan, tumbuh dan berkembang dengan baik pada daerah tropis antara 130 Lintang Utara dan 120 Lintang Selatan (Hartley 1988). Ketinggian tempat yang ideal untuk tanaman kelapa sawit adalah 5 m sampai 200 m di atas permukaan laut. Perkebunan kelapa sawit yang mempunyai produktivitas yang tinggi terdapat pada daerah yang mempunyai keragaman suhu udara bulanan yang kecil.
Kelembaban udara. Tanaman kelapa sawit tumbuh baik di kawasan tropis dengan rata-rata kelembaban udara harian berkisar antara 75 sampai 85%. Apabila kelembaban udara rendah, penyinaran efektif juga tidak akan berfungsi dengan baik. Vapour Pressure Deficit (PVD) yang tinggi menyebabkan penutupan
stomata yang akan mempengaruhi proses fotosintesis yang dapat menyebabkan penurunan produksi. Udara kering dengan kelembaban udara rendah menyebabkan konduksi stomata menurun yang mengakibatkan pertukaran gas antara jaringan tanaman dan atmosfer terganggu.
Infloresens Kelapa Sawit
Primordia bunga diproduksi pada setiap ketiak daun pada saat inisiasi daun. Primodia dapat berkembang menjadi infloresen jantan, betina atau hermaprodit. Oleh karena itu, produksi tandan buah segar sangat terkait dengan tingkat produksi daun, yang dipengaruhi oleh kondisi lingkungan dan status hara tanaman kelapa sawit. Bunga dapat gugur sebagai tanggap terhadap cekaman, dan produksi yang tinggi hanya dapat diperoleh dengan nisbah jenis kelamin yang tinggi (bunga betina: total bunga) dan tingkat aborsi yang rendah. Potensi hasil dengan demikian ditentukan oleh tingkat produksi daun, nisbah jenis kelamin dan jumlah aborsi bunga.
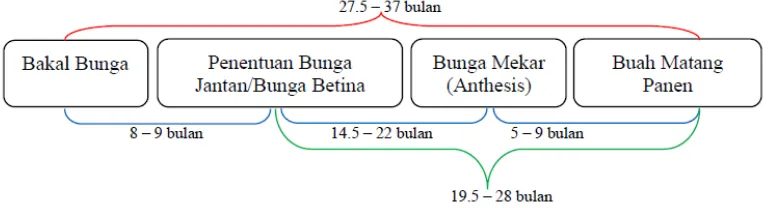
Pada tanaman dewasa infloresen berkembang sekitar 2 sampai 3 tahun (Adam et al. 2005) (Gambar 2). Setiap infloresen terdiri dari spikelet yang
tertutup oleh seludang yang kokoh. Spikelet tersusun dalam bentuk spiral pada tengah-tengah aksis. Sekitar 1 bulan setelah bunga muncul di atas dasar pelepah daun, seludang luar bunga akan terbuka. Dua sampai tiga minggu kemudian, seludang bagian dalam terbuka dan bunga yang terdapat pada spikelet akan terlihat.
Gambar 2 Skema waktu yang dibutuhkan pada setiap fase perkembangan bunga kelapa sawit (Sumber: Hartley 1988).
Bunga betina terdiri dari floral triads yang berisi bunga pistilate tunggal yang diapit oleh dua bunga staminate abortif, sedangkan bunga jantan mengandung bunga staminate fungsional tunggal (Adam et al. 2005) (Gambar 3).
Permukaan reseptif dari lobus stigma yang ditekan satu sama lain ketika muda akan membuka ketika bunga dewasa. Pada bagian tengah bunga betina, setiap spikelet dapat menghasilkan 12 sampai 30 bunga, sedangkan pada spikelet bagian atas dan bawah hanya menghasilkan 12 bunga atau kurang.
Gambar 3 Komposisi infloresens betina, menunjukkan brakteol dan spina secara tampak dekat (Sumber: Jacquemard 1998).
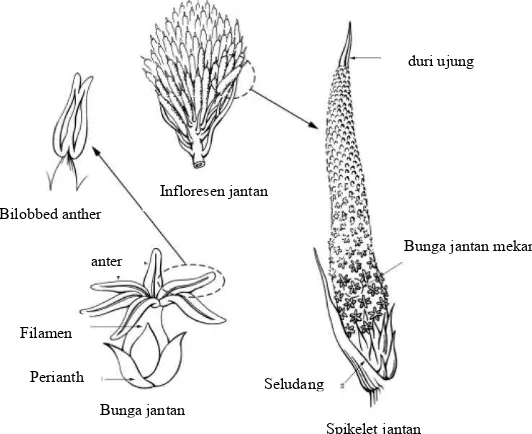
Bunga jantan ditopang oleh tangkai yang panjang dan terdiri dari spikelet yang menyerupai jari berbentuk silinder, masing-masing terdiri dari 700 sampai 1 200 bunga jantan. Bunga jantan terdiri dari periant dan androesium berbentuk tabung dengan enam benang sari (Gambar 4). Bunga mulai membuka dari bagian dasar spikelet. Tepung sari berwarna kuning pucat dan memiliki aroma yang khas. Satu tandan bunga jantan dapat mengandung 25 sampai 50 g tepung sari (Hartley 1988).
Gambar 4 Komposisi infloresen jantan, menunjukkan spikelet, bunga dan anter dan duri secara tampak dekat. (Sumber: Jacquemard 1998.)
Trilobe stigma, Sepal dan
braktea
Bunga betina tanpa braktea
Anderoecium rudimenter
Braktea bunga
Infloresens
Bunga jantan mekar Infloresen jantan
Bunga jantan
duri ujung
anter
Spikelet jantan
Braktea spiked
Bilobbed anther
Seludang Perianth
Kelapa sawit adalah tanaman berumah satu (bunga jantan dan betina terpisah tetapi terdapat pada tanaman yang sama). Bunga jantan dan bunga betina mempunyai waktu matang yang tidak sama (bergantian), karena berada pada ketiak pelepah yang umurnya berbeda. Oleh karena itu kelapa sawit merupakan tanaman menyerbuk silang obligat. Tanaman kelapa sawit komersial diserbuki oleh kumbang Elaedobius kamerunicus, yang pertama kali diperkenalkan di Asia
Tenggara pada awal tahun 1980 (Syed et al. 1982).
Serangga tertarik pada bunga jantan sebagai tempat makan dan melengkapi siklus hidup karena mempunyai aroma yang khas, yang dilepaskan ketika bunga mulai melepaskan serbuk sari saat bunga mekar. Hal ini berlangsung selama 2 sampai 5 hari. Bunga betina juga menghasilkan aroma yang khas saat bunga mekar yang berlangsung selama 36 sampai 48 jam dan kumbang membawa serbuk sari dari bunga jantan ke bunga betina pada tanaman yang berdekatan.
Tanaman kelapa sawit memproduksi bunga jantan atau betina untuk periode tertentu (alternate bearing), oleh karena itu dibutuhkan adanya tanaman yang
memproduksi polen dan bunga reseptif agar penyerbukan dapat terjadi. Nisbah seks sebagian ditentukan secara genetik tapi juga sangat dipengaruhi oleh faktor lingkungan. Tanaman yang mengalami cekaman diantaranya kekeringan, kelembaban udara yang rendah, kekurangan hara, pemangkasan yang berlebih dan serangan penyakit memiliki nisbah seks yang rendah dan hasil yang sedikit.
Tanaman kelapa sawit akan merespons cekaman kekurangan air dan hara pada saat diferensiasi seks dengan cara mengubah primordia infloresen menjadi infloresen jantan. Periode dari inisiasi bunga sampai panen tandan buah sekitar 40 bulan dan cekaman akan mempengaruhi produktivitas pada 3 tahun berikutnya (Corley & Tinker 2003).
Buah Kelapa Sawit
Buah kelapa sawit adalah tipe buah batu atau satu buah yang mengandung biji yang ditutupi oleh mesokarp dengan berbagai bentuk dari hampir bulat, bulat telur atau memanjang. Panjang buah kelapa sawit berkisar antara 2 sampai 7 cm dan terdiri dari kulit (eksokarp) tipis, mesokarp, cangkang (endokarp), dan endosperm atau kernel. Kulit buah dan mesokarp disebut juga perikarp yang mengandung sebagian besar minyak mentah kelapa sawit dengan rendemen 20 sampai 27%, sedangkan kernel (inti sawit) mengandung minyak inti dengan rendemen 4 sampai 6% (Wahid et al. 2005). Mesokarp buah kelapa sawit juga
mengandung banyak karotenoid (Sambanthamurthi et al. 2000)
karoten. Fase V merupakan fase pemasakan yang ditandai dengan meningkatnya konsentrasi hormon ABA dan etilena (Tranbarger et al. 2011).
Penampakan luar buah bervariasi terutama saat pematangan. Jenis paling umum adalah buah tipe nigresens yang berwarna ungu tua sampai hitam pada apeks dan tidak berwarna pada bagian dasar sebelum buah masak. Pada waktu masak warna bervariasi dari jingga ke merah, yang disebabkan oleh terjadinya perubahan kandungan karoten. Jenis buah yang relatif jarang adalah tipe virescens
yang berwarna hijau sebelum masak dan saat matang berubah menjadi warna jingga kemerahan. Jenis buah lain tanpa karoten dalam mesokarp disebut sebagai
albescens, namun jenis ini sangat jarang. Struktur internal buah menunjukkan
variasi yang cukup besar, yang paling penting adalah karakter ketebalan cangkang yang ditentukan secara genetik. Buah kelapa sawit ada yang tanpa cangkang atau memiliki cangkang hingga ketebalan 8 mm. Bentuk buah internal ditentukan oleh faktor genetik.
Tandan buah berisi sekitar 1 500 buah dengan nisbah buah terhadap tandan berkisar antara 60 sampai 70%. Pada waktu tandan buah berkembang hingga masak, tandan buah ditopang oleh pelepah daun ke 30 sampai ke 32 dan bobot tandan buah bervariasi dari beberapa kilogram sampai 10 kg pada tanaman muda dan 10 sampai 30 kg pada tanaman dewasa (8 sampai 10 tahun setelah tanam). Buah bagian luar lebih berwarna dan buah bagian dalam kurang berpigmen. Terdapat juga beberapa buah partenokarpi yang berkembang meskipun tidak terjadi pembuahan.
Absisi pada Buah Kelapa Sawit
Proses penanggalan (pelepasan) buah kelapa sawit melibatkan pemisahan sel yang terjadi pada dua zona absisi yang terdapat pada bagian dasar buah. Zona absisi utama yang paling besar berada antara dua jaringan yang mudah dibedakan, yaitu mesokarp buah yang kaya akan lipida dan pedikel (tangkai buah). Zona absisi berbatasan dengan bagian luar dasar buah. Zona utama terdiri dari 8 sampai 10 lapisan sel yang dapat dengan mudah dilihat sevcara visual. Menggunakan pewarnaan khusus sel-sel terlihat mengandung inti sel, sedangkan batas zona absisi tidak memiliki karakterisasi yang jelas. Sel terpisah menjadi dua zona yang berurutan, yaitu zona absisi utama kemudian perbatasan zona absisi. Dilaporkan bahwa etilena menginduksi pemisahan hanya pada zona absisi utama, sementara itu bagaimana sinyal menginduksi pemisahan pada bagian perbatasan zona absisi masih belum diketahui (Tranbarger et al. 2011).
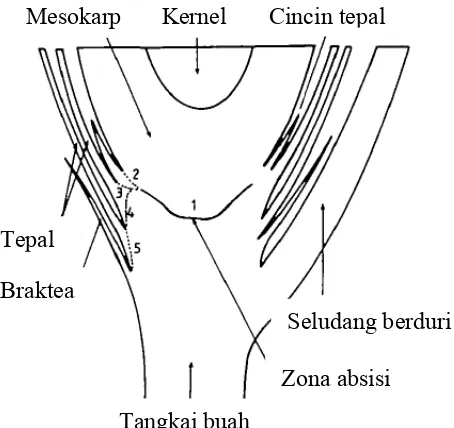
Anatomi absisi pada buah kelapa sawit berbeda dengan buah-buahan komersial pada umumnya. Absisi terjadi dalam dua tahap dengan jarak 1 sampai 2 hari antar keduanya (Osborne et al. 1992). Pada tahap pertama buah terpisah dari
Gambar 5 Representasi diagramatik potongan longitudinal daerah absisi buah kelapa sawit yang mengindikasikan urutan dan posisi pemisahan sel yang terjadi diantara jaringan yang berbeda. (Sumber: Henderson & Osborne 1994)
Pemisahan pada posisi 1 diinisiasi oleh etilena atau prekursor etilena seperti asam 1-aminosiklopropana-1-karboksilat (ACC). Pemisahan dapat terhambat oleh adanya auksin. Absisi pada bagian dasar buah dari tepal atau pada fase kedua tidak terjadi sebagai respons terhadap etilena secara tunggal, tetapi terdapat komponen lain yang terlibat. Zona absisi pada buah kelapa sawit memiliki karakteristik spesifik seperti tingginya ekspresi enzim poligalakturonase dan
unmethylated pectin pada dinding selnya (Henderson et al. 2001). Roongsattham et al (2012) menemukan beberapa transkrip untuk enzim poligalakturonase (PG)
yang sangat kuat diinduksi oleh etilena dan terekspresi selama pemisahan sel.
Marka Amplified Fragment Length Polymorphism (AFLP)
Teknologi marka molekuler memiliki peranan yang semakin penting dalam pengujian keragaman genetik, hubungan genetik dan pemetaan genom tanaman. Kemajuan di bidang genetika molekuler, menghasilkan berbagai teknik yang berbeda untuk menganalisis variasi genetik. Beberapa marka genetik berbasis PCR telah digunakan untuk memberikan informasi tentang variasi genetik pada spesies tanaman. Salah satu marka molekuler yang banyak dipakai adalah marka AFLP (Amplified Fragmenth Length Polymorphism).
Teknik AFLP didasarkan pada amplifikasi selektif fragmen pemotongan dari DNA genom. Teknik ini terdiri dari tiga tahapan yang terdiri dari 1) pemotongan DNA dan ligasi adaptor oligonukleotida, 2) amplifikasi selektif
Kernel
Mesokarp Cincin tepal
rudime nterMesokar p
Zona absisi Seludang berduri Tepal
Braktea
fragmen pemotongan, dan 3) analisis gel hasil fragmen yang diamplifikasi. Amplifikasi PCR fragmen pemotongan diperoleh dengan menggunakan adaptor dan sekuen situs pemotongan sebagai situs target untuk penempelan primer. Amplifikasi selektif dicapai dengan menggunakan primer yang diekstensi ke fragmen pemotongan. Amplifikasi hanya terjadi pada fragmen ekstensi yang cocok dengan nukleotida pengapit situs restriksi. Fragmen pemotongan dapat divisualisasikan dengan PCR tanpa perlu pengetahuan tentang susunan nukleotidanya.
Teknik AFLP memungkinkan ko-amplifikasi sejumlah besar fragmen pemotongan. Sejumlah fragmen dapat dianalisis secara bersamaan, namun hal ini tergantung pada resolusi sistem deteksi. Biasanya 50 sampai 100 fragmen pemotongan diamplifikasi dan dideteksi pada gel poliakrilamida yang didenaturasi. Teknik AFLP merupakan suatu teknik sidik jari DNA yang sangat baik untuk DNA yang cukup kompleks (Vos et al. 1995).
AFLP telah terbukti sangat baik dalam menjelaskan keanekaragaman pada tingkat spesies dan menjadi marka yang efektif dalam analisis genom tanaman. AFLP merupakan teknik yang efektif, murah, dan hemat waktu untuk diferensiasi genetik pada bunga kultivar Mei (Yang et al. 2005). Marka ini lebih disukai
daripada penanda DNA berbasis PCR lainnya terutama karena nisbahmultipleks yang tinggi dan tidak memerlukan informasi urutan DNA (Opara et al. 2010).
Kekurangan utama dari marka AFLP adalah marka bersifat dominan sehingga tidak dapat mendeteksi heterozigositas. Namun, analisis komparatif menggunakan beberapa marka berbasis PCR menunjukkan bahwa teknologi multi-lokus AFLP adalah salah satu metode terbaik yang tersedia untuk evaluasi plasma nutfah. Garcia et al (2004) menyatakan bahwa AFLP merupakan marka
molekuler terbaik untuk sidik jari dan melihat hubungan genetik di antara galur inbrida jagung tropis dengan akurasi tinggi. AFLP juga lebih efisien daripada marka SSR, meskipun SSR adalah kodominan dan mendeteksi tingkat polimorfisme yang tinggi per lokus. Polimorfisme yang ditunjukkan oleh marka AFLP tidak hanya melimpah tetapi juga stabil dan secara statistik dapat diandalkan.
cDNA-AFLP
cDNA-AFLP merupakan teknik transkriptomik yang tidak memerlukan informasi sekuen, dan dapat digunakan sebagai alat pencarian gen pengendali suatu karakter. cDNA-AFLP adalah adaptasi dari teknik AFLP (Bachem et al.
1996). Metode ini didasarkan pada amplifikasi selektif fragmen cDNA yang dihasilkan oleh enzim restriksi endonuklease, pemisahan produk dengan elektroforesis dan pembandingan pola pita antar sampel dengan kontrol. Metode sidik jari RNA membutuhkan sejumlah kecil RNA awal dan oleh karena itu lebih cocok untuk mengisolasi gen yang terekspresi secara diferensial.
ini memungkinkan analisis pada berbagai macam jaringan dan tahapan perkembangan tanaman.
Distribusi situs pemotongan yang tidak merata yang digunakan dalam menghasilkan fragmen cDNA akan berakibat negatif pada kinerja cDNA-AFLP. Beberapa transkrip kadang-kadang diwakili oleh satu fragmen, sementara yang lain tidak terdeteksi sehingga mengurangi cakupan analisis.
Transposon (Elemen Loncat)
Transposon adalah suatu fragmen DNA yang dapat berpindah dari satu kromosom ke kromosom lain dan sering melakukan proses duplikasi dirinya sendiri. Proses perpindahan elemen ini disebut transposisi yang dikendalikan oleh gen transposase (trp) yang terdapat pada elemen tersebut. Transposon bersifat
khas, yaitu hanya berfungsi bagi dirinya dan tidak dapat mentransposisikan elemen loncat lain. Transposon terdapat pada eukariot dan prokariot. Transposon merupakan komponen dinamis dalam genom eukariot yang dapat mencapai 80% pada genom sereal (Bennetzen 2000).
Transposon pada eukariot dibagi dalam dua kelompok berdasarkan mekanisme transposisinya. Elemen kelas I transposisinya dimediasi oleh mRNA. Kelompok ini dapat dibagi berdasarkan mekanisme transposisi dan struktur, yaitu
Long Terminal Repeats (LTR) retrotransposon dan non LTR retrotransposon. Non
LTR retrotransposon terdiri dari Long Interspersed Nuclear Elements (LINE) dan Short Interspersed Nuclear Element (SINE). Sementara elemen kelas II dimediasi
oleh DNA dan mempunyai terminal inverted repeat (Finnegan 1989).
Transposon mempunyai pengaruh yang besar dalam struktur genom dan fungsi gen. Walaupun transposon terdapat pada semua spesies, tetapi pengaruhnya terhadap perubahan genom sangat bervariasi meskipun pada tanaman yang berkerabat dekat. Hal ini terjadi melalui aktivitas yang ditimbulkan seperti transposisi, insersi dan pematahan kromosom (Bennetzen 2000). Elemen loncat dapat teraktivasi dalam genom oleh cekaman dan perubahan kondisi lingkungan maupun akibat kondisi dalam proses kultur jaringan (Hirochika 1997). Hasil analisis mengindikasikan bahwa pengaktifan Tos17 adalah penyebab utama
terjadinya mutasi pada padi yang diinduksi oleh kultur jaringan.
Kemajuan dalam bidang biologi molekuler dan teknologi sekuensing tanaman memungkinkan pemanfaatan transposon untuk analisis evolusi genom, keragaman genetik dan dalam bidang ekologi molekuler (Feschotte et al. 2002).
Elemen loncat dapat diaplikasikan untuk studi filogenetik, genetika populasi, ekologi molekuler dan konservasi (Ray 2007). Sanz et al (2007) menggunakan
transposon untuk analisis keragaman genetik spesies Vicia.
Analisis transposon pada tanaman kelapa sawit dilakukan untuk melihat pengaruh elemen loncat terhadap abnormalitas yang terjadi selama proses kultur jaringan. Hasil analisis diperoleh bahwa fenotipe mantle tidak disebabkan oleh
perpindahan transposon tetapi mungkin terkait dengan perubahan bentuk metilasi dari komponen genom yang lain (Kubis et al. 2003). Copia-like retroelement
3 KARAKTERISASI SIFAT FISIK DAN BIOKIMIA
FENOMENA TANDAN BUAH KERAS KELAPA SAWIT
Abstract
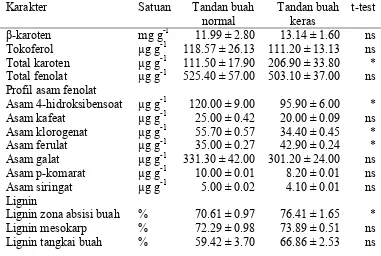
Abnormal fruits like hard bunch from seedling derived palms are found in some oil palm plantation in Indonesia especially areas where drought periods are predominated. The objective of this study was to characterize the physical and biochemical properties related to the abnormal oil palm fruits. The bunch samples, taken from oil palm plantation in Lampung, were analyzed their physical and chemical properties including carotenoids, tocopherol, phenolic acids, and lignin. The results indicated that some parameters (such as fresh fruit bunch weight, spikelet weight, total caroten, 4-hydroxybenzoic acid, chlorogenic acid, ferulic acid, and lignin of fruit abscission zone) observed on normal and hard bunch showed significantly different. In contrast, the other properties related to spikelet number, number of normal fruits, fruit weight, fruit set, β-carotene, α-tocopherol, total phenolic, caffeic acid, gallic acid, p-coumaric acid, syringic acid, mesocarp lignin, and pedicle lignin, did not significantly differed on both type of bunches. This result suggests that metabolic disturbancies probably did not exist during bunch growth and development in hard bunch. The lignin content in abscission zone, however, was significantly higher on hard bunch compared to that on normal bunch (76.41 vs 70.61%), and may cause the reduced detachment of fruit on the bunch.
Key word: abnormal fruit, bunch analysis, fruit ligninification, drought stress.
Abstrak
Buah abnormal dalam bentuk tandan buah keras pada tanaman yang diperbanyak dengan biji ditemukan di lokasi yang mempunyai bulan kering dalam satu tahun. Tujuan penelitian ini adalah untuk menetapkan karakter fisik dan biokimia yang terkait dengan fenomena tandan buah keras pada kelapa sawit. Sampel diambil dari pohon kelapa sawit Tenera (D x P) berumur 20 tahun di perkebunan di Lampung. Analisis yang dilakukan mencakup sifat fisik dan kimia tandan, diantaranya kandungan karotenoid, tokoferol, asam galakturonat, senyawa fenolat, dan lignin. Hasil yang diperoleh menunjukkan bahwa karakter bobot tandan buah segar, jumlah spikelet, total karoten, asam 4-hidroksibensoat, asam klorogenat, asam ferulat, dan kandungan lignin pada zona absisi buah berbeda nyata antara tandan buah segar dan tandan normal. Sementara jumlah spikelet, jumlah buah normal, bobot buah segar, fruitset, kandungan β-karoten, kandungan
normal berturut-turut 76.41%, dan 70.61% menyebabkan buah tidak mudah rontok dari tandan buah.
Kata kunci: Analisis tandan, buah abnormal, lignifikasi buah, cekaman kekeringan.
Pendahuluan
Penampakan tandan buah keras secara umum berbeda dengan tandan buah normal. Umumnya bagian ujung (distal) buah pecah, kulit buah berwarna lebih hitam dengan ukuran buah relatif lebih besar. Mesokarp buah berwarna lebih oranye dan berserat dibandingkan dengan buah normal. Hal ini menimbulkan masalah di kebun dan pengolahan di pabrik kelapa sawit.
Pemanenan tandan buah di perkebunan kelapa sawit menggunakan sistem rotasi 7 sampai 10 hari. Namun, banyak tandan buah masak yang tidak dapat dipanen karena tidak adanya buah yang memberondol. Apabila tandan buah masak tidak dipanen pada saat yang tepat buah menjadi sangat masak pada rotasi panen berikutnya. Hal ini menjadi masalah di pabrik pengolahan kelapa sawit, karena mengakibatkan kadar asam lemak bebas menjadi tinggi dan kualitas serta nilai jual CPO menurun. Di samping itu dalam proses pengolahan tandan buah keras, banyaknya buah tidak lepas atau masih menempel pada tandan buah menyebabkan rendemen minyak yang dihasilkan menurun.
Terbentuknya tandan buah keras yang umumnya ditemukan di perkebunan di Lampung disebabkan tanaman mengalami kekurangan air akibat tidak meratanya curah hujan, didukung oleh beberapa unsur iklim yang mempercepat hilangnya air dari tanah dan udara. Hal ini mengakibatkan tanaman terpapar pada kondisi cekaman air hampir dalam waktu yang cukup lama. Pemahaman terhadap mekanisme tanggap tanaman terhadap kondisi kekeringan diperlukan dalam upaya meningkatkan produksi dan kualitas minyak kelapa sawit khususnya di daerah Lampung.
Menurut Boyer & McLaughlin (2007) dan Ruan et al (2012) fase awal dari
perkembangan buah dan biji merupakan periode yang paling sensitif terhadap cekaman abiotik diantaranya kekeringan, panas, dan dingin. Huang et al (2008)
melaporkan bahwa cekaman kekeringan dapat menyebabkan terjadinya perubahan fisiologis dan biokimiawi yang kompleks pada proses pertumbuhan dan perkembangan tanaman. Selain itu cekaman kekeringan dapat menekan fotosintesis yang merupakan lintasan biosintetik utama, dan memiliki hubungan nyata terhadap lintasan metabolisme lain diantaranya metabolisme berbagai senyawa penting (Chaves et al. 2009).
Cekaman kekeringan juga menyebabkan terjadinya degradasi berbagai macam metabolit termasuk metabolit sekunder, pembawa elektron, asam amino, hormon, senyawa aromatik, komponen struktur sel, gula, polisakarida, asam lemak, lipid, dan hara an-organik (Gong et al. 2010).
Tujuan
Tujuan penelitian ini adalah menetapkan karakter fisik dan beberapa komponen biokimia pada tandan buah keras.
Bahan dan Metode
Tempat dan Waktu
Penelitian dilaksanakan di laboratorium Proteomic dan Metabolomic Departemen Bioteknologi PT. SMART Tbk. dari bulan Juni 2012 sampai bulan Juni 2013. Tahapan penelitian terdiri atas analisis fisik tandan dan analisis komponen biokimia buah.
Materi Penelitian
Tandan buah normal dan tandan buah keras diambil di tempat pengumpulan hasil (TPH). Tandan buah normal diambil pada TPH yang sama dengan tempat pengambilan buah tandan keras. Buah dipanen dari tanaman kelapa sawit tipe Tenera (D x P) berumur 20 tahun di perkebunan kelapa sawit di Lampung. Analisis sifat fisik dan kimia dilakukan pada masing-masing 40 tandan buah keras dan tandan buah normal.
Analisis Tandan
Sampel buah diberi label kemudian dibawa ke laboratorium untuk analisis lebih lanjut. Analisis yang dilakukan meliputi analisis fisik tandan, prosedur analisis mengikuti standar operasional kebun. Tandan buah segar ditimbang, selanjutnya dipisahkan spikelet dari tandan buah. Jumlah spikelet dihitung dan bobot tandan kosong ditimbang.
Sebanyak 3.5 kg sampel buah untuk analisis minyak berasal dari 30 spikelet dengan komposisi 8 : 9 : 8 berurut-turut dari zona atas, tengah dan bawah tandan. Sebanyak 10 spikelet diambil secara acak dengan komposisi 3 : 4 : 3 dari masing-masing zona, dan diambil 3 buah dari tiap spikelet yang masing-masing mewakili zona bagian atas, tengah dan bawah spikelet. Bobot basah mesokarp dan biji ditimbang, sedang berat kering sampel diperoleh dari hasil kering oven selama 12 jam pada 80 0C. Peubah lain yang diukur adalah jumlah buah normal, dan buah infertil.
Analisis Karotenoid dan Tokoferol
Ekstraksi kandungan karotenoid dan tokoferol dilakukan mengikuti metode Ping & Gwandoline (2006) yang dimodifikasi. Mesokarp buah dipotong kecil dan dikering oven selama 12 jam pada suhu 80 0C, selanjutnya digerus sampai halus menggunakan Nitrogen cair. Ekstrak kasar diekstrak dalam larutan metanol diikuti dengan direndam dalam larutan heksana, aseton dan heksana/aseton (50:50 v/v).
Profil karoten dan tokoferol diperoleh dengan Acquity column UPLC BEH
C18 1.7 µm (2.1 x 50 mm) (Waters). Sebanyak 1 g sampel ditimbang, dilarutkan dalam metanol 10 mL. Campuran digoyang selama 10 menit dan selanjutnya disaring. Sebanyak 10 mL heksana ditambahkan ke dalam hasil saringan, digoyang selama 10 menit dan disaring. Ke dalam hasil saringan ditambahkan sebanyak 10 mL aseton, digoyang selama 10 menit dan disaring. Selanjutnya ditambahkan 10 mL heksana:aseton (1:1), digoyang selama 10 menit dan disaring. Selanjutnya semua pelarut digabung, digoyang selama 10 menit dan disaring. Larutan selanjutnya diuapkan, pelet dilarutkan dengan 2 mL heksana.
Profil karotenoid diukur pada panjang gelombang 450 menggunakan β-karoten sebagai standar. Sedangkan kandungan tokoferol diukur pada panjang gelombang 292 nm menggunakan α tokoferol sebagai standar.
Analisis Senyawa Fenolat
Ekstraksi kandungan fenolat mengikuti metode Fuchs et al (2010) yang
dimodifikasi. Kandungan total fenolat diukur menggunakan spektrofotometer. Sebanyak 5 g mesokarp ditimbang, digerus dengan bantuan Nitrogen cair sampai menjadi bubuk. Sebanyak 1 g sampel ditimbang, dilarutkan dalam 50 mL Metanol : HCl 2M 1:1. Sampel selanjutnya disonikasi pada suhu 60 0C selama 60 menit. Sampel disaring dan filtrat diuapkan pada suhu 60 0C. Residu yang diperoleh ditambahkan 50 mL akuades.
Larutan diekstraksi menggunakan 3 x 25 mL Etil asetat, fasa Etil asetat dipisahkan, kemudian diuapkan pada suhu 40 0C selama 30 menit. Residu yang diperoleh dilarutkan menggunakan 2 mL Metanol, kemudian sebanyak 40 μL dipipet dan ditambahkan 2 μL akuades. Selanjutnya ke dalam sampel ditambahkan 100 μL Folin Ciocalteu Reagen (FCR) 2N, diinkubasi selama 3
menit dan ditambahkan 200 μL Na2CO3 35 % serta 2 660 μL akuades.
Larutan blanko disiapkan dengan cara 40 μL akuades dipipet ditambahkan 2 μL akuades kemudian ditambahkan sebanyak 100 μl FCR 2N. Sampel diinkubasi selama3 menit kemudian ditambahkan 200 μL Na2CO3 35 %, dan terakhir 2 660 μL akuades.
Larutan standar disiapkan dengan cara 10 mg Asam kafeat ditimbang, dilarutkan dengan akuades hingga 10 mL (konsentrasi 1 000 ppm). Selanjutnya larutan standar diencerkan menjadi 5 ppm, 10 ppm, 20 ppm dan 40 ppm dalam 500 μL akuades. Masing-masing larutan standar 5 sampai 40 ppm dipipet sebanyak 40 μL dan ditambahkan 2 μL akuades. Ke dalam larutan ditambahkan 100 μL FCR 2N, diinkubasi selama 3 menit, ditambahkan 200 μL Na2CO3 35 %, untuk mencukupkan volume ditambahkan 2 660 μL akuades. Sampel total fenolat diukur dengan spektrofotometer pada panjang gelombang 725 nm.
Profil asam fenolat diperoleh dengan Acquity column UPLC BEH C18 1.7
Larutan standar yang digunakan adalah asam galat, asam siringat, asam kafeat, asam klorogenat, asam p-komarat, asam 4-hidroksibensoat dan asam ferulat. Masing-masing ditimbang sebanyak 2 mg, dilarutkan dengan akuades hingga 2 mL. Selanjutnya dipipet sebanyak 100 μL, ditambahkan 900 μL akuades, disaring dengan milipore dan siap untuk diinjeksikan ke dalam sistem UPLC. Analisis kandungan asam fenolat diukur pada panjang gelombang 280 nm (Neo et al. 2008).
Analisis Lignin
Senyawa ekstraktif sampel dihilangkan dengan menambahkan campuran heksana : etanol (1:1 v/v) dan dikocok selama 24 jam pada suhu ruang. Sampel disaring dan dicuci dengan etanol 96% untuk menghilangkan heksana. Selanjutnya sampel diekstrak dengan etanol 96% selama 4 jam, disaring dan dicuci dengan air. Kemudian di masukkan dalam tabung Erlenmeyer yang telah diisi 50 mL air panas, dipanaskan di atas penangas air selama 1 jam. Sampel disaring dan dicuci dengan air mendidih, dibiarkan sampai kering udara.
Pengujian lignin mengikuti metode Dence & Lin (1994) yang dimodifikasi. Sebanyak 5 mL 72% asam sulfat, ditambahkan dengan hati-hati ke dalam 500 mg sampel bebas zat ekstraktif, diinkubasi pada suhu ruang selama 3 jam sambil dikocok. Selanjutnya sampel diencerkan, dipanaskan di dalam autoklaf selama 30 menit pada suhu 121 0C. Kemudian disaring dan dikeringkan dengan oven dan ditimbang. Kandungan lignin adalah ratio antara berat sampel akhir/berat sampel awal (%).
Analisis Histologi
Analisis histologi dilakukan menurut metode Sass (1951). Sampel direndam dalam larutan larutan FAA dan divakum selama minimal 24 jam. Setelah itu sampel direndam secara berurutan dalam larutan Etanol 70%, Etanol 95%, Etanol absolut, Etanol : Xilol (3 : 1), Etanol : Xilol (1 : 1), Etanol : Xilol (1 : 3), Xilol I, dan Xilol II. Sampel direndam lagi dalam larutan infiltrasi masing-masing minimal 3 jam. Tahapan perendaman yang dilakukan adalah direndam dalam larutan Xilol : parafin ¼ bagian, diganti dengan parafin ¼ bagian, dilanjutkan dalam larutan Xilol : parafin ½ bagian, diganti dengan parafin ½ bagian, dalam larutan Xilol : parafin ¾ bagian, diganti dengan parafin ¾ bagian dan dalam larutan Xilol : parafin satu bagian, diganti dengan parafin satu bagian.
Sampel diletakkan dalam parafin cair dan dibiarkan hingga membeku, setelah itu sampel diiris. Kaca objek yang dipakai telah diolesi dengan haupt adhesive/glycerin. Selajutnya preparat yang telah diiris pada gelas objek ditetesi
sedikit air dan diletakan di atas hot plate, diikuti dengan beberapa tahap
pewarnaan.
Setelah dilakukan pewarnaan dengan berbagai larutan selanjutnya preparat yang berisi sayatan sampel ditutup dengan entellan. Sampel diamati menggunakan
Hasil dan Pembahasan
Analisis Tandan
Bobot tandan buah yang dipanen selama pengamatan berkisar antara 15 sampai 55 kg, sedangkan jumlah spikelet berkisar antara 100 sampai 300 buah (Gambar 6). Hasil analisis untuk seluruh peubah karakteristik fisik tandan tampak bahwa yang berbeda nyata hanya untuk bobot tandan buah segar dan bobot spikelet (Tabel 1). Perbedaan ini kemungkinan disebabkan pada tandan buah normal beberapa buah memberondol, sedang pada tandan buah keras buah tidak memberondol.
Berdasarkan hasil pengamatan pada karakter fisik yang lain meliputi berat buah, nilai fruitset, jumlah buah normal dan jumlah spikelet terlihat tidak ada perbedaan antara tandan buah keras dan tandan buah normal. Hasil ini mengindikasikan bahwa pembentukan dan perkembangan buah pada tandan buah keras berlangsung dalam keadaan normal.
Bobot dan jumlah tandan buah segar adalah faktor utama dalam menghitung produksi tanaman kelapa sawit. Tandan buah keras secara umum memiliki bobot tandan buah yang lebih tinggi, namun hal ini menjadi tidak berarti karena tandan buah keras umumnya tidak terpanen. Tandan buah keras yang tidak dapat dipanen tepat waktu akan terlalu masak pada rotasi panen berikutnya.
Tan et al (2009) melaporkan bahwa tandan buah yang terlambat dipanen
akan menyebabkan kualitas Crude Palm oil (CPO) menurun karena nilai asam
lemak bebas yang tinggi sehingga berdampak terhadap turunnya nilai jual CPO. Ebongue et al. (2006) menyatakan bahwa mesokarp buah kelapa sawit memiliki
aktivitas enzim lipase yang tinggi. Aktivitas lipase menyebabkan asidifikasi yang melepaskan asam lemak bebas pada mesokarp buah masak kelapa sawit. Aktivitas lipase dapat dihilangkan dengan perlakuan pemanasan, sedangkan asiditas dapat dikurangi dengan cara memanen sebelum buah dalam kondisi terlalu masak.
Di samping karakter fisik buah tandan buah keras yang berbeda dengan buah normal, perbedaan lainnya adalah umumnya buah dari tandan buah keras berwarna lebih hitam. Bentuk buah lebih bulat dan lobus buah pecah (Gambar 6). Tabel 1 Karakter fisik tandan buah keras dan tandan buah normal
Gambar 6 Penampakan tandan buah keras dan tandan buah normal kelapa sawit yang sudah masak. A. Tandan buah keras, terlihat tidak ada bekas buah yang memberondol dan B) tandan buah normal, terlihat bekas buah masak yang memberondol.
Analisis Beberapa Komponen Biokimia Buah
Kandungan total karoten, asam klorogenat, asam ferulat dan lignin zona absisi buah pada tandan buah keras berbeda nyata dibandingkan dengan buah pada tandan buah normal (Tabel 2). Ramakhrisna & Ravishankar (2011) melaporkan bahwa akumulasi senyawa tersebut sering terjadi pada waktu tanaman mengalami cekaman sebagai fungsi adaptasi tanaman terhadap cekaman lingkungan.
Neo et al (2008) melaporkan bahwa minyak kelapa sawit mengandung
banyak antioksidan yang berfungsi baik bagi kesehatan manusia seperti karotenoid, tokoferol, dan senyawa fenolat. Pada kondisi cekaman kekeringan antioksidan tersebut berfungsi sebagai senyawa yang terlibat dalam mekanisme pertahanan tanaman terhadap cekaman kekeringan.
Senyawa fenolat, asam fenolat dan turunannya maupun polifenol mempunyai peran penting dalam detoksifikasi radikal bebas (Ksouri et al. 2007).
Senyawa polifenol juga digunakan sebagai substrat oleh kerja enzim peroksidase dalam melawan H2O2 (Yildiz-Aktas et al. 2009). Detoksifikasi pada tanaman terjadi melalui dua cara, yaitu enzimatik dan non enzimatik. Tanggap yang umum terjadi adalah dengan cara meningkatkan sintesis senyawa fenolat (Parida et al.
2004).
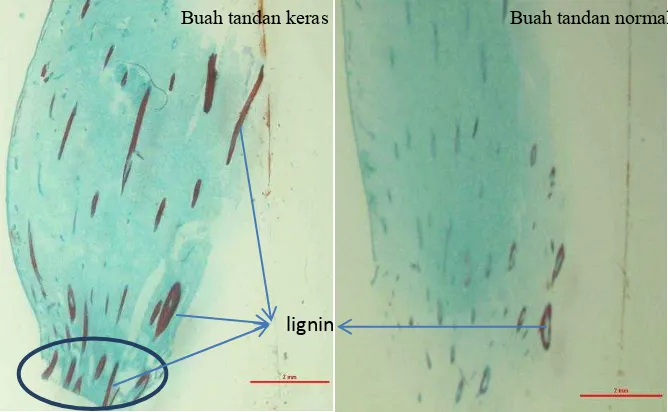
Satu jenis fenolik lain yang diakumulasi selama cekaman kekeringan adalah lignin. Lignin berfungsi sebagai sistem pertahanan terhadap cekaman. Lignin memungkinkan dinding sel impermeable terhadap air, sehingga memungkinkan pengangkutan bahan organik pada jaringan xylem. Namun demikian, walaupun lignin mempunyai fungsi yang baik bagi tanaman, tetapi kandungan lignin yang terlalu tinggi dapat menyebabkan masalah dalam beberapa keperluan industri.
Tabel 2 Karakter biokimia pada tandan buah keras dan tandan buah normal Keterangan : ns = tidak signifikan pada α 0.05 an * = signifikan pada α 0.05
Kandungan lignin yang tinggi pada zona absisi buah tandan buah keras diduga menyebabkan buah tidak mudah untuk memberondol (absisi) dari tandan buah. Absisi adalah proses pemisahan sel sehingga tanaman dapat melepaskan sebagian organnya seperti daun, bunga dan buah, yang terjadi pada lokasi yang disebut zona absisi. Proses ini terjadi dengan melibatkan koordinasi banyak proses biokimia.
Henderson & Osborne (1994) menyatakan bahwa absisi buah kelapa sawit terjadi melalui dua tahap, yaitu pemisahan sel dari tangkai buah yang diinisiasi oleh etilena atau prekursornya, kemudian tahap ke dua adalah pemisahan sel pada daerah cincin tepal yang tergantung dari proses pelepasan pada fase pertama. Proses pelepasan pada tahap ke dua ditentukan oleh umur dan kematangan buah serta tekanan yang terjadi. Tranbarger et al (2011) melaporkan bahwa pemisahan
sel menjadi dua zona yang berurutan, yaitu zona absisi utama kemudian perbatasan zona absisi. Dilaporkan bahwa etilena menginduksi pemisahan hanya pada zona absisi utama, sementara itu bagaimana sinyal menginduksi pemisahan pada bagian perbatasan zona absisi masih belum diketahui