PENGARUH KADAR FOSFATIDILKOLIN KEDELAI
PAKAN YANG BERBEDA TERHADAP KINERJA
PERTUMBUHAN IKAN KERAPU TIKUS
(Cromilepfes altivelis)
OLEH
:MUHAMMAD SIARAH
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
SIARAH. Pengaruh Kadar Fosfatidilkolin Kedelai Pakan yang
Berbeda terhadap Kine rja Pertumbuhan Ikan Kerapu Tikus (Crornileptes aitivelis). Dibimbing oleh Dr. Ir. Dedi Jusadi, M.Sc, Dr. Ir. Ing Mokoginta, MS dan Dr. Ir. I.N. Adiasmara Giri, MS.
Tujuan penelitian adalah mencari kadar fosfatidilkolin (FK) optimum untuk pertumbuhan ikan kerapu tikus. Di dalarn penelitian ini perlakuan yang digunakan adalah dosis FK kedeIai (kemurnian FK 53%) dalam pakan 0,00%, 1,89%, 3,79%, 5,67%, dan 7,56%, atau kandungan FK dalam pakan sebesar 0,69%, 1,23%, 2,36%, 3,43% dan 4,60%. Tiap perlakuan terdiri dari 3 ulangan. Pakan percobaan rnempunyai kandungan protein dan energi yang sama. Ikan uji yang digunakan adalah juvenil ikan kerapu tikus dengan bobot rata-rata 2,99*0,01 g yang dipelihara dalam bak fiber volume 30 L. Ikan dipelihara dengan kepadatan ikan 10 ekoribak diberi pakan 2 kali sehari (pagi dan sore) secara at satiation selama 84 hari.
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang be t-judul :
PENGARUH KADAR FOSFATIDLLKOLIN KEDELAl PAKAN YANG BERBEDA TERHADAP KINERJA PERTUMBUHAN
LKAN
K E W U TMUS (Cromileptes altivelis).Adalah benar merupakan hasil karya saya sendiri dan belum pernah dipublikasikan.
Semua sumber data dan inforrnasi yang digunakan telah dinyatakan secara jelas dan
dapat diperiksa kebenarannya.
PENGARUH KADAR FOSFATIDILKOLIN KEDELAI
PAKAN YANG BERBEDA TERHADAP KINERJA
PERTUMBUHAN IKAN KERAPU TIKUS
(Cromileptes
altivelis)
MUHAMMAD SIARAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
PROGRAM PASCASARJANA
TNSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Kadar Fosfatidilkolin Kedelai Pakan Yang Berbeda
Terhadap Kinerja Pertumbuhan Ikan Kerapu Tikus
(Cromilepfes altivelzs)
Nama : Muhammad Siarah
NRP : 99464
Program Studi : Ilmu Perairan
Menyetujui,
1 . Komisi Pembimbing
A
j
',-
Dr. I " edi Jusadi MSc Ketua
Dr. Ir.
IIN.
Adiasmara Giri, MS AnggotaMengetahui,
L Program Studi Ilmu Perair
A
r. Kusman Surnawidiaia. MSc
Penulis dilahirkan di Kolaka pada tanggal 1 Januari 1968 sebagai anak ke 6 dari 8 bersaudara dari pasangan Muhammad Sunusi clan Hajrah. Pendidikan sarjana ditempuh di Program Studi Perikanan, Fakultas Petemakan Universitas Hasanuddin Ujung Pandang, lulus pada tahun 199 1. Pada tahun 1999 penulis diterima di Program Studi Ilmu Perairan Program Pascasarnaja IPB. Beasiswa pendidikan Pascasarjana diperoleh dari Proyek ARMP-I1 Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karyah ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei hingga Agustus 2001 ini ialah fosfatidilkolin pakan, dengan judul: Pengaruh Kadar Fosfatidilkolin Kedelai Pakan yang Berbeda terhadap Kinerja Pertumbuhan Ikan Kerapu Tikus (Cromileptes altlvelis).
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Dedi Jusadi, M.Sc selaku Ketua Komisi Pembimbing, serta Ibu Dr. Ir. Ing Mokoginta, MS dan Dr. Ir. I.N. Adiasmara Gin, MS masing-masing selaku Anggota Komisi Pembimbing yang telah banyak memberikan saran. Disamping itu, ucapan terima kasih penulis sampaikan kepada Bapak Kepala Balai Besar Riset Perikanan Budidaya Laut Gondol-Bali yang telah memberikan izin penelitian. Ucapan terima kasih juga penulis sampaikan kepada Bapak Lalu Sukarno beserta staf di Laboratorium Biokimia dan Enzimatik Balai Penelitian Bioteknologi Pertanian yang telah membantu di dalam analisis kimia. Hal yang sama penulis sampaikan kepada Kepala BPTP Kendari, Kepala Puslit Sosial Ekonomi dan Pemimpin Proyek A R M P -
I1 Badan Penelitian clan Pengembangan Pertanian, Departemen Pertanian yang telah membantu dan memberikan beasiswa pendidikan pascasarjana di IPS. Ungkapan terima kasih yang sebesar-besarnya penulis sampaikan kepada ayah, ibu, istriku Ir. Ummy Riasari, dan ke dua putriku Sasqia Fesanti Utami dan Zahra Jinan Fadillah serta kakak dan adik atas segala doa dan kasih sayangnya.
Akhir kata, semoga karya ilmiah ini bermanfaat.
DAFTAR
IS1
Halaman
...
DAFTAR TABEL ... v111
DAFTAR LAMF'IRAN ... ix
PENDAHULUAN Latar Belakang ... 1
Pendekatan dan Perumusan Masalah ... 3
Tujuan clan Manfaat Penelitian ... 4
Hipotesis ... 4
TINJAUAN PUSTAKA . . ... Kebutuhan Nutrls~ . . 5
Fosfol~p~d ... 8
BAHAN DAN METODE PENELITIAN . . Pakan UJI ... 14
Pemeliharaan Ikan ... 16
Pengukuran Kecemaan Pakan ... 17
. . . . Anal~sls
. .
K l m ~ a. .
... 17Anallsls S t a t ~ s t ~ k ... 18
. . . ... Peubah yang DIUJ I 19 HASIL DAN PEMBAHASAN Hasil ... 21
Komposisi Proksimat Tubuh ... 21
Komposisi Kelas Lipid dan Asam Lemak . . ... 21
Kinerj a Perturnbuhan ... 24
Pernbahasan ... 26
DAFTAR TABEL
Halaman
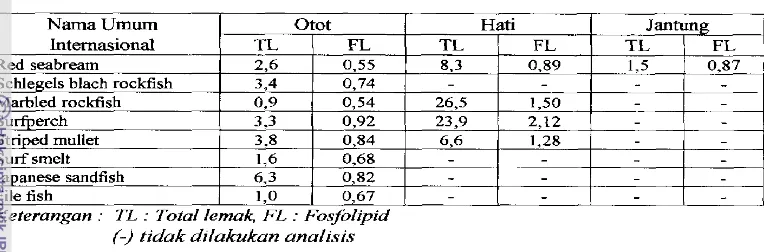
1. Kandungan lemak total dan fosfolipid (g/JOOg bobot sampel basah) pada I1 otot, hati, dan jantung beberapa spesies ikan perairan pantai dan karang
...
(Takama et al. 1994)
2. Kebutuhan fosfolipid pada fase larva dan juvenil ikan (Couttea et al. 1997).. 12 3. Komposisi bahan pakan penelitian (% bobot kering pakan )... ... 14 4. Hasil analisis proksimat, kadar asam lemak dan kelas lipid pakan penelitian 15
... (% bobot kering pakan)
5. Komposisi proksimat tubuh ikan diakhir penelitian (% bobot kering) ... 2 1 6. Data hasil analisis kelas lipid dan asam lemak totaI tubuh, hati dan Otot
ikan diakhir penelitian (% bobot kering) ... 23
DAFTAR
LAMPIRAN
Halaman
1 . Ekstraksi lechitin teknis kedelai ... 34
2 . Komposisi vitamin mix dan mineral mix dalam mg/100 g pakan (Giri et al . 1999) ... 35
3 . Analisis kadar protein pakan dan tubuh ikan (metode semi mikro Kjeldahl ; Takeuchi 1988) ... 36
4 . Analisis kadar lemak pakan dan tubuh ikan ( metode ether ekstraksi ... SoxhIet ; Takeuchi 1988) 37 5 . Analisis kadar abu pakan (Takeuchi 1988) ... 38
6 . Analisis serat kasar pakan (Takeuchi 1988) ... 39
... 7 . Pengukuran kadar air (Takeuchi 1988) 40 ... 8
.
Analisis kelas lipid (AOAC 1995) 41 9.
Analisis asam lemak (Apriyanto et al.
1989)...
4310
.
Suhu. salinitas dan pH air selama penelitian ... 4511 . Oksigen terlamt. amoniak dan nitrit air selama penelitian ... 46
12 . Analisis Cr203 pakan dan feses ikan (Takeuchi 1988) ... 47
13
.
Rata-rata hasil analisis proksimat tubuh ikan diakhir penelitian (% bobot kering) ... 4814
.
Data hasil analisis asam lemak total tubuh. hati dan otot ikan diakhir penelitian (% bobot kering) ... 4915 . Rata-rata bobot ikan selama penelitian (g) ... 50
17 . Data hasil perhitungan konsumsi pakan (KP). retensi protein (RP). retensi lemak (RL). indeks hepatosomatik
(IH).
laju pertumbuhan harian (LPH). efisiensi pakan (EP). dan kecernaan total bahan kering pakan (KTBKP) ...18 . Hasil analisis sidik ragam konsumsi pakan ...
19 . Hasil analisis sidik ragam retensi protein ...
20 . Hasil analisis sidik ragam retensi lemak ...
21 . Hasil analisis sidik ragam indeks hepatosomatik ...
22 . Hasil analisis sidik ragam laju pertumbuhan harian ...
23 . Analisis sidik ragam efisiensi pakan ...
PENDAHULUAN
Latar Belakang
Budidaya ikan kerapu tikus (Cromileptes altivelis) dewasa ini banyak mengalami
kemajuan, khususnya upaya penyediaan benih lewat panti pembenihan (hatchery)
yang saat ini sedang dirintis oleh lembaga-lembaga penelitian dan kalangan
pengusaha. Awal perkembangan produksi massal benih kerapu tikus hingga umur 50
hari dimulai pada tahun 1996-1 997 dengan hasil kelangsungan hidup sebesar 0,1%,
dan tahun 1997-1998 meningkat menjadi 3,9% (Sugama et ai. 1998). Data terakhir
yang dilaporkan oleh Kawahara et al.(2000) dengan lama pemeliharaan 43 hari diperoleh kelangsungan hidup 31,348,5%. Namun perkembangan produksi larva
hingga juvenil tidak diikuti dengan penyediaan pakan buatan untuk ikan tersebut,
sehingga pakan yang diberikan kebanyakan pakan komersial umurn yang tidak
mencirikan kebutuhan nutrisi ikan kerapu tikus.
Hingga sekarang ini, usaha pembesaran yang dilakukan oleh petani-petani ikan
masih mengandalkan pakan ikan rucah sebagai sumber pakan ikan kerapu.
Keberadaan pakan jenis ini hanya dapat diperoleh dengan jumlah yang cukup pada
musim-musim tertentu saja, sehingga merupakan suatu kendala bagi petani ikan di
seluruh Indonesia untuk mengembangkan usaha pembesaran secara
berkesinambungan. Upaya penggunaan pakan buatan bempa pelet telah dicobakan
pada juvenil ikan kerapu tikus dan ternyata disenangi dan memberikan respon
Penggunaan pakan berupa pelet diharapkan dapat membantu memecahkan
masalah petani dalam ha1 penyediaan pakan utama untuk pengembangan budidaya.
Di samping itu komposisi bahan pakan dapat diatur sesuai dengan kebutuhan nutrisi
ikan kerapu tikus, sehingga pertumbuhan ikan lebih optimal. Informasi penelitian
mengenai kebutuhan nutrisi ikan kerapu tikus masih terbatas pada kebutuhan protein,
lemak, karbohidrat, vitamin B-6 dalam bentuk pyridoxine-HC1 dan vitamin C daiam
bentuk L-ascorbyl-2-phosphate-magnesium (APM). Giri et al. (1999) melaporkan
bahwa yuwana ikan kerapu tikus (bobot badan 5,5*0,2 g) membutuhkan protein
54,2%, lemak 9,0% (bobot badan 6,5*0,6 g) dan vitamin C 30 mg APM/kg pakan
(bobot badan 13,5+0,9 g). Sedangkan Subiyakto (2000) memperoleh kebutuhan
vitamin C yang terbaik daiarn pakan untuk pertumbuhan dan respon terhadap stres
sebesar 25 mg APMkg pakan (bobot badan 2,96*1,4 g). Adapun Lestari (2001)
memperoleh kebutuhan vitamin B-6 (pyndoxine-HC1) untuk pertumbuhan ikan
kerapu tikus dengan bobot badan 14,17*0,14 g sebesar 60 mglkg pakan. Mengenai
kebutuhan karbohidrat, Suwirya et al. (200 1) melaporkan bahwa jumlah karbohidrat jenis dextrin yang dibutuhkan untuk juvenil ikan kerapu tikus dengan bobot badan
Et0,03 g adalah 14%. Sedangkan informasi kebutuhan nutrisi Iainnya masih belum
diketahui.
Untuk dapat mencapai pertumbuhan yang optimal, kebutuhan nutrisi ikan hams
lengkap dan berimbang untuk mendukung proses-proses fisiologis dan metabolisme
di dalam tubuh ikan. Fosfolipid (lecithin) merupakan salah satu komponen membran
sel tersebut. Di pihak lain, ikan laut mempunyai kemampuan mensintesis fosfolipid
yang rendah. Lehninger (1982) menyatakan bahwa sebagian besar hewan mempunyai
kemampuan mensintensis lecithin, tetapi kemampuannya sangat rendah. Oleh karena
itu, fosfolipid perlu ditambahkan jika ingm mendapatkan pertumbuhan yang lebih
baik. Untuk melengkapi informasi kebutuhan nutrisi ikan kerapu perlu dilakukan
penelitian tenbng kebutuhan fosfolipid, khususnya fosfatidilkolin.
Pendekatan dan Perumusan Masalah
Salah satu unsur nutrisi yang memegang peranan penting di dalam sistem
membran sel adaIah fosfolipid. Fosfolipid dalam membran sel berperan
meningkatkan permeabilitas sehingga memudahkan transpor nutrien dari luar ke
dalam sel untuk digunakan dalam proses metabolisme (anabolisme dun
katabolisme). Pada kadar fosfolipid optimum, sistem kerja membran sel dalam
transpor nutrien dari luar ke dalam sel ataupun sebaliknya akan berjalan dengan baik. Narnun kenyataannya bahwa fosfolipid yang dihasilkan oleh ikan tidak mencukupi
kebutuhan ikan. Hal ini disebabkan oleh kemampuan ikan untuk memproduksi
enzim-enzim yang terkait dengan sintesis fosfolipid jurnlahnya terbatas, diantaranya
enzim A7.P sitraf liuse sebagai enzim pertama dalam rangkaian pembentukan
fosfolipid yang fungsinya untuk membentuk acetyl Co-A, kemudian enzim
acefyl Co-A curboxylase untuk membentuk malonil-CoA, selanjutnya enzim
gZyceroIfosfatase acyZtransferase untuk membentuk fosfatidic acid yang seterusnya
(Sargent et al. 1988). Beberapa hasil penelitian menunjukkan bahwa kebutuhan
fosfolipid pada ikan dan krustasea berkisar 1-3% dari bobot kering pakan (Coutteau
et al. 1997), sedangkan kebutuhan optimum ikan kerapu tikus belum diketahui.
Oleh karena itu, pemberian pakan tanpa memperhitungkan kadar fosfolipid yang
sesuai dengan kebutuhan ikan, maka pakan tersebut tidak akan dapat dimanfaatkan
oleh ikan secara optimal. Untuk meningkatkan kine rja membran sel tersebut, maka
dalam pakan ikan perlu ditambahkan fosfolipid, dalam ha1 ini fosfatidilkolin kedelai.
Tujuan dan Manfaat Penelitian
Tujuan penelitian adalah mencari kadar fosfatidilkolin (FK) optimal untuk
pertumbuhan ikan kerapu tikus (Cromzleptes altivelis). Sedangkan manfaat penelitian
adalah dapat memberikan informasi tentang kadar FK kedelai yang terbaik untuk
dijadikan dasar dalam penyusunan ransurn pakan.
Hipotesis
Penambahan FK kedelai tertentu dalam pakan dengan kandungan nutrisi yang
cukup dan seimbang serta kondisi lingkungan hidup yang layak akan meningkatkan
TINJAUAN PUSTAKA
Kebutuhan Nutrisi
Pakan dan bahan-bahan pokok pakan hams mengandung sumber-sumber nutrisi
dan energi yang esensial untuk pertumbuhan, reproduksi, dan kesehatan ikan.
Kekurangan pada salah satu substansinya dapat menguranp laju pertumbuhan,
menimbulkan penyakit, dan beberapa kasus yang menyebabkan laju pertumbuhan
rendah. Kebutuhan akan komposisi pakan ditentukan dari energi, protein dan asam
amino, lemak, mineral, dan vitamin (NRC 1993).
Protein adalah bahan organik terbesar di dalam jaringan ikan, kira-kira mencapai
65-75% dari total bobot kering dasar (Wilson 1989 ; Hepher 1990). Namun
kebutuhan protein di dalam pakan pada sebagian besar ikan berkisar antara 35-50%
(Hepher 1990). Ikan mengkonsumsi protein untuk mendapatkan asam amino. Asam
amino digunakan oleh bermacam-macam jaringan untuk sintesis protein baru.
Tingkat optimal protein di dalam pakan ikan dipengaruhi oleh keseimbangan
proteinlenergi, komposisi asam amino clan kecernaannya, dan sumber-sumber energi
non-protein di dalam pakan (Wilson 1989).
Penelitian mengenai kebutuhan protein pakan ikan kerapu tikus telah
dilakukan oleh Giri et al. (1999). Pada pemeliharaannya, surnber protein yang
digunakan adalah kasein, tepung ikan, tepung cumi, tepung rebon, dan tepung
Artemia dengan menggunakan ikan uji dengan bobot rata-rata 5,5*0,2 g. Kebutuhan
lanjut dinyatakan bahwa secara kuantitatif kebutuhan protein ini relatif tinggi,
sehingga merupakan suatu kendala dalarn pemilihan bahan baku untuk fomulasi
pakannya. Namun kebutuhan ini dapat ditekan dengan mengoptimalkan kandungan
protein dengan kandungan energi pakan. Menurut Shiau dan Lan (1 996), kandungan
protein pakan Epinephelus malabaricus dapat diturunkan dari 50,2% menjadi 44,0%
dengan mempertahankan kandungan energi 340-375 kca1/100 g pakan. Sedangkan
Rachmansyah et al. (1999) memperoleh kebutuhan optimum protein untuk laju
pertumbuhan harian ikan kerapu tikus berukuran 2 5 4 0 g, yaitu sebesar 45,32%.
Adapun Achrnad et a/. (1992) yang melakukan penelitian pada ikan kerapu lumpur
yang dipelihara dalarn kerarnba jaring apung memperoleh kebutuhan protein yaitu
50% dengan energi sebesar 359 kcal ME/100g pakan.
Lemak dalam pakan adalah penting sebagai sumber energi dan asam lemak
esensial (EFA) dan dibutuhkan untuk pertumbuhan dan perkembangan tubuh yang
normal (NRC 1993). Lemak selain sebagai sumber energi juga drgunakan untuk
struktur sel, perawatan tubuh, dan untuk mempertahankan integritas pada
biomembran (Watanabe 1988). New (1987) melaporkan bahwa kebutuhan optimum
lemak pada ikan kerapu (Epinephelus sp.) didalam pakannya sekitar 14%. Namun
kandungan lemak yang terbaik didalam pakan ikan kerapu tersebut adalah 13,5% dari
bobot kering pakan (Boonyaratpalin 1997). Kebutuhan lemak dalam pakan untuk
juvenil ikan kerapu tikus ukuran 6,5+0,6 g yang memberikan pertumbuhan terbaik
Penelitian mengenai kebutuhan karbohidrat pada ikan-ikan karnivora tidak begrtu
banyak dilakukan, ha1 ini berkaitan dengan tingkat pemanfaatan karbohidrat yang
rendah pada jenis ikan ini. Disamping itu kebutuhan karbohidrat sulit ditentukan dan
penggunaannya dalam proses metabolisme belum jelas, karena glukosa darah lebih
mudah diperoleh dari proses glukoneogenesis dibandingkan langsung dari
karbohidrat (Zomeveld et al. 1991). Dilaporkan oleh Suwirya et al. (2001) bahwa kebutuhan karbohidrat jenis dextrin untuk juvenil ikan kerapu tikus dengan bobot
badan 8*0,03 g adalah 14%. Sedangkan Boonyaratpalin (1997) melaporkan bahwa
ikan kakap (Lutes caalcarzfier) yang diberi karbohidrat 10% pertumbuhannya baik,
tetapi ketika dinaikkan hingga 27% pertumbuhan ikan terharnbat. Pertumbuhan
terbaik jika kandungan karbohidrat tidak lebih dari 20%.
Vitamin adalah senyawa organik yang dibutuhkan dalam jumlah yang sedikit dan
fungsinya amat besar, namun beberapa organisme tidak dapat mensintesisnya.
Vitamin dapat diklasifikasikan dalam dua bentuk yaitu yang larut dalam air, di
antaranya : vitamin B kompleks, kolin, inositol dan vitamin C, sedangkan rang larut
dalam lemak adalah : vitamin A, D, E, dan K (NRC 1983 ; NRC 1993). Fungsi utama
dari vitamin C (asam askorbat) yaitu berperan dalam hidroksilasi prolin pada
hidroksiprolin untuk digunakan pa& sintesis tulang rawan atau tulang muda
(De Silva dan Anderson 1995). Asarn askorbat adalah kofaktor didalam hidroksilasi
prolin menjadi hidroksiprolin dalam pembentukan kolagen (NRC 1983).
Informasi kebutuhan vitamin pada ikan kerapu yang diketahui hanya terbatas pada
(pyridoxin-HC1) dalam pakannya memperoleh kebutuhan untuk pertumbuhan ikan
kerapu tikus (bobot badan 14,17*0,14 g) sebesar 60 mg/kg pakan. Boonyaratpalin
(1997) melaporkan bahwa kebutuhan minimum L-ascorbyl-2-phospate-Mg untuk
pertumbuhan normal ikan kerapu jenis Epinephelus iauvzna yaitu 30 mg/kg dari
bobot kering pakan Hal ini sejalan dengan hasil penelitian yang dilakukan oleh Giri
et aE. (1999) pa& ikan kerapu tikus berukuran 13,5*0,9 g, yaitu diperoleh kebutuhan
vitamin C (L-ascorbyl-2-phospate-Mg) sebesar 30 mg/kg pakan. Sedangkan
Subiyakto (2000) memperoleh kebutuhan vitamin C yang terbaik dalam pakan untuk
pertumbuhan dan respon terhadap stres sebesar 25 mg APlWkg pakan (bobot badan
2,96~1,4 g).
Seperti halnya vitamin, mineral dibutuhkan dalam jumlah relatif sedikit
(Lovell 1989). Mineral dibutuhkan oleh ikan untuk pertumbuhan tulang dan gigi
(Zonneveld et al. 1991), dan dalam bentuk ion. dapat menjaga keseimbangan asam
basa dan hubungan tekanan osmosis dalam tubuh dengan lingkungan dan merupakan
komponen penting dari hormon dan enzim (NRC 1993). Mineral yang dibutuhkan
untuk ikan adalah kalsium, magnesium, fosfor, dan sedikit koper, iodin, besi,
mangan, selenium, dan zinc (Watanabe 1988).
Fosfolipid
Bagian lemak yang cukup penting dan berada dalam sel adalah fosfolipid, yaitu
lemak yang mengandung fosfor. Lecithin adalah sebuah fosfolipid penting terutama
molekul asam fosfat dan dua molekul asam lemak dengan ketiga gugusan hidroksil
dari molekul gliserol (Campbell dan Smith 1982). Piliang dan Djojosoebagio (1996)
menyatakan bahwa fosfolipid mempunyai gugusan asam maupun basa, oleh karena
itu fosfolipid mempunyai gugusan hidrofilik (gugusan yang dapat menarik atau
mengikat air). Di samping itu fosfolipid juga mengandung asam lemak yang
mempunyai potensi sebagai lipofilik (gugusan yang dapat menarik lemak) dan juga
mempunyai kemampuan sebagai penolak air atau gugus hidrofobik. Dengan
demikian, lecithin mempunyai kemampuan untuk mempertahankan kestabilan fase
air yang terdapat di luar dan di dalam sel karena adanya gugus hidrofilik, sedangkan
gugus hidrofobik yang dipunyai lecithin memungkinkan zat-zat yang larut dalam
lemak yang terdapat di luar sel unhk masuk ke dalam sel.
Fosfolipid merupakan bagian terbesar dari lemak yang ada didalam biornembran.
Biomembran pada jaringan ikan, seperti pada kebanyakan jaringan hewan,
mengandung FK sebagai bagian fosfolipid terbesar yang diikuti oleh
fosfatidiletanolamin (FE), fosfatidilserin (FS), fosfatidilinositol (FI), kardioplin, dan
sfingomielin sebagai komponen yang terkecil (Sargent et al. 1989). Sintesis
fosfolipid dan sfingolipid meliputi banyak reaksi yang kompleks, tempat
berlangsungnya proses sintesis fosfolipid di dalam hati dan fosfolipid dtranspor ke
jaringan tubuh oleh lipoprotein dalam bentuk VLDL (very low density lipoprotein),
LDL (low densiq lipoprotein) HDL ( high density lipoprotein) (Champbell d m Smith
1982 ; Piliang dan Djojosoebagio 1996). Disamping itu juga karena sifatnya
lemak dalam darah. Dalam proses transpor nutrien, fosfolipid memudahkan
terjadinya hanspor &if molekul-molekul dan ion-ion melewati sel membran, dan
juga mempermudah te jadinya &fusi karbondioksida (Piliang dan Djojosoebagio
1996).
Komposisi asam lemak dalam fosfolipid pada spesies ikan putih (white-flesh $sh
species) telah diteliti oleh Takama et al. (1994). Komponen utarna yang didapatkan
adalah golongan n-3 polyunsaturated fatty acid dan jumlahnya melebihi 50% pada
total asam lemak. Omega 3 (n-3) Highlyunsaturated fatty acid (HUFA) seperti
eicosapentaenoic acid (EPA) dan docosahexaenoic acid (DHA) yang banyak
didapatkan dalam lemak, diakui mempunyai peranan yang efektif dalam mencegah
hiperl~pidemia, thrombosis, artherosklerotik kardipat, infarksi miokardiak, dan
embolus cereblal. Fungsi fisiologi n-3 PUFA adalah lebih efektif dalam bentuk
fosfolipid daripada triasilgliserol atau asam lemak etil ester. Keberadaan asam lemak
tak jenuh membran sel dapat menjaga dan memperbaiki fluiditas membran, sehingga
fungsi metabolisme sel tetap berjalan normal. Penambahan n-3 KUFA dapat
mengaktifkan ke j a enzim (N~+/K+) ATP-ase, karena asam lemak tersebut memiliki
titik cair yang rendah, sehingga dapat rneningkatkan fleksibilitas dan permeabilitas
membran (Li et al. 1994). Kandungan lemak total dan fosfolipid beberapa spesies
ikan perairan pantai dan karang pada organ utarna seperti otot, hati dan jantung dapat
Tabel 1 . Kandungan lemak total dan fosfolipid (g/lOO g bobot sampel basah) pada otot, hati, dan jantung beberapa spesies ikan perairan pantai dan karang
(Takama et aZ. 1994)
Keterangun : TL : Total lernuk, FL : Fosfolipid
f-) tidak difakukan anul&is-
Tabel I memperlihatkan bahwa pada bagian otot kisaran kandungan fosfolipid
untuk sepsies ikan perairan pantai dan karang yaitu berkisar 0,55-0,92% bobot tubuh
basah, sedangkan pada bagan hati ikan red seabream, marbled rockfish, surfperch
dan striped mullet berkisar 0.62-2.12%. Selanjutnya pada bagian jantung pada ikan
red seabream, kandungan fosfolipid adalah 0,87% dan bobot sampei basah.
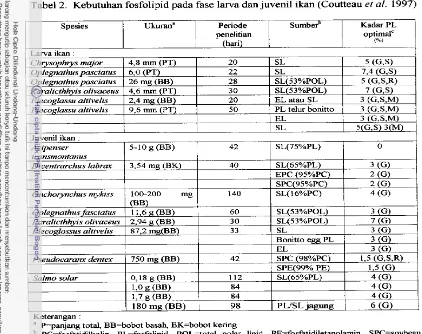
Adapun kebutuhan fosfolipid yang optimal untuk beberapa jenis lama dan juvenil
ikan laut berdasarkan evaluasi beberapa parameter pengamatan, yaitu kelangsungan
hidup, pertumbuhan, sensitivitas stres, kelainan tulang dan komposisi tubuh atau
analisis lipid dapat dilihat pada Tabel 2. Tampak pada Tabel 2 bahwa pada fase larva
ikan sangat sensitif terhadap defisiensi fosfolipid. Suplai fosfolipid dalam pakan
pada fase juvenil nampaknya kurang efektif terhadap kelangsungan hidup ikan
dibanding pada fase lama seperti yang ditunjukkan pada ikan rockbream
[image:22.509.61.443.96.222.2]Tabel 2. Kebutuhan fosfolipid pada fase larva dan juvenil ikan (Coutteau et al. 1997) Kadar PL
optimalc
Juvenil ikan :
S u m b d
tranSmontarms Dicentrarchus l a b r a
Onchorynchus mykiss
Keterangan :
" P=panjang total, BB=bobot basah, BK=bobot kering
PC=fosfatidilkolin, PL=fosfolipid. POL=total polar lipid, PE=fosfatidiletanolamin, SPC=soybean fosfatidilkolin, SPE = soybean fosfatidiletanolamin, SL=soybean lechitin. dan EL=egg lechitin
G=pertumbuhan, =kelangsungan hidup, R-esisten terhadap stres, M=malformasi Periode
penelitian Spesies
0
Acipenser
I
5-lOg(BB)Oplegnathus fasciatus Paralicthhyis olivaceus Plecoglossus altivelis
Pada fase larva, ikan tidak mampu mensintesis fosfolipid untuk mencukupi Ukurana
42
/
SL(75%PL)3 3 4 mg (BK)
100-200 mg
kebutuhan fonnasi komponen sel yang b a r - pada permulaan periode pertumbuhan F I
(BB)
1 1,6 g (BB) 2.94 g (BB) 87,2 mg(BB)
larva yang cepat (Kanazawa 1993 ). Sebagian besar ikan dan krustasea yang diteliti
mempunyai kebutuhan fosfolipid (FK + FI) pa& fase larva berkisar 1-3% dari bobot 40 140 60 30 33 SL(65%PL) EPC (95%PC) SPC(95%PC) SL(16NPC) 3 (G) 2 (G) 2 (G) 4 (G)
SL(53%POL) SL(53%POL) SL
Bonitto e m PL
[image:23.503.24.446.57.391.2]kering pakan (Coutteau el al. 1997). Sedangkan Kanazawa (1997) melaporkan
bahwa kebutuhan fosfolipid yang terbaik pada larva ikan red sea bream adalah 3%
dengan sumber fosfolipid yang digunakan yaitu lecithin kedelai. Fosfolipid dalam
tubuh ikan marnpu meningkatkan daya tahan tubuh ikan terhadap perubahan kualitas
air lingkungan. Tampak bahwa jenis fosfolipid dalam pakan akan memberikan
respon toleransi yang berbeda. Hasil penelitian Tago et al. (1999) memperlihatkan bahwa fosfolipid jenis 1,2-di-22:6-FK lebih berperan dalam fungsi toleransi terhadap
BAHAN DAN METODE PENELITIAN
Pakan Uji
Pakan uji yang digunakan dalam penelitian ini ada 5 macam berbentuk pelet.
Pelet dikeringkan dengan freez dryer dan disimpan pada suhu 4°C sebelum dan
selarna penelitian berlangsung. Komposisi bahan nutrisi penyusun pakan setiap
perlakuan sama, sedangkan yang bewariasi adalah kadar FK kedelai. Sumber FK
kedelai yang digunakan adalah lechitin tekms yang telah ditingkatkan kemumian
FK-nya dari 20% menjadi 53% (Lampiran 1). Persentase FK kedelai pakan yang
dicobakan yaitu 0,00%, 1,89Oh, 3,79%, 5,67%, dan 7,5696 atau kandungan FK dalam
pakan sebesar 0,69%, 1,23%, 2,36%, 3,43%, dan 4,60% dari bobot kering pakan.
Sumber protein pakan menggunakan kasein, tepung ikan, dan tepung rebon dengan
iso protein dan iso energi; sedangkan sumber lemak adalah minyak ikan dan lechitin
kedelai dengan total kandungan Iemak berkisar 11,95-12,84. Komposisi bahan
penyusun pakan disajikan pada Tabel 3.
Tabel 3. Komposisi bahan pakan penelitian (Oh bobot kering pakan)
Bahan Pakan
Keterangan :
*'
Komposisi mineral mix dan vitamin mix tertera pada Lampiran 2. Kadar FK pakan (5%)Kasein Tepung ikan
Untuk mengetahui komposisi proksimat, lipid polar (fosfolipid) dan netral dan
asam lemak pakan uji, dilakukan analisis kimia (Lampiran 3-9). Hasil analisis
tersebut dapat dilihat pada Tabel 4 di bawah ini
Tabel 4. Hasil analisis proksimat, kadar asam lemak dan kelas lipid pakan penelitian
(% bobot kering pakan)
Kornposisi Kadar FK pakan (%)
0,69 1,23 2,36 3,43 4,60
karbohidrat 4,10 KcaVg (NRC 1993). Z n-6
C n-3
X n-3 HUFA Rasio C n-6/ n-3
Keterangan : - Total energi pakan dihihrng berdasarkan : protein 5.65 KcaVg, lemak 9,45 KcaVg dan 1,39
1,94 0,86 0,72
1,20 1,54 0,84 0,78
1.41 2.15 0,95 0,66
1.48 2.16 0,90 0,69
Pemeliharaan Ikan
Ukuran ikan uji yang drgunakan dalam penelitian ini yaitu rata-rata 2,99*0,01 g
yang diperoleh dari Balai Besar Riset Perikanan Budidaya Laut Gondol-Bali.
Sebelum digunakan, ikan uji terlebih dahulu diadaptasikan selama 2 minggu terhadap
kondisi Iingkungan dan pakan yang akan diujikan. Pemeliharaan selama adaptasi
dilakukan dalam bak fiber volume 2 m3 dengan tujuan agar ikan mendapatkan
perlakuan yang sama. Untuk menjaga agar kualitas air didalam bak tetap baik, setiap
pagi dilakukan penyiponan kotoran ikan sebelum pemberian pakan. Pakan buatan
yang diberikan adalah pakan yang tidak mengandung FK.
Setelah ikan selesai diadaptasikan, ikan-ikan yang akan ditebar dalam bak
percobaan diseleksi terlebih dahulu agar mendekati ukuran yang seragam. Ikan
ditebar dalam wadah penelitian berupa bak polikarbonat sebanyak 15 buah dengan
volume masing-masing bak 30 T- yang dilengkapi dengan sistem air mengalir dengan
pergantian air mencapai 20 L/jam. Padat penebaran ikan per bak sebanyak 10 ekor.
Air yang digunakan diperoleh dari laut melalui mesin pompa yang dihubungkan
dengan pipa paralon. Selama masa percobaan ikan diberi pakan secara perlahan-
lahan dua kali sehari sampai ikan tidak mau menerima pakan lagi (at satiation).
Pakan yang tidak dimakan dikumpulkan dan ditimbang untuk mengetahui konsumsi
pakan, sedangkan kotoran ikan disipon setiap hari.
Untuk mengetahui perkembangan pertumbuhan ikan, dilakukan pengukuran bobot
ikan uji setiap interval 2 minggu selama masa penelitian. Penimbangan dilakukan
percobaan ditimbang untuk digunakan sebagai data perhitungan peubah efisiensi
pakan.
Pengukuran kimia air ini dilakukan pada awal, tengah, dan akhir penelitian. Hasil
pengukuran kualitas air yaitu, suhu 29-30°C, salinitas 30-32 ppt, pH 8,10-8,32,
oksigen terlarut 4,98-5,36 ppm, amoniak 0,29-0,47 ppm dan nitrit 0,04-0,08 ppm.
Data lengkap kimia air dapat dilihat pada Lampiran 10-1 1.
Pengukuran Kecernaan Pakan
Pengukuran kecemaan pakan dilakukan pada setiap perlakuan untuk mengetahui
tingkat kecernaan total bahan kering pakan. Pengukuran ini dilaksanakan pada akhir
percobaan. Sebelum pengukuran dilakukan, ikan uji terlebih dahulu dipuasakan
selama 24 jam. Selanjutnya ikan diberi pakan yang telah mengandung indikator
Cr203 berkisar 0.854.89% clan diberikan 2 kali sehari (pukul 08.00 dan 14.00).
Adaptasi ikan terhadap pakan yang mengandung Cr203 dilakukan selama 4 hari dan
pada hari ke 5 pengumpulan feses dimulai. Kepatan pengumpulan feses dilakukan
selama 7 hari. Feses yang telah terkumpul disentrifuse dengan kecepatan 3000 rpm
selama 10 menit kemudian disimpan dalamji.eezer untuk dianalisis kecernaan bahan
keringnya (Lampiran 12). Kondisi wadah d m media pemeliharaan ikan sama seperti
yang telah diuraikan sebelumnya.
Analisis Kimia
Analisis proksimat pakan dan tubuh ikan dilakukan pada awal dan akhir
dan air yang dilakukan mengikuti prosedur Takeuchi (1988). Analisis proksimat
dilakukan di Laboratorium Balai Besar Riset Perikanan Budidaya Laut Gondol-Bali.
Perhitungan BETN menggunakan rumus sebagai berikut :
BETN
-
100 - (KPK +KLK t Kab + S K )Keterangan :
BETN = bahan ekstrak tanpa nitrogen, KPK = kadar protein kasar KLK = kadar
lemak kasar, Kab = kadar abu, clan SK = serat kasar
Demikian pula dengan analisis Cr203 untuk kecernaan pakan dilakukan rnengikuti
prosedur Takeuchi (1988), kelas lipid mengikuti prosedur AOAC (1995) dan asam
lemak mengikuti prosedur Apriyantono et al. (1989). Pengujian asam lemak
menggunakan alat GLC (gas liquid chromatography) dan kelas lipid menggunakan
alat HFLC (high performance liquid chromatography). Analisis Cr203, kelas lipid
dan asam lemak setiap perlakuan dilakukan di Laboratorium Riokimia dan Enzimatik
Balai Penelitian Bioteknologi (Balithio) pertanian.
Analisis Statistik
Metode perancangan yang digunakan dalam penelitian ini yaitu rancangan acak
lengkap (RAL) dengan 5 perlakuan dan 3 ulangan. Sebagai perlakuan adalah dosis
FK kedelai yang berbeda yaitu 0,69%, 1,23%, 2,36%, 3,43%, dan 4,60% dari total
pakan. Peuhah yang diuji dengan penggunaan model statistik yaitu laju pertumbuhan
harian, kelangsungan hidup, efisiensi pemberian pakan, retensi Iemak, retensi
mengetahui pengaruh pakan uji terhadap peubah yang diukur tersebut digunakan
analisis ragam (uji F), jika berbeda nyata dilanjutkan dengan uji BNT (Steel and
Torrie 1995). Sedangkan kelas lipid dan asam lemak dianalisis secara deskriptif
Peubah yang Diuji
Untuk mengevaluasi pengaruh pakan penelitian terhadap ikan, beberapa peubah
yang berkaitan dengan pertumbuhan dan pakan uji diukur, yaitu laju pertumbuhan
harian, efisiensi pemberian pakan, retensi protein, retensi lemak, indeks hepasomatik
dan nilai kecernaan total bahan kering pakan.
Laju pertumbuhan harian dihitung dengan menggunakan rumus yang
dikemukakan oleh Huisman (1 976) :
- -
w*
= W,( l + O . O l LY )'Keterangan : -
W, = bobot rata-rata benih pada akhir percobaan (g) -
W, = bobot rata-rata benih pada awal percobaan (g)
oc
= laju pertumbuhan harian individu (Oh)t = jurnlah hari selama percobaan.
Efisiensi pemberian pakan dihitung dengan menggunakan rumus yang
dikemukakan oleh NRC (1 983) :
Keterangan :
W, = bobot ikan pada akhir percobaan (g)
W, = bobot ikan pada awal percobaan (g)
D = jumlah bobot ikan yang mati selama percobaan (g)
F = jumlah bobot pakan yang dikonsumsi selama percobaan (g dalam bobot kering).
Retensi lemak (RL) dan Retensi protein (RP) dihitung dengan menggunakan
rumus yang dikemukakan oleh Takeuchi (1988) :
Pertambahan bobot lemak tubuh (g)
R L = 100%
Bobot total lemak yang dikonsurnsi (g)
Pertambahan bobot protein tubuh (g)
RP = . 100%
Bobot total protein yang dikonsumsi (g)
Indeks hepatosomatik (M) dihitung dengan menggunakan rumus yang digunakan
oleh Suwirya et uE. (200 1 ) :
bobot hepatosomatik
IH = . 100%
bobot tubuh
Nilai kecernaan total bahan kering pakan dihitung dengan menggunakan rumus
yang dikemukakan oleh Watanabe (1988) :
Keterangan :
Da = kecernaan total bahan kering (%)
b = persentase indikator bahan kering dalam pakan
HASIL
DAN PEMBAHASAN
H a s i 1
Komposisi Proksimat Tubuh
Untuk melihat pengaruh kadar fosfatidilkolin pakan terhadap komposisi proksimat
tubuh ikan kerapu tikus dilakukan analisis proksimat. Hasil analisis proksimat dapat
dilihat pada Tabel 5. Sedangkan data lengkap dapat dilihat pada Lampiran 13. Dari
Tabel 5 terlihat bahwa kandungan protein, lemak, abu, dan kadar air antar perlakuan
relatif seragam.
Tabel 5. Komposisi proksimat tubuh ikan hakhir penelitian (% bobot kering)
Komposisi Kelas Lipid dan Asam Lemak
Pengaruh kadar fosfatidilkolin pakan terhadap lipid polar (fosfolipid) dan netral
tub& dapat dilihat pa& Tabel 6. Dari Tabel 6 terlihat bahwa kadar lipid netral total tubuh dan otot cenderung menurun seiring dengan meningkatnya kadar FK pakan,
[image:32.509.56.450.67.567.2]lagi pada kadar FK 3,43% dan 4,60%. Sedangkan kadar fosfolipid total tubuh memperlihatkan kecenderungan sebaliknya dari lipid netral.
Dari Tabel 6 terlihat bahwa asam lemak n-6 dan n-3 pada hati cenderung meningkat hingga perlakuan 4,60%, sedang pada bagian total tubuh dan otot
cenderung meningkat hingga perlakuan 3,43% kemudian menurun pada
perlakuan 4,6096. Rasio n-6 dan n-3 pada total tubuh dan hati memperlihatkan
kecenderungan yang meningkat, sedangkan otot memperlihatkan kecenderungan
Tabel
6.Data hasil analisis kelas lipid d m asam lemak total tubuh, hati dm otot ikan diakhir penelitian
(%bobot kering)
C
n-3C
n-61 n-3Keterangan
:Data hasil analisis lengkap asam lemak dapat dilihat pada Lampiran
14.
2.43
1.31 3,88
0,95 4,95
1,20 4,52
1,27 5,86
1,30 5,05
1,31 0,77
1,78 0,76
1,91 0,83
1,60 1,30
0,88 1,59
0,70 2,59
0,56 1,84
0,82 2,44
0,60 2,37
0,66 2,51
Kinerja Pertumbuhan
Perubahan bobot ratit-rata individu ikan kerapu tikus yang diberi pakan
mengandung FK yang berbeda selama penelitian dapat dilihat pada Gambar di bawah
ini. Sedangkan data lengkap dapat dilihat pada Lampiran 15.
0 2 4 6 8 10 12
Waktu pemeliharaan (minggu)
Perubahan bobot rata-rata individu ikan kerapu tikus selama penelitian.
Berdasarkan Gambar d~ atas terlihat bahwa kadar FK dalam pakan mempcngaruhi
pertumbuhan, yang awalnya relatif seragam dan setelah memasuki minggu ke 12
pengaruh masing-masing perlakuan terhadap pertumbuhan berubah. Pakan yang
memberikan pengaruh pertumbuhan yang tertinggi yaitu pada perlakuan 3,4396 pakan
dengan bobot rata-rata 27,19 g yang diikuti oleh perlakuan 2,36%, 1,23%, 0,79% dan
terendah pada perlakuan 4,60% yang secara berturut-turut bobot rata-ratanya yaitu
27,19 g, 27,12 g, 26,27 g dan 24,14 g.
Pola pertumbuhan ikan seperti yang terlihat pada Gambar di atas akan
pengaruhnya dapat dilihat pada Tabel 7 mengenai peubah konsumsi pakan dan
peubah yang berkaitan dengan kine rja pertumbuhan. Sedangkan data lengkap dapat
dilihat pada Lampiran 16-24.
Tabel 7. Nilai rata-rata konsumsi pakan (KP), retensi protein
(RP),
retensi lemak(RL), indeks hepatosomatik
(IH),
kecernaan total bahan kering pakan (KTBKP), laju perturnbuhan harian (LPH), dan efisiensi pakan (EP) pada setiap perlakuanKeterangan : Huruf yang berbeda dalam satu baris yang sama menyatakan perbedaan antar perlakuan (P<0,05).
Peubah
Tabel 7 memperlihatkan pengaruh kadar FK kedelai dalam pakan terhadap
beberapa peubah yang diamati pada. Dari Tabel 7 di atas terlihat bahwa konsumsi Kadar FK pakan ( O h )
pakan dan indeks hepatosomatik sama antar perlakuan. Retensi protein, retensi
lemak dan laju pertumbuhan harian pa& perlakuan 1,23O/~3,43% sama dan lebih
0,69
tinggi dibanding perlakuan 0,69 dan 4,60%. Sedangkan kecernaan total bahan kering 2,36
1,23
pakan pada perlakuan 1,23Y&4,60% sama dan lebih tinggi dibanding dengan
perlakuan 0,69%. Adapun efisiensi pakan pada perlakuan 0,69%3,43% sama dan
3.43
lebih tinggi dibanding dengan perlakuan 4,60%.
Pembahasan
Hasil penelitian menunjukkan bahwa perbedaan kadar FK pakan memberikan
pengaruh yang reIatif kecil terhadap komposisi proksimat tubuh ikan kerapu tikus
(Tabel 5). Relatif kecilnya komposisi proksimat tersebut karena pakan yang diberikan
mengandung protein dan energi yang reIatif seragam (zsoprotein dun isoenergi).
Adanya perbedaan kadar FK pakan akan mempengaruhi proses pencemaan pakan
d a l m tubuh ikan. Hal ini disebabkan oleh peran FK yang ada &lam pakan sebagai
zat pengemulsi terhadap lemak dengan sifatnya yang larut dalam air (hidrofilik) dan
lemak (Iipofilik). Keberadaan FK pakan tersebut berdampak kepada kecemaan total
bahan kering pakan yang lebih baik. Terlihat pada Tabel 7 bahwa nilai kecemaan
total bahan kering pakan lebih tinggi pada perlakuan FK pakan dari 1,230/0-4,60%
dibanding pada perlakuan FK pakan 0,69% (P<0,05). Diduga dengan penambahan
FK pakan akan meningkatkan emulsifier lemak, sehingga mempermudah proses
absorbsi lemak ke &lam tubuh. Beberapa penelitian mengungkapkan bahwa Iechitin
dibutuhkan sebagai pengemulsi lipid dalam pencernaan pada larva ikan dan crustacea
(Kanazawa 1993). Ditambahkan oleh Coutteau et al. (1997) bahwa fosfolipid dalam
pakan meningkatkan emulsifikasi clan absorbsi lipid dalam sistem pencernaan,
disamping itu membuat kecemaan pakan lebih baik.
Bahan pakan yang telah tercema diteruskan ke hati dalam bentuk kilomikron
untuk dikatalisis menjadi senyawa-senyawa yang lebih sederhana. Kemampuan hati
untuk mengkatalisis senyawa tersebut tercermin dari nilai indeks hepatosomatik.
(P>0,05). Diduga bahwa proses pemecahan lemak 'lzpolzsis' dan sintesis lemak
'ljpogenesis' berjalan relatif sama. Ha1 ini didukung data hasil analisis proksimat
tubuh (Tabel 51, khususnya lemak tubuh yang relatif sama.
Peranan fosfolipid sangat penting selain sebagai emulsifier juga sebagai media
transportasi. Bertambahnya fosfolipid tubuh dari perlakuan FK pakan 0,69%-4,6096
(Tabel 6) maka akan meningkatkan laju transportasi lemak dalam bentuk lipoprotein
sehingga memperlancar dan memperbaiki proses pembentukan membran sel. Namun
demikian, peningkaian kinerja membran sel dipengaruhi pula oleh kandungan asam
lemak, khususnya asarn lemak tak jenuh rantai panjang.
Gambaran kebutuhan ikan &an asam lemak terefleksi pada jumlah asam lemak
yang dikandung pada total tubuh ikan. Terlihat pada Tabel 6 bahwa asam lemak n-6
dan n-3 total tub& ikan meningkat dari perlakuan kadar
FK
0,69% sampai 3,43%.Fenomena ini menunjukkan bahwa walaupun terjadi penarnbahan FK pakan, namun
asam lemak n-3 tubuh turut meningkat juga. Hal ini disebabkan karena aff~nitas asam
Iemak n-3 lebih besar dari asam lemak n-6. Sargent eef al. (1995) dan Murray et a[. (1997) menyatakan bahwa asam lemak n-3 memiliki affinitas yang lebih besar
terhadap enzim A - 6 dan A-5 desaturase jika dibanding dengan asam lemak n-6. Lebih
lanjut BNF (1992) menambsthkan bahwa ha1 yang demikian disebabkan oleh
kompetisi asam lemak n-6 dan n-3 P U F A dalam perpanjangan turunan rantai C I 8
menjadi C20 dan C22, dimana C18:3n-3 mempunyai potensi untuk menghambat
CI8:2n-6. Sedangkan pada perlakuan FK pakan 4,60% asarn lemak n-3 dan n-6
dan n-6 sudah optimal. Diduga penambahan FK pakan sebesar 4,60% menyebabkan
terjadinya umpan balik ke sistim syaraf pusat (central nervous system) untuk
meregulasi kembali agar membatasi produksi enzim elonguse yang berperan dalam
perpanjangan rantai karbon asam lemak.
Pada tabel 6 juga terlihat bahwa asam lemak docosahexaenoid acid (C22:6n-3)
atau DHA tubuh ikan menunjukkan peningkatan dari perlakuan kadar FK pakan
0,69% sampai 3,43%. Diduga pada perlakuan ini kinerja sel meningkat untuk
menunjang transportasi lemak khususnya asam lemak DHA dari luar ke dalam sel.
Asam lemak DHA ini digunakan untuk pembentukan membran sel dan berperan
dalam meningkatkan permeabilitas sel. Stubbs dan Smith (1 984) menyatakan bahwa stabilitas, permeabilitas dan fluiditas membran sangat ditentukan oleh asam lemak
dalam fosfolipid. Ditarnbahkan bahwa membran dengan asam lemak tak jenuh lebih
tinggi mempunyai fluiditas yang lebih tinggi pula.
Kelancaran transpor lemak dalam bentuk lipoprotein dari luar ke dalam sel akibat
permeabilitas membran sel yang baik &an m e m p e n g d penyimpanan lemak dan
protein tubuh (lemak dan protein struktural). Keberadaan protein dan lemak tubuh
mempengaruhi nilai retensi protein dan retensi lemak (Tabel 7). Retensi protein dan
retensi lemak lebih tinggi didapatkan pada perlakuan FK pakan 1,23% sampai 3,43%
dibanding perlakuan 4,60% (P<0,05). Nilai retensi ini menggambarkan bahwa FK
pakan pada kadar tersebut berperan dalam meningkatkan pemanfaatan protein dan
lemak untuk struktur tubuh, sehingga pada perlakuan FK pakan 1,23-3,43% tejadi
KESIMPULAN
Kadar FK kedelai di dalam pakan yang optimal untuk pertumbuhan ikan
kerapu tikus adalah 1,23%. Hal ini didasari atas pertimbangan pada kadar tersebut
merupakan kadar FK terendah yang menghasilkan pertumbuhan d m nilai efisiensi
DAFTAR PUSTAKA
Achmad T, Ardiansyah M, Ismunandar D. 1992. Pengaruh pemberian pakan berkadar protein berbeda terhadap pertumbuhan kerapu lumpur, Epinephelus tauvina. Jurnal Penelitian Budidaya Pantai, Maros. 8 (2) : 71-80.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedamawati, Budiyanto S. 1989. Petunjuk laboratorium : AnaIisis pangan. IPB Press.
Association of Analitical Chemistry (AOAC). 1995. Official methods of analisys of AOAC, 16th edn. AOAC IntemationaI, Arlington.
Boonyaratpalin M. 1997. Nutrient requirements of marine food fish cultured in Southeast Asia. Aquaculture, 15 1 : 283-3 13.
British Nutrition Foundation's (BNF). 1992. Unsaturated fatty acids: Nutritional and physiological significance. Chapman and HaII.
Campbell PN, Smith AD. 1982. Biochemistry illustrated. Courtauld Institute of Biochesmistry, The Middlesex Hospital Medical School, London.
Coutteau P, Guerden I, Camara MR, Bergot P, Sorgeloos P. 1997. Review on the dietary effects of phospholipid in fish and crustacean larviculture. Aquaculture, 155 : 149-164.
De Silva SS, Anderson TA. 1995. Fish nutrition in aquaculture. Chapman & Hall, AquacuIture Series I, London.
Giri INA, Suwirya K, Marzuqi M. 1999. Kebutuhan protein, lemak dan vitamin C untuk yuwana ikan kerapu tikus (Cromileptes altivelis). Jurnal Penelitian Perikanan Indonesia. 5 (3) : 38-45.
Hepher B. 1990. Nutrition of pond fishes. Cambridge University Press, Cambridge, New York.
Hutapea JE, Wardoyo, Ismi S, Setiawati KM. 1997. Tanggapan larva kerapu bebek (Cromileptes altivelis) terhadap pakan buatan. Laporan Hasil Penelitian (belum dipublikasikan). Balai Besar Riset Perikanan Budidaya Laut Gondol- Bali
Kanazawa A. 1997. Effects of docosahexaenoic acid and phospolipid on stress tolerance of fish. Aquaculture, 155 : 129-140.
Kanazawa A. 1993. Essential phospholipids of fish and crustaceans in Kaushik SJ, Luquet P, Editors. Fish nutrition in practice, Les Colloques
INRA,
Paris.Kawahara S, Setiadi E, Ismi S, Tridjoko, Sugarna K. 2000. Succesful mass fry production of humpback grouper, Cromileptes altivelis. LOLITKANTA-JICA Booklet No. 10, Gondol Research Station for Coastal Fisheries, Central Research Institute for Fisheries, Indonesia.
Lehninger, AL. 1982. Principles of biochemistry. Wooth Publisher, Inc., Park Avenue South, New York.
Lestari AS. 2001. Pengaruh kadar pyridoxin yang berbeda dalam pakan terh~dap kadar hemoglobin, hematokrit dalam darah dan pertumbuhan ikan kerapu tikus (Cromilepfes alfivelis). Program Studi Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Li MH, Wise DJ, Johnson MR, Robinson EH. 1994. Dietary manhaden oil reduced resistence of channel catfish (Zctalurus punctatus) to Edwurdsiella ictaluri. Aquaculture, 128 : 335-344.
Lovell RT. 1989. Diet and fish husbandry in Halver JE, Editor. Fish nutrition. Academic Press, Inc., Washington.
Murray KM, Granner DK, Mayes PA, Rodwell VW. 1997. Biokimia harper. Santoso AH, penerjemah : Penerbit Buku Kedokteran EGC. Terjemahan dari Harper's biochemistry.
National Research Council (NRC). 1983. Nutrient requirements of warmwater fishes and shellfishes. National Academy of Sciences, Wahington D.C.
New Ml3. 1987. Feed and feeding of fish and srimp : a manual on the preparation and presentation of compounds feeds for srimp and fish in aquaculture. United Nations Development Program. Food and Agriculture Organization of The United Nations, Rome.
Piliang WG, Djojosoebagio S. 1996. Fisiologi nutrisi volume I. Universitas Indonesia.
Rachmansyah, Palinggi NN, Pong-Masak PR, Mangawe AG, Laining A. 1999. Formulasi pakan buatan untuk pembesaran ikan kerapu. Laporan akhir penelitian (belum dipublikasikan). Bagian Proyek Penelitian clan Pengembangan Perikanan Maros, Badan Penelitian clan Pengembangan Pertanian, Departemen Pertanian. 22 hal.
Sargent J, Henderson FU, Tocher DR. 1988. The lipids in Halver JE, Editor. Fish Nutrition. Academic Press, Inc. Washington.
Sargent JR, Be11 JG, Bell M V , Handerson RJ, Tocher DR. 1995. Requirement criteria for essential fatty acids. RosenthaI, Schnack D, Hilge V. Editors. Journal of Applied IchthyoIogy. Blackwell Wissenchafts-Verlag, Berlin.
Shiau SY, Lan CW. 1996. Optimum dietary protein level and protein to energy ratio for growth of grouper Epinephelus malabaricus. Aquaculture, 145 : 259-266.
Steel RGD, Tonie J.H. 1995. Prinsip dan prosedur statistika. Sumantri B, pene rjemah ; PT. Gramedia. Te jemahan dari : Principles and procedures of statistics
Stubbs CD, Smith AD. 1984. The modification of mamalian membrane polyunsaturated fatty aacids composition in relation to membrane fluidity and function. Biochem. Biophys. Acta, 79 : 89-137.
Subiyakto S. 2000. Pengaruh kadar L-ascorbyI-2-phosphate-magnesium (APM) pakan terhadap kadar vitamin C hati, asam lemak w-6 dan w-3 dan rasio hydroksi prolin/prolin tubuh dan kinerja pertumbuhan serta respon stres juvenil ikan kerapu tikus (Cromileptes altivelzs). Program Pascasarjana Institut Pertanian Bogor.
Suwirya K, Marzuki M. 1998. Pengaruh fosfolipid dalam pakan terhadap pematangan gonad udang windu (Penaeus monodon) asal tambak. Jurnal Penelitian Perikanan Indonesia, 4(1): 75-79.
Suwirya K, Giri INA, Marzuqi M. 1998. Penggunaan pakan buatan dalam pemeliharaan yuwana ikan kerapu bebek, Crom~leptes altrvelis, hasil pembenihan daZam Sudradjat A, Heruwaty ES, Sugama K, Poernomo A,, Azwar ZI, Giri DJA, Penyunting. Perkembangan terakhir teknologi budidaya pantai untuk mendukung pemulihan ekonomi nasional. Prosiding Seminar Teknologi Perikanan Pantai, Bali, 6-7 Agustus 1988.
Suwirya K, Giri M A , Marzuqi M, Tridjoko. 2001. Kebutuhan karbohidrat untuk pertumbuhan juvenil kerapu bebek, Cromileptes altivelis. Laporan Teknis Proyek Inventarisasi Evaluasi Potensi Sumberdaya Kelautan Gondol-Bali Tahun Anggaran 2001 (belum d r p u b l i h i ) . Balai Besar Riset Perikanan Budidaya Laut Gondol-Bali.
Tago A, Yamamoto Y, Teshima S, Kanazawa A. 1999. Effects of 1,2-di-20-:5- phosphatidylcholin (PC) and 1,2-di-22:6-PC on growth and stress tolerance of Japanese flounder (Paralichthys olivaceus) larvae. Aquaculture, 179 : 23 1- 239.
Takama K, Suzuki T, Yoshida K, Arai H, Anma H. 1994. Lipid content and fatty acid composition of phospholipids in white-flesh fish spesies. Fisheries Sciences, 60 (2) : 177-184.
Takeuchi T. 1988. Laboratory work
---
chemical evaluation of dietary nutrients in Watanabe T, Editor. Fish nutrition and mariculture. JICA Textbook, The general aquaculture course.Watanabe T. 1988. Fish nutrtiton and mariculture. JICA Textbook, The general aquaculture course.
Wilson RP. 1989. Amino acids and proteins in Halver JE, Editor. Fish Nutrition. Academic Press, Inc., Washington.
Lampiran 1. Ekstraksi lechitin teknis kedelai
1. Masukkan licrosof C-18 sebanyak 10 g ke dalam tabung ekstraksi, kemudian tabung ekstraksi di hubungkan dengan peristaltic pump. Rangkaian aIat ekstraksi yang telah dibuat, dijepit pada tiang penjepit. Tempatkan wadah di bawah rangkaian alat tersebut sebagai media penampung.
2 . Lechitin teknis yang telah disediakan dimasukkan kedalam peristaltic pump. Secara perlahan-lahan lechitin yang berada dalamperistaltic pump akan mengalir dengan kecepatan alir 1 mymenit melewati tabung ekstraksi.
3. Cairan yang keluar dari &bung ekstraksi adaiah lechitin yang telah ditingkatkan kemurniannya.
Lampiran 2. Komposisi vitamin mix dan mineral mix dalam mg1100 g pakan (Giri et al. 1999)
Nama Bahan
I
P dalam bentuk tunggal
Jumlah Vitamin :
P dalam bentuk mix
- Thiamin
-
Riboflavin - Ca- Pantotenate-
Niacin- Piridoxin
-
HCL-
Biotin-
Folic Acid - Inositol-
P- Aminobensoic Acid T o t a l5,OO 5,OO 1,OO 20,OO 4,OO 0,600 1,500 200,OO 251,100 - Cianocobalamin
-
Cholin Chloride - Vitamin C - J3- Carotin-
Menadion-
Calcigerol-
a- Tocofe~ol T o t a l0,O 1 900,OO 3,OO 15,OO 4,OO 1,90 20,OO 1060,91 - - -
Mineral Mix :
-
-PO4 -Ca- Lactate-
Na&P04 - FeC124H20-
ZnSO, - hhso4 - CuS04-
C U S O ~ ~ H Z O - MgS04- K J T o t a l
Lampiran 3. Analisis kadar protein pakan dan tubuh ikan (metode semi mikro Kjeldahl ; Takeuchi 1988)
1. 0,5-1,O g contoh ditimbang clan dimasukkan ke daIam labu Kjeldahl, dan salah satu labu digunakan sebagai blanko, dimana pada labu itu tidak dimasukkan contoh.
2. Ke dalam labu no. 1 ditarnbahkan 3 g katalis (K2SO4 f CuS04.5H20) dengan rasio 9 : 1, clan 10 ml H2SO4 pekat.
3. Labu no.2 dipanaskan 3 4 jam, sampai cairan dalam labu berwarna hijau, setelah itu pemanasan diperpanjang 30 menit lagi.
4. Larutan didinginkan, lalu ditambahkan air destilasi 30 ml, kemudian Iarutan no.2 dimasukkan ke labu takar, tambahkan larutan destilasi sampai volume larutan menjadi 100 ml.
5. Dilakukan proses destilasi untuk membebaskan kembali NH3 yang berasal dari proses destruksi pada no.4.
6 . Labu erlenrneyer diisi 10 m1 H2SO4 0.05 N dan ditambahkan 2-3 tetes indikator (metyl red atau methylen blue) dipersiapkan sebagai penampung N H 3 yang dibebaskan dari labu no.4.
7. Labu destilasi diisi 5 ml larutan no.4, lalu ditarnbahkan Iarutan sodium hidroksid 30%.
8. Pemanasan dengan uap terhadap labu destilasi (no.7) dilakukan minimum 10 menit setelah kondensasi uap terlihat pada kondensor.
9. Larutan dalam labu erlenmeyer dititrasi dengan 0,05 N larutan sodium hidroksid. 0.0007* (Vb - Vs) ' F ' 6.25
**
' 2010. % Protein = 100%
S
Keterangan :
Vs
-
ml0,05 N titar NaOH untuk contoh Vb = ml titar NaOH untuk blankoF = faktor koreksi dari 0,05 N larutan NaOH S = bobot contoh (g)
*
= setiap ml 0,05 N NaOH ekuivalen dengan 0,0007 g nitrogenLampiran 4. Analisis kadar lemak pakan dan tubuh ikan (metode ether ekstraksi Soxhlet; Takeuchi 1988)
1. Labu ekstraksi dipanaskan pada suhu 100°C selama 1 jam, kemudian didinginkan selama 30 menit dalam eksikator. Panaskan kernbali selama 30 menit, lalu dinginkan, kemudian timbang. Proses tersebut diulang sampai tidak ada perbedaan bobot labu lebih dari 0,3 mg. Bobot labu ekstraksi ( A)
2. 5 g contoh dimasukkan ke dalam tabung filter, lalu dipanaskan pada suhu 90-100°C selama 2-3 jam.
3. Tempatkan tabung filter pada 110.2 ke dalam ekstraksi dari alat soxchlet, kemudian sambungkan kondensor dengan labu ekstraksi pada no. 1 yang telah diisi 100 ml petroleum ether.
4. Panaskan ether pada labu ekstraksi dengan menggunakan water bath, suhu 70°C selama 16 jam.
5. Panaskan labu ekstraksi pada suhu 100 "C, kemudian ditimbang (B) B - A
6. O h lipid = 100%
Lampiran 5. Analisis kadar abu pakan (Takeuchi 1988)
1. Cawan porselin dipanaskan pada suhu 600°C selama 1 jam dengan menggunakan mujfjVefurnace, kemudian dibiarkan sarnpai suhu m@e furnace
turun sampai 1 10°C, lalu cawan porselin dikeluarkan clan disimpan dalam
eksikator selama 30 menit, lalu ditimbang (A).
2. Masukkan contoh lalu ditimbang (B), angka penimbangan sampai 4 desimal.
3. Panaskan dalam mumefurnace pada suhu 600°C selama semalam.
4. Cawan porselin dikeluarkan lalu didinsnkan dalarn eksikator selama 30 menit, laiu ditimbang (C).
C - A
5. % Kadar abu = ' 100%
Lampiran 6. Analisis serat kasar pakan (Takeuchi 1988)
1. Bahan ditimbang sebanyak 0,5 g (a), masukkan ke dalam erlenmeyer 350 ml.
2. Kemudian ditambahkan 50 ml &So4 0,3 N, panaskan selama 3 0 menit kemudian didinginkan, tambahkan lagi 25 ml NaOH 1,s N, panaskan selama 3 0 menit.
3. Kertas saring dipanaskan dan ditimbang (Xl), kemudian pasang pada corong buther
dan
hubungkan pada vacum pump untuk mempercepat penyaringan.4. Larutan dan bahan yang dipanaskan dituangkan ke dalarn corong buther, kemudian dibilas dengan 5 0 ml air panas, 50 ml H2S04, 0,3 N, 50 ml air panas dan 25 ml aseton.
5. Siapkan cawang porselin yang sudah dipanaskan pada suhu 105-llO°C, dieksikator dan timbang (X2).
6. Kemudian panaskan di atas pembakar bunzen dan dimasukkan ke dalarn tanur pada suhu 600°C hingga bewarnah putih, didinginkan dan ditimbang (X3).
7. Persentase kadar serat kasar dapat diperoleh dengan rumus
( X 3 - X 2 X I )
% Serat kasar = 100%
Lampiran 7. Pengukuran kadar air (Takeuchi 1988).
1. Cawang porselin dipanaskan pada suhu 105-1 10°C selama 1 jam, kemudian didinginkan dalam eksikator dan ditimbang (Xl).
2. Bahan ditimbang sebanyak 2-3 g (a)
3. Cawang dan bahan dipanaskan selama 4 6 jam pada suhu 105-1 10°C dieksikator dan ditimbang (X2).
4. Persentase kadar air diperoleh dengan rumus sebagai berikut
( X I + a ) X 2
% kadar air =
-
100%Lampiran 8. Analisis kelas lipid (AOAC 1995)
A. Lipid Polar
1. 0,5 g contoh dimasukkan ke dalam tabung filter, tempatkan tabung filter ke dalam ekstraksi dari alat soxchlet, kemudian sambungkan kondensor dengan labu ekstraksi yang telah diisi 100 ml petroleum ether.
2. Panaskan ether pada labu ekstraksi dengan menggunakan water bath, suhu 50°C selama 12-16 jam.
3. Lemak kasar yang dihasilkan dimasukkan ke dalam kolurn yang berisi florisil, lemak pertarna yang keluar merupakan lipid polar 1
4. Lipid polar yang masih tersisa dalam kolum yang mengandung florisil dielusi dengan larutan fase gerak CC14, CH30H dan air dengan perbandingan 65:35:4 selama tiga kali. Hasil yang keluar merupakan lipid polar ke 2, lipid polar ke 2 ini dimasukkan dalarn frezeer drier pada suhu -49 "C sekitar 1-2 jam. Lipid polar 1 dan 2 ditimbang dan setelah itu siap untuk disuntikkan ke HPLC
B. Lipid Netral
1 . Sisa lemak yang terdapat dalam kolum florisil merupakan senyawa lipid netral, untuk mengeluarkannya digunakan larutan fase gerak, yaitu : CC14, aseto nitril dan metanol dengan perbandingan 92 :8 : 0,l dan dielusi sebanyak 3 kali.
Nama dan spesifikasi HPLC yang digunakan untuk analisis komposisi kelas lipid adalah sebagai berikut :
Nama alat/bahan Type HPLC Detektor Kolom
Panjang kolom
Range
/
0,1Intergrator
1
Hitachi D 2500JenislSatuan Water 150
Absorban detector Lipid
30 cm
3 8 " '
Suhu kolom Suhu detecktor Fase gerak
3 S°C 3 S°C
CC14, CH30H dan air
Chart Speed Volume injeksi Limit detektor
5 m d m e n i t 2 pl
Lampiran 9. Analisis asam lemak (Apriyantono et al. 1989)
Penyiapan (preparasi) analisis asam lemak dengan gas liquid chromatography (GLC) adalah sebagai berikut :
A. Ekstraksi lemak
1. Timbang 5 g contoh dalam saringan timbel, kemudian tutup dengan kapas-wool yang bebas lemak.
2. Letakkan timbel yang berisi contoh dalam alat ekstraksi Soxhlet, kemudian pasang alat kondensor di atasnya dan labu lemak di bawahnya.
3. Tuangkan pelarut hexan 100 ml ke dalam labu lemak volume 200 ml. Lakukan repluks selarna 5 jam sampai pelarut yang turun kembali ke labu lemak berwamah jernih.
4. Distilasi pelarut yang ada dalam labu lemak, tampung pelarutnya. Selanjutnya labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu
105°C.
5. Setelah kering, didinginkan dalam desikator selarna 15 menit. Lemak yang terkurnpul ditimbang.
B. Saponifikasi
1. Timbang lemak hasil ekstraksi sebanyak 0,2 g dalam erlenrneyer 300 ml. Tambahkan 50 ml KOH beralkohol.
2. Larutan didinginkan dan bagian dalam pendingin tegak selama 5 menit.
3. Titrasi dengan HCL 0,5 N sarnpai wama merah jambu hilang.
b. Preparasi metil ester asam lemak (Supelco Inc., 1975 dalam Apriyantono et
al. 1989)
1. Kedalam botol kecil yang berisi asam lemak bebas ditambahkan 2 ml pelarut heksan, kemudian ditambahkan pula 2 ml BF3-metanol. Botol ditutup dan campuran dikocok, kemudian dipanaskan daIam air mendidih selama 3 menit.
2. Sentrifuse botol dengan kecepatan 5000 rpm selama 10 menit untuk memisahkan kedua lapisan tersebut. Selanjutnya lapisan heksan dipindahkan ke botol kecil lainnya.
3. Sampel siap untuk disuntikkan ke GLC.
Nama dan spesifikasi GLC yang digunakan untuk analisis komposisi asam lemak adalah sebagai berikut :
Chart Speed Volume inj eksi Limit detektor
5 m d m e n i t 2 pl
Larnpiran 1 1. Oksigen terlarut, amoniak dan nitrit air selama penelitian
Perlakuad Ulangan
A 1
2
Kisaran
Amoniak (ppm)
Awal = 0,33
Tengah IAkhir I
B 1
2 Kisaran
Kisaran
1
0,31-0,471
0,31-01361
0,07-0I
I
Ii
0,40 0,37 0,40-0,37
2
1
0,33Nitrit (ppm)
Awal = 0,06
Tengah
/
Akhir I0,42 0,34 0,34-0,42
Oksigen terlmt (ppm)
Awal = 5,65
Tengah
I
Akhir I 0,360,34 0,34-0,36
Kisaran ] 0,33-0,47
/
0,32-0,341
0,07/
0,041
5,06-5,321
5,20-5,22 0,32E I 2 Kisaran
0,35 0,33 0,35
0,07
1
0,041
5,321
5,20 0,07 0,06 0,06-0,07 0,30 0,29 0,29-0,30 0,07Lampiran 12. Analisis Cr203 pakan dan feses ikan (Takeuchi 1988)
1. Contoh sebanyak 0,1-0,2 g dmasukkan ke dalam labu Kjeldahl. Tambahkan 5 ml asam nitrit dan dipanaskan selama 30 menit sampai volume larutan menjadi 1 ml, kemudian didinginkan.
2. Tambahkan 3 ml asam perelorik ke dalam labu tadi, lalu dipanaskan kembali hingga asap putih keluar dimana larutan akan berubah warna dari hijau menjadi kuning atau oranye.
3 . Panaskan kembali selama 10 menit, kemudian didingnkan.
4. Pindahkan larutan yang telah dingin ke dalam gelas ukur 100 ml, kemudian diencerkan hingga 100 ml.
5. Ukur absorban larutan dengan spektrometer pa& panjang gelombang 350 nm.
6. Persamaan hubungan Cr203 dengan absorbansi
Keterangan Y = nilai absorban
Lampiran 13. Rata-rata hasil anal