TIKUS PUTIH
( Rattus norvegicus
)
MUNAWWAR KHALIL
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Kajian Pengolahan dan
Toksisitas Khitosan Larut Air dengan Menggunakan Tikus Putih (Rattus norvegicus) adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua informasi yang berasal atau dikutip
dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir
tesis ini.
Bogor, Januari 2007
dengan Menggunakan Tikus Putih (Rattus norvegicus). Dibimbing oleh EDY HARTULISTIYOSO dan SINGGIH WIBOWO.
Tujuan penelitian ini adalah untuk mempelajari cara pembuatan khitosan larut air (CMC) dengan karakteristiknya dan mengetahui pengaruh toksisitas CMC melalui perubahan biokimia darah dan hispatologi jaringan hati dan ginjal pada tikus percobaan.
Penelitian ini dilakukan dalam 2 tahap yaitu Tahap I, persiapan bahan baku, pengolahan khitin, pengolahan khitosan, pengolahan CMC dengan perlakuan suhu (50, 70 dan 90 oC) dan mengkarakterisasinya (viskositas, kelarutan, rendemen, pH, kadar air, kadar abu, derajat deasetilasi, protein dan nitrogen). Tahap II meliputi proses aplikasi CMC dengan konsentrasi yang berbeda yaitu 0 %, 0.5 %, 1 %, 1.5 % dan 2 % pada tikus percobaan yang dilakukan selama 21 hari dan pengamatan terhadap perubahan biokimia darah dan hispatologi jaringan hati dan ginjal.
Hasil pengamatan terhadap viskositas menunjukkan hasil yang bervariasi yaitu antara 123.67-338.33 Cps, dimana terdapat perbedaan yang nyata pada semua perlakuan (P<0.05) dan ternyata penggunaan suhu berpengaruh kepada viskositas, artinya semakin tinggi suhu akan menurunkan viskositas. Kelarutan CMC juga diperoleh hasil yang bervariasi, berkisar antara 95.08-99.84 %. Hasil tertinggi diperoleh pada pelakuan suhu 70 oC dan terrendah pada perlakuan 50 oC. Terdapat perbedaan yang nyata (P<0.05) antara perlakuan 50 oC dengan 70 oC dan 90 oC, sedangkan perlakuan 70 oC tidak berbeda nyata (P>0.05) dengan perlakuan 90 oC. Untuk nilai pH diperoleh hasil antara 4.33-4.57. Sebenarnya untuk menaikkan pH sampai netral sangat sulit dilakukan, karena dengan menambahkan NaOH akan mengendapkan larutan dan tidak dapat ditarik dengan isopropil alkohol. Derajat deasetilasi dihasilkan berkisar antara 61.51-63.51%. Secara umum hasil ini masih di bawah standar yang ditetapkan oleh Protan Laboratories yaitu >70 %. Hasil analisis sidik ragam ternyata tidak berpengaruh nyata (P>0.05) pada semua perlakuan.
Berdasarkan hasil analisis biokimia darah SGOT diperoleh hasil antara 137.77– 154.33 U/l dan SGPT 42.30–55.28 U/l. Hampir semua hasil analisis ini di bawah perlakuan kontrol, artinya tidak terjadi peningkatan enzim dalam darah yang menunjukkan kerusakan pada hati. Pada analisis Kreatinin tidak terjadi perubahan sampai pada konsentrasi 0.5 dan 1 %, sedangkan pada 1.5 dan 2 % mengalami pembendungan ringan dengan terjadinya pertumbuhan sel baru untuk memproteksi sel dari pengaruh bahan yang bersifat toksik. Kadar BUN meningkat pada perlakuan 1% yaitu sebesar 33.67 mg/dl, lebih besar dari perlakuan kontrol yaitu 25.67 mg/dl, sedangkan perlakuan 1.5 dan 2 % terjadi penurunan. Hal ini menunjukkan bahwa semakin tinggi konsentrasi CMC yang diberikan, maka kadar BUN dalam darah semakin menurun.
©
Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungiKAJIAN PENGOLAHAN DAN TOKSISITAS
KHITOSAN LARUT AIR DENGAN MENGGUNAKAN
TIKUS PUTIH (
Rattus norvegicus
)
MUNAWWAR KHALIL
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Pasca Panen
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
telah dapat menyelesaikan penulisan Tesis ini dengan judul Kajian Pengolahan
dan Toksisitas Khitosan dengan Menggunakan Tikus Putih (Rattus norvegicus) sebagai salah satu syarat dalam menyelesaikan Program Magister Sains.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih kepada
Bapak Dr. Ir. Edy Hartulistiyoso, M.Sc dan Bapak Dr. Ir. Singgih Wibowo, MS
selaku Ketua dan Anggota Komisi Pembimbing yang telah banyak meluangkan
waktu untuk memberikan bimbingan dan arahannya dalam penulisan Tesis ini.
Kemudian penulis mengucapkan terimakasih kepada Bapak Dr. W. Farid Ma’ruf
selaku Kepala Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan
dan Perikanan Jakarta, atas bantuan dana, fasilitas dan kerjasamanya. Ibu Ir.
Yusro Nuri Fazwya, M.Si beserta staf peneliti lainnya yang telah bersedia
membantu selama pengumpulan data. Bapak Prof. Dr. Ir. Hadi Karya Purwadaria,
Ipm (mantan Ketua Departemen Teknologi Pasca Panen/TPP) dan Dr. Ir. I Wayan
Budiastra, M.Agr selaku Ketua Departemen Teknologi Pasca Panen (TPP),
terimakasih atas perhatian dan motivasinya. Ibu drh. Ekowati Handharyani, DVM,
MS, PhD yang telah bersedia membantu dalam menganalisis
hispatologi-toksisitas khitosan larut air (CMC). Ucapan terimakasih yang tak terhingga dan
setulus-tulusnya kepada Ayahanda Abdurrahman Ibrahim (Alm) dan Ibunda
Ummi Usman, Abang, Kakak, Adik serta seluruh anggota keluarga atas doa,
dukungan dan kasih sayangnya. Tidak lupa pula penulis mengucapkan
terimakasih kepada teman-teman Jurusan Teknologi Pasca Panen (TPP) angkatan
2002 khususnya dan teman-teman dari Ikatan Mahasiswa Pascasarjana Aceh
(IKAMAPA) Bogor pada umumnya, atas dorongan semangat dan
kebersamaannya.
Terakhir penulis juga sangat mengharapkan saran-saran dan kritikan yang
bersifat membangun atas kekurangan dan ketidaksempurnaan dalam penulisan
Tesis ini, semoga dapat bermanfaat bagi pembacanya.
Bogor, Januari 2007
Halaman
1 Spesifikasi Khitosan ………... 8
2 Spesifikasi Khitosan Larut Air ………... 29
3 Hasil Rata-rata Kadar SGOT dan SGPT dalam Darah ………. 32
Halaman
1 Struktur molekul khitin ... 8
2 Struktur molekul khitosan ... 9
3 Struktur khitosan larut air ... 11
4 Diagram proses pembuatan khitin ... 18
5 Diagram proses pembuatan khitosan ... 19
6 Diagram proses pembuatan khitosan larut air ... 19
7 Penampang melintang hati pada perlakuan kontrol (0%) ... 31
8 Penampang melintang hati pada perlakuan 1.5% ... 31
9 Pengaruh CMC terhadap biokimia darah ... 34
10 Penampang melintang ginjal pada perlakuan kontrol (0%) ... 35
11 Penampang melintang ginjal pada perlakuan 2% ... 35
12 Grafik rata-rata berat badan tikus yang diberi CMC selama 21 hari ... 36
Halaman
1 Hasil rata-rata pengolahan khitosan larut air ………... 45
2 Data hasil analisis biokimia darah tikus percobaan ………... 46
3 Data berat badan harian………... 47
4 Data rata-rata sisa pakan per hari selama 21 hari... 48
5 Spektrum infra merah khitosan larut air (50 oC) dengan deasetilasi 72 jam pada spektrometer infra merah IR-408 ... 49
6 Spektrum infra merah khitosan larut air (70 oC) dengan deasetilasi 72 jam pada spektrometer infra merah IR-408 ... 50
7 Spektrum infra merah khitosan larut air (90 oC) dengan deasetilasi 72 jam pada spektrometer infra merah IR-408 ... 51
8 Analisa ragam terhadap viskositas khitosan larut air ……….... 52
9 Analisa ragam terhadap kelarutan khitosan larut air ………... 53
10 Analisa ragam terhadap nilai pH khitosan larut air ………... 54
11 Analisa ragam terhadap kadar air khitosan larut air …………... 55
12 Analisa ragam terhadap derajat deasetilasi khitosan larut air …... 56
13Analisa ragam terhadap SGOT darah ... 57
14 Analisa ragam terhadap SGPT darah ... 58
15 Analisa ragam terhadap Kreatinin darah ... 59
16 Analisa ragam terhadap BUN darah ... 60
Latar Belakang
Perairan Indonesia mempunyai potensi perikanan yang cukup besar
dengan berbagai jenis ikan dan udang. Udang merupakan salah satu hasil
perikanan yang saat ini masih menjadi primadona ekspor hasil perikanan
Indonesia, karena disamping mempunyai nilai ekonomis yang cukup baik juga
merupakan bahan pangan yang mempunyai nilai gizi yang tinggi.
Udang merupakan salah satu komoditas yang penting dan sebagai
penghasil devisa terbesar bagi negara disamping komoditas lainnya. Permintaan
pasar semakin meningkat seiring dengan bertambahnya jumlah penduduk dunia,
juga semakin meningkatnya jumlah ekspor udang dari tahun ke tahun. Kenyataan
ini menunjukkan bahwa komoditas udang mempunyai peranan penting dalam
aktifitas ekspor produk perikanan Indonesia.
Udang pada umumnya diekspor dalam bentuk udang beku. Hal ini
mendorong para pengusaha perikanan Indonesia untuk mengembangkan industri
pembekuan udang. Menurut Suptijah (1992), ada tiga macam produk udang beku
yang sudah terkenal yaitu udang yang dibekukan dalam keadaan utuh tanpa
dikuliti atau dipotong kepalanya, udang yang telah dipisahkan kepalanya tetapi
tidak dikuliti, dan udang yang telah dikupas kulitnya serta dipisahkan kepalanya.
Kedua produk udang beku terakhir akan meninggalkan sisa pengolahan (limbah)
berupa kepala, kulit atau kepalanya saja.
Besarnya produksi udang dewasa ini akan menghasilkan limbah berupa
kulit yang besar jumlahnya. Apabila melimpahnya limbah kulit ini tidak diiringi
dengan pemanfaatan yang tepat maka akan menjadi masalah yang serius karena
limbah udang sama halnya seperti limbah perikanan lainnya akan mudah sekali
mengalami pembusukan sehingga akan menimbulkan polusi terhadap lingkungan.
Khitosan merupakan salah satu contoh produk hasil pemanfaatan limbah
udang yang mempunyai prospek untuk dikembangkan karena ketersediaan bahan
baku (limbah) udang yang besar. Menurut Sandford dalam Knorr (1984),
jenis spesiesnya, sedangkan limbah udang yang dihasilkan dari produksi udang
beku mencapai 50–60 % dari berat utuh.
Berdasarkan hasil penelitian yang sudah ada diketahui bahwa khitosan
mempunyai manfaat yang cukup banyak pada berbagai bidang kehidupan.
Sebagai contoh, khitosan dapat menghilangkan kontaminan, memisahkan
petroleum dari air limbah, pelapis benih yang akan ditanam (pertanian), anti
kolesterol, anti koagulan dalam darah dan absorben logam berat (Brzeski 1987).
Selama ini limbah udang hanya dimanfaatkan sebagai bahan tambahan
dalam pembuatan terasi, kerupuk udang dan pelet. Pemanfaatan limbah udang
lebih lanjut yaitu sebagai bahan dasar pembuatan khitin dan khitosan (Brzeski
1987). Limbah industri pengolahan udang ini mengandung 40–50 % khitin,
25–30 % kalsium karbonat dan 15–20 % protein (Putro 1987).
Penanganan dan pengolahan limbah udang melalui industri pengolahan
khitin dan khitosan menjadi perhatian, karena senyawa yang hampir sama
dengan selulosa ini ternyata menunjukkan keandalan di berbagai bidang dan
mempunyai prospek tinggi sebagai komoditi perdagangan.
Memperhatikan potensi produksi udang dan limbah udang terutama
kulitnya yang semakin meningkat dan bisa diandalkan, maka pemanfaatan khitin
dan khitosan harus mendapat perhatian yang lebih besar dalam
pengembangannya di Indonesia.
Pemanfaatan khitosan banyak digunakan dalam berbagai keperluan
industri, baik industri pangan, non pangan, maupun pengolahan limbah industri
(koagulasi dan flokulasi), sebagai penstabil dan pengental. Penggunaan khitosan
sebagai penurun kadar lemak dikembangkan antara lain sebagai penurun kadar
lemak pada tikus putih (Sugano et al. 1980).
Khitosan merupakan turunan khitin yang hanya dapat larut dalam larutan
asam organik seperti asam asetat tetapi tidak larut dalam air dan pelarut organik
lainnya seperti dimetil sulfida. Sehubungan khitosan ini harus dilarutkan dulu
dalam asam asetat, aplikasinya juga terbatas karena pH rendah, maka para
pemakai khitosan harus menyiapkan ruangan khusus asam dan peralatan lainnya
termasuk peralatan pengaman untuk menghindari bahaya dari asam asetat
untuk menghasilkan khitosan yang lebih baik perlu dilakukan, salah satu caranya
yaitu dengan melakukan pengolahan khitosan larut air atau lebih dikenal dengan
karboksimetil khitosan (CMC).
Dengan dihasilkannya CMC ini diharapkan penggunaan khitosan pada
berbagai bidang kehidupan bisa lebih ditingkatkan, mengingat CMC lebih praktis
dan efektif dibanding khitosan larut asam. CMC selain lebih aman untuk
digunakan karena memiliki pH yang netral, juga penggunaan air sebagai pelarut
lebih menguntungkan dibandingkan asam, karena air tersedia dimana-mana dan
mudah didapatkan sehingga akan mengurangi biaya penggunaan khitosan.
Khitosan larut air dapat diaplikasikan pada berbagai bidang seperti
kosmetika, pengawetan makanan, kesehatan dan agrikultur. Pada buah-buahan
dapat ditingkatkan waktu simpannya dan tetap segar setelah dikeluarkan dari
pendingin dengan menggunakan lapisan tipis (film) khitosan larut air. Selain itu
khitosan larut air juga berguna sebagai pengkhelat tembaga (Cu) pada air limbah,
antikoagulan dan juga sebagai zat antimikroba (Angka dan Suhartono 2000).
Tikus putih sebagai hewan percobaan merupakan hewan yang sengaja
dipelihara untuk dipakai sebagai hewan model, guna mempelajari dan
mengembangkan fisiologi, farmatologi, biokimia, patologi dan kadang-kadang
digunakan untuk diagnostika dalam dunia kedokteran. Berdasarkan hasil
penelitian sebelumnya tikus putih sudah diketahui mempunyai sifat respon
biologik dan adaptasi mendekati manusia (Hanum 1996).
Tikus atau rat (Rattus norvegicus) telah diketahui sifat-sifatnya dengan sempurna, mudah dipelihara, merupakan hewan yang relatif sehat dan cocok
untuk berbagai penelitian antara lain; penelitian tentang manfaat vitamin,
alkoholisme metabolisme lemak dan tingkah laku. Sudah banyak informasi
tentang fisiologi, anatomi genetik dan tingkah laku dari tikus putih sehingga dapat
diinterpretasikan dan diektrapolasikan ke manusia (Waynforth 1980).
Tikus secara luas digunakan untuk penelitian di laboratorium, terutama
tikus putih yang berasal dari Asia Tengah dan tidak ada hubungannya dengan
Norwegia seperti yang diduga dari namanya. Seperti halnya mencit terdapat tikus
kekhususan tertentu antara lain galur sprague-dawley: berwarna albino putih, berkepala kecil dan ekornya lebih panjang daripada badannya; galur wistar
ditandai dengan kepala besar dan ekor yang lebih pendek, dan galur long-evans
yang lebih kecil daripada tikus putih dan memiliki warna hitam pada bagian
kepala dan tubuh bagian depan (Malole dan Pramono 1989).
Tikus putih merupakan hewan percobaan yang banyak digunakan dalam
penelitian laboratorium. Dalam pemanfaatannya tikus adalah hewan yang mudah
didapat, harganya murah dan dalam pengujian secara patologis sangat mudah
dilakukan. Melalui pengujian patologis/hispatologis akan dapat diketahui adanya
perubahan-perubahan pada fungsi organ seperti, perubahan fungsi hati (SGOT,
SGPT) dan fungsi ginjal (Kreatinin, BUN) akibat pengaruh metabolisme bahan.
Tujuan Penelitian
Selama ini khitosan dikenal sebagai salah satu produk yang tidak beracun,
oleh karena itu maka penelitian ini mempunyai tujuan umum adalah untuk
mengetahui pengaruh pemberian dan toksisitas CMC tarhadap gangguan
hispatologik pada hati dan ginjal tikus percobaan.
Adapun tujuan khusus dari penelitian ini adalah:
- Mempelajari cara pengolahan CMC dengan karakteristiknya.
- Mengetahui pengaruh toksisitas CMC melalui perubahan kadar SGOT
(Serum Glutamic Oxaloacetic Transferase), SGPT (Serum Glutamic Piruvic Transferase), Kreatinin dan BUN (Blood Urea Nitrogen) darah serta jaringan hati dan ginjal hewan percobaan.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai
kemungkinan adanya efek toksin dari CMC dan gangguan hispatologis yang
TINJAUAN PUSTAKA
Khitosan
Kulit udang yang mengandung senyawa kimia khitin dan khitosan
merupakan limbah yang mudah didapat dan tersedia dalam jumlah yang banyak,
yang selama ini belum termanfaatkan secara maksimal.
Saat ini budidaya udang di tambak telah berkembang dengan pesat,
karena udang merupakan komoditi ekspor yang dapat dihandalkan dalam
meningkatkan ekspor non-migas dan merupakan salah satu jenis biota laut yang
bernilai ekonomis tinggi. Udang di Indonesia pada umumnya diekspor dalam
bentuk udang beku yang dibuang bagian kepala, kulit, dan ekornya.
Sebagian besar limbah udang berasal dari kulit, kepala, dan ekornya.
Fungsi kulit udang tersebut pada hewan udang (hewan golongan invertebrata)
yaitu sebagai pelindung. Kulit udang mengandung protein (25–40 %), kalsium
karbonat (45–50 %), dan khitin (15–20 %), tetapi besarnya kandungan komponen
tersebut tergantung pada jenis udangnya. Sedangkan kulit kepiting mengandung
protein (15.60–23.90 %), kalsium karbonat (53.70–78.40 %), dan khitin (18.70–
32.20 %). Hal ini juga tergantung pada jenis kepiting dan tempat hidupnya
(Focher et al. 1992).
Limbah yang dihasilkan dari proses pembekuan udang, pengalengan
udang, dan pengolahan kerupuk udang berkisar antara 30 % –75 % dari berat
udang. Dengan demikian jumlah bagian yang terbuang dari usaha pengolah udang
cukup tinggi (Anonim 1994). Limbah kulit udang mengandung konstituen utama
yang terdiri dari protein, kalsium karbonat, khitin, pigmen, abu, dan lain-lain
(Anonim 1994).
Selama ini di Indonesia sebagian kecil dari limbah udang sudah
termanfaatkan dalam hal pembuatan kerupuk udang, petis, terasi, dan bahan
pencampur pakan ternak. Sedangkan di negara maju seperti Amerika Serikat dan
Jepang, limbah udang telah dimanfaatkan di dalam industri sebagai bahan dasar
pembuatan khitin dan khitosan. Manfaatnya diberbagai industri modern banyak
sekali seperti industri farmasi, biokimia, bioteknologi biomedikal, pangan, kertas,
mempunyai sifat sebagai bahan pengemulsi koagulasi dan penebal emulsi (Lang
1995).
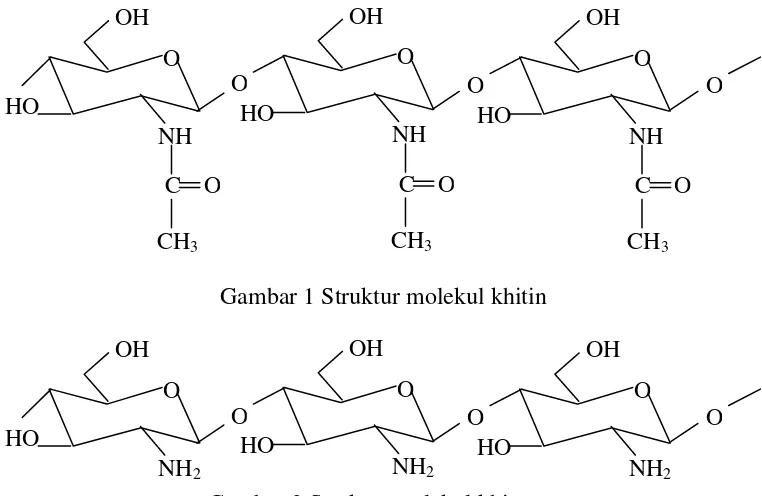
Khitosan adalah polimer linier berberat molekul tinggi dari 2-deoksi
2-amino-glukosa, merupakan produk deasetilasi dari khitin dengan alkali kuat,
bersifat polimer kationik sehingga tidak larut dalam air atau alkali pada pH di atas
6.5, tetapi dapat larut cepat dalam asam organik cair seperti asam formiat, asam
sitrat dan asam mineral kecuali sulfur. Khitosan disebut juga dengan mempunyai
kreatifitas kimia yang tinggi (Tokura 1995).
Khitosan merupakan senyawa yang tidak larut dalam air, larutan basa
kuat, sedikit larut dalam HCl dan HNO3, dan H3PO4, dan tidak larut dalam
H2SO4. Khitosan tidak beracun, mudah mengalami biodegradasi dan bersifat
polietrolitik (Hirano 1989). Disamping itu khitosan dapat dengan mudah
berinteraksi dengan zat-zat organik lainnya seperti protein. Oleh karena itu,
khitosan relatif lebih banyak digunakan pada berbagai bidang industri terapan
dan industri kesehatan (Muzarelli 1986).
Sumber Khitosan
Sumber utama khitin dan khitosan yang dapat digunakan dalam
pengembangan lebih lanjut di perairan Indonesia adalah limbah udang. Suptijah
et al. (1992) menyatakan bahwa limbah udang dikategorikan menjadi tiga jenis berdasarkan jenis pengolahannya, yaitu :
a. Kepala udang yang biasanya merupakan hasil sampingan dari industri
pembekuan udang tanpa kepala.
b. Kulit udang yang biasanya merupakan hasil samping dari industri
pembekuan udang atau industri pengalengan udang.
c. Campuran keduanya yang biasanya berasal dari industri pengalengan
udang.
Johnson dan Peniston (1982) menyatakan bahwa kulit udang dan rajungan
merupakan limbah pengolahan udang dan rajungan yang mencapai 50–60 % dari
Sifat-sifat Fisikokimia Khitin dan Khitosan
Menurut Ornum (1992), khitin adalah suatu polimer linier yang tersusun
oleh 2.000-3.000 monomer N-asetil D-glukosamin dalam ikatan β (1-4). Khitin
mudah mengalami degradasi secara biologis, tidak beracun, tidak larut dalam air,
asam anorganik encer, dan asam-asam organik tetapi larut dalam dimetil
asitamida dan lithium klorida.
Knorr (1982) menyatakan bahwa khitosan merupakan polimer rantai
panjang glokosamin (2-amino-2 deoksiglukosa). Menurut Ornum (1992), khitosan
mempunyai sifat-sifat tertentu yaitu: struktur molekulnya dalam keadaan cair
sensitif terhadap kekuatan ion tinggi, daya refulsif antara fungsi amin menurun
sesuai dengan fleksibelitas rantai khitosan, dan pendekatannya dalam ruang
distabilkan oleh ikatan hidrogen menghasilkan suatu molekul resisten yang tahan
terhadap stres mekanik dan kemampuan berkembang bertambah.
Khitosan berbentuk spesifik dan mengandung gugus amino dalam rantai
karbonnya pada posisi C2. Hal ini menyebabkan khitosan bermuatan positif yang
berlawanan dengan polisakarida lainnya (Ornum 1992). Bahan-bahan seperti
protein, anion polisakarida dan asam nukleat yang bermuatan negatif akan
berinteraksi kuat dengan khitosan berbentuk ion netral (Sandford 1989).
Khitin dan khitosan merupakan senyawa kimia yang mudah
menyesuaikan diri, hidrofobik (tidak larut dalam air tetapi larut dalam asam),
memiliki reaktivitas tinggi (karena mengandung gugus –OH dan gugus NH2)
untuk ligan yang bervariasi (sebagai bahan pewarna dan penukar ion). Disamping
itu, khitosan tidak larut dalam basa atau media campuran asam basa dan posisi
silang khitosan memiliki sifat yang sama baiknya dengan khitin (Muzarelli, 1977
dalam Zeng 1997).
Menurut Austin (1984), khitosan tidak larut dalam air, larutan alkali pada
pH di atas 6.5 dan pelarut organik, tetapi larut dengan cepat dalam asam organik
encer seperti asam format, asam asetat, asam sitrat, dan asam mineral lain kecuali
sulfur. Sifat kelarutan khitosan dipengaruhi oleh berat molekul, derajat deasetilasi
dan rotasi spesifik yang dapat bervariasi dan tergantung dari sumber dan metode
Pernyataan di atas didukung oleh Ornum (1992) yang menyatakan bahwa
khitosan dapat larut dalam suatu larutan asam organik tetapi tidak larut dalam
pelarut organik lainnya seperti dimetil sulfoksida dan juga tidak larut pada pH 6.5.
Pelarut khitosan yang baik adalah asam format dengan konsentrasi 0.2–1.0 %,
sedangkan pelarut yang umum digunakan adalah asam asetat dengan konsentrasi
1–2 %.
Khitosan memiliki sifat reaktivitas kimia yang tinggi, menyebabkannya
mampu mengikat air dan minyak. Hal ini didukung oleh adanya gugus polar dan
non polar yang dikandungnya. Karena kemampuan tersebut, khitosan dapat
digunakan sebagai bahan pengental atau pembentuk gel yang sangat baik, sebagai
pengikat, penstabil dan pembentuk tekstur (Brzeski 1987).
Menurut Sandford dan Hutchings (1987), khitosan berbentuk tepung,
serpihan maupun larutan. Pada umumnya mutu khitosan terdiri dari beberapa
parameter yaitu bobot molekul, kadar air, kadar abu, kelarutan, warna dan derajat
deasetilasi (Ornum 1992).
Khitosan adalah produk deasetilasi dari khitin dengan menggunakan
larutan alkali (Johnson dan Peniston 1982), khitin di alam tidak berada dalam
keadaan murni tetapi bergabung dengan unsur-unsur lain seperti: protein, mineral
dan berbagai macam pigmen. Khitin berikatan kovalen dengan sebagian protein
dan berasosiasi dengan unsur mineral membentuk mokopolisakarida yang
berfungsi sebagai material pelindung pada udang. Oleh sebab itu untuk
perlakuan yang sesuai dengan karakter asosiasi khitin dengan protein dan
mineral.
Khitin didapat dengan jalan ekstraksi bahan baku untuk memisahkan
komponen-komponen mineral, protein, lemak dan lain-lain sebagai komponen
pengotor. Proses-proses demineralisasi dan deproteinasi sangat perlu dilakukan
dalam pemurnian khitin. Proses demineralisasi dapat dilakukan dengan
menambahkan HCl 1 N dengan perbandingan bobot bahan dan volume
pengekstrak 1:7 (b/v) dipanaskan pada suhu 70-75 oC selama satu jam (Suptijah et al. 1992). Pemisahan mineral bertujuan untuk menghilangkan senyawa anorganik yang ada pada limbah tersebut. Mineral utama yang terdapat pada kulit udang
adalah kalsium dalam bentuk CaCO3 dan sedikit Ca3(PO4)3 (Purwatiningsih
1993).
Deproteinasi dilakukan untuk menghilangkan protein dari limbah udang.
Keefektivan proses tersebut tergantung dari kekuatan larutan basa dan tingginya
suhu yang digunakan. Menurut Suptijah et al. 1992, bahwa penggunaan NaOH 3.5 % dengan pemanasan 60 oC selama dua jam dapat dilakukan sebagai alternatif
deproteinasi. Penghilangan gugus asetil (-COCH3) dari khitin dilakukan dengan
menggunakan larutan NaOH pekat (50 %) dengan perbandingan 1:20 b/v
dipanaskan pada suhu 120-140 oC selama satu jam.
Gambar 1 Struktur molekul khitin
Aplikasi Khitin dan Khitosan
Khitosan digunakan di dalam berbagai industri, antara lain sebagai
perekat kualitas tinggi, pemurnian air minum (mempunyai daya koagulasi/daya
penghilangan partikel koloid), sebagai senyawa pengkelat, meningkatkan zat
warna dalam industri kertas, tekstil dan pulp karena sifatnya yang baik untuk
mencegah pengerutan. Khitosan juga dapat digunakan sebagai pengangkut
(carrier) obat dan komponen alat-alat operasi seperti sarung tangan, benang operasi, membran pada operasi plastik (Angka dan Suhartono 2000).
Dalam bidang pertanian, kompleks khitin dengan protein dapat
dicampurkan ke dalam tanah untuk mengurangi resiko serangan cacing parasit
terhadap tanaman dan dapat meningkatkan sekresi enzim khitinase pada tanaman.
Dalam industri kosmetika, khitin dapat digunakan sebagai pengemulsi, bahan
pelembab dan juga sebagai pencahar (Ditjen Perikanan 1989).
Pada bidang industri pangan, senyawa komplek micro chrystalin chitin (mcc) merupakan salah satu turunan khitin yang banyak digunakan dalam industri
pangan sebagai bahan pengental (pembentuk gel) yang sangat baik dan juga
bermanfaat sebagai pengikat, penstabil, pembentuk tekstur, enkapsulasi dan film
formatin (Stand dan Ali 1982).
Dalam bidang industri, manfaat khitin dan khitosan paling luas dalam
pengolahan limbah cair. Menurut Knorr (1984), terdapat tiga hal penting untuk
aplikasi khitin dan khitosan dimasa yang akan datang, yaitu sebagai bahan
fungsional yang digunakan dalam proses water treatment, sebagai bahan fungsional dalam industri pangan, dan sebagai polimer hasil turunan baru yang
digunakan dalam bidang teknologi polimer.
Di bidang kesehatan, khitin dan khitosan telah dimanfaatkan sebagai
bahan anti tumor, sebab mempunyai kemampuan penggumpalan sel-sel leukemia
dan mempunyai sifat anti bakterial dan anti koagulasi dalam darah. Khitosan
dapat digunakan untuk membuat lensa dari polimer khitin, dan sebagai bahan anti
kolesterol. Selain itu khitosan juga dapat digunakan sebagai pengganti tulang
Khitosan Larut Air
Khitosan larut air adalah suatu senyawa turunan khitosan yang dapat larut
dalam air, dan memiliki banyak potensi untuk diaplikasikan pada pembuatan
obat-obatan, kosmetik, pengawetan makanan dan kesehatan (Davies et al. 1989). Selanjutnya Davies et al. (1989) juga menyatakan bahwa khitosan larut air merupakan senyawa yang secara kimia lebih stabil, larut dalam air,
biodegradable, biocompatible, non tosik dan dapat menyerap logam berat.
Isolasi khitosan larut air dapat dilakukan dengan metode Bader dan
Birkholz (1997) melalui penambahan monokloroasetat terhadap khitosan dalam
suasana alkali. Proses tersebut disebut proses karboksimetilasi, yaitu proses
pengubahan khitosan ke sifat basa, dimana khitosan dilarutkan dalam larutan asam
asetat, diendapkan dengan penambahan natrium hidroksida dan terakhir
direaksikan dengan asam monokloroasetat yang bertujuan untuk mengganti ion
hidrogen (ion H) pada gugus hidroksil (OH) dan gugus amin (NH2).
Pada kondisi alkali reaksi khitosan dengan monokloroasetat akan
menghasilkan khitosan dengan reaksi sebagai berikut:
a. Tahap pertama
Khitosan dengan natrium hidroksida bereaksi membentuk alkoksida.
ROH + NaOH RO-Na+ + H2O
ROH = Khitosan
Gugus hidroksil pada struktur khitosan merupakan asam lemah, sehingga
apabila konsentrasi natrium hidroksida yang digunakan semakin tinggi, maka
akan semakin tinggi pula produksi alkoksida dan hasil reaksi.
b. Tahap kedua
Subsitusi klorida dari asam monokloroasetat ke dalam bentuk alkoksida
khitosan menjadi khitosan larut air.
RO-Na+ + CH2COOH CH2COOH + NaCl
Disamping reaksi tersebut terjadi kompetisi reaksi subsitusi dari OH- pada asam
monokloroasetat.
2NaOH + CH2COOH CH2COOH + NaCl + H2O
Cl OH
Walaupun RO- merupakan alkali kuat jika dibandingkan dengan OH-, rantai R
sangat panjang dan menyebabkan sulit bereaksi (Doan 2001).
Khitosan larut air dapat diaplikasikan pada berbagai bidang seperti
kosmetika, pengawet makanan, kesehatan dan agrikultur. Pada buah-buahan dapat
ditingkatkan umur simpannya dan tetap segar setelah keluar dari pendingin
dengan menggunakan lapisan tipis (film) khitosan larut air. Selain itu, khitosan
larut air juga berguna sebagai pengkhelat tembaga (Cu) pada air limbah,
antikoagulan dan juga sebagai zat antimikroba (Angka dan Suhartono 2000).
Gambar 3 Struktur khitosan larut air
Hewan Percobaan
Tikus putih sangat baik sebagai hewan percobaan, karena tikus dapat
berkembangbiak sama seperti mencit. Dalam beberapa percobaan tikus lebih
menguntungkan terutama karena tubuh tikus yang lebih besar bila dibandingkan
dengan mencit. Tikus memiliki metabolisme tubuh tertentu yang membedakannya
Pada kenyataannya bila dibandingkan dengan tikus liar, tikus percobaan
atau tikus laboratorium lebih cepat dewasa, tidak memperlihatkan perkawinan
musiman dan umumnya lebih cepat berkembangbiak. Berat badan tikus
4 minggu rata-rata mencapai 35–40 g dan bobot berat badan tikus dewasa rata-rata
200–250 g, tetapi dapat lebih atau kurang dari batas tergantung pada galur (Smith
dan Mangkoewidjojo 1988).
Untuk memenuhi kebutuhan makanan tikus, di Indonesia dipakai makanan
ayam petelur (kandungan protein 18 %) yang mudah didapat di toko makanan
ayam, karena sudah mencukupi bahkan melebihi kebutuhan tikus yang hanya
memerlukan 12 % protein. Pengalaman menunjukkan bahwa pemberian
kecambah kacang hijau dapat meningkatkan fertilitas tikus. Seekor tikus dewasa
membutuhkan 5 g makanan dan 10 ml air minuman per hari per 100 g berat
badan. Tingkat konsumsi makanan dipengaruhi oleh temperatur kandang,
kelembaban, kesehatan, dan kualitas makanan itu sendiri. Sebagai hewan
nokturnal, tikus aktif makan di malam hari (Malole dan Pramono 1989).
Toksisitas Khitosan
Struktur kimia dari khitin dan khitosan menghasilkan kadar toksisitas
yang sangat rendah. Berat molekul yang tinggi dan kandungan enzim yang sangat
rendah untuk mendegradasi rangkaian ß-glukosidik di dalam sistem
gastrointestinal manusia. Khitin dan khitosan dapat diekskresikan tanpa
terjadinya perubahan pada feses dan tidak terjadinya absorpsi yang tinggi.
Rendahnya absorpsi ini diharapkan dapat menghindari sistem toksisitas yang
tinggi (Weiner 1988).
Sangat rendahnya daya toksisitas dari khitosan telah diuji oleh Arai et al.
(1968) dengan menggunakan tikus betina. Penambahan LD-50 secara oral > 10
g/kg mengindikasikan sangat rendahnya kadar toksisitas. Dalam laporan lainnya,
ketika menggunakan khitosan sebagai makanan tambahan, Bough dan Landers
(1976), memberikan makanan diet kepada tikus dari kasein, padatan air dadih
(susu kerbau yang difermentasi) atau padatan air dadih yang terkoagulasi yang
Dalam hal ini tidak terdapat perbedaan yang signifikan dalam kelompok
tikus selama 3 bulan pemberian makanan tambahan. Dalam penelitian selanjutnya
dengan melakukan pengujian terhadap tikus jantan dengan memberikan makanan
yang mengandung makanan diet dengan kandungan 1.0 %, 2.5 %, 5.0 %, 10.0 %
dan 15.0 % khitosan yang mengandung sellulosa. Perkembangan yang sangat
cepat akan meningkatkan dan menurunkan pemanfaatan makanan yang terdapat
dalam khitosan pada dosis 10 % dan 15 %. Hal ini diharapkan untuk mengurangi
kandungan nutrisi yang disebabkan oleh pertukaran porsi yang besar dari
makanan tambahan yang tidak mengandung serat dan yang tidak dapat dicerna.
Berat ginjal, hati dan limpa juga terjadi penurunan berat pada dosis 10 % dan 15
%, sesuai dengan yang diharapkan sebagai pembuka untuk tingkatan yang lebih
tinggi dalam diet. Tidak ada sifat toksisitas yang lain yang berpengaruh sangat
signifikan disini.
Terjadinya toksisitas pada jaringan, yang pada pemeriksaan histologi
tampak berupa degenerasi sel bersama-sama dengan pembentukan vakuola besar,
penimbunan lemak dan nekrosis, patut mendapat perhatian yang besar. Kerja
toksik jenis ini tidak mengubah fungsi sel (misalnya kandungan glikogen atau
konsentrasi berbagai enzim), tetapi struktur sel langsung dirusak. Efek toksik yang
demikian sering terlihat dalam jaringan hati dan ginjal, segera setelah senyawa
toksik mencapai konsentrasi yang tinggi dalam organ ini. Ini memberikan
petunjuk yang jelas bahwa disini terjadi lesi (luka) kimia pada biopolimer organel
sel (Wattimena et al. 1986). Efek lain adalah terjadinya ketidak normalan fungsi hati dan ginjal yang dapat berpengaruh kepada kegagalan fungsi kedua organ
tersebut. Parameter yang biasa digunakan adalah komposisi kimia darah seperti
SGOT, SGPT, Kreatinin dan BUN.
Salah satu kelebihan penelitian hewan ialah kita dapat menggunakan satu
atau beberapa dosis yang relatif tinggi yang menginduksi tanda-tanda toksisitas.
Tanda-tanda ini akan membantu menunjukkan secara tepat organ sasaran dan efek
khusus yang kemudian dapat diperiksa secara kritis pada hewan yang diberi dosis
yang lebih rendah. Penggunaan dosis tinggi semacam itu sebagian juga dapat
menyingkirkan kebutuhan untuk memakai sejumlah besar hewan dalam
dikendalikan secara ketat dan efek toksik dapat ditentukan dengan menggunakan
berbagai jenis pengukuran (Frank 1995).
Hewan yang paling banyak digunakan adalah tikus dan mencit. Hewan ini
digunakan karena mudah didapat, ukurannya kecil, harganya murah, mudah
ditangani, dan data toksikologinya relatif banyak. Selain itu, penetapan toksisitas
pada hati dan ginjal sering merupakan bagian penelitian jangka pendek dan jangka
panjang yang biasanya dilakukan pada tikus dan mencit (Gray 1976).
Penurunan Berat Badan
Kelompok tikus yang mendapatkan penambahan khitosan dapat
mengalami penurunan berat badan. Keberadaan khitosan dan nutrisi lainnya
sebagai serat makanan diduga dapat mengganggu penyerapan lemak, karena serat
makanan ini dapat mengikat asam empedu, sedangkan asam empedu berperan
untuk mengemulsifikasi lemak sehingga mudah dicerna dan diserap oleh tubuh
(Bari 2001).
Selain itu serat makanan terbukti dapat mempengaruhi aktifitas
enzim-enzim protease dengan menggunakan hewan percobaan (Muchtadi 1989).
Keberadaan serat makanan dapat mengganggu efisiensi penggunaan protein oleh
tubuh sehingga penambahan berat badan akan terhambat.
Kadar lemak yang cenderung menurun akibat pemberian tepung cangkang
udang disebabkan TCU (True Color Unit) mengandung khitin alami yang memiliki kemampuan absorpsi lemak (Gallaher 2003). Hasil penelitian ini sesuai
dengan Ikeda et al. (1989) yang dikutip oleh Sudibya (1999), bahwa tikus yang diberi pakan yang mengandung kolesterol, asam oleat dan serat yang terdiri dari
selulosa dan khitosan, ternyata serat yang dikandung oleh khitosan dapat
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Balai Besar Riset Pengolahan Produk dan
Bioteknologi Kelautan dan Perikanan (BBRP2B) Slipi Jakarta Pusat, mulai pada
bulan Juni 2004 sampai dengan Februari 2006. Kemudian dilanjutkan di
Laboratorium Lapang Fakultas Peternakan selama 3 minggu yaitu mulai tanggal
14 Maret sampai tanggal 2 April 2006. Untuk analisis hispatologi dilaksanakan di
Laboratorium Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat
Bahan
1. Bahan baku
Bahan baku yang digunakan dalam penelitian ini adalah kulit udang putih
dari jenis udang Amerika (Litopenaeus vannamei) dalam kondisi segar yang diperoleh dari PT. Sentral Pertiwi Bahari, Muara Baru Jakarta Utara.
Kulit udang dimasukkan ke dalam cool box yang telah dilapisi es sampai
penuh, kemudian ditutup lagi dengan lapisan es sampai menutupi seluruh
permukaan kulit udang agar tetap dalam kondisi dingin dan segar hingga
sampai ke tempat pengolahan.
2. Bahan Kimia
Bahan kimia yang digunakan dalam penelitian ini adalah natrium oksida
(NaOH), asam klorida (HCL), kalium bromida (KBr), asam asetat (H2Ac),
methanol, asam borat (H2BO3), asam monokloroasetat, aquades, indikator
Toshiro, asam sulfat (H2SO4), iso propil alkohol (IPA), garam Kjeldahl,
kloroform, regen analisis SGOT dan SGPT dan regen hispatologi.
3. Hewan percobaan
Hewan percobaan yang digunakan dalam penelitian ini adalah tikus putih
(Rattus norvegicus) jantan galur Sprague Dawley, yang diperoleh dari Laboratorium Lapang Fakultas Peternakan sebanyak 15 ekor dengan berat
4. Pakan
Pakan yang diberikan adalah jenis pakan standar berbentuk cramble yang diproduksi oleh PT. Indonesia Formula Feed, Kedung Badak Bogor
dengan komposisi protein 20 %, lemak 6 %, serat kasar 6 %, Abu 9 % dan
M. E 2.700 Kcal/Kg. Bahan baku pakan ini terdiri dari jagung kuning,
bungkil kedelai, tepung ikan, dedak gandum, bungkil kalapa,
Dl-Methionin, L-Lysin, vitamin dan mineral.
Alat
1. Alat pengolahan dan analisis
Alat yang digunakan dalam pengolahan khitin, khitosan dan analisis CMC
antara lain adalah cool box, dandang, keranjang, timbangan, para-para,
gelas ukur, baker gelas, labu Kjeldahl, viskometer, kompor gas, oven,
desikator, thermometer, FTIR spektrofotometer, lakmus, pH meter, pipet,
cawan porselin, pengaduk, kertas saring, water bath, hotplate stirer, tanur, dan peralatan lain yang diperlukan. Peralatan untuk keperluan analisis
adalah; wadah pembiusan (killing jar), gunting, pisau bedah, pinset, baki bedah, spuit 3 ml, wadah tempat spesimen organ dan darah, timbangan
analitik, pipet volumetrik, photometer Biosystems BTS–330 dan
mikroskop optik merk Olympus jenis polarizing.
2. Alat pemeliharaan tikus
Tempat yang digunakan untuk pemeliharaan tikus adalah kandang yang
terbuat dari wadah plastik yang berukuran panjang x lebar x tinggi
(30 x 25 x 10 cm) dan tertutup kawat kasa serta disusun berdasarkan
perlakuan percobaan. Wadah tempat pakan juga terbuat dari bahan plastik
berbentuk mangkuk dan wadah tempat minum dengan memakai botol
bekas yang telah dipasang selang tetesan air.
Metode Penelitian
Penelitian ini dilakukan melalui 2 tahap. Tahap I meliputi proses
pengolahan dan penentuan karakterisasi CMC. Tahap II merupakan tahap aplikasi
CMC pada tikus percobaan untuk melihat kadar toksisitas melalui analisis
Glutamic Piruvic Transferase), Kreatinin dan BUN (Blood Urea Nitrogen) dan analisis histopatologi terhadap jaringan hati dan ginjal.
Penelitian Tahap I
Pelaksanaan penelitian tahap I meliputi persiapan bahan baku kulit udang,
pengolahan khitin, khitosan menjadi CMC dan analisis proksimat serta
menentukan karakterisasinya. Penelitian tahap I ini juga lebih ditekankan pada
pengolahan CMC dengan perlakuan suhu, yaitu suhu 50 oC, 70 oC dan 90 oC. Dari
ketiga perlakuan suhu tersebut, maka diambil satu perlakuan suhu saja yang
mempunyai hasil terbaik untuk diaplikasikan pada hewan percobaan.
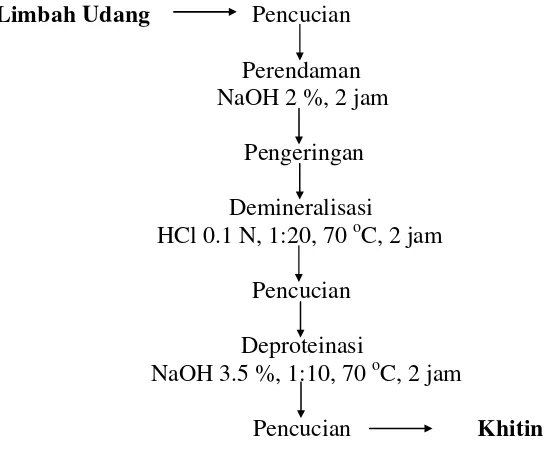
Pengolahan Khitin (Suptijah et al. 1992)
a. Demineralisasi
Bahan baku yang sudah berupa kulit udang kering dicampur dengan HCl
0.1 N dengan perbandingan 1 : 20 (1 lt HCl dilarutkan dalam 20 lt air). Dalam
proses pencampuran ini, dilakukan pengadukan supaya terjadi reaksi antara
mineral dengan HCl. Setelah itu campuran didiamkan selama 2 jam, kemudian
dilakukan pencucian dan penyaringan dengan air sampai pH netral.
b. Deproteinasi
Bahan hasil demineralisasi dicampur dengan NaOH 3.5 % dengan
perbandingan 1 : 10 (1 kg NaOH dilarutkan dalam 10 lt air). Selanjutnya
campuran dipanaskan pada suhu 70 oC selama 2 jam. Setelah itu dilakukan
penyaringan dan pencucian dengan air sampai pH netral, dikeringkan dan
diperoleh khitin.
Pengolahan Khitosan (Suptijah et al. 1992)
Khitin yang dihasilkan direndam dalam larutan NaOH pekat 60 % dengan
perbandingan 1 : 20 (1 kg NaOH dilarutkan dalam 20 lt air). Kemudian khitosan
dipanaskan pada suhu 70 oC selama 72 jam sambil diaduk. Setelah proses
deasetilasi selesai, selanjutnya dilakukan penirisan dan pencucian dengan air
sampai pH netral. Khitosan dijemur sampai kering sehingga diperoleh khitosan
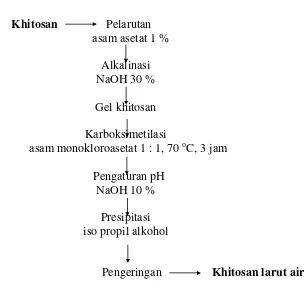
Pengolahan Khitosan Larut Air (CMC)
Proses pengolahan CMC dilakukan berdasarkan metode Bader dan
Birkholz (1997) yang dimodifikasi. Khitosan yang telah diblender dilarutkan
dalam larutan asam asetat 1 % pada suhu kamar. Setelah larut ditambahkan
natrium hidroksida 30 % (75 ml) sehingga larutan menjadi alkali dan membentuk
gel khitosan. Gel yang terbentuk dipisahkan dengan penyaringan dan diperas
untuk memisahkan gel dengan larutan sampai membentuk gumpalan setengah
kering. Gumpalan tersebut dileburkan kembali untuk proses karboksimetilasi
dengan cara menambahkan asam monokloroasetat dengan perbandingan 1 : 1.
Proses karboksimetilasi dilakukan pada suhu 70 oC selama 3 jam.
Kemudian didinginkan dan dilakukan pengaturan pH menjadi 4 dengan
menambahkan natrium hidroksida 10 %, dilanjutkan dengan proses presipitasi
menggunakan iso propil alkohol. Hasil presipitasi dikeringkan di bawah terik
matahari sampai kering dan digiling sehingga dihasilkan CMC berbentuk serbuk.
CMC ditimbang dan siap untuk digunakan dan dianalisis. Terhadap produk yang
dihasilkan diamati viskositas, kelarutan, rendemen, pH, kadar air, kadar abu,
protein, nitrogen dan derajat deasetilasi untuk mendapatkan hasil karakterisasinya.
Proses pengolahan dapat dilihat pada Gambar berikut:
Limbah Udang Pencucian
Perendaman
NaOH 2 %, 2 jam
Pengeringan
Demineralisasi
HCl 0.1 N, 1:20, 70 oC, 2 jam
Pencucian
Deproteinasi
NaOH 3.5 %, 1:10, 70 oC, 2 jam
Pencucian Khitin
Khitin Deasetilasi
NaOH 60 %, 70 oC, 72 jam
Pencucian Sampai pH netral
Pengeringan Khitosan
Gambar 5 Diagram proses pembuatan khitosan (modifikasi Suptijah 1992)
Khitosan Pelarutan asam asetat 1 %
Alkalinasi NaOH 30 %
Gel khitosan
Karboksimetilasi
asam monokloroasetat 1 : 1, 70 oC, 3 jam
Pengaturan pH NaOH 10 %
Presipitasi iso propil alkohol
Pengeringan Khitosan larut air
Gambar 6 Diagram proses pembuatan khitosan larut air (modifikasi Bader dan
Analisis
Kadar Air (Sulaeman et al. 1992)
Kadar air ditentukan dengan menggunakan cara oven pada suhu 105 oC.
Sampel ditimbang sebanyak 1.5 g dan dikeringkan dalam oven sampai beratnya
konstan. Kadar air dihitung dengan menggunakan rumus:
Cawan dikeringkan dalam oven pada suhu 103 oC selama 30 menit, lalu
didinginkan dalam desikator dan ditimbang. Sampel ditimbang sebanyak 3–5 g di
dalam cawan, lalu diletakkan dalam tanur pada suhu 550 oC selama 4–5 jam
hingga diperoleh abu yang berwarna putih keabuan. Kemudian didinginkan dalam
desikator, lalu ditimbang.
Sampel ditimbang sebanyak 0.01–0.02 g, lalu dimasukkan ke dalam labu
kjeldahl 50 ml. Ditambahkan K2SO4 dan HgO (1 : 1) sebanyak 2 g dan 2 ml
H2SO4 pekat. Sampel didestruksikan hingga menjadi cairan berwarna hijau
bening, kemudian ditimbangkan.
Sampel yang telah dingin dibilas dengan aquades, lalu dimasukkan ke
dalam alat destilasi serta ditambahkan 10 ml NaOH pekat. Kemudian sampel
didestilasi dan destilat ditangkap dengan 5 ml asam borat jenuh yang telah diberi
2–4 tetes indikator (campuran metal merah 2 % dan metal biru 0.2 % dalam
dengan menggunakan HCl 0.02 N yang telah distandardisasi hingga berwarna
Langkah-langkah pengukuran kadar nitrogen adalah sebagai berikut:
sampel sebanyak 5 g dan satu buah tablet kjeltec dimasukkan ke dalam tabung
kjeltec, kemudian ditambahkan 10 ml asam sulfat 0.1 N. Selanjutnya bahan
didestruksi pada suhu 430 oC sampai warna larutan menjadi bening, kemudian
dilakukan tahap destilasi dengan menggunakan kjeltec. Hasil proses destilasi ini
dititrasi dengan HCl 0.1 %. Selanjutnya dilakukan pembuatan larutan blanko,
langkah-langkah pembuatannya hampir sama dengan pembuatan larutan sampel,
akan tetapi larutan blanko tidak menggunakan sampel pada tahap destruksi. Kadar
nitrogen dihitung dengan menggunakan persamaan:
Nitrogen (%) = [ ( 14,01 x (A-B) x C) ] x 100%
Spektrum infra merah bahan dapat dibuat dengan menggunakan
spektrofotometer FITR Perkin Elmer. Frekwensi yang digunakan berkisar antara
4.000 cm-1. Sampel sebanyak 5 mg digerus dengan 200 mg serbuk KBr.
Kemudian sampel yang telah tercampur homogen dengahn KBr dicetak sehingga
menghasilkan cetakan tipis transparan dan dianalisa dengan spektrofotometer
infra red. Nilai persen N-deasetilasi dapat dihitung dengan rumus:
% N- deasetilasi = 100%
Keterangan: A1 = Absorbansi pada panjang gelombang 1.640 – 1.700 cm-1
A2 = Absorbansi pada panjang gelombang 3.200 – 3.500 cm-1
1.33 = Perbandingan A1 dengan A2 pada N-deasetilasi 100 %
Viskositas (Sophanodora dan Benjakula, 1993)
Khitosan sebanyak 2 g dilarutkan dalam 200 ml asam asetat 2 %.
Selanjutnya dilakukan pengukuran nilai viskositas menggunakan viskometer
rotari model BM. Rotari yang digunakan saat pengukuran viskositas adalah rotari
no. 2 dengan kecepatan putaran 60 rpm. Sedangkan untuk CMC dilarutkan dalam
aquades dengan konsentrasi 1 % pada suhu kamar. Kemudian diukur dengan
menggunakan spindel dan dengan kecepatan putaran yang sama. Nilai viskositas
dihitung dengan menggunakan rumus:
Viskositas (Cps) = nilai terukur x (konstanta R-2, v 60 rpm)
Kelarutan
Menggunakan metode Lembono (1989). Kertas saring dikeringkan dalam
oven selama 30 menit dan ditimbang. Kemudian dilakukan penyaringan terhadap
1 g khitosan yang dilarutkan dalam 100 ml asam asetat 1 % dengan menggunakan
pompa vakum. Sedangkan untuk CMC dilarutkan dalam aquades. Kertas saring
kemudian dikeringkan dalam oven pada suhu 100 oC selama 3 jam. Setelah itu
masukkan dalam desikator selama 15 menit dan timbang.
Kelarutan = x100%
Penelitian tahap II dilakukan untuk mengaplikasikan CMC pada tikus
percobaan dengan tujuan pengujian toksisitasnya. CMC dijadikan sebagai bahan
CMC terhadap biokimia darah (SGOT, SGPT, Kreatinin dan BUN) dan
perubahan pada jaringan hati dan ginjal secara hispatologis.
Hewan Percobaan
Hewan percobaan yang digunakan adalah tikus putih (Rattus norvegicus) jantan galur Sprague-Dawley yang berumur 8 minggu, bobot badan antara 130–175 g sebanyak 15 ekor yang diperoleh dari Laboratorium Lapang Fakultas
Peternakan IPB Bogor. Sebelum digunakan untuk percobaan, semua tikus
diaklimatisasi selama 4 hari untuk menyesuaikan lingkungan dan mengontrol
bobot badannya. Setelah melewati masa aklimatisasi semua tikus ditimbang dan
ditempatkan dalam kandang sesuai dengan kelompok perlakuan. Selama
penelitian berlangsung, tikus diberi pakan dengan komposisi nutrisi standar
dengan panambahan persentase CMC dan minuman air selama 3 minggu sebelum
dilakukan analisis. Berdasarkan pengamatan terhadap konsumsi pakan selama
proses aklimatisasi berlangsung, maka kebutuhan konsumsi pakan per ekor tikus
adalah sebanyak 20 g per hari.
Pengambilan Darah dan Organ
Sebelum dilakukan pembedahan, tikus terlebih dahulu dibius dengan
menggunakan kloroform dengan cara memasukkan tikus ke dalam killing jar. Hal
ini dilakukan karena melalui proses pembiusan lebih layak bila dilihat dari segi
etika terhadap hewan percobaan. Setelah pingsan tikus diambil darahnya dari
bagian atrium jantung dengan menggunakan spuit 3 ml. Kemudian tikus
dimasukkan kembali ke dalam wadah yang telah diberi kloroform untuk beberapa
sat hingga tikus mati. Hati dan ginjal diambil dengan cara dibedah setelah tikus
mati untuk dianalisis kadar toksisitas dan untuk pembuatan preparasi hispatologi.
Setelah selesai maka semua tikus dibuang. Selanjutnya jaringan tersebut
dipreparasi dengan pewarnaan hematoxylin-eosin (HE) dan diamati di bawah
mikroskop optik merk Olympus jenis polarizing dengan 40 kali pembesaran.
Sedangkan pada analisis darah yang diamati adalah Kreatinin, BUN, SGPT/ALT
dan SGOT/AST darah dengan menggunakan metode IFCC (International
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah
Rancangan Acak Lengkap (RAL). Faktor perlakuan yang diterapkan adalah suhu
proses yaitu; suhu 50 oC, 70 oC dan 90 oC selama 3 jam dan masing-masing
perlakuan diulang 3 kali. Sedangkan pada pengujian toksisitas, yang menjadi
faktor pengamatan adalah persentase khitosan larut air yang dicampur dengan
pakan yaitu; CMC0 = 0 %, CMC1 = 0.5 %, CMC2 = 1 %, CMC3 = 1.5 % dan
CMC4 = 2 %. Masing-masing perlakuan diulang 3 kali.
Model matematika yang digunakan dalan Rancangan Acak Lengkap ini
(Steel dan Torrie 1989) adalah:
Yijk = μ + Ai + Bj + Σij
Keterangan:
Yijk = Nilai pengamatan
μ = Nilai tengah
Ai = Pengaruh perlakuan pada taraf ke-i
Bj = Pengaruh perlakuan pada taraf ke-j Σij = Pengaruh sisa dari ulangan
Analisis data dilakukan dengan menggunakan analisis ragam (ANOVA)
dengan uji-F. Suatu perlakuan memberikan pengaruh nyata apabila Fhitung >
Ftabel dengan derajat bebas tertentu pada taraf 5 % dan berpengaruh sangat nyata
apabila nilai Fhitung > Ftabel dengan derajat bebas tertentu pada taraf 1 %. Uji
lanjut yang digunakan untuk mengetahui taraf terbaik dari masing-masing
HASIL DAN PEMBAHASAN
Penelitian Tahap I
Penelitian tahap I dimaksudkan untuk mempelajari proses pengolahan
khitosan menjadi CMC. Hasil rendemen yang diperoleh pada pengolahan khitosan
larut air ini berkisar antara 91.66 % sampai 98.82 %. Untuk hasil terendah
terdapat pada perlakuan suhu 50 oC, sedangkan hasil tertinggi terdapat pada
perlakuan suhu 90 oC dengan perlakuan alkalinasi natrium hidroksida 60 % dari
khitosan hasil deasetilasi selama 72 jam.
Berdasarkan hasil yang diperoleh menunjukkan bahwa viskositas CMC
yang dihasilkan sangat bervariasi. Hasil analisis viskositas tertinggi dihasilkan
pada perlakuan suhu 70 oC yaitu sebesar 338.33 Cps dan viskositas terendah
terdapat pada perlakuan suhu 50 oC adalah sebesar 123.67 Cps. Dari hasil sidik
ragam ternyata diperoleh hasil yang berbeda nyata (P<0.05) pada semua
perlakuan, dimana perlakuan suhu 50 oC berbeda nyata dengan perlakuan suhu
70 oC dan 90 oC, demikian juga dengan perlakuan suhu 70 oC berbeda nyata
(P<0.05) dengan perlakuan suhu 90 oC. Hal ini berarti bahwa semakin tinggi suhu
maka viskositas CMC akan semakin menurun (Lampiran 1).
Viskositas CMC tidak menunjukkan kecenderungan yang jelas. Terdapat
beberapa faktor yang dapat mempengaruhi viskositas seperti lama proses
karboksimetilasi, suhu dan konsentrasi NaOH yang digunakan. Pada proses ini
biasanya membutuhkan waktu proses yang lebih lama, penggunaan suhu dan
konsentrasi NaOH yang tinggi akan berakibat pada menurunnya nilai viskositas
CMC yang dihasilkan. Hal ini disebabkan oleh proses depolimerisasi (pemutusan
rantai polimer) sehingga menghasilkan khitosan dengan rantai yang lebih pendek.
Kelarutan CMC juga menunjukkan tingkat kelarutan yang bervariasi.
Tingkat kelarutan CMC berkisar antara 95.08 % sampai 99.84 %. Kelarutan CMC
tertinggi diperoleh pada perlakuan suhu 70 oC, sedangkan hasil terendah
dihasilkan pada perlakuan suhu 50 oC. Berdasarkan hasil analisis sidik ragam
ternyata kelarutan diperoleh hasil yang berbeda nyata (P<0.05) antara perlakuan
suhu 50 oC dengan perlakuan suhu 70 oC dan 90 oC, sedangkan perlakuan suhu
menunjukkan bahwa dengan adanya peningkatan suhu maka kelarutan CMC akan
meningkat, yang berarti bahwa perlakuan suhu karboksimetilasi berpengaruh
nyata (P<0.05) terhadap kelarutan CMC (Lampiran 1).
Kalarutan suatu zat juga tergantung pada ukuran partikel dan struktur zat
itu sendiri. Kelarutan naik dengan turunnya ukuran partikel sehingga sebelum
dilarutkan dalam air, dilakukan penghalusan CMC yang setelah dikeringkan.
Gambaran struktur seperti perbandingan gugus polar terhadap gugus nonpolar dari
molekul akan mempengaruhi kelarutan zat tersebut. Bila ada gugus polar
tambahan dalam molekul maka kelarutan dalam air meningkat seperti pada
khitosan yang larut dalam air. Dengan adanya substitusi gugus karboksimetil dari
asam-asam monokloroasetat pada struktur khitosan maka terdapat gugus polar
tambahan dalam molekul yang menyebabkan CMC dapat larut dalam air.
Hasil viskositas dan kelarutan CMC tertinggi dari perlakuan suhu 70 oC.
Hal ini dikarenakan khitosan tersebut mempunyai derajat deasetilasi tertinggi
(63.51) sehingga mempunyai gugus amin paling banyak dalam struktur
molekulnya. Gugus karboksimetil dari asam monokloroasetat akan menggantikan
gugus hidroksil dan gugus amin dari struktur khitosan, sehingga dengan
banyaknya gugus amin yang tersedia pada struktur khitosan akan meningkatkan
substitusi gugus karboksimetil yang dapat meningkatkan hasil CMC. Dengan
meningkatnya substitusi gugus karboksimetil ke gugus hidroksil maupun amin
akan menyebabkan CMC yang dihasilkan semakin bersifat polar sehingga
meningkatkan kelarutan dalam air. Jika CMC yang larut dalam air semakin
banyak maka akan meningkatkan viskositas larutan.
Hasil analisis kadar air berkisar antara 17.12 % sampai 20.76 %. Kadar air
tertinggi dihasilkan pada perlakuan suhu 50 oC dan kadar air terendah dihasilkan
pada perlakuan suhu 70 oC. Hasil analisis sidik ragam menunjukkan bahwa
perlakuan suhu berpengaruh nyata terhadap kadar air CMC, dimana perlakuan
90 oC berbeda nyata dengan perlakuan suhu 50 oC dan 70 oC. Sedangkan
perlakuan suhu 50 oC tidak berbeda nyata dengan perlakuan suhu 70 oC. Hal ini
disebabkan oleh kontinuitas proses pengeringan yang tidak stabil, kelembaban
yang tinggi dalam ruang penyimpanan dan kemampuan CMC dalam menyerap air
Nilai pH dihasilkan berkisar antara 4.33 sampai 4.57. Untuk nilai pH
tertinggi dihasilkan pada perlakuan suhu 90 oC yaitu sebesar 4.49, sedangkan nilai
pH terendah dihasilkan pada perlakuan suhu 70 oC sebesar 4.45. Nilai pH pada
penelitian ini berada di bawah pH netral, demikian juga dengan penelitian
Dwiyitno (2003) yang menghasilkan pH ≤ 4, tidak berbeda jauh dari penelitian
sebelumnya. Hasil analisis sidik ragam menunjukkan bahwa perlakuan suhu tidak
berpengaruh nyata (p>0.05) terhadap pH CMC. Pada penelitian ini juga untuk
menghasilkan nilai pH netral sangat sulit dilakukan, karena dengan menambahkan
natrium hidroksida akan menyebabkan semua larutan mengendap sehingga sulit
dipisahkan dan tidak dapat ditarik dengan isopropil alkohol. Penambahan natrium
hidroksida juga berpengaruh terhadap kualitas dan rendemen CMC yang
dihasilkan (Lampiran 1).
Derajat deasetilasi merupakan suatu parameter yang sangat penting untuk
menentukan mutu CMC. Derajat deasetilasi menunjukkan persentase gugus asetil
yang terdapat dalam rendemen CMC. Semakin tinggi nilai derajat deasetilasi,
maka gugus asetil yang terdapat dalam rendemen CMC tersebut akan semakin
sedikit (Alamsyah 2000).
Derajat deasetilasi produk CMC yang dihasilkan dalam penelitian ini
berkisar antara 61.51–63.51 %. Secara umum derajat deasetilasi produk CMC
yang dihasilkan masih di bawah standar mutu yang ditetapkan Protan Laboratories
yaitu > 70 %. Hasil analisis sidik ragam menunjukkan bahwa perlakuan suhu
tidak berpangaruh nyata (P>0.05) pada semua perlakuan (Lampiran 1).
Penelitian Tahap II
Berdasarkan hasil analisis pada penelitian tahap I yang meliputi analisis
proksimat (kadar air, kadar abu, protein, nitrogen), pH, rendemen, viskositas,
kelarutan dan derajat deasetilasi, maka dari ketiga perlakuan suhu 50 oC, 70 oC
dan 90 oC ternyata pada perlakuan 70 oC diperoleh hasil yang lebih baik dan lebih
tinggi dari perlakuan lainnya. Maka dari itu penelitian tahap II ini lebih terfokus
pada pengolahan CMC hanya dengan satu perlakuan suhu saja, yaitu perlakuan
suhu 70 oC dengan waktu deasetilasi khitosan 72 jam, dimana dari perlakuan
Tabel 2 Spesifikasi Khitosan Larut Air
Parameter Spesifikasi Parameter* Spesifikasi*
Penampakan
* http://www. Greatvistachemical.com/ biochemical/ carboxymethyl chitosan.html.
Penelitian tahap II ini juga bertujuan untuk mengetahui kadar toksisitas
yang terkandung dalam CMC yang diaplikasikan pada tikus percobaan. Perlakuan
terhadap tikus percobaan dilakukan dengan cara mencampur CMC dengan pakan
dan dengan persentase CMC yang berbeda yaitu, perlakuan kontrol, 0.5 %, 1 %,
1.5 %, dan 2 % dari masing-masing jumlah pakan yang akan diberikan.
Setelah melalui masa pemeliharaan selama 21 hari, maka dilakukan
analisis hispatologi (hati dan ginjal) dan biokimia darah yang meliputi kadar
SGOT, SGPT, Kreatinin dan BUN.
Salah satu pemeriksaan klinis untuk mengetahui adanya kelainan pada hati
adalah dengan memeriksa kadar SGOT dan SGPT. Kerusakan hati akut pada
anjing mengakibatkan meningkatnya aktifitas SGOT dan SGPT, demikian juga
pada kucing yang mengalami peradangan hati yang akut. Tingkat kerusakan hati
dapat digambarkan dengan besarnya kadar enzim tersebut dalam serum (Friberg
1992).
Glutamic oxaloacetic aminotransferase (GOT) serum atau asam aspartat transferase (AST), merupakan salah satu enzim yang sering dikaitkan dengan kerusakan atau matinya sel hati. Enzim ini mengkatalis pemindahan bolak balik
gugus amino antara asam amino aspartat dengan asam α ketoglutarat (Briefs
1992).
Hati merupakan organ paling banyak mengandung enzim aspartat
kadar enzim AST serum atau SGOT (Widmann 1985) atau karena adanya
kerusakan atau perbaikan jaringan hati, maka hati akan meningkatkan pengeluaran
enzim AST (Focus On Hepatitis International 1997).
Hasil analisis kadar SGOT berkisar antara 137.77 U/l–157.33 U/l, dimana
terjadi peningkatan pada perlakuan 1% dan menurun pada perlakuan 1.5% dan
2 %. Hal ini membuktikan bahwa semakin tinggi persentase CMC yang diberikan
akan mengakibatkan kadar SGOT menurun, artinya tidak terjadi kerusakan pada
fungsi hati.
Enzim AST (SGOT) tidak spesifik untuk disfungsi hati, karena enzim ini
juga ditemukan pada otot rangka, ginjal dan pankreas (Widmann 1985).
Disamping AST, enzim juga dihubungkan dengan tingkat kerusakan sel hati
adalah Alaninaminotransferase (ALT) atau Glutamat Pyruvic Transferase (GPT). Enzim ALT mengkatalis reaksi pemindahan gugus amino antara L-alanin dan
asam α ketoglutarat menjadi piruvat dan glutamat.
Enzim ALT merupakan enzim yang spesifik ada pada hati. Peningkatan
kadar enzim ini dalam darah dapat menunjukkan adanya kerusakan pada hati.
Dilaporkan bahwa peningkatan SGPT pada anjing dapat terjadi karena adanya
penyakit hati, degenerasi lemak pada hati, nekrosis hati dan tumor hati yang berat
(Sustriawan 1999).
Berdasarkan hasil analisis kadar SGPT, maka kadar SGPT tertinggi
terdapat pada perlakuan kontrol yaitu sebesar 55.28 U/l dan semakin menurun
pada perlakuan lainnya, yang berarti bahwa semakin tinggi konsentrasi CMC yang
diberikan akan mengakibatkan kadar SGPT semakin menurun secara nyata
(P<0.01) dan hal ini berarti tidak terjadi kerusakan pada hati. Demikian juga
bahwa kadar SGPT yang tinggi dapat digunakan sebagai indikator yang tepat
untuk menunjukkan tingkat kerusakan hati jika tidak ada penyakit pada organ
selain hati.
Hasil pembacaan hispatologi terhadap jaringan hati tikus percobaan
terlihat bahwa pada konsentrasi CMC 0.5 % dan 1 % tidak ada perubahan,
bahkan terjadi peningkatan jumlah sel kupffer dan bentuk jaringan hati terlihat
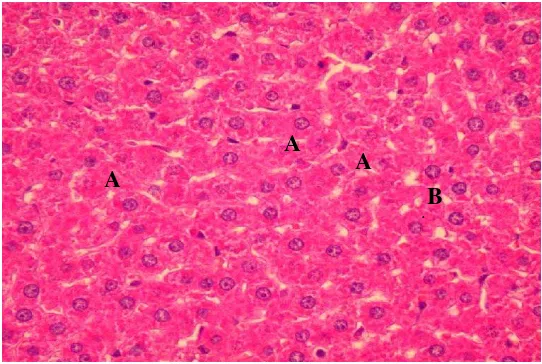
sama seperti pada kontrol (Gambar 7). Perubahan sel mulai terlihat pada
hati dan pertumbuhan sel-sel kupffer menjadi meningkat, yang berfungsi sebagai
sel pertahanan atau sebagai imun sistem terhadap bahan (Gambar 8).
Gambar 7 Penampang melintang hati pada perlakuan kontrol (0 %)
Gambar 8 Penampang melintang hati pada perlakuan 1.5 %
Keterangan: A. Sel mengalami degenerasi ringan; B. Sel kupffer meningkat
Dengan semakin tingginya konsentrasi CMC yang masuk ke dalam tubuh,
sel pada jaringan hati tidak memperlihatkan perubahan yang lebih berat. Hal ini
diperkuat dengan analisis biokimia darah yang menunjukkan tidak adanya
pengaruh pemberian CMC terhadap kadar SGOT dan SGPT. Kadar SGOT dan
SGPT semakin menurun dengan meningkatnya konsentrasi CMC yang diberikan. A
B A
A
Nilai SGOT darah tikus pada perlakuan kontrol dan perlakuan lainnya
melebihi standar normal. Tingginya nilai SGOT tidak hanya bersumber dari
hepatosit, tetapi dapat diperoleh dari sumber yang lain yaitu jantung, ginjal,
pankreas, tulang dan otot (Davidson 1981). Hal ini karena SGOT dihasilkan dari
pelepasan enzim glutamat oxaloasetat transaminase dalam darah. Oleh karena itu pengukuran SGOT tidak spesifik untuk mengetahui keadaan fungsi hati, walaupun
tetap dapat digunakan untuk menilai keadaan hati dan organ lainnya. Selain itu
SGOT sangat dipengaruhi oleh organ lain, nilai pengukuran juga sangat
dipengaruhi oleh beberapa faktor antara lain cara pengambilan darah, banyak
sedikitnya serum darah yang diperoleh dan lama penyimpanan serum darah
sebelum diperiksa.
Tabel 3 Hasil rata-rata kadar SGOT dan SGPT dalam darah
Kadar dalam darah (U/l) Perlakuan CMC (%)
Kadar SGOT Kadar SGPT
0 154,27 + 29.38a 55.28 + 6.63a
Ginjal merupakan bagian utama dari sistem saluran ekskresi yang terdiri
dari ginjal kiri dan ginjal kanan serta terletak di rongga perut bagian belakang, di
bawah sekat rongga dada (diafragma). Bentuknya seperti kacang merah dan
dibagian cekung terdapat pembuluh darah yang masuk ke dalam maupun ke luar
ginjal. Di belakang pembuluh darah terletak saluran halus yaitu ureter yang
menghubungkan ginjal dengan kantung urin (vesica urinaria) dan dari kantung
urin ini, urin keluar lewat saluran uretra (Doxey 1983).
Ginjal terbagi dalam korteks dan medula, dimana di dalam korteks
terdapat bagian yang dengan mata telanjang terlihat seperti butiran kasar disebut
nefron. Tiap nefron merupakan inti fungsional dari ginjal (sebagian unit filtrasi
ginjal) dan terdiri dari glomerulus dan tubulus bagian yang berfungsi sebagai
penyaring (OSHA 1999). Semua darah yang akan disaring dan dibersihkan ginjal
harus melalui glomerulus dan hasil saringan glomerulus masuk ke dalam tubulus
ginjal untuk diolah lebih lanjut dan akhirnya menghasilkan urin. Di dalam ginjal
kreatinin, amonia dan air dapat melewati saringan, sedangkan yang berguna bagi
tubuh seperti protein terutama dengan ukuran molekul besar tidak melewati
saringan ini, tetap dalam aliran darah (Japaries 1995).
Ginjal termasuk organ tubuh yang sangat rentan terhadap zat racun
(toksin). Toksin dalam hal ini logam berat dapat masuk ke dalam darah melalui
makanan, udara ataupun terserap melalui kulit. Di ginjal darah akan disaring dan
zat yang akan dibuang akan dipekatkan, akibatnya toksinpun menjadi lebih pekat
sehingga efek racunnya menjadi lebih nyata (Doxey 1983).
Hasil dari analisis toksisitas dalam ginjal terlihat bahwa pada konsentrasi
0.5 % dan 1 % tidak ada perubahan, sama seperti kontrol, sedangkan pada
konsentrasi 1.5 % dan 2 % terjadi pembendungan ringan, artinya terjadi
pertumbuhan sel baru yang berfungsi untuk memproteksi sel dari pengaruh bahan
yang bersifat toksik.
Kadar kreatinin relatif lebih stabil dibandingkan dengan kadar BUN,
karena nilai kreatinin kontrol dan semua perlakuan masih berada dalam kisaran
normal (0.2–0.8 mg/dl) biarpun terdapat sedikit peningkatan seperti pada
perlakuan 0.5 dan 1 % yaitu sebesar 0.82 dan 0.85 mg/dl. Akan tetapi pada
perlakuan selanjutnya 1.5 dan 2 % kembali menurun menjadi 0.57 dan 0.65 mg/dl.
Kestabilan ini mengindikasikan bahwa kreatinin tidak berpengaruh oleh asupan
pakan, sehingga tidak terpengaruh oleh keberadaan senyawa-senyawa yang
diduga bersifat antinutrisi maupun toksik. Menurut Girindra (1998), kadar
kreatinin dalam serum sangat mantap, hampir tidak dipengaruhi oleh pakan, umur,
sex, senam maupun diet dan peningkatan kreatinin terjadi jika fungsi ginjal
terganggu. Secara hispatologi tidak ditemukan perubahan baik pada kontrol
maupun perlakuan, walaupun terjadi sedikit kenaikan tetapi tidak mengganggu
kestabilan kreatinin serum.
Kadar BUN tertinggi diperoleh sebesar 33.67 mg/dl yaitu pada perlakuan
1 %, lebih tinggi dibandingkan dengan perlakuan kontrol yaitu sebesar
25.67 mg/dl dan BUN menurun sesuai dengan semakin tingginya konsentrasi
CMC dalam pakan. Kadar BUN di atas normal ini dihasilkan pada semua
perlakuan, sehingga tidak terjadi hambatan reaksi pembentukan ureum yang
akhirnya menghasilkan ureum di atas standar normal (15–21 mg/dl). Sedangkan
pada perlakuan kontrol, tingginya kadar BUN dipengaruhi oleh tingginya
persentasi protein dalam pakan.
Creat inin BUN SGOT SGP T
Gambar 9 Pengaruh CMC terhadap biokimia darah
Dari hasil pembacaan hispatologi jaringan ginjal juga memperlihatkan
bahwa dengan makin tingginya konsentrasi CMC yang diberikan tidak
mengakibatkan adanya perubahan sel pada jaringan bagian kortex ginjal, artinya
tidak ada perubahan seperti halnya pada perlakuan kontrol (Gambar 10), dimana
susunan glomerulus dan tubulus masih teratur (Gambar 11).
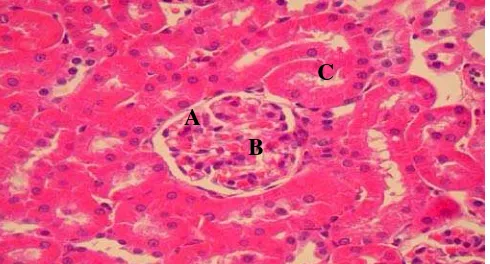
Gambar 11 Penampang melintang ginjal pada perlakuan 2 %
Keterangan: A. Glomerulus; B. Sel mengalami pembendungan ringan; C. Tubulus
Selama perlakuan, tikus tidak memperlihatkan perubahan tingkah laku
ataupun tanda-tanda keracunan karena semua terlihat normal. Penimbangan berat
badan dilakukan setiap hari selama 21 hari dengan berat badan rata-rata seperti
terlihat pada Gambar 12.
Gambar 12 Grafik rata-rata berat badan tikus yang diberi CMC selama 21 hari
Hasil pengamatan terhadap konsumsi pakan harian terlihat bahwa tingkat
konsumsi pakan dari semua tikus terdapat perbedaan pada semua perlakuan.
Pakan yang diberi perlakuan persentase CMC hampir semuanya meninggalkan A
B