ISOLASI DAN IDENTIFIKASI SENYAWA FLAVONOIDA
DARI EKSTRAK ETANOL KULIT BATANG INGUL (Toona
sinensis (Juss.) M.Roem)
SKRIPSI
OLEH:
TIMOTIUS ZENDRATO NIM 091501101
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ISOLASI DAN IDENTIFIKASI SENYAWA FLAVONOIDA
DARI EKSTRAK ETANOL KULIT BATANG INGUL (Toona
sinensis (Juss.) M.Roem)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
TIMOTIUS ZENDRATO NIM 091501101
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ISOLASI DAN IDENTIFIKASI SENYAWA FLAVONOIDA
DARI EKSTRAK ETANOL KULIT BATANG INGUL (Toona
sinensis (Juss.) M.Roem)
OLEH:
TIMOTIUS ZENDRATO NIM 091501101
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 27 Juli 2013
Pembimbing I, Panitia Penguji,
Drs. Nahitma Ginting, M.Si., Apt. Dr. Ginda Haro, M.Sc., Apt. NIP 195406281983031002 NIP 195108161980031002
Pembimbing II, Drs. Nahitma Ginting, M.Si., Apt.
NIP 195406281983031002
Dra. Aswita Hafni Lubis, M.Si., Apt. Dra. Masria Lasma Tambunan, M.Si., Apt. NIP 195304031983032001 NIP 195005081977022001
Dra. Erly Sitompul, M.Si., Apt. NIP 195006121980032001
Medan, 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa atas anugerah dan kasih
setia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan
skripsi ini yang berjudul Isolasi dan Identifikasi Senyawa Flavonoida dari Ekstrak
Etanol Kulit Batang Ingul (Toona Sinensis (Juss.) M.Roem). Skripsi ini diajukan
sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas
Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih yang
sebesar-besarnya kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan
Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas
sehingga penulis dapat menyelesaikan perkuliahan. Bapak Drs. Nahitma Ginting,
M.Si., Apt., dan Ibu Dra. Aswita Hafni Lubis, M.Si., Apt., selaku dosen
pembimbing yang telah memberikan waktu, bimbingan, dan nasehat selama
penelitian hingga selesainya penyusunan skripsi ini. Bapak Dr. Ginda Haro,
M.Sc., Apt., Ibu Dra. Masria Lasma Tambunan, M.Si., Apt., dan Ibu Dra. Erly
Sitompul, M.Si., Apt., selaku dosen penguji yang telah memberikan saran dan
arahan kepada penulis dalam menyelesaikan skripsi ini. Kepada Bapak dan Ibu
staf pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah mendidik
dan mengarahkan dalam perkuliahan, khususnya kepada Bapak Dr. Martua
Pandapotan Nasution, MPS., Apt., sebagai dosen penasehat akademik selama
perkuliahan berlangsung.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
Gea, S.Pd., yang tiada hentinya berkorban dengan tulus ikhlas bagi kesuksesan
penulis, juga kepada kedua adikku Ciptani Putri Zendrato dan Ela Asrini
Zendrato, yang selalu setia memberi doa, dorongan, dan semangat, serta kepada
teman-teman farmasi, terkhusus sains dan teknologi farmasi 2009, yang telah
memberi bantuan, dukungan dan motivasi selama penulis melakukan penelitian.
Akhirnya, penulis sadar bahwa tulisan ini masih banyak kekurangan
disana sini. Oleh karena itu, sangat diharapkan kritik dan saran yang bersifat
membangun dari pembaca, semoga skripsi ini dapat menjadi sumbangan yang
berarti bagi ilmu pengetahuan khususnya pada ilmu farmasi.
Medan, September 2013 Penulis
ISOLASI DAN IDENTIFIKASI SENYAWA FLAVONOIDA DARI EKSTRAK ETANOL KULIT BATANG INGUL (Toona sinensis (Juss.)
M.Roem)
ABSTRAK
Tumbuhan yang digunakan pada penelitian ini adalah kulit batang dari tumbuhan ingul (Toona sinensis (Juss.) M.Roem.). Kayu dari pohon ingul ini termasuk kayu yang bernilai tinggi dan lebih tahan lama dibandingkan kayu jenis lain. Kulit batang dan akar sering digunakan untuk ramuan obat. Telah dilakukan pengujian aktivitas antibakteri dari ekstrak etanol kulit batang ingul terhadap beberapa bakteri gram positif dan gram negatif. Kulit batang ingul ini diduga mengandung senyawa flavonoida yang berkhasiat sebagai antibakteri. Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi senyawa flavonoida yang terdapat dalam kulit batang ingul.
Hasil karakterisasi simplisia yakni kadar air 4,10%, kadar sari larut dalam air 17,39%, kadar sari larut dalam etanol 15,46%, kadar abu total 5,78%, kadar abu yang tidak larut dalam asam 1,35%. Hasil skrining fitokimia positif untuk senyawa flavonoida, tanin, streoida/triterpenoida, glikosida dan glikosida antrakinon. Pembuatan ekstrak dilakukan secara perkolasi menggunakan pelarut etanol 80%, dipekatkan dengan rotary evaporator dan difreeze dryer sampai diperoleh crude extract. Ekstrak etanol yang diperoleh dilakukan fraksinasi dengan ekstraksi cair-cair menggunakan pelarut n-heksana, etilasetat dan etanol. Hasil ekstraksi cair-cair yang diperoleh dilakukan kromatografi kertas (KKt) dengan berbagai fase gerak. Hasil KKt dari masing-masing ekstrak, terbaik pada ekstrak etilasetat dengan fase gerak BAA (butanol:asam asetat:air, 4:1:5). Kemudian dilakukan KKt preparatif, diperoleh empat pita yaitu pita I Rf = 0,25, pita II Rf = 0,45, pita III Rf = 0,60, dan pita IV Rf = 0,70. Isolat yang diperoleh dilakukan uji kemurnian dengan KKt preparatif dua arah dengan fase gerak arah pengembangan pertama menggunakan BAA dan fase gerak arah pengembangan kedua menggunakan forestal dan asam asetat 50%.
Hasil uji kemurnian isolat yang menunjukkan isolat murni atau tunggal yaitu isolat pada pita III dan pita IV. Isolat pita III dan pita IV, diidentifikasi secara spektrofotometri UV-Vis dengan menggunakan pereaksi geser (shift
reagent). Hasil penafsiran spektrum UV-Vis dengan menggunakan pereaksi geser
terhadap pita III tidak dapat diduga jenis flavonoida apa karena nilai panjang gelombang yang tidak sesuai, sedangkan hasil penafsiran spektrum UV-Vis dengan pereaksi geser terhadap pita IV adalah diduga senyawa flavonoida jenis flavanon/dihidroflavonol yang mempunyai gugus OH pada atom C nomor 5 dan 7 serta tidak terdapatnya gugus orto di OH pada cincin A maupun pada cincin B. Pita IV kemudian diidentifikasi gugus fungsinya secara spektrofotometri inframerah. Analisis FTIR menunjukkan adanya gugus fungsi C-H sp3, C=C, dan OH.
Kata kunci : karakterisasi, skrining fitokimia, ekstrak, fraksinasi, isolasi, dan
ISOLATION AND IDENTIFICATION OF FLAVONOID FROM ETHANOL EXTRACT OF INGUL CORTEX (Toona sinensis (Juss.)
M.Roem.)
ABSTRACT
The plant used in this research was ingul (Toona sinensis (Juss.) M.Roem.) cortex. The ingul tree has a high value and more durable then kinds of other tree. The cortex and root oftentimes used for medicine. Testing of antibacterial activity with ethanol extract from ingul cortex had been conducted. Ingul cortex was predicted had a flavonoid compound that have an antibacterial activity. The objectives of this study are isolation and identification flavonoid compound from ingul cortex.
The characterization of simplicia result showed that water concentration was 4.10%, concentration of water soluble extract was 17.39%, concentration of ethanol soluble extract was 5.46%, total concentration of ash was 5.78%, concentration of acid insoluble ash was 1.35%. Result of phytochemical screening showed that positive for flavonoid, tannin, streoid/triterpenoid, glycoside and anthraquinone glycoside compound. Extraction was conducted by percolation with ethanol 80%, then it was rotary evaporator, freeze dryer until it had been crude extract. Ethanol extract was fractination with extraction by liquid-liquid using the n-hexane, ethyl acetat and ethanol. The fractionation result was conducted through paper chromatography with several phases of motion. The paper chromatography result of each extract was best found in extract of ethyl acetat with buthanol : acetat acid: water (BAW) (4:1:5) expander. Then conducted with preparative of paper chromatography, four stains had been gained, they were stain I Rf = 0.25, stain II Rf = 0.45, stain III Rf = 0.60, and stain IV Rf = 0.70. Then conducted with two direction paper chromatography with BAW as first expander then forestal and acetat acid 50 % as the second expander.
The result of pure chromatography showed that stain III and stain IV were pure. Stain III and stain IV then were identificated with spectrophotometry UV-Vis using shift reagent. The interpretation result of spectrum UV-UV-Vis by using shift reagent of stain III can not predicted because it was not relevant with flavonoid class. But the interpretation result of spectrum UV-Vis by using shift reagent of stain IV was predicted flavonoid compound kind of flavanon/dihidroflavonol with cluster of hidroxilation in C number 5 and 7, and also there were not orto di OH in ring B and ring A. Then stain IV was identificated with spectrophotometry infrared. Analysis of FTIR showed that there were group function sp3 C-H, C=C, and OH.
Keywords: characterization, phytochemical screening, extract, fractination,
3.4.6 Penetapan kadar abu total ... 34
3.8 Analisis Senyawa Flavonoida secara Kromatografi Kertas (KKt) Kualitatif ... 38
3.9 Isolasi Senyawa Flavonoida secara Kromatografi Kertas (KKt) Preparatif ... 39
3.10 Uji Kemurnian Isolat ... 40
3.11 Analisis Jenis Flavonoida secara Spektrofotometri Ultraviolet-Visible Menggunakan Pereaksi Geser (shift reagent) ... 40
3.12 Analisis Gugus Fungsi Flavonoida secara Spektrofotometri FTIR (Fourier Transform Infra Red) ... 41
BAB IV HASIL DAN PEMBAHASAN ... 42
4.1 Identifikasi Tanaman ... 42
4.2 Karakterisasi Simplisia ... 42
4.2.2 Pemeriksaan mikroskopik ... 43
4.2.3 Pemeriksaan karakteristik serbuk simplisia ... 44
4.3 Skrining Fitokimia Serbuk Simpilisia dan Ekstrak ... 45
4.4 Pembuatan Serbuk Simplisia ... 45
4.4.1 Ekstraksi dengan pelarut etanol 80% ... 45
4.4.2 Ekstraksi cair-cair ... 46
4.5 Analisis Kromatografi Kertas (KKt) ... 46
4.6 Analisis Kromatografi Kertas (KKt) Dua Arah ... 47
4.7 Analisis Spektrum UV-Vis dengan Pereaksi Geser (Shift Reagent) ... 48
4.7.1 Analisis spektrum pita III ... 48
` 4.7.2 Analisis Spektrum pita IV ... 49
4.8 Analisis Spektrum FTIR (Fourier Transform Infra Red) ... 51
BAB V KESIMPULAN DAN SARAN ... 53
5.1 Kesimpulan ... 53
5.2 Saran ... 53
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Halaman
Tabel 4.1. Hasil Identifikasi Tanaman ... 42
Tabel 4.2. Pemeriksaan Karakteristik Serbuk Simplisia ... 44
Tabel 4.3. Skrining Fitokimia Serbuk Simplisia dan Ekstrak Kulit
Batang Ingul (Toona sinensis (Juss.) M.Roem.) ... 45
Tabel 4.4. Panjang Gelombang Spektrum Isolat Pita III dalam
Metanol ... 48
Tabel 4.5. Panjang Gelombang Spektrum Isolat Pita IV dalam
Metanol ... 49
Tabel 4.6. Panjang Gelombang Spektrum Isolat Pita IV dalam
Metanol dengan Natrium Hidroksida ... 49
Tabel 4.7. Panjang Gelombang Spektrum Isolat Pita IV dalam Metanol dan Natrium Asetat serta Natrium Asetat dalam
Asam Borat ... 50
Tabel 4.8. Panjang Gelombang Spektrum Isolat Pita IV dalam Metanol dan Aluminium Klorida serta Aluminiun Klorida
DAFTAR GAMBAR
Halaman
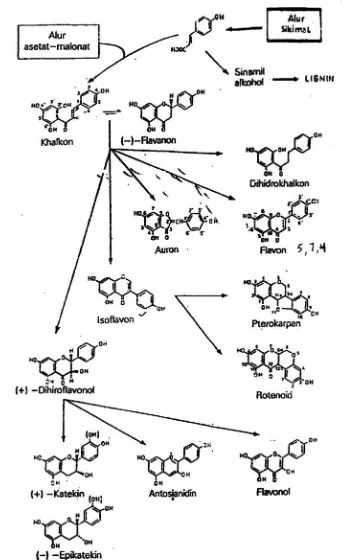
Gambar 1. Kerangka dasar senyawa flavonoida ... 9
Gambar 2. Hubungan jenis monomer flavonoida ... 10
Gambar 3. Struktur flavonol ... 14
Gambar 4. Struktur flavon ... 14
Gambar 5. Struktur Isoflavon ... 15
Gambar 6. Struktur flavanon ... 15
Gambar 7. Struktur flavanonol ... 16
Gambar 8. Struktur katekin ... 16
Gambar 9. Struktur leukoantosianidin ... 17
Gambar 10. Struktur antosianin ... 17
Gambar 11. Struktur khalkon ... 18
Gambar 12. Struktur auron ... 18
Gambar 13. Simplisia Kulit Batang Ingul (Toona sinensis (Juss.) M.Roem.) ... 43
Gambar 14. Mikroskopik Serbuk Simplisia Kulit Batang Ingul (Toona sinensis (Juss.) M.Roem.) ... 43
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Tumbuhan ... 56
Lampiran 2. Tanaman Ingul (Toona sinensis (Juss.) M. Roem) ... 57
Lampiran 3. Serbuk Simplisia Kulit Batang Ingul (Toona sinensis (Juss.) M. Roem) ... 58
Lampiran 4. Perhitungan Penetapan Karakteristik Simplisia ... 59
Lampiran 5. Bagan Pembuatan Ekstrak Kulit Batang Ingul (Toona Sinensis (Juss.) M. Roem) ... 64
Lampiran 6. Bagan Pembuatan Ekstrak Cair-Cair dari Ekstrak Kulit Batang Ingul (Toona sinensis (Juss.) M. Roem) ... 65
Lampiran 7. Hasil Kromatografi Kertas (KKt) ... 66
Lampiran 8. Hasil Kromatografi Kertas (KKt) Preparatif ... 81
Lampiran 9. Hasil Kromatografi Kertas (KKt) Dua Arah ... 82
Lampiran 10. Hasil Spektrum UV-Vis ... 86
ISOLASI DAN IDENTIFIKASI SENYAWA FLAVONOIDA DARI EKSTRAK ETANOL KULIT BATANG INGUL (Toona sinensis (Juss.)
M.Roem)
ABSTRAK
Tumbuhan yang digunakan pada penelitian ini adalah kulit batang dari tumbuhan ingul (Toona sinensis (Juss.) M.Roem.). Kayu dari pohon ingul ini termasuk kayu yang bernilai tinggi dan lebih tahan lama dibandingkan kayu jenis lain. Kulit batang dan akar sering digunakan untuk ramuan obat. Telah dilakukan pengujian aktivitas antibakteri dari ekstrak etanol kulit batang ingul terhadap beberapa bakteri gram positif dan gram negatif. Kulit batang ingul ini diduga mengandung senyawa flavonoida yang berkhasiat sebagai antibakteri. Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi senyawa flavonoida yang terdapat dalam kulit batang ingul.
Hasil karakterisasi simplisia yakni kadar air 4,10%, kadar sari larut dalam air 17,39%, kadar sari larut dalam etanol 15,46%, kadar abu total 5,78%, kadar abu yang tidak larut dalam asam 1,35%. Hasil skrining fitokimia positif untuk senyawa flavonoida, tanin, streoida/triterpenoida, glikosida dan glikosida antrakinon. Pembuatan ekstrak dilakukan secara perkolasi menggunakan pelarut etanol 80%, dipekatkan dengan rotary evaporator dan difreeze dryer sampai diperoleh crude extract. Ekstrak etanol yang diperoleh dilakukan fraksinasi dengan ekstraksi cair-cair menggunakan pelarut n-heksana, etilasetat dan etanol. Hasil ekstraksi cair-cair yang diperoleh dilakukan kromatografi kertas (KKt) dengan berbagai fase gerak. Hasil KKt dari masing-masing ekstrak, terbaik pada ekstrak etilasetat dengan fase gerak BAA (butanol:asam asetat:air, 4:1:5). Kemudian dilakukan KKt preparatif, diperoleh empat pita yaitu pita I Rf = 0,25, pita II Rf = 0,45, pita III Rf = 0,60, dan pita IV Rf = 0,70. Isolat yang diperoleh dilakukan uji kemurnian dengan KKt preparatif dua arah dengan fase gerak arah pengembangan pertama menggunakan BAA dan fase gerak arah pengembangan kedua menggunakan forestal dan asam asetat 50%.
Hasil uji kemurnian isolat yang menunjukkan isolat murni atau tunggal yaitu isolat pada pita III dan pita IV. Isolat pita III dan pita IV, diidentifikasi secara spektrofotometri UV-Vis dengan menggunakan pereaksi geser (shift
reagent). Hasil penafsiran spektrum UV-Vis dengan menggunakan pereaksi geser
terhadap pita III tidak dapat diduga jenis flavonoida apa karena nilai panjang gelombang yang tidak sesuai, sedangkan hasil penafsiran spektrum UV-Vis dengan pereaksi geser terhadap pita IV adalah diduga senyawa flavonoida jenis flavanon/dihidroflavonol yang mempunyai gugus OH pada atom C nomor 5 dan 7 serta tidak terdapatnya gugus orto di OH pada cincin A maupun pada cincin B. Pita IV kemudian diidentifikasi gugus fungsinya secara spektrofotometri inframerah. Analisis FTIR menunjukkan adanya gugus fungsi C-H sp3, C=C, dan OH.
Kata kunci : karakterisasi, skrining fitokimia, ekstrak, fraksinasi, isolasi, dan
ISOLATION AND IDENTIFICATION OF FLAVONOID FROM ETHANOL EXTRACT OF INGUL CORTEX (Toona sinensis (Juss.)
M.Roem.)
ABSTRACT
The plant used in this research was ingul (Toona sinensis (Juss.) M.Roem.) cortex. The ingul tree has a high value and more durable then kinds of other tree. The cortex and root oftentimes used for medicine. Testing of antibacterial activity with ethanol extract from ingul cortex had been conducted. Ingul cortex was predicted had a flavonoid compound that have an antibacterial activity. The objectives of this study are isolation and identification flavonoid compound from ingul cortex.
The characterization of simplicia result showed that water concentration was 4.10%, concentration of water soluble extract was 17.39%, concentration of ethanol soluble extract was 5.46%, total concentration of ash was 5.78%, concentration of acid insoluble ash was 1.35%. Result of phytochemical screening showed that positive for flavonoid, tannin, streoid/triterpenoid, glycoside and anthraquinone glycoside compound. Extraction was conducted by percolation with ethanol 80%, then it was rotary evaporator, freeze dryer until it had been crude extract. Ethanol extract was fractination with extraction by liquid-liquid using the n-hexane, ethyl acetat and ethanol. The fractionation result was conducted through paper chromatography with several phases of motion. The paper chromatography result of each extract was best found in extract of ethyl acetat with buthanol : acetat acid: water (BAW) (4:1:5) expander. Then conducted with preparative of paper chromatography, four stains had been gained, they were stain I Rf = 0.25, stain II Rf = 0.45, stain III Rf = 0.60, and stain IV Rf = 0.70. Then conducted with two direction paper chromatography with BAW as first expander then forestal and acetat acid 50 % as the second expander.
The result of pure chromatography showed that stain III and stain IV were pure. Stain III and stain IV then were identificated with spectrophotometry UV-Vis using shift reagent. The interpretation result of spectrum UV-UV-Vis by using shift reagent of stain III can not predicted because it was not relevant with flavonoid class. But the interpretation result of spectrum UV-Vis by using shift reagent of stain IV was predicted flavonoid compound kind of flavanon/dihidroflavonol with cluster of hidroxilation in C number 5 and 7, and also there were not orto di OH in ring B and ring A. Then stain IV was identificated with spectrophotometry infrared. Analysis of FTIR showed that there were group function sp3 C-H, C=C, and OH.
Keywords: characterization, phytochemical screening, extract, fractination,
BAB I
PENDAHULUAN
1.1 Latar Belakang
Ingul (Toona sinensis (Juss.) M.Roem) merupakan tumbuhan dari suku
Meliaceae, berupa pohon berukuran sedang sampai besar, tinggi dapat mencapai
25 m dengan diameter batang dapat mencapai 70 cm. Kayu dari pohon ingul
termasuk kayu yang bernilai tinggi dan lebih tahan lama dibandingkan kayu jenis
yang lain. Kayunya sangat keras, berwarna kemerahan, bernilai tinggi, serta
memiliki sifat kayu yang baik, tahan terhadap pelapukan, banyak digunakan untuk
pembuatan perabot rumah. Kayunya tergolong kayu yang awet, dan tahan
perendaman dalam air selama bertahun-tahun. Beberapa bagian pohon terutama
kulit batang dan akar sering digunakan untuk ramuan obat, yaitu untuk mengobati
penyakit diare dan disentri, pengawet minuman, penyemprot hama pada tanaman
jeruk, dan daunnya dapat digunakan untuk lalapan (Dharmawati, 2002).
Kulit batang ingul telah diuji aktivitas antibakteri dalam bentuk ekstrak
etanol terhadap beberapa bakteri gram positif dan bakteri gram negatif. Ekstrak
etanol kulit batang ingul menunjukkan hasil yang memuaskan sebagai antibakteri
pada konsentrasi 75 mg/ml terhadap bakteri Escherichia coli dan Bacillus subtilis
sedangkan terhadap bakteri Shigella dysenteriae baru menunjukkan hasil yang
memuaskan pada konsentrasi 100 mg/ml. Konsentrasi terkecil yang masih
menghambat pertumbuhan bakteri Escherichia coli dan Bacillus subtilis yaitu 6
Kulit batang ingul diduga mengandung senyawa flavonoida yang
berkhasiat sebagai antibakteri. Flavonoida berkhasiat sebagai antioksidan,
antibakteri dan anti inflamasi (Harborne, 1987). Flavonoida merupakan salah satu
golongan fenol alam yang terbesar pada tumbuhan hijau dan mengandung 15
atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6-C3-C6 dan
terdapat dalam semua tumbuhan hijau sehingga pastilah ditemukan pula pada
setiap ekstrak tumbuhan (Markham, 1988). Umumnya senyawa flavonoida dalam
tumbuhan terikat dengan gula sehingga disebut sebagai glikosida dan aglikon
flavonoida yang berbeda-beda mungkin saja terdapat pada satu tumbuhan dalam
beberapa bentuk kombinasi glikosida (Harborne, 1987).
Berdasarkan uraian latar belakang di atas, untuk meningkatkan
pemanfaatan kulit batang ingul sebagai sumber obat khususnya sebagai obat
antibakteri maka penulis melakukan penelitian tentang Isolasi dan Identifikasi
Senyawa Flavonoida dari Ekstrak Etanol Kulit Batang Ingul (Toona sinensis
(Juss.) M.Roem).
1.2 Perumusan Masalah
Berdasarkan uraian latar belakang di atas, maka perumusan masalah pada
penelitian ini adalah:
a. Apakah senyawa flavonoida dapat diisolasi dari ekstrak etanol kulit batang
ingul (Toona sinensis (Juss.) M. Roem.)?
b. Apakah senyawa flavonoida yang diperoleh dari hasil isolasi dapat
diidentifikasi secara spektrofotometri UV-Vis menggunakan pereaksi
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian
ini adalah:
a. Senyawa flavonoida dapat diisolasi dari ekstrak etanol kulit batang ingul
(Toona sinensis (Juss.) M. Roem.).
b. Senyawa flavonoida yang diperoleh dari hasil isolasi dapat diidentifikasi
secara spektrofotometri UV-Vis menggunakan pereaksi geser dan secara
spektrofotometri FTIR.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah:
a. Untuk mengisolasi senyawa flavonoida dari ekstrak etanol kulit batang
ingul (Toona sinensis (Juss.) M. Roem.)
b. Untuk mengidentifikasi senyawa flavonoida yang diperoleh dari hasil
isolasi secara spektrofotometri UV-Vis menggunakan pereaksi geser dan
secara spektrofotometri FTIR.
1.5 Manfaat Penelitian
Manfaat penelitian yang dilakukan adalah:
a. Sebagai sumber informasi ilmiah tentang kandungan senyawa metabolit
sekunder yang terkandung di dalam kulit batang ingul (Toona sinensis
b. Sebagai sumber informasi ilmiah tentang jenis senyawa flavonoida yang
terkandung di dalam kulit batang ingul (Toona sinensis (Juss.) M. Roem.).
c. Sebagai sumber informasi ilmiah untuk penentuan struktur kimia dari
senyawa flavonoida yang terkandung di dalam kulit batang ingul (Toona
sinensis (Juss.) M. Roem.).
d. Untuk meningkatkan pemanfaatan kulit batang ingul (Toona sinensis
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Penyebaran dan Habitat
Toona sinensis (sinonim.Cedrella sinensis A. Juss.) adalah spesies Toona
yang terdapat di Asia Tenggara, Korea Selatan dan Utara, bagian tenggara India,
Myanmar, Malaysia, dan bagian barat Indonesia. Dalam bahasa Malaysia disebut
suren. Jenis ini dijumpai di hutan-hutan primer maupun sekunder, dan banyak
tumbuh di hutan pedesaan sering dijumpai disepanjang sungai di daerah bukit dan
lereng-lereng pada ketinggian 1.200 – 2.700 m dpl (Dharmawati, 2002).
2.1.2 Meliaceae
Tumbuhan yang tergolong dalam suku Meliaceae biasanya berupa semak
atau pohon, mempunyai kelenjar resin atau kelenjar minyak, daun majemuk,
menyirip, duduknya tersebar, tanpa daun penumpu, bunga aktinomorf. Kelopak
sering kali kecil, terdiri dari 4-5 daun kelopak. Buahnya berupa buah kendaga atau
buah batu. Biji dengan atau tanpa endosperm, seringkali bersayap. Sekitar 750
jenis tumbuhan merupakan warga suku ini terbagi dalam kurang lebih 50 marga,
tersebar di daerah- daerah iklim panas. Misalnya Melia azedarach, Aglaia odorata
sebagai tanaman hias, bunga sering digunakan sebagai pewangi pakaian. Cedrella
odorata, penghasil kayu sedar (Gembong, 1991).
2.1.3 Deskripsi Tumbuhan
Pohon berukuran sedang sampai besar, dapat mencapi tinggi 25 meter.
kelihatan licin pada pohon yang muda, menjadi pecah dan terasa kasar pada
pohon yang sudah tua. Daunnya lebar, kadang-kadang mengelompok diujung
cabang, panjangnya 50-70 cm, dengan 8-20 pasang anak daun. Permukaan dan
tulang daun sebelah atas umumnya berbulu. Bunga dihasilkan pada musim panas,
bunga dijumpai diujung cabang, berukuran kecil, dengan diameter 4-5 mm,
berwarna putih atau pink pucat. Buah berupa kapsul dengan panjang 2-3,5 cm,
buah terdiri dari beberapa ruang yang didalamnya terdapat beberapa benih
(Dharmawati, 2002).
2.1.4 Sistematika Tumbuhan
Menurut hasil identifikasi tanaman dari LIPI Bogor, diperoleh:
Dunia : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Sapindales
Famili : Meliaceae
Genus : Toona
Spesies : Toona sinensis (A.Juss.) M.Roem
2.1.5 Nama Daerah
Nama daerah dari pohon ingul adalah ingul (Karo), suren (Malaysia).
2.1.6 Kegunaan
Daun-daun muda digunakan sebagai sumber sayur di Cina dan Malaysia.
Daunnya memiliki aroma sehingga dapat menggantikan bawang, selain itu
daunnya mengandung racun yang dapat menyebabkan kejang hebat dan kematian.
Buah, kulit batang dan akarnya, digunakan sebagai obat tradisional yaitu diare
kronik dan anemia, astringen. Bubuk akar digunakan sebagai minuman penyegar
dan peluruh seni (diuretik). Kayunya sangat keras, berwarna kemerahan, bernilai
tinggi, serta memiliki sifat kayu yang baik. Banyak digunakan untuk pembuatan
furniture atau perabot rumah (Bocker dan Backhuizen, 1963).
2.2 Uraian kimia
2.2.1 Senyawa Flavonoida
Flavonoida adalah suatu kelompok senyawa fenol terbesar yang ditemukan
di alam dan yang memiliki potensial sebagai antioksidan serta bioaktifitas sebagai
obat. Senyawa flavonoida sebenarnya terdapat pada semua bagian tumbuhan
termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan
flavonoida ini berada di dalam tumbuh-tumbuhan, kecuali alga. Namun ada juga
flavonoida yang terdapat pada hewan, misalnya dalam kelenjar berang-berang dan
sekresi lebah. Dalam sayap kupu - kupu dengan anggapan bahwa flavonoida
berasal dari tumbuh-tumbuhan yang menjadi makanan hewan tersebut dan tidak
dibiosintesis di dalam tubuh mereka. Penyebaran jenis flavonoida pada golongan
tumbuhan yang tersebar yaitu angiospermae, chlorophyta, fungi, bryophyta
(Markham, 1988).
Sekitar 2% dari seluruh karbon yang difotosintesis oleh tumbuhan (atau
kira-kira 1 x 109 ton/tahun) diubah menjadi flavonoida atau senyawa yang
berkaitan dengannya. Sebahagian besar tanin pun berasal dari flavonoida. Jadi
merupakan senyawa 15 karbon yang umumnya tersebar di seluruh dunia
tumbuhan. Lebih dari 2000 flavonoida yang berasal dari tumbuhan telah
diidentifikasi. Kerangka dasar flavonoida biasanya diubah sedemikian rupa
sehingga terdapat lebih banyak ikatan rangkap, menyebabkan senyawa itu dapat
menyerap cahaya tampak, dan ini yang membuatnya berwarna. Sebagian besar
flavonoida yang terdapat pada tumbuhan terikat pada molekul gula sebagai
glikosida dan dalam bentuk campuran, jarang sekali dijumpai berupa senyawa
tunggal. Disamping itu sering ditemukan campuran yang terdiri dari flavonoida
yang berbeda kelas. Misalnya antosianin dalam mahkota bunga yang berwarna
merah, ungu dan biru. Pigmen ini juga terdapat di berbagai bagian tumbuhan lain,
misalnya buah tertentu, batang, daun, dan bahkan akar. Sering flavonoida terikat
di sel epidermis. Flavonoida dalam tumbuhan mempunyai fungsi sebagai pigmen
warna. Senyawa flavonoida dalam tubuh manusia berfungsi sebagai antioksidan,
antibakteri, dan anti inflamasi sehingga baik untuk pencegahan kanker. Manfaat
lain dari flavonoida ini adalah untuk melindungi sel, meningkatkan efektivitas
vitamin C, anti inflamasi, anti bakteri, anti diabetes, diuretik dan sebagai
antibiotik (Markham, 1988).
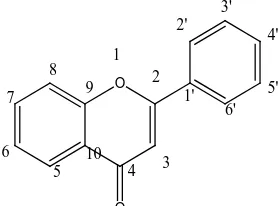
2.2.2 Struktur Dasar Senyawa Flavonoida
Senyawa flavonoida mempunyai kerangka dasar karbon yang terdiri dari
15 atom karbon, dua cincin benzen (C6) terikat pada suatu rantai propana (C3)
sehingga bentuk susunan C6 –C3 – C6 (Markham, 1988). Struktur dasar
C C C
Gambar 1. Kerangka dasar senyawa flavonoida
2.2.3 Biosintesa dari Flavonoida
Pola biosintesa flavonoida pertama kali disarankan oleh Birch. Menurut
Birch, pada tahap-tahap pertama dari biosintesa flavonoida suatu unit C6-C3
berkombinasi dengan tiga unit C2 menghasilkan unit C6-C3-(C2 + C2 + C2).
Kerangka C15 yang dihasilkan dari kombinasi ini telah mengandung gugus-gugus
fungsi oksigen pada posisi-posisi yang diperlukan. Adapun cincin A dari struktur
flavonoida berasal dari jalur poliketida, yakni kondensasi dari tiga unit asetat atau
malonat, sedangkan cincin B dan tiga atom karbon dari rantai propan berasal dari
jalur fenilpropanoid (jalur shkimat). Dengan demikian, kerangka dasar karbon
dari flavonoida dihasilkan dari kombinasi antara dua jalur biosintesa yang utama
untuk cincin aromatik, yakni jalur shkimat dan jalur asetat malonat (Harbone,
1987).
Senyawa-senyawa flavonoida terdapat dalam semua bagian tumbuhan
tinggi, seperti bunga, daun, ranting, buah, kayu, kulit kayu, dan akar. Akan tetapi,
senyawa flavonoida tertentu seringkali terkonsentrasi dalam suatu jaringan
tertentu, misalnya antosianidin adalah zat warna dari bunga, buah dan daun.
Sebagian besar dari flavonoida alam ditemukan dalam bentuk glikosida, dimana
unit flavonoida terikat pada suatu gula. Oleh karena itu, ada baiknya bila pada
kesempatan ini diingatkan kembali bahwa secara umum, suatu glikosida adalah
ikatan glikosida. Pada prinsipnya ikatan glikosida terbentuk apabila gugus
hidroksil dari alkohol beradisi kepada gugus karbonil dari gula (Harbone, 1987).
Pada hidrolisa oleh asam, suatu glikosida terurai kembali atas komponen-
komponennya menghasilkan gula dan alkohol yang sebanding, dan alkohol yang
dihasilkan ini disebut aglikon. Lazimnya, residu gula dari glikosida flavonoida
alam ialah glukosa, ramnosa, galaktosa, dan gentibiosa sehingga glikosida
tersebut masing-masing disebut glukosida, ramnosida, galaktosida dan
gentiobiosida. Flavonoida dapat ditemukan sebagai mono, di atau triglikosida,
dimana satu, dua atau tiga gugus hidroksil dalam molekul flavonoida terikat oleh
gula. Poliglikosida larut dalam air dan hanya sedikit larut dalam pelarut-pelarut
organik seperti eter, benzen, klorofom, dan aseton. Dari segi struktur,
senyawa-senyawa flavonoida turunan flavon dapat dianggap sebagai 2-arilkromon. Oleh
sebab itu, sebagaimana kromon dan kumarin, flavonoid dapat dideteksi
berdasarkan warnanya dibawah sinar tampak atau sinar ultraviolet. Oleh karena
itu, karakterisasi flavonoida akhir-akhir ini lazimnya dilakukan dengan
pengukuran-pengukuran spektrofotometri (Harbone, 1987).
2.2.4 Klasifikasi Senyawa Flavonoida
Flavonoida merupakan senyawa metabolit sekunder yang terdapat pada
tanaman hijau kecuali alga. Flavonoida yang lazim ditemukan pada tumbuhan
tingkat tinggi (angiospermae) adalah flavon dan flavonol dengan C- dan O-
glikosida, isoflavon C dan O-glikosida dan dihidrokhalkon, proantosinidin dan
antosianin. Golongan flavon, flavonol, khalkon, flavanon, dan isoflavon juga
sering ditemukan dalam bentuk aglikonnya. Istilah flavonoida diberikan untuk
senyawa-senyawa fenol yang berasal dari kata flavon, yaitu nama dari salah satu
flavonoid yang terbesar jumlahnya dalam tumbuhan. Senyawa-senyawa flavon ini
karbon yang terikat pada cincin B dari 1,3-diarilpropana dihubungkan oleh
jembatan oksigen sehingga membentuk cincin heterosiklik yang baru (cincin C).
Senyawa-senyawa flavonoida terdiri dari beberapa jenis, tergantung pada tingkat
oksidasi dari rantai propan dari sistem 1,3 diarilpropana. Dalam hal ini, flavon
mempunyai tingkat oksidasi yang terendah sehingga senyawa ini dianggap
sebagai senyawa induk dalam tatanama senyawa-senyawa turunan flavon. Dari
berbagai jenis flavonoid tersebut, flavon, flavonol, dan antosianin adalah jenis
yang banyak ditemukan di alam, sehingga seringkali dinyatakan sebagai
flavonoida utama. Sedangkan jenis-jenis flavonoida yang tersebar di alam dalam
jumlah yang terbatas ialah khalkon, flavanon dan leukoantosianidin. Flavonoida
mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita
serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak,
umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida
(Harborne, 1987).
Flavonoida biasanya terdapat sebagai O-glikosida, pada senyawa tersebut
satu gugus hidroksil flavonoida (atau lebih) terikat pada satu gula dengan ikatan
hemiasetal yang tidak tahan asam. Pengaruh glikosilasi menyebabkan flavonoida
menjadi kurang reaktif dan lebih mudah larut dalam air (cairan). Sifat terakhir ini
memungkinkan penyimpanan flavonoida di dalam vakuol sel. Walaupun gugus
hidroksil pada setiap posisi dalam inti flavonoida dapat diglikosilasi. Glukosa
merupakan gula yang sangat penting umum terlibat, walaupun galaktosa,
ramnosa, xilosa dan arabinosa sering juga terdapat. Gula lain yang kadang-kadang
ditemukan ialah alosa, manosa, fruktosa, apiosa dan asam glukuronat serta
Gula juga terikat pada atom karbon flavonoida dan dalam hal ini gula
tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon
yang tidak tahan asam. Glikosida yang demikian disebut C-glikosida. Sekarang
gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8
dalam inti flavonoida. Jenis gula yang terlibat ternyata jauh lebih sedikit daripada
jenis gula pada O-glikosida, biasanya dari jenis glukosa yang paling umum
(misalnya viteksin, orientin), dan juga galaktosa (misalnya apigenin 8-C
galaktosida), ramnosa (misalnya violantin), xilosa (misalnya visenin -1) dan
arabinosa. Jenis aglikon flavonoida yang terlibat juga sangat terbatas. Walaupun
isoflavon, flavanon, dan flavonol kadang-kadang terdapat dalam bentuk
C-glikosida, sebegitu jauh hanya flavon C- glikosida yang paling lazim ditemukan
(Markham, 1988).
Selain itu flavonoida dapat dikelompokkan berdasarkan keragaman pada
rantai C3 yaitu:
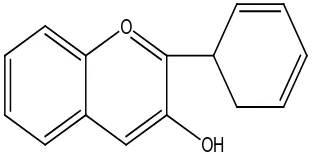
a. Flavonol
Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida,
dan aglikon flavonol yang umum yaitu kamferol, kuersetin, dan mirisetin yang
berkhasiat sebagai antioksidan dan anti inflamasi. Flavonol lain yang terdapat di
alam bebas kebanyakan merupakan variasi struktur sederhana dari flavonol.
Larutan flavonol dalam suasana basa dioksidasi oleh udara tetapi tidak begitu
cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan
O
O
OH
Gambar 3. Struktur flavonol
b. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat
gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi,
serta reaksi warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit
daripada jenis glikosida pada flavonol. Flavon stabil terhadap asam kuat dan
eternya yang mudah didealkilasi dengan penambahan HI atau HBr, atau dengan
aluminium klorida dalam pelarut inert. Flavon yang paling umum dijumpai adalah
apigenin dan luteolin. Luteolin merupakan zat warna yang pertama kali dipakai di
Eropa. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang
terikat pada gula melalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida.
Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoid
(Harborne, 1987).
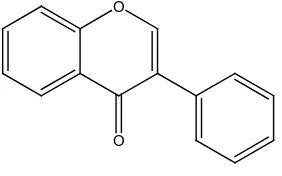
c. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan
sebagai fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan
sebagai pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena
reaksinya tidak khas dengan pereaksi warna manapun. Beberapa isoflavon
(misalnya daidzein) memberikan warna biru muda cemerlang dengan sinar UV
bila diuapi amonia, tetapi kebanyakan yang lain tampak sebagai bercak
lembayung yang pudar dengan amonia berubah menjadi coklat (Harborne, 1987).
O
O
Gambar 5. Struktur Isoflavon
d. Flavanon
Flavanon (biasanya sebagai glikosida) terdistribusi luas di alam. Flavanon
terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan
konstituen utama dari tanaman genus prenus dan buah jeruk. Dua glikosida yang
paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan
jeruk (Harborne, 1987).
O
O
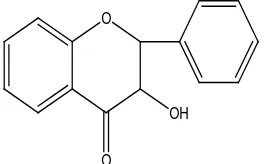
e. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit
sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini
diabaikan karena konsentrasinya rendah dan tidak berwarna (Harborne, 1987).
O
O
OH
Gambar 7. Struktur flavanonol
f. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan
berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental
Uncaria gambir dan daun teh kering yang mengandung kira-kira 30% senyawa
ini. Katekin berkhasiat sebagai antioksidan (Harborne, 1987).
O
Gambar 8. Struktur katekin
7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tan warna, terutama terdapat pada
tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya
O
HO OH
OH
Gambar 9. Struktur leukoantosianidin
8. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar
luas dalam tumbuhan. Pigmen yng berwarna kuat dan larut dalam air ini adalah
penyebab hampir semua warna merah jambu, merah marak , ungu, dan biru dalam
daun, bunga, dan buah pada tumbuhan tinggi. Secara kimia semua antosianin
merupakan turunan suatu struktur aromatik tunggal yaitu sianidin, dan semuanya
terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus
hidroksil atau dengan metilasi atau glikosilasi. Antosianin ini umumnya tidak
terdapat di lumut hati, ganggang, dan tumbuhan tingkat rendah lainnya, walaupun
beberapa antosianin dan flavonoida ada di lumut tertentu. Antosianin jarang
ditemui di gimnospermae, walaupun gimnospermae mengandung jenis lain dari
flavonoida (Harborne, 1987).
O
OH
Gambar 10. Struktur antosianin
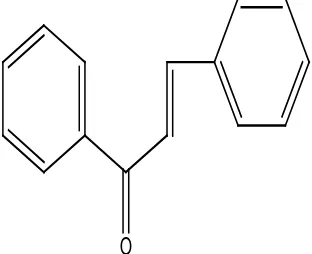
9. Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat kuat dengan
glikosidanya, karena hanya pigmen dalam bentuk glikosida yang dapat bergerak
pada kromatografi kertas dalam pengembang air (Harborne, 1987).
O
Gambar 11. Struktur khalkon
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu
dan briofita. Dalam larutan basa senyawa ini berwarna merah ros dan tampak pada
kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning
kuat berubah menjadi merah jingga bila diberi uap amonia (Harborne, 1987).
O
C H
O
Gambar 12. Struktur auron
2.3 Metode Ekstraksi
Ekstraksi adalah suatu kegiatan penelitian kandungan kimia yang dapat
larut sehingga terpisah dari bahan yang tidak dapat larut sehingga menggunakan
Ada beberapa cara ekstraksi menggunakan pelarut antara lain:
1. Cara dingin
a. Maserasi
Maserasi adalah proses pengekstraksian simplisia menggunakan pelarut
dengan beberapa kali pengadukan dan pendiaman pada temperatur ruangan.
Sedangkan remaserasi adalah pengulangan penambahan pelarut setelah dilakukan
penyaringan maserat pertama dan seterusnya (Ditjen POM, 1979).
b. Perkolasi
Perkolasi adalah ekstraksi menggunakan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan, serbuk simplisia
yang akan diperkolasi tidak langsung dimasukkan kedalam bejana perkolator,
tetapi dibasahi atau dimaserasi terlebih dahulu dengan cairan penyari
sekurang-kurangnya 3 jam. Bila serbuk simplisia tersebut langsung dialiri dengan cairan
penyari, maka cairan penyari tidak dapat menembus ke seluruh sel dengan
sempurna (Ditjen POM, 1979).
2. Cara panas
a. Refluks
Refluks adalah ekstraksi menggunakan pelarut pada temperatur titik
didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingan balik (Ditjen POM, 1979).
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru,
jumlah pelarut relatif konstan dengan adanya pendingin balik (Ditjen POM,
1979).
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar) yaitu secara umum
dilakukan pada temperatur 40-500C (Ditjen POM, 1979).
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980C)
selama waktu tertentu (15-20 menit) (Ditjen POM, 1979).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (≥ 30 0C) dan temperatur
sampai titik didih air (Ditjen POM, 1979).
2.4 Kromatografi
Kromatrografi adalah metode pemeriksaan berdasarkan proses migrasi
dari komponen-komponen senyawa diantara dua fase yaitu fase diam dan fase
gerak. Fase gerak membawa zat terlarut melalui media sehingga terpisah dari zat
terlarut lainnya yang terelusi lebih awal atau lebih akhir. Umumnya zat terlarut
dibawa melalui media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas.
Fase diam dapat bertindak sebagai penyerap, seperti alumina dan slika gel atau
dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam
dan fase gerak. Dalam proses ini suatu lapisan cairan pada penyangga yang inert
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari
fase diam, yang dapat berupa zat padat atau zat cair. Jika fase diam berupa zat
padat disebut kromatografi serapan, jika berupa zat cair disebut kromatografi
partisi. Karena fase gerak dapat berupa zat cair atau gas maka terdapat empat
macam sistem kromatografi, yaitu :
1. Fase gerak cair-fase diam dan padat (kromatografi serapan) :
• Kromatografi lapis tipis
• Kromatografi kolom
2. Fase gerak gas-fase diam padat :
• Kromatografi gas padat
3. Fase gerak cair-fase diam cair (kromatografi partisi) :
• Kromatografi kertas
4. Fase gerak gas-fase diam cair :
• kromatografi gas cair
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa
senyawa-senyawa yang dipisahkan terdistribusi diantara fase gerak dan fase diam
dalam perbandingan yang sangat berbeda-beda dari satu senyawa terhadap
senyawa yang lain (Sastrohamidjojo, 1991).
Kromatografi kertas merupakan kromatografi partisi dimana fase geraknya
adalah cair yang disokong oleh molekul-molekul selulosa dari kertas. Kertas yang
digunakan adalah kertas Whatman No.1 dan kertas yang lebih tebal Whatman No.
3 biasanya untuk pemisahan campuran dalam jumlah yang lebih besar karena
Fase gerak yang digunakan biasanya campuran dari suatu komponen
organik yang utama air dan berbagai tambahan seperti asam-asam, basa atau
pereaksi-pereaksi kompleks dengan tujuan untuk memperbesar kelarutan dari
beberapa senyawa atau untuk mengurangi kelarutan yang lainnya
(Sastrohamidjojo, 1991). Fase gerak terdiri dari satu atau beberapa pelarut dan
bila diperlukan dapat menggunakan sistem pelarut multi komponen, berupa suatu
campuran sederhana mungkin yang terdiri atas maksimum tiga komponen. Pada
pemisahan senyawa organik selalu menggunakan pelarut campur, tujuannya untuk
memperoleh polaritas yang tepat sehinga diperoleh pemisahan senyawa yang baik.
Kombinasi pelarut berdasarkan atas polaritas masing-masing pelarut sehingga
dengan demikian diperoleh sistem penggabung yang cocok (Stahl, 1985).
Jarak pengembang senyawa pada kromatogram biasanya dinyatakan
dengan harga Rf (Stahl, 1985).
Rf = Jarak perambatan bercak dari titik pentotolan
Jarak perambatan pelarut dari titik pentotolan
Jarak yang ditempuh oleh tiap bercak dari titik pentotolan diukur dari
pusat bercak dan harga Rf berada antara 0,00–1,00. Harga Rf sangat beguna untuk
mengidentifikasi suatu senyawa (Eaton, 1989).
Faktor-faktor yang mempengaruhi harga Rf adalah sebagai berikut:
(Sastrohamidjojo, 1991).
1. Struktur kimia senyawa yang dipisahkan
2. Sifat penyerap
3. Tebal dan kerataan lapisan penyerap
4. Pelarut dan drajat kemurniannya
6. Teknik percobaan
7. Jumlah cuplikan yang digunakan
Menurut Sastrohamidjojo (1991), kromatografi kertas dapat
dikembangkan dengan cara:
1. Menurun (desendens)
Dilakukan dengan membiarkan fase gerak merambat turun pada kertas
kromatografi, kertas digantungkan dalam bejana menggunakan batang kaca dan
batang kaca lain menahan ujung atas kertas yang tercelup dalam fase gerak.
Setelah bejana ditutup, fase gerak dibiarkan merambat turun pada kertas.
2. Menaik (esendens)
Kertas digantung pada penggantung berbentuk kail yang dipasang pada
penutup bejana kromatografi. Pelarut diletakkan pada bagian bawah dari bejana
lalu ujung bawah kertas dicelupkan ke dalam fase gerak sehingga fase gerak
merambat naik pada kertas.
3. Mendatar
Kertas yang digunakan berbentuk bulat dan ditengahnya diberi lubang
tempat untuk meletakkan sumbu yang terbuat dari gulungan kertas atau benag.
Fase gerak akan naik membasahi kertas dan merambat melingkar memisahkan
senyawa yang ditotolkan.
Kromatografi kertas merupakan metode yang paling sering digunakan
dalam hal analisis senyawa polar (flavonoida). Untuk tujuan isolasi, hanya
memerlukan sejumlah bahan yang sedikit. Komponen senyawa flavonoid
umumnya mudah dipelajari dengan metode kromatografi karena sifatnya yang
kromatografi kertas yaitu senyawa flavonoida dapat menghasilkan warna alami
dari berbagi komponen senyawa bila dilihat dibawah sinar ultraviolet yang mudah
diamati pada kertas. Kedua, tekniknya mudah dipelajari, memberikan hasil yang
cepat dan memerlukan peralatan yang tidak mahal. Selain itu, metode
kromatografi kertas merupakan cara terbaik untuk mengidentifikasi campuran
senyawa flavonoida dengan jumlah yang sedikit (Geissman, 1962).
2.5 Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet adalah suatu metode spektrofotometri serapan
dengan cara mengukur serapan radiasi elektromagnetik suatu larutan pada panjang
gelombang tertentu. Spktrum ultraviolet digambarkan sebagai hubungan antara
panjang gelombang (frekuensi serapan) dengan insensitas serapan (transmitansi
atau absorbansi) (Sastrohamidjojo, 1985).
Apabila suatu molekul menyerap radiasi ultraviolet, maka didalam
molekul tersebut terjadi perpindahan atau tranmisi tingkat energi elektron-elektron
ikatan di orbital molekul paling luar dari tingkat energi yang lebih mudah (orbital
ikatan π) ketingkat energi yang lebih tinggi (orbital anti ikatan π*). Keuntungan
dari serapan ultraviolet adalah selektifnya dimana gugus-gugus yang khas dapat
dikenal dalam molekul-molekul yang sangat kompleks. Serapan molekul didalam
daerah ultraviolet bergantung pada struktur elektronik dari molekul, apabila suatu
molekul menyerap radiasi ultraviolet, di dalam molekul terjadi perpindahan
tingkat energi elektron-elektron ikatan pada orbital molekul paling luar dari
tingkat energi yang lebih rendah ketingkat energi yang lebih tinggi (Noerdin,
2.5.1 Pereaksi Geser (Shift Reagent)
Spektrofotometri UV adalah cara yang paling berguna untuk menganalisis
struktur flavonoida, biasanya ditentukan dalam larutan dengan pelarut metanol
atau etanol. Spektrum senyawa flavonoida terdiri atas dua pita absorbsi
maksimum, yaitu pita I pada rentang 300-550 nm dan pita II pada 240-285 nm.
Pita I menunjukkan absorbsi sistem benzoil pada cincin A (Markham, 1988).
Kedudukan gugus hidroksi fenol bebas pada inti flavonoida dapat
ditentukan dengan menambahkan pereaksi geser ke dalam larutan cuplikan dan
mengamati puncak serapan yang terjadi (Markham, 1988). Langkah pertama yang
dilakukan dalam menafsirkan spektrum yaitu menentukan jenis flavonoida dengan
memperhatikan:
1. Bentuk umum spektrum dalam metanol
2. Panjang gelombang pita serapan
3. Data kromatografi kertas
Langkah kedua adalah memperhatikan arti perubahan spektrum yang
disebabkan oleh penembahan berbagai pereaksi geser (Markham, 1988).
2.5.2 Spektrum Natrium Metoksida
Natrium metoksida merupakan basa kuat yang dapat mengionisasi hampir
semua gugus hidroksi pada inti flavonoida. Spektrum ini biasanya merupakan
petunjuk sidik jari pola hidroksilasi dan juga bermanfaat untuk mendeteksi gugus
hidroksi yang lebih asam dan tidak tersubstitusi. Degradasi atau pengurangan
kekuatan spektrum setelah waktu tertentu merupakan petunjuk baik akan adanya
gugus yang peka terhadap basa. Pereaksi pengganti natrium metoksida yang
2.5.3 Spektrum AlCl3 dan AlCl3/ HCl
AlCl3 membentuk kompleks tahan asam dengan gugus hidroksi (pada C3
atau C5) dan keton, juga membentuk kompleks tak tahan asam dengan gugus
orto-dihidroksi, sehingga dapat digunakan untuk mendeteksi kedua gugus
tersebut. Spektrum AlCl3/HCl hanya berguna untuk mendeteksi gugus hidroksi
yang bertetangga dengan gugus keton, karena gugus tersebut dengan AlCl3 akan
membentuk senyawa kompleks yang tahan asam (Mabry dkk, 1970).
2.5.4 Spektrum Natrium Asetat
Natrium asetat hanya menyebabkan pengionan yang berarti pada gugus
hidroksil flavonoida yang paling asam. Jadi natrium asetat digunakan terutama
untuk mendeteksi adanya gugus 7-hidroksil bebas (atau yang setara) (Mabry dkk,
BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental berdasarkan
rancangan acak lengkap, yang meliputi pengumpulan, identifikasi, pengolahan
sampel, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, analisis
kromatografi, uji kemurnian isolat dan identifikasi hasil isolasi yang diperoleh.
Penelitian ini dilakukan di Laboratorium Fitokimia dan Laboratorium Penelitian,
Fakultas Farmasi, Universitas Sumatera Utara, Medan.
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat gelas
laboratorium, aluminium foil, neraca kasar (O’Haus), neraca listrik (Vibra AJ),
blender (Philips), lemari pengering buatan, penangas air, oven listrik (Fisher
scientific), seperangkat alat penetapan kadar air, seperangkat alat refluks,
seperangakat alat destilasi, tanur, desikator, hot plate (Fissons), krus porselin,
cawan porselin berdasar rata, cawan porselin, mikroskop (Olympus), kaca objek,
kaca penutup, krus tang, labu bersumbat, mortir, stamper, sapatula, termometer
(Pyrex) seperangkat alat perkolasi, rotary evaporator (Buchi 461), freeze dryer
(Edward), bejana kromatografi, sinar lampu UV 366 nm (Camag), botol
penyemprot, lemari pendingin (Karl Kolb), spektrofotometer ultraviolet-visibel
(Shimadzu UV-1800), dan spektrofotometer IR/Fourier Transform Infra Red
3.1.2 Bahan-bahan
Bahan tumbuhan yang digunakan adalah kulit batang ingul (Toona
sinensis korteks). Bahan kimia yang digunakan berkualitas pro analisis kecuali
dinyatakan lain adalah etanol (Merck), n-heksana (Merck), etilasetat (Merck),
isopropanol (Merck), toluena (Merck), benzena (Merck), n-butanol (Merck) , amil
alkohol (Merck), asam klorida pekat (Merck), asam sulfat pekat (Merck), asam
asetat anhidrida (Merck), asam asetat (Merck), aluminium (III) klorida (Merck),
besi (III) klorida (Merck), raksa (II) klorida (Merck), natrium hidroksida (Merck),
timbal (II) asetat (Merck), natrium asetat (Merck), kalium iodida (Merck), iodium
(Merck), asam nitrat pekat (Merck), bismut (III) nitrat (Merck), serbuk
magnesium, α-nafto (Merck), kloralhidrat, asam borat, etanol 96% (hasil destilasi)
(CV. Rudang Jaya), air suling (CV. Rudang Jaya), aluminium klorida 5%
(Merck), kertas Whatmann No. 1 dan kertas Whatmann No. 3.
3.2 Pengumpulan dan Penyiapan Simplisia
3.2.1 Pengumpulan Sampel
Pengumpulan dilakukan secara purposif, yaitu tanpa membandingkan
tumbuhan serupa dari daerah lain. Bahan penelitian ini adalah kulit batang ingul
yang diambil dari halaman belakang Gereja Batak Karo Protestan (GBKP) di
Desa Kampung Dalam, Kecamatan Kabanjahe, Kabupaten Karo, Sumatera Utara.
Kulit batang ingul yang diambil adalah kulit batang dari pohon ingul yang sudah
besar dan tua dengan diameter batang kurang lebih 80 cm dan tinggi pohon ingul
kurang lebih 20 meter. Gambar tumbuhan segar dapat dilihat pada Lampiran 2,
3.2.2 Identifikasi Tanaman
Identifikasi tanaman ingul dilakukan di ”Herbarium Bogoriense” Bidang
Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI),
Bogor. Hasilnya dapat dilihat pada Lampiran 1, halaman 56.
3.2.3 Penyiapan Simplisia
Kulit batang ingul yang telah dikumpulkan dicuci di bawah air mengalir
hingga bersih, ditiriskan, lalu disebarkan di atas kertas koran polos, kemudian
ditimbang sebagai berat basah lalu dikeringkan di lemari pengering pada suhu
40oC hingga kering. Kulit batang ingul dianggap kering jika dipatahkan mudah
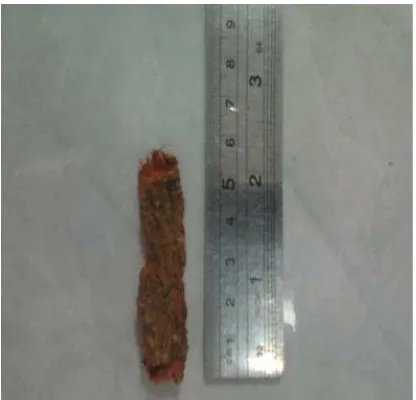
hancur, kemudian ditimbang sebagai berat kering. Simplisia kering selanjutnya
diserbuk menggunakan blender dan disimpan dalam kantung plastik sebelum
digunakan. Gambar serbuk simplisia dapat dilihat pada Lampiran 3, halaman 58.
3.3 Pembuatan Larutan Pereaksi
3.3.1 Pereaksi Mayer
Raksa (II) klorida sebanyak 1,36 g dilarutkan dalam air suling hingga 60
ml (larutan I), 5 g kalium iodida dilarutkan dalam 10 ml air suling (larutan II)
kemudian larutan I dicampur dengan larutan II dan ditambahkan air suling hingga
100 ml (Depkes, 1989).
3.3.2 Pereaksi Dragendorff
Bismut (III) nitrat sebanyak 8 g dilarutkan dalam 20 ml asam nitrat
(larutan I) dan 27,2 g kalium iodida dilarutkan dalam 50 ml air suling (larutan II),
sempurna. Diambil larutan jernih dan diencerkan dalam air secukupnya hingga
100 ml (Depkes, 1989).
3.3.3 Pereaksi Bouchardat
Kalium iodida sebanyak 4 g dilarutkan dalam 20 ml air suling sampai
kalium iodida larut dengan sempurna, lalu ditambahkan 2 g iodium sedikit demi
sedikit dan dicukupkan dengan air suling hingga 100 ml (Depkes, 1989).
3.3.4 Pereaksi Liebermann-Burchard
Sebanyak 20 bagian asam asetat anhidrat dicampur dengan satu bagian
asam sulfat pekat (Ditjen POM, 1979).
3.3.5 Pereaksi Molish
α-naftol sebanyak 3 g dilarutkan dalam asam nitrat 0,5 N secukupnya
hingga diperoleh larutan 100 ml (Ditjen POM, 1989).
3.3.6 Pereaksi Besi (III) Klorida 1% b/v
Besi (III) klorida sebanyak 1 g dilarutkan dalam air suling hingga
diperoleh larutan 100 ml (Ditjen POM, 1979).
3.3.7 Pereaksi Timbal (II) Asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas
karbondioksida hingga 100 ml (Depkes, 1989).
3.3.8 Pereaksi Asam Klorida 6 N
Asam klorida pekat sebanyak 50 ml diencerkan dalam air suling hingga
100 ml (Markham, 1988).
3.3.9 Pereaksi Asam Klorida 2 N
Asam klorida pekat sebanyak 17 ml diencerkan dalam air suling hingga
3.3.10 Pereaksi Asam Sulfat 2 N
Asam sulfat pekat sebanyak 5,5 ml diencerkan dalam air suling hingga 100
ml (Depkes, 1989).
3.3.11 Pereaksi Kloralhidrat
Kloralhidrat sebanyak 50 g dilarutkan dalam 20 ml air suling (Depkes,
1989).
3.3.12 Pereaksi Natrium Hidroksida 2 N
Natrium hidroksida sebanyak 8,002 g dilarutkan dalam air suling bebas
karbondioksida hingga diperoleh larutan 100 ml (Ditjen POM, 1979).
3.3.13 Pereaksi Aluminium Klorida 5% b/v
Aluminium (III) klorida sebanyak 5 g dilarutkan dalam metanol hingga
100 ml (Markham, 1988).
3.3.14 Pereaksi Forestal
Asam asetat – air suling – asam klorida dengan perbandingan 30 : 10 : 3
dicampur lalu didiamkan selama 15 jam (Markham, 1988).
3.3.15 Pereaksi Asam Asetat 50%
Asam asetat sebanyak 50 ml diencerkan dalam air suling hingga 100 ml,
dibiarkan selama 12 jam (Markham, 1988).
3.3.16 Pereaksi Asam Klorida 1%
Asam klorida pekat sebanyak 2,7 ml diencerkan dalam air suling hingga
100 ml, dibiarkan selama 5 jam (Markham, 1988).
3.3.17 Pereaksi Asam Klorida 5%
Asam klorida pekat sebanyak 13,5 ml diencerkan dalam air suling hingga
3.3.18 Pereaksi BAA (Butanol:Asam asetat: Air)
n-butanol – asam asetat – air suling dengan perbandingan 4 : 1 : 5
dicampur di dalam corong pisah, dibiarkan selama 17 jam sampai memisah
sempurna, kemudian diambil lapisan atas (Markham, 1988).
3.4 Penentuan Karakteristik simplisia
Penentuan karakteristik simplisia meliputi pemeriksaan makroskopik,
pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari larut air,
penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar
abu tidak larut asam (Ditjen POM, 1995; WHO, 1992).
3.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan cara memperhatikan bentuk,
ukuran, warna, bau, dan rasa simplisia kulit batang ingul.
3.4.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik serbuk simplisia dilakukan untuk mengetahui
fragmen dari simplisia dengan cara serbuk simplisia ditaburkan di atas kaca objek
yang telah ditetesi larutan kloralhidrat dan akuades dan ditutup dengan kaca
penutup kemudian diamati di mikroskop.
3.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Alat meliputi labu alas 500 ml, tabung penerima 5 ml berskala 0,05 ml, pendingin,
tabung penyambung, pemanas listrik.
Toluen 200 ml dan air suling 2 ml dimasukkan ke dalam labu alas bulat,
didestilasi selama 2 jam. Toluen didinginkan selama 30 menit dan volume air
pada tabung penerima dibaca. Serbuk simplisia sebanyak 5 g yang telah ditimbang
seksama dimasukkan ke dalam labu tersebut, lalu dipanaskan hati-hati selama 15
menit. Setelah toluen mulai mendidih, kecepatan tetesan diatur kurang lebih 2
tetes tiap detik, hingga sebagian besar air terdestilasi, kemudian kecepatan
destilasi dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian
dalam pendingin dibilas dengan toluen yang telah dijenuhkan. Destilasi
dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin
sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca.
Kadar air dihitung dalam persen (WHO, 1992). Perhitungannya dapat dilihat pada
Lampiran 4, halaman 59.
3.4.4 Penetapan Kadar Sari Larut Air
Serbuk simplisia sebanyak 5 g dimaserasi selama 24 jam dalam 100 ml air
kloroform (2,5 ml kloroform dalam air suling 1000 ml) dalam labu bersumbat
sambil sesekali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam,
lalu disaring. Diuapkan 20 ml filtrat sampai kering dalam cawan dangkal berdasar
rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC hingga
diperoleh bobot tetap, kemudian dihitung kadar sari larut air (Ditjen POM, 1995).
Perhitungannya dapat dilihat pada Lampiran 4, halaman 60.
3.4.5 Penetapan Kadar Sari Larut Etanol
Serbuk simplisia sebanyak 5 g dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama
kering dalam cawan dangkal berdasar rata yang telah ditara. Sisanya dipanaskan
dalam oven pada suhu 105oC hingga diperoleh bobot tetap, kemudian dihitung
kadar sari larut etanol (Ditjen POM, 1995). Perhitungannya dapat dilihat pada
Lampiran 4, halaman 61.
3.4.6 Penetapan Kadar Abu Total
Serbuk simplisia sebanyak 2 g yang telah digerus, ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijarkan perlahan-lahan pada suhu 550oC hingga arang habis,
lalu didinginkan dan ditimbang hingga diperoleh bobot tetap. Kemudian dihitung
kadar abu total (Ditjen POM, 1995;WHO, 1992). Perhitungannya dapat dilihat
pada Lampiran 4, halaman 62.
3.4.7 Penetapan Kadar Abu Tidak Larut Asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan
dengan 25 ml asam klorida encer selama 5 menit. Bagian yang tidak larut asam
dikumpulkan, disaring melalui kertas saring bebas abu, kemudian dicuci dengan
air panas. Residu dan kertas saring dipijarkan, didinginkan dan ditimbang hingga
diperoleh bobot tetap, kemudian dihitung kadar abu tidak larut asam (Ditjen
POM, 1995;WHO, 1992). Perhitungannya dapat dilihat pada Lampiran 4,
halaman 63.
3.5 Skrining Fitokimia
3.5.1 Pemeriksaan Flavonoida
Serbuk simplisia sebanyak 10 g ditambahkan 100 ml air panas, dididihkan
kemudian diambil 5 ml lalu ditambahkan 0,1 g serbuk magnesium, 1 ml asam
klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida
positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol
(Farnsworth, 1966).
3.5.2 Pemeriksaan Alkaloida
Serbuk simplisia sebanyak 0,5 g ditambahkan 1 ml asam klorida 2 N dan 9
ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu
disaring. Filtrat dipakai untuk percobaan berikut:
a. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua
atau tiga dari percobaan di atas (Ditjen POM,1995).
3.5.3 Pemeriksaan Saponin
Serbuk simplisia sebanyak 0,5 g dimasukkan ke dalam tabung reaksi dan
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik, jika terbentuk buih yang mantap setinggi 1-10 cm yang stabil
tidak kurang dari 10 menit dan tidak hilang dengan penambahkan 1 tetes asam
klorida 2 N, menunjukkan adanya saponin (Depkes,1989).
3.5.4 Pemeriksaan Steroida / Triterpenoida
Serbuk simplisia sebanyak 1 g dimaserasi dengan 20 ml n-heksan selama 2
jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Sisa ditambahkan 2
Liebermann-Burchard), jika timbul warna ungu atau merah kemudian berubah menjadi biru
ungu atau biru hijau menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.5.5 Pemeriksaan Glikosida
Serbuk simplisia sebanyak 3 g disari dengan 30 ml campuran etanol 95%
dengan air suling (7:3) dan 10 ml larutan asam sulfat 2 N. Direfluks selama 1 jam,
didinginkan dan disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan
25 ml timbal (II) asetat 0,4 M, dikocok, lalu didiamkan selama 5 menit dan
disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3)
dilakukan berulang-ulang sebanyak 3 kali. Kumpulan sari air diuapkan pada
temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol. Larutan
sisa dimasukkan dalam tabung reaksi, selanjutnya diuapkan di atas penangas air.
Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi Molish, kemudian
secara perlahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung.
Glikosida positif jika terbentuk cincin ungu pada batas kedua cairan
(Depkes,1989).
3.5.6 Pemeriksaan Glikosida Sianogenik
Sepuluh gram serbuk simplisia dihaluskan dalam lumpang, dilembabkan
dengan sedikit air (jangan berlebihan), dimasukkan kedalam erlenmeyer,
diselipkan kertas saring yang telah dibasahi natrium pikrat, ditutup erlenmeyer
dengan karet dan plastik, dan dibiarkan terkena sinar matahari. Adanya glikosida
sianogenik jika timbulnya warna merah pada kertas saring (Depkes 1989).
3.5.7 Pemeriksaan Glikosida Antrakinon
Sebanyak 0,2 gram serbuk simplisia ditambah 2 ml larutan FeCl3, 8 ml air,
ml benzen, dikocok, dan didiamkan. Lapisan benzen dipisahkan dan dicuci dua
kali dengan masing-masing 2 ml air sampai lapisan benzen berwarna kuning.
Dikocok lapisan benzen ini dengan 2 ml NaOH 2 N lalu didiamkan. Lapisan air
berwarna merah dan lapisan benzen tidak berwarna menunjukkan adanya
antrakinon (Depkes, 1989).
3.5.8 Pemeriksaan Tanin
Serbuk simplisia sebanyak 0,5 g disari dengan 10 ml air suling, lalu
disaring. Filtrat diencerkan dengan air suling sampai tidak berwarna. Diambil 2
ml larutan lalu ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%, jika terjadi
warna biru atau hijau kehitaman menunjukkan adanya tanin (Depkes,1989).
3.6 Pembuatan Ekstrak
Serbuk simplisia sebanyak 400 g dimasukkan ke dalam bejana tertutup dan
dibasahi dengan cairan penyari etanol 80% sampai semua simplisia terendam,
dibiarkan selama 3 jam. Massa dipindahkan sedikit demi sedikit ke dalam
perkolator, kemudian dituangi cairan penyari secukupnya sampai semua simplisia
terendam dan terdapat selapis cairan penyari di atasnya, perkolator ditutup dengan
aluminium foil dan dibiarkan selama 24 jam. Kran perkolator dibuka dan
dibiarkan tetesan ekstrak mengalir dengan kecepatan 1 ml tiap menit,
ditambahkan berulang-ulang cairan penyari secukupnya hingga selalu terdapat
selapis cairan penyari di atas simplisia. Perkolasi dihentikan setelah tetesan
perkolat terakhir tidak bereaksi lagi dengan pereaksi untuk uji senyawa golongan
flavonoida. Perkolat yang diperoleh diuapkan menggunakan rotary evaporator