TRANSFORMASI MAGNESIUM HIDROKSISITRAT MENJADI METIL ESTER HIDROKSISITRAT MENGGUNAKAN KATALIS
1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
SKRIPSI
RAHEL JULIARTA TAMBA 100802029
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
TRANSFORMASI MAGNESIUM HIDROKSISITRAT MENJADI METIL ESTER HIDROKSI MENGGUNAKAN KATALIS
1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
RAHEL JULIARTA TAMBA 100802029
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Transformasi magnesium hidroksisitrat menjadi metilester hidrksisitrat menggunakan
katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana
Kategori : Skripsi
Nama : Rahel Juliarta Tamba Nomor Induk Mahasiswa : 100802029
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, Oktober 2015
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Nimpan Bangun, M.Sc Prof. Dr. Seri Bima Sembiring, M.Sc NIP. 195012221980031002 NIP. 194907181976031001
Disetujui oleh
Departemen Kimia FMIPA USU Ketua
PERNYATAAN
TRANSFORMASI
MAGNESIUM HIDROKSISITRAT
MENJADI
METILESTER HIDROKSISITRAT MENGGUNAKAN KATALIS
1,2-DIMETIL,1,1,2,2-TETRAFENILSULFONATODISILANA
SKRIPSI
S
aya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.Medan, Oktober 2015
PENGHARGAAN
Terpujilah Tuhan Yesus Kristus yang pemilik penelitian ini, sehingga dalam pengerjaannya dan penyusunan skripsi boleh diselesaikan dengan baik.
Dengan rasa hormat penulis mengucapkan banyak terima kasih kepada Bapak Dekan Dr. Sutarman M.Sc, Ibu Dr. Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia yang telah memberikan dukungan selama penyelesaian skripsi ini. Terima kasih kepada Bapak Prof. Dr. Seri Bima Sembiring, M.Sc selaku dosen pembimbing I dan Bapak Dr. Nimpan Bangun, M.Sc selaku dosen pembimbing II yang yang telah banyak memberikan motivasi, wawasan ilmu kimia, mengajarkan keterampilan kerja maupun penulisan laporan hasil penelitian, serta dukungan dana selama penulis melakukan penelitian, kepada Bapak Dr. Mimpin Ginting, M.S selaku dosen pembimbing akademik, kepada staf dosen Lab. Kimia Anorganik serta seluruh dosen dan staf pegawai yang telah banyak memberikan bimbingan dan membantu penulis selama penulis menjalani perkuliahan.
Penulis juga ingin mengucapkan terima kasih yang sangat dalam kepada kedua orang tua ayah dan ibu tercinta H. Tamba dan M.Gultom yang sudah berjerih lelah dan penuh kasih dalam doa dan semangat yang luar biasa sampai penulis akhirnya menyelesaikan perkuliahan ini. Kepada abang Kampher Tamba (A.David), Kimura, kak Jenni, adik Sri dan Yusuf yang setiap waktu mendoakan penulis dan memberikan semangat yang luar biasa hingga akhirnya penulis menyelesaikan perkuliahan ini.
Dengan segala kerendahan hati penulis mengucapkan terima kasih kepada setiap orang yang telah banyak membantu penelitian ini, kepada glycon company, Pak Bayu (FARMASI USU), Elvira (ITB), bang Hamdan (SOCI), kepada asisten Laboratorium Anorganik. Kepada teman-teman 2010, adik 2011- 2013, Eunike , Fredy, Chika,dan Burton Simanullang terima kasih untuk setiap waktu, semangat, doa dan kebersamaan selama ini, serta kepada setiap pihak yang tidak dapat disebutkan satu persatu.
Penulis menyadari karena keterbatasan penulis sehingga skripsi ini masih jauh dari kesempurnaan. Semoga skripsi ini dapat bermanfaat bagi siapa saja yang membacanya demi kemajuan ilmu pengetahuan.
TRANSFORMASI
MAGNESIUM HIDROKSISITRAT
MENJADI
METILESTER HIDROKSISITRAT MENGGUNAKAN KATALIS
1,2-DIMETIL,1,1,2,2-TETRAFENILSULFONATODISILANA
ABSTRAK
Telah dilakukan pembuatan garam Magnesium hidroksisitrat dari bahan crude Kalium hidroksisitrat dengan penambahan larutan MgCl2 50%, campuran larutan
tersebut diuapkan pelarutnya dan diperoleh endapan Magnesium hidroksisitrat bersama pengotor. Endapan Magnesium hidroksisitrat dimurnikan dengan cara rekristalisasi menggunakan campuran etanol/air. Magnesium hidroksisitrat berwarna putih dan kadar Mg sebesar 12, 58%. Spektrum FT-IR υc=o dari garam pada bilangan
gelombang 1579 cm-1. Magnesium hidroksisitrat yang diperoleh dipakai sebagai sumber asam hidroksisitrat untuk esterifikasi dengan metanol menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana dengan pemanasan pada suhu 120 0C selama 10 jam yang menghasilkan ester trimetilhidroksisitrat dengan yield 83,75%, kemudian dikarekterisasi dengan menggunakan FT-IR, 1H-NMR, 13C-NMR. Spektrum FT-IR menunjukan υc=o ester pada 1734 cm-1. Spektrum 1H-NMR ester
trimetil hidroksisitrat ( 500MHz, CDCl3) yang diperoleh menunjukkan adanya
pergeseran kimia pada δ 4,910 ppm (1H,HO-CH), δ 4,3029 ppm (1H, HO-C-C), δ 3,833 ppm, δ 3,8092 ppm, δ 3,7681 ppm (9H, O-CH3), δ 3,0092 ppm (1H, C-HC-C), δ 3,2321 ppm dan δ 2,7755 ppm (2H, C-CH2-C). Spektrum 13C-NMR ester
trietilhidroksisitrat (125 MHz, CDCl3) yang diperoleh menunjukkan adanya pergeseran kimia pada δ 52,06 ppm (C-O-CH3), δ 53,03 ppm (C-O-CH3), δ 53,48
ppm (C-O-CH3), δ 172,08 ppm ( CH2-CO-O), δ 172,60 ppm (CH2-CO-O), δ 170,97
ppm (CH2-CO-O), δ 74,6 ppm ( HO-CH-CO), δ 79,17 ppm (HO-C-CO), 39,52 ppm (
C-CH2-CO).
TRANSFORMATION MAGNESIUM HYDROXYCITRYC TO BE
METHYL HYDROXYCITRIC ESTER USING CATALYST
1,2-DIMETHYL, 1,1,2,2-TETRAFENILSULFONATODISILANA
ABSTRACT
Magnesium salt of hydroxycitrate has been preparated from solution potassium hydroxycitrate with 50% solution of magnesium chlorida, the solvent of solution was evaporated and obtained precipitate (Mg3(HCA)2) together with impurities. The
precipitate (Mg3(HCA)2) was purified by recrystallization using ethanol/water.
Mg3(HCA)2 was characterrized using FT-IR spectra showed υc=O at wave number
1579 cm-1and Mg containing 12,58. Mg3(HC)2 obtained is used as a source of HCA
to esterification with methanol using a catalyst mixture of 1,2-dimethyl-1,1,2,2-tetrafenilsulfonatodisilana and H2SO4(p) with a heating temperature of 120 0C for 10
hours resulted in trimethyl ester with a yield of 83.75% and it was then characterrized using FT-IR, 1H-NMR, 13C-NMR. FT-IR spectra showed υc = o ester at 1734 cm-1. 1
H-NMR spectrum hydroxycitric trimethyl hydroxycitrate ester (500MHz, CDCl3) obtained showed a chemical shift in δ 4,910 ppm (1H,HO-CH), δ 4,3029 ppm (1H, HO-C-C), δ 3,833 ppm, δ 3,8092 ppm, δ 3,7681 ppm (9H, O-CH3), δ 3,0092 ppm
(1H, C-HC-C), δ 3,2321 ppm dan δ 2,7755 ppm (2H, C-CH2-C). 13C-NMR spectra
trimethyl hydroxycitrate ester (125 MHz, CDCl3) obtained showed chemical shifts at
δ 172.60 ppm (C-CO-O), δ 172.08 ppm (C-CO-O), δ 170.97 ppm (C-CO-O), δ 79.17 ppm (HO-C-CO), δ 74, 6 ppm (HO-CH-CO), δ 53, 48 ppm (CO-CH3), δ 53.03 ppm
(CO-CH3), δ 52.06 ppm (CO-CH3), 39.52 ppm (C-CH2-CO).
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi viii
Daftar Gambar x
Daftar Singkatan xi
Daftar Lampiran xii Bab 1. Pendahuluan 1.1. Latar Belakang 1
1.2. Permasalahan 4
1.3. Tujuan Penelitian 5
1.4. Manfaat Penelitian 5
1.5. Lokasi Penelitian 5
1.6. Metodologi Penelitian 6
Bab 2. Tinjauan Pustaka 2.1. Asam Hidroksi Sitrat 7
2.1.1. Turunan Asam HidroksiSitrat 8
2.1.1.1. Garam-Garam Hidroksisitrat 8
2.1.1.1.1. Garam Tunggal 8
2.1.1.1.2. Garam Rangkap 8
2.1.1.1.3. Tri-Penta Salt Hidroksi sitrat 10 2.1.1.2. Ester-Ester Hidroksi Sitrat 11
2.1.2. Kegunaan Asam Hidroksi Sitrat 14 2.2 Ester 15 2.2.1 Esterifikasi 15
2.3 Katalis 18
2.3.1. Katalis Homogen 18
2.3.2. Katalis Heterogen 19
2.3.3. Katalis Enzim 20 Bab 3. Metodologi Penelitian 3.1. Alat 21 3.2. Bahan 21
3.3.1. Pembuatan Magnesium HidroksiSitrat 22 3.3.2. Esterifikasi Asam Hidroksi Sitrat 22
3.4. Bagan Penelitian 23
3.4.1. Pembuatan Magnesium Hidroksisitrat 23 3.4.2. Esterifikasi Asam hidroksi Sitrat 24 Bab 4. Hasil Dan Pembahasan
4.1. Pembuatan Magnesium Hidroksisitrat 25 4.2. Esterifikasi Asam Hidroksisitrat 27
Bab 5. Kesimpulan dan Saran
5.1. Kesimpulan 32
5.2. Saran 32
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
1.1. Reaksi Kalsium Hidroksisitrat dengan H2SO4 2
1.2. Esterifikasi Asam Hidroksisitrat 2
1.3. Pembentukan Magnesium Hidroksisitrat 3
1.4. Esterifikasi Magnesium Hidroksisitrat Dengan Metanol 4
2.1. Formula Garam Rangkap 9
2.2. Formula I Garam Rangkap Asam Hidroksisitrat 9
2.3. Formula II Garam Rangkap Asam Hidroksisitrat 10
2.4. Formula III Garam Rangkap Asam Hidroksisitrat 10
2.5. Struktur Tripel salt Hidroksisitrat 10
2.6. Esterifikasi Asam Hidroksisitrat Dengan Metanol 11
2.7. Esterifikasi Kalsium Hidroksisitrat Dengan Benzil Alkohol 12
2.8. Esterifikasi Dikalium Niasin Hidroksisitrat 12
2.9. Esterifikasi Asam Hidroksisitrat Dengan Etanol 13
2.10. Pembentukan Etil Sulfat 13
2.11. Pembentukan Asam Hidroksisitrat 13
2.12. Esterifikasi Asam Hidroksisitrat dengan Etanol 14
2.13. Struktur Gugus Fungsi Ester 15
2.14. Asam Asetat Dengan Alkohol Skunder 17
2.16. Reaksi Asam Karboksilat Dengan alkohol Tersier 18
4.1. Reaksi Pembentukan Garam Magnesium Hidroksisitrat 27
4.2. Spektrum FT-IR Magnesium Hidroksisitrat 27
4.3. Reaksi Esterifikasi Magnesium Hidroksisitrat denfan Metanol 28
4.4. Spektrum FT-IR Trimetilhidroksisitrat 39
4.5. Spektrum 1H-NMR Ester Trimetilhidroksisitrat 30
DAFTAR SINGKATAN
Mg3(HCA)2= Magnesium Hydroxycitrate
HCA = Hydroxycitrate Acid
FT-IR = Fourier Transform – Infra Red
HPLC = High Performance Liquid Chromatography SSA = Spektroskopi Serapan Atom
1
HNMR = 1Proton – Nuclear Magnetic Resonance
13
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
TRANSFORMASI
MAGNESIUM HIDROKSISITRAT
MENJADI
METILESTER HIDROKSISITRAT MENGGUNAKAN KATALIS
1,2-DIMETIL,1,1,2,2-TETRAFENILSULFONATODISILANA
ABSTRAK
Telah dilakukan pembuatan garam Magnesium hidroksisitrat dari bahan crude Kalium hidroksisitrat dengan penambahan larutan MgCl2 50%, campuran larutan
tersebut diuapkan pelarutnya dan diperoleh endapan Magnesium hidroksisitrat bersama pengotor. Endapan Magnesium hidroksisitrat dimurnikan dengan cara rekristalisasi menggunakan campuran etanol/air. Magnesium hidroksisitrat berwarna putih dan kadar Mg sebesar 12, 58%. Spektrum FT-IR υc=o dari garam pada bilangan
gelombang 1579 cm-1. Magnesium hidroksisitrat yang diperoleh dipakai sebagai sumber asam hidroksisitrat untuk esterifikasi dengan metanol menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana dengan pemanasan pada suhu 120 0C selama 10 jam yang menghasilkan ester trimetilhidroksisitrat dengan yield 83,75%, kemudian dikarekterisasi dengan menggunakan FT-IR, 1H-NMR, 13C-NMR. Spektrum FT-IR menunjukan υc=o ester pada 1734 cm-1. Spektrum 1H-NMR ester
trimetil hidroksisitrat ( 500MHz, CDCl3) yang diperoleh menunjukkan adanya
pergeseran kimia pada δ 4,910 ppm (1H,HO-CH), δ 4,3029 ppm (1H, HO-C-C), δ 3,833 ppm, δ 3,8092 ppm, δ 3,7681 ppm (9H, O-CH3), δ 3,0092 ppm (1H, C-HC-C), δ 3,2321 ppm dan δ 2,7755 ppm (2H, C-CH2-C). Spektrum 13C-NMR ester
trietilhidroksisitrat (125 MHz, CDCl3) yang diperoleh menunjukkan adanya pergeseran kimia pada δ 52,06 ppm (C-O-CH3), δ 53,03 ppm (C-O-CH3), δ 53,48
ppm (C-O-CH3), δ 172,08 ppm ( CH2-CO-O), δ 172,60 ppm (CH2-CO-O), δ 170,97
ppm (CH2-CO-O), δ 74,6 ppm ( HO-CH-CO), δ 79,17 ppm (HO-C-CO), 39,52 ppm (
C-CH2-CO).
TRANSFORMATION MAGNESIUM HYDROXYCITRYC TO BE
METHYL HYDROXYCITRIC ESTER USING CATALYST
1,2-DIMETHYL, 1,1,2,2-TETRAFENILSULFONATODISILANA
ABSTRACT
Magnesium salt of hydroxycitrate has been preparated from solution potassium hydroxycitrate with 50% solution of magnesium chlorida, the solvent of solution was evaporated and obtained precipitate (Mg3(HCA)2) together with impurities. The
precipitate (Mg3(HCA)2) was purified by recrystallization using ethanol/water.
Mg3(HCA)2 was characterrized using FT-IR spectra showed υc=O at wave number
1579 cm-1and Mg containing 12,58. Mg3(HC)2 obtained is used as a source of HCA
to esterification with methanol using a catalyst mixture of 1,2-dimethyl-1,1,2,2-tetrafenilsulfonatodisilana and H2SO4(p) with a heating temperature of 120 0C for 10
hours resulted in trimethyl ester with a yield of 83.75% and it was then characterrized using FT-IR, 1H-NMR, 13C-NMR. FT-IR spectra showed υc = o ester at 1734 cm-1. 1
H-NMR spectrum hydroxycitric trimethyl hydroxycitrate ester (500MHz, CDCl3) obtained showed a chemical shift in δ 4,910 ppm (1H,HO-CH), δ 4,3029 ppm (1H, HO-C-C), δ 3,833 ppm, δ 3,8092 ppm, δ 3,7681 ppm (9H, O-CH3), δ 3,0092 ppm
(1H, C-HC-C), δ 3,2321 ppm dan δ 2,7755 ppm (2H, C-CH2-C). 13C-NMR spectra
trimethyl hydroxycitrate ester (125 MHz, CDCl3) obtained showed chemical shifts at
δ 172.60 ppm (C-CO-O), δ 172.08 ppm (C-CO-O), δ 170.97 ppm (C-CO-O), δ 79.17 ppm (HO-C-CO), δ 74, 6 ppm (HO-CH-CO), δ 53, 48 ppm (CO-CH3), δ 53.03 ppm
(CO-CH3), δ 52.06 ppm (CO-CH3), 39.52 ppm (C-CH2-CO).
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Asam hidroksisitrat telah diketahui memiliki banyak kegunaan, beberapa diantaranya yaitu untuk mengobati obesitas, menaikkan berat badan, mengatasi kelaparan, hiperlipemia dan lipemia posprandial lipemia (Bangun,2008). Asam hidroksisitrat dapat diperoleh dari tumbuhan Genus Garcinia Cambogia dengan kadar 33-54% (Jena,2002). Asam ini dapat diperoleh dengan mengubah bentuknya menjadi garam, seperti kalsium hidroksisitrat, magnesium hidroksisitrat dan dalam bentuk esternya. Hal ini disebabkan asam hidroksisitrat memiliki sifat yang tidak stabil karena bersetimbang dengan lakton (Gokarju, G. 2007), sehingga tidak dapat diisolasi.
Selain asam hidroksisitrat ester hidroksisitrat juga diketahui memiliki banyak kegunaan yaitu sebagai anti mikroba, anti bakteri, anti jamur (Mackeen, 2000), campuran kosmetik dan pembersih kulit (Kamachi,H. 2007), mengurangi bau badan (Gupta, 2007), anti tumor, anti oksidan dan anti keracunan sel (Mackeen, 2012).
Esterifikasi asam hidroksisitrat telah dilakukan dengan cara mereaksikan asam hidroksisitrat dengan metanol menggunakan katalis H2SO4 pekat pada suhu 60 0C
selama 2 jam menghasilkan ester dimetil hidroksisitrat (Hida,2005). Selain itu Kamachi dalam patent nya (2007) telah melaporkan esterifikasi asam hidroksisitrat menggunakan kalsium hidroksisitrat sebagai prekursor dengan benzil alkohol dan asam toluensulfonat sebagai katalis dan toluene sebagai pelarut. Campuran ini direfluks selama 4 jam dan menghasilkan ester tribenzil hidroksi sitrat.
Fantoso (2014) telah mengesterifikasi asam hidroksisitrat yang terbentuk secara in situ dari kalsium hidroksisitrat dengan H2SO4(p), dengan etanol dan dipanaskan
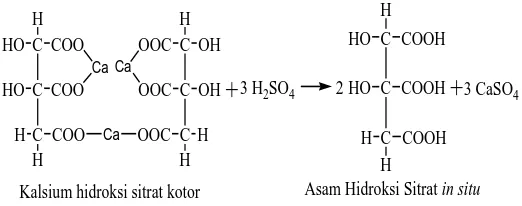
membentuk asam hidroksisitrat secara in situ dapat dilihat dari Gambar 1.1 di bawah
Asam Hidroksi Sitrat in situ Kalsium hidroksi sitrat kotor
Gambar 1.1. Reaksi antara kalsium hidroksisitratdengan H2SO4 (Fantoso,2014)
Dan reaksi pembentukan ester trimetil hidroksi sitrat dapat dilihat pada Gambar 1.2 dibawah ini:
Asam Hidroksi Sitrat Trietil Hidroksi Sitrat (yield 17,56%)
Gambar 1.2. Reaksi pebentukan ester trimetil hidroksisitrat (Fantoso, 2010) Oleh kerena itu untuk membuat ester yang murni perlu pembuatan garam hidroksi sitrat yang murni. Pemurnian garam hidroksi sitrat dapat dilakukan dengan cara rekristalisasi. Garam kalsium hidroksisitrat tidak larut dalam air sehingga tidak dapat direkristalisasi dengan air, tetapi garam Magnesium hidroksisitrat dapat larut dalam air.
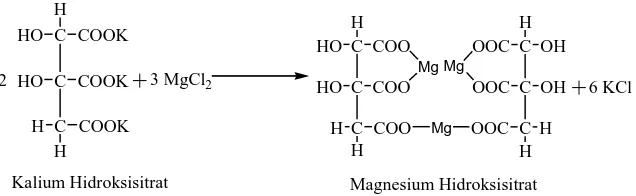
Sehingga dibuat garam magnesium hidroksisitrat. Garam Magnesium hidroksisitrat dapat dibuat dengan mereaksikan larutan kalium hiroksi sitrat dengan larutan MgCl2 .
C
Kalium Hidroksisitrat Magnesium Hidroksisitrat
Gambar 1.3 Reaksi pembentukan magnesium hidroksi sitrat.
Untuk memperoleh ester dengan yield yang tinggi, diperlukan penggunaan katalis asam. Pada umumnya katalis yang digunakan adalah asam sulfat, tetapi kelemahan katalis ini dapat menimbulkan korosi pada reaktor, pencemaran lingkungan, dan tidak dapat digunakan kembali sehingga harga produk menjadi lebih mahal ( Basumatary,2013). Oleh karena itu katalis padat dengan gugus fungsi asam sulfonat telah banyak dikembangkan karena gugus asam sulfonat memiliki aktivitas katalitik yang tinggi (Voort,dkk, 2013).
Bangun,dkk (2015) baru-baru ini telah mensintesis katalis berfase padat turunan dari silana yang tersubsitusi dengan gugus fenilsulfonat yaitu tetrafenilsulfonatodisilana (DMTPS) dengan cara mensulfonasi 1,2-dimetil-1,1,2,2-tetrafenildisilana. Katalis ini memiliki kestabilan termal sangat baik, dapat digunakan pada suhu tinggi yang bersifat reusable dan mampu mengkatalisis reaksi esterifikasi asam karboksilat rantai panjang dengan alkohol primer dan skunder. Esterifikasi asam-asam lemak tinggi seperti asam palmitat dan stearat dengan alkohol primer (metanol) maupun skunder (2-butanol dan 2-propanol) dengan menggunakan katalis DMTPS dan diperoleh yield yang cukup baik antara 48%-86,1%. Selain itu, reaksi transesterifikasi CPO berkadar asam lemak bebas 7,82% dengan metanol juga telah dilakukan dengan katalis yang sama dan menghasilkan yield yang sangat baik yaitu 95,9% (Bangun,dkk. 2015).
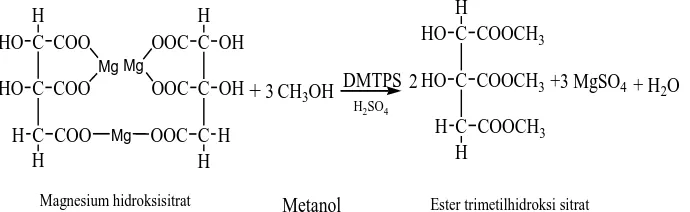
Oleh karena itu,katalis DMTPS digunakan pada esterifikasi garam magnesium hidroksisitrat dengan metanol. Karena garam Magnesium hidroksisitrat tidak larut didalam metanol, maka kedalam campuran reaksi ditambahkan sedikit H2SO4(p),
C
Magnesium hidroksisitrat Metanol Ester trimetilhidroksi sitrat
+3 MgSO4
3 2
Gambar 1.4. Reaksi esterifikasi magnesium hidroksi sitrat dengan metanol menggunakan katalis DMTPS.
1.2 Permasalan
1. Asam hidroksi sitrat dari buah Cambogia sukar diperoleh karena bersetimbang dengan lakton. Kalsium hidroksisitrat yang diperoleh sukar larut dalam air, sehingga tidak dapat dimurnikan.
2. Oleh karena itu untuk mengatasi masalah tersebut, dibuat garam Magnesium hidroksisitrat yang larut dalam air sehingga mudah dimurnikan dengan rekristalisasi. Kristal magnesium hidroksisitrat murni dibuat sebagai sumber asam hidroksisitrat untuk diesterifiksi dengan metanol untuk memperoleh ester trimetilhidrokisitrat dengan menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana.
1.3 Tujuan Penelitian
1. Untuk memperoleh garam magnesium hidroksi sitrat yang murni sebagai sumber asam hidroksisitrat murni.
1.1Manfaat Penelitian
Penelitian mengenai pemurnian asam hidroksi sitrat dan esterifikasi asam hidroksi sitrat masih sedikit , sehingga hasil penelitian ini diharapkan dapat menambah informasi mengenai cara esterifikasi asam hidroksi sitrat dan karakterisasinya.
1.2Lokasi Penelitian
Penelitian ini di lakukan di Laboratorium Kimia Anorganik FMIPA USU, Medan. Analisa FT-IR di lakukan di PT SOCI MAS Medan
Analisa SSA dilakukan di Laboratorium BARISTAN Medan
Analisa NMR dilakukan di laboratorium Kimia Organik ITB, Bandung
1.3Metodologi Penelitian
Ada 2 zat yang di buat dalam penelitian ini:
1. Pembuatan Magnesium Hidroksisitrat
Kalium hidroksi sitrat kasar berupa sirup pH larutan 1% = 10 diencerkan dengan akuades, kemudian dipanaskan, lalu di tambahkan larutan MgCl2
50% sampai pH = antara 6-7. Campuran larutan tersebut di uapkan pelarut nya hingga ¾ bagian yang menguap. Dalam kondisi dingin diperoleh magnesium hidroksisitrat. Kristal Magnesium hidroksisitrat yang diperoleh di
Garam magnesium hidroksisitrat diperoleh putih dan dikarakterisasi. Analisa FT-IR dilakukan untuk melihat gugus fungsi pada garam magnesium hidroksisitrat, analisa AAS untuk mengetahui kadar Mg dalam garam
magnesium hidroksisitrat.
2. Esterifikasi Asam Hidroksisitrat dengan Metanol
Metanol kering di campurkan dengan asam sulfat, magnesium hidroksi sitrat dan katalis DMTPS, campuran tersebut di panaskan pada suhu 120 0C selama 10 jam sambil di aduk. Kemudian dari campuran reaksi diisolasi esternya menggunakan pelarut diklorometana dan dimurnikan dengan mengekstraksi menggunakan n-heksan/etanol. Ester yang diperoleh dianalisa. Analisa FT-IR untuk mengetahui terbentuknya ester. Analisa 1H-NMR dan 13C-NMR dilakukan untuk mengetahui proton dan karbon pada ester yang diperoleh.
BAB 2
TINJAUAN PUSTAKA
2.1 Asam Hidroksi Sitrat
Asam hidroksi sitrat sering di sebut asam garcinia karena salah satu kandungan utama pada tumbuhan genus Garcinia adalah asam hidroksi sitrat (Mackeen, 2012). Pada kulit tumbuhan spesis Garcinia selain mengandung asam hidroksi sitrat sebagai kandungan utama nya (23-54%) terdapat juga asam hidroksi sitrat lakton (6-20%) (Moffet,1997) dan asam-asam lain nya yang pada umumnya adalah asam sitrat (~30%) (Jena,2002).
dipekatkan dengan alkohol kemudian dinetralkan dengan basa alkali ( Lewis dkk, 1965), selain itu dengan mengekstraksi tanaman Rosella ( Hibiscus Sabdariffa L) menggunakan pelarut aseton dan methanol dan diikuti dengan rekristalisasi (Baitii, 2009) dan dapat juga dilakukan dengan menggunakan mikroorganisme Bacilus Megaterium dan Steptomyces (Hida, 2005).
Beberapa sifat fisik asam hidroksi sitrat yaitu memiliki titik lebur 178 0C , larut dalam air, alkohol dan sedikit larut dalam eter, memiliki sifat hidroskopis yang sangat tinggi. Selain itu asam hidroksi sitrat memiliki sifat yang kurang stabil dalam bentuk yang bebas, sehingga dapat berubah bentuk menjadi lakton selama adanya pemekatan dan penguapan. Asam hidroksi sitrat stabil dalam bentuk lakton, garam dan dalam bentuk ester (Jena,2002).
2.1.1 Turunan Asam Hidroksi Sitrat
Asam hidroksi sitrat yang dalam bentuk bebas tidak stabil maka di buat kebentuk garam-garam nya atau pun dalam bentuk ester nya.
2.1.1.1 Garam – garam Hidroksi Sitrat
Garam-garam hidroksi sitrat sudah banyak di sintesis, dalam bentuk garam tunggal, garam rangkap dan garam, garam tripel, tetra dan peta logam yang berbeda.
2.1.1.1.1 Garam Tunggal
Berapa garam tunggal dapat di buat, seperti kalsium hidroksi sitrat dan magnesium hidroksi sitrat, dan kalium hidroksi sitrat (Jena, 2002). Sudah dilakukan pembuatan garam kalsium hidroksi sitrat, memiliki sifat sifat tidak larut dalam air. Pembuatan nya dengan cara menambahkan kalsium hidroksida ke dalam ekstrak asam hidroksisitrat dengan kondisi netral pH=7 (Samuel, 2004), di buat juga dengan penambahan larutan CaCl2 40% pH= 9 (Fantosa, 2014).Garam magnesium hidroksi
larutan MgCl2 0.5M dalam pelarut etanol dan dengan penambahan polyvinyl
polypyrrolidone (Shrivastava, 2001).
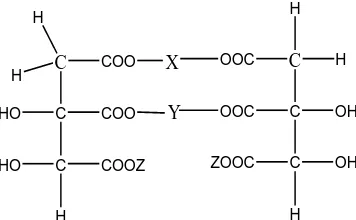
2.1.1.1.2 Garam Rangkap (Memiliki Dua Logam Berbeda)
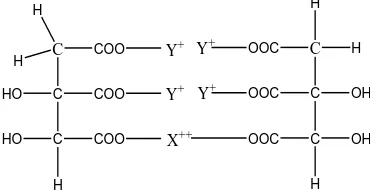
Garam rangkap hidroksisitrat memiliki dua logam yang berbeda. Logam– logam tersebut dapat dibentuk dari logam golongan IA dan IIA. Logam golongan IA seperti Li atau Na atau K atau Rb atau Cs atau Fr. Dan logam golongan IIA seperti Be, Mg, Ca, Sr, Ba atau Ra. Dengan formula yang di bentuk X (logam golongan IA) memiliki konsentrasi 1.5-51% dan Y (logam golongan IIA) memiliki konsentrasi 2.0-50.9% dan konsentrasi dari asam hidroksi sitrat dalam jenis garam nya 31.0-93.0%.
Pembuatan garam rangkap dengan logam X dan Y dimana logam X yang di tambahkan adalah dalam bentuk garam hidroksi dan logam Y yang di tambahkan adalah dalam bentuk garam klorida nya, dan pengendapan yang di lakukan dengan menggunakan pelarut yang bersifat polar dan akan menghasilkan garam rangkap yang bentuk serbuk yang larut dalam air. Bentuk umum yang di temukan (Balasubramanyam,2002) dapat dilihat pada Gambar 2.1 sebagai berikut :
C COO
-Gambar 2.1 Formula Garam Rangkap
Dan formula yang lain di temukan oleh Moffet (2013) sebagai brikut:
C COO
Dan formula II (Moffet,2013) dapat dilihat pada Gambar dibawah ini:
Gambar 2.3 Formula II garam rangkap Asam Hidroksisitrat Dan dapat juga dibuat pada formula III seperti Gambar dibawah ini:
C COO
Gambar 2.4 Formula III garam rangkap Asam Hidroksisitrat
2.1.1.1.3 Tri-tetra-penta Salt Hidroksisitrat
Garam ini (tripel salt hidroksisitrat) dibentuk pada formula sebagai berikut:
C COO
Gambar 2.5 Stuktur tripel salt Hidroksi Sitrat (Gokarju,2007)
larutan magnesium karbonat kemudian kalsium hidroksida dan kalium hidroksida dengan proses pemanasan dan akhir reaksi diperoeh pH = 7. Pembuatan tetra-penta salt hidroksi sitrat juga dapat dilakukan dengan metode yang sama seperti pebuatan tripel salt hidroksi sitrat (Gokarju, 2007).
2.1.1.2 Ester -Ester Hidroksi Sitrat
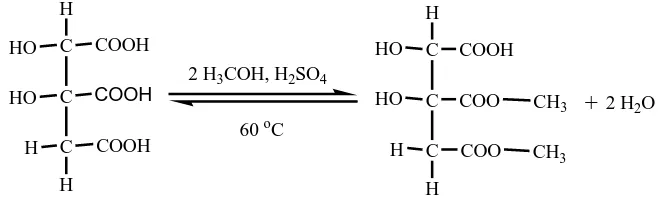
Sudah ada beberapa macam ester dari asam hidroksi sitrat yang disintesis, seperti: dimetil hidroksi sitrat, tribenzil hidroksi sitrat, dikalium niasin hidroksisitrat, dan dibutil-metil hidroksi sitrat dan trietil hidroksi sitrat.
Esterifikasi pembuatan dimetil hidroksi sitrat telah dilakukan dengan cara mereaksikan asam hidroksi sitrat dengan metanol pada suhu 60 0C selama 2 jam (Hida, 2005). Pada penelitian itu hanya ada dua gugus asam karboksilat yang teresterikasi. Reaksi yang terjadi dapat dilihat pada Gambar 2.6 seperti dibawah ini.:
C
Gambar 2.6. Reaksi Esterifikasi Asam hidroksisitrat dengan Metanol.
C
Gambar 2.7. Reaksi Esterifikasi Kalsium Hidroksisitrat dengan Benzil Alkohol.
Dikalium niasin hidroksi sitrat diperoleh dengan cara mereaksikan kalium hidroksi sitrat dengan niacin dan HCl pada Gambar 2.8 dibawah ini (Gupta, 2007).
Gambar 2.8 Reaksi Pembentukan Ester Dikalium Niasin Hidroksi Sitrat Dibutil-metil hidroksi sitrat diperoleh dengan mereaksikan ekstrak metanol buah kering G. atroviridis dengan n-butanol pada Gambar 2.9 dibawah ini (Mackeen, 2002).
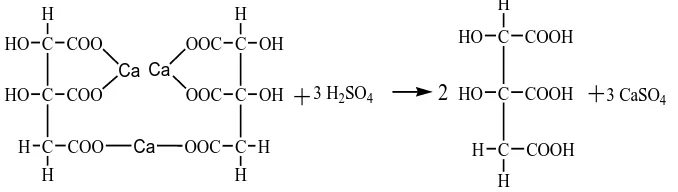
Gambar 2.9. Reaksi Esterifikasi Asam hidroksisitrat Dengan butanol Trietil hidroksi sitrat dibuat dengan mereaksikan asam hidroksi sitrat dari garam kalsium hidroksi sitrat secara in situ dengan menggunakan H2SO4 dalam
cairan kental kuning bening dengan yield 17,56% dan beberapa campuran asam organik lain nya (Fantoso, 2014). Reaksi pertama terjadi pembentukan etil sulfat pada Gambar 2.10 dibawah ini.
+
+
H2SO4 (p) C2H5-O-SO3HC2H5OH H2O
Gambar 2.10. Reaksi Pembentukan Etil Sulfat
Kemudian pembentukan asam hidroksi sitrat dengan asam sulfat yang terjadi secara in situ, sepert Gambar 2.11 dibawah ini.
C
Gambar 2.11. Reaksi pembentukan asam hidroksi sitrat
Dan reaksi esterifikasi asam hidroksi sitrat dengan etil sulfat dapat dilihat pada Gambar 2.12 berikut:
3 C2H5-O-SO3H
Gambar 2.12. Reaksi Esterifikasi Asam Hidroksi Sitrat dengan etil sulfat
2.1.2 Kegunaan Asam Hidroksi Sitrat dan Turunan nya
Asam hidroksi sitrat dan turunannya memiliki banyak kegunaan. Asam hidroksi sitrat telah diketahui memiliki banyak kegunaan, beberapa diantaranya yaitu untuk mengobati obesitas, menaikkan berat badan, mengatasi kelaparan, hiperlipemia, posprandial lipemia (Bangun,2008), sebagai bahan pengawet makanan, perasa,
mengubah sitrat dan koenzim A kebentuk oksalaasetat dan asetil koenzim A (Gokarju, 2010), mengontrol berat badan, meningkatkan oksidasi lemak menjadi energi, menurunkan indeks massa tubuh, menurunkan nafsu makan, meningkatkan kolesterol HDL(Bagchi,2008), dan penurun kolesterol LDL yang potensial (Kim,2011).
Garam – garam turunan asam hidroksisitrat berfungsi untuk mengontrol dan mencegah peradangan (Clouatre, 2013), sebagai suplemen gizi dalam minuman, mengkontrol obesitas (Balasubramanyam,2000), antistres, antilelah, regenarasi sel, mengurangi sintesis kolesterol dan menghambat penimbunan lemak di dalam sel otot polos vascular (Shrivastava, 2001). Sedangkan ester hidroksisitrat memiliki banyak kegunaan yaitu sebagai campuran kosmetik dan pembersih kulit (Kamachi 2007), anti tumor, anti oksidan, anti keracunan sel (Mackeen, 2012), mengurangi bau badan (Gupta, 2007), anti mikroba, anti bakteri, anti jamur (Mackeen, 2000).
2.2 Ester
Ester adalah senyawa organik yang memiliki karakteristik gugus fungsi sebagai berikut (Stoker, 1991):
C
RII O
O RI
Gambar 2.11 Struktur gugus fungsi Ester
2.2.1 Esterifikasi
Esterifikasi adalah proses pembuatan ester. Esterifikasi dapat dilakukan dengan berbagai cara dan menggunakan bermacam – macam katalis.
Esterifikasi dapat dilakukan dengan mereaksikan asam karboksilat dengan alkohol dan menggunakan asam sebagai katalis, dapat berupa asam sulfat maupun asam klorida (Fessenden, 1986) atau pun RSO3H, dan H3PO4 sebagai katalis
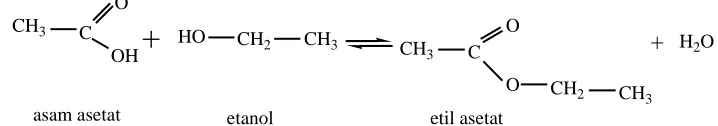
homogen (Nowicki, 2013). Reaksi esterifikasi yang sederhana di buat yaiitu dengan mereaksikan asam asetat dengan etanol menghasilkan etil asetat dengan air (Gambar 2.12).
CH3
O
OH
C HO
CH2 CH
3
CH3 C O CH2 CH3
+
O
+ H2O
asam asetat etanol etil asetat
Gambar 2.12. Reaksi Asam asetat dengan Alkohol menghasilkan etil asetat. Karena reaksi esterifikasi bersifat reversible, maka untuk memperoleh rendemen tinggi dari ester, kesetimbangan harus di geser kearah sisi ester. Salah satu teknik yang di gunakan adalah menggunakan salah satu zat pereaksi yang berlebih dan teknik lain nya yaitu membuang salah satu produk dari dalam campuran pereaksi. Misalnya, dengan menghilangkan air (Fessenden, 1989). Pada umumnya, zat pereaksi yang di gunakan berlebih adalah alkohol. Hal ini di karenakan alkohol dengan air dapat membentuk campuran heteroazeotrop, sehingga air tersebut dapat di hilangkan (Nowocki,2013). Untuk menghilangkan air yang terbentuk dapat juga di gunakan asam sulfat pekat, hal ini di sebabkan karena asam sulfat pekat bersifat hidroskopis (Austin, 1966).
Reaksi antara alkohol dengan asam karboksilat dapat berlangsung tergantung struktur kedua nya.
Kereaktifan alkohol berikut membentuk ester:
CH3OH > Alkohol primer > Alkohol skunder > alkohol tersier
O
asam karboksilat tersier butanol ester tersier butil karboksilat
H3C
Sebagai contoh esterifikasi asam hidroksi sitrat dengan alkohol primer misalnya dengan mereaksikan asam asetat dengan etanol menghasilkan etil asetat (Stoker, S.2008). Dimana diketahui bahwa etil asetat dapat dipergunakan sebagai pelarut (Reaksi 2.8).
Esterifikasi asam karboksilat dengan alkohol skunder sebagai contoh reaksi antara asam butirat dengan 2-heksanol menghasilkan 2-heksil butirat dapat dilihat pada Gambar 2.13 dibawah ini (Romero, 2011).
O
asam butirat 2-heksanol 2-heksil butirat OH
C4H9 C CH3
H
Gambar 2.13. Reaksi Asam Karboksilat dengan Alkohol Skunder.
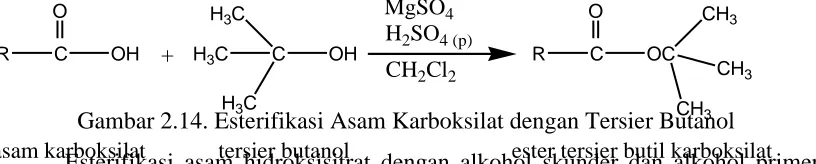
Reaksi asam karboksilat dengan alkohol tersier sebagi contoh yaitu reaksi antara asam karboksilat dengan tersier butanol. Cara yang dilakukan yaitu dahulu diawali dengan dehidrasi tersier butanol menjadi isobutilena yang diikuti dengan adisi asam karboksilat menghasilkan ester tersier butil karboksilat. Reaksi dapat dilihat pada Gambar 2.14 dibawah ini.seperti (Otera,2003) .
Gambar 2.14. Esterifikasi Asam Karboksilat dengan Tersier Butanol
Esterifikasi asam hidroksisitrat dengan alkohol skunder dan alkohol primer pada umumnya lebih sulit dilakukan karena adanya halangan sterik yang lebih besar dari alkohol primer (Nowicki, 2013).
Katalis merupakan suatu senyawa yang dapat meningkatkan laju reaksi tetapi tidak ikut terkonsumsi oleh reaksi. Katalis digunakan secara luas baik di laboratorium dan industri (Shriver & Atkins, 1999 ).
Suatu katalis biasanya bekerja dengan membentuk ikatan kimia ke satu atau lebih pereaksi yang kemudian dapat membantu konversi dari pereaksi menjadi produk. Katalis tidak mempengaruhi kesetimbangan reaksi. Penjelasan kimia dari proses katalisis secara kualitatif diberikan melalui mekanisme reaksi (Gates, 1991).
Katalis pada dasarnya dapat dibagi menjadi tiga bagian, yaitu: katalisis homogen, katalisis heterogen, dan katalisis enzim.
2.3.1. Katalis Homogen
Pada sistem katalisis homogen, katalis mempunyai fasa yang sama dengan reaktan dan produk reaksi (Istadi,2011), katalis homogeny juga dapat dibagi menjadi katalis asam dan katalis basa. Katalis asam homogen umumnya digunakan adalah H2SO4,
HCl, dan H3PO4. Akan tetapi penggunaan katalis ini memerlukan waktu reaksi yang
lama, dapat menyebabkan korosi pada reaktor yang digunakan, rasio molar alkohol dengan minyak harus besar serta memerlukan suhu yang tinggi (Helwani, 2009).
Cara kerja katalis homogen umumnya melibatkan pembentukan senyawa kompleks antara yang bersifat tidak stabil dalam tahap – tahap reaksi. Katalis dengan reaktan membentuk kompleks antara yang mengakibatkan reaktan dalam kompleks menjadi aktif membentuk produk baru dan disertai dengan pelepasan katalisatornya (Sugiyarto,2003). Kerugian katalis homogen adalah sulit untuk dipisahkan dari produk dan biayanya mahal. Katalis homogen juga dapat menyebabkan korosi dan pencemaran lingkungan (Gates, dkk.,1979).
2.3.2. Katalis Heterogen
pendopingan oksida logam untuk meningkatkan kebasaannya seperti oksida logam Na, Li, dan K yang didoping pada CaO, MgO dan BaO (D’Cruz, 2007) dan oksida campuran antara oksida logam Na, Li, dan La2O3 (Singh dan Fernando 2009).
Selain katalis heterogen basa, banyak juga katalis heterogen asam yang dapat digunakan untuk reaksi esterifikasi. Katalis senyawa karbon berbasis sulfonat menjadi katalis yang paling diminati saat ini karena memiliki gugus –SO3H dengan
kerangka karbon yang stabil dan memiliki aktifitas katalitik yang ( Voort,dkk, 2013). Kiss, dkk (2006) telah meneliti penggunaan resin penukar ion sebagai katalis reaksi esterifikasiyaitu Amberlyst-15 dan Nafion-NR50. Dari hasil yang diperoleh, diketahui bahwa kedua katalis ini meskipun memiliki banyak gugus sulfonat, namun kedua resin tersebut menunjukkan ketidakstabilan selama proses reaksi. Kedua katalis ini menunjukkan aktivitas awal yang cukup tinggi, tapi katalis Amberlyst-15 setelah 2 jam reaksi menjadi tidak aktif, sedangkan katalis Nafion-NR50 setelah 4,5 jam reaksi. Hal ini membuat kedua katalis resin tersebut tidak dapat digunakan secara terus-menerus dalam proses industri. Disamping itu, harga kedua katalis tersebut sangat mahal.
Sidabutar (2011) telah menggunakan katalis padat polistirena sulfonat dengan derajat sulfonasi 6,24% pada reaksi transesterifikasi minyak jarak berkadar asam lemak bebas tinggi menghasilkan metil ester sebesar 93%. Namun katalis ini tidak tahan terhadap suhu tinggi dan mudah terdegradasi.
Bangun,dkk (2015) baru-baru ini telah mensintesis katalis berfase padat turunan dari silana yang tersubsitusi dengan gugus fenil sulfonat yaitu 1,1,2,2-tetrafenilsulfonatodisilana (DMTPS) dengan cara mensulfonasi 1,2-dimetil-1,1,2,2-tetrafenildisilana. Katalis ini memiliki kestabilan termal sangat baik, dapat digunakan pada suhu tinggi yang bersifat reusable dan mampu mengkatalisis reaksi esterifikasi asam karboksilat rantai panjang dengan alkohol primer dan skunder.
antara alkohol dengan minyak atau lemak akan semakin besar sehingga tidak perlu menggunakan co-solvent seperti dietil eter dan benzen.
2.3.3. Katalis Enzim
Enzim adalah molekul-molekul protein dengan ukuran koloid yang berada diantara ranah homogen molekular dan heterogen makroskopik. Enzim merupakan gaya penggerak di dalam reaksi-reaksi biokimia. Biasanya enzim merupakan katalis yang sangat efisien dan selektif. Sebagai contoh, reaksi dekomposisi H2O2 yang
dikatalisasi oleh enzim catalase adalah lebih cepat 109 kali daripada dikatalisasi oleh katalis anorganik (Istadi,2011).
Banyak reaksi yang dikatalisis enzim berlangsung di dalam sel biologis. Di dalam sitoplasma terkandung larutan biologis dengan banyak molekul, termasuk reaktan, produk, dan enzim di dalam larutan. Karakteristik khusus Enzim memiliki struktur yang fleksibel. Sifat fleksibel ini sangat penting dalam mengkatalisis reaksi. Sebagai contoh, ikatan reaktan dengan enzim dapat dibuat menjadi kecil tetapi perubahan signifikan dalam geometri bagian katalitik, seperti hasil dari pembatasan pembelahan, pemutusan antara enzim dan intermediet katalitik lebih baik daripada pemutusan antara enzim dan reaktan.
BAB 3
METODE PENELITIAN
3.1 Alat-alat
− Thermo Control
− Indikator Universal Macherey Nagel
− Lemari Pendingin UHF-200T Uchida
− Neraca Digital AS 220/C/2 Radwag
− Spektrometer 13C-NMR Agilent
− Spektrometer FT-IR Agilent
− Spektrometer Serapan Atom Z-2000 Hitachi
− Spektrofotometer HPLC Agilent
3.2 Bahan-bahan
− Larutan Kalium Hidroksi Sitrat kasar Glycon Company
− Larutan MgCl2 50% p.a Merck
− Metanol Kering p.a Merck
− H2SO4pekat p.a. Merck
− Diklorometan p.a. Merck
− Na2SO4 anhidrat p.a. Merck
− n-heksan Teknis
− NaCl jenuh p.a Merck
− Etanol Teknis
3.3 Prsedur Percobaan
3.3.1 Pembuatan Magnesium Hidroksi Sitrat
Kalium hidroksisitrat kasar berupa sirup pH larutan 1% = 10 diencerkan dengan akuades, kemudian dipanaskan, lalu ditambahkan larutan MgCl2 50% sampai
pH = antara 6-7. Campuran larutan tersebut diuapkan pelarut nya hingga ¾ bagian yang menguap. Dalam kondisi dingin diperoleh magnesium hidroksisitrat kotor. Kristal Magnesium hidroksisitrat yang diperoleh direkristalisasi menggunakan campuran air/etanol. Garam magnesium hidroksisitrat diperoleh putih kemudian dikarakterisasi. Analisa FT-IR dilakukan untuk mengetahui terbentuknya garam magnesium hidroksisitrat, analisa AAS untuk mengetahui kadar Mg dalam garam
Magnesium hidroksisitrat.
Kedalam autoclave dimasukkan 110,42 ml metanol kering, 3,382 ml H2SO4(P)
dalam kondisi dingin sambil diaduk. Kemudian ditambahkan 10 gram magnesium hidroksi sitrat, dan 0.297 gram katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana kemudian dipanaskan sambil diaduk pada suhu 120 0C selama 10 jam. Produk rekasi kemudian disaring. Filtrat ditambahkan NaCl jenuh dan diekstraksi menggunakan diklorometan sampai tiga kali. Kemudian diklorometan didestilasi. Crude ester yang diperoleh kemudian diekstraksi menggunakan etanol:n-heksan. Pelarut diuapkan dan divakum. Ester trimetil hidroksisitrat kemudian dikarekterisasi menggunakan FT-IR,
1
H-NMR, dan 13C-NMR.
3.4 Bagan Penelitian
500 gram kalium hidroksisitrat kasar
Diencerkan dengan 500 ml aquadest Dipanaskan
Ditambahkan laruan MgCl2 50% hingga pH = antara 6-7
Dipanaskan pada suhu 120 0C sampai larutan tinggal sepertiga bagian Didinginkan selama 1 malam
Endapan
Direkristalisasi hingga putih
Kristal Magnesium Hidroksisitrat putih
Dianalisa FT-IR, SSA Hasil
Filtrat Disaring
110,42ml metanol kering
dimasukkan kedalam autoclave ditambahkan 3,382ml H2SO4(P)
ditambahkan o,297 gram DMTPS
dipanaskan sambil di aduk pada suhu 120 0C selama 10 jam
Campuran Hasil Reaksi
Filtrat Endapan
ditambahkan NaCl jenuh
di ekstraksi dengan diklorometan sebanyak 3kali
Fraksi diklorometan
dianalisa dengan, FT-IR,1H-NMR, 13C-NMR
dicuci ditambahkan 10gram Magnesium hidroksisitrat
divakum
Trimetil Hidroksisitrat
Hasil
di destilasi pelarut
crude ester
endapan di cuci dengan diklorometan
diklorometan di keringkan
katalis
BAB 4
Penelitian ini dilakukan untuk memperoleh ester hidroksisitrat yang dibuat dengan cara mengesterifikasi asam hidroksisitrat dengan metanol. Namun, asam hidroksisitrat murni sulit diperoleh. Oleh karena itu, terlebih dahulu itu dibuat garam magnesium hidroksisitrat yang murni sebagai sumber asam hidroksisitrat yang akan diesterifikasi dengan metanol menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana.
4.1 Pembuatan Magnesium Hidroksi Sitrat
Pembuatan Magnesium hidroksisitrat dilakukan dengan cara mereaksikan larutan kalium hidroksisitrat berkadar 40,4% dengan larutan MgCl2 50% pada pH = antara
6-7 dan terjadi reaksi seperti Gambar 4.1. Setelah reaksi berlangsung sempurna, pelarut diuapkan sebagian sampai terbentuk endapan Magnesium hidroksisitrat, kemudian endapannya disaring. Endapan magnesium hidroksisitrat tersebut diperoleh bersama zat pengotor berwarna hitam, kemudian endapan magnesium hidroksisitrat tersebut direkristalisasi menggunakan campuran etanol/air hingga diperoleh kristal Magnesium hidroksisitrat berwarna putih. Reaksi yang terjadi seperti Gambar 4.1 dibawah ini.
Kalium hidroksisitrat Magnesium hidroksisitrat
2
Gambar 4.1. Reaksi Pembentuan Garam Magnesium Hidroksi sitrat
perhitungan tersebut diketahui bahwa magnesium hidroksisitrat yang diperoleh murni.
Untuk melihat terbentuknya garam magnesium hidroksisitrat, dilakukan analisis dengan FT-IR. Spektrum FT-IR dari produk reaksi diatas ditunjukkan pada Gambar 4.2 di bawah ini.
Gambar 4.2 Spektrum FT-IR Magnesium Hidroksisitrat
Spektrum FT-IR dari produk reaksi tesebut menunjukkan adanya 4 (empat) pita serapan masing-masing panjang gelombang 3287 cm-1,1579 cm-1,1391 cm-1, dan 1093 cm-1.
Pita serapan pada bilangan gelombang υO-H 3287 cm-1 disebabkan oleh gugus
O-H dari garam magnesium hidroksisitrat dan pita serapan bilangan gelombang υc-o
1093 cm-1 diberikan oleh gugus C-O alkohol dari hidroksisitrat. Ini menunjukkan bahwa senyawa tersebut mengandung gugus hidroksil. Demikian juga dengan pita
serapan pada υC=O asimetris 1579 cm-1 diberikan oleh gugus karbonil dari garam magnesium hidroksi sitrat yang juga disertai pita serapan υC-O simetris 1391 cm-1. Ini
menunjukkan bahwa Magnesium hidroksisitrat telah terbentuk dan dapat dibandingkan dengan spectrum FT-IR garam kalium hidroksisitrat yang diperoleh Majeed, 2004 dilampiran 1 yang menunjukkan pada bilangan gelombang υC=O 1617
cm-1 dari karbonil garam kalium telah bergeser pada bilangan gelombang υC=O 1579
4.2 Esterifikasi Asam Hidroksisitrat
Reaksi esterifikasi asam hidroksisitrat yang diperoleh dari reaksi diatas dengan metanol dan H2SO4(p) menggunakan katalis DMTPS dilakukan pada suhu 120 0C
selama 10 jam reaksi yang terjadi dapat dilihat seperti Gambar dibawah ini.
Gambar 4.3 Reaksi Esterifikasi Magnesium Hidroksi Sitrat dengan Metanol Ester yang terbentuk diekstraksi dari campuran hasil reaksi dengan diklorometana. Larutan ester dalam diklorometana masih mngandung katalis sebagai pengotor. Selanjutnya diklorometana diuapkan dan cairan yang diperoleh dilarutkan dengan etanol, dan esternya diekstraksi kembali dari larutan etanol dengan n-heksana, kemudian heksana diuapkan dan diperoleh ester trimetilhidroksisitrat berwarna kuning bening.
Gambar 4.4 Spektrum FT-IR Produk Reaksi Esterifikasi
Spektrum FT-IR dari produk reaksi tersebut menunjukkan adanya pita serapan pada bilangan gelombang 3287 cm-1, 2961 cm-1, 1734 cm-1, 1441 cm-1, 1207 cm-1, 1207 cm-1, 849 cm-1.
Pita serapan pada bilangan gelombang υO-H 3287 cm-1 yang diberikan oleh
gugus O-H dan pita serapan pada bilangan geolombang υC-O 1184 cm-1 menunjukkan
C-O alkohol. Kedua pita serapan tersebut menunjukkan adanya gugus hidroksil pada senyawa yang dianalisa. Pada pita serapan pada bilangan gelombang υC-H 2961 cm-1
yang diberikan oleh gugus C-H dari CH3. Demikian juga pada pita serapan bilangan gelombang υC=O 1734 cm-1 yang bergeser sebesar 155 cm-1 dari υC=O garam
magnesium hidroksisitrat (υC=O 1579 cm-1 ) menunjukkan telah terbentuknya ester
trimetilhidroksisitrat didukung oleh adanya pita serapan pada bilangan gelombang 1207 cm-1 dari υC-O-C dari karbonil. Tekukan CH2 ditunjukkan pada bilangan
gelombang 1441 cm-1 yang didukung oleh pita serapan pada bilangan gelombang 849 cm-1 yang menunjukkan vibrasi tekukan roking CH2.
Spektrum 1H-NMR produk reaksi esterifikasi tersebut yang di run pada frekuensi 500MHz dan pelarut CDCl3 ditunjukkan pada Gambar 4.3 dibawah ini.
Spektrum 1H-NMR menunjukkan adanya pergeseran kimia pada δ 4,9108 ppm, 4,3029 ppm, δ 3,8338 ppm, 3,8092 ppm, 3,7681 ppm, δ 3,0092 ppm, δ 3,2321 ppm
dan δ 2,7755 ppm.
Pada pergeseran kimia pada δ 4,9108 ppm yang diberikan oleh gugus OH alkohol skunder (1H, HO-CH) a, pada pergeseran kimia δ 4,3029 ppm yang diberikan oleh gugus OH tersier (1H, HO-C-) b, pada pergeseran kimia δ 3,8338 ppm, 3,8092 ppm, 3,7681 ppm diberikan oleh ketiga gugus metil CH3 (9H, O-CH3) c, pada pergeseran kimia δ 3,0092 ppm diberikan oleh proton CH (1H, O–CH-C) d Proton C–CH2-C e menunukkan 2 pergeseran kimia masing-masing doublet (JHH =
1,8 Hz) pada δ 3,2321 ppm dan δ 2,7755 ppm (2H, C-CH2-C). Hal ini disebabkan
karena kedua proton tersebut tidak ekivalen secara kimia (chemically non equeivalent). Karena atom karbon yang mengikat kedua proton memiliki sifat yang asimetris dan menyebabkan kedua proton tidak ekivalen secara kimia akan memberikan 2 pergseran kimia masing-masing doublet (Silverstein, 1963).
Dari gambar spektrum 1H-NMR diatas menunjukkan bahwa pada produk reaksi telah terbentuk ester trimetilhidroksisitrat dan diperoleh etanol sebagai pengotor yang masih ada dalam ester trimetilhidroksisitrat yang diperoleh.
Spektrum 13C-NMR produk reaksi esterifikasi yang di run pada frekuensi 125 MHz, dan pelarut CDCl3 yang ditunjukkan pada Gambar 4.6.
H
^ = pengotor (metanol) * = pengotor (etanol)
Gambar 4.6 Spektrum 13C-NMR Ester Trimetil Hidroksi Sitrat (CDCl3)
Spektrum 13C-NMR diatas menunjukkan adanya 3 karbon karbonil C-CH2
-CO- yang berdekatan masing-masing pada δ 172,60 ppm a, δ 172,08 ppm b, dan δ 170,97 ppm c. Pada pergeseran kimia δ 79,17 ppm diberikan oleh 1 atom Karbon tersier dari C-C-CO d, pada pergeseran kimia δ 74,6 ppm diberikan oleh 1 atom karbon skunder dari C-CH-CO e. Pada pergeseran kimia δ 53,03 ppm (f), δ 53,48 ppm g, dan δ 52,06 ppm h diberikan oleh ketiga karbon dari gugus metil O-CH3. Demikian juga pada pergeseran kimia δ 39,52 ppm diberikan oleh 1 atom karbon dari C-CH2-CO i.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesipulan
1. Pembuatan magnesium hidroksisitrat telah dapat dibuat dengan mereaksikan larutan kalium hidroksi sitrat dengan larutan MgCl2 50% pada pH = antar 6-7
berupa padatan putih dengan kadar Mg 12,83%.
2. Katalis 1,2-Dimetil,1,1,2,2-Tetrafenilsulfonatodisilana dapat mengkatalisis reaksi esterifikasi asam hidroksisitrat dari magnesium hidroksisitrat dengan methanol selama 10 jam pada suhu 120 0C menghasilkan ester trimetilhidroksisitrat yang berwarna kuning bening dengan yield 87,75%.
5.2. Saran
1. Metanol dan etanol masih terdapat sebagai zat pengotor pada ester trimetilhidroksisitrat. Untuk menghilangkannya dapat dilakukan dengan proses vakum yang lebih lama.
DAFTAR PUSTAKA
Austin,G.T. 1996.Industri Proses Kimia. Erlangga. Jakarta.
Basumatary, S. 2013. Transesterification with Heterogenous Catalyst in Production of Biodiesel : A Review. Journal of Chemical and Pharmaceutical Research. 5(1):1-7.
Bagchi,D., Preuss, H.G., and Ohia, S.E. Penemu; Interhealth Nutraceuticals Incorporated. 26 Feb 2008. Compositions Incorporating (-)-Hydroxycitric Acid and Related Methods For Promoting Fat Oxidation. US patent 7,335,651.
Baiiti,N., Mohamad, O., Ramadan, G., Halimaton, S.O., and Bacthiar, A.B. 2009.Extraction of Hydroxycitric Acid (HCA) In The Form of Lactone On Roselle Accession 3, 21 and Its Mutants. Di dalam: Malaysia Congress on Genetics; Genting Highlands, 4-6 August 2009. Genting Highlands: Genetic Resources and Breeding. Hl, 98–101.
Bangun, N., Clouatre, D.L., Shah, P., and Clouatre, D.E. Penemu;20 Nov 2008.Dimeric Double Metal Salts of (-)-Hydroxycitric Acid, Methods of Making and Uses of Same. Patentscope WO/2008/140444.
Bangun, N., Manullang, W., Panggabean, L., Sembiring, S. B., Simangunsong, R., Bali, P., Panjaitan, F., 2015. Performance of Tetraphenylsulfonato Disilane in Catalttic Transesterification of Crude Palm Oil and Esterification of Fatty Acids with Secondary Alcohols. Procedia Chemistry, 14 : 295 - 300
Balasubramanyam,k. Chandrasekhar,B.,.2000. Soluble Double Salt Of Group IA And IIA Of (-)Hydroxycitric Acid, Process Of Preparating The Same And Its Use In Beverages And Other Food Products Without Efeccting Their Flavor And Propertis. 6,160,172
Clouatre,D.L. Penemu;10 Sep 2002.Potasium(-)-Hydroxycitric Acid Methods For Pharmaceutical Preparation For Stable And Controlled Delivery. US6,447,807B1
Clouatre,D.L. Penemu; 2 Feb 2006. (-)-Hydroxycitric Acid For The Modulation of Angiotensin-Converting Enzyme. US 2006/0025482.
Crabtree, R. 2005. The Organometallic Chemistry of the Transition Metals. 4th Ed. Willey-Interface. New Jersey.
Fantoso.2014. Esterifikasi Asam Hidroksi Sitrat Yang TerbentukSecara Insitu Dengan Etanol Menggunakan Katalis H2SO4. Medan [Skripsi] USU.
Fessenden, R.J., dan Fessenden, J.S. 1986.Kimia Organik. Jilid 2. Edke3. Erlangga. Jakarta.
Fessenden, R.J., dan Fessenden, J.S. 1986.Kimia Organik. Jilid 1. Edke3. Erlangga. Jakarta.
Gates, B.C. 1991. Catalytic Chemistry. John Wiley & Sons, Inc. New York.
Gates, B.C., Katzer, J.R., and Schuit, G.C.A. 1979. Chemistry of Catalytic Processes. McGraw-Hill Company. New York.
Gokaraju, G.R., Gokaraju, R.R., Gottumukkala, V.S., and Pratha, S. Penemu; Laila Impex. 5 Apr 2005. Process For Preparing Highly Water Soluble Double Salts of Hydroxycitric Acid Particularly Alkali And Alkaline Earth Metal Double Salts. US patent 6,875,891.
Gokaraju, G.R., Gokaraju, R.R., Gottumukkala, S., and Somepalli, V. Penemu; Laila Impex. 24 Apr 2007.Tripel Mineral Salts of (-)-Hydroxycitric Acid and Processes For Preparing The Same. US patent 7,208,615.
Gokarju,G.R. 2010. Double Salts Of (-)Hydroxycitric Acid And Process For Preparing The Same. US7,741,370B2
Gupta, S.K. Penemu: Bioderm Reseacrh. 8 Feb 2007. Topical Deodorant Compositions Based on Hydroxycitric Acid. US 20070031256A1.
Helwani, Z. 2009. Solid Heterogenous Catalysts for Transesterification of Trigliserides With Methanol: A Review. Appl Catal A:363:1-10
Hida,H., Yamada, T., and Yamada, Y. 2005. Production of Hydroxycitric Acid by Microorganisms. Biochemistry. 69: 1555-1561.
Holtzclaw, F.H., dan Robinson, W.R. 1988. College Chemistry with Qualitative Analysis. 8th Ed. D. C. Heath and Company. USA.
Jena, B.S., Jayaprakasha, G.K., Singh, R.P., and Sakariah, K.K. 2002. Chemistry and Biochemistry of (-)-Hydroxycitric Acid from Garcinia. Journal of Agricultural and Food Chemistry. 50: 10-22.
Kamachi, H., Katoh, T., and Aoki, H. Penemu: Showa Denko, K.K. 20 Des 2007. Hydroxycitric Acid Derivatives andSkin External Preparations Using the Same. US patent 20070293577A1.
Kim,J.E., Jeon, S.M., Park, K.H., Lee, W.S., Jeong, T.S., McGregor, R.A., and Choi, M.S. 2011. Does Glycine Max Leaves Or Garcinia Cambogia Promote Weight-Loss Or Lower Plasma Cholesterol In Overweight Individuals: A Randomized Control Trial. Nutrition Journal. 10: 94.
Kiss, A., Dimian, A., Rothenberg, G. 2006. Solid Acid Catalyst for Biodiesel Production-Towards Sustainable Energy.Weinheim.Wiley-VCH Verlag GmbH & Co. KGaA
Leach, B.E. 1983. Applied Industrial Catalysis. Volume 2. Academic Press. New York.
Mackeen, M.M., Ali, A.M., Lajis, N.H., Kawazu, K., Kikuzaki, H., and Nakatani, N. 2002. Antifungal Garcinia Acid Esters from the Fruits of Garcinia atroviridis. 51c : 591-595.
Mackeen, M.M., Mooi, L.Y., Mohidin, A., Mat, N., Lajis, N.H., and Ali, A.M. 2012. Noncytotoxic and Antitumour-PromotingActivities of Garcinia Acid Esters fromGarcinia atroviridisGriff. ex T. Anders (Guttiferae). 2012.
Moffett,A. and Shah, P. Penemu; Glykon Technologies Group, LLC. 5 Feb 2013 Dimeric Double Metal Salts of (-)-Hydroxycitric Acid, Methods of Making and Uses of Same. US patent 8,367,864.
Nowicki, J., and Mosiewski, J.M. 2013. Esterifi Cation of Fatty Acids With C8-C9 Alcohols Over Selected SulfonicHeterogeneous Catalysts. Polish Journal of Chemical Technology. 15, 3: 42 – 47.
Peng, W., Lu, C., Z., Lin, F. 2013. Carbon-coated Mesoporous Silica Functionalized With Sulfonic Acid Groups and Its Aplication to Acetalization. Chinise JournalOf Catalysis. 34 (2013) 934-941
Samuel,P.,Saravanan,S., 23 Des 2004. Hydroxycitric Acid Complex Metal Salts, Compotition, And Methods. US0259937
Shriver, D. & Atkins, P. 1999. Inorganic Chemistry.Third Edition. New York. Oxford University Press.
Shrivastava,R. and Lambropoulus, P. Penemu; 24 Apr 2001.Magnesium(-) Hydroxycytrate, Method of Preparation, Applications, and Compositions in Particular Pharmaceutical Containing Same. US patent 6,221,901.
Sidabutar, A., 2011. Penggunaan Polistirena Sulfonat Sebagai Katalis Transesterifikasi Minyak Jarak Pagar (Jatropha curcas) Berkadar Asam Lemak Tinggi.[Skripsi].Medan : Universitas Sumatera Utara.
Silverstein, R.M. , Bassler, G.C., Morrill, T.C. 1981. Spectrometric Identification of Organic Compound.4th Edition. New York. John Wiley & Sons.
Stoker,S.,Walker. 1988. Fundamental Of Chemistry,General,Organik, Biological. Boston: Allyn And Bacon. 412-15
Sugiyarto, K.H. 2003. Kimia Anorganik II. Edisi Revisi. Universitas Negeri Yogyakarta. Yogyakarta.
Venkateswara,G.R., Karunakara, A.C., Santhosh, R.R., Ranjit, D., and Reddy, G.C. 2009. Hydorxycitric Acid Lactone and Its Salts: Preparation and Appetite Suppression Studies. Food Chemistry. 210: 235-239.