ASHIF IRVAN YUSUF
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul “Purifikasi parsial dan karakterisasi enzim mananase dari Bacillus pumilus” merupakan karya saya
bersama komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
Ashif Irvan Yusuf
ASHIF IRVAN YUSUF. Partial Purification and Characterization of Mannanase Enzyme from Bacillus pumilus. Under direction of ANJA MERYANDINI and YOPI
Bacillus pumilus isolate is one of bacterial collection from Biotechnology Culture Collection (BTCC) LIPI, isolated from Pari island waters was examined to determine the ability of bacteria to degrade mannan from Locust Bean Gum
(LBG). Based on qualitative analysis, this isolate showed the abilities to degrade mannan while the quantitative analysis showed the highest mannanase activity was obtained on the third day of incubation time at 3,2 U/mL with 0,9 U/mg specific activity. Initial purification using ultrafiltration 5000 WMCO showed mannanase activity at 5,1 U/mL with 1,44 U/mg specific activity. Enzyme purification by gel filtration produced a peak in fraction no.31 with mannanase activity at 4,2 U/mL with 4,00 U/mg specific activity. Analysis of hydrolitic products by thin layer chromatography showed that the main products from
Locust Bean Gum are manobiose, manotetraose and manohexaose. Maximum activity of the mannanase enzyme produced by B. pumilus isolate occurred at pH 5,0 and temperature of 40°C. This enzyme has 30,17 kDa single protein band when running with SDS PAGE with Michaelis Menten (Km) and maximum velocity (Vmax) at 0,076 mg/mL and 0,02 U/mg respectively.
ASHIF IRVAN YUSUF. Purifikasi Parsial dan Karakterisasi Enzim Mananase dari Bacillus pumilus. Dibimbing oleh ANJA MERYANDINI dan YOPI.
Manan sebagai fraksi penyusun hemiselulosa pada tanaman mempunyai beberapa fungsi yang diantaranya sebagai bahan utama penyusun dinding sel tanaman dan sumber energi bagi benih tanaman yang sedang tumbuh. Manan dapat dihidrolisis menjadi manosa ataupun manooligosakarida dengan bantuan enzim. Mananase adalah enzim pendegradasi manan yang mampu menghidrolisis rantai utamanya. Pemanfaatan mananase di bidang industri berkembang pesat terutama dalam bidang pakan, pangan dan pemutihan kertas.
Mikroorganisme darat telah banyak dilaporkan sebagai penghasil enzim mananase beserta karakteristiknya masing-masing. Sebaliknya masih sedikit sekali informasi yang ada mengenai mikroorganisme dari perairan khususnya bakteri laut sebagai penghasil enzim mananase. Daerah perairan laut dengan kondisi lingkungan yang sangat berbeda dari daratan seperti kondisi kadar garam yang tinggi, tekanan tinggi, temperatur rendah dan kondisi cahaya yang berbeda tentu mempengaruhi keragaman genetik dan biokimia mikroba laut dalam menghasilkan enzim, khususnya mananase.
Penelitian ini bertujuan untuk menganalisis salah satu isolat bakteri yang diisolasi dari perairan laut untuk mendapatkan informasi mengenai kemampuan isolat tersebut sebagai kandidat penghasil enzim mananase. Untuk itu perlu dilakukan suatu identifikasi secara kualitatif dan kuantitatif dari isolat sebagai penghasil enzim serta memurnikan dan mengkarakterisasi enzim mananase yang dihasilkan isolat tersebut.
Isolat yang digunakan adalah Bacillus pumilus hasil isolasi dari pantai pulau Pari, Jakarta. Langkah awal adalah identifikasi isolat secara kualitatif dengan metoda pewarnaan merah kongo dan secara kuantitatif dengan metoda asam dinitrosalisilat (DNS). Analisis produk hidrolisis menggunakan metoda kromatografi lapis tipis, dan pemurnian dilakukan dengan ultrafiltrasi dan kromatografi gel filtrasi. Hasil uji kualitatif dan kuantitatif akan menunjukkan potensi isolat menghasilkan enzim mananase, sehingga bisa dimanfaatkan sebagai sumber penghasil enzim mananase.
Isolat B. pumilus kemudian ditumbuhkan pada media dengan substrat spesifik untuk mengetahui pola pertumbuhan isolat dan saat optimum panen enzim mananase. Enzim mananase hasil optimasi tersebut digunakan sebagai sampel enzim yang akan dimurnikan serta dikarakterisasi.
4,44 %.
Analisis terhadap reaksi hidrolisis yang dilakukan enzim mananase perlu dilakukan untuk mengetahui tipe kerja enzim. Hasil kromatografi lapis tipis menunjukkan enzim bekerja secara endo dengan cara memotong secara acak rantai utama manan sehingga menghasilkan manooligosakarida berupa manobiosa manotetraosa dan manoheksaosa. Hasil SDS PAGE dengan pewarnaan perak didapat sebuah pita protein tunggal dari enzim hasil pemurnian dengan berat molekul sekitar 30,17 kDa.
Karakterisasi dilakukan terhadap enzim hasil pemurnian tersebut untuk mengetahui kondisi yang optimal untuk memproduksi enzim mananase dari isolat
B. pumilus. Karakterisasi dilakukan pada kondisi pH dan suhu yang berbeda. Kondisi pH optimum didapat pada pH 5,0 sedangkan suhu optimum pada suhu 40 °C. Analisis kinetika reaksi menggunakan substrat sepesifik manan yaitu locust bean gum didapat nilai konstanta Michaelis Menten (Km) sebesar 0,10 mg/mL dan nilai kecepatan reaksi maksimum (Vmax) sebesar 0,02 U/mg.
Hasil ini menunjukkan kemampuan mikroba laut untuk menghasilkan enzim mananase. Nilai yang kecil menunjukkan perlunya dilakukan optimasi terhadap media tumbuh isolat, substrat spesifik yang digunakan dan optimasi terhadap kondisi inkubasi saat produksi enzim, sehingga bisa diketahui kemampuan maksimal dari isolat dalam memproduksi enzim mananase.
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
ASHIF IRVAN YUSUF
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi:
Judul Tesis : Purifikasi Parsial dan Karakterisasi Enzim Mananase dari
Bacillus pumilus
Nama : Ashif Irvan Yusuf
NRP : P051090181
Disetujui,
Komisi Pembimbing
Prof. Dr. Anja Meryandini, MS Ketua
Dr. Yopi Anggota
Diketahui:
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Prof. Dr. Suharsono, DEA Dr. Ir. Dahrul Syah, M.Sc.Agr
Bismillahirrahmanirrohiim, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis mampu menyelesaikan penulisan karya ilmiah ini. Tema penelitian yang dilaksanakan sejak bulan Maret 2011 ini ialah produksi enzim, dengan judul Purifikasi Parsial dan Karakterisasi Enzim Mananase dari Bacillus pumilus.
Ucapan terima kasih pertama kali penulis sampaikan kepada Prof. Dr. Anja Meryandini, MS. dan Dr. Yopi selaku komisi pembimbing yang telah banyak memberikan masukan dan arahan selama penyelesaian tesis ini. Rasa terima kasih juga penulis sampaikan kepada Prof. Dr. Suharsono selaku Ketua Program Studi Bioteknologi yang telah banyak membantu selama penulis melaksanakan studi di Program Studi Bioteknologi. Tak lupa terima kasih penulis haturkan kepada Dr. Nisa Rachmania Mubarik MSi. selaku dosen penguji luar komisi yang telah bersedia memberikan masukan dan tambahan wawasan untuk perbaikan karya ilmiah ini.
Terima kasih juga penulis sampaikan kepada LIPI yang telah memberikan kesempatan kepada saya untuk melakukan penelitian di Pusat Penelitian Bioteknologi LIPI. Terima kasih juga penulis sampaikan kepada Ibu Nanik, Ade, Lia dan Alex yang telah banyak membantu dalam pelaksanaan penelitian, rekan-rekan Bioteknologi Angkatan 2009, serta semua pihak yang telah membantu dalam penyelesaian tesis ini. Semoga Allah SWT membalas semua amal baik yang telah diberikan.
Bogor, Oktober 2012
Penulis dilahirkan di Jambi pada tanggal 12 November 1980, putra kedua dari 3 bersaudara anak pasangan Bapak Muhammad Yusuf dan Ibu Zulfa Ahmad. Penulis menyelesaikan pendidikan dasar hingga menengah atas (SMU) di Jambi, dan menempuh pendidikan tinggi pada jenjang S1 di Fakultas Peternakan, Universitas Padjadjaran, Bandung dari tahun 1998 hingga 2003. Program magister dilanjutkan di Program Studi Bioteknologi, Institut Pertanian Bogor pada tahun angkatan 2009 atas biaya sendiri.
Halaman
DAFTAR TABEL ... xxi
DAFTAR GAMBAR ... xxiii
DAFTAR LAMPIRAN ... xxv
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA Manan ... 5
Enzim ... 8
Enzim Mananase ... 9
Sumber Enzim Mananase ... 11
Kromatografi ... 12
SDS-PAGE ... 14
Spektrofotometri Protein ... 15
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 17
Alat dan Bahan ... 17
Metode Penelitian Isolat dan Kondisi Kultur ... 18
Peremajaan B. pumilus ... 18
Analisis Kualitatif Isolat Penghasil Enzim Mananase ... 18
Aktivitas Enzim Mananase ... 19
Optimasi Waktu Produksi ... 19
Produksi Enzim Ekstrak Kasar ... 20
Pemekatan Enzim ... 20
Kromatografi Lapis Tipis ... 21
Kromatografi Gel Filtrasi ... 21
SDS-PAGE ... 22
Optimasi Waktu Produksi ... 25
Produksi dan Pemekatan Enzim Mananase ... 26
Kromatografi Lapis Tipis ... 27
Kromatografi Gel Filtrasi ... 28
SDS-PAGE ... 29
Pengaruh pH dan Suhu ... 30
Kinetika Reaksi (Km dan Vmax) ... 30
Pembahasan ... 31
SIMPULAN DAN SARAN ... 37
DAFTAR PUSTAKA ... 39
Halaman
1 Struktur kimia dan fungsi manan pada tanaman ... 7
2 Sifat beberapa gel sephadex ... 13
3 Pemurnian enzim mananase dari B. pumilus ... 29
4 Data perhitungan penentuan nilai Km dan Vmax ... 31
5 Perbandingan karakter beberapa enzim mananase asal bakteri ... 34
Halaman
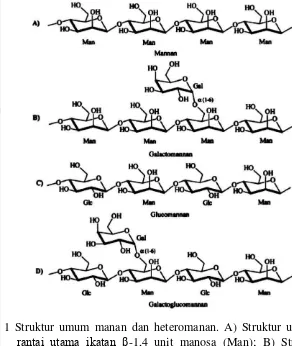
1 Struktur umum manan dan heteromanan ... 6 2 Reaksi enzimatis pada struktur galaktoglukomanan ... 10 3 Struktur locust bean gum dan tara gum ... 11 4 Struktur guar gum ... 11 5 Proses polimerisasi dari akrilamida ... 15 6 Hasil peremajaan dan zona bening isolat B. pumilus pada media
Halaman
PENDAHULUAN
Latar Belakang
Dinding sel tanaman adalah salah satu sumber karbon organik terbanyak di bumi. Bahan utama penyusun dinding sel primer tanaman adalah selulosa, hemiselulosa dan pektin, sedangkan dinding sel sekunder sering diperkuat dengan adanya lignin, polimer aromatik heterogen (Gilbert 2010). Hemiselulosa adalah polisakarida heterogen yang memiliki bentuk linear dan mempunyai grup cabang yang terikat dengan ikatan hidrogen pada serat mikroselulosa di dinding sel tanaman (Shallom & Shoham 2003).
Manan dan heteromanan adalah bagian dari fraksi penyusun hemiselulosa pada dinding sel tanaman. Fungsi fisiologis manan dan heteromanan adalah media penyimpanan polisakarida sebagai sumber energi bagi benih yang sedang tumbuh, dan sebagai komponen struktural jaringan selulosa-hemiselulosa yang fungsinya mirip dengan xyloglukan (Dhawan & Kaur 2007, Schröder et al. 2009). Manan dan heteromanan dapat ditemukan pada benih legum dan dinding sel tanaman seperti locust bean gum (LBG), daging kopra, biji kopi dan benih kelapa. Heteromanan memiliki rantai utama β-1,4 yang terikat dengan unit manosa dan glukosa, serta rantai samping yaitu unit α-1,6-galaktosa yang terikat pada rantai utama manosa (Schröder et al. 2009).
Manan dapat dihidrolisis jadi manosa atau manooligosakarida melalui pemotongan endo oleh β-mananase dan pemotongan ekso oleh β-manosidase (Dhawan & Kaur 2007). Mananase adalah enzim yang mampu menghidrolisis secara acak ikatan β-1,4 pada tulang punggung polimer manan (Schröder et al.
2009). Mananase sebagai enzim pendegradasi manan sangat menarik untuk dipelajari karena fungsi dan pemanfaatannya pada berbagai proses industri, terutama untuk meningkatkan kualitas pangan dan pemutihan enzimatis dari bubur kayu lunak pada industri kertas (Dhawan & Kaur 2007).
karena enzim dari mikroorganisme laut relatif lebih stabil dan aktif dibanding dengan enzim yang sama berasal dari tanaman atau hewan (Bull et al. 2000). Lingkungan perairan laut sangat berbeda jika dibandingkan dengan lingkungan darat sehingga mikroorganisme laut memiliki struktur genetik berbeda akibat dari habitat hidup yang unik. Lingkungan perairan laut memiliki keragaman kondisi dari daerah yang kaya nutrisi hingga lokasi yang minim nutrisi dimana hanya ada beberapa organisme saja yang mampu bertahan. Kompleksitas kondisi lingkungan perairan laut melibatkan kadar garam yang tinggi, tekanan tinggi, temperatur rendah, dan kondisi cahaya yang khusus, sehingga memberikan kontribusi terhadap perbedaan antara enzim yang dihasilkan oleh mikroorganisme laut dengan enzim sejenis dari mikroorganisme darat (Chen & Kim 2010). Hal ini memacu perkembangan teknologi enzim asal mikroorganisme laut akhir-akhir ini untuk menghasilkan produk yang bermanfaat.
Samudra sebagai habitat kehidupan yang sangat luas sehingga memiliki berbagai bentuk kehidupan dan menyebabkan kompetisi pemanfaatan ruang dan nutrisi yang sangat tinggi. Kondisi tersebut membuat mikroorganisme laut memiliki berbagai jenis sistem enzim agar dapat beradaptasi dan bertahan hidup di lingkungan perairan laut yang kompleks (Chen & Kim 2010). Penelitian mengenai enzim yang dihasilkan dari mikroorganisme laut masih sangat sedikit sehingga mikroorganisme dari laut dianggap sebagai sumber penghasil enzim yang cukup menjanjikan dengan potensi aplikasi yang belum dapat diperkirakan.
Penelitian mengenai mikroorganisme penghasil enzim mananase dari mikroorganisme yang diisolasi dari darat sudah banyak diketahui, tapi masih sedikit sekali informasi mengenai pemanfaatan mikroorganisme laut sebagai penghasil enzim mananase. Peneliti akhir-akhir ini telah mampu mengisolasi enzim mananase dari bakteri laut, actinomycetes, jamur dan mikroorganisme laut lain dan beberapa produk dari hasil isolat tersebut diharapkan mampu diterapkan di dunia industri. Toshiyoshi dan Manabu (1978) menunjukkan bakteri golongan
koleksi kultur laut China. Hasil karakterisasi dan purifikasi enzim mananase dari
Pantoea agglomerans menunjukkan karakter stabil pada jarak pH 4 – 10, toleran pada temperatur di bawah 60°C dan menunjukkan aktivitas optimal pada larutan NaCl. Karakter tersebut menunjukkan bahwa P. agglomerans merupakan isolat yang potensial untuk dimanfaatkan di bidang industri khususnya pangan. Politz et al. (2000) juga berhasil mengkarakterisasi bakteri laut Rhodothermus marinus
sebagai bakteri penghasil enzim thermostabil mananase.
Mikroorganisme laut memiliki keragaman genetik dan biokimia yang sangat besar, tetapi masih sedikit sekali yang berhasil diidentifikasi. Bakteri laut saat ini dilihat sebagai sumber enzim, khususnya mananase, yang menjanjikan dengan potensi aplikasi yang beragam. Analisa yang lebih mendalam perlu dilakukan untuk mengidentifikasi dan mengetahui karakter dari isolat bakteri laut sebagai penghasil enzim mananase, serta pemurnian enzim mananase yang dihasilkan dari isolat bakteri laut tersebut.
Tujuan Penelitian
Penelitian ini bertujuan untuk memurnikan dan mengkarakterisasi enzim mananase yang dihasilkan dari bakteri yang diisolasi dari laut.
Manfaat Penelitian
TINJAUAN PUSTAKA
Manan
Analisis struktural terhadap polisakarida penyusun dinding sel tanaman menunjukkan dinding sel tanaman dikotil tersusun atas 3 kelas utama polisakarida yaitu selulosa, hemiselulosa dan lignin dan membentuk biomassa lignoselulosa (Moreira & Filho 2008, Gilbert 2010). Hemiselulosa merupakan bagian dari polisakarida penyusun dinding sel tanaman yang tidak larut dalam air atau agen pengkelat, tetapi dapat larut dalam larutan alkali (Selvendran & O’neill 1λ85). Rantai utama hemiselulosa adalah berbagai polimer gula yang linear ataupun bercabang dengan unit penyusun seperti xilosa, L-arabinosa, manosa, D-galaktosa dan D-glukosa serta grup asetil dengan struktur yang bercabang. Struktur penyusun tersebut membuat hemiselulosa memiliki bentuk amorf sehingga lebih mudah untuk dihidrolisis (Gilbert 2010).
Komponen yang termasuk ke dalam hemiselulosa adalah manan, xilan, galaktan dan arabinan. Manan bersama xilan adalah unsur utama hemiselulosa penyusun dinding sel tanaman (Vries & Visser 2001, Dhawan & Kaur 2007, Schröder et al. 2009). Hemiselulosa sebagai biomassa terletak di antara lignin dan kumpulan serat selulosa. Hemiselulosa berinteraksi membentuk ikatan kovalen dengan lignin dan interaksi non-kovalen dengan selulosa dengan fungsi menjaga integritas in situ selulosa dan melindungi terjadinya degradasi selulosa (Puls & Schuseil 1993).
Gambar 1 Struktur umum manan dan heteromanan. A) Struktur umum manan, rantai utama ikatan β-1,4 unit manosa (Man); B) Struktur utama galaktomanan, rantai utama ikatan β-1,4 unit manosa dengan ikatan unit galaktosa (Gal) terikat pada beberapa unit (Man); C) Struktur utama glukomanan, rantai utama ikatan β-1,4 unit manosa (Man) dan unit glukosa (Glc); D) Struktur utama galaktoglukomanan, rantai utama ikatan β-1,4 unit manosa (Man) dan unit glukosa (Glc) dengan ikatan α-1,6 unit galaktosa (Gal) yang terikat pada beberapa unit (Man) (Dhawan & Kaur 2007).
heteromanan (Dhawan & Kaur 2007), sehingga derajat hidrolisis galaktomanan akan menurun dengan peningkatan substitusi oleh galaktosa (Hilge et al. 1998)
Tabel 1 Struktur kimia dan fungsi manan di tanaman (Schröder et al. 2009)
a Derajat polimerisasi, indikasi panjang rantai polisakarida b Air pada kisaran pH normal
Manan dan heteromanan terdistribusi luas di alam sebagai bagian dari hemiselulosa di kayu keras (hardwoods) dan kayu lunak (softwoods) (Capoe et al. 2000), benih tanaman legum (Buckeridge et al. 2000, Handford et al. 2003) dan pada kacang (Lundqvist et al. 2002). Manan pada kayu keras tersusun atas ikatan β-1,4 dengan unit manopiranosa dan glukopiranosa, sedangkan pada kayu lunak tersusun atas dua tipe yang berbeda dari asetilasi galaktoglukomanan. Manan terdiri atas glukosa, manosa dan galaktosa dengan rasio 1:3:1 pada kayu keras dan 1:4:0,1 pada kayu lunak (Lundqvist et al. 2002).
Polisakarida Rantai
Tidak ada -Penyimpanan polisakarida Galaktomanan (1-4)-β
-D-manosa
Manan berfungsi sebagai cadangan makanan dan polisakarida struktural pada dinding sel tanaman. Manan, galaktomanan (keduanya dalam benih) dan glukomanan (dalam bulbs atau tubers) adalah bentuk umum penyimpanan cadangan makanan di dalam dinding sel utama. Bentuk ini akan didegradasi oleh embrio atau shoot yang sedang tumbuh. Pada benih, proses ini terjadi pada periode tertentu setelah imbibisi.
Enzim
Enzim adalah protein yang memiliki kemampuan mengkatalis atau meningkatkan rata-rata reaksi kimia (Smith 1997, Grisham et al. 1999) pada metabolisme sel dan proses-proses biologis lainnya. Sebagian besar proses yang terjadi di sel biologis memerlukan enzim agar mendapatkan produk dengan hasil yang signifikan. Enzim sebagai katalis bekerja dengan menurunkan energi aktivasi reaksi tapi tidak digunakan oleh reaksi yang dikatalisnya ataupun mengubah keseimbangan reaksi.
Enzim secara umum merupakan protein globular dengan beberapa pengecualian sejumlah kecil RNA katalitik dan kompleks RNA/protein, mempunyai ukuran mulai dari 62 asam amino (monomer dari 4-oxalocrotonate tautomerase) (Chen et al. 1992) hingga lebih dari 2500 asam amino pada enzim pensintesis asam lemak hewan. Bentuk enzim berbasis RNA yang paling umum ditemukan adalah ribosom dengan sisi katalitik yang bernama ribozyme. Aktivitas dari enzim ditentukan oleh struktur 3 dimensinya (Anfinsen 1973). Meskipun struktur enzim menentukan fungsinya, memperkirakan aktivitas enzim hanya dari strukturnya merupakan masalah yang sangat sulit dan belum bisa dipecahkan (Dunaway 2008).
Aktivitas spesifik enzim adalah unit umum lainnya dimana aktivitas spesifik adalah aktivitas dari enzim untuk tiap miligram protein. Aktivitas spesifik mengukur kemurnian dari enzim yaitu jumlah dari produk yang dibentuk oleh enzim pada waktu tertentu dengan kondisi per miligram enzim. Aktivitas spesifik setara dengan rataan dari reaksi dikali dengan volume reaksi dibagi dengan berat dari enzim. SI unit nya adalah katal Kg-1, tapi unit yang lebih praktis adalah mol mg-1 min-1.
Enzim Mananase
Hidrolisis manan atau heteromanan menjadi gula sederhana membutuhkan kerja beberapa jenis enzim untuk menghidrolisis rantai utama dan rantai samping dari heteromanan, serta memotong ujung asetil jika heteromanan memiliki unit asetil. Kompleks enzim penghidrolisis manan terdiri atas endo-1,4-β-mananase (EC 3.2.1.78, manan endo-1,4-β-manosidase), α-galaktosidase (EC 3.2.1.22), β -manosidase (EC 3.2.1.25), β-glukosidase (EC 3.2.1.21) dan asetil manan esterase (EC 3.1.1.6).
Gambar 2 Reaksi enzimatis pada struktur galaktoglukomanan (Moreira & Filho 2008)
Mananase termasuk enzim yang bersifat indusibel pada fungi dan bakteri. Manan yang masih berbentuk polisakarida tidak mampu melakukan penetrasi dinding sel sehingga perlu dipecah menjadi molekul yang lebih sederhana. Manan akan menginduksi mikroba untuk memecah polimer menjadi molekul yang lebih kecil. Molekul kecil ini berupa monomer dan oligomer hasil hidrolisis enzim yang dihasilkan oleh sel (Moreira & Filho 2008). Kemampuan mikroba menghasilkan mananase sangat dipengaruhi oleh jenis substrat manan seperti glukomanan, galaktomanan dan glukogalaktomanan. Sarat utama substrat adalah polisakarida yang memiliki rantai utama β-(1,4) yang terikat pada unit manosa (Schröder et al.
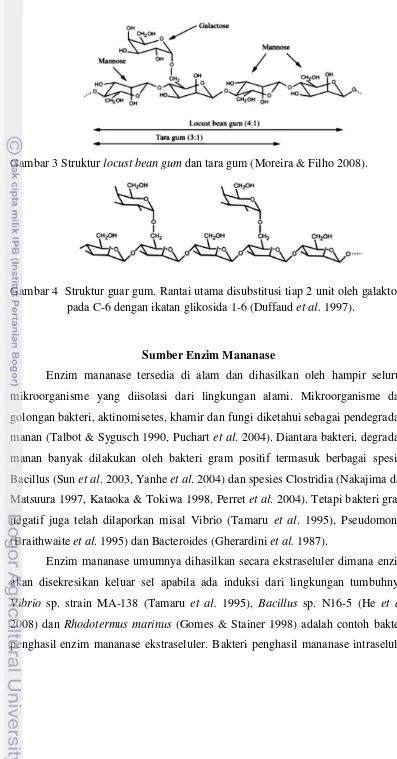
2009). Hasil ekstraksi dari tanaman umum digunakan sebagai substrat saat produksi enzim mananase ekstraselular (Moreira & Filho 2008). Substrat dari tanaman yang sering digunakan untuk studi mananase adalah galaktomanan dari
Gambar 3 Struktur locust bean gum dan tara gum (Moreira & Filho 2008).
Gambar 4 Struktur guar gum. Rantai utama disubstitusi tiap 2 unit oleh galaktosa pada C-6 dengan ikatan glikosida 1-6 (Duffaud et al. 1997).
Sumber Enzim Mananase
Enzim mananase tersedia di alam dan dihasilkan oleh hampir seluruh mikroorganisme yang diisolasi dari lingkungan alami. Mikroorganisme dari golongan bakteri, aktinomisetes, khamir dan fungi diketahui sebagai pendegradasi manan (Talbot & Sygusch 1990, Puchart et al. 2004). Diantara bakteri, degradasi manan banyak dilakukan oleh bakteri gram positif termasuk berbagai spesies Bacillus (Sun et al. 2003, Yanhe et al. 2004) dan spesies Clostridia (Nakajima dan Matsuura 1997, Kataoka & Tokiwa 1998, Perret et al. 2004). Tetapi bakteri gram negatif juga telah dilaporkan misal Vibrio (Tamaru et al. 1995), Pseudomonas (Braithwaite et al. 1995) dan Bacteroides (Gherardini et al. 1987).
Enzim mananase umumnya dihasilkan secara ekstraseluler dimana enzim akan disekresikan keluar sel apabila ada induksi dari lingkungan tumbuhnya.
Vibrio sp. strain MA-138 (Tamaru et al. 1995), Bacillus sp. N16-5 (He et al.
juga ditemukan pada Sporocytophaga coccoids dan Aerobacter mannolyticus
(Dekker & Richards 1976).
Kromatografi
Pemurnian enzim bertujuan untuk memisahkan enzim dari protein lain yang terdapat pada ekstrak kasar. Pemurnian diperlukan untuk mempelajari karakteristik fisik dan biologis suatu enzim. Metode dan tingkat pemurnian yang diharapkan tergantung pada target pemanfaatan enzim selanjutnya. Tingkat kemurnian tinggi tidak terlalu dibutuhkan jika hanya untuk mempelajari aktivitas biologis enzim. Enzim dengan tingkat kemurnian tinggi hingga 100 % biasanya diperlukan ketika mempelajari struktur enzim.
Tahap awal pemurnian enzim adalah pengendapan atau pemekatan enzim ekstrak kasar hasil ekstraksi atau isolasi enzim dari sumber penghasilnya. Pembiakan enzim tergantung kepada sumber enzim (tanaman, hewan, mikroorganisme), letak enzim (ekstraseluler, intraseluler) dan biosintesis enzim (konstitutif, induktif). Produksi enzim ekstraseluler dari mikroorganisme cenderung lebih mudah dilakukan. Ekstraksi enzim dapat dilakukan dengan menggunakan sentrifugasi, sehingga dapat dipisahkan sel mikroorganisme dari media yang mengandung enzim.
Kromatografi adalah suatu tehnik analisis biokimia pemisahan protein dimana tidak memerlukan waktu lama pada pengerjaannya. Pemisahan dilakukan berdasarkan fase gerak dan fase diamnya. Fase gerak berupa cairan atau gas, sedangkan fase diam dapat berupa padatan atau cairan. Pemisahan dilakukan dengan melewatkan campuran melalui medium alir baik cair maupun gas, sehingga menyebabkan perpindahan yang berbeda dari tiap-tiap komponen individunya. Aliran biasanya menggunakan tekanan atau gravitasi (Rosenberg 1996, Bintang 2010).
melewati pori tergantung pada bentuknya dan berat molekulnya. Metode ini efektif untuk memisahkan enzim dari pelarut penggumpal, larutan garam dan bufer yang tidak dikehendaki.
Bahan gel yang penting adalah dekstran (polimer gula) yang mengalami ikatan silang dengan bantuan epikhlorhidrin sehingga dekstran tidak larut dalam air. Daya serap ini tergantung pada jumlah ikatan silang yang terbentuk, semakin banyak ikatan maka daya serap terhadap air semakin rendah. Gel dekstran dikenal dengan istilah sephadex (Tabel 2) dengan sifat-sifat tahan terhadap garam atau basa pada konsentrasi tinggi tetapi rusak oleh asam (di bawah pH 2) dan oksidator kuat.
Kromatografi lapis tipis adalah tehnik pemisahan molekul menggunakan plat silika. Sampel diteteskan pada plat dan batas migrasi pelarut ditandai. Posisi senyawa yang ada dalam campuran sampel dapat dilihat dengan reaksi pewarnaan setelah plat dikeringkan. Rasio jarak yang ditempuh senyawa dan jarak yang ditempuh pelarut disebut nilai Rf (retention factor). Nilai Rf dipengaruhi ketebalan plat. Silika adalah bahan yang paling banyak digunakan untuk pemisahan senyawa. Atmosfer kamar (chamber) pemisah harus jenuh oleh pelarut dengan cara penggunaan wadah yang sekecil mungkin (Bintang 2010).
Tabel 2 Sifat beberapa gel sephadex (Bintang 2010)
Tipe Kisaran BM hasil fraksinasi Air terikat (g/g gel kering)
Volume larutan pengembang (mL/g gel kering) Polisakarida
(da)
Peptida dan Protein
G10 1 – 700 1 – 700 1,0 2
G15 1 – 1,5x103 1 – 1,5x103 1,5 3
G25 100 – 5,0x103 1000 – 5,0x103 2,5 5
G50 500 – 1,0x104 1500 – 3,0x104 5,0 10
SDS-PAGE
Elektroforesis adalah suatu proses pemisahan fraksi campuran berdasarkan pergerakan partikel bermuatan karena pengaruh medan listrik. Mobilitas elektroforesis dipengaruhi oleh medium serta bentuk dan muatan molekul (Bintang 2010). Elektroforesis gel poliakrilamid (PAGE) adalah salah satu cara untuk menganalisis protein yang sering digunakan. Informasi yang bisa diperoleh dari tehnik PAGE adalah penentuan berat molekul, kemurnian protein, struktur sub unit, aktivitas enzim dan urutan asam amino (Rosenberg 1996)
Protein setelah didenaturasi akan bereaksi dengan SDS yang merupakan detergen anionik sehingga membentuk kompleks dengan muatan negatif. Protein bermuatan negatif ini akan dipisahkan berdasarkan muatan dan ukurannya pada matriks gel poliakrilamid. Berat molekul protein dapat ditentukan menggunakan protein standar yang telah diketahui berat molekulnya dengan membandingkan nilai mobilitas relatifnya (Rf). Keuntungan dari metode ini dengan adanya denaturasi protein menjadi utas tunggal akan mempermudah ketika melewati pori pada akrilamida. Keuntungan lainnya adalah pemisahan berdasarkan ukuran polipeptida sehingga bisa diperoleh hasil yang cukup jelas untuk komponen yang dipisahkannya (Scopes 1994, Walker 1996)
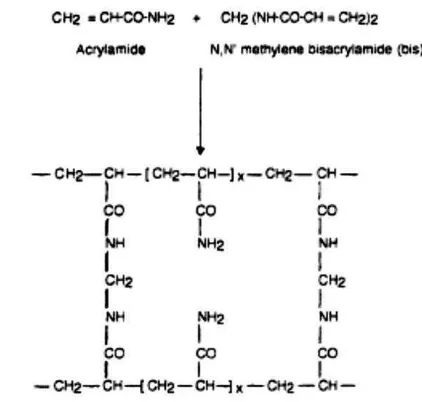
Monomer akrilamida ketika dicampur dengan N,N’ -metilene-bis-akrilamida (bis-metilene-bis-akrilamida) akan membentuk ikatan silang ketika ditambahkan dengan agen polimerisasi amonium persulfat (APS). Proses polimerisasi dapat dipercepat dengan penambahan N,N,N’,N’-tetrametilene-diamina (TEMED) (Gambar 5). Ukuran pori gel ditentukan oleh perbandingan konsentrasi akrilamida dengan bisakrilamida. Semakin rendah konsentrasi maka ukuran pori gel akan semakin besar (Rosenberg 1996, Walker 1996).
molekul SDS (Bintang 2010). Bromophenol Blue berfungsi sebagai pewarna pelacak sehingga jalannya elektroforesis bisa di monitor. Sukrosa atau gliserol akan memberikan kepadatan kepada larutan sampel sehingga sampel mudah masuk ke dalam sumur gel.
Gambar 5 Proses polimerisasi dari akrilamida (Walker 1996)
Terdapat berbagai metode pendeteksi protein yang dipisahkan dengan tehnik SDS-PAGE, salah satunya pewarnaan perak. Semua prosedur pewarnaan perak tergantung reduksi ionik perak menjadi bentuk metalnya. Kation perak membentuk kompleks dengan grup amino protein (Dunn 1996). Pewarnaan perak cukup sensitif, 10 – 20 kali lebih sensitif dibanding pewarnaan menggunakan
Coomassie Blue sehingga mampu mendeteksi protein dalam jumlah nanogram (Scopes 1994, Rosenberg 1996). Pewarnaan ini biasanya menghasilkan warna monokromatik coklat gelap.
Spektrofotometri Protein
gangguan dari chromopores dan tidak bisa digunakan untuk mengukur diterjen dan agen denaturasi.
Penyerapan radiasi ultraviolet oleh protein tergantung pada kandungan triptofan (trp) dan tirosin (tyr) (dan sejumlah kecil kandungan fenilalanin (phe) dan ikatan disulfida). Trp, tyr dan phe memiliki cincin aromatik yang mampu menyerap sejumlah besar cahaya pada panjang gelombang 280nm sehingga protein dengan unit amino tersebut memiliki molar penyerapan yang tinggi. Nilai molar penyerapan protein pada 280 nm (extinction coefficient) biasanya ditampilkan sebagai E1% (10 mg/mL) atau E1mg/mL.
Adanya chromophores non protein (misal heme dan pyrodoxal) dapat menaikkan nilai A280. Adanya asam nukleat juga bisa mengganggu karena
memiliki cincin purin dan pirimidin. Asam nukleat memiliki nilai serapan tertinggi pada 260 nm dengan pertimbangan penyerapan memanjang hingga 280 nm. Nilai konsentrasi protein dapat diperkirakan dengan rumus berikut dengan koreksi untuk menghilangkan penyerapan oleh nukleotida di 280 nm dengan mengukur di A260 (Aitken & Learmonth 1996, Wilson & Walker 2000).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di laboratorium Biorekayasa Lingkungan, Bidang Bioproses, Pusat Penelitian Bioteknologi LIPI Cibinong. Penelitian dilakukan dari Maret 2011 – April 2012.
Alat dan Bahan
Alat yang di gunakan dalam penelitian ini adalah laminar air flow
(Bioclean Bench Sanyo MCV-B131F), inkubator bergoyang (ThermolyneROSI 1000™), neraca analitik (Persico 303A dan Sartorius TE 15025), penangas air (CV Klaten Engineriing Type F St.02.2007), spektrofotometer UV-VIS (Shimadzu UV-Pharmaspec 1700), pengaduk magnetik (IKA RH basic 2), vortex (Mixer Fisher Scientific), membran dialisis (membran selulosa), alat elektroforesis (Atto Pagerun AE-6531), kolom kromatografi dan autoklaf (Everlight TA-630), serta peralatan umum yang digunakan di laboratorium seperti pipet ukur, microtube eppendord, thermometer, kuvet, timer, gelas ukur, tabung reaksi, erlenmeyer dan gelas piala. Sentrifuse yang digunakan adalah HIMAC CT15RE (rotor T15A61 kecepatan max 15.000 rpm/21.500 x g) dan Eppendorf Centrifuge 5415R (kecepatan max 13.200 rpm/16.110 x g).
Bahan yang digunakan dalam penelitian ini adalah isolat Bacillus pumilus
koleksi BTCC-LIPI. Media kultur terdiri atas Marine Art® SF-1 Artificial Sea Water (ASW), locust bean gum (LBG), ekstrak khamir, agar-agar dan pepton. Reagen dinitrosalisilat (DNS) terdiri atas DNS, NaOH, KNa-Tartrat. Bufer fosfat, bufer sitrat, bufer glisin NaOH. Sephadex G-75 dan bufer fosfat 0,02M pH 7,2 untuk kromatorafi gel filtrasi. Bahan Kromatografi lapis tipis terdiri atas Plat KLT (silica gel 60 F254, Merck), asam asetat dan pelarut anilin hidrogen phtalat. Bahan
Metode Penelitian Isolat dan Kondisi Kultur
Isolat Bacillus pumilus yang digunakan adalah hasil isolasi dari perairan pulau Pari, Jakarta. Isolat ditumbuhkan pada media Marine Art® SF-1 Artificial Sea Water (ASW) 3,8% (b/v) dengan penambahan ekstrak khamir 0,1% (b/v), pepton 0,5% (b/v) dan penggunaan substrat spesifik manan Locust Bean Gum
(LBG) 0,5% (b/v). Untuk media padat, ditambahkan agar-agar sebanyak 1,5% (b/v) pada media ASW. Kultur isolat diinkubasi pada suhu ruang (±30°C) di atas inkubator bergoyang dengan kecepatan 150 rpm.
Peremajaan B. pumilus
Isolat B. pumilus dari gliserol stok diremajakan dengan menumbuhkan isolat pada media ASW padat mengandung substrat LBG di dalam cawan Petri. Isolat gliserol di tetes pada media padat lalu disebar menggunakan batang penyebar dan diinkubasi selama 72 - 96 jam pada suhu ruang.
Analisis Kualitatif Isolat Penghasil Enzim Mananase
Analisis kualitatif dilakukan untuk mengetahui kemampuan isolat untuk mendegradasi substrat spesifik. Uji kualitatif menggunakan metode pewarnaan merah kongo. Koloni isolat hasil peremajaan ditotolkan menggunakan tusuk gigi steril pada media ASW padat yang mengandung substrat LBG lalu diinkubasi pada suhu ruang selama 72 jam. Isolat yang tumbuh pada media padat diwarnai dengan menggunakan pewarna merah kongo 0,2 % (b/v) dengan cara digenangkan di atas media hingga isolat terendam lalu diinkubasi selama 30 menit lalu dibilas menggunakan NaCl 2% (b/v) sebanyak 3 – 5 kali setiap 15 menit hingga zona bening jelas terlihat. Zona bening merupakan indikator adanya aktivitas enzim mananase yang diukur dengan indeks mananolitik dengan membandingkan selisih antara diameter zona bening dan koloni bakteri dengan diameter koloni.
Aktivitas Enzim Mananase
Aktivitas enzim mananase diukur menggunakan metode Miller (1959) yang telah dimodifikasi dengan menggunakan larutan asam dinitrosalisilat (DNS), KNa-tartrat dan NaOH. Sampel dibuat dengan cara menambahkan 0,25 mL enzim ekstrak kasar ke dalam 0,25 mL larutan substrat mengandung 0,5% (b/v) LBG yang dilarutkan di dalam bufer fosfat 0,02 M pH 7,2 lalu diinkubasi pada suhu 30°C selama 30 menit. Reaksi enzimatis dihentikan dengan penambahan 0,75 mL DNS lalu dipanaskan pada suhu 95°C selama 20 menit. Sebagai kontrol 0,75 mL DNS ditambahkan kedalam 0,25 mL substrat sebelum ditambahkan 0,25 mL enzim ekstrak kasar dan dipanaskan pada suhu 95°C selama 20 menit. Aktivitas enzim diukur menggunakan spektrofotometer pada panjang gelombang 540 nm.
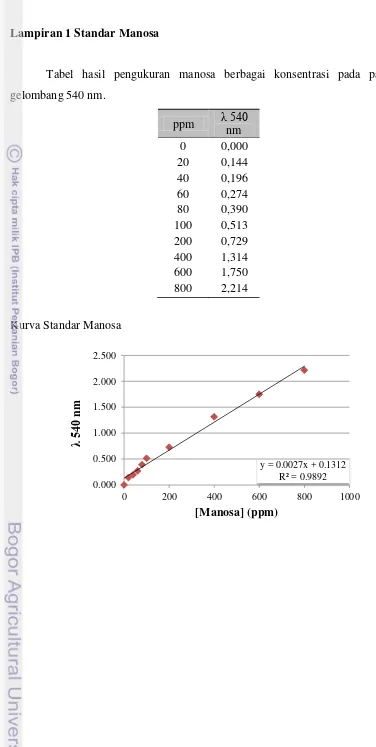
Aktivitas enzim mananase dinyatakan dalam U/mL dimana 1 unit enzim mananase adalah jumlah enzim yang dibutuhkan untuk memecah 1 µmol manan menjadi manosa untuk tiap menit reaksi pada kondisi yang telah ditentukan. Aktivitas spesifik enzim didefinisikan sebagai unit aktivitas enzim per mg protein. Sebagai standar digunakan kurva standar manosa. Pembuatan standar dilakukan dengan mengukur berbagai tingkat konsentrasi manosa (ppm) pada panjang gelombang 540 nm. Sebanyak 1 mL manosa direaksikan dengan 1,5 mL DNS lalu dipanaskan pada suhu 95°C selama 20 menit sebelum di ukur menggunakan spektrofotometer (Lampiran 1).
⁄
Keterangan Xs = jumlah gula tereduksi sampel Xk = jumlah gula tereduksi kontrol p = pengenceran
t = waktu inkubasi BM = berat molekul manosa
Optimasi Waktu Produksi
dalam 500 mL media ASW cair lalu diinkubasi pada inkubator bergoyang pada kecepatan 150 rpm dan suhu ruang. Sampel kultur diambil setiap 24 jam selama 5 hari dimana saat penambahan isolat ke dalam media dihitung sebagai jam ke-0. Aktivitas enzimatis dan jumlah sel dihitung. Jumlah sel tiap sampel kultur di ukur menggunakan spektrofotometer pada panjang gelombang 660 nm. Enzim ekstrak kasar diperoleh dengan mensentrifugasi sampel kultur pada kecepatan 11.000 rpm selama 15 menit, suhu 4 °C. Aktivitas enzim diukur menggunakan metode Miller (1959). Aktivitas enzim tertinggi digunakan sebagai patokan waktu optimum inkubasi pada saat perbanyakan produksi enzim mananase.
Produksi Enzim Ekstrak Kasar
Enzim ekstrak kasar diperoleh dari media hasil kultur isolat yang ditumbuhkan di media cair ASW menggunakan LBG sebagai substrat dengan waktu inkubasi disesuaikan dengan waktu produksi optimum. Media hasil kultur disentrifugasi pada kondisi 11.000 rpm dan 4°C selama 15 menit. Supernatan yang didapat adalah enzim ekstrak kasar yang digunakan untuk tahap selanjutnya disimpan pada suhu 4 °C. Aktivitas enzim dihitung menggunakan metode Miller (1959). Kadar protein diukur menggunakan spektrofotometer UV-VIS pada panjang gelombang 280 nm (Wilson & Walker 2000). Aktivitas spesifik enzim didapat dengan membandingkan antara aktivitas enzim dengan kadar proteinnya.
Pemekatan Enzim
Enzim hasil pemekatan disimpan pada ruangan bersuhu 4°C untuk digunakan pada tahap uji berikutnya.
Kromatografi Lapis Tipis
Enzim direaksikan dengan substrat 0,5% LBG pada berbagai waktu inkubasi (30, 60, 90 menit, 2, 6, 24 jam) dengan perbandingan substrat enzim sebesar 2 : 1. Hasil inkubasi dipanaskan pada suhu 100 °C selama 20 menit untuk menghentikan reaksi, kemudian disentrifugasi dengan kecepatan 11.000 rpm pada suhu 4 °C selama 10 menit. Sebagai standar digunakan manosa, manobiosa, manotriosa, manopentosa dan manoheksosa dengan masing-masing konsentrasi 1000 ppm disatukan di satu tabung dengan konsentrasi perbandingan yang sama.
Plat KLT dipotong sesuai kebutuhan lalu ditandai menggunakan pensil 2B sebagai batas awal penotolan (1 cm dari bagian bawah plat) dan batas akhir untuk elusi plat (1 cm dari bagian atas plat). Sebanyak 6 µL sampel dan 4 µL campuran standar ditotolkan pada plat dengan jarak 4 mm antar sampel, lalu dikeringkan dengan menggunakan pengering rambut untuk tiap kali penotolan. Plat KLT kemudian dimasukkan ke dalam chamber glass yang berisi eluen (n-butanol : asam asetat : aquades dengan perbandingan 2:1:1). Pergerakan eluen diamati hingga batas akhir eluen pada plat. Plat kemudian dikeluarkan dari dalam
chamber glass dan dibiarkan mengering di dalam lemari asam. Plat disemprot secara merata dengan pelarut anilin hidrogen phtalat untuk memunculkan noda, kemudian plat kembali di keringkan di dalam lemari asam. Plat yang sudah kering dimasukkan ke dalam oven dengan suhu 100 °C untuk memunculkan noda selama ± 20 menit.
Kromatografi Gel Filtrasi
perlahan agar tidak terbentuk gelembung udara. Matriks dibilas menggunakan bufer fosfat 0,02 M pH 7,2 sebanyak 3 kali volume kolom.
Sampel hasil pemekatan ultrafiltrasi diaplikasikan ke dalam kolom sebanyak 1 mL. Kolom dielusi menggunakan bufer fosfat 0,02 M pH 7,2 dengan kecepatan laju alir 1 mL/menit. Fraksi hasil pemisahan dikoleksi menggunakan
microtube (eppendorf) sebanyak 100 tabung dengan volume masing-masing tabung 1 mL. Aktivitas enzimatis dan kandungan protein masing-masing fraksi dihitung untuk menentukan fraksi dengan kemampuan enzimatis dan kadar protein tertinggi. Fraksi-fraksi yang menunjukkan aktivitas mananase tertinggi dikumpulkan dan dianggap sebagai enzim mananase murni yang akan digunakan pada uji selanjutnya.
SDS-PAGE
Analisis SDS-PAGE menggunakan poliakrilamid sebesar 4% untuk gel penahan dan 12,5% untuk gel pemisahnya. Enzim murni sebanyak 15 µL ditambah 5 µL loading buffer didenaturasi dengan pemanasan pada suhu 100 °C selama 10 menit. Sampel kemudian dimasukkan ke dalam sumur gel penahan. Proses runing elektroforesis berlangsung selama 4 jam pada kondisi tegangan 60 volt dan hambatan 30 mA.
Setelah running gel direndam di dalam larutan fiksasi (metanol 50%, asam asetat 10%) selama semalam sambil diagitasi. Gel dibilas dengan ddH2O sebelum
dimasukkan ke dalam larutan pembilas (20% etanol) sebanyak 3 kali masing-masing 20 menit. Gel kemudian dibilas dengan ddH2O sebelum dimasukkan ke dalam larutan sensitize (0,05 g Na2S2O3 dalam 250 ml aquades) selama 1 menit.
Gel kembali di bilas dengan ddH2O sebelum diwarnai dengan perak nitrat 1%
(b/v) selama 20 menit pada suhu 4°C. Gel dibilas dengan ddH2O sebelum
dimasukkan ke dalam larutan developing (5% Na2CO3; 0,05% formalin; 0,0004%
Karakterisasi Enzim Mananase
Karakterisasi enzim mananase meliputi pH optimum, suhu optimum dan kinetika reaksi enzimatis. Karakterisasi dilakukan dengan menguji aktivitas enzim mananase dengan menggunakan substrat LBG 0,5 % (b/v). Nilai pH diukur dari pH 3,0 sampai pH 9,0 dengan selang 0,5 unit. Bufer yang digunakan adalah bufer sitrat (pH 3,0 – 5,0), bufer fosfat (pH 5,5 – 8,0) dan bufer glycine-NaOH (pH 8,5 – 9,0). Karakterisasi suhu dilakukan dengan membedakan suhu inkubasi enzim substrat dari suhu 30 – 80 °C dengan selang 10 °C.
Kinetika reaksi mengukur nilai konstanta Michaelis Menten (Km) dan kecepatan reaksi maksimum (Vmax). Perhitungan dilakukan dengan menghitung aktivitas enzim pada kondisi pH dan suhu optimum pada berbagai konsentrasi LBG sebagai substrat (0,10%, 0,25%, 0,50%, 0,75% dan 1,00%) dengan waktu inkubasi berbeda (15, 30, 45 dan 60 menit). Hasil yang didapat akan di plot pada persamaan linear dengan menggunakan persamaan :
(
)
Keterangan : Vi = Kecepatan awal
Km = Konstanta Michaelis-Menten Si = Konsentrasi substrat
HASIL DAN PEMBAHASAN
Hasil Analisis Kualitatif Bacillus pumilus
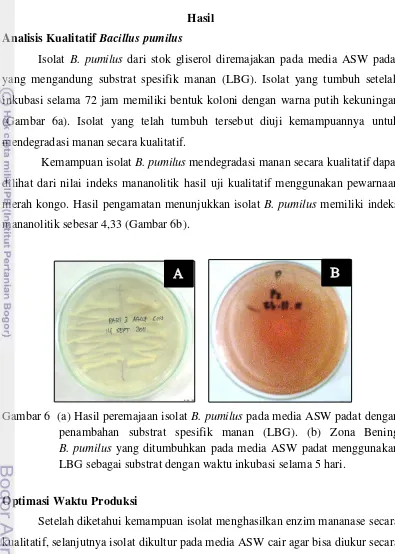
Isolat B. pumilus dari stok gliserol diremajakan pada media ASW padat yang mengandung substrat spesifik manan (LBG). Isolat yang tumbuh setelah inkubasi selama 72 jam memiliki bentuk koloni dengan warna putih kekuningan (Gambar 6a). Isolat yang telah tumbuh tersebut diuji kemampuannya untuk mendegradasi manan secara kualitatif.
Kemampuan isolat B. pumilus mendegradasi manan secara kualitatif dapat dilihat dari nilai indeks mananolitik hasil uji kualitatif menggunakan pewarnaan merah kongo. Hasil pengamatan menunjukkan isolat B. pumilus memiliki indeks mananolitik sebesar 4,33 (Gambar 6b).
Gambar 6 (a) Hasil peremajaan isolat B. pumilus pada media ASW padat dengan penambahan substrat spesifik manan (LBG). (b) Zona Bening
B. pumilus yang ditumbuhkan pada media ASW padat menggunakan LBG sebagai substrat dengan waktu inkubasi selama 5 hari.
Optimasi Waktu Produksi
kuantitatif terhadap kemampuan B. pumilus menghasilkan enzim mananase dapat dilihat dari kurva aktivitas enzim dan turbiditas sel bakteri (Gambar 7).
Gambar 7 Kurva aktivitas enzim dan turbiditas B. pumilus yang diinokulasi pada media ASW pH 7 pada suhu 30°C dengan LBG 0,5 % (b/v) sebagai substrat. (-▲-) Pengukuran OD sel pada panjang gelombang 660nm. (-♦-) Aktivitas enzim mananase (U/mL).
Aktivitas enzim mananase dari jam ke-0 terus mengalami peningkatan tiap 24 jam hingga aktivitas enzimatis tertinggi didapat pada jam ke-72 sebesar 7,7 U/mL. Setelah jam 72 aktivitas enzimatis kembali menurun hingga jam ke-120. Jumlah sel hasil pengukuran OD sel pada panjang gelombang 660 nm juga menunjukkan peningkatan dari jam ke-0 hingga jam ke-96. Fase eksponensial pertumbuhan isolat terlihat dimulai dari jam ke-24 hingga jam ke-96 sebelum memasuki fase stasioner. Dengan membandingkan antara grafik aktivitas enzimatis dengan kurva pertumbuhan, ditentukan waktu optimal untuk inkubasi isolat yang akan digunakan pada saat produksi enzim mananase adalah pada jam ke-72.
Produksi dan Pemekatan Enzim Mananase
Enzim mananase diproduksi pada skala 1 liter yang akan digunakan untuk pemurnian dan karakterisasi. Isolat dikultur pada media ASW cair dengan substrat LBG dengan menggunakan hasil optimasi waktu produksi sebagai patokan waktu inkubasi. Hasil perhitungan aktivitas enzim ekstrak kasar hasil produksi pada
skala 1 liter sebesar 3,24 U/mL dengan jumlah protein sebesar 3,55 mg/ml. Aktivitas spesifik enzim ekstrak kasar sebesar 0,91 U/mg.
Enzim ekstrak kasar didialisis untuk mengurangi garam – garam yang ada di media. Enzim hasil dialisis dipekatkan menggunakan ultrafiltrasi dan didapat nilai aktivitas enzimatis sebesar 5,1 U/mL dengan jumlah protein sebesar 3,54 mg/ml. Aktivitas spesifik enzim mananase hasil pemekatan dengan ultrafiltrasi sebesar 1,44 U/mg.
Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) adalah uji kualitatif yang dilakukan untuk mengetahui pola pemotongan enzim mananase isolat B. pumilus terhadap substrat manan tertentu. Noda dari sampel enzim mananase yang telah direaksikan dengan LBG pada berbagai waktu inkubasi yang berbeda dibandingkan dengan standar yang ada (Gambar 8). Hasil hidrolisis enzim mananase terhadap LBG tidak menunjukkan terbentuknya monomer manosa (M). Spot noda yang terbentuk menunjukkan pola pemotongan yang menghasilkan dimer dan oligomer manosa yaitu manobiosa, manotetraosa hingga manoheksaosa.
Gambar 8 Hasil KLT enzim mananase dengan substrat LBG (1:2) menggunakan standar manosa (M), manobiosa (M2), manotriosa (M3), manotetraosa (M4) dan manoheksaosa (M6). Perlakuan dengan perbedaan waktu inkubasi enzim yaitu 30 menit (1), 60 menit (2), 90 menit (3), 2 jam (4), 6 jam (5) dan 24 jam (6).
1 2 3 4 5 6
M
M2
M3
M4
M6
M
M2
M3
M4
Kromatografi Gel Filtrasi
Pemurnian enzim dilakukan dengan menggunakan kromatografi gel filtrasi dengan matrik kolom sephadex G-75, dimana diharapkan protein pada enzim akan terpisah berdasarkan ukuran molekulnya. Jumlah protein fraksi enzim hasil gel filtrasi dihitung dari nilai absorbansi pada panjang gelombang 280 nm dan aktivitas enzimatis dihitung dengan menggunakan metoda Miller (Gambar 9). Fraksi yang ditampung mulai memperlihatkan aktivitas enzimatis pada fraksi ke-21, hingga puncak tertinggi didapat pada fraksi ke 31. Hal yang sama ditunjukkan oleh kadar protein yang terhitung, dimana fraksi dengan kadar protein tertinggi ada pada fraksi ke-30. Tiga fraksi hasil koleksi dengan aktivitas enzimatis dan kadar protein tertinggi dikumpulkan. Aktivitas enzimatis fraksi tertinggi yang didapat sebesar 4,2 U/mL dengan kadar protein sebesar 1,05 mg/mL. Aktivitas spesifik enzim hasil pemurnian dengan kromatografi gel filtrasi sebesar 4,0 U/mg.
Gambar 9 Kurva fraksi hasil kromatografi gel filtrasi B. pumilus pada kolom matrik sephadex G-75, dengan laju alir bufer fosfat 0,02 M pH 7,2 1mL/menit. (----) aktivitas enzimatis enzim hasil kolom untuk masing-masing fraksi. ( ) jumlah protein hasil pengukuran OD 280 nm.
Hasil pemurnian enzim mananase B. pumilus dari tiap tahap pemurnian dapat dilihat di Tabel 3. Aktivitas spesifik mengalami peningkatan dari tiap tahap pemurnian dimana setelah mengalami tahap gel fitrasi enzim memiliki aktivitas spesifik sebesar 4,0 U/mg. Kromatografi gel filtrasi meningkatkan kemurnian enzim mananase sebesar 4,38 x dibanding enzim ekstrak kasar. Perolehan enzim
hasil pemurnian menggunakan kromatografi gel filtrasi sebesar 4,44% dari enzim ekstrak kasarnya.
Tabel 3 Pemurnian enzim mananase dari B. pumilus Tahap
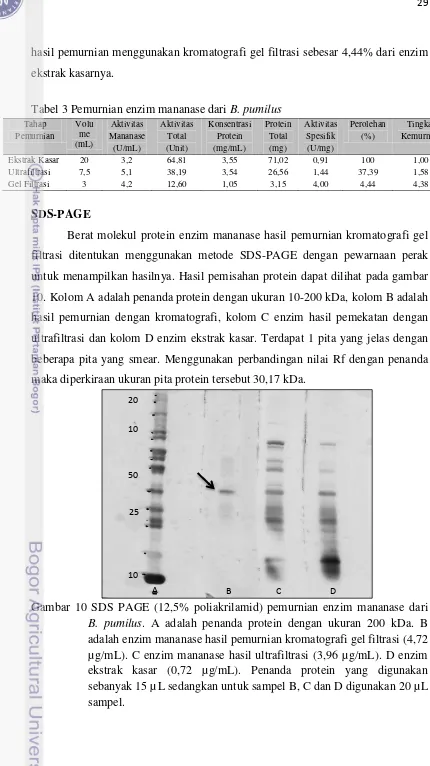
Berat molekul protein enzim mananase hasil pemurnian kromatografi gel filtrasi ditentukan menggunakan metode SDS-PAGE dengan pewarnaan perak untuk menampilkan hasilnya. Hasil pemisahan protein dapat dilihat pada gambar 10. Kolom A adalah penanda protein dengan ukuran 10-200 kDa, kolom B adalah hasil pemurnian dengan kromatografi, kolom C enzim hasil pemekatan dengan ultrafiltrasi dan kolom D enzim ekstrak kasar. Terdapat 1 pita yang jelas dengan beberapa pita yang smear. Menggunakan perbandingan nilai Rf dengan penanda maka diperkiraan ukuran pita protein tersebut 30,17 kDa.
Gambar 10 SDS PAGE (12,5% poliakrilamid) pemurnian enzim mananase dari
Pengaruh pH dan Suhu
Karakterisasi terhadap enzim dilakukan untuk mengetahui kondisi optimum enzim mananase isolat B. pumilus hasil pemurnian pada substrat LBG.
Pengaruh pH terhadap aktivitas enzim dapat dilihat pada gambar 11a sedangkan pengaruh suhu pada gambar 11b. Enzim memperlihatkan aktivitas tertinggi pada pH 5,0 (Gambar 11a). Aktivitas tertinggi enzim pada suhu 40°C, walaupun masih menunjukkan aktivitas yang baik hingga suhu 60°C (Gambar 11b).
Gambar 11 Pengaruh pH (A) dan suhu (B) terhadap aktivitas enzim mananase dari
B. pumilus hasil kromatografi gel filtrasi. (A) Reaksi enzimatis di lakukan pada pH antara 3,0 – 9,0 ( 0,02 M sitrat pH 3,0 – 5,5; 0,02 M fosfat pH 6,0 – 8,0; 0,02 glycine-NaOH pH 8,5 – 9,0) pada suhu 30°C selama 30 menit. (B) Reaksi enzimatis dilakukan pada berbagai temperatur dari 30°C hingga 80°C selama 30 menit pada pH 7,2.
Kinetika Reaksi (Km dan Vmax)
Konstanta Michaelis Menten (Km) dan kecepatan reaksi maksimum (Vmax) didapat dengan mereaksikan enzim mananase hasil kromatografi gel filtrasi pada kondisi pH dan suhu optimumnya. Reaksi enzimatis dilakukan menggunakan substrat spesifik manan (LBG) pada berbagai tingkatan konsentrasi. Data perhitungan untuk berbagai tingkat konsentrasi substrat (Tabel 4) kemudian diplot kedalam persamaan garis regresi antara nilai 1/[S] terhadap nilai 1/V sehingga diperoleh persamaan linearnya (Gambar 12).
Persamaan regresi yang didapat Y = 4,558X + 46,585 dengan nilai R2 = 0,8309 diplot ke dalam resiprokal Lineweaver-Burk untuk mendapatkan nilai Km dan Vmax. Menggunakan plot resiprokal Lineweaver-Burk didapat nilai konstanta Michaelis (Km) dan kecepatan reaksi maksimum (Vmax) sebesar 0,10 mg/mL dan 0,02 U/mg secara berurutan.
Tabel 4 Data perhitungan penentuan nilai Km dan Vmaks
No [S] 1/[S] Vi 1/Vi Persamaan Regresi
1 0,10 10,0 0,0113 88,50 Y=0,0113x + 0,923
2 0,25 4,0 0,0134 74,63 Y=0,0185x + 0,923
3 0,50 2,0 0,0170 58,82 Y=0,0170x + 2,315
4 0,75 1,3 0,0185 54,05 Y=0,0134x + 1,929
5 1,00 1,0 0,0247 40,49 Y=0,0247x + 4,784
Gambar 12 Persamaan linear antara 1/[S] terhadap 1/Vi
Pembahasan
B. pumilus adalah salah satu spesies Bacillus yang banyak terdapat di lautan (Parvathi et al. 2009), karena B. pumilus memiliki daya tahan yang tinggi terhadap kondisi lingkungan ekstrim seperti ketersediaan nutrisi rendah, intensitas sinar tinggi, kandungan H2O2 dan paparan bahan kimia (Nicholson et al. 2000). Bacillus pumilus mampu menghasilkan enzim protease pada kondisi garam tinggi (NaCl 4 M, KCl 4 M) dan tetap mempertahankan aktivitasnya hingga 80% (Suhartono et al. 1997).
Isolat B. pumilus yang digunakan sebagai mikroorganisme penghasil enzim mananase adalah hasil isolasi dari pulau Pari di Teluk Jakarta dengan tujuan untuk mengetahui kemampuan bakteri laut menghasilkan enzim mananase (Djohan 2012). Hasil penapisan awal secara kualitatif menunjukkan kemampuan isolat ini untuk mendegradasi manan. Araujo dan Ward (1990), Aurora et al.
(2003) sebelumnya juga telah melaporkan kemampuan B. pumilus dari isolat darat y = 4.558x + 46.585
R² = 0.8309
0 20 40 60 80 100
0 2 4 6 8 10
1
/Vi
untuk menghasilkan enzim mananase. Kemampuan isolat B. pumilus dari laut menghasilkan enzim mananase lebih lanjut belum diketahui.
Nilai indeks mananolitik B. pumilus asal laut ini hampir sama dengan nilai indeks yang dilaporkan oleh Seftiono (2008) dari Streptacidiphilus luteoalbus
dengan nilai indeks sebesar 4, Setianingrum (2009) dari Streptomyces purpurascens dengan nilai indeks 5 dan Sari (2011) dari Saccharopolyspora flava
dengan nilai indeks sebesar 4,63. Hasil analisis kualitatif yang menunjukkan terbentuknya zona bening dan nilai indeks yang cukup besar mengindikasikan bahwa isolat mampu menghasilkan enzim khususnya endo mananase.
Uji kualitatif menggunakan pewarna merah kongo adalah uji kualitatif yang baik, karena penggunaan merah kongo dengan konsentrasi 1% (b/v) selama 15 menit akan memunculkan zona bening yang kontras. Uji kualitatif dengan pewarna merah kongo adalah uji spesifik untuk endo-enzim karena tidak terbentuknya zona bening saat menggunakan α-galaktosidase sebagai substrat dan hanya terjadi sedikit peningkatan intensitas warna dengan β-manosidase sebagai substrat. Konsentrasi substrat juga mempengaruhi terbentuknya zona bening dimana diameter zona akan berkurang secara linear seiring dengan penambahan konsentrasi 0,1–1,0% (b/v) pada substrat galaktomanan (Downie et al. 1994).
Aktivitas enzim terukur yang didapat dinyatakan dalam satuan unit (U) dengan tingkat kemurnian enzim yang dapat dilihat dari nilai aktivitas spesifiknya (Bintang 2010). Aktivitas enzimatis dan aktivitas spesifik enzim akan sangat beragam tergantung asal isolat dan jenis substrat yang digunakan. Aktivitas enzimatis dan aktivitas spesifik dari sesama B. pumilus yang telah dilaporkan oleh Araujo dan Ward (1990) sebesar 78 U/mg serta Aurora et al. (2003) sebesar 0,2 U/mg. Aktivitas spesifik tersebut menunjukkan nilai yang berbeda walaupun menggunakan LBG sebagai substrat. Laporan lain juga menunjukkan nilai aktivitas enzimatis dan aktivitas spesifik yang berbeda pada golongan Bacillus
seperti B. Stearothermophilus (Talbot & Sygusch 1990) sebesar 97 U/mg pada substrat LBG dan B. amylolequifaciens (Mabrouk & El Ahnawy 2008) sebesar 61,5 U/mg pada substrat limbah kulit kentang.
Analisis kualitatif hidrolisis LBG menggunakan enzim mananase isolat B. pumilus mengindikasikan bahwa enzim termasuk ke dalam tipe enzim endo-mananase. Noda pada KLT menunjukkan hasil hidrolisis LBG sebagai sumber manan menghasilkan manobiosa dan manotetraosa hingga manoheksaosa, tapi tidak menunjukkan ada terbentuknya molekul manosa. Sebagian besar laporan menunjukkan enzim mananase yang bersifat endo pada substrat LBG (Talbot & Sygusch 1990, Blibech et al. 2010, 2011), meskipun ada juga laporan mengenai mananase dengan tipe ekso-mananase (Jones & Ballou 1969).
Hasil karakterisasi enzim mananase dari isolat B. pumilus menunjukkan bahwa enzim ini aktif bekerja pada kondisi pH sedikit asam, sehingga sedikit berbeda dengan beberapa bakteri lain penghasil enzim mananase yang pernah dikarakterisasi (Tabel 5). Umumnya enzim mananase dari bakteri memiliki pH optimum pada kisaran pH normal, tapi pH optimum enzim mananase B. pumilus
mirip dengan enzim mananase dari Rhodotermus marinus yaitu pada pH 5,4 dimana bakteri ini juga berasal dari laut seperti isolat B. pumilus. Piontek et al.
memiliki aktivitas tertinggi pada suhu 40 °C, walaupun aktivitasnya masih tinggi hingga suhu 60 °C.
Tabel 5 Perbandingan karakter beberapa enzim mananase asal bakteri Nama
Bacillus stearothermophilus 74 6,5 70 ATCCb Ethier et al. 1998
Bacillus subtilis KU-1 40 7,0 55 Kyoto Univ. Zakaria et al. 1998
Rhodotermus marinus 45 5,4 75 ATCCb Politz et al. 2000
a
Deutsche Sammlung von Mikroorganismen, Germany
b
American Type Culture Collection
Hasil SDS-PAGE menunjukkan adanya sebuah pita protein yang jelas terbentuk. Berat molekul dari pita protein tersebut berdasarkan nilai Rf terhadap penanda protein adalah sebesar 30,17 kDa. Pita tunggal ini didapat dari enzim hasil pemurnian menggunakan kromatografi gel filtrasi. Berat molekul dari isolat
B. pumilus ini termasuk kecil jika dibandingkan dengan beberapa isolat lain penghasil enzim mananase (Tabel 5) dimana berat molekul enzim mananase dari
B. stearothermophilus adalah 74 kDa dan bakteri penghasil mananase yang lain rata-rata memiliki berat molekul 45 kDa. Pita tunggal ini walaupun dengan nilai berat molekul kecil, merupakan enzim mananase yang aktif pada substrat LBG.
Hasil dari SDS-PAGE juga menunjukkan adanya pita protein yang smear, artinya pita tersebut ada tapi hanya berupa bayangan pada gel hasil SDS-PAGE. Pita smear ini terlihat pada kolom enzim hasil pemurnian gel filtrasi, dimana pita smear tersebut mengindikasikan ada enzim mananase dari isolat B. pumilus hasil pemurnian kromatografi gel filtrasi belum terlalu murni. Kromatografi gel filtrasi hanya mampu memurnikan secara parsial enzim mananase yang diperoleh.
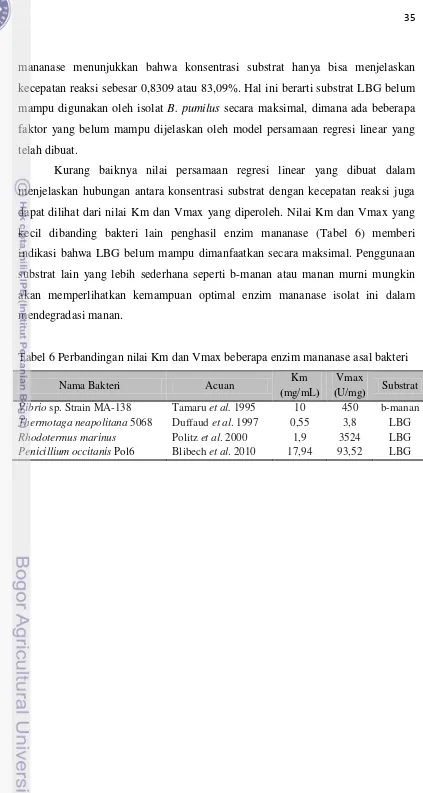
Hasil perhitungan kinetika reaksi menunjukkan enzim mananase dari
mananase menunjukkan bahwa konsentrasi substrat hanya bisa menjelaskan kecepatan reaksi sebesar 0,8309 atau 83,09%. Hal ini berarti substrat LBG belum mampu digunakan oleh isolat B. pumilus secara maksimal, dimana ada beberapa faktor yang belum mampu dijelaskan oleh model persamaan regresi linear yang telah dibuat.
Kurang baiknya nilai persamaan regresi linear yang dibuat dalam menjelaskan hubungan antara konsentrasi substrat dengan kecepatan reaksi juga dapat dilihat dari nilai Km dan Vmax yang diperoleh. Nilai Km dan Vmax yang kecil dibanding bakteri lain penghasil enzim mananase (Tabel 6) memberi indikasi bahwa LBG belum mampu dimanfaatkan secara maksimal. Penggunaan substrat lain yang lebih sederhana seperti b-manan atau manan murni mungkin akan memperlihatkan kemampuan optimal enzim mananase isolat ini dalam mendegradasi manan.
Tabel 6 Perbandingan nilai Km dan Vmax beberapa enzim mananase asal bakteri
Nama Bakteri Acuan Km
(mg/mL)
Vmax
(U/mg) Substrat
Vibrio sp. Strain MA-138 Tamaru et al. 1995 10 450 b-manan
Thermotaga neapolitana 5068 Duffaud et al. 1997 0,55 3,8 LBG
Rhodotermus marinus Politz et al. 2000 1,9 3524 LBG
SIMPULAN DAN SARAN
Isolat Bacillus pumilus terbukti mampu mendegradasi manan dengan cara menghasilkan enzim mananase. Hasil pengujian secara kualitatif dan kuantitatif isolat B. pumilus menghasilkan enzim mananase menunjukkan enzim yang bersifat endo-enzim. Kromatografi gel filtrasi hanya dapat memurnikan enzim ini secara parsial. Enzim ini bersifat mesofil dan aktif pada pH asam. Penggunaan substrat LBG kurang mampu mempresentasikan kemampuan enzim mananase dari isolat B. pumilus.
DAFTAR PUSTAKA
Aitken A, Learmonth MP. 1996. Protein determination by UV absorbtion. Di dalam Walker JM, editor. The protein protocol handbook. 10th ed. New Jersey. Humana Press Inc : 3.
Anfinsen CB. 1973. Principles that govern the folding of protein chains. Science
181 : 223–230.
Araujo A, Ward OP. 1990. Mannanase components from Bacillus pumilus. Appl Environ Microbiol 56 : 1954-1956.
Aurora DD, Lestari Y, Meryandini A. 2003. Identification of mannanase pro-ducing bacteria and characterization of the enzyme. J Mikrobiol Indones
8 : 31-33.
Bintang M. 2010. Biokimia : Tehnik Penelitian. 12th ed. Jakarta. Erlangga.
Blibech M, Ghorbel RE, Fakhfakh I, Ntarima P, Piens K, Bacha AB, Chaabouni SE. 2010. Purification and characterization of a low molecular weight of β-mannanase from Penicillium occitanis Pol6. Appl Biochem Biotechnol
160 : 1227-1240.
Blibech M, Chaari F, Bhiri F, Dammak I, Ghorbel RE, Chaabouni SE. 2011. Production of manno-oligosaccharides from locust bean gum using immobilized Penicillium occitanis mannanase. J Mol Catalysis B: Enzymatic 73 : 111-115.
Braithwaite KL, Black GW, Hazlewood GP, Ali BR, Gilbert HJ. 1995. A non-modular endo-beta-1,4-mannanase from Pseudomonas fluorescent sub species cellulosa. J Biochem 305 : 1005-1010.
Buckeridge MS, dos Santos PH, Tiné MA. 2000. Mobilization of storage cell wall polysaccharides in seeds. Plant Physiol Biochem 38 : 141-156.
Bull AT, Ward AC, Goodfellow M. 2000. Search and discovery strategies for biotechnology: The paradigm shift. Microbiol Mol Biol Rev 64: 573–606. Capoe P, Kubackova M, Alfoldi J. 2000. Galactoglucomannan from the secondary
cell wall of Picea abies L. Carbohydr Res 329 : 635-645.
Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, Whitman CP. 1992. 4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer. J Biol Chem 267: 17716–17721. Chen Z, Kim SK. 2010. Research and application of marine microbial enzymes:
Dekker RFH, Richards GN. 1976. Hemicellulases : Their occurrence, purification, properties and mode of actions. Adv Carbohydr Chem Biochem 32 : 277-352
Dhawan S, Kaur J. 2007. Microbial mannanases : An overview of productions and applications. Crit Rev in Biotechnol 27 : 197-216.
Djohan AC. 2012. Isolasi dan idenktifikasi bakteri manolitik laut dari pulau pari [tesis]. Bogor : Sekolah Pascasarjana, Institut Pertanian Bogor.
Downie B, Hilhorst HWM, Bewley JD. 1994. A new assay for quantifying endo-β-D-mannanase activity using congo red dye. Phytochemistry 36 : 829-835
Duffaud GD, Carol M, McCutchen, Pascal L, Parker KN, Kelly RM. 1997. Purification and characterization of extremely thermostable β -mannanase, β-mannosidase, and α-galactosidase from the hyper thermophilic eubacterium Thermotoga neapolitana 5068. Appl Environ Microbiol 63 : 169-177.
Dunaway MD. 2008. Enzyme function discovery. Structure 16 : 1599–1600. Dunn MJ. 1996. Detection of proteins in polyacrylamide gels by silver staining.
Di dalam Walker JM, editor. The protein protocol handbook. 10th ed. New Jersey. Humana Press Inc : 229-230.
Ethier N, Talbot G, Sygusch J. 1998. Gene cloning, DNA sequencing, and expression of thermostable β-mannanase from Bacillus stearothermophilus.Appl Environ Microbiol 64 : 4428-4432.
Franco PF, Ferreira HM, Filho EXF. 2004. Production and characterization of hemicelluloses activities from Trichoderma harzianum strain T4.
Biotechnol Appl Biochem 40 : 255-259.
Gherardini F, Babcock M, Salyers A. 1987. Purification and characterization of a cell-associated, soluble mannanase from Bacteroides ovatus. J Bacteriol
169 : 2038-2043.
Gilbert HJ. 2010. The biochemistry and structural biology of plant cell wall deconstruction. Plant Physiol 153 : 444-455.
Gomes J, Steiner W. 1998. Production of a high activity of an extremely thermostable β-mannanase by the thermopilic eubacterium Rhodotermus marinus, grown on locust bean gum. Biotechnol Lett 20 : 729-733.
Handford MG, Baldwin TC, Goubet F. 2003. Localization and characterization of cell wall mannan polysaccharides in Arabidopsis thaliana. Planta 218 : 27-36.
He X, Liu N, Li W, Zhang Z. 2008. Inducible and constitutive expression of a novel thermostable alkaline β-mannanase from alkaliphilic Bacillus sp. N16-5 in Phichia pastoris and characterization of the recombinant enzyme. Enzyme and Microbial Technol 43 : 13-18.
Hilge M, Gloor SM, Rypniewski W, Sauer O, Heightman TD, Zimmermann W, Winterhalter K, Piontek K. 1998. High-resolution native and complex structure of thermostable β-mannanase from Thermomonospora fusca –
substrate spesificity in glycosyl hydrolase family 5. Structure 6 : 1433-1444.
Jones GH, Ballou CE, 1969. Studies on the Structure of Yeast Mannan : Mode of action of the Arthrobacterα-mannosidase on yeast mannan. J Biol Chem
244 : 1052-1059.
Kataoka N, Tokiwa Y. 1998. Isolation and characterization of an active mannanase-producing anaerobic bacterium C. tertium KT-5A from lotus soil. J Appl Microbiol 84 : 357-367.
Lundqvist J, Teleman A, Junel L, Zacchi G, Dahlman O, Tjerneld F, Stalbrand H. 2002. Isolation and characterization of galactoglucomannan from spruce (Picea abies). Carbohydr Polym 48 : 29-39.
Mabrouk MEM, El Ahwany AMD. 2008. Production of β-mannanase by Bacillus amylolequifaciens 10A1 cultured on potato peels. Afri J Biotechnol 7 : 1123-1128.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. J Anal Chem 31 : 426-428.
Moreira LRS, Filho EXF. 2008. An overview of mannan structure and mannan degrading enzyme systems. Appl Microbiol Biotechnol 79 : 165-178. Nakajima N, Matsuura Y. 1997. Purification and characterization of konjac
glucomannan degrading enzyme from anaerobic human intestinal bacterium Clostridium butyricum – Clostridium beijerinckii group. Biosci Biotechnol Biochem 61 : 1739-1742.
Nicholson WL, Munakata N, Horneck G, Melosh HJ, Setlow P. 2000. Resistance of Bacillus endospores to extreme terresterial and extraterresterial environments. Microbiol Mol Biol Rev 64 : 548-572.