ALFIA ANNUR AINI AZIZI
A24070046
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Alfia Annur Aini Azizi1, Agus Purwito2, dan Ni Made Armini Wiendi2 1
Student of Agronomy and Horticulture Department, Agriculture Faculty IPB, (email: alfia.azizi@gmail.com)
2
Staff Agronomy and Horticulture Department, Agriculture Faculty IPB
Abstract
The aims of the research was to study the effect of Chitosan and BAP on in vitro shoot proliferation of Mentha piperita. This research was conducted from March 2011 to November 2011 at Tissue Culture’s Laboratory, Departement of Agronomy and Horticulture IPB, Bogor. The research was arrangement on completely randomized block design. This research consisted of two factors and three replications and each replication consisted 15 observation unit. The first factor is Chitosan with three levels of concentration of 0 mg/l, 10 mg/l, and 20 mg/l. The second factor is BAP with five levels of concentration of 0 mg/l, 0.5 mg/l, 1 mg/l, 1,5 mg/l, and 2 mg/l. Axilar shoots of Mentha piperita explant were cultured on MS medium contained Chitosan and BAP as treatment. The culture was incubated for eight weeks in culture room with temperature 250C and light intensity 1000 lux. The result showed the treatment of Chitosan are significantly affected initial growth, number and length of shoot, number of node, root, and biomass. The treatments of BAP and its interaction with Chitosan are not significantly affected to all variable observed. Chitosan 0 mg/l and BAP 1.5 mg/l is the best treatment for initial growth, number of node, and root.
RINGKASAN
ALFIA ANNUR AINI AZIZI. Induksi Proliferasi Tunas In Vitro Mentha piperita melalui Penambahan BAP dan Chitosan. (Dibimbing oleh AGUS PURWITO dan NI MADE ARMINI WIENDI).
Mentha piperita adalah tanaman herba penghasil menthol. Perbanyakan konvensional M. piperita mengurangi hasil panen sekaligus mengakumulasikan patogen terutama virus. Salah satu solusi perbanyakan M. piperita adalah penyediaan bibit melalui kultur jaringan. Penelitian ini bertujuan untuk mempelajari pengaruh zat pengatur tumbuh tanaman BAP dan konsentrasi senyawa aditif Chitosan terhadap proliferasi tunas Mentha piperita secara in vitro.
Chitosan merupakan produk yang dihasilkan dari demineralisasi dan deproteinisasi limbah udang atau kepiting. Chitosan pernah diteliti dapat meningkatkan jumlah tunas pada kultur Dendrobium. Benzylaminopurin adalah zat pengatur tumbuh golongan sitokinin yang dapat mendorong pertumbuhan tunas.
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, pada bulan Maret hingga November 2011. Penelitian ini disusun dalam Rancangan Kelompok Lengkap Teracak (RKLT) dengan 2 faktor. Faktor pertama yaitu konsentrasi Chitosan yang terdiri atas tiga taraf percobaan 0.0 mg/l; 10.0 mg/l; dan 20.0 mg/l. Faktor kedua yaitu konsentrasi BAP dengan lima taraf percobaan yaitu 0.0 mg/l; 0.5 mg/l; 1.0 mg/l; 1.5 mg/l; dan 2.0 mg/l. Kombinasi perlakuan dari dua faktor tersebut menghasilkan 15 satuan percobaan yang masing-masing diulang sebanyak 3 kali. Terdapat 5 botol dalam setiap ulangan dan setiap botol ditanami 3 eksplan, sehingga terdapat 675 satuan amatan. Bahan eksplan yang digunakan adalah buku aktif planlet Mentha piperita yang telah diperbanyak di media MS tanpa zat pengatur tumbuh.
dan kontaminasi cendawan sebesar 4.89 %. Eksplan yang mati sebanyak 8 dari 675 eksplan yang diamati.
Chitosan menghambat secara nyata waktu muncul tunas, jumlah tunas per eksplan, tinggi tunas, jumlah buku per eksplan, dan pertumbuhan akar Mentha piperita secara in vitro. Perlakuan media dengan penambahan Chitosan memberikan pengaruh positif terhadap warna batang dan persentase bobot kering planlet Mentha piperita.
BAP memberikan pengaruh yang nyata terhadap waktu muncul tunas namun tidak memberikan pengaruh yang nyata saat 8 MST (minggu setelah tanam) terhadap jumlah tunas per eksplan, tinggi tunas, jumlah buku per eksplan, pertumbuhan akar, dan persentase bobot kering Mentha piperita secara in vitro. Media MS dengan penambahan 1.5 mg/l BAP tanpa chitosan memberikan pengaruh terbaik terhadap induksi proliferasi planlet Mentha piperita namun tidak berbeda nyata dengan media MS tanpa BAP.
Tidak ada interaksi yang nyata antara Chitosan dan BAP terhadap waktu muncul tunas, jumlah tunas per eksplan, tinggi tunas, warna batang, dan persentase bobot kering Mentha piperita secara in vitro. Ada interaksi yang nyata terhadap jumlah buku per eksplan saat 5 dan 6 MST, serta pertumbuhan akar saat 8 MST.
INDUKSI PROLIFERASI TUNAS IN VITRO Mentha piperita
MELALUI PENAMBAHAN BAP DAN CHITOSAN
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
ALFIA ANNUR AINI AZIZI
A24070046
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Judul
:
INDUKSI PROLIFERASI TUNAS IN VITRO
Mentha piperita MELALUI PENAMBAHAN BAP
DAN CHITOSAN
Nama
:
ALFIA ANNUR AINI AZIZI
NIM
:
A24070046
Menyetujui,
Dosen Pembimbing I
(Dr. Ir. Agus Purwito, MSc. Agr) NIP. 19611101 198703 1 003
Dosen Pembimbing II
(Dr. Ir. Ni Made Armini Wiendi, MS) NIP. 19610412 198703 2 003
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
(Dr. Ir. Agus Purwito, MSc. Agr) NIP: 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta Timur pada tanggal 4 September 1989. Penulis merupakan anak pertama dari Bapak Abdul Rochman dan Ibu Elia Zulfa. Tahun 2001 penulis lulus dari SDN R. A. Fadilah 03 pagi Jakarta, kemudian pada tahun 2004 penulis menyelesaikan studi di SLTPN 102 Jakarta. Selanjutnya penulis lulus dari SMAN 8 Jakarta pada tahun 2007. Tahun 2007 penulis diterima di IPB melalui Undangan Seleksi Masuk IPB (USMI) sekaligus menjadi mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Tahun 2010 penulis menjadi asisten praktikum mata kuliah Manajemen Air dan Hara, serta asisten responsi mata kuliah Metode Statistik. Pada tahun 2011 penulis menjadi asisten praktikum mata kuliah Dasar Bioteknologi Tanaman serta asisten responsi mata kuliah Metode Statistik.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penelitian yang berjudul ”Pengaruh Konsentrasi BAP dan Chitosan terhadap Daya Proliferasi Tunas Mentha piperita secara In Vitro” ini
dapat diselesaikan dengan baik.
Penulis menyampaikan terima kasih kepada:
1. Dr. Ir. Agus Purwito, MSc. Agr dan Dr. Ir. Ni Made Armini Wiendi, MS selaku dosen pembimbing skripsi yang telah memberikan arahan dan bimbingan dalam penelitian ini.
2. Ayah, ibu, adik, dan keluarga besar yang telah memberi doa, dukungan dan semangat dalam menyelesaikan penelitian.
3. Prof. Dr. Ir. Sudarsono selaku dosen pembimbing akademik yang telah memberikan arahan dalam pelaksanaan akedemik penulis.
4. Keluarga Lab. Kultur Jaringan : Indah, Yudia, Mastika, Meyga, Neneng, Rara, Risa, Koko Limas, Uda Yudi, Mba Ai, Mr. Consti, Bu Irni, Eka, Dwi, dan Pak Wasil. Terimakasih atas bantuan dan dukungan kepada penulis selama menjalankan penelitian.
5. Teman-teman yang telah membantu selama penelitian : Guntur, Lia Juwita, Andra, Ita, Mita dan Dita.
6. Teman-teman Agronomi dan Hortikultura angkatan 44.
7. Bapak Wahyudin, petani sayur yang telah memberikan tanaman Mentha piperita sebagai bahan penelitian penulis.
8. Pihak-pihak yang tidak dapat disebutkan satu per satu atas perhatian, dukungan, doa, dan bantuan kepada penulis selama ini.
Semoga hasil penelitian ini dapat berguna bagi pihak yang memerlukan.
Bogor, Mei 2012
DAFTAR ISI
Media kultur Jaringan Tanaman ...5
Zat Pengatur Tumbuh ...7
Sitokinin ...8
Chitosan ...8
In VitroMentha sp. ... 10
BAHAN DAN METODE PENELITIAN ... 13
Waktu dan Tempat Penelitian ... 13
Alat dan Bahan Penelitian ... 13
Metode Penelitian ... 13
Pelaksanaan Percobaan ... 14
Pengamatan ... 15
HASIL DAN PEMBAHASAN ... 18
Keadaan Umum Penelitian... 18
Saat Terbentuk Tunas Aksilar Mentha piperitaIn Vitro ... 19
Persentase Eksplan Mentha piperita In Vitro yang Bertunas ... 21
Jumlah Tunas per Eksplan... 22
Tinggi Tunas Mentha piperita in Vitro ... 25
Jumlah Buku Aktif per Planlet Mentha piperita in Vitro ... 28
Warna Batang Tunas ... 31
Pertumbuhan Akar Mentha piperita In Vitro ... 33
Persentase Bobot Kering Planlet Mentha piperita ... 36
Penyediaan Bibit Mentha piperita secara in Vitro ... 38
KESIMPULAN ... 40
DAFTAR PUSTAKA ... 41
DAFTAR TABEL
Nomor Halaman
1. Rekapitulasi Sidik Ragam Saat Muncul Tunas M. piperita
secara In Vitro pada Media MS dengan Penambahan
Chitosan dan BAP... 20
2. Saat Muncul Tunas Mentha piperita secara In Vitro pada
Berbagai Konsentrasi Chitosan.... 20
3. Saat Muncul Tunas Mentha piperita secara In Vitro pada
Berbagai Konsentrasi BAP.... 21
4. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP
terhadap Jumlah Tunas per Eksplan Mentha piperita... 23
5. Jumlah Tunas per Eksplan Mentha piperita pada Berbagai
Konsenterasi Chitosan... 23
6. Jumlah Tunas per Eksplan Mentha piperita pada Berbagai
Konsentrasi BAP saat 2 dan 8 MST... 24
7. Persentase Eksplan Membentuk Tunas Aksilar Lebih dari
2 Saat 8 MST... 24
8. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP
terhadap Tinggi Tunas Mentha piperita secara in Vitro... 26
9. Tinggi Mentha piperita pada Berbagai Konsentrasi
Chitosan... 26
10. Tinggi Mentha piperita secara in Vitro pada Berbagai
Konsentrasi BAP saat 4 MST... 27
11. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP
terhadap Jumlah Buku Mentha piperita... 28
12. Jumlah Buku Aktif per Eksplan Mentha piperita secara in
Vitro pada Berbagai Konsentrasi Chitosan... 29
13. Jumlah Buku Aktif per Eksplan Mentha piperita pada
Berbagai Konsentrasi BAP saat 2 dan 7 MST... 29
14. Jumlah Buku Mentha piperita pada Berbagai Interaksi
15. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP terhadap Pertumbuhan Akar Mentha piperita secara in
Vitro... 34
16. Hasil DMRT Pengaruh Konsentrasi Chitosan terhadap
Pertumbuhan Akar Mentha piperita secara in Vitro.... 34
17. Skor Pertumbuhan Akar Mentha piperita pada Berbagai
Interaksi Chitosan dan BAP Saat 8 MST... 35
18. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP
terhadap Persentase Bobot Kering Planlet Mentha piperita. 36
19. Rata-rata Jumlah Buku per Eksplan Mentha piperita pada
DAFTAR GAMBAR
Nomor Halaman
1. Eksplan Mentha piperita yang Terserang Bakteri Putih ... 18
2. Eksplan Mentha piperita yang Terserang Cendawan ... 19
3. Histogram Persentase Eksplan Bertunas pada Kultur
Mentha piperita secara In Vitro... 21
4. Proliferasi Tunas pada eksplan Mentha piperita secara in Vitro pada Media MS dengan Penambahan Chitosan dan
BAP ... 25
5. Perbandingan Tinggi Planlet Mentha piperita pada
Perlakuan BAP yang Sama ... 27
6. Buku Mentha piperita yang Mati Saat Usia Planlet Tujuh
Minggu... 31
7. Skor Warna Batang Planlet Mentha piperita Skor 0 (kiri atas), Skor 1 (kanan atas), Skor 2 (kiri bawah), Skor 3
(kanan bawah)... 31
8. Skor Warna Batang Planlet M. piperita saat 8 MST.... 32
9. Pertumbuhan Akar Mentha piperita dengan Skor 1
(A), Skor 2 (B), Skor 3 (C), dan Skor 4 (D)... 33
10. Persentase Bobot Kering Planlet Mentha piperita pada
Latar Belakang
Menthol adalah salah satu senyawa monoterpene yang merupakan senyawa volatil yang memiliki aroma dan rasa khas sehingga sering dimanfaatkan sebagai pemberi aroma dan rasa dari produk-produk yang bersifat komersial seperti kosmetik, obat-obatan, pewangi, dan makanan. Kebutuhan industri dari produk yang dihasilkan oleh Mentha sp. ini sangat besar, akan tetapi sampai saat ini Indonesia belum mampu untuk memenuhi kebutuhan tersebut. Impor produk turunan dari Mentha sp. setiap tahun semakin meningkat, pada tahun 2006 nilai impor mencapai US $ 3 780 000 setara dengan 34 milyar rupiah (BPS, 2007).
Sejalan dengan meningkatnya kebutuhan minyak mint dan kristal menthol maka perbanyakan bibit Mentha piperita perlu mendapat perhatian. Secara konvensional, tanaman Mentha diperbanyak melalui stolonnya atau dengan setek pucuk dan setek batang yang panjangnya 5-8 cm. Cara ini membutuhkan bibit berupa setek pucuk, batang atau stolon yang cukup banyak sehingga akan mengurangi hasil terna yang dipanen. Perbanyakan yang terus-menerus menggunakan metode vegetatif akan mengakumulasikan penyakit sistemik terutama virus. Salah satu cara untuk memenuhi kebutuhan bibit yang banyak dan bebas penyakit dengan waktu yang cepat tanpa mengurangi hasil panen serta tidak membutuhkan areal tanam yang luas ialah memanfaatkan teknologi kultur jaringan.
Zat pengatur tumbuh sitokinin banyak digunakan di dalam kultur jaringan untuk berbagai keperluan. Benzylaminopurin (BAP) paling banyak digunakan untuk memacu pembentukan tunas karena BAP termasuk sitokinin yang dapat mendorong pembelahan sel-sel meristematik (George and Sherington, 1984). Sitokinin BAP untuk mendorong pembentukan tunas dan mengurangi dominansi apikal (Pierik, 1987).
1994). Pada penelitian ini dipelajari pengaruh 6-Benzylaminopurin (BAP) dan Chitosan terhadap daya proliferasi tunas Mentha piperita secara in vitro yang nantinya dapat dipergunakan sebagai bibit induk tanaman Mentha piperita.
Tujuan
Tujuan dari penelitian ini ialah mempelajari pengaruh zat pengatur tumbuh tanaman BAP dan konsentrasi Chitosan terhadap proliferasi tunas Mentha piperita secara in vitro.
Hipotesis
Hipotesis yang dikemukakan pada penelitian ini adalah sebagai berikut:
1. Terdapat pengaruh yang nyata dari konsentrasi BAP terhadap proliferasi tunas Mentha piperita secara in vitro.
2. Terdapat pengaruh yang nyata dari konsentrasi Chitosan terhadap proliferasi tunas Mentha piperita secara in vitro.
TINJAUAN PUSTAKA
Mentha piperita
Tanaman Mentha piperita L termasuk ke dalam Kingdom Plantae dengan Divisi Spermatophyta. Sub divisi Angiospermae, Kelas Dicotyledonae, Famili Solanales, Ordo Labialae, dan Genus Mentha. Tanaman ini merupakan persilangan dari Mentha aquatica dan Mentha spicata (Croteau et al., 2005). Tanaman ini lebih dikenal dengan nama Peppermint. Daun Mentha piperita
mengandung saponin, flavonida,dan polifenol di samping minyak atsiri. Selain tergolong dalam tanaman obat dan aromatik, tanaman ini dapat menjadi gulma atau invasif (Handayani, 2010).
Menurut Badan Penelitian Tanaman Obat dan Aromatik (1986) Mentha piperita tumbuh tegak dengan tinggi 30-90 cm dan bentuk batang segi empat berwarna ungu. Daun tanaman ini berbentuk bulat telur dengan panjang 2,5-10 cm, bentuk pangkal daun runcing atau tumpul, tepi daun bergerigi kasar, helaian daun bagian atas halus dengan warna hijau gelap, sedang bagian bawah berwarna pucat dan sedikit berbulu. Bunga berwarna ungu, tersusun dalam karangan bunga majemuk semu. Karangan bunga ini tumbuh pada ujung batang atau cabang (bunga terminal).
Kultur Jaringan Tanaman
Kultur jaringan tanaman merupakan suatu teknik untuk mengisolasi bagian tanaman (sel, jaringan, dan organ tanaman), untuk ditumbuhkan pada media dengan kondisi aseptik agar bagian tanaman tersebut dapat memperbanyak diri dan membentuk tanaman yang sempurna (Wattimena et al., 1992; Gunawan 1992; Caponetti et al., 2000; Ahloowalia et al., 2004). Kultur jaringan disebut juga kultur in vitro yang berarti kultur di dalam wadah gelas (Wattimena et al., 1992). Konsep yang mendasari kultur jaringan adalah teori totipotensi (Wetherell, 1982) dan plastisitas tanaman (Anonim, 2003). Totipotensi merupakan kemampuan sel secara genetik untuk membentuk tanaman lengkap bila berada dalam lingkungan yang sesuai, karena di dalam masing-masing sel tumbuhan mengandung informasi genetik yang lengkap (Wetherell, 1982; Anonim, 2003). Secara teoritis, semua sel hidup dalam tanaman berasal dari satu sel zigot dalam ovari. Dengan demikian meskipun sel tersebut berdiferensiasi menjadi batang, daun, akar, dan bunga, mereka tetap mempunyai informasi genetik yang sama dengan induknya (Wattimena et al., 1992). Adapun plastisitas tanaman adalah kemampuan tanaman untuk mengadaptasikan sistem metabolisme, pertumbuhan dan perkembangannya agar sesuai dengan lingkungan tumbuh (Anonim, 2003).
Profesor Murashige dari California University mengembangkan tiga tahapan mikropropagasi dalam perbanyakan tanaman secara in vitro. Tahap pertama adalah menyiapkan eksplan yang akan ditumbuhkan pada media aseptik. Tahap kedua meliputi penggandaan propagul dengan cara meningkatkan jumlah cabang aksilar ataupun pembentukan tunas-tunas baru. Tahap ketiga merupakan tahap pengakaran secara in vitro dan pendewasaan planlet sebelum diaklimatisasi (Torres, 1989; Wattimena, 1992).
Eksplan
Eksplan merupakan bahan untuk inisiasi kultur yang diambil dari bagian suatu tanaman (Gunawan, 1992). Keberhasilan morfogenesis suatu kultur in vitro
sangat dipengaruhi oleh eksplan yang dikulturkan. Eksplan menyangkut jenis eksplan, umur, ukuran, dan cara mengkulturkannya. Umur eksplan akan berpengaruh terhadap inisiasi, dan kemampuan morfogenesis langsung atau tidak langsung. Bagian tanaman yang masih muda (juvenile) merupakan bagian tanaman yang paling baik untuk eksplan, hampir pada semua tanaman. Hal yang sama juga terjadi pada eksplan yang berasal dari planlet in vitro. Potensial morfogenetik kalus meningkat hanya dalam waktu singkat (satu atau dua kali subkultur) yang diikuti dengan kemampuan regenerasi yang tinggi, setelah itu morfogenesisnya menurun. Setiap jenis tanaman maupun organ memiliki ukuran optimum untuk dikulturkan. Eksplan yang terlampau kecil akan kurang daya tahannya jika dikulturkan, sementara bila terlalu besar akan sulit mendapatkan eksplan yang steril. Pertumbuhan atau morfogenesis eksplan dapat juga dipengaruhi oleh cara penempatan eksplan dalam medium. Faktor ini erat kaitannya dengan transportasi hara dan zat pengatur tumbuh ke dalam eksplan (Wattimena et al., 1992).
Menurut Ahloowalia et al. (2004), semua bagian dari tanaman dapat menjadi sumber eksplan. Bagian tanaman yang biasa digunakan sebagai eksplan adalah meristem pucuk, tunas, tunas aksilar, pucuk, bagian kecil batang, nuselus, dan embrio zygotik. Bagian tanaman seperti meristem, anther, polen, ovule, dan mikrospora sering dikulturkan untuk inisiasi kalus.
Media kultur Jaringan Tanaman
Pembentukan tunas secara in vitro baik melalui morfogenesis langsung maupun tidak langsung sangat tergantung pada jenis dan konsentrasi tepat dari senyawa organik, inorganik, dan zat pengatur tumbuh (Wattimena et al., 1992). Selain komponen penyusun media, faktor lain yang perlu diperhatikan adalah pH media kultur. pH media kultur sangat menentukan (1) kelarutan dari garam-garam penyusun media, (2) pengambilan (uptake) dari zat pengatur tumbuh dan garam-garam lain, dan (3) Efisiensi pembekuan agar-agar (Gunawan, 1992).
Media kultur jaringan dapat berupa media padat, semi padat, atau cair tergantung pada keberadaan dari pemadat media. Beberapa jaringan memiliki respon yang lebih baik pada media padat, dan lainnya pada media cair. Pada umumnya, pemilihan jenis media tergantung pada tujuan dan species tanaman yang dikulturkan (Prakash, 2004). Bahan pemadat yang paling banyak digunakan adalah agar-agar. Selain agar-agar, zat pemadat lain adalah gelrite dan Phytagel
yang merupakan polisakharida yang diproduksi dari bakteri (Byel, 2000).
Media kultur jaringan dibedakan menjadi media dasar dan media perlakuan. Komposisi media dasar adalah kombinasi zat yang mengandung hara esensial (makro dan mikro), sumber energi, dan vitamin. Beberapa media dasar yang banyak digunakan antara lain: Murashige dan Skoog (MS), B5, White, Vacin dan Went, N6, Schenk dan Hildebrandt, Woody Plant Medium (WPM), Nitsch dan Nitsch, dan Knop. Media MS adalah media dasar yang paling banyak digunakan (Gunawan, 1992). Tiap formula tersebut memiliki keunggulan masing-masing. Media dasar tersebut ada yang baik digunakan pada berbagai tanaman, dan ada yang baik untuk tanaman tertentu saja. Tidak ada garansi bahwa suatu media dasar baik untuk semua genotipe atau kultivar dalam spesies yang sama (LIPI, 1998).
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) adalah senyawa organik yang disintesis salah satu bagian tanaman dan dipindahkan ke bagian lain. ZPT pada konsentrasi yang sangat rendah mampu menimbulkan suatu respon fisiologis, biokimia, dan morfologis (Wattimena, 1988; Salisbury dan Ross, 1995). Menurut Wattimena (1988), peran ZPT dalam pertumbuhan dan perkembangan kultur sangat besar. ZPT mengawali reaksi-reaksi biokimia dan mengubah komposisi kimia di dalam media tanam, yang mengakibatkan terbentuknya organ tanaman seperti akar, daun, bunga, dan lain-lain. Beyl (2000) menambahkan, ZPT memberikan pengaruh pada eksplan jika diberikan dalam konsentrasi yang rendah (0.001 µM sampai 10 µM). Penggunaan ZPT pada konsentrasi yang rendah efektif dalam mengatur inisiasi dan perkembangan tunas dan akar pada eksplan serta embrio dalam media padat ataupun cair.
Zat pengatur tumbuh yang sering digunakan dalam kultur in vitro terdiri dari lima golongan yaitu auksin, sitokinin, giberelin, asam absisik, dan etilen (Anonim, 2003). Golongan ZPT yang sangat penting dalam kultur jaringan adalah auksin dan sitokinin (Gunawan, 1992; Beyl, 2000). Zat pengatur tumbuh dalam kultur jaringan pada umumnya digunakan secara kombinasi (Wattimena et al., 1992). Perbandingan serta interaksi auksin dan sitokinin pada media kultur sangat menentukan arah morfogenesis dalam pembentukan tunas dan akar (Wattimena et al., 1992; Prakash, 2004). Penggunaan nisbah auksin dan sitokinin untuk induksi tunas dan akar dapat berbeda pada satu genus, species bahkan kultivar suatu tanaman (Torres, 1989). Menurut Wetherell (1982), sitokinin dan auksin memiliki pengaruh yang berlawanan, oleh karena itu dalam pemakaian kedua ZPT tersebut harus mempertimbangkan perbandingannya dalam media. Perbandingan auksin-sitokinin yang tinggi baik untuk pembentukan tunas, sedangkan perbandingan auksin-sitokinin yang rendah baik untuk pembentukan akar.
dicapai bila dalam media ditambahkan sitokinin dengan konsentrasi 10 mg/l (Balittro, 1987).
Sitokinin
Golongan sitokinin adalah turunan dari adenin. Golongan ini sangat penting dalam pengaturan pembelahan sel dan morfogenesis (Wattimena, 1988; Gunawan, 1992). Selain pembelahan sel, sitokonin mampu menstimulasi pertumbuhan tunas dalam kultur in vitro. Sitokinin dengan konsentrasi yang tinggi (1-10 mg/l) mampu menginduksi pembentukan tunas, namun menghambat pembentukan akar (Byel, 2000). Menurut Wattimena (1988), sitokinin juga dapat mempengaruhi perkembangan embrio dan memperlambat proses penghancuran butir-butir klorofil. Pengaruh sitokinin pada berbagai proses tersebut diduga pada tingkat pembuatan protein, mengingat kesamaan struktur sitokinin dengan adenin yang merupakan komponen DNA dan RNA.
Sitokinin yang sering digunakan dalam kultur jaringan adalah BAP
(6-benzylaminopurine), 2iP (IPA) [N6-(2-isopentyl)adenine], Kinetin
(6-furfurylaminopurine), Thidiazuron (1-phenyl-3-(1,2,3-thiadiazol-5-yl), dan Zeatin (4-hydroxy-3-methyl-trans-2-butenylaminopurine) (Torres, 1989). Umumnya BAP lebih banyak digunakan karena relatif lebih murah dan tahan degradasi (Gunawan, 1992). Benzylaminopurin (BAP) paling baik digunakan untuk memacu pembentukan tunas karena BAP termasuk sitokinin yang dapat mendorong pembelahan sel-sel meristematik (George dan Sherington, 1984). Pierik (1987) menambahkan BAP dapat mendorong pembentukan tunas adventif dan mengurangi dominansi apikal.
Chitosan
Gambar 2. Struktur Chitosan (Tolaimatea et al., 2003)
Chitosan merupakan polimer kationik yang bersifat nontoksik, dapat mengalami biodegradasi dan bersifat biokompatibel. Chitosan dapat aktif dan berinteraksi dengan sel, enzim atau matrik polimer yang bermuatan negatif (Stephen, 1995) serta sebagai bahan antibakteri (Lim et al., 2002). Berdasarkan sifat-sifat tersebut, chitosan dapat digunakan sebagai zat aditif dan aman diaplikasikan dalam media kultur jaringan.
Penelitian yang telah dilakukan Nge et al. (2006), menyimpulkan chitosan dapat menstimulasi pertumbuhan tunas Dendrobium secara in vitro. Chitosan yang diisolasi dari cendawan dengan konsentrasi 15 ppm dan chitosan oligomer udang dengan konsentrasi 20 ppm adalah yang paling efektif terhadap propagasi protocorm kultur jaringan anggrek. Sebelumnya, Chang et al. (1998) menemukan bahwa elisitor chitosan dapat mengkonversikan pulegone menjadi menthol dengan konsentrasi optimum 200 mg/l dalam kultur suspensi kalus Mentha piperita
sehingga kadar Menthol meningkat. Chitogel, produk turunan dari chitosan, diketahui mampu meningkatkan pertumbuhan vegetatif pada planlet anggur. Penelitian ini menunjukkan rata-rata produksi O2 naik 2 kali lipat pada planlet yang dikulturkan pada media yang mengandung 1.75% chitogel dan fiksasi CO2 naik 1.5 kali lipat. Hal ini mengindikasi chitogel memiliki pengaruh yang menguntungkan terhadap hasil fotosintesis dan fisiologi planlet anggur (Ait Barka, 2004)
Aplikasi chitosan dan oligomer kitin meningkatkan aktifitas Phenylalanine Ammonia-lyase (PAL) dan Tyrosine Ammonia-lyase (TAL), enzim kunci dalam
(Ocimum basilicum L.) (Kim et al., 2005). PAL dan TAL dimodifikasi melalui
Phenylpropanoid pathways untuk menghasilkan prekursor metabolit sekunder, termasuk lignin, flavonoid pigmen, dan phytoalexins yang berperan penting dalam interaksi tanaman dengan patogen (Uthairatanakij et al., 2007). Pemberian chitosan meningkatkan aktifitas Polyphenol Oxidase (PPO) pada kultivar tahan penyakit (Thipyapong et al., 2004; Raj et al., 2006). Pra-inkubasi kultur suspensi sel gandum pada media pertumbuhan Pantoea agglomerans dengan kitin dan chitosan memberikan peningkatan yang besar pada aktifitas peroksidase ekstraselular (Ortmann dan Moerschbacher, 2006). Selain itu, chitosan mungkin terlibat dalam mengatur biosintesis fenolik. Hal ini ditunjukkan bahwa chitosan dapat menginduksi chitinase maupun chitosanase yang merupakan anggota kelompok Pathogenesisrelated (PR) protein tanaman (Collinge et al., 1993; van Loon et al., 1994). PR protein ini dapat mendegradasi dinding sel beberapa fitopatogen sehingga dapat berperan langsung dalam sistem pertahanan tanaman inang (Dixon et al., 1994; Graham dan Sticklen 1994).
In VitroMentha sp.
Gati dan Mariska dari Balai Penelitian Tanaman Obat dan Aromatik telah melakukan kultur jaringan Mentha Spp. pada tahun 1987. Eksplan yang digunakan berasal dari Mentha piperita dan Mentha crispa. Tujuan penelitian kultur jaringan Mentha piperita yang mereka lakukan ialah perbanyakan bibit
Mentha piperita secara in vitro dan hasilnya bibit Mentha piperita yang dihasilkan melalui kultur jaringan tidak berbeda jauh dengan bibit Mentha piperita yang diperbanyak secara konvensional melalui setek stolon.
Disamping penelitian perbanyakan vegetatif telah pula dilakukan penelitian untuk meningkatkan metabolisme sekunder pada Mentha piperita
secara in vitro. Eksplan jaringan daun atau batang yang ditanam dalam media MS dengan penambahan ZPT 2,4-dichlorophenoxyacetic acid (2,4-D) 1 mg/l memberikan hasil rata-rata berat kering kalus tertinggi yaitu 1,0285 g/botol. Analisis kandungan kalus hasil percobaan hanya dilakukan secara kualitatif (Mariska, 1989). Pertumbuhan dan produksi monoterpene pada M. piperita dan
M. citrata dapat ditingkatkan dengan mengkulturkan pucuk tanaman pada flask
esensial dari kultur suspensi sel Mentha piperita dapat ditingkatkan dengan melakukan kultur suspensi sel pada alat cell- recycled air- lift bioreactor selama 30 hari secara terus-menerus (Chung et al., 1994).
Kultur Mentha sp. secara in vitro menggunakan sumber eksplan dari pucuk muda tanaman Mentha sp. dari lapang yang telah disterilisasi. Kultur pucuk
Mentha sp. di ruang gelap selama tiga minggu hanya menghasilkan pulegone. Sedangkan kultur pucuk Mentha spp pada kondisi 16 jam cahaya per hari akan menghasilkan menthone, menthol, dan pulegone sebagai senyawa utama (Asai et al., 1994). Sumber eksplan yang berasal dari stolon tidak memuaskan karena jumlah tunas yang dihasilkan jauh lebih sedikit (6) dari eksplan yang berasal dari batang (21). Pengadaan bibit selanjutnya melalui kultur jaringan menggunakan sumber eksplan dari batang (Balittro, 1987)
Pengaruh 2,4 D, BAP, dan kinetin terhadap kalus dan tunas Mentha arvensis varietas Tempaku telah diteliti oleh Kurniawati (2004). Media MS dengan penambahan 0.5 mg/l BAP paling baik digunakan untuk menginduksi jumlah tunas, merangsang pertambahan tinggi tunas, menambah jumlah planlet, mempercapat peningkatan tinggi planlet, dan merangsang pembentukan daun M. arvensis var. Tempaku. Sedangkan untuk memacu pertumbuhan akar dapat digunakan media MS dengan penambahan auksin 3 mg/l 2,4 D. Kombinasi 1 mg/l 2.4 D dan 1 mg/l kinetin mampu menghasilkan kalus yang berwarna kecoklatan, remah, dan embriogenik serta dapat bertahan hidup lebih lama dengan tetap melakukan penambahan ukuran.
BAHAN DAN MET ODE PENELIT IAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Maret 2011 hingga bulan November 2011 di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor.
Alat dan Bahan Penelitian
Alat yang digunakan dalam penelitian ini adalah autoklaf untuk sterilisasi alat maupun media dengan tekanan 17.5 psi (pound per square inch) dan suhu 1210C, pH meter untuk mengukur derajat keasaman media yang sesuai, laminar air flow cabinet sebagai kotak pindah steril, shaker untuk proses sterilisasi bahan, dan neraca digital untuk mengukur massa, serta peralatan lainnya seperti magnetic stirrer, tabung erlenmeyer, gelas ukur, botol kultur, pipet volumetrik, tisu, pinset, gunting, cawan petri, dan bunsen.
Bahan tanaman yang digunakan dalam penelitian ini adalah pucuk Mentha piperita yang diperoleh dari petani di Cipanas, Jawa Barat. Bahan lain yang digunakan antara lain aquades, larutan stok media Murashige-Skoog (MS), Chitosan yang telah dilarutkan dengan pelarut asam asetat, 6-Benzylaminopurin
(BAP), larutan sterilan dengan bahan aktif sodium hipoklorit 5.25%, dan alkohol. Eksplan dikulturkan dahulu pada media dasar MS tanpa zat pengatur tumbuh untuk perbanyakan bahan tanaman penelitian sebelum dikultur pada media penelitian.
Metode Penelitian
� = �+ + + ( ) +� +�
Yijk = pengamatan pada konsentrasi Chitosan ke-i, konsentrasi BAP ke-j, dan ulangan ke-k {k = 1,2,3,...,15}
μ = rataan umum
αi = pengaruh konsentrasi Chitosan ke-i {i = 1,2,3} βj = pengaruh konsentrasi BAP ke-j {j = 1,2,...,5} (αβ)ij = pengaruh interaksi Chitosan ke-i dengan BAP ke-j
ρk = pengaruh aditif kelompok yang diasumsikan tidak ada interaksi dengan pengaruh perlakuan
εijk = pengaruh acak pada konsentrasi Chitosan ke-i, konsentrasi BAP ke-j dan ulangan ke-k
Pengolahan data menggunakan uji F dengan program aplikasi SAS (Statistical Analysis System). Faktor yang berpengaruh nyata dilakukan uji nilai tengah menggunakan DMRT (Duncan Multiple Range Test) pada taraf 5% (Mattjik dan Sumertajaya, 2006).
Pelaksanaan Percobaan Persiapan Alat
Alat yang digunakan selama proses penelitian harus dalam keadaan steril untuk meminimalkan kontaminasi. Alat-alat dicuci dengan deterjen dan dibilas air mengalir sampai bersih. Alat tanam seperti pinset, scalpel, gunting, dan cawan petri dibungkus terlebih dahulu menggunakan kertas selanjutnya disterilisasi bersama botol kultur dengan menggunakan autoklaf pada suhu 1210C dan tekanan 17.5 psi (pound per square inch) selama 60 menit.
Persiapan Media Perlakuan
telah diautoklaf disimpan selama 4 hari untuk memastikan media bebas dari mikroorganisme.
Sterilisasi Bahan Tanam
Pucuk Mentha piperita yang diambil dari lapang dicuci bersih dengan air mengalir kemudian direndam dalam larutan bakterisida (Agrept) dan fungisida (Dithane 45) yang masing-masing konsentrasinya 4 g/l selama 3 jam dengan alat shaker. Setelah direndam bakterisida dan fungisida, pucuk Mentha piperita dibilas air steril dua kali lalu direndam sambil dikocok dalam sodium hipoklorit 30% (v/v) selama 30 menit. Selanjutnya bilas sekali lalu direndam dan dikocok dalam sodium hipoklorit 10% (v/v) selama 10 menit. Pucuk yang telah disterilisasi langsung ditanam pada media MS tanpa zat pengatur tumbuh sebagai pra kondisi dan untuk perbanyakan bahan tanam sebelum disubkultur ke media perlakuan.
Subkultur Eksplan ke Media Perlakuan
Planlet pada media MS tanpa zat pengatur tumbuh disubkultur ke media perlakuan. Eksplan yang digunakan berupa buku tunggal dan bagian pucuk tidak digunakan sebagai eksplan. Setiap eksplan terdiri atas satu buku yang memiliki sepasang mata tunas. Masing-masing botol kultur ditanami tiga eksplan kemudian kultur disimpan dalam ruangan dengan suhu 250C dan cahaya 1000 lux selama delapan minggu.
Pengamatan
Peubah diamati setiap minggu selama 2 bulan dengan peubah yang diamati antara lain:
1. Persentase eksplan yang terkontaminasi
Persentase kontaminasi dihitung dari jumlah eksplan yang terkontaminasi oleh cendawan atau bakteri dibagi dengan jumlah seluruh eksplan dan dikali 100%.
2. Saat terbentuk tunas Mentha piperita in vitro
3. Persentasi eksplan Mentha piperita yang bertunas
Persentasi eksplan bertunas didapat dari jumlah eksplan yang menghasilkan tunas dibagi jumlah seluruh eksplan dari masing-masing perlakuan dan dikali 100%.
4. Jumlah tunas per eksplan Mentha piperita in vitro
Jumlah tunas yang tumbuh dari setiap eksplan diamati dan dihitung. 5. Tinggi Tunas Mentha piperita in vitro
Tinggi tunas diukur mulai dari pangkal tumbuh hingga ujung tunas. Pengukuran tinggi dilakukan dari luar botol kultur dengan cara menempelkan penggaris di dinding botol kultur dan posisi botol kultur harus sejajar dengan mata.
6. Jumlah buku per tunas Mentha piperita in vitro
Buku tunas adalah pertemuan tiap ruas yang ditandai dengan tumbuhnya daun. Jumlah buku tunas dihitung dari buku paling bawah hingga ujung dari setiap tunas.
7. Skor Warna batang tunas Mentha piperita in vitro
Warna batang planlet merupakan peubah kualitatif sehingga pengambilan data menggunakan sistem skor. Skor tertinggi adalah 3 dengan warna yang mendekati warna tanaman Mentha piperita di lapang.
Skor Keterangan
8. Skor pertumbuhan akar planlet Mentha piperita
Skor Keterangan
0 eksplan yang tidak tumbuh akar
1 eksplan yang memiliki jumlah akar kurang dari 10
2 eksplan yang memiliki jumlah akar lebih dari sama dengan 10 namun kurang dari 20
3 eksplan yang memiliki jumlah akar lebih dari sama dengan 10 namun kurang dari 20 dan panjang akarnya lebih dari 2 cm
4 eksplan yang memiliki jumlah akar lebih dari sama dengan 20
9. Persentase bobot kering
Persentase bobot kering dihitung dengan cara bobot kering dibagi bobot planlet segar dan dikali 100%. Pengamatan ini hanya menggunakan tiga ulangan kerena bersifat destruktif. Ulangan berupa planlet Mentha piperita
HASIL DAN PEMBAHASAN
Keadaan Umum Penelitian
Bahan tanam yang didapat dari lapang harus melalui proses sterilisasi sebelum masuk penelitian. Sterilisasi tidak mudah karena tanaman Mentha piperita berbentuk herba sehingga bagian pucuk dekat dengan tanah yang dapat menjadi sumber pathogen, selain itu morfologi tanaman yang sedikit berbulu menyebabkan larutan sterilan tidak dapat bekerja dengan optimal. Kendala ini dapat diatasi dengan menggunakan antibiotik dan surfaktan dalam sterilisasi. Proses sterilisasi membutuhkan waktu cukup lama sekitar 3 bulan. Setelah di dapat bahan tanam yang aseptik, bahan tanam tersebut diperbanyak pada media MS0 untuk memperoleh bahan eksplan penelitian.
Kontaminasi sudah terjadi di minggu pertama setelah tanam sebesar 2.52% dari total semua eksplan saat penelitian. Kontaminasi dapat disebabkan oleh cendawan atau bakteri. Kontaminasi cendawan sebesar 1.19% dari keseluruhan total eksplan sedangkan kontaminasi bakteri terjadi sebesar 1.33%. Saat pengamatan terakhir, yaitu 8 minggu setelah tanam, kontaminasi meningkat menjadi 8.59% dari total semua eksplan. Kontaminasi cendawan dan bakteri masing-masing meningkat menjadi 4.89% dan 3.70%.
Gambar 1. Eksplan Mentha piperita yang Terserang Bakteri
Kontaminasi bakteri dapat berasal dari alat tanam, eksplan, atau media. Menurut Evans et al. (2003), kontaminasi bakteri biasanya terbawa dari eksplan dengan karakteristik seperti lapisan lendir dan memiliki beberapa warna seperti
putih, pink, kuning, dan cream. Pada penelitian ini jenis bakteri yang menyerang adalah bakteri yang memiliki warna kuning dan putih. Selama bakteri belum kontak langsung dengan eksplan, eksplan dapat diselamatkan dengan cara pindah tanam ke media yang steril.
Gambar 2. Eksplan Mentha piperita yang Terserang Cendawan
Kontaminasi cendawan kemungkinan besar terjadi saat proses subkultur eksplan ke media perlakuan. Kontaminasi ini ditandai dengan adanya hifa yang muncul pada eksplan atau media. Saat cendawan muncul, cendawan akan menutupi eksplan dengan cepat dan menyebabkan kematian eksplan. Seluruh eksplan yang terkontaminasi cendawan pada penelitian ini tidak berhasil disterilisasi.
Jumlah eksplan mati yang bukan disebabkan bakteri maupun cendawan sebanyak 8 dari 675 eksplan. Eksplan yang mati tidak menunjukkan tanda-tanda pertumbuhan dan berwarna coklat dari minggu pertama sampai kedelapan setelah tanam. Eksplan mati disebabkan saat subkultur planlet induk alat tanam yang digunakan terlalu panas setelah dibakar pada bunsen atau karena eksplan dibiarkan terlalu lama di cawan petri setelah disubkultur.
Saat Terbentuk Tunas Aksilar Mentha piperitaIn Vitro
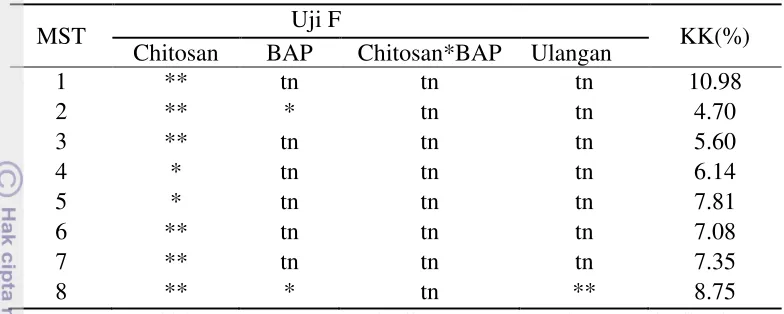
Berdasarkan hasil analisis terhadap data yang dikumpulkan, ternyata perlakuan tunggal Chitosan maupun BAP berpengaruh sangat nyata terhadap saat munculnya tunas. Sementara, interaksi antara Chitosan dan BAP tidak berpengaruh nyata terhadap saat munculnya tunas (Tabel 1).
Tabel 1. Sidik Ragam Saat Muncul Tunas Aksilar In Vitro M. piperita
pada Media MS dengan Penambahan Chitosan dan BAP.
Uji F
KK (%)
Chitosan BAP Chitosan*BAP Ulangan
** ** tn tn 6.84
Keterangan: tn = Tidak berpengaruh nyata pada uji F
** = Berpengaruh sangat nyata pada uji F dengan taraf 1 % KK = Koefisien Keragaman
Perlakuan tanpa Chitosan menunjukkan rata-rata waktu muncul tunas yang tercepat yaitu 4.7 hari setelah tanam dan konsentrasi Chitosan 20 mg/l menunjukkan rata-rata waktu muncul tunas yang terlama yaitu 6.2 hari setelah tanam. Hal ini berarti Chitosan berpengaruh sangat nyata menghambat waktu muncul tunas Mentha piperita. Pengaruh tersebut tidak diharapkan dalam pertumbuhan tunas dan produksi bibit karena semakin lama waktu muncul tunas akan semakin lama tersedianya sumber eksplan untuk propagasi. Uji nilai tengah faktor tunggal Chitosan terhadap saat muncul tunas Mentha piperita disajikan pada Tabel 2 berikut. tidak berbeda nyata menurut uji DMRT taraf 5%.
KK = Koefisien keragaman
Tabel 3. Saat Muncul Tunas Aksilar In Vitro Mentha piperita pada menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
KK = Koefisien keragaman
Persentase Eksplan Mentha piperita In Vitro yang Bertunas
Tunas tumbuh dari ketiak daun karena eksplan yang digunakan dalam penelitian ini adalah organ buku dari planlet induk. Tunas in vitro Mentha piperita
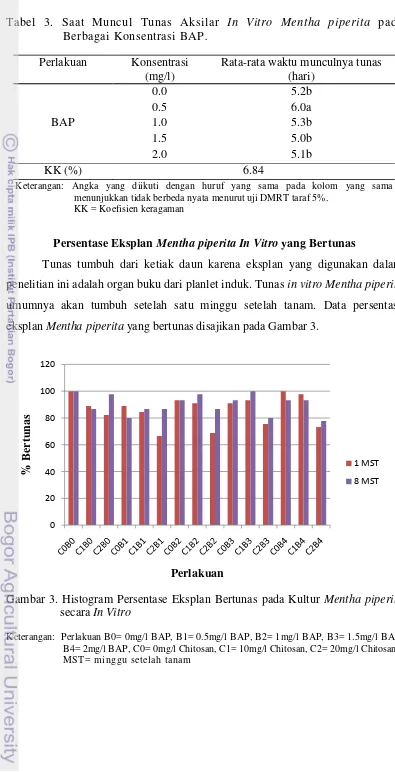
umumnya akan tumbuh setelah satu minggu setelah tanam. Data persentase eksplan Menthapiperita yang bertunas disajikan pada Gambar 3.
Gambar 3. Histogram Persentase Eksplan Bertunas pada Kultur Mentha piperita
secara In Vitro
Persentase eksplan bertunas tertinggi pada minggu pertama setelah tanam terjadi pada perlakuan C0B0 (Chitosan 0 mg/l dan BAP 0 mg/l) dan C0B4 (Chitosan 0 mg/l dan BAP 2 mg/l) dengan jumlah eksplan 45 dan persentase 100%. Perlakuan C2B1 (Chitosan 20 mg/l dan BAP 0.5 mg/l) memiliki jumlah dan persentase bertunas terendah yaitu sebesar 30 eksplan dan 66.67%. Total eksplan yang bertunas pada minggu pertama setelah tanam adalah 583 dari 675 eksplan dengan persentase 86.37%.
Pada minggu ke delapan setelah tanam, perlakuan C0B0 memiliki persentase eksplan bertunas tertinggi. Selain C0B0, perlakuan C1B3 (Chitosan 10 mg/l dan BAP 1.5 mg/l) juga memiliki persentase eksplan bertunas 100% dengan jumlah eksplan yang bertunas 45. Perlakuan C2B4 (Chitosan 20 mg/l dan BAP 2 mg/l) memiliki jumlah dan persentase bertunas terendah yaitu sebesar 35 eksplan dan 77.78%. Total eksplan yang bertunas pada minggu kedelapan setelah tanam adalah 609 dari 675 eksplan dengan persentase 90.22%.
Jumlah eksplan bertunas yang bertambah pada minggu kedelapan dari minggu pertama karena ada eksplan yang baru bertunas setelah pengamatan di minggu pertama. Penurunan jumlah eksplan yang bertunas pada minggu kedelapan dari minggu pertama disebabkan oleh adanya kematian eksplan akibat kontaminasi selama waktu pengamatan.
Jumlah Tunas per Eksplan
Tabel 4. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP terhadap Jumlah Tunas per Eksplan Mentha piperita.
MST Uji F KK(%)
Chitosan BAP Chitosan*BAP Ulangan
1 ** tn tn tn 10.98
Keterangan: tn = Tidak berpengaruh nyata pada uji F, * = Berpengaruh nyata pada uji F dengan taraf 5 %, ** = Berpengaruh sangat nyata pada uji F dengan taraf 1 %, KK = Koefisien Keragaman, MST = Minggu Setelah Tanam.
Sidik ragam terhadap jumlah tunas per eksplan Mentha piperita
menunjukkan Chitosan memberikan pengaruh yang nyata, BAP hanya memberikan pengaruh yang nyata pada 2 dan 8 minggu setelah tanam, sedangkan interaksi Chitosan dan BAP tidak memberikan pengaruh yang nyata selama pengamatan. Hasil uji nilai tengah Duncan Multiple Range Test (DMRT) pada pengaruh konsentrasi Chitosan terhadap jumlah tunas per eksplan Mentha piperita
disajikan pada Tabel 5.
Tabel 5. Jumlah Tunas per Eksplan Mentha piperita pada Berbagai Konsenterasi Chitosan. tidak berbeda nyata menurut uji DMRT taraf 5%.
KK = koefisien keragaman
Berdasarkan tabel di atas, semakin tinggi konsentrasi Chitosan pada media maka semakin rendah jumlah tunas yang dihasilkan tiap eksplan Mentha piperita. Chitosan memberikan pengaruh negatif terhadap pertumbuhan tunas planlet. Pengaruh ini justru tidak diharapkan dalam proliferasi tunas Mentha piperita
Tabel 6. Jumlah Tunas per Eksplan Mentha piperita pada Berbagai Konsentrasi BAP saat 2 dan 8 MST.
Konsentrasi BAP (mg/l) Jumlah tunas/ eksplan
2 MST 8 MST menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
MST = minggu setelah tanam KK = koefisien keragaman
Tabel 7 menunjukkan persentasi jumlah eksplan yang menghasilkan tunas lebih dari dua di masing-masing perlakuan. Persentase eksplan yang membentuk tunas lebih dari 2 pada media tanpa Chitosan lebih tinggi dibandingkan persentase eksplan pada media dengan Chitosan 10 mg/l dan 20 mg/l. Hal ini menunjukkan bahwa Chitosan dapat menghambat pertumbuhan tunas Mentha piperita secara in vitro. Terjadinya proliferasi tunas Mentha piperita in vitro pada media MS dengan penambahan berbagai konsentrasi Chitosan dan BAP disajikan lebih jelas pada Gambar 4.
Gambar 4. Proliferasi Tunas pada eksplan Mentha piperita secara in Vitro
pada media MS dengan penambahan Chitosan dan BAP
Keterangan: (A) Media MS + 1.5 mg/l BAP
(B) Media MS + 1.5 mg/l BAP + 20 mg/l Chitosan
Tinggi Tunas Mentha piperita in Vitro
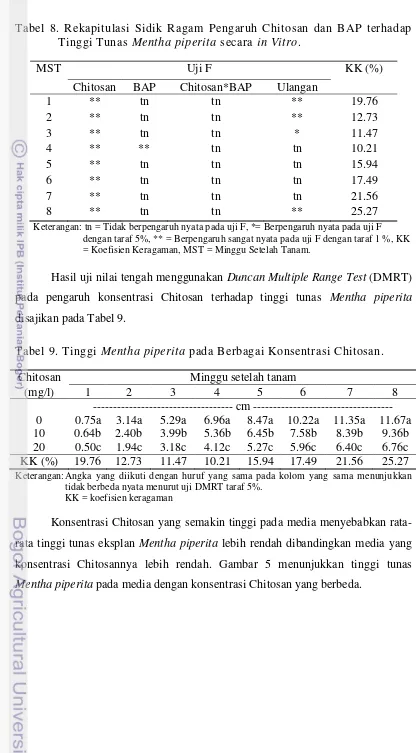
Chitosan berpengaruh sangat nyata pada minggu pertama sampai kedelapan setelah tanam sedangkan BAP hanya berpengaruh sangat nyata saat minggu keempat setelah tanam terhadap tinggi tunas Mentha piperita secara in vitro. Interaksi Chitosan dan BAP tidak memiliki pengaruh yang nyata terhadap tinggi tunas Mentha piperita. Hasil sidik ragam pengaruh Chitosan dan BAP terhadap tinggi tunas Mentha piperita disajikan pada Tabel 8.
Tabel 8. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP terhadap Tinggi Tunas Mentha piperita secara in Vitro.
MST Uji F KK (%)
Keterangan: tn = Tidak berpengaruh nyata pada uji F, *= Berpengaruh nyata pada uji F dengan taraf 5%, ** = Berpengaruh sangat nyata pada uji F dengan taraf 1 %, KK = Koefisien Keragaman, MST = Minggu Setelah Tanam.
Hasil uji nilai tengah menggunakan Duncan Multiple Range Test (DMRT) pada pengaruh konsentrasi Chitosan terhadap tinggi tunas Mentha piperita
disajikan pada Tabel 9.
Tabel 9. Tinggi Mentha piperita pada Berbagai Konsentrasi Chitosan.
Chitosan Minggu setelah tanam
(mg/l) 1 2 3 4 5 6 7 8
tidak berbeda nyata menurut uji DMRT taraf 5%. KK = koefisien keragaman
Konsentrasi Chitosan yang semakin tinggi pada media menyebabkan rata-rata tinggi tunas eksplan Mentha piperita lebih rendah dibandingkan media yang konsentrasi Chitosannya lebih rendah. Gambar 5 menunjukkan tinggi tunas
Gambar 5. Perbandingan Tinggi Planlet Mentha piperita pada Perlakuan BAP yang Sama
Hasil uji nilai tengah menggunakan Duncan Multiple Range Test
(DMRT) pada pengaruh konsentrasi BAP terhadap tinggi tunas per eksplan
Mentha piperita disajikan pada Tabel 10.
Tabel 10. Tinggi Mentha piperita secara in Vitro pada Berbagai Konsentrasi BAP saat 4 MST
Konsentrasi BAP (mg/l) Tinggi Tunas (cm)
0.0 5.06c
0.5 5.17bc
1.0 5.73ab
1.5 5.36bc
2.0 6.10a
KK (%) 10.21
Keterangan: Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
MST= minggu setelah tanam
Secara umum, konsentrasi BAP tidak berpengaruh nyata terhadap tinggi tunas namun pada minggu keempat setelah tanam, media dengan penambahan BAP 2.0 mg/l dengan rata-rata tunas tertinggi yaitu 6.10 cm. Eksplan yang ditumbuhkan dengan BAP cenderung menghasilkan tunas yang tinggi karena BAP meningkatkan pembelahan sel yang dikenal dengan sitokinesis.
sangat nyata dengan nilai Korelasi Pearson sebesar 84 %. Korelasi tersebut menunjukkan makin pendek tunas maka makin sedikit jumlah buku yang dapat disubkultur untuk dijadikan sumber eksplan.
Jumlah Buku Aktif per Planlet Mentha piperita in Vitro
Buku aktif mencerminkan tingkat proliferasi tunas karena perbanyakan planlet M. piperita dilakukan menggunakan buku aktif. Chitosan memberikan pengaruh yang nyata pada dua sampai delapan minggu setelah tanam sedangkan BAP memiliki pengaruh yang nyata saat minggu kedua dan ketujuh setelah tanam terhadap jumlah buku aktif per planlet M. piperita. Interaksi antara Chitosan dengan BAP berpengaruh nyata terhadap jumlah buku aktif per planlet Mentha piperita saat minggu kelima dan keenam setelah tanam. Hasil sidik ragam rata-rata jumlah buku Mentha piperita ditampilkan pada Tabel 11.
Tabel 11. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP terhadap Jumlah Buku Mentha piperita.
MST Chitosan BAP Perlakuan Chitosan*BAP Ulangan KK (%)
1 tn tn tn ** 10.30
2 ** * tn ** 7.39
3 ** tn tn ** 7.94
4 ** tn tn * 6.84
5 ** tn * tn 9.38
6 ** tn ** * 10.23
7 ** * tn * 16.50
8 * tn tn ** 25.53
Keterangan: tn = Tidak berpengaruh nyata pada uji F, * = Berpengaruh sangat nyata pada Uji F dengan taraf 5 %, ** = Berpengaruh sangat nyata pada Uji F dengan taraf 1 %, KK = Koefisien Keragaman, MST = Minggu Setelah Tanam.
Hasil uji nilai tengah menggunakan Duncan Multiple Range Test (DMRT) pada pengaruh konsentrasi Chitosan terhadap jumlah buku Mentha piperita
Tabel 12. Jumlah Buku Aktif per Eksplan Mentha piperita secara in Vitro
pada Berbagai Konsentrasi Chitosan.
Chitosan Jumlah buku/ eksplan
(mg/l) 2 MST 3 MST 4 MST 7 MST 8 MST menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
MST = minggu setelah tanam.
Berdasarkan Tabel 12, semakin tinggi konsentrasi Chitosan pada media maka semakin sedikit jumlah buku yang dihasilkan tiap tunas Mentha piperita. Hal ini berbanding lurus dengan tinggi tunas yang semakin pendek saat konsentrasi Chitosan meningkat.
Uji nilai tengah DMRT pengaruh BAP terhadap jumlah buku per eksplan
M. piperita saat minggu kedua dan ketujuh setelah tanam ditampilkan di Tabel 13.
Tabel 13. Jumlah Buku Aktif per Eksplan Mentha piperita pada Berbagai Konsentrasi BAP saat 2 dan 7 MST.
Konsentrasi BAP Jumlah buku/ ekplan
(mg/l) 2 MST 7 MST menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
KK= koefisien keragaman MST = minggu setelah tanam.
Interaksi Chitosan dan BAP berpengaruh nyata saat 5 dan 6 minggu setelah tanam. Media MS tanpa Chitosan dengan penambahan 1.5 mg/l BAP menghasilkan jumlah buku Mentha piperita terbanyak saat 5 MST dengan rata-rata 13.16 buku aktif per planlet. Perlakuan yang sama juga menghasilkan jumlah buku aktif terbanyak saat 6 MST (Tabel 14).
Tabel 14. Jumlah Buku Mentha piperita pada Interaksi Chitosan dan BAP Saat 6 MST menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
KK= koefisien keragaman
Media MS dengan penambahan BAP 1.5 mg/l tanpa Chitosan menghasilkan jumlah buku terbanyak dengan rata-rata 15.63 buku aktif per planlet pada 6 MST. Jumlah buku aktif penting dalam perbanyakan tanaman kultur jaringan karena buku merupakan sumber eksplan tunas aksilar. Semakin banyak jumlah buku yang dihasilkan semakin banyak jumlah tunas aksilar untuk perbanyakan bibit Mentha piperita.
Gambar 6. Buku Mentha piperita yang Mati Saat Usia Planlet Tujuh Minggu
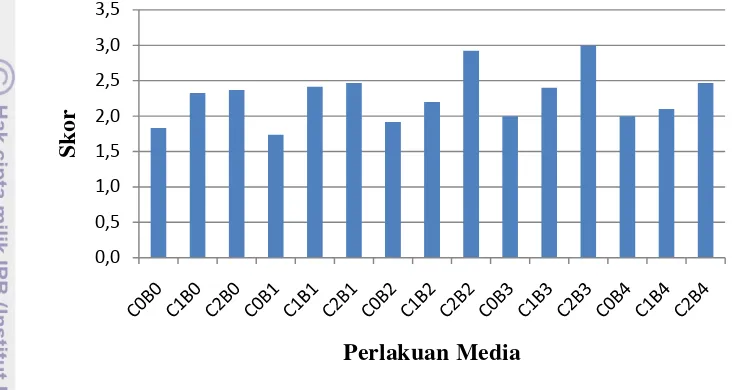
Warna Batang Tunas In Vitro Mentha piperita
Warna batang merupakan peubah kualititatif sehingga data yang diambil digolongkan berdasarkan skor dengan skala 0-3. Skor tertinggi untuk warna batang hijau keunguan (Gambar 7). Warna hijau keunguan ini mendekati warna batang tanaman Mentha piperita yang tumbuh in vivo (di lapang).
Gambar 7. Skor Warna Batang Planlet Mentha Piperita Skor 0 (A), Skor 1 (B), Skor 2 (C), Skor 3 (D).
Keterangan: skor 0= warna planlet yang vitreous, 1= warna planlet hijau muda, 2= warna planlet hijau tua, 3= warna planlet hiaju keunguan.
A B
Planlet Mentha piperita memiliki warna yang seragam sampai empat minggu setelah tanam, karena itu pengamatan dimulai dari minggu kelima hingga kedelapan setelah tanam. Data rata-rata skor warna batang tunas Mentha piperita
saat 8 MST disajikan pada Gambar 8 berikut.
Gambar 8. Skor Warna Batang Planlet M. piperita saat 8 MST
Keterangan: Perlakuan B0= 0mg/l BAP, B1= 0.5mg/l BAP, B2= 1mg/l BAP, B3= 1.5mg/l BAP, B4= 2mg/l BAP, C0= 0mg/l Chitosan, C1= 10mg/l Chitosan, C2= 20mg/l Chitosan
Gambar 8 menunjukkan skor warna batang planlet M. piperita yang ditanam dalam media dengan penambahan Chitosan 20 mg/l (C2) lebih tinggi dibandingkan yang ditanam pada media C0 dan C1 pada konsentrasi BAP yang sama. Warna batang Mentha piperita semakin mendekati hijau keunguan pada media tanam yang lebih tinggi konsentrasi Chitosannya.
Chitosan meningkatkan aktifitas enzim yang memproduksi prekursor metabolit sekunder, termasuk lignin (Uthairatanakij et al., 2007). Diduga lignin pada batang planlet M. piperita yang ditanam di media MS dengan penambahan Chitosan bertambah sehingga batang planlet menjadi lebih tebal dan berwarna hijau keunguan. Hal tersebut dapat memberikan pengaruh positif terhadap pertahanan planlet dari serangan mikroorganisme dan meningkatkan vigor planlet ketika diaklimatisasi.
Rata-rata skor warna batang Mentha piperita berkurang pada saat minggu ketujuh setelah tanam. Hal ini disebabkan warna batang planlet yang memucat bahkan ada beberapa planlet yang mengalami browning. Browning adalah gejala
senesensi pada planlet yang ditunjukkan dengan daun, batang, atau akar yang berwarna kecokelatan. Oleh sebab itu, planlet M. piperita harus disubkultur saat empat atau lima minggu setelah tanam untuk menghindari kekurangan buku aktif akibat browning.
Pertumbuhan Akar Mentha piperita In Vitro
Akar planlet Mentha piperita berjenis serabut dan pertumbuhannya tidak teratur. Hal ini menyulitkan pengamatan sehingga pertumbuhan akar diamati menggunakan sistem skor (Gambar 9). Pengamatan dengan sistem skor dilakukan untuk mengefisiensikan waktu pengamatan agar peneliti dapat mengamati semua peubah dari 225 satuan amatan (satu ulangan) dalam satu hari.
Gambar 9. Pertumbuhan Akar Mentha piperita dengan Skor 1 (A), Skor 2 (B), Skor 3 (C), dan Skor 4 (D).
Keterangan: skor 0= tidak ada akar, 1= jumlah akar < 10, 2= 10≤ jumlah akar <20, 3= 10≤ jumlah akar <20 dan panjangnya >2 cm, 4= jumlah akar ≥20.
Pengamatan akar dilakukan mulai minggu kelima hingga kedelapan setelah tanam ketika melihat adanya perbedaan pertumbuhan akar Mentha piperita
secara in vitro dari masing-masing perlakuan. Sidik ragam pengaruh Chitosan dan BAP ditunjukkan pada Tabel 15.
A
D B
Tabel 15. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP terhadap Pertumbuhan Akar Mentha piperita secara in Vitro.
MST Chitosan BAP Perlakuan Chitosan*BAP Ulangan KK (%)
5 ** tn tn ** 20.88
6 ** tn tn ** 17.84
7 ** tn tn ** 18.94
8 ** tn ** ** 13.28
Keterangan: tn = Tidak berpengaruh nyata pada uji F, * = Berpengaruh nyata pada uji F dengan taraf 5 %, ** = Berpengaruh sangat nyata pada uji F dengan taraf 1 %, KK = Koefisien Keragaman, MST = Minggu Setelah Tanam.
Chitosan memberikan pengaruh yang sangat nyata sebaliknya BAP tidak memberikan pengaruh yang nyata terhadap pertumbuhan akar Mentha piperita
secara in vitro. Interaksi Chitosan dengan BAP berpengaruh sangat nyata terhadap akar Mentha piperita di akhir pengamatan. Uji nilai tengah DMRT pengaruh Chitosan terhadap pertumbuhan akar M. piperita in vitro memperoleh hasil yang disajikan pada Tabel 16.
Tabel 16. Pengaruh Konsentrasi Chitosan terhadap Skor Akar Mentha piperita secara in Vitro.
Konsentrasi Chitosan Rata-rata skor akar
(mg/l) 5 MST 6 MST 7 MST tidak berbeda nyata menurut uji DMRT taraf 5%
MST = minggu setelah tanam.
Tabel 17. Skor Pertumbuhan Akar Mentha piperita pada Berbagai Interaksi Chitosan dan BAP Saat 8 MST.
Konsentrasi BAP menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
KK= koefisien keragaman
Interaksi Chitosan dan BAP terhadap pertumbuhan akar Mentha piperita
yang menghasilkan skor akar tertinggi saat 8 MST yaitu media MS tanpa Chitosan dan penambahan 1.5 mg/l BAP dengan skor 3.72. Artinya eksplan yang dikulturkan pada komposisi media MS ditambah 1.5 mg/l BAP memiliki akar yang jumlahnya lebih dari sama dengan 20 dan panjangnya lebih dari 2 cm.
Akar merupakan organ tanaman yang berfungsi menyerap unsur hara yang dibutuhkan tanaman untuk tumbuh dan berkembang. Terhambatnya pertumbuhan akar pada media perlakuan dengan Chitosan menyebabkan jumlah tunas, jumlah buku, dan tinggi tunas planlet Mentha piperita ikut terhambat. Selain itu, akar yang pendek dan jumlahnya yang sedikit dapat menyebabkan tanaman sulit bertahan saat aklimatisasi.
Terdapat dua mekanisme yang diduga menghambat pertumbuhan akar planlet M. piperita. Mekanisme pertama, Chitosan merupakan polimer kationik yang dapat berikatan dengan unsur anion (Aranaz, 2009). Unsur fosfor (P) yang merangsang pertumbuhan akar diserap oleh akar dalam bentuk H2PO4- (Madjid, 2007), tetapi karena ada Chitosan dalam media perlakuan planlet M. piperita
sehingga terjadi persaingan antara akar dengan chitosan dalam mengikat unsur P. Kekurangan fosfor menyebabkan pertumbuhan akar planlet terhambat dan meyebabkan penyerapan hara oleh akar juga terhambat.
tanaman dari mikroorganisme namun jika berlebihan akan menjadi toksik bagi tanaman. Fenolik pada media tanam menghambat pertumbuhan akar sehingga akar tidak menyerap hara dengan optimal.
Persentase Bobot Kering Planlet Mentha piperita
Chitosan merupakan biopolimer sakarida yang dihasilkan dari proses deasetilasi kitin (Hadwiger, 2006). Polisakarida yang dikandung Chitosan diduga dapat meningkatkan biomassa pada planlet Mentha piperita. Menurut hasil sidik ragam, Chitosan memberikan pengaruh yang sangat nyata terhadap persentase bobot kering planlet Mentha piperita (Tabel 18).
Tabel 18. Rekapitulasi Sidik Ragam Pengaruh Chitosan dan BAP terhadap Persentase Bobot Kering Planlet Mentha piperita.
Perlakuan
KK (%)
Chitosan BAP Chitosan*BAP Ulangan
** tn tn ** 23.47
Keterangan: tn = Tidak berpengaruh nyata pada uji F
** = Berpengaruh sangat nyata pada uji F dengan taraf 1 % KK = koefisien keragaman
Hasil uji nilai tengah DMRT persentase bobot kering planlet Mentha piperita pada berbagai konsentrasi Chitosan ditampilkan pada Gambar 10.
Gambar 10. Persentase Bobot Kering Planlet Mentha piperita pada Media
Persentase bobot kering terbesar yaitu 10.87% terdapat pada perlakuan media dengan konsentrasi Chitosan 20 mg/l. Berdasarkan hasil uji nilai tengah, persentase bobot kering pada perlakuan Chitosan 20 mg/l berbeda sangat nyata dari perlakuan Chitosan 0 dan 10 mg/l. Hal ini berarti Chitosan dapat meningkatkan biomassa dari bobot planlet Mentha piperita segar. Chitosan meningkatkan aktifitas enzim yang memproduksi prekursor metabolit sekunder, termasuk lignin (Uthairatanakij et al., 2007). Hal ini yang diduga meningkatkan persentase biomasa planlet M. piperita yang dikulturkan pada media MS dengan penambahan Chitosan.
Penambahan Chitosan menghambat munculnya tunas, tinggi planlet, jumlah tunas per eksplan, jumlah buku per eksplan, dan pertumbuhan akar
Mentha piperita. Menurut Wiendi et al. (1992), secara umum pembentukan tunas secara in vitro baik melalui morfogenesis langsung ataupun tidak langsung sangat tergantung pada jenis dan konsentrasi yang tepat dari senyawa organik, inorganik, dan zat pengatur tumbuh (ZPT). Berdasarkan pernyataan diatas, konsentrasi Chitosan 10 dan 20 mg/l diduga tidak sesuai terhadap pertumbuhan vegetatif planlet M. piperita. Perlu diteliti lebih lanjut dengan konsentrasi Chitosan yang lebih rendah terhadap proliferasi Mentha piperita in vitro.
Konsentrasi Chitosan menunjukkan pengaruh yang baik terhadap peubah pengamatan warna batang dan persentase bobot kering planlet Mentha piperita. Pitta-Alvarez et al. (2000), menyatakan tidak semua tanaman kultur merespon elisitor, dan beberapa elisitor menginduksi rute metabolisme yang berbeda dari target yang diinginkan. Elisitor yang digunakan oleh Pitta-Alvarez dan Giulietti dalam penelitian mereka adalah Chitosan. Elisitor Chitosan berhasil meningkatkan kandungan alkaloid pada akar tanaman Brugmansia candida. Berdasarkan hal ini, pengaruh Chitosan yang menghambat pertumbuhan vegetatif
Mentha piperita sedangkan planlet yang dihasilkan setiap perlakuan dari penelitian tidak mencapai batas minimal proses ekstraksi tersebut.
Penyediaan Bibit Mentha piperita secara in Vitro
Salah satu tujuan kultur jaringan ialah penyediaan bibit. Pertumbuhan dan perkembangan Mentha piperita secara in vitro cukup cepat. Oleh karena itu, untuk mengetahui jumlah bibit yang dapat dihasilkan, perlu dilakukan perhitungan jumlah bibit Mentha piperita yang diperoleh dalam 1 tahun.
Tabel 19. Rata-rata Jumlah Buku per Eksplan Mentha piperita pada Media MS dengan Penambahan Chitosan dan BAP.
Perlakuan Minggu setelah tanam
1 2 3 4 5 6 7 8
Keterangan: Perlakuan B0= 0mg/l BAP, B1= 0.5mg/l BAP, B2= 1mg/l BAP, B3= 1.5mg/l BAP, B4= 2mg/l BAP, C0= 0mg/l Chitosan, C1= 10mg/l Chitosan, C2= 20mg/l Chitosan
Y = B x An x (1-M) = 1 x 910 x (1-0.098) = 3 145 079 530
Keterangan: Y = jumlah planlet yang dihasilkan
A = jumlah tunas yang dihasilkan setiap subkultur (faktor multiplikasi) B = jumlah eksplan yang ditanam
n = jumlah subkultur pada periode tertentu (1 tahun) M = % eksplan yang mati dan terkontaminasi (Mariska, 2012)
Eksplan Mentha piperita yang dihasilkan dari 1 tunas aksilar yang dikulturkan pada MS0 dan disubkultur setiap bulan selama 1 tahun menghasilkan 3 145 079 530 planlet dengan asumsi kontaminasi dan jumlah eksplan mati sama dengan saat penelitian sebesar 9.8 %, serta tidak ada pengaruh eksternal seperti tenaga kerja dan kapasitas laboratorium.
KESIMPULAN
1. BAP memberikan pengaruh yang nyata terhadap waktu muncul tunas namun tidak berpengaruh nyata saat 8 MST terhadap jumlah tunas per eksplan, tinggi tunas, jumlah buku per eksplan, pertumbuhan akar, dan persentase bobot kering Mentha piperita secara in vitro. Media MS dengan penambahan 1.5 mg/l BAP tanpa Chitosan memberikan pengaruh terbaik terhadap pertumbuhan vegetatif planlet Mentha piperita namun tidak berbeda nyata dengan media MS tanpa BAP.
2. Chitosan secara nyata menghambat munculnya tunas, jumlah tunas per eksplan, tinggi tunas, jumlah buku per eksplan, dan pertumbuhan akar
Mentha piperita secara in vitro. Perlakuan media dengan penambahan Chitosan memberikan hasil terbaik pada warna batang dan persentase bobot kering planlet Mentha piperita.
3. Interaksi Chitosan dan BAP tidak memberikan pengaruh yang nyata terhadap waktu muncul tunas, jumlah tunas per eksplan, tinggi tunas, dan persentase bobot kering Mentha piperita secara in vitro. Namun berinteraksi nyata terhadap jumlah buku per eksplan saat 5 dan 6 MST, serta pertumbuhan akar saat 8 MST.
4. Perlakuan terbaik untuk waktu muncul tunas, jumlah buku, dan pertumbuhan akar planlet Mentha piperita adalah media dasar MS dengan penambahan 1.5mg/l BAP dan tanpa Chitosan, namun perlakuan ini tidak berbeda nyata dengan media MS tanpa penambahan BAP dan Chitosan (MS0).
DAFTAR PUST AKA
Ahloowalia, B.S., J. Prakash, V.A. Savangikar, and C. Savangikar. 2004. Plant Tissue Culture. Proceedings of a Technical Meeting. FAO/IAEA Division of Nuclear Techniques in Food and Agriculture. Viena. 1-30.
Ait Barka ,E., P. Eullaffroy, C. Clément, and G. Vernet. 2004. Chitosan improves development, and protects Vitis vinifera L. against Botrytis cinerea. Plant Cell Reports22:608-614.
Anonim. 2003. Plant tissue culture. www.oup.com. [12 september 2010].
Aranaz, I. 2009. Functional characterization of chitin and chitosan. Current Chemical Biology 3:203-230.
Asai, I., K. Yoshihira, T. Omoto, N. Sakui, and K. Shimomura. 1994. Growth and monoterpene production in shoot culture and regenerates of Mentha arvensis. Plant Tissue Culture Letters 11(3): 218-225.
Balai Penelitian Tanaman Obat dan Aromatik. 1986. Kemungkinan Pembudidayaan Tanaman Penghasil Minyak Atsiri Potensial, Panili, dan Lidah Buaya. Departemen Pertanian. Bogor.
Balai Penelitian Tanaman Obat dan Aromatik. 1987. Laporan Perbanyakan Tanaman Mentha Melalui Kultur Jaringan. Departemen Pertanian. Bogor.
Beyl, C.A. 2000. Getting started with tissue culture, media preparation, sterile technique and laboratory equipment, p. 21-38. In Robert N. Trigiano and Dennis J. Gray (Eds.). Plant Tissue Culture Concept and Laboratory Exercise Second Edition. CRC Press. New York.
BPS. 2001 – 2007. Statistik Impor tahun 2000 – 2006.
Caponetti J.D., D.J. Gray, and R.N. Trigiano. 2000. History of plant tissue and cell culture, p. 11-17. In Robert N. Trigiano and Dennis J. Gray (Eds.). Plant Tissue Culture Concept and Laboratory Exercise Second Edition. CRC Press. New York.
Chang, J.H., J.H. Shin, I.S. Chung, and H.J. Lee. 1998. Improved menthol production from chitosan-elicited suspension culture of Mentha piperita. Biotechnology Letters 20(12): 1097–1099.