1
KARAKTERISASI FISIK DAN OPTIK
LARUTAN TEH HIJAU BERDASARKAN
VARIASI WAKTU DAN SUHU PENYIMPANAN
MILA ARMIGUSTIEN
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
2
ABSTRAK
MILA ARMIGUSTIEN. Karakterisasi Fisik dan Optik Larutan Teh Hijau Berdasarkan Variasi Waktu dan Suhu Penyimpanan. Dibimbing oleh Ir. HANEDI DARMASETIAWAN,M.S dan
Dr. AKHIRUDDIN MADDU,M.Si.
Teh (Camellia sinensis L.) merupakan salah satu bahan penyegar yang sangat banyak dikonsumsi dan dapat memberikan pengaruh diet bagi kesehatan dan terapi. Kandungan utama yang terdapat dalam teh adalah golongan polifenol yaitu tanin. Teh yang tersebar berupa teh hijau, teh hitam, dan teh oolong. Tujuan dalam penelitian ini mengetahui dan mempelajari karakterisasi fisik dan optik larutan teh hijau berdasarkan variasi waktu dan lama penyimpanan. Karakterisasi fisik yang dilakukan adalah kerapatan dan viskositas. Karakterisasi optik yang dilakukan dengan menggunakan spektrometer UV/Vis. Kerapatan yang dihasilkan menunjukkan tidak berbeda nyata pada taraf 5% terhadap perbedaan komposisi dan suhu penyimpanan. Secara fisis, perbedaan komposisi dan suhu penyimpanan tidak mempengaruhi kerapatan larutan teh hijau. Viskositas yang dihasilkan menunjukkan berbeda nyata pada taraf 5% dan 1% terhadap perbedaan komposisi dan suhu penyimpanan. Secara fisis, perbedaan komposisi dan suhu penyimpanan mempengaruhi viskositas larutan teh hijau. Kadar tanin yang dihasilkan menunjukkan berbeda sangat nyata pada taraf 1% terhadap perbedaan komposisi dan suhu penyimpanan. Penyimpanan pada suhu 10 ̊C dapat memperpanjang masa simpan dan menghambat terjadinya proses perubahan komposisi kandungan dalam larutan teh dibandingkan terhadap suhu 26 ̊C. Larutan teh hijau yang disimpan pada suhu 10 ̊C menunjukkan hasil yang terbaik.
3
KARAKTERISASI FISIK DAN OPTIK
LARUTAN TEH HIJAU BERDASARKAN
VARIASI WAKTU DAN SUHU PENYIMPANAN
MILA ARMIGUSTIEN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Fisika
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
4
Judul
: Karakterisasi Fisik dan Optik Larutan Teh Hijau Berdasarkan Variasi Waktu
dan Suhu Penyimpanan
Nama : Mila Armigustien
NRP
: G74061243
Disetujui
Ir. Hanedi Darmasetiawan, M.S
Dr. Akhiruddin Maddu, M.Si
Pembimbing 1
Pembimbing 2
Diketahui
Dr. Akhiruddin Maddu, M.Si
Ketua Departemen Fisika
5
RIWAYAT HIDUP
Penulis bernama lengkap Mila Armigustien yang merupakan anak pertama dari pasangan Suratno dan Sudarmi. Penulis dilahirkan di Jakarta, 16 Agustus 1988. Penulis mengawali pendidikan formal di TK Nurul Huda, kemudian dilanjutkan di SD Negeri Jatisari, SLTP Negeri 24 Bekasi, dan SMA Negeri 6 Bekasi.
vi
KATA PENGANTAR
01234ا 67234ا 8ا 09:
Segala puji hanya bagi Allah, kami memuji?Nya, memohon pertolongan dan ampunan kepada?Nya, kami berlindung kepada Allah dari kejahatan diri kami dan kejelekan amalan?amalan kami, barangsiapa yang Allah beri petunjuk, maka tidak ada yang dapat menyesatkannya, dan barangsiapa yang Allah sesatkan, maka tidak ada yang dapat memberinya hidayah. Dan aku bersaksi bahwa tidak adaillahyang berhak diibadahi dengan benar kecuali Allah semata, tidak ada sekutu bagi?Nya, dan aku bersaksi bahwa MuhammadShalallahu ’alaihi wa sallamadalah hamba dan utusan AllahSubhanahu wa Ta’ala.
Penelitian ini berjudul ”Karakterisasi Fisik dan Optik Larutan Teh Hijau
Berdasarkan Variasi Waktu dan Suhu Penyimpanan.”
Dalam penyusunan penelitian ini penulis tidak terlepas dari dukungan beberapa pihak baik langsung maupun tidak langsung. Oleh karena itu penulis ingin menyampaikan ucapan terima kasih yang sebesar?besarnya kepada:
1. Bapak Ir. Hanedi Darmasetiawan, M.S selaku dosen pembimbing yang telah memberikan dukungan, motivasi, serta arahan kepada panulis.
2. Bapak Dr. Akhiruddin Maddu, M.Si selaku dosen pembimbing yang telah memberikan dukungan, motivasi, serta arahan kepada panulis.
3. Bapak Ir. Hanedi Darmasetiawan, M.S selaku editor dalam penyusunan penelitian yang telah meluangkan waktu untuk memberikan arahan.
4. Bapak Drs. Sidikrubadi Pramudito selaku dosen penguji yang telah memberikan pelajaran dan arahan yang berharga.
5. Keluarga besar penulis: Ibu, Bapak, Ayah mutiaraku, mutiaraku Farros, dan Adikku serta Rivai’s family atas segala doa, dukungan yang tidak ternilai harganya baik secara fisik maupun moril, kasih sayang, cinta yang begitu besar, bimbingan dalam menjalani hidup ini serta pelajaran yang sangat berharga.
6. Mba Novia yang telah banyak berbagi pengalaman dan pelajaran serta semangat kepada penulis sejak awal hingga kini. Si kecil Khaula yang membuat hari?hari selalu ceria dengan senyuman dan manjanya.
7. Warga Wisma Hikmatunnisaa: Mba Tri LH, Bungas, Elva, Fitry, dan Tika, serta akhwat yang lain. Terima kasih atas segala dorongan, kebersamaan, pengertian, masukan, dan berbagai bantuan selama ini yang penulis terima. Jazaakumullaahu khairon (Semoga Allah membalas kalian dengan kebaikan).
8. Teman?teman satu laboratorium yang telah banyak membantu, semoga Allah Azza wa Jallamembalas dengan kebaikan kepada kalian semua.
9. Teman?teman fisika angkatan 41, 42, 43, dan 44 yang telah banyak membantu penulis. Penulis menyadari bahwa penelitian ini masih jauh dari sempurna dan perlu banayak masukan serta saran. Semoga penelitian ini dapat bermanfaat bagi seluruh pihak yang membutuhkan. Akhir doa penulis adalahAlhamdulillaahi Robbil ’Alamiiin.
Bogor, Mei 2012
vii
DAFTAR ISI
Halaman
DAFTAR TABEL... viii
DAFTAR GAMBAR...ix
DAFTAR LAMPIRAN ...ix
PENDAHULUAN...1
Latar Belakang ...1
Tujuan ...1
Hipotesis ...1
TINJAUAN PUSTAKA...1
Teh (Camellia sinensis L)...1
Kandungan senyawa kimia dalam teh...2
Tanin ...3
Pengertian tanin ...3
Struktur tanin ...4
Sumber tanin...4
Manfaat tanin ...5
Spektroskopi...5
Prinsip spektroskopi...6
Spektroskopi UV?Vis...7
Kerapatan ... 8
Viskositas ... 9
METODE PENELITIAN ... 9
Waktu dan Tempat...9
Bahan dan Alat...9
Metode Penelitian ...9
Tahap pembuatan larutan ...9
Tahap karakterisasi fisik ...9
Kerapatan ...9
Viskositas...20
Tahap pengujian kadar tanin ...21
Rancangan Percobaan ...22
HASIL DAN PEMBAHASAN...24
Karakterisasi Fisik Larutan Teh Hijau...24
Kerapatan ...24
Viskositas ...26
Sifat Optik Larutan Teh Hijau ...29
KESIMPULAN DAN SARAN...40
Kesimpulan ...40
Saran ...40
DAFTAR PUSTAKA...41
viii
DAFTAR TABEL
Halaman
Tabel 1. Komposisi teh hijau ...3
Tabel 2. Komposisi teh hitam ...3
Tabel 3. Jenis spektroskopi dan spektrum elektromagnetik...8
ix
DAFTAR GAMBAR
Halaman Gambar 1. Struktur molekul tanin ...5 Gambar 2. Spektra elektromagnetik ...6 Gambar 3. Radiasi yang melewati sampel...14 Gambar 4. Hubungan lama penyimpanan dan kerapatan larutan teh hijau pada
penyimpanan suhu 26 ̊C ...24 Gambar 5. Hubungan lama penyimpanan dan kerapatan larutan teh hijau pada
penyimpanan suhu 10 ̊C ...25 Gambar 6. Hubungan lama penyimpanan dan viskositas pada larutan teh hijau
pada penyimpanan suhu 26 ̊C ...27 Gambar 7. Hubungan lama penyimpanan dan viskositas pada larutan teh hijau
pada penyimpanan suhu 10 ̊C ...28 Gambar 8. Hubungan panjang gelombang dan absorbansi larutan teh hijau
sampel 1 pada penyimpanan suhu 26 ̊C ...30 Gambar 9. Hubungan panjang gelombang dan absorbansi larutan teh hijau
sampel 1 pada penyimpanan suhu 10 ̊C ...31 Gambar 10. Hubungan panjang gelombang dan absorbansi larutan teh hijau
sampel 2 pada penyimpanan suhu 26 ̊C ...33 Gambar 11. Hubungan panjang gelombang dan absorbansi larutan teh hijau
sampel 2 pada penyimpanan suhu 10 ̊C ...34 Gambar 12. Hubungan panjang gelombang dan absorbansi larutan teh hijau
sampel 3 pada penyimpanan suhu 26 ̊C ...35 Gambar 13. Hubungan panjang gelombang dan absorbansi larutan teh hijau
sampel 3 pada penyimpanan suhu 10 ̊C ...36 Gambar 14. Hubungan lama penyimpanan dan absorbansi larutan teh hijau pada
penyimpanan suhu 26 ̊C...37 Gambar 15. Hubungan lama penyimpanan dan absorbansi larutan teh hijau pada
x
DAFTAR
LAMPIRAN
Halaman
Lampiran 1. Diagram alir penelitian ... 44
Lampiran 2. Alat yang digunakan dalam penelitian... 46
Lampiran 3. Perhitungan sidik ragam (analisis variasi) kerapatan... 47
Lampiran 4. Perhitungan sidik ragam (analisis variasi) viskositas ... 50
1
PENDAHULUAN
Latar Belakang
Teh (Camellia sinensis L.) merupakan salah satu bahan penyegar yang sangat banyak di konsumsi dan dapat memberikan pengaruh diet bagi kesehatan dan terapi (Rehman, Almas, Shahzadi, Bhatti, Saleem 2002). Beberapa kandungan senyawa kimia di dalam teh dapat memberi kesan warna, rasa, dan aroma yang memuaskan peminumnya (Yan 2007). Tiga jenis teh yang mendasar yaitu teh hijau, teh hitam, dan teh oolong. Teh diproduksi dari bagian pucuk daun muda dari tanaman teh (Camellia sinensis L). Prosedur pembuatan teh hijau, hanya dengan pengeringan daun, menjaga polifenol sebagai pewarna hijau. Prosedur fermentasi untuk memproduksi teh hitam mengubah polifenol ke dalam teaflavin, tearubigin, dan lain?lain, proses ini mengakibatkan warna merah kegelapan. Teh oolong diperoleh melalui proses semi fermentasi, kombinasi proses pembuatan teh hijau dan teh hitam, fermentasi sebagian ini menghasilkan warna kemerah?merahan yang disebut dengan “green leaf with red border” (daun hijau dengan pinggiran merah) (Yan 2007).
Salah satu kandungan yang terdapat dalam teh (Camelia sinensisL.) adalah tanin (Kartikasari 2008). Tanin merupakan komposisi polifenol yang dapat larut dalam air yang tersebar luas dalam tumbuhan (Rehman, Almas, Shahzadi, Bhatti, Saleem 2002). Teh mengandung zat antioksidan yang dikenal dengan sebutan polifenol, yang tampaknya berperan besar dalam pencegahan berbagai macam penyakit. Polifenol mempunyai kemampuan menetralisir radikal bebas, suatu produk sampingan dari proses kimiawi dalam tubuh yang mengganggu. Kemampuan inilah yang mungkin menjadi jawaban, mengapa teh kemudian juga bisa mencegah serangan jantung dan kanker (Kartikasari 2008).
Penentuan struktur yang terdapat dalam suatu senyawa dapat dilakukan dengan menggunakan metode spektroskopi. Metode spektroskopi memiliki banyak keuntungan. Biasanya hanya sedikit sampel bahan yang diperlukan, dan acap kali dapat dikembalikan jika diperlukan. Metode ini berlangsung cepat, kadang?kadang hanya memerlukan waktu beberapa menit. Selain itu, biasanya ada informasi struktur yang lebih terperinci
dari spektrum jika dibandingkan dengan metode laboratorium biasa (Hart 2003).
Tujuan
Tujuan penelitian ini adalah
1. Mengetahui dan mempelajari tanin dalam teh hijau.
2. Mengetahui dan mempelajari pengaruh kepekatan teh hijau terhadap kadar tanin.
3. Mengetahui dan mempelajari pengaruh perubahan karakterisasi fisik terhadap kadar tanin.
4.
Mengetahui dan mempelajari pengaruh lama penyimpanan terhadap kadar tanin dan perubahan fisik.Hipotesis
Perubahan struktur fisis tanin dalam larutan teh hijau dapat dipengaruhi oleh kepekatan larutan, lama penyimpanan, dan perubahan karakterisasi fisik selama penyimpanan.
TINJAUAN PUSTAKA
Teh (
L.)
Teh merupakan minuman yang dihasilkan dari pemrosesan daun tanaman teh yang dimasukkan ke dalam air yang mendidih. Tanaman teh (Camellia sinensis L.) berasal dari Asia tenggara. Daunnya hijau gelap mengandung bahan kimia kafein dan tanin. Teh menempati urutan pertama sebagai minuman yang sangat terkenal di dunia.
Teh, berdasarkan proses fermentasi pengolahannya dikelompokan menjadi tiga jenis yaitu teh hijau (tidak mengalami fermentasi), teh hitam (mengalami fermentasi), dan teh oolong (mengalami fermentasi sebagian). Produksi teh tidak seluruhnya dihasilkan dari proses fermentasi, tetapi cukup dihasilkan dari reaksi enzim yang terdapat dalam daun teh.
Teh hijau merupakan produk yang lebih banyak di sukai dibandingkan dengan yang lainnya, kecuali jika daunnya dipanaskan sebelum diproses pengadukan untuk menghancurkan enzim. Daun tetap hijau seluruhnya selama berlangsungnya pemrosesan, dan karakteristik aroma dari teh hitam tidak terbentuk. Teh hijau disortir berdasarkan umur dan bentuk (Gaman 1981).
2
askorbat, asam folat, vitamin E, mangan,potasium, polisakarida, florida alami, yang secara keseluruhan bisa mengurangi kadar kolesterol dan lemak makanan, mengurangi resiko penyakit kardio?serebrovaskular, menangkal radikal bebas, membunuh bakteri dan virus influenza, anti peradangan, menghilangkan panas dalam dan iritasi, mengoptimalkan metabolisme gula, mengurangi resiko keracunan makanan, mengatasi masalah perut dan usus, mencegah bau mulut dan pengeroposan gigi, memperkuat daya tahan tubuh, menurunkan stres, menyegarkan tubuh dan menenangkan pikiran, serta mencegah kegemukan. Teh hijau juga mengandung lebih dari 25 jenis asam amino, termasuk 6 jenis yang mutlak diperlukan tubuh dan Histidine diperlukan untuk pertumbuhan bayi. Walaupun kandungan asam amino dalam teh hijau tidak tinggi, tapi bisa menambah kekurangan kadar yang dibutuhkan tubuh setiap hari.
Bahan kimia penting yang menyusun rasa segar pada teh adalah polifenol, kafein, dan minyak esensial.Kandungan nutrisi tiap 100 gram daun teh 75?80% air, bagian terlarut dan tidak terlarut adalah polifenol (25%), protein (20%), kafein (2,5?4,5 %), serat (27%), karbohidrat (4%), pektin (6%), dan energi 17 kJ. Kualitas teh yang baik ditentukan oleh tingginya kadar polifenol dan aktivitas enzim selama fermentasi (Ashari 2006).
Teh mengandung zat antioksidan yang dikenal dengan sebutan polifenol, yang tampaknya berperan besar dalam pencegahan berbagai macam penyakit. Polifenol mempunyai kemampuan menetralisir radikal bebas, suatu produk sampingan dari proses kimiawi dalam tubuh yang mengganggu. Kemampuan inilah yang mungkin menjadi jawaban, mengapa teh kemudian juga bisa mencegah serangan jantung dan kanker (Nenden 2007).
Kandungan
senyawa
kimia
dalam teh
Kualitas teh yang baik sebagian besar terletak pada komposisi kimiawinya. Komposisi tersebut berbeda?beda menurut tipe, klon, musim, kondisi lingkungan pertumbuhannya, dan perubahan warna daun teh setelah proses pembuatannya. Senyawa kimia dalam daun teh secara umum dapat digolongkan menjadi empat kelompok, yaitu (1) substansi fenol,
yang terdiri atas flavanol dan flavonol, (2) substansi bukan fenol, di antaranya karbohidrat, pektin, alkaloid, protein, lemak, asam amino, klorofil, asam organik, vitamin, mineral, (3) substansi aromatik, dan (4) enzim. Di antara keempat kelompok senyawa tersebut, substansi fenol dianggap paling berperan dalam menentukan kualitas teh hitam (Yulia 2006).
Teh mengandung komponen volatile sebanyak 404 macam dalam teh hitam dan sekitar 230 macam dalam teh hijau. Komponen volatile tersebut berperan dalam memberikan cita rasa yang khas pada teh.
Komponen aktif yang terkandung dalam teh, baik yangvolatilemaupun yang tidak volatile antara lain polifenol (10 ? 25%),methylxanthines, asam amino, peptida, komponen organik lain, asam tanin(9?20%), vitamin C (150?250 %), vitamin E (25?70 %), vitamin K (300?500 IU/g), ß?karoten (13?20 %), kalium (1795 %), magnesium (192 %), mangan (300?600 ug/ml), fluor (0,1?4,2 mg/L), seng (5,4 %), selenium (1,0?1,8 %), tembaga (0,01 %), besi (33 %), kalsium (7 %), kafein (45?50 %).
Teh sebagian besar mengandung ikatan biokimia yang disebut polifenol, termasuk di dalamnya flavonoid. Flavonoidmerupakan suatu kelompok antioksidan yang secara alamiah ada pada sayur?sayuran, buah? buahan, dan minuman seperti teh dan anggur. Pada tanaman, flavonoids memberikan perlindungan terhadap stres lingkungan, sinar ultra violet, serangga, jamur, virus, dan bakteri, di samping sebagai pengendali hormon dan enzim inhibitor.
3
Komposisi teh hijau ditunjukkanpada Tabel 1 dan komposisi teh hitam ditunjukkan pada Tabel 2.
Tabel 1. Komposisi teh hijau
Komponen
% (b/b) Berat kering
Kafein 7.43
(?) Epikatekin 1.98 (?) Epikatekin
galat 5.20
(?) Epigalokatekin 8.42 (?) Epigalokatekin
galat 20.29
Flavonol 2.23
Teanin 4.70
Asam glutamat 0.50 Asam aspartat 0.50
Arginin 0.74
Asam amino lain 0.74
Gula 6.68
Bahan yang dapat mengendapkan alkohol
12.13 Kalium
(potasium) 3.96 Sumber: Tuminah 2004 Tabel 2. Komposisi teh hitam
Komponen % (b/b) Berat kering Kafein 7.56 Teobromin 0.69 Teofilin 0.25
(?) Epikatekin 1.21 (?) Epikatekin
galat 3.86
(?) Epigalokatekin 1.09 (?) Epigalokatekin
galat 4.63
Glikosida
flavonol sedikit Bisflavanol sedikit Asam teaflavat sedikit Teaflavin 2.62 Tearubigin 35.90 Asam galat 1.15 Asam klorogenat 0.21
Lanjutan Tabel 2. Komposisi Teh Hitam Komponen % (b/b) Berat kering Gula 6.85 Pektin 0.16 Polisakarida 4.17 Asam oksalat 1.50 Asam malonat 0.02 Asam suksinat 0.09 Asam malat 0.31 Asam akonitat 0.01 Asam sitrat 0.84
Lipid 4.79
Kalium
(potasium) 4.83 Mineral lain 4.70
Peptida 5.99
Tanin 3.57
Asam amino lain 3.03
Aroma 0.01
Sumber: Tuminah 2004
Pada teh hijau, katekin merupakan komponen utama, sedangkan pada teh hitam dan teh oolong, katekin diubah menjadi teaflavin dan tearubigins. Sifat fungsional teh hijau lebih tinggi jika dibandingkan dengan teh hitam.Ini ditunjukkan polifenol teh hijau jauh lebih berperan untuk mencegah terjadinya kanker dibandingkan polifenol pada teh hitam (Hilyatuzzahroh 2006).
Tanin
Pengertian tanin
4
Tanin juga dikenal sebagai asamtanin, adalah nama umum untuk sejenis kelompok produk sayur? sayuran, baik amorf ataupun kristal, diperoleh dari berbagai tanaman, dan penggunaan komersialnya yang penting selama ini adalah dalam industri penyamakan kulit (Subiarto 2002). Tanin terdiri atas dua kelompok besar “hydrolysable tannin” dan "condensed tannins".“Hydrolysable tannin” atau tanin yang terhidrolisa terdiri dari molekul gallotannins dan ellagitanins. Sedangkan "condensed tannins” atau tanin terkondensasi merupakan suatu polimerflavanyang tidak mengalami hidrolisa, yaitu molekul katekin. Tanin terkondensasi ini yang banyak terkandung dalam tanaman herbal (Lestari 2009). Tanin terkondensasi merupakan fenol dari stuktur kompleks menengah, dan yang lainnya adalah ester dari glukosa atau gula lainnya dengan satu atau lebih asam trihidroksibenzoat (trihydroxybenzoic acids). Rumus empiris C14H14O11 adalah rumus yang
biasanya dikenakan pada tanin umumnya (Subiarto 2002).
Untuk keperluan penyamakan, ekstrak?ekstrak itu dapat digunakan langsung atau dalam bentuk yang dipekatkan dengan jalan mengekstrak kembali bahan taninnya. Setelah diberi perlakuan dengan tanin, kulit mentah terwarnai dan terhindar dari pembusukan. Penyamakan nabati dapat mengawetkan serat?serat kulit dari serangan bakteri. Di dalam serat itu juga terbentuk sifat?sifat tertentu seperti kelenturannya dan kepadatannya, yang bukan saja khas menurut jenis kulit, melainkan juga bergantung pada bahan penyamak dan cara penyamakannya. Hasilnya berupa kulit samak yang banyak sekali manfaatnya (Lemmens 1999).
Struktur Tanin
Tanin merupakan komposisi polifenol yang dapat larut dalam air yang tersebar luas dalam tumbuhan (Rehman, Almas, Shahzadi, Bhatti, Saleem 2002). Mempunyai sifat kelat dan mempunyai kemampuan menyamak kulit. Tanin dapat digunakan sebagai pertahanan tumbuhan dan menghambat
pertumbuhan tumor. Fenol dan glikosida fenolik dengan beberapa jenis yang berbeda tersebar luas dalam alam dan ditemukan dalam banyak golongan dari komponen alam yang mempunyai unit aromatik. Beberapa golongan bahan polimer penting dalam tumbuhan (lignin, melanin, tanin) merupakan senyawa polifenol (Kartikasari 2008).
Ekstraksi dengan air atau campuran air dan alkohol adalah langkah pertama dalam memproduksi tanin. Pengendapan, diikuti dengan evaporasi pada temperatur rendah, adalah langkah berikutnya untuk menghasilkan produk komersial (Subiarto 2002). Efektivitas tanin tergantung dari dosisnya (Lestari 2009).
Sumber Tanin
Tanin banyak terdapat di dalam tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan kayu (Harborne 1987), sumber terbaik untuk mendapatkannya adalah kantung?kantung pada pohon ek (oak galls) dan kulit kayu pohon sumac (Subiarto 2002). Menurut batasannya, tanin dapat bereaksi dengan protein membentuk kopolimer mantap yang tidak larut dalam air. Dalam industri, tanin adalah senyawa yang berasal dari tumbuhan, yang mampu mengubah kulit hewan yang mentah menjadi kulit siap pakai karena kemampuannya menyambungsilangkan protein (Harborne 1987).
5
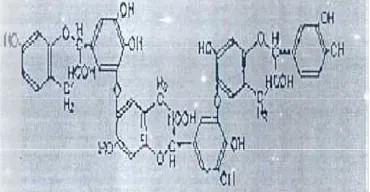
Gambar 1. Struktur molekul taninManfaat Tanin
Tanin dapat bermanfaat sebagai antihelmintik dan antimikroba.Sebagai antihelmintik, tanin terbukti mengurangi jumlah telur parasit yang tampak dari sekresi di faeces. Efek antimikroba didapatkan karena tanin dapat menyebabkan terbentuknya lapisan pelindung dari koagulasi protein pada mukosa intestinal, sehingga melindungi vili dari kolonisasi mikroba (Lestari 2009).
Di Jepang telah ditemukan satu material baru untuk menyerap uranium dan unsur?unsur transuranik seperti plutonium, ameresium, dan kurium, yaitu tanin (Subiarto 2002). Tanin dapat berfungsi sebagai penyamak kulit. Selain menjadikan kulit tersamak, tanin juga dapat menyamak jala, tali, dan layar. Setelah di samak, peralatan pancing dapat menjadi lebih tahan terhadap air laut. Tanin digunakan pula sebagai perekat, bahan pewarna, dan mordan. Misalnya, tanin proantosianidin dapat digunakan pada pembuatan kayu lapis (chipboard), sebagai ganti fenol sintetik, yang produksinya sangat bergantung pada harga minyak bumi. Beberapa tumbuhan penghasil tanin merupakan ramuan bahan kunyahan (masticatories) berkat sifat kelatnya itu, misalnya gambir dari Uncaria gambir (Hunter) Roxb (Lemmens 1999).
Tanin juga dimanfaatkan secara luas untuk keperluan pengobatan dapat dimanfaatkan untuk obat penyakit gula, untuk pengaturan keseimbangan hormon yang dikeluarkan oleh pankreas, sebagai obat cacing, dan antibiotik. Tanin yang
terkandung dalam minuman seperti teh, kopi, anggur, dan bir, berguna sebagai penyedap dan pemberi aroma, kandungan tanin di dalam beberapa macam buah?buahan penting sekali untuk menentukan mutu buah. Tanin juga digunakan dalam pembuatan tinta, untuk menghilangkan kerak pada alat penggodok, dan untuk mengurangi kekentalan lumpur bor pada saat pengeboran sumur minyak bumi yang letaknya dalam (Lemmens 1999).
Asupan tanin yang berlebihan dapat mengakibatkan insomnia, pening atau mual, jantung berdebar dan satu cangkir teh setelah makan akan mengakibatkan dispepsia (Rehman, Almas, Shahzadi, Bhatti, Saleem 2002). Tanin dalam dosis tinggi dapat menimbulkan efek samping hingga toksik. Bila melewati membran mukosa usus, tanin akan bereaksi dan berikatan dengan protein pada mukus dan sel epitel mukosa. Membran mukosa akan mengikat lebih kuat dan menjadi kurang permeabel. Dosis tinggi dari tanin dapat menimbulkan efek tersebut berlebih, sehingga mengakibatkan iritasi pada membran mukosa usus. Komponen dari kondensasi tanin juga dapat merusak mukosa traktus gastrointestinal, serta mengurangi absorpsi zat?zat makanan dan beberapa asam amino esensial terutama methionin danlysine. Untuk itu, tanaman herbal dengan kandungan tanin yang tinggi sebaiknya tidak diberikan pada kondisi inflamasi atau ulserasi traktus gastrointestinal (Lestari 2009).
Spektroskopi
6
Gambar 2. Spektra elektromagnetikRadiasi elektromagnetik atau cahaya merupakan sebuah bentuk energi yang memiliki tingkah laku yang dapat digambarkan oleh sifat gelombang dan partikel. Sifat optik dari radiasi elektromagnetik antara lain difraksi, difraksi paling baik diterangkan oleh perilaku cahaya sebagai gelombang. Interaksi radiasi elektromagnetik dengan sampel dapat menyebabkan terjadinya peristiwa absorbsi dan emisi. Peristiwa ini lebih baik digambarkan oleh perilaku cahaya sebagai partikel atau foton (Harvey 2000).
Radiasi elektromagnetik terdiri dari medan listrik dan medan magnet yang saling tegak lurus melalui lintasan panjang yang lurus dengan sebuah kecepatan tetap. Interaksi radiasi elektromagnetik dengan sampel dapat dijelaskan menggunakan medan listrik dan medan magnet. Ketika sebuah sampel menyerap radiasi elektromagnetik maka akan terjadi perubahan energi. Interaksi antara sampel dan radiasi elektromagnetik mudah dipahami jika diasumsikan bahwa radiasi elektromagnetik tetap dalam celah partikel elektrik yang disebut dengan foton. Ketika foton diserap oleh sampel, hal ini menyebabkan perubahan struktur dan energi yang diperoleh oleh sampel (Harvey 2000).
Frekuensi dan panjang gelombang radiasi elektromagnetik memiliki banyak tingkatan jarak. Radiasi elektromagnetik dibagi ke dalam wilayah yang berbeda berdasarkan tipe transisi atomik atau molekular yang memberikan peningkatan absorpsi atau emisi foton (Harvey 2000).
Prinsip spektroskopi
Persamaan 1, menjelaskan hubungan antara energi cahaya (atau bentuk radiasi lainnya), E, dan frekuensi,v.
……..(1)
Keterangan:
E= energi cahaya (joule)
h= tetapan Planck (6.626 x 10?34J.s) v= frekuensi (hertz)
(Sumber:Hart 2003)
Persamaan ini menyatakan bahwa ada hubungan langsung antara frekuensi cahaya dan energinya: semakin tinggi frekuensi, semakin tinggi energi. Hubungan frekuensi cahaya dan panjang gelombang berbanding terbalik, persamaan itu dapat ditulis
.……..(2)
Keterangan:
c =kecepatan cahaya di ruang hampa (3 x 108m.s?2)
λ =panjang gelombang (m) (Sumber:Hart 2003)
7
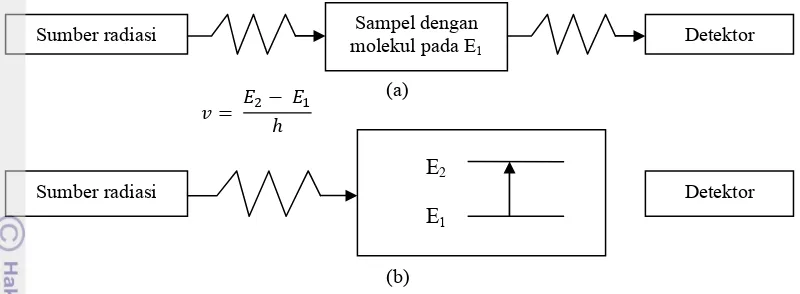
Sumber radiasi Sampel denganmolekul pada E1
Detektor
(a)
(b)
Gambar 3.Radiasi yang melewati sampel (a).Radiasi yang tidak di serap oleh molekul (b). Radiasi yang diserap oleh molekul
Molekul dapat berada pada berbagai tingkat energi. Contohnya, ikatan molekul tertentu dapat meregang, bengkok, atau berotasi. Elektron dapat bergerak dari satu orbital ke orbital lain, dan seterusnya. Proses ini terkuantisasi artinya, ikatan dapat meregang, bengkok, atau berotasi hanya dengan frekuensi (atau energi, keduanya proposional) tertentu, dan elektron hanya dapat melompat di antara orbital?orbital dengan selisih energi tertentu. Selisih energi (atau frekuensi) inilah yang di ukur lewat berbagai jenis spektrum.
Prinsip kerja spektroskopi sangatlah sederhana dan dinyatakan dengan bagan pada Gambar 3. Suatu molekul pada tingkat energi tertentu, E1, dikenakan radiasi. Radiasi
melewati molekul dan merambat ke detektor. Selama molekul tidak menyerap radiasi, banyaknya radiasi yang terdeteksi akan sama dengan banyaknya radiasi yang dipancarkan oleh sumber (Gambar 3.a). Pada frekuensi yang berhubungan dengan transisi energi molekul tertentu, artinya dari E1ke E2, radiasi ini akan
di serap oleh molekul dan tidak akan
muncul di detektor (Gambar 3.b). Jadi spektrum terdiri atas rekaman atau plot dari banyaknya energi (radiasi) yang di terima detektor sewaktu energi asupannya divariasikan secara berangsur?angsur. Tabel 3, adalah rangkuman daerah spektrum elektromagnetik yang memperlihatkan transisi yang sesuai dengan daerah kerja beberapa jenis spektroskopi (Hart 2003).
Spektroskopi UVCVis
Spektroskopi UV/Vis merupakan spektroskopi yang sumber radiasinya berasal dari spektrum ultraviolet dan cahaya tampak. Pengukuran absorbansi berdasarkan radiasi ultraviolet dan cahaya tampak ditemukan luas penggunaannya untuk identifikasi dan penentuan yang banyak sekali pada molekul inorganik dan organik. Metode absorbansi molekular ultraviolet dan cahaya tampak mungkin paling luas digunakan pada semua teknik analisis kuantitatif di laboratorium kimia dan klinis diseluruh dunia (Skoog, Holler, Nieman 1998).
Sumber radiasi Detektor
8
Tabel 3. Jenis spektroskopi dan spektrum elektromagnetikDaerah spektrum Jenis spektroskopi Sumber radiasi Frekuensi (hertz) Panjang gelombang (meter) Energi (kcal/ mol) Jenis transisi Resonansi magnetik inti Gelombang radio (60?600) x 106 (bergantung pada kekuatan magnet pada instrumen) 5?0.5 (6?60) x 10?6
Spin inti
Inframerah Cahaya inframerah
(0.2?1.2) x 1014
(15.0?2.5) x 10?6
2?12 Vibrasi molekul Sinar tampak? ultraviolet (elektronik) Cahaya tampak atau ultraviolet (0.375?1.5) x 1015
(8?2) x 10?7 37?150 Keadaan elektronik
Daerah sinar tampak pada spektrum (artinya, tampak oleh mata manusia) berhubungan dengan cahaya yang panjang gelombangnya 400 sampai 800 nanometer (nm). Cahaya ultraviolet mempunyai panjang gelombang yang lebih pendek, sekitar 200 sampai 400 nm. Intensitas suatu pita serapan dapat dinyatakan secara kuantitatif. Intensitas pita bergantung pada struktur molekul tertentu dan juga pada banyaknya molekul penyerap dalam lintasan cahaya. Absorbansi, yaitu log dari nisbah intensitas cahaya?masuk dan intensitas cahaya?keluar dari sampel, diberikan oleh persamaan
..
…(3)..
…(4)Keterangan: A= absorbansi
I0= intensitas cahaya masuk sampel
I= intensitas cahaya keluar sampel T= transmitansi
P0= daya radiasi pelarut (watt)
P= daya radiasi larutan (watt)
(Sumber: Skoog, Holler, Nieman 1998)
.
……(5)Keterangan: A= absorbansi
ε= absorbansi molar (L.mol?1.cm?1) c= konsentrasi larutan (mol.L?1) l = panjang wadah sampel yang di lewati cahaya (cm)
(Sumber: Hart 2003)
Nilai ε untuk setiap puncak dalam spektrum senyawa mempunyai ciri tetap dari struktur molekul tertentu (Hart 2003).
Kerapatan
9
………(6)
Keterangan :
= kerapatan (g.cm?3)
= massa benda yang diukur (g)
! = volum benda yang diukur (cm3)
Kerapatan bergantung pada beberapa faktor antara lain suhu dan tekanan. Cairan mempunyai kerapatan yang sedikit berubah pada jangkauan tekanan dan suhu yang tinggi. Gula dan garam dapat meningkatkan kerapatan larutan tetapi kadang?kadang kerapatan juga dapat turun jika dalam larutan terdapat lemak atau alkohol (Gaman, Sherington 1981).
Viskositas
Viskositas merupakan sebuah ukuran penolakan sebuah fluida terhadap perubahan bentuk. Biasanya diterima sebagai kekentalan atau penolakan terhadap penuangan. Viskositas menggambarkan penolakan dalam fluida pada aliran dan merupakan sebuah cara untuk mengukur gesekan fluida. Air memiliki viskositas rendah, sedangkan minyak sayur memiliki viskositas tinggi (Rani 1989). Pada zat cair, viskositas disebabkan oleh gaya kohesi antar molekul (Giancoli 2001). Viskositas dirumuskan sebagai berikut
"
#/
/
………(7)Keterangan :
%= viskositas (poise). F = gaya (dyne).
A = luas permukaan (cm2) v = kecepatan (cm.s?1)
l= jarak aliran kecepatan yang diamati (cm).
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Spektroskopi dan Laboratorium Biofisika, Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Penelitian dilaksanakan selama 5 bulan yaitu, pada bulan Januari?Mei 2011.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini berupa daun teh hijau,aquades, dan aseton.
Alat yang digunakan dalam penelitian ini adalah spektroskopi UV?Vis ‘Genesys 10uv’, neraca analitik, extech instrument heavy duty thermometers, viskometer Gilmont, hot plate, magnetic stirrer atau pengaduk magnetik, gelas beker, gelas plastik, tabung ukur, stopwatch, penyaring teh, corong, sudip, dan kertas saring.
Metode Penelitian
Tahapan penelitian ini meliputi tahap pembuatan larutan, tahap karakterisasi fisik, dan tahap pengujian kadar tanin. Tahapan penelitian adalah sebagai berikut:
Tahap pembuatan larutan
Tahap pembuatan larutan ini dilakukan dengan cara sebagai berikut:
a. Memanaskanaquades300 mL di dalam gelas beker 300 mL menggunakan hot plate hingga suhuaquadesmencapai 60̊C. b. Memasukkan masing?masing
sampel seperti tertera pada Tabel 4. dan magnetic stirrer dalam aquades 60̊C kemudian diaduk dengan kecepatan putar 350 rpm selama 3 menit.
c. Menyaring larutan teh hijau mula?mula dengan menggunakan penyaring teh kemudian dengan kertas saring.
Tabel 4. Komposisi daun teh hijau pada masing?masing sampel
Keterangan sampel
Komposisi daun teh hijau
(gram)
Sampel 1 3
Sampel 2 2
10
Tahap karakterisasi fisik
Karakterisasi fisik yang diukur adalah kerapatan dan viskositas.
Kerapatan
Pada penelitian ini dilakukan pengukuran kerapatan cairan. Kerapatan adalah massa per satuanvolumepada suhu dan tekanan tertentu. Kerapatan (ρ) suatu zat ditentukan dengan membandingkan massa dan volume zat yang akan diukur. Mula?mula cairan diukur volumenya dengan menggunakan tabung ukur dan setelah itu diukur massanya menggunakan neraca analitik, sehingga dengan menggunakan persamaan 6 akan diperoleh kerapatan cairan.
Viskositas
Pada pengukuran viskositas dapat dilakukan dengan mengunakan alat ukur yang disebut viskometer bola?jatuh atau viskometer Gilmont. Alat ukur ini cukup sederhana dan bekerja berdasarkan keseimbangan gaya?gaya yang bekerja pada bola jatuh yang bergerak di dalam sampel cairan.
Cara awal menggunakan alat ini yaitu dengan memasukkan aquades ke dalam tabung viskometer Gilmont kemudian dikeringkan menggunakan aseton. Aquades dimasukkan kembali ke dalam viskometer kemudian di catatwaktu bola turun dari tera pertama sampai tera kedua. Cairan uji kemudian dimasukkan ke dalam viskometer tersebut. Posisi viskometer dibalik sehingga bola turun. Bola yang turun dari tanda tera pertama sampai tanda tera kedua dicatat waktunya. Viskositas bisa dihitung dengan membandingkan larutan air dan larutan yang diuji dengan menggunakan persamaan:
%
&'()'* +,-./0/0123,123,40405,-.,6,-.78,-.785,-.,6.
..(8)Keterangan:
%&'()'* = viskositas cairan/
larutan yang diuji (cP).
%'() = viskositas air (1 cP). '()= kerapatan air (gram/cm3).
&'()'* = kerapatan cairan/
larutan yang diuji (gram/cm3). 9:;' = kerapatan bola baja (7,96 gram/cm3).
<&'()'* = waktu jatuhnya bola
dalam cairan/larutan yang diuji dari tera pertama sampai tera kedua (sekon).
<'()= waktu jatuhnya bola dalam air dari tera pertama sampai tera kedua (sekon)
(Sumber: Budhiarti 2008)
Tahap pengujian kadar tanin
Tahap ini dilakukan secara kualitatif untuk mengetahui kandungan yang terdapat dalam larutan teh hijau tersebut. Masing?masing sampel ditempatkan di dalam kuvet hingga batas kuvet, kemudian dimasukkan secara bergantian ke dalam spektroskopi UV/Vis ‘Genesys 10uv’, yang diawali dengan larutan blanko pada pengujian awal. Mencatat hasil yang ditunjukkan oleh spektroskopi UV?Vis ‘Genesys 10uv’ tersebut. Membuat spektrum yang dihasilkan oleh spektroskopi UV?Vis ‘Genesys 10uv’.
Proses metode penelitian untuk lebih jelasnya dapat dilihat pada diagram alir penelitian pada Lampiran 1.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) faktorial dengan dua kali ulangan.
Penelitian ini dilakukan dengan faktor?faktor:
11
B2 : Suhu 10 ̊CC = Lama penyimpanan H1 : Hari ke?0 (awal) H2 : Hari ke?1 H3 : Hari ke?3 H4 : Hari ke?5 H5 : Hari ke?7
Model matematis untuk rancangan percobaan adalah
=(>?; @ A B(A C>A D?A /BC7(>A /BD7(?
A/CD7>?A /BCD7(>?A E(>?;
Keterangan :
i = 1, 2, 3 (komposisi daun teh) j = 1,2 (suhu penyimpanan) k = 1,2,3,4,5 (lama penyimpanan) l = 1,2 (ulangan percobaan)
=(>?; = nilai pengamatan untuk setiap
perlakuan
@ = rataan umum
B( = pengaruh utama perlakuan A pada taraf i
C> = pengaruh utama perlakuan B pada taraf j
D? = pengaruh utama perlakuan C pada taraf k
/BC7(> = pengaruh interaksi kombinasi
perlakuan A pada taraf i dan B pada taraf j
/BD7(? = pengaruh interaksi kombinasi perlakuan A pada taraf i dan C pada taraf k
/CD7>? = pengaruh interaksi kombinasi
perlakuan B pada taraf j dan C pada taraf k
/BCD7(>?= pengaruh interaksi perlakuan A ke i, B ke j dan C ke k
E(>?; = pengaruh acak
HASIL DAN PEMBAHASAN
Karakterisasi Fisik Larutan Teh Hijau
Pengujian karakterisasi fisik larutan teh hijau dilakukan berupa uji kerapatan dan uji viskositas.
Kerapatan
Hasil perhitungan secara keseluruhan kerapatan larutan teh hijau pada penyimpanan suhu 26 ̊C dapat dilihat pada Gambar 4. Kerapatan dapat menunjukkan ukuran seberapa banyak entitas berada dalam suatu jumlah yang tetap dalam ruang.
Berdasarkan hasil perhitungan yang dapat dilihat pada Gambar 4, memperlihatkan kurva yang relatif naik dan turun. Menurut Munson, Young, Okiishi, 2002. Nilai kerapatan dapat bervariasi cukup besar diantara fluida yang berbeda, namun untuk zat? zat cair, variasi tekanan dan suhu umumnya hanya memberikan pengaruh yang kecil terhadap nilai kerapatan. Nilai kerapatan pada masing?masing sampel yang ditunjukkan Gambar 4, memperlihatkan hasil yang berbeda menurut Munson, Young, Okiishi, 2002.
Perbedaan yang diperoleh dalam penelitian ini diduga adanya perubahan komposisi yang terkandung dalam larutan teh. Larutan teh hijau dapat tercemar mikroba, secara sensori dibuktikan dengan timbulnya bau dan terjadinya perubahan warna. Perubahan ini dapat menunjukkan bahwa dalam larutan teh hijau tersebut sudah terjadi perubahan baik secara fisik ataupun kimia. Sedangkan jika sampel disimpan pada suhu 10 ̊C memperlihatkan kurva yang relatif stabil.
12
Gambar 4. Hubungan lamapenyimpanan dan kerapatan larutan teh hijau pada penyimpanan suhu 26 ̊C
Berdasarkan hasil perhitungan yang dapat dilihat pada Gambar 5, sampel 1 dan sampel 2 relatif stabil dibandingkan dengan sampel 3. Grafik yang relatif stabil ini menunjukkan perubahan fisik ataupun kimia yang terjadi dalam larutan teh hijau tidak terlalu nyata. Penyimpanan pada suhu 10 ̊C dapat menghambat proses perubahan komposisi penyusun larutan teh, perubahan komposisi larutan teh dapat disebabkan adanya bakteri, ketika ditempatkan dalam suhu 10 ̊C maka dapat menghambat terjadinya perubahan suhu dan tidak tercemar oleh udara luar. Secara sensori, larutan teh hijau yang disimpan dalam suhu 10 ̊C tidak menimbulkan adanya perubahan bau ataupun warna yang nyata seperti pada larutan teh hijau yang disimpan pada suhu 26 ̊C. Hasil pengolahan data menunjukkan bahwa perbedaan perlakuan komposisi daun teh dan tempat penyimpanan menunjukkan tidak berbeda nyata pada tingkat 5% dengan besar koefisien keragaman sebesar 6.56%, yang artinya perbedaan perlakuan komposisi dan tempat penyimpanan tidak mempengaruhi kerapatan.
Gambar 5. Hubungan lama penyimpanan dan kerapatan
larutan teh hijau pada penyimpanan suhu 10 ̊C
Viskositas
Sifat fisik yang dapat dilihat selain kerapatan yaitu viskositas. Istilah viskositas biasa digunakan dalam menjelaskan aliran fluida untuk mengkarakterisasi derajat gesekan internal dalam fluida. Gesekan internal ini atau gaya viskositas berhubungan dengan resistansi dua lapisan fluida yang berdekatan yang saling bergerak secara relatif antara satu dan lainnya. Viskositas menyebabkan energi kinetik dari fluida berubah menjadi energi internal. Mekanisme ini serupa dengan objek yang meluncur pada permukaan horizontal kasar yang kehilangan energi kinetik. Hubungan lama penyimpanan dan viskositas larutan teh pada penyimpanan suhu 26
̊
C dapat dilihat pada Gambar 6. Lama penyimpanan secara relatif tidak mengakibatkan perubahan viskositas seperti dapat dilihat pada Gambar 6. Pada sampel 1 menunjukkan terjadi penurunan pada penyimpanan hari ke?3 kemudian terjadi peningkatan hingga penyimpanan hari ke?7. Perubahan ini dapat terjadi disebabkan oleh adanya perubahan komposisi larutan teh hijau sehingga terjadi penurunan. Pada sampel 2 terjadi penurunan pada penyimpanan hari ke?1 kemudian mengalami peningkatan pada penyimpanan hari ke?3 kemudian mengalami penurunan pada penyimpanan hari ke?5 dan mengalami peningkatan kembali pada penyimpanan hari ke?7.
0.8 0.9 1 1.1
0 1 3 5 7
K er ap ata n (g /m L)
Lama penyimpanan (hari keC)
sampel 1 sampel 2 sampel 3
0 0.5 1 1.5
0 1 3 5 7
K er ap ata n (g /m L)
Lama penyimpanan (hari keC)
13
Gambar 6. Hubungan lamapenyimpanan dan viskositas larutan teh hijau pada penyimpanan suhu 26 ̊C
Pada sampel 3 waktu penyimpanan hari ke?3 mengalami peningkatan kemudian mengalami penurunan hingga hari ke?7. Penurunan dan peningkatan yang terjadi pada masing?masing sampel relatif tidak terlalu besar. Berdasarkan sensori, secara relatif larutan tidak mengalami perubahan jika dibandingkan dengan pertama kali sampel larutan dibuat.
Hubungan lama penyimpanan dan viskositas larutan teh hijau pada penyimpanan suhu 10 ̊C ditunjukkan pada Gambar 7.
Berdasarkan hasil perhitungan yang dapat dilihat pada Gambar 7, sampel 1 mengalami peningkatan viskositas pada penyimpanan hari ke?3 kemudian mengalami penurunan hingga penyimpanan hari ke?7. Pada sampel 2 waktu penyimpanan hari ke? 1 mengalami peningkatan kemudian mengalami penurunan hingga penyimpanan hari ke?7. Pada sampel 3 waktu penyimpanan hari ke?1 mengalami peningkatan kemudian mengalami penurunan pada hari penyimpanan hari ke?3 dan mengalami peningkatan kembali hingga penyimpanan hari ke?7.
Gambar 7. Hubungan lama penyimpanan dan viskositas
larutan teh hijau pada penyimpanan suhu 10 ̊C
Hasil pengolahan data menunjukkan bahwa perbedaan perlakuan komposisi daun teh dan tempat penyimpanan menunjukkan berbeda nyata pada tingkat 5% dan 1% dengan koefisien keragaman 4.37%, yang artinya perbedaan komposisi daun teh dan tempat penyimpanan menunjukkan adanya pengaruh terhadap viskositas.
Sifat Optik Larutan Teh Hijau
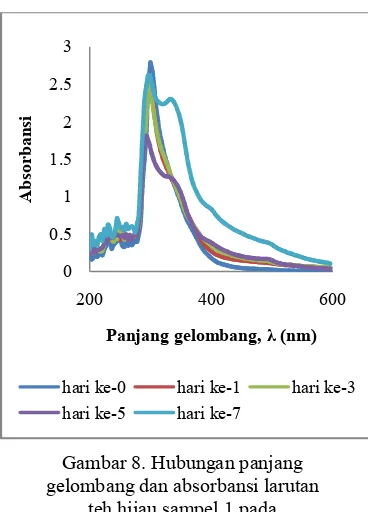
Tanin yang terkandung dalam larutan teh hijau dapat diketahui dengan menggunakan metode spektroskopi UV/Vis. Prinsip dasar metode ini yaitu setiap partikel penyusun suatu larutan atau bahan memiliki nilai absorbansi pada panjang gelombang yang spesifik bergantung pada molekul yang menyusun larutan tersebut. Pengukuran kadar tanin tersebut ditunjukkan melalui spektrum serapan yang terbentuk yang memiliki nilai beragam bergantung pada molekul penyusun bahan tersebut. Pengukuran kadar tanin pada masing?masing sampel akan dibahas sebagai berikut:Kadar tanin sampel 1 ditentukan berdasarkan nilai absorbansi pada spektrum serapan yang ditunjukkan pada Gambar 8 dan Gambar 9. Spektrum yang terbentuk menunjukkan komposisi dalam larutan teh hijau tersebut, setiap molekul penyusun yang terdapat dalam larutan teh hijau menentukan bentuk spektrum yang dihasilkan. Pengujian kadar tanin pada larutan teh hijau dilakukan pada dua kondisi penyimpanan, Gambar 8 menunjukkan spektrum serapan larutan teh hijau pada penyimpanan suhu 26 ̊C, sedangkan Gambar 9 menunjukkan spektrum serapan larutan teh hijau pada penyimpanan suhu 10 ̊C.
0 0.5 1 1.5
0 1 3 5 7
V is ko si ta s (c P )
Lama penyimpanan (hari keC)
sampel 1 sampel 2 sampel 3
0.8 0.9 1 1.1 1.2
0 1 3 5 7
V is ko si ta s (c P )
Lama penyimpanan (hari keC)
14
Penyimpanan hari ke?0 larutan tehhijau pada suhu 26 ̊C, puncak serapan berada pada panjang gelombang 300 nm dengan nilai absorbansi 2.79. Pada penyimpanan hari ke?1 menunjukkan penurunan puncak serapan. Puncak serapan berada pada panjang gelombang 299 nm dengan nilai absorbansi sebesar 2.55. Pada penyimpanan hari ke?3, puncak serapan menurun hingga sebesar 2.476 pada panjang gelombang 299 nm. Pada penyimpanan hari ke?5 puncak serapan berada pada panjang gelombang 293 nm dengan nilai absorbansi sebesar 1.809. Selanjutnya pada penyimpanan hari ke?7 penyimpanan suhu 26 ̊C nilai absorbansi menjadi 2.618 dengan panjang gelombang 299 nm, pada penyimpanan hari ke?7 ini terjadi peningkatan dibandingkan pada penyimpanan hari ke?5. Peningkatan nilai absorbansi pada penyimpanan hari ke?7 jika dibandingkan dengan penyimpanan hari ke?5 belum diketahui penyebabnya. Jika dilihat pada Gambar 8 spektrum serapan penyimpanan hari ke?5 dan ke?7, terlihat adanya puncak serapan baru. Pada penyimpanan hari ke?5 terbentuk puncak serapan baru pada panjang gelombang 336 nm dengan nilai absorbansi sebesar 1.218. Pada penyimpanan hari ke?7 pada panjang gelombang 300 nm dengan nilai absorbansi sebesar 2.301.
Puncak serapan baru yang terbentuk menunjukkan adanya dekomposisi kandungan larutan teh. Puncak serapan yang terbentuk berada di sebelah kanan puncak serapan yang pertama dengan nilai absorbansi yang lebih kecil. Hal ini menunjukkan adanya dekomposisi kandungan yang memiliki nilai absorbansi yang lebih rendah dan merupakan komponen turunan dari komposisi awal. Selama penyimpanan, larutan teh hijau dapat mengalami penguraian molekul atau dekomposisi kandungan penyusun sehingga selama penyimpanan dapat terjadi perubahan karakteristik serapan. Proses dekomposisi ini dapat diakibatkan oleh adanya kerja mikroba dalam larutan teh hijau tersebut. Adanya puncak serapan baru atau perubahan spektrum ini mengindikasikan terjadinya penguraian molekul atau dekomposisi penyusun dalam larutan atau peningkatan molekul baru pada larutan teh hijau tersebut.
Gambar 8. Hubungan panjang gelombang dan absorbansi larutan
teh hijau sampel 1 pada penyimpanan suhu 26 ̊C
Penyimpanan hari ke?0 larutan teh hijau pada suhu 10 ̊C, puncak serapan berada pada 300 nm dengan nilai absorbansi 2.79. Pada penyimpanan hari ke?1, puncak serapan berada pada 299 nm dengan nilai absorbansi 2.754. Nilai absorbansi mulai mengalami penurunan, namun besarnya penurunan nilai absorbansi relatif sedikit dibandingkan dengan penyimpanan larutan teh hijau pada suhu 26 ̊C. Pada penyimpanan hari ke?3 dan hari ke?5, puncak serapan yang terbentuk sama seperti puncak serapan pada penyimpanan hari ke?1, namun mengalami perubahan nilai absorbansi menjadi 2.716 dan 2.574. Pada penyimpanan hari ke?7, puncak serapan berada pada 296 nm dengan nilai absorbansi 2.376. Spektrum serapan larutan teh hijau sampel 1 pada penyimpanan suhu 10 ̊C dapat dilihat pada Gambar 9.
Penyimpanan larutan teh hijau pada suhu 10 ̊C tidak menunjukkan perubahan spektrum yang berarti. Spektrum serapan yang dihasilkan menunjukkan puncak serapan hanya satu, tidak terbentuk puncak serapan baru seperti dapat dilihat pada Gambar 9. Hal ini menunjukkan bahwa penyimpanan pada suhu 10 ̊C dapat menjaga komposisi larutan teh hijau. Penyimpanan pada suhu 10 ̊C dapat mengakibatkan tidak terbentuknya molekul penyusun baru atau tidak terjadi dekomposisi dalam larutan teh hijau. Secara umum Gambar 9 menunjukkan tidak terjadi perubahan spektrum.
0 0.5 1 1.5 2 2.5 3
200 400 600
A bs or ba ns i
Panjang gelombang, λ (nm)
hari ke?0 hari ke?1 hari ke?3
15
Gambar 9. Hubungan panjanggelombang dan absorbansi larutan teh hijau sampel 1 pada penyimpanan suhu 10 ̊C
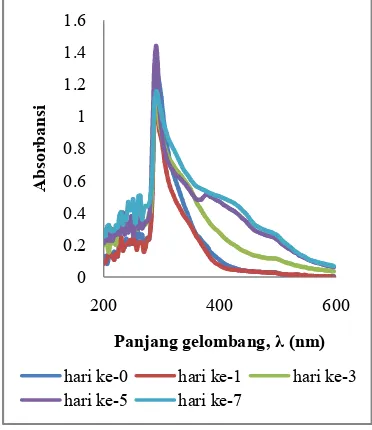
Kadar tanin sampel 2 ditentukan berdasarkan spektrum serapan pada Gambar 10 dan Gambar 11. Gambar 10 menunjukkan spektrum serapan pada penyimpanan suhu 26
̊
C sedangkan pada Gambar 11 menunjukkan spektrum serapan pada penyimpanan suhu 10
̊
C.
Pada penyimpanan suhu 26 ̊C hari ke? 0 puncak serapan terbentuk pada panjang gelombang 296 nm dengan nilai absorbansi sebesar 2.168. Pada penyimpanan hari ke?1, puncak serapan berada pada panjang gelombang 293 nm dengan nilai absorbansi sebesar 2.122, selama penyimpanan satu hari terlihat terjadi perubahan puncak serapan dan nilai absorbansi, hal ini menunjukkan bahwa selama satu hari larutan teh hijau sudah mengalami perubahan meskipun perubahan tersebut tidak terlalu besar. Pada penyimpanan hari ke?3, puncak serapanberada pada panjang gelombang 290 nm dengan nilai absorbansi sebesar 1.524 dan pada penyimpanan hari ke?5 puncak serapan berada pada panjang gelombang 290 nm dengan nilai absorbansi sebesar 1.883 dan pada penyimpanan hari ke? 7 puncak serapan berada pada panjang gelombang 293 nm dengan nilai absorbansi sebesar 1.935. Pada sampel 2 ini puncakserapan baru yang terbentuk tidak terlalu terlihat jika dibandingkan dengan sampel 1 yang dapat dilihat pada Gambar 8. Hal ini dipengaruhi oleh kepekatan larutan yang diakibatkan oleh komposisi yang membentuk larutan tersebut.
Gambar 10. Hubungan panjang gelombang dan absorbansi larutan teh
hijau sampel 2 pada penyimpanan suhu 26 ̊C
Spektrum serapan sampel 2 pada penyimpanan suhu 10 ̊C dapat dilihat pada Gambar 11. Pada awal penyimpanan, puncak serapan berada pada panjang gelombang 296 nm dengan nilai absorbansi sebesar 2.168. Pada hari ke?1 hingga hari ke?7 penyimpanan, puncak serapan yang terbentuk tidak mengalami perubahan, namun pada masing?masing lama penyimpanan terjadi perbedaan pada nilai absorbansi. Pada penyimpanan hari ke?1 nilai absorbansi sebesar 2.180, penyimpanan hari ke?3 sebesar 2.245, penyimpanan hari ke?5 sebesar 2.298, dan penyimpanan hari ke?7 sebesar 2.265.
Berdasarkan spektrum absorbansi yang ditunjukkan pada Gambar 11 terlihat puncak serapan yang terbentuk pada masing? masing lama penyimpanan relatif tidak menunjukkan perubahan. Hal ini menunjukkan bahwa dalam penyimpanan suhu 10 ̊C tidak mengakibatkan adanya perubahan komposisi molekul dalam larutan teh hijau tersebut.
Kadar tanin sampel 3 ditentukan berdasarkan nilai absorbansi pada Gambar 12 dan Gambar 13. Spektrum serapan sampel pada penyimpanan suhu 26 ̊C ditunjukkan pada Gambar 12 dan spektrum serapan sampel pada penyimpanan suhu 10 ̊C ditunjukkan pada Gambar 13. Pada penyimpanan hari ke?0 suhu 26 ̊C, puncak serapan pada panjang gelombang 293 nm dengan nilai absorbansi sebesar 1.272. Pada
0 0.5 1 1.5 2 2.5 3
200 400 600
A bs or ba ns i
Panjang gelombang, λ (nm)
hari ke?0 hari ke?1 hari ke?3
hari ke?5 hari ke?7
0 0.5 1 1.5 2 2.5
200 400 600
A bs or ba ns i
Panjang gelombang, λ (nm)
hari ke?0 hari ke?1 hari ke?3
16
penyimpanan hari ke?1 puncak serapan padapanjang gelombang 290 nm dengan nilai absorbansi sebesar 1.036. Selama penyimpanan satu hari terlihat mulai terjadinya pergeseran puncak serapan dan nilai absorbansi. Hal ini menunjukkan bahwa telah terjadi perubahan komposisi di dalam larutan.
Pada penyimpanan hari ke?3 hingga hari ke?7, puncak serapan terbentuk pada panjang gelombang yang sama dengan puncak serapan yang terbentuk pada penyimpanan hari ke?1 yaitu sebesar 290 nm, namun pada masing?masing lama penyimpanan terjadi perbedaan pada nilai absorbansi. Pada penyimpanan hari ke?3 nilai absorbansi sebesar 1.112 sedangkan pada penyimpanan hari ke?5 sebesar 1.44 dan pada penyimpanan hari ke?7 sebesar 1.157.
Spektrum serapan sampel 3 pada penyimpanan suhu 10 ̊C ditunjukkan pada Gambar 13. Pada penyimpanan hari ke?0, puncak serapan yang terbentuk berada pada panjang gelombang 293 nm dengan nilai absorbansi sebesar 1.272. Pada penyimpanan hari ke?1, puncak serapan yang terbentuk berada pada panjang gelombang 293 nm dengan nilai absorbansi 1.273. Pada penyimpanan hari ke?3, puncak serapan yang terbentuk berada pada 296 nm dengan nilai absorbansi sebesar 1.771.
Gambar 11. Hubungan panjang gelombang dan absorbansi larutan
teh hijau sampel 2 pada penyimpanan suhu 10 ̊C
Pada penyimpanan hari ke?5, puncak serapan yang terbentuk berada pada panjang
gelombang 290 nm dengan nilai absorbansi sebesar 1.426. Pada penyimpanan hari ke?7, puncak serapan yang terbentuk berada pada panjang gelombang 293 nm dengan nilai absorbansi sebesar 1.274.
Gambar 12. Hubungan panjang gelombang dan absorbansi larutan
teh hijau sampel 3 pada penyimpanan suhu 26 ̊C
Berdasarkan spektrum serapan yang dapat dilihat pada Gambar 13 tidak terlihat adanya puncak serapan baru yang terbentuk, namun pada lama penyimpanan yang berbeda terlihat terjadinya perubahan nilai absorbansi. Pada masing?masing lama penyimpanan terjadi pergeseran puncak serapan, namun tidak terbentuk puncak serapan baru. Hal ini mungkin saja terjadi disebabkan oleh adanya proses perubahan komposisi dalam larutan tersebut.
Pada sampel 1 penyimpanan suhu 26
̊
C dan penyimpanan suhu 10 ̊C relatif menunjukkan adanya perbedaan dibandingkan dengan sampel 2 dan sampel 3. Hal ini dapat saja terjadi berkaitan dengan komposisi yang dikandung pada sampel 1. Pada sampel 1 jumlah daun teh yang dilarutkan ke dalamaquadesjumlahnya lebih banyak dibandingkan dengan sampel 2 dan sampel 3, sehingga perubahan spektrum yang dihasilkan pada masing?masing sampel berbeda.
Kurva nilai absorbansi pada panjang gelombang serapan terhadap lama penyimpanan pada masing?masing sampel pada penyimpanan suhu 26 ̊C dan pada penyimpanan suhu 10 ̊C ditunjukkan
0 0.5 1 1.5 2 2.5
200 400 600
A bs or ba ns i
Panjang gelombang, λ (nm)
hari ke?0 hari ke?1 hari ke?3
hari ke?5 hari ke?7
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
200 400 600
A bs or ba ns i
Panjang gelombang, λ (nm)
hari ke?0 hari ke?1 hari ke?3
17
masing?masing pada Gambar 14 dan Gambar15.
Gambar 13. Hubungan panjang gelombang dan absorbansilarutan
teh hijau sampel 3 pada penyimpanan suhu 10 ̊C
Berdasarkan hasil penelitian yang dapat di lihat pada Gambar 14. Sampel 1, mengalami penurunan nilai absorbansi hinggapenyimpanan hari ke?5. Hal ini menunjukkan semakin lama waktu penyimpanan mengakibatkan kadar komposisi penyusun larutan teh semakin menurun sehingga mengakibatkan nilai absorbansi yang menurun. Pada penyimpanan hari ke?5 hingga hari ke?7 terjadi peningkatan nilai absorbansi, hal ini diakibatkan adanya senyawa baru sehingga ada peningkatan nilai absorbansi.
Gambar 14. Hubungan lama penyimpanan dan absorbansi
larutan teh hijau pada penyimpanan suhu 26 ̊C
Sampel 2, mengalami penurunan nilai absorbansi hingga hari ke?3. Hal ini menunjukkan semakin lama waktu penyimpanan mengakibatkan kadar komposisi penyusun larutan teh semakin menurun sehingga mengakibatkan nilai absorbansi yang menurun. Pada penyimpanan hari ke?3 hingga hari ke?7 terjadi peningkatan nilai absorbansi, hal ini diakibatkan adanya penyusun komposisi yang baru sehingga ada peningkatan nilai absorbansi.
Sampel 3, mengalami penurunan nilai absorbansi hingga hari ke?1. Setelah penyimpanan hari ke?1, absorbansi meningkat hingga penyimpanan hari ke?5. Setelah itu kurva menunjukkan penurunan kembali seperti yang terjadi pada penyimpanan hari ke?1. Penurunan ini menunjukkan semakin lama waktu penyimpanan mengakibatkan kadar penyusun larutan teh semakin menurun sehingga mengakibatkan nilai absorbansi yang menurun. Ketika terjadi peningkatan nilai absorbansi, hal ini diakibatkan adanya senyawa baru sehingga ada peningkatan nilai absorbansi.
Hasil percobaan yang menunjukkan penurunan dan peningkatan yang terbentuk pada masing?masing sampel terjadi pada lama penyimpanan yang berbeda. Hal ini diakibatkan adanya perbedaan komposisi penyusun larutan teh hijau. Sehingga mengakibatkan adanya perbedaan kurva. Kurva nilai absorbansi terhadap lama penyimpanan pada penyimpanan suhu 10 ̊C ditunjukkan pada Gambar 15.
Beradasarkan Gambar 15, sampel 1 mengalami penurunan nilai absorbansi seiring dengan lamanya waktu penyimpanan, penurunan ini disebabkan adanya perubahan komposisi yang terkandung dalam larutan teh hijau. Sampel 2 mula?mula mengalami peningkatan nilai absorbansi hingga penyimpanan hari ke?3 kemudian mengalami penurunan hingga penyimpanan hari ke?7. Sampel 3 mula?mula mengalami peningkatan nilai absorbansi hingga penyimpanan hari ke? 3 kemudian mengalami penurunan hingga penyimpanan hari ke?7.
Sampel 2 dan sampel 3 mula?mula mengalami peningkatan nilai absorbansi kemudian mengalami penurunan absorbansi, karena jumlah daun teh yang dilarutkan lebih sedikit dibandingkan dengan sampel 1, sehingga dapat mempengaruhi komposisi yang terkandung dalam larutan teh hijau. Penurunan nilai absorbansi seiring dengan lama penyimpanan dapat disebabkan adanya
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2
200 400 600
A bs or ba ns i
Panjang gelombang, λ (nm)
hari ke?0 hari ke?1 hari ke?3
hari ke?5 hari ke?7
0 1 2 3
0 1 3 5 7
A bs or ba ns i
Lama penyimpanan (hari keC)
18
perubahan kadar penyusun larutan teh hijau.Semakin lama penyimpanan pada suhu 26 ̊C maka nilai absorbansi akan semakin menurun.
Gambar 15. Hubungan lama penyimpanan dan absorbansi
larutan teh hijau pada penyimpanan suhu 10 ̊C
Besarnya perubahan nilai absorbansi terhadap lama penyimpanan pada penyimpanan suhu 10 ̊C relatif tidak mengalami perbedaan jika dibandingkan dengan perubahan nilai absorbansi terhadap lama penyimpanan pada penyimpanan suhu 26 ̊C yang dapat dilihat pada Gambar 14. Hasil pengolahan data menunjukkan bahwa perbedaan perlakuan komposisi daun teh dan tempat penyimpanan menunjukkan berbeda sangat nyata pada tingkat 1% dengan koefisien keragaman 11.5%, yang artinya perbedaan jumlah daun teh yang dilarutkan dan perbedaan tempat penyimpanan menunjukkan adanya pengaruh terhadap lama penyimpanan.
KESIMPULAN DAN SARAN
Kesimpulan
Kadar tanin yang terkandung dalam larutan teh hijau dapat ditentukan dengan menggunakan metode spektoskopi UV/Vis. Kadar tanin dalam larutan teh dapat terjadi penurunan jika larutan teh di simpan semakin lama. Penyimpanan larutan teh hijau dalam suhu 10 ̊C dapat memperpanjang masa simpan dan menghambat terjadinya proses perubahan komposisi kandungan dalam larutan teh dibandingkan jika disimpan pada suhu 26 ̊C.
Saran
Berdasarkan penelitian ini dapat disarankan agar diadakan penelitian lebih lanjut dengan memvariasi jenis daun teh, memperlama waktu penyimpanan, melakukan variasi suhu penyeduhan daun teh, menggunakan penyaring yang sudah diketahui ukurannya, serta diadakan penelitian lanjutan untuk mengidentifikasi senyawa baru yang terbentuk akibat penyimpaan larutan teh dengan melakukan uji kimia dan menguji sifat?sifat yang terkandung baik secara toksisitas atau yang lainnya.
DAFTAR PUSTAKA
Ashari S. 2006. Hortikultura Aspek Budidaya. Jakarta: Universitas Indonesia (UI?press).
Gaman, P.M, K.B. Sherrington. 1981. The Science of Food. Oxford: Pergamon Press.
Harborne J B. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisa Tumbuhan.Ed ke? 2.Kosasih dan Iwang, penerjemah. Terjemahan dari: Phytochemical Methods. Institut Teknologi Bandung, Bandung.
Hart H. 2003. Kimia Organik: Suatu Kuliah Singkat. Ed ke?11.Achmadi S S, penerjemah; Safitri A, editor. Terjemahan dari: Organic Chemistry.Jakarta: Erlangga. Harvey D. 2000. Modern Analytical
Chemistry. Amerika: Mc Graw Hill Companies, Inc.
Hilyatuzzahroh. 2006. Korelasi kadar tanin pada produk teh komersial dengan aktivitasnya sebagai senyawa antibakteri EPEC K101.[Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor.
Kartikasari N E. 2008. Uji toksisitas ekstrak daun awar0awar (ficus septica burm.f ) terhadap artemia salina leach dan profil kromatografi lapis tipis.[Skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta. 0 1 2 3
0 1 3 5 7
A bs or ba ns i
Lama penyimpanan (hari keC)
19
Lemmens R H M J, Wulijarni. 1999.SumberDaya Nabati Asia Tenggara No 3.Tumbuhan Penghasil Pewarna dan Tanin. PT Balai Pustaka (Persero) Jakarta bekerja sama dengan prosea Indonesia, Bogor. Lestari N. 2009. Uji toksisitas akut ekstrak
valerian (Valeriana officinalis) terhadap gastrointestinal mencit BalB/C. [Skripsi]. Semarang: Fakultas Kedokteran, Universitas Diponegoro.
Lisdawati V, Wiryowidagdo S, Kardono L B S. 2007. Solasi dan elusidasi struktur senyawa lignan dan asam lemak dari ekstrak daging buahPhaleria macrocarpa. Bul. Penel. Kesehatan 35(3): 115?124. Munson, Young, Okiishi. 2002. Mekanika
Fluida.Ed ke?4.Harinaldi, Budiarso, penerjemah; Hardani, editor. Terjemahan dari: Fundamentals of Fluid Mechanics Fourth Edition. Jakarta: Erlangga.
Nenden S.Z. 2007.Penentuan Indeks Kepedasan, Indeks Pengembangan, dan Kadar Tanin Dalam Simplisia. Laboratorium Farmakognosi Analitik Program Studi Sains Dan Teknologi Farmasi Sekolah Farmasi Institut Teknologi Bandung.
Rani H. 1989. Jenis dan Mekanisme Kerja Bahan Pengawet Makanan.Bogor : IPB Press.
Rehman S, Almas K, Shahzadi N, Bhatti N, Saleem A . 2002. Effect of time and temperature on infution of tannin from comercial brands of tea. Int J AgrBiol, 4(2): 285?287.
Saeni M S. 1989.Kimia Lingkungan. Bogor : Depdikbud. Dirjen Pendidikan Tinggi Pusat Antar Universitas Ilmu Hayat.IPB.
Skoog D, Holler E, Nieman T. 1998. Principles of Instrumental Analysis, 5th ed.United States: Thomson Learning, Inc.
Tuminah S. 2004. Teh (Camellia sinensis O.K. var. Assamica (Mast)) sebagai salah satu sumber antioksidan.J Cermin Kedokteran.144: 52?54. Ummah M K. 2010.Ekstraksi dan pengujian
aktivitas antibakteri senyawa tanin
pada daun belimbing wuluh(Averrhoa bilimbi L.).[Skripsi]. Malang: Fakultas Sains dan Teknologi, Universitas Islam Negeri Maulana Malik Ibrahim. Yan S. 2007. NIR Evaluation of quality of tea
and it’s market price. spectroscopy europe. 19(2): 16?19.
21
Lampiran 1.Diagram alir penelitian.Tahap Pembuatan Larutan
Tahap karakterisasi fisik dan kadar tanin
Larutan teh hijau
Uji karakterisasi fisik dan kadar tanin
Penyimpanan larutan teh hijau Memanaskan 300 mLaquades
denganhot plate hingga mencapai suhu 60 ̊C
Sampel dimasukkan dalamaquades bersuhu 60 ̊C, kemudian
diaduk dengan kecepatan putar 350 rpm
selama 3 menit
Penyaringan dengan saringan teh dan kertas saring
22
Lanjutan Lampiran 1. Diagram alir penelitian.Suhu 26 ̊C Suhu
26 ̊C
Suhu 10 ̊C Suhu
10 ̊C
Uji karakterisasi dan kadar tanin pada hari ke?0,
hari ke?1, hari ke?3, hari ke?5, dan hari ke?7
Sampel 2
Pengolahan data dan analisis Penyimpanan larutan teh hijau
Sampel 1 Sampel 3
Suhu 26 ̊C
Suhu 10 ̊C
Penulisan laporan
23
Lampiran 2. Alat yang digunakan dalam penelitiana b
c d
e
24
Lampiran 3. Perhitungan sidik ragam (analisis variasi) kerapatanLangkah 1
Pengelompokan data
Perlakuan
Hasil kerapatan (g/mL) Jumlah perlakuaan
(T)
Rataan perlakuan
1 2 3 4 5
A 1.007 0.935 0.982 0.998 1.005 4.927 0.985 B 1.007 0.994 0.989 1.004 0.975 4.969 0.994 C 0.947 0.996 1.004 0.940 0.917 4.804 0.961 D 0.947 1.069 0.982 0.930 0.918 4.846 0.969 E 0.943 0.936 1.224 1.116 1.170 5.389 1.078 F 0.943 0.992 0.973 0.992 0.923 4.823 0.965 Jumlah
umum (G) 29.758
Rataan
umum 0.992
Keterangan:
A = sampel 1 pada penyimpanan suhu 10 ̊C B = sampel 1 pada penyimpanan suhu 26 ̊C C = sampel 2 pada penyimpanan suhu 10 ̊C D = sampel 2 pada penyimpanan suhu 26 ̊C E = sampel 3 pada penyimpanan suhu 10 ̊C F = sampel 3 pada penyimpanan suhu 26 ̊C 1 = hari pembuatan larutan teh hijau
2 = hari pertama penyimpanan larutan teh hijau 3 = hari ketiga penyimpanan larutan teh hijau 4 = hari kelima penyimpanan larutan teh hijau 5 = hari ketujuh penyimpanan larutan teh hijau
Langkah 2
Menentukan derajat bebas (d.b) untuk setiap sumber keragaman dengan menggunakant sebagai banyaknya perlakuan danrbanyaknya ulangan sebagai berikut:
d.bumum = (r)(t) – 1 = (5)(6) – 1 = 29 d.bperlakuan =t– 1 = 6 – 1 = 5
25
Lanjutan Lampiran 3. Perhitungan sidik ragam (analisis variasi) kerapatanLangkah 3
Dengan menggunakanXiuntuk menunjukkan pengukuran ke?i, Ti sebagai jumlah perlakuan ke?i,
dann sebagai banyaknya percobaan [yaitun=(r)(t)], faktor koreksi dan berbagai jumlah kuadrat (JK) dihitung sebagai berikut:
Faktor koreksi (FK) 2
G n
=
JK umum = F G *
(H (
FK
JK perlakuan
2
1
t
i i
T
FK
r
=
=
−
∑
JK galat = JK umum ? JK perlakuan
Langkah 4
Menghitung kuadrat tengah (KT) untuk setiap sumber keragaman dengan membagi JK dengand.b yang bersangkutan:
KT perlakuan = JK perlakuan
< 1
KT galat = JK galat
</J 17
Langkah 5
Menghitung nilaiFuntuk menguji beda nyata perbedaan perlakuan sebagai berikut:
K KT perlakuanKT galat
Langkah 6
Memasukkan semua data pada langkah 2 hingga langkah 5 ke dalam garis besar sidik ragam sebagai berikut:
Sumber
keragaman Derajat bebas (d.b)
Jumlah kuadrat (JK)
Kuadrat
tengah (KT) Fhitung
Ftabel
5% 1%
Perlakuan 5 0.048 0.010 2.363 2.62 3.90
Galat percobaan 24 0.098 0.004
26
Lanjutan Lampiran 3. Perhitungan sidik ragam (analisis variasi) kerapatankk =6.38%
tn
= tidak berbeda nyata pada tingkat 5%
Lanjutan Lampiran 2. Perhitungan Sidik Ragam (Analisis Variasi) Kerapatan
Langkah 7
Menghitung koefisien keragaman (kk), sebagai berikut:
LL MKT galat
27
Lampiran 4. Perhitungan sidik ragam (analisis variasi) viskositasLangkah 1
Pengelompokan data
Perlakuan Hasil viskositas (cP)
Jumlah perlakuaan
(T)
Rataan perlakuan
1 2 3 4 5
A 1.006 1.076 1.159 1.104 1.064 5.409 1.082 B 1.006 0.985 0.915 0.985 1.104 4.995 0.999 C 1.015 1.064 1.015 1.021 0.991 5.106 1.021 D 1.015 0.985 0.985 0.982 1.015 4.982 1.000 E 0.979 1.113 1.021 1.058 1.088 5.259 1.052 F 0.979 0.985 1.030 1.018 1.006 5.018 1.004 Jumlah
umum (G) 30.769
Rataan
umum 1.026
Keterangan:
A = sampel 1 pada penyimpanan suhu 10 ̊C B = sampel 1 pada penyimpanan suhu 26 ̊C C = sampel 2 pada penyimpanan suhu 10 ̊C D = sampel 2 pada penyimpanan suhu 26 ̊C E = sampel 3 pada penyimpanan suhu 10 ̊C F = sampel 3 pada penyimpanan suhu 26 ̊C 1 = hari pembuatan larutan teh hijau
2 = hari pertama penyimpanan larutan teh hijau 3 = hari ketiga penyimpanan larutan teh hijau 4 = hari kelima penyimpanan larutan teh hijau 5 = hari ketujuh penyimpanan larutan teh hijau
Langkah 2
Menentukan derajat bebas (d.b) untuk setiap sumber keragaman dengan menggunakant sebagai banyaknya perlakuan danrbanyaknya ulangan sebagai berikut:
d.bumum = (r)(t) – 1 = (5)(6) – 1 = 29 d.bperlakuan =t– 1 = 6 – 1 = 5
28
Lanjutan Lampiran 4. Perhitungan sidik ragam (analisis variasi) viskositasLangkah 3
Dengan menggunakanXiuntuk menunjukkan pengukuran ke?i, Ti sebagai jumlah perlakuan ke?i,
dann sebagai banyaknya percobaan [yaitun=(r)(t)], faktor koreksi dan berbagai jumlah kuadrat (JK) dihitung sebagai berikut:
Faktor koreksi (FK) = G*N
JK umum = F G *
(H (
FK
JK perlakuan = ∑ P( 8 (H
Q –FK
JK galat = JK umum ? JK perlakuan
Langkah 4
Menghitung kuadrat tengah (KT) untuk setiap sumber keragaman dengan membagi JK dengand.b yang bersangkutan:
KT perlakuan = JK perlakuan
< 1
KT galat = JK galat
</J 17
Langkah 5
Menghitung nilaiFuntuk menguji beda nyata perbedaan perlakuan sebagai berikut:
K KT perlakuan
KT galat Langkah 6
Memasukkan semua data pada langkah 2 hingga langkah 5 ke dalam garis besar sidik ragam sebagai berikut:
Sumber
keragaman Derajat bebas (d.b)
Jumlah kuadrat (JK)
Kuadrat tengah
(KT) Fhitung
Ftabel
5% 1%
Perlakuan 5 0.030 0.006 2.939tn 2.62 3.9
Galat
percobaan 24 0.048 0.002
Umum 29 0.078
kk =4.36%
*
29
Lanjutan Lampiran 4. Perhitungan sidik ragam (analisis variasi) viskositasLangkah 7
Menghitung koefisien keragaman (kk), sebagai berikut:
30
Lampiran 5. Perhitungan sidik ragam (analisis variasi) nilai absorbansiLangkah 1
Pengelompokan data
Perlakuan Hasil nilai absorbansi
Jumlah perlakuaan
(T)
Rataan perlakuan
1 2 3 4 5
A 2.790 2.754 2.716 2.574 2.376 13.210 2.642 B 2.790 2.550 2.476 1.809 2.618 12.243 2.449 C 2.168 2.180 2.298 2.245 2.265 11.156 2.231 D 2.168 2.122 1.524 1.883 1.935 9.632 1.926 E 1.272 1.273 1.771 1.426 1.274 7.016 1.403 F 1.272 1.036 1.112 1.440 1.157 6.017 1.203 Jumlah
umum (G) 59.274
Rataan umum 1.976
Keterangan:
A = sampel 1 pada penyimpanan suhu 10 ̊C B = sampel 1 pada penyimpanan suhu 26 ̊C C = sampel 2 pada penyimpanan suhu 10 ̊C D = sampel 2 pada penyimpanan suhu 26 ̊C E = sampel 3 pada penyimpanan suhu 10 ̊C F = sampel 3 pada penyimpanan suhu 26 ̊C 1 = hari pembuatan larutan teh hijau
2 = hari pertama penyimpanan larutan teh hijau 3 = hari ketiga penyimpanan larutan teh hijau 4 = hari kelima penyimpanan larutan teh hijau 5 = hari ketujuh penyimpanan larutan teh hijau
Langkah 2
Menentukan derajat bebas (d.b) untuk setiap sumber keragaman dengan menggunakant sebagai banyaknya perlakuan danrbanyaknya ulangan sebagai berikut:
d.bumum = (r)(t) – 1 = (5)(6) – 1 = 29 d.bperlakuan =t– 1 = 6 – 1 = 5
31
Lanjutan Lampiran 5. Perhitungan sidik ragam (analisis variasi) nilai absorbansiLangkah 3
Dengan menggunakanXiuntuk menunjukkan pengukuran ke?i, Ti sebagai jumlah perlakuan ke?i,
dann sebagai banyaknya percobaan [yaitun=(r)(t)], faktor koreksi dan berbagai jumlah kuadrat (JK) dihitung sebagai berikut:
Faktor koreksi (FK) = G*N
JK umum = F G *
(H (
FK
JK perlakuan = ∑ P( 8 (H
Q –FK
JK galat = JK umum ? JK perlakuan
Langkah 4
Menghitung kuadrat tengah (KT) untuk setiap sumber keragaman dengan membagi JK dengand.b yang bersangkutan:
KT perlakuan = JK perlakuan
< 1
KT galat = JK galat
</J 17
Langkah 5
Menghitung nilaiFuntuk menguji beda nyata perbedaan perlakuan sebagai berikut:
K KT perlakuan
KT galat
Langkah 6
Memasukkan semua data pada langkah 2 hingga langkah 5 ke dalam garis besar sidik ragam sebagai berikut:
Sumber keragaman
Derajat bebas (d.b)
Jumlah kuadrat (JK)
Kuadrat tengah
(KT) Fhitung
Ftabel
5% 1%
Perlakuan 5 8.2975216 1.65950432 32.13319353** 2.62 3.9 Galat percobaan 24 1.2394692 0.05164455
Umum 29 9.5369908
kk= 11.5%
**
32
Lanjutan Lampiran 5. Perhitungan sidik ragam (analisis variasi) nilai absorbansiLangkah 7
Menghitung koefisien keragaman (kk), sebagai berikut:
2
ABSTRAK
MILA ARMIGUSTIEN. Karakterisasi Fisik dan Optik Larutan Teh Hijau Berdasarkan Variasi Waktu dan Suhu Penyimpanan. Dibimbing oleh Ir. HANEDI DARMASETIAWAN,M.S dan
Dr. AKHIRUDDIN MADDU,M.Si.
Teh (Camellia sinensis L.) merupakan salah satu bahan penyegar yang sangat banyak dikonsumsi dan dapat memberikan pengaruh diet bagi kesehatan dan terapi. Kandungan utama yang terdapat dalam teh adalah golongan polifenol yaitu tanin. Teh yang tersebar berupa teh hijau, teh hitam, dan teh oolong. Tujuan dalam penelitian ini mengetahui dan mempelajari karakterisasi fisik dan optik larutan teh hijau berdasarkan variasi waktu dan lama penyimpanan. Karakterisasi fisik yang dilakukan adalah kerapatan dan viskositas. Karakterisasi optik yang dilakukan dengan menggunakan spektrometer UV/Vis. Kerapatan yang dihasilkan menunjukkan tidak berbeda nyata pada taraf 5% terhadap perbedaan komposisi dan suhu penyimpanan. Secara fisis, perbedaan komposisi dan suhu penyimpanan tidak mempengaruhi kerapatan larutan teh hijau. Viskositas yang dihasilkan menunjukkan berbeda nyata pada taraf 5% dan 1% terhadap perbedaan komposisi dan suhu penyi