PATOGENITAS TERHADAP PADI GALUR ISOGENIK
INDRA KURNIAWAN SAPUTRA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
dengan Teknik Biomolekuler dan Karakter Patogenitas terhadap Padi Galur
Isogenik. Dibimbing oleh I MADE ARTIKA dan TASLIAH.
Peningkatan produksi padi mengalami kendala karena adanya cekaman biotik
seperti penyakit hawar daun bakteri (HDB). Tujuan penelitian ini adalah untuk
mengidentifikasi penyakit HDB yang disebabkan oleh bakteri
Xanthomonas
oryzae
pv
oryzae
(Xoo) dengan teknik biomolekuler menggunakan tiga primer
spesifik Xoo pada PCR koloni dan mengetahui arah virulensi terhadap isolat Xoo
asal Jawa Barat, Sumatera Barat, Kalimantan Barat dengan teknik
clip method
dalam analisis karakter patogenitas dengan varietas padi galur isogenik dan
varietas populer. Hasil pemurnian didapatkan 72 isolat yakni 20 isolat asal Jawa
Barat, 30 isolat asal Sumatera Barat, dan 22 isolat asal Kalimantan Barat.
Sebagian besar isolat teridentifikasi positif Xoo kecuali isolat Xoo11-023 asal
Sumatera Barat teridentifikasi negatif Xoo. Hasil karakter patogenitas didapatkan
bahwa padi varietas Code yang mengandung gen resisten
Xa
4-
Xa
7 serta IRBB5
yang mengandung gen resisten
xa
5 merupakan varietas padi yang tahan terhadap
bakteri asal ketiga wilayah tersebut. Intensitas penyakit rerata Code dan IRBB5
oleh isolat asal Jawa Barat sebesar 1.62 % dan 3.55 %, Sumatera Barat 2.10 %
dan 2.97 %, Kalimantan Barat 2.17 % dan 4.45 %. Isolat Xoo11-042 asal
Sumatera Barat merupakan isolat bervirulensi tinggi yakni intensitas penyakit
rerata untuk varietas Code 3.29 % dan IRBB5 6.90 % yang tergolong agak tahan.
oryzae
with Biomolecular Technique and Pathogenecity Character toward
Near-Isogenic Lines (NILs). Under the direction of I MADE ARTIKA and TASLIAH.
Increased production of paddy can face obstacle because the biotic stresses
like bacterial leaf blight (BLB). The aim of this research to identification BLB
caused by
Xanthomonas oryzae
pv
oryzae
(Xoo) by biomolecular technique using
three primers specific Xoo through PCR colony, and to know virulence of Xoo
isolates from West Java, West Sumatera, West Borneo by clip method for
character of pathogenicity analysis using near-Isogenic lines and popular varieties.
The purifying result were obtained 72 isolates namely 20 isolates from West Java,
30 isolates from West Sumatera, 22 isolates from West Borneo. Most of isolates
were identified Xoo positive, except isolate Xoo11-023 from West Sumatera were
identified Xoo negative. The character of pathogenicity showed that Code which
contain resistant gene
Xa
4-
Xa
7 and IRBB5 which contain resistant gene
xa
5 were
resistant to Xoo from all three areas. The average disease intensity on Code and
IRBB5 of isolates from West Java was 1.62 % and 3.55%, West Sumatera was
2.10 % and 2.97 %, West Borneo was 2.17 % and 4.45 %. Isolate Xoo11-042
from West Sumatera was the one having highest virulence with average disease
intensity on Code 3.29 % and IRBB5 6.90 % which classified as moderate
resistant.
PATOGENITAS TERHADAP PADI GALUR ISOGENIK
INDRA KURNIAWAN SAPUTRA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama
: Indra Kurniawan Saputra
NRP
: G84070009
Disetujui,
Komisi Pembimbing
Dr. Ir. I Made Artika, M. App. Sc
Tasliah, M.Si
Ketua
Anggota
Diketahui,
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
Rasa syukur sepenuh hati sebagai insan beriman penulis panjatkan kepada
Allah SWT karena atas segalanya maka penulis dapat menyelesaikan skripsi yang
berjudul ”
Identifikasi
Xanthomonas oryzae
pv
. oryzae
dengan Teknik
Biomolekuler dan Karakter Patogenitas terhadap Padi Galur Isogenik
”. Shalawat
serta salam semoga senantiasa tercurahkan kepada baginda Rasulullah SAW.
Skripsi ini disusun berdasarkan kegiatan penelitian yang dilakukan dari bulan
September 2011 hingga bulan Maret 2012, di Laboratorium Biologi Molekuler
dan rumah kawat
Blast Nursery
, Balai Besar Biogen Cimanggu, Bogor.
Penulis mengucapkan terimakasih kepada Bapak Dr. Ir. I Made Artika,
M.App.Sc dan Ibu Tasliah M.Si selaku pembimbing yang telah memberikan kritik
dan saran yang membangun. Penulis mengucapkan terimakasih kepada orang tua
dan seluruh keluarga yang telah mendukung secara moril maupun materil. Ucapan
terimakasih juga kepada Bapak Joko Prasetiyono, Bapak Mahrup dan Ibu Fatimah
atas bantuan teknis maupun teoritis selama pengerjaan penelitian ini. Terimakasih
penulis ucapkan juga kepada teman-teman yang selalu memberikan bantuan serta
semua pihak sehingga tersusunnya skripsi ini.
Penulis berharap semoga skripsi ini dapat bermanfaat bagi kemajuan
pengetahuan, pendidikan, dan penelitian.
Bogor, Juli 2012
Bapak Syafruddin dan Ibu Hayati. Penulis dilahirkan di Sumbawa Besar pada
tanggal 15 Agustus 1989. Penulis menempuh pendidikan formal di SDN 1
Labuhan Sumbawa (1995-2001), SMPN 1 Labuhan Badas Sumbawa (2001-2004),
dan SMAN 1 Sumbawa Besar (2004-2007). Pada tahun 2007 penulis lulus seleksi
masuk Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB
(USMI) sebagai mahasiswa Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama menjadi mahasiswa penulis aktif dalam kegiatan kemahasiswaan
diantaranya staf Badan Eksekutif Mahasiswa Tingkat Persiapan Bersama (BEM
TPB) dan Anggota aktif FORCES IPB pada periode 2007/2008, staf periode
2008/2009 dan ketua periode 2009/2010 di Himpunan Profesi Departemen
Biokimia (CREBs). Penulis juga menjadi asisten praktikum pada bidang studi
Struktur dan Fungsi Biomolekul di Departemen Biokimia pada tahun ajaran
2010-2011. Disamping itu, penulis pernah mendapatkan penghargaan setara emas dalam
kegiatan penunjang PKM dan setara perak dalam PKMP pada PIMNAS (Pekan
Mahasiswa Nasional) XXIV tahun 2011 di Universitas Hasanuddin, Makassar.
Penulis mendapatkan kesempatan sebagai penyaji poster dalam kegiatan
8
thInternational Paper and Coating Chemistry Symposium,
Swedia dan penyaji oral
dalam seminar se-Eropa, Universitas Wageningen, Belanda pada tahun 2012.
Penulis pernah mengikuti kegiatan Praktik Lapangan di Balai Besar
Pascapanen Cimanggu Bogor bagian bangsal pengolahan tepung pada periode Juli
hingga Agustus 2010 dengan judul ”Optimasi Purifikasi Tepung Glukomanan dari
Umbi Iles-iles
(Amorphophallus oncophyllus)
dengan Metode Enzimatis”.
Karya
penulis yang telah didaftarkan paten yakni
dengan judul “Isolasi dan
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 2
Hawar Daun Bakteri (HDB) .. ... 2
Karakterisasi
Xanthomonas oryzae
pv.
oryzae
... 3
Padi Varietas Galur Isogenik ... 4
Teknik Biomolekuler
Polymerase Chain Reaction
(PCR) Koloni ... 5
Elektroforesis Fragmen DNA ... 6
BAHAN DAN METODE ... 7
Alat dan Bahan ... 7
Metode ………
... 7
HASIL DAN PEMBAHASAN ... 9
Isolat Bakteri Xoo ... 9
Identifikasi Bakteri Xoo Menggunakan PCR koloni ... 10
Karakter Patogenitas ... 11
SIMPULAN DAN SARAN ... 13
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
1
Gen-gen resisten terhadap HDB ... 2
2
Perkembangan strain Xoo di daerah penghasil padi di Indonesia ... 4
3
Daftar varietas padi dalam karakter patogenitas pada rumah kawat ... 9
4
Indikator pembobotan intensitas penyakit padi karakter patogenitas ... 9
DAFTAR GAMBAR
Halaman
1
Fisiologi bakteri Xoo ... 3
2
Interaksi molekuler bakteri Xoo dan gen resisten ... . 4
3
Tahap perubahan temperatur PCR ... 6
4
Koloni Xoo dalam media cawan Wakimoto Agar (WA) ... 9
5
Elektroforegram PCR koloni dengan menggunakan primer XO ... 10
6
Elektroforegram PCR koloni dengan menggunakan primer Xoo2976 . 10
7
Elektroforegram PCR koloni dengan menggunakan primer Xoo ... .. 11
8
Histogram rerata intensitas penyakit isolat HDB asal Jawa Barat ... . 12
9
Histogram rerata intensitas penyakit isolat HDB asal Sumatera Barat... . 12
1
Diagram alir penelitian ... . 17
2
Asal isolat bakteri Xoo dan varietas padi yang diidentifikasi ... . 18
3
Elektroforegram PCR koloni hasil identifikasi seluruh isolat
menggunakan primer XO ... 19
4
Elektroforegram PCR koloni hasil identifikasi seluruh isolat dengan
menggunakan primer Xoo2976 ... . 20
5
Elektroforegram PCR koloni hasil identifikasi seluruh isolat
menggunakan primer Xoo ... 20
6
Visualisasi virulensi bakteri Xoo dalam karakter patogenik pada padi
varietas galur isogenik dan populer ... 21
7
Intensitas penyakit (IP) rerata varietas Code dan IRBB5 ... 23
8
Hasil intensitas penyakit (IP) rerata isolat dalam uji patogenitas rumah
PENDAHULUAN
Kebutuhan padi di Indonesia terus meningkat seiring dengan meningkatnya kebutuhan pangan. Peningkatan produksi padi mengalami banyak kendala karena adanya serangan dari cekaman abiotik maupun biotik. Cekaman abiotik berupa kekeringan, banjir atau keracunan aluminium, besi, dan logam-logam lainnya, sedangkan cekaman biotik meliputi serangan hama dan penyakit seperti penyakit Hawar Daun Bakteri (HDB). Penyakit HDB pada padi merupakan penyakit padi nomor satu di Indonesia untuk padi persawahan. Kerusakan akibat penyakit tersebut secara kuantitatif akan mengurangi hasil panen dan rendahnya bobot 1000 biji, sedangkan kerusakan secara kualitatif ditunjukkan oleh tidak berkualitasnya gabah. Kerusakan sedang berkisar 10 – 20 %, sementara kerusakan berat mencapai lebih dari 50 %. Penurunan hasil padi akibat HDB umumnya berkisar 15 – 23 % (Kadir 2009). Data Direktorat Perlindungan Pangan (2011) melaporkan bahwa di tahun 2010 luas lahan yang terserang penyakit HDB sebesar 54.796 ha dan terus meningkat di masa tanam 2010 – 2011 sebesar 64.123 ha di seluruh Indonesia.
Penyakit ini disebabkan oleh bakteri
Xanthomonas oryzae pv oryzae (Xoo). Hasil infeksi Xoo memiliki kesamaan dengan bentuk hasil infeksi dari bakteri Xanthomonas oryzae pv oryzicola (Xoc). Bakteri Xoc merupakan bakteri penyebab penyakit daun bergaris, terlihat hasil infeksi kedua penyakit tersebut sama secara fenotif bahwa daun yang terinfeksi akan memiliki warna kuning keabu-abuan (Liu et al. 2006), maka diperlukan identifikasi yang tepat untuk membedakan infeksi tersebut.
Identifikasi bisa dilakukan melalui postulat Koch yakni (1) mikroorganisme tertentu selalu ditemukan berasosiasi dengan penyakit yang ditimbulkan, (2) mikroorganisme dapat diisolasi dan ditumbuhkan sebagai biakan murni di laboratorium, (3) biakan murni tersebut jika diinjeksikan pada binatang yang sesuai dapat menimbulkan penyakit, dan (4) mikroorganisme tersebut dapat diisolasi kembali dari hewan yang telah terinfeksi (Priyani 2003). Panjangnya proses dalam menggunakan postulat Koch maka identifikasi pun dapat dilakukan secara biomolekuler setelah diketahui urutan DNA untuk genom Xoo dengan menggunakan primer spesifik Xoo yang digunakan oleh Lang et al. (2010) dan Onasanya et al. (2010) melalui analisis
Polymerase Chain Reaction (PCR). Teknik PCR telah umum digunakan dalam mengidentifikasi bakteri patogen tanaman melalui koloni (Sakthivel et al. 2001), serta mempermudah dalam pengkontrolan bakteri Xoo melalui pengamatan gen resisten padi terhadap patogen dan merupakan pendekatan yang paling efektif (Liu et al. 2006).
Dilaporkan bahwa hampir seluruh daerah di Indonesia telah tersebar penyakit HDB. Daerah endemik HDB adalah Jawa Barat dan Jawa Tengah dengan tingkat dan strain yang berbeda (Hanarida et al. 2007). Bakteri Xoo memiliki berbagai jenis strain. Di Indonesia sejak tahun 1998 telah terdapat 9 strain Xoo (Hartini & Kardin 1998). Tingginya strain Xoo akan berdampak terhadap berbagai jenis virulensi ke tanaman padi. Selain itu perubahan virulensi ditentukan oleh tiga komponen yakni patogen, inang (padi), dan lingkungan biotik dan abiotik. Masing-masing komponen dapat mengalami perubahan sifat, jika satu komponen berubah maka akan mempengaruhi tingkat virulensi patogen (Kadir 2009). Salah satu kultivar yang dapat dimanfaatkan adalah padi varietas galur isogenik dan diduga mampu menghasilkan arah virulensi Xoo pada suatu wilayah. Padi galur isogenik merupakan varietas padi dari hasil rakitan dengan menggunakan padi kultivar IR 24 sebagai recurrent parent. Galur isogenik memiliki tingkat keragaman gen yang sama, serta mudah untuk disisipkan gen ketahanan terhadap HDB. Hubungan patotipe Xoo dan kultivar padi mengikuti pola gen ke gen, maka jumlah dan komposisi masing-masing virulen pun dapat diketahui (Hartini & Kardin 1998).
TINJAUAN PUSTAKA
Hawar Daun Bakteri (HDB)
Penyakit HDB merupakan penyakit utama padi sawah di Indonesia yang disebabkan oleh bakteri Xanthomonas oryzae
pv oryzae (Xoo). Menurut Ou (1985) penyakit HDB pertama kali ditemukan di Indonesia pada tahun 1948/1949 pada musim hujan, pada waktu itu penyakit ini disebut sebagai kresek atau hama lodoh dan diamati di Indonesia pertama kali pada tahun 1988 (Mew 1988). Tahun 1999 Nyvall (1999) dalam Liu
et al. (2006) melaporkan bahwa kresek merupakan salah satu jenis gejala dari HDB yakni serangan HDB terjadi pada masa pembibitan, yang menyebabkan daun pada tanaman menjadi kuning pucat, layu, dan mati. Kresek merupakan gejala penyakit yang paling destruktif, sedangkan HDB adalah gejala yang lebih umum. Infeksi terjadi pada tanaman padi setelah pembibitan hingga dewasa. Infeksi ditandai dengan water-soaked greyish atau corak keabu-abuan dalam 1 – 2 minggu. Bagian ujung daun padi yang terinfeksi akan meluas hingga pelepah daun (Mew et al. 1993; Ou 1985).
Penyakit HDB dapat menurunkan tingkat produksi padi (Zhao et al. 2007) dan berkurangnya bobot dari 1000 biji secara kuantitatif. Bobot 1000 biji merupakan nisbah dari 1000 biji yang dihasilkan dalam produksi padi. Penurunan hasil padi akibat HDB umumnya berkisar 15 – 23 % (Kadir 2009). Tambah lagi menurut Liu et al. (2006) sebelum diterapkannya penggunaan varietas resisten, dan karantina kerusakan akibat HDB mencapai 20 – 30 %. Kerusakan secara kualitatif dapat berupa penurunan kualitas gabah karena gangguan pemasakan (Ou 1985; Kadir 2009). Kerusakan akibat kresek dapat mencapai hingga 60 – 75 % (Ou 1985). Di Indonesia pada tahun 2006, terdapat 519.200 ha tanaman padi yang terserang dengan organisme pengganggu tanaman (OPT) dan yang terserang HDB seluas 74.243 ha dan merupakan serangan terluas dari HDB (Direktorat Perlindungan Tanaman Pangan 2007). Data terbarukan Direktorat Perlindungan Pangan (2011) melaporkan bahwa di tahun 2010 luas lahan yang terserang penyakit HDB sebesar 54.796 ha dan terus meningkat di masa tanam 2010 – 2011 yaitu sebesar 64.123 ha di seluruh Indonesia. Tinggi dan rendahnya data tersebut disebabkan oleh tingkat perubahan strain pada HDB cukup tinggi.
Pengendalian HDB dilakukan melalui kebiasaan, kimiawi, biologis, dan melalui gen resisten HDB. Pengendalian berdasarkan kebiasaan bercocok tanam padi yakni pemberian disinfektan pada benih, drainase yang tepat pada saat pembibitan, pemberian pupuk, penghilangan tanaman pengganggu, serta pembakaran lahan setelah panen, dan adanya penggiliran tanaman. Pengendalian ini tidak begitu efektif, karena bentuk penyebaran HDB juga dipengaruhi oleh angin dan hujan dari tanaman padi yang terinfeksi lainnya (Liu
et al. 2006).
Pengendalian secara kimiawi dilakukan dengan cara pemanfaatan senyawa-senyawa seperti L-kloramfenikol, nikel-dimetilditiokarbamat, detianon, dan fentiazon, namun sebagian besar tidak bisa diharapkan, karena selain mahal, adanya variabilitas yang tinggi dari HDB (Gnanamanickam et al.
1999). Pengendalian secara biologis biasanya menggunakan bakteri antagonis dari HDB yakni Pseudomonas flourescens, P. putida, dan beberapa jenis Bacillus. Meskipun secara sistematik respon antara bio-kontrol dan HDB tidak diketahui, akan tetapi penelitian Vasudevan et al. pada tahun 2002 dalam Liu
et al. (2006) menunjukkan interaksi tersebut juga dipengaruhi oleh padi yang memiliki gen resisten. Penggunaan padi yang mengandung gen resisten HDB merupakan pengendalian HDB yang efektif karena membawa lebih banyak ketahanan berbeda sehingga mempunyai spektrum ketahanan yang lebih luas dan lebih awet (McCouch & Tanksley 1991 dalam Suwarno et al. 2002). Menurut Liu et al. (2006) telah diketahui 29 gen resisten HDB yakni gen Xa (Tabel 1). Gen
Xa5, Xa7, dan Xa21 merupakan gen yang paling efektif untuk strain bakteri di Indonesia (Suwarno et al. 2002).
Tabel 1 Gen-gen resisten terhadap HDB
Gen Kromosom Sumber Gen
Xa1 Xa2 Xa3 Xa4 xa5 Xa7 xa8 Xa10 Xa11 4 4 11 11 5 6 7 11 Bk Kogyoku Tetep Wase aikoku 3
TKM 6 Aus Boro Lines
DV85 P1231129
(Lanjutan dari Tabel 1)
Gen Kromosom Sumber Gen
Xa12 xa13 Xa14 xa15 Xa16 Xa17 Xa18 xa19 xa20 Xa21 Xa22 Xa23 xa24 Xa25(a) Xa25(b) Xa26 Xa27 xa28 Xa29 4 8 4 Bk Bk Bk Bk Bk Bk 11 11 11 Bk 4 12 11 6 Bk 1 Kogyoku BJ1 (Aus Boro)
TN1 M41, Mutant Herebare Tetep Asominori IR24, Tonoyoshiki XM5 XM6 O.longistaminata Zhachanglong O.rufipogon DV86, DV85, Aus295 HX-3,mutant Minghui 63 Minghui 63 Minghui 63 O. minuta Lota Sail O. officinalis
Bk: belum diketahui (Liu et al. 2006)
Karakterisasi Xanthomonas oryzae pv. oryzae
Bakteri Xoo pertama kali dikenal dengan nama Xanthomonas campestris, Xanthomonas oryzae, Xanthomonas kresek, Xanthomonas
pv. oryzae hingga akhirnya diidentifikasi dengan nama Xanthomonas oryzae pv. oryzae
(Xoo). Bakteri ini tergolong bakteri Gram negatif yang menyebabkan penyakit hawar daun pada tanaman padi (Swings et al. 1990). Klasifikasi Xoo menurut Swings et al. (1990) tergolong dalam dunia Bakteria, filum Proteobakteria, kelas Gamma Proteobakteria,
ordo Xanthomodales, famili
Xanthomonadaceae, genus Xanthomonas, dan spesies Xanthomonasoryzae pv. oryzae.
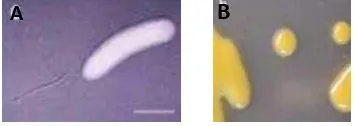
Bakteri Xoo berbentuk batang (Gambar 1A), memiliki ujung bulat, sel tunggal memiliki panjang 2.0 µm – 7.0 µm, lebar 0.4µm – 0.7 µm. Sel bergerak dengan menggunakan flagella tunggal yang berada di ujung sel (monotrichous). Pada media padat sel Xoo berbentuk cembung, bulat, berlendir, dan berwarna kuning karena menghasilkan pigmen xanthomonadin (Gambar 1B). Xoo merupakan bakteri aerob obligat yakni bakteri yang memerlukan oksigen untuk pertumbuhannya dan tidak membentuk spora. Suhu optimal untuk tumbuh 25 – 30 oC (Liu et al. 2006).
Bakteri Xoo memiliki inang yang cukup beragam dan umumnya berasal dari golongan Poaceae seperti Oryza sativa, Leersia spp., Laptochloa spp., Paspalum scrabiculatum, dan Zizania. Agrawal dan Sinclair (1996) dalam Agustiansyah (2011) menyatakan bahwa Xoo pada benih padi dapat bertahan selama 9 – 16 bulan. Ketahanan bakteri akan turun setelah masa simpan 2 tahun dengan suhu penyimpanan 25 – 35 oC, turunnya ketahanan bakteri tersebut disebabkan adanya bakteriofage yang mengurangi populasi Xoo. Pada daerah beriklim sedang seperti Australia, Xoo dapat hidup di dalam tanah selama 1 – 3 bulan bergantung terhadap kelembaban dan keasaman tanah. Di daerah tropis, pada musim kemarau Xoo dapat bertahan pada rizofer tanaman dan batang gulma (Ou 1985).
Bakteri Xoo akan menginfeksi padi melalui jaringan hidatoda yang berada pada samping dan ujung daun melalui proses gutasi. Bakteri Xoo akan masuk secara pasif pada daun melalui larutan gutasi yang terbentuk. Selain itu juga melalui luka pada tanaman (Ou 1985). Selanjutnya bakteri termultifikasi di dalam ruang interseluler, dan menyebar ke tanaman lainnya melalui xilem (Liu et al. 2006). Setelah beberapa hari sel bakteri mengisi pembuluh xilem, terdapat bintik-bintik seperti benang pada daun. Proses ini menjadi karakteristik utama bahwa tanaman padi telah terinfeksi HDB (Mew et al. 1993). Penyebaran Xoo dari setiap tanaman dipengaruhi melalui angin, hujan, air irigasi, adanya singgungan antar daun padi, petani, dan hama (Nyvall 1999 dalam Liu et al. 2006). Bakteri Xoo diketahui merupakan bakteri yang memiliki patotipe yang tinggi. Telah dilaporkan bahwa terdapat 30 strain Xoo yang berbeda dari beberapa negara (Adhikari et al. 1996; Mew 1988; Noda et al.
2001 dalam Liu et al. 2006). Di Indonesia, yang telah dilaporkan Kadir (2009) dalam Tabel 2 terdapat 8 strain Xoo (II, III, IV, V, VI, VII, VIII, X, XII) di berbagai wilayah. Bakteri Xoo memiliki tingkat perbedaan
Gambar 1 Fisiologi bakteri Xoo. (A) Sel tunggal Xoo dalam SEM. (B) Xoo dalam media yeast extract agar (Liu et al. 2006).
Tabel 2 Perkembangan strain Xoo di daerah penghasil padi di Indonesia.
Tahun Strain Daerah
Penularan 1977
1980
1996/1997 1997
1997/1998 1998 1998/1999 1999/2000
2000
2001 2009
II, III, IV, V
III, IV,V, VI, VIII IV, VII, X III, IV, VII,
VIII VIII, XII
VIII V, VIII, X III, IV, VIII
V, VI, VIII, X III, IV, VIII
X
Sulawesi Selatan, Jawa,
Bali, Kalimantan
Jawa Barat
Jawa Barat Jawa Barat
Jawa Barat Jawa Barat Jawa Barat Jawa Barat, Jawa Tengah,
DIY Jawa Tengah
Jawa Barat Jawa Barat Sumber: Kadir (2009)
genetik yang tinggi diantara beda isolat berdasarkan analisis patotipe dari 300 isolat berbeda dari Asia (Adhikari et al. 1995). Tingginya variabilitas tersebut disebabkan adanya interaksi antara inang (Oryza sativa), bakteri Xoo, lingkungan abiotik dan biotik. Perubahan salah satu komponen
mempengaruhi patogenitas Xoo (Kadir 2009).
Padi Varietas Galur Isogenik
Galur isogenik atau near-isogenic lines
(NILs) adalah galur padi yang memiliki susunan genetik yang sama kecuali satu atau beberapa pada gen atau lokus tertentu yang sengaja disisipkan dan telah diketahui fungsinya dengan jelas. Pembuatan padi varietas galur isogenik dilakukan dengan metode silang balik (cross back), hingga didapatkan gen yang diharapkan (Hartini & Kardin 1998). Perakitan galur isogenik pada padi telah berhasil dilakukan oleh Ogawa et al. pada tahun 1991 dalam Hartini dan Kardin (1998) dengan menggunakan padi kultivar IR24 sebagai tetua ulangan dan padi yang diketahui mengandung gen resisten HDB sebagai tetua donor (Tabel 1). Kultivar IR24 dipilih karena kerentanannya terhadap semua jenis strain yang ada di Jepang dan Filipina (Ogawa & Yamamoto, 1987). Padi varietas galur isogenik selanjutnya dimanfaatkan untuk memantau perubahan komposisi patotipe Xoo di suatu daerah karena galur isogenik memiliki latar belakang genetika yang seragam. Hubungan yang mengikuti pola gen ke gen patotipe Xoo dan kultivar padi mempermudah untuk mengetahui jumlah dan komposisi gen virulen pada masing-masing patotipe Xoo (Hartini & Kardin 1998).
Interaksi (Gambar 2) galur isogenik yang
mengandung gen resisten HDB terhadap virulensi Xoo, secara molekuler akan menghasilkan reaksi berantai sebagai bentuk pertahanan tanaman padi yang sesuai dengan konsep gen ke gen. Virulensi Xoo pada umumnya akan dipengaruhi oleh dua gen yakni gen rax dan hrp (Liu et al 2006). Kedua gen tersebut menyandikan protein yang akan membentuk sistem sekresi. Gen rax akan menyandikan protein sekresi pada sekresi tipe 1 yakni T1SS (type 1 secretion system). Protein virulen Xoo atau disebut dengan elisitor yang melalui sekresi tersebut adalah avrXa21, avrXa26, avrXa1, avrxa5, dan avrxa13 (Burdman et al. 2004). Gen hrp atau singkatan dari hypersensitivity reaction and for pathogenesis yang akan menyandikan sistem sekresi yakni T3SS (Type III secretion system merupakan protein yang bersifat hidrofobik). Elisitor Xoo melalui sekresi tersebut adalah avrXa2, avrXa7, avrXa10 (Schornack et al 2006). Sedangkan elisitor -elisitor tersebut disandikan oleh kelompok gen
AvrBs3/ PthA seperti gen PthXo06, PthXo07 yang menyandikan protein serupa
transcription activator-like (TAL) yang selanjutnya akan mempengaruhi proses transkripsi (Liu et al. 2006).
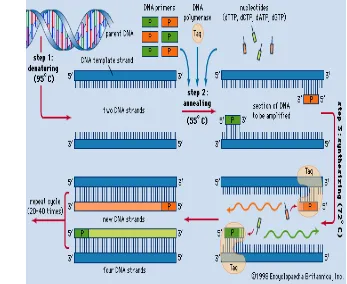
Teknik Biomolekuler Polymerase Chain
Reaction (PCR) Koloni
Teknik biomolekuler merupakan teknik yang berkaitan dengan analisis makromolekul. Analisis makromolekul dapat dilakukan berdasarkan atas reaksi kimiawi yang ditimbulkan oleh interaksinya dengan molekul lain. Salah satu teknik dasar biomolekuler adalah Polymerase Chain Reaction (PCR) (Yuwono 2006). Teknik PCR ditemukan oleh Kary Mulis dan memperoleh hadiah nobel pada tahun 1993. Teknik tersebut banyak digunakan secara luas dalam biologi molekuler, termasuk dalam pendeteksian patogen tanaman (Sakthivel et al. 2000). Penamaan PCR berasal dari komponen kunci PCR yakni DNA polimerase. DNA polimerase merupakan enzim dalam replikasi
in vitro yang digunakan dalam mengamplifikasi utas DNA secara eksponensial sejumlah 2n (n adalah jumlah siklus) sehingga terjadi reaksi berantai yang menghasilkan jutaan DNA dari satu utas DNA. Reaksi rantai polimerase merupakan reaksi penggandaan fragmen DNA dengan sensitivitas, selektivitas yang tinggi, dan terjadi pada waktu yang sangat cepat. Sensitivitas dan selektivitas ditentukan oleh
dua fragmen oligonukleotida (umumnya dengan panjang 20 bp) atau disebut dengan primer (Theopillus & Rapley 2002).
Teknik PCR memerlukan DNA sebagai target pengamplifikasi dengan panjang urutan terpendek 50 – 100 bp dan urutan terpanjang 10 kb. Lalu diperlukan primer yang akan menandai bagian tertentu dari DNA sebagai titik awal dan akhir dari sintesis DNA. Proses pemanjangan DNA target pun memerlukan enzim yang stabil dalam panas seperti Taq polimerase yakni enzim yang diisolasi dari bakteri Thermus aquaticus (bakteri golongan termofilik) hidup pada suhu 70 – 80 oC. Taq polimerase akan berfungsi sebagai pengkatalis reaksi polimerisasi DNA maka diperlukan kompleks pembangun DNA yakni deoksinukleotida trifosfat (dNTP) yang mengandung adenin (A), guanin (G), sitosin (C), dan timin (T). Komponen lainnya yang diperlukan dalam PCR yakni larutan bufer yang berfungsi menjaga keoptimuman aktivitas dan stabilitas DNA dari pengaruh lingkungan dan larutan MgCL2 yang berfungsi untuk membantu keefektifan Taq polimerase (Theopillus & Rapley 2002).
Teknik PCR pun dapat digunakan untuk memayar koloni bakteri menggunakan primer spesifik disebut dengan PCR koloni (Sakthivel
et al. 2000). Prinsip kerja PCR koloni pada umumnya berdasarkan perubahan temperatur. Temperatur berguna untuk enzim dalam polimerisasi DNA, pemutusan ikatan hidrogen, dan titik leleh dari primer. PCR koloni juga akan memiliki siklus temperatur amplifikasi pada tiga tahap (Gambar 3) yakni denaturasi, penempelan, dan pemanjangan. Pada tahap denaturasi suhu 94 – 98 oC selama 20 – 30 detik menyebabkan pemutusan ikatan hidrogen sehingga menghasilkan utas tunggal DNA. Selanjutnya tahap penempelan (annealing) suhu 50 – 65 oC selama 20 – 40 detik merupakan tahap penempelan primer terhadap utas DNA yang terbentuk pada tahap sebelumnya. Suhu pada tahap ini akan bergantung pada Tm (temperature melting) dari primer. Biasanya temperatur berada sekitar 3 – 5 oC di bawah Tm primer dan akan menunjukkan reaksi secara spesifik (McPherson & Moller 2006). Pada tahap ini primer tersisipkan dengan DNA target dan akan membentuk komplemen. Tahap akhir
adalah tahap pemanjangan
DNA baru melalui penambahan dNTP dengan
arah pertumbuhan 5’ – 3’. Siklus akan terus
berulang sesuai dengan yang diinginkan (Pestana et al. 2010).
Umumnya tahap kerja PCR koloni didahului dan diakhiri oleh tahapan pra-denaturasi dan final elongasi. Pra-denaturasi dilakukan selama 1 – 3 menit jika komponen GC pada DNA target kurang dari 50% atau akan mencapai 10 menit jika kandungan GC DNA target berlebih. Proses ini memastikan kesempurnaan denaturasi dan mengaktivasi Taq polimerase karena bersifat
hot-start atau aktif setelah dipanaskan terlebih dahulu. Disamping itu, pada fase ini terjadi perusakan awal dari sel sehingga primer akan mudah tersisipkan pada DNA target. Final elongasi dilakukan pada suhu optimum enzim (70 – 72 oC) selama 5 – 15 menit untuk memastikan bahwa setiap utas tunggal yang tersisa sudah diperpanjang secara sempurna. Proses ini dilakukan setelah siklus PCR berakhir dan sangat penting ketika fragmen DNA akan diperbanyak ke dalam vektor (Pestana et al. 2010).
Elektroforesis Fragmen DNA
Teknik elektroforesis merupakan teknik bioanalitik yang berfungsi untuk memisahkan molekul dalam suatu campuran dengan
pengaruh medan listrik yang dialirkan pada suatu medium yang mengandung sampel yang akan dipisahkan. Teknik ini memanfaatkan muatan listrik yang ada pada makromolekul seperti DNA sehingga terjadi pemisahan fragmen DNA (Yuwono 2006).
Elektroforesis fragmen DNA terjadi dengan adanya peran medium yang memisahkan dua elektroda yakni katoda untuk menunjukkan kutub negatif dan anoda untuk menunjukkan kutub positif. Molekul yang bermuatan negatif akan menuju ke arah anoda dan begitu pula sebaliknya (Mikkelsen & Corton 2004). Fragmen DNA dipisahkan melalui media yakni gel poliakrilamid dan agarosa. Poliakrilamid biasanya digunakan untuk DNA dengan ukuran molekul kurang dari 100 nukleotida, sedangkan agarosa adalah gel yang lebih umum digunakan karena mampu memisahkan fragmen DNA yang lebih panjang (Nelson & Cox 2004).
Kondisi panas mempermudah dalam pembentuk gel ke cetakan dengan membuat sumur-sumur di ujung gel. Setelah mengeras agarosa membentuk matriks dengan kerapatan yang ditentukan oleh konsentrasi dari agarosa. Jika medan listrik dialirkan diantara kedua ujung gel maka DNA yang bermuatan negatif pada pH netral akan bergerak ke anoda atau kutub positif (Yuwono 2006; Sudjadi 2008).
Kecepatan migrasi dalam elektroforesis fragmen DNA ditentukan oleh ukuran DNA, konformasi DNA, konsentrasi agarosa dan besaran tegangan yang digunakan. Molekul DNA yang lebih besar bergerak lebih lambat karena terjadi gesekan lebih besar disebabkan karena DNA harus melewati pori-pori gel, sehingga laju kurang efisien daripada DNA dengan ukuran yang lebih kecil. Konformasi DNA yang berbentuk sirkuler superkoil (I), sirkuler bernoktah (II), dan linier (III) dari DNA yang berukuran sama akan bermigrasi melalui agarosa dengan kecepatan yang berbeda. Umumnya konformasi I lebih cepat dari konformasi III. Tegangan listrik akan mempengaruhi laju terlihat dari peningkatan tegangan listrik yang mengakibatkan mobilitas fragmen DNA yang berukuran besar naik secara diferensial (Sudjadi 2008). Disamping itu, kecepatan migrasi dipengaruhi oleh arah medan listrik, adanya pewarna interkalasi, komposisi dari bufer elektroforesis, komposisi basa, dan temperatur (Sambrook et al. 1989).
Cara yang paling mudah untuk mendeteksi DNA pada gel agarosa melalui proses staining yakni pewarnaan dengan menggunakan etidium bromida (EtBr). Senyawa EtBr merupakan karsinogen yang mampu berflouresensi ketika diradiasi oleh sinar ultraviolet (Mikkelsen & Corton 2004). Senyawa EtBr dapat digunakan untuk deteksi utas tunggal atau ganda asam nukleat, akan tetapi afinitas EtBr pada asam nukleat utas tunggal relatif rendah dan hasil flouresensinya kurang baik (Sudjadi 2008).
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan meliputi gunting, pinset, tusuk sate, cawan Petri, cawan reaksi, neraca analitik, tabung reaksi, gelas ukur, gelas piala, inkubator, mesin autoklaf,
shacker, bunsen, labu Erlenmeyer, pipet tetes, pipet mikro, tabung Eppendorf, kapas, PCR -plate. Selain itu juga digunakan perangkat seperti laminar air flow cabinet,
elektroforesis, PCR (DNA engine tetrad2 MJ research), oven microwave (sanyo), kulkas, Chemidoc UV-illuminator Bio-Rad.
Bahan-bahan yang digunakan dalam isolasi bakteri Xoo adalah etanol 70% dan 95%, daun terserang HDB dari 3 wilayah (Jawa Barat, Kalimantan Barat, Sumatera Barat), air steril, dan media tumbuh Wakimoto (sukrosa, pepton, Ca(NO3)24H2O, Na2HPO47H2O, FeSO47H2O, bakto agar, dalam destilat H2O). Uji karakter patogenitas menggunakan padi varietas isogenik (IRBB-1, IRBB-2, IRBB-3, IRBB-4, IRBB-5, IRBB-7, IRBB-10, IRBB-11, IRBB-14, IRBB-21) serta varietas populer (IR24, IR64, S. Putih, K. Bali), dan menggunakan media tumbuh
Nutrient Broth (NB) (beef extract, pepton, NaCl). Bahan-bahan yang digunakan dalam identifikasi PCR yakni 3 pasang primer (Xoo2976, XO, Xoo), isolat Xoo, ddH2O, dNTP, GC rich, 10x bufer PCR, Taq polimerase, minyak mineral. Identifikasi elektroforesis fragmen DNA dengan menggunakan bahan gel agarosa, bufer Tris-asetat-EDTA (TAE), loading dye¸ penanda DNA 100 bp (vivantis), dan senyawa etidium bromida.
Metode
Penelitian ini dilakukan dalam beberapa tahapan. Tahap awal adalah pengambilan sampel tanaman padi yang terserang penyakit HDB di daerah Jawa Barat, Kalimantan Barat, dan Sumatera Barat. Tahap selanjutnya adalah tahap isolasi dan pemurnian bakteri Xoo berdasarkan morfologi, serta tahap identifikasi bakteri Xoo menggunakan PCR dengan 3 pasang primer yakni Xoo2976F
(GCCGTTTTTCTTCCTCAGC) dan
Xoo2976R (AGGAAAGGGTTTGTGGAAG C) (Lang et al. 2010); XOF (ATGCC GATCACCATGCCGAT) dan XOR (TGGC CTTGTCGTACGAGCTC) (Lee et al. 2005); XooF1 (TGGTAGTCCACGCCCTAAAC) dan XooR1 (CCTGAGCTACAGACCCGA AG) (Onasanya et al. 2010). Tahap terakhir adalah uji karakter patogenitas terhadap isolat positif bakteri Xoo dengan varietas padi galur isogenik dan varietas populer (Noor et al.
2006).
Pengambilan Sampel HDB (IRRI 1996)
Kalimantan Barat (tergolong rendah). Prevalensi tersebut berdasarkan data Direktorat Perlindungan Pangan (2011). Daun padi yang mengalami gejala HDB yakni daun yang berwarna kuning keabu-abuan, dipotong, dimasukan ke dalam kantong kertas, dan disimpan dalam suhu ruang.
Isolasi dan Pemurnian Bakteri Xoo (IRRI 1996)
Pembuatan Media Wakimoto Agar (WA) Modifikasi IRRI (1996). Labu Erlenmeyer 1000 mL dicampurkan 20 g sukrosa, 5 g pepton, 0.5 g Ca(NO3)24H2O, 1.82 g Na2HPO47H2O, 0.05 g FeSO47H2O, 18 g bakto agar, dalam 1 L destilat H2O, diaduk, ditutup dengan Aluminium foil, dan diautoklaf selama 15 menit pada suhu 121 oC, selanjutnya media dituangkan pada cawan Petri untuk media cawan dan tabung reaksi yang tertutup kapas steril dan dilakukan secara diagonal untuk media miring, lalu didinginkan. Proses dilakukan dalam laminar air flow cabinet.
Isolasi Bakteri Xoo (IRRI 1996). Daun yang mengalami gejala HDB dicuci dengan air, dipotong kecil berkisar 1 x 1 cm, direndam dengan etanol 70% selama 3 menit. Selanjutnya dibilas dengan air steril sebanyak dua kali selama 2 menit. Setelah itu, daun digores dengan menggunakan tusuk sate, dan digoreskan kembali ke media cawan Wakimoto agar (WA) yang telah diberi label sesuai kode isolat (Lampiran 2). Cawan Petri disimpan selama 48 jam. Proses ini dilakukan dalam laminarair flow cabinet.
Pemurnian Bakteri Xoo (IRRI 1996). Media cawan yang telah tumbuh ditandai dengan koloni kuning keputihan. Satu ose koloni dari cawan digoreskan ke dalam media miring WA yang telah ditandai berdasarkan penomoran isolat Xoo yang didaftarkan sebelumnya, dan disimpan pada suhu ruang hingga uji selanjutnya. Proses ini dilakukan di dalam laminar air flow cabinet.
Identifikasi Bakteri Xoo Menggunakan PCR (Lang et al. 2006)
Terdapat beberapa tahapan dalam identifikasi Xoo menggunakan PCR yakni persiapan primer, DNA target, PCR mix, dan verifikasi elektroforesis. Persiapan primer pengujian menggunakan konsentrasi 5 µM
forward dan reverse. Selanjutnya persiapan DNA target, dilakukan dalam laminar air flow
cabinet dengan mengambil 2 ose isolat Xoo yang dimasukkan ke 100 µL air steril dalam mikro tube. Lalu disimpan dalam suhu ruang. Persiapan PCR mix yakni mencampurkan ddH2O 14.4 µL, 10x bufer PCR 2 µL, 10 mM dNTP 0.4 µL, 5 µM primer 1 µL, GC rich
1µL, Taq polimerase (5 unit/µL) (Invitrogen), 1µL DNA target. Volume total yakni 20 µL dan ditambahkan 60 µL mineral oil agar tidak mengalami penguapan. Selanjutnya dimasukkan ke dalam PCR plate untuk diamplifikasi dengan suhu yang telah di optimasi berdasarkan Lang et al. (2010) yaitu denaturasi 94 oC selama 30 detik, penempelan 60 oC selama 30 detik, pemanjangan 68 oC selama 2 menit hingga 31 siklus. Lalu sampel disimpan pada suhu 4 oC.
Dilakukan verifikasi dengan menggunakan elektroforesis. Gel yang digunakan adalah gel agarosa 2%. Bak elektroforesis yang digunakan dimasukkan bufer TAE secukupnya, gel dimasukkan ke dalam bak lalu diinjeksikan DNA target sebanyak 10 µL yang sebelumnya ditambahkan loading dye 3 µL, serta 3 µL untuk penanda DNA 100 bp (vivantis), dialirkan arus listrik selama 1 jam 30 menit. Kemudian dilakukan staining dengan direndam selama 5 menit menggunakan etidium bromida, digoyangkan, dibilas dengan air selama 1 menit. Lalu divisualisasikan dengan menggunakan Chemidoc Bio-Rad.
Karakter Patogenik (Noor et al. 2006).
Persiapan Media Tanam (Yunus 1998). Sejumlah 30 bak tanah yang telah digenangi air selama 2 minggu, diberi pupuk SP36 0.18 g/bak, urea 0.255 g/bak, dan KCl 0.045 g/bak.
Tabel 3 Daftar varietas padi dalam karakter patogenitas pada rumah kawat.
No Varietas Keterangan 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Nipponbare Ciherang Code IR64 S. Putih Cisadane K. Bali IRBB1 IRBB2 IRBB3 IRBB4 IRBB5 IRBB7 IRBB20 IRBB11 IRBB14 IRBB21 IR24
Padi umur pendek Varietas populer Terkandung Xa4-Xa7
Varietas populer Populer Sumatera
Cek rentan Cek rentan Terkandung Xa1 Terkandung Xa2 Terkandung Xa3 Terkandung Xa4 Terkandung xa5 Terkandung Xa7 Terkandung Xa20 Terkandung Xa11 Terkandung Xa14 Terkandung Xa21 Tidak terdapat gen Xa
Uji Karakter Patogenitas Noor et al. (2006). Setelah padi berumur 4 minggu selanjutnya diinokulasikan isolat yang telah positif Xoo pada media NB yakni 10 isolat terbaik dari masing-masing daerah. Diinokulasi dengan cara pengguntingan (clip
-method) ujung daun dengan menggunakan gunting steril, lalu daun dicelupkan ke dalam koloni bakteri Xoo. Setiap 1 minggu kemudian secara berturut-turut selama 2 minggu dilakukan pengamatan dengan parameter pengamatan panjang daun dan panjang serangan untuk mendapatkan intensitas penyakit (IP). Intensitas penyakit dihitung dengan rumus:
IP =panjang serangan (cm)
panjang daun (cm) x 100%
dan dilakukan pembobotan. Indikator pembobotan berdasarkan skala 0 – 100 % disajikan pada Tabel 4.
Tabel 4 Indikator pembobotan intensitas penyakit padi karakter patogenitas
Pembobotan IP (%) Keterangan 0
1 – 5.9 6 – 12.9 13 – 25.9 26 – 50.9 51 – 75.9 76 – 100
Sangat tahan (ST) Tahan (T) Agak tahan (AT) Sedang (S) Agak peka (AP) Peka (P)
Sangat peka (SP) Sumber: IRRI (1996); IP: Intensitas penyakit
HASIL DAN PEMBAHASAN
Isolat Bakteri Xoo
Isolat-isolat Xoo didapatkan dari tiga wilayah yang menunjukkan bahwa penyakit HDB merupakan penyakit utama yang menyerang daerah tersebut yakni, Sumatera Barat, Jawa Barat, dan Kalimantan Barat. Disamping itu ketiga wilayah tersebut menunjukkan perbedaan penyerangan HDB secara signifikan. Berdasarkan data Direktorat Perlindungan Pangan (2011) bahwa prevalensi serangan untuk Jawa Barat adalah endemik, Sumatera Barat tergolong sedang, dan Kalimantan Barat tergolong rendah. Jenis padi pada daerah tersebut terlihat pada Lampiran 2. Hasil isolasi dari ketiga daerah tersebut yang telah dimurnikan dengan menggunakan agar miring dengan media WA didapatkan 72 isolat diantaranya 20 isolat berasal dari Jawa Barat, 30 isolat berasal dari Sumatera Barat, dan 22 isolat berasal dari Kalimantan Barat. Isolat tersebut menunjukkan ciri-ciri Xoo secara fenotip (Gambar 4). Menurut Liu et al
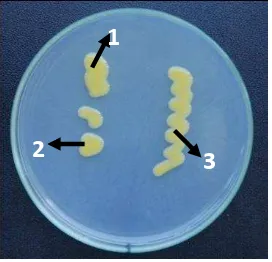
(2006) bakteri Xoo memiliki bentuk fenotip pada media padat yakni berlendir, cembung, bulat, dan berwarna kuning karena adanya pigmen Xanthomonadin. Penggunaan media WA dimaksudkan karena media tersebut telah terbukti dapat menghasilkan kultur murni dan bersih jika dibandingkan dengan media Yeast dextrose calcium carbonate (YDC) (Noor et al. 2006). Sedangkan penggunaan kapas dalam peremajaan bakteri disebabkan karena bakteri tersebut termasuk dalam bakteri obligat aerob (Liu et al. 2006) yang memerlukan oksigen untuk tumbuh. Kapas memiliki pori-pori kecil untuk keluar masuknya udara dan membantu dalam proses sterilisasi yakni mengurangi uap air dalam pematangan media.
Gambar 4 Koloni Xoo dalam media cawan WA (1) cembung, (2) ujung bulat, (3) berwarna kuning.
1
2
Identifikasi Bakteri Xoo Menggunakan PCR Koloni
Isolat dari ketiga daerah tersebut diidentifikasi dengan menggunakan primer spesifik yang dikembangkan oleh Lee et al.
(2005) primer XO (F: ATGCCGATCACCA TGCCGAT; R: TGGCCTTGTCGTACGAG CTC), Lang et al. (2010) primer2976 (F: GCCGTTTTTCTTCCTCAGC; R: AGGAA AGGGTTTGTGGAAGC) dan Onasanya et al. (2010) primer Xoo (F: TGGTAGTCCA CGCCCTAAAC; R: CCTGAGCTACAGA CCCGAAG), melalui metode PCR koloni, yakni proses pemilihan DNA secara cepat yang telah teramplifikasi oleh primer spesifik, bahkan untuk mengetahui DNA teramplifikasi dapat berasal dari koloni yang berada dalam larutan dan langsung direaksikan dalam PCR
(Dafa’alla et al. 2000)
Profil temperatur PCR yang digunakan adalah temperatur 94 oC untuk denaturasi awal selama 3 menit bertujuan untuk memecah dinding sel bakteri, DNA denaturasi dan persiapan Taq polimerase karena bersifat
hot-start atau aktif setelah dipanaskan terlebih dahulu (Penstana et al. 2010), temperatur 94oC untuk denaturasi DNA menjadi utas tunggal selama 30 detik, temperatur 60oC untuk penempelan primer selama 30 detik, temperatur 68 oC untuk pemanjangan primer selama 30 detik. Pengulangan siklus dilakukan sebanyak 31 kali. Tahap akhir adalah pemastian utas tunggal telah teramplifikasi secara sempurna pada temperatur 68 oC selama 10 menit (Lang et al 2010).
Identifikasi dengan menggunakan primer XO yang dikembangkan oleh Lee et al. (2005) merupakan primer berdasarkan urutan DNA KACC10331 pada NCBI dan merupakan gen penyandi protein sistem sekresi tipe III (T3SS) pada Xanthomonas oryzae. Primer yang umum untuk membedakan spesies Xanthomonas oryzae dan tidak spesifik untuk patogen varian. Primer XO berada pada pita DNA ukuran 534 bp. Elektroforegram (Gambar 5) menunjukkan bahwa seluruh isolat teridentifikasi positif Xoo kecuali isolat dengan kode Xoo11-023 tidak menunjukkan adanya pita DNA pada ukuran 534 bp, maka isolat Xoo11-023 tidak termasuk dalam spesies Xanthomonas oryzae.
Hasil identifikasi dengan menggunakan primer Xoo2976 yang dikembangkan oleh Lang et al. 2010, memunculkan pita DNA pada ukuran 300 bp. Menurut Lang et al
(2010), pita DNA akan muncul pada ukuran
Gambar 5 Elektroforegram PCR koloni dengan menggunakan primer XO. (P) Penanda, (20 – 28) Nomor Isolat Xoo.
337 bp dengan target primer pada gen yang menyandikan domain protein katalitik. Samahalnya dengan primer sebelumnya semua isolat menunjukkan positif bakteri Xoo kecuali isolat Xoo11-023 yang tidak menunjukkan pita DNA pada ukuran 337 bp (Gambar 6).
Primer Xoo2976 didapatkan dari pendekatan urutan basa nitrogen 16s rRNA. Urutan basa nitrogen 16s rRNA merupakan urutan RNA yang bersifat ubiquitous (ada dimana-mana) dengan fungsi identik pada seluruh organisme prokaryot. Urutan ini pun memiliki beberapa daerah dengan urutan basa yang relatif konservatif dan variatif, karena sifat ini yang menyebabkan 16s rRNA sebagai acuan identifikasi (Pangastuti 2006). Akan tetapi, 98.6% 16s rRNA menunjukan kesamaan pada genus Xanthomonas, sehingga untuk membedakan patogen secara spesifik dilakukan pemotongan pada urutan 16s – 23s rRNA yakni urutan antara 16s rRNA dan 23s rRNA berupa ruang internal rRNA (Lang et al
2010).
Hasil identifikasi dengan menggunakan primer Xoo yang terlihat pada Gambar 7,
Gambar 6 Elektroforegram PCR koloni dengan menggunakan primer Xoo2976. (P) Penanda, (19 – 27) Nomor isolat Xoo.
P
Gambar 7 Elektroforegram PCR koloni dengan menggunakan primer Xoo. (P) Penanda, (19 – 28) Nomor isolat Xoo.
menunjukkan pita DNA berada pada ukuran antara 800 – 900 bp dan 900 – 1000 bp, hal ini sesuai dengan penelitian Onasanya et al.
(2010) bahwa primer Xoo berada pada ukuran yang bervariasi. Penentuan untuk menunjukkan isolat tersebut positif akan terlihat munculnya pita DNA pada sumur elektroforesis. Semua isolat menunjukkan hasil yang positif, ditunjukkan dengan adanya pita DNA pada seluruh isolat kecuali pada isolat Xoo11-023. Isolat ini tidak memperlihatkan adanya pita DNA pada sumur elektroforesis. Primer Xoo didesain berdasarkan urutan DNA genom dari referensi NCBI dengan kode urutan NC_007705.1 (Onasanya et al 2010).
Isolat Xoo11-023 yang berasal dari Sumatera Barat, pada ketiga primer tidak memunculkan pita DNA atau tidak berada dalam ukuran yang tepat. Menurut Onasanya
et al. (2010), bahwa hasil elektroforesis yang memunculkan adanya pita DNA menunjukkan isolat tersebut positif bakteri Xoo dan sebaliknya. Pada daun yang terinfeksi isolat Xoo11-023 memiliki daun kuning keabu-abuan dari ujung hingga pangkal daun, sedangkan pada media WA pun menunjukkan bentuk yang licin atau berlendir, cembung, dan berwarna kuning. Walaupun dalam penyerangan dan gejala sama, diduga isolat tersebut merupakan Xanthomonoas oryzae pv.
oryzicola (Xoc) yang merupakan kerabat terdekat dari bakteri Xoo (Bogdanove et al.
2011).
Karakter Patogenitas
Tanaman padi yang diuji ditanam selama 4 minggu dan diinokulasi melalui clipmethod
yaitu pemotongan ujung daun padi yang akan diamati sehingga bakteri Xoo dapat
menginfeksi inang. Pemotongan ujung daun dimaksudkan karena bentuk infeksi bakteri Xoo yang bermula dari ujung daun yaitu jaringan hidatoda dengan membuat luka pada daun (Ou 1985). Selanjutnya ujung daun akan terlihat menguning hingga akhirnya seluruh daun melalui ruas daun semakin menguning keputih-putihan dan mati (Liu et al 2006).
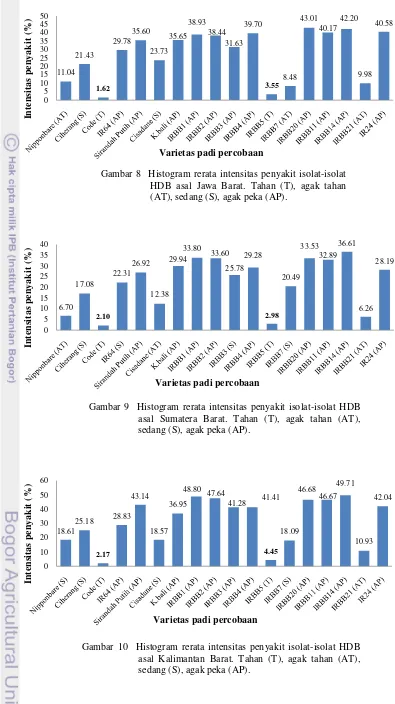
Isolat-isolat asal Jawa Barat menunjukkan bahwa padi varietas Code dan IRBB5 adalah varietas yang tergolong tahan sedangkan Nipponbare, IRBB7, dan IRBB21 tergolong agak tahan berdasarkan hasil pembobotan. Code memiliki intensitas penyakit rerata 1.62 % dan IRBB5 sebesar 3.55% (Gambar 8). Isolat-isolat asal Sumatera Barat menunjukkan bahwa varietas Code dan IRBB5 tergolong tahan terhadap HDB dengan intesitas penyakit rerata 2.10% dan 2.97%, sedangkan varietas Nipponbare, Cisadane, dan IRBB21 merupakan varietas padi agak tahan berdasarkan hasil pembobotan (Gambar 9). Serangan isolat-isolat asal Kalimantan Barat menunjukkan bahwa varietas Code dan IRBB5 pun tergolong tahan dengan jumlah rerata intensitas penyakit sebesar 2.17% dan 4.45%, sedangkan varietas yang agak tahan hanya varietas IRBB21 (Gambar 10).
Varietas Code dan IRBB5 tahan pada tiga wilayah tersebut. Padi varietas Code merupakan padi hasil persilangan (crossback) dari IR64 sebagai tetua berulang dan IRBB7 sebagai tetua donor. Varietas IR64 memiliki gen ketahan terhadap HDB yakni gen dominan Xa4, sedangkan IRBB7 mengandung gen dominan Xa7, sehingga Code menghasilkan dua gen ketahan HDB yakni
Xa4 dan Xa7 (BB Biogen 2007). Gen Xa4 berada di kromosom 11 yang berdekatan dengan gen Xa26 yang resisten terhadap strain HDB asal Filipina yakni strain 1,4,5,7,8, dan 10 sehingga secara luas dibudidaya sebelum terpatahkan pada tahun 1970an (Wang et al.
2001). Gen Xa7 terletak pada kromosom 6 yang resisten terhadap strain HDB asal Filipina tipe 1, 2, 3, 4, 5, 7, 8, 9, dan 10 (Lee and Khush 2000 dalam Liu et al. 2006). Ketahanan kedua gen tersebut sangat tinggi maka kombinasi kedua gen memberikan efek yang saling melengkapi (aditif) untuk menurunkan serangan patogen secara kualitatif. Varietas IRBB5 merupakan varietas monogenik hasil persilangan dari IR24 dan padi kelompok aus boro asal Bangladesh sebagai tetua donor gen xa5 (Oryzae sativa
L). Gen xa5 merupakan gen resesif yang berada di kromosom 5 dan merupakan
18.61 25.18 2.17 28.83 43.14 18.57 36.95 48.80 47.64 41.28 41.41 4.45 18.09 46.68 46.67 49.71 10.93 42.04 0 10 20 30 40 50 60 Inte ns it a s peny a k it ( %)
Varietas padi percobaan 6.70 17.08 2.10 22.31 26.92 12.38 29.94 33.80 33.60 25.78 29.28 2.98 20.49 33.53 32.89 36.61 6.26 28.19 0 5 10 15 20 25 30 35 40 Inte ns it a s peny a k it ( %)
Varietas padi percobaan 11.04 21.43 1.62 29.78 35.60 23.73 35.65 38.93 38.44 31.63 39.70 3.55 8.48 43.01 40.17 42.20 9.98 40.58 0 5 10 15 20 25 30 35 40 45 50 Int e nsit a s pe ny a k it ( %)
Varietas padi percobaan
Gambar 8 Histogram rerata intensitas penyakit isolat-isolat HDB asal Jawa Barat. Tahan (T), agak tahan (AT), sedang (S), agak peka (AP).
Gambar 9 Histogram rerata intensitas penyakit isolat-isolat HDB asal Sumatera Barat. Tahan (T), agak tahan (AT), sedang (S), agak peka (AP).
penyandi subunit protein sekresi gamma TFIIA, serta resisten terhadap strain HDB asal Filipina tipe 1, 2, 3, 5, 7, 8, 9, dan 10 (Iyer dan Mc Couch 2004). Gen xa5 merupakan salah satu gen yang sangat efektif tahan terhadap strain di Indonesia sehingga gen tersebut potensial digunakan dalam penanggulangan penyakit hawar daun di Indonesia (Yunus 1998).Gen xa5 dalam interaksi dengan bakteri Xoo akan menghasilkan protein termodifikasi dari penyandian subunit transkripsi pada pre- initiation complex (PIC), sehingga dapat menurunkan avirulensi xa5 (avr xa5) (Liu et al. 2006).
Isolat yang berasal dari Sumatera Barat memiliki tingkat virulensi paling tinggi dengan indikator tahan varietas Code dan IRBB5. Berdasarkan uji patogenitas didapatkan bahwa isolat dengan no. kode Xoo11-042 memiliki intensitas rerata terhadap Code 3.29% dan bahkan IRBB5 tergolong agak tahan dengan intensitas rerata 6.90% (Gambar 11). Kuatnya virulensi Xoo11-042 diduga disebabkan karena adanya gen penyandi avirulensi Xa7, yang merupakan gen penting dalam penyerangan bakteri Xoo. Kehilangan gen tersebut dapat melemahkan virulensi Xoo (Bai et al. 2000).
SIMPULAN DAN SARAN
Simpulan
Sejumlah 72 isolat Xanthomonas oryzae
pv oryzae yang berhasil diisolasi dari 3 lokasi, yakni 20 isolat asal Jawa Barat, 30 isolat asal Sumatera Barat, dan 22 isolat asal Kalimantan Barat. Hasil identifikasi dengan
PCR koloni menunjukkan seluruh isolat positif Xoo kecuali isolat Xoo11-023 asal Sumatera Barat yang tidak teridentifikasi sebagai bakteri Xoo. Analisis karakterisasi patogenik menggunakan varietas padi galur isogenik menunjukkan bahwa varietas Code yang mengandung Xa4-Xa7 dan IRBB5 mengandung Xa5 untuk isolat Jawa Barat, Sumatera Barat, dan Kalimantan Barat adalah tahan untuk isolat Xoo ketiga wilayah tersebut. Isolat yang memiliki tingkat virulensi paling tinggi adalah isolat Xoo11-042 asal Sumatera Barat yang menurunkan ketahan IRBB5 hingga tergolong agak tahan berdasarkan pembobotan.
Saran
Perlu dilakukan selektifitas dan sensitifitas metode. Dilakukan penelitian lebih lanjut terkait kelompok isolat-isolat dalam pengujian sehingga lebih mudah mengetahui profil kelompokmdan tingkat evolusi pada bakteri Xoo, serta dilakukan pengujian gen ketahanan terhadap varietas populer agar dapat dikombinasikan dengan gen ketahanan lainnya melalui metode back cross atau transgenik.
DAFTAR PUSTAKA
Adhikari et al.. 1995. Genetic diversity of
Xanthomonas oryzae pv oryzae in Asia.
Appl. Environ. Microbiol. 61: 966-971.
Agustiansyah. 2011. Perlakuan benih untuk perbaikan pertumbuhan tanaman, hasil, dan mutu benih padi serta pengendalian
. 8.61
26.03
3.29 32.89
35.37
20.39 28.85
51.38
37.40
29.81 32.24
6.90 32.21
35.04 37.41
41.16
7.65 34.13
0.00 10.00 20.00 30.00 40.00 50.00 60.00
Inte
ns
it
a
s
peny
a
k
it
(
%)
Varietas padi percobaan
penyakit hawar daun bakteri dan pengurangan penggunaan pupuk fosfat. [Disertasi]. Mayor Ilmu dan Teknologi Benih. Sekolah Pascasarjana IPB, Bogor.
Bai J, Choi SH, Ponciano G, Leung H, Leach JE. 2000. Xanthomonas oryzae pv. oryzae avirulence gene contribute differently and specifically to pathogen aggressiveness. Mol. Plant Microbe Interact 13: 1322-1329.
[BB Biogen] Balai Besar Biogen. 2007. Varietas unggul padi sawah tahan HDB.
Warta Penelitian dan Pengembangan Pertanian 29: 17-18.
Bogdanove AJ et al. 2011. Two new complete genome sequence offer insight into host and tissue specificity of plant pathogenis
Xanthomonas spp. Am. Soc. Microbiol
193 : 5450-5464.
Burdman S, Shen Y, Lee SW, Xue Q, Ronald P. 2004. RaxH/RaxR: a two-component regulatory system in Xanthomonas oryzae pv oryzae required for AvrXa21 activity. Mol. Plan-microbe interact
17:602-612.
Dafa’alla TH, Hobom G, Zahner H. 2000. Direct colony identification by PCR-miniprep. Molecular Biology 1: 65-66.
[Direktorat Perlindungan Tanaman Pangan]. 2007. OPT Padi di Indonesia. Jakarta: Departemen Pertanian RI.
[Direktorat Perlindungan Pangan]. 2011. Prakiraan serangan BLB pada padi di Indonesia masa tanam tahun 2011. [terhubung berkala] www.deptan.go.id (15 November 2011).
Gnanamanickam S, Brida PV, Narayanan N, Vasudevan P, Kavitha S. 1999. An overview of bacterial blight disease of rice and strategies for its management.
Current sci 77: 1435-1443.
Hanarida et al. 2007. Galur padi baru tahan hawar daun bakteri. Warta 29: 5-6.
Hartini RH, Kardin KM. 1998. Pengelompokan isolat Xanthomonas oryzae pv oryzae dengan menggunakan galur isogenik padi IRRI. Hayati 5: 66-72.
[IRRI] International Rice Research Institute.. 1996. Standard Evaluation System for Rice. Fourth Edition. Philiphines: 52 p.
Iyer AS, McCouch SR. 2004. The rice bacterial blight resistance gene xa5 encodes a novel form of diseases resistance. Mol. Plant-Microbe Interact
17: 1348-1354.
Kadir TS. 2009. Menangkal HDB dengan Menggilir Varietas. Warta Penelitian dan Pengembangan Pertanian 31: 1-3.
Lang JM et al.. 2010. Genomics-based diagnostic marker development for
xanthomonas oryzae pv oryzae and x. oryzae pv oryzicola. Plant Disease 94: 311-319.
Lee BM et al. 2005. The genome sequence of
Xanthomonas oryzae pathovar oryzae KACC10331, the bacterial blight pathogen of rice. Nucleic Acids Research
33: 577-586.
Liu DON et al.. 2006. Xanthomonas oryzae
pathovars: model patogen of a model crop. Mol Plant Path 7: 303-324.
McCouch SR, Abenes ML, Angeles R, Khush GS, Tanksley SD. 1991. Molecular tagging or recessive gene, xa-5, for resistance to bacterial blight of rice. Rice Genetic Newsletter 8: 143-145.
McPherson MJ, Moller SG. 2006. PCR 2nd Edition (The Basics). Unitied Kingdom: Taylor and Francis Group.
Mew TW, Alvarez AM, Leach JE, Swings J. 1993. Focus on bacterial blight of rice.
Plant Dis 77: 5-21.
Mew TW. 1988. An overview of the world bacterial blight situation. International work shop on bacterial blight of rice. Manila: International Rice Research Institute.
Mikkelsen SR, Corton E. 2004. Bioanalitycal Chemistry. New Jersey: John willey & Sons.
Noor A, Chaudhry Z, Rashid H, Mirza B. 2006. Evaluation of resistance or rice varieties against bacterial blight caused by Xanthomonas oryzae pv. oryzae. Pak. J. Bot. 38: 193-203.
Ogawa T, Yamamoto T. 1987. Near-isogenic lines as internasional differentials for resistance to bacterial blight of rice.
[terhubung berkala]
http://www.gramene.org/newsletters/rice _genetics (5 Desember 2011).
Onasanya A et al. 2010. Development of combined molecular diagnostic and DNA fingerprinting technique for rice bacteria patogens in Africa.
Biotechnology 9: 89-105.
Ou SH. 1985. Rice Disease. London: Commonwealth Mycological Institute.
Pangastuti A. 2006. [Review] Definisi spesies prokaryota berdasarkan urutan basa gen penyandi 16s rRNA dan gen penyandi protein. Biodiversitas 7: 292-296.
Pestana EA, Belak S, Diallo A, Crowther JR, Viljoen GJ. 2010. Early, Rapid and Sensitive Veterinary Moleculaer Diagnostics Real Time PCR Applications. London : Spriger Dordecth.
Phil A. 2010. The polymerase chain reaction (PCR): cloning DNA in the test tube.
[terhubung berkala]
http://schoolworkhelper.net/2010/07/the- polymerase-chain-reaction-pcr-cloning-dna-in-the-test-tube/ (16 Desember 2011).
Priyani N. 2003. Sejarah penemuan mikroba. USU digital library. [terhubung berkala] www.repository.usu.ac.id/bitstream/1234 56789/821/1/biologi-nunuk.pdf. (5
Januari 2012).
Sakthivel N, Mortensen CN, Mathur SB. 2001. Detection of Xanthomonas oryzae pv oryzae in artificially inoculated and naturally infected rice seeds and plants by moleculer techniques. Apllied Microbiol Biotechnol 56: 435-441.
Sambrook J, Fritsch EF, Maniatis T. 1989.
Moleculer Cloning A Laboratory
Manual. New York: Cold Spring Harbour Lab. CSH.
Schornack S, Meyer A, Romer P, Jordan T, Lahaye T. 2006. Gene-for-gene-mediated recognition of nulear-target AvrBs3-like bacterial efector proteins. J. Plant Physiol 163: 256-272.
Sudjadi. 2008. Bioteknologi Kesehatan. Yogyakarta: Kanisius.
Suwarno, Lubis E, Allidawati, Sunaryo. 2002. Perbaikan ketahanan varietas padi sawah dan gogo terhadap hawar daun bakteri dan blas melalui seleksi dengan markah molekuler. Di dalam: Perbaikan Varietas Padi melalui Seleksi dengan Markah Molekuler dan Kultur Anter. Prosiding Hasil Penelitian Rintisan dan Bioteknologi Tanaman; Bogor 30-31 Januari 2001. Sukamandi: Balai Penelitian Tanaman Padi. hlm 53.
Swings J et al.. 1990. Reclassification of the causal agents of bacterial blight (Xanthomonas campestris pathovar oryzae) and bacterial leaf streak (Xanthomonas campestris pathovar oryzicola) of rice as pathovar of
Xanthomonas oryzae new species (Ex Ishiyama 1922) sp. J. Syst. Bacteriol. 40: 309-311.
Theopillus BDM, Rapley R. 2002. PCR Mutation Detection Protocols. New Jersey: Humana-Pr.
Wang W et al. 2001. Chromosome landing at the bacterial blight resistance gene Xa4 locus using a deep coverage rice BAC library. Mol. Gen. Genomics 265:118-125.
Yunus M. 1998. Studi pautan marka molekuler dengan gen ketahanan terhadap bakteri hawar daun (Gen xa5) pada padi. [Tesis] Program Pasca Sarjana. Institut Pertanian Bogor, Bogor.
Yuwono T. 2006. Biologi Molekuler. Jakarta: Erlangga.
Lampiran 1 Diagram alir penelitian
Pengambilan sampel di Jabar,
Sumbar, dan Kalbar
Isolasi bakteri dari daun terserang
HDB
Identifikasi
Xanthomonas oryzae
pv
. oryzae
(Xoo) menggunakan
PCR
Elektroforesis fragmen DNA
Negatif
Positif
Analisis karakter patogenitas
Analisis dihentikan
Pembobotan dan Analisis Data
No Kode isolat Varietas Lokasi 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 Xoo11-001 Xoo11-002 Xoo11-003* Xoo11-004 Xoo11-005 Xoo11-006 Xoo11-007* Xoo11-008 Xoo11-009 Xoo11-010 Xoo11-011* Xoo11-012* Xoo11-013* Xoo11-014* Xoo11-015* Xoo11-016* Xoo11-017* Xoo11-018 Xoo11-019 Xoo11-020* Xoo11-021 Xoo11-022 Xoo11-023 Xoo11-024 Xoo11-025 Xoo11-026* Xoo11-027 Xoo11-028 Xoo11-029 Xoo11-030 Xoo11-031 Xoo11-032 Xoo11-033* Xoo11-034* Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Ciherang Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah
Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Cianjur – Jabar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar
No Kode isolat Varietas Lokasi
35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 Xoo11-035 Xoo11-036* Xoo11-037 Xoo11-038* Xoo11-039 Xoo11-040 Xoo11-041 Xoo11-042* Xoo11-043 Xoo11-044* Xoo11-045 Xoo11-046* Xoo11-047 Xoo11-048* Xoo11-049 Xoo11-050* Xoo11-052 Xoo11-053* Xoo11-054* Xoo11-055* Xoo11-056* Xoo11-057 Xoo11-058 Xoo11-059 Xoo11-060 Xoo11-062 Xoo11-063 Xoo11-064 Xoo11-065 Xoo11-066 Xoo11-067 Xoo11-068* Xoo11-069 Xoo11-071* Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Kuriak putiah Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10 Inpari 10
Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Maninjau – Sumbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar
Lampiran 2 Asal isolat bakteri Xoo dan varietas padi yang diidentifikasi
(Lanjutan dari Lampiran 2)
No Kode isolat Varietas Lokasi
69 70 71 72
Xoo11-072* Xoo11-073* Xoo11-074* Xoo11-075*
Inpari 10 Inpari 10 Inpari 10 Inpari 10
Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar Senakin – Kalbar
*= Isolat dalam pengujian karakter patogenitas
Lampiran 3 Elektroforegram hasil PCR koloni identifikasi seluruh isolat
menggunakan primer XO (Lee
et al.
2005). (P) Penanda, (K)
Kontrol, (1
–
72) Nomor isolat.
P P P
P
Lampiran 4 Elektroforegram hasil PCR koloni identifikasi seluruh isolat dengan
menggunakan primer Xoo2976 (Lang
et al
. 2010). (P) Penanda, (K)
kontrol, (1
–
72) Nomor isolat Xoo.
Lampiran 5 Elektroforegram hasil PCR koloni identifikasi seluruh isolat dengan
menggunakan primer Xoo (Onasanya
et al
. 2010). (P) Penanda, (K)
kontrol, (1
–
72) Nomor isolat Xoo.
\
P P
P
P
P
P P
P
P
Lampiran 6 Visualisasi virulensi bakteri Xoo dalam karakter patogenik pada padi
varietas galur isogenik dan populer.
Virulensi Isolat Xoo11-007 asal Jawa Barat yang memiliki virulensi rendah. (1) Nipponbare, (2) Ciherang, (3) Code, (4) IR64, (5) S. Putih, (6) Cisadane, (7) K. Bali, (8) IRBB1. (9) IRBB2, (10) IRBB3, (11) IRBB4, (12) IRBB5 (13) IRBB7, (14) IRBB20, (15) IRBB11, (16) IRBB14, (17) IRBB21, (18) IR24
(Lanjutan dari Lampiran 6)
Lampiran 7 Intensitas penyakit (IP) rerata varietas Code dan IRBB5.
Isolat Jabar IP rerata Code Xoo11-015 Xoo11-020 Xoo11-012 Xoo11-007 Xoo11-016 Xoo11-017 Xoo11-013 Xoo11-003 Xoo11-011 Xoo11-014 1.44 1.57 1.64 0.64 2.03 2.2 1.22 2.01 1.39 2.05 Intensitas rerata
isolat 1.619
Isolat Jabar IP rerata IRBB5 Xoo11-015 Xoo11-020 Xoo11-012 Xoo11-007 Xoo11-016 Xoo11-017 Xoo11-013 Xoo11-003