MINYAK NILAM SEBAGAI BIOFUNGISIDA UNTUK
MENGENDALIKAN PENYAKIT ANTRAKNOSA
(Colletotrichum capsici (Syd.) Butler & Bisby)
PADA BUAH CABAI
DESNI ROHA MIRIAM S.
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Minyak Nilam sebagai Biofungisida untuk Mengendalikan Penyakit Antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby) pada Buah Cabai” adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir skripsi ini.
Bogor, Juli 2013
ABSTRAK
DESNI ROHA MIRIAM S. Minyak nilam sebagai biofungisida untuk mengendalikan penyakit antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby) pada buah cabai. Dibimbing oleh BONNY POERNOMO WAHYU SOEKARNO.
Antraknosa merupakan salah satu penyebab rendahnya produktivitas cabai di Indonesia yang disebabkan oleh C. capsici. Pengendalian yang banyak dilakukan petani adalah menggunakan fungisida. Penggunaan fungisida yang kurang bijaksana dapat berdampak negatif terhadap lingkungan. Penelitian ini dilakukan untuk menguji potensi minyak nilam sebagai biofungisida dalam menekan pertumbuhan C. capsici penyebab penyakit antraknosa pada cabai. Dalam penelitian ini dilakukan isolasi dan pemurnian C. capsici, uji in vitro
dengan cara isolat C. capsici ditumbuhkan pada media PDA yang dicampur dengan minyak nilam (A dan B) dengan konsentrasi 10%, 5%, 2.5%, 1.25%, dan 0.625% yang dilakukan secara terpisah, isolat C. capsici ditumbuhkan pada media PDA sebagai kontrol negatif (Kn) dan pada media PDA yang dicampur dengan fungisida mankozeb sebagai kontrol positif (Kp). Diameter awal isolat C. capsici
yaitu 7 mm. Variabel yang diukur adalah pertumbuhan koloni C. capsici dan persentase penghambatan pertumbuhan koloni C. capsici. Hasil pengujian menunjukkan minyak nilam A efektif secara nyata menekan pertumbuhan C. capsici dibandingkan minyak nilam B pada 10 HSP yaitu mencapai 91.15% pada setiap konsentrasi kecuali pada konsentrasi 0.625% kemampuan penghambatan sebesar 85.92%. Minyak nilam A dengan konsentrasi 2.5% digunakan pada uji in vivo. Pada uji in vivo minyak nilam diaplikasi pada buah cabai secara preventif, kuratif, dan induksi resisten. Variabel yang diukur yaitu masa inkubasi dan intensitas serangan penyakit. Hasil pengujian menunjukkan masa inkubasi pada uji kuratif yaitu 8 HSI, uji preventif dan induksi resisten 5 HSI, sedangkan intensitas serangan C. capsici pada 10 HSI pada uji kuratif 4.80%, preventif 23.20%, dan induksi resisten 29.60%, dibandingkan dengan Kp 29.60% dan Kn 68.80%.
ABSTRACT
DESNI ROHA MIRIAM S. Patchouli oil as biofungicide to control anthracnose disease (Colletotrichum capsici (Syd.) Butler & Bisby) on the chilies. Supervised by BONNY POERNOMO WAHYU SOEKARNO.
Anthracnose is one of the caused of low chili productivity in Indonesian its caused by C. capsici. Much farmer using a fungicide as a controlling. Using of fungicide with uncontrolled could have a negative impact on the environment. The aim of this study is to test the potential of patchouli oil as fungicide in suppresses the growth of C. capsici causes anthracnose disease on chili. In this study conducted the isolation and purification of C. capsici, test in vitro by isolates C. capsici grown on PDA mixed with patchouli oil (A and B) with a concentration of 10%, 5%, 2.5%, 1.25%, and 0.625% done separately, isolates of
C. capsici grown on PDA medium as a negative control (Kn) and PDA media mixed with fungicides mankozeb as a positive control (Kp). Initial diameter isolates C. capsici is 7 mm. The measured variable is growth of colonies of C. capsici and percentage inhibition of colony growth of C. capsici. The results showed that patchouli oil A effectively significant suppresed C. capsici growth compare to patchouli oil B at 10 HSP in 91.15% at each concentration except were concentration of 0.625% with inhibitory ability of 85.92%. The patchouli oil A with a concentration of 2.5% used in the in vivo test. The in vivo test was applicated of patchouli oil in chilies with preventive, curative, and resistance induction. Variables which measured are the incubation period and intensity disease. The results showed an incubation period on curative test was 8 HSI, preventive and induction of resistant test was 5 HSI, while the intensity of the attacks C. capsici at 10 HSI at test curative 4.80%, preventive 23.20%, and resistance induction 29.60%, compared with Kp 29.60% and Kn 68.80%.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
MINYAK NILAM SEBAGAI BIOFUNGISIDA UNTUK
MENGENDALIKAN PENYAKIT ANTRAKNOSA
(Colletotrichum capsici (Syd.) Butler & Bisby)
PADA BUAH CABAI
DESNI ROHA MIRIAM S.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Minyak Nilam sebagai Biofungisida untuk Mengendalikan Penyakit Antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby)pada Buah Cabai
Nama : Desni Roha Miriam S. NIM : A34080104
Disetujui oleh
Dr. Ir. Bonny Poernomo Wahyu Soekarno M.Si. Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih M.Si. Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas kasih anugrah dan penyertaan-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Minyak Nilam sebagai Biofungisida untuk Mengendalikan Penyakit Antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby) pada Buah Cabai”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan di Laboratorium Mikologi Departemen Proteksi Tanaman dari bulan Agustus 2012 sampai Pebruari 2013. Pembuatan skripsi ini tentunya tidak terlepas dari bantuan dan masukan dari berbagai pihak. Oleh sebab itu penulis menyampaikan terimakasih kepada Dr. Ir. Bonny Poernomo Wahyu Soekarno M.Si. selaku dosen pembimbing yang telah memberikan bimbingan, arahan, saran, dan pengetahuan kepada penulis. Ucapan terimakasih juga kepada Dra. Dewi Sartiami M.Si. selaku dosen penguji tamu serta kepada seluruh dosen dan staf pegawai Departemen Proteksi Tanaman yang telah memberikan bimbingan, arahan, saran, motivasi dan pengetahuan yang sangat luas kepada penulis. Tidak lupa juga penulis menyampaikan terimakasih kepada bapak Dadang Surachman sebagai laboran di Laboratorium Mikologi yang telah memberikan masukan dan membantu dalam pelaksanaan penelitian ini. Penulis mengucapkan terimakasih kepada keluarga tercinta khusunya kedua orang tua tercinta, ayah Juara Sakerebau dan ibu Ertina Saleleubaja beserta kakak-kakak tersayang Evanirwati Sakerebau, Christiana Sakerebau S.Th, Maya Rumantir Sakerebau S.Pd, abang-abang ipar diantaranya Marius Saroro S.Pd, Paber Sapatadekat serta ponakan tersayang Enjelina Saroro dan keluarga besar yang ada di Mangaungau serta saudara terkasih Radianus S.Pi yang selalu memberi semangat, doa, dan kasih sayangnya kepada penulis. Tidak lupa ucapan terimakasih juga ditujukan kepada Pemerintah Daerah Kabupaten Kepulauan Mentawai yang telah membiayai kuliah dan kebutuhan selama menempuh pendidikan di Institut Pertanian Bogor dan teman-teman PTN 45, 46 dan 47 beserta rekan kerja di Laboratorium Mikologi dan teman-teman seperjuangan Hans DW. Siritoitet S.P, Jon PT. Sakoikoi S.Pi, Helma HP. Saleleubaja, Maria Sagulu, dan adek-adek tingkat dari Mentawai yang selalu memberikan dukungan, semangat, dan doanya. Penulis menyadari karya ini mungkin masih terdapat kekurangan, namun penulis berharap semoga karya ilmiah ini dapat bermanfaat, sehingga dapat memberikan kontribusi positif terhadap perkembangan pertanian berkelanjutan di Indonesia.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x DAFTAR LAMPIRAN xi PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 3
BAHAN DAN METODE 4
Tempat dan Waktu Penelitian 4
Bahan dan Alat 4
Metode 4
Pembuatan Media PDA sebagai Media Tumbuh 4
Isolasi Patogen dari Tanaman Sakit 4
Penyediaan Minyak Nilam 5
Uji In Vitro 5
Uji In Vivo 5
Uji Preventif 5
Uji Kuratif 6
Uji Induksi Resisten 6
Rancangan Percobaan dan Analisis Data 7
HASIL DAN PEMBAHASAN 8
Isolasi dan Identifikasi Cendawan Patogen 8
Uji In Vitro 9
Uji In Vivo 11
PENUTUP 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Hasil analisa kandungan minyak nilam 10
2 Rataan diameter koloni C. capsici pada media tumbuh PDA dengan perlakuan minyak nilam (A dan B) secara in vitro pada 10 HSP
11
1 Gejala awal penyakit antraknosa (a) dan serangan lanjut antraknosa pada buah cabai (b) minyak nilam B dengan konsentrasi 10% (h), 5% (i), 2.5% (j), 1.25% (k) dan 0.625% (l)
10
6 Buah cabai pada 10 HSI dengan aplikasi minyak nilam A secara preventif (a), kuratif (b), induksi resisten (c), kontrol positif (d) dan kontrol negatif (e) pada uji in vivo
12
7 Intensitas serangan C. capsici pada buah cabai 1-10 HSI pada pengujian in vivo
DAFTAR LAMPIRAN
1 Minyak nilam yang digunakan dalam penelitian, minyak nilam A (kiri) dan minyak nilam B (kanan)
19
2 Kromotogram nilam A 19
3 Kromotogram nilam B 19
4 Rataan pertumbuhan C. capsici pada berbagai konsentrasi minyak nilam A pada uji in vitro
20
5 Rataan pertumbuhan C. capsici pada berbagai konsentrasi minyak nilam B pada uji in vitro
20
6 Data masa inkubasi penyakit antraknosa pada buah cabai pada uji in vivo
21
7 Rataan intensitas serangan C. capsici pada buah cabai dari 1-10 HSI pada uji in vivo
1
PENDAHULUAN
Latar Belakang
Cabai (Capsicum annum L.) merupakan komoditas sayuran yang memiliki nilai komersial tinggi, sehingga mendorongan petani untuk membudidayakan cabai. Menurut Badan Pusat Statistik (2012), produktivitas cabai nasional Indonesia tahun 2011 adalah 7.34 ton/ha dengan luas panen sebesar 121 063 ribu hektar. Angka tersebut masih rendah bila dibandingkan dengan potensi produksinya yang dapat mencapai 12 ton/ha (Suryaningsih et al. 1996; Purwati et al. 2000).
Salah satu masalah utama pada tanaman cabai adalah gangguan penyakit antraknosa yang disebabkan oleh C. capsici dan C. gloeosporioides Pens di pertanaman maupun di penyimpanan (Suryaningsih et al. 1996). Lebih lanjut Widodo (2007) melaporkan bahwa C. acutatum J.H. Simmonds juga banyak menyerang pertanaman cabai di Indonesia. Salah satu penyakit penting terbawa benih cabai disebabkan oleh C. capsici dan infeksi patogen ini bersifat laten dalam bentuk apresorium sampai pemasakan buah sehingga sukar untuk dikendaliakan (Sinaga et al. 1992; Agrios 1997). Suryaningsih et al. (1996) melaporkan kehilangan hasil akibat serangan antraknosa dapat mencapai 21%-63% pada musim hujan, namun Widodo (2007) melaporkan bahwa kehilangan hasil akibat serangan antraknosa pada cabai dapat mencapai 10%-80% dimusim hujan dan 2%-35% dimusim kemarau.
Upaya pengendalian antraknosa sampai saat ini masih banyak dilakukan dengan penggunaan fungisida berbahan aktif benomil, triabendazol, kaptan, klorotalonil, dan kuintozen (Soesanto 2006). Penggunaan fungisida tersebut menyebabkan resistensi terhadap beberapa jenis patogen pada tanaman serta residu pestisida diatas batas aman buah cabai. Dengan demikian, pengendalian alternatif yang lebih efektif, tetapi aman bagi konsumen dan lingkungan perlu dikembangkan. Asie (2004) menjelaskan pestisida botani memiliki keunggulan dibandingkan dengan pestisida sintetik baik dari segi upaya pengendalian penyakit pada tanaman maupun lingkungan. Salah satu upaya perlindungan tanaman cabai dari infeksi C. capsici yaitu penggunaan minyak nilam yang mempunyai efek fungisida.
Nilam merupakan salah satu tanaman penghasil minyak atsiri. Tanaman ini termasuk famili Labiateae, ordo Lamiales, kelas Angiospermae, dan divisi Spermatophyta dengan nama ilmiah Pogostemon sp. (Santoso 1990). Di Indonesia, jenis nilam yang dibudidayakan ialah nilam Aceh (P. cablin Benth) yang banyak ditanam di daerah Nanggroe Aceh Darussalam, Sumatera Utara, Sumatera Barat, dan sebagian di Jawa. Jenis ini berasal dari Filipina, kemudian berkembang ke Malaysia, Madagaskar, Paraguay, Brazilia, dan Indonesia (Mangun 2006).
2
kebutuhan industri makanan (untuk penambah rasa), pembuatan insektisida, pembuatan pestisida, kebutuhan farmasi (untuk pembuatan obat antiradang, antifungi, antiseptik, antijerawat, anti-inflamasi, antidepresi, antiflogistik, serta dekongestan), dan sebagai aromaterapi (Santoso 1990; Mangun 2006; Nuryani et al. 2007; Sukamto 2009; Rusli 2010).
Minyak nilam tersusun atas komponen utama yaitu patchouli alkohol (C15H26o), patchoulen (C15H24), kariofilen, dan norpatchoulenol yang berfungsi
sebagai zat pengikat (fiksatif) serta belum dapat digantikan oleh zat sintesis. Komponen lain diantaranya eugenol (C10H12O2), patchouli camphor, kadinen,
benzaldehida (C7H6O6), sinnamaldehida, α-pinen (C10H16), -pinen, α
-patchoulene, -Patchoulene, aristolone, nookatone, -Vetivone, α-Vetivone, Corymbolone, dan seskuiterpena lainnya (Mangun 2006; Purwati 2011; Sariadi 2012).
Purwati (2011) menjelaskan bahwa minyak nilam mengandung komponen seskuiterpena gugus fungsional diantaranya patchouli alkohol, kariofilen oksida,
aristolone, nookatone, -Vetivone, α-Vetivone, dan Corymbolone. Patchouli
alkohol merupakan komponen utama penyusun minyak nilam dan digunakan sebagai indikator kualitas minyak nilam terutama dari karakteristik bau yang dihasilkan, dan merupakan senyawa seskuiterpen trisiklik yang tidak larut dalam air, tetapi larut dalam alkohol, eter atau pelarut organik yang lain memiliki titik didih 280.37 oC serta bentuk kristal berwarna putih dengan titik leleh 56 ºC.
Patchoulen, α-patchoulene, -patchoulene, -patchoulene, norpatchoulenol, α -guaiane, α-bulnesene, seychellene dan germacrene A termasuk ke dalam komponen seskuiterpena(Purwati 2011; Sariadi 2012).
Eugenol termasuk dalam komponen oxygenated monoterpen yang merupakan suatu senyawa fenol yang dapat bereaksi dengan basa kuat dan bersifat anti fungi, berupa cairan berbentuk minyak, tidak berwarna atau sedikit kekuningan, dan akan menjadi coklat jika kontak dengan udara, sulit larut dalam air tetapi larut dalam pelarut organik, larut dalam 5:6 dengan alkohol 50%, larut dalam 2:3 dengan alkohol 60% dan larut dalam 1:2 dengan alkohol 70% (Guenther 2006; Purwati 2011). Benzaldehida merupakan cairan tidak berwarna, memiliki kemampuan untuk mengkondensasi dengan beberapa macam aldehida untuk membentuk nilai tinggi pada parfum (Guenther 2006). Sinnamaldehida merupakan senyawa aldehida aromatik, dapat teroksidasi pada gugus aldehidanya sehingga pada ikatan rangkap akan terbentuk asam sinamat, yang pada akhirnya akan membentuk asam benzoat serta benzaldehida. Senyawa α-pinen dan -Pinen
merupakan komponen yang termasuk ke dalam monoterpen. Senyawa α-pinen bersifat larut dalam alkohol pekat dan tidak larut dalam air. -pinen merupakan senyawa yang larut dalam alkohol pekat dan sukar larut dalam alkohol encer (Guenther 2006; Purwati 2011).
Tujuan Penelitian
3
Manfaat Penelitian
4
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor untuk pengujian secara in vitro dan in vivo, sampel buah cabai diperoleh dari lahan pertanaman cabai di daerah Kampung Gede, Desa Gunung Bunder II, Kecamatan Pamijahan, Kabupaten Bogor. Waktu penelitian dilakukan pada bulan Agustus 2012 sampai bulan Pebruari 2013.
Bahan dan Alat
Bahan yang digunakan dalam penelitian adalah buah cabai merah keriting (C. annum) yang menunjukan gejala penyakit antraknosa, buah cabai merah keriting yang sehat, isolat murni C. capsici, minyak nilam (A dan B), media tumbuh Potato Dextrose Agar (PDA), akuades steril, fungisida mankozeb 80 WP, tween 80%, alkohol 70%, dan alkohol 90%. Alat yang digunakan antara lain nampan, plastik bening, aluminium foil, cawan petri, labu erlenmeyer, gelas ukur,
cork borer, sarung tangan, plastik wrap, spidol, label dan sprayer.
Metode
Pembuatan Media PDA sebagai Media Tumbuh
Sebanyak 200 g kentang yang sudah dikupas dan dipotong kecil direbus dengan akuades 1000 ml selama ± 30 menit. Setelah masak, disaring untuk diambil ekstraknya, kemudian ditambah akuades hingga mencapai volume 1000 ml dan dimasak kembali sambil ditambahkan 20 g dektrosa dan tepung agar sebanyak 15 g lalu diaduk. Setelah bercampur sempurna dan masak, dituangkan kedalam labu erlenmeyer (250 ml), lalu disterilisasi dengan autoklaf pada suhu 121 oC dan tekanan 1 atm selama 15 menit (Navitasari 2007).
Isolasi Patogen dari Bahan Tanaman Sakit
Sampel buah cabai yang menunjukkan gejala terserang patogen C. capsici
5
kebutuhan. Semua kegiatan isolasi C. capsici dilakukan dalam kondisi aseptik di
laminar air flow.
Penyediaan minyak nilam
Minyak nilam yang digunakan dalam penelitian ada dua jenis yaitu minyak nilam yang diperoleh dari pasar (A) dan minyak nilam yang dihasilkan oleh suatu lembaga penelitian (B). Minyak nilam tersebut akan diuji keefektifannya dalam menekan pertumbuhan cendawan C. capsici secara terpisah dengan uji in vitro di laboratorium.
Uji In Vitro
Isolat murni C. capsici yang berumur 10 hari dipotong dengan diameter 7 mm ditumbuhkan pada medium PDA yang telah dicampur dengan tween 80% dan masing-masing minyak nilam (A dan B) dengan konsentrasi 10%, 5%, 2.5%, 1.25%, dan 0.625% secara terpisah (Wiratno et al. 2011). Kontrol yang digunakan adalah kontrol positif (Kp), yaitu isolat yang ditumbuhkan pada medium PDA yang telah dicampur fungisida mankozeb dengan konsentrasi 0.02% (v/v), dan kontrol negatif (Kn) yaitu isolat yang ditumbuhkan pada medium PDA tanpa perlakuan minyak nilam. Tiap perlakuan masing-masing diulang 10 kali. Pengamatan dilakukan setiap hari dengan mengukur pertumbuhan diameter koloni
C. capsici menggunakan penggaris sampai pertumbuhan koloni C. capsici pada kontrol menutup seluruh permukaan media tumbuh. Keefektifan minyak nilam menekan pertumbuhan koloni C. capsici dihitung dengan rumus:
Daya hambat = DK - DP X 100% DK
DK = Diameter koloni C. capsici pada kontrol negatif (mm) DP = Diameter koloni C. capsici pada perlakuan (mm)
Uji In Vivo
Konsentrasi efektif yang dihasilkan dalam uji in vitro digunakan sebagai konsentrasi perlakuan pada uji in vivo. Pada uji in vivo, sampel buah cabai yang telah diperoleh dari lahan pertanaman cabai, dicuci dengan air bersih kemudian ditiriskan dan dikeringanginkan. Sterilisasi permukaan buah cabai dilakukan dengan merendaman buah dalam alkohol 70% selama 3 menit, kemudian dikeringkanginkan. Setelah itu, buah cabai dicuci kembali dengan akuades steril kemudian dikeringanginkan di atas meja laminar yang telah dialasi kertas saring. Aplikasi minyak nilam terpilih pada buah cabai dilakukan secara preventif, kuratif, dan uji induksi resistensi. Setiap perlakuan diulang 5 kali dan setiap ulangan terdiri 5 buah cabai.
a. Uji Preventif
Pengujian ini dilakukan dengan pencelupan buah cabai pada minyak nilam dengan konsentrasi terpilih yang telah dicampur dengan akuades steril dan tween
6
dicelupkan pada akuades steril. Setelah metode pencelupan selesai, buah cabai pada masing-masing perlakuan diinkubasi selama 48 jam pada suhu dan kelembaban ruang. Setelah inkubasi 48 jam, buah cabai diinokulasi secara buatan dengan suspensi C. capsici konsentrasi 107 spora/ml, selanjutnya diinkubasi kembali (Prayogo 2006).
b. Uji Kuratif
Pengujian ini dilakukan dengan cara menginkubasi buah cabai selama 48 jam di suhu ruang, yang sebelumnya sudah disterilisasi permukaan. Setelah inkubasi 48 jam, cabai diinokulasi secara buatan dengan suspensi C. capsici
konsentrasi 107 spora/ml kemudian diinkubasi kembali sampai muncul gejala pertama pada salah satu buah cabai. Apabila salah satu buah cabai menunjukkan gejala penyakit antraknosa, dilakukan aplikasi minyak nilam dengan metode pencelupan sampel pada minyak nilam dengan konsentrasi terpilih yang telah dicampur dengan akuades steril dan tween 80% dengan konsentrasi 0.02% (v/v) selama 30 detik, kemudian ditiriskan dan dikeringanginkan. Untuk Kp, buah cabai dicelupkan pada fungisida mankozeb dengan konsentrasi rekomendasi dan untuk Kn, buah cabai dicelupkan pada akuades steril. Selanjutnya, buah cabai pada masing-masing perlakuan diinkubasi selama 48 jam pada suhu dan kelembaban ruang. Setelah inkubasi 48 jam, dilakukan inokulasi buatan suspensi C. capsici
konsentrasi 107 spora/ml pada buah cabai, selanjutnya diinkubasi kembali.
c. Uji Induksi Resisten
Pengujian ini dilakukan dengan pencelupan buah cabai pada minyak nilam dengan konsentrasi terpilih yang telah dicampur dengan akuades steril dan tween
80% dengan konsentrasi 0.02% (v/v) selama 30 detik, kemudian ditiriskan dan dikeringanginkan. Setelah itu, buah cabai dimasukkan kedalam nampan yang dialasi dengan kertas lembab dan sedotan. Untuk Kp, buah cabai dicelupkan pada fungisida mankozeb dengan konsentrasi rekomendasi dan untuk Kn buah cabai dicelupkan pada akuades steril. Setelah inkubasi 48 jam, selain kontrol, buah cabai yang diberi perlakuan minyak nilam dicuci dengan akuades steril, dikeringanginkan, kemudian diinokulasi secara buatan suspensi C. capsici
konsentrasi 107 spora/ml,kemudian diinkubasi kembali pada suhu ruang.
Pada uji in vivo ini, suspensi cendawan C. capsici konsentrasi 107 spora/ml yang akan diinokulasi pada buah cabai, untuk mengetahui jumlah spora dihitung menggunakan haemocytometer. Pada pengujian ini, pengamatan dilakukan setiap hari sampai akhir percobaan yaitu hari kesepuluh. Variabel yang diamati pada setiap metode pengujian yaitu menghitung (a) masa inkubasi yaitu munculnya gejala pertama penyakit antraknosa pada masing-masing buah cabai (b) menghitung tingkat keparahan penyakit pada setiap perlakuan dengan rumus :
Intensitas serangan = ∑(n × V) X 100% Z × N
Keterangan:
N = Jumlah buah setiap kelas bercak V = Nilai skor setiap kelas bercak N = Jumlah buah yang diamati
7
Rancangan Percobaan dan Analisis Data
8
HASIL DAN PEMBAHASAN
Isolasi dan Identifikasi Cendawan Patogen
Isolasi patogen dilakukan dari sampel buah cabai yang menunjukkan gejala antraknosa yang berasal dari lahan pertanaman cabai petani di daerah Kampung Gede, Desa Gunung Bunder II, Kecamatan Pamijahan, Kabupaten Bogor, Jawa Barat. Secara geografis Desa Gunung Bunder II terletak membujur di sebelah utara dan selatan dengan ketinggian sekitar 700 meter dari permukaan laut dengan suhu antara 20 ºC–28 ºC dengan topografi wilayah yang sebagian besar (60%) berupa bukit sampai bergunung (Rokhmah 2009).
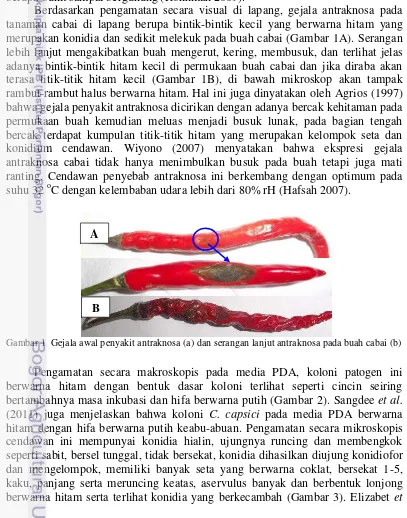
Berdasarkan pengamatan secara visual di lapang, gejala antraknosa pada tanaman cabai di lapang berupa bintik-bintik kecil yang berwarna hitam yang merupakan konidia dan sedikit melekuk pada buah cabai (Gambar 1A). Serangan lebih lanjut mengakibatkan buah mengerut, kering, membusuk, dan terlihat jelas adanya bintik-bintik hitam kecil di permukaan buah cabai dan jika diraba akan terasa titik-titik hitam kecil (Gambar 1B), di bawah mikroskop akan tampak rambut-rambut halus berwarna hitam. Hal ini juga dinyatakan oleh Agrios (1997) bahwa gejala penyakit antraknosa dicirikan dengan adanya bercak kehitaman pada permukaan buah kemudian meluas menjadi busuk lunak, pada bagian tengah bercak terdapat kumpulan titik-titik hitam yang merupakan kelompok seta dan konidium cendawan. Wiyono (2007) menyatakan bahwa ekspresi gejala antraknosa cabai tidak hanya menimbulkan busuk pada buah tetapi juga mati ranting. Cendawan penyebab antraknosa ini berkembang dengan optimum pada suhu 32 oC dengan kelembaban udara lebih dari 80% rH (Hafsah 2007).
Gambar 1 Gejala awal penyakit antraknosa (a) dan serangan lanjut antraknosa pada buah cabai (b)
Pengamatan secara makroskopis pada media PDA, koloni patogen ini berwarna hitam dengan bentuk dasar koloni terlihat seperti cincin seiring bertambahnya masa inkubasi dan hifa berwarna putih (Gambar 2). Sangdee et al.
(2011) juga menjelaskan bahwa koloni C. capsici pada media PDA berwarna hitam dengan hifa berwarna putih keabu-abuan. Pengamatan secara mikroskopis cendawan ini mempunyai konidia hialin, ujungnya runcing dan membengkok seperti sabit, bersel tunggal, tidak bersekat, konidia dihasilkan diujung konidiofor dan mengelompok, memiliki banyak seta yang berwarna coklat, bersekat 1-5, kaku, panjang serta meruncing keatas, aservulus banyak dan berbentuk lonjong berwarna hitam serta terlihat konidia yang berkecambah (Gambar 3). Elizabet et
9
al. (1967) juga melaporkan bahwa C. capsici mempunyai banyak aservulus berbentuk bulat atau lonjong berwarna hitam dengan diameter 70-120 µ, dan memiliki banyak seta yang berwarna coklat muda sampai coklat tua yang merupakan aservulus, bersekat 1-5, kaku serta meruncing ke atas dan panjang seta 250 µ, lebar 5-8 µ. Semangun (2000) menyatakan bahwa konidia cendawan ini hialin, berbentuk tabung (silindris), ujungnya tumpul atau bengkok seperti sabit, bersel tunggal, tidak bersekat, panjang konidia 16-30 µ x 2.5-4 µ, dan konidia dihasilkan diujung konidiofor. Lebih lanjut Sangdee et al. (2011) menjelaskan rata-rata panjang dan lebar konidia C. capsici bervariasi antara 23.5-35 µ dan 2.5-3.75 µ tergantung pada tempat pengambilan sampel tanaman sakit yang di isolasi.
Gambar 2 Koloni C. capsici pada media PDA berumur 10 hari
Gambar 3 Morfologi cendawan C. capsici dibawah mikroskop dengan perbesaran 40 x 10 yaitu konidia (a), seta (b), aservulus (c) dan konidia yang berkecambah (d)
Uji In Vitro
Hasil uji in vitro menunjukkan penambahan minyak nilam (Lampiran 1) pada medium tumbuh PDA dengan beragam konsentrasi mampu menekan pertumbuhan koloni C. capsici secara signifikan dibanding kontrol negatif (Gambar 4 dan 5). Salah satu penyebab mampunya minyak nilam menekan pertumbuhan C. capsici yaitu adanya senyawa eugenol yang memiliki sifat anti fungi. Pleczar et al. (2008) menyatakan bahwa fenol atau eugenol yang berasal dari tumbuhan mempunyai sifat sebagai anti fungi. Manohara et al. (1994) menjelaskan eugenol dari minyak cengkeh dengan konsentrasi 300 ppm dapat menghambat pertumbuhan Phytophthora sp. mencapai 83%-95% dan Rigidoporus lignosus mencapai 100%. Lebih lanjut Febriyati (2010) melaporkan bahwa senyawa kariofilen, pachouli alkohol danfenol mampu menghambat pertumbuhan bakteri Staphylococcus epidermis dan Streptococcus mutan melalui degradasi dinding sel. Senyawa-senyawa tersebut merupakan bagian dari komponen penyusun minyak nilam.
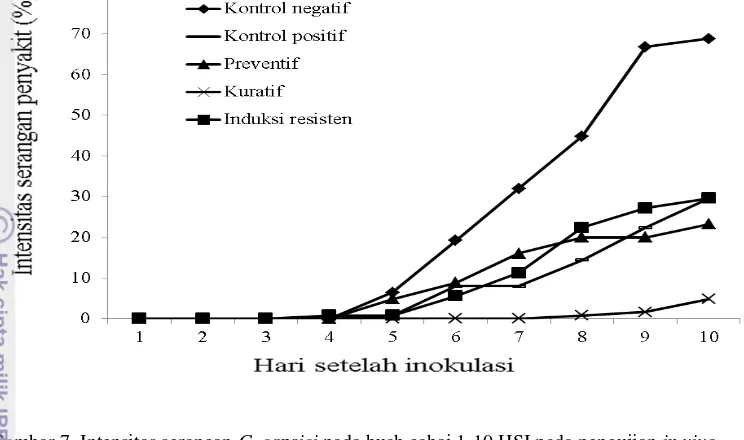
Hasil uji in vitro juga menunjukkan minyak nilam A lebih efektif menekan pertumbuhan koloni C. capsici dibanding miyak nilam B (Tabel 2), namun berdasarkan hasil uji kandungan patchouli alkohol dan eugenol pada minyak nilam A lebih rendah dari pada minyak nilam B (Tabel 1, Lampiran 2 dan 3). Hal ini diduga adanya senyawa lain pada minyak nilam yang bersifat anti fungi selain
patchouli alkohol dan eugenol.
c
10
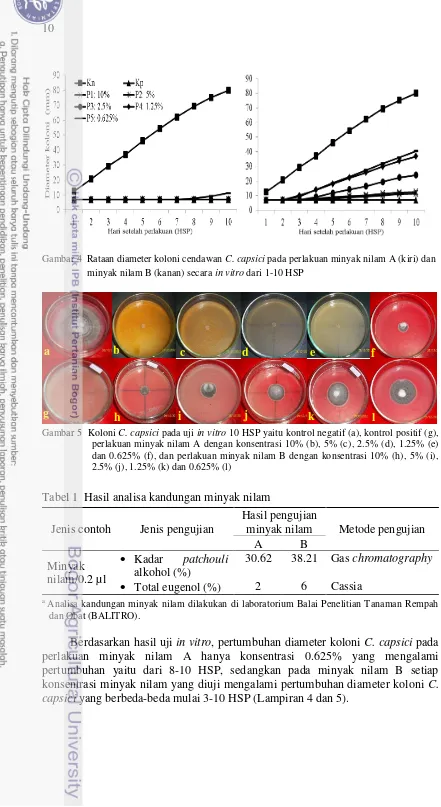
Gambar 4 Rataan diameter koloni cendawan C. capsici pada perlakuan minyak nilam A (kiri) dan minyak nilam B (kanan) secara in vitro dari 1-10 HSP
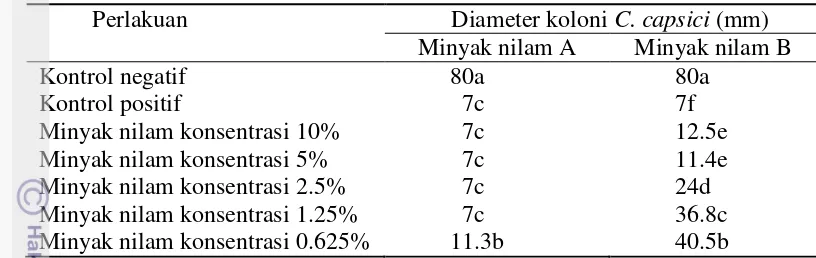
Gambar 5 Koloni C. capsici pada uji in vitro 10 HSP yaitu kontrol negatif (a), kontrol positif (g), perlakuan minyak nilam A dengan konsentrasi 10% (b), 5% (c), 2.5% (d), 1.25% (e) dan 0.625% (f), dan perlakuan minyak nilam B dengan konsentrasi 10% (h), 5% (i), 2.5% (j), 1.25% (k) dan 0.625% (l)
Tabel 1 Hasil analisa kandungan minyak nilam
Jenis contoh Jenis pengujian
Hasil pengujian
minyak nilam Metode pengujian
A B
Minyak nilam/0.2 µl
Kadar patchouli
alkohol (%)
30.62 38.21 Gas chromatography
Total eugenol (%) 2 6 Cassia a
Analisa kandungan minyak nilam dilakukan di laboratorium Balai Penelitian Tanaman Rempah dan Obat (BALITRO).
Berdasarkan hasil uji in vitro, pertumbuhan diameter koloni C. capsici pada perlakuan minyak nilam A hanya konsentrasi 0.625% yang mengalami pertumbuhan yaitu dari 8-10 HSP, sedangkan pada minyak nilam B setiap konsentrasi minyak nilam yang diuji mengalami pertumbuhan diameter koloni C. capsici yang berbeda-beda mulai 3-10 HSP (Lampiran 4 dan 5).
a b c d e f
11
Tabel 2 Rataan diameter koloni C. capsici pada media tumbuh PDA dengan perlakuan minyak nilam (A dan B) secara in vitro pada 10 HSP
Perlakuan Diameter koloni C. capsici (mm)
Minyak nilam A Minyak nilam B
Kontrol negatif 80a 80a
Minyak nilam konsentrasi 0.625% 11.3b 40.5b a
Nilai tengah yang memiliki huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan DMRT α = 5%.
Tabel 3 Daya hambat minyak nilam (A dan B) terhadap pertumbuhan koloni C. capsici pada media tumbuh PDA pada 10 HSP
Perlakuan Daya hambat (%)
Minyak nilam A Minyak nilam B
Kontrol positif 91.15a 91.15a
Minyak nilam konsentrasi 10% 91.15a 85.48b
Minyak nilam konsentrasi 5% 91.15a 84.49c
Minyak nilam konsentrasi 2.5% 91.15a 69.66d
Minyak nilam konsentrasi 1.25% 91.15a 53.48e
Minyak nilam konsentrasi 0.625% 85.92b 48.83f
Catatan kaki seperti pada Tabel 2.
Pada akhir pengamatan (10 HSP), minyak nilam A mampu menekan pertumbuhan koloni C. capsici sebesar 85.92%-91.15%, sedangkan minyak nilam B mampu menghambat 48.83%-85.48% (Tabel 3). Minyak nilam merupakan salah satu minyak atsiri yang mengandung senyawa eugenol seperti halnya pada minyak cengkeh. Mugiono (2002) menyatakan daya hambat minyak cengkeh pada konsentrasi 0.1%, 0.2%, 0.4%, dan 0.8% mampu menekan pertumbuhan
Aspergillus flavus (Link.) dan Fusarium oxysporum (Schl.) mencapai 100% pada benih kedelai. Lebih lanjut Asie (2004) melaporkan bahwa minyak daun cengkeh dengan konsentrasi 0.06% mampu menghambat pertumbuhan C. capsici hingga 100% secara in vitro.
Uji In Vivo
12
bermakna minyak nilam dapat memperpanjang masa simpan buah cabai. Oleh karena itu perlu dikaji ulang konsentrasi minyak nilam yang digunakan untuk
Catatan kaki seperti pada Tabel 2; HSI: hari setelah inokulasi.
Aplikasi minyak nilam dengan konsentrasi 2.5% pada buah cabai mampu menekan intensitas serangan C. capsici secara nyata dibandingkan dengan kontrol negatif (Tabel 4 dan Gambar 7).
Gambar 6 Buah cabai pada 10 HSI dengan aplikasi minyak nilam A secara preventif (a), kuratif (b), induksi resisten (c), kontrol positif (d) dan kontrol negatif (e) pada uji in vivo
Aplikasi minyak nilam secara preventif maupun induksi resisten mampu menekan intensitas serangan C. capsici secara nyata dibandingkan dengan kontrol negatif, tetapi tidak berbeda nyata dengan kontrol positif, kecuali pada perlakuan kuratif (Lampiran 7). Hal tersebut menunjukkan minyak nilam sangat efektif menekan intensitas serangan C. capsici sebanding dengan fungisida sintetik. Asie (2004) juga melaporkan bahwa pestisida botani dalam bentuk minyak lebih efektif menekan pertumbuhan patogen dibandingkan dalam bentuk tepung. Aplikasi minyak nilam pada buah cabai mempunyai efek induksi resistensi. Hal ini sangat bermanfaat untuk meningkatkan ketahanan buah cabai.
Berdasarkan hasil pengujian in vivo pada aplikasi minyak nilam secara kuratif memiliki intensitas serangan terendah dari perlakuan lainnya dengan intensitas serangan penyakit hingga 10 HSI mencapai 4.80%, sedangkan pada aplikasi minyak nilam secara preventif mencapai 23.20%, dan aplikasi minyak nilam secara induksi resisten mencapai 29.60% (Tabel 5).
Perlakuan Masa inkubasi (HSI) Rata-rata
13
Gambar 7 Intensitas serangan C. capsici pada buah cabai 1-10 HSI pada pengujian in vivo
Tabel 5 Data intensitas serangan C. capsici pada buah cabai pada 10 HSI dengan pengujian secara in vivo
Perlakuan Intensitas serangan C. capsici (%)
Kontrol negative 68.80a
Kontrol positif 29.60b
Preventif 23.20b
Kuratif 4.80c
Induksi resisten 29.60b
Catatan kaki seperti pada Tabel 2.
14
PENUTUP
Simpulan
Berdasarkan hasil percobaan in vitro dan in vivo, minyak nilam efektif menekan pertumbuhan C. capsici sebanding dengan fungisida sintetik. Aplikasi minyak nilam A pada konsentrasi 2.5% pada uji in vivo mampu menekan tingkat serangan C. capsici pada buah cabai serta dapat memperpanjang masa simpan buah cabai.
Saran
15
DAFTAR PUSTAKA
Agrios GN. 1997. Plant Pathology. Fourth edition.Tokyo (JP). Academic Press. Asie KV. 2004. Matriconditioning plus pestisida botani untuk perlakuan benih
cabai terinfeksi Colletotrichum capsici: evaluasi mutu benih selama peyimpanan [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
[BPS] Badan Pusat Statistik. 2012. Komoditas Indonesia: produktivitas cabai nasional naik tahun 2011 [Internet]. [diunduh 2013 Maret 24]. Tersedia pada: http://komoditasindonesia.com/2012/08/bps-produktivitas-cabai nasional-naik-1012.
Elizabeth JMM, Suhr BC, Waterston JM. 1976. Description on Pathogenic Fungi and Bacteri. London (GB): CMI.
Febriyati. 2010. Analisis komponen kimia fraksi minyak atsiri daun sirih (Piper betle Linn.) dan uji aktivitas antibakteri terhadap beberapa jenis bakteri gram positif [skripsi]. Jakarta (ID): Program Study Farmasi, Universitas Islam Negeri Syarif Hidayatullah.
Guenther E. 2006. Minyak Atsiri. Ketaren S, penerjemah. Jakarta (ID): UI Press. Terjemahan dari: The Essential Oils.
Hafsah S. 2007. Penapisan genotipe dan analisis genetik ketahanan papaya terhadap penyakit antraknosa di Tajur dan Gunung Geulis Bogor [disertasi]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Manohara D, Wahyono D, Sukamto. 1994. Pengaruh tepung dan minyak cengkeh terhadap Phytophthora sp., Rigidoporus sp. dan Sclerotium sp. Prosiding Seminar Hasil Penelitian dalam rangka Pemanfaatan Pestisida Nabati; 1994 Desember 1-2; Bogor. Bogor (ID): Research and Development Centre for Biology (RDCB). hlm 19-27.
Mugiono. 2002. Pengujian potensi minyak sereh wangi dan minyak cengkeh untuk mengendalikan cendawan patogenik terbawa benih kedelai (Glycine
Max (L.) Merr.): Aspergillus flavus (Link.) dan Fusarium oxysporum (Schl.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Mangun HMS. 2006. Nilam: Hasilkan Minyak Berkualitas Mulai dari Teknik Budi daya hingga Proses Penyulingan. Cetakan ke-2. Jakarta (ID): Penebar Swadaya.
Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor (ID): Institut Pertanian Bogor Press.
Navitasari L. 2007. Aplikasi ekstrak tumbuhan untuk perlakuan benih padi dan kedelai [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nuryani Y, Emmyzar, Wahyudi A. 2007. Teknologi Unggulan Nilam: Perbenihan dan budidaya pendukung varietas unggul. Bogor (ID): Pusat Penelitian dan Pengembangan Perkebunan.
Pleczar MJ, Chan ECS. 2008. Dasar-Dasar Mikrobiologi. Ed ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL. Jakarta (ID): UI press. Terjemahan dari: Elements of Microbiology.
16
Prayogo Y. 2006. Upaya mempertahankan keefektifan cendawan entomopatogen untuk mengendalikan hama tanaman pangan. Jurnal Litbang Pertanian. 25(2): 47-54.
Purnomo B. 2006. Dasar-dasar perlindungan tanaman: konsepsi dan cara perlindungan tanaman. [Internet]. [diunduh 2013 Juli 3]. Tersedia pada:
http://id.scribd.com/doc/73175828/perlindungan-tanaman.
Purwati Y. 2011. Komposisi aroma minyak nilam komersial dari beberapa daerah di Indonesia [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rokhmah MK. 2009. Peningkatan pengetahuan peternak tentang tatalaksana usaha ternak domba melalui media cetak leaflet: Kasus peternak Desa Gunung Bunder II Kecamatan Pamijahan, Desa Cigudeg Kecamatan Cigudeg dan Desa Cibunian Kecamatan Pamijahan Kabupaten Bogor [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rusli MS. 2010. Sukses Memproduksi Minyak Atsiri. Jakarta (ID): Agro Media Pustaka.
Santoso HB. 1990. Bertanam Nilam. Bahan Industri Wewangian. Yogyakarta (ID): Kanisius.
Sinaga MS, Supramana, Widodo, Soekarno BWP. 1992. Kemungkinan pengendalian hayati bagi Colletotrichum capsici (Syd) Butl. et Bisby penyebab antraknosa pada cabai. Laporan Akhir Penelitian Pendukung PHT dalam Rangka Pelaksanaan Program Nasional Pengendalian Hama Terpadu. Kerjasama Proyek Prasarana Fisik Bappenas dengan Fakultas Pertanian. IPB. Bogor.
Suryaningsih Er, Sutarya R, Duriat AS. 1996. Penyakit tanaman cabai merah dan pengendaliannya. Di dalam: Duriat AS, Widjaja W, Hadisoeganda A, Soetiarso TA, Prabaningrum L, editor. Teknologi Produksi Cabai Merah. Bandung (ID): Balai Penelitian Tanaman Sayuran.
Semangun H. 2000. Penyakit-penyakit Tanaman Hortikultura di Indonesia.
Yogyakarta (ID): Gajah Mada Universitas Press.
Soesanto L. 2006. Penyakit Pascapanen: Sebuah Pengantar. Yogyakarta (ID): Kanisius.
Sukamto. 2009. Prospek tanaman nilam penghasil minyak atsiri; pengembangannya melalui sistim pola tanam. Jurnal Perkembangan teknologi TRO. 21(2): 48-55.
Sangdee A, Sachan S, Khankhum S. 2011. Morphological, pathological and molecular variability of Colletotrichum capsici causing anthracnose of chilli in the North-east of Thailand. African Journal of Microbiology Research
[Internet]. 5(25):4368-4372. Tersedia pada:
http://www.academicjournals.org/ajmr/pdf/pdf2011/9Nov/Sangdee%20et% 20al.pdf. DOI: 10.5897/AJMR11.476.
Sariadi. 2012. Pemurnian minyak nilam dengan proses adsorpsi menggunakan bentonit. Jurnal Teknologi. 12(2):100-104.
Widodo. 2007. Status of chili anthracnose in Indonesia. First International Symposium on Chili Anthracnose; 2007 September 17-19; Seoul. Seoul (KR): Seoul National University.
Wiyono S. 2007. Perubahan iklim dan ledakan hama dan penyakit tanaman.
17
Iklim: Tantangan Masa Depan Indonesia, Diselenggarakan Oleh KEHATI; 2007 Juni28; Jakarta. Bogor (ID): Institut Pertanian Bogor.
Wiratno, Siswanto, Luluk, Suriati S. 2011. Efektivitas beberapa jenis tanaman obat dan aromatik sebagai insektisida nabati untuk mengendalikan
18
19
Lampiran 1 Minyak nilam yang digunakan dalam penelitian, minyak nilam A (kiri) dan minyak nilam B (kanan)
Lampiran 2 Kromatogram nilam A
Lampiran 3 Kromatogram nilam B
20
Lampiran 4 Rataan pertumbuhan C. capsici pada berbagai konsentrasi minyak nilam A pada uji in vitro
Perlakuan Diameter koloni C. capsici (mm)
1 HSP 2 HSP 3 HSP 4 HSP 5 HSP 6 HSP 7 HSP 8 HSP 9 HSP 10 HSP
Kontrol negatif 12.5a 20.7a 29.3a 37a 46.3a 54.4a 62.2a 69.4a 75.2a 80a
Kontrol positif 7b 7b 7b 7b 7b 7b 7b 7b 7b 7c
Minyak nilam konsentrasi 10% 7b 7b 7b 7b 7b 7b 7b 7b 7b 7c
Minyak nilam konsentrasi 5% 7b 7b 7b 7b 7b 7b 7b 7b 7b 7c
Minyak nilam konsentrasi 2.5% 7b 7b 7b 7b 7b 7b 7b 7b 7b 7c
Minyak nilam konsentrasi 1.25% 7b 7b 7b 7b 7b 7b 7b 7b 7b 7c
Minyak nilam konsentrasi 0.625% 7b 7b 7b 7b 7b 7b 7b 7.8b 9.3b 11.3b
a
Nilai tengah yang memiliki huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan DMRT α=5%.
Lampiran 5 Rataan pertumbuhan C. capsici pada berbagai konsentrasi minyak nilam B pada uji in vitro
Perlakuan Diameter koloni C. capsici (mm)
1 HSP 2 HSP 3 HSP 4 HSP 5 HSP 6 HSP 7 HSP 8 HSP 9 HSP 10 HSP
Kontrol negatif 12.5a 20.7a 29.3a 37a 46.3a 54.4a 62.2a 69.4a 75.2a 80a
Kontrol positif 7b 7b 7d 7e 7e 7e 7e 7e 7e 7f
Minyak nilam konsentrasi 10% 7b 7b 7.4d 8d 8.9d 9.6d 10.2d 11.3d 12.1d 12.5e
Minyak nilam konsentrasi 5% 7b 7b 7d 7.2de 8de 8.8d 9.4d 10.2d 11.1d 11.4e
Minyak nilam konsentrasi 2.5% 7b 7b 7d 9.1c 11.7c 14.2c 16.4c 19.4c 22.3c 24d Minyak nilam konsentrasi 1.25% 7b 7b 10.1b 13.9b 18b 22.1b 25.8b 29.8b 33.7b 36.8c Minyak nilam konsentrasi 0.625% 7b 7b 9.4c 14.1b 18.5b 22.8b 27.5b 31.9b 36.1b 40.5b
20
2
0
Lampiran 6 Data masa inkubasi penyakit antraknosa pada buah cabai pada uji in vivo
Perlakuan
Masa inkubasi buah cabai ke-n (HSI)
Ulangan ke- 1 2 3 4 5
1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5
Kontrol negatif 6 - - - - 6 6 5 6 6 5 5 7 5 8 5 7 5 5 7 6 6 6 - 5 Kontrol positif 6 10 10 10 9 10 10 10 9 9 8 8 9 9 9 5 6 6 6 6 6 6 6 6 8
Preventif 8 - - 8 - 7 7 7 7 7 6 5 - 5 5 5 7 6 8 - 5 - 6 - 5
Kuratif - - - 9 - - - 8 - - 10 - 10 - - - - -
Induksi resisten - - 9 7 8 7 7 4 6 8 - 6 8 8 6 6 6 7 7 7 8 8 8 8 8 a
Ke-n: Ke-1, 2, 3, 4, 5 merupakan jumlah ulangan buah cabai pada setiap ulangan perlakuan.
Lampiran 7 Rataan intensitas serangan C. capsici pada buah cabai dari 1-10 HSI pada uji in vivo
Catatan kaki seperti pada Lampiran 4.
Perlakuan 1 HSI 2 HSI 3 HSI 4 HSI 5 HSI 6 HSI 7 HSI 8 HSI 9 HSI 10 HSI
Kontrol negatif 0.00a 0.00a 0.00a 0.00a 6.40a 19.20a 32.00a 44.80a 56.80a 68.80a Kontrol positif 0.00a 0.00a 0.00a 0.00a 0.80b 8.00b 8.00bc 20.00b 22.40b 29.60b Preventif 0.00a 0.00a 0.00a 0.00a 4.80ab 8.80b 16.00b 20.00b 20.00b 23.20b Kuratif 0.00a 0.00a 0.00a 0.00a 0.00b 0.00b 0.00c 0.80c 1.60c 4.80c Induksi resisten 0.00a 0.00a 0.00a 0.00a 0.80b 5.60b 11.20b 22.40b 27.20b 29.60b
22