DEWI MURNI A.
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis “Pengaruh Cekaman Suhu terhadap Penyakit Koi Herpes Virus (KHV) pada Ikan Koi (Cyprinus carpio koi)” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2012
(KHVD) at Koi Fish (Cyprinus carpio koi). Under direction of FACHRIYAN HASMI PASARIBU and ABDUL GANI AMRI SIREGAR.
Koi fish are susceptible to Koi Herpes Virus Disease (KHVD). The disease is caused by the Koi herpesvirus, and mortality rate up to 80-95% within 2 weeks after infection. Koi herpesvirus is included in the virus that is hexagonal with a diameter of 100 nm. This study aims to determine the effect of temperature stress on the ability of Koi herpesvirus infects KHV free Koi fish and know the nature of transmission. Isolation and identification of Koi herpesvirus originate from the gills of Koi fish organs by the method of polymerase chain reaction (PCR) using PCR-KIT IQ2000TM. In this research, there were 8 fish groups of research, including the 6 fish group of test fish and two control test. The fish were injected with a virus suspension 10% as much as Koi herpesvirus 0.1 ml in intra peritoneal. For 14 days, seven of the first group as a fish's treatment of extreme temperatures at night 18-19 0C and 30-31 0C during the day. The 8th group of fish without control treatment temperature extremes. In a sequence group, the number of fish that were positive of KHVD were 5/5, 7/10, 5/5, 8/10, 0/5, 0/10, 4/5 and 0/5. KHV isolates with codes D143, D144 and M628 extremely virulent KHV isolates and not in the code D139. Stressed fish more susceptible to KHV- infection and KHV-infected fish easily transmit the koi herpesvirus in healthy fish or cohabitation by contamination of water in the aquarium and / or direct contact.
(KHV) pada Ikan Koi (Cyprinus carpio koi). Dibimbing oleh FACHRIYAN HASMI PASARIBU dan ABDUL GANI AMRI SIREGAR.
Ikan Koi mudah terserang penyakit Koi Herpes Virus (KHV). Penyakit ini disebabkan oleh Koi herpesvirus dengan angka mortalitas hingga 80-95% selama 2 minggu pasca infeksi. Bentuk morfologi dari Koi herpesvirus adalah ikosahedral dengan diameter 100 nm (Fenner et al. 1993). Koi herpesvirus dapat memperbanyak diri pada temperatur 18-30°C dan biasanya muncul pada pergantian musim yaitu musim kemarau ke musim hujan (Sunarto 2005). Penyakit KHV ini masuk ke Indonesia sejak 2002 (Rukyani et al. (2005) melalui perdagangan ikan lintas antar negara (Pasaribu, 2003). Penyakit KHV menyebabkan penurunan produksi ikan Koi secara drastis (Kementerian Kelautan dan Perikanan 2010).
Penelitian ini bertujuan untuk mengetahui pengaruh cekaman suhu terhadap kemampuan Koi herpesvirus menginfeksi ikan Koi bebas KHV dan mengetahui sifat penularannya. Hasil dari penelitian ini diharapkan dapat memberikan solusi dalam penanganan dan pengendalian yang tepat bagi para petani ikan dan bagi pihak yang berkepentingan dalam memberantas penyakit KHV.
Penelitian ini dilakukan beberapa laboratorium, yaitu 1) Laboratorium Virologi dan Uji Coba Balai Riset Kelautan dan Perikanan Jakarta, 2) Laboratorium Kesehatan Satwa Akuatik FKH-IPB, 3) Laboratorium Virologi dan Uji Coba Balai Besar Karantina Ikan Makassar, dan 4) Laboratorium Kualitas Air FKIP Universitas Hasanuddin Sulawesi Selatan. Penelitian ini dilakukan sejak bulan November 2010 sampai dengan Oktober 2011.
mempunyai perbedaan gen KHV satu sama lain baik kuantitas dan semikualitas. Secara berurutan sampel D139, D143, D144 dan M628 mempunyai kuantitas 20, 200, 2000 dan 2000 copies DNA dan semikualitas 229bp (+), 240bp (++), 630 bp (+++) dan 630 bp (+++). Stock virus dengan kode D144 digunakan untuk uji coba pada kelompok 1A dan 1B, stock virus kode D143 untuk kelompok 2A dan 2B, stock virus D139 untuk kelompok 3A dan 3B, stock virus M628 (milik BBKI Makassar) untuk kelompok 4A dan 4B. Setelah diberi perlakuan suhu ekstrim, ikan menunjukkan hasil positif KHV pada hari ke-7 sampai ke-11 pasca injeksi. Hasil positif KHV ini diketahui setelah dilakukan pemeriksaan berdasarkan gejala sakit, perubahan makroskopis dan pemeriksaan biologi molekuler metode nested PCR. Hasil positif KHV tersebut secara berurutan kelompok adalah 5/5, 7/10, 5/5, 8/10, 0/5, 0/10, 4/5 dan 0/5.
Walau ikan termasuk dalam hewan poikilotermal, ikan Koi mudah mengalami stres ketika terjadi perubahan suhu air hingga 5ºC dalam tempo singkat. Biasanya ikan Koi dapat bertahan hidup pada suhu 8-30ºC. ketika ikan Koi mengalami stres, tekanan darah dari tubuh ikan Koi akan turun sehingga syaraf simpatis dan medula adrenal menstimulasi jaringan hipotalamus untuk mensekresikan katekolamin, adenocorticosteroid (ACTH). Hal ini menyebabkan hipertropi kelenjar adrenal, atropi kelenjar limfe dan menekan produksi leukosit sehingga daya tahan tubuh turun. Selain itu, produksi interferon, antibodi dan Cell mediated immunity (CMI) turun akibat level corticosteroid dalam darah tinggi. Hal ini menyebabkan tubuh menjadi lebih peka terhadap infeksi virus KHV.
©
Hak Cipta Milik IPB, Tahun 2011 Hak Cipta Dilindungi Undang-UndangDilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
DEWI MURNI A.
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Mikrobiologi Medik
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Cekaman Suhu terhadap Penyakit Koi Herpes Virus (KHV) pada Ikan Koi (Cyprinus carpio koi)
Nama : Dewi Murni A. NRP : B253090041
Program Studi : Mikrobiologi Medik
Disetujui: Komisi Pembimbing
Prof. Dr. drh. Fachriyan Hasmi Pasaribu Ketua
drh. Abdul Gani Amri Siregar, MS. Anggota
Diketahui:
Ketua Program Studi Mikrobiologi Medik
Prof. Dr. drh. Fachriyan Hasmi Pasaribu
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc.Agr.
Puji syukur penulis panjatkan kepada Allah SWT, yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tesis ini. Tema dari penelitian ini adalah “Pengaruh Cekaman Suhu terhadap Penyakit Koi Herpes Virus (KHV) pada ikan Koi (Cyprinus carpio koi)”.
Penulis ucapkan terima kasih kepada Prof. Dr. drh. Fachriyan Hasmi Pasaribu dan drh. Abdul Gani Amri Siregar, MS selaku komisi pembimbing yang telah memberikan arahan dan bimbingan kepada penulis selama penelitian dan penulisan tesis. Penulis ucapkan terima kasih pula kepada Laboratorium Kesehatan Satwa Akuatik FKH-IPB, Laboratorium Virologi dan Uji Coba Balai Riset Kelautan dan Perikanan Jakarta, Laboratorium Virologi dan Uji Coba Balai Besar Karantina Ikan Makassar dan Laboratorium Kualitas Air FKIP UNHAS Makassar atas bantuan dan kerjasamanya. Tak lupa ucapan terima kasih penulis sampaikan kepada PEMDA Kabupaten POLMAN Provinsi SULBAR sebagai sponsor penelitian ini.
Terima kasih yang sebesar-besarnya penulis sampaikan kepada Ayahanda Prof. Dr. drh. Fachriyan Hasmi Pasaribu yang telah memberikan support moral dan dana studi penulis pada Program Magister “Mikrobiologi Medik” Sekolah Pascasarjana Institut Pertanian Bogor. Terima kasih pula kepada keluarga besar Roesdi dan To Nadi yang telah sabar memberikan doa malamnya demi kelancaran studi dan penelitian penulis. Terima kasih pula penulis sampaikan kepada semua pihak atas segala bantuan dan kerjasamanya.
Akhir kata penulis berharap semoga penelitian ini bermanfaat.
Bogor, Januari 2012
Penulis dilahirkan di Bumiayu, Jawa Tengah pada tanggal 26 April 1977 dari pasangan Bapak Khamitt To Nadi dan Ibu Roesse Roesdi. Pendidikan Program Sarjana dan Profesi Kedokteran Hewan ditempuh di Fakultas Kedokteran Hewan UGM dan lulus pada tahun 2007. Tahun 2009, penulis mendapat kesempatan untuk melanjutkan studi pada Program Magister “Mikrobiologi Medik” Sekolah Pascasarjana Institut Pertanian Bogor dengan bantuan dana studi dari Ayahanda Prof. Dr. drh. Fachriyan Hasmi Pasaribu dan dana penelitian dari PEMDA Kabupaten POLMAN Provinsi SULBAR.
DAFTAR TABEL ………...
1.1 Latar Belakang………... 1.2 Tujuan Penelitian………... 1.3 Manfaat penelitian………. II. TINJAUAN PUSTAKA………...
2.1 Ikan Koi (Cyprinus carpio koi) ……… 2.5 Penyakit Koi Herpes Virus (KHV) ……….. 2.5.1 Cara Penularan…..………... 2.5.2 Gejala Klinis………... 2.5.3 Perubahan Makroskopis………... 2.5.4 Diagnosa………... 2.6 Polymerase Chain Reaction (PCR) ………..
2.6.1 Single PCR………... 2.6.2 Nested PCR………... III. BAHAN DAN METODE………..
3.1 Tempat dan Waktu………. 3.2 Materi dan Metode Penelitian………..……….. 3.2.1 Materi Penelitian……….……... 3.2.2 Metode Penelitian………..………... 3.2.2.1 Identifikasi Koi herpesvirus dari Organ Insang Ikan
Koi dengan Metode Nested PCR…….
3.2.2.2 Ekstraksi Organ dan Pembuatan Suspensi Koi herpesvirus 10%………... 3.2.2.3 Infeksi Suspensi Koi herpesvirus 10% pada Ikan
Diagnosa Penyakit dan Kualitas Air……… 3.3 Analisa Data………... IV. HASIL DAN PEMBAHASAN………. 4.1 Isolasi dan Identifikasi Koi herpesvirus …………..………. 4.2 Ekstraksi Organ dan Pembuatan Suspensi virus KHV 10%... 4.3 Injeksi Suspensi Virus KHV 10% pada Ikan Coba……….... 4.4 Diagnosa……….………... 4.4.1 Gejala Klinis………... 4.4.2 Perubahan Makroskopis………... 4.4.3 Pemeriksaan Sampel Insang dengan Metode Nested PCR…. 4.5 Patogenesa Penyakit KHV………... 4.6 Cara Penularan KHV………... 4.7 Kualitas Air dan Cekaman Suhu……..……….
1. Master mix I dari nested PCR……… 2. Master mix I dari nested PCR……… 3. Siklus amplifikasi-nested PCR……….. 4. Disain cakaman suhu terhadap infeksi virus KHV ...…….………… 5. Gejala klinis ikan sakit pasca infeksi virus KHV 10% ... 6. Perubahan makroskopis ikan sakit pasca infeksi virus KHV 10% ... 7. Pemeriksaan sampel insang dengan metode nested PCR………. 8. Diagnosa Penyakit KHV ………...
16 16 16 20 23 24 28 28
1. Jenis-jenis ikan Koi……...……….……….. 2. Proses amplifikasi ekstrak DNA dalam thermocycler……… 3. Diagram amplifikasi pada nested PCR……….……….…. 4. Pola standar dan sampel positif dengan PCR-KIT IQ2000 TM ……. 5. Isolasi dan identifikasi Koi herpesvirus dengan metode nested PCR 6. Gejala klinis ikan Koi suspect KHV …………...……… 7. Perubahan makroskopis ikan Koi suspect KHV ……….………….. 8. Hasil elektroforesis uji nested PCR kelompok 1A……….……….… 9. Hasil elektroforesis uji nested PCR kelompok 1B……….……….… 10. Hasil elektroforesis uji nested PCR kelompok 2A…….……….…… 11. Hasil elektroforesis uji nested PCR kelompok 2B……….……….… 12. Hasil elektroforesis uji nested PCR kelompok 3A……….……….… 13. Hasil elektroforesis uji nested PCR kelompok 3B……….……….… 14. Hasil elektroforesis uji nested PCR kelompok 4A……….……….… 15. Hasil elektroforesis uji nested PCR kelompok 4B……….……….… 16. Uji kualitas air deplesi oksigen (DO) ..……….. 17. Uji kualitas air amonia (NH3)……….. 18. Uji kualitas air nitrit (NO2) ……….…… 19. Uji kualitas air nitrat (NO3)………
Halaman
1. PCR KIT IQ2000TM KHV………...
2. Metode Penelitian………..
3. Gejala klinis pasca injeksi suspensi virus KHV 10%... 4. Perubahan makroskopis pasca injeksi suspensi virus KHV 10%... 5. Pemeriksaan biologi molekuler metode Nested PCR……… 6. Diagnosa Penyakit KHV………...
7. Uji Nitrogen-Amonia………
8. Uji Nitrogen –Nitrat……….. 9. Uji nitrogen Nitrit……….. 10.Data Pengamatan suhu………..
43 45 48 52 55 56 57 58 59 60
I. PENDAHULUAN
1.1 Latar Belakang
Belakangan ini komoditas ikan koi (Cyprinus carpio koi) berkembang
dengan pesat di pasaran nasional. Ikan koi merupakan ikan hias yang berhabitat
pada air tawar dan diminati oleh para hobies. Ikan Koi mempunyai hubungan
kekerabatan sangat erat dengan ikan Mas (Cyprinus carpio carpio) karena memiliki
famili, genus, dan spesies yang sama (Susanto 2000). Ikan-ikan tersebut mudah
terserang penyakit Koi Herpes Virus (KHV) yang disebabkan oleh Koi herpesvirus
(Hendrick et al. 1997). Koi herpesvirus berbentuk ikosahedral dengan diameter 100
nm (Fenner et al. 1993). Virus KHV dapat memperbanyak diri pada temperatur
antara 18-30°C (Sunarto 2005) dan tidak bersifat menular kepada manusia (Rukyani
dan Sunarto 2003).
Di Indonesia, penyakit KHV pada tahun 2002 tercatat telah menyebabkan
kematian hingga 80-95% selama masa inkubasi (Anonim 2005). Namun
belakangan ini angka kematian akibat infeksi virus KHV tersebut telah turun. Hal
ini diduga akibat virus KHV telah lama terpapar pada kawasan budidaya ikan Koi
maupun ikan Mas.
KHV pertama kali diidentifikasi di Israel dan Amerika Serikat pada tahun
1998 dan diduga sebagai penyebab kematian massal ikan Koi baik stadia juvenil
maupun dewasa (Hedrick et al. 1998). Kejadian wabah penyakit KHV pertama
kali di Indonesia dilaporkan oleh Rukyani et al. (2005) ke Badan Kesehatan
Hewan Dunia (Office International des Epizooties, OIE) yang ditandai dengan
adanya kasus kematian massal pada ikan Koi dan ikan Mas pada bulan Juni 2002.
Awalnya penyakit KHV menyerang ikan Koi di Blitar (Jawa Timur), kemudian
menyerang ikan Mas di Jawa Barat. Setelah kejadian tersebut, KHV menyerang
daerah lainnya yaitu Lubuklinggau (Sumsel), Danau Maninjau (Sumbar) dan
Danau Toba (Sumut) (Departemen Kelautan dan Perikanan 2002). Penyakit ini
masuk ke Indonesia melalui perdagangan ikan lintas antar negara (Pasaribu 2003).
Penyakit ini menyebar sampai ke Eropa, Jepang, Rusia, Israel, Korea, Amerika
Sejak ada wabah penyakit KHV di Indonesia, produksi ikan Koi dan ikan
Mas mengalami penurunan yang drastis (Departemen Kelautan dan Perikanan
2010). Wabah penyakit KHV ini biasanya muncul pada pergantian musim yaitu
musim kemarau ke musim hujan. Penyakit ini telah menyebar di berbagai wilayah
di Indonesia. Penyakit KHV berstatus endemik di beberapa provinsi di Indonesia
yaitu Jawa, Bali, Sumatera, Lombok, Bima, Kalimantan, Sulawesi Utara,
Sulawesi Tengah, Sulawesi Tenggara, Sulawesi Selatan, Sorong dan Timika.
Sedang Sulawesi Barat, Gorontalo dan Maluku adalah daerah bebas KHV
(Kementerian Kelautan dan Perikanan 2010). Hingga hari ini belum ada obat
untuk penyakit tersebut (Pasaribu 2011). Namun telah dikembangkan penelitian
vaksin (Nuryati 2010) dan imunostimulan terhadap penyakit KHV (Pasaribu
2011).
1.2 Tujuan
Tujuan penelitian ini adalah untuk menguji pengaruh cekaman suhu
terhadap kemampuan virus KHV menginfeksi ikan Koi yang bebas KHV serta
menguji sifat penularannya.
1.3 Manfaat
Harapan dari penelitian ini adalah dapat memberikan solusi yang tepat
dalam pengendalian, penanganan dan pemberantasan penyakit KHV pada
II. TINJAUAN PUSTAKA
2.1 Ikan Koi (Cyprinus carpio koi)
2.1.1 Sistematika dan Ciri Morfologi Ikan Koi
Ikan Koi berasal dari keturunan ikan karper hitam atau ikan Mas yang
melalui proses perkawinan silang dan menghasilkan keturunan yang berwarna-
warni. Ikan Koi memiliki klasifikasi yang sama dengan ikan Mas, seperti berikut:
Filum : Chordata
Ikan Koi dan ikan Mas mempunyai hubungan kekerabatan yang sangat
erat karena memiliki famili, genus, dan spesies yang sama. Menurut Susanto
(2000), badan ikan Koi berbentuk seperti torpedo dengan alat gerak berupa sirip.
Ikan Koi jantan mempunyai bentuk tubuh langsing, sedangkan ikan Koi betina
bentuk tubuhnya agak membulat. Ikan koi memiliki 5 sirip yaitu sirip dada, sirip
perut, sirip anal, sirip ekor dan sirip punggung. Sirip dada dan sirip ekor ikan Koi
tersusun atas jari-jari lunak. Sirip punggung tersusun atas 3 jari-jari keras dan 20
jari-jari lunak sedang sirip perut tersusun atas 9 jari-jari lunak. Sirip anus tersusun
atas 3 jari-jari keras dan jari-jari lunak. Pada sisi badan dari pertengahan batang
sampai batang ekor terdapat gurat sisi yang berguna untuk merasakan getaran
suara. Garis ini terbentuk dari urat-urat yang ada di dalam sisik.
2.1.2 Pakan dan Pola Makan
Ikan Koi tergolong dalam hewan omnivora. Biasanya pakan ikan Koi
berupa ikan kecil, kerang-kerangan atau jenis tumbuh-tumbuhan. Pakan utama
anak Koi adalah udang-udang renik (Daphnia). Sejalan dengan pertumbuhan
badannya, ikan Koi dapat memakan serangga air, jentik-jentik nyamuk atau
Menurut Susanto (2000), ikan Koi di dalam air mampu mengenali
pakannya dan bahkan mencarinya diantara lumpur di dasar kolam, karena ikan
Koi mempunyai organ penciuman yang sangat tajam. Organ penciuman ini berupa
dua pasang kumis yang terletak pada bagian kiri dan kanan mulutnya. Ikan Koi
akan memburu sepotong pakan atau mengaduk-aduk lumpur untuk mendapatkan
pakan yang dibutuhkan. Mulut ikan Koi berukuran cukup besar dan dapat
disembulkan. Pakan berukuran kecil bersama-sama air memasuki rongga mulut
langsung ditelan masuk ke dalam kerongkongan dan dicerna di usus. Sedang air
melewati lamella insang setelah oksigen dalam air diserap.
2.1.3 Jenis Koi
Berbagai jenis ikan Koi, diantaranya adalah ikan Koi Kohaku, Koi Taisho
Sanke, Koi Showa Sanshoku, Koi Utsurimono, Koi Asagi, Koi Ogon yang, Koi
Kin Ginrin, Koi Bekko, Shiro Bekko Ki Bekko Aka Bekko, Koi Tancho dan Koi
Koromo atau Goromo (Tiara dan Muhananto 2011).
Gambar 1 Jenis ikan Koi
Pertumbuhan ikan Koi tergantung pada suhu air, pakan dan jenis kelamin.
Enam bulan pertama, ikan Koi tumbuh sangat cepat. Sampai umur 2 tahun, ikan
tahun ikan Koi betina tumbuh pesat dibandingkan ikan Koi jantan (Tiara dan
Muhananto 2011).
2.2 Kualitas Air
Air merupakan media hidup yang sangat mendukung dalam pertumbuhan
dan kelangsungan hidup organisme akuatik. Setiap jenis ikan memiliki batas
toleran yang berbeda-beda dan dinyatakan dengan kisaran nilai tertentu. Ada
beberapa parameter kelayakan perairan perikanan disebut kualitas air. Parameter
kualitas air ini digolongkan menjadi 2 yaitu secara fisika dan kimia. Kualitas air
tersebut diantaranya adalah suhu, salinitas, kekeruhan, oksigen terlarut, pH,
amonia, nitrat dan nitrit (Effendy 2003).
Suhu merupakan salah satu parameter air yang berperan penting sebagai
controlling factor. Metabolisme optimal akan terjadi pada suhu yang optimal.
Setiap jenis ikan mempunyai batas toleran yang berbeda-beda. Effendy (2003)
mengatakan bahwa ikan Koi dapat hidup pada kisaran suhu 8-30ºC, oleh sebab itu
ikan Koi dapat di pelihara di seluruh Indonesia, mulai dari pantai hingga daerah
pegunungan. Suhu ideal untuk pertumbuhan ikan Koi adalah 15-25ºC.
2.2.1 Power of hydrogen (pH)
Kesuburan air juga ditentukan oleh pH dimana logaritma negatif dari
konsentrasi ion hidrogen (pH) = -log [H]. Air murni pada suhu 25 C memiliki
konsentrasi pH 7. Perairan dengan pH netral sampai alkalis dapat digunakan untuk
budidaya ikan daripada perairan dengan pH asam. Ikan Koi bertahan hidup pada
pH 6,5-8. Perubahan pH biasanya menimbulkan stres pada ikan. Kemampuan air
menahan perubahan pH lebih penting daripada nilai pH itu sendiri. Namun Boyd
(1982) mengatakan bahwa ikan akan mati pada pH < 4; ikan tidak dapat
bereproduksi pada pH 4-5; laju pertumbuhan ikan menjadi lambat pada pH 5-6;
layak untuk budidaya pada pH 6,5-9; pertumbuhan ikan menjadi lambat pada pH
9-11; dan bila pH >11 maka ikan akan mati.
2.2.2 Deplesi Oksigen (DO)
Kebutuhan ikan terhadap oksigen tergantung pada jenis, ukuran, aktivitas,
suhu dan kualitas pakan. Ikan kecil masih bertahan hidup untuk beberapa saat
pada DO 0,0-0,3 mg/liter, namun akan mati pada DO 0,3-1,0 mg/liter. Bila DO air
lambat tetapi pada DO > 5 mg/liter maka ikan akan tumbuh secara optimal
(Effendy 2003).
2.2.3 Amonia
Amonia dihasilkan akibat dari proses pemupukan, ekskresi ikan,
dekomposisi mikroba dari komponen nitrogen. Ketika amonia memasuki perairan,
ion hidrogen langsung bereaksi dan mengubah amonia ke dalam suatu kondisi
keseimbangan antara ion amonium yang tidak beracun (NH4+) dan amonia tak
terionisasi (NH3) yang beracun (Boyd 1982).
NH3 + H+ + OH- NH4+ + OH-
Penguraian amonia di dalam air bergantung pada pH dan suhu. Selain itu
juga dipengaruhi faktor lain seperti kekuatan ion dalam larutan dan salinitas.
Toksisitas amonia dapat meningkat pada kondisi DO yang rendah. Amonia tak
terionisasi (NH3) akan menurun secara relatif menjadi amonia yang terionisasi
(NH4+) pada air sadah dan bersalinitas.
Total amonia dalam bentuk NH4+ dan NH3 tergantung pada peningkatan
pH dan temperatur. Pengaruh pH terhadap amonia lebih dominan dibandingkan
temperatur. Air dengan pH yang rendah memiliki ion hidrogen lebih banyak
sehingga bentuk NH4+ lebih dominan, yang mana NH4+ tidak beracun bila jauh
lebih banyak dibandingkan NH3. Peningkatan suhu air juga dapat meningkatkan
NH3 jauh lebih banyak dibandingkan NH4+,sehingga dapat membahayakan ikan
yang berada dalam sistem tersebut.
Keberadaan amonia mempengaruhi pertumbuhan karena mereduksi
masukan oksigen yang disebabkan oleh rusaknya insang, menambah energi untuk
keperluan detoksifikasi, mengganggu osmoregulasi dan mengakibatkan kerusakan
fisik pada jaringan.
Kadar amonia yang tinggi juga mempengaruhi permeabelitas tubuh ikan
terhadap air dan mengurangi konsentrasi ion dalam tubuh, meningkatkan
konsumsi oksigen pada jaringan, merusak insang dan mengurangi kemampuan
darah dalam melakukan transport oksigen. Ketika konsentrasi amonia
dilingkungan meningkat, eksresi amonia pada ikan akan turun sehingga kadar
konsentrasi amonia lingkungan yang tinggi secara terus-menerus akan
menurunkan pertumbuhan dan meningkatkan kerentanan terhadap penyakit.
Kadar amonia bebas yang tidak terionisasi (NH3) pada air tawar sebaiknya
tidak lebih 0,2 mg/liter, karena pada beberapa spesies ikan zat tersebut dapat
bersifat toksik. Pada kadar amonia 0,52 mg/liter, pertumbuhan tubuh ikan akan
turun hingga 50% dan tidak akan terjadi pertumbuhan pada konsentrasi 0,97
mg/liter. Kadar amonia yang tinggi merupakan salah satu parameter adanya
pencemaran bahan organik. Kadar amonia yang tinggi dapat terjadi pula pada
dasar danau yang mengalami deplesi oksigen (Effendy 2003).
UNESCO/WHO/UNEP (1992) menyampaikan bahwa kadar maksimum kualitas
air yang diperkenankan untuk kehidupan organisme akuatik adalah 1.37-2.2
mg/liter.
2.2.4 Nitrit Nitrogen (NO2-N)
Ion nitrit dibentuk dari nitrat (NO3-) atau ion amonium (NH4+) oleh
mikroorganisme tertentu yang dapat ditemukan di tanah dan air. Nitrit dihasilkan
dari dekomposisi feses dan sisa pakan oleh bakteri Nitrosomonas. Nitrit juga
merupakan produk intermediet antara amonium dan nitrat. Toksisitas nitrit
mungkin berhubungan dengan konsentrasi asam nitrit, yang tergantung pada suhu,
pH dan salinitas. Rendahnya pH akan meningkatkan pembentukan asam nitrit.
Selain itu toksisitas nitrit (atau asam nitrit) akan meningkat pada konsentrasi DO
rendah dan suhu yang tinggi.
Kalium dan klorida dapat meningkatkan toleransi ikan terhadap nitrit
karena ion-ion tersebut dapat bersaing dengan nitrit dalam transportasi melalui
epitel insang, sehingga dapat menurunkan jumlah pengambilan nitrit di air.
Penurunan pH akan meningkatkan toksisitas nitrit karena nitrit akan dikonversi
menjadi asam nitrit. Selain itu, toksisitas nitrit juga dipengaruhi oleh ukuran ikan,
oksigen terlarut, kandungan nitrit, status makanan dan infeksi (Effendy 2003).
Konsentrasi toksik nitrit berbeda-beda tergantung spesies, untuk salmoid
sekitar 0.3 mg/l NO2-N, dan catfish 13 mg/l NO2-N. Namun secara umum
konsentrasi nitrit yang aman bagi ikan adalah 0.6 mg/l NO2-N
(UNESCO/WHO/UNEP 1992). Saat nitrit diabsorbsi oleh ikan, nitrit akan
Hb+ NO2- Met-Hb
Nitrit akan mengoksidasi ferro (Fe2+) menjadi ferri (Fe3+). Hal ini meyebabkan
darah tidak dapat mengikat oksigen, sehingga toksisitas nitrit akan menyebabkan
aktivitas hemogloblin menurun. Toksisitas nitrit disebut methemoglobinaemia
(Murray 2000).
2.2.5 Nitrat Nitrogen (NO3-N)
Ion nitrat dibentuk oleh oksidasi lengkap dari ion amonium oleh
mikroorganisme yang berada dalam tanah, air dan atau akibat proses nitrifikasi
dari amonia. Bakteri yang berperan dalam nitrifikasi untuk mengubah nitrit
menjadi nitrat menjadi nitrogen bebas (N2) yang dapat terlepas dari sistem gas.
Reaksi ini dapat ditemukan pada biofilter dan lingkungan alamiah serta
bertanggung jawab untuk mempertahankan konsentrasi amonia dalam kisaran
yang layak. Nitrat (NO3-) umumnya tidak beracun bagi ikan, namun bila kadar
nitrat lebih dari 0,2 mg/liter dapat menyebabkan peningkatan jumlah nutrient di
dalam ekosistem air (eutrofikasi) dan selanjutnya menstimulasi pertumbuhan alga
dan tumbuhan air (blooming) (Effendy 2003). Blooming dapat menyebabkan
produksi destritus berlebihan sehingga menghabiskan suplai oksigen di perairan
dan menyebabkan kematian bagi ekosistem perairan (Prasetyo 2011).
Ledakan populasi fitoplankton yang diikuti dengan keberadaan jenis
fitoplankton beracun akan menimbulkan Ledakan Populasi Alga Berbahaya
(Harmful Algae Blooms – HABs). Faktor yang dapat memicu ledakan populasi
fitoplankton berbahaya antara lain karena adanya eutrofikasi upwelling yang
mengangkat massa air kaya unsur-unsur hara (Aunurohim et al. 2009).
Pencemaran antropogenik tergambarkan bila nitrat lebih dari 5 mg/liter. Hal ini dapat terjadi akibat kehadiran feses manusia atau hewan.
2.3 Stres
Stres adalah sejumlah respon fisiologis yang terjadi pada saat individu
mempertahankan homeostasis. Berbagai faktor yang mempengaruhi stres,
diantaranya adalah perubahan kebiasaan pola hidup secara draktis misal terhadap
makan dan minum, transportasi jarak yang jauh, perpindahan kolam lama ke
kolam baru, kehadiran predator, penanganan dan perlakuan yang kasar serta
Faktor lain yang menyebabkan stres adalah spesies ikan, kualitas dan
kuantitas ikan, bentuk kontainer, kuantitas sisa pakan dalam akuarium/kolam, dan
kecepatan laju kendaraan. Kondisi lingkungan turut menentukan tingkat stres, ini
meliputi temperatur, kelembaban, suara gaduh, ventilasi dan cahaya serta
perlakuan selama perjalanan.
Ikan mudah megalami stres. Hal ini biasanya akibat transportasi dari satu
lokasi ke lokasi lainnya misal dari kolam satu ke kolam lain, dari kolam satu ke
kolam pemasaran, atau dari kolam ke plastik pengemasan baik melalui
transportasi darat, udara maupun laut sering (Ross and Ross 1999). Selain itu,
faktor penyebab stres lainya adalah perubahan jenis pakan, perlakuan dari
karyawan atau petugas yang kasar, kepadatan ikan dalam kolam/akuarium/
kemasan plastik serta suara gaduh lingkungan.
Pada saat ikan mengalami stres, ikan akan mengeluarkan banyak tenaga
secara ekstra untuk menghadapi perubahan lingkungan yang mendadak. Ketika
terjadi perubahan suhu dalam air maka suhu tubuh ikan turut berubah-ubah. Ikan
menggunakan energi berlebihan untuk mempertahankan diri dalam waktu tertentu
sehingga energi untuk pertumbuhannya berkurang. Stres dapat mengakibatkan
daya tahan tubuh ikan menurun bahkan menyebabkan kematian.
2.4 Koi herpesvirus (KHV)
Virus herpes banyak terdapat di lingkungan, tipe virus ini mampu menyerang
manusia dan hewan. Lebih dari 100 spesies virus herpes saat ini, delapan
diantaranya menyerang manusia dan bersifat zoonosis. Virus herpes termasuk
dalam tipe virus yang memiliki ukuran besar dibandingkan dengan virus yang
lainnya. Secara morfologi, anggota virus herpes memiliki struktur yang serupa satu
dengan yang lainnya.
Morfologi struktur dari virus herpes dari arah dalam keluar terdiri dari
genom DNA utas ganda linier (double helix linear), berbentuk toroid, kapsid,
lapisan tegumen, dan selubung. Kapsid terdiri atas protein yang tersusun dalam simetri
ikosahedral. Tegumen yang terdapat diantara kapsid dan selubung merupakan massa
fibrous dengan ketebalan yang bervariasi.
Amplop virus bersifat sedikit pleomorphic (mampu berubah bentuk),
diproyeksikan dengan banyaknya duri (spike) yang menyebar merata di seluruh
permukaan virus herpes. Nukleokapsid virus herpes dikelilingi oleh kulit yang terdiri
dari bahan globular yang sering asimetris. Virus herpes memiliki total panjang
genom 120.000-220.000 nm dengan rasio guanine dan cytosine 35-75 % (Fenner et al.
1993 ).
2.4. 1 Klasifikasi Herpesviridae
Herpesviridae diklasifikasikan menjadi 3 sub famili yaitu Alphaherpesvirus,
Betaherpesvirus dan Gammaherpesvirus. Sub-famili Alphaherpesvirus memiliki 2 genus
yaitu Simplexvirus dan Varicellovirus. Betaherpesvirus memiliki 3 genus yaitu
sitomegalovirus, muromegalovirus dan roseolovirus, sedang Gammaherpesvirus
memiliki 2 genus yaitu lymphocryptovirus dan rhadinovirus.
2.4.2Replikasi Virus Herpes
Virus herpes bereplikasi dalam metabolisme sel inang dengan menggunakan
asam nukleat. Virus yang menempel pada induk semang akan masuk dalam
metabolisme induk semang dan keluar dari sel induk semang dengan merusak
membran plasma (Sugiri 1992).
Awalnya peplomer glikoprotein amplop berfusi dengan reseptor sel inang.
Kemudian proteoglikan heparin sulfat (nukleokapsid) memasuki sitoplasma dengan
cara virion amplop berfusi dengan membran sel atau melalui vakuola fagositis.
Kompleks DNA-protein kemudian terbebaskan dari nukleokapsid dan memasuki
nukleus, menghentikan sintesis makromolekul sel inang. mRNA, protein dan ß
ditranskripsi oleh polymerase RNA II sel. RNA diubah menjadi mRNA dan ditranslasi
menjadi protein, yang menstimulasi terjadinya translasi mRNA ß menjadi protein ß.
Runutan replikasi, transkripsi dan translasi terjadi lagi. Replikasi DNA virus dengan
menggunakan beberapa protein, ß dan protein sel inang. Transkripsi terjadi dengan
terbentuknya mRNA dengan urutan terletak sepanjang genom, selanjutnya terjadi
translasi menjadi protein. Selama siklus dihasilkan lebih dari 70 protein tersandi-virus.
Replikasi DNA virus terjadi di nukleus (Fenner et al. 1993). Protein alfa dan beta
merupakan enzim dari protein lain yang akan berikatan dengan DNA genom virus
(Sugiri 1992).
Transkripsi DNA virus terjadi sepanjang siklus replikasi di dalam sel dengan
DNA virus selanjutnya dirakit menjadi virion pada membran inti sel. Pelepasan virion
dari sitoplasma keluar inti sel terjadi melalui struktur tubuler atau melalui proses
eksositosis vakuola yang berisi virion (Sugiri 1992).
2.5 Penyakit Koi Herpes Virus(KHV)
Penyakit KHV merupakan salah satu penyakit infeksius yang menyerang
spesies ikan Koi dan ikan Mas yang disebabkan oleh golongan virus DNA. Di
Indonesia, kasus penyakit KHV diawali di Blitar pada tahun 2002 yang mana telah
terjadi kematian massal (80%-95%). Kira-kira akhir April 2002, kasus kematian ikan
Mas terjadi di Subang serta kasus serupa pada bulan Mei 2002 terjadi di sentra
budidaya ikan Mas di daerah Cirata, Jawa Barat. Wabah penyakit KHV kembali
terjadi di daerah Lubuk Linggau, Sumatra Selatan pada bulan Februari 2003 dengan
gejala yang ditimbulkan sama seperti yang ditemukan pada ikan Mas di pulau Jawa.
Kemudian wabah terus menyebar di propinsi sekitarnya termasuk Bengkulu, dan
Jambi. Wabah KHV di Indonesia telah menyebar sampai ke Denpasar (Bali),
Banyuwangi, Tulungagung, Blitar, Malang, Kediri, dan Surabaya (Jawa Timur),
Semarang dan Brebes (Jawa Tengah), Subang, Bogor, Bandung, Purwakarta, Cianjur,
dan Bekasi (Jawa Barat), Banten, dan Lampung, Bengkulu, dan Sumatera Selatan
(Sumatra) (Pasaribu 2003).
Penyakit ini masuk ke Indonesia melalui perdagangan ikan lintas antar
negara (Pasaribu 2003). Penyakit ini menyebar sampai ke Eropa, Jepang, Rusia,
Israel, Korea, Amerika Serikat, Malaysia dan Indonesia (Kementerian Kelautan
dan Perikanan 2010). Sejak ada wabah penyakit KHV di Indonesia, produksi ikan
Koi dan ikan Mas mengalami penurunan yang drastis (Departemen Kelautan dan
Perikanan 2010).
2.5.1 Cara Penularan
Penyakit KHV ini menyebar melalui kontak langsung antara ikan sehat dan
ikan yang sakit, kontaminasi air, transportasi dan penanganan yang tidak higienis
seperti pergantian lingkungan. Secara morfologi KHV termasuk dalam golongan
herpesvirusyaitu virus yang memiliki bentuk ikosahedral dengan diameter 100 nm. Koi
herpesvirus pada umumnya dapat hidup dan memperbanyak diri pada temperatur
2.5.2 Gejala Klinis
Ikan yang terinfeksi penyakit KHV akan memperlihatkan gejala penurunan
nafsu makan, lemah, penurunan permeabelitas mukosa kulit dan insang. Penurunan
permeabelitas mukosa kulit ini menyebabkan kulit tampak kering, hemorrhagi pada
sirip dan kulit, nekrosa sel insang atau menjadi nekrosis pada ujung lamela (OATA
2001; Departemen Kelautan dan Perikanan 2010). Ikan yang terserang penyakit ini
akan sedikit banyak mengalami perubahan tingkah laku antara lain ikan berenang di
permukaan air, berkumpul mendekati sumber aerasi, gerakan yang kurang terkontrol,
dan terlihat dispnoe pada permukaan air.
2.5.3 Perubahan Makroskopis
Pada pemeriksaan perubahan makroskopis ditemukan adanya nekrosa pada
insang, sisik, sirip, ekor, ginjal, limpa, dan hati (Sunarto 2005). Belakangan ini
perubahan makroskopis akibat infeksi virus KHV jarang muncul, namun ikan yang
terinfeksi KHV biasanya mati mendadak.
2.5.4 Diagnosa
Diagnosa penyakit KHV sampai saat ini dengan 3 cara yaitu berdasar gejala
klinis dan perubahan makroskopis, pemeriksaan histopatologi dan pemeriksaan biologi
molekuler dengan metode PCR. Diagnosa berdasar perubahan kondisi fisik atau sakit
dengan gejala klinis dan perubahan makroskopis digolongkan ke dalam level 1, dan
pemeriksaan histopatologi digolongkan dalam cara diagnosa penyakit ikan pada level 2.
Diagnosa penyakit ikan dalam level tertinggi adalah pemeriksaan biologi molekuler
dengan metode PCR yaitu termasuk dalam level 3 (Departemen Kelautan dan
Perikanan 2007). Penggolongan level diagnosa penyakit ini disesuaikan dengan fasilitas
peralatan yang ada. Diagnosa penyakit pada level 1 biasanya dilakukan oleh para
petugas lapang dan stasion kelas 2. Diagnosa penyakit pada level 2 dilakukan oleh para
petugas di laboratorium dan stasion kelas 1 karantina ikan, sedangkan diagnosa
penyakit pada level 3 dilakukan oleh petugas laboratorium virologi pada Balai Besar
dan Balai Riset dalam Departemen Kelautan dan Perikanan.
Selain itu diagnosa KHV dapat dilakukan dengan cara isolasi virus pada
kultur jaringan. Sel yang digunakan adalah sel fibroblast dari Koi Tail (KT). Supernatan
homogenat dari bagian ikan yang dianggap sakit di inokulasikan dalam KT, kemudian
Setelah diinokulasikan, virus dapat terdeteksi dengan terlihatnya efek sitopatik yang
cepat dalam kultur sel (Sunarto 2005).
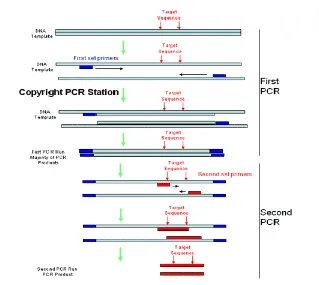
2.6 Polymerase Chain Reaction (PCR)
2.6.1 Single PCR
PCR merupakan suatu teknik perbanyakan (amplifikasi) potongan DNA
secara in vitro pada daerah spesifik yang dibatasi oleh dua buah primer
oligonukleotida. Primer yang digunakan sebagai pembatas daerah yang
diperbanyak adalah DNA untai tunggal yang urutannya komplemen dengan DNA
templatenya. Proses tersebut mirip dengan proses replikasi DNA secara in vivo
yang bersifat semi konservatif. Teknik ini mampu memperbanyak sebuah urutan
105-106 kali lipat dari jumlah nanogram DNA template (Stephenson 2003). PCR
dilakukan dengan bantuan alat yang disebut thermocycler (Muladno 2010).
Dalam proses PCR membutuhkan 4 komponen utama, yaitu (1) DNA
template, (2) oligopolisakarida primer, (3) deoxyribonucleotida triphosphate dan
(4) enzim polymerase. DNA template adalah frakmen DNA yang akan
dilipatgandakan. Oligopolisakarida primer adalah suatu sekuen pendek dari
oligonukleotida yaitu antara 15-25 basa nukleotida yang akan digunakan untuk
mengawali sintesis rantai DNA. Deoxiribonucleotida triphosphate sering disebut
dNTP, ini terdiri dari dATP, dCTP, dGTP dan dTTP. Enzim polymerase adalah
enzim yang melakukan katalisis reaksi sintesis rantai DNA. Komponen lain yang
juga penting adalah senyawa buffer (Yuwono 2006).
Reaksi pelipatgandaan suatu frakmen DNA dimulai dengan melakukan
denaturasi DNA template sehingga rantai DNA yang berantai ganda akan
dipisahkan menjadi rantai tunggal. Denaturasi menggunakan panas (90 C) selama
1-2 menit, kemudian suhu diturunkan menjadi 55 C selama 1-2 menit, sehingga
primer menempel (annealing) pada cetakan terpisah menjadi rantai tunggal.
Primer akan membentuk jembatan hidrogen dengan template pada daerah sekuen
yang komplementer dengan sekuen primer (Glick dan Pasternak 1998).
Pada single PCR membutuhkan sepasang primer untuk proses annealing.
Primer pertama adalah oligonukleotida dalam primer ini mempunyai sekuen yang
identik dengan salah satu rantai DNA template pada ujung 5’-fosfat, primer kedua
DNA template yang lain. Setelah proses annealing, suhu inkubasi ditingkatkan
menjadi 72 C selama 1,5 menit. Pada suhu ini, DNA polymerase akan melakukan
proses polimerase rantai DNA yang baru berdasarkan informasi yang ada pada
DNA template. Setelah polimerasi, rantai DNA yang baru akan membentuk
jembatan hidrogen dengan DNA template . DNA rantai ganda akan terbentuk
dengan adanya ikatan hidrogen antara DNA template dengan rantai DNA baru
hasil polimerasi, selanjutnya akan didenaturasi lagi. Rantai DNA yang baru
tersebut akan berfungsi sebagai cetakan bagi reaksi polimerasi berikutnya
(Yuwono 2006).
Proses amplifikasi tersebut diulang lagi sampai 25-30 kali/siklus sehingga
pada akhir siklus akan mendapatkan molekul-molekul DNA rantai ganda yang
baru hasil polimerasi dalam jumlah yang jauh lebih banyak dibandingkan dengan
jumlah DNA cetakan yang digunakan. Banyaknya siklus amplifikasi tergantung
pada DNA target di dalam campuran reaksi (Glick dan Pasternak 1998).
Hasil amplifikasi ini dapat divisualisasikan dengan mata telanjang setelah
melewati proses elektroforesis dengan menggunakan gel poliakrilamida atau gel
agarose. Prinsip elektroforesis adalah molekul DNA bermuatan negatif pada pH
netral akan bermigrasi ke arah yang bermuatan positif. Migrasi molekul DNA
pada gel elektroforesis dipengaruhi oleh komposisi dan kelarutan ion buffer
elektroforesis. Beberapa buffer yang digunakan diantaranya Tris Asetate EDTA
(TAE), Tris pHospate EDTA (TBE) dan Tris Borate EDTA (TPE), serta buffer
alkalin elektroforesis (Sambrook et al. 1989). Pada saat elektroforesis, molekul
DNA akan berikatan dengan ethidium bromida (EtBr) sehingga molekul DNA
Gambar 2 Proses amplifikasi ekstrak DNA dalam thermocycler
2.6.2 Nested PCR
Ada berbagai metode PCR, diantaranya adalah Nested PCR. Metode
Nested PCR ini biasanya digunakan untuk mendiagnosa suatu penyakit dengan
tingkat sensitifitas dan spesifisitas yang tinggi.
Pada prinsipnya, nested PCR menggunakan 2 pasang primer dengan 2
kali/siklus amplifikasi, hal ini berbeda dengan PCR biasa atau single PCR yang
mana hanya menggunakan 1 pasang primer dengan 1 kali siklus amplifikasi. Oleh
karenanya nested PCR lebih sensitif dan spesifik dibandingkan dengan single
PCR, sehingga mampu untuk mendeteksi virus/bakteri dalam jumlah sedikit.
Tabel 1 Master mix I dari nested PCR
Total Mastermix Volume: 40 µl
DNA Template 10 µl
Primer mix. Forward and Reverse
primers (5 pmoles/µl each)
4 µl
Total Mastermix Volume: 49 µl
DNA Template (Sample from external round PCR product)
1 µl
Tabel 3 Siklus amplifikasi-nested PCR
PCR Machine Cycling Parameters For Both External and Internal PCR Rounds
94ºC/30 sec 1 cycle
III. METODOLOGI
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Virologi dan Uji Coba Balai
Riset Kelautan dan Perikanan Jakarta, Laboratorium Kesehatan Satwa Akuatik
FKH-IPB, Laboratorium Virologi dan Uji Coba Balai Besar Karantina Ikan
Makassar, dan Laboratorium Kualitas Air Fakultas Kelautan dan Ilmu Perikanan
Universitas Hasanuddin Sulawesi Selatan. Penelitian ini dilakukan mulai bulan
November 2010 sampai Oktober 2011.
3.2 Materi dan Metode Penelitian
3.2.1 Materi Penelitian
Alat dan bahan yang digunakan dalam penelitian ini adalah akuarium,
termometer, cecker water quality, aerator dan ikan Koi dari daerah bebas KHV
Takkalar, Sulawesi Selatan, untuk uji coba infeksi dan kohabitasi. Alat lain yang
digunakan adalah scalpel, pinset, timbangan, cawan petri, mortar-pastel,
sentrifuse, filter 0.45µl, tabung mikro, tissue steril dan bahan yang digunakan
adalah insang suspect KHV dan phosphate buffer saline (PBS) pH 7.1 untuk
membuat suspensi KHV 10%. Selain itu, bahan yang digunakan adalah
mikropipet, tabung mikro, blok pemanas, sentrifuse, incubator, pestel, vortex,
tissue steril dan bahan berupa ethanol 95%, lysis buffer dan ddH2Ountuk ekstraksi
DNA. Alat thermal cycler dengan blok sampel 0.2 ml, peralatan elektroforesis,
UV illuminator, vortex mixer, mikropipet dan camera digital foto system
merupakan rangkaian peralatan untuk uji PCR. Dalam uji PCR ini menggunakan
ekstrak DNA, bahan ethidium bromide (EtBr), ethanol 95%, TAE atau TBE
elektroforesis buffer, agarose dan Kit IQ 2000TM KHV.
3.2.2 Metode Penelitian
3.2.2.1 Identifikasi Koi herpesvirus dari Organ Insang Ikan Koi dengan
Metode Nested PCR
Sampel ikan Koi yang diduga sakit akibat serangan KHV diambil dari
kolam ikan Koi milik petani. Ikan Koi tersebut dinekropsi dan diambil organ
insangnya, kemudian disimpan dalam freezer -80 OC. Untuk membuktikan adanya
(Gilad et al. 2002; Anonim 2006) dan agar didapatkan produk PCR yang lebih
sensitif dan spesifik maka digunakan metode nested PCR sebagaimana
diungkapkan oleh Srisuvan et al. (2010).
Pada penelitian ini dilakukan dengan tiga tahapan yaitu ekstraksi DNA
sampel, amplifikasi DNA, dan analisa hasil PCR. Hasil ekstraksi DNA
diamplifikasi menggunakan PCR-KIT IQ2000TM KHV dan dilakukan dengan 2
tahap running pada alat thermocycler.
Running tahap pertama adalah denaturation 94 OC (20 detik), annealing
62 OC (20 detik), extention 72 OC (20 detik), elongasi 72 OC (30 detik) dan 20 OC
(30 detik). Running tahap kedua adalah denaturasi 94 OC (20 detik), annealing
60 OC (20 detik), extention 72 OC (20 detik), elongasi pada 72 OC (30 detik) dan
20 OC (30 detik). Running tahap pertama dilakukan sebanyak 15 siklus sedang
running tahap kedua sebanyak 30 siklus (Farming IntelliGene Tech Corp 2010).
Hasil amplifikasi DNA dielektroforesis dengan menggunakan gel agarose
2% dan Ethidium bromida (EtBr) pada100 Voltage selama 40 menit. Menurut
Stephenson (2003), molekul DNA dan EtBr akan reaksi dan terpendar dibawah
lampu ultraviolet (UV trans-iluminator). Hasil elektroforesis ini dapat
divisualisasikan dan dibaca dengan alat geldoc XR.
Gambar 4 Pola standar dan sampel positif dengan PCR-KIT IQ2000 TM KHV: lane (1) standar 1 adalah 2000 copies/reaksi (kontrol positif), (2) standar 2 adalah 200 copies/reaksi (kontrol positif), (3) standar 3 adalah 20 copies/reaksi (kontrol positif), (4) ddH2O, (5) sampel dengan infeksi KHV berat, (6) sampel dengan infeksi KHV ringan, (7) sampel negatif KHV, dan (M) masker 848bp, 630bp, 333bp (www.iq2000kit.com).
Virus KHV dapat diidentifikasi secara kuantitatif dengan menggunakan
spektrofotometer nanodrof (Muladno 2010) dan semikualitatif dengan metode
nested PCR. Pada penelitian ini uji nested PCR menggunakan PCR-KIT
kuantitatif yaitu terjadi 20 copies DNA, 200 copies DNA dan 2000 copies DNA
(www.iq2000kit.com). Pada identifiksasi secara semikualitatif, tervisualisasi pada
229 bp, 440bp dan 630bp yang mana secara berurutan ini telah tersirat pada
band 1, 2 dan 3 (Gambar 4). Identitas marker adalah 333 bp, 630 bp dan 848 bp
(Farming IntelliGene Tech Corp, 2010).
3.2.2.2 Ekstraksi Organ dan Pembuatan Suspensi Koi herpesvirus 10%
Insang dari ikan positif Koi herpesvirus diekstraksi dan dibuat suspensi
dengan konsentrasi 10%. Yaitu dalam suasana dingin (-4 C), insang diekstraksi
dan dilarutkan dalam PBS pH 7,1 dengan perbandingan 1 gram insang dan 9 ml
PBS. Larutan tersebut disentrifuse pada 5000 rpm selama 5 menit kemudian
suspensinya difilter pada 0,45µm.
3.2.2.3 Infeksi Suspensi Koi herpesvirus 10% pada Ikan Koi Bebas KHV
Ikan yang akan digunakan adalah ikan-ikan bebas KHV. Ikan-ikan yang
baru datang diaklimatisasi terlebih dahulu minimal selama 1 minggu, selajutnya
dikelompokan menjadi 8 kelompok yaitu 1A, 1B, 2A, 2B, 3A, 3B, 3B, 4A dan
4B. Enam kelompok pertama merupakan kelompok ikan perlakuan dan 2
kelompok lainnya adalah kelompok kontrol. Masing-masing 5 ekor ikan pada
setiap kelompok diinokulasi dengan suspensi virus KHV 10% sebanyak 0,1 ml
secara intra peritoneal namun kelompok 1B, 2B dan 3B diberi 5 ekor ikan
kohabitasi tanpa diberi suspensi virus KHV 10%.
3.2.2.4 Perlakuan Suhu Ekstrim
Perlakuan suhu ekstrim ini dilakukan pada 7 kelompok pertama, dan tidak
pada kelompok ke-8. Yaitu setelah ikan diinfeksi, ikan-ikan tersebut diberi
perlakuan suhu ekstrim yaitu suhu air disuasanakan menjadi 18-19 OC selama 14
jam pada malam hari dan 30-31 OC selama 10 jam pada siang hari. Suhu 18-19 OC
dapat dicapai dan dipertahankan dengan cara memasukkan es balok yang
dibungkus dalam plastik dan mengganti es balok secara periodik atau 2.5 sampai 3
jam sekali. Agar suhu 30-31 OC dapat dicapai dan dipertahankan, maka dilakukan
dengan mengatur jendela ruang Laboratorium Uji Coba BBKI Makassar,
Tabel 4 Disain cekaman suhu terhadap infeksi virus KHV
Keterangan Kelompok ikan (Ekor)
1 2 3 4 1A 1B 2A 2B 3A 3B 4A 4B
Suspensi virus KHV 10% (630bp) (440bp) (229bp) (630bp)
∑ikan disuntik 0,1 ml IP 5 5 5 5 5 5 5 5
∑ikan kohabitasi 0 5 0 5 0 5 0 0
Cekaman suhu ekstrim
(18-19 C ke/dari 30-31 C) √ √ √ √ √ √ √ -
3.2.2.5 Pengamatan Ikan Coba Berdasarkan Waktu, Diagnosa Penyakit dan
Kualitas Air
Ikan yang telah diinjeksi diamati setiap hari selama masa infeksi yaitu 14
hari. Parameter pengamatan ikan yang terinfeksi berdasarkan waktu, diagnosa
penyakit dan kualitas air. Diagnosa penyakit berdasar gejala klinis, perubahan
makroskopis, dan pemeriksaan biologi molekuler metode nested PCR. Pengukuran
kualitas air dilakukan dengan menggunakan alat cecker water quality setiap 2.5
sampai 3 jam sekali. Selain itu kualitas air diukur dengan menggunakan alat
spektrofotometer. Cecker waterquality digunakan untuk mengidentifikasi kualitas
air berupa pH, suhu, salinitas, oksigen terlarut (DO), sedang spektrofotometer untuk
mengetahui kadar nitrit (NO2), nitrat (NO3) dan amonia (NH3).
3.3 Analisa Data
IV. HASIL DAN PEMBAHASAN
4.1 Isolasi dan Identifikasi Koi herpesvirus
Ada 12 sampel ikan Koi yang di duga sakit dan diberi kode sampel yaitu
D138, D139, D140, D141, D142, D143, D144, D145, D146, D147, D148 dan D149.
Setelah dilakukan pemeriksaan dengan metode PCR ternyata ada 5 dari 12 sampel
yang positif terhadap KHV yaitu sampel ikan koi yang diberi kode D139 (lane 2)
tertera pada 229bp, D143 (lane 6) tertera 440 bp,D144 (lane 7) tertera pada 630
bp, D147 (lane 10) tertera pada 440 bp dan D149 (lane 12) tertera pada 630 bp
(Gambar 5).
Gambar 5 Isolasi dan identifikasi Koi herpesvirus dengan metode PCR (A): lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, lane 1,3,4,5,8,9 dan
11 adalah sampel insang ikan coba negatif KHV, lane 2, 6, 7, 10 dan 12 adalah sampel positif KHV
4.2 Ekstraksi Organ dan Pembuatan Suspensi Koi herpesvirus 10%
Pada penelitian ini, organ insang diekstraksi dan dibuat suspensi dengan
konsentrasi 10% yaitu dengan perbandingan 1 gram organ insang dan 9 ml PBS
pH 7.1. Sampel organ yang digunakan berasal dari kode D139, D143 danD144
(sampel asal lapang) dan M628 (isolat KHV asal Balai Besar Karantina Ikan
Makassar). Hal ini dilakukan dengan pertimbangan sampel mempunyai perbedaan
kuantitas copies DNA dan semikualitas. Secara berurutan, semikualitas dari D139,
D143, D144 dan M628 pada uji nested PCR adalah 229 bp, 240 bp, 630 bp dan 630
bp. Nilai semikualitatif tersebut setara dengan kuantitas/jumlah copies DNA yang
mana 229 bp setara 20 copies DNA, 240 bp setara 200 copies DNA dan 630 bp setara
2000 copies DNA.
4.3 Injeksi Suspensi virus KHV 10% pada Ikan Coba
Suspensi virus KHV 10%diinjeksikan pada 5 ekor ikan coba dari
masing-masing kelompok. Injeksi tersebut dilakukan secara intra peritoneal sebanyak 0.1
ml/ekor. Suspensi virus KHV dengan kode D144 diinjeksikan untuk kelompok ikan
1A dan 1B, D143 untuk kelompok 2A dan 2B serta D139 untuk kelompok ikan 3A
dan 3B. Ikan-ikan pada kelompok 4A dan 4B diinjeksi suspensi KHV 10% berkode
M628.
4.4 Diagnosa
Ikan-ikan coba dinyatakan sakit setelah dilakukan 3 macam pemeriksaan
yaitu berdasarkan gejala klinis dan perubahan makroskopis (level 1) serta
pemeriksaan biologi molekuler dengan metode PCR (level 3) (Anonim, 2007).
4.4.1 Gejala Klinis
Secara umum ikan menunjukkan gejala klinis yang hampir sama,
tergantung tingkat keparahannya. Ikan sakit akan mendekati pusat aerasi, mata
cekung, sirip punggung dan ekor ptechiae dan geripis, ikan berada di tepi dan
gerakan menjadi tidak seimbang, lesi pada ekor, lesi pada sisik bahkan mati tanpa
gejala klinis (Gambar 6 dan Tabel 5).
Gambar 6 Ikan menunjukkan gejala klinis suspect KHV: (a) mendekati aerasi, (b) mata cekung, (c) ikan berada di tepi, (d dan e) ikan kohab tertular penyakit dan
(f) gerakan tidak seimbang
a
d c
b
Tabel 5 Gejala klinis pasca infeksi suspensi virus KHV 10%
Gejala Klinis Kelompok Ikan Coba (Ekor)
1 2 3 4 A B A B A B A B
Mata cekung 2 3 1 4 0 0 2 0
Gerakan lambat 4 4 3 7 0 0 3 0
Gerakan tidak seimbang 2 4 3 5 0 0 2 0
Ikan selalu di tepi akuarum 4 8 3 6 0 0 3 0
Ikan tidak mau makan 4 6 3 7 0 0 1 0
Ikan mati mendadak
tanpa gejala sakit 0 1 0 0 0 0 0 0
4.4.2 Perubahan Makroskopis
Setelah dilakukan nekropsi dan pemeriksaan makroskopis ternyata
ikan-ikan tersebut menunjukkan perubahan makroskopis. Secara umum, perubahan
makroskopis tersebut berupa ptechiae pada ekor, sirip punggung dan sirip dada,
ptechiae dan nekrosis pada ekor, hemmorhagi pada bagian caudal, nekrosis pada
kulit bagian caudal dan ekor, bercak putih ringan pada insang, nekrosis pada
insang dan ptechiae pada ginjal (Gambar 7 dan Tabel 6).
a b c
Gambar 7 Perubahan makroskopis suspect KHV: (a)ptechiae pada ekor, (b) ptechiae pada sirip punggung, (c) ptechiae dan nekrosis pada ekor, (d)
ptechiae pada sirip dada, (e) hemmorhagi pada bagian caudal, (f)nekrosis pada
kulit bagian caudal dan ekor, (g) bercak putih ringan pada insang, (h) nekrosis pada insang, dan (i) ptechiae pada ginjal
Tabel 6 Perubahan makroskopis pasca infeksi virus KHV 10%
Keterangan
Kelompok Ikan Uji Coba (Ekor)
1 2 3 4
4.4.3 Pemeriksaan Biologi Molekuler dengan Metode Nested PCR
Nested PCR adalah salah satu teknik untuk mendiagnosa suatu penyakit
dengan tingkat sensifitas dan spesifitas yang tinggi. Nested PCR dilakukan 2 kali/
siklus amplifikasi dengan menggunakan 2 pasang primer sehingga dapat
mendeteksi material dalam jumlah sedikit.
Mekanisme kerja dari Nested PCR adalah memperbanyak potongan DNA
dengan bantuan enzim DNA polymerase dan dua pasang primer. Pasangan
primer pertama akan mengamplifikasi fragmen dengan cara kerja mirip single
PCR atau PCR biasa. Pasangan primer kedua biasanya disebut nested primers
yang berikatan di dalam fragmen DNA (produk PCR) pertama untuk
memungkinkan terjadinya amplifikasi produk PCR yang kedua, yang mana
hasilnya lebih pendek dari primer pertama. Dengan menggunakan nested PCR,
jika ada fragmen yang salah diamplifikasi maka kemungkinan bagian tersebut
diamplifikasi untuk kedua kalinya oleh primer yang kedua sangat rendah. Dengan
demikian, nested PCR adalah salah satu teknik PCR yang sangat spesifik dalam
melakukan amplifikasi (http://www.pcrstation.com/nested pcr/).
Pada penelitian ini digunakan metode uji biologi molekuler nested PCR
dengan menggunakn Kit IQ2000TM spesifik terhadap KHV. Pada uji nested PCR
ini dilengkapi dengan 2 pasang primer yang lebih sensitif dan spesifik dalam
mendiagnosa KHV. Namun nested PCR pada prosedur IQ2000TM ini hanya dapat
mendeteksi virus KHV pada batas jumlah copies DNA tertentu. Deteksi virus
KHV dari sampel organ insang sebanyak 20-1000 copies DNA, sampel larva <
1cm sebanyak 20-10.000 copies DNA dan hasil swab sebanyak 20-200 copies
DNA, sedangkan deteksi virus KHV dari sampel DNA plasmid KHV sebanyak 2
copies DNA KHV. Jumlah copies DNA tersebut menentukan sensitifitas dan
spesifisitas dalam deteksi virus KHV (Farming IntelliGene Tech Corp 2010).
Gen target dari primer KIT IQ2000TM KHV adalah 2 pita DNA utama
yaitu pita DNA dengan panjang 229 bp dan atau 440 bp. Namun dapat pula
terbentuk pada panjang 630bp (Farming IntelleGene Tech Corp 2010). Pita DNA
yang tervisualisasi pada 229bp setara dengan 20 copies DNA. Pita DNA yang
tervisualisasi pada 440bp setara dengan 200 copies DNA. Pita DNA yang
tervisualisasi pada 630bp setara dengan 2000 copies DNA (www.iq2000kit.com).
Sunarto (2007) mengungkapkan bahwa pita DNA yang terbentuk pada panjang
630 bp merupakan bentuk visualisasi dari kasus KHV dengan tingkat virulensi
yang sangat tinggi.
Pada penelitian ini, visualisasi dari produk PCR terlihat pada pita DNA
kedua yang tersekuensing sebanyak 440 basepare (bp). Yang mana produk PCR
ini merupakan hasil dari amplifikasi primer pertama yaitu forword-1 dan reverse
-1. Setelah amplifikasi dengan primer pertama selesai, amplifikasidilanjutkan oleh
primer kedua yaitu forword-2 dan reverse-2 dan menghasilkan produk PCR kedua
yang tertera pada pita DNA pertama 229 bp. Selanjutnya akhir dari running pada
amplifikasi kedua, primer pertama dan primer kedua tercampur sehingga muncul
pita DNA ketiga yang tersekuensing pada 630bp.
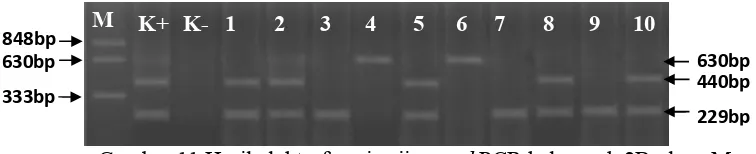
Lima dari 12 sampel organ insang ikan Koi positif KHV, 3 diantaranya
digunakan sebagai stock virus karena mempunyai perbedaan kuantitas dan
berkode D139, D143, D144 dan M628. Yang mana isolat virus KHV dengan
kode D139 berstatus positif KHV dengan panjang 229bp dan setara dengan 20
copies DNA, D143 berstatus positif KHV dengan panjang 440bp dan setara
dengan 200 copies DNA, dan D144 berstatus positif KHV dengan panjang 630bp
dan setara dengan 2000 copies DNA. Pada virus M628 mempunyai kuantitas dan
semikuantitas sama dengan isolat virus KHV berkode D144. Oleh karenanya
isolat D139 dikategorikan positif (+), isolat D143 dikategorikan positif (++),
isolat D144 dan M628 dikategorikan positif (+++).
Berdasarkan hasil pemeriksaan biologi molekuler dengan metode Nested
PCR, masing-masing kelompok ikan coba menunjukkan hasil elektroforesis uji
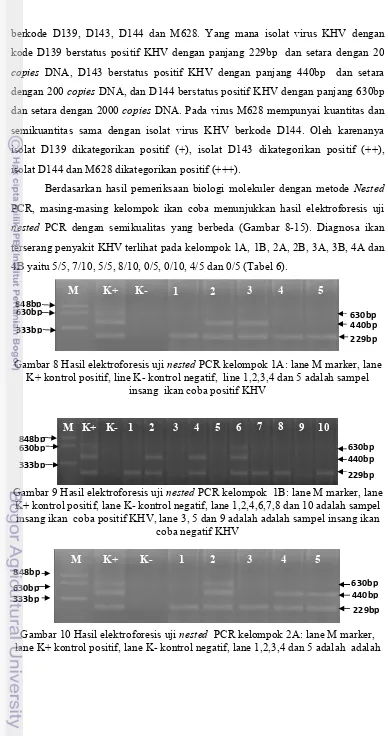
nested PCR dengan semikualitas yang berbeda (Gambar 8-15). Diagnosa ikan
terserang penyakit KHV terlihat pada kelompok 1A, 1B, 2A, 2B, 3A, 3B, 4A dan
4B yaitu 5/5, 7/10, 5/5, 8/10, 0/5, 0/10, 4/5 dan 0/5 (Tabel 6).
Gambar 8 Hasil elektroforesis uji nested PCR kelompok 1A: lane M marker, lane K+ kontrol positif, line K- kontrol negatif, line 1,2,3,4 dan 5 adalah sampel
insang ikan coba positif KHV
Gambar 9 Hasil elektroforesis uji nested PCR kelompok 1B: lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, lane 1,2,4,6,7,8 dan 10 adalah sampel
insang ikan coba positif KHV, lane 3, 5 dan 9 adalah adalah sampel insang ikan coba negatif KHV
Gambar 10 Hasil elektroforesis uji nested PCR kelompok 2A: lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, lane 1,2,3,4 dan 5 adalah adalah
sampel insang ikan coba positif KHV
Gambar 11 Hasil elektroforesis uji nested PCR kelompok 2B: lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, , lane 1,2,3,5,7,8,9, dan
10 adalah sampel insang ikan coba adalah positif KHV, lane 4 dan 6 adalah adalah sampel insang ikan coba negatif KHV
Gambar 12 Hasil elektroforesis uji nested PCR kelompok 3A: lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, lane1,2,3,4 dan 5 adalah adalah
sampel insang ikan coba negatif KHV
Gambar 13 Hasil elektroforesis uji nested PCR kelompok 3B: lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, lane 1,2,3,4,5,6,7,8,9 dan 10
adalah adalah sampel insang ikan coba negatif KHV
Gambar 14 Hasil elektroforesis uji nested PCR kelompok 4A: lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, lane 1,3,4 dan 5 adalah adalah sampel insang ikan coba positif KHV, lane 2 adalah adalah sampel insang ikan
Gambar 15 Hasil elektroforesis uji nested PCR kelompok 4B: lane M marker, lane K+ kontrol positif, lane K- kontrol negatif, lane 1,2,3,4 dan 5 adalah adalah
sampel insang ikan coba negatif KHV
Tabel 7 Hasil pemeriksaan sampel insang dengan metode nested PCR
Kelompok
Ikan Coba Hasil pemeriksaan dengan metode PCR
1 2 3 4 5 6 7 8 9 10
Ikan coba yang telah diinjeksi virus KHV10% telah menunjukkan aktivitas
virus KHV dalam tubuh. Bahkan ikan coba yang sakit telah menularkan virus
KHV pada ikan-ikan kohabitasi yang berada dalam satu akuarium. Hal ini terlihat
dengan adanya gejala klinis, perubahan makroskopis dan konfirmasi dari uji
nested PCR. Diagnosa penyakit KHV pada kelompok 1A terdapat 5/5 ekor,
kelompok 1B terdapat 7/5 ekor, 2A terdapat 5/5 ekor, 2B terdapat 8/5 ekor dan 4ª
terdapat 4/5 ekor namun tidak terjadi pada kelompok 3A, 3B dan 4B (Tabel 8).
Tabel 8 Diagnosa Penyakit KHV
Keterangan
Kelompok Ikan (Ekor) 1A 1B 2A 2B 3A 3B 4
∑ikan di diagnosa sakit akibat
penyakit KHV 5/5 7/10 5/5 8/10 0/5 0/10 4/5 0/5
M K+ K- 1 2 3 4 5
333bp 333bp
4.5 Patogenesa Penyakit KHV
Transmisi virus KHV melalui kontak langsung dengan ikan terinfeksi,
dengan ekskreta ikan yang terinfeksi dan/ atau dengan air atau lumpur dari ikan
yang terinfeksi. Gejala klinis akan muncul setelah melewati masa inkubasi selama
4-5 hari sejak proses penginfeksian, namun masa inkubasi akan bertambah
panjang tergantung suhu dan faktor lainnya. Setelah virus KHV masuk dalam sel,
virus akan bereplikasi dalam inti sel menyebabkan inti sel membengkak dan
membentuk benda inklusi intra nuclear dan ini dapat digunakan sebagai bahan
diagnose penyakit KHV.
4.6 Cara Penularan KHV
Penyakit KHV ini menyebar melalui kontak langsung antara ikan terjangkit
sakit dan ikan sehat, kontaminasi air, transportasi, dan penanganan seperti pergantian
lingkungan serta fluktuasi temperatur (Sunarto 2005). Pada penelitian ini, kelompok
1B, 2B dan 3B terdiri dari 5 ekor ikan injeksi dan 5 ekor ikan kohabitasi. Setelah
diberi perlakuan suhu ekstrim, ikan-ikan kohabitasi terlihat sakit bahkan kematian
pada hari ke-9 dan ke-11. Hal ini akibat air dalam akuarium terkontaminasi oleh
virus KHV dari ikan yang diinjeksi virus KHV dan/atau kontak langsung . Secara
berurutan kelompok, ada 2/5, 3/5 dan 0/5 ekor ikan kohabitasi terlihat sakit.
4.7 Kualitas Air, Cekaman Suhu dan Stres
Air merupakan media hidup bagi organisme perairan yang sangat
mendukung dalam pertumbuhan dan kelangsungan hidup akuatik. Setiap jenis
ikan memiliki batas toleran yang berbeda-beda dan dinyatakan dengan kisaran
nilai tertentu. Ada beberapa parameter kelayakan perairan yang disebut dengan
kualitas air. Parameter kualitas air ini digolongkan menjadi 2 yaitu secara fisika
dan kimia. Kualitas air tersebut diantaranya adalah pH, suhu, salinitas, oksigen
terlarut (DO), nitrit (NO2), nitrat (NO3) dan amonia (NH3) (Effendi 2003).
4.7.1 Power of hydrogen (pH)
Kualitas air sangat penting dalam budidaya ikan. Air yang kurang baik
akan menyebabkan ikan Koi mudah terserang penyakit. Power of hydrogen (pH)
turut menentukan kesuburan air. Perairan yang alkalis atau netral lebih produktif
daripada yang asam. Perubahan pH biasanya menimbulkan stres pada ikan. Pada
Menurut Tiara dan Muhananto (2011) bahwa ikan Koi dapat bertahan hidup pada
pH 6,5-8.
4.7.2 Salinitas
Ikan Koi dapat bertahan hidup pada salinitas 2-10 ppt (Effendy 2003).
Salinitas adalah konsentrasi total ion yang terdapat di perairan (Boyd 1988).
Salinitas mirip dengan klorida adalah klorida, bromida dan iodida. Pada penelitian
ini rata-rata nilai salinitas airnya adalah 0.1 ppt. Hal ini jauh dibawah standar
normal bagi kelayakan hidup ikan Koi.
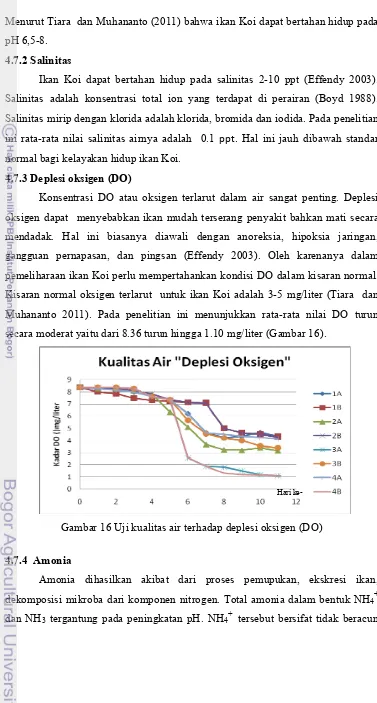
4.7.3Deplesi oksigen (DO)
Konsentrasi DO atau oksigen terlarut dalam air sangat penting. Deplesi
oksigen dapat menyebabkan ikan mudah terserang penyakit bahkan mati secara
mendadak. Hal ini biasanya diawali dengan anoreksia, hipoksia jaringan,
gangguan pernapasan, dan pingsan (Effendy 2003). Oleh karenanya dalam
pemeliharaan ikan Koi perlu mempertahankan kondisi DO dalam kisaran normal.
Kisaran normal oksigen terlarut untuk ikan Koi adalah 3-5 mg/liter (Tiara dan
Muhananto 2011). Pada penelitian ini menunjukkan rata-rata nilai DO turun
secara moderat yaitu dari 8.36 turun hingga 1.10 mg/liter (Gambar 16).
Gambar 16 Uji kualitas air terhadap deplesi oksigen (DO)
4.7.4 Amonia
Amonia dihasilkan akibat dari proses pemupukan, ekskresi ikan,
dekomposisi mikroba dari komponen nitrogen. Total amonia dalam bentuk NH4+
(Effendy 2003).. Ikan mampu bertahan hidup pada kualitas amonia 1.37-2.2
mg/liter (UNESCO/WHO/UNEP 1992). Pada penelitian ini, rata-rata kadar
amonia dari setiap akuarium meningkat yaitu antara 0.000 hingga 0.290 mg/liter
sejak ikan menunjukkan gejala klinis dan kematian pada hari ke-7 dan ke-8
(Gambar 17).
Gambar 17 Uji kualitas air terhadap amonia (NH3)
4.7.5 Nitrit (NO2)
Demikian halnya suhu yang tinggi dapat pula meningkatkan asam nitrit
yang bersifat toksik bagi ikan. Saat nitrit diabsorbsi oleh ikan, nitrit akan bereaksi
dengan hemoglobin membentuk methemoglobin. Nitrit akan mengoksidasi ferro
(Fe2+) menjadi ferri (Fe3+). Hal ini meyebabkan darah tidak dapat mengikat
oksigen, sehingga toksisitas nitrit akan menyebabkan penurunan aktivitas
hemogloblin. Toksisitas nitrit disebut methemoglobinaemia (Murray et al. 2000).
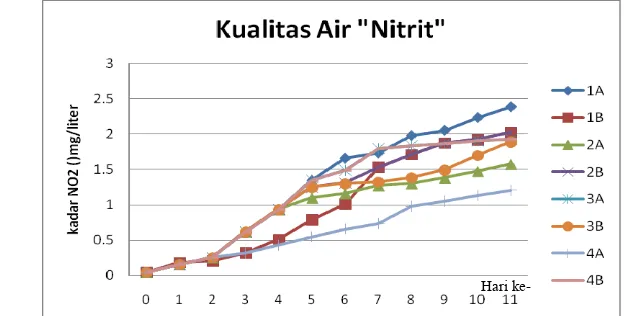
Gambar 18 Uji kualitas air terhadap nitrit (NO2) Hari ke-
Hal ini sebagai akibat dari meningkatnya metabolisme tubuh pada saat
tubuh menghadapi suhu lingkungan yang tinggi. Dekomposisi feses dan sisa
pakan dapat meningkatkan konsentrasi ion nitrit yang akan diurai oleh bakteri
Nitrosomonas. Peningkatan konsentrasi nitrit dipengaruhi juga oleh pH dan
salinitas. Pada konsentrasi DO yang rendah, kadar nitrit akan meningkat (Effendy
2003). Ikan mampu bertahan hidup pada kualitas nitrit 0.06 mg/liter
(UNESCO/WHO/UNEP 1992), Pada penelitian ini, rata-rata kadar nitrit
meningkat dari setiap akuarium dari 0.046 menjadi 1.91 mg/liter (normal 0.06
mg/liter). Kadar nitrit pada hari ikan coba mulai menunjukkan gejala klinis dan
kematian (hari ke-7) adalah 1.662 mg/liter.
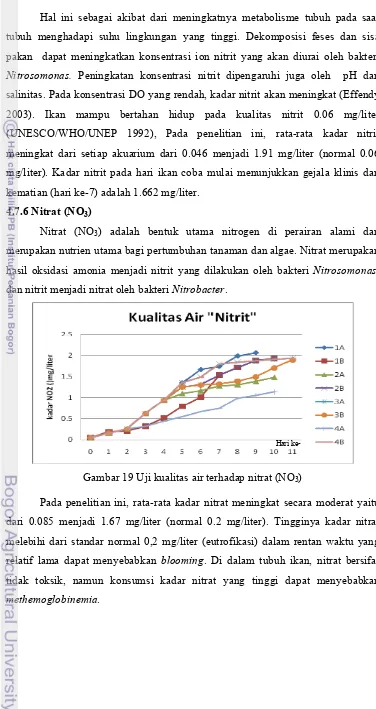
4.7.6 Nitrat (NO3)
Nitrat (NO3) adalah bentuk utama nitrogen di perairan alami dan
merupakan nutrien utama bagi pertumbuhan tanaman dan algae. Nitrat merupakan
hasil oksidasi amonia menjadi nitrit yang dilakukan oleh bakteri Nitrosomonas,
dan nitrit menjadi nitrat oleh bakteri Nitrobacter.
Gambar 19 Uji kualitas air terhadap nitrat (NO3)
Pada penelitian ini, rata-rata kadar nitrat meningkat secara moderat yaitu
dari 0.085 menjadi 1.67 mg/liter (normal 0.2 mg/liter). Tingginya kadar nitrat
melebihi dari standar normal 0,2 mg/liter (eutrofikasi) dalam rentan waktu yang
relatif lama dapat menyebabkan blooming. Di dalam tubuh ikan, nitrat bersifat
tidak toksik, namun konsumsi kadar nitrat yang tinggi dapat menyebabkan
methemoglobinemia.