BIOETANOL
MOTTO MANURUNG
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
MOTTO MANURUNG. Sakarifikasi dan Fermentasi Simultan (SFS) dari Limbah Ekstraksi Alginat untuk Pembuatan Bioetanol. Dibimbing oleh IRIANI SETYANINGSIH dan BAGUS SEDIADI BANDOL UTOMO
Bioetanol merupakan salah satu bahan bakar alternatif yang digunakan untuk mengurangi ketergantungan terhadap minyak yang dapat dibuat dari bahan baku yang mengandung selulosa. Rumput laut merupakan salah satu bahan baku berupa biomasa yang mengandung selulosa, memiliki produksi yang tinggi dan diimbangi dengan produksi limbah yang tinggi juga. Oleh karena itu perlu dilakukan penelitian mengenai pemanfaatan limbah dari pengolahan rumput laut sebagai bahan baku untuk memproduksi bioetanol sebagai sumber energi alternatif. Tujuan penelitian ini melihat pengaruh perbedaan suhu dan pH terhadap bioetanol yang dihasilkan dengan menggunakan metode sakarifikasi dan fermentasi simultan.
Penelitian ini terdiri dari 2 tahapan, yaitu tahap persiapan kultur mikroorganisme dan tahap sakarifikasi dan fermentasi simultan. Tahap pertama meliputi persiapan kultur mikroorganisme yaitu Trichoderma viride yang ditumbuhkan dalam media PDA selama 7 hari serta Saccharomyces cereviceae
yang ditumbuhkan dalam media PDA dan yeast extract selama 3 hari. Tahap kedua meliputi proses sakarifikasi dan fermentasi simultan dimana limbah ekstraksi alginat, air dan media andreoti dicampur ke dalam erlemeyer 2 L, kemudian dilakukan penetapan pH 4, 4,5 dan 4,8 serta disterilisasi pada suhu 1210C selama 15 menit. Media yang telah disterilisasi dilakukan penambahan 10% (v/v) suspensi T. viride dan S. cereviceae, selanjutnya dilakukan proses sakarifikasi dan fermentasi simultan selama 4 hari dengan suhu yang digunakan 30, 34 dan 380C. Analisis yang dilakukan meliputi pengukuran OD α = 600 nm, pH, total gula pereduksi setiap 24 jam dan konsentrasi etanol.
Komposisi limbah rumput laut hasil ekstraksi alginat memiliki kandungan selulosa sebesar 30,26 ± 0,02% yang digunakan oleh Trichoderma viride dan
Saccharomyces cereviceae dalam pembentukan etanol. Limbah ekstraksi alginat sebagai bahan baku yang digunakan dalam penelitian ini memiliki kadar air 10,42 ± 0,92 %.
BIOETANOL
MOTTO MANURUNG
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Sakarifikasi dan Fermentasi Simultan (SFS) dari Limbah Ekstraksi Alginat untuk Pembuatan Bioetanol
Nama Mahasiswa : Motto Manurung NRP : C34070038
Program Studi : Teknologi Hasil Perairan
Menyetujui
Pembimbing I Pembimbing II
Dr. Ir. Iriani Setyaningsih, MS Dr. Ir. Bagus S B Utomo, MAppSc NIP. 19600925 198601 2 002 NIP. 19551008 198203 1 003
Mengetahui
Ketua Departemen Teknologi Hasil Perairan.
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP. 1958 0511 1985 03 1 002
Dengan ini saya menyatakan bahwa skripsi dengan judul “Sakarifikasi dan
Fermentasi Simultan (SFS) dari Limbah Ekstraksi Alginat untuk Pembuatan
Bioetanol” adalah benar karya saya sendiri dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi
manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di
bagian akhir skripsi ini.
Bogor, November 2011
Motto Manurung
NRP C34070038
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungbalai, Sumatera Utara pada
tanggal 19 Mei 1989 dari Ayah bernama O. Manurung dan Ibu
yang bernama J. Doloksaribu. Penulis merupakan anak pertama
dari lima bersaudara.
Penulis menempuh pendidikan formal dimulai dari TK
Budimurni Tanjungbalai kemudian melanjutkan ke SD Methodist 1 Tanjungbalai
dan lulus pada tahun 2001. Pada tahun yang sama penulis malanjutkan sekolah di
SMP Swt Katolik Tritunggal Tanjungbalai, dan lulus pada tahun 2004. Pendidikan
selanjutnya ditempuh di SMA Negeri 1 Tanjungbalai dan lulus pada tahun 2007.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor (IPB) pada tahun
2007 melalui jalur Undangan Saringan Masuk IPB (USMI) diterima sebagai
mahasiswa Departemen Teknologi Hasil Perairan (THP), Fakultas Perikanan dan
Ilmu Kelautan.
Selama aktif perkuliahan, penulis aktif dalam berbagai organisasi
kemahasiswaan, seperti Kordinator Pelayanan Komisi Pelayan Siswa UKM PMK
IPB 2009-2010, dan Himpunan Mahasiswa Teknologi Hasil Perairan
(HIMASILKAN) divisi Sosial Kemasyarakatan periode 2009-2010. Penulis juga
aktif sebagai asisten luar biasa mata kuliah Iktiologi pada tahun 2009-2010,
asisten mata kuliah Penanganan Hasil Perairan pada tahun 2009-2010, asisten
mata kuliah Mikrobiologi Hasil Perairan 2009-2010, Asisten mata kuliah
Diversifikasi Hasil Perairan dan Pengembangan Produk Perairan 2010-2011,
Asisten mata kuliah Teknologi Pemanfaatan hasil Samping dan Limbah Industri
Perairan 2010-2011 dan Asisten mata kuliah Agama Kristen Protestan 2010-2011.
Penulis melakukan penelitian dan menyusun skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu
Kelautan, dengan judul “Sakarifikasi dan Fermentasi Simultan (SFS) dari
LImbah Ekstraksi Alginat untuk Pembuatan Bioetanol”, dibimbing oleh Dr.
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas kasih
dan anugerah yang diberikanNya kepada penulis dalam penyusunan skripsi yang
berjudul “Sakarifikasi dan Fermentasi Simultan (SFS) dari Limbah Ekstraksi
alginat untuk Pembuatan Bioetanol” merupakan salah satu syarat untuk
memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor.
Penulis mengucapkan terima kasih kepada seluruh pihak yang telah
membantu dalam penyelesaian skripsi ini, diantaranya kepada:
1) Dr.Ir. Iriani Setyaningsih, MS dan Dr. Ir. Bagus Sediadi Bandol Utomo,
MAppSc sebagai komisi pembimbing atas segala saran, kritik, arahan,
perbaikan dan motivasi, serta semua ilmu yang telah diberikan.
2) Desniar, S.Pi, M.Si sebagai dosen penguji atas segala saran, kritik, arahan,
perbaikan dan motivasinya serta ilmu yang telah diberikan.
3) Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen Teknologi
Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian
Bogor.
4) Dr. Ir. Agoes Mardiono Jacoeb, Dipl. Biol selaku komisi pendidikan
Departemen Teknologi hasil Perairan.
5) Kedua orang tua saya O. Manurung dan J. br Doloksaribu serta
adik-adikku Erwin, Dedi Midian, Jefri dan Muller atas segala doa dan apapun
yang telah diberikan kepadaku yang tak terhitung banyaknya.
6) Krisna Alfiani atas doa dan dukungannya selama pengerjaan skripsi ini.
7) Andreas Romulo, Hadasa Prabawati dan Fanny Aprilta atas kenangan,
kebersamaan yang tak terlupakan selama melayani di Komisi Pelayanan
Siswa.
8) Teman-teman Komisi Pelayanan Siswa (KPS) UKM PMK IPB dan para
Penghuni Sekret KPS yang telah untuk kenangan yang berharga dan tidak
terlupakan.
9) Bu Ida, Mas Made, Mas Gunawan, Mba. Putri, Mba Ericka, Mba Wiwi,
viii
seluruh staf Balai Besar Riset Pengolahan Produk dan Bioteknologi
Kelautan Perikanan, terimakasih atas bantuan dan bimbingan selama
menjalankan penelitian dan juga Feli yang telah bayak membantu dan
berjuang pada penelitian ini.
10)Rekan-rekan THP 44 terkhusus buat Yunny kosasih dan Tri Utami Ratna
Puri dan 43 yang selalu memberikan bantuan tenaga, pikiran, motivasi dan
doa untuk membantu penulis dari penelitian hingga penyelesaian skripsi
ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak
kekurangannya. Penulis mengharapkan saran dan kritik yang bersifat membangun
untuk perbaikan skripsi ini. Semoga skripsi ini bermanfaat bagi semua pihak yang
memerlukannya.
Bogor, November 2011
Halaman
DAFTAR ISI ... ix
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2 TINJAUAN PUSTAKA ... 3
2.1 Klasifikasi dan Deskripsi Sargassum Sp... 3
2.2 Alginat dan Ekstraksi Alginat ... 5
2.3 Limbah Rumput Laut ... 6
2.4 Hidrolisis Enzim ... 7
2.5 Sakarifikasi dan Fermentasi Simultan ... 9
2.6 Mikroba Penghasi Etanol ... 9
2.7 Bioetanol ... 11
3 METODOLOGI ... 12
3.1 Waktu dan Tempat Penelitian ... 12
3.2 Bahan dan Alat ... 12
3.2.1 Bahan... 12
3.2.2 Alat ... 12
3.3 Tahapan Penelitian ... 13
3.4 Analisa Kimia... 16
3.4.1 Kadar air... 16
3.4.2 Total gula pereduksi ... 17
3.4.3 Pertumbuhan mikroorganisme ... 17
3.4.4 Derajat keasaman (pH) ... 18
x
Halaman
4 HASIL DAN PEMBAHASAN ... 19
4.1 Kadar Air ... 19
4.2 Kadar Selulosa ... 20
4.3 Kultur Trichoderma Viride ... 21
4.4 Kultur Saccharomyces cereviceae ... 22
4.5 Kinerja Proses Sakarifikasi dan Fermentasi Simultan ... 23
4.5.1 Proses sakarifikasi dan fermentasi simultan pada suhu 30 0C. 23
4.5.2 Proses sakarifikasi dan fermentasi simultan pada suhu 34 0C. 27
4.5.3 Proses sakarisikasi dan fermentasi simultan pada suhu 38 0C . 30
5 KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA ... 37
Nomor Halaman
1 Rumput laut coklat (Sargassum sp) ... 3
2 Skema kultur Trichoderma viride ... 14
3 Skema kultur Saccharomyces cereviceae ... 14
4 Skema sakarifikasi dan fermentasi simultan ... 16
5 a. Rumput laut coklat yang belum diekstraksi ... 20
b. Limbah hasil ekstraksi yang telah dikeringkan ... 20
6 Karakter fisik Trichoderma viride selama 7 hari ... 21
7 Karakter fisik Saccharomyces cereviceae pada hari ke 3 ... 22
8 Absorbansi mikroorganisme selama proses SFS pada suhu 30 0C ... 24
9 Grafik nilai pH pada proses SFS pada suhu 30 0C ... 24
10 Grafik total gula pereduksi selama SFS pada suhu 30 0C ... 24
11 Absorbansi mikroorganisme selama proses SFS pada suhu 34 0C ... 27
12 Grafik nilai pH pada proses SFS pada suhu 34 0C ... 27
13 Grafik total gula pereduksi selama SFS pada suhu 34 0C ... 28
14 Absorbansi mikroorganisme selama proses SFS pada suhu 38 0C ... 31
15 Grafik nilai pH pada proses SFS pada suhu 38 0C ... 31
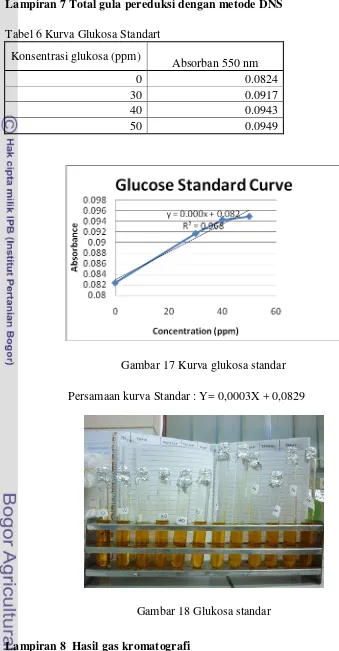
16 Grafik total gula pereduksi selama SFS pada suhu 38 0C... 32
17 Kurva glukosa standar ... 49
18 Glukosa standar ... 49
19 Rekaman uji etanol ... 50
DAFTAR TABEL
Nomor Halaman
1 Komposisi kimia Sargassum sp dari Kepulauan Seribu ... 5
Nomor Halaman
1 Jumlah mikroorganisme pada OD α = 600 nm pada suhu 300 C ... 43
2 Jumlah mikroorganisme pada OD α = 600 nm pada suhu 340C ... 44
3 Jumlah mikroorganisme pada OD α = 600 nm pada suhu 380C ... 45
4 Total gula pereduksi pada suhu 300C ... 46
5 Total gula pereduksi pada suhu 340C ... 47
6 Total gula pereduksi pada suhu 380C ... 48
7 Kurva glukosa standar dengan metode DNS ... 49
1 PENDAHULUAN
1.1 Latar Belakang
Kebutuhan manusia akan energi akan terus meningkat setiap tahun terkait
dengan perkembangan kegiatan ekonomi dan pertambahan jumlah penduduk. Hal
tersebut ditunjukkan oleh kian bertambah output serta beragam aktivitas ekonomi
yang dilakukan oleh masyarakat, sehingga peningkatan kebutuhan energi adalah
suatu hal yang tak bisa dihindari (Syariep 2005). Kementerian Energi dan
Sumberdaya Mineral (2006) mencatat bahwa terjadinya pertumbuhan yang cukup
substansial dalam permintaan energi final di Indonesia pada kurun waktu
1990-2005, yaitu dengan rata-rata pertumbuhan konsumsi sebesar 4,08% per tahun.
Pada akhir tahun 2005, konsumsi energi final di Indonesia mencapai angka sekitar
816.762 SBM (Setara Barel Minyak) dan minyak menjadi jenis energi yang paling
dominan sebesar 524.045 SBM.
Seiring dengan bertambahnya penduduk dan pertumbuhan ekonomi di
Indonesia, serta menipisnya cadangan minyak bumi, maka dicari energi alternatif
untuk menunjang kebutuhan akan energi. Salah satu alternatif penyediaan energi
dengan mengkonversi biomasa menjadi bioetanol. Kekayaan Indonesia yang
berlimpah akan sumber daya hayati termasuk mikroorganisma, sangat
memungkinkan untuk pemanfaatan biomasa lignoselulosa menjadi bioetanol,
yang sampai saat ini belum dikembangkan secara optimal. Penelitian pembuatan
bioetanol telah lama dilakukan, umumnya menggunakan bahan dasar molases
yang merupakan produk samping dari pabrik gula. Selain itu digunakan juga
bahan berpati, antara lain singkong dan jagung yang berpotensi juga sebagai
bahan pangan (Anindyawati 2009).
Bioetanol merupakan hasil proses fermentasi glukosa dari bahan yang
mengandung komponen pati atau selulosa. Bioetanol diproduksi dengan
menggunakan teknologi biokimia, melalui proses fermentasi gula dari bahan baku
karbohidrat menggunakan bantuan mikroorganisme. Etanol yang diproduksi
dipisahkan dengan air melalui proses distilasi dan dehidrasi. Bioetanol diproduksi
tebu) atau limbah biomasa (tongkol jagung, limbah jerami, limbah rumput laut,
dan limbah sayuran lainnya (Prihandana et al. 2007).
Salah satu sumberdaya hayati laut Indonesia yang cukup potensial adalah
rumput laut atau yang dikenal dengan sebutan ganggang laut atau alga laut.
Beberapa diantaranya banyak dimanfaatkan dalam pembuatan agar, karagenan,
alginat dan produk hasil ekstraksinya digunakan sebagai bahan makanan rumah
tangga dan juga sebagai bahan tambahan dalam industri makanan, farmasi,
kosmetik, tekstil, kertas dan cat. Penggunaan dan pengolahan rumput laut tersebut
dapat meningkatkan tingginya produksi limbah, sehingga hal tersebut
memberikan potensi yang baik untuk pengembangan sumberdaya alternatif
sebagaimana yang sedang berkembang saat ini (Anggadiredja et al. 2006). Oleh
karena itu perlu dilakukan penelitian mengenai pemanfaatan limbah dari
pengolahan rumput laut sebagai bahan baku untuk memproduksi bioetanol sebagai
sumber energi alternatif dan meningkatkan penerapan Zero Waste terhadap limbah
rumput laut.
Proses pembuatan bioetanol dalam penelitian ini dilakukan dengan
menggunakan dua biakan mikroorganisme, yaitu Trichoderma viride dan
Saccharomyces cereviceae melalui metode sakarifikasi dan fermentasi simultan
dengan substrat limbah ekstraksi alginat. Sakarifikasi dan fermentasi simultan
merupakan metode yang menggabungkan dua tahap menjadi satu tahap yang
bertujuan untuk mempersingkat waktu proses dan meningkatkan rendemen etanol
(Hermiati et al 2010) dan belum diketahui suhu dan pH yang baik dalam proses
sakarifikasi dan fermentasi simultan, sehingga perlu dilakukan penelitian
pembuatan bioetanol dengan menggunakan metode sakarifikasi dan fermentasi
simultan dengan suhu dan pH yang berbeda.
1.2 Tujuan Penelitian
Tujuan penelitian ini adalah melihat pengaruh perbedaan suhu dan pH
terhadap bioetanol yang dihasilkan dengan menggunakan metode sakarifikasi dan
2 TINJAUAN PUSTAKA
2.1 Klasifikasi dan Deskripsi Sargassum sp
Sargassum adalah salah satu genus dari kelompok rumput laut coklat yang
merupakan genera terbesar dari family sargassaceae. Klasifikasi Sargassum sp
(Anggadiredja et al. 2006) adalah sebagai berikut :
Divisio : Thallophyta
Kelas : Phaeophyceae
Bangsa : Fucales
Suku : Sargassaceae
Marga : Sargassum
Jenis : Sargassum polyfolium
Sargassum crassifolium
Sargassum merupakan alga coklat yang terdiri dari kurang lebih 400 jenis
di dunia. Jenis-jenis Sargassum sp yang dikenal di Indonesia ada sekitar 12
spesies, yaitu : Sargassum duplicatum, S. histrix, S. echinocarpum, S. gracilimun,
S. obtusifolium, S. binderi, S. policystum, S. crassifolium, S. microphylum, S.
aquofilum, S. vulgare, dan S. polyceratium (Rachmat 1999). Bentuk Sargassum sp
dapat dilihat pada Gambar 1.
Sargassum sp. memiliki bentuk thallus gepeng, banyak percabangan yang
menyerupai pepohonan di darat, bangun daun melebar, lonjong seperti pedang,
memiliki gelembung udara yang umumnya soliter, batang utama bulat agak kasar,
dan holdfast (bagian yang digunakan untuk melekat) berbentuk cakram. Pinggir
daun bergerigi jarang, berombak, dan ujung melengkung atau meruncing
(Anggadiredja et al. 2008). Sargassum biasanya dicirikan oleh tiga sifat yaitu
adanya pigmen coklat yang menutupi warna hijau, hasil fotosintesis terhimpun
dalam bentuk laminaran dan alginat serta adanya flagel (Tjondronegoro et al.
1989). Sargassum tersebar luas di Indonesia, tumbuh di perairan yang terlindung
maupun yang berombak besar pada habitat batu. Di Kepulauan Seribu (Jakarta)
alga ini biasa disebut oseng. Zat yang dapat diekstraksi dari alga ini berupa alginat
yaitu suatu garam dari asam alginik yang mengandung ion sodium, kalsium
dan barium (Aslan 1999). Pada umumnya Sargassum tumbuh di daerah terumbu
karang (coral reef) seperti di Kepulauan Seribu, terutama di daerah rataan pasir
(sand flat ). Daerah ini akan kering pada saat surut rendah, mempunyai dasar
berpasir dan terdapat pula pada karang hidup atau mati. Pada batu-batu ini tumbuh
dan melekat rumput laut coklat (Atmadja dan Soelistijo 1988).
Rumput laut jenis Sargassum umumnya merupakan tanaman perairan yang
mempunyai warna coklat, berukuran relatif besar, tumbuh dan berkembang pada
substrat dasar yang kuat. Bagian atas tanaman menyerupai semak yang berbentuk
simetris bilateral atau radial serta dilengkapi bagian sisi pertumbuhan. Umumnya
rumput laut tumbuh secara liar dan masih belum dimanfaatkan secara baik..
Rumput laut coklat memiliki pigmen yang memberikan warna coklat dan dapat
menghasilkan algin atau alginat, laminarin, selulosa, fikoidin dan manitol yang
komposisinya sangat tergantung pada jenis (spesies), masa perkembangan dan
kondisi tempat tumbuhnya (Maharani dan Widyayanti 2010).
Komponen utama dari alga adalah karbohidrat sedangkan komponen lainnya
yaitu protein, lemak, abu (sodium dan potasium) dan air 80-90% (Chapman
1970). Komposisi kimia Sargassum menurut Yunizal (2004) dapat dilihat pada
5
Tabel 1 Komposisi Kimia Sargassum sp dari Kepulauan Seribu
Komposisi Kimia Persentase (%)
Alginat adalah fikokoloid atau hidrokoloid yang diekstraksi dari
Phaeophyceae (alga coklat). Senyawa alginat merupakan suatu polimer linier yang
terdiri dari dua satuan monomerik, ß -D -asam manuronat dan α -L -asam guluronat (Horn 2000). Rumput laut coklat yang potensial untuk digunakan
sebagai sumber penghasil alginat diantaranya adalah jenis Macrocystis,
Turbinaria, Padina dan Sargassum sp. Kandungan alginat pada rumput laut coklat
tergantung musim, tempat tumbuh, umur panen dan jenis rumput laut.
Alginat terdapat pada semua jenis alga coklat sebagai komponen penyusun
dinding sel seperti hal selulose dan pektin. Secara kimia, asam alginat adalah
senyawa komplek yang termasuk karbohidrat koloidal hidrofilik hasil polimerisasi
D asam Mannuronat dengan rumus kimianya (C6H8O6)n dimana nilai n diantara
80 sampai 83 (Maharani dan Widyayanti 2010).
Pada prinsipnya ekstraksi alginat dilakukan dengan memasak ganggang
coklat dalam suasana basa dengan larutan Na2CO3 atau NaOH, kemudian larutan
alginat kasar ini ditambahkan asam mineral kuat sehingga asam alginat
mengendap. Beberapa proses pemurnian produk ini melibatkan proses
penjernihan, pemucatan, dan pengendapan kalsium alginat. Produk akhir
umumnya dijadikan bentuk garam alginat yang dapat larut dalam air, terutama
natrium alginat (Maharani dan Widyayanti 2010).
Proses pembuatan alginat menurut Rasyid (2010) dimulai dengan
sisa-sisa kotoran yang masih menempel sehingga mempermudah proses pembentukan
asam alginat, kemudian dicuci dengan akuades untuk menghilangkan sisa asam.
Sampel yang sudah dicuci ditambahkan larutan natrium karbonat 4% untuk
pembentukan natrium alginat sambil diaduk sampai menjadi pasta. Pasta yang
terbentuk diencerkan dengan aquades sambil diaduk kemudian disaring.
Selanjutnya dipucatkan dengan menambahkan larutan hidrogen peroksida 25% ke
dalam filtrat dan kemudian ditambahkan larutan kalsium klorida 5% sehingga
terbentuk endapan berwarna putih. Ke dalam endapan yang terbentuk
ditambahkan larutan asam klorida 5%. Asam alginat yang terbentuk ditandai
dengan timbulnya gumpalan di bagian atas cairan. Setelah disaring, residu yang
diperoleh ditambah dengan larutan natrium hidroksida 10%. Untuk proses
pemurnian dan memudahkan penyaringan, ke dalam campuran ditambahkan
isopropanol 95%. Endapan bersama kertas saring yang telah diketahui bobotnya
dikeringkan dalam oven suhu 600C. Endapan yang telah kering ditimbang
bersama kertas saring untuk penentuan kadar natrium alginat. Hasil yang
diperoleh adalah natrium alginat, selanjutnya dihaluskan dan dianalisis kadar
natrium alginat, kadar air dan nilai viskositasnya.
2.3 Limbah Rumput Laut
Berdasarkan catatan statistik Departemen Kelautan dan Perikanan 2007
(DKP 2008) produksi rumput laut nasional pada tahun 2004 baru mencapai
410.570 ton. Pada tahun 2005 jumlah produksi tersebut meningkat menjadi
910.636 ton, kemudian pada tahun 2006 terus meningkat hingga mencapai
1.079.850 ton. Pada tahun 2007, tercatat sebanyak 1.343.700 ton rumput laut
dihasilkan dalam waktu satu tahun. Nilai produksi yang sangat besar ini
dikarenakan permintaan rumput laut sebagai bahan baku industri sangat besar baik
di dalam maupun di luar negeri. Peningkatan ini didukung oleh kegiatan intensif
budi daya rumput laut yang dilakukan oleh pemerintah dan masyarakat. Indonesia
memiliki potensi sebanyak 540 jenis rumput laut tetapi sampai saat ini, jenis
rumput laut yang banyak dibudidayakan hanya berkisar kurang dari 10 jenis,
Pengolahan dari 100% rumput laut segar menghasilkan limbah olahan yang
7
prospek pengolahan rumput laut masih belum diimbangi dengan penanganan
pengolahan limbahnya. Sehingga limbah pengolahan rumput laut cenderung
terbuang dan hanya menjadi sampah organik. Pada tahun 2008 limbah dari
pengolahan rumput laut sekitar 1.682.542 ton. Jumlah yang besar ini sangat
disayangkan jika tidak diolah dan dimanfaatkan dengan baik (Harvey 2009). Perlu
adanya pemanfaatan dan pengolahan limbah sehingga dapat menerapkan prinsip “zero waste industry”. Produk olahan limbah tersebut dapat menjadi suatu produk
yang memiliki nilai tambah yang jauh lebih tinggi jika dibandingkan dengan nilai
produk awalnya. Limbah hasil olahan rumput laut tersebut masih mengandung
selulosa dan kadar selulosa yang dikandung oleh limbah mencapai 15-25%.
Selulosa tersebut merupakan bahan baku yang berpotensi untuk pembuatan
bioetanol (Kim et al. 2007).
2.4 Hidrolisis Enzim
Hidrolisis adalah reaksi kimia yang memecah molekul air (H2O) menjadi
kation hydrogen (H+) dan anion hidroksida (OH-) melalui suatu proses kimia.
Proses ini biasanya digunakan untuk memecah polimer tertentu, contohnya
polimer organik yang memiliki rantai karbon. Ada tiga metode hidrolisis yang
biasa digunakan, yaitu 1) hidrolisis asam encer (dilute acid hydrolysis), 2)
hidrolisis asam pekat (concentrated acid hydrolisis) dan 3) hidrolisis enzim
(enzyme hydrolysis). Hidrolisis selulosa menjadi gula-gula sederhana dapat
dilakukan menggunakan tiga metode di atas. Namun dari beberapa penelitian
melaporkan bahwa proses hidrolisis secara enzimatis lebih menguntungkan dari
pada menggunakan asam yaitu tidak menimbulkan korosi, proses dapat
berlangsung pada kondisi mild (pH 4,8 dan suhu 500C) dan rendemen lebih tinggi
(Duff dan Murray 1996).
Proses hidrolisis selulosa secara enzimatis menghasilkan gula pereduksi
(glukosa). Selanjutnya glukosa tersebut digunakan sebagai substrat dalam
produksi etanol melalui proses fermentasi. Selulase adalah enzim yang dapat
mengkatalis terjadinya reaksi hidrolisis selulosa menjadi glukosa. Tiga enzim
utama yang terdapat dalam selulase kompleks adalah endoglukonase,
ikatan 1,4-β-glikosidik secara acak pada daerah amorf selulosa menghasilkan
glukosa, selubiosa dan selodekstrin. Eksoglukanase menghidrolisis selodektrin
dengan memutus unit selubiosa dari ujung rantai polimer, sedangkan selobiose
menghidrolisis selubiosa dan selo-oligosakarida menjadi glukosa (Syamsudin
2006).
Hemiselulase adalah kelompok enzim yang mempunyai kemampuan
menghidrolisis hemiselulosa. Hidrolisis dari hemiselulosa dapat dipantau dari
jumlah D-xilosa, L-arabinosa, D-glukosa, D-mannosa, D-galaktosa dan L-amnosa
yang dihasilkan. Karena kemampuannya dalam menghidrolisis xilan, maka
hemiselulase biasa disebut juga dengan xilanase.
Trichoderma viride merupakan salah satu mikroorganisme yang dapat
menghasilkan enzim selulase untuk memecah selulosa menjadi gula-gula
sederhana. T. viride termasuk dalam genus Trichoderma, famili Moniliceae dan
ordo Moniliales. Kapang ini mudah dilihat karena penampakannya berserabut
seperti kapas namun jika spora telah timbul akan tampak berwarna hijau tua
(Domsch dan Gams 1972). T. viride mampu memproduksi kompleks enzim
selulase yang lengkap yaitu endoselulase dan eksoselulase yang dapat
menghidrolisis selulosa kristalin dan selulosa non kristalin. Pada enzim selulosa
dapat terjadi sinergisme antara endoselulase dan eksoselulase, dan juga antar
eksoselulase.
Pertumbuhan T. viride optimal pada pH sekitar 4 sedangkan untuk produksi
enzim selulase mendekati pH 3. Selama produksi enzim, pH harus dipertahankan
dalam kisaran 3-4 karena inaktivasi enzim akan terjadi di bawah pH 2. Suhu
optimum pertumbuhan sekitar 32 – 350 C dan produksi enzim sekitar 25 – 300 C.
Karakteristik dari enzim selulase adalah memiliki pH optimum 4 dan akan tetap
stabil pada pH 3 – 7. Suhu optimum adalah 500 C dan aktivasinya akan menurun
jika suhunya lebih dari 500 C (Waluyo 2004).
Trichoderma viride selain mampu memproduksi enzim selulase, juga dapat
menghasilkan enzim endo-1,4-xilanase yang dapat mendegradasi xilan. Berat
molekul xilanase yang dihasilkan dari Trichoderma viride adalah sebesar 22.000
dalton. T. viride mampu secara simultan melakukan proses detoksifikasi dan
senyawa-9
senyawa inhibitor seperti furfural dan hydroxymethylfurfural. Kapang ini juga
mampu memetabolisme gula dari golongan pentosa maupun heksosa dan tidak
terlalu sensitif terhadap material-material lignoselulosik.
2.5 Sakarifikasi dan Fermentasi Simultan
Secara umum sintesa bioetanol yang berasal dari biomassa terdiri atas dua
tahap utama, yaitu hidrolisis dan fermentasi. Pada metode terdahulu proses
hidrolisis dan fermentasi dilakukan secara terpisah dan yang terbaru adalah proses
sakarifikasi dan fermentasi simultan.
Sakarifikasi dan fermentasi simultan (SFS) adalah kombinasi antara
hidrolisis enzim dan fermentasi yang dilakukan dalam suatu reaktor. Proses ini
memiliki keuntungan yaitu polisakarida yang terkonversi menjadi monosakarida
tidak kembali menjadi polisakarida karena monosakarida langsung difermentasi
menjadi etanol (Samsuri et al. 2007). Pada proses SFS, hidrolisis selulosa dan
fermentasi gula tidak dilakukan secara terpisah atau bertahap, tetapi secara
simultan. Mikrob yang digunakan pada proses SFS biasanya adalah jamur
penghasil enzim selulase, seperti T. reesei, T.viride, dan khamir S. cerevisiae.
Suhu optimal proses SFS adalah 38°C, yang merupakan perpaduan suhu optimal
hidrolisis (45–50°C) dan suhu optimal fermentasi (30°C). Proses SFS memiliki
keunggulan dibandingkan dengan proses hidrolisis dan fermentasi bertahap.
Beberapa keunggulan tersebut adalah: 1) meningkatkan kecepatan hidrolisis
dengan mengonversi gula yang terbentuk dari hasil hidrolisis selulosa yang
menghambat aktivitas enzim selulase, 2) mengurangi kebutuhan enzim, 3)
meningkatkan rendemen produk, 4) mengurangi kebutuhan kondisi steril karena
glukosa langsung dikonversi menjadi etanol, 5) waktu proses lebih pendek, dan
6) volume reaktor lebih kecil karena hanya digunakan satu reaktor (Sun dan
Cheng 2002).
2.6 Mikroba Penghasil Etanol
Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik
karbohidrat, protein, lemak atau lainnya, melalui kegiatan katalis biokimia yang
dan Dunn 1981). Menurut Oura di dalam Dellweg (1983), secara sederhana proses
fermentasi alkohol dari bahan baku yang mengandung gula (glukosa) terlihat pada
reaksi berikut :
C6H12O6 2C2H5OH + 2 CO2
Dari reaksi di atas, 70% energi bebas yang dihasilkan dibebaskan sebagai
panas. Secara teoritis 51,5% karbohidrat diubah menjadi etanol dan 48,9%
menjadi CO2.
Khamir yang sering digunakan dalam proses fermentasi etanol adalah
Saccharomyces cereviceae, karena jenis ini dapat berproduksi tinggi, toleran
terhadap etanol yang cukup tinggi (12-18% v/v), tahan terhadap kadar gula tinggi
dan tetap aktif melakukan fermentasi pada suhu 4-320 C (Harrison dan Graham
1970)
Saccharomyces cereviceae merupakan salah satu mikroorganisme penghasil
bioetanol melalui proses fermentasi. S. cereviceae termasuk ke dalam kelas
Ascomucetes yang dicirikan dengan pembentukan askus yang merupakan tempat
pembentukan askopora. S. cereviceae memperbanyak diri secara aseksual yaitu
dengan bertunas (Pelezar dan Chan 1986). Saccharomyces cereviceae sering
digunakan dalam fermentasi etanol karena sangat tahan dan toleran terhadap kadar
etanol yang tinggi (12-18% v/v), tahan pada kadar gula yang cukup tinggi dan
tetap aktif melakukan fermentasi pada suhu 4-320C. S. cereviceae mempunyai
aktivitas optimum pada suhu 30-340C dan tidak aktif pada suhu lebih dari 400C. S.
cereviceae dapat memfermentasi glukosa, sukrosa, galaktosa serta rafinosa
(Kunkee dan Mardon 1970). Biakan S. cerviceae mempunyai kecepatan
fermentasi optimum pada pH 4,48 (Harrison dan Graham 1970).
Rendemen alkohol dari heksosa dalam fermentasi menggunakan khamir dari
genus Saccharomyces dapat mencapai 90% (Boyles 1984 diacu dalam Arnata
2009). Proses fermentasi oleh Saccharomyces adalah proses pengubahan sebagian
besar energi dari gula ke dalam bentuk etanol. Efisiensi pengubahan energi
tersebut dapat mencapai 97% (Campbel 1983). Mekanisme pembentukan etanol
oleh khamir melalui jalur Embden-Meyerhorf-Parnas Pathway (EMP) atau
glikolisis. Hasil dari EMP adalah memecah glukosa menjadi 2 molekul piruvat.
11
asetaldehid dan CO2 oleh enzim piruvat decarboksilase, setelah itu oleh enzim
alkohol dehidrogenase dirubah menjadi etanol (Zaldivar et al. 2001)
2.7 Bioetanol
Etanol merupakan produk fermentasi yang dapat dibuat dari substrat yang
mengandung karbohidrat (gula, pati, atau selulosa). Etanol adalah salah satu
senyawa alkohol dengan rumus kimia C2H5OH yang berupa cairan yang tidak
berwarna, jernih, mudah menguap, memiliki bau yang sangat halus dan rasa yang
pedas (Hambali et al. 2007).
Bioetanol merupakan salah satu bahan bakar alternatif untuk mengurangi
ketergantungan terhadap minyak. Karena masyarakat kita sudah sangat familiar
dengan bahan cair yaitu BBM maka bioetanol diharapkan dapat mensubsitusi
kebutuhan terhadap bensin. Bioetanol bersifat multi-guna karena dicampur dengan
bensin pada komposisi berapapun memberikan dampak yang positif. Campuran
anatara gasoline (bensin) dengan alkohol(bioetanol) disebut gasohol (Prescott dan
Dunn 1981).
Proses pembentukan bioetanol dengan bahan baku tanaman yang
mengandung selulosa, dilakukan melalui proses penguraian selulosa menjadi gula
(glukosa) larut air. Proses pembuatan glukosa dibantu oleh hidrolisis asam dan
enzim. Hidrolisis asam salah satunya dengan menggunakan asam sulfat, kurang
dapat berkembang sehingga yang umum saat ini digunakan adalah penambahan
air dan enzim. Kemudian dilakukan proses fermentasi gula menjadi bioetanol
dengan penambahan ragi (yeast) (Nurdyastuti 2008). Pembuatan bioetanol dengan
bahan baku selulosa terdiri dari beberapa proses yaitu proses hidrolisis enzim,
proses fermentasi dan proses pemurnian bioetanol (Irawati 2006 dan Subekti
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April sampai bulan Juli 2011.
Pengujian dilaksanakan di Laboratorium Mekanisasi Proses, Laboratorium
Bioteknologi dan koleksi kultur, Laboratorium Kimia dan Laboratorium
instrument Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan
Perikanan, Jakarta, laboratorium Kimia Hasil Hutan-THH IPB dan Laboratorium
Saraswanti, Bogor.
3.2 Bahan dan Alat
3.2.1 Bahan
Bahan baku yang digunakan adalah limbah ekstraksi alginat dari rumput
laut coklat (Sargassum sp), kapang Trichoderma viride dan khamir
Saccharomyces cereviceae.
Bahan-bahan kimia yang digunakan dalam pembuatan media adalah pepton,
tween 80, (NH4)2SO4, Urea (H2NCONH2), KH2PO4.3H2O, CaCl2.2H2O,
MgSO4.7H2O dan mineral stok yang terdiri dari HCl 37%, FeSO4.7H2O, ZnCl2,
CoCl2.6H2O.
Bahan kimia yang digunakan dalam pembuatan reagen DNS (asam 3,
5-dinitrosalisilat) adalah DNS, NaOH, Na-K tartrat, phenol dan Na-Metabisulphite.
Sedangkan bahan kimia lain yang digunakan dalam penelitian ini adalah media
Potato Dextro Agar (PDA), buffer sitrat 0,2 M, asam sitrat, trisodium sitrat, HCl,
NaOH, Na2CO3, glukosa monohidrat dan yeast ekstrak.
3.2.2 Alat
Alat yang digunakan untuk penelitian meliputi : erlemeyer 2 L, water bath,
pH meter, bulb, mikropipet 100-1000 µ L, tabung reaksi, labu ukur, batang
pengaduk, autoklaf, inkubator, dan gelas ukur.
Alat-alat yang digunakan untuk analisa meliputi : cawan, oven, furnace,
desikator, alumunium foil, erlemeyer, ruang laminar, timbangan digital,
waterbath, gelas piala, vortex, penangas air, spektrometer UV/VIS Perkin Elmer,
13
3.3 Tahapan Penelitian
Sakarifikasi dan fermentasi simultan (SFS) dengan kultur biakan T. viride
dan S. cereviceae dari limbah ekstraksi alginat untuk pembuatan bioetanol terdiri
dari dua tahap penelitian yaitu persiapan kultur mikroorganisme dan proses
sakarifikasi dan fermentasi simultan. Dua tahap penelitian ini merupakan
modifikasi dari Arnata (2009) dan Sari (2010). Tahapan penelitian antara lain
meliputi : 1) persiapan kultur dan 2) proses sakarifikasi dan fermentasi simultan
(SFS) selama 4 hari dengan dua kali pengulangan.
1) Persiapan kultur
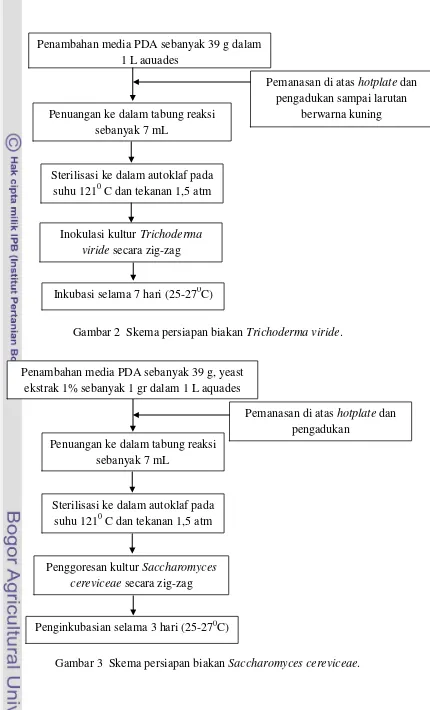
Persiapan kultur pada penelitian ini meliputi persiapan kultur kapang
T.viride, dimana kultur kapang T. viride sebelum digunakan disegarkan dulu agar
dapat memproduksi enzim selulase dengan optimal. Media yang digunakan adalah
PDA (Potato Dextrose Agar) yang dibuat miring. Tahapan persiapannya sebagai
berikut : PDA ditambah akuades (39g/L), kemudian dipanaskan di atas hotplate
dan diaduk sampai larutan berwarna kuning jernih, lalu dituangkan kedalam
tabung reaksi sebanyak 7 ml tiap tabung reaksi dan ditutup rapat, kemudian
dilakukan sterilisasi dengan autoklaf pada suhu 1210C dan tekanan 1,5 atm selama
15 menit. Tabung reaksi dimiringkan selama 1 hari. Keesokan harinya dilakukan
inokulasi dengan cara menggores secara zig zag menggunakan jarum ose yang
dimulai dari dasar tabung. Semua dilakukan dalam kondisi aseptis. Selanjutnya
T.Viride diinkubasi pada suhu 25-280C selama 7 hari. Skema persiapan kultur
T.viride dapat dilihat pada Gambar 2. Persiapan kultur S.cereviceae yang
dilakukan dengan cara membiakkan S. cereviceae pada media PDA yang telah
ditambah yeast extract dan aquades, kemudian dipanaskan di atas hotplate lalu
diaduk sampai larut. Proses persiapan kultur S. cereviceae selanjutnya sama
seperti persiapan kultur T.viride. Skema persiapan kultur S. cereviceae dapat
Gambar 2 Skema persiapan biakan Trichoderma viride.
Gambar 3 Skema persiapan biakan Saccharomyces cereviceae. Penambahan media PDA sebanyak 39 g dalam
1 L aquades
Pemanasan di atas hotplate dan pengadukan sampai larutan
berwarna kuning Penuangan ke dalam tabung reaksi
sebanyak 7 mL
Sterilisasi ke dalam autoklaf pada suhu 1210 C dan tekanan 1,5 atm
Inokulasi kultur Trichoderma viride secara zig-zag
Inkubasi selama 7 hari (25-270C)
Pemanasan di atas hotplate dan pengadukan
Penuangan ke dalam tabung reaksi sebanyak 7 mL
Sterilisasi ke dalam autoklaf pada suhu 1210 C dan tekanan 1,5 atm
Penggoresan kultur Saccharomyces cereviceae secara zig-zag
Penginkubasian selama 3 hari (25-270C) Penambahan media PDA sebanyak 39 g, yeast
15
2) Proses sakarifikasi dan fermentasi simultan
Proses sakarifikai dan fermentasi simultan dilakukan dengan cara
memasukkan limbah ekstraksi alginat ke dalam erlemeyer 2 L dan dicampur
dengan air sambil diaduk sampai berbentuk bubur (dikuantifikasi jumlah aquades
yang diperlukan). Setelah itu dilakukan penambahan media andreoti, pepton dan
tween 80 dan dilakukan pengecekan pH media setelah itu ditentukan pHnya
menjadi 4; 4,5; dan 4,8 dengan penambahan HCL 3M atau NaOH 3M dan pH
dijaga dengan larutan buffer Na-sitrat 0,2 M. Kemudian dilakukan proses
sterilisasi pada suhu 1210C selama 15 menit. Setelah suhu medianya 25-300C,
ditambahkan kultur T. viride dan kultur S. cereviceae diinkubasi dalam waterbath
pada suhu 30, 34 dan 380 C. Pengambilan sampel dilakukan setiap 24 jam selama
proses fermentasi dan sakarifikasi simultan berlangsung dengan melakukan
pemisahan antara padatan dan cairan (filtrat) selama 4 hari. Skema proses
sakarifikasi dan fermentasi simultan dapat dilihat pada Gambar 4.
Gambar 4 Skema sakarifikasi dan fermentasi simultan.
3.4 Analisis Kimia
Analisis yang dilakukan pada penelitian ini dengan mengukur beberapa
parameter meliputi kadar air, total gula pereduksi, pertumbuhan mikroorganisme,
pH, dan konsentrasi crude etanol.
3.4.1 Kadar air ( Sari 2010)
Pengkuran kadar air pada penelitian ini merupakan modifikasi dari AOAC
(1984) yang diacu dalam Sari (2010) yaitu sampel sebanyak 2 g dimasukkan
dalam cawan yang telah diketahui bobotnya. Kemudian dikeringkan dalam oven
bersuhu 100-1050C sampai bobot konstan. Setelah itu didinginkan dalam
desikator dan ditimbang.
Bobot awal – Bobot akhir
Kadar Air = X 100% Bobot contoh
Sakarifikasi dan fermentasi simultan selama 4 hari, pada suhu 300C, 340C dan 380C dalam
waterbath
Analisa pertumbuhan jumlah mikroorganisme dengan mengukur
OD λ = 600 nm, Total Gula Pereduksi (TGP) setiap 24 jam dan Penambahan 10% (v/v) dari
jumlah sel suspensi T. viride dan
S. cereviceae per 100 ml media
17
3.4.2 Penetapan total gula pereduksi metode DNS (Miller 1959 diacu dalam Subekti 2006)
Prinsip metode ini adalah dalam suasana alkali gula pereduksi akan
mereduksi asam 3,5-dinitrosalisilat (DNS) membentuk senyawa yang dapat
diukur absorbansinya pada panjang gelombang 550 nm.
Penyiapan pereaksi DNS
Pereaksi DNS dibuat dengan melarutkan 10,6 g asam 3, 5-dinitrosalisilat
dan 19,8 g NaOH dalam 1416 mL air. Setelah itu ditambahkan 306 g Na-K
Tartrat, 7,6 g fenol yang dicairkan pada suhu 500C dan 8,3 g Na-Metasulfit.
Larutan ini diaduk rata, kemudian 3 mL larutannya dititrasi dengan HCL 0,1
N dengan indikator fenolftalein. Banyaknya titrasi berkisar antara 5-6 mL.
Jika kurang dari itu harus ditambahkan 2 g NaOH untuk setiap ml kekurangan
HCL 0,1 N.
Penentuan kurva standar
Kurva standar dibuat dengan mengukur nilai gula pereduksi pada glukosa
dengan selang 0,2-0,5 mg/L. Kemudian nilai gula pereduksi dicari dengan
metode DNS. Hasil yang didapatkan diplotkan pada grafik secara linear.
Penetapan total gula pereduksi
Pengujian gula pereduksi menggunakan kurva standar DNS dengan cara: 1
mL sampel dimasukkan ke dalam tabung reaksi, ditambahkan 3 mL pereaksi
DNS. Larutan tersebut ditempatkan dalam air mendidih selama 5 menit.
Dibiarkan sampai dingin pada suhu ruang. Kemudian diukur absorbansinya
pada panjang gelombang 550 nm. DNS akan menjaga kestabilan hasil
hidrolisis enzim dan mengikat gula pereduksi sebagai indikator terjadinya
aktivitas enzim.
3.4.3 Pertumbuhan Trichoderma viride dan Saccharomyces cereviceae
Penentuan pertumbuhan sel fungi atau yeast dilakukan dengan analisis
spektrofotometri dengan prinsip turbidimetri. Prinsip turbidimetri ini adalah
analisis konsentrasi suatu zat berdasarkan kekeruhannya dibandingkan dengan
sampel blanko yang dianggap nilai 0 absorban atau full scale transmitan atau tidak
Pada penentuan konsentrasi sel fungi atau yeast, kekeruhan disebabkan oleh
suspensi sel fungi atau yeast. Blanko yang digunakan adalah larutan medium
yang persis sama dengan medium hidrolisis atau fermentasi yang belum
digunakan sebagai medium pertumbuhan fungi atau yeast. Analisis dilakukan
dengan mengambil data absorbansi dengan menggunakan spektrometer UV/VIS
Perkin Elmer dengan α = 600 nm.
3.4.4 Derajat keasaman (pH)
Pengukuran pH dilakukan dengan menggunakan pH meter dimana data pH
selama proses fermentasi di ukur setiap 24 jam.
3.4.5 Konsentrasi etanol (Subekti 2006)
Pengukuran konsentrasi etanol dilakukan dengan menggunakan Gas
Chromatography (GC). Konsentrasi etanol diperoleh dari perhitungan rasio Area
dimana Luas area etanol sampel dibagi dengan luas area n-propanol sampel.
Kemudian hasil rasio area tersebut dibagi dengan slope hasil kurva kalibrasi
4 HASIL DAN PEMBAHASAN
Limbah hasil ekstraksi alginat yang digunakan pada penelitian ini
dikeringkan sebelum digunakan sebagai bahan baku pembuatan bioetanol.
Analisis yang dilakukan terhadap limbah ekstraksi alginat meliputi kadar air dan
kadar selulosa.
4.1 Kadar air
Limbah ekstraksi alginat sebagai bahan baku yang digunakan dalam
penelitian ini memiliki kadar air 10,42 ± 0,92%. Fardiaz (1989) menyatakan
bahwa air dibutuhkan sebagai reaktan dalam berbagai reaksi biokimia. Penelitian
Cuevas et al. (2010) melaporkan bahwa S. cereviceae dapat tumbuh dengan kadar
air berkisar antara 8-10% dari bahan baku olive-pruning debris, sedangkan pada
hasil penelitian Ahmed (2010) dilaporkan bahwa T. viride dapat tumbuh pada
kadar air 5% pada bahan baku jerami gandum. Kadar air pada penelitian ini masih
berada pada kisaran dimana mikroorganisme T. viride dan S. cereviceae tersebut
dapat tumbuh. Kadar air limbah ekstraksi alginat berkisar antara 5-10%.
Hasil analisis limbah ekstraksi alginat memiliki kadar air yang tergolong
aman untuk pertumbuhan mikroorganisme yang digunakan pada penelitian ini.
Loebis (2008) menyatakan bahwa kandungan air juga berpengaruh pada substrat
pertumbuhan kapang, aktivitas enzim, laju transfer massa oksigen dan
karbondioksida. Kapang membutuhkan aktifitas air untuk germinasi spora dan
pertumbuhannya relatif lebih rendah dibandingkan bakteri. Winarno (2010)
menyatakan bahwa kadar air dari bahan juga sangat mempengaruhi laju reaksi
enzimatik. Kadar air bebas yang rendah akan menyebabkan terjadinya halangan
dan rintangan sehingga difusi enzim atau substrat terhambat. Akibatnya hidrolisis
hanya terjadi pada bagian substrat yang langsung berhubungan dengan enzim.
Kadar air dapat digunakan untuk mengetahui daya simpan dari bahan dan sangat
berpengaruh terhadap mutu. Semakin tinggi kadar air suatu bahan maka daya
simpannya semakin rendah dan mutu dari bahan tersebut menjadi rendah.
Penampakan fisik dari rumput laut coklat (Sargassum sp) yang belum
diekstraksi dan limbah hasil ekstraksi alginat yang telah dikeringkan dapat dilihat
a b
Gambar 5 a) Rumput laut coklat yang belum diekstrkasi dan b) limbah rumput laut hasil ekstraksi yang telah dikeringkan.
4.2 Kadar Selulosa
Selulosa adalah karbohidrat paling melimpah di alam, namun
pemanfaatannya belum optimum. Selulosa terdiri atas monomer glukosa yang
dihubungkan dengan ikatan β-1,4-glikosida, sehingga dapat menghidrolisis ikatan
glikosida menjadi glukosa, yang kemudian dapat digunakan untuk berbagai
tujuan, seperti produksi bioetanol (Kamara et al. 2006). Limbah hasil ekstraksi
alginat pada penelitian ini yang digunakan sebagai media hidrolisis enzim
mengandung crude selulosa sebesar 30,26 ± 0,02% dari limbah ekstraksi alginat.
Kadar crude selulosa yang digunakan pada penelitian ini lebih tinggi
dibandingkan hasil penelitian yang dilakukan oleh Sari (2010), yaitu pada rumput
laut coklat jenis Sargassum sp yang telah dibuat menjadi tepung memiliki kadar
selulosa sebesar 15,80 ± 0,79%. Subaryono (2009) menyatakan bahwa dinding sel
rumput laut coklat tidak hanya terdiri dari selulosa namun juga terdapat
komponen-komponen seperti alginat dengan jumlah yang cukup besar yaitu
33,93% dari Sargassum sp kering, sedangkan Roswiem (1991) menyatakan
bahwa komposisi kimia Sargassum sp memiliki kadar air sebesar 11,71%, kadar
abu sebesar 34,57%, kadar protein sebesar 5,53%, kadar lemak sebesar 0,74%
21
4.3 Kultur Trichoderma viride
Inkubasi T. viride dilakukan selama 7 hari. Pertumbuhan T. viride
ditentukan dengan pengamatan secara penampakan fisik setiap 24 jam. Kultivasi
T. viride dilakukan selama 7 hari, karena mengacu pada hasil penelitian Arnata
(2009) yang menyatakan bahwa waktu tercapainya aktifitas maksimum T. viride
untuk menghasilkan enzim selulase adalah 7 hari setelah diinkubasi dan memiliki
aktivitas enzim selulase (CMCase) sebesar 5,05 ± 0,42 IU/mL. Enari (1983)
menyatakan bahwa pengukuran aktivitas enzim selulase dimaksudkan untuk
mengetahui kerja endo-glukanase dan glukanohidrolase. Kedua enzim ini
merupakan bagian dari enzim selulase yang dapat menghidrolisis selulosa yang
telah direnggangkan dengan asam posfat dan selulase yang telah disubsitusi
seperti CMC (Carboksil Metil Celulase). Irawadi (1991) menyatakan bahwa CMC
adalah turunan selulosa dapat larut yang digunakan sebagai substrat bagi enzim
endoglukanase. Enzim yang dapat menghidrolisis CMC ini sering disebut
CMCase.
Trichoderma viride merupakan salah satu mikroorganisme yang
digunakan untuk mendapatkan enzim selulase (Winarno 2010). Enzim selulase
digunakan dalam proses hidrolisis dimana proses hidrolisis ini memiliki kelebihan
pada tingkat efektivitas dan efisiensi proses, yaitu tanpa proses netralisasi
dibandingkan dengan hidrolisis asam, sehingga pada tahap hidrolisis ini akan
memanfaatkan aktivitas enzim selulase yang dihasilkan oleh kapang T. viride
yang memiliki aktivitas tinggi sehingga dapat diperoleh randemen gula yang
cukup baik (Kamara 2006). Adapun karakter fisik dari T. viride dapat dilihat pada
Gambar 6.
Hari ke 1 Hari ke 2 Hari ke 3 Hari ke 4 Hari ke 5 Hari ke 6 Hari ke 7
Kondisi pertumbuhan T. viride dapat dilihat pada Gambar 6. Pada hari
pertama spora mengalami germinasi membentuk miselium berwarna putih.
Pembentukan miselium semakin cepat sampai hari ketiga dan mulai terjadi
perubahan warna menjadi agak kehijauan. Hari keenam sampai hari ketujuh
terjadi perubahan dari warna putih menjadi warna hijau yang semakin jelas.
T.viride adalah kapang yang berwarna hijau terang karena terbentuknya bola-bola
konidia yang melekat satu sama lain. Hal ini sesuai dengan Fardiaz (1989) yang
menyatakan bahwa ciri-ciri spesifik kapang T. viride adalah mempunyai miselium
septat, memiliki koniofora bercabang banyak, septat, dan ujung percabangannya
merupakan sterigma, membentuk konidia bulat atau oval, berwarna hijau terang,
dan berbentuk bola-bola berlendir.
4.4 Kultur Saccharomyces cereviceae
Kultur Saccharomyces cereviceae dilakukan selama 3 hari. Mikroorganisme
S. cereviceae yang akan memfermentasi dan mengubah sebagian besar energi dari
gula ke dalam bentuk etanol. Efisiensi pengubahan energi tersebut dapat mencapai
97% (Campbel 1983). Penampakan secara fisik S. cereviceae ada yang
membentuk film atau lapisan pada permukaan medium, umumnya kering dan
berlendir, berwarna putih atau krem serta tidak berbau. Penampakan fisik
S.cereviceae setelah dikultivasi selama 3 hari dapat dilihat pada Gambar 7.
23
4.5 Kinerja proses sakarifikasi dan fermentasi simultan
Pembuatan bioetanol dari limbah hasil ekstraksi alginat dilakukan dengan
menggunakan metode sakarifikasi dan fermentasi simultan, yang menggunakan
dua biakan mikroorganisme dengan suhu dan pH yang berbeda. Biakan yang
digunakan adalah T. viride dan S. cereviceae. Kinerja proses dari sakarifikasi dan
fermentasi simultan ini dapat dilihat dari beberapa parameter, yaitu pH,
pengukuran OD mikroorganisme dengan panjang gelombang (λ) 600 nm, total
gula pereduksi dan kadar etanol.
Proses sakarifikasi dan fermentasi simultan, hidrolisis selulosa dan
fermentasi gula tidak dilakukan secara terpisah atau bertahap, tetapi secara
simultan. Mikroorganisme yang digunakan pada proses sakarifikasi dan
fermentasi simultan biasanya jamur penghasil enzim selulase, seperti T. reesei, T.
viride, dan khamir S. cerevisiae. Suhu optimal proses sakarifikasi dan fermentasi
simultan adalah 38°C, yang merupakan perpaduan suhu optimal hidrolisis (45– 50°C) dan suhu optimal fermentasi (30°C) (Sun dan Cheng 2002). Proses
sakarifikasi dan fermentasi simultan juga tidak menggunakan peralatan yang
mahal dan mengurangi kemungkinan kontaminasi oleh organisme yang tidak
diinginkan (Wyman et al. 1992). Karakter proses sakarifikasi dan fermentasi
simultan menurut Samsuri et al. (2007) adalah polisakarida yang terkonversi
menjadi monosakarida tidak kembali menjadi polisakarida karena monosakarida
langsung difermentasi menjadi etanol. Shen et al. (2007) dan Hari Khrisna et al.
(2001) menyatakan bahwa sakarifikasi dan fermentasi simultan adalah sebuah
metode yang dapat meningkatkan kinerja enzim karena pengurangan dari
penghambat produk. Hal itu memerlukan lebih sedikit enzim yang dapat
meningkatkan hasil dan produksinya.
4.5.1. Proses sakarifikasi dan fermentasi simultan pada suhu 30 0C
Perlakuan pertama pada penelitian ini menggunakan suhu 30 0C dengan
pH 4; 4,5; dan 4,8. Kondisi ini memungkinkan kapang Trichoderma viride dan
Saccaromyces cereviceae untuk tumbuh dengan baik. Grafik nilai pH, OD, dan
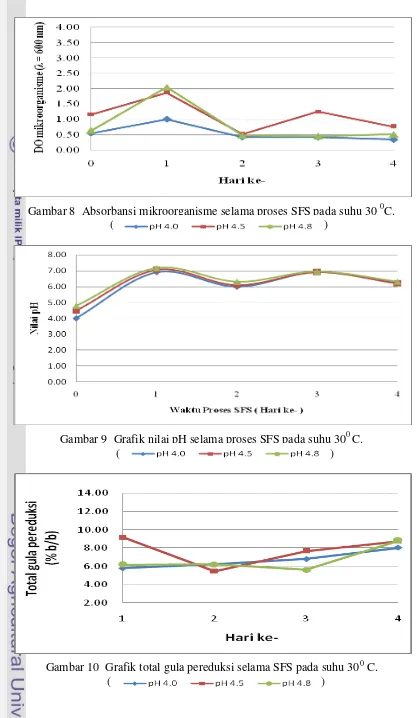
Gambar 8 Absorbansi mikroorganisme selama proses SFS pada suhu 30 0C. ( )
Gambar 9 Grafik nilai pH selama proses SFS pada suhu 300 C. ( )
25
Pertumbuhan dapat didefenisikan sebagai pertambahan secara teratur
semua komponen di dalam sel hidup (Fardiaz 1989). Mikroorganisme akan
tumbuh dan mempunyai aktifitas fisiologis sebagai respon terhadap
lingkungannya. Pola pertumbuhan dan penghasilan suatu produk menggambarkan
kemampuan sel dalam merespon lingkungan (Wang et al. 2006). Pertumbuhan
T.viride dan S. cereviceae pada medium dengan pH 4; 4,5; dan pH 4,8 yang dapat
dilihat pada Gambar 8 mempunyai kecenderungan pola pertumbuhan yang sama
pada setiap pH yaitu hari ke-0 sampai dengan hari pertama mengalami fase
logaritmik yang ditandai dengan meningkatnya jumlah mikroorganisme pada hari
pertama. Kenaikan jumlah mikroorganisme tersebut dipengaruhi juga oleh suhu
pertumbuhan mikroorganisme, dimana suhu optimum Trichoderma viride untuk
tumbuh 28-300C (Waluyo 2004) dan suhu optimum Saccharomyces cereviceae
30-340C (Kunkee dan Mardon 1970).
Lamanya fase logaritmik bervariasi tergantung dari jumlah dan pengaruh
medium yang digunakan, lingkungan pertumbuhan dan jumlah inokulum dimana
jumlah awal sel yang tinggi akan mempercepat fase logaritmik. Hari pertama
sampai hari keempat pertumbuhan kedua mikroorganisme tersebut mengalami
penurunan. Hal ini diduga terjadi karena zat nutrisi di dalam medium sudah sangat
berkurang karena dipakai oleh kedua mikroorganisme tersebut untuk
pertumbuhannya. Hal ini sesuai dengan pernyataan Fardiaz (1989) bahwa
penurunan jumlah mikroorganisme disebabkan oleh zat nutrisi di dalam medium
sudah sangat berkurang dan juga disebabkan oleh adanya hasil-hasil metabolisme
yang mungkin beracun atau dapat menghambat pertumbuhan jasad renik.
Peningkatan dan penurunan jumlah mikroorganisme akan mempengaruhi pH
media. Nilai pH media selama proses sakarifikasi dan fermentasi simultan selama
4 hari pada suhu 300 C dengan pH media awal 4; 4,5; dan 4,8 yang dapat dilihat
pada Gambar 9 berturut-turut berkisar antara 4,00-6,90, 4,5-7,06 dan 4,8-7,17.
Kenaikan pH pada perlakuan ini diduga disebabkan oleh munculnya
senyawa-senyawa amoniakal akibat metabolit sekunder dari mikroorganisme tersebut dan
juga diakibatkan oleh penggunaan karbon oleh mikroorganisme sehingga
Gula pereduksi adalah gula yang mempunyai kemampuan untuk
mereduksi. Gula pereduksi dihitung dengan menggunakan metode DNS. Gula
pereduksi akan menghasilkan warna kuning sampai kemerah-merahan sesuai
dengan kandungan gula sederhana yang terdapat di dalam cairan media SFS. Hal
ini dikarenakan adanya gugus keton dan aldehid (-CHO). Contoh gula pereduksi
adalah glukosa, manosa, fruktosa, laktosa, maltose dan lain-lain (Subekti 2006).
Pengukuran total gula pereduksi pada penelitian ini dimulai dari hari pertama
karena pada hari ke 0 diasumsikan belum terjadi hidrolisis enzim untuk
menghasilkan gula pereduksi. Total gula pereduksi yang dihasilkan dari proses
sakarifikasi dan fermentasi simultan pada suhu 300C dapat dilihat pada Gambar 10
yang berada pada kisaran 5,48 – 9.18% (b/b), dimana dari hari pertama sampai
hari keempat cenderung meningkat. Peningkatan total gula pereduksi menurut
Sari (2010) disebabkan adanya enzim selulase yang menghidrolisis selulosa
menjadi gula pereduksi. Peningkatan total gula pereduksi juga diduga disebabkan
oleh ketidakmampuan S. cereviceae untuk menggunakan total gula pereduksi
untuk menghasilkan bioetanol, sehingga total gula pereduksi tetap tinggi. Tamada
et al. (1987) menyatakan bahwa ada hubungan antara aktivitas selulase dan
produksi glukosa karena selulase digunakan untuk pemecahan selulosa menjadi
glukosa.
Etanol yang terbentuk selama proses sakarifikasi dan fermentasi simultan
merupakan produk hasil metabolit sekunder dari pertumbuhan mikroorganisme.
Pada proses sakarifikasi dan fermentasi simultan pada suhu 300 C tidak
menghasilkan kadar etanol (0% etanol) yaitu pada pH awal 4; 4,5 dan 4,8. Etanol
tidak terbentuk diduga karena kondisi sampel yang memiliki pH mencapai 7 yang
dapat mengakibatkan mikroorganisme tersebut tidak menghasilkan aktivitas
enzim yang maksimal. Fardiaz (1989) menyatakan bahwa bahwa kebanyakan
khamir lebih menyukai tumbuh pada keadaan asam, yaitu pH 4-4,5 dan tidak
dapat tumbuh dengan baik pada medium alkali, kecuali jika telah beradaptasi.
Etanol belum dihasilkan pada perlakuan suhu 300C diduga disebabkan
oleh kurangnya waktu proses SFS. Kondisi ini didukung oleh hasil pengukuran
total gula pereduksi (TGP) yang mana TGP terbentuk setiap harinya meningkat
27
fermentasi. Hasil pengukuran OD mikroorganisme menunjukkan bahwa
mikroorganisme tersebut belum memasuki fase stasioner dan masih mengalami
fluktuasi sehingga etanol belum terbentuk.
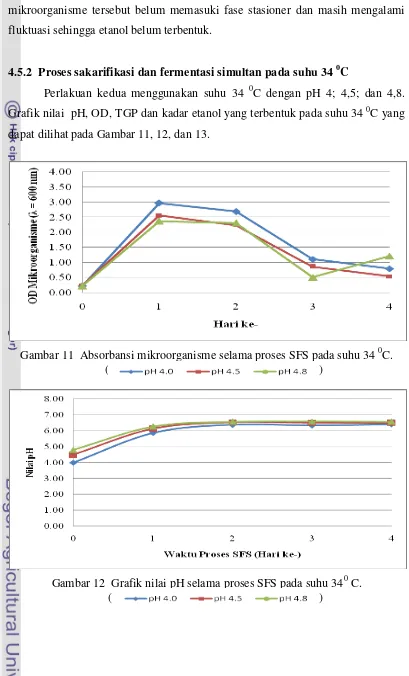
4.5.2 Proses sakarifikasi dan fermentasi simultan pada suhu 34 0C
Perlakuan kedua menggunakan suhu 34 0C dengan pH 4; 4,5; dan 4,8.
Grafik nilai pH, OD, TGP dan kadar etanol yang terbentuk pada suhu 34 0C yang
dapat dilihat pada Gambar 11, 12, dan 13.
Gambar 11 Absorbansi mikroorganisme selama proses SFS pada suhu 34 0C. ( )
Gambar 13 Grafik total gula pereduksi selama SFS pada suhu 340C. ( )
Pertumbuhan mikroorganisme pada media dengan pH 4, 4,5, dan 4,8 pada
Gambar 11 memiliki kecenderungan yang sama yaitu mengalami peningkatan
pada hari pertama kemudian mengalami penurunan pada hari kedua sampai hari
keempat. Peningkatan jumlah mikroorganisme pada hari ke 0 sampai hari pertama
dipengaruhi oleh banyak faktor diantaranya adalah faktor biologis, misalnya:
bentuk dan sifat mikroorganisme terhadap lingkungan yang ada, asosiasi
kehidupan organisme yang bersangkutan dan kandungan non biologis, misalnya
kandungan hara didalam media kultur, suhu, kadar oksingen, cahaya, bahan kimia
dan lain-lain. Jika faktor-faktor diatas optimal, maka peningkatan kurva akan
tampak meningkat (Pelczar dan Chan 1986). Hal ini didukung oleh Fardiaz (1989)
yang menyatakan bahwa nutrien di dalam medium sudah habis, energi cadangan
di dalam sel habis dan habisnya nutrien didalam medium diakibatkan oleh
pemakaian ke dua jenis mikroorganisme untuk pertumbuhannya dan
mempengaruhi pH media.
Nilai pH media pada suhu 340 C yang dapat dilihat pada Gambar 12
dengan pH media awal 4; 4,5; dan 4,8 berturut-turut diperoleh nilai perubahan pH
berkisar 4,0 - 6,42; 4,5 – 6,51 dan 4,8 – 5,59. Kenaikan pH pada suhu 34 0C
menurut Yulianto (2001) juga disebabkan oleh yeast extract yang digunakan dapat
mengalami deaminasi hingga mengakibatkan pH media meningkat dan perubahan
naik turunnya pH kultur dipengaruhi oleh besar kecilnya perbandingan antara
29
diduga disebabkan oleh penggunaan karbon yang digunakan untuk pertumbuhan
sehingga menghasilkan senyawa amoniakal melalui proses metabolit sekunder.
Jumlah mikroorganisme mengalami penurunan dari hari pertama sampai dengan
hari selanjutnya. Hal ini diduga glukosa mempengaruhi pertumbuhan
mikroorganisme. Petrik et al. (1982) konsentrasi glukosa yang terlalu tinggi dapat
menyebabkan depresi pada sistem metabolisme mitokondria dan sintesis sel atau
sering disebut dengan glucose effect.
Total gula pereduksi yang dihasilkan dari proses sakarifikasi dan
fermentasi simultan pada suhu 340C dapat dilihat pada Gambar 13 berkisar antara
3,49-12,95% (b/b). Total gula pereduksi pada awal proses mengalami kenaikan.
Hasil penelitian Resita (2006) menunjukkan bahwa peningkatan total gula
pereduksi tersebut disebabkan oleh mikroorganisme T. viride yang menghidrolisis
selulosa menjadi gula pereduksi menggunakan enzim selulase yang dihasilkannya
sehingga pada hari pertama sampai hari kedua total gula pereduksi naik.
Peningkatan gula pereduksi yang dihasilkan menunjukkan bahwa cukup nutrisi
bagi T. viride untuk menghasilkan enzim selulase dan juga dapat dilihat OD
mikroorganisme meningkat yang berarti mikroorganisme tersebut dapat tumbuh
dengan baik.
Hari ketiga total gula pereduksi mengalami penurunan, hal ini disebabkan
gula pereduksi digunakan mikroorganisme untuk pertumbuhan sel dan
pembentukan produk. Hal ini menurut Putri dan Sukandar (2008) disebabkan oleh
gula pereduksi yang terdapat dalam media digunakan sebagai sumber karbon bagi
sel khamir untuk mensintesis energi melalui fermentasi etanol. Adanya enzim
selulase yang dihasilkan mampu melonggarkan dan menghidrolisis ikatan-ikatan
selulosa, sehingga Saccharomyces cereviceae lebih mudah memanfaatkan glukosa
hasil hidrolisis untuk menghasilkan etanol.
Pada proses sakarifikasi dan fermentasi simultan pada suhu 34 0C tidak
menghasilkan etanol yaitu dengan pH awal 4; 4,5; dan 4,8. Horn (2000)
menyatakan bahwa hal tersebut diduga oleh masih adanya komponen-komponen
lain yang dapat menghambat pembentukan etanol seperti alginat, fukoidan, protein
proses degradasi protein serta bentuk phenol yang kompleks dengan protein tidak
dapat diakses untuk didegradasi oleh mikroorganisme.
Etanol tidak terbentuk pada penelitian ini juga diduga karena kondisi
sampel yang memiliki pH mencapai 7 yang dapat mengakibatkan mikroorganisme
tersebut tidak menghasilkan aktivitas enzim yang maksimal karena menurut
Harrison dan Graham 1970 menyatakan bahwa biakan S. cereviceae mempunyai
kecepatan fermentasi optimum pada pH 4,48. Fardiaz (1989) juga menyatakan
bahwa kebanyakan khamir lebih menyukai tumbuh pada keadaan asam, yaitu pH
4 – 4,5 dan tidak dapat tumbuh dengan baik pada medium alkali, kecuali jika telah
beradaptasi.
Faktor lain yang menyebabkan tidak terbentuknya etanol antara lain
karena penggunaan nutrien oleh Trichoderma viride untuk mengubah selulosa
menjadi glukosa yang mengakibatkan kepada pertumbuhan Saccharomyces
cereviceae menjadi terganggu dan tidak dapat memprodukasi etanol. Etanol tidak
terbentuk pada perlakuan ini juga diduga diakibatkan kurangnya waktu proses
SFS untuk mengubah glukosa menjadi etanol. Hal tersebut dapat dilihat bahwa
total gula pereduksi masih meningkat walaupun pada hari ketiga mengalami
penurunan dan juga OD mikroorganisme belum memasuki fase stasioner dan
masih mengalami fluktuasi sehingga etanol belum terbentuk. Shofiyanto (2008)
menyatakan bahwa disamping kondisi lingkungan seperti suhu dan pH, kebutuhan
nutrient dan kofaktor juga memegang peranan penting bagi kehidupan khamir.
Kebutuhan relatif nutrien sebanding dengan komponen utama sel khamir, yaitu
mencakup karbon, oksigen, nitrogen dan hidrogen. Pada jumlah lebih rendah,
fosfor, sulfur, potasium, dan magnesium juga harus tersedia untuk sintesis
komponen-komponen minor. Beberapa mineral (Mn, Co, Cu dan Zn) dan faktor
pertumbuhan organik (asam amino, asam nukleat, dan vitamin) diperlukan dalam
jumlah kecil. Substrat yang digunakan untuk memproduksi etanol dalam jumlah
besar biasanya mengandung nutrien yang diperlukan untuk pertumbuhan khamir.
4.5.3 Proses sakarifikasi dan fermentasi simultan pada suhu 380 C
Perlakuan ketiga menggunakan suhu 38 0C dengan pH 4; 4,5; dan 4,8.
31
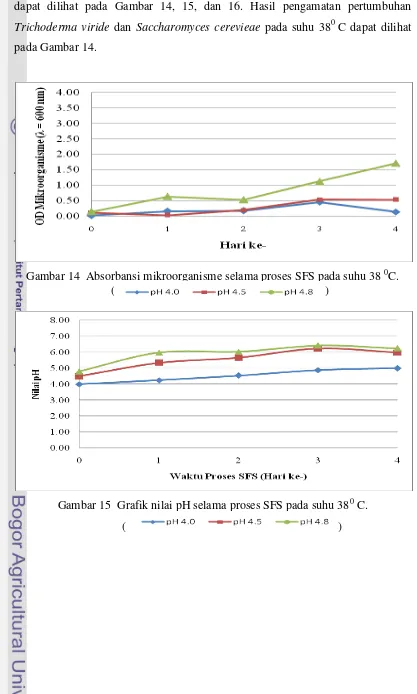
dapat dilihat pada Gambar 14, 15, dan 16. Hasil pengamatan pertumbuhan
Trichoderma viride dan Saccharomyces cerevieae pada suhu 380 C dapat dilihat
pada Gambar 14.
Gambar 14 Absorbansi mikroorganisme selama proses SFS pada suhu 38 0C. ( )
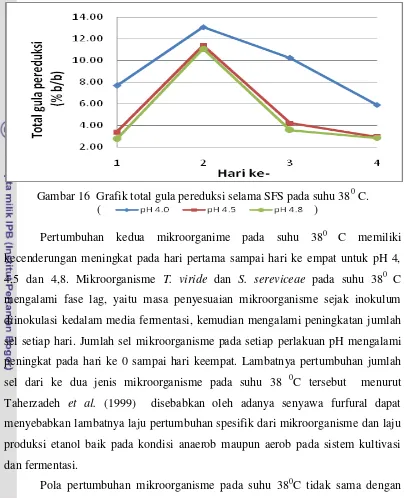
Gambar 15 Grafik nilai pH selama proses SFS pada suhu 380 C.