IKAN NILA
Oreochromis niloticus
MULYATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Penapisan Bakteri Probiotik untuk Pengendalian Penyakit Streptococcosis pada Ikan Nila Oreochromis niloticus adalah benar hasil karya saya sendiri dengan arahan dari komisi pembimbing dan belum pernah dipublikasikan kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Juni 2010
MULYATI
MULYATI. Screening of Probiotic Bacterium for Controling Streptococcosis in Tilapia Oreochromis niloticus. Under the direction of SUKENDA and WIDANARNI.
Streptococcus iniae is a pathogenic bacteria that responsible for streptococcosis disease in tilapia. The used of probiotic bacteria is one of the method in aquaculture that was used to control infectious diseases. The aimed of this research was to find probiotic bacteria from intestine of fresh water fishes and water media potentially inhibit S. iniae infection in tilapia. Eighty six isolates of bacteria that had been isolated from tilapia, common carp, siam catfish, walking catfish and jelawat, as well as from water media, were in vitro and in vivo tested to find out its ability to inhibit S. iniae. Five isolates namely AN3, AL4, WY3 that isolated from tilapia, common carp and catfish intestine respectively, as well as DM1 and KH1 from water media have inhibition activity against S. iniae in vitro and in vivo test. The highest protection of tilapia against S. iniae was showed in fish previously injected with DM1 and AN3. 16SrRNA gene based sequencing of DM1 and AN3 showed that the isolate was Proteus mirabilis and Aeromonas sobria respectively.
MULYATI. Penapisan Bakteri Probiotik untuk Pengendalian Penyakit Streptococcosis pada Ikan Nila Oreochromis niloticus. Dibimbing oleh SUKENDA dan WIDANARNI.
Streptococcus iniae adalah bakteri patogen yang menjadi penyebab utama atas wabah penyakit streptococcosis pada ikan nila. Penyakit S. iniae biasanya muncul pada saat adanya perubahan cuaca secara drastis. S. iniae dapat menyebabkan kerusakan jaringan otak yang mengganggu keseimbangan ikan bahkan dapat menyebabkan kematian. Salah satu alternatif untuk menghambat S. iniae adalah dengan menggunakan bakteri probiotik yang dapat menekan pertumbuhan Streptococcus tersebut.
Penelitian ini bertujuan untuk mendapatkan sejumlah isolat bakteri probiotik asal usus dan air pemeliharaan ikan air tawar yang potensial menghambat pertumbuhan S. iniae serta efektif untuk mengendalikan penyakit infeksi streptococcosis pada ikan nila.
Bakteri probiotik diisolasi dari usus (saluran pencernaan) ikan air tawar seperti ikan jelawat Leptobarbus hoeveni Blkr, ikan mas Cyprinus carpio, ikan nila Oreochromis niloticus, ikan lele Clarias sp., ikan patin Pangasius hyphothalmus, dan air pemeliharaan ikan air tawar menggunakan media TSA-Agar.
Jumlah isolat bakteri yang diisolasi dari ikan nila, ikan lele, ikan mas, ikan jelawat, ikan patindan air pemeliharaan sebanyak 86 isolat bakteri. Dari 86 isolat bakteri tersebut, 27 diantaranya diisolasi dari usus ikan nila, sembilan dari ikan lele, 10 dari ikan patin, 10 dari ikan mas, satu dari ikan jelawat dan 29 dari air pemeliharaan.
dengan isolat bakteri probiotik diamati setelah uji tantang dengan bakteri S. iniae sampai hari ke-15 pasca infeksi. Pemberian isolat bakteri probiotik dengan injeksi memberikan pengaruh yang nyata (p<0,05) terhadap tingkat kelangsungan hidup ikan nila yang diinjeksi dengan bakteri S. iniae. Hal ini terlihat dari tingkat kelangsungan hidup ikan nila pada kontrol positif (hanya diinokulasi S. iniae) lebih rendah (73,33%) dibanding perlakuan dengan penambahan isolat probiotik (86,67-100%).
Peningkatan nilai kelangsungan hidup ikan nila disebabkan karena adanya penghambatan pertumbuhan S. iniae oleh bakteri probiotik dengan menurunnya jumlah populasi bakteri S. iniae, baik pada otak maupun pada darah ikan nila dibandingkan dengan perlakuan kontrol positif. Berdasarkan analisa ragam, pemberian isolat bakteri melalui injeksi memberikan pengaruh yang nyata (p<0,05) terhadap jumlah S. iniae pada otak dan darah ikan nila.
Pengamatan terhadap pertumbuhan, dalam hal ini pertumbuhan harian ikan nila hingga hari ke-15 pemeliharaan menunjukkan bahwa tidak memberikan perbedaan nyata (P>0,05) antar perlakuan.
Hasil sekuensing gen 16S-rRNA isolat AN3 menunjukkan bahwa isolat tersebut termasuk spesies Aeromonas sobria dengan indeks kemiripan 99%, sedangkan isolat DM1 termasuk spesies Proteus mirabilis dengan indeks kemiripan 99%.
Lima isolat bakteri probiotik (AN3, AL4, WY3, DM1 dan KH1) memiliki potensi menghambat pertumbuhan S. iniae pada ikan nila. Kelima isolat tersebut mampu meningkatkan kelangsungan hidup ikan nila yang diinfeksi dengan S. iniae sehingga bisa digunakan sebagai probiotik. Kelima isolat tersebut dapat dijadikan alternatif pengendalian penyakit streptococcosis pada ikan nila.
©
Hak Cipta Milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
IKAN NILA
Oreochromis niloticus
MULYATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : C151070051
Disetujui
Komisi Pembimbing
Dr. Ir. Sukenda, M.Sc. Dr. Ir. Widanarni, M.Si. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Akuakuktur
Prof. Dr. Ir. Enang Harris, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT, karena hanya atas rahmat dan karunia serta ridho-Nyalah tesis yang berjudul Penapisan Bakteri Probiotik untuk Pengendalian Penyakit Streptococcosis pada Ikan Nila Oreochromis niloticus dapat diselesaikan.
Pelaksanaan penelitian dan penulisan tesis ini tidak terlepas dari bantuan dan bimbingan berbagai pihak. Pada kesempatan ini, penulis menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Bapak Dr. Sukenda dan Ibu Dr. widanarni selaku komisi pembimbing atas pengarahan dan bimbingan yang telah diberikan selama penelitian dan penulisan tesis ini sehingga dapat penulis selesaikan dengan baik.
2. Ketua Program Studi Ilmu Akuakultur, Staf Laboratorium Kesehatan Ikan, Institut Pertanian Bogor yang telah membantu dalam penyediaan fasilitas hingga terlaksananya penelitian ini.
3. Ayahanda dan Ibunda, adik-adikku yang telah banyak memberikan bantuan baik materi maupun moral serta suami tercinta Ma’mur yang selama ini telah banyak berkorban dan bersabar, hingga penulis mampu menyelesaikan studi ini dengan baik.
4. Rekan-rekan AKU’ 2007 (Suryati, Sunarto, Sabariah, Ilyas Rajamuddin, Mirna, Darmi, Rahmawati, Tita, Mulyasari, Deni, Indra, Afrizal, Ririn, Dian, Suryansah, Mien, Ellen, Dita, Purnamawati, Adang, Didik, Dasu, Ujang Dinding, Limin, Ratnawati). Teman-teman Bara 132 (Uni, Wiwik, Ancu, Rusli, Bu Mia, Pak Patur, Warnida, Dhody, Pak Sahrir, Pak Danial) serta adik-adik mahasiswa BDP 41,42 atas kerja samanya.
Bogor, Juni 2010
Penulis dilahirkan di Ujung Pandang pada tanggal 10 Juli 1970, dari Ayah Drs. H. Kaharuddin Pasdar dan Ibu Hj. Sitti Harisah, S.Pd. Penulis merupakan anak pertama dari tujuh bersaudara.
Tahun 1989 penulis lulus dari SMA Negeri 8 Makassar dan pada tahun itu juga penulis terdaftar sebagai mahasiswa Politeknik Pertanian Unhas dan selesai pada tahun 1992. Tahun 1996 terdaftar sebagai mahasiswa Jurusan Perikanan Fakultas Pertanian Universitas Muhammadiyah Makassar melalui jalur transfer untuk mendalami program budidaya perairan.
DAFTAR ISI
Bakteri Streptococcus sp. pada Ikan Nila ... 4
Ikan Nila Oreochromis niloticus ... 5
Probiotik Akuakultur... 7
Mekanisme Kerja Probiotik ... 9
Identifikasi Bakteri dengan Teknik Molekuler... 12
METODOLOGI PENELITIAN ... 13
Waktu dan Tempat... 13
Isolasi dan Pemurnian ... 13
Uji Penghambatan Bakteri terhadap S. iniae secara In Vitro... 14
Uji Patogenisitas Bakteri Probiotik ... 14
Uji Penghambatan Bakteri terhadap S. iniae secara In Vivo... 15
Identifikasi Bakteri secara Molekuler... 15
Ekstraksi DNA ... 15
Amplifikasi gen 16S-rRNA dengan PCR ... 16
Parameter yang Diamati ... 17
Tingkat Kelangsungan Hidup Ikan Nila ... 17
Laju Pertumbuhan Bobot Harian Ikan Nila... 17
Populasi Bakteri ... 18
Analisa Statistik... 18
HASIL DAN PEMBAHASAN ... 19
Isolat Bakteri Probiotik ... 19
Penghambatan Bakteri terhadap S. iniae secara In Vitro... 20
Patogenisitas Bakteri Probiotik... 21
Penghambatan Bakteri terhadap S. iniae secara In Vivo... 22
Identifikasi Bakteri Terpilih ... 28
KESIMPULAN DAN SARAN ... 31
Kesimpulan ... 31
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
1 Streptococcus iniae pewarnaan gram pembesaran 1000X ... 5
2 Penampilan Koloni Bakteri Probiotik, A. Isolat DM1 dan B. Isolat AN3 ... 19
3 Kelangsungan Hidup Ikan Nila pada Uji Patogenisitas... 22
4 Kelangsungan Hidup Ikan Nila pada Uji In Vivo ... 23
5 Rataan Populasi Bakteri S.iniae dalam Otak Ikan Nila... 24
6 Rataan Populasi Bakteri S.iniae dalam darah ikan Nila... 25
7 Pohon filogenetik isolat AN3 ... 29
DAFTAR LAMPIRAN
Halaman 1 Pembuatan media TSA (Trypticase Soy Agar), TSB (Trypticase Soy
Broth), BHIA (Brain Heart Infission Agar) dan PBS (Phospat Buffer
saline ……… 37
2 Asal dan Kode Isolat Bakteri Probiotik yang Digunakan dalam
Penelitian ……….. ……... 39
3 Karakteristik Morfologi Koloni Bakteri Air Tawar yang Potensial
sebagai Bakteri Probiotik terhadap S.iniae ………. 40
4 Zona Hambat yang Dihasilkan Bakteri Probiotik terhadap S.iniae…. 42
5 e Kelangsungan Hidup Ikan Nila (%) terhadap Bakteri Probiotik
selama Uji Patogenisitas ……… 43 6 Analisia Ragam dan Uji Duncan Tingkat Kelangsungan Hidup Ikan
Nila (%) terhadap Bakteri Probiotik selama Uji patogenisitas ……… 44
7 Kelangsungan Hidup (ekor) Ikan Nila pada Uji Tantang Bakteri
Probiotik dengan S. iniae pada Ikan Nila……….. 45
8 Analisis Ragam dan Uji Duncan Tingkat Kelangsungan Hidup (%)
Bakteri Probiotik dengan S. iniae pada Ikan Nila ……… 47
9 Populasi Bakteri S.iniae (cfu/ml) pada Otak Ikan Nila Setelah Diinjeksi
Bakteri Probiotik dengan S. iniae pada Ikan Nila Setiap 6 Jam ……… 48
10 Populasi Bakteri S.iniae (cfu/ml) Setiap 6 Jam pada Otak Ikan Nila
Setelah Diinjeksikan Bakteri Probiotik dengan S. iniae pada Ikan Nila 49
11 Analisis Ragam dan Uji Duncan Populasi Bakteri S.iniae pada
Otak Ikan Nila Setiap 6 Jam……….. 49
12 Populasi Bakteri S. iniae (cfu/gr) pada Darah ikan nila setelah
Diinjeksi Setiap 6 Jam Pengamatan ……….. 53
13 Populasi Bakteri S.iniae (cfu/ml) Setiap 6 Jam pada Darah Ikan Nila
Setelah Diinjeksikan Bakteri Probiotik dengan S. iniae pada Ikan Nila 54
14
15
Analisis Ragam dan Uji Duncan Log Jumlah Populasi Bakteri S.iniae
pada Darah Ikan Nila Setiap 6 Jam………..
Pertumbuhan Harian (%) Ikan Nila selama Pengamatan ……….
55
16
17
22
Analisis Ragam dan Uji Duncan Pertumbuhan Harian (%) Bakteri Probiotik dengan S. iniae pada Ikan Nila ………
Hasil Sekuensing 16S-rRNA Isolat AN3 ……….
Hasil Sekuensing 16S-rRNA Isolat DM1 ………
59
60
PENDAHULUAN
Latar Belakang
Ikan nila Oreochromis niloticus merupakan jenis ikan yang mempunyai nilai ekonomis tinggi dan merupakan komoditas penting dalam budidaya ikan air tawar dunia. Beberapa hal yang mendukung pentingnya komoditas ikan nila adalah memiliki toleransi yang luas terhadap kondisi lingkungan, memiliki kemampuan yang efisien dalam membentuk protein dari bahan organik, limbah domestik dan pertanian, memiliki kemampuan tumbuh yang baik dan mudah tumbuh dalam sistem budidaya intensif (Sucipto 2007).
Streptococcus iniae adalah bakteri patogen yang menjadi penyebab utama atas wabah penyakit streptococcosis pada ikan nila dan telah mengakibatkan kerugian budidaya ikan nila hampir di seluruh dunia dimana ikan ini dibudidayakan. Kerugian ekonomi yang disebabkan oleh S. iniae diperkirakan hingga US$ 10 juta per tahun di Amerika Serikat dan lebih dari US$ 100 juta di seluruh dunia (Baiano et al. 2008). Clark et al. (2000) melaporkan bahwa
penyakit S. iniae menyebabkan kematian ikan nila sekitar 50% sejak bulan
pertama dan meningkat hampir menjadi 80% sampai akhir masa pemeliharaan dalam keramba di Filipina.
Penyakit yang disebabkan oleh S. iniae ini bisa menyerang semua jenis ikan nila, baik ikan nila merah maupun ikan nila hitam. Penyakit S. iniae biasanya muncul pada saat adanya perubahan cuaca secara drastis, dari panas ke hujan maupun sebaliknya. S. iniae menyebabkan kerusakan jaringan otak yang mengganggu keseimbangan ikan bahkan dapat menyebabkan kematian (Supriyadi dan Komaruddin 2003).
menyebabkan timbulnya resistensi mikroorganisme patogen dan meninggalkan residu pada ikan dan lingkungannya (FAO/WHO/OIE 2006).
Mikroflora yang berada di lingkungan perairan dan saluran pencernaan organisme akuatik menunjukkan peran yang menguntungkan dalam menghadapi serangan penyakit (Gomez-Gill et al. 2000). Sebuah pendekatan baru yang dapat diterima di akuakultur adalah penggunaan bakteri probiotik untuk mengontrol patogen (Gomez-Gill et al. 2002; Robertson et al. 2000). Penggunaan bakteri probiotik ini dapat menekan pertumbuhan bakteri patogen, meningkatkan resistensi terhadap penyakit, meningkatkan nilai nutrisi ikan dan menjaga kualitas air dalam sistem produksi (Verschuere et al. 2000).
Kompetisi bakteri patogen dan bakteri probiotik telah dibuktikan oleh beberapa peneliti. Beberapa bakteri yang ditemukan di usus ikan air tawar mempunyai kemampuan antibakterial terhadap beberapa strain bakteri patogen
(Sugita et al. 1996). Strain Carnobacterium sp. yang diisolasi dari saluran
pencernaan ikan salmon atlantik, dapat digunakan sebagai probiotik dalam
budidaya ikan salmon atlantik dan rainbow trout (Roberston et al. 2000).
Mikroorganisme dari isi saluran pencernaan ikan flounder, Paralichtys olivacus telah diisolasi sebanyak 199 jenis, dari jumlah tersebut terpilih Weisella hellenica DS-12 sebagai kandidat probiotik karena mempunyai aktivitas antimikroba yang sempurna terhadap mikrob patogen dan dapat meningkatkan pertumbuhan flounder (Tae 2003).
Penelitian lainnya adalah penelitian yang dilakukan oleh Widanarni et al. (2003) dan Muliani et al. (2002) yang memperoleh beberapa isolat bakteri dari tambak dan air laut yang mampu menekan serangan bakteri Vibrio harveyi penyebab penyakit vibriosis pada udang sehingga kelangsungan hidup meningkat.
Vine et al. (2004) menemukan bahwa dengan penambahan bakteri kandidat
lingkungan pemeliharaan ikan lele dumbo menunjukkan kemampuan
menghambat A. hydrophila sehingga kelangsungan hidup dan pertumbuhan ikan
lele dumbo meningkat. Sasanti (2008) mendapatkan beberapa isolat yang diisolasi dari terumbu karang menunjukan kemampuan menghambat pertumbuhan V. harveyi pada larva udang sehingga dapat meningkatkan kelangsungan hidup larva udang. Sehubungan dengan hal tersebut diatas maka pemberian bakteri probiotik diharapkan dapat menekan pertumbuhan bakteri S. iniae dan dapat mengatasi penyakit streptococcosis dari serangan bakteri tersebut pada ikan nila.
Tujuan dan Manfaat
Penelitian ini bertujuan untuk mendapatkan sejumlah isolat bakteri probiotik asal usus dan air pemeliharaan ikan air tawar yang potensial menghambat pertumbuhan S. iniae serta efektif untuk mengendalikan penyakit infeksi streptococcosis pada ikan nila.
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai potensi isolat asal usus dan air pemeliharaan dalam menghambat pertumbuhan S. iniae untuk penanggulangan panyakit streptococcosis pada ikan nila.
Hipotesis
TINJAUAN PUSTAKA
Bakteri Streptococcus sp. pada Ikan Nila
Streptococcus sp. adalah bakteri penyebab penyakit infeksi yang serius dan telah diisolasi dari beberapa jenis ikan air tawar dan ikan laut. Penyakit tersebut dikenal sebagai streptococcosis dan juga menjadi masalah utama dalam budidaya ikan nila (Al Harbi 1996; Perera et al. 1994). Dilaporkan oleh Clark et al. (2000) bahwa penyakit streptococcosis menyebabkan kematian ikan nila sekitar 50% sejak bulan pertama dan meningkat hampir menjadi 80% sampai akhir masa pemeliharaan dalam keramba di Filipina.
Pada beberapa budidaya ikan khususnya nila, infeksi Streptococcus sp. dapat menyebabkan penyakit meningoencephalitis karena menyerang otak (Dodson et al. 1999; Fuller et al. 2001). Kematian ikan akibat infeksi tersebut ditandai dengan adanya perubahan-perubahan pada bagian eksternal maupun internal tubuh ikan, seperti oleh adanya pendarahan, exopthalmia, ulcer atau luka pada permukaan tubuh dan perubahan warna pada hati. Ikan yang terserang streptococcosis menunjukkan gejala seperti sisiknya hilang, gerakan renang tidak menentu (erratic), sirip gripis (Clark et al. 2000). Pada beberapa kasus, infeksi menyebabkan kerusakan patologi yang berbeda pada ikan nila, tergantung pada tipe sel. Limfosit dan sel sitotoksik non spesifik (NCC) adalah target sel dari mikroorganisme ini (Taylor et al. 2001).
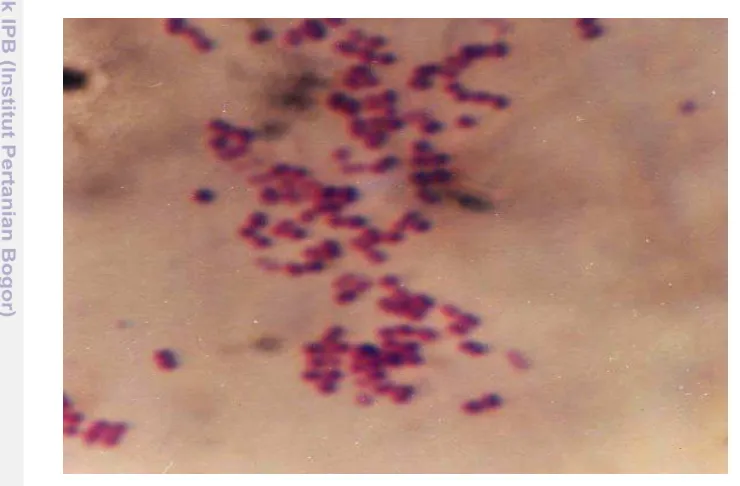
Bakteri yang diisolasi dari ikan nila O. niloticus dan diidentifikasi sebagai S. iniae adalah bakteri gram positif berbentuk bulat (coccus dan kadang-kadang avoid) biasanya terdapat dalam bentuk rantai yang terdiri dari dua hingga sepuluh sel (Gambar 1). Bakteri ini bersifat tidak bergerak (non motil), tidak berkapsul, tidak membentuk spora, katalase dan oksidase negatif, memperlihatkan beta
hemolisis, tumbuh pada suhu 10oC tetapi tidak pada 45oC, dapat menghidrolisa
esculin tetapi tidak pada hipurate, menghasilkan asam dari glukosa, manitol, saksin dan trehalose tetapi tidak pada laktosa atau sorbitol (Bowser et al. 1998; Al Harbi, 1996; Perera et al. 1994; Toranzo et al. 1994; Rotta, 1984 dan Kusuda et al. 1999, diacu dalam Plumb, 1999).
Gambar 1 Streptococcus iniae hasil pewarnaan gram (pembesaran 1000 X).
Ikan Nila Oreochromis niloticus
Ikan nila merupakan ikan yang berasal dari Afrika. Ikan nila terdiri atas 3 genus yaitu : Oreochromis, Sarotherodon dan Tilapia (Fitzsimmons 2000; Chapman 2000). Karakteristik yang membedakan diantara ketiganya adalah dalam hal melindungi telur/larvanya. Spesies dari genus Sarotherodon dan Oreochromis mengerami dan melindungi larva di mulut induknya, pada umumnya
genus Tilapia menginkubasi telur pada sarang yang dibuatnya di dasar kolam. Untuk selanjutnya, penggunaan nama dari ketiga genus tersebut adalah tilapia, nila tilapia diperuntukkan bagi spesies Oreochromis niloticus.
Ikan nila dapat mencapai ukuran 40 cm. Ikan ini dapat mencapai matang telur pada umur 4-5 bulan dengan berat 120-180 g, dan dapat memijah beberapa kali dalam setahun. Pada kebanyakan ikan nila, ikan jantan umumnya berukuran lebih besar dari ukuran ikan betina. Hal ini disebabkan karena ikan betina secara teratur akan memijah walaupun telur tidak dibuahi sehingga energi untuk pertumbuhan digunakan untuk memproduksi telur. Bila ada ikan jantan dan telur dibuahi maka ikan betina akan berpuasa selama pengeraman telur di dalam mulutnya, sehingga ikan akan kurus (Angka et al. 1990).
Lingkungan ekologis ikan nila merupakan bentopelagik yang hidup di perairan tawar maupun perairan payau. Di daerah tropis ikan nila tahan pada temperatur 8–42oC. Ikan nila merupakan ikan pemakan phytoplankton dan alga bentos. Antigenisitas dari bakteri S. iniae akan meningkat seiring dengan peningkatan salinitas. Ikan nila pada salinitas 15–30 ppt dengan suhu perairan 25–30oC telah rentan terhadap S. iniae dari pada ikan nila yang dipelihara pada perairan tawar dengan suhu yang sama (Chang & Plumb 1996).
Probiotik Akuakultur
Probiotik telah didefinisikan dalam beberapa pengertian tergantung pada pemahaman mekanismenya dalam memberikan pengaruh bagi kesehatan dan kehidupan organisme. Istilah probiotik pertama kali dicetuskan untuk mendeskripsikan senyawa yang dihasilkan mikroorganisme yang dapat menstimulir pertumbuhan mikroorganisme lain. Selanjutnya definisi probiotik berkembang menjadi organisme dan senyawa yang dapat menghasilkan keseimbangan mikroflora usus. Beberapa definisi tentang probiotik diungkapkan oleh beberapa peneliti antara lain: Irianto (2003) mendefinisikan probiotik sebagai makanan tambahan (suplemen) berupa sel-sel mikroba hidup yang memiliki pengaruh menguntungkan bagi hewan inang yang mengkonsumsinya melalui penyeimbangan flora mikroba di dalam intestinumnya. Namun definisi ini lebih ditujukan pada hewan teresterial dan manusia dengan menekankan bahwa probiotik merupakan mikroba hidup yang diberikan melalui makanan. Dalam aplikasinya pada akuakultur perlu ditinjau kembali, karena karakteristik lingkungan perairan berbeda dengan terestrial (Irianto 2003). Oleh karena itu,
Verschuere et al. (2000) mengusulkan definisi probiotik sebagai mikroba
tambahan yang memberikan pengaruh menguntungkan bagi inang melalui modifikasi komunitas mikroba atau assosiasi dengan inang, menjamin perbaikan penggunaan pakan atau perbaikan nilai nutrisinya, memperbaiki respon inang terhadap penyakit atau memperbaiki kualitas lingkungan ambangnya.
Beberapa kriteria yang perlu dipertimbangkan untuk mendapatkan produk probiotik dengan pengaruh positif yang optimal bagi inangnya menurut Aslamyah (2006), Schrezenmeir & Vrese (2001), Irianto (2003), Lisal (2005), Ellen & Gibson (2006) dan Kesarcodi-Watson et al. (2008) adalah sebagai berikut:
1. Spesies bakteri probiotik sebaiknya merupakan mikroflora normal usus
2. Mempunyai kapasitas untuk bertahan hidup (survive), untuk melakukan kolonisasi (colonize) serta melakukan metabolisme (metabolize) dalam saluran cerna.
3. Bersifat non patogenik dan non toksik bagi inang.
4. Toleran terhadap asam lambung dan garam empedu.
5. Memiliki kemampuan untuk menempel dan mengkolonisasi usus.
6. Memiliki aktivitas antagonistik terhadap mikroba patogen.
7. Terbukti memiliki pengaruh yang menguntungkan bagi inangnya baik secara
in vitro maupun secara in vivo.
8. Memiliki kemampuan untuk bertahan selama proses pengolahan dan selama
waktu penyimpanan.
9. Produk probiotik diharapkan memiliki jumlah sel hidup yang besar (107
sampai 109).
10. Probiotik dapat disiapkan sebagai produk sel hidup pada skala industri.
Selain itu, probiotik dapat terjaga stabilitas dan sintasannya untuk waktu yang lama pada waktu penyimpanan maupun di lapangan.
Pemanfaatan probiotik dalam bidang perikanan menyebabkan definisi probiotik mengalami perkembangan. Pada hewan akuatik, tidak hanya saluran pencernaan yang penting, tapi juga air yang menjadi habitatnya (Gomez-Gill et al. 2000). Hal ini didukung oleh Verschuere et al. (2000) yang menyatakan bahwa pada hewan akuatik selain saluran pencernaan, air di sekeliling organisme tersebut juga memegang peranan penting.
Menurut Gomez-Gill et al. (2000), konsep probiotik yang dikembangkan
bioremidiasi digolongkan pula sebagai probiotik. Pada akuakultur, probiotik dapat berasal dari bakteri, yeast, mikroalga serta bakteriofag.
Pemanfaatan beberapa bakteri yang berada dalam wadah budidaya dan tubuh mikroorganisme akuatik seperti ikan dan udang sebagai probiotik telah dilakukan dan mampu menunjukkan pengaruh positif terhadap pertumbuhan dan kesehatan melalui peningkatan keseimbangan mikrobial dalam tubuh (Gullian et al. 2004; Nikoskelainen et al. 2003; Villamil et al. 2003). Beberapa jenis bakteri yang mampu berperan sebagai probiotik pada organisme akuatik Vibrio alginolythicus, Vibrio harveyi, Pseudomonas sp., Nitrobacter sp. untuk udang, Nitrosomonas sp., Lactic bacteria, Lactobacillus plantarum, Lactobacillus helveticus, Streptococcus lactis untuk ikan turbot, Alteromonas sp., Aeromonas media untuk Oyster, Rosebacter sp., Vibrio sp. untuk scallop (Gomez-Gil et al. 2000). Bakteri yang dominan terdapat pada air tawar antara lain Aeromonas sp., Plesiomonas, Clostridium sp., Enterobacteriaceae dan beberapa diantaranya bersifat antagonistik satu sama lain misalnya dengan kemampuan antibakterial, sehingga bisa dimanfaatkan sebagai probiotik bagi ikan air tawar (Sugita et al. 1996).
Mekanisme Kerja Bakteri Probiotik
Menurut Verschuere et al. (2000), mekanisme kerja bakteri probiotik dapat dibagi beberapa cara, yaitu : (1) produksi senyawa inhibitor, (2) kompetisi terhadap senyawa kimia atau sumber energi (nutrisi) , (3) kompetisi terhadap tempat pelekatan, (4) peningkatan respon imum (kekebalan), (5) perbaikan kualitas air , (6) interaksi dengan fitoplankton.
Vine at al. (2004) menyatakan bahwa probiotik yang bekerja di dalam
Probiotik pada akuakultur umumnya hanya diseleksi berdasarkan kemampuannya menghasilkan senyawa antimikrobial, walau demikian pada mukosa usus juga penting agar mereka tetap berada di usus inang. Kompetisi terhadap tempat pelekatan terjadi antara kandidat probiotik (API-AP5) yang diisolasi dari ikan badut (Amphiprion percula) terhadap bakteri patogen A. hydrophila dan V. alginolyticus. Kandidat probiotik tersebut mempunyai kemampuan untuk melekat pada mukosa usus ikan dan berkompetisi dengan bakteri patogen, sehingga dengan penambahan bakteri probiotik akan mengurangi pelekatan bakteri patogen (Vine et al. 2004). Substansi antibakterial telah dihasilkan beberapa bakteri yang diisolasi dari saluran pencernaan ikan budidaya air tawar terhadap beberapa strain patogen antara lain A. hydrophila (Sugita et al. 1996).
Hasil penelitian Gullian et al. (2004) menunjukkan bahwa kolonisasi bakteri probiotik (Vibrio P62, Vibrio P63 dan Bacillus P64) pada hepatopankreas Penaeus vannamei masing-masing adalah 83%, 60% dan 58%. Interaksi kompetisi dengan V. harveyi (S2) dievaluasi dengan monoklonal antibodi dengan penghambatan oleh strain probiotik masing-masing 54%, 19% dan 34%.
Nikoskelainen et al. (2003) menyatakan bahwa beberapa parameter imun
ikan rainbow trout meningkat dengan pemberian bakteri probiotik (Lactobacillus rhamnosus) dalam pakan selama dua minggu, yaitu terjadi peningkatan aktivitas respiratory burst, komplemen dan antibodi.
spesiesnya) ke dalam kultur alga dapat meningkatkan nilai nutrisi dari alga tersebut dan selanjutnya dapat meningkatkan pertumbuhan dan kelangsungan hidup larva kerang.
Tahapan seleksi bakteri probiotik untuk kegiatan pemeliharaan larva hewan akuatik mencakup beberapa tahap berikut: (1) pengumpulan informasi dasar yang didapat dari studi pustaka maupun dilapangan; (2) pengumpulan probiotik potensial meliputi kelangsungan hidup bakteri probiotik dan kemampuan bersaing dengan galur patogen; (3) evaluasi kemampuan probiotik potensial berkompetisi dengan galur patogen meliputi kemampuan hidup probiotik pada inang dan lingkungannya, kemampuan melekat pada permukaan tubuh inang, kemampuan membentuk koloni dan mencegah perkembangan bakteri patogen baik dengan memproduksi senyawa inhibitor maupun berkompetisi nutrien; (4) pendugaan patogenisitas probiotik potensial yang meliputi probiotik tidak boleh patogen pada inang; (5) evalusai pengaruh probiotik potensial pada larva dengan hasil terbaik yang dilihat dari nilai kelangsungan hidup tertinggi, penambahan bobot terbesar, peningkatan daya tahan tubuh inang terhadap stress dan serangan patogen terendah; dan (6) analisis ekonomi biaya laba (Gomez-Gill 1998).
Identifikasi Bakteri dengan Teknik Molekuler
Identifikasi bakteri dapat dilakukan menggunakan analisis fenotipik dengan mempelajari sifat fisiologis atau biokimianya (Hadioetomo 1993) maupun analisis genotipik secara molekuler. Seringkali hasil uji biokimia atau fisiologi tersebut berbeda karena perbedaan ekspresi gen. Untuk karakterisasi galur-galur dalam satu spesies perlu dilihat sifat yang paling mendasar dan relatif stabil yaitu dengan analisis genotipik (Singleton 1995).
Teknik PCR (Polymerase Chain Reaction) adalah suatu teknik biologi molekuler untuk memperbanyak sekuen DNA tertentu (lebih dari 100 juta kopian) dalam waktu hanya beberapa jam, oleh karena itu teknik ini disebut pula amplifikasi DNA. Dengan PCR, molekul DNA dapat diperbanyak sampai jutaan kopi dalam tabung reaksi. Teknik ini terdiri dari beberapa siklus yang setiap siklusnya terdiri atas 3 tahap yaitu tahap denaturasi, pelekatan primer (primer anealling) dan pemanjangan (elongasi) (Griffin and Griffin 1993).
Berdasarkan Marchesi et al. (1998) tersedia beberapa primer yang dapat
METODOLOGI PENELITIAN
Waktu dan Tempat
Penelitian berlangsung dari bulan Januari sampai dengan bulan Nopember 2009. Isolasi bakteri dan uji in vitro dilakukan di Laboratorium Kesehatan Ikan, uji in vivo di Teaching Farm, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Sekuensing untuk identifikasi bakteri dilakukan di Laboratorium PT. Charoen Pokphand Indonesia, Jakarta.
Isolasi dan Pemurnian Bakteri
Bakteri probiotik diisolasi dari usus (saluran pencernaan) ikan air tawar seperti ikan jelawat Leptobarbus hoeveni Blkr, ikan mas Cyprinus carpio, ikan
nila Oreochromis niloticus, ikan lele Clarias, sp., ikan patin Pangasius
hyphothalmus, dan air pemeliharaan ikan air tawar.
Sampel saluran pencernaan (usus) ditimbang sebanyak 1 gram digerus menggunakan mortar, lalu ditambahkan 9 ml larutan fisiologis (Lampiran 1). Setelah sampel usus dan larutan fisiologis tercampur rata, sebanyak 0,1 ml dari campuran tersebut ditambahkan ke dalam 0,9 ml larutan fisiologis dalam
eppendof sehingga diperoleh konsentrasi 10-1 atau pengenceran 10 kali.
Pengenceran serupa dilakukan terus sehingga diperoleh konsentrasi 10-7 dan 10-8. Sebanyak 0,1 ml dari masing-masing konsentrasi disebar pada media Trypticase Soy agar (TSA-agar) (Lampiran 1) secara merata lalu diinkubasi pada suhu ruang (28-31oC) selama 24-48 jam.
tercampur rata, sebanyak 0,1 ml dari campuran tersebut ditambahkan ke dalam 0,9
ml larutan fisiologis dalam eppendof sehingga diperoleh konsentrasi 10-1 atau
pengenceran 10 kali. Pengenceran serupa dilakukan terus sehingga diperoleh
konsentrasi 10-3 dan 10-4. Sebanyak 0,1 ml dari masing-masing konsentrasi
disebar pada media TSA-agar secara merata lalu diinkubasi pada suhu ruang
(28-31oC) selama 24-48 jam. Koloni yang tumbuh kemudian digunakan dalam uji in
vitro. Berdasarkan penampilan koloni yang tumbuh, setiap koloni yang berbeda dikultur-murnikan sampai didapatkan koloni tunggal yang merupakan biakan murni.
Uji Penghambatan Bakteri terhadap S. iniae secara In Vitro
Isolat S. iniae dan bakteri kandidat probiotik berumur 24 jam diencerkan
hingga memiliki tingkat kepadatan masing-masing 106 sel/ml. S. iniae disebar pada media BHI-agar (Lampiran 1) sebanyak 0,1 ml dan kertas cakram (Whatman antibiotic assay paper 42) ditetesi suspensi bakteri probiotik sebanyak 0,05 ml, kemudian ditaruh diatas media BHI-agar yang telah diberi S. iniae. Setelah diinkubasikan selama 24 jam pada suhu ruang, diameter zona hambat diukur. Isolat yang menghasilkan zona bening menunjukkan kemampuan menghambat S. iniae. Lima isolat yang memiliki zona hambat terluas dipilih untuk digunakan pada uji selanjutnya.
Uji Patogenisitas Bakteri Probiotik
Sebelum dilakukan uji in vivo pada ikan nila dengan S. iniae, perlu diketahui patogenisitas bakteri hasil seleksi dengan mengujinya pada ikan nila. Satu lup dari masing-masing isolat ditumbuhkan dalam media TSB (Lampiran 1) secara terpisah. Kultur ditempatkan pada shaker water bath pada suhu 28-29oC. Selanjutnya disentrifugasi dengan kecepatan 3.000 rpm selama 24 jam. Pellet sel yang terbentuk kemudian diresuspensikan dalam larutan fisiologis dan diinjeksikan pada ikan nila yang berukuran rata-rata 11 gram dengan konsentrasi
106 CFU/ml sebanyak 0,1 ml/ekor, serta PBS 0,85% streil (Lampiran 1) sebagai
secara intramuskular. Pada setiap perlakuan dan kontrol, ikan nila dipelihara dalam akuarium dengan kepadatan 10 ekor/akuarium dengan 3 ulangan. Pengamatan tingkat kelangsungan hidup (SR) ikan nila dilakukan selama 10 hari, ikan yang mati dihitung setiap hari dan dibandingkan dengan kontrol.
Uji Penghambatan Bakteri terhadap S. iniae secara In Vivo
Isolat bakteri probiotik yang paling potensial dan tidak bersifat patogen diuji efektifitasnya dalam menghambat serangan S. iniae pada ikan nila. Isolat
bakteri probiotik dengan konsentrasi 106 CFU/ml diinjeksikan pada ikan nila
sebanyak 0,1 ml/ekor. Penyuntikan dilakukan pada hari pertama dan pada hari 3 (tiga) dilakukan uji tantang (challenge) dengan injeksi bakteri S. iniae konsentrasi
105 CFU/ml sebanyak 0,1 ml/ekor secara intramuskular. Pada uji ini, ikan nila
dipelihara dalam akuarium dengan kepadatan 10 ekor/akuarium.
Percobaan dilakukan dengan tiga ulangan termasuk kontrol (kontrol positif : hanya diinokulasi S. iniae, dan kontrol negatif tanpa diinjeksi S. iniae maupun bakteri probiotik). Pengamatan dilakukan selama 15 hari meliputi kelangsungan hidup, pertumbuhan, dan jumlah bakteri S. iniae pada otak dan darah setiap 6 jam selama 48 jam.
Identifikasi Bakteri secara Molekuler
Identifikasi isolat bakteri yang memberikan tingkat kelangsungan hidup tertinggi dilakukan berdasarkan hasil sekuensing gen 16S-rRNA (Marchesi et al. 1998). Sekuensing gen 16S-rRNA terdiri dari tahapan ekstraksi DNA, amplifikasi gen 16S-rRNA dengan PCR (Suwanto, 2002), dan sekuensing dengan mesin Sequenser.
a. Ekstraksi DNA
selanjutnya supernatan dibuang. Tahap ini diulang sebanyak tiga kali. Pellet bakteri yang terbentuk diresuspensi dengan 1 ml buffer TE 1X dan disentrifugasi 6.000 rpm 2 menit. Setelah disentrifugasi, supernatan yang ada dibuang.
Pellet yang tertinggal diresuspensi dengan 500 µl buffer TE 1X, selanjutnya ditambahkan 100 µl lysozyme 50 mg/ml lalu diinkubasi selama 1 jam
pada suhu 37oC. Setelah diinkubasi ditambahkan 100 µl SDS 10% dan 10 µl
proteinase-K lalu dibolak-balik perlahan-lahan hingga tercampur. Selanjutnya
diinkubasi kembali pada suhu 37oC selama 1 jam. Selanjutnya ditambahkan 100
µl 5 M NaCl dan 100 µl 10% CTAB/NaCl yang telah dihangatkan terlebih dahulu
(65oC) selanjutya diinkubasi selama 20 menit pada suhu 65oC. Kemudian
ditambahkan 500 µl campuran phenol: chloroform: isoamylalcohol (25:24:1) lalu divortex hingga tercampur. Selanjutnya disentrifugasi selama 10 menit dengan kecepatan 10.000 rpm.
Cairan yang terbentuk yang berada pada lapisan teratas dipindahkan ke dalam eppendof baru lalu ditambahkan 0,6 volum isopropanol dingin. Tabung eppendof dibolak-balik secara perlahan supaya tercampur selanjutnya selama 20
menit disimpan di suhu -20oC. Kemudian disentrifugasi pada kecepatan
maksimal selama 5 menit pada suhu -4oC. Supernatan yang ada dibuang,
selanjutnya ditambahkan 1 ml etanol 70% dingin lalu disentrifugasi lagi pada kecepatan maksimum selama 2 menit. Supernatan dibuang kembali, lalu disimpan di suhu ruang hingga etanol menguap habis. Sebelum disimpan DNA ditambah dengan elution buffer atau aquabidest steril serta dilakukan pengecekan dengan elektroferesis.
b. Amplifikasi gen 16S-rRNA dengan PCR
Primer yang digunakan adalah primer universal untuk domain bakteri berupa forward primer 63f (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan reserve primer 1387r (5’-GGG CGG WGT GTA GGC-3’) (Marchesi et al., 1998). Semua komponen reaksi dicampur dalam microtube dan dimasukkan dalam mesin PCR. Tahapan PCR terdiri dari pre start 94oC, 2 menit; tahap denaturasi 92oC, 30 detik; tahap annealing 55oC, 30 detik, tahap elongasi 72oC selama 1 menit. Proses
tahap stop PCR pada suhu 4oC. Kemudian hasil PCR disimpan pada suhu -20oC, serta dilakukan pengecekan dengan elektroforesis.
Parameter yang diamati
a. Tingkat Kelangsungan Hidup Ikan Nila
Tingkat kelangsungan hidup ikan nila dihitung menggunakan rumus (Effendi 2002).
Nt = Jumlah ikan yang hidup pada akhir penelitian (ekor) No = Jumlah ikan yang hidup pada awal penelitian (ekor)
b. Laju Pertumbuhan Bobot Harian Ikan Nila
Bobot rata-rata ikan nila diamati pada awal dan akhir penelitian dan pertumbuhan dihitung dengan menggunakan rumus (Effendi 2002)
c. Populasi Bakteri
Populasi bakteri yang dihitung yaitu jumlah S. iniae di otak dan darah. Jumlah bakteri dihitung berdasarkan rata-rata jumlah koloni yang tumbuh dikalikan dengan faktor pengenceran.
Analisis Statistik
HASIL DAN PEMBAHASAN
Isolat Bakteri Probiotik
Jumlah isolat bakteri kandidat probiotik yang diisolasi dari ikan nila, ikan lele, ikan mas, ikan jelawat, ikan patin dan air pemeliharaan sebanyak 86 isolat bakteri (Lampiran 2). Dari 86 isolat bakteri tersebut, 27 diantaranya diisolasi dari usus ikan nila, sembilan dari ikan lele, 10 dari ikan patin, 10 dari ikan mas, satu dari ikan jelawat dan 29 dari air pemeliharaan. Total 86 isolat tersebut selanjutnya diuji daya hambatnya terhadap S. iniae.
Penampilan koloni isolat-isolat tersebut pada media TSA-agar bervariasi. Warna koloni terdiri dari krem, putih, putih abu-abu, dan putih kekuningan (Gambar 2). Ukuran dan bentuk koloninya juga bermacam-macam ada yang bundar kecil, bundar besar, dan tidak beraturan dan menyebar. Tepian koloni ada yang licin dan berlekuk. Elevasi koloninya cembung, datar dan seperti tetesan (Lampiran 3). Hasil penelitian Agustina (2006) menunjukkan bahwa bakteri yang diisolasi dari usus dan air pemeliharaan ikan lele menampilkan koloni yang berwarna putih transparan, putih krem, kuning krem dan kuning.
Gambar 2 Penampilan Koloni Bakteri Probiotik, A. Isolat DM1 dan B. Isolat AN3.
S. iniae yang digunakan dalam penelitian ini merupakan koleksi Balai Riset Perikanan Budidaya Air Tawar Sempur, Jawa Barat. Bakteri tersebut telah diuji bersifat patogen pada ikan nila.
Penghambatan Bakteri Probiotik terhadap S. iniae secara In Vitro
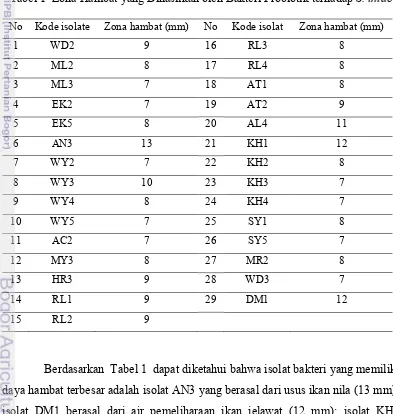
Berdasarkan hasil seleksi secara in vitro terhadap 86 isolat dalam menghambat pertumbuhan S. iniae, diperoleh 29 isolat yang menghasilkan zona hambat (Tabel 1; Lampiran 4). Dari 29 isolat tersebut, 12 diantaranya diisolai dari usus ikan nila, tiga dari usus ikan lele, empat dari usus ikan patin, satu dari usus ikan mas, enam dari air pemeliharaan ikan nila, dua dari air pemeliharaan ikan mas dan satu dari air pemeliharaan ikan jelawat. Selanjutnya dari 29 isolat tersebut, lima isolat dipilih untuk digunakan pada pengujian patogenisitas ikan nila.
Tabel 1 Zona Hambat yang Dihasilkan oleh Bakteri Probiotik terhadap S. iniae
No Kode isolate Zona hambat (mm) No Kode isolat Zona hambat (mm)
berasal dari air pemeliharaan ikan nila (12 mm); isolat AL4 berasal dari usus ikan mas (11 mm); dan isolat WY3 berasal dari usus ikan patin (10 mm).
Wilayah jernih di sekitar koloni atau pertumbuhan bakteri S. iniae menunjukkan bahwa senyawa antimikroba yang dihasilkan bakteri probiotik tersebut mampu menghambat pertumbuhan bakteri S. iniae. Kepekaan bakteri S. iniae terhadap bahan antimikroba ditunjukkan oleh luasnya wilayah jernih sekitar pertumbuhan bakteri S. iniae.
Berdasarkan Verschuere et al. (2000) populasi mikroba dapat
melepaskan substansi kimia yang memiliki kemampuan bakterisidal atau bakteriostatis yang dapat mempengaruhi populasi mikroba lain. Secara umum kemampuan menghambat pertumbuhan bakteri lain dikarenakan satu atau kombinasi dari beberapa faktor seperti: produksi antibiotik, bakteriosin, siderophores, lysozymes, protease dan atau hidrogen peroksida atau mempengaruhi pH media dengan menghasilkan asam organik tertentu.
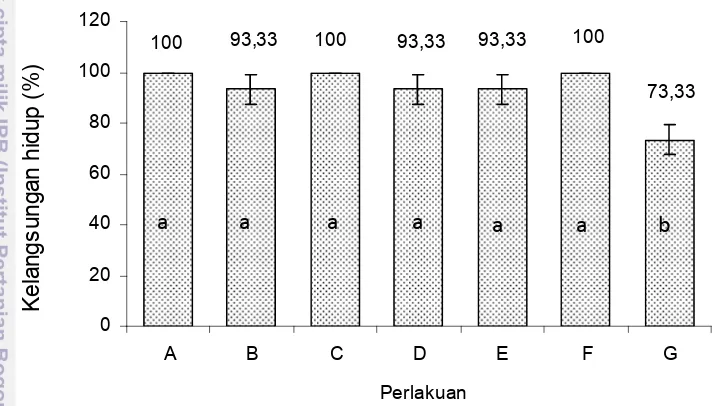
Patogenisitas Bakteri Probiotik
menyebabkan ikan nila sakit atau tidak patogen sehingga bakteri probiotik tersebut dapat digunakan untuk uji selanjutnya.
Hasil penelitian Agustina (2006) menunjukkan bahwa dengan pemberian bakteri probiotik yang diisolasi dari usus (BB1) dan air pemeliharaan (KL4) dengan cara injeksi dan dipelihara selama 7 hari tidak bersifat patogen pada benih ikan lele.
100 93,33 100 93,33 93,33 100
73,33
Gambar 3 Kelangsungan hidup ikan nila pada uji patogenisitas.
Verschuere et al. (2000) menyatakan bahwa probiotik merupakan agen
mikroba hidup yang memberikan pengaruh menguntungkan pada inang, dengan demikian bakteri probiotik tidak boleh bersifat patogen terhadap inang, baik dalam kondisi normal maupun stres. Berdasarkan hal ini maka kelima isolat tersebut masih aman dan dapat diharapkan untuk menekan perkembangan bakteri patogen.
Penghambatan Bakteri terhadap S. iniae pada secara In Vivo
Tingkat kelangsungan hidup ikan nila yang diinjeksi dengan isolat bakteri probiotik diamati setelah uji tantang dengan bakteri S. iniae sampai hari ke-15. Tingkat kelangsungan hidup ikan nila dapat dilihat pada Gambar 4.
Pemberian isolat bakteri probiotik dengan injeksi memberikan pengaruh yang nyata (p<0.05) terhadap tingkat kelangsungan hidup ikan nila yang diinjeksi dengan bakteri S. iniae (Lampiran 7 dan 8). Isolat-isolat tersebut diduga dapat menghambat pertumbuhan S.iniae sehingga dapat meningkatkan kelangsungan hidup ikan nila Hal ini terlihat dari tingkat kelangsungan hidup ikan nila pada kontrol positif (hanya diinokulasi S. iniae) lebih rendah (73,33%) dibanding perlakuan dengan penambahan isolat probiotik (86,67%-100%). Berdasarkan
Verschuere et al. 2000, bakteri probiotik dapat menjamin perbaikan dalam
penggunaan pakan atau memperbaiki nutrisinya juga memperbaiki respon inang terhadap penyakit.
100 86,67 100 96,67 96,67 100
73,33
Gambar 4 kelangsungan hidup ikan nila pada uji in-vivo.
Hasil penelitian Rengpipat et al. (1998b) menggunakan probiotik Bacillus S11 menunjukkan bahwa setelah diberi perlakuan probiotik selama 100 hari dan kemudian diuji tantang dengan V. harveyi selama 10 hari, nilai kelangsungan hidup udang windu mencapai 100% dibanding pada kontrol 26%.
Haryanti et al. (2000) melaporkan bahwa penambahan bakteri strain BY-9
dengan konsentrasi 106 CFU/ml pada media pemeliharaan larva udang windu
menghasilkan tingkat kelangsungan hidup 59,3% sedangkan pada kontrol 14,7%. Sedangkan Agustina (2006) juga melaporkan bahwa dengan perlakuan pemberian pakan dengan penambahan bakteri probiotik KL4 memberikan tingkat
kelangsungan hidup sebesar 84,45%, diikuti oleh perlakuan pemberian pakan dengan penambahan bakteri probiotik BBI sebesar 80,00% sedangkan pada kontrol memberikan tingkat kelangsungan hidup sebesar 55,56%.
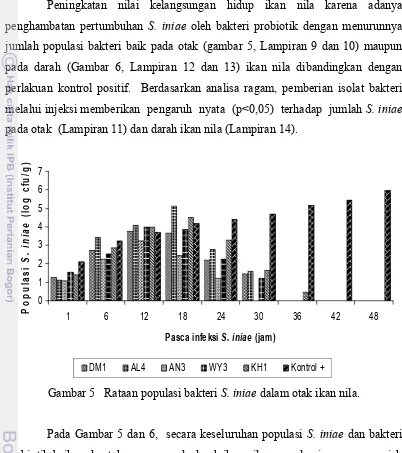
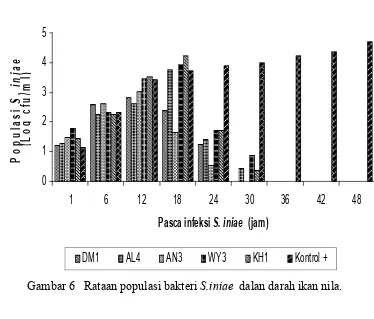
Peningkatan nilai kelangsungan hidup ikan nila karena adanya penghambatan pertumbuhan S. iniae oleh bakteri probiotik dengan menurunnya jumlah populasi bakteri baik pada otak (gambar 5, Lampiran 9 dan 10) maupun pada darah (Gambar 6, Lampiran 12 dan 13) ikan nila dibandingkan dengan perlakuan kontrol positif. Berdasarkan analisa ragam, pemberian isolat bakteri melalui injeksi memberikan pengaruh nyata (p<0,05) terhadap jumlah S. iniae pada otak (Lampiran 11) dan darah ikan nila (Lampiran 14).
0
Pasca infeksi S. iniae (jam)
P
DM1 AL4 AN3 WY3 KH1 Kontrol +
Gambar 5 Rataan populasi bakteri S. iniae dalam otak ikan nila.
0
DM1 AL4 AN3 WY3 KH1 Kontrol +
Gambar 6 Rataan populasi bakteri S.iniae dalan darah ikan nila.
Populasi S. iniae pada ikan nila untuk perlakuan dengan penambahan
bakteri probiotik lebih rendah dibanding perlakuan tanpa probiotik, bahkan pada jam ke-30 S. iniae sudah tidak terdeteksi lagi. Tidak terdeteksinya S. iniae pada jam ke-30 diduga karena terjadi penurunan populasi S. iniae pada otak dan darah ikan (akibat dihambat pertumbuhannya oleh bakteri probiotik) sehingga peluang untuk berkolonisasi di tubuh ikan semakin kecil bila dibandingkan bakteri tanpa penambahan probiotik dan kemungkinan lain karena adanya kompetisi tempat pelekatan atau sumber nutrisi (Verschuere et al 2000). Hal ini menunjukkan bahwa peningkatan nilai kelangsungan hidup pada perlakuan dengan penambahan probiotik karena adanya kompetisi dari bakteri probiotik yang mencegah
terjadinya jumlah (quorum) S. iniae yang dibutuhkan untuk mengekspresikan
Rendahnya populasi S. iniae pada otak dan darah pada pemberian probiotik disebabkan oleh adanya kemampuan bakteri probiotik mengeluarkan senyawa antibakterial atau senyawa lain yang dapat menghambat pertumbuhan bakteri patogen seperti antibiotik, bacteriocins, siderospore, lysozyme, protease dan asam organik (Sugita et al. 1998). Nakamura et al. (1999) juga mengemukakan bahwa bakteri yang berperan sebagai agen biokontrol akan menghasilkan senyawa vibriostatik atau vibrisidal. Dengan diproduksinya senyawa tersebut menyebabkan terjadinya niche competition antara S. iniae dengan bakteri agen biokontrol. Kemampuan mikroba menghambat perkembangan mikroba patogen, menunjukkan kemampuannya untuk mempertahankan keseimbangan mikroflora di dalam saluran pencernaan ikan. Kemampuan tersebut berhubungan dengan kemampuannya menghasilkan senyawa antimikroba yaitu peptide yang disentesis dalam ribosom (Aslamyah 2006). Flora normal pada usus memiliki fungsi perlindungan yang penting untuk menekan bakteri patogen dan virus, menstimulir daya tahan lokal dan sistemik, serta mengubah aktivitas metabolik mikroba usus. Selain itu, mikroba probiotik juga menekan mikroba patogen karena terjadinya kompetisi sisi penempelan (reseptor), peningkatan produksi lendir atau mukosa usus, dan kompetisi nutrisi (Salminen dan Wright 1993). Hasil penelitian ini sesuai dengan pendapat tersebut bahwa dengan adanya penambahan isolat bakteri dapat mengurangi mortalitas akibat serangan S. iniae.
Penurunan populasi bakteri kemungkinan karena sebelum perlakuan telah terjadi pre-kolonisasi pada ikan nila oleh bakteri lain. Kolonisasi oleh bakteri lain juga sangat mungkin terjadi seperti ditunjukkan pada penelitian
Rengpipat et al (1998b), dimana pada percobaan tersebut larva udang juga
imun pada ikan rainbow trout serta Irianto dan Austin (2002) yang menggunakan probiotik untuk mengontrol furunkulosis pada ikan rainbow trout. Gomez-Gil et al. (2000) menyatakan bahwa probiotik merupakan agen yang mampu mencegah kerusakan pada inang yang ditimbulkan oleh patogen umumnya melalui kompetisi, tetapi sebagian besar dengan menghasilkan substansi yang mampu menghambat pertumbuhan atau pelekatan mikroorganisme yang berbahaya.
Rengpipat et al. (1998b 2000) menyatakan bahwa peningkatan nilai
kelangsungan hidup udang windu pada perlakuan dengan penambahan probiotik Bacillus S11 karena adanya kompetisi eksklusif oleh probiotik tersebut pada saluran pencernaan udang. Bahkan pemberian probiotik pada stadia awal larva memberikan hasil yang lebih optimal karena sejak awal saluran pencernaan larva maupun lingkungannya telah didominasi oleh bakteri yang menguntungkan (Rengpipat et al. 1998a).
Pengamatan terhadap pertumbuhan, dalam hal ini pertumbuhan harian ikan nila dilakukan pada hari ke-15 (Tabel 2 ). Hasil penelitian ini menunjukkan bahwa pertumbuhan harian ikan nila sampai hari ke-15 tidak memperlihatkan perbedaan yang nyata antar perlakuan (P>0,05) (Lampiran 15 dan 16). Hal lain diduga karena 15 hari masa penelitian yang dilakukan terlalu singkat. Penelitian Agustina (2006) menggunakan bakteri probiotik yang diisolasi dari saluran pencernaan dan selama 21 hari pemeliharaan menghasilkan pertumbuhan yang berbeda nyata dibanding kontrol selama pemeliharaan pada ikan lele.
Tabel 2 Pertumbuhan Harian Ikan Nila Selama Penelitian
Perlakuan Pertumbuhan harian (%)
DM1 1,21 ± 0,69a
Identifikasi Bakteri Terpilih
Isolat yang diperoleh meski telah diuji patogenisitasnya dan mampu menghambat pertumbuhan S. iniae perlu dikarakterisasi dan diidentifikasi untuk keperluan kontrol kualitas.
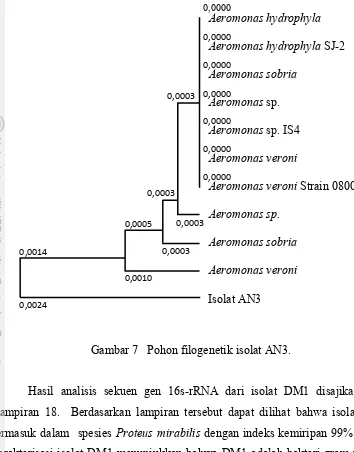
Hasil analisis sekuen gen 16s-rRNA dari isolat AN3 disajikan pada Lampiran 17. Berdasarkan lampiran tersebut dapat dilihat bahwa isolat AN3 termasuk dalam spesies Aeromonas sobria dengan indeks kemiripan 99%. Austin dan Austin (1999) melaporkan bahwa A. sobria GC2 bermanfaat untuk ikan rainbow trout ketika diberikan sebagai feed lenturment untuk kontrol Lactococcosis dan Streptococcus. Hasil karakterisasi isolat AN3 menunjukkan bahwa AN3 adalah bakteri gram negatif, berbentuk batang pendek, bersifat motil, oksidatif dan fermentatif, koloninya berwarna putih, tepian licin dengan bentuk koloni bundar cembung pada media TSA-agar.
Gambar 7 Pohon filogenetik isolat AN3.
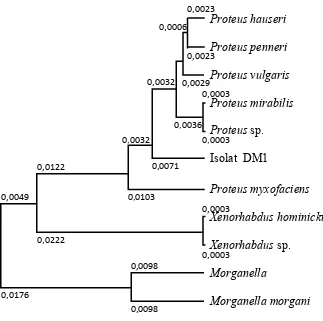
Hasil analisis sekuen gen 16s-rRNA dari isolat DM1 disajikan pada Lampiran 18. Berdasarkan lampiran tersebut dapat dilihat bahwa isolat DM1 termasuk dalam spesies Proteus mirabilis dengan indeks kemiripan 99%. Hasil karakterisasi isolat DM1 menunjukkan bahwa DM1 adalah bakteri gram negatif, berbentuk batang panjang, bersifat motil, koloninya berwarna putih abu-abu, tepian licin, dengan bentuk koloni bundar cembung pada media TSA-agar.
Hasil analisis gen 16S-rRNA dari isolat DM1 dibuat pohon filogenetik untuk mengetahui kedekatan kekerabatan dengan bakteri lain dengan membandingkan basa-basa DNA (Gambar 8)
Aeromonas hydrophyla
KESIMPULAN DAN SARAN
Kesimpulan
1. Lima isolat bakteri probiotik yaitu (AN3, AL4, WY3, DM1 serta KH1)
memiliki potensi penghambatan pertumbuhan S. iniae ikan nila.
2. Kelima isolat tersebut mampu meningkatkan kelangsungan hidup ikan nila
yang diinfeksi dengan S. iniae sehingga bisa digunakan sebagai probiotik.
Saran
1. Kelima isolat tersebut dapat dijadikan alternatif pengendalian penyakit
streptococcosis pada ikan nila.
2. Perlu pengujian lanjut di lapang untuk menguji isolat- isolat bakteri yang
DAFTAR PUSTAKA
Angka S.L, Mokoginta I, Hamid H. 1990. Anatomi dan histologi banding beberapa ikan air tawar yang dibudidayakan di Indonesia. Departemen Pendidikan dan Kebudayaan. Direktorat Jendral Pendidikan Tinggi. Institut Pertanian Bogor.
Al Harbi AH, 1996. First Isolation of Streptococcus sp from hybrid Tilapia (Oreochromis noloticus x O. aureus) in Saudi Arabia. Aquaculture 128:195-201.
Agustina. 2006. Penapisan Bakteri Kandidat Probiotik untuk Pengendalian Penyakit Infeksi Aeromonas hydrophila pada Ikan Lele Dumbo (Clarias sp.). [Tesis]. Program Pascasarjana, Institut Pertanian Bogor.
Aslamyah S. 2006. Penggunaan mikroflora Saluran Pencernaan Sebagai Probiotik Untuk Meningkatkan Pertumbuhan dan Kelangsungan Hidup Ikan Bandeng. [Disertasi]. Sekolah Pascasarjana. Institut Pertanian Negeri Bogor.
Austin B, Austin D.A. 1999. Bacterial Fish Pathogens, Diseases of Farmed and Wild Fish, 3rd (revised) ed. Springer-Praxis, Godalming.
Baiano J, Tumbol RA, Umapathy A, Barnes AC. 2008. Identification and Molekuler characterization of a fibrinogen binding protein from Streptococcus iniae. BMC Mikrobiologi. Volume 8.
Chang PH., and Plumb, J.A. 1996. Histopathology of eksperimental Streptococcus sp. Infection in tilapia Oreochromis niloticus L. and channel catfish. Ichtalurus punctatus (Rafinesque). J. of fish Dis. 19:235-241.
Chapman FA. 2000. Culture of Hybrid Tilapia: A Reference Profile.
http://edis.ifas.ufl.edu/BODY_FA012. [20 April 2003].
Chytanya R, Karunasagar I. 2002. Inhibition of shrimp pathogenic vibrio by a marine Pseudomonas I-2 strain. Aquaculture 208: 1-10.
Clark JS, Paller B, Smith PD. 2000. Prevention of Streptococcus in Tilapia by vaccination : The Phillipine Experience ag. ArizonaBiochemical and Molecular Typing if Streptococcus iniae Isolation from Fish and Human Cases. J Fish Dis. 22:331-336.
Duillet PA, Langdon CJ. 1994. Use of a probiotic for the culture of larvae of the pacific oyster (Crassostrea gigas Thunberg). Aquaculture 119 : 25-40 Effendie MI. 2002. Metode Biologi Ikan. Yayasan Dewi Sri. Bogor. P :30-31.
Ellen S & Gibson G. 2006. Probiotic and Prebiotics. Reference Section: US Gastroenterology Review.
Evans J, Shoemaker CA, Klesius PH. 2000. Experimental Streptococcus iniae Infection of hybrid striped Bass (Morone chrysops x morone saxatilis) and Tilapia (Oreochromis niliticus) by Nares Inoculation. Aquaculture 189 : 197-210.
FAO/WHO/OIE. 2006. Expert Consultation on antimicrobial use in aquaculture and antimicrobial resistance. Seoul, Republic of South Korea, June 13-16. Fitzsimmons K. 2000. Future trends of tilapia aquaculture in the Americas. In: Tilapia Aquaculture in the Americas , Vol. 2. 2. pp. hal. 252–264 (Costa-Pierce, BA and JE Rakocy, Eds.). Baton Baton Rouge, Louisiana: World Aquaculture Society ,
Fuller JD, Bast DJ, Nizet V, Low DE, Azavedo JC. 2001. Streptococcus iniae virulence is Associated with a Distinct Genetic Profile. Infection and Immunity 69 (4) : 1994-2000.
Gatesoupe FJ. 1999. The use of probiotics in aquaculture. (Review). Aquaculture : 147-165.
Gomez-Gill B, Roque A. 1998. Selection of probiotic for use in aquaculture. Di dalam : Flegel T. W., editor. Advances in Shrimp Biotecnology.
Proceeding to the special session on Shrimp biotechnology, 5 th Asian
Fisheries Forum : Chiangmai, Bangkok Thailand : National Center fo Genetic Engineering and Biotechnology. Hlm 175.
Gomez-Gill B, Roque A, Turnbull JF. 2000. The use and selection of probiotic bacteria for use in the culture of larval aquatic organisms. Aquaculture 191 : 259-270.
Gomez-Gill B, Roque A, Velasco-Blanco G. 2002. Culture of Vibrio alginolyticus C7b, a potential probiotic bacterium, with the microalga Chaetoceros muelleri. Aquaculture 211 : 43-48.
Griffin, HG and Griffin AM. 1993. DNA sequencing : Recent Innivations and future trends. J Appl Biochem and Biotech 38: 147-159.
Gullian M, Thompson F, Rodriguez J. 2004. Selection of probiotic bacteria and study of their immunostimulatory effect in Penaeus vannamei. Aquaculture 233 : 1-4.
Haryati, Sugama, K, Tsumura S & Nishijima T. 2000. Vibriostatic bacterium isolated from seawater: Potentiality as probiotic agent in the rearing of Penaeus monodon larvae. Ind. Fish. Res. J. 6: 26-32.
Irianto A. 2003. Probiotik Akuakultur. Gadjah Mada University Press. 125 halaman.
Irianto A, Austin B. 2002. Use probiotic to control furunculosis in rainbow trout (Oncorhynchus mykiss Walbaum). Journal of Fishes Diseases 25 : 333-342.
Kesarcodi-Watson A, Kaspar H, Lategan J, Gibson L. 2008. Probiotics in aquaculture: The need, principles and mechanisms of action and screening processes. Aquaculture, 274: 1-14.
Lay BW. 1994. Analisis mikroba di Laboratorium. PT. Raja Grafindo Persada. Jakarta.
Li et al. 2006. Comparative study between probiotic bacterium Arthrobacter XE-7 and chloramphenicol on protection of Penaeus chinensis PL from pathogenic vibrios. Aquaculture 253: 140-147.
Lisal JS. 2005. Konsep Probiotik dan Prebiotik untuk Modulasi Mikrob Usus Besar. Medical Nusantara, 26: Oktober-Desember.
Marchesi. 1998. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA. J. Appl. Environt. Mikrobiol. 64:795-799.
Moeller RB. 2000. Biology of Fish. 4th International Discus Championship 2002. Discus Page Holland. http:/Biology of fish II. Htm. [4 Oktober 2002]. Muliani. 2002. Isolasi dan Karakterisasi Bakteri Asal Laut Sulawesi untuk
Biokontrol Penyakit Vibriosis pada Larva Udang Windu Penaeus monodon Fabricus. [Tesis]. Program Pascasarjana, Institut Pertanian Bogor. Bogor.
Nakamura, A,K.G. Takahashi, and K.Mori. 1999. Vibriostatic bacteria isolated from rearing seawater of oyster broodstock : Potenciality as biocontrol agents for vibriosis in oyster larvae. Fish Pathology, 34(3): 139-144.
Nikoskelainen S, Ouwehand AC, Bylund G. 2003. Immune enhancement in rainbow trout (Oncorhynchus mykiss) by potential probiotic bacteria (Lactobacillus rhamnosus). Fish dan Shellfish Immunologyy 15 :443-452. Nguyen HT, Kanai K, Yoshikoshi K. 2002. Ecological Incestigation of
Perera RP., Johnson SK., Collins MD, and Lewis DH. 1994. Streptococcus ineae associated with mortality of Tilapia nilotica and Tilapia aurea hybrids. J. Aquat. Anim. Health 6:335-340.
Plumb JA. 1999. Health Maintenance and Principal Microbial Disease of Cultured Fishes. Iowa State University Press, Ames, Iowa. Hlm 297-304. Rengpipat S, Rukpratanpo S, Pryatiratitivorakul S, Menasveta P. 1998a.
Probiotic in aquaculture: a case study of probiotics for larvae of black tiger shrimp Penaeus monodon. Di dalam: Flagel TW, editor, Advances in Shrimp Biotechnology. Proceedings to the special session on shrimp biotechnology, 5th Asian Fisheries Forum; Chiengmai, Thailand. Bangkok: National Center for Genetic Engineering and Biotechnology, hlm 176-181. Rengpipat S, Rukpratanpo S, Pryatiratitivorakul S, Menasveta P. 1998b. Effects
of a probiotic bacterium on black tiger shrimp Penaeus monodon survival and growth. Aquaculture 167:301-133.
Rengpipat S, Rukpratanpo S, Pryatiratitivorakul S, Menasveta P. 2000. Immunity enhancement in black tiger shrimp Penaeus monodon by a probiont bacterium (Bacillus S11). Aquaculture 191:271-288.
Robertson PAW, O’Dowd C, Burrells C, Williams P, Austin B. 2000. Use Carnobacterium sp. As probiotic for atlantic salmon (Salmon salar L) and rainbow trout (Oncorhynchus mykiss Walbaum). Aquaculture International 185, 235-243.
Salminen S, von-Wrigh A. 1993. Lactic Acid Bacteria. New York: Mascel Dekker
Sasanti AD. 2008. Penapisan Bakteri Kandidat Probiotik Asal Terumbu Karang Untuk Pengendalian vibriosis pada Larva Udang Windu (Penaeus monodon). [Tesis]. Program Pascasarjana, Institut Pertanian Bogor. Bogor.
Schrezenmeir J & Vrese M. 2001. Probiotics, Prebiotics and Synbiotic-Approaching a Definition. American. Journal of Clinical Nutrition. 73: 2; 361-364.
Singleton P. 1995. Bacteria in Biology, Biotechnology and Medicine 3rd Edition. John Wiley & Sons Ltd. England.
Sucipto A. 2007. Budidaya Ikan Nila (Oreochromis niloticus). Sukabumi: Direktorat Jendral Budidaya, Balai Besar Pengembangan Budidaya Air Tawar.
Sugita H, Shibuya K, Shimooka H, Deguchi Y. 1996. Antibacterial abilities of Intertinal bacteria in freshwater cultured fish. Aquaculture 145:203.
Sugita H, Y. Hirose N, Matsuo, Deguchi Y. 1998. Production of the antibacterial substance by Bacillus sp. Strain NM 12, an intestinal bacterium of Japanese coastal fish. Aquaculture 165: 269-280.
Supriyadi dan Komaruddin, O. 2003. Kerusakan Jaringan Ikan Nila (Oreochromis niloticus) yang terinfeksi penyakit Streptococcociasis. Jurnal Penelitian Perikanan Indonesia. Vol 9 (2). Jakarta.
Suwanto. 2002. Compilation of Practical Manual. Biotrop Training Course in Microbial Biodiversity.
Tae Kwang Oh. 2003. Probiotik effect of Weissella hellenica DS-12 in fleounder (Paralichthys olivaceus). Korea Research Institute of Bioscience and Biotechnology, PO Box 115, Yusung, Taejon, 305-600, Korea. Htm Microsoft HTML Document 5,0.
Taylor SL, Jaso-Friedmann L, Allison AB, Elder AB, Eldar A, Evans DL. 2001. Streptococcus iniae Inhibition of Apoptosis of Nonspesific Cytotoxic Cells : A Mechanism Of Activation of Innate Immunity In Teleosts. Diseases of Aquatic organism 46 : 15-21.
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture. J Microbio Mol Biol Rev 64-655-671.
Villamil L, Figueras A, Planas M, Novoa B. 2003. Control of Vibrio alginolyticus in Artemia culture by treatment with bacterial probiotics. Aquaculture 219:43-56.
Vine NG, Leukes WD, Kaiser H, Daya S, Baxter J, Hech T. 2004. Competition for attachement of aquaculture candidate probiotic and pathogenic bacteria on fish intestinal mucus. Fish Diseases 27: 319-326.
Widanarni, Suwanto A, Sukenda, Lay BW. 2003. Potency of Vibrio isolates for biocontrol of Vibriosis in tiger shrimp (Penaeus monodon) Larvae. Biotropia. 20: 11-23.
Lampiran 1 Media yang digunakan untuk mengisolasi Bakteri Probiotik
A. Media TSA (Trypticase Soy Agar)
TSA 4 g
Akuades 100 ml
Cara pembuatan :
Semua bahan dicampur menjadi satu dalam erlemeyer lalu dipanaskan
dalam penangas air sambil digoyang sesekali hingga larut. Kemudian media
tersebut diautoklaf pada suhu 121oC dengan tekanan uap 1 atm selama 15
menit.
B. Media TSB (Trypticase Soy Broth)
TSB 3 g
Akuades 100 ml
Cara pembuatan :
Semua bahan dicampur menjadi satu dalam erlemeyer lalu dipanaskan
dalam penangas air sambil digoyang sesekali hingga larut. Kemudian media
tersebut diautoklaf pada suhu 121oC dengan tekanan uap 1 atm selama 15
menit.
C. BHIA (Brain Heart Infussion Agar)
BHIA 4 g
Akuades 100 ml
Cara pembuatan:
Semua bahan dicampur menjadi satu dalam erlemeyer lalu dipanaskan
tersebut diautoklaf pada suhu 121oC dengan tekanan uap 1 atm selama 15
menit.
D. PBS (Phospat Buffer saline)
NaCL 8.0 g
KH2PO4 0.2 g
Na2H2PO4 1.5 g
KCl 0.2 g
Akuades 1000 ml
Cara pembuatan:
Semua bahan dicampur menjadi satu dalam erlemeyer lalu dipanaskan
dalam penangas air sambil digoyang sesekali hingga larut. Kemudian media
tersebut diautoklaf pada suhu 121oC dengan tekanan uap 1 atm selama 15
Lampiran 3 Karakteristik Morfologi Koloni Bakteri Air Tawar yang Potensial sebagai Bakteri Probiotik terhadap S. iniae
Kode
isolat Jenis sampel
Ciri-ciri
Bentuk/ukuran tepian elevasi Warna MR2 Usus ikan nila Bundar/kecil licin cembung Krem AN3 Usus ikan nila Bundar/kecil licin cembung Putih
WD2 Usus ikan nila Tdk beraturan &
ML2 Usus ikan nila Bundar/kecil licin cembung Putih krem ML3 Usus ikan nila Bundar/besar licin cembung Kuning
MY3 Usus ikan nila Bundar/kecil licin cembung Putih kuning
SY1 Usus ikan nila Bundar/kecil licin cembung Putih abu-abu SY5 Usus ikan nila Bundar/besar licin cembung Krem
RL1 Usus ikan nila Bundar/kecil licin cembung Putih abu-abu
RL2 Usus ikan nila Bundar/kecil licin cembung Putih abu-abu
RL3 Usus ikan nila Bundar/sedang licin cembung Putih kuning
RL4 Usus ikan nila Bundar/sedang licin cembung Putih kuning
KH1 Air pemeliharaa nila Bundar/kecil licin cembung Putih kuning KH2 Air pemeliharaa nila Bundar/sedang licin cembung Krem KH3 Air pemeliharaa nila Bundar/sedang licin cembung Krem
KH4 Air pemeliharaan
ikan nila Bundar/sedang licin cembung Putih abu-abu
WD3 Air pemeliharaa
ikan nila Bundar/kecil licin cembung Putih abu-abu
HR3 Air pemeliharaa ikan nila
Tdk beraturan &
WY2 Usus ikan patin Bundar/sedang licin cembung Putih krem
WY3 Usus ikan patin Bundar/sedang licin cembung Putih kuning
WY4 Usus ikan patin Bundar/sedang licin cembung Putih abu-abu WY5 Usus ikan patin Bundar/sedang licin cembung Kuning
AC2 Usus ikan lele Bundar/kecil licin cembung Putih kuning EK2 Usus ikan lele Bundar/besar licin cembung Putih
EK5 Usus ikan lele Bundar/kecil licin cembung Putih abu-abu
AL4 Usus ikan Mas Bundar/kecil licin cembung Putih abu-abu
AT1 Air pemeliharaan
ikan mas Bundar/kecil licin cembung Putih kuning
AT2 Air pemeliharaan
ikan mas Bundar/kecil licin cembung Putih kuning
DM1 Air pemeliharaan
Lampiran 4 Zona Hambat yang Dihasilkan Bakteri Probiotik terhadap S. iniae
Keterangan :
A : Isolat DM1 D : Isolat AL4 B : Isolat AN3 E : Isolat WY3 C : Isolat KH1
WY3 A1
A2
Kontrol A3
B1
B2
Kontrol B3
C2 C1
Kontrol C3
D2 D1
Kontrol
D3
E1
Kontrol
Lampiran 5 Kelangsungan Hidup Ikan Nila (%) terhadap Bakteri Probiotik Rata-rata 100 100 100 100 100 93.33 93.33 93.33 93.33 93.33 Standar deviasi 0.00 0.00 0.00 0.00 0.00 5.77 5.77 5.77 5.77 5.77 Rata-rata 100 100 100 100 100 96.67 93.33 93.33 93.33 93.33 Standar deviasi 0.00 0.00 0.00 0.00 0.00 5.77 5.77 5.77 5.77 5.77
1 100 100 100 100 100 90 90 90 90 90 KH1 2 100 100 100 100 100 100 100 100 100 100
Lampiran 6 Analisis Ragam dan Uji Duncan Tingkat Kelangsungan Hidup (%) Ikan Nila terhadap Bakteri Probiotik selama Uji patogenisitas
Sumber keragaman db JK KT F.hitung F. Tabel 5%
Perlakuan 6 1600,00 266,67 14,00 3,48
Galat 14 266,67 19,05
Total 20 1866,67
Perlakuan Rata-rata Beda Dengan BJND 2 3 4 5 6 7 0.05
A 100,00 a
B 93,33 6,67 a
C 100,00 6,67 0,00 a
D 93,33 6,67 0,00 6,67 a
E 93,33 0,00 6,67 0,00 6,67 a
Lampiran 8 Analisis Ragam dan Uji Duncan Tingkat Kelangsungan Hidup (%) Bakteri Probiotik dengan S. iniae pada Ikan Nila
Sumber keragaman db JK KT F.hitung F. Tabel 5%
Perlakuan 6 1800.00 300.00 6.30 2.85
Galat 14 666.67 47.62
Total 20 2466.67
Perlakuan Rata-rata Beda Dengan BJND
2 3 4 5 6 7 0.05
DM1 100,00 a
AL4 86,67 13,33 b
AN3 100,00 13,33 0,00 a
WY3 96,67 3,33 10,00 3,33 ab
KH1 96,67 0,00 3,33 10,00 3,33 ab
K- 100,00 3,33 3,33 0,00 13,33 3,33 a
K+ 73,33 26,67 23,33 23,33 26,67 13,33 26,67 b
P 0.05 (P, 14) 3,03 3,18 3,27 3,33 3,37 3,39