STRUKTUR DAN KERAGAMAN GENETIK
POPULASI LOKAL MONYET EKOR PANJANG
(Macaca fascicularis) DI JAWA TIMUR, BALI, DAN LOMBOK
I NENGAH WANDIA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi “Struktur dan Keragaman Genetik Populasi Lokal Monyet Ekor Panjang (Macaca fascicularis) di Jawa Timur, Bali, dan Lombok” adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal dari atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2007
I Nengah Wandia
ABSTRAK
I NENGAH WANDIA. Struktur dan Keragaman Genetik Populasi Lokal Monyet Ekor Panjang (Macaca fascicularis) di Jawa Timur, Bali, dan Lombok. Di bawah bimbingan BAMBANG SURYOBROTO, SRI SUPRAPTINI MANSJOER, dan HADI S. ALIKODRA.
Monyet ekor panjang tersebar luas di Daratan Asia Tenggara, Lempeng Sunda, Kepulauan Filipina, dan daerah Wallacea Selatan. Di Indonesia hewan ini diduga berasal dari Daratan Asia Tenggara dan penyebarannya di kepulauan selatan diyakini dari barat ke timur dengan Jawa sebagai awal. Pulau Bali dan Lombok terpisah oleh selat yang dalam sehingga menimbulkan ketidakjelasan cara penyebaran monyet ekor panjang ke daerah sebelah timur garis Wallace. Penelitian ini mengungkapkan struktur populasi, keragaman fenotipe kualitatif, dan keragaman genetik populasi lokal monyet ekor panjang di Jawa Timur (sebagai asal) serta Pulau Bali dan Lombok yang mengapit garis Wallace dengan tujuan untuk mengetahui sejarah kehidupan yang telah dilaluinya. Penelitian dilakukan di dua populasi lokal di Kawasan Jawa Timur, enam populasi lokal di Pulau Bali, dan dua populasi lokal di Pulau Lombok.
Hasil penelitian menunjukkan parameter-parameter demografi bervariasi dan monyet muda adalah anggota terbanyak di masing-masing populasi lokal. Rasio monyet jantan dan betina dewasa beragam dengan kisaran sempit antara 1:1,7 dan 1:3,7 dengan rataan 1:2,3. Nisbah antara ukuran populasi efektif terhadap jumlah monyet dewasa rata-rata 0,75 untuk seluruh populasi lokal. Dua rasio ini mungkin merupakan karakter khas populasi lokal monyet ekor panjang di Indonesia.
Secara umum, monyet ekor panjang di Jawa Timur, Bali dan Lombok memiliki warna yang sama untuk mahkota, rambut punggung, rambut paha lateral, dan kulit abdomen. Warna mahkota, rambut pungggung, dan rambut paha lateral tersebut adalah kuning keemasan-kecokelatan, serta warna kulit abdomennya kebiruan. Selain itu, seluruh monyet ekor panjang yang diobservasi memiliki cambang transzigomatikus. Karakter jambul dan pusaran kepala, secara umum, ditemukan di seluruh populasi lokal di Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok. Dapat disimpulkan bahwa populasi monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau Lombok memiliki fenotipe yang sama.
Keragaman genetik populasi lokal dikaji menggunakan penanda DNA mikrosatelit. Populasi lokal yang diteliti, secara umum, berada dalam keseimbangan Hardy-Weinberg yang berarti bahwa anggotanya melakukan perkawinan secara acak. Analisis genetik menunjukkan populasi monyet ekor panjang di Kawasan Jawa Timur memiliki rataan heterosigositas dan rataan jumlah alel per lokus (berturut-turut 0,653 dan 4,89) lebih tinggi daripada yang ditemukan di Pulau Bali (0,580 dan 3,98) dan Pulau Lombok (0,481 dan 3,56). Hasil penelitian mengindikasikan bahwa penyebaran monyet ekor panjang di kepulauan selatan Indonesia berjalan dari barat ke timur dengan Jawa Timur sebagai pintu penyebaran.
ABSTRACT
I NENGAH WANDIA. Population Structure and Genetic Variation in Local Populations of Long Tailed Macaques (Macaca fascicularis) in East Java, Bali, and Lombok. Under the supervision of BAMBANG SURYOBROTO, SRI SUPRAPTINI MANSJOER, and HADI S. ALIKODRA.
The long tailed macaque is widely distributed in Mainland Southeast Asia, Sunda Shelf, Philippine Archipelago, and southern archipelago of Wallacea. Mainland Southeast Asia was regarded as their origin and subsequent migration in Southern Archipelago of Indonesia was predicted from west to east with Java as the gate. Bali and Lombok Islands are separated by deep strait which causes uncertainty about mode of their transportation to the eastern region of Wallace line. This study explored the population structures, the qualitative phenotypes, and the genetic variations of long-tailed macaques in East Java Region (as the origin) and Bali and Lombok Islands which flank Wallace line with the aim to infer their past migration. Sampling was conducted at two local populations in East Java Region, six in Bali Island, and two in Lombok Island.
Results showed that the parameters of demography varied and juvenile macaques comprised the most portions in each local population. Ratios of adult male to adult female varied in small range from 1:1.7 to 1:3.7 with an average of 1:2.3. Ratios of effective population size to total number of adult males and females were homogeneous with an average of 0.75 across local populations. The two ratios may be regarded as typical characters of macaque populations in Indonesia.
In general, the macaques in East Java, Bali, and Lombok have the same color of crown, dorsal pelage, lateral thigh pelage, and abdominal skin. The color of the crown, the dorsal pelage, and the lateral thigh pelage was golden-yellow to brown, and that of the abdominal skin was bluish. Furthermore, all of the long tailed macaques observed had transzygomatic type lateral facial crest. The characteristics of the phenotypes of crest and swirl on head were, generally, to be found throughout the local populations. It can be concluded that the populations of long tailed macaques in East Java Region (Java), Bali, and Lombok have the same phenotypic characters.
The genetic variation in the local populations was examined using microsatellite DNA markers. The populations examined, in general, were regarded as being in Hardy-Weinberg equilibrium which means that the members of the local populations mate randomly. The genetic assessment demonstrated that the populations in East Java had average heterozygosity per individual and average number of alleles per locus (0.653 and 4.89, respectively) relatively higher than those of the populations in Bali (0.580 and 3.98) and Lombok (0.481 and 3.56). The results indicated that the migration patterns of long tailed macaques in Southern Archipelago of Indonesia went from west to east with East Java (Java) as the origin.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam
STRUKTUR DAN KERAGAMAN GENETIK
POPULASI LOKAL MONYET EKOR PANJANG
(Macaca fascicularis) DI JAWA TIMUR, BALI, DAN LOMBOK
I NENGAH WANDIA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Progam Studi Primatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Struktur dan Keragaman Genetik Populasi Lokal Monyet Ekor Panjang (Macaca fascicularis) di Jawa Timur, Bali, dan Lombok
Nama Mahasiswa : I Nengah Wandia Nomor Pokok : P067030011
Program Studi : Primatologi (PRM)
Disetujui
Komisi Pembimbing
(Dr. Bambang Suryobroto) Ketua
(Dr. Ir. Sri Supraptini Mansjoer) (Prof. Dr. Ir. Hadi S. Alikodra, MS)
Anggota Anggota
Diketahui,
Ketua Program Studi Primatologi Dekan Sekolah Pascasarjana
(Prof. Drh. Dondin Sajuthi, MST, PhD) (Prof. Dr. Ir. Khairil A. Notodiputro, MS)
PRAKATA
Pertama-tama, penulis memanjatkan puji syukur kehadirat Tuhan Yang Maha Esa karena atas perkenan-Nya disertasi yang berjudul “Struktur dan Keragaman Genetik Populasi Lokal Monyet Ekor Panjang (Macaca fascicularis) di Jawa Timur, Bali, dan Lombok” dapat diselesaikan.
Penulis mengucapkan terima kasih kepada Dr. Bambang Suryobroto, Dr. Ir. Sri Supraptini Mansjoer, dan Prof. Dr. Ir. Hadi S. Alikodra, M.S atas semua arahan dan bimbingan dari sebelum penelitian sampai penulisan disertasi ini. Ucapan terima kasih juga penulis tujukan kepada Dekan FKH dan Rektor Univesitas Udayana yang telah memberikan izin tugas belajar, Dekan Sekolah Pascasarjana IPB dan Rektor IPB yang telah menerima penulis sebagai mahasiswa di Sekolah Pascasarjana IPB, dan Direktur Jendral Pendidikan Tinggi yang telah memberikan beasiswa BPPS.
Secara khusus, penulis menyampaikan apresiasi yang setinggi-tingginya kepada Dr. Bambang Suryobroto (Kepala Laboratorum Zoologi FMIPA, IPB), Dr. Agustin Fuentes (Notredame University), Dr. N. K. Mahardika (Direktur Biomedik FKH-UNUD), Dr. drh. Diah Iskandariati (Kepala Laboratorium Mikrobiologi PSSP), drh. Nengah Budiarsa (APPERI), dan drh. Aida L. Rompis (Direktur Pusat Kajian Primata UNUD) atas bantuan fasilitas, bahan kimia, dan finansial sehingga penelitian dapat diselesaikan sesuai yang direncanakan. Juga, kepada drh. I Gd. Soma MKes, drh. IGA. Arta Putra, MS, Dr. drh. I Kt. Suatha, drh. I Pt. Yasa, dan Islamul Hadi, SSi, MSi, sebagai tim inti penangkap monyet saat penelitian lapangan, serta anggota lainnya yang tidak bisa disebutkan satu per satu, penulis menyampaikan penghargaan atas bantuan tenaga fisik di lapangan.
Penulis tidak lupa juga mengucapkan terima kasih kepada pengelola atau pemangku adat di Pura Gunung Pengsong, Pura Bukit Gumang, Wanara Wana Ubud, Sangeh, Alas kedaton, Pura Uluwatu, Pura Pulaki, dan Pura Giri Sloka Alas Purwo. Demikian pula, kepada petugas polisisi hutan di lokasi Alas Purwo, Baluran, dan Sangeh atas segala bantuan fisiknya, penulis mengucapkan terima kasih yang sebesar-besarnya. Kepada staf dan teman-teman di Laboratorium Zoologi FMIPA IPB, penulis menyampaikan penghargaan setinggi-tingginya atas bantuan dan kerjasamanya. Akhirnya, kepada isteri dan keluarga, penulis menyampaikan banyak terima kasih atas kesabaran dan dukungan moral serta materialnya selama menempuh studi di IPB.
Semoga disertasi ini ada manfaatnya.
RIWAYAT HIDUP
I NENGAH WANDIA, anak kedua dari pasangan suami istri Ketut Singra dan Ni Nengah Wengsi, lahir tanggal 1 Oktober 1966 di Jembrana, Bali. Pendidikan sekolah dasar diselesaikan pada tahun1979 di SD 2 Dangintukadaya, Negara, Jembrana. Pada tahun 1982, pendidikan menengah pertama ditamatkan di SMP 1 Negara, dan pendidikan menengah atas diselesaikan pada tahun 1985 di SMA 1 Negara, Jembrana. Selanjutnya, penulis mengikuti pendidikan kedokteran hewan di Program Studi Kedokteran Hewan Universitas Udayana dan memperolah gelar Sarjana Kedokteran Hewan (Drs. Med. Vet.) pada tahun 1989, dan gelar Dokter Hewan diraih oleh penulis di tempat yang sama pada tahun 1991. Tahun 2001, penulis menyelesaikan pendidikan pascasarjana S2 di Program Studi Primatologi, Sekolah Pascasarjana IPB, Bogor, dan tahun 2003 penulis melanjutkan ke jenjang pendidikan S3 di program studi yang sama.
Sejak tahun 1994 sampai sekarang penulis menjadi staf pengajar di Fakultas Kedokteran Hewan Universitas Udayana. Pada bulan Oktober 1999, penulis mendapatkan kesempatan mengikuti pelatihan dan seminar Asian Science Seminar on Biodiversity selama dua minggu di Primate Research Institute, Kyoto University, Inuyama, Aichi, Jepang.
ix
DAFTAR ISI
halaman
DAFTAR TABEL ………. xii
DAFTAR GAMBAR ……… xiv
DAFTAR LAMPIRAN ………. xvi
PENDAHULUAN ……… Latar Belakang ……… Identifikasi Masalah ……… Tujuan Penelitian ……… Pemecahan Masalah ……….. Hipotesis ………. Manfaat Penelitian ………..
1 1 4 4 4 5 6 TINJAUAN PUSTAKA ………
Monyet Ekor Panjang (Macaca Fascicularis) ……… Reproduksi ……….. Morfologi ……… Genetika Populasi Monyet Ekor Panjang ………... DNA Mikrosatelit ………... Amplifikasi Fragmen DNA ……….. Keragaman Genetik ………
7 7 11 11 13 14 15 16 MATERI DAN METODE PENELITIAN ………
Pendekatan Populasi ……….. Waktu dan Lokasi Penelitian ……… Koleksi dan Analisis Data ……… Pendekatan Morfologi Eksternal (Fenotipe Kualitatif)………….. Waktu dan Lokasi Penelitian ……… Alat dan Bahan ………. Koleksi dan Analisis Data Fenotipe ………. Pendekatan Genetik (Mikrosatelit) ……… Waktu dan Lokasi Penelitian ……… Alat dan Bahan ……….. Primer Mikrosatelit ……… Pengambilan Contoh Darah Monyet Ekor Panjang ………... Ekstraksi dan Purifikasi DNA Total ……….
Amplifikasi Lokus Mikrosatelit ………... Peubah Genetika Populasi ………. Analisis Data Mikrosatelit………..
x HASIL DAN PEMBAHASAN ………
Struktur Populasi Lokal Monyet Ekor Panjang di Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok ………...
Hasil Penelitian ……… Kelompok Sosial dan Komposisi Umur Anggota Populasi Lokal ……….. Kepadatan Populasi Lokal………. Rasio Monyet Ekor Panjang Jantan dan Betina Dewasa serta Ukuran Populasi Efektif ………. Pembahasan ……… Simpulan ……… Keragaman Fenotipe Kualitatif Populasi Lokal Monyet Ekor Panjang di Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok
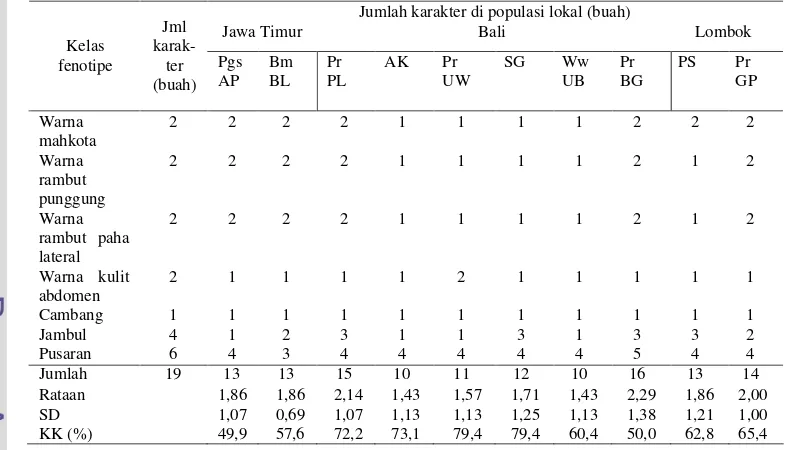
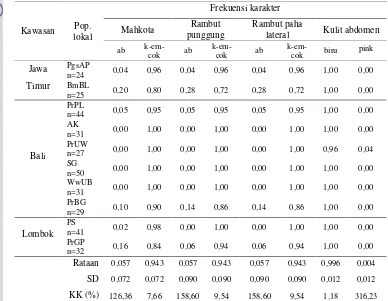
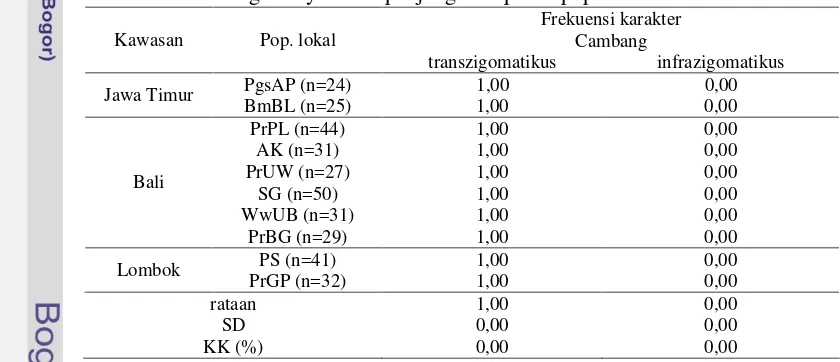
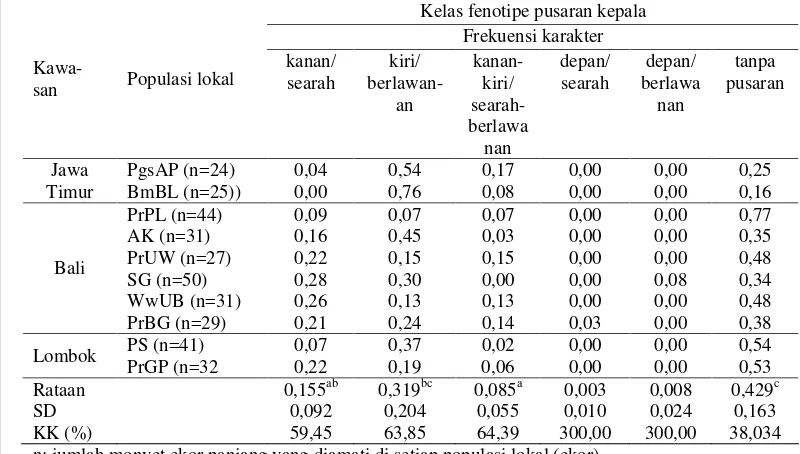
Hasil Penelitian ……… Kelas Fenotipe Kualitatif dan Sebaran Karakter……… Warna Mahkota, Rambut Punggung, Rambut Paha Lateral, dan Kulit Abdomen ……….. Cambang (Crest Lateral Wajah) dan Jambul ………… Pusaran Rambut Kepala ……… Analisis Korespondensi Karakter Fenotipe Kualitatif Monyet Ekor Panjang Penelitian ……….. Pembahasan ………
Warna Mahkota, Rambut Punggung, Rambut Paha Lateral, dan Kulit Abdomen ……….. Cambang dan Jambul ……… Pusaran Rambut Kepala Monyet Ekor Panjang………. Kekhasan Fenotipe Populasi Lokal Monyet Ekor Panjang ……….. Simpulan ……… Struktur Genetik Populasi Lokal Monyet Ekor Panjang di Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok……… Hasil Penelitian ………
Alel dan Lokus Polimorfik ……… Distribusi Frekuensi Alel ……….. Variasi Genetik dan Keseimbangan Hardy-Weinberg... Deferensiasi Genetik Populasi Lokal Dalam Pulau dan Aliran Genetik ………... Diferensiasi Genetik Populasi Lokal Seluruh Pulau …. Jarak Genetik Antar Populasi Lokal ………. Pembahasan ………
Lokus Mikrosatelit Polimorfik dan Penyebaran Alel… Keragaman dan Diferensiasi Genetik ………... Jarak Genetik Antar Populasi Lokal ………. Simpulan ……… Pembahasan Umum ………
Struktur Populasi, Keragaman Fenotipe Kualitatif, dan Keragaman Genetik Populsi Lokal ………
xi Filogeografi Monyet Ekor Panjang Jawa Timur, Bali, dan
Lombok ……… Spesiasi Aloptrik ……… Keragaman Genetik Sebagai Basis Pengelolaan Populasi Lokal Monyet Ekor Panjang ………..
104 107 109 SIMPULAN DAN SARAN ………..
Simpulan ………. Saran ………
112 112 112
DAFTAR PUSTAKA ………... 113
xii
DAFTAR TABEL
Halaman
1 Jumlah monyet ekor panjang dewasa yang diamati untuk data
fenotipe kualitatif di masing-masing populasi lokal …………... 22 2 Jumlah contoh darah monyet ekor panjang pada masing-masing
populasi lokasi ………... 23
3 Struktur populasi, luas habitat, dan kepadatan populasi lokal monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau
Lombok ……… 30
4 Rasio jantan dan betina dewasa serta ukuran populasi efektif (Ne) populasi lokal monyet ekor panjang di Kawasan Jawa
Timur, Pulau Bali, dan Pulau Lombok ……… 32 5 Sebaran karakter kelas fenotipe kualitatif di sepuluh populasi
lokal monyet ekor panjang………. 41
6 Distribusi frekuensi warna mahkota, rambut punggung, rambut paha lateral, dan kulit abdomen monyet ekor panjang di sepuluh
populasi lokal ………... 44
7 Frekuensi karakter transzigomatikus dan infrazigomatikus kelas fenotipe jambul pipi monyet ekor panjang di sepuluh populasi
lokal………. 46
8 Frekuensi karakter tengah/tegak, kiri/ke kiri, kiri/tegak, dan tanpa jambul kelas fenotipe jambul monyet ekor panjang di
sepuluh populasi lokal………... 47 9 Frekuensi karakter kanan/searah, kiri/berlawanan,
kanan-kiri/searah-berlawanan, sepan/searah, depan/berlawanan, dan tanpa pusaran kelas fenotipe pusaran kepala monyet ekor
panjang di sepuluh populasi lokal ……...………. 50 10 Jumlah alel pada masing-masing lokus mikrosatelit di sepuluh
populasi lokal monyet ekor panjang ……… 68 11 Heterosigositas dan simpangan baku masing-masing lokus
mikrosatelit pada populasi lokal monyet ekor panjang di
Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok ………… 80 12 Rataan heterosigositas (H) dan galat baku (SE) populasi lokal
monyet ekor panjang di Kawasan Jawa Timur, Pulau Bali, dan
Pulau Lombok ... 81 13 Nilai FIT masing-masing lokus mikrosatelit pada populasi lokal
xiii
14 Diferensiasi genetik (FST) dan jumlah migran efektif (Nem)
pada populasi lokal dalam Kawasan Jawa Timur, Pulau Bali,
dan Pulau Lombok ……….. 84
15 Jarak genetik standar Nei (DS) antar populasi lokal monyet ekor
panjang ………. 86
16 Rataan jarak genetik standar Nei (DS) antar populasi kawasan
xiv
DAFTAR GAMBAR
Halaman
1 Diagram alur kerangka pikir penelitian ………. 6 2 Populasi lokal monyet ekor panjang yang diteliti untuk struktur
populasi dan fenotipe kualitatif ………. 18 3 Lokasi pencuplikan darah monyet ekor panjang ………... 23 4 Komposisi monyet anak, muda, dan dewasa di masing-masing
populasi lokal monyet ekor panjang………... 31 5 Komposisi gabungan monyet anak dan muda, betina dewasa, dan
jantan dewasa di masing-masing populasi lokal monyet ekor
panjang……… 31
6 Warna mahkota, rambut punggung, dan rambut paha lateral monyet
ekor panjang ………. 43
7 Warna kulit adomen monyet ekor panjang ……… 45 8 Cambang (A) dan jambul (B) monyet ekor panjang………. 46 9 Sebaran frekuensi jenis (posisi dan kecondongan) jambul monyet
ekor panjang di seluruh populasi lokal ……….. 48 10 Pusaran kepala pada monyet ekor panjang ……… 49 11 Proyeksi karakter fenotipe monyet ekor panjang pada sumbu F1
dan F2 analisis korespondensi berganda ……….. 54 12 Proyeksi karakter fenotipe monyet ekor panjang, jenis kelamin, dan
populasi lokal pada sumbu F1 dan F2 analisis korespondensi
berganda ……… 56
13 Proyeksi karakter fenotipe monyet ekor panjang, jenis kelamin, dan populasi lokal pada sumbu F1 dan F3 analisis korespondensi
berganda ……… 58
14 Alel lokus D1S533 ……… 67
15 Rataan jumlah alel seluruh populasi lokal di dalam Kawasan Jawa
Timur, Pulau Bali, dan Pulau Lombok ……….. 69 16 Rataan alel per lokus seluruh populasi lokal di dalam Kawasan
xv
17 Distribusi frekuensi alel lokus D1S533 di sepuluh populasi lokal
monyet ekor panjang ………. 70
18 Distribusi frekuensi alel lokus D1S548 di sepuluh populasi lokal
monyet ekor panjang ……… 71
19 Distribusi frekuensi alel lokus D1S550 di sepuluh populasi lokal
monyet ekor panjang ……….. 72
20 Distribusi frekuensi alel lokus D2S367 di sepuluh populasi lokal
monyet ekor panjang ……… 73
21 Distribusi frekuensi alel lokus D3S1768 di sepuluh populasi lokal
monyet ekor panjang ………. 74
22 Distribusi frekuensi alel lokus D4S243 di sepuluh populasi lokal
monyet ekor panjang ………. 75
23 Distribusi frekuensi alel lokus D4S2456 di sepuluh populasi lokal
monyet ekor panjang ……… 77
24 Distribusi frekuensi alel lokus D5S820 di sepuluh populasi lokal
monyet ekor panjang ………. 78
25 Distribusi frekuensi alel lokus D2S1368 di sepuluh populasi lokal
monyet ekor panjang ………. 79
26 Rataan heterosigositas (H) seluruh populasi lokal di dalam
Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok ……… 82 27 Diferensiasi genetik populasi lokal monyet ekor panjang (FST)
untuk seluruh kawasan atau pulau (Jawa Timur, Pulau Bali, Pulau
Lombok) ……… 85
28 Pengelompokan populasi lokal monyet ekor panjang berdasaran
jarak genetik standar Nei (DS) dengan metode UPGMA ………….. 87
xvi DAFTAR LAMPIRAN
Halaman
1 Preparasi membran dialisis, larutan dialisis, dan urea lysis buffer…. 121 2 Pewarnaan perak (silver staining) pada gel poliakrilamid 7% …….. 122 3 Rumus yang digunakan dalam analisis fenotipe dan genetik ……… 123 4 Kelas fenotipe jambul monyet ekor panjang dan Uji T ………... 127 5 Kelas fenotipe pusarankepala monyet ekor panjang dan Uji T …… 128 6 Analisis korespondensi karakter fenotipe monyet ekor panjang …... 129 7 Frekuensi alel masing-masing lokus mikrosatelit pada sepuluh
populasi lokal monyet ekor panjang ………. 132 8 Ideks Fiksasi (FIT) lokus mikrosatelit pada masingmasingpopulasi
lokal monyet ekor panjang dan nilai ?2 ………. 134 9 Runutan nukleotida primer mikrosatelit yang digunakan untuk
penelitian ……… 136
10 Alel mikrosatelit yang terobservasi pada monyet ekor panjang (Elektroforesis pada gel poliakrilamid 7% dengan pewarnaan
perak) ……… 137
PENDAHULUAN
Latar Belakang
Monyet ekor panjang (Macaca fascicularis) tersebar luas di Daratan Asia Tenggara, Lempeng Sunda, Kepulauan Filipina, dan daerah Wallacea Selatan.
Monyet ekor panjang di Indonesia diperkirakan berasal dari Daratan Asia Tenggara dan bermigrasi melebihi satu juta tahun yang lalu (awal Pleistocene) saat Daratan Asia dan Lempeng Sunda menyatu (Eudey 1980; Wheatley 1980; Fooden 1995). Fosilnya yang ditemukan di Desa Trinil, Jawa Tengah berumur lebih tua jika dibandingkan dengan yang ditemukan di Pulau Timor dan Pulau Flores (Fooden 1995). Hal ini meyakinkan para ahli bahwa penyebarannya di kepulauan selatan Indonesia berjalan dari barat ke timur dengan populasi Jawa sebagai pusat penyebaran. Penyebarannya dari Jawa ke Bali diperkirakan melalui migrasi langsung karena kedua pulau beberapa kali menyatu saat proses glasiasi (pembentukan lempengan es) (Fooden 1995). Namun, cara penyebarannya ke pulau yang berada di sebelah timur garis Wallace belum jelas.
2 maksimum yang terakhir ( 18 ribu tahun yang lalu) (Fooden 1995). Hal ini meniscayakan migrasi monyet ekor panjang juga menyeberangi laut sebagai cara penyebarannya ke kepulauan sebelah timur garis Wallace.
Penelitian sebelumnya mengenai variasi genetik monyet ekor panjang di Indonesia dengan penanda protein darah menemukan adanya ketidakselarasan antara keragaman genetik bersanding dengan letak geografi kelompok monyet ekor panjang Jawa, Bali, dan Lombok (Kawamoto et al. 1984). Keragaman genetik populasi atau kelompok sosial monyet ekor panjang di Pulau Bali seyogyanya lebih tinggi daripada yang ditemukan di Pulau Lombok sebagai akibat dari efek founder, tetapi hasil penelitian (Kawamoto et al. 1984) menunjukkan hal sebaliknya. Dinyatakan pula bahwa ada bantuan manusia bagi migrasi dari Pulau Jawa langsung ke Pulau Lombok. Penelitian lebih lanjut diperlukan untuk mendapatkan ketegasan mengenai pola migrasi monyet ekor panjang ke kepulauan sebelah timur garis Wallace.
Struktur genetik suatu spesies mencerminkan biodiversitas pada tingkat yang paling dasar. Struktur genetik ini tidak hanya memberikan informasi tentang biodiversitas pada saat ini, tetapi juga menunjukkan sejarah kehidupan yang telah dilaluinya dan kondisi mendatang yang akan dialaminya. Kemampuan retrospektif dan prospektif ini diperoleh dengan mengetahui parameter-parameter yang menentukan struktur genetik populasi (Nozawa et al. 1996; Hartl dan Clark 1997; Frankham et al. 2004). Oleh karena itu, data struktur genetik suatu spesies atau populasi bukan saja dapat menerangkan sejarahnya, tetapi juga dapat digunakan sebagai dasar pertimbangan strategi konservasinya.
3 mengelompokkan monyet ekor panjang di Pulau Jawa, Pulau Bali, dan Pulau Lombok ke dalam M. f. fascicularis. Berkaitan dengan hal ini, variasi genetik antar populasi juga dapat digunakan sebagai bahan pertimbangan untuk penegasan suatu klasifikasi.
Terlepas dari kisah penyebarannya, kini, sebagian besar populasi monyet ekor panjang di suatu pulau berada dalam populasi-populasi lokal yang terpisah satu dengan yang lain. Meskipun keberadaan menjadi beberapa populasi lokal cukup menguntungkan seperti tidak musnah seluruhnya jika terjadi bencana alam atau wabah penyakit di satu lokasi dan memberi insentif ekonomi tinggi pada masyarakat sekitarnya, populasi demikian cukup rentan terhadap kehanyutan genetik dan tekanan silang dalam (Avise 1994; Nozawa et al. 1996; Hartl dan Clark 1997). Kehilangan keragaman genetik populasi yang berkelanjutan akan mengancam keberadaan jangka panjang populasi lokal tersebut. Langkah-langkah konservasi in situ sangat diperlukan untuk menghindarkan kesirnaan dari habitat alaminya.
4 Berdasarkan pada informasi di atas, sangat menarik untuk meneliti cara penyebaran monyet ekor panjang melewati garis Wallace, isolasi geografi dan fragmentasi populasi, serta kondisi ekosistem kontemporer. Penelitian kali ini dilakukan pada populasi lokal monyet ekor panjang yang menempati Kawasan Jawa Timur (sebagai populasi asal) serta Pulau Bali dan Pulau Lombok yang mengapit garis Wallace. Penelitian menyangkut demografi populasi dan keragaman genetik populasi yang didekati melalui morfologi eksternal (fenotipe kualitatif) dan penanda mikrosatelit (DNA).
Identifikasi Masalah
1 Belum adanya informasi struktur populasi monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau Lombok.
2 Kurangnya informasi keragaman genetik populasi lokal monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau Lombok yang didekati dengan morfologi eksternal (fenotipe kualitatif) dan mikrosatelit (DNA inti).
Tujuan Penelitian
1 Mendapatkan kejelasan proses migrasi monyet ekor panjang di kepulauan selatan Indonesia.
2 Mengkaji struktur populasi lokal monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau Lombok.
3 Mengkaji keragaman morfologi eksternal (fenotipe kualitatif) dan keragaman genetika molekuler dengan penanda mikrosatelit populasi lokal monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau Lombok.
Pemecahan Masalah
5 terhadap keberlangsungan hidup masing-masing populasi lokal di Jawa Timur, Bali, dan Lombok.
Keragaman genetik populasi lokal dianalisis menggunakan dua pendekatan yaitu morfologi eksternal (fenotipe kualitatif) dan mikrosatelit (DNA inti). Pendekatan fenotipe kualitatif digunakan karena keragamannya lebih dipengaruhi oleh keragaman materi genetiknya. Meskipun fenotipe kualitatif sangat susah diketahui pola pewarisan ke generasi berikutnya karena bersifat multifaktorial, fenotipe kualitatif cukup baik untuk identifikasi keunikan suatu populasi dan identifikasi subspesies. Pendekatan genetik menggunakan mikrosatelit (DNA inti) sebagai penanda molekul. Pendekatan ini lebih mencerminkan struktur genetik populasi karena mikrosatelit merupakan materi genetik itu sendiri. Mikrosatelit telah digunakan secara luas sebagai penanda molekul di berbagai studi genetika populasi karena beberapa keunggulan yang dimilikinya seperti kelimpahannya tinggi dalam genom eukariot, polimorfismenya tinggi akibat mutasi dan rekombinasi, dan amplifikasinya mudah secara in vitro melalui polymerase chain reaction (PCR). Kejelasan proses migrasi monyet ekor panjang di kepulauan selatan Indonesia didapatkan melalui pengkajian kecenderungan penurunan keragaman genetik populasi dan kecenderungan peningkatan jarak genetik populasi dari barat ke timur dengan populasi di Jawa Timur sebagai pusat penyebaran. Secara keseluruhan, kerangka pemikiran penelitian dituangkan ke dalam diagram alur seperti ditampilkan pada Gambar 1.
Hipotesis
1. Struktur populasi menentukan kestabilan populasi lokal monyet ekor panjang di setiap lokasi.
2. Karakteristik fenotipe kualitatif populasi lokal monyet ekor panjang antar pulau berbeda.
6
Manfaat Penelitian
1. Informasi yang diperoleh dapat digunakan sebagai model untuk proses migrasi dan sejarah penyebaran mamalia.
2. Struktur dan keragaman genetik populasi dapat dijadikan bahan pertimbangan dalam penyusunan strategi konservasi (pengawetan, pengembangan, dan pemanfaatan) populasi lokal monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau Lombok.
Gambar 1 Diagram alur kerangka pikir penelitian. Karakteristik
demografi
Populasi lokal Di Jatim, Bali, Lombok
Monyet ekor panjang Melintasi garis
Wallace Isolasi geografi dan fragmentasi Ekosistem kontemporer
Keragaman genetik populasi lokal
Pendekatan fenotipe kualitatif
Pendekatan mikrosatelit
Struktur populasi Karakter kualitatif
Sebaran alel Peubah genetika populasi
Analisis
Interpretasi: modus migrasi
TINJAUAN PUSTAKA
Monyet Ekor Panjang (Macaca fascicularis)
Klasifikasi
Monyet ekor panjangtermasuk kelompok monyet dunia lama (Old World monkey) dan diklasifikasikan sebagai berikut (Napier dan Napier 1985; Swindler 1998):
Kelas : Mammalia Ordo : Primates
Subordo : Anthropoidea Infraordo : Catarrhini
Superfamili : Cercopithecoidea
Famili : Cercopithecidae Subfamili: Cercopithecinae
Genus : Macaca
Spesies : Macacafascicularis
Berdasarkan pada anatomi saluran reproduksi, Fooden (1980) membagi genus Macaca menjadi empat grup yaitu silenus-sylvanus, sinica, fascicularis, dan arctoides. Grup silenus-sylvanus ditandai oleh glans penis bilobus tumpul dan lebar. Glans penis pada grup sinica lebar tetapi ujungnya lancip. Pada grup
fascicularis, glans penisnya bilobus tumpul tetapi sempit, dan pada grup
arctoides, glans penisnya memanjang dan ujungnya lancip. Anatomi saluran reproduksi betina grup silenus-sylvanus sama dengan grup fascicularis. Kedua grup ini memiliki serviks uterus dan kolikuli servikalis berukuran sedang atau moderat. Sedangkan pada grup sinica, ukuran organ tersebut sangat besar. Sementara, pada grup arctoides, kolikuli servikalis tidak ada tetapi ditemukan organ kolikulus vestibularis. M. fascicularis dimasukkan ke dalam kelompok
fascicularis bersama-sama M. cyclopis, M. mulatta, dan M. fuscata.
8
sublimiatus (Pulau Lombok, Pulau Sumbawa, Pulau Flores, dan Pulau Sumba), dan M. f. limiatus (Pulau Timor). Sementara, Supriatna dan Wahyono (2000) melaporkan ada empat subspesies monyer ekor panjang di Indonesia yaitu M. f. fascicularis (Sumatera, Kalimantan, Jawa, Bali, Lombok, Sumbawa, Flores, Sumba hingga Timor), M. f. fusca (Pulau Simaleu), M. f. karimondjawai (Pulau Karimunjawa), dan M. f. lasiae (Pulau Lasia).
Kelompok Sosial
Monyet ekor panjang hidup dalam sebuah kelompok sosial. Kelompok sosial didefinisikan sebagai kelompok yang di antara anggotanya terjalin komunikasi secara intensif (Jolly 1985). Kelompok sosial monyet ekor panjang termasuk dalam multi-male group yakni dalam satu kelompok terdapat beberapa jantan dan betina dewasa serta anak-anaknya (Napier dan Napier 1985; Mitchell dan Erwin 1986; Williams dan Bernstein 1995). Sebuah kelompok sosial sering terbagi menjadi beberapa subkelompok (Rowe 1996).
Adanya lebih dari satu jantan dewasa dalam sebuah kelompok sosial sering menimbulkan ketegangan di antara jantan sekelompok. Keadaan ini menimbulkan hirarki dominansi pada jantan dalam kelompok tersebut. Perilaku sosial anggota kelompok sangat dipengaruhi oleh hirarki dominansi. Secara umum, hirarki dominansi tertinggi diduduki oleh jantan dewasa (alpha male) (Swindler 1998).
Secara kolektif, monyet betina berperan penting dalam kehidupan sosial meskipun secara individual merupakan subordinat dari monyet jantan. Monyet ekor panjang bersifat matrilinial. Monyet betina membentuk inti permanen dari kelompok sosial karena tetap tinggal pada kelompok kelahirannya. Monyet jantan yang lahir sering bermigrasi ke kelompok sosial lainnya (Napier dan Napier 1985; Mitchell dan Erwin 1986).
9 ditemukan daerah teritori. Daerah ini akan dicegah terhadap masuknya anggota kelompok lain (Jolly 1985; Napier dan Napier 1985).
Pakan
Monyet ekor panjang melakukan aktivitas di siang hari (diurnal). Sebagian besar aktivitasnya dilakukan di atas tanah (terrestrial), dan sebagian lagi pada pohon (arboreal). Monyet ini memiliki kantong pipi sebagai tempat penyimpanan makanan untuk sementara (Napier dan Napier 1985). Primata ini termasuk hewan frugivora (makanan utama buah-buahan) sampai omnivora. Selain buah-buahan, jenis pakan lainnya berupa serangga, bunga rumput, jamur, kepiting, moluska, akar, biji, dan telor (Wheately 1980, 1989).
Penyebaran dan Habitat
Monyet ekor panjang tersebar luas dari 20o Lintang Utara sampai 10o Lintang Selatan dan 92o Bujur Timur sampai 128o Bujur Timur (Wheatley 1980). Monyet ekor panjang Indonesia diperkirakan berasal dari Daratan Asia Tenggara. Penyebarannya terjadi lebih dari satu juta tahun yang lalu (awal Pleistocene) saat Daratan Asia Tenggara menyatu dengan Lempeng Sunda akibat pembentukan lempengan es (glasiasi) dan penurunan permukaan air laut (Fooden 1995). Selanjutnya, penyebaran dan isolasi monyet ini di Kepulauan Sunda dimulai sejak 20 ribu tahun yang lalu selama proses glasiasi terakhir (Eudey 1980).
Di Indonesia, fosil monyet ekor panjang tertua ditemukan di Desa Trinil (daerah di bagian timur Jawa Tengah) dengan umur mendekati satu juta tahun yang lalu (Fooden 1995). Fosil monyet ekor panjang juga ditemukan di Pulau Timor dengan umur lebih kurang 4.500 tahun dan Pulau Flores dengan umur lebih kurang 3.500 tahun. Para ahli meyakini bahwa penyebaran monyet ekor panjang di Indonesia dimulai dari barat (Pulau Jawa sebagai daerah asal) ke timur (Eudey 1980; Fooden 1995).
10 Pulau Bali menyatu dengan Pulau Jawa, dan mengalami pemisahan serta isolasi sejak sebelum 5 ribu tahun yang lalu akibat peningkatan permukaan air laut (pembentukan Selat Bali, Fooden 1995).
Proses penyebaran genus Macaca ini ke pulau bagian timur garis Wallace seperti Pulau Lombok dan Sumbawa tampaknya belum jelas. Berbeda dengan Pulau Bali yang dipisahkan oleh selat dangkal (Selat Bali) dari Pulau Jawa, Pulau Lombok dipisahkan oleh selat yang dalam dan lebar (Selat Lombok) dari Pulau Bali. Saat glasiasi maksimum terakhir (±18 ribu tahun yang lalu) Pulau Lombok menyatu dengan Pulau Sumbawa dan Moyo tetapi tetap terpisah dengan Pulau Bali. Selanjutnya, Pulau Lombok, Sumbawa, dan Moyo terpisah bersamaan dengan peningkatan permukaan air laut sejak sebelum 5 ribu tahun yang lalu (Fooden 1995). Beberapa hipotesis telah dimunculkan untuk menerangkan hal tersebut seperti penyebaran melalui migrasi saat pulau-pulau tersebut menyatu, melalui berenang dan rafting antar pulau, dan introduksi manusia (Fooden 1995). Indikasi bahwa keberadaannya di kawasan timur garis Wallace akibat introduksi manusia tampak sejalan dengan hipotesis yang dilansir oleh Kawamoto dan Suryobroto (1985).
11
Reproduksi
Kematangan seksual dimulai siapnya individu untuk bereproduksi baik secara fisik maupun mental. Kematangan seksual monyet ekor panjang jantan pada umur 51,6 bulan (Rowe 1996). Kematangan seksual jantan ditandai oleh volume testis yang lebih besar dari 20 cm3. Meskipun monyet jantan memproduksi sperma yang cukup banyak pada umur 3,5 tahun, monyet tersebut belum dinyatakan dewasa secara sosial. Selain itu, monyet ini tidak memberikan kontribusi yang nyata untuk perkawinan sampai 2-3 tahun kemudian (Hendrickx dan Dukelow 1995). M. fascicularis betina mengalami pubertas pada umur 2-3 tahun. Pubertas ditandai oleh kejadian menstruasi pertama (menarche). Siklus menstruasi berkisar 28-32 hari dan ovulasi terjadi pada hari ke 12 sampai hari ke 15 (Hendrickx dan Dukelow 1995). Kematangan seksual monyet ekor panjang betina pada umur 50,4 bulan, dan lama kebuntingan berkisar antara 160–170 hari. Umur melahirkan pertama umumnya 46 bulan, dan interval kelahiran antara 12– 24 bulan (Rowe 1996). Secara umum, monyet ini melahirkan satu anak. Penyapihan anak dilakukan pada umur 12-18 bulan (Hendrickx dan Dukelow 1995).
Dalam multi male group, ada kompetisi antar jantan untuk mengawini betina. Pembentukan ikatan sementara antara seekor betina siap kawin dengan seekor jantan dapat menurunkan intensitas perkelahian antar jantan. Ikatan ini dapat terjadi selama satu periode siap kawin. Selama periode ini, jantan tersebut akan selalu dekat dan mengawasi betina pasangannya (Napier dan Napier 1985).
Betina siap kawin menunjukkan pembengkakan dan perubahan warna kulit di sekitar alat kelamin luar. Pembengkakan dan perubahan warna menjadi kemerahan dikarenakan oleh pengaruh hormon estrogen dalam darah. Pembengkakan maksimum terjadi saat ovulasi dan setelahnya mengalami penurunan (Zappler 1972).
Morfologi
12 tulang duduk (ischium) (Napier dan Napier 1985). Monyet ini memiliki warna rambut bervariasi dari coklat kekuningan atau abu-abu sampai coklat gelap. Warna rambut di bagian ventral tubuh lebih pucat. Rambut di atas mahkota kepala tumbuh kearah belakang yang sering berbentuk jambul (crest) yang lancip (Groves 2001). Monyet ekor panjang memiliki cambang (crest di lateral wajah) bertipe tranzigomatikus atau infrazigomatikus (Fooden 1995). Monyet ekor panjang jantan dewasa memiliki kumis, sedangkan pada betina yang dewasa ditemukan jenggot. Anak yang baru lahir berambut hitam dan wajahnya berambut tipis. Warna kulit wajahnya abu-abu gelap dengan kulit kelopak mata bagian medial lebih pucat (Chiarelli 1972; Rowe 1996).
Monyet ekor panjang menunjukkan perbedaan ukuran antara jantan dan betina (sexual dimorphism). Bobot tubuh monyet ekor panjang jantan 4,7-8,3 kg dan yang betina 2,5-5,7 kg. Panjang kepala dan badan jantan berkisar 412-648 mm dan betina berkisar 385-503 mm. Panjang ekor monyet jantan 435-655 mm dan betina 400-550 mm. Indeks intermembral 93 (Rowe 1996).
Jumlah gigi permanen genus Macaca 32 buah (2I – 1C – 2PM – 3M/2I – 1C - 2PM – 3M). Gigi seri atas agak lebar terutama gigi seri pertama, sedangkan gigi seri kedua lebih kecil dan sering lancip. Gigi seri bawah kedua lebih lebar dari gigi seri bawah pertama. Gigi taring atas berukuran panjang baik pada jantan maupun betina, tetapi yang jantan lebih panjang dari yang betina. Gigi taring bawah lebih pendek dari taring atas, namun tetap menonjol melebihi tepi deretan geligi lainnya. Premolar ketiga (P3) atas memiliki satu atau dua kuspis, sedangkan P4 umumnya memiliki tiga kuspis (Swindler 1998).
Bentuk premolar bawah bervariasi. P3 bawah memiliki sebuah kuspis yang memanjang, sedangkan P4 memiliki dua sampai empat kuspis. Molar atau geraham Macaca adalah bilophodont. Pada masing-masing molar terdapat empat kuspis (dua cuspis buccalis dan dua cuspis lingualis yang dihubungkan oleh
13
Genetika Populasi Monyet Ekor Panjang
Genus Macaca memiliki jumlah kromosom 2N=42 buah. Tipe kromosomnya meliputi metasentrik, submetasentrik, dan akrosentrik (Marks 1994 dalam Swindler 1998).
Distribusi varian atau alel genetik populasi monyet ekor panjang antar pulau bervariasi. Penelitian variabilitas genetik monyet ekor panjang di Indonesia menunjukkan bahwa sejumlah tiga alel plasma protease inhibitor (Pi) ditemukan dari lima alel kodominan yang ada pada monyet Asia. Sejumlah empat alel
plasma transferrin (Tf) ditemukan pada monyet Indonesia dari lebih kurang 13 alel Tf yang terdapat pada monyet Asia. Dua alel plasma alkaline phosphatase
(Alp) ditemukan pada monyet Bali. Dari dua alel plasma thyroxin-binding prealbumin (TBPA) yang ditemukan pada monyet Asia, hanya satu alel (F) yang ditemukan pada monyet Jawa, Sumatera, dan Bali. Varian hemoglobin ß, tepatnya Hb ß6, hanya tersebar pada monyet Bali (kelompok sosial Kukuh). Tiga alel cell phosphohexose isomerase (Phi) ditemukan pada monyet Indonesia dari 13 alel yang ada di monyet Asia. Sejumlah tiga alel cell phosphoglucomutase I (Pgm-I) ditemukan pada monyet Indonesia dari lima alel yang terdapat di monyet Asia. Varian baru cell phosphoglucomutase II, Pgm-II6, ditemukan pada kelompok sosial monyet di Bukit Cangang, sedangkan kelompok sosial lainnya di Indonesia hanya ditemukan alel Pgm-II1. Monyet Indonesia tersebar oleh dua alel cell lactate dehydrogenase A (LdhA), sedangkan pada monyet Malaysia ditemukan tiga alel (LdhA 1-3). Monyet Indonesia hanya tersebar oleh dua alel
cell isocitrate dehydrogenase (Idh). Penyebaran varian-varian tersebut tidak sama pada berbagai area di Indonesia (Kawamoto et al. 1981).
14 monyet ekor panjang di Bali di bawah 4%, sedangkan monyet ekor panjang di Jawa dan Sumatera Barat di atas 4%. Diferensiasi genetik (GST) monyet ekor
panjang antar kelompok sosial di pulau yang berbeda (Jawa, Sumatera, dan Bali) 0,4695. Diferensiasi genetik antar kelompok sosial di Bali 0,1024, di Jawa 0,2933, dan di Sumatera 0,0826 (Kawamoto et al. 1981). Dalam publikasi Perwitasari-Farajallah et al. (1999) ditemukan bahwa rataan heterosigositas kelompok sosial monyet di Jawa Barat 0,06 dan diferensiasi genetik antar populasi lokal 0,241. Di lain pihak, dengan menggunakan penanda DNA mitokondria, diferensiasi genetik antar populasi lokal 100%.
DNA Mikrosatelit
Tidak semua runutan deoxyribonucleic acid (DNA) dalam genom eukariot menyandi protein atau ribonucleic acid (RNA). Namun demikian, tidak menyandi tidak berarti runutan tersebut tanpa makna. Beberapa kelas DNA berulang, tidak menyandi, yang ditemukan dalam genom eukariot adalah satelit DNA, jumlah ulangannya banyak (> 104) dan letaknya berurutan; minisatelit dan mikrosatelit, jumlah ulangannya sedang dan letaknya berurutan; dan transposable elements, jumlah ulangannya sedang sampai banyak dan letaknya tersebar (Page dan Holmes 1998).
Mikrosatelit, dikenal juga sebagai simple sequence repeats (SSRs) atau
simple tandem repeats (STRs) (Whitton et al. 1997), merupakan runutan pendek sederhana (khususnya di-, tri-, dan tetranukleotida) yang terulang secara berurutan dalam genom eukariot (Hearne et al. 1992; Avise 1994). Polimorfisme alelik mikrosatelit timbul karena perbedaan jumlah salinan motif (unit runutan) akibat mutasi dan rekombinasi (Bowcock et al. 1994; Page dan Holmes 1998; Moxon dan Wills 1999). Polimorfisme ini sering dikenal sebagai simple sequence length polymorphism (SSLPs) (Avise 1994; Brown 1999) atau short tandem repeats polymorphism (STRPs) (Page dan Holmes 1998).
15 atau penambahan jumlah motif atau unit runutan mikrosatelit tersebut. Hal ini menimbulkan polimorfisme alelik mikrosatelit (Li dan Graur 1991; Li 1997; Page dan Holmes, 1998). Penambahan motif timbul jika gelung terjadi pada runutan (utas) baru, dan pengurangan motif terjadi jika gelung terdapat pada runutan lama, template (Moxon dan Wills 1999).
Mikrosatelit telah digunakan secara luas sebagai penanda dalam dunia genetika molekuler. Beberapa karakter mikrosatelit, seperti memiliki variabilitas yang tinggi, kemudahan untuk membedakan genotipe melalui ukuran jumlah motif, dan mudah didekati melalui teknik PCR, menjadikan mikrosatelit sebagai penanda molekul yang baik untuk mempelajari struktur genetik suatu populasi (Bowcock et al. 1994; Cooper et al. 1997; Dominggo-Roura et al. 1997; Simonsen et al. 1998; Viard et at. 1998; Witte dan Rogers 1999; Warren et al. 2000; Wandia 2003; Perwitasari-Farajallah 2004; Wandia et al. 2004). Selain itu, mikrosatelit dapat digunakan dalam paternity test (Ely et al. 1991; Pepin et al.
1995; Nair et al. 2000; Newman et al. 1999; Smith et al. 2000), pemetaan dan analisis keterpautan gen (Hearne et al. 1992; Krawczak dan Schmidtke 1994; Muladno 2000), penanganan kasus forensik, dan identifikasi suatu penyakit (Krawczak dan Schmidtke 1994; Page dan Holmes 1998). Dengan analisis keterpautan mikrosatelit pada suatu gen tertentu, mikrosatelit dapat digunakan sebagai penanda molekul untuk menyeleksi lokus yang membawa sifat atau karakter kuantitatif (quantitative trait loci) (Muladno 2000).
Amplifikasi Fragmen DNA
Teknik Polymerase Chain Reaction (PCR) sangat memudahkan dalam penggandaan, pendeteksian, dan pemanipulasian klon fragmen DNA dari berbagai sumber. Teknik PCR hanya membutuhkan konsentrasi DNA (template) yang sangat sedikit dan dapat mengamplifikasi DNA target secara eksponensial. Teknik ini menjadi semakin berkembang dan menggeser penggunaan kloning dalam ilmu Biologi Molekuler (Innis et al. 1990).
16 primer ke template DNA yang sesuai. Penempelan dilakukan pada suhu ± 55oC;
dan 3) Tahap elongasi. Tahap ini dilakukan pada suhu ± 72oC, di mana Tag DNA Polymerase melakukan aktivitas polimerisasi unit DNA dengan arah 5’ ke 3’ yang komplementer dengan runutan DNA template yang diapit oleh satu set primer. Fragmen DNA hasil polimerisasi ini selanjutnya menjadi template untuk siklus berikutnya sehingga produk akhir fragmen DNA sangat banyak (peningkatan secara eksponensial). Siklus PCR biasanya dilakukan sebanyak 30 kali dan ditambah satu siklus setelah siklus ketiga puluh dengan waktu elongasi yang lebih panjang (5 menit). Waktu elongasi lebih panjang memberi kesempatan untuk fragmen DNA teramplifikasi secara keseluruhan (Erlich 1989; Newton dan Graham 1994; Becker et al. 1996).
Efisiensi PCR sangat dipengaruhi oleh konsentrasi berbagai komponen. Komponen yang terlibat yaitu Tag DNA Polymerase, dNTP (deoksinuklosida trifosfat), ion Mg, template DNA, dan primer. Selain itu, suhu dan lama waktu untuk masing-masing tahap dalam setiap siklus PCR akan mempengaruhi kualitas dan spesifisitas produk PCR (Innis et al. 1990; Davis et al. 1994; Becker et al. 1996).
Keragaman Genetik
Menggambarkan besarnya keragaman genetik dalam populasi dan mempelajari mekanisme untuk mempertahankan keragaman merupakan salah satu aspek utama genetika populasi. Keragaman genetik suatu populasi dapat didekati pada berbagai jenjang, seperti keragaman alel pada protein (lokus struktural) (Kawamoto dan Ischak 1981; Kawamoto et al. 1982, 1985; Nozawa et al. 1982; Kawamoto dan Suryobroto 1985; Takenaka et al. 1985a, 1985b; Perwitasari-Farajallah et al. 1999), folimorfisme situs pemotongan DNA oleh enzim (Restriction Fragment Length Polymorphism) (Hoelzer et al. 1992; Suzuki et al. 1994; Harihara et al. 1996; Perwitasari Farajallah et al. 1999; Yoshimi dan Takasaki 2003), polimorfisme runutan DNA (Hayashi et al. 1995; Comas et al,
1996; Hiendleder et al. 1998; Kim et al, 1998), keragaman alel pada jumlah
17
DNA (RAPD) (Ayliffe et al. 1994; Kimberling et al. 1996; Neveu et al. 1996, 1998), dan polimorfisme mikrosatelit (Cooper et al. 1997; Brunner et al. 1998; Simonsen et al. 1998; Viard et al. 1998; Ciofi dan Bruford 1999; McCracken et al. 1999; Muladno 2000; Wirth 2000; Perwitasari-Farajallah 2004; Wandia et al. 2004).
Penggunaan mikrosatelit sebagai penanda molekul semakin meningkat akhir-akhir ini. Melalui PCR, polimorfisme mikrosatelit cukup mudah untuk didekati. Kenyataan ini membawa penanda molekul ini semakin banyak digunakan dalam dunia genetika populasi. Variasi alelik mikrosatelit dapat dihitung melalui pemisahan produk PCR secara elektroforesis. Genotipe individu (homosigot (satu pita) dan heterosigot (dua pita) pada organisme diploid) dengan mudah dapat ditentukan dan frekuensi alel dalam populasi dapat dihitung setelah pita dimunculkan dengan suatu pewarnaan (Lessa dan Apllebaum 1993; Krawczak dan Schmidtke 1994; Bonhomme et al. 2005; Rogers et al. 2005; Kanthaswamy et al. 2006).
Keragaman genetik populasi bukan saja menggambarkan kondisi populasi masa kini, tetapi juga mencerminkan masa lalu yang dilaluinya. Struktur populasi, kisah pemisahan populasi, diferensiasi genetik, dan rekonstruksi filogenetik adalah parameter yang dapat diungkapkan dengan data keragaman genetik suatu populasi. Selain itu, variabilitas genetik juga dapat digunakan sebagai dasar untuk mengungkapkan sebagian proses spesiasi secara molekuler pada suatu spesies (Melnick dan Hoelzer 1993; Nozawa et al. 1996).
Keragaman genetik suatu populasi dapat memberi petunjuk mengenai keadaan populasi di masa mendatang. Keragaman genetik rendah akan membahayakan kelestarian suatu spesies atau populasi karena timbulnya populasi yang homosigot. Keragaman genetik dipengaruhi oleh ukuran populasi efektif, mutasi (penyisipan, pelesapan, dan penggantian nukleotida), migrasi (aliran genetik), kawin dalam (inbreeding), hanyutan genetik (genetic drift), dan efek
MATERI DAN METODE PENELITIAN
Pendekatan Populasi
Waktu dan Lokasi Penelitian
[image:35.612.116.501.422.556.2]Penelitian lapangan dilakukan pada bulan Februari sampai dengan Mei tahun 2005. Survei dan koleksi data populasi dilakukan pada dua populasi lokal monyet ekor panjang di Kawasan Jawa Timur yaitu Pura Giri Sloka Alas Purwo (PgsAP) dan Bama Baluran (BmBL); enam populasi lokal di Pulau Bali yaitu Pura Pulaki (PrPL), Alas Kedaton (AK), Pura Uluwatu (PrUW), Sangeh (SG), Wanara Wana Ubud (WwUB), dan Pura Bukit Gumang (PrBG); serta dua populasi lokal di Pulau Lombok yaitu Gunung Pusuk (PS) dan Pura Gunung Pensong (PrGP) (Gambar 2). Alasan utama pemilihan populasi lokal tersebut adalah anggota populasi sudah terhabituasi dengan baik sehingga peluang ditangkap cukup besar untuk keperluan pencuplikan darah. Selain itu, pencuplikan dilakukan pada populasi lokal antar pulau yang berdekatan untuk melihat pola penyebaran keragaman genetik dari barat ke timur (Gambar 2).
Gambar 2 Populasi lokal monyet ekor panjang yang diteliti untuk struktur populasi dan fenotipe kualitatif. ?: lokasi populasi lokal.
Koleksi dan Analisis Data
20 monyet di sekitar lingkungan mereka, pengamatannya terhadap keberadaan monyet di dalam habitat, pengetahuannya mengenai pemberian pakan tambahan dan penangkapan monyet.
21
Pendekatan Morfologi Eksternal (Fenotipe Kualitatif)
Waktu dan Lokasi Penelitian
Penelitian di lapangan dilakukan pada bulan Februari sampai dengan Mei 2005, bersamaan dengan pengambilan data populasi dan pencuplikan darah. Pengamatan fenotipe kualitatif monyet ekor panjang dilakukan pada populasi lokal yang sama dengan yang disurvei untuk data populasi. Populasi lokal tersebut adalah PgsAP dan BmBL di Kawasan Jawa Timur; PrPL, AK, PrUW, SG, WwUB, dan PrBG di Pulau Bali; PS dan PrGP di Pulau Lombok (Gambar 2).
Alat dan Bahan
Peralatan yang digunakan untuk pengambilan data fenotipe kualitatif antara lain dengan teropong binokuler, kamera, kertas dan alat tulis.
Koleksi dan Analisis Data Fenotipe
22 pengamatan difokuskan pada posisi (di kanan, di tengah, atau di kiri garis median kepala) dan kecondongannya (ke kiri, tegak, atau ke kanan). Sementara, untuk kelas fenotipe pusaran kepala, pengamatan ditujukan pada posisi (di kanan, di depan, atau di kiri jambulkepala) dan arah pusarannya (searah putaran jarum jam atau berlawanan arah jarum jam). Data fenotipe kualitatif yang berasal dari monyet jantan dan betina dewasa digabung dan dianalisis menggunakan software
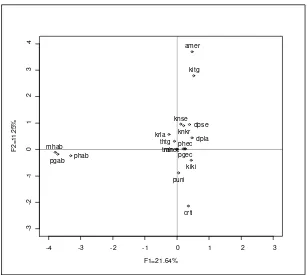
[image:39.612.103.510.349.591.2]R version 2.3.1 serta ditampilkan secara deskriptif. Analisis korespondensi berganda terhadap profil karakter fenotipe dilakukan untuk melihat perbedaan antar populasi lokal dan jenis kelamin. Analisis korespondensi berganda menggunakan program CORAN (Lebart et al. 1984) dan pemetaan koordinat pada bidang dua dimensi menggunakan software R version 2.3.1.
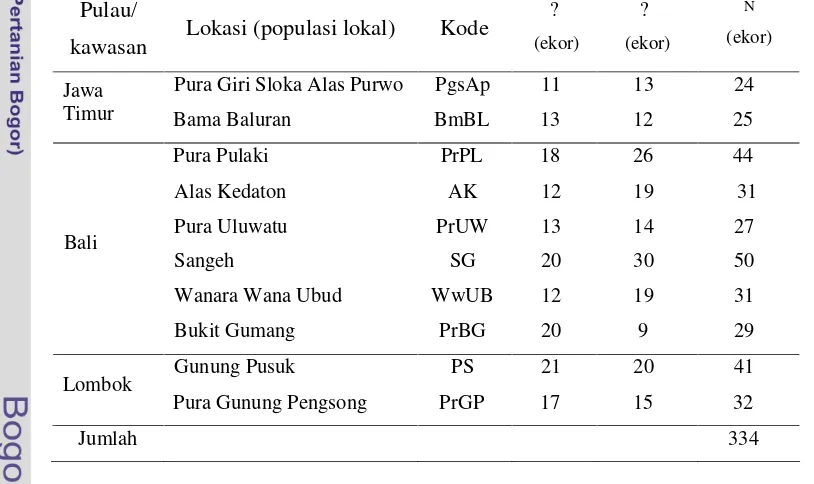
Tabel 1 Jumlah monyet ekor panjang dewasa yang diamati untuk data fenotipe kualitatif di masing-masing populasi lokal
Pulau/
kawasan Lokasi (populasi lokal) Kode
?
(ekor) ?
(ekor)
N
(ekor)
Pura Giri Sloka Alas Purwo PgsAp 11 13 24 Jawa
Timur Bama Baluran BmBL 13 12 25
Pura Pulaki PrPL 18 26 44
Alas Kedaton AK 12 19 31
Pura Uluwatu PrUW 13 14 27
Sangeh SG 20 30 50
Wanara Wana Ubud WwUB 12 19 31 Bali
Bukit Gumang PrBG 20 9 29
Gunung Pusuk PS 21 20 41 Lombok
Pura Gunung Pengsong PrGP 17 15 32
Jumlah 334
23
Pendekatan Genetik (Mikrosatelit)
Waktu dan Lokasi Penelitian
Sejumlah 159 contoh darah monyet ekor panjang dari sepuluh populasi lokal berhasil dikoleksi. Pencuplikan contoh darah monyet ekor panjang dilaksanakan pada bulan Februari sampai dengan Mei 2005 bersamaan dengan pengambilan data populasi dan fenotipe kualitatif, kecuali pada lima populasi lokal di Pulau Bali, pencuplikannya dilakukan pada tahun 2000 dan telah tersedia dalam bentuk DNA (Tabel 2 dan Gambar 3). Analisis genetik dilakukan di Laboratorium Zoologi, Jurusan Biologi, FMIPA IPB, Gunung Gede pada bulan Juli 2005 sampai dengan Mei 2006.
Tabel 2 Jumlah contoh darah monyet ekor panjang pada masing-masing populasi lokasi
Pulau Lokasi (populasi lokal) Kode Jumlah (ekor) Pura Giri Sloka Alas Purwo PgsAp 15 Jawa Timur
Bama Baluran BmBL 14 Pura Pulaki PrPL 13 * Alas Kedaton AK 17 * Pura Uluwatu PrUW 16 *
Sangeh SG 18 *
Wanara Wana Ubud WwUB 13 * Bali
Bukit Gumang PrBG 20 Gunung Pusuk PS 17 Lombok
Pura Gunung Pengsong PrGP 16
Jumlah 159
Keterangan: * pencuplikan tahun 2000 dan telah tersimpan dalam bentuk DNA
24 Penyertaan contoh DNA tahun 2000 untuk analisis genetik pada penelitan saat ini tidak akan mengurangi kebermaknaan dari hasil penelitian. Frekuensi suatu alel berfluktuasi dari generasi ke generasi. Namun, perubahan frekuensi alel (alel netral) karena mutasi atau pengaruh faktor peluang dalam satu generasi sangat rendah (Li 1991; Perwitasari-Farajallah 1998). Frekuensi alel yang ditemukan dari contoh DNA populasi monyet tahun 2000 tidak akan berbeda secara nyata jika dibandingkan dengan hasil pencuplikan contoh pada populasi yang sama tahun 2005 (satu generasi monyet ekor panjang 5-7 tahun).
Alat dan Bahan
Peralatan yang digunakan pada penelitian antara lain alat suntik 10 ml, seperangkat alat tulup, tabung Eppendorf, pipet mikro, pipet Pasteur, alat pemusing, tabung mikro, tip, rak tabung mikro, boks es, seperangkat alat PCR, seperangkat alat elektroforesis, seperangkat alat visualisasi, seperangkat alat pewarnaan, dan timbangan elektrik.
Bahan yang digunakan antara lain kapas, alkohol 70%, Ketamin HCl, EDTA 10%, lysis buffer (NaCl 0,2%, EDTA 1 mM), bufer pencuci (NaCl 0,9%, EDTA 1mM), larutan 1x STE, larutan SDS 10%, larutan NaCl 10 M, urealysis buffer, proteinase K, RNAse, membran dialisis (VISKING® Seamless cellulose tubing), fenol, kloroform isoamilalkohol, bahan untuk PCR, bahan untuk pembuatan gel agarose dan poliakrilamid, bahan untuk elektroforesis, bahan untuk pemuatan contoh, dan bahan untuk pewarnaan.
Primer Mikrosatelit
25 nukleotida sehingga alelnya mudah dibedakan dengan cara elektroforesis, tetapi juga amplifikasinya melalui PCR sangat konsisten. Selain itu, lokus tersebut menunjukkan polimorfisme pada berbagai penelitian yang telah dilakukan terutama pada monyet Rhesus.
Pengambilan Contoh Darah Monyet Ekor Panjang
Monyet dibius dengan Ketamin HCl (dosis 10 mg/kg bobot badan) dengan cara ditulup. Sebanyak 5-10 ml darah diambil dari vena femoralis dengan menggunakan alat suntik 10 ml yang telah diisi EDTA 10% 0,1-0,4 ml sebagai antikoagulan. Darah dipisahkan menjadi tiga bagian yaitu plasma darah, buffy coat (mengandung sel darah putih), dan sel darah merah dengan pemusingan 3500 rpm (maksimum 1500 g) selama 15 menit. Untuk pencuplikan tahun 2000,
buffy coat disimpan pada 0o sampai 4o C sebelum diproses lebih lanjut, atau disimpan di dalam alat pembeku (freezer) untuk diproses selanjutnya di lain waktu. Sebaliknya, untuk pencuplikan tahun 2005, buffy coat langsung dituangkan ke dalam tabung yang telah berisi larutan urea lysis buffer.
Ekstraksi dan Purifikasi DNA Total
Ekstraksi dan purifikasi DNA total untuk buffy coat tahun 2000 menggunakan metode Kan et al. (1977) dalam Perwitasari-Farajallah (1998). Ekstraksi menggunakan fenol-kloroform dan purifikasi dengan membran dialisis. Membran dialisis disiapkan dengan cara seperti yang diterangkan dalam Sambrook et al. (1989).
26 1000 g) selama 10-15 menit. Selanjutnya, supernatan dibuang lalu ditambahkan bufer pencuci (NaCl 0,9%, EDTA 1mM) 10 ml. Dipusingkan pada 3000 rpm (maksimum 1000 g) selama 10 menit. Supernatan dibuang setelah pemusingan selesai. Dimasukkan ke dalamnya larutan 1x STE 2 ml, dikocok perlahan sampai tercampur, lalu ditambahkan Proteinase K (10 mg/ml) 30 l dan SDS 10% 0,5 ml. Diinkubasi pada suhu 55oC sambil diputar pelan selama dua jam atau sampai suspensi homogen. Selesai diinkubasi, dituangkan ke dalamnya larutan NaCl 5 M sebanyak 1/10x volume, fenol 0,5-1,0x volume dan larutan kloroform isoamil alkohol (CIAA) 0,5-1,0x volume, kemudian diputar pelan dalam suhu ruang selama 75-120 menit. Setelah itu, pemusingan 3000 rpm (maksimum 1000 g) dilakukan selama 20 menit. Fase air (lapis atas) dipindahkan ke kantong dialisis dengan pipet Pasteur. Setiap kantong dialisis diberi nomor dengan klip plastik. Dialisis dilakukan dalam dua liter larutan 1x TE 4o C selama minimal lima jam atau semalam sambil dikocok pelan. Selanjutnya, sol DNA dari kantong dialisis dipindahkan ke tabung Falcon. Ditambahkan RNase 30 l, dan dikocok pelan beberapa kali. Diinkubasi pada suhu 37oC selama 30 menit dalam
waterbath. Setelahnya, ditambahkan larutan 5 M NaCl 1/10x volume dan Proteinase K 30 l. Diinkubasi pada 55oC selama dua jam sambil diputar perlahan. Selesai inkubasi, ditambahkan fenol dan CIAA masing-masing 0,5 kali volume. Diputar pelan pada suhu ruang selama 75-120 menit. Kemudian, dipusingkan pada 3000 rpm (maksimum 1000 g) selama 15 menit. Fase air (lapis atas) dipindahkan ke kantong dialisis dan didialisis dalam dua liter larutan 1xTE 4oC selama minimal lima jam atau semalam. Selanjutnya, sol DNA dari kantong dialisis dipindahkan ke botol penyimpan DNA dan diisi dengan dua tetes CIAA. Botol penyimpan DNA diberi label dan disimpan pada suhu 4oC.
27 pada suhu kamar selama dua jam. Selesai pemutaran, tabung dipusingkan 3500 rpm (maksimum 1500 g) selama 15 menit. Fase air (lapis atas) dipindahkan ke kantong dialisis dengan pipet Pasteur. Dialisis dilakukan dalam dua liter larutan 1x TE 4o C semalam sambil dikocok pelan. Selanjutnya, sol DNA dari kantong dialisis dipindahkan ke botol penyimpan DNA yang sebelumnya telah dilabel. Dua tetes CIAA ditambahkan ke dalam sol DNA dan disimpan pada suhu 4oC.
Hasil purifikasi dilihat dengan cara elektroforesis pada gel agarose 0,5% volume 80 ml dalam larutan 1xTAE (Tris Acetat EDTA, pH 8,0). Fragmen dimunculkan dengan pewarna etidium bromida setelah dimigrasikan selama 35 menit dengan voltase 50 V. Penanda yang digunakan adalah DNA ? HindIII untuk mengetahui adanya fragmen DNA dengan berat molekul tinggi (high molecular weight DNA). Fragmen DNA yang terwarnai divisualisasikan pada foto dengan kamera Polaroid di bawah sinar ultraviolet.
Amplifikasi Lokus Mikrosatelit
Mikrosatelit diamplifikasi melalui Polymerase Chain Reaction (PCR). Setiap unit reaksi PCR mengandung 1x bufer PCR; 3 mM MgCl2; masing-masing
0,16 mM dNTP; masing-masing 0,48 mM sepasang primer; dan sebanyak 0,25 U Taq DNA Polimerase. Setiap reaksi PCR dibuat dengan volume 12,5 l dengan komposisi 10x buffer A 1,25 l (Fisher Scientific), MgCl2 25 mM 0,75 l
(Promega), dNTP 10 mM mix 0,2 l, primer Reverse dan Forward 20 mM masing-masing 0,3 l, Taq DNA Polymerase 5 U/ l (Fisher Scientific) 0,05 l,
template DNA 2 l, dan air deionase 7,65 l. Urutan pencampuran dilakukan secara bebas, kecuali Taq DNA Polimerase dicampur untuk yang terakhir. Campuran divorteks dan dipusingkan sebentar (Hillis et al. 1996).
Amplifikasi menggunakan mesin TaKaRa PCR Thermal Cycler MP. Kondisi PCR untuk masing-masing primer mikrosatelit sebagai berikut. Pra PCR: denaturasi 94 oC selama lima menit; PCR: denaturasi 94 oC 45 detik, annealing
28 selama satu menit, dan elongasi 72 oC selama satu menit; dan post PCR: elongasi 72 oC selama lima menit. PCR dilakukan sebanyak 30 siklus.
Variasi alel mikrosatelit dipisahkan secara elektroforesis pada gel poliakrilamid 7% dalam larutan 1x penyangga TBE (Tris Borak EDTA, pH 8.0) dengan voltase 160 V selama 120 menit. Sejumlah 1µl produk PCR dicampur dengan 0,2 µl penyangga pemuat (5x dye), selanjutnya dimasukkan ke dalam sumur gel poliakrilamid yang telah disiapkan. Pita dimunculkan dengan pewarnaan perak dan panjang basa diukur dengan membandingkan terhadap penanda standard 100 bp DNA ladder (Gibco BRL, Life Technologies).
Peubah Genetika Populasi
Pita yang muncul pada gel poliakrilamid adalah suatu alel mikrosatelit. Keragaman alel mikrosatelit dapat dilihat dari beda jarak migrasi alel pada gel (Lessa dan Applebaum 1993; Krawczak dan Schmidtke 1994). Genotipe ditentukan berdasarkan variasi pita alel. Genotipe untuk monyet jantan dan betina tidak dibedakan karena penanda molekul yang digunakan terletak pada kromosom somatik sehingga variasi pasangan alel sama-sama berasal dari kedua induk secara acak. Selanjutnya, frekuensi masing-masing alel setiap lokus mikrosatelit di masing-masing populasi lokal dihitung dengan menggunakan rumus Nei (1987).
Peubah genetika populasi yang akan dihitung meliputi keragaman genetik, Keseimbangan Hardy-Weinberg untuk mengetahui pola kawin acak dalam populasi lokal , diferensiasi genetik populasi lokal dalam dan antar pulau, aliran genetik (gene flow), dan jarak genetik antar populasi lokal.
Analisis Data Mikrosatelit
29 Untuk menganalisis Keseimbangan Hardy-Weinberg dalam populasi lokal monyet ekor panjang, digunakan indeks fiksasi (FIT). Di bawah asumsi tidak
terjadi seleksi terhadap alel kodominan, penyimpangan nilai FIT dari nol (tidak
terjadi inbreeding) diuji dengan uji ?2 dengan derajat bebas satu (Nei 1987). Diferensiasi genetik antar populasi lokal dihitung dengan menggunakan penduga FST atau GST (Nei 1987; Nei dan Kumar 2000). Dalam hal ini,
keragaman genetik total (HT) dipilah menjadi dua komponen yaitu keragaman
genetik dalam (HS) dan antar populasi lokal (DST). Diferensiasi genetik mengukur
besarnya defisit keragaman genetik populasi lokal relatif terhadap heterosigositas genetik total.
Aliran genetik dihitung dengan menggunakan model pulau (Avise 1994). Pada model ini, setiap kelompok akan menerima imigran dengan laju m secara random dari sebuah populasi yang anggotanya besar. Aliran genetik diekspresikan dengan jumlah efektif migran setiap generasi (Nem).
Jarak genetik antar populasi lokal dihitung menggunakan jarak genetik standar Nei (Ds) (Takezaki dan Nei 1996)di bawah asumsi infinite allele model. Jarak genetik tersebut dijadikan dasar untuk membuat dendogram dengan metode
unweighted pair-group method with arithmetic average (UPGMA). Jarak genetik standar Nei (DS) dan dendogram dibuat dengan menggunakan program Phylip
HASIL DAN PEMBAHASAN
Struktur Populasi Lokal Monyet Ekor Panjang di Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok
Hasil Penelitian
Kelompok Sosial dan Komposisi Umur Anggota Populasi Lokal
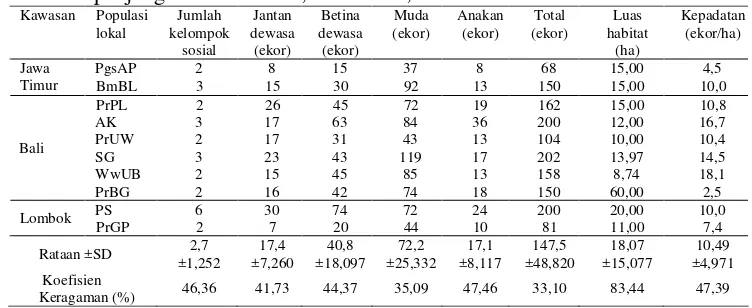
[image:47.612.130.506.377.531.2]Sensus terhadap sepuluh populasi lokal monyet ekor panjang yang berada di Kawasan Jawa Timur, Pulau Bali, dan Pulau Lombok menunjukkan jumlah kelompok sosial yang menyusun populasi lokal cukup beragam (koefisien keragaman 46,36%), meskipun sebagian besar populasi lokal tersusun atas dua kelompok sosial. Hal serupa, jumlah monyet jantan dewasa, betina dewasa, muda, dan anakan di masing-masing populasi lokal bervariasi dengan koefisien keragaman berturut-turut 41,73, 44,37, 35,09, dan 47,46% (Tabel 3).
Tabel 3 Struktur populasi, luas habitat, dan kepadatan populasi lokal monyet ekor panjang di Jawa Timur, Pulau Bali, dan Pulau Lombok
Kawasan Populasi lokal Jumlah kelompok sosial Jantan dewasa (ekor) Betina dewasa (ekor) Muda (ekor) Anakan (ekor) Total (ekor) Luas habitat (ha) Kepadatan (ekor/ha)
PgsAP 2 8 15 37 8 68 15,00 4,5
Jawa
Timur BmBL 3 15 30 92 13 150 15,00 10,0
PrPL 2 26 45 72 19 162 15,00 10,8
AK 3 17 63 84 36 200 12,00 16,7
PrUW 2 17 31 43 13 104 10,00 10,4
SG 3 23 43 119 17 202 13,97 14,5
WwUB 2 15 45 85 13 158 8,74 18,1
Bali
PrBG 2 16 42 74 18 150 60,00 2,5
PS 6 30 74 72 24 200 20,00 10,0
Lombok
PrGP 2 7 20 44 10 81 11,00 7,4
Rataan ±SD 2,7 ±1,252 17,4 ±7,260 40,8 ±18,097 72,2 ±25,332 17,1 ±8,117 147,5 ±48,820 18,07 ±15,077 10,49 ±4,971 Koefisien
Keragaman (%) 46,36 41,73 44,37 35,09 47,46 33,10 83,44 47,39
31
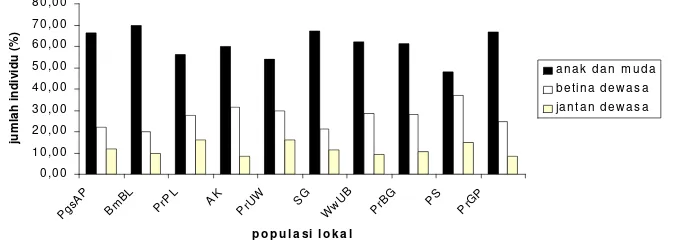
Penggabungan jumlah monyet anakan dan muda dilakukan untuk melihat gambaran kenormalan komposisi umur populasi di masing-masing populasi lokal (Gambar 5). Penggabungan tersebut menghasilkan pola kurva yang sama di setiap populasi lokal. Jumlah gabungan monyet anakan dan muda menempati proporsi yang paling tinggi (48-70%, rataan 61,15%) dususl oleh monyet betina dewasa dan selanjutnya monyet jantan dewasa.
0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00
PgsAP BmBL PrPL AK PrUW SG WwUB PrBG PS PrGP
Populasi lokal ju m la h in d iv id u (% ) anak muda betina dewasa jantan dewasa
Gambar 4 Komposisi monyet anak, muda, dan dewasa di masing-masing populasi lokal monyet ekor panjang. Monyet muda mendominasi di seluruh populasi lokal, kecuali pada PS, frekuensinya relatif sama dengan monyet betina dewasa. Monyet betina dewasa ditemukan dengan proporsi tertiggi kedua setelah mony