TUMINEM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Nematoda Puru Akar pada Ubi jalar (Ipomoea batatas L.) dan Potensi Bakteri Probiotik Tanaman sebagai Agens Biokontrol : Studi Kasus di Papua Barat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Potensi Bakteri Probiotik Tanaman sebagai Agens Biokontrol : Studi Kasus di Papua Barat. Dibimbing oleh SUPRAMANA, MEITY SURADJI SINAGA dan GIYANTO.
Ubi jalar merupakan salah satu komoditas unggulan di Provinsi Papua Barat. Komoditas ini menjadi makanan pokok bagi sebagian besar penduduk asli Papua Barat. Survei awal yang dilakukan antara April-September 2014 mengamati penurunan kualitas dan kuantitas ubi jalar. Berdasarkan gejala di lapangan, penurunan kualitas hasil disebabkan oleh infeksi nematoda puru akar. Nematoda puru akar (Meloidogyne spp.) dikenal sebagai patogen tanaman penting termasuk ubi jalar. Nematoda puru akar pada ubi jalar belum dilaporkan di Indonesia, khususnya Papua dan Papua Barat. Oleh karena itu, penelitian tentang nematoda puru akar yang berasosiasi dengan ubi jalar penting untuk pengelolaan penyakit ini dengan benar di lapangan.
Identifikasi nematoda yang tidak tepat menyebabkan metode pengendalian yang tidak sesuai misalnya aplikasi pestisida sintetis. Pendekatan yang berbeda dalam pengelolaan nematoda puru akar telah dikembangkan di lapangan untuk memfasilitasi penggunaan berbagai mikroorganisme sebagai agens biokontrol yang ramah lingkungan. Bakteri probiotik memiliki potensi yang menjanjikan sebagai agens biokontrol yang dapat dikembangkan. Penelitian lebih lanjut termasuk eksplorasi dan pengujian karakteristik fisiologi bakteri probiotik diperlukan untuk menentukan mekanisme bakteri probiotik mengendalikan nematoda puru akar. Penelitian ini bertujuan untuk mengindentifikasi nematoda puru akar pada ubi jalar di Papua Barat, mendapatkan bakteri probiotik dari ubi jalar yang memiliki potensi tinggi sebagai agens biokontrol dan menganalisis mekanisme pengendalian bakteri probiotik terhadap nematoda puru akar.
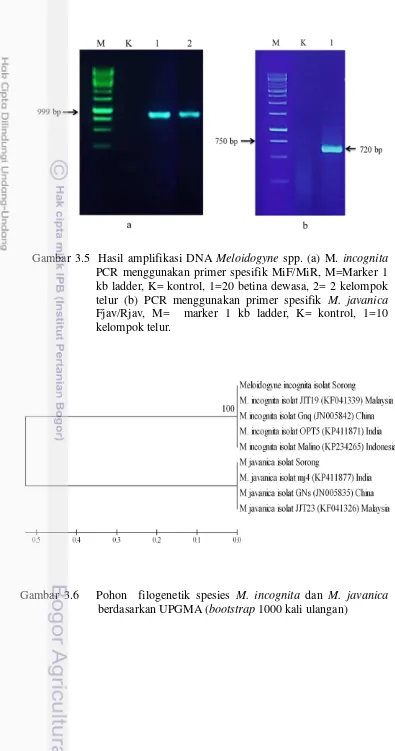
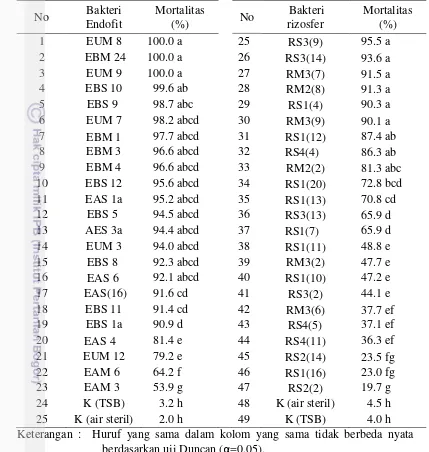
Tanaman terinfeksi nematoda puru akar menunjukkan berbagai gejala antara lain ubi tidak sepenuhnya berkembang atau berubah menjadi akar yang keras, dan tumbuh akar di permukaan ubi. Pembedahan akar dan teknik pewarnaan dengan asam fuchsin ditemukan betina dewasa dan kelompok telur Meloidogyne spp. di dalam akar terinfeksi. Identifikasi morfologi berdasarkan karakteristik pola perineal betina ditemukan dua spesies Meloidogyne yaitu M. incognita dan M. javanica. Analisis molekuler menggunakan primer spesifik M. incognita dan M. javanica menunjukkan bahwa Meloidogyne asal Papua Barat memiliki homologi yang tinggi dengan spesies serupa dari Malino (Indonesia), India, Malaysia dan Cina.
untuk membunuh nematoda dievaluasi berdasarkan kemampuan menghasilkan hidrogen sianida (HCN) serta enzim lipase, kitinase, dan protease. Tidak ada isolat bakteri yang menghasilkan HCN, 22 isolat menghasilkan lipase, 21 isolat menghasilkan protease, dan 3 isolat menghasilkan kitinase. Karakterisasi fisiologi selanjutnya untuk mengevaluasi potensi bakteri dalam memacu pertumbuhan tanaman, termasuk kemampuan untuk menfiksasi nitrogen, menghasilkan hormon pertumbuhan IAA dan melarutkan fosfat. Semua isolat bakteri mampu menfiksasi nitrogen dan menghasilkan IAA dan 19 isolat dapat melarutkan fosfat.
Identifikasi molekuler terhadap 25 isolat bakteri menggunakan primer universal 63-F/1387-R diperoleh bakteri jenis Bacillus subtilis, Enterobacter sp, Enterobacter ludwigii, Enterobacter cloaceae, Pseudomonas putida, Agrobacterium larrymorei, Pseudomonas plecoglossicida, P. monteilii, Burkholderia cepacia, Microbacterium testaceum, Curtobacterium sp., Agrobacterium tumefaciens, Bacillus aryabhattai, Acinetobacter sp., dan Bacillus barbaricus.
Mekanisme pengendalian bakteri probiotik ubi jalar terhadap nematoda puru akar dievaluasi berdasarkan kemampuan menghambat penetasan telur, pembentukan puru akar, reproduksi nematoda dan potensi induksi ketahanan sistemik. Bakteri Enterobacter sp. EBS(10) dan Burkholderia cepacia EAS(6) efektif menghambat penetasan telur, mendegradasi dinding sel telur, mengganggu permeabilitas dan embriogenesis telur Meloidogyne sp. Bakteri berikutnya yaitu Enterobacter sp. EAS(1a), Enterobacter sp. EAS(3a), Pseudomonas plecoglossicida RS4(4), P. putida RS3(14), E. ludwigii RM3(7), Enterobacter sp. RS1(12), Bacillus aryabatthai EUM(3) dan Curtobacterium sp. EBS(12) memiliki kemampuan menghambat pembentukan puru. Modifikasi metode split root system pada ubi jalar menunjukkan Curtobacterium sp. EBS(12), Enterobacter sp. EBS(10), Agrobacterium larrymoorei EBS(9), Enterobacter sp. EAS(3a), Enterobacter cloaceae EBM(24), Pseudomonas monteilii RM2(2), P. plecoglossicida RS4(4), Bacillus subtilis RS1(4) dan Enterobacter ludwigii RM3(7), dapat menginduksi ketahanan ubi jalar terhadap nematoda puru akar. Aplikasi 13 isolat bakteri dapat menurunkan reproduksi nematoda ( Pi/Pf 0.4 sampai 0.89) serta mengurangi populasi nematoda di dalam tanah.
Informasi tentang identitas yang pasti, karakteristik fisiologi, dan mekanisme pengendalian bakteri probiotik terhadap nematoda berguna sebagai pembuktian ilmiah untuk pengembangan strategi pengendalian Meloidogyne sp. pada ubi jalar. Pemanfaatan bakteri probiotik diharapkan dapat meningkatkan produksi ubi jalar dan mengurangi penggunaan pestisida sintetis secara berlebihan.
Potency of Plant Probiotic Bacteria as Biocontrol Agents: A Case Study in West Papua. Supervised by SUPRAMANA, MEITY SURADJI SINAGA and GIYANTO.
Sweet potato is one of the leading commodities in West Papua Province. This commodity becomes the staple food for the majority of the native population of West Papua. Initial surveys that were conducted between April to September 2014 observed the decreasing quality and quantity of sweet potato tubers. Based on field symptoms, the declining yield quality might be caused by the root knot nematoda infection. The root knot nematoda (Meloidogyne spp.) is known as important plant pathogen including sweet potato. However, root knot nematoda on sweet potato has not been reported present in Indonesia, especially Papua and West Papua. Therefore, the research on root knot nematoda associated with sweet potato is important in order to manage these parasites properly in the field.
The incorrect identification leads to the improper control methods that relay on the synthetic pesticides application. Different approach in managing this nematoda in the field has been developed to facilitate the use of various microorganisms as control agent which is more friendly to environment. Plant probiotic bacteria offer a promising potential as biocontrol agent that can be developed. Further studies including exploration and physiological characteristic testing of the probiotic bacteria are needed to determine the mechanisms of this microorganism to control root knot nematodas. This study is aimed to identify the root knot nematodas on sweet potato in West Papua, obtain probiotic bacteria of sweet potato that have high potential as biocontrol agent and investigate the control mechanisms of probiotic bacteria against root knot nematodas.
The infected to plants showed various symptoms, such as tubers are not fully developed or turn into a hard roots, and formation of roots on tuber surface. Root dissection and acid fuchsin staining techniques found adult females and eggs mass of Meloidogyne spp. inside the infected roots. Morphological identification based on specific characteristics of female perineal pattern found two species of Meloidogyne, that were M. incognita and M. javanica. Molecular analysis using specific primers for M. incognita and M. javanica showed that West Papuans Meloidogyne have high homology levels with the similar species from Malino (Indonesia), India, Malaysia and China.
capacity of bacteria to kill nematoda was evaluated based on their ability to produce hydrogen cyanide (HCN) and enzymes including lipase, chitinase, and protease. There was no bacterial isolate produce HCN, 22 isolates produce lipase, 21 isolates produce protease and 3 isolates produce chitinase. Further physiological characterization was conducted to evaluate the potency of bacteria to promote plant growth, including their ability to fix Nitrogen, produce plant growth hormone IAA, and dissolve phosphate. All of the bacteria isolates were able to fix Nitrogen and produce IAA and 19 isolates were also able to dissolve phosphate.
Molecular identification of the 25 bacterial isolates was carried out using universal primer 63-F / 1387-R. The bacteria identified were: Bacillus subtilis, Enterobacter sp, Enterobacter ludwigii, Enterobacter cloaceae, Pseudomonas putida, Agrobacterium larrymorei, Pseudomonas plecoglossicida, P. monteilii, Burkholderia cepacia, Microbacterium testaceum, Curtobacterium sp., Agrobacterium tumefaciens, Bacillus aryabhattai, Acinetobacter sp., and Bacillus barbaricus.
Control mechanism of endophytic and rhizospheric bacteria against root knot nematoda of sweet potato was evaluated based on their ability to inhibit egg hatching, formation of root knot, nematoda reproduction and induction of systemic resistance. Enterobacter sp. EBS (10) and Burkholderia cepacia EAS (6) effectively inhibit the egg hatching, degrade the egg cell walls, disrupt the developing eggs of Meloidogyne spp. The following bacteria: Enterobacter sp. EAS (1a), Enterobacter sp. EAS (3a), Pseudomonas plecoglossicida RS4 (4), P. putida RS3 (14), E. ludwigii RM3 (7), Enterobacter sp. RS1 (12), Bacillus aryabatthai EUM (3) and Curtobacterium sp. EBS (12) were able to inhibit the formation of gall. Modified split root methods on sweet potato revealed that Curtobacterium sp. EBS (12), Enterobacter sp. EBS (10), Agrobacterium larrymoorei EBS (9), Enterobacter sp. EAS (3a), Enterobacter cloaceae EBM (24), P. monteilii RM2 (2), P. plecoglossicida RS4 (4), B. subtilis RS1 (4) and E. ludwigii RM3 (7), were able to induce systemic resistance to root knot nematodas. Application of these 13 bacterial isolates were able to reduce nematoda reproduction factors ( Pi / Pf) by 0.4 to 0.89 as well as reducing nematoda populations in the soil.
Information on the definite identity, physiological cahracteristic, and their control mechanism against nematoda of the probiotic bacteria are useful as a scientific justification for the development of control strategy for Meloidogyne spp. on sweetpotato. Utilization of probiotic bacteria is expected to increase the production of sweet potatoes and reduce the excessive use of synthetic pesticides.
©Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB
TUMINEM
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
Pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
Penguji Luar Komisi pada Ujian Tertutup : 1. Dr. Ir. Asep Setiawan, MS
(Departemen Agronomi dan Hortikultura, Fakultas Pertanian Institut Pertanian Bogor)
2. Dr. Ir. Kikin Hamzah Mutaqin, MSi
(Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor)
Penguji Luar Komisi pada Ujian Terbuka : 1. Dr. Ir. Asep Setiawan, MS
(Departemen Agronomi dan Hortikultura, Fakultas Pertanian Institut Pertanian Bogor)
2. Dr. Ir. Dwi Iswari M.Sc.P
(Direktur Perlindungan Tanaman Pangan, Direktorat Jenderal Tanaman Pangan, Kementrian Pertanian)
Segala puji bagi Allah yang telah melimpahkan kasih dan karunia-Nya kepada penulis sehingga penulis dapat menyelesaikan disertasi ini. Penelitian yang dilaksanakan sejak bulan Januari 2014 sampai Agustus 2015 ini memilih tema tentang nematoda puru akar pada ubijalar dan potensi bakteri probiotik tanaman sebagai agens biokontrol.
Penulis menyampaikan penghargaan dan ucapan terimakasih yang tak terhingga kepada Dr. Ir. Supramana MSi, Prof. Dr. Ir. Meity Suradji Sinaga MSc dan Dr. Ir. Giyanto MSi selaku komisi pembimbing, atas semua bimbingan, arahan, pengkayaan wawasan, saran dan dukungan moril yang diberikan dengan tulus hingga disertasi ini selesai.
Ucapan terimakasih juga disampaikan kepada Pemerintah Provinsi Papua Barat, Bidang Pengembangan Sumber Daya Manusia atas dukungan dana selama penulis menyelesaikan studi dan penelitian. Ucapan terimakasih disampaikan kepada Dinas Pertanian Tanaman Pangan dan Hortikultura, Balai Proteksi Tanaman Pangan dan Hortikultura Provinsi Papua Barat yang telah memberikan ijin, kepercayaan dan menugaskan penulis untuk mengikuti pendidikan Program Doktor di Program Studi Fitopatologi, Sekolah Pascasarjana, Institut Pertanian Bogor. Ucapan terimakasih disampaikan kepada Pimpinan dan staf Balai Uji Terap Teknik dan Metode Karantina Pertanian (BUTTMKP) Bekasi, Laboratorium Mikrobiologi dan Lingkungan Pusat Penelitian Bioteknologi dan Bioindustri Indonesia, Laboratorium Pengamatan Hama dan Penyakit (LPHP) BPTPH Papua Barat, dan Laboratorium Nematologi Departemen Proteksi Tanaman IPB yang telah memberikan sarana laboratorium selama penelitian. Ucapan terimakasih juga penulis sampaikan kepada Rektor IPB, Dekan Sekolah Pascasarjana IPB, Ketua Departemen Proteksi Tanaman beserta staf, Ketua Program Studi Fitopatologi, Ketua Program Studi Entomologi beserta seluruh jajarannya, staf pengajar Mayor Entomologi-Fitopatologi, staf administrasi pascasarjana, serta rekan-rekan angkatan 2011 atas dukungan dan kerjasama selama penulis menempuh pendidikan di Sekolah Pascasarjana IPB.
Ucapan terimakasih juga disampaikan kepada kedua orang tua ibu dan bapak tercinta, ibu mertua, suami, anak-anak, adik sekeluarga, adik dan kakak ipar serta seluruh keluarga besar atas segala doa, dukungan dan kasih sayangnya. Terimakasih juga disampaikan kepada teman-teman staf LPHP Papua Barat, THL POPT di Kabupaten Sorong, pimpinan dan staf Karantina Tumbuhan di Manokwari dan Sorong yang telah membantu kelancaran penelitian ini.
Akhir kata terimakasih yang tulus penulis sampaikan kepada semua pihak yang telah membantu selama penelitian dan penulisan disertasi ini. Semoga disertasi ini bermanfaat bagi perkembangan ilmu dan teknologi khususnya dalam upaya melengkapi komponen pengendalian nematoda secara terpadu.
Bogor, Januari 2016
DAFTAR TABEL Vi
DAFTAR GAMBAR Vii
DAFTAR LAMPIRAN Viii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
Hipotesis 4
Manfaat Penelitian 5
Kebaruan dan Keunggulan Penelitian 5
Ruang Lingkup Penelitian 5
2 TINJAUAN PUSTAKA 7
3 IDENTIFIKASI NEMATODA PARASIT YANG BERASOSIASI
DENGAN UBI JALAR (Ipomoea batatas L.) DI PROVINSI PAPUA
BARAT 23
Pendahuluan 23
Metode 24
Hasil 27
Pembahasan 35
Simpulan 42
4 ISOLASI, SELEKSI, KARAKTERISASI DAN IDENTIFIKASI
BAKTERI PROBIOTIK TANAMAN SEBAGAI BIOKONTROL
NEMATODA PURU AKAR 43
Pendahuluan 43
Metode 45
Hasil 50
Pembahasan 57
Simpulan 63
5 MEKANISME BAKTERI PROBIOTIK UBI JALAR
MENGENDALIKAN NEMATODA PURU AKAR 64
Pendahuluan 64
Metode 65
Hasil 67
Pembahasan 72
Simpulan 76
6 PEMBAHASAN UMUM 77
7 SIMPULAN UMUM 88
8 SARAN 89
DAFTAR PUSTAKA 90
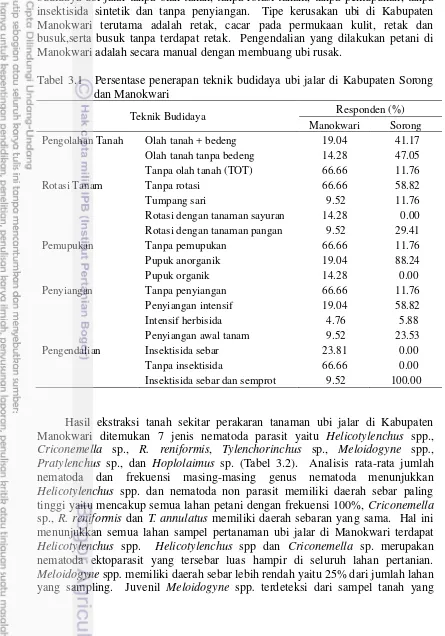
3.1 Persentase penerapan teknik budidaya ubi jalar di Kabupaten Sorong
dan Manokwari 28
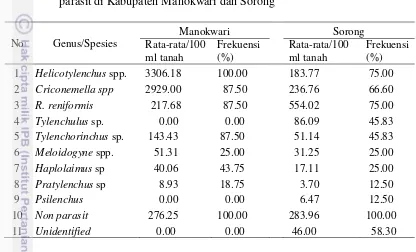
3.2 Rerata juvenil dari sampel tanah dan frekuensi penyebaran nematoda parasit di Kabupaten Manokwari dan Sorong 29
3.3 Rerata, frekuensi dan kelimpahan nematoda parasit dari akar dan ubi di Kabupaten Sorong 31
4.1 Bakteri probiotik ubi jalar dan uji patogenisitas 50
4.2 Pengaruh kultur filtrat bakteri probiotik ubi jalar terhadap mortalitas juvenil 2 Meloidogyne spp. 51
4.3 Morfologi koloni bakteri probiotik ubi jalar dan pewarnaan Gram 52
4.4 Karakter fisiologi dan produksi hormon pertumbuhan bakteri 54
4.5 Homologi bakteri probiotik ubi jalar dengan data Base NCBI 56
5.1 Persentase penghambatan penetasan telur, populasi juvenil dan jumlah puru Meloidogyne spp. pada aplikasi bakteri probiotik ubi jalar 68
5.2 Hasil analisis uji T potensi bakteri probiotik menginduksi ketahanan ubi jalar terhadap Meloidogyne spp.. 69
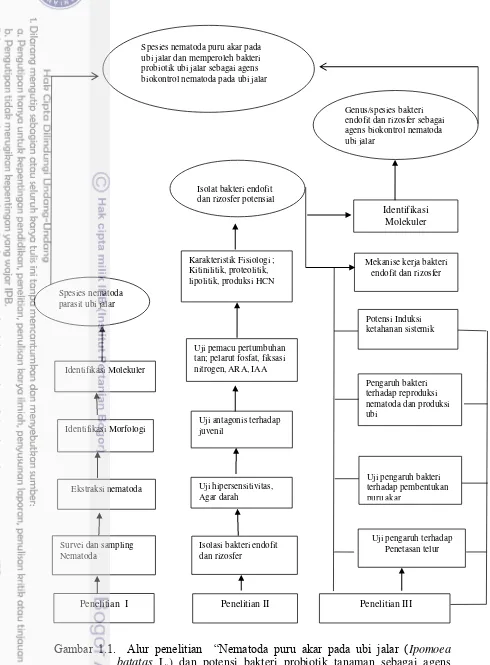
1.1 Alur penelitian “Nematoda puru akar pada ubi jalar (Ipomoea batatas L.) dan potensi bakteri probiotik tanaman sebagai agens biokontrol : studi kasus
di Papua Barat 6
3.1 Perbedaan teknik budidaya ubi jalar di Kabupaten Sorong dan Manokwari 30
3.2 Gejala nematode puru akar pada ubi jalar 32
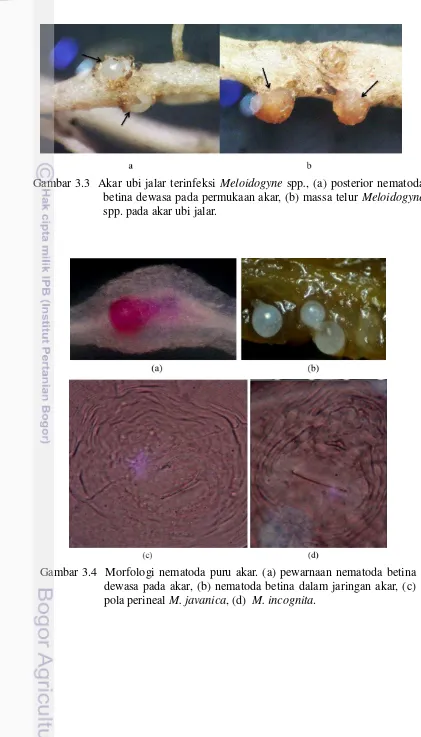
3.3 Akar ubi jalar terinfeksi Meloidogyne spp.. 33
3.4 Morfologi nematoda puru akar 33
3.5 Hasil amplifikasi DNA Meloidogyne spp. 34
3.6 Pohon filogenetik spesies M. incognita dan M. javanica berdasarkan
UPGMA (bootstrap 1000 kali ulangan 34
4.1 Sel bakteri 53
4.2 Morfologi koloni bakteri 53
5.1 Pengujian potensi bakteri menginduksi ketahanan tanaman menggunakan
metode split root system yang dimodifikasi 66
5.2 Pengaruh kultur filtrat terhadap penetasan telur nematoda 67
5.3 Tanaman ubi jalar umur 4 minggu setelah tanam 70
1 Criconemella sp. 104
2 Helicotylenchus multicinctus 104
3 Helicotylenchus pseudorobustus 105
4 Rotylenchulus reniformis 105
5 Tylenchorinchus sp. 106
6 Hoplolaimus sp. 106
7 Tylenchus sp. 107
8 Juvenil 2 Meloidogyne sp.. 107
9 Caloosia sp. 108
10 Psilenchus sp. 108
11 Pratylenchus sp. 109
12 Nematoda Predator 109
13 Nematoda pemakan bakteri 110
14 Hasil Perunutan nukleotida isolat Meloidogyne incognita 111 15 Hasil Perunutan nukleotida isolat Meloidogyne javanica 113
16 Uji produksi toksin hemolisin 115
17 Pengujian Karakter fisiologi bakteri 115
18 Pengujian di rumah kaca 116
19 Pewarnaan akar ubi jalar tanpa perlakuan 116
20 Produksi ubi pada pengujian rumah kaca 117
1 PENDAHULUAN
Latar Belakang
Ubi jalar merupakan salah satu tanaman pangan yang memiliki arti penting bagi masyarakat Papua dan Papua Barat. Selain sebagai bahan pangan pokok, ubi jalar dianggap sebagai warisan leluhur yang berperan penting dalam berbagai upacara adat, keagamaan, komunikasi sosial dan sumber pendapatan keluarga. Ubi jalar menjadi salah satu komoditas unggulan lokal di Provinsi Papua Barat dengan wilayah pengembangan meliputi beberapa kabupaten. Kabupaten Sorong dan Manokwari merupakan salah satu sentra pengembangan ubi jalar di Provinsi Papua Barat (Dinas Pertanian Provinsi Papua Barat, tidak dipublikasikan). Berdasarkan hasil pengamatan di lapangan, diketahui terjadi penurunan kualitas dan kuantitas produksi ubi jalar yang diduga disebabkan infeksi nematoda parasit tanaman.
Nematoda parasit tanaman dapat menyebabkan kerusakan pada tanaman dan dianggap ancaman serius bagi produksi ubi jalar di beberapa negara. Sebagian besar kerusakan pada ubi jalar disebabkan oleh beberapa genus nematoda tetapi yang banyak mempengaruhi produksi ubi jalar adalah Meloidogyne spp., Rotylenchulus reniformis, Pratylenchus spp. dan Ditylenchus spp. (Luc et al. 2005). Nematoda R. reniformis saat ini merupakan nematoda yang cukup penting dan mengancam produksi ubi jalar di Lousiana, negara bagian Amerika Serikat. Nematoda ini juga menginfeksi beberapa tanaman budidaya dan telah menyebar secara nyata selama dekade terakhir.
Nematoda puru akar Meloidogyne spp. tersebar luas dan menjadi masalah yang serius di daerah dengan jenis tanah berpasir. M. incognita adalah salah satu spesies penting yang berasosiasi dan menyebabkan kerusakan pada ubi jalar di Jepang (Luc et al. 2005). Infeksi nematoda ini cenderung lebih mudah dikenali dibandingkan kerusakan oleh nematoda parasit lainnya. Gejala di atas permukaan tanah dapat dilihat melalui daun yang menguning, tanaman menjadi kerdil dan cenderung mudah layu (Mackay et al. 1990). Tanaman yang terinfeksi nematoda Meloidogyne . dapat menyerupai tanaman yang kekurangan unsur hara (Mulyadi 2009). Nematoda ini dapat merusak kualitas ubi jalar karena menyebabkan blister (cacar) dan retak pada ubi (Ye et al. 2008).
Nematoda menyebabkan kehilangan hasil yang nyata pada tanaman ubi jalar di beberapa negara antara lain Nigeria, Meloidogyne incognita menyebabkan penurunan hasil panen ubi jalar varietas puerto rico, white star dan red nancy (Olabiyi 2007). Hasil survei distribusi nematoda parasit tanaman ubi jalar (85 sampel tanah) dan talas (22 sampel tanah) di bagian tengah dan selatan pulau Kyushu Jepang, menunjukkan 96% pertanaman ubi jalar terinfeksi nematoda M. incognita dan sisanya M. arenaria dan M. javanica (Iwahori et al. 2000).
hari. Gejala tersebut sulit untuk dibedakan dengan gejala kekurangan unsur hara, sehingga upaya pengendalian yang dilakukan oleh petani kurang tepat. Selama ini upaya pengendalian yang dilakukan petani adalah dengan menggunakan pupuk dan pestisida kimia sintetis. Cara pengendalian nematoda dengan menggunakan pestisida kimia sintetis dapat menyebabkan kerusakan dan pencemaran lingkungan, gangguan kesehatan terhadap petani, meninggalkan residu kimia berbahaya bagi konsumen serta menurunkan jumlah mikroba dan mikro fauna yang berperan penting dalam keseimbangan ekosistem pertanian. Pengendalian dengan memanfaatkan agens hayati yang lebih ramah ligkungan perlu dilakukan untuk mengurangi penggunaan pestisida sintetik.
Pengendalian hayati dengan memanfaatkan mikroorganisme menguntungkan yang berasosiasi dengan tanaman. Mikroorganisme menguntungkan tersebut di antaranya adalah bakteri probiotik tanaman. Bakteri probiotik tanaman adalah bakteri yang berasosiasi dengan tanaman yang dapat meningkatkan pertumbuhan tanaman inang bila diaplikasikan dalam jumlah yang cukup (Islam dan Hossain 2012). Menurut Spence et al. (2012), di antara mikroorganisme yang berasosiasi dengan tanaman, beberapa bermanfaat bagi tanaman karena mikroorganisme tersebut bersifat antagonis terhadap berbagai patogen tanaman, menginduksi ketahanan tanaman bahkan meningkatkan pertumbuhan tanaman. Bakteri yang dapat dikelompokkan sebagai probiotik tanaman harus memiliki peran yang bermanfaat bagi pertumbuhan tanaman, ketika mengoloni jaringan tanaman atau sebagai bakteri endofit, tidak bersifat patogen dan aman bagi manusia (Flores-Felix et al. 2015). Beberapa bakteri probiotik tanaman yang mengoloni bagian permukaan akar (rizosfer) memiliki sifat positif dan mempengaruhi pertumbuhan tanaman melalui beberapa mekanisme antara lain fiksasi nitrogen, pelarut fosfat, besi, meningkatkan ketersediaan air, menghasilkan hormon tanaman dan hormon pengatur pertumbuhan tanaman (Barufa et al. 2008). Bakteri probiotik tanaman dapat berasal dari bakteri yang mengoloni permukaan akar (rizosfer) (Barufa et al. 2008) maupun bakteri yang mengoloni jaringan akar (endofit) (Flores-Felix et al. 2015). Berdasarkan definisi tersebut, bakteri endofit dan rizosfer tanaman ubi jalar yang memiliki kemampuan menambat nitrogen, pelarut fosfat, menghasilkan hormon pertumbuhan IAA dan metabolit sekunder serta tidak bersifat patogen dapat dikelompokkan sebagai bakteri probiotik tanaman.
siderofor. Pseudomonas earuginosa Strain IE-6 secara in vitro memproduksi senyawa toksik yang menyebabkan kematian juvenil M. javanica (Siddiqui et al. 2001). Beberapa hasil penelitian lainnya menunjukkan bahwa bakteri endofit yang diisolasi dari kapas antara lain Brevundimonas vesucularis, Serratia marcescens, Pseudomonas fluorescens, B. cepacia, Phyllobacterium rubiacaerum dapat mengurangi populasi dan jumlah puru M. incognita (Hallman et al. 1998). Bakteri endofit yang diisolasi dari ubi jalar antara lain Rahnella aquatilis, Pseudomonas sp., Rhodanobacter sp dan Phyllobacterium diketahui memiliki aktivitas pemacu pertumbuhan tanaman dan sebagai biokontrol (Khan dan Doty 2009), tetapi keefektifannya sebagai pengendali nematoda parasit tanaman belum diketahui.
Bakteri rizosfer atau rizobakteria adalah bakteri yang mengolonisasi perakaran tanaman. Rizosfer adalah bagian tanah dimana lebih banyak terdapat bakteri di sekitar akar tanaman daripada tanah yang jauh dari akar tanaman. Beberapa bakteri rizosfer telah banyak dimanfaatkan sebagai pemacu pertumbuhan maupun sebagai agens biokontrol nematoda. Moghaddam et al. (2014) melaporkan bahwa bakteri rizosfer Bacillus pumilus strain ToIrFT-KC806241 dan ToIrMA-KC806242 terbukti dapat mengurangi persentase penetasan telur, menyebabkan mortalitas juvenil M. javanica sebesar 83.33 sampai 99.33%, mengurangi indeks puru akar dan kelompok telur pada pengujian laboratorium dan rumah kaca. Bakteri yang diisolasi dari rizosfer tanaman tomat P. aeruginosa juga dilaporkan menurunkan populasi nematoda M. incognita di dalam tanah dan indeks puru akar serta meningkatkan pertumbuhan tanaman tomat (Shankar et al. 2011).
Bakteri endofit dan rizosfer menghasilkan metabolit sekunder yang bersifat nematisidal, memproduksi enzim, menginduksi ketahanan sistemik, dan meningkatkan ketahanan tanaman terhadap stres lingkungan. Mekanisme kerja bakteri endofit dan rizosfer tersebut akan mempengaruhi populasi dan perkembangan nematoda.
Nematoda parasit yang berasosiasi dengan ubi jalar di Provinsi Papua Barat belum pernah dilaporkan, demikian pula bakteri probiotik ubi jalar yang memiliki potensi sebagai agens biokontrol nematoda. Penelitian mengenai nematoda parasit dan bakteri probiotik ubi jalar sebagai agens biokontrol perlu dilakukan dalam usaha pengelolaan nematoda parasit yang ramah lingkungan.
Perumusan Masalah
Pengendalian nematoda pada ubi jalar yang dilakukan oleh petani selama ini adalah menggunakan pestisida sintetik. Aplikasi pestisida sintetik dapat menimbulkan berbagai masalah lingkungan dan residu pada produk hasil pertanian. Penggunaan bakteri probiotik tanaman sebagai agens biokontrol merupakan salah satu alternatif pengendalian nematoda puru akar. Bakteri probiotik tanaman adalah bakteri yang berasosiasi dengan tanaman yang dapat meningkatkan pertumbuhan tanaman inang bila diaplikasi dalam jumlah yang cukup. Bakteri endofit dan rizosfer merupakan bakteri probiotik yang telah banyak digunakan sebagai agens bikontrol nematoda puru akar. Bakteri probiotik yang berasosiasi dengan ubi jalar diketahui memiliki aktivitas pemacu pertumbuhan tanaman tetapi keefektifannya sebagai biokontrol nematoda puru akar belum dilaporkan. Berdasarkan hal tersebut, penting dilakukan eksplorasi, identifikasi dan pengujian kemampuan bakteri endofit dan rizosfer ubi jalar sebagai biokontrol nematoda puru akar. Sebagai agens biokontrol, bakteri endofit dan rizosfer harus bersifat aman bagi lingkungan dan manusia, sehingga perlu dilakukan seleksi potensi patogenisitas terhadap tanaman dan mamalia. Bakteri yang telah melalui tahap seleksi dan tidak berpotensi patogen, perlu diidentifikasi secara morfologi dan molekuler sehingga diketahui spesies bakteri endofit dan rizosfer potensial. Pengujian beberapa sifat fisiologi meliputi kemampuan bakteri menghasilkan enzim kitinase, proteinase, lipase, HCN, pelarut fosfat, penambat nitrogen dan fitohormon perlu dilakukan untuk mengetahui karakter fisiologi yang mendukung potensi bakteri tersebut sebagai agens biokontrol. Karakter lain yang perlu dilakukan pengujian adalah kemampuan bakteri menginduksi ketahanan tanaman serta mekanisme bakteri mengendalikan nematoda puru akar pada ubi jalar.
Tujuan Penelitian
Penelitian ini bertujuan untuk determinasi yang akurat penyebab puru akar pada ubi jalar di Provinsi Papua Barat, memperoleh isolat bakteri probiotik ubi jalar yang potensial sebagai agens biokontrol nematoda puru akar dan menganalisis mekanisme pengendalian bakteri probiotik dalam mengendalikan nematoda puru akar.
Hipotesis
1. Salah satu patogen yang menyebabkan malformasi ubi, nekrotik pada akar dan menurunkan produksi ubi jalar di Provinsi Papua Barat adalah nematoda puru akar.
2. Nematoda puru akar tersebut dapat dikendalikan dengan memanfaatkan bakteri probiotik yang berasosiasi dengan ubi jalar.
3. Terdapat beberapa isolat bakteri probiotik yang tidak patogen terhadap tanaman dan mamalia yang memiliki potensi sebagai agens biokontrol nematoda puru akar.
Manfaat Penelitian
Deskripsi gejala pada tanaman ubi jalar diharapkan dapat membantu memudahkan petani dan petugas mengenali gejala di lapangan yang disebabkan oleh infeksi nematoda puru akar. Identifikasi morfologi dan molekuler memberikan kepastian spesies nematoda yang menginfeksi ubi jalar sehingga berdasarkan data tersebut diharapkan dapat disusun rencana pengelolaan penyakit secara tepat.
Pemanfaatan bakteri probiotik ubi jalar sebagai agens biokontrol nematoda puru akar mendukung peningkatan produksi ubi jalar dan mengurangi penggunaan pestisida sintetik secara berlebihan yang berpotensi merusak lingkungan dan meninggalkan residu pada produk hasil pertanian. Karakter fisiologi dan mekanisme biokontrol bakteri probiotik diharapkan memberikan informasi yang dapat digunakan sebagai dasar untuk mengoptimalkan peran bakteri probiotik ubi jalar dalam meningkatkan produksi dan mengendalikan nematoda puru akar.
Kebaruan dan Keunggulan Penelitian
Penelitian ini menghasilkan beberapa nilai kebaruan yaitu untuk pertama kalinya spesies nematoda puru akar yang menyebabkan kerusakan pada ubi jalar di Provinsi Papua Barat berhasil diidentifikasi secara morfologi dan molekuler serta gejala yang ditimbulkan dapat dideskripsikan dengan jelas. Diperoleh 25 isolat bakteri probiotik ubi jalar untuk pertama kalinya dilaporkan keefektifannya sebagai biokontrol nematoda puru akar. Isolat bakteri tersebut terdiri atas 9 isolat bakteri rizosfer, 9 isolat bakteri endofit batang, 4 isolat bakteri endofit akar dan 3 isolat bakteri endofit ubi. Diketahuinya beberapa mekanisme pengendalian nematoda puru akar oleh bakteri probiotik ubi jalar meliputi antagonis melalui produksi metabolit sekunder berupa enzim pendegradasi dinding sel juvenil dan telur nematoda yaitu protease, kitinase, lipase dan potensi memacu pertumbuhan tanaman melalui kemampuan bakteri melarutkan fosfat, menambat nitrogen serta menghasilkan fitohormon. Keunggulan penelitan ini adalah spesies bakteri probiotik ubi jalar antagonis dan pemacu pertumbuhan tanaman yang dihasilkan dari penelitian ini dapat digunakan sebagai agens biokontrol nematoda puru akar pada tanaman ubi jalar.
Ruang Lingkup Penelitian
Penelitian dilaksanakan mulai bulan Januari 2014 sampai Agustus 2015 melalui 3 tahapan yaitu survei teknik budidaya ubi jalar pendataan lokasi dan sampling di Kabupaten Sorong dan Manokwari, identifikasi morfologi dan molekuler nematoda puru akar ubi jalar, isolasi, seleksi dan karakterisasi fisiologi bakteri probiotik ubi jalar, identifikasi molekuler bakteri probiotik, mekanisme bakteri probiotik ubi jalar mengendalikan nematoda puru akar melalui pengujian terhadap penetasan telur dan pengujian potensi bakteri probiotik menginduksi ketahanan ubi jalar terhadap nematoda puru akar di lapangan terbatas (Gambar 1.1)
2 TINJAUAN PUSTAKA
Ubi jalar (Ipomoea batatas L.)
Tanaman ubi jalar merupakan salah satu komoditas unggulan Provinsi Papua barat. Komoditas ini telah lama dikenal oleh masyarakat Papua dan Papua barat sebagai bahan pangan pokok sumber karbohidrat. Secara taksonomis ubi jalar termasuk dalam ordo Solanales, famili Convolvulaceae, genus Ipomoea dan spesies yang banyak dibudidayakan adalah Ipomoea batatas Lamb. Tanaman ubi jalar secara umum terdiri atas dua bagian utama yaitu organ tanaman yang ada di atas permukaan tanah (shoots) berupa batang utama dan cabang (sulur), daun, bunga dan biji serta organ tanaman yang berada di dalam tanah berupa akar (fiberous roots) dan ubi (tuberous roots). Berdasarkan morfologi ubi jalar, akar ubi jalar digolongkan dalam tiga tipe yaitu (a) akar utama yang tumbuh pada batang (akar advertitif) tegak lurus ke bawah, akar yang tumbuh kesamping di zona perakaran dekat permukaan tanah, (b) akar cabang atau akar baru yang tumbuh pada akar utama, sebagian besar tumbuh ke arah samping (akar lateral), (c) akar ubi yaitu akar yang tumbuh pada ubi baik pada kulit ubi maupun pada akar di bagian ujung ubi. Beda antara akar besar dan akar ubi terletak pada bentuk dan fungsi akar tersebut. Akar ubi berkembang makin besar dan mengendalikan proses inisiasi dan akar besar atau akar utama relatif tetap dan mengendalikan pertumbuhan serta menyerap air dan nutrisi (Wahyuni dan Wargiono 2012).
Ubi jalar menghasilkan ubi sebagai hasil pertumbuhan sekunder dari beberapa akar (tuberousroots) pada zona perakaran (lapisan tanah sedalam 20 sampai 25 cm). Sebagian besar ubi berkembang dari bakal calon ubi yang terdapat pada sistem akar serabut. Ubi juga terbentuk dari akar-akar yang tumbuh pada buku-buku batang yang tumbuh menjalar dipermukaan tanah, tetapi ubi yang terbentuk biasanya berukuran kecil sehingga tidak memiliki nilai ekonomis. Ubi memiliki ukuran, bentuk, warna kulit dan warna daging yang bervariasi tergantung varietasnya. Bentuk ubi pada umumnya adalah membulat, oblong memanjang, elip memanjang serta tidak beraturan. Bentuk ubi pada varietas yang sama seringkali juga bervariasi. Kulit ubi ada yang berwarna putih, kuning, ungu, jingga dan merah dengan struktur kulit antara tipis, tebal dan bergetah (Wahyuni dan Wargiono 2012). Sebagian besar ubi jalar di Kabupaten Manokwari memiliki kulit ubi berwarna merah dengan bagian dalam ubi berwarna putih dan kulit ubi putih dengan bagian dalam ubi putih. Petani ubi jalar di Kabupaten Sorong mengembangkan ubi jalar dengan warna kulit dan bagian dalam ubi putih.
kelembagaan adat. Hal ini menyebabkan adopsi inovasi berjalan lambat sehingga menjadi kendala tersendiri dalam upaya peningkatan produksi pertanian.
Hal tersebut berbeda dengan petani ubi jalar di Kabupaten Sorong yang sebagian besar adalah warga non lokal atau transmigrasi. Umumnya warga pendatang atau transmigrasi memiliki ketrampilan dan penguasaan teknik budidaya pertanian lebih modern serta memiliki orientasi ekonomi dan bisnis sehingga upaya peningkatan produksi dapat dicapai (Baransano 2011). Hal ini terlihat dari luas tanam, pengelolaan hama dan penyakit, penanganan pasca panen dan pemasaran hasil panen. Setiap petani ubi jalar di Kabupaten Sorong memiliki luas pertanaman ubi jalar berkisar antara 0.5 sampai 1 hektar, lebih luas dibandingkan petani ubi jalar di Kabupaten Manokwari berkisar antara 0.1 sampai 0.25 ha (hasil survei langsung di lapangan).
Produksi Ubi jalar di Papua Barat
Ubi jalar merupakan tanaman pangan penting yang secara luas dapat tumbuh di daerah beriklim tropis dan sub tropis. Ubi jalar mempunyai daya adaptasi luas, sehingga dapat tumbuh dan berkembang dengan baik diseluruh Indonesia. Tanaman ubi jalar dapat tumbuh dengan baik pada daerah dengan ketinggian 0 sampai 3000 m di atas permukaan laut (mdpl). Suhu optimum untuk pertumbuhan ubi jalar adalah 24 C dan curah hujan optimum 750 sampai 1500 mm per tahun. Ubi jalar cenderung toleransi terhadap kekeringan, dapat tumbuh baik pada berbagai tipe tanah, pH tanah optimum untuk pertumbuhannya berkisar antara 5.6 – 6.6. (Wardiyono 2009).
Provinsi Papua Barat dengan luas wilayah 115 363.50 km2, terletak pada ketinggian 0 sampai 1600 meter di atas permukaan laut, suhu udara rata-rata berkisar antara 20.7 ⁰Csampai 28.25 ⁰C dengan kelembapan udara berkisar antara 83.6% sampai 85.2% dan lama penyinaran rata-rata 52.36% sampai 128.81%, sangat potensial untuk pengembangan komoditas-komoditas pertanian terutama ubi jalar. Sebanyak 60% penduduk Papua menggunakan ubi jalar sebagai makanan pokok terutama penduduk yang mendiami daerah pegunungan pada ketinggian 1500 sampai 2500 mdpl (Samori et al. 1998). Jumlah penduduk Provinsi Papua Barat kurang lebih 816 986 jiwa dengan pertumbuhan penduduk 4.1% tahun (Statistik Daerah 2014) mengakibatkan permintaan terhadap pangan terus meningkat sehingga diversifikasi pangan non beras guna pemenuhan kebutuhan pangan sangat diperlukan. Ubi jalar sebagai sumber pangan lokal menjadi alternatif pemerintah daerah untuk dikembangkan dan menjadikannya sebagai salah satu komoditas unggulan Provinsi Papua Barat.
produksi ubi jalar di Papua Barat terutama disebabkan oleh menurunnya luas panen dan produktivitas yang terjadi di Kabupaten Sorong, Raja Ampat, Teluk Bintuni dan kabupaten lainnya kecuali Kabupaten Manokwari dan Kaimana mengalami peningkatan produksi ubi jalar (BPS Papua Barat 2015).
Berdasarkan data Direktorat Jenderal Tanaman Pangan tahun 2011 menunjukkan bahwa produksi ubi jalar tertinggi di Indonesia dihasilkan oleh Provinsi Jawa Barat yaitu sebesar 429 378 ton dengan luas panen 27 931 ha. Produksi terbesar kedua dihasilkan oleh Provinsi Papua yaitu 348 438 ton dengan luas panen 34 413 ha. Produksi ubi jalar di Papua Barat tergolong rendah jika dibandingkan produksi nasional, namun cenderung mengalami kenaikan. Pada tahun 2009 produksi ubi jalar di Provinsi Papua Barat sebesar 10 599 ton/ha dan pada tahun 2011 menjadi 13 409 ton/ha (BPS Papua Barat 2011).
Organisme Pengganggu Tanaman (OPT) Ubi jalar
Faktor yang mempengaruhi hasil ubi jalar antara lain adalah varietas, kesuburan tanah, ketinggian tempat budidaya, iklim serta gangguan hama dan penyakit (Nonci 2005). Menurut Supriyatin (2013), hama utama yang menyebabkan kehilangan hasil pada tanaman ubi jalar adalah kumbang penggerek ubi atau hama boleng (Cylas formicarius). Hama ini dapat menurunkan hasil ubi jalar hingga 80%, di lapangan maupun selama penyimpanan di gudang. Kumbang C. formicarius tersebar luas di wilayah tropis dan subtropis, dan belum lama ini ditemukan di daerah yang lebih tinggi. Terdapat tiga spesies utama kumbang penggerek ubi yaitu C. formicarius, ditemukan di daerah tropis khususnya di Asia, C. punsticollis di Sub-Sahara Afrika, dan Euscepis postfasciatus ditemukan di Karibia dan beberapa negara kepulauan di Pasifik (AVRDC 2004). Ketiga spesies tersebut mempunyai siklus hidup yang serupa dan dapat dikendalikan dengan cara yang sama (Nonci 2005).
Kerusakan yang ditimbulkan oleh Cylasformicarius ditandai dengan adanya lubang gerekan pada ubi akibat aktivitas makan kumbang dewasa. Oviposisi kumbang betina juga menyebabkan terbentuknya lubang pada ubi. Larva yang berkembang di dalam ubi membuat lubang gerekan dan menyebabkan kerusakaan yang nyata. Ubi yang rusak menghasilkan senyawa beracun (terpene) sehingga ubi tidak dapat dikonsumsi. Kerusakan yang timbul pada pangkal batang yaitu terjadinya malformasi, penebalan dan adanya retakan pada bagian dalam jaringan yang terserang (Ames et al. 1997).
Hasil tanaman sehat 2.8 sampai 4.5 kali lebih tinggi dibandingkan dengan tanaman yang terinfeksi SPVD (Gutierrez et al. 2003).
Bakteri patogen meskipun bukan penyakit yang umum pada ubi jalar tetapi dapat menyebabkan kerugian secara ekonomi. Bakteri mempengaruhi jaringan vaskular, ubi dan akar serabut sehingga dapat meyebabkan batang membusuk dan layu. Beberapa bakteri patogen yang menginfeksi ubi jalar antara lain Erwinia chrysanthemi yang menginfeksi akar dan batang, Pseudomonas solanacearum dan Streptomyces ipomoea (Ames et al. 1997).
Cendawan patogen utama yang menginfeksi ubi jalar adalah penyakit kudis yang disebabkan olah Elsinoe batatas, Sphaceloma batatas pada daun dan batang, busuk pada ubi yang disebabkan oleh cendawan Ceratocystis fimbriata, layu Fusarium yang disebabkan oleh Fusarium oxysporum f. sp. batatas, hawar daun yang disebabkan oleh Alternaria bataticola, Phomopsis ipomoea-batatas dan beberapa cendawan lain Alternaria spp., Cercospora sp., Septoria sp., Ascochyta sp., Curvularia sp., Colletotrichum sp., and Pestalotia batatae. Penyakit kudis tersebar hampir diseluruh negara Asia Tenggara, Ocenia, Mexico, Brazil, New Caledonia, Papua New Guinea, Kepulauan Solomon, Tonga dan Vanuatu (Ames et al. 1997).
Penyakit kudis yang disebabkan oleh cendawan Elsinoe batatas ditemukan tersebar di dataran rendah Kabupaten Manokwari dan Sorong. Cendawan ini dilaporkan menginfeksi tanaman ubi jalar di kebun percobaan Fakultas Pertanian Universitas Cenderawasih (UNIPA) di Manokwari (Karuna 2012). Infeksi cendawan pada daun ubi jalar ditandai dengan terdapat bercak-bercak coklat dan selanjutnya menjadi coklat kehitaman. Bercak-bercak berkembang semakin luas dan bersatu dengan bercak yang lain. Infeksi lebih lanjut menyebabkan pertumbuhan daun tidak normal, tangkai dan helaian daun keriting dan kerdil (Ames et al. 1997). Batang terinfeksi terdapat bercak berwarna coklat di sepanjang batang dan di bagian tengahnya berwarna ungu atau coklat. Batang lebih tegak daripada batang sehat dan mempunyai ruas-ruas yang pendek, terdapat banyak kudis pada tangkai dan tulang daun. Penyakit ini dapat menyebabkan penurunan hasil ubi jalar lebih dari 30% (Nasrun et al. 1993).
Nematoda parasit tanaman dapat menyebabkan kerusakan pada tanaman dengan beberapa cara dan dianggap ancaman serius bagi produksi ubi jalar di beberapa negara. Sebagian besar kerusakan pada ubi jalar disebabkan oleh beberapa jenis nematoda tetapi yang banyak mempengaruhi produksi ubi jalar adalah Meloidogyne spp., Rotylenchulus reniformis, Pratylenchus spp. dan Ditylenchus spp. (Luc et al. 2005). Nematoda puru akar (Meloidogyne spp.) tersebar luas dan menjadi masalah yang serius di daerah dengan jenis tanah berpasir. Para ilmuwan yang tergabung dalam International Meloidogyne Project (IMP) memperkirakan kehilangan hasil rata-rata oleh nematoda puru akar pada ubi jalar adalah 15% di Amerika Selatan, 24% di Afrika Barat dan 6% di Asia Tenggara (Cervantes-Flores 2000).
Meloidogyne spp. Klasifikasi
Tylenchoidea, Famili Meloidogynidae, Subfamili Meloidogyninae dan genus Meloidogyne (Taylor dan Sasser 1978). Nematoda ini memiliki banyak spesies tetapi yang telah diidentifikasi dan dianggap sebagai parasit penting pada tanaman ada lima spesies yaitu M. incognita, M. javanica, M. arenaria, M. hapla dan M. chitwood. Di Indonesia telah ditemukan M. incognita, M. javanica, M. arenaria, M. hapla, M. Graminicola dan M. inortata (Mulyadi, 20 09).
Morfologi
Nematoda Meloidogyne spp. memiliki tubuh seksual dimorfik, dengan ukuran tubuh yang sangat kecil sehingga untuk mengetahui ciri morfologinya hanya dapat dilihat menggunakan mikroskop. Perubahan morfologis yang terjadi dalam satu siklus hidup Meloidogyne spp. yaitu bentuk telur, juvenil dan dewasa (jantan serta betina). Telur-telur nematoda diletakkan di dalam massa telur yang terdapat di luar tubuh nematoda betina dan disekresikan oleh sel-sel kelenjar rektum. Telur umumnya berwarna putih, berbentuk lonjong. Nematoda betina dapat menghasilkan telur sebanyak 300 sampai 400 telur (Dropkin 1991). Pada akhir embriogenesis dalam telur Meloidogyne terbentuk juvenil stadia 1 (J1). Segera setelah juvenil 1 mengalami ganti kulit pertama masih dalam telur menjadi juvenil 2 yang merupakan stadia infektif. Juvenil berbentuk vermiform dengan panjang tubuh antara 400 sampai 600 μm, panjang stilet 10 sampai 15 μm, memiliki knob yang jelas kelenjar esopfagus tumpang tindih pada usus bagian ventral dan ekor meruncing.
Nematoda betina berbentuk seperti buah alpukat, berwarna putih kekuningan dengan diameter tubuh memanjang antara 440 sampai 1300 μm dan lebar 325 sampai 700 μm. Nematoda betina bersifat menetap (sedentary) dalam akar tanaman inang dan mempunyai dua buah indung telur (ovarium) (Perry et al. 2009). Kenampakan paling khas pada nematoda Meloidogyne adalah pada pola perenial yaitu gambaran khas pada kutikula di bagian tubuh posterior nematoda betina yang dapat digunakan untuk mencirikan masing-masing spesies.
Nematoda jantan berbentuk vermiform, aktif bergerak namun tidak bersifat parasit pada tanaman. Ukuran tubuh relatif panjang antara 1.0 sampai 1.5 mm dan diameter tubuh antara 30 sampai 36 μm. Stilet relatif pendek antara 18 sampai 24
μm dan mempunyai knob pada pangkal stiletnya. Ekor relatif pendek membulat dan tidak mempunyai bursa yaitu alat tambahan yang berupa lembaran kutikula pada kedua sisi samping ekor. Bila diperlakukan dengan panas, maka tubuh nematoda akan berbentuk setengah lingkaran. Pada umumnya nematoda jantan memiliki satu atau dua testis (Luc et al. 2005).
Biologi dan Daur Hidup
perubahan sel-sel yaitu terbentuknya sel-sel raksasa (giant cell) yang merupakan sumber makanan bagi nematoda. Juvenil 2 yang menetap di dalam jaringan tanaman mengalami pertumbuhan dan pergantian kulit hingga menjadi juvenil 3 (J3) dan juvenil 4 (J4) dan selanjutnya menjadi nematoda betina dewasa atau jantan (Dropkin 1991).
Nematoda jantan berbentuk vermiform dan hidup di dalam tanah atau pada jaringan akar tetapi tidak bersifat parasit, sedangkan nematoda betina berbentuk seperti buah pear akan tetap berada dan tinggal pada daerah makanannya atau sel awal di dalam stele dengan bagian posterior tubuhnya berada pada permukaan akar. Siklus hidup nematoda Meloidogyne dari saat terjadinya awal makan (initial feeding) sampai terbentuknya nematoda dewasa antara 3 sampai 8 minggu. Reproduksi nematoda Meloidogyne spp. pada umumnya secara partenogenesis.
Pertumbuhan dan perkembangan Meloidogyne spp. dipengaruhi oleh berbagai faktor lingkungan diantaranya suhu, tipe tanah, pH tanah, dan eksudat akar tanaman inang. M. incognita, M. javanica dan M. arenaria pada umumnya memerlukan suhu relatif tinggi antara 25 sampai 30 °C, sedangkan M. hapla di daerah dengan suhu relatif lebih rendah dengan kisaran suhu optimal antara 15 sampai 25 °C. Suhu berpengaruh terhadap perkembangan embrio telur, penetasan, pertumbuhan dan reproduksi, penyebaran serta kemampuan bertahan hidup. Meloidogyne spp. pada umumnya berkembang baik pada semua tipe tanah, tetapi kerusakan berat terutama terjadi di daerah dengan tipe tanah ringan atau berpasir. Keasaman tanah atau pH optimum untuk perkembangan Meloidogyne spp. antara 6.4 sampai 7.0. Pada pH tanah di bawah 5.2 pertumbuhan dan perkembangannya terhambat (Mulyadi 2009). Eksudat akar tanaman inang mempengaruhi peningkatan penetasan telur, tetapi senyawa tersebut tidak diperlukan untuk keberhasilan daur hidupnya (Dropkin 1991).
Mekanisme Infeksi Meloidogyne spp.
Mekanisme infeksi Meloidogyne spp dimulai dari juvenil 2 yang bersifat infektif bergerak menuju ke ujung-ujung akar dan penetrasi ke dalam jaringan yang berada di belakang ujung akar yaitu di daerah yang sedang mengalami perpanjangan. Molekul signal nematoda atau elisitor dikeluarkan dari kelenjar esophagus nematoda yang dinjeksikan melalui stilet ke dalam jaringan inang. Meloidogyne spp. mempunyai dua kelenjar esophagus yaitu kelenjar dorsal dan subventral. Kelenjar dorsal juvenil 2 mengeluarkan enzim selulase, hemiselulase dan endopektin transeliminase yang dapat menghidrolisis dinding sel tanaman. Terurainya bahan-bahan penyusun dinding sel tersebut menyebabkan dinding sel rusak dan terbentuk luka sehingga nematoda dapat masuk ke dalam jaringan tanaman dan bergerak di antara sel-sel menembus jaringan sel yang terdapat cukup cairan makanan. Meloidogyne spp. betina dewasa yang bersifat endoparasit menetap dalam jaringan sel dan dari kelenjar subventral nematoda betina dewasa tersebut disekresikan enzim protease yang dapat menghidrolisis protein dalam jaringan tanaman menjadi asam-asam amino. Salah satu asam amino tersebut adalah triftofan yang merupakan prekusor pembentukan auksin yang diduga membantu terbentuknya puru pada akar tanaman yang terinfeksi Meloidogyne spp. (Perry et al. 2009).
nutrisi pada daun (antara lain N, P, K, Ca, Mg dan Fe). Infeksi Meloidogyne spp. juga menyebabkan terhambatnya laju fotosintesis karena adanya hambatan aliran nutrisi dan air ke daun, terjadinya klorosis, terjadinya penutupan stomata daun (tanaman layu). Selain itu, infeksi nematoda puru akar juga menyebabkan terjadinya pengurangan baik panjang maupun jumlah akar, sehingga kemungkinan menyebabkan zat-zat tumbuh yang dihasilkan akar juga terhambat antara lain giberalin dan sitokinin (Mulyadi 2009)
Gejala pada Ubi jalar
Infeksi oleh Meloidogyne spp merupakan serangkaian proses yang dapat menyebabkan perubahan seluruh fisiologi tanaman inang. Nematoda secara individual hanya mempunyai efek yang kecil, tetapi hasil akumulasi dari sejumlah besar nematoda menyebabkan kerusakan pada tanaman inang (Dropkin 1991). Menurut Mitkowski dan Abawi (2003), Meloidogyne menimbulkan gejala yang khas pada akar. Aktivitas makan nematoda menyebabkan terbentuknya puru pada seluruh jaringan akar yang terinfeksi. Jumlah puru atau tingkat keparahan puru akar tergantung pada beberapa faktor yaitu kepadatan populasi nematoda, spesies dan ras Meloidogyne serta spesies tanaman inang. Puru yang terbentuk pada akar terinfeksi menyebabkan disfungsi dalam penyerapan dan translokasi nutrisi dan air sehingga tanaman mudah layu terutama dalam keadaan kering (Luc et al. 2005). Tanaman terinfeksi Meloidogyne juga dapat menyerupai tanaman yang kekurangan nutrisi (Overstreet et al. 2008).
Tanaman ubi jalar yang terinfeksi Meloidogyne spp menimbulkan gejala baik di atas tanah maupun di bawah permukaan tanah. Menurut Ames et al. (1997), gejala di atas permukaan tanah tanaman ubi jalar terinfeksi Meloidogyne spp. mula-mula daun menjadi kuning, tanaman mudah layu, produksi bunga tidak normal dan tanaman menjadi kerdil. Selain itu, pertumbuhan tunas lebih sedikit dibandingkan tanaman yang tidak terinfeksi. Gejala kerusakan di bawah tanah ditunjukkan dengan adanya pecah atau retakan pada ubi (Mitkowski dan Abawi 2003), permukaan ubi menjadi seperti cacar (blister) yaitu timbul tonjolan melalui epidermis (Ames et al. 1997). Nematoda betina berwarna putih sampai kuning dan seringkali ditemukan pada ubi yang retak dan di bawah area permukaan atau bintil pada ubi (Overstreet et al. 2008). Jika nematoda menginfeksi akar pada awal pertumbuhan, maka akar memiliki tekstur yang kasar, terbentuk puru dan sebagian besar sistem perakaran menjadi nekrotik. Pada beberapa varietas terjadi pencoklatan sampai hitam pada lapisan luar daging ubi jalar yang tidak terlihat dengan jelas jika ubi tidak dikupas (Mitkowski dan Abawi 2003).
Pengendalian Nematoda Parasit
pestisida sintetik (Mustika 2010).
Penggunaan varietas tahan terhadap nematoda merupakan cara pengendalian yang efektif untuk menekan kepadatan populasi nematoda parasit dan membatasi ambang kerusakan sehingga dapat menekan kehilangan hasil tanaman. Ketahanan tanaman terhadap nematoda didefinisikan sebagai kemampuan tanaman untuk menekan perkembangan atau reproduksi nematoda. Tanaman tahan atau resisten mungkin saja terinfeksi oleh nematoda tetapi ketidaksesuaian sifat fisik dan kimia tanaman akan menekan perkembangan nematoda. Penggunaan varietas tahan pada sistem budidaya tanaman semusim dapat mengurangi atau menekan kepadatan populasi nematoda di dalam tanah ke level yang tidak merusak tanaman sampai pertanaman berikutnya, sehingga memungkinkan rotasi tanam lebih singkat dan lebih baik. Selain itu dengan penggunaan varietas tahan dapat membatasi kompleks penyakit yang berhubungan dengan nematoda seperti Rhizoctonia dan cendawan lainnya. Namun demikian, sampai saat ini di Indonesia belum ada yang melaporkan varietas ubi jalar yang tahan terhadap nematoda parasit tanaman (Mustika 2010).
Rotasi tanam dan pengendalian gulma sangat penting dalam pengelolaan nematoda parasit tanaman. Rotasi tanam dengan tanaman bukan inang dapat menekan kerapatan populasi nematoda R. reniformis dan Meloidogyne spp. hingga di bawah ambang ekonomi. Penanaman tanaman bukan inang selama dua tahun secara berturut-turut setelah ubi jalar dapat menurunkan kerapatan populasi nematoda parasit (Overstreet et al. 2008). Davis et al. (2003) melaporkan bahwa rotasi tanam selama satu tahun dengan jagung dan kedelai secara nyata menekan kerapatan populasi nematoda R. reniformis dan meningkatkan produksi kapas. Penerapan rotasi tanam dalam jangka panjang juga akan memberikan pengaruh yang lebih baik terhadap ekologi tanah dibandingkan aplikasi nematisida. Menurut Sipes dan Schmitt (2000), rotasi tanam dengan sorghum, jagung dan kedelai secara nyata dapat menekan populasi R. reniformis hingga 92% dibandingkan lahan yang secara terus menerus ditanami kapas. Hasil penelitian lainnya menunjukkan bahwa rotasi tanam dengan kedelai tahan kultivar Forrest kepadatan populasi nematoda lebih rendah (berkisar antara 495 sampai 1 470/200 cm3) dibandingkan dengan tanah yang ditanami kapas secara terus menerus, kepadatan populasi berkisar antara 1 879 sampai 9 440/200 cm3 (Leach et al. 2012). Spesies tanaman bukan inang sangat potensial untuk dikembangkan dalam skema rotasi tanam (Inserra et al. 1994).
tanaman tomat menurun seiring dengan peningkatan konsentrasi serbuk biji pepaya. Bahan organik lain yang dapat dimanfaatkan untuk mengendalikan nematoda Meloidogyne spp. adalah cacahan enceng gondok. Menurut Siddiqui dan Alam (1989), ekstrak cacahan daun enceng gondok mengandung senyawa yang bersifat nematisidal dan nemostatik.
Pengendalian dengan menggunakan komponen aktif tanaman seperti nematisida botani telah banyak dilakukan. Tanaman yang mengandung komponen nematisidal di antaranya adalah Tagetes spp, mimba, lantana dan sambiloto. Komponen aktif nematisidal dari Tagetes spp. yaitu Tiofena ᾳ- terthienyl, adalah salah satu senyawa yang paling beracun yang secara alami ditemukan pada Tagetes spp. Senyawa ini dapat mengurangi populasi nematoda parasit tumbuhan dan patogen lain (Chitwood 2002). Pemanfaatan ekstrak bagian tanaman mimba antara lain daun, bunga, buah, kulit batang dan getah yang diaplikasikan pada benih tomat, terung dan okra secara nyata menurunkan populasi M. incognita dan R. reniformis (Siddiqui dan Alam 1991).
Pemanfaatan bakteri probiotik tanaman untuk pengendalian nematoda puru akar dilaporkan oleh Yobo (2000). Bakteri probiotik tanaman telah banyak diisolasi dan dikembangkan secara komersial sebagai agens biokontrol berbagai patogen tanaman maupun sebagai biofertilizer untuk meningkatkan kesuburan tanah dan mengurangi penggunaan pupuk kimia sintetik.
Bakteri Probiotik Tanaman
(Barufa et al. 2008) maupun bakteri yang mengoloni jaringan akar (endofit) (Flores-Felix et al. 2015). Berdasarkan definisi tersebut, bakteri endofit dan rizosfer tanaman ubi jalar yang memiliki kemampuan menambat nitrogen, pelarut fosfat, menghasilkan hormon pertumbuhan IAA dan metabolit sekunder serta tidak bersifat patogenik dapat dikelompokkan sebagai bakteri probiotik tanaman.
Bakteri endofit adalah bakteri yang mengolonisasi jaringan tanaman sehat tanpa menyebabkan kerusakan pada inangnya (Bacon dan James 2007). Bakteri endofit mempunyai pengaruh yang menguntungkan bagi tanaman inangnya, seperti menekan perkembangan patogen secara langsung dengan memproduksi senyawa antagonis, kompetisi untuk zat besi, detoksifikasi atau degradasi faktor virulensi atau secara tidak langsung menginduksi ketahanan sistemik (ISR) pada tanaman terhadap penyakit tertentu, gangguan sinyal, kompetisi nutrisi dan niche, gangguan aktivitas kelangsungan hidup, perkecambahan dan sporulasi patogen (Jha et al. 2013). Bakteri endofit juga dilaporkan dapat meningkatkan pertumbuhaan tanaman baik secara langsung maupun tidak langsung (Surette et al. 2003). Secara langsung, bakteri endofit menyediakan nutrisi bagi tanaman seperti nitrogen, fosfat dan mineral lainnya serta menghasilkan hormon pertumbuhan seperti etilen, auksin dan sitokinin (Thakuria et al. 2004). Hallman et al. (1995) melaporkan bahwa bakteri endofit juga dapat berkontribusi dalam pengendalian nematoda M. incognita pada tomat. Beberapa isolat bakteri endofit dari kapas dilaporkan secara nyata dapat menurunkan puru pada akar yang disebabkan oleh M. incognita (Hallmann et al. 1998).
Selain bakteri endofit, bakteri rizosfer banyak dilaporkan dapat memacu pertumbuhan tanaman, menginduksi ketahanan tanaman dan bersifat antagonis terhadap patogen tanaman. Bakteri rizosfer adalah bakteri yang mengolonisasi tanah di sekitar perakaran atau rizosfer. Rizosfer didefinisikan sebagai tanah sekitar perakaran tanaman dimanabiologi dan kimia tanah dipengaruhi oleh akar (Lines-Kelly 2005). Akar tanaman secara kontinyu memproduksi dan mengeluarkan senyawa berupa asam amino, gula sederhana, senyawa fenolik dan metabolit sekunder lainnya (Bais et al. 2006). Senyawa-senyawa yang disekresikan oleh akar tersebut menyebabkan berlimpahnya mikroorganisme terutama bakteri. Beberapa genus bakteri yang telah dilaporkan banyak dijumpai di rizosfer di antaranya adalah Pseudomonas, Arthrobacter, Agrobacterium, Azotobacter, Mycobacterium, Flavobacterium, Cellulomonas dan Micrococcus (Rao 2007). Pseudomonas sp. yang diisolasi dari daerah rizosfer memiliki sifat yang beragam, ada yang merugikan dan menguntungkan tanaman. Pseudomonas yang menguntungkan memiliki kemampuan menghasilkan senyawa metabolit sekunder yang dapat menekan patogen dan menghasilkan senyawa yang dibutuhkan untuk pertumbuhan tanaman. Hasil isolasi rizosfer tanaman tomat diketahui terdapat bakteri B. subtilis dan P. fluorescens yang memproduksi protease dan menyebabkan mortalitas terhadap Meloidogyne javanica sebesar 25% sampai 53% (Tariq et al. 2011).
(Li et al., 2002), produksi enzim litik, pemacu pertumbuhan tanaman (Tian et al. 2007), produksi enzim ACC deaminase (Nascimento et al. 2012) dan induksi respon ketahanan tanaman (Siddiqui dan Shaukat, 2003).
Produksi Metabolit Sekunder
Produksi senyawa toksik (antibiosis) bakteri probiotik merupakan mekanisme penting aksi bakteri terhadap nematoda parasit tanaman. Beberapa bakteri endofit dan rizosfer dilaporkan menghasilkan metabolit sekunder antara lain senyawa HCN, enzim ekstraseluler yang berperan penting dalam pengendalian patogen tanaman. Enzim ekstraseluler yang dihasilkan bakteri endofit dan rizosfer diantaranya adalah kitinase, protease dan lipase.
Enzim kitinase merupakan enzim penting yang dihasilkan oleh bakteri antagonis untuk mengendalikan patogen terutama patogen tular tanah. Enzim ini dapat mendegradasi dinding sel patogen yang tersusun dari senyawa kitin, antara lain dinding sel cendawan, nematoda dan serangga. Enzim kitinase banyak dimanfaatkan untuk mengendalikan nematoda karena enzim ini dapat mendegradasi lapisan tengah dari telur nematoda seperti M. javanica, R. reniformis, Tylenchulus semipetrans dan Pratylenchus minyus (Tian et al. 2000), dan lapisan telur Heterodera schachtii dan H. glicines. Kitinase juga dapat membunuh Tylenchulus dubius dengan menghasilkan senyawa yang dapat merubah struktur kutikula nematoda (Tian et al. 2000). Peranan enzim kitinase dalam ketahanan terhadap infeksi patogen dapat melalui penghambatan pertumbuhan patogen dengan menghidrolisis dinding sel patogen dan pelepasan elicitor endogen yang kemudian memacu reaksi ketahanan sistemik pada tanaman inang sehingga terjadi penurunan atau penghambatan invasi patogen.
Enzim lainnya yang dihasilkan oleh bakteri endofit dan berperan dalam degradasi dinding sel patogen adalah enzim protease. Enzim protease selain berfungsi mendegradasi dinding sel patogen, juga digunakan oleh bakteri untuk melakukan penetrasi secara aktif ke dalam jaringan tanaman. Siddiqui dan Shaukat (2003) melaporkan bahwa protease yang dihasilkan oleh bakteri P. fluorescens dapat menghambat penetasan telur nematoda. Benhamou et al. (1996) juga melaporkan bahwa enzim selulase dan pektinase yang dihasilkan oleh P. fluorescens dapat digunakan oleh bakteri tersebut untuk mengolonisasi daerah interselular jaringan korteks akar sehingga terjadi penghambatan invasi patogen.
Hidrogen sianida (HCN) merupakan senyawa metabolit sekunder yang umumnya dihasilkan oleh bakteri Pseudomonas kelompok fluorescens dan juga oleh kelompok Pseudomonas lain. HCN yang dihasilkan oleh bakteri Corynebacterium paurometabolu dapat membunuh larva dan menghambat penetasan telur nematoda (Mena dan Pimental 2002) dan HCN yang dihasilkan oleh Pseudomonas kelompok fluorescens dapat mengendalikan beberapa patogen, diantaranya cendawan Macrophomina phaseolina (Reetha et al. 2014) dan Fusarium oxysporum f.sp lycopersici penyebab layu pada tanaman tomat (Toua et al. 2013.
dengan konsentrasi 50% dapat menghambat penetasan telur M. incognita sebesar 75.2% pada hari ke 5 setelah aplikasi. Bakteri ini diketahui menghasilkan metabolit sekunder yang terdiri atas berbagai senyawa antimikrobial dan memiliki potensi sebagai agens biokontrol berbagai patogen tanaman seperti bakteri, cendawan dan nematoda. Metabolit sekunder yang dihasilkan oleh bakteri Burkholderia ambifaria BC-F dilaporkan mengandung senyawa yang mampu menghambat penetasan telur, mobilitas juvenil 2 M. incognita dan beberapa cendawan patogen tular tanah (Li et al. 2002). Produksi senyawa bioaktif oleh bakteri endofit dapat memfasilitasi dominasi relung biologi dalam tanaman inang sehingga dapat memberikan perlindungan terhadap tanaman (Tan dan Zhou 2001).
Produksi ACC Deaminase
Enzim 1-aminocyclopropane-1-carboxylate deaminase atau ACC deaminase merupakan enzim yang diproduksi oleh beberapa mikroorganisme untuk mendegradasi asam amino siklopropanoid 1-aminocyclopropane-1-carboxylic acid atau ACC menjadi α-ketobutirat dan amonia yang merupakan sumber N dan karbon bagi bakteri. Asam amino ACC merupakan prekursor hormon etilen pada tanaman, sehingga ketersediaannya menjadi faktor utama dalam biosintesis hormon etilen. Etilen merupakan hormon pertumbuhan yang berperan dalam pengaturan beberapa respon fisiologis yang mempengaruhi perkembangan akar. Konsentrasi etilen yang terlalu tinggi menyebabkan ketahanan tanaman terhadap patogen menjadi lemah (Shaharoona et al. 2007). Beberapa hasil penelitian melaporkan bahwa peningkatan konsentrasi etilen pada tanaman terutama pada fase pertumbuhan vegetatif dapat menghambat perkembangan akar dan melemahkan ketahanan tanaman terhadap infeksi patogen (Glick et al. 2007). Enzim ACC deaminase dapat mengurangi pengaruh penghambatan pertumbuhan tanaman karena meningkatnya etilen dengan cara menghidrolisis ACC yang terbentuk dalam jaringan akar (Glick et al. 1998).