SUHU MEDIA PEMELIHARAAN YANG BERBEDA
HENNI SYAWAL
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi ”Efektivitas Pemberian Vaksin
multifiliis Common Carp (Cyprinus carpio L) at Different Temperatures of Media. Under direction of NASTITI KUSUMORINI, WASMEN MANALU, and RIDWAN AFFANDI.
The aims of this study were to assess the physiological and haematological responses of fish due to different water temperatures, Ichthyophthirius multifiliis
(ich) infection, and vaccination with ich theront stadia. The research was conducted in three stages. The first stage was designed to determine the temperature range that could cause stress in fish and had potency to cause ich infection. In the second stage, fish was infected with ich. The last stage was carried out to investigate the effect of vaccination. Physiological changes in fish from each stage were determined. The results of the first stage showed that cortisol levels at 20, 24, and 28⁰C and glucose levels at 24 and 28oC increased until 21st day. Fish that was kept at 24oC had the lowest survival rate (87±3.35%) and fish that was kept at 32oC had the highest survival rate (100%). In the second stage, infected fish at 20oC was under great stress, which was characterized by the increase in cortisol levels by 51.38% on 3rd day, increase in glucose levels by 60.93%, decrease in osmolarity by 18.40%, decrease lymphocytes percentage by 16.44%, and the lowest survival rate (58.11±2.16%). The damage that was affected by I. multifiliis could be seen by the presence of hypercellular, many goblet cells, and infiltration of lymphocytes cells. Lastly, vaccination caused the decrease in cortisol levels and increase in glucose levels until 14th day. The prevalence of I. multifiliis in the vaccinated fish decreased with the increase in temperature, and I. multifiliis prevalence at 20⁰C was 80.03±10.00% and at 28⁰C was 0%, and the highest survival rate was obtained at 28⁰C (100%).
terhadap Ikan Mas (Cyprinus carpio L) pada Suhu Media Pemeliharaan yang Berbeda. Dibimbing oleh NASTITI KUSUMORINI, WASMEN MANALU, dan RIDWAN AFFANDI.
Ichthyophthirius multifiliis (ich) adalah salah satu jenis ektoparasit dari golongan Protozoa, yang biasa menyerang ikan-ikan air tawar. Penyakit yang ditimbulkannya dinamakan Ichthyophtiriasis atau lebih dikenal dengan “White spot”, karena gejala yang ditimbulkan berupa bintik putih yang terdapat pada bagian kulit, sirip, insang, dan mata. Akibat patogenitas ich dapat menyebabkan kematian hingga 80-100% dalam waktu yang relatif singkat sehingga dapat menimbulkan kerugian secara ekonomis. Tingkat patogenitas dan siklus hidup ich dipengaruhi oleh suhu lingkungan media pemeliharaan ikan. Pencegahan terhadap penyakit ini sudah banyak dilakukan dengan menggunakan bahan kimia, namun hasilnya tidak memuaskan karena bahan tersebut tidak dapat membunuh semua stadia dari ich. Salah satu usaha untuk mencegah serangan penyakit ini adalah dengan pemberian vaksin yang berasal dari salah satu stadia ich, yaitu stadia theront. Pemberian vaksin pada ikan lebih aman, karena dapat melindungi dari penyakit tersebut dalam jangka waktu yang relatif lama, dan tidak menimbulkan resistensi. Keberhasilan pemberian vaksin pada ikan dipengaruhi oleh suhu media pemeliharaan. Perubahan suhu di lingkungan media pemeliharaan dapat mempengaruhi kehidupan ikan bahkan dapat menyebabkan stres. Ikan yang mengalami stres berkepanjangan akan mudah terinfeksi oleh mikroorganisme patogen. Tujuan penelitian adalah, pertama untuk mengkaji respons fisiologis dan hematologis ikan yang dipelihara pada suhu media pemeliharaan yang berbeda. Kedua, mengkaji respons fisiologis dan hematologis ikan yang diinfeksi dengan ich stadia theront dan kemudian dipelihara pada suhu media pemeliharaan yang berbeda. Ketiga, mengkaji respons fisiologis dan hematologis ikan yang diberi vaksin ich stadia theront dan kemudian dipelihara pada suhu media yang berbeda.
dengan cara pemberian vaksin ich stadia theront yang telah diinaktifkan pada suhu 47⁰C selama 30 menit. Pemberian vaksin pada ikan uji dengan cara perendaman selama 15 menit, dosis tiga mLL-1 (kepadatan sel theront 8.000 selMl-1 vaksin), untuk melihat kemanjuran dari vaksin dilakukan uji tantang pada hari ke-15 pascaimunisasi dengan dosis 5.000 sel/ikan. Perubahan fisiologis ikan uji dari setiap tahap penelitian, seperti kadar kortisol diukur dengan metode RIA kit (CORTISOL[125]) IZOTOP, kadar glukosa dengan metode enzimatis colorimetric kit Glucose liquicolor GOD-PAP, nilai osmolaritas diukur dengan OSMOTAT 030. Untuk melihat perubahan gambaran darah, seperti kadar hemoglobin diukur dengan metode Cyanmethemoglobin, nilai hematokrit, total eritrosit, dan total leukosit dengan cara pemeriksaan darah rutin. Parameter tambahan pada tahap kedua dan ketiga adalah menghitung tingkat prevalensi ich pada ikan, gambaran jaringan insang dianalisis melalui preparat histologis yang diwarnai dengan Hematoksilin dan Eosin. Pada tahap ketiga dilakukan uji immobilisasi untuk mengetahui titer antibodi.
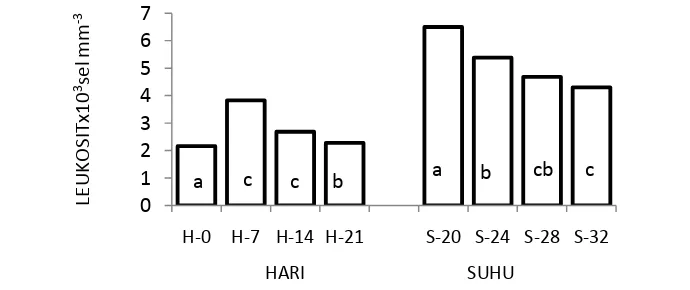
Temuan hasil penelitian pada tahap pertama adalah sebagai berikut: perubahan nilai fisiologis dan hematologis ikan mas selama pengamatan secara keseluruhan mengalami penurunan seiring dengan lamanya waktu pemeliharaan dan meningkatnya suhu media pemeliharaan. Pada penelitian ini, ikan yang dipelihara pada suhu 20 dan 24⁰C mengalami stres yang ditandai dengan ting-ginya kadar kortisol dan glukosa. Sintasan yang dihasilkan berkisar antara 87-100%, sintasan tertinggi didapatkan pada suhu 32⁰C.
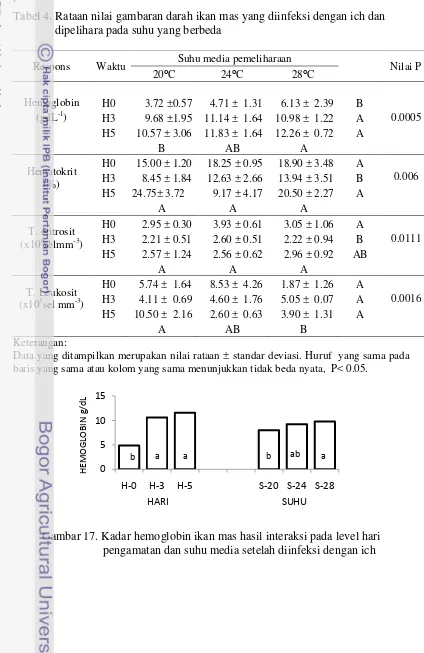
Hasil penelitian pada tahap kedua menunjukkan bahwa ikan mas yang diinfeksi dengan ich dan dipelihara pada suhu 20⁰C mengalami stres berat, yang ditandai dengan terjadinya peningkatan kadar kortisol, kadar glukosa, penurunan persentase limfosit, dan terjadinya kerusakan insang pada hari ke-3. Tingginya patogenitas ich pada suhu rendah terlihat dari tingginya angka prevalensi pada suhu 20⁰C, yaitu sebesar 62.77±5.17%. Kesemua ini mempengaruhi angka sin-tasan. Sintasan terendah didapatkan dari ikan yang dipelihara pada suhu 20⁰C, yakni sebesar 58.11±2.16%.
Hasil penelitian pada tahap ketiga menunjukkan bahwa kadar kartisol mengalami penurunan hingga mendekati nilai normal sampai hari ke-14 dan kembali meningkat sebesar 20.35% pada hari ke-21 setelah dilakukan uji tantang. Pada suhu rendah, titer antibodi lebih lama terbentuk dan titernya juga lebih rendah dibandingkan dengan ikan yang dipelihara pada suhu hangat atau men-dekati suhu optimum. Tingkat prevalensi ich tertinggi didapatkan pada suhu media pemeliharaan 20⁰C, yakni sebesar 80.03±0.00%. Selanjutnya efektivitas pemberian vaksin terlihat dari hasil sintasan ikan uji setelah dilakukan uji tantang, didapatkan hasil bahwa semakin tinggi suhu media pemeliharaan maka sintasan yang dihasilkan semakin tinggi. Sintasan tertinggi diperoleh pada suhu 28⁰C, adalah sebesar 100% dan terendah pada suhu 18⁰C, yakni sebesar 69.9±1.48%.
©
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis
SUHU MEDIA PEMELIHARAAN YANG BERBEDA
HENNI SYAWAL
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Mayor Ilmu-ilmu Faal dan Khasiat Obat
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: 1. Dr. Drh. Damiana Rita Ekastuti, MS
(Departemen AFF-FKH IPB)
2. Dr. MuntiYuhana, S.Pi. M.Si.
(Departemen Budidaya Perairan FPIK-IPB)
Penguji pada Ujian Terbuka:
1. Dr. Drh. Angela Mariana Lusiastuti, M.Si
(Balai Penelitian dan Pengembangan Budidaya Air Tawar, KKP)
2. Dr. Ir. Sukenda, M.Sc
(Departemen Budidaya Perairan FPIK-IPB)
segala karunia Nya sehingga penelitian dan penulisan disertasi ini dapat
diselesaikan dengan judul: Efektivitas Pemberian Vaksin Ichthyophthirius
multifiliis terhadap Ikan Mas (Cyprinus carpio L) pada Suhu Media Pemeliharaan yang Berbeda.
Pada kesempatan ini penulis sampaikan ucapan terima kasih yang tak terhingga kepada Dr. Dra. Nastiti Kusomorini, Prof. Ir. Wasmen Manalu, PhD dan Dr. Ir. Ridwan Affandi, DEA selaku komisi pembimbing yang telah banyak mem-berikan bimbingan dan arahan, mulai dari penyusunan proposal, pelaksanaan penelitian dengan segala kemudahan fasilitas laboratorium baik di lingkungan FKH maupun FPIK IPB, hingga penulisan disertasi. Terima kasih penulis sampaikan pada Dr. Munti Yuhana, SPi. MSi dan Dr. Drh. Damiana Rita Ekastuti, MS yang telah ber-sedia sebagai penguji luar komisi pada sidang tertutup.
Ucapan terima kasih sebesar-besarnya penulis sampaikan kepada Ayahanda Syawal Hassan, Ibunda (Almh. Nurliam, M), Etek Yulinar, M dan keluarga, Ayahanda Yuliar dan ibunda Yunidar (mertua), Kakanda Yunisda dan keluarga, adik-adik beserta adik ipar semua, yang selama ini telah banyak memberikan motivasi dan doa buat keberhasilan penulis dalam menyelesaikan studi program doktor.
Ucapan terima kasih khusus disampaikan kepada suami tercinta Drs. Yufrizal, MSi, dan anak-anakku tersayang (Mohd. Syahrizal SPt, RH. Fitri Faradilla, STp, dan M. Putra Wibowo) yang selama ini sudah banyak berkorban dengan penuh keikhlasan dalam memberikan dukungan demi keberhasilan penulis meraih gelar akademis tertinggi.
Terima kasih kepada pihak berwenang di Kementrian Pendidikan dan Nasional yang telah memberikan bantuan beasiswa BPPS Dikti dan dana penelitian melalui Hibah Bersaing tahun 2010 dan 2011. Terima kasih juga kepada Pimpinan dan rekan-rekan di Fakultas Perikanan dan Ilmu Kelautan Universitas Riau, Lembaga Penelitian Universitas Riau, dan semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu penulis dalam masa studi, penelitian, dan penulisan disertasi hingga selesai.
Maheswari, Dr. Aryani Sismin, Dr. Anita Esfandiari, dan Dr. Susderthi yang selalu meluangkan waktu buat penulis untuk berdiskusi.
Semoga Allah SWT yang maha luas kasih sayang-Nya membalas semua kebaikan itu dengan keselamatan, kesehatan, dan keberkahan hidup yang berlipat ganda. Semoga hasil penelitian ini bermanfaat dalam pengembangan ilmu pengetahuan di bidang perikanan dan berguna bagi yang memerlukan,…… Amin.
Bogor, Juni 2012
Penulis dilahirkan di Lirik (Indragiri Hulu-Riau) pada tanggal 12 Maret 1962, anak
pertama dari tujuh bersaudara pasangan berbahagia Syawal Hasan dan Almh. Nurliam
Mahmud. Pendidikan Sarjana ditempuh di Program Studi Budidaya Perairan, Fakultas
Perikanan dan Ilmu Kelautan, Universitas Riau, lulus pada tahun 1988. Pada tahun 1989
diterima sebagai dosen di Fakultas Perikanan dan Ilmu Kelautan, Universitas Riau. Pada
tahun 1994, penulis berkesempatan melanjutkan pendidikan S-2 di Pascasarjana Institut
Pertanian Bogor pada Program Studi Sains Veteriner, lulus pada tahun 1998. Pada tahun
2007, kembali melanjutkan pendidikan S-3, dan diterima pada Mayor Ilmu-ilmu Faal dan
Khasiat Obat, Sekolah Pascasarjana, Institut Pertanian Bogor, dengan mendapatkan
beasiswa dari Badan Penyelenggara Program Pendidikan Pascasarjana (BPPS), Departemen
Pendidikan Nasional. Selain itu penulis juga mendapatkan dana bantuan penelitian melalui
Program Hibah Bersaing dari DP2M DIKTI pada tahun 2010 dan 2011.
Penulis bekerja sebagai dosen di Jurusan Budidaya Perairan Fakultas Perikanan dan
Ilmu Kelautan Universitas Riau, dari tahun 1989 sampai sekarang. Bidang studi yang
diajarkan adalah Parasit dan Penyakit Ikan dan Avertebrata Air.
Selama mengikuti program S-3, penulis telah menulis beberapa karya ilmiah antara lain, berjudul “Imunisasi Ikan Jambal Siam dengan Vaksin Ichthyophthirius multifiliis”
yang diterbitkan pada Jurnal Veteriner. Jurnal Kedokteran Hewan Indonesia 2010.11(3). “Respons Fisiologis Ikan Jambal Siam (Pangasius hypopthalamus) pada Suhu Media Pemeliharaan yang Berbeda” diterbitkan pada Berkala Perikanan Terubuk 39 (1) Feb 2011. ISSN. Kedua tulisan ini merupakan penelitian pendahuluan untuk disertasi, yang didanai
oleh DP2M DIKTI melalui proyek penelitian Hibah Bersaing tahun 2007 dan 2008. Karya
ilmiah selanjutnya merupakan bagian dari disertasi dengan judul “Respons Fisiologis dan
xiii
Morfologi dan Siklus Hidup Ichthyophthirius multifiliis 18
Patogenitas Ichthyophthirius multifiliis 20
Vaksinasi 21
Metode Pemberian Vaksin 21
Faktor yang Mempengaruhi Keberhasilan Vaksinasi 23 Klasifikasi dan Habitat Ikan Mas (Cyprinus carpio L) 24
xiv
Abstract 45
Pendahuluan 45
Bahan dan Metode 47
Hasil 49
Pembahasan 60
Kesimpulan 64
Daftar Pustaka 64
RESPONS STRES IKAN MAS (Cyprinus carpio L) AKIBAT PEMBERIAN VAKSIN Ichthyophthirius multifiliis PADA SUHU MEDIA PEMELIHARAAN YANG BERBEDA
Abstract 67
Pendahuluan 67
Bahan dan Metode 68
Hasil 72
Pembahasan 83
Kesimpulan 87
Daftar Pustaka 87
PEMBAHASAN UMUM 91
KESIMPULAN DAN SARAN 95
DAFTAR PUSTAKA 97
xv
1. Rataan nilai parameter fisiologis ikan mas yang dipelihara pada
suhu media yang berbeda 31
2. Rataan nilai hematologis ikan mas yang dipelihara pada suhu
media yang berbeda 33
3. Rata-rata kualitas air dari setiap perlakuan selama pengamatan 36
4. Rataan nilai gambaran darah ikan mas yang diinfeksi dengan ich
dan dipelihara pada suhu yang berbeda 50
5. Persentase nilai diferensiasi sel leukosit ikan mas yang diinfeksi
dengan ich dan dipelihara pada suhu yang berbeda 54
6. Rataan kadar kortisol dan glukosa ikan mas yang diinfeksi dengan
ich dan dipelihara pada suhu yang berbeda 56
7. Nilai osmolaritas ikan mas yang diinfeksi dengan ich dan dipelihara
pada suhu yang berbeda 57
8. Rataan persentase prevalensi ich dan sintasan ikan mas yang diinfeksi
dengan ich dan dipelihara pada suhu yang berbeda 60
9. Nilai parameter hematologis ikan mas yang diberi vaksin ich 68
10. Persentase nilai diferensiasi sel leukosit ikan mas yang diberi
vaksin ich 73
11. Kadar kortisol dan kadar glukosa ikan mas yang diberi vaksin ich 76
12. Rataan nilai osmolaritas plasma ikan mas yang diberi vaksin ich 80
13. Hasil uji imobilisasi pada serum ikan mas yang diberi vaksin ich 81
xvi
1. Kerangka berpikir penelitian 4
2. Interaksi ikan dengan faktor fisika, kimia, dan biologi 6
3. Mekanisme peningkatan kadar kortisol dalam darah 10
4. Mekanisme peningkatan kadar glukosa plasma 11
5. Mekanisme kortisol menghambat pembentukan antibody 12
6. Perlindungan nonspesifik dan spesifik dari serangan agen infeksius 15
7. Proses pembentukan antibodi 16
8. Interaksi antara makrofag, antigen, dan limfosit pada ikan 16
9. Siklus hidup Ichthyophthirius multifiliis 19 10. Kadar kortisol ikan mas hasil interaksi pada level hari dan
suhu media pemeliharaan yang berbeda 31
11. Kadar glukosa ikan mas hasil interaksi pada level hari dan suhu
media pemeliharaan yang berbeda 32
12. Kadar hemoglobin ikan mas hasil interaksi pada level hari dan suhu
media pemeliharaan yang berbeda 33
13. Kadar hematokrit ikan mas hasil interaksi pada level hari dan suhu
media pemeliharaan yang berbeda 33
14. Total eritrosit ikan mas hasil interaksi pada level hari dan suhu
media pemeliharaan yang berbeda 35
15. Rataan total leukosit ikan mas yang dipelihara pada suhu
media yang berbeda 35
16. Persentase sintasan ikan mas pada akhir pengamatan 36
17. Kadar hemoglobin ikan mas hasil interaksi pada level hari
pengamatan dan suhu media setelah diinfeksi dengan ich 50
18. Nilai hematokrit ikan mas hasil interaksi pada level hari
pengamatan dan suhu media setelah diinfeksi dengan ich 51
19. Total eritrosit ikan mas hasil interaksi pada level hari
pengamatan dan suhu media setelah diinfeksi dengan ich 52
20. Total leukosit ikan mas hasil interaksi pada level hari
pengamatan dan suhu media setelah diinfeksi dengan ich 53
21. Persenase limfosit ikan mas hasil interaksi pada level hari
pengamatan dan suhu media setelah diinfeksi dengan ich 54
22. Persentase monosit ikan mas hasil interaksi pada level hari
xvii
24. Kadar kortisol ikan mas hasil interaksi pada level hari
pengamatan dan suhu media setelah diinfeksi dengan ich 56
25. Kadar osmolaritas ikan mas hasil interaksi pada level hari
pengamatan dan suhu media setelah diinfeksi dengan ich 58
26. Preparat histologis insang ikan mas 72 jam pascainfeksi 59
27. Kadar hemoglobin ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 73
28. Nilai hematokrit ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 74
29. Total eritrosit ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 74
30. Total leukosit ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 75
31. Nilai limfosit ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 76
32. Nilai monosit ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 77
33. Nilai neutrofil ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 78
34. Kadar kortisol ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 79
35. Kadar glukosa ikan mas hasil interaksi pada level hari dan
suhu setelah diberi vaksin ich dan diuji tantang dengan ich 80
36. Nilai osmolaritas ikan mas hasil interaksi pada level hari dan
xviii
1. Gejala ikan terinfeksi Ichthyophthirius multifiliis dan ciri-ciri
2. Ichthyophthirius multifiliis 109
3. Menghitung kepadatan sel theront dari Ichthyophthirius multifiliis 109 4. Histopatologi insang ikan mas akibat diinfeksi dengan Ich 110
5. Prosedur pembuatan vaksin ich dan uji viabilitas terhadap sel theront 111
6. Prosedur uji imobilisasi 112
7. Analisis ragam kadar kortisol ikan mas yang dipelihara pada
suhu media yang berbeda 113
8. Analisis ragam kadar glukosa ikan mas yang dipelihara pada
suhu media yang berbeda 114
9. Analisis ragam nilai hematokrit ikan mas yang dipelihara pada
suhu media yang berbeda 115
10. Analisis ragam kadar hemoglobin ikan mas yang dipelihara
pada suhu media yang berbeda 116
11. Analisis ragam total eritrosit ikan mas yang dipelihara pada
suhu media yang berbeda 117
12. Analisis ragam total leukosit ikan mas yang dipelihara pada
suhu media yang berbeda 118
13. Analisis ragam kadar hemoglobin ikan mas yang diinfeksi
dengan ich 119
14. Analisis ragam nilai hematokrit ikan mas yang diinfeksi
dengan ich 120
15. Analisis ragam total eritrosit ikan mas yang diinfeksi
dengan ich 120
16. Analisis ragam total leukosit ikan mas yang diinfeksi
dengan ich 121
17. Analisis ragam nilai limfosit ikan mas yang diinfeksi dengan ich 121
18. Analisis ragam nilai monosit ikan mas yang diinfeksi dengan ich 122
19. Analisis ragam nilai neuterofil ikan mas yang diinfeksidengan ich 122
20. Analisis ragam kadar kortisol ikan mas yang diinfeksi dengan ich 123
21. Analisis ragam kadar glukosa ikan mas yang diinfeksi dengan ich 123
22. Analisis ragam untuk nilai osmolaritas ikan mas yang
xix
25. Analisis ragam nilai hematokrit ikan mas yang diberi vaksin dan
diuji tantang dengan ich 125
26. Analisis ragam kadar hemoglobin ikan mas yang diberi vaksin
dan diuji tantang dengan ich 126
27. Analisis ragam total eritrosit ikan mas yang diberi vaksin
dan diuji tantang dengan ich 126
28. Analisis ragam total leukosit ikan mas yang diberi vaksin
dan diuji tantang dengan ich 127
29. Analisis ragam nilai limfosit ikan mas yang diberi vaksin
dan diuji tantang dengan ich 128
30. Analisis ragam nilai monosit ikan mas yang diberi vaksin
dan diuji tantang dengan ich 129
31. Analisis ragam nilai neuterofil ikan mas yang diberi vaksin
dan diuji tantang dengan ich 129
32. Analisis ragam kadar kortisol ikan mas yang diberi vaksin
dan diuji tantang dengan ich 130
33. Analisis ragam kadar glukosa ikan mas yang diberi vaksin
dan diuji tantang dengan ich 130
34. Analisis ragam nilai osmolaritas ikan mas yang diberi vaksin
dan diuji tantang dengan ich 131
35. Analisis ragam prevalensi ikan mas yang diberi vaksin
dan diuji tantang dengan ich 131
36. Analisis ragam sintasan ikan mas yang diberi vaksin
PENDAHULUAN
Latar Belakang
Usaha budi daya ikan mas telah banyak dilakukan masyarakat secara
intensif, baik yang dipelihara di kolam, keramba, maupun jaring apung. Usaha
intensif ini biasanya dilakukan dengan kepadatan tinggi dan pemberian pakan
yang maksimal agar ikan tumbuh dengan cepat. Namun, usaha ini sering juga
mengalami kegagalan karena adanya serangan penyakit. Kegagalan akibat
penyakit ini bisa mencapai 30-90%, bahkan dapat mencapai 100% apabila kondisi
lingkungan ekstrim dan adanya mikroorganisme patogen di perairan (Supriyadi
dan Komaruddin 2003).
Kendala utama dalam pengembangan usaha budi daya ikan air tawar
adalah penyediaan benih yang masih terbatas, baik kualitas maupun kuantitas.
Salah satu penyebab timbulnya kendala tersebut adalah karena tingginya angka
kematian pada saat masih berukuran benih. Angka kematian atau mortalitas bisa
mencapai 80–100% yang disebabkan oleh serangan parasit, bakteri, virus, dan
jamur (Nigrelli et al. 1976). Salah satu penyakit yang kerap menyerang adalah Ichthyophthiriasis atau “White Spot”. Penyakit ini disebabkan oleh parasit
golongan protozoa (Ichthyophthirius multifiliis). Parasit ini menyerang organ ikan bagian luar, seperti kulit, sirip, insang, dan mata, yang akibatnya dapat
menimbulkan kematian pada ikan peliharaan, terutama yang masih berukuran
benih, dengan laju kematian mencapai 100% dalam waktu relatif singkat
(Matthews 2005).
Keberadaan parasit ich di perairan akan lebih mudah penyebarannya
apabila diikuti oleh padat penebaran yang tinggi, sedangkan faktor lingkungan
yang sangat berpengaruh pada perkembangan parasit ich adalah suhu. Suhu
merupakan faktor pengontrol di perairan karena dapat mempengaruhi siklus hidup
dan ukuran parasit ich, selain itu juga mempengaruhi kadar oksigen terlarut dan
NH3 di dalam air.
Pengendalian penyakit ichthyophthiriasis ini sudah dilakukan dengan
menggunakan bahan kimia, namun cara ini tidak efektif apabila ich telah
melakukan penetrasi ke kulit dan insang. Selain itu, bahan tersebut tidak dapat
adalah tercemari lingkungan dan produk makanan (Xu et al. 2007). Kesulitan dalam mengatasi penyakit tersebut dikarenakan siklus hidup ich sangat
dipengaruhi oleh perubahan suhu lingkungan pemeliharaan. Selain pengendalian
suhu, usaha lain untuk mengatasi hal tersebut di atas adalah melakukan
pencegahan dengan cara pemberian vaksin ich.
Suhu merupakan salah satu faktor penyebab stres pada ikan. Perubahan
suhu pada media pemeliharaan akan sangat berpengaruh pada semua proses
fisiologis ikan, seperti laju pernapasan, metabolisme, denyut jantung, dan sirkulasi
darah di dalam tubuh (Nofrizal et al. 2009). Ikan yang mengalami stres akan menunjukkan peningkatkan sekresi katekolamin dan kortisol (Berne dan Levy
1988). Kedua hormon tersebut pada kadar yang tinggi akan berpengaruh negatif
pada sistem imunitas ikan. Hal ini disebabkan karena meningkatnya kortisol
dalam plasma akan menurunkan aktivitas sel-sel leukosit. Akibatnya, kekebalan
ikan akan menurun sehingga rentan terinfeksi oleh bakteri, virus, parasit, dan
jamur. Dengan demikian, infeksi dapat menimbulkan kematian dalam jumlah
yang banyak.
Perumusan Masalah
Kondisi lingkungan pada kegiatan budi daya intensif sering bermasalah
karena luasan wadah yang digunakan terbatas, kepadatan ikan dalam wadah
pemeliharaan tinggi, dan pemberian pakan yang banyak. Dengan demikian,
banyak dihasilkan sisa pakan yang tidak termanfaatkan dan feses ikan yang
kemudian menumpuk di dasar perairan. Kondisi ini akan memicu penurunan
kualitas air, dan sebagai akibatnya dapat meningkatkan populasi mikroorganisme
patogen yang sebetulnya juga sudah ada di perairan tersebut. Akibat kondisi
perairan yang buruk ini, ikan akan mengalami stres dan kondisi fisiologisnya
terganggu sehingga memicu terjadinya penurunan fungsi kekebalan tubuh.
Dengan demikian, ikan mudah terinfeksi oleh mikroorganisme patogen, seperti
parasit, bakteri, jamur, dan virus. Akibatnya, angka mortalitas ikan menjadi tinggi,
terutama pada saat ikan masih di kolam pendederan atau saat awal pemeliharaan
di kolam pembesaran. Kematian umumnya disebabkan oleh kegagalan ikan
Berdasarkan hal tersebut di atas maka perlu dicari suatu alternatif untuk
pencegahan agar usaha budi daya intensif tetap berhasil. Pemberian vaksin pada
ikan merupakan salah satu upaya untuk meningkatkan kekebalan ikan terhadap
suatu penyakit. Dengan demikian, angka sintasan dapat ditingkatkan dan pada
akhirnya produksi dapat meningkat.
Penelitian tentang penyakit Ichthyophthiriasis yang disebabkan oleh
parasit Ichthyophthirius multifiliis di Indonesia jarang sekali dilakukan. Sejauh ini penelitian-penelitian lebih banyak mengkaji tentang patogenitas dan cara
pen-cegahan penyakit yang disebabkan oleh bakteri dan virus yang biasa menyerang
ikan, sedangkan tentang parasit sangat jarang dilakukan. Penelitian ini tidak hanya
mengkaji patogenitas I. multifiliis, pencegahan dengan pemberian vaksin, tetapi juga mengkaji kondisi fisiologis ikan akibat patogenitas I. multifiliis dan pemberian vaksin serta pengaruh suhu media pemeliharaan yang berbeda.
Suhu perairan sangat mempengaruhi kondisi fisiologis ikan dan siklus
hidup parasit ich. Suhu dapat menimbulkan stres pada ikan dan juga dapat
mempengaruhi sistem kekebalan sehingga ikan rentan terhadap serangan ich.
Pengaturan suhu media pemeliharaan dan pemberian vaksin dapat memperbaiki
kualitas hidup ikan. Salah satu keberhasilan dalam pemberian vaksin ke ikan
juga sangat ditentukan oleh suhu lingkungan.
Tujuan Penelitian
1. Mengkaji respons stres pada ikan mas yang dipelihara pada suhu media yang
berbeda
2. Mengkaji respons stres pada ikan mas yang diinfeksi dengan Ich thyophthirius multifiliis dan dipelihara pada suhu media yang berbeda 3. Mengkaji respons stres pada ikan mas akibat diberi vaksin I. multifiliis dan dipelihara pada suhu media yang berbeda
Manfaat Penelitian
Manfaat penelitian ini adalah sebagai dasar untuk pengembangan
Kebaruan (Novelty)
Penggunaan stadia theront sebagai vaksin dari Ichthyophthirius multifiliis
yang diinaktifkan dapat mencegah terjadinya infeksi yang disebabkan oleh I. multifiliis.
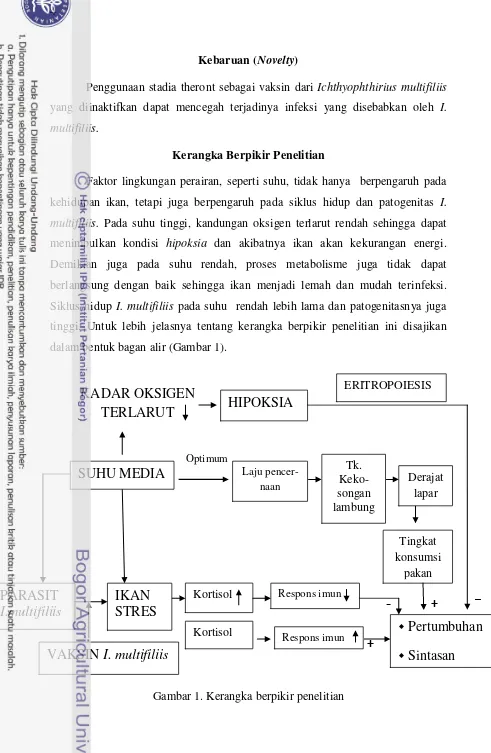
Kerangka Berpikir Penelitian
Faktor lingkungan perairan, seperti suhu, tidak hanya berpengaruh pada
kehidupan ikan, tetapi juga berpengaruh pada siklus hidup dan patogenitas I. multifiliis. Pada suhu tinggi, kandungan oksigen terlarut rendah sehingga dapat menimbulkan kondisi hipoksia dan akibatnya ikan akan kekurangan energi. Demikian juga pada suhu rendah, proses metabolisme juga tidak dapat
berlangsung dengan baik sehingga ikan menjadi lemah dan mudah terinfeksi.
Siklus hidup I. multifiliis pada suhu rendah lebih lama dan patogenitasnya juga tinggi. Untuk lebih jelasnya tentang kerangka berpikir penelitian ini disajikan
TINJAUAN PUSTAKA
Adaptasi Ikan terhadap Lingkungan
Ikan telah berevolusi sehingga cara beradaptasi dengan lingkungan
berbeda dari hewan teresterial. Adanya sisik, sirip, dan lendir (mukus) pada
permukaan tubuh dapat melindungi ikan dari gangguan eksternal. Ikan memiliki
6-8 sirip, dengan adanya sirip-sirip ini akan memudahkan ikan bergerak maju dan
mundur. Karena air memiliki kepadatan molekul yang tinggi, yaitu 800 kali lebih
padat dibandingkan udara, maka ikan memerlukan sejumlah besar kekuatan otot.
Sisik yang ada melekat erat pada kulit dan ditutupi lendir berfungsi untuk
melindungi kulit dari cedera dan infeksi. Ikan-ikan yang tidak bersisik telah
berevolusi dengan tanpa sisik, tetapi memiliki duri tajam di beberapa bagian sirip,
yang berfungsi untuk melindungi diri dari predator. Adanya lendir di atas sisik
sangat efektif untuk menghambat pelekatan dan melumpuhkan serangan
mikroorganisme patogen, mengurangi gesekan, dan memudahkan pergerakan.
Suhu pada lingkungan akuatik relatif stabil sehingga hewan yang hidup di
dalamnya tidak mengalami permasalahan yang serius terhadap perubahan suhu
lingkungan. Pelepasan panas dari tubuh ikan terutama melalui insang. Kelebihan
panas pada hewan akuatik akan diserap oleh air sehingga suhu tubuh ikan akan
stabil dan relatif sama dengan suhu air di sekitarnya. Pada hewan teresterial, suhu
tubuh selalu berubah dengan variasi cukup besar. Cara hewan teresterial
mengatur suhu tubuhnya yaitu dengan cara konduksi, konveksi, radiasi, dan
evaporasi (Hoar 1984).
Suhu dapat mempengaruhi proses fisiologis dan biokimia pada beberapa
hewan, termasuk ikan. Pengaruh suhu tersebut, antara lain mempengaruhi asupan
makanan, laju metabolisme, proses enzim, fungsi membran, dan sintesis protein
(Wedemeyer 1996). Selanjutnya dilaporkan bahwa perubahan suhu dalam waktu
yang lama, baik terhadap suhu rendah atau tinggi, dapat mempengaruhi kondisi
fisiologis dan biokimia dan secara umum proses ini dinamakan aklimatisasi suhu.
Faktor yang Mempengaruhi Kesehatan Ikan
Perubahan faktor lingkungan harus direspons oleh ikan. Respons ikan
mempertahankan hidupnya, termasuk di dalamnya agar dapat tumbuh dan
berkembang biak. Faktor lingkungan dapat mempengaruhi kesehatan dan kondisi
fisiologis ikan. Faktor lingkungan tersebut dapat dikelompokkan dalam tiga
faktor, yaitu faktor fisika, kimia, dan biologi. Interaksi antara ketiga faktor
lingkungan tersebut diilustrasikan pada Gambar 2 (Wedemeyer 1996).
Faktor kimia (kualitas air) - Kandungan oksigen
- Toksin metabolit (NH3, CO2)
Faktor biologi - Mikroorganisme patogen dan nonpatogen
Faktor Fisika - Suhu - Kepadatan
- Cahaya
Gambar 2. Interaksi ikan dengan faktor fisika, kimia, dan biologi (Wedemeyer 1996)
Faktor Fisika
Suhu perairan mempunyai kaitan yang cukup erat dengan besarnya
intensitas cahaya yang masuk ke dalam suatu perairan. Besarnya intensitas cahaya
akan menentukan derajat panas, yakni semakin banyak sinar matahari yang masuk
maka semakin tinggi suhu air. Namun, semakin bertambahnya kedalaman air
maka akan menurun suhu perairan. Suhu yang terdeteksi di permukaan air
dipengaruhi oleh keadaan meteorologi, seperti curah hujan, penguapan,
dalam Purnamawati 2009). Kedalaman perairan merupakan parameter penting untuk kelayakan luasan wadah usaha budi daya ikan. Hal ini juga terkait dengan
kualitas air, seperti suhu, kecerahan, dan kecepatan arus.
Suhu merupakan salah satu faktor lingkungan yang dapat menimbulkan
stres pada ikan. Stres adalah ketidak mampuan suatu organisme mempertahankan
kondisi homeostasis akibat terganggunya individu tersebut oleh adanya
rang-sangan dari luar yang dinamai dengan stresor (Kubilay dan Ulukoy 2002). Suhu
juga dapat mempengaruhi daya tahan berenang ikan dan denyut jantung ikan
Trachurus japonicus, yaitu 25.3 denyut per menit pada suhu 10°C, 38.9 pada suhu
15°C, dan 67.2 denyut per menit pada suhu 22°C. Denyut jantung juga meningkat
dengan meningkatnya kecepatan renang ikan (Nofrizal et al. 2009).
Kepadatan atau padat tebar yang tinggi di suatu wadah pemeliharaan ikan
dapat mengakibatkan berkurangnya oksigen terlarut, terjadinya akumulasi
ammonia yang berasal dari sisa metabolisme, dan banyaknya feses yang
menumpuk. Hal ini dapat menyebabkan menurunnya kualitas air, dan berdampak
buruk pada ikan yang ditandai dengan tingginya kadar kortisol dan kadar glukosa
pada ikan (Ortuno et al. 2002). Kepadatan adalah salah satu penyebab stres pada ikan tilapia dan terjadi peningkatan kadar glukosa setelah 2 jam pengurungan
yang ditandai dengan terjadinya proses glikogenolisis.
Faktor Kimia
Ikan memerlukan energi untuk melakukan aktivitas, seperti berenang,
pertumbuhan, dan reproduksi. Kebutuhan ikan akan oksigen bergantung pada laju
metabolisme, dan pada dasarnya terkait dengan suhu air dan ukuran ikan. Ikan di
air hangat lebih banyak membutuhkan oksigen dibandingkan ikan di air dingin.
Konsumsi oksigen pada ikan kecil lebih banyak per unit bobot badan
dibandingkan ikan besar (Wedemeyer 2001).
Proses pengambilan oksigen dan pelepasan karbon dioksida dinamakan
respirasi. Masuknya oksigen melalui insang dengan cara memompakan air terus
menerus, menyebabkan terjadinya pergerakan oksigen ke dalam pembuluh kapiler
darah insang yang jumlahnya ribuan. Pergerakan ini terjadi karena adanya
pembuluh darah kapiler, sehingga oksigen akan berdifusi ke pembuluh darah
kapiler. Apabila oksigen telah berdifusi dalam darah maka akan berikatan dengan
Fe++ yang terkandung dalam hemoglobin. Hemoglobin bertanggung jawab untuk
mengatur PO2 di dalam jaringan. Tekanan oksigen di dalam kapiler jaringan tidak
lebih dari 40 mmHg. Apabila PO2 lebih tinggi dari 40 mmHg, oksigen yang
diperlukan oleh jaringan tidak dapat ke luar dari hemoglobin (Fujaya 2004).
Pengikatan oksigen oleh hemoglobin di dalam darah, kemudian dibawa ke
jaringan dipengaruhi oleh faktor lingkungan, seperti suhu (Nielsen 1997).
Konsentrasi oksigen dalam air dipengaruhi oleh laju difusi dari udara,
fotosintesis oleh tumbuhan air, dan respirasi organisme perairan. Jika fitoplankton
di perairan melimpah, konsentrasi oksigen akan tinggi hingga sore hari.
Konsentrasi oksigen yang dihasilkan dari proses fotosintesis berlangsung pada
siang hari dengan bantuan cahaya matahari. Pada malam hari, konsumsi oksigen
meningkat, karena semua organisme hidup memanfaatkan oksigen untuk respirasi
akibatnya pada pagi hari konsentrasi oksigen rendah (Tucker 1993). Kelarutan
oksigen dalam air menurun dengan meningkatnya suhu dan salinitas. Ketersediaan
oksigen di perairan sering menjadi faktor pengontrol dalam kehidupan ikan. Ikan
yang mengalami kekurangan oksigen atau dalam kondisi hipoksia akan
mengalami penurunan nafsu makan, energi yang dihasilkan sedikit sehingga
pergerakan juga lambat (Randall et al. 2004).
Banyak permasalahan pada kegiatan budi daya intensif baik langsung
maupun tidak langsung, pada perubahan patofisiologi darah dan sistem
sirkulasinya. Sebagai contoh, insang yang terinfeksi parasit dapat berakibat
terjadinya penyempitan kapiler dan kerusakan struktur anatomi lamella sekunder
insang, akibatnya terjadi gangguan pernapasan. Apabila ikan dalam kondisi stres
akibat penanganan, maka produksi epinefrin dapat meningkatkan sirkulasi darah
ke insang sehingga terjadi peningkatan pengambilan oksigen dari air (Wedemeyer
1996).
Faktor Biologi
Interaksi antara ikan dan organisme lain di dalam lingkungan wadah
pemeliharaan harus dapat dikendalikan, terutama terhadap agen yang dapat
pakan alami, seperti cacing tubifex. Faktor lain yang juga dapat mengganggu
kenyamanan ikan adalah pemangsa, seperti adanya burung pemakan ikan.
Pemangsa ini dapat membantu penyebaran penyakit ke dalam perairan (Woo et al.
2002).
Kondisi lingkungan perairan yang subur karena terjadinya ledakan
populasi alga (algae bloom), dapat berdampak buruk pada usaha budi daya. Pada umumnya algae bloom hanya melibatkan spesies tunggal dan sering dinamai berdasarkan warna koloni algae penyebabnya. Alga Microcystis (bluegreen algae) adalah alga air tawar yang dapat menimbulkan gangguan pada ikan dan hewan perairan, karena dapat menurunkan kadar oksigen di perairan dan toksin
yang dihasilkan alga tersebut dapat mengganggu pernapasan (Irianto 2005).
Respons Ikan terhadap Suhu
Respons stres pada ikan secara umum dapat dikategorikan ke dalam tiga
kelompok, yaitu respons stres primer, sekunder, dan tersier (Iwama dan Nakanishi
1996). Respons stres primer ditandai dengan pelepasan hormon katekolamin dan
kortisol ke dalam sirkulasi sehingga kadar kortisol di dalam plasma meningkat
dan merupakan indikator utama stres. Hormon katekolamin berasal dari jaringan
chromaffin, sedangkan kortisol berasal dari jaringan interrenal. Respons stres
sekunder sering juga dikatakan sebagai efek metabolik yang ditandai dengan
meningkatnya kadar glukosa plasma. Respons stres tersier adalah apabila ikan
tidak mampu untuk melakukan aklimasi atau beradaptasi terhadap stressor, maka
ikan akan mengalami gangguan pertumbuhan dan reproduksi. Mekanisme
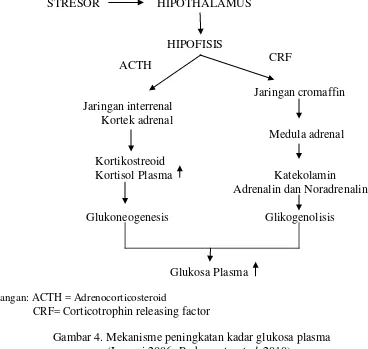
peningkatan kadar kortisol diilustrasikan pada Gambar 3 dan kadar glukosa
STRESOR HIPOTHALAMUS
HIPOFISIS
ACTH
Jaringan cromaffin Jaringan interrenal
Kortek adrenal
Medula adrenal
Kortikostreoid
Kortisol Plasma Katekolamin Adrenalin dan Noradrenalin
Glukoneogenesis Glikogenolisis
Glukosa Plasma
Keterangan: ACTH = Adrenocorticosteroid
CRF= Corticotrophin releasing factor
Gambar 4. Mekanisme peningkatan kadar glukosa plasma (Isnaeni 2006: Purbayanto et al. 2010)
Kadar kortisol yang tinggi dapat mempengaruhi respons imun, yang
di-tandai dengan menurunnya aktivitas fagositik leukosit, meningkatnya pelepasan
neutrofil dari sumsum tulang, namun efektivitasnya menurun (Berne dan Levy
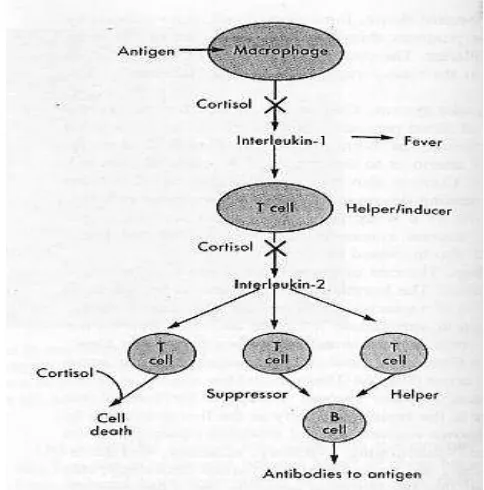
1988). Selanjutnya juga dikatakan bahwa kortisol menghambat produksi
inter-leukin-1 oleh makrofag dan interleukin-2 oleh sel T helper. Mekanisme kortisol
menghambat produksi interleukin disajikan pada Gambar 5.
Ikan yang mengalami stres berkepanjangan dapat berisiko tinggi untuk
terinfeksi bakteri dan parasit (Costas et al. 2008). Jorgensen dan Buchmann (2007) menjelaskan bahwa meningkatnya kadar kortisol dapat menyebabkan ikan
dalam kondisi kronis atau akut selama diinfeksi dengan Ichthyophthirius- multifiliis. Stres menyebabkan terjadinya hiperglisemia, kondisi ini diperlukan
Gambar 5. Mekanisme kortisol menghambat pembentukan antibodi
(Berne dan Levy 1988)
Keberhasilan transfer glukosa ke dalam sel sangat ditentukan oleh kinerja
insulin. Apabila kinerja insulin meningkat, maka masuknya glukosa ke dalam sel
akan lebih efektif sehingga glukosa segera tersedia sebagai sumber energi.
Naiknya transfer glukosa ke dalam sel yang disebabkan oleh peran kromium
mengakibatkan turunnya glukosa dalam darah dengan cepat (Hastuti 2004). Hal
ini dijelaskan karena kortisol dapat menyebabkan terjadinya immunosupresif.
Pelepasan kortikosteroid dan katekolamin, memicu terjadinya peningkatan
glukosa plasma dan gangguan osmotik (Mazeaud et al. 1977 dalam Shrimton et al. 2001).
Suhu air dikenal sebagai suatu regulator penting dari respons kekebalan
ikan. Suhu lingkungan yang rendah dapat meningkatkan penekanan respons imun
baik pertahanan nonspesifik maupun spesifik (Koeypudsa dan Jongjareanjai
2010). Selanjutnya Bozorgnia et al. (2011) juga melaporkan bahwa suhu
berpengaruh signifikan pada proses fisiologis ikan, seperti respons imun,
pertumbuhan dan metabolisme. Suhu normal untuk ikan beradaptasi di daerah
pertumbuhan berkisar antara 25-31⁰C (Popma dan Masser 1999 dalam Atli dan
Canli 2008).
Suhu dapat mempengaruhi aktivitas Na+K+-ATPase dan morfologi insang
ikan air tawar maupun air laut. Pola perubahannya, pada ikan air tawar lebih
konsisten apabila dibandingkan dengan ikan air laut (Evans dan Claiborne 2006).
Na+K+-ATPase berperan penting pada saat adaptasi terhadap perubahan faktor
suhu dan salinitas (Inman dan Lockwood 1977 dalam Atli dan Canli 2008).
Sistem Kekebalan pada Ikan
Ikan termasuk hewan vertebrata yang sistem pertahanannya mirip dengan
hewan mamalia dan burung. Sistem pertahanannya dikelompokkan ke dalam dua
kategori, yaitu sistem pertahanan bawaan dari lahir (innate) dan sistem pertahanan yang didapatkan (adaptive). Perlindungan didasarkan atas kekebalan bawaan
(innate immunity) secara umum tidak bergantung pada struktur organisme yang menyerang. Namun, komponennya bereaksi cepat dan relatif tidak bergantung
pada suhu. Ikan memiliki kemampuan respons imun nonspesifik dan spesifik
(humoral) yang diperantarai sel (cell-mediated immune response) (Woo 2006).
Sistem Kekebalan Nonspesifik
Sistem kekebalan nonspesifik adalah jika inang memberikan respons yang
sama terhadap berbagai jenis antigen, baik antigen berkontak untuk pertama kali
dengan inang maupun yang sudah berulang, tanpa menimbulkan respons memori
pada tubuh inang. Jika suatu individu terpapar oleh bahan asing maka yang
pertama kali akan merespons adalah sistem pertahanan bawaan atau nonspesifik.
Kulit dan mukus, merupakan sistem pertahanan fisik pertama (kekebalan
non-spesifik) pada ikan yang dapat mencegah masuknya mikroorganisme patogen
(Stoskopf 1993). Keuntungan lainnya dari kulit adalah dapat mempertahankan
osmolaritas terhadap lingkungan perairan (Ellis 1988). Selanjutnya dilaporkan
mukus atau lendir yang terdapat pada permukaan tubuh ikan, juga berfungsi untuk
menghambat kolonisasi mikroorganisme pada integumen.
Mukus pada kulit dihasilkan oleh sel-sel goblet, yang berfungsi untuk
mencegah menempelnya bakteri, fungi, parasit, dan virus. Mukus mengandung
sistem kekebalan nonspesifik. Baru-baru ini ditemukan antibodi yang dihasilkan
sebagai akibat infeksi parasit dan bakteri di lendir dan antibodi yang dihasilkan
bukan berasal dari serum, tetapi dihasilkan oleh limfosit yang terdapat pada kulit.
Molekul humoral pada mukus ikan ini termasuk lektin (kharbohidrat), transferin,
dan merupakan komponen dari sistem komplemen. Sel-sel nonspesifik dari sistem
imun ikan termasuk monosit atau makrofag jaringan, granulosit (heterofil), dan
sitotoksit (Craig et et al. 2005). Selanjutnya, Douglas et al. (2001) melaporkan bahwa mukus yang terdapat di kulit dan usus juga mengandung bahan
antimikrob, yaitu berupa peptida, seperti pleurosidin. Bahan ini diekpresikan pada
hari pertama hingga hari ketiga setelah menetas, dan diduga memegang peranan
penting dalam kehidupan ikan sebelum berkembangnya sistem kekebalan.
Lisozim mempunyai aktivitas antibakteri (khususnya pada Gram positif) yang
menyebabkan lisis dan dapat juga berperan sebagai opsonin (Ellis 1988). Lisozim
juga dilaporkan dapat meningkatkan fagositosis (Engstad et al. 1992). Mekanisme sistem kekebalan ini tidak menunjukkan spesifisitas terhadap bahan asing dan
mampu melindungi tubuh terhadap berbagai jenis patogen.
Ikan yang dipelihara pada suhu 20οC mempunyai aktivitas dan produksi
komplemen yang meningkat bila dibandingkan dengan yang dipelihara pada suhu
5 dan 10οC. Namun, peningkatan aktivitas komplemen ini apakah akibat
peningkatan produksi protein komplemen atau perubahan fungsi protein
komplemen pada ikan yang dipelihara pada suhu tinggi belum diketahui
(Nikoskelainen et al. 2004). Selanjutnya dilaporkan juga bahwa terjadi penurunan aktivitas hemolitik dari serum ikan channel catfish pada musim semi dan musim dingin. Demikian juga dengan kemampuan opsonisasi plasma ikan menurun pada
pemeliharaan di suhu rendah. Efisiensi opsonisasi plasma ikan rainbow trout lebih efisien pada kisaran suhu 10–15οC, dengan rasio OZ (Opsonisasi Zymozan) dan
NOZ (Non Opso-nisasi Zymozan) tidak lebih dari 1.0 (Nikoskelainen et al. 2004).
Sistem Kekebalan Spesifik (humoral)
Kekebalan spesifik atau humoral erat kaitannya dengan pembentukan
antibodi. Perkembangan respons ikan terhadap kekebalan nonspesifik, spesifik,
dan memori kekebalan sepesifik diilustrasikan pada Gambar 6. Apabila agen
akan terstimulasi dan menghambat serangan agen infeksi. Jika sistem kekebalan
nonspesifik ini dapat bekerja dengan baik, maka penyakit tidak akan berkembang.
Sebaliknya, apabila sistem ini tidak bisa melawan antigen yang masuk maka
penyakit akan berkembang. Untuk mengatasi hal ini maka mekanisme pertahanan
spesifik akan berperan dalam proses penyembuhan dan memblok perkembangan
infeksi. Selanjutnya, apabila terinfeksi kembali, maka sistem kekebalan memori
spesifik akan langsung merespons sehingga ikan terlindungi dari penyakit.
Gambar 6. Perlindungan nonspesifik dan spesifik dari serangan agen infeksius (www. dsm.com/en_VS/downloads/dnp/51644_vitaminC.pdf).
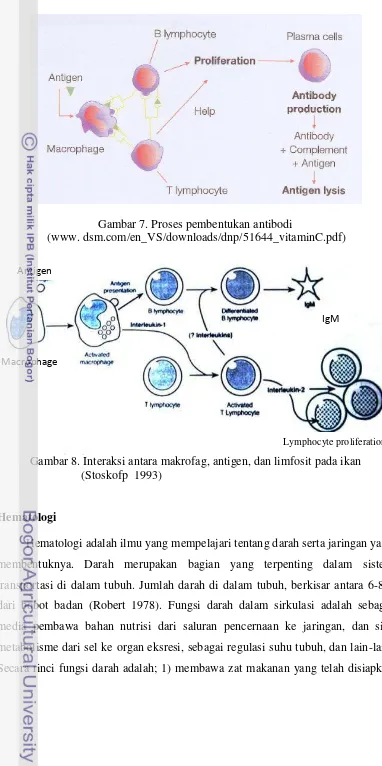
Mekanisme pertahanan spesifik dalam pembentukan antibodi adalah
dimulai dari adanya antigen yang masuk kemudian ditelan oleh makrofag,
selanjutnya makrofag akan mengaktivasi sel limfosit B untuk melakukan
pro-liferasi. Makrofag diaktivasi juga untuk menghasilkan interleukin-1 yang
kemudian akan mengaktifkan sel limfosit T untuk kembali memproduksi
interleukin-2, yang mendukung terjadinya proliferasi sel-sel limfoblas dan
men-stimulasi sel limfosit B untuk menghasilkan immunoglobulin. Ikan hanya
mensintesis satu jenis immunoglobulin, yaitu immunoglobulin M (IgM) Stoskopf
1993. IgM lebih efisien dari pada IgG dalam aktivasi komplemen, opsonisasi
netralisasi dari virus, dan aglutinasi (Tizar 1987). Mekanisme pembentukan
antibodi mulai dari hadirnya antigen hingga terbentuknya antibodi diilustrasikan
Gambar 7. Proses pembentukan antibodi
(www. dsm.com/en_VS/downloads/dnp/51644_vitaminC.pdf)
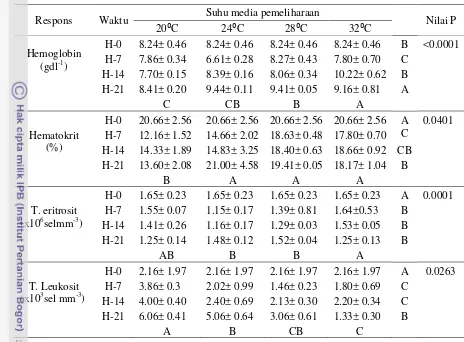
Gambar 8. Interaksi antara makrofag, antigen, dan limfosit pada ikan (Stoskofp 1993)
Hematologi
Hematologi adalah ilmu yang mempelajari tentang darah serta jaringan yang
membentuknya. Darah merupakan bagian yang terpenting dalam sistem
transportasi di dalam tubuh. Jumlah darah di dalam tubuh, berkisar antara 6-8%
dari bobot badan (Robert 1978). Fungsi darah dalam sirkulasi adalah sebagai
media pembawa bahan nutrisi dari saluran pencernaan ke jaringan, dan sisa
metabolisme dari sel ke organ eksresi, sebagai regulasi suhu tubuh, dan lain-lain.
Secara rinci fungsi darah adalah; 1) membawa zat makanan yang telah disiapkan
Lymphocyte proliferation
Macrophage Antigen
oleh saluran pencernaan menuju ke seluruh jaringan tubuh, 2) membawa oksigen
ke jaringan, 3) membawa karbon dioksida dari jaringan, 4) membawa produk
buangan dari berbagai jaringan untuk diekresikan, 5) membawa hormon dari
kelenjar endokrin ke organ lain, 6) berperan penting dalam pengendalian suhu
tubuh, 7) berperan dalam mempertahankan keseimbangan air, 8) berperan dalam
sistem buffer untuk membantu mempertahankan pH, 9) penggumpalan atau
pembekuan darah sehingga dapat mencegah terjadinya kehilangan darah yang
berlebihan pada saat luka, dan 10) mengandung berbagai faktor penting untuk
mempertahankan tubuh dari serangan penyakit (Anderson dan Swicki 1995;
Iwama dan Nakanishi 1996).
Darah ikan terdiri atas sel darah merah (eritrosit) dan sel darah putih
(leukosit). Eritrosit merupakan bagian utama dari sel darah, warna merah
disebabkan oleh adanya hemoglobin. Hemoglobin merupakan zat warna (pigmen)
darah yang berupa ikatan kompleks protein terkonjugasi, yang dibentuk oleh
pigmen dan protein sederhana. Protein ini adalah suatu histon yang disebut globin.
Warna merah dari hemoglobin disebabkan oleh heme, yaitu suatu ikatan metalik
mengandung sebuah atom besi (Fe) (Swenson 1984 dalam Hidayaturrahmah 2011).
Produksi hemoglobin dipengaruhi oleh kadar Fe di dalam tubuh karena besi
merupakan komponen terpenting dalam pembentukan molekul heme. Jika tidak
terdapat transferin dalam jumlah yang cukup akan menyebabkan kegagalan dalam
pengangkutan zat besi menuju eritroblast. Hal ini dapat menimbulkan kondisi
anemia hipokromik yang berat, yaitu terjadinya penurunan jumlah eritrosit yang
mengandung lebih sedikit hemoglobin (Guyton dan Hall 1997).
Nilai hematokrit adalah suatu istilah yang digunakan untuk menyatakan
persentase (berdasarkan volume) dari darah yang terdiri atas sel-sel darah merah.
Nilai hematokrit dapat digunakan sebagai perkiraan jumlah eritrosit di dalam
tubuh secara cepat. Jika nilai hematokrit dalam darah rendah maka dapat diartikan
bahwa jumlah sel darah merah di dalam tubuh lebih sedikit dibandingkan dengan
kondisi normal (Foster et al. 2006).
Leukosit merupakan salah satu sel darah yang mempunyai peran sangat
memiliki kemampuan bergerak bebas dan mampu keluar dari pembuluh darah
menuju jaringan dalam melakukan fungsinya. Jumlah leukosit jauh di bawah
eritrosit dan bervariasi bergantung pada jenis hewannya. Jumlah leukosit yang
menyimpang dari keadaan normal mempunyai arti klinik penting dalam
mengevaluasi gangguan kesehatan. Jumlah leukosit akan meningkat secara pesat
dalam waktu singkat apabila terjadi suatu penyakit infeksi ( Iwama dan Nakanishi
1996). Sel leukosit, terdiri atas limfosit, monosit, neutrofil, dan trombosit dengan
fungsi yang berbeda-beda.
Morfologi dan Siklus Hidup Ichthyophthirius multifiliis
Ichthyophthirius multifiliis (ich) adalah parasit golongan protozoa yang biasa menyerang ikan air tawar pada usaha budi daya intensif. Patogenitas ich
dapat menyebabkan mortalitas hingga 100%. Parasit ini bersifat obligat dan
hidup atau tinggal di bawah epitelium kulit, insang, dan sirip, serta memakan
jaringan inangnya (Lobo-da-Cunha dan Azevedo 1990). Ichthyophthirius-multifiliis bentuknya bundar, seluruh permukaan tubuh ditutupi oleh silia yang berguna untuk bergerak dan melakukan penetrasi ke lapisan epidermis ikan. Ich
memiliki sejumlah vakuola, mikro dan makro nukleus. Makro nukleus bentuknya
seperti tapal kuda yang merupakan ciri khas dari I. multifiliis. Stadia trophozoid dari I. multifiliis berukuran 0.5-1cm, sedangkan theront berukuran
25-70x15-22μm (Lom dan Dykova 1992).
Ich stadia dewasa dinamakan trophozoid dan akan lepas dari tubuh ikan,
dinamakan trophont. Trophont akan mensekresikan gelatin dan membentuk kista.
Trophont tersebut akan bergerak secara perlahan dan mulai melakukan
pembelahan sel secara binary fision. Trophont akan menghasilkan theront yang jumlahnya berkisar antara 250-2.000 sel (Lom dan Dykova 1992). Kemampuan
trophont menghasilkan theron sangat bergantung pada ukuran trophozoid dan
lamanya berada di tubuh ikan (Ewing dan Kocan 1986). Siklus hidup ich terdiri
atas tiga fase, yaitu fase hidup bebas (theront), fase bersifat parasit (trophozoid),
dan fase reproduksi (trophont) (Lobo-da-Cunha dan Azevedo1994). Theront yang
dihasilkan akan langsung bergerak aktif mencari inang (host), apabila tidak menemukan inang dalam waktu maksimal 94 jam theront akan mati. Siklus hidup
Faktor lingkungan, seperti suhu, sangat berpengaruh pada siklus hidup ich. Pada
suhu 10oC siklus hidup lebih kurang 20 hari, pada suhu 13-15⁰C menjadi 12 hari,
pada suhu 18–20οC turun menjadi 7 hari, dan pada suhu 22–24οC adalah 3–6 hari.
Faktor lain yang berpengaruh adalah pH, dan kandungan oksigen. pH di bawah 5
atau di atas 10, dan konsentrasi oksigen 0.2 mgL-1 akan menyebabkan kematian
ich pada semua stadia (Lom dan Dykova 1992). Siklus hidup ich diliustrasikan
pada Gambar 9.
Gambar 9. Siklus hidup Ichthyophthirius multifiliis Noga (2000) Keterangan : a. Trophozoid, b. Trophont, c. Theront
Suhu yang optimum bagi ich (stadia theront) untuk melakukan invasi ke
ikan adalah pada suhu 24–26οC, sedangkan pada suhu 29οC I. multifiliis tidak mampu menginfeksi ikan. Hal ini terbukti dari ikan yang terinfeksi ich ditularkan
ke ikan sehat yang dipelihara pada suhu 29οC tidak terjadi infeksi, sebaliknya ikan
yang sebagai sumber infeksi ini jadi sembuh (Syawal et al. 2001).
Penyebaran penyakit ini dipicu oleh adanya peningkatan aktivitas budi
daya dan perdagangan ikan hias. Patogenitasnya meningkat apabila ikan dalam
kondisi stres akibat tingginya populasi ikan dalam wadah pemeliharaan, kualitas
air yang buruk, dan mutu pakan yang rendah (Paperna 1996 dalam Woo et al.
2002). Penyakit ichthyophthiriasis biasanya berkembang apabila suhu air relatif
hangat dan ikan dalam kondisi stres akibat kandungan oksigen rendah, atau
kepadatan ikan tinggi (Woo 2006). Jutaan ikan mati pada usaha budi daya
al. 2006). Kasus ini sering terjadi pada sistem budi daya tertutup, seperti di kolam dan akuarium, serta adanya ikan baru yang membawa parasit ich (Maki 2002).
Patogenitas Ichthyophthirius multifiliis
Theront melakukan penetrasi dan perporasi ke dalam epitel kulit ikan
di-mungkinkan oleh adanya enzim yang dihasilkan ich, yaitu enzim hialuronidase.
Enzim hialuronidase selain digunakan untuk merobek dinding sel trophont agar
theront dapat keluar, juga digunakan untuk melarutkan lapisan zat tanduk dari
sisik sehingga ich dapat masuk ke dalam lapisan epitel (Stanley 1995). Parasit ich
menyerang epitel insang dan kulit sehingga menimbulkan kerusakan dan
akibatnya keseimbangan osmotik terganggu (Witeska et al. 2010).
Xu et al. (2000) melaporkan bahwa theront adalah stadia infektif dari ich yang menyerang ikan Lepomis macrochirus, kemudian menempel dan berkembang menjadi trophozoid, serta bergerak secara memutar pada jaringan
epidermis ikan tersebut. Lebih dari 88% theront dapat menempel pada sirip,
insang, dan kulit setelah satu jam pascainfeksi. Theront berkembang menjadi
trophozoid dan meningkat diameternya dari 27.21μm menjadi 30+3.1 μm setelah
4 jam pascainfeksi pada organ insang. Peningkatannya, sebesar 9.6% dengan
rata-rata 1.2% / jam dari 4 sampai 8 jam pascainfeksi.
Patogenitas ich dimulai ketika theront sudah menempel pada permukaan
kulit atau insang, maka ich mulai melakukan perforasi ke bagian epidermis.
Selanjutnya ich mengeluarkan enzim yang bersifat racun bagi jaringan sehingga
terbentuk nekrosis pada lapisan spongosum pada dua jam pascainfeksi. Kemudian
nekrosis berkembang hingga ke lapisan kompaktum, 3–48 jam pascainfeksi.
Dengan demikian, sistem osmoregulasi terganggu dan keseimbangan ion-ion di
dalam tubuh menjadi tidak stabil sehingga berakhir dengan kematian (Mulyana
1999). Ikan yang terinfeksi berat dapat menimbulkan reaksi inflamasi pada kulit,
terjadinya peningkatan hiperplasia pada sel-sel epitel, dan secara umum juga
meningkatkan jumlah sel-sel mukus pada kulit (Hines dan Spira 1974 dalam
Dickerson 2006). Selanjutnya dilaporkan bahwa hasil pengamatan histopatologi
Vaksinasi
Vaksin
Vaksin merupakan sediaan antigen yang diperoleh dari mikroorganisme
patogen atau substrat yang merupakan produk dari patogen tersebut dan bersifat
immunogenik, antigenik, dan protektif yang kemudian dilemahkan atau dimatikan
(Kamiso 1996). Suatu vaksin bersifat immunogenik apabila dapat merangsang
pembentukan antibodi. Idealnya suatu vaksin adalah harga relatif murah, mudah
diberikan, aman terhadap ikan maupun lingkungan, dan efektif dapat
meningkatkan kekebalan ikan (Stoskopf 1993).
Vaksinasi adalah suatu proses pemasukan antigen ke dalam tubuh untuk
mendapatkan kekebalan spesifik dan nonspesifik sehingga tanggap terhadap jenis
patogen tertentu (Kamiso 1996). Ellis (1988) melaporkan bahwa respons
kekebalan yang timbul setelah vaksinasi adalah respons spesifik (humoral), sesuai
dengan jenis antigen yang diberikan. Selanjutnya dilaporkan juga bahwa vaksin
tidak menimbulkan dampak negatif berupa munculnya jenis patogen yang resisten
dan tidak menyebabkan akumulasi di dalam tubuh. Secara umum ada dua jenis
vaksin, yaitu vaksin hidup (aktif) dan inaktif. Vaksin hidup bisa berasal dari
parasit, seperti menggunakan ich stadia trophont maupun stadia theront,
sedangkan vaksin inaktif didapatkan dengan cara melemahkan atau mematikan
bakteri, parasit, dan virus.
Perkembangan vaksin parasit lebih lambat bila dibandingkan dengan
perkembangan vaksin dari bakteri dan virus. Ada beberapa alasan kenapa vaksin
parasit sulit untuk dikembangkan. Pertama, karena kesulitan dalam memanipulasi
parasit protozoa dan helmin di laboratorium. Kedua, kesulitan dalam mengkultur
baik secara in vivo maupun in vitro. Ketiga, pada hakikatnya parasit mempunyai siklus hidup yang komplit dan melibatkan beberapa inang atau host (Ellis 1988).
Metode Pemberian Vaksin
Vaksinasi pada ikan dapat dilakukan dengan cara penyuntikan pada bagian
intramuskular atau intraperitoneal, pencelupan, perendaman, penyemprotan
bertekanan tinggi, dan secara oral, yaitu melalui pakan. Aplikasi vaksinasi dengan
lain karena dapat dilakukan pada berbagai ukuran serta dalam jumlah yang banyak
(Ellis 1988). Pemberian vaksin dengan cara penyuntikan biasanya dilakukan pada
ikan berukuran besar atau induk, sedangkan ikan yang berukuran kecil dengan
cara perendaman. Anderson 1974 dalam Ellis 1988 melaporkan bahwa pemberian vaksin secara penyuntikan di bagian intraperitoneal lebih baik, karena antigen
cepat diserap, namun perlu dilakukan secara cermat agar tidak mengena usus.
Pemberian vaksin melalui oral juga ada kelemahannya, karena antigenik yang
diberikan dapat mengalami kerusakan di dalam saluran pencernaan (Austin dan
Austin 1987 dalam Stoskopf 1993).
Ling et al.(1993) melaporkan bahwa induk ikan tilapia yang divaksin dengan 0.1 mL garam fisiologis yang mengandung 2.3x105 sel theront dapat
memberikan hasil sintasan yang tertinggi, yaitu 95.3% pada anak ikan tilapia,
setelah dilakukan uji tantang (pemaparan) dengan ich stadia theront. Selanjutnya
ikan channel catfish yang diimunisasi dengan theront hidup, baik secara perendaman maupun diinjeksikan secara intraperitonium (i.p.), maupun trophont
yang telah disonikasi kemudian diberikan secara injeksi di bagian
intraperitonium (i.p.), dapat memberikan respons kekebalan humoral dan
memberikan perlindungan terhadap parasit ich setelah dilakukan uji tantang (Xu
et al. 2004). Hasil penelitian juga dilaporkan bahwa semua ikan yang diimunisasi
dengan theront hidup, baik secara perendaman maupun dengan cara injeksi
menghasilkan lebih dari 90% ikan yang diimunisasi secara injeksi intraperitonium
(i.p.) dengan trophont yang disonikasi berhasil hidup setelah diuji tantang dengan
theront. Ikan kontrol tidak mendapatkan perlindungan sehingga terjadi mortalitas
100%. Syawal dan Siregar (2010) juga telah melaporkan bahwa pemberian vaksin
sel utuh dari theront yang diinaktifkan dengan pemanasan, dan diberikan ke ikan
jambal siam secara perendaman dengan dosis 3mLL-1 selama 15 menit dapat
menghasilkan sintasan hingga 100% setelah dilakukan uji tantang.
Ikan rainbow trout yang diimunisasi dengan trophont yang disonikasi dan diberikan secara injeksi di bagian intraperitonium (i.p.) dengan dosis rata-rata 10–
20 trophont per gram ikan, memperlihatkan tingkat infeksi lebih rendah
dibandingkan dengan ikan yang diimunisasi secara perendaman atau yang tidak
cutaneous (bagian kulit) pada ikan yang diimunisasi pada penelitian ini. Informasi
lain adalah 2 dari 20 ikan yang diimunisasi dengan trophont yang disonikasi dan
diberikan secara injeksi secara intraperitonium terlihat adanya trophont setelah 5
hari diuji tantang dengan theront (Dalgaard et al. 2002).
Ikan mas (Carassius auratus) yang diimunisasi dengan theront hidup baik secara perendaman maupun diinjeksi, dapat melindungi ikan pada level yang
tinggi dari infeksi ich setelah dilakukan uji tantang. Pada ikan Carassius auratus
yang diimunisasi dengan trophont baik yang disonikasi maupun yang tidak
diso-nikasi dan pemberiannya secara injeksi, maka hasilnya lebih rendah dari ikan
yang diimunisasi dengan trophont yang disonikasi maupun yang tidak disonikasi
dan diberikan secara perendaman (Osman et al. 2009).
Faktor yang Mempengaruhi Keberhasilan Vaksinasi
Pemberian vaksin kepada ikan sudah banyak dilakukan, terutama vaksin
yang berasal dari antigen bakteri dan virus. Namun, vaksin yang berasal dari
parasit jarang dilakukan karena isolat dan media kulturnya belum tersedia.
Dengan demikian akan mengalami kesulitan untuk mendapatkan antigen dalam
jumlah yang banyak. Demikian juga halnya dengan parasit Ichthyophthirius multifiliis, karena ich adalah parasit obligat pada ikan sehingga hanya bisa didapatkan dari ikan hidup. Jadi untuk mendapatkan ich sebagai antigenik dalam
skala besar untuk membuat vaksin mengalami kesulitan ( Dickerson 2006).
Keberhasilan pemberian vaksin untuk meningkatkan kekebalan terhadap
suatu penyakit pada ikan sangat dipengaruhi oleh suhu lingkungan pemeliharaan.
Pada suhu rendah, terjadi penekanan mekanisme kekebalan nonspesifik, humoral,
dan sel yang diperantari. Dengan demikian, pada suhu rendah antibodi yang
terbentuk lebih lama dan kadarnya juga rendah. Sebaliknya, pada suhu tinggi,
pembentukan antibodi lebih cepat dan kadarnya juga tinggi (Stoskopf 1993). Suhu
rendah dapat menurunkan kapasitas opsonisasi dalam serum. Opsonisasi pada
serum ikan rainbow trout akan lebih efisien pada suhu 10 dan 15οC (Nikoskelainen et al. 2004). Selanjutnya juga dikatakan bahwa pada suhu rendah akan menyebabkan terjadinya penekanan imun (imunosupresif), sehingga akan mempengaruhi terbentuknya titer antibodi. Ikan rainbow trout yang diberi vaksin