SAYU PUTU YUNI PARYATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Antibodi Anti-idiotipe sebagai Kandidat Vaksin Rabies adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Desember 2006
rabies. Di bawah bimbingan I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO dan FACHRIYAN HASMI PASARIBU.
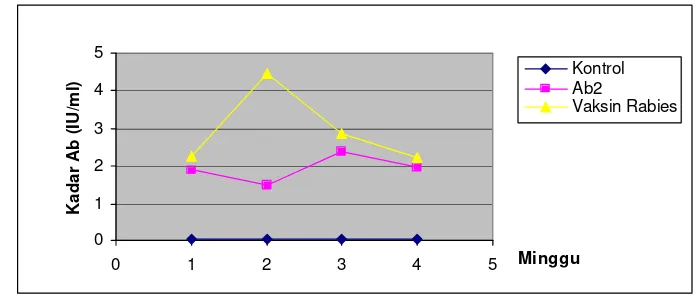
Serum anti rabies (SAR) yang diproduksi pada kuda, disebut antibodi 1 (Ab1) digunakan untuk mengimunisasi ayam. Imunoglobulin ayam (IgY) anti-Ab1 merupakan antibodi anti-idiotipe (Ab2) terhadap rabies, dipanen dari darah ayam setiap minggu selama 10 minggu. Rata-rata titer Ab2 tertinggi diperoleh pada minggu ketiga dan keempat pasca vaksinasi. Pemurnian IgY (Ab2) dilakukan melalui pengendapan dengan amonium sulfat jenuh konsentrasi 60% dan 50%, dilanjutkan dengan dialisis menggunakan PBS pH 8,0 selama 24 jam pada suhu 2 – 8 oC. Pemurnian tahap berikutnya dengan kolom kromatografi afinitas spesifik terhadap IgY, menghas ilkan protein dengan berat molekul 185.000, 95.000 dan 49.000 dalton. Sebanyak 3 ekor kelinci New Zealand White diimunisasi dengan Ab2 dan 3 ekor kelinci lainnya sebagai kelompok kontrol. Pemeriksaan serum kelinci (Ab3) dengan teknik Agar Gel Presipitation Test (AGPT), menunjukkan Ab3 bereaksi homolog dengan Ab2 dan virus rabies. Reaksi juga memperlihatkan pola reaksi identitas sebagian (partial identity) antara Ab2 dan virus, menunjukkan bahwa tidak semua dari Ab2 yang terbentuk dari responnya terhadap Ab1 mengandung internal image yang dapat menginduksi antibodi spesifik terhadap antigen aslinya. Pengujian serum terhadap kadar antibodi rabies menunjukkan bahwa Ab2 mampu menginduksi respon antibodi lebih dari 0,5 IU/ml mulai minggu pertama sampai keempat pasca vaksinasi.
Kesimpulan dari hasil penelitian ini, yaitu antibodi anti-id iotipe mampu menginduksi tingkat antibodi protektif terhadap virus rabies, sehingga Ab2 dapat digunakan sebagai antigen pengganti dalam imunisasi rabies.
Candidate. Under the direction of I WAYAN TEGUH WIBAWAN, RETNO DAMAYANTI SOEJOEDONO dan FACHRIYAN HASMI PASARIBU.
Anti rabies serum (ARS) called antibody 1 (Ab1) was used as the antigen to immunize laying chickens. Anti-Ab1 chicken immunoglobulins (IgY), the anti-idiotype antibodies against rabies (Ab2) was isolated from chicken blood every week for ten weeks. The highest titer of Ab2 was found at the third week after the last immunization. Immunoglobulin Y was separated by means of ammonium sulfate precipitation, then dialyzed using PBS pH 8.0 for 24 hours at 2 – 8 oC and purified using affinity chromatography column for IgY lead the proteins molecules with 185,000; 95,000 and 49,000 dalton in weigth. Purified IgY was used to immunize New Zealand White rabbit and the antibody response (Ab3) was detected using Agar Gel Precipitation Test (AGPT). The Ab3 showed specific reaction with Ab2 as well as rabies virus. Interestingly, Ab2 and rabies virus express partial identity reaction. This lead the insight, that not all parts of Ab2 are internal image of rabies virus. The efficacy of Ab3 was detected using enzyme linked immunosorbent assay (ELISA) and indicated that the level of Ab3 titer is protective according to WHO standard (more than 0.5 IU/ml).
The conclusion of this study is the anti-idiotype antibody can induce protective immune response against rabies virus and can be used as an alternative for rabies anti-idiotype vaccine.
SAYU PUTU YUNI PARYATI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Disetujui
Komisi Pembimbing
Dr. drh. I Wayan Teguh Wibawan, MS Ketua
Dr. drh. Retno D. Soejoedono, MS. Prof. Dr. drh. Fachriyan H. Pasaribu Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Sains Veteriner
Dr. drh. Bambang P. Priosoeryanto, MS. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
Tuhan Yang Maha Esa, karena atas berkah dan rahmatNya penulis dapat menyelesaikan penyusunan disertasi sebagai tugas akhir untuk menyelesaikan pendidikan program doktor di Program Studi Sains Veteriner pada Sekolah Pascasarjana IPB. Dalam penelitian ini, penulis mengambil judul : Antibodi Anti-idiotipe sebagai Kandidat Vaksin Rabies”.
Penulis menyampaikan penghargaan dan hormat serta terima kasih yang tulus kepada dosen pembimbing, yaitu Bapak Dr. drh. I Wayan Teguh Wibawan, MS., Ibu Dr. drh. Retno D. Soejoedono, MS. dan Bapak Prof. Dr. drh. Fachriyan H. Pasaribu yang telah membantu, membimbing, memberikan pengarahan dan semangat kepada penulis mulai dari rencana mengikuti pendidikan, selama mengikuti pendidik an, persiapan dan pelaksanaan penelitian hingga penyusunan disertasi ini.
Terima kasih penulis sampaikan kepada Pimpinan Proyek BPPS Dikti, Departemen Pendidikan Nasional RI yang telah memberikan beasiswa kepada penulis selama mengikuti pendidikan. Ucapan terima kasih penulis sampaikan juga kepada Ibu drh. Lia Siti Halimah, M.Si. dan staf di laboratorium Uji Hewan PT. Bio Farma Bandung, atas segala bantuan yang telah diberikan. Demikian juga kepada Bapak drh. I Dewa Made Ngurah Dharma, M.Sc., Ph.D. selaku Kepala Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan (BBPMSOH) di Gunung Sindur, Bogor beserta staf, penulis menyampaikan terima kasih atas bantuan dan kesempatan yang diberikan untuk menggunakan fasilitas laboratorium.
Kepada Ibunda dan Ayahanda I Gusti Kayan Suparta (alm.), Ibunda dan Ayahanda I Gusti Ngurah Mecutan, adik-adik tercinta serta seluruh keluarga, penulis menyampaikan terima kasih yang sedalam-dalamnya dan penghargaan yang setinggi-tingginya atas doa, bimbingan, serta dorongan semangat yang tak pernah berhenti diberikan dalam kehidupan penulis dengan suasana penuh cinta. Terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada suami tercinta, Ir. I Gusti Ngurah Sudira, MSAe., yang dengan penuh rasa kasih, sabar dan penuh pengertian, selalu mendoakan, memberikan dorongan, berkorban dan mendampingi penulis, sehingga penulis dapat mengikuti pendidikan, menyelesaikan penelitian dan disertasi ini. Terima kasih pula untuk anak -anak tercinta, Gusti Ayu Sinta Deasy Andani dan Gusti Ngurah Dananjaya Gandhewa, yang senantiasa memberikan warna serta dorongan dalam kehidupan penulis.
Penulis menyadari, bahwa karya ilmiah ini belum sempurna. Oleh karena itu, dengan rendah hati penulis mohon maaf dan berharap semoga karya kecil ini dapat bermanfaat.
Bogor, Desember 2006
Penulis dilahirkan pada tanggal 4 Juni 1965 di Tabanan, Bali, sebagai putri pertama dari empat bersaudara, dari ayah I Gusti Kayan Suparta (alm.) dan ibu Ni Putu Daning. Pendidikan sarjana dan profesi dokter hewan ditempuh di Program Studi Kedokteran Hewan Universitas Udayana, lulus tahun 1990.
Tahun 1999, penulis memperoleh kesempatan melanjutkan pendidikan program magister di Program Studi Sains Veteriner pada Program Pascasarjana IPB dan menamatkannya pada tahun 2002. Pada tahun dan perguruan tinggi yang sama, penulis memperoleh kesempatan untuk melanjutkan ke program doktor. Beasiswa pendidikan pascasarjana diperoleh dari Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional melalui Biaya Pendidikan Program Pascasarjana (BPPS).
DAFTAR TABEL ... vii
Pengujian Antibodi Kelinci terhadap Virus Rabies dengan Metode Enzyme Linked Immunosorbent Assay (ELISA) ... 29
Pemotongan Imunoglobulin Kuda Anti Rabies ... 32
Imunisasi Kelinc i dengan Antibodi Anti-idiotipe (Ab2) ... 45
Pengujian Serum Kelinci dengan metode AGPT ... 46
Pengujian Antibodi Kelinci terhadap Virus Rabies dengan Metode ELISA ... 50
KESIMPULAN DAN SARAN Kesimpulan ... ... 56
Saran ... 56
DAFTAR PUSTAKA ... 57
LAMPIRAN ... 63
1. End-point proteksi 50% populasi mencit dari SAR ………. 34 2. End-point proteksi 50% populasi mencit dari Serum Referensi ………. 34 3. Titer antibodi anti-idiotipe pada serum ayam diuji dengan AGPT ... 36 4. Hasil pengukuran kandungan imunoglobulin yang telah dimurnikan ….. 44 5. Hasil pengujian serum kelinci (Ab3) terhadap antibodi rabies yang
diuji dengan metode ELISA ... 52 6. Hasil pengujian serum kelinci (Ab3) terhadap antibodi rabies dengan
1. Skema antibodi dengan det erminan isotypic, allotypic dan idiotypic ... 5
2. Skema kaskade idiotipe (Hiernaux 1988) ………... 10
3. Perbedaan struktur IgY dan IgG (Anonim 2002) ... 13
4. Patogenesis Rhabdovir us (Hunt 2004) ……….. 16
5. Skema penyebaran virus rabies (Baron et al. 2004) ………... 17
6. Garis presipitasi pada uji imunodifusi (AGPT) menunjukkan adanya reaksi homolog antara serum anti rabies (Ab1) dengan vaksin rabies ... 32
7. Skema pemotongan imunoglobulin (A) dengan enzym pepsin, menghasilkan fraksi Fc (B) dan fraksi F(Ab)2 (C) ... 33
8. Garis presipitasi (tanda panah) pada uji imunodifusi (AGPT) menunjukkan adanya reaksi homolog antara antiserum ayam (Ab2) dengan SAR (Ab1) ... 35
9. Grafik Titer Antibodi terhadap Ab1 pada Serum Ayam ... 37
10. Proses pengendapan protein dengan amonium sulfat (A), diperoleh endapan berwarna putih (B) ………. 38
11. Proses dialisis larutan protein menggunakan PBS pH 8,0 ……… 39
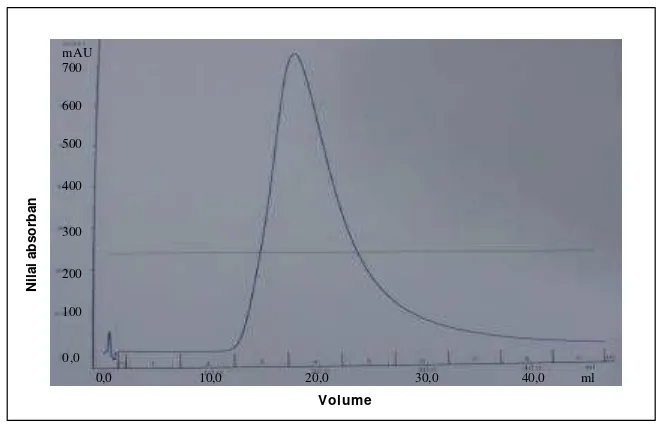
12. Pemurnian dengan kromato grafi afinitas spesifik, IgY terdeteksi pada panjang gelombang 280 nm. ………... 40
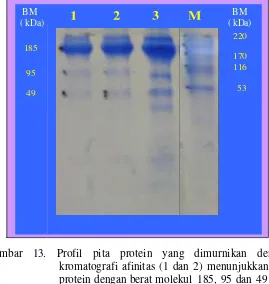
13. Profil pita protein yang dimurnikan dengan kromatografi afinitas (1 dan 2) dan hasil pengendapan dengan amonium sulfat (3) diband ingkan dengan marker (M) ………. 41
14. Pemekatan larutan IgY menggunakan tabung dialisis dan PEG 6000 di sekeliling tabung ……… 42
15. Pembentukan abses steril di tempat penyuntikan pada kelinci yang diimunisasi dengan Ab2 yang diemulsikan dalam CFA ... 46
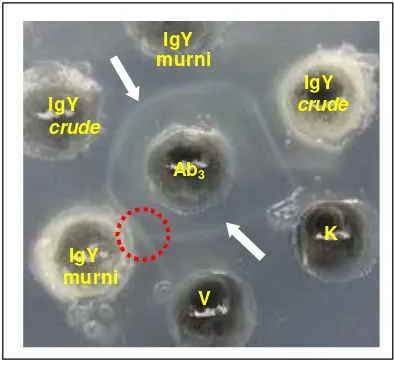
16. Serum kelinci (Ab3) bereaksi spesifik dengan virus rabies (V) dan Ab2, ditunjukkan dengan garis presipitasi (tanda panah) yang membentuk pola reaksi identitas sebagian (tanda lingkaran) antara Ab2 dan virus rabies ... 47
17. Ilustrasi pembentukan Ab3, dimana hanya sebagian Ab3 saja yang mempunyai spesifisitas sama dengan serum asal ... 49
18. Pola nilai OD serum kelinci terhadap titer antibodi rabies yang diuji dengan metode ELISA ... 50
1. Prosedur kerja pada uji potensi serum anti rabies ... 64
2. Contoh perhitungan uji potensi serum kuda anti rabies (SAR) ... 66
3. Reagensia untuk kromatografi afinitas (Fast Protein Liquid Chromatography = FPLC) ... 67
4. Reagensia untuk ELISA ... 68
5. Perhitungan berat molekul protein ... ... 69
6. Tabel 10. Berat molekul protein pada serum ayam ... 70
7. Tabel 11. Rekapitulasi hasil pembacaan nilai OD Ab3 antibodi rabies pada serum kelinci yang diuji dengan metode ELISA .. ... 71
8. Tabel 12 Hasil pembacaan ELISA OD serum kontrol (+) dan (-) pemerikasaan serum kelinci kontrolpada panjang gelombang 414 nm ... 71
9. Kurva standar serum kontrol ... 71
10. Tabel 13 : Hasil pembacaan ELISA serum kelinci kontrol (diimunisasi dengan NaCl fisiologis) dibandingkan OD serum kontrol (+) dan (-) pada panjang gelombang 414 nm ... 71
11. Tabel 14 : Hasil pembacaan ELISA OD serum kontrol (+) dan (-) pemeriksaan serum kelinci yang diimunisasi dengan Ab2 pada panjang gelombang 414 nm ... 72
12. Kurva standar serum kontrol ... 72
13. Tabel 15: Hasil pembacaan ELISA serum kelinci yang diimunisasi dengan Ab2 dibandingkan OD Serum Kontrol (+) dan (-) pada panjang gelombang 414 nm ... 72
14. Tabel 16 Hasil pembacaan ELISA OD serum kontrol (+) dan (-) pemeriksaan serum kelinci yang diimunisasi dengan vaksin rabies pada panjang gelombang 414 nm ... 73
15. Kurva standar serum kontrol ... …... 73
16. Tabel 17. Hasil pembacaan ELISA serum kelinci yang diimunisasi dengan vaksin rabies dibandingkan OD serum kontrol (+) dan (-) pada panjang gelombang 414 nm... 73
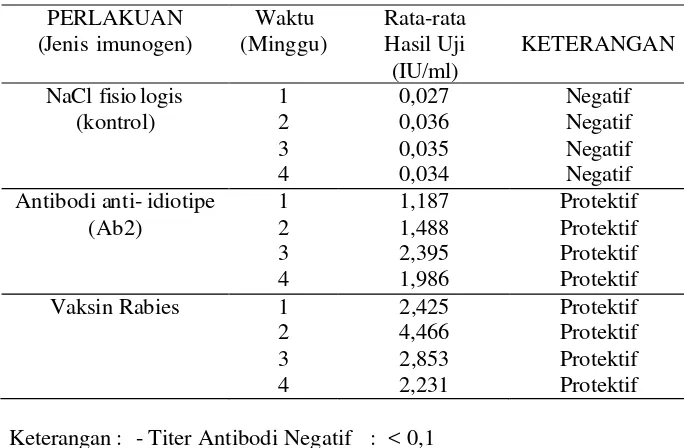
17. Tabel 18. Kadar antibodi spesifik terhadap rabies (Ab3) serum kelinci yang diperiksa dengan metode ELISA. ... 74
Banyak agen penyakit bersifat sangat infeksius dan sulit dibiakkan, menyebabkan penggunaannya sebagai vaksin dan reagen serologis menjadi tidak aman karena dapat menjadi virulen apabila digunakan sebagai vaksin. Agen penyakit yan g sulit dibiakkan juga merupakan salah satu kendala dalam produksi vaksin. Contohnya, adalah dalam produksi vaksin rabies. Penyakit rabies merupakan salah satu penyakit zoonosis yang paling ditakuti dan dapat mengganggu ketenteraman hidup masyarakat, menular akut pada susunan saraf pusat dan dapat menyerang semua hewan berdarah panas, terutama anjing, kucing dan kera, juga manusia. Apabila gejala klinis sudah timbul, selalu diikuti dengan kematian.
Pencegahan rabies terutama dilakukan dengan vaksinasi menggunakan vaksin dari virus rabies yang telah diinaktifkan. Namun, apabila vaksin ini dibuat dari virus virulen, maka terdapat kemungkinan di antara sekian juta dosis vaksin yang dipakai ada yang mengandung virus virulen yang justru dapat menimbulkan kasus penyakit. Kelemahan ini dapat diatasi dengan pemakaian vaksin unit struktur atau vaksin subunit, yang terdiri dari antigen netralisasi virus dan adjuvan. Dengan vaksin ini, resiko seperti pada vaksin hidup dan vaksin inaktif tidak ada, tetapi biasanya vaksin subunit tidak begitu imunogenik. Sedangkan antigen protein yang didapat melalui sintesa kimia atau kloning gen mungkin gagal melipat sesuai konfigurasi molekul asli sehingga struktur epitop antigenik tidak sesuai dengan antigen asli.
lebih sulit dan membutuhkan biaya yang sangat mahal (Singh dan Kumar 2004). Penggunaan bahan -bahan kimia seperti beta propiolacton untuk inaktivasi virus juga dapat menimbulkan efek samping berupa reaksi alergi (WHO 2002).
Vaksinasi pada hewan yang rentan terhadap rabies, termasuk hewan liar yang dapat berperan sebagai penyebar rabies, merupakan strategi penting untuk menekan kasus rabies. Oleh karena itu, pengembangan vaksin yang aman, efektif dan protektifmerupakan tantangan di masa depan. Salah satu alternatif yang dapat dilakukan adalah dengan pengembangan vaksin antibodi anti-idiotipe.
Penggantian antigen dengan antibodi anti-idiotipe dapat menghasilkan imunitas spesifik untuk mencapai tujuan imunisasi. Laporan pertama mengenai antibodi anti-idiotipe yang protektif dalam suatu vaksinasi telah dilaporkan menggunakan mencit yang diinfeksi dengan Trypanosoma. Beberapa kasus penggunaan antibodi anti-id iotipe dalam vaksinasi telah pula dicoba pada berbagai penyakit bakterial, viral dan neoplastik. Thanavala et al. (1985) telah mengidentifikasi dua jenis antibodi anti-idiotipe monoklonal yang menyerupai antigen permukaan hepatitis B dan mempunyai kemampuan mengikat antibodi terhadap hepatitis B pada berbagai spesies. Selain untuk imunisasi aktif, antibodi anti-id iotipe juga dapat menekan pertumbuhan tumor dan mencegah terjadinya kanker (Qian et al. 1997 ; Benvenuti 2000).
sistem imun inang terhadap agen infeksius. Pemberian anti-idiotipe pada simpanse sebelum pemberian antigen HBs mampu meningkatkan titer antibodi terhadap HBs dibandingkan dengan tanpa pemberian anti-idiotipe (Kennedy et al. 1984).
Rumusan Masalah
Sampai saat ini, vaksinasi rabies pada hewan umumnya menggunakan vaksin virus inaktif yang dapat beresiko adanya virus virulen, sangat infeksius dan ganas. Pada manusia, telah pula digunakan berbagai vaksin asal biakan sel manusia maupun hewan serta beberapa vaksin sub unit dan rekombinan, namun masih ditemukan berbagai kendala, seperti adanya efek samping dan biaya produksi yang mahal.
Banyak agen penyakit yang sulit ditumbuhkan atau dibiakkan secara buatan untuk kepentingan pembuatan vaksin menyebabkan produksi vaksin juga dapat terhambat atau membutuhkan biaya yang sangat mahal. Anti-idiotipe merupakan alternatif yang baik untuk vaksin karena dapat mengatasi kesulitan mendapatkan jumlah antigen yang memadai. Hal ini biasa dijumpai pada agen penyebab penyakit yang sangat infeksius yang sulit ditumbuhkan dalam jumlah besar. Antibodi anti-idiotipe yang memiliki karakteristik serologis internal image
dapat diproduksi dalam jumlah banyak dan tidak mengandung resiko adanya agen infeksius.
Maksud dan Tujuan
Maksud dan tujuan penelitian ini adalah :
1. Mempelajari prospek penggunaan antibodi anti-idiotipe sebagai kandidat vaksin untuk pencegahan rabies yang aman, efektif dan protektif.
2. Membandingkan tingkat kekebalan yang dihasilkan oleh vaksin antibodi anti-idiotipe terhadap rabies dengan vaksin virus.
Manfaat Penelitian :
Penelitian ini diharapkan dapat memberikan suatu metode pengembangan antibodi anti-idiotipe yang dapat digunakan sebagai vaksin dan reagen pemeriksaan serologis yang aman, efektif dan protektif.
Hipotesis
1. Antibodi anti-id iotipe rabies merupakan mimikri dan mengandung
internal image dari virus rabies.
2. Antibodi anti-id iotipe rabies bersifat imunogenik dan menginduksi terbentuknya antibodi yang mampu berikatan secara homolog dengan antigen virus rabies.
3. Antibodi anti-idiotipe rabies mampu menginduksi tingkat kekebalan yang lebih tinggi dibandingkan vaksin virus rabies.
TINJAUAN PUSTAKA
Antibodi
Jika hewan terpapar oleh suatu antigen, maka respon imun akan terjadi pada tubuh hewan tersebut. Respon humoral yang terjadi menghasilkan antibodi. Struktur molekul antibodi terdiri dari empat rantai protein berbentuk seperti huruf “Y” yang dihubungkan oleh ikatan d isulfida. Satu molekul antibodi terdiri dari dua pasang rantai polipeptida berat (heavy = H) dan ringan (light = L), masing-mas ing mempunyai daerah variabel (VH dan VL) dan daerah konstan (CH dan CL). Daerah variabel (V) tersusun dari sekitar 110 sampai 130 asam amino, merupakan gugus NH2 sebagai tempat ikatan antara rantai H dan L. Daerah konstan C pada rantai H meliputi daerah aktivasi komplemen dan molekul reseptor Fc dari berbagai jenis sel.
Gambar 1. Skema antibodi dengan determinan isotypic, allotypic dan
idiotypic.
Terdapat tiga kelas determinan antigenik yang diekspresikan oleh daerah V dan C, yaitu : (1) determinan isotypic, membedakan rantai ringan menjadi dua klas, yaitu kappa (?) dan lamda (?), sedangkan rantai berat mempunyai lima isotipe berbeda yang membagi imunoglobulin menjadi lima klas yang berbeda dengan fungsi yang berbeda-beda pula (pada manusia, IgG, IgM, IgA, IgE, IgD) (Saldanha 2000) ; (2) determinan allotypic, dibedakan dari produk gen pada lokus yang sama (IgG1, IgG2a, IgG2b ) ; dan (3) determinan idiotypic, dihubungkan dengan spesifisitas ikatan antigen (Gambar 1).
Allotypic,
variasi asam amino pada lokus yang sama
Idiotypic,
variasi dihubungkan dengan spesifisitas ikatan antigen
Daerah variabel (V) selanjutnya dibagi menjad i daerah hipervariabel (HV) dan daerah framework (FR). Pada rantai berat dan ringan, ditemukan tiga daerah HV (HV1, HV2 dan HV3) dan empat daerah FR yang memiliki rangkaian asam amino yang lebih stabil. Daerah HV juga disebut complementarity determining region (CDR) karena daerah ini merupakan bagian yang mengalami kontak langsung dengan permukaan antigen, mempunyai panjang dan rangkaian asam amino berbeda pada antibodi yang berbeda (Anonim 2000). Hal ini menyebabkan antibodi mempunyai spesifisitas dan afinitas yang berbeda-beda pula terhadap penanda target (target marker) pada antigen. Daerah spesifik untuk berikatan dengan antigen ini disebut paratop dan mengekspresikan beberapa kumpulan idiotop yang mampu meningkatkan produksi antibodi.
Idiotipe
rekombinasi batas segmen V, D dan J untuk menghasilkan berbagai sekuens
junctional (Roitt et al. 1993).
Diversitas antibodi juga dapat terjadi dengan adanya insersi nukleotida pada daerah N dari segmen D dan J, suatu proses yang berhubungan dengan ekspresi terminal deoxynucleotidyl transferase. Cara ini sangat meningkatkan
repertoire gen ? dan d reseptor-T. Sistem imun mempunyai mekanisme pembentukan diversitas lebih lanjut, yaitu pada saat dua rantai yang berbeda digunakan untuk pengenalan molekul. Pada saat ini terjadi kombinasi yang menghasilkan variabilitas baru. Bila satu rantai berat berpasangan dengan rantai ringan yang berbeda, spesifisitas akhir antibodi akan berubah (Roitt et al. 1993).
Antibodi Anti-idiotipe
Kumpulan beberapa idiotop disebut dengan idiotipe (Ab1) yang mampu menginduksi antibodi anti-idiotipe (Ab2) (Lin dan Zhou 1995). Apabila Ab1 murni disuntikkan kepada hewan lain, maka Ab1 akan dikenali sebagai antigen asing dan menimbulkan respon kebal Ab2 yang kuat (Harlow dan Lane 1988; Vizcaino 2004). Antibodi Ab2 dapat mengenali daerah pengikatan antigen pada Ab1 dan dapat berikatan dengan Ab1 sebagaimana halnya Ab1 berikatan dengan antigen (Field et al. 2002), menunjukkan bahwa Ab2 memiliki struktur yang mirip dengan antigen. Selanjutnya, Ab2 dapat menginduksi terbentuknya Ab3 yang dapat mengenali Ab2 dan seterusnya, sehingga pada akhirnya dapat menginduksi terbentuknya serangkaian autoantibodi yang dapat saling mengenali satu sama lain membentuk suatu jaringan idiotipik (Jerne 1985).
Interaksi determinan idiotipe dan antibodi anti-id iotipe dapat mempengaruhi modulasi respon imun, mengaktivasi atau menekan respon imun humoral dan selular (Shoenfeld 2004). Pemberian anti-id iotipe dapat menekan ekspresi idiotipe dan memacu pembentukan idiotipe spesifik limfosit T
yang terjadi seperti antigen asing yang merangsang pembentukan respon imun (Nisonoff 1991).
Teori jaringan idiotipik Jerne (1985) juga menjelaskan, bahwa imunisasi dengan suatu antigen dapat menginduksi bukan hanya antibodi spesifik terhadap antigen (Ab1), tapi juga antibodi yang dapat mengenali Ab1. Hal ini terjadi karena struktur khas (idiotipe) pada daerah pengikatan antigen dari Ab1 mampu menginduksi sistem imun untuk membentuk Ab2 yang meniru struktur antigen eksternal dan bahkan terjadi terhadap antigen sendiri (self antigen) (Roitt et al.
1993 ; Vogel et al. 2000). Melalui mekanisme yang sama, akan terbentuk Ab3. Ab1 dan Ab3 mempunyai kemampuan berikatan yang sama dan dalam beberapa kasus, mempunyai susunan asam amino yang sama pada daerah pengikatan antigennya (Roitt et al. 1993).
Anti-idiotipe yang hanya mengenali satu antibodi saja dikatakan mengenali idiotop pribadi (IdI) dan menyokong pendapat bahwa tiap antibodi mempunyai struktur yang unik. Sering juga molekul antibodi mempunyai struktur asam amino yang sangat mirip satu sama lain sehingga mempunyai idiotipe yang sama. Ini dikenal sebagai idiotipe public (umum) atau idiotipe cross reacting
(IdX). Idiotipe umum juga sering disebut dengan common dan share idiotope. Respon kebal Ab2 yang terbentuk dapat digolongkan berdasarkan topografi target idiotipe menjadi kelompok yang tidak mampu menghambat antigen (antigen -noninhibitable group) (Ab2a) dan kelompok yang mampu menghambat antigen (antigen -inhibitable group) (Ab2ß). Kelompok ketiga disebut dengan Ab2?, merupakan antibodi anti-idiotipe yang mengenali
combinating site id iotop di dekat daerah pengikatan antigen dan mampu menghambat pengikatan antigen dengan pengaruh sterik, tetapi tidak membentuk struktur yang mirip dengan antigen asli. Jadi, hanya Ab2ß dan Ab2? yang dapat menghambat ikatan Ab1 dengan antigen (Ban et al. 1994).
terbatas dalam peningkatan respon imun pada spesies berbeda (Kennedy et al.
1986). Jika Ab2 berikatan di dekat paratop dari antibodi dan reaksinya dapat dihambat oleh antigen karena pengaruh sterik dan allosterik, maka Ab2 ini disebut dengan Ab2? (Guancheng et al. 2001).
Sejumlah Ab2 yang terbentuk akibat responnya terhadap Ab1 dapat mengekspresikan determinan idiotipe yang meniru antigen aslinya, disebut Ab2ß. Antibodi anti-idiotipe Ab2ß mengandung internal image dari antigen eksternal, sehingga disebut juga antibodi internal image (Guancheng et al. 2001). Interaksi antigen dengan Ab1 dapat dihambat oleh Ab2ß, demikian juga interaksi Ab2ß dengan Ab1 dapat dihambat oleh antigen. Antibodi Ab2ß mampu menimbulkan respon antibodi terhadap antigen asli pada hewan lain. Hal ini merupakan indikasi bahwa Ab2 yang dihasilkan mengenali IdX yang berlokasi pada atau dekat antigen
combinating site Ab1 (Zhou et al. 1994). Baik antigen maupun antibodi anti-idiotipe mempunyai tempat ikatan yang sama dan dapat berikatan secara kompetitif dengan idiotipe (Bentley et al. 1990).
Antibodi Ab2ß memiliki struktur idiotipe yang menunjukkan internal
image terhadap epitop antigenik yang dikenali dari Ab1 dan mempunyai kemampuan meniru struktur tiga dimensi determinan antigen atau epitop berdasarkan atas kemiripan struktur kimia hapten dan lekukan idiotop di atas permukaan imunoglobulin. Meskipun merupakan struktur tiga dimensi dari asam amino, namun antibodi internal image juga dapat meniru epitop protein, karbohidrat atau lemak (Ban et al. 1994). Struktur tiga dimensi Ab2ß menunjukkan, bahwa mimikri asam amino terletak pada lekukan antigen binding site dari daerah hipervariabel rantai berat (Luo et al. 2000). Ab2ß meniru struktur antigen melalui proses saling melengkapi (complementary) dan homobodies (R ico dan Hall 1989; Kennedy dan Attanasio 1990). Struktur antigenik yang potensial akan ditiru dan disajikan kembali dengan struktur yang mirip (internal image) oleh idiotipe (Zhou et al. 1991).
(Ab2a, Ab2ß dan Ab2?). Pada Gambar 2 dapat dilihat skema kaskade idiotipe (Hiernaux 1988). Epitop dari suatu antigen asing menginduksi respon imun yang ditandai dengan terbentuknya antibodi Ab1. Selanjutnya, Ab1 menginduksi terbentuknya Ab2 yang mengandung tiga subset, yaitu subset Ab2a , Ab2ß dan Ab2?. Setiap subset dari Ab2 akan menginduksi anti-anti-idiotipe Ab3 yang sangat kompleks dan beragam.
Gambar 2. Skema kaskade idiotipe (Hiernaux 1988).
Suatu molekul antibodi internal image yang tepat dapat menginduksi respon imun yang sama dengan yang ditimbulkan oleh antigen eksternal, sehingga Ab2 merupakan alternatif yang baik untuk vaksin. Antidodi anti-id iotipe yang dihasilkan dari antibodi spesifik terhadap suatu antigen dapat menginduksi respon imun selular (cell-mediated immune response) dan humoral (Kennedy et al.
1987). Respon imun selular ditandai dengan adanya proliferasi limfosit T yang dapat mengenali antigen yang berada pada permukaan molekul major histocompatibility complex (MHC) (Guancheng et al. 2001).
mengaktifkan mekanisme mikrosidal dari makrofag. Di pihak lain, kelompok sel T sitotoksik hanya mengenali antigen dalam keadaan bergabung dengan molekul MHC kelas I. Melalui pengenalan terhadap antigen permukaan ini, sel-sel T sitotoksik menyerang dan membunuh sasarannya. Sel T sitotoksik juga melepaskan ?-interferon yang membantu memperkecil penyebaran virus ke sel-sel lainnya yang berdekatan (Roitt et al. 1993).
Antibodi Anti -idiotipe sebagai Vaksin
Antibodi anti-idiotipe (Ab2) mampu meniru struktur antigenik yang potensial dan memiliki internal image id iotop yang berbeda-beda (Zhou et al.
1991), sehingga dapat digunakan sebagai antigen pengganti dalam pemeriksaan serologis dan mendeteksi antibodi dari spesies hewan berbeda. Jika Ab2 digunakan sebagai imunogen, akan mengakibatkan peningkatan respon antibodi spesifik (Ab3). Idiotipe Ab1 identik dengan Ab3 (Clark et al. 1996). Kekhasan reaksi idiotipe-anti-idiotipe ini digunakan sebagai dasar untuk menghasilkan reagen anti-imunoglobulin spesifik (Harlow dan Lane 1988).
Respon Ab2 yang hanya bereaksi terhadap epitop tunggal agen infeksius mampu memberikan perlindungan protektif terhadap antigen yang memiliki beragam epitop dan dapat mencegah timbulnya autoimun yang akan merusak jaringan inang dan komponen tubuh yang lain apabila digunakan agen penyakit yang memiliki determinan antigenik yang mirip dengan jaringan inang (Kennedy dan Attanasio 1990).
Antibodi anti-idiotipe memiliki karakteristik serologis internal image
(Perosa dan Dammaco 1994), sangat potensial digunakan sebagai imunogen (Fields et al. 2002) dan antigen dalam serodiagnostik, preparasi vaksin (Thanavala
C (SGC) ganas dan dapat digunakan sebagai prekursor awal sistem imun inang terhadap agen infeksius. Pemberian Ab2 pada simpanse sebelum pemberian antigen HBs mampu meningkatkan titer antibodi terhadap HBs dibandingkan dengan tanpa pemberian Ab2 (Kennedy et al. 1984).
Perkembangan anti-id iotipe yang mampu meniru antigen asli sebagai vaksin memiliki keuntungan : (1) vaksin anti-idiotipe dapat meningkatkan respon kebal dari vaksin konvensional yang semula tidak efektif atau lemah (Huang et al.
1988); (2) anti-idiotipe dapat diproduksi dengan mudah dalam jumlah yang banyak; (3) kesulitan yang berhubungan dengan tenaga, biaya dalam penyediaan antigen dari agen penyakit dapat dieliminasi; (4) bahaya penyebaran agen infeksius dalam pelaksanaan di lapangan dapat dihindari (Lin dan Zhou 1995); (5) vaksin idiotop mer angsang klon imun yang toleran dan tersembunyi (McNamara
et al. 1984); (6) dapat digunakan pada pasien immunocompromise yang tidak memberikan respon terhadap vaksin hidup; (7) vaksin anti-idiotipe mampu memberikan kekebalan protektif pada sistem imun prematur (Huang et al. 1988); (8) protektif menghambat penyebaran secara vertikal infeksi suatu mikroorganisme (Kennedy et al. 1996); (9) mengurangi efek klinis yang merugikan dari penggunaan vaksin konvensional (Clark et al. 1996).
Produksi Antibodi Anti -idiotipe pada Ayam
Secara umum sistem imun pada ayam menyerupai s istem imun pada mamalia. Imunoglobulin pada ayam diberi nama imunoglobulin Y (IgY), merupakan salah satu kelas antibodi dalam serum dan kuning telur kelompok amfibi, reptil dan aves. Kemiripan struktur antara IgY dan IgG mamalia menyebabkan IgY disetarakan dengan IgG (Narat 2003).
Gambar 3. Perbedaan struktur IgY dan IgG (Anonim 2002).
Pemilihan ayam untuk produksi Ab2 memiliki beberapa kelebihan, di antaranya adalah karena antibodi ayam (IgY) mempunyai afinitas dan aviditas yang lebih tinggi terhadap protein mamalia; tidak berikatan dengan faktor rheumatoid dan reseptor Fc mamalia; tidak mengaktifkan sistem komplemen mamalia dan tidak berikatan dengan protein A dan G dari Staphylococcus aureus
(Anonim 2004). Hal ini disebabkan karena perbedaan secara struktural pada daerah Fc antara IgY dan IgG, karena fungsi biologi imunoglobulin diaktivasi oleh regio Fc.
Sistem imun ayam sangat responsif terhadap protein asing atau mikroorganisme yang memaparnya, baik sebagai akibat vaksinasi ataupun infeksi alam. Carlander (2002) menyatakan, ayam memiliki sensitivitas tinggi terhadap protein asing, sehingga dengan jumlah sedikit dapat memberikan respon pembentukan antibodi. Keberadaan kelenjar Hadrian di daerah nasotrakheal dan
Bursa Fabricius memungkinkan unggas sangat responsive terhadap berbagai protein asing (Coleman 2000). Secara filogenik, antara ayam dan mamalia mempunyai jarak yang jauh menyebabkan aviditas antibodi ayam lebih tinggi terhadap protein mamalia dibandingkan aviditas antibodi mamalia terhadap protein mamalia. Antibodi ayam dapat mengenali lebih banyak epitop antigenik pada antigen mamalia. Produksi Ab2 pada ayam juga sangat menguntungkan karena respon imun unggas (ayam) terbukti persisten. Antigen mamalia yang
disuntikkan pada ayam mampu menginduksi titer IgY yang tinggi dan bertahan lama pada telur (Gassmann et al. 1990).
Selain itu, IgY dapat diperoleh dari telur tanpa harus menyakiti hewan dan jumlah antibodi yang dihasilkan lebih banyak. Ayam biasanya bertelur 5 sampai 6 butir per minggu dan sebutir kuning telur yang mempunyai volume 15 ml rata-rata mengandung 50 – 100 mg IgY, dimana 2% sampai 10% adalah antibodi spesifik (Schade et al. 1996). Keunggulan lainnya, karena pemeliharaan ayam lebih mudah dan murah.
Virus Rabies
Rabies atau penyakit anjing gila dikenal juga dengan nama Lyssa (Inggris), Rage ( Perancis ), Tolwut ( Jerman ) dan Hydrophobia, adalah infeksi viral akut pada susunan saraf yang ditandai dengan kelumpuhan yang progresif dan berakhir dengan kematian. Penyakit ini menyerang hewan berdarah panas dan manusia. Secara umum, anjing merupakan penular terpenting kasus rabies pada manusia yang biasanya terjadi melalui gigitan hewan terinfeksi rabies (WHO 2002).
Penyebab penyakit ini adalah virus keluarga Rhabdoviridae, berbentuk peluru, berukuran 180 X 75 nm. Struktur virus tersusun dari inti riboprotein (RNA), lemak dan karbohidrat. Genom RNA mengandung 5 jenis protein, yaitu nucleoprotein (N), phosphoprotein (P), matrix protein (M), glycoprotein (G) dan polymerase (L). Virus rabies stabil pada pH 3 – 11 dan dapat hidup beberapa tahun pada suhu –70 0C atau dalam keadaan beku kering yang disimpan pada suhu –4 0C (Baer 1991). Pada jaringan yang disimpan dalam gliserin, virus tahan beberapa minggu pada suhu kamar dan berbulan -bulan pada suhu 4 0C dan dapat diinaktifkan dengan cepat melalui pengawetan dengan cara dikeringkan, pemberian sinar ultra violet dan sinar X, sinar matahari, tripsin, b-propriolakton, ether dan detergen (Wunner 1991).
congkok dan musang. Tetapi yang paling potensial menyebarkan rabies adalah anjing (90%), kucing (6%) dan kera (3%) (Ghosh 1998).
Patogenesis dan Imunitas Rabies
Masa inkubasi rabies pada anjing dan kucing berkisar antara 3 sampai 8 minggu dengan variasi 10 hari sampai 6 bulan . Sedangkan pada ternak seperti sapi, kuda, babi, domba dan kambing, masa inkubasinya berkisar antara 1 sampai 3 bulan dan pada manusia 9 hari sampai beberapa tahun. Masa inkubasi pada manusia berkisar antara 10 hari sampai 3 tahun, dengan rata-rata 1 sampai 3 bulan. Masa inkubasi ini tergantung kepada : 1) jumlah virus yang masuk melalui luka, dapat dilihat dari parah atau tidak serta banyaknya luka; 2) letak luka gigitan, semakin dekat ke otak, semakin pendek masa inkubasinya; 3) persarafan luka gigitan, misalnya gigitan di jari atau genital biasanya diikuti masa inkubasi yang pendek, dan 4) virulensi dari virus rabies (Baer 1991).
Penularan virus rabies biasanya terjadi dari air ludah hewan tertular ke hewan lain. Beberapa cara penularan yang dilaporkan, meliputi kontaminasi membran mukosa seperti mata, hidung dan mulut, melalui udara (aerosol) dan cangkok kornea (Baer 1991). Alves et al. (2003) melaporkan, bahwa virus rabies yang diinokulasikan per oral pada marmut dapat menyebabkan terjadinya infeksi virus pada berbagai organ, seperti otak, paru-paru dan lambung, namun tidak ditemukan adanya antibodi yang mampu melindungi hewan dari tantangan virus. Infeksi virus rabies juga pernah dilaporkan menyebabkan viraemia dengan titer virus rendah, memberikan gambaran awal proses terjadinya penyebaran virus ke berbagai organ (Acha dan Szyfres 1986).
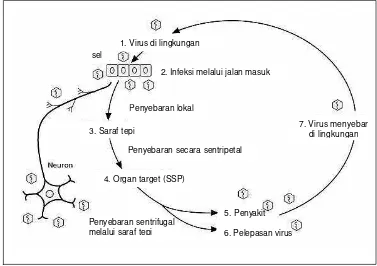
Bila virus bereplikasi secara lokal pada otot ditempat luka gigitan atau pada jaringan ikat, biasanya tidak terlihat adanya gejala klinis. Tetapi, seringkali infeksi yang terjadi disertai dengan invasi ke ujung-ujung saraf tepi kemudian menyebar ke axon saraf menuju susunan saraf pusat (SSP) dan mengakibatkan berbagai tingkatan encephalitis yang dapat berakibat fatal (Anonimus 1997). Pada Gambar 4 dapat dilihat rute perjalanan dan patogenesis Rhabdovirus.
terutama di hypocampus, sel-sel Purkinye dan kelenjar ludah. Di dalam saraf pusat, virus mengalami replikasi perpindahan progeni virus dari sel ke sel yang lain. Penyebaran virus di dalam saraf pusat terjadi dengan cepat, diikuti dengan penyebaran virus ke saraf tepi dan jaringan -jaringan lain, termasuk kelenjar ludah (Baer 1991). Pada anjing, 3 sampai 5 hari sebelum terlihat gejala klinis, kelenjar ludah sudah mengandung virus dan terus infektif selama hewan sakit.
Gambar 4. Patogenesis Rhabdovirus (Hunt 2004).
Selanjutnya, glikoprotein virus akan berikatan secara spesifik dengan reseptor asetilkolin atau neurotransmitter reseptor lainnya menuju ujung-ujung saraf. Virus menyebar sampai ke axon saraf tepi atau bahkan ke saraf pusat (SSP), menyebabkan virus dapat terhindar dari serangan antibodi. Penyebaran virus berlangsung melalui tulang belakang dimana virus bereplikasi. Pada keadaan ini, biasanya muncul gejala klasik rabies, mulai dari peningkatan suhu tubuh, diikuti dengan parasthesia serta kekakuan otot. Selajutnya, hewan menjadi hiperaktif, agresif dan hipersalivasi (furious rabies) (Baron et al. 2004). Virus mencapai tulang belakang dengan kecepatan 8 – 20 mm per hari (Alves et al. 2003). Ketika mencapai SSP, virus bereplikasi di bagian korteks otak dan secara klinis mengakibatkan gejala dumb rabies, yaitu hewan mengalami depresi, koma dan berakhir dengan kematian akibat kesulitan bernafas. Dari otak, virus menyebar secara sentrifugal melalui saraf menuju berbagai organ, seperti korteks adrenal, pankreas dan yang paling penting adalah glandula salivarius sebagai organ tempat keluarnya virus dari sel inang. Pada Gambar 5 dapat dilihat skema penyebaran virus rabies, sebagaimana digambarkan oleh Baron et al. (2004).
Gambar 5. Skema penyebaran virus rabies (Baron et al. 2004). 3. Saraf tepi
Penyebaran secara sentripetal 1. Virus di lingkungan
sel
2. Infeksi melalui jalan masuk
Penyebaran lokal
4. Organ target (SSP)
7. Virus menyebar di lingkungan
Penyebaran sentrifugal melalui saraf tepi
5. Penyakit
Pada sistem saraf, sebagian besar virus dirakit di dalam membran sitoplasmik sel inang, tetapi sel inang tidak mengalami lisis sehingga hanya sedikit antigen virus yang dapat merangsang mekanisme respon imun inang. Di dalam glandula salivarius, kuncup -kuncup virus keluar dari membran plasma pada permukaan saluran sel-sel mukosa dalam konsentrasi cukup tinggi menuju saliva. Sehingga pada saat-saat terjadi replikasi virus di dalam SSP yang menyebabkan hewan menjadi agresif dan menggigit apa saja, maka saliva penderita dalam keadaan sangat infeksius.
Vaksin dan Vaksinasi Rabies
Lebih dari seratus tahun yang lalu, Louis Pasteur telah mengembangkan vaksin rabies pertama untuk manusia yang dibuat dari jaringan saraf. Selanjutnya, vaksin inaktif dibuat pada otak domba dan bayi mencit yang kemudian dihubungkan dengan efek samping berupa reaksi neurologik pasca vaksinasi, seperti meningoencephalitis, meningoencephalomyelitis, myelitis dan paralysis
yang dapat terjadi antara 1 sampai 2 minggu pasca vaksinasi (WHO 2002). Kejadian reaksi neurologik ini bervariasi, berkisar 1 kasus dari 200 sampai 8000 orang yang divaksinasi dapat menderita reaksi neurologik dan lebih dari 14% menjadi letal.
Sejak tahun 1983, vaksin virus rekombinan (Vaccinia-rabies glycoprotein, V-RG) untuk hewan mulai dikembangkan. Prinsip pembuatan vaksin ini adalah dengan menyelipkan suatu gen dari mikroorganisme ke dalam genom mikroorganisme lainnya sebagai vektor. Vaksin dibuat dengan menyelipkan gen protein G dari virus rabies ke dalam genom virus vaccinia. Vaksin ini lebih stabil terhadap suhu, aman dan dapat diberikan per oral. Namun, vaksin ini mempunyai kelemahan, yaitu adanya vektor yang justru dapat menginfeksi lebih banyak lagi spesies hewan karena tidak bersifat spesifik terhadap spesies tertentu (non species-specific).
Selanjutnya dikembangkan vaksin DNA dengan cara menyisipkan gen yang mengkode protein imunogenik ke dalam plasmid suatu bakteri yang telah diketahui. Walaupun tingkat kekebalan yang dihasilkan tidak setinggi yang dihasilkan oleh vaksin tradisional, vaksin ini cukup efektif untuk mencegah kasus rabies, tetapi vaksin ini hanya efektif apabila diberikan pada hewan yang belum pernah terpapar rabies (pre-exposure vaccination) (Anonim 1999).
Evaluasi Hasil Vaksinasi Rabies
Untuk mengetahui efektivitas antibodi anti rabies yang terbentuk pasca vaksinasi dapat dilakukan pengujian secara in vivo melalui uji tantang (challenge test) maupun in vitro dengan uji serologi. Pengujian potensi vaksin rabies, secara rutin telah dilakukan sesuai metode National Institutes of Health (NIH Test) dengan vaksinasi dan uji tantang intra cerebral. Perlakuan ini dapat menyebabkan tekanan dan penderitaan pada hewan laboratorium (Rooijakkers et al. 1996).
Sejalan dengan prinsip yang diajukan oleh European Center for the Validation of Alternative Methods (ECVAM) tentang pemakaian hewan coba, yaitu “Refinement (perbaikan), Reduction (pengurangan) and Replacement
(penggantian) (3R)”, The World Health Organization (WHO) merekomendasikan penggunaan uji serologi dalam pengujian safety dan potency vaksin rabies (Cussler et al. 2002; WHO 2003). Salah satu metode pengukuran titer antib odi dalam serum dapat dilakukan dengan Enzyme linked immunosorbent assay
titer antibodi minimal 0,5 IU untuk dapat terhindar dari serangan virus rabies (Beniek et al. 2000; Piza et al. 2002; WHO 2003)
BAHAN DAN METODE PENELITIAN
Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Imunologi dan Laboratorium Terpadu Fakultas Kedokteran Hewan Institut Pertanian Bogor, Laboratorium Uji Hewan PT. Biofarma Bandung dan Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan (BBPMSOH) Bogor, berlangsung selama 14 bulan.
Bahan
Hewan Percobaan
Hewan yang digunakan dalam penelitian ini adalah ayam layer strain Isa Brown umur 22 minggu untuk pembuatan antibodi anti-idiotipe (Ab2), kelinci
New Zealand White berbobot 2,5 kg sebagai hewan percobaan pada uji serologi terhadap virus rabies dan mencit strain ddY umur 3 – 5 minggu, berat badan 14-16 gram. Pakan yang diberikan pada ayam adalah ransum komersial produksi PT. Missouri, sebanyak 100 gram/hari/ekor, sedangkan untuk kelinci diberikan pakan berbentuk pellet standar untuk pakan hewan laboratorium PT. Biofarma, diberikan 5 gram/100 gram BB/hari. Pakan untuk mencit diberikan sebanyak 6 gram/hari/ekor dan diberikan minum secara ad libitum.
Ayam dipelihara secara individual pada kandang yang dibuat dari kayu dan bambu dengan sistem baterai, ditempatkan pada ruang terbuka. Kandang kelinci dibuat dari stainless dengan ukuran 48 X 32 X 60 cm/ekor dan kandang mencit berupa kotak plastik berukuran 30 X 60 X 15 cm yang dapat menampung sebanyak 10 ekor mencit. Pemeliharaan kelinci dan mencit dilakukan dalam ruangan dengan suhu 25 - 26 oC dan kelembaban 54 – 60%, serta diberikan penerangan selama 10 jam/hari.
Serum Kuda Anti Rabies (SAR)
Pemurnian antibodi dilakukan melalui pengendapan dengan amonium sulfat jenuh dan didialisis dalam Phosphate Buffer Saline (PBS) pH 8 selama 24 jam. SAR digunakan sebagai imunogen dalam pembuatan antibodi anti-idiotipe (Ab2)
Challenge Virus Standard (CVS)
Challenge Virus Standard (CVS) adalah sediaan virus standard dari WHO untuk uji tantang (Challenge Test) terhadap vaksin rabies dan / atau serum rabies untuk penentuan nilai potensi vaksin rabies dan / atau serum rabies uji dengan memperbandingkannya dengan vaksin dan / atau serum rabies referensi. Dalam penelitian ini, CVS digunakan untuk uji potensi SAR yang akan digunakan sebagai imunogen untuk menginduksi antibodi anti-idiotipe.
Bahan dan Media
Media dan bahan yang digunakan adalah serum kuda normal (SKN) 2% sebagai bahan pengencer pada uji potensi SAR. Vaksin rabies komersial, digunakan untuk reidentifikasi SAR. Bahan -bahan untuk uji imunodifusi, di antaranya : Agarose, Polyethylene Glycol (PEG) 6000, NaN3, Phosphate Buffer
Saline (PBS) pH 7,4 dan pH 8. Bahan -bahan untuk pemurnian protein, yaitu : amonium sulfat ((NH4)2 SO4) jenuh, NaCl fisiologis, kantung dialisis, kolom kromatografi, matriks afinitas spesifik IgY, matriks Diethylaminoethyl (DEAE) - cellulosae, Potasium Sulfat (K2SO4), NaH2PO4, propanol dan akuades. Uji
Sodium Dodecyl Polyacrylamide Gel Electrophoresis (SDS-PAGE) menggunakan
Tetra Methyl Etilen Diamin (TEMED), Acrylamide, Bisacrylamide, Sodium Dodecyl Sulfate (SDS), Tris HCl dan amonium ferosulfat, serta bahan-bahan yang digunakan pada teknik Enzyme linked immunosorbent assay (ELISA).
Peralatan
Metode
Karakterisasi Serum Kuda Anti Rabies (SAR)
Serum kuda anti rabies (SAR) yang telah diendapkan dengan amonium sulfat jenuh, diamati kondisi fisik (warna, bau, keutuhan) dan kemasannya untuk mengetahui apakah SAR memenuhi persyaratan untuk digunakan dalam penelitian ataupun untuk terapi imunologis.
Reidentifikasi Serum Kuda Anti Rabies (SAR)
Reidentifikasi SAR dilakukan dengan uji imunodifusi Agar Gel Precipitation Test (AGPT). Medium dibuat dengan melarutkan 0,4 gram agarose dan 1,2 gram Polyethylen e Glycol (PEG) 6000 ke dalam 20 ml aquades dan 20 ml PBS pH 7,4, kemudian dididihkan selama 5 ~ 10 menit dan ditambahkan 10% NaN3 40 µl. Dengan menggunakan pipet 10 ml, campuran agar cair tersebut dituangkan di atas plate dan dibiarkan mengeras. Setelah mengeras, dibuat lubang-lubang untuk tempat antigen dan antiserum dengan menggunakan alat gel puncher.
Ke dalam lubang-lubang yang telah tersedia, diisikan SAR (lubang tengah) dan vaksin rabies di lubang sekitarnya, kemudian diinkubasikan pada 37o C. Pengamatan dilakukan setelah 24 sampai 48 jam. Adanya garis presipitasi menunjukkan adanya reaksi homolog antara SAR sebagai antiserum dan vaksin rabies sebagai antigen.
Pemotongan Imunoglobulin dan Purifikasi Fragmen F(ab)2
Pemotongan imunoglobulin kuda ditujukan untuk memperoleh fragmen F(ab)2 dari imunoglobulin. Fragmen F(ab)2, selanjutnya disebut Ab1, akan digunakan untuk merangsang terbentuknya antibodi spesifik terhadap epitop Ab1 pada kelinci. Antibodi yang akan terbentuk oleh Ab1 ini merupakan antibodi anti-idiotipe (Ab2). Pemotongan dilakukan dengan menggunakan enzim pepsin, sehingga akan diperoleh 1 fragmen F(ab)2 divalen yang mengandung 2 Fab dan 1 fragmen Fc.
imunoglobulin. Laru tan diinkubasikan pada penangas air dengan suhu 37 oC selama 12 – 24 jam. Reaksi dihentikan dengan menambahkan 3,0 M Tris pH. 8,8 sebanyak 10% dari volume larutan, disentrifus dengan kecepatan 10.000 g selama 30 menit. Selanjutnya dilakukan isolasi fragmen F(ab)2 menggunakan
DEAE-cellulose (Harlow dan Lane 1988).
Gel DEAE Cellulose dalam column chromatography dibilas dengan Tris buffer 10 mM. Imunoglobulin kuda yang sudah dipotong dengan pepsin dimasukkan ke dalam kolom, sehingga gel akan berikatan dengan imunoglobulin.
Tris buffer kemudian ditambahkan lagi sampai diperkirakan gel dan fragmen F(ab)2 imunoglobulin sudah berikatan dengan sempurna. Pada saat ini, proteinprotein lain akan lolos yang dapat dilihat dari kenaikan garis grafik. Protein -protein ini dibuang. Selanjutnya dilakukan elusi fragmen F(ab)2 imunoglobulin dari gel.
Fragmen F(ab)2 imunoglobulin akan terelusi dengan meningkatnya kadar NaCl dalam Tris buffer 10 mM. Elusi dilakukan dengan menambahkan Tris buffer 10 mM yang mengandung 100 mM dan 300 mM NaCl. Fragmen F(ab)2 imunoglobulin yang terelusi akan terdeteksi oleh monitor absorban yang ditandai dengan naiknya garis sampai terbentuk garis puncak grafik. Larutan ditampung dalam gelas erlenmeyer. Selanjutnya dilakukan dialisis dalam larutan PBS pH 8,0 selama satu malam pada suhu 2 – 8 oC. Gel dicuci kembali dengan Tris buffer 10 mM pH 8,0.
Uji Potensi Ab1
masing-masing pada 5 ekor hewan model (mencit) per enceran sebanyak 0,03 ml/ekor secara intracerebral.
Observasi dilakukan mulai hari ke-6 hingga hari ke-10 setelah penyuntikan dengan mengamati kematian dan gejala-gejala rabies (paralisis dan konvulsi/spasmus) sebagai respon positif. Nilai Effective Dose (ED)50 Serum Rabies Uji-CVS, Serum Referensi Rabies-CVS dan Kontrol CVS dihitung berdasarkan end-point proteksi 50% populasi ( = kematian 50% populasi = X50) sesuai dengan rumus Spearman – Karber sebagai berikut :
Log X50 = - {X0 – (1/2)d + d ? [(ri)/ni]} ; dimana
X0 : Log10 pengenceran terendah dimana semua hewan model positif d : Log10 faktor pengenceran
ri : Jumlah hewan model yang positif
ni : Jumlah hewan model per pengenc eran (setelah dikurangi yang mati selama 5 hari pertama).
Nilai potensi Serum Rabies Uji dihitung dengan rumus :
P = {(ED50 Serum Uji) / (ED50 Serum Referensi) X Potensi Serum Referensi (IU/ml).
Produksi Antibodi Anti -Idiotipe (Ab2)
Satu minggu setelah penyuntikan terakhir, dilakukan pengambilan darah ayam melalui vena brachialis atau axillaris di daerah sayap dengan menggunakan
spuit. Darah dalam spuit diinkubasikan selama 30 menit pada suhu 37 oC, selanjutnya diinkubasikan pada suhu 4 oC selama 30 sampai 60 menit. Serum dipisahkan dari komponen-komponen darah yang lain, kemudian dilakukan uji presipitasi agar (AGPT) untuk mendeteksi adanya antibodi spesifik terhadap Ab1. Jika titer antibodi terhadap Ab1 dalam darah cukup tinggi yang ditunjukkan dengan adanya garis presipitasi, maka mulai dilakukan koleksi darah dan telur.
Pengendapan Imunoglobulin Ayam (IgY = Ab2) dengan Amonium Sulfat
Pemurnian antibodi anti-idiotipe Ab2 dari serum ayam dilakukan sesuai metode baku Harlow dan Lane (1988). Serum dipresipitasikan dengan amonium sulfat jenuh secara bertahap menggunakan persentase 60% dan 50%. Sebanyak 50 ml serum ditambah dengan 30 ml amonium sulfat jenuh (60%) d itambahkan setetes demi setetes di atas alat pemutar (stirrer), diaduk kira-kira selama 60 menit, kemudian disentrifugasi dengan kecepatan 3500 rpm selama 15 menit. Supernatan dibuang dan endapan yang terbentuk dilarutkan ke dalam NaCl fisiologis hingga mencapai volume semula. Dengan cara yang sama, kemudian ditambahkan lagi 25 ml amonium sulfat jenuh (50%), supernatan dibuang dan endapan ditambahkan NaCl fisiologis hingga mencapai volume semula. Selanjutnya dilakukan dialisis selama 24 jam dalam larutan PBS pH 8,0.
Pemurnian dengan Kolom KromatografiAfinitas
Selanjutnya dilakukan elusi IgY dari matriks dengan larutan NaH2PO4 20 mM pH 7,5. Imunoglobulin yang terelusi akan terdeteksi oleh monitor absorban yang ditandai dengan naiknya garis sampai terbentuk garis puncak. Larutan ini ditampung dalam gelas erlenmeyer, kemudian dipekatkan sampai kira-kira kembali ke volume asal. Selanjutnya dilakukan dialisis selama 24 jam dalam larutan PBS pH 8,0. Matriks dicuci dengan Cleaning buffer (larutan 30% propanol dalam larutan NaH2PO4 20 mM pH 7,5).
Pengukuran kadar IgY dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 280 ηm. Selanjutnya dilakukan analisis pita protein menggunakan metode Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS-PAGE) (Hames dan Rickwood 1987).
Karakterisasi Antibodi Anti-Idiotipe
Karakterisasi antibodi anti-id iotipe dilakukan dengan uji imunodifusi menggunakan metode AGP (Agar Gel Precipitation) dan SDS-PAGE (Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis).
Uji Imunodifusi
Setelah medium AGPT disiapkan, ke dalam lubang-lubang yang telah tersedia, diisikan antibodi anti-idiotipe (Ab2) (lubang tengah) dan antibodi 1 (Ab1) sebagai antigen di lubang sekitarnya, kemudian diinkubasikan pada 37o C. Pengamatan dilakukan setelah 24 sampai 48 jam. Adanya garis presipitasi menunjukkan adanya reaksi homolog antara antibodi anti-idiotipe sebagai antiserum dan Ab1 sebagai antigen.
Sodium Dodecyl Polyacrylamide Gel Electrophoresi s (SDS-PAGE)
Untuk mengetahui pola protein dari antibodi anti-id iotipe yang terbentuk, dilakukan karakterisasi dengan SDS-PAGE. Penanda berat molekul digunakan
sisir bagian bawah. Setelah gel membeku, sisir casset dipasang kemudian dituangkan stacking gel dengan perlahan -lahan sampai dengan batas atas sisir casset. Setelah stacking gel membeku, gel casset dipasang pada alat elektroforesis.
Running buffer dituangkan ke dalam bak elektroforesis, sisir dilepas dengan hati-hati sehingga batas atas sisir tid ak terlepas. Sampel kemudian diinokulasikan sebanyak 10 µl. Selanjutnya elektroforesis dijalankan pada tegangan 200 volt dengan kuat arus 40 mA. Pewarnaan pita protein menggunakan biru komasi dan estimasi berat molekul protein IgY dilakukan dengan membandingkannya dengan
marker.
Pengukuran Ko nsentrasi Antibodi Anti -idiotipe (Ab2)
Pengukuran konsentrasi Ab2 dilakukan dengan metode Bradford (1976) menggunakan spektrofotometer. Sebanyak 1 ml reagen Bradford dicampurkan dengan 100 µl Ab2, selanjutnya diinkubasikan selama 5 menit. Absorbansi sampel ditentukan dengan pembacaan pada spektrofotometer pada panjang gelombang 595 nm. Konsentrasi sampel dihitung berdasarkan kurva standar yang telah dibuat.
Imunisasi Kelinci de ngan Antibodi Anti-idiotipe (Ab2)
Imunisasi kelinci dilakukan untuk merespon terbentuknya antibodi terhadap antibodi anti-idiotipe (Ab2). Antibodi yang diperoleh dari serum kelinci merupakan anti- antibodi anti-id iotipe (Ab3), diharapkan mempunyai karakteristik serologis sama dengan Ab1 (SAR asal kuda), sehingga mampu bereaksi homolog dengan antibodi anti-idiotipe (Ab2) maupun dengan antigen virus rabies.
Sebanyak 9 ekor kelinci New Zealand White dibagi menjadi 3 kelompok, yaitu : kelompok I sebagai kelomp ok kontrol, disuntik dengan NaCl fisiologis; kelompok II, disuntik dengan antibodi anti-idiotipe (Ab2) yang diemulsikan dalam ajuvan, yaitu Freund’s Complete adjuvant (FCA) digunakan pada imunisasi pertama dan Freund’s Incomplete adjuvant (FIA) pada imunis asi kedua; dan kelompok III, disuntik dengan vaksin rabies (Rabisin, Romindo Primavetcom).
dilakukan dengan menyuntikkan secara sub kutan 0,5 ml Ab2 yang diemulsikan dalam 0,5 ml FCA. Vaksinasi kedua dilakukan dengan 0,5 ml Ab2 yang diemulsikan dalam 0,5 ml Freund’s Incomplete Adjuvant (FIA) satu minggu setelah penyuntikan pertama. Dengan cara dan jarak waktu yang sama, kelompok III disuntik dengan satu dosis vaksin rabies, yaitu sebanyak 1 ml vaksin inaktif yang telah diemulsikan dalam ajuvan (Rose 1999).
Serum kelinci dipanen satu minggu setelah imunisasi terakhir. Pengambilan darah kelinci dilakukan mela lui vena di daerah daun telinga menggunakan syringe 5 ml, selanjutnya diinkubasikan pada suhu 37 oC selama 30 menit dan pada suhu 2-8 oC selama 30 menit. Serum dipisahkan dari komponen -komponen darah, selanjutnya dilakukan pemeriksaan antibodi melalui uji imunodifusi dengan metode AGPT.
Pemeriksaan antibodi dilakukan setiap minggu selama 4 minggu kemudian dilakukan pengujian kadar antibodi kelinci terhadap virus rabies dengan metode
enzyme linked immunosorbent assay (ELISA). Metode ini direkomendasikan oleh WHO untuk menguji potensi suatu produk vaksin rabies (Caruana et al. 2003; Gamoh et al. 2003).
Pengujian Antibodi Kelinci terhadap Virus Rabies dengan Metode Enzyme
Linked Immunosorbent Assay (ELISA)
Prinsip kerja ELISA adalah mengevaluasi reaksi an tara glikoprote in virus dengan antibodi rabies yang akan berikatan secara spesifik. Komplek antigen -antibodi ini dapat dideteksi dengan menambahkan -antibodi anti kelinci yang dilabel enzim horseradish peroxidase (HRP). Jumlah komplek antigen antibodi terlihat dari intensitas warna yang timbul setelah ditambahkan dengan substrat (misalnya : 2,2-azino di 3-ethylbenzothiazoline – 6-sulphonic acid = ABTS). Intensitas warna yang terbentuk dibaca menggunakan Elisa reader pada panjang gelombang 414 nm (Kresno 2001).
Antigen virus rabies dalam coating buffer dilekatkan (coating) pada plate
diinkubasikan, sisa antigen yang tidak terikat dicuci dengan 200 µl tween 0,05% dalam PBS (PBST). Pencucian diulangi 3 sampai 4 kali. Blocking antigen dilakukan dengan menambahkan bovine serum albumin (BSA) 0,05% dalam PBS pada sumur, diinkubasikan pada 37oC selama 1 jam dan dicuci dengan PBST sebanyak 3 sampai 4 kali. Pada periode yang sama, disiapkan enceran serum control (positif dan negatif) dengan phosphate buffer secara seri kelipatan dua dimulai dari 5 X 10-1 sebanyak 5 tah ap. Serum kontrol telah diketahui nilai IU pada uji SN (serum netralisasi) terhadap serum referensi. Selanjutnya ke dalam sumur ditambahkan 100 µl antiserum kelinci yang telah diencerkan 50 kali, serum kontrol positif dan negatif sesuai dengan desain yang telah dibuat, diinkubasikan pada 37oC selama 1 jam, kemudian dicuci dengan PBST sebanyak 3 sampai 4 kali. Konjugat Goat Anti Rabbit IgG (SIGMA) diencerkan dengan pengenceran 8000 kali, lalu ditambahkan pada sumur dan diinkubasikan pada 37oC selama 1 jam dan dicuci lagi dengan PBST sebanyak 3 sampai 4 kali, dilanjutkan dengan penambahan substrat 2,2-azino di 3-ethylbenzothiazoline – 6-sulphonic acid
(ABTS, SIGMA) mengandung H2O2 (10 µl H2O2 / 100 ml substrat ABTS) sebanyak 100 µl dan diinkubasi optimal sekitar 15 sampai 30 menit pada suhu kamar secara gelap . Pembacaan nilai Optical Density (OD) dilakukan pada Elisa reader dengan filter 414 nm.
Kalkulasi dan Interpretasi Hasil Uji ELISA
Nilai OD dikonversikan ke dalam Equivalen Unit (EU) atau International Unit (IU) berdasarkan hasil pembacaan serum kontrol positif yang diencerkan pada sumur A1,2 sampai pada F1,2 berturut-turut mulai 1,0; 0,5; 0,25; 0,125; 0,06 dan 0,03 IU. Data serum kontrol dan serum sampel dibuat nilai rata-rata, kemudian dibuat grafik serum kontrol pada kertas grafik atau menggunakan
software Microsoft Excell sebagai garis positif. Selanjutnya ditentukan garis logaritmik sebagai garis koreksi dari garis positif.
sebagai nilai kandungan antibodi serum uji yang dapat dihitung dengan persamaan garis logaritmik pada garis koreksi dari garis positif.
Analisis Data
HASIL DAN PEMBAHASAN
Karakterisasi Serum Kuda Anti Rabies
Serum kuda anti rabies berbentuk cairan tak berwarna dalam kemasan utuh dengan nomor bacth RSM 013, diproduksi tanggal 18 Maret 2003. Waktu daluwarsa produk selama dua tahun. Kemasan dalam bentuk vial 10 ml, disimpan pada suhu 2 – 8 oC.
Reidentifikasi SAR
Reidentifikasi SAR (Ab1) dengan uji imunodifusi Agar Gel Presipitation
Test (AGPT) menunjukkan reaksi positif dengan vaksin rabies, ditunjukkan dengan terbentuknya garis presipitasi (Gambar 6). Hal ini berarti bahwa terjadi reaksi serologi yang homolog antara Ab1 dengan vaksin virus rabies karena Ab1 merupakan antibodi spesifik terhadap virus rabies.
Gambar 6. Garis presipitasi (tanda panah) pada uji imunodifusi (AGPT) menunjukkan adanya reaksi homolog antara serum anti rabies (Ab1) dengan vaksin rabies (V).
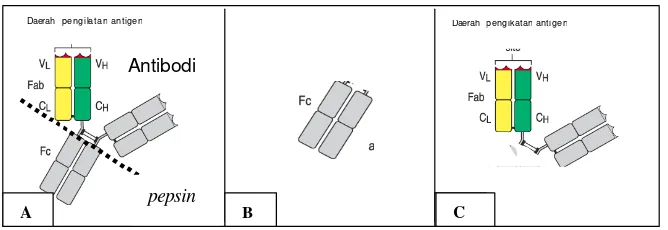
Pemotongan Imunoglobulin Kuda Anti Rabies
Hasil pemotongan imunoglobulin dengan enzim pepsin, diperoleh fragmen Fc dan F(Ab)2, seperti yang terlihat pada skema Gambar 7. Fragmen F(Ab)2
V
K
K
Ab1
K
V
selanjutnya disebut dengan antibodi 1 (Ab1), digunakan untuk mengimunisasi ayam dalam produksi antibodi anti-idiotipe (Ab2).
Gambar 7. Skema pemotongan imunoglobulin (A) dengan enzim pepsin, menghasilkan fragmen Fc (B) dan fragmen F(Ab)2 (C).
Penggunaan fragmen F(Ab)2 dari antibodi sebagai Ab1 dapat meningkatkan spesifisitas dan mengurangi heterogenitas antibodi yang akan terbentuk dari hasil imunisasi menggunakan Ab1 sebagai antigen. Adanya satu antigen dalam campuran antigen dapat menghilangkan respon imun terhadap antigen yang lain secara jelas. Hal ini juga terjadi pada epitop dalam satu molekul; misalnya respon terhadap epitop pada imunisasi dengan fragmen Fab IgG menunjukkan respon yang lebih besar dibandingkan imunisasi dengan IgG yang disebabkan sifat menghambat bagian Fc. Mekanisme dari efek ini merupakan hasil persaingan antara peptida antigen yang telah diproses untuk berikatan dengan lekuk MHC. Kemampuan ini tergantung pada perbedaan kesempatan untuk bertemu dengan protease pada saat molekul membuka, dan ada atau tidak adanya susunan asam amino tertentu untuk memecahnya dan menghasilkan peptide dalam jumlah besar dengan afinitas yang relatif tinggi untuk lekuk MHC. Kemungkinan bahwa antigen tertentu dalam campuran atau epitop tertentu dari antigen tertentu, dapat menghambat respon imun yang bersifat protektif (Roitt 2003).
Segre et al. (1992) menyatakan, bahwa afinitas dan heterogenitas dari antibodi idiotipe berpengaruh terhadap afinitas dan heterogenitas antibodi anti- idiotipe yang dihasilkan pada mencit yang sama. Hal ini menunjukkan, bahwa antibodi idiotipe dan antibodi anti- idiotipe saling mempengaruhi satu sama lain secara mutualisme melalui efek imunoregulasi internal.
pepsin
A B C
Daerahpengikatanantigen
Antibodi
Uji Potensi SAR (Ab1)
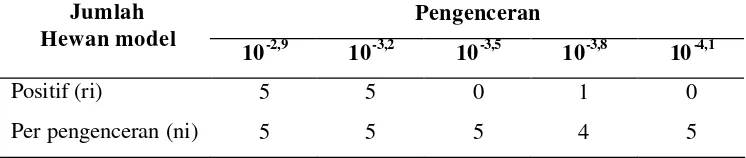
Pengenceran yang digunakan pada serum uji (SAR) dan serum referensi adalah pengenceran 10-2,9, 10-3,2, 10-3,5, 10-3,8 dan 10-4,1. Masing-masing serum enceran dinetralisasi dengan 31,6-316 LD50/0,03 ml Virus Rabies Standar (CVS). Data hasil uji potensi SAR dan Serum Referensi pada uji netralisasi menggunakan hewan percobaan mencit disajikan pada Tabel 1 dan 2. Nilai Efective Dose (ED)50 Serum Rabies Uji-CVS, Serum Referensi Rabies -CVS dan Kontrol CVS dihitung berdasarkan end-point proteksi 50% populasi ( = kematian 50% populasi = X50) sesuai dengan rumus Spearman – Karber (Atanasiu 1960).
Tabel 1. End -point proteksi 50% populasi mencit dari SAR
Pengenceran
Tabel 2. End -point proteksi 50% populasi mencit dari Serum Referensi
Pengenceran
Selanjutnya, perhitungan menggunakan rumus Spearman – Karber, diperoleh nilai ED50 SAR = 10
-3,95
dan ED50 Serum Referensi = 10 -4
sekitar 97,2 IU imunoglobulin anti rabies. Serum yang diuji dikatakan memenuhi syarat atau lolos uji apabila memiliki potensi sama atau lebih tinggi dibandingkan dengan potensi serum referensi (International Standard Serum), yaitu sama atau lebih tinggi dari 86,6 IU/ml (Atanasiu 1960). Dosis pemakaian imunoglobulin kuda anti rabies untuk pengobatan terhadap rabies adalah 40 IU per kilogram berat badan (Gamble 2002).
Produksi Antibodi Anti -Idiotipe (Ab2) pada Ayam
Satu minggu setelah diimunisasi dengan 0,5 ml Ab1 secara intravena selama 3 minggu, serum ayam diperiksa dengan teknik AGPT. Hasil uji serum menunjukkan reaks i serologi negatif terhadap Ab1, terlihat dari tidak terbentuknya garis presipitasi pada media agarose. Serum ayam mulai menunjukkan reaksi positif satu minggu setelah vaksinasi ulangan (booster) menggunakan Ab1 yang diemulsikan dalam Freund’s incomplete adjuvant (FIA). Adjuvan membantu imunogen yang kurang imunogenik dalam menggertak sistem imun tubuh. Selain itu, ajuvan juga dapat berfungsi sebagai pembawa antigen menuju lokasi sistem imun dan melepaskannya sedikit demi sedikit (sebagai depot antigen), sehingga masa pembentukan antibodi berlangsung lebih lama (Leenaars et al. 1997).
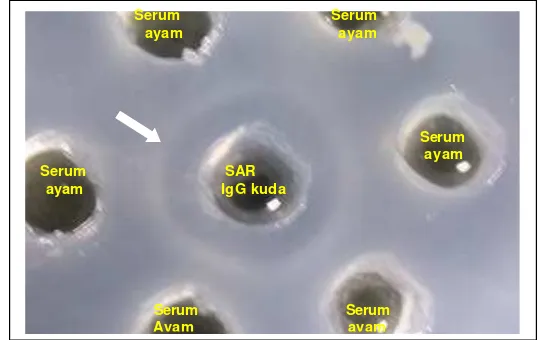
Gambar 8. Garis presipitasi (tanda panah) pada uji imunodifusi (AGPT) menunjukkan adanya reaksi homolog antara antiserum ayam (Ab2) dengan SAR (Ab1).
Hasil uji serum ayam yang mengandung antibodi anti-idiotipe (Ab2) dengan Ab1 menunjukkan adanya reaksi homolog, ditandai dengan terbentuknya
garis presipitasi pada AGPT (Gambar 8). Migliorini dan Schwartz (1988) menyatakan, bah wa daerah variabel suatu antibodi atau bagian dari molekul yang mengikat antigen bersifat antigenik dan dapat menggertak terbentuknya antibodi terhadap daerah variabel itu sendiri jika disuntikkan pada hewan yang berbeda spesiesnya atau bahkan pada hewan yang sama spesiesnya. Uji antara Ab2 dengan vaksin rabies menunjukkan reaksi negatif, karena epitop dari antigen virus rabies tidak homolog dengan paratop Ab2. Untuk menghasilkan kekuatan ikatan antara antigen dan antibodi diperlukan struktur yang cocok antara keduanya (Kennedy 1985).
Antigen yang diimunisasikan pada hewan akan menginduksi terbentuknya antibodi sekitar satu minggu pasca vaksinasi (Tizard 1988). Beberapa faktor yang berpengaruh terhadap pembentukan antibodi, di antaranya adalah umur hewan, ukuran molekul antigen, kerumitan struktur kimiawi antigen, konstitusi genetik, metode pemasukan antigen dan dosis antigen (Liddell dan Weeks 1995). Pada Tabel 3 disajikan hasil uji AGPT antibodi terhadap Ab1 dalam serum ayam.
Tabel 3. Titer antibodi anti-idiotipe pada serum ayam diuji dengan AGPT Titer antibodi pada serum ayam pada minggu
No.
Keterangan : K (kontrol negatif).
imunoglobulin yang dihasilkan ini menurun perlahan-lahan karena proses katabolisme (Tizard 1988).
Gambar 9. Grafik Titer Antibodi terhadap Ab1 pada Serum Ayam.
Terbentuknya garis presipitasi pada uji AGPT menunjukkan bahwa pada serum ayam telah terjadi respon imun (Ab2) terhadap F(Ab)2 imunoglobulin kuda anti rabies (Ab1). Imunoglobulin Y (Ab2) akan ditransfer dari serum menuju kuning telur dengan proses yang analog dengan proses transfer antibodi melalui plasenta pada mamalia, selanjutnya IgY dalam kuning telur akan terserap pada saat embrio berkembang menjadi anak ayam (Narat 2003). Antibodi yang terbentuk ini merupakan antibodi anti-idiotipe yang diharapkan mempunyai karakteristik serologis yang sama dengan antigen aslinya dan dapat digunakan sebagai antigen pen gganti dalam imunisasi.
Kemampuan meniru struktur antigen aslinya (internal image) merupakan landasan penggunaan antibodi anti-id iotipe sebagai antigen pengganti. Antibodi anti-id iotipe digunakan untuk menggertak antibodi yang mempunyai spesifisitas sama dengan penggunaan vaksin virus rabies pada spesies hewan yang sama atau berbeda. Sebagaimana halnya antigen, antibodi anti-idiotipe mempunyai kemampuan berikatan secara kompetitif dengan antibodi spesifik terhadap antigen aslinya (Fields et al. 1995).
Sebagian antibodi yang terbentuk pada ayam mempunyai karakteristik antigenik yang sama dengan antigen aslinya. Antibodi ini disebut dengan antibodi anti-id iotipe (Wise et al. 2005). Hipotesis Jerne (1985) menyatakan, bahwa
daerah hipervariabel dari suatu imunoglobulin (antibodi) dapat bersifat sebagai antigen dan antibodi yang terbentuk dari antigen tersebut merupakan antibodi anti-id iotipe yang dapat berikatan secara langsung dengan paratope atau daerah pengikatan antigen (antigen binding site) dari antibodi pertama (Ab1). Dengan demikian, antibodi anti-id iotipe juga dapat menghambat pengikatan antigen aslinya secara kompetitif (Liddell dan Weeks 1995).
Purifikasi dan Karakterisasi Imunoglobulin Ayam (IgY)
Tahap pertama pemurnian imunoglobulin ayam (IgY) melalui pengendapan protein dengan amonium sulfat jenuh diperoleh endapan protein berwarna putih, sebagaimana terlihat pada Gambar 10. Menurut Harlow dan Lane (1988), ketika suatu larutan garam dengan konsentrasi tinggi dan mengandung banyak ion seperti ion amonium ((NH4)+) dan ion sulfat (SO42-) ditambahkan ke dalam larutan yang mengandung protein, maka larutan garam tersebut akan bersaing dengan protein untuk mengikat molekul air. Molekul air akan berpindah dan berikatan dengan garam, sehingga kelarutan protein menjadi berkurang, menyebabkan protein mengendap . Protein yang mengendap mempunyai afinitas yang lebih baik terhadap molekul protein lain daripada dengan molekul air.
Gambar 10. Proses pengendapan protein dengan amonium sulfat (A), diperoleh endapan berwarna putih (B).
Faktor-faktor yang berpengaruh terhadap pengendapan protein, di antaranya adalah jumlah dan posisi grup polar, berat molekul protein, pH larutan dan temperatur ketika pengendapan terjadi. Kebanyakan antibodi akan mengendap pada kondisi 50% jenuh. Kelemahan pengendapan dengan amonium sulfat adalah
protein yang diinginkan, misalnya antibodi, tidak didapatkan dalam keadaan murni, terkontaminasi oleh protein-protein dengan berat molekul tinggi lainnya. Oleh karena itu, pengendapan dengan amonium sulfat tidak dapat digunakan sebagai metode tunggal, tetapi harus dikombinasikan dengan metode yang lain (Beynon et al. 1981).
Endapan protein selanjutnya dilarutkan dengan NaCl fisiologis. Untuk menghilangkan garam yang terdapat pada larutan protein dilakukan dialisis menggunakan PBS pH 8,0 selama 24 jam pada suhu 2 – 8 oC. Tabung dialisis direndam dalam larutan buffer, maka molekul-molekul garam akan keluar melalui pori-pori tabung secara bertahap hingga konsentrasi garam di dalam dan di luar tabung dialisis menjadi sama (Gambar 11).
Gambar 11. Proses dialisis larutan protein menggunakan PBS pH 8,0.