'3
£
SK RIP S I
ISOLASI DAN SELEKSI B.AKTERI ASAM LAKTAT
YANG BERSIFAT ANTIMIKROBA
DARI PIKEL;/ KETIMUN DAN ACAR
Oleh SlAW LIE
F 27. 0052
1 9 9 5
FAKUL TAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGaR
Laksmi Jenie, dan
c.c.
Nurwitri Andjaya.Ringkasan
Bakteri asam laktat mempunyai kemampuan untuk menghambat pertumbuhan
bakteri perusak dan bakteri patogen. Penelitian ini bertujuan untuk mendapatkan
isolat bakteri asam laktat yang berasal dari aear dan pikel ketimun yang efektif
dalam menekan pertumbuhan baik mikroba patogen maupun pembusuk.
Isolat bakteri asam laktat diseleksi berdasarkan kemampuannya didalam
menghambat pertumbuhan bakteri perusak (Alcaligenes sp. OSM 30002 dan
Pseu-domonas fluorescens OSM 50106) dan bakteri patogen (Escherichia coli,
Staphylo-coccus aureus, Salmonella typhimurium, Vibrio parahaemolyticus, dan Listeria
monocytogenes) dengan uji difusi sumur. Senyawa antimikroba yang diidentifikasi
berupa persen asam tertitrasi, hidrogen peroksida, dan bakteriosin. lsolat bakteri
asam laktat unggul diuji lebih lanjut dengan melihat pengaruh waktu kontak antara
isolat unggul dengan bakteri perusak dalam media ekstrak ikan rueah. Interval
waktu kontak yang digunakan adalah 0, 4, 8, dan 24 jam. Analisis dilakukan
terha-dap jumlah bakteri asam laktat, jumlah bakteri perusak, persen asam tertitrasi, dan
pengukuran pH media ekstrak ikan rueah.
Bakteri asam laktat yang berhasil diisolasi dari pikel ketimun adalah sebanyak
14 isolat, yang terdiri dari 8 isolat Lb. plantarum, 3 isolat Lactobacillus
. Uji aktivitas antimikroba dilakukan terhadap 7 isolat Lb. plantarum, 1 isolat Lb. Jermentum, dan 2 isolat Pediococcus. Kecuali Lb. Jermentum, isolat yang lain menunjukkan aktivitas antimikroba, baik terhadap bakteri pembusuk maupun
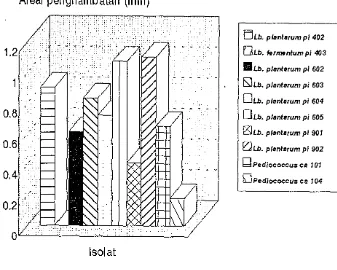
terha-dap bakteri patogen. Dilihat dari penghambatan terhadap Alcaligenes sp. dan P. fluorescens, Lb. plantarum pi 402 dan Lb. plantarum pi 902 merupakan isolat yang
paling menghambat pertumbuhan bakteri per,usak tersebut.
Hasil identifikasi senyawa antimikroba menunjukkan bahwa isolat bakteri
asam laktat memproduksi asam dalam media sintetik asam laktat dan hidrogen
peroksida dalam media air pepton 1 %. Sedangkan uji bakteriosin terhadap Alcali-genes sp. dan P. fluorescens memberikan hasil yang negatif.
Hasil uji kontak antara Lb. plantarum pi 402 dan Lb. plantarum pi 902 dengan Alcaligenes sp. dan P. fluorescens menunjukkan bahwa kedua isolat bakteri asam laktat tersebut dapat menghambat pertumbuhan Alcaligenes sp. dan P. fluores-cens. Penghambatan Lb. plantarum pi 402 terhadap Alcaligenes sp. lebih baik daripada penghambatan Lb. plantarum pi 902. Setelah kontak 4 jam, pertumbuhan
DARI PlKEL KETIMUN DAN ACAR
Oleh
SlAW LIE F 27.0052
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN pada Jurusan TEKNOLOGI PANGAN DAN GIZI
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
1995
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Dr. Ir.
ISOLASI DAN SELEKSI BAKTERI ASAM LAKTAT
YANG BERSIFAT ANTIMIKROBA
DARI PIKEL KETIMUN DAN ACAR
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Jurusan TEKNOLOGI PANGAN DAN GIZI
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
Siaw Lie
F 27.0052
Dilahirkan pada tanggal 1 Oktober 1972
di Berastagi
Tanggal lulus : 25 April 1995
,
Bogor, II Mal 1995
Disetujui oleh,
. Sri Laksmi . Nurwitri Andjaya, DAA
Puji dan syukur penulis panjatkan kepada Tuhan Yang
Pengasih, atas berkat dan rahmat-Nya penulis dapat
menye-lesaikan penulisan skripsi ini.
Ucapan terima kasih dan penghargaan yang
sebesar-besarnya penulis haturkan kepada:
1. Dr. Ir. Lilis Nuraida, MSc .• Dr. Ir. Betty Sri Laksmi
Jenie, MS., dan Ir. C.C. Nurwitri Andjaya, DAA selaku
dosen pembimbing yang telah banyak memberikan bimbingan
dan pengarahannya.
2. Bapak, Ibu, dan saudara-saudaraku yang selalu
memberi-kan bimbingan dan dorongan sehingga penyusunan skripsi
ini dapat diselesaikan.
3. Idawati, Shinta, Ati, dan Wiman, atas kerja sama,
dorongan dan bantuannya selama penelitian dan
penyu-sunan skripsi.
4. Bapak, Ibu, dan keluarga Rahmat yang telah memberikan
perhatian dan dorongan selama penelitian dan penyusunan
skripsi.
5. Agustina, Lili, Ling-Ling, Evi, Meliana, Yoli, Ana,
Emil, Fanny, dan Cha-Cha di Radar 43 yang senantiasa
memberikan perhatian dan dorongan kepada penulis.
dan penyusunan skripsi.
7. Ibu Ari, Ibu sri, Ibu Antin, Pak Taufik, Pak Mul, Pak
Dunung, dan segenap laboran di Laboratorium Jurusan
TPG, PAU, dan AP4 yang telah banyak membantu penulis
dalam kelancaran jalannya penelitian ini.
8. Kepada semua pihak yang tidak dapat disebutkan satu
persatu yang telah membantu peneliti selama penelitian
dan penyusunan skripsi ini.
Penulis menyadari bahwa penulisan ini masih jauh dari
sempurna, oleh karena itu saran dan kritik yang membangun
sangat diharapkan untuk penyempurnaan tulisan ini.
Akhir kata, penulis mengharapkan semoga skripsi ini
dapat bermanfaat bagi pihak-pihak yang membutuhkan.
Bogor, April 1995
Penulis
Halaman
KATA PENGANTAR i
DAFTAR lSI
DAFTAR TABEL
DAFTAR GAMBAR
i i i
v
vi
viii DAFTAR LAMP I RAN
I. PENDAHULUAN 1
3
3 II. TINJAUAN PUSTAKA
A. IKAN RUCAH
B. MIKROBIOLOGI IKAN . . . 4
C. BAKTERI ASAM LAKTAT 6 6 D. E. a. Karakteristik Bakteri Asam Laktat b. Aktivitas Antimikroba Bakteri Asam Laktat 8 c. Peranan Bakteri Asam Laktat sebagai sebagai Bahan Pengawet Makanan . . . 17
PIKEL . . . 19
KARAKTERISTIK BEBERAPA BAKTERI PERUSAK 23 1. Pseudomonas fluorescens . . . 23
2. Alcaligenes sp. . . .. 24
F. KARAKTERISTIK BEBERAPA BAKTERI PATOGEN 25 1. Escherichia coli . . . 25
2. Listeria monocytogenes . . . 26
3. Salmonella typhimurium . . . 27
4. staphylococcus aureus . . . 28
5. Vibrio parahaemolyticus . . . 28
1. Isolasi dan Identifikasi Bakteri Asam
Laktat dari Pikel Ketimun dan Acar 32
2. Seleksi Isolat Bakteri Asam Laktat 40
3. Identifikasi Senyawa Antimikroba , 40
4. Pengaruh Waktu Kontak Bakteri Asam
Laktat dengan Bakteri Perusak dalam
Media Ekstrak Ikan Rucah . . . 43
5. Analisis . . . 46
IV. HASIL DAN PEMBAHASAN . . . 49
A. ISOLASI DAN IDENTIFlKASI BAKTERI ASAM LAKTAT . . . 49
B. SELEKSI BAKTERI ASAM LAKTAT . . . 54
C. IDENTIFlKASI SENYAWA ANTIMIKROBA . . . 61
1. Total Asam Tertitrasi . . . 61
2. Hidrogen Peroksida . . . 63
3. Produksi Bakteriosin . . . 65
D. PENGARUH WAKTU KONTAK BAKTERI ASAM LAKTAT DENGAN MIKROBA PERUSAK DALAM MEDIA EKSTRAK lKAN RUCAH . . . 67
v. KESIMPULAN DAN SARAN . . . 76
A. KESIMPULAN . . . 76
B. SARAN . . . 77
DAFTAR PUS TAKA . . . 79
LAMPlRAN . . . 84
Tabel 1. Sifat-sifat umum bakteri asam laktat Tabel 2. Bakteri yang ditemukan mendominasi
fermentasi ketimun dalam berbagai
Halaman
9
tahap fermentasi . . . 23
Tabel 3. Hasil uji pewarnaan gram isolat bakteri
asam laktat dari pikel ketimun 51
Gambar 1. Isolasi dan identifikasi bakteri asam
laktat dari pikel ketimun dan acar . . . 39 Gambar
Gambar
Gambar
2. Diagram alir uji
3. Pikel ketimun
4. Acar
kontak 45
50
50
Gambar 5. Lactobacillus plantarum pi 402 . . . 53 Gambar 6. Pediococcus ca 101 . . . 53 Gambar
Gambar Gambar
7. uji difusi sumur terhadap S. aureus 8. Areal penghambatan Alcaligenes sp. 9. Areal penghambatan P. fluorescens Gambar 10. Areal penghambatan E. coli
55
56
56
57
Gambar 11. Areal penghambatan L. monocytogenes . . . 58 Gambar 12. Areal penghambatan S. typhimurium . . . 59
Gambar 13. Areal penghambatan S. aureus 59
Gambar 14. Areal penghambatan V. parahaemolyticus 60
Gambar 15. Total asam yang diproduksi oleh
bakteri asam laktat 62
Gambar 16. Akumulasi hidrogen peroksida yang
dihasilkan oleh bakteri asam laktat . . . 64 Gambar 17. Log (Nc/No) Alcaligenes sp. setelah
uji kontak dengan bakteri asam laktat 68
Gambar 18. Log (Nc/No) bakteri asam laktat setelah
uji kontak dengan Alcaligenes sp.
. ...
69 Gambar 19. Log (Nc/No) P. fluorescens setelahuji kontak dengan bakteri asam laktat 70
Gambar 20. Log (Nc/No) bakteri asam laktat setelah
uji kontak dengan P. fluorescens
...
71asam laktat dalam media ekstrak ikan
rucah
Gambar 22. % asam laktat dan pH P. fluorescens yang dikontakkan dengan isolat bakteri
asam laktat dalam media ekstrak ikan
rucah
vii
73
Halaman
Lampiran 1. Kurva standar hidrogen peroksida . . . 85
Lampiran 2. Sifat fisiologi dan 「ゥッォゥセゥ。@ bakteri
asam laktat yang diisolasi dari
pikel ketimun . . . 86
Lampiran 3. Sifat fisiologi dan biokimia bakteri
asam laktat yang dilsolasi dari acar ... 87
Lampiran 4. Hasil pengukuran areal penghambatan
terhadap bakteri patogen dan pembusuk .. 88
Lampiran 5. Total asam yang diproduksi oleh bakteri asam laktat dalam media
sintetik asam laktat . . . 89
Lampiran 6. Akumulasi hidrogen peroksida yang
diproduksi oleh bakteri asam laktat
dalam air pepton 1 % . . . 90
Lampiran 7. Pengaruh bakteri asam laktat terhadap
bakteri perusak dalam media ekstrak
ikan rucah . . . . . . . . . . . . .. 91
Bakteri asam laktat di dalam fermentasi makanan
secara spontan sering ditemukan sebagai mikroba dominan
yang menghambat pertumbuhan bakteri P7mbusuk dan patogen.
Kultur bakteri asam laktat dapat diperoleh dari
produk-produk fermentasi sayuran (pikel, sauerkraut, sayur asin,
dan sebagainya), fermentasi ikan (silase, bekasem,
chao-teri, terasi, dan sebagainya), dan fermentasi susu (keju,
yogurt, susu asam, dan sebagainya).
Ikan merupakan salah satu hasil perairan yang
banyak dimanfaatkan oleh manusia karena beberapa
kele-bihannya. Ikan merupakan sumber protein hewani yang
sangat potensial dan biasanya kandungan proteinnya sekitar
15 - 24 % tergantung dari jenis ikannya. Protein ikan
mempunyai daya cerna yang sangat tinggi yaitu hingga
sekitar 55 %. Akan tetapi ikan merupakan bahan pangan
yang sangat mudah mengalami kerusakan biologis oleh enzim
dan mikroorganisme pembusuk sehingga memerlukan penanganan
yang khusus untuk mempertahankan mutunya (Rahayu et al.,
1992) .
Untuk memperpanjang masa simpan ikan sebagai salah
satu alternatif dapat dilakukan penambahan kultur bakteri
asam laktat terseleksi. ',--1 Llndgren dan Dobrogosz (1990)
telah meneliti bahwa kultur starter bakteri asam laktat
menghambat sejumlah bakteri patogen pada daging dan
produk ikan tanpa fermentasi. Kultur bakteri asam laktat
tertentu ditambahkan pada daging sapi, daging unggas tanpa
tulang, steak sapi yang dikemas vakum dan udang, untuk
memperpanjang masa simpan produk pangan tersebut.
Aktivi-tas antimikroba ini disebabkan oleh produksi asam, H20 2 , dan bakteriosin oleh bakteri asam laktat.
Di antara galur-galur bakteri asam laktat, terdapat
perbedaan kemampuan dalam menghambat pertumbuhan bakteri
perusak dan patogen. Oleh sebab itu dalam penelitian ini
akan diisolasi bakteri asam laktat dari pikel ketimun dan
acar yang merupakan produk fermentasi spontan oleh bakteri
asam laktat.
Penelitian ini bertujuan untuk mendapatkan isolat
bakteri asam laktat yang berasal dari pikel ketimun dan
acar yang efektif dalam menghambat pertumbuhan bakteri
perusak dan bakteri patogen yang sering terdapat pada
ikan. Dalam penelitian ini dilakukan juga identifikasi
senyawa antimikroba yang dihasilkan oleh isolat bakteri
A. lKAN RUCAH
Ikan rucah adalah segala jenis ikan (termasuk
cumi-cumi dan rajungan) yang merup'akan hasil sampingan
dari suatu penangkapan. Sebetulnya ikan rucah
ter-tangkap secara tidak sengaja oleh para nelayan yang
tujuan usaha penangkapan utamanya adalah ikan-ikan
be-sar, misalnya tongkol, tenggiri, bawal putih, dan
sebagainya. Ikan rucah umumnya ditangkap pada
keda-laman antara 2-20 m. Pada musim barat, ikan rucah
cenderung hidup di bagian dasar laut sehingga tidak
banyak tertangkap.
Dari segi gizi, ikan rucah mempunyai nilai yang
sama dengan ikan-ikan lainnya yang digemari konsumen
atau jenis ikan meja, misalnya kembung, kakap, bawal,
dan lain-lain. Tetapi dipandang dari selera mungkin
saja ikan rucah tidak seenak ikan bawal, tenggiri atau
tongkol (Moeljanto, 1982).
Ikan rucah dan sisa-sisa olahan yang tidak bisa
dimakan manusia secara langsung, dapat digunakan
seba-gai bahan baku untuk membuat tepung ikan (Kompiang dan
Ilyas, 1983).
Pada umumnya daging ikan mengandung 16-20 %
-200000 IU/g vitamin D, 70 mg/g kolestrol, 10 asam
ami-no esensial, dan 10 asam amiami-no ami-non esensial
(Hadiwiyo-to, 1993).
B. MIKROBIOLOGI IKAN
Daging dan cairan ikan sehat yang masih segar
pad a umumnya steril secara alamiah, akan tetapi kulit,
lendir, insang, dan saluran pencernaan ikan mengandung
sejumlah mikroba, terutama bakteri. Kebanyakan
bak-teri ini berperan dalam kebusukan ikan (Moeljanto,
1982) .
Bakteri yang berperan dalam pembusukan ikan
merupakan bakteri gram negatif yang bersifat
psikro-trofik, karena ikan pada umumnya disimpan di dalam es
selama penangkapan dan penyimpanan. Bakteri ini
anta-ra lain dari grup Pseudomonas, Acinetobacter atau
Alcaligenes. Sedangkan mi.kroorganisme patogen yang
sering mengkontaminasi ikan yaitu staphylococcus
aureus, Salmonella sp., Clostridium botulinum,
Liste-ria monocytogenes, dan Vibrio parahaemolyticus
(Lindgren dan Dobrogosz, 1990).
Menurut Hadiwiyoto (1993), mikrobiologi ikan
ter-gantung pada tempat asal ikan ditangkap, keadaan, dan
sanitasi penangkapan ikan. Jenis-jenis ikan yang
ditangkap pada daerah-daerah yang bersuhu rendah
Pseudomonas, antara lain P . . pelludium, P. genicula-tum, P. povonacea, P. nigricans, P. fluorescens, P.
ovalis, P. fragi, P. multistriatum, P. schuylkillien-sis. Sementara itu golongan bakteri Achromobacter, Aerobacter, Flavobacterium, Micrococcus, dan Cytophaga
juga ditemukan. Ikan-ikan yang berasal dari daerah
panas, misalnya daerah エイッーセウL@ banyak mengandung
bak-teri mesofil yang kebanyakan dari golongan
Micrococ-cus. Ikan yang hidup di air tawar kebanyakan
mengan-dung Aeromonas, Lactobacillus, Brevibacterium,
Alcali-genes, dan streptococcus. Meskipun demikian
jenis-je-nis bakteri yang terdapat pada ikan selain
tergan-tung pada sumber pencemarannya juga tergantergan-tung pada
jenis hasil perikanan, perlakuan yang diberikan, dan
kerusakan yang ada pada ikan. Ikan-ikan yang
berlen-dir pada permukaan tubuhnya banyak mengandung
jenis-jenis Pseudomonas, Alcaligenes, Micrococcus,
Flavo-bacterium, CoryneFlavo-bacterium, Sarcina, Serratia, Vibrio, dan Bacillus.
Bakteri yang bersifat patogen (dapat menyebabkan
penyakit pada manusia) juga sering dijumpai pad a ikan,
seperti misalnya Clostridium, Salmonella, Shigella,
dan Vibrio. Bakteri klostridia yang sering ditemukan pada ikan adalah C. sporogenes, C. welchii, C. tetani. Vibrio yang sering ditemukan pada ikan adalah Vibri.o
c. BAKTERI ASAM LAKTAT
NセLN@ -"
a. Karakteristik Bakteri Asam Laktat
Dalam mikrobiologi pangan, pengelompokan
bakteri berdasarkan sifat ーセイエオュ「オィ。ョョケ。@ pada
makanan lebih penting daripada pengelompokan
ber-dasarkan sifat-sifat lainnya. Dengan
pengelom-pokan ini mudah diduga perubahan-perubahan yang
akan terjadi pada makanan jika suatu bakteri yang
termasuk dalam suatu kelompok tumbuh pada makanan.
Sifat yang terpenting dari bakteri asam
laktat adalah kemampuannya untuk menfermentasi
gula menjadi asam laktat. Sifat ini penting dalam
pembuatan produk fermentasi seperti fermentasi
sayur-sayuran (sauerkraut, pikel, dan sebagainya),
fermentasi susu (keju, yoghurt, susu asam, dan
sebagainya), dan fermentasi ikan (silase, bekasem,
chaoteri, terasi, dan sebagainya). Karena
pro-duksi asam oleh bakteri asam laktat berjalan
cepat, maka pertumbuhan mikroba lain yang tidak
diinginkan dapat terhambat (Fardiaz, 1989 dan
Rahayu et al.,1992).
Menurut stamer (1979), bakteri dapat
dikla-sifikasikan sebagai bakteri asam laktat
berda-sarkan perbedaan taksonomi (morfologi dan
termasuk gram positif berbentuk batang dan koki,
tidak membentuk ウーセイ。L@ tidak motil atau sedikit
sekali yang motil. Secara fisiologi, pada
metabo-lisme secara fermentasi, produksi akhir utama
adalah asam laktat, katalase negatif walaupun
beberapa spesies dapat menunjukkan reaksi positif
di bawah kondisi pertumbuhan tertentu,
mikroaero-filik sampai anaerob, kebutuhan nutrisi
kemoorga-notrofik dan kompleks, kebutuhan akan temperatur
mesofilik. Sifat jasad renik yang tumbuh pada
bahan pangan umumnya kemoorganotrofik, dimana
sebagai sumber energi dan sumber karbon
mengguna-kan senyawa organik (Fardiaz, 1989).
Bakteri asam laktat terutama menfermentasi
monosakarida dan disakarida, tetapi di dalam kasus
tertentu juga menfermentasi polisakarida, patio
Bakteri asam laktat yang memecah glukosa menjadi
asam laktat disebut bakteri asam laktat
homofer-mentatif.
berikut :
Prosesnya dapat ditunjukkan sebagai
glukosa ---> 2 asam laktat
Grup lain yang dikenal sebagai bakteri asam laktat
heterofermentatif memecah glukosa menjadi asam
asetat. Proses fermentasi yang umum dari tipe ini
(Prescott dan Dunn, 1959) sebagai berikut:
glukosa ---> asam laktat + CO2 + etil alkohol
Menurut Fardiaz (1989) yang termasuk bakteri
asam laktat adalah famili Lactobacillaceae,
yaitu Lactobacillus, dan famili streptococcaceae,
terutama Leuconostoc, streptococcus(dengan grup
D), Lactococcus (streptococcus grup N), dan
Pe-diococcus. Pediococcus dan beberapa spesies
Lac-tobacillus, misalnya Lb. lactis dan Lb. plantarum,
bersifat homofermentatif, sedangkan Leuconostoc
dan spesies Lactobacillus lainnya, seperti Lb.
brevis, bersifat heterofermentatif. Sifat umum
bakteri asam laktat dapat dilihat pada Tabel 1.
b. Aktivitas Antimikroba Bakteri Asam Laktat
Dalam fermentasi spontan, bakteri asam
lak-tat sering ditemukan sebagai mikroflora dominan
yang menghambat bakteri pembusuk dan patogen.
Aktivitas antimikroba disebabkan oleh metabolit
bakteri asam laktat berupa : asam organik (asam
laktat, asam asetat, asam format), diasetil, H20 2 ,
CO 2 , secara sendiri-sendiri atau kombinasi.
Se-lain itu penghambatan juga disebabkan ッャセセセjセセセ@
Tabel 1. Sifat-sifat umum bakteri asarn laktat *
morfologi toleransi suhu opt.
NaCl (%) °C
Kelas fi5io10gi
1- Homofermentatif
Genus
A. Lactobacillus batang 3-6 37-45
Spesies
1- thermobacterium 3-6 37-45
2. streptobacterium 9 28-32
B. Pediococcus kokus 25-33
Spesies
1- cerevisiae 10
2. demnosus 4
3. holophilus 10-18
4. parbulus 6.5
c. streptococcus kokus
Spesies
1- enterococcus 6.5 37
2. lactis 2.4 30
3. pyogenes 6.5 37
4. viridans 6.4 37
2. Hetero£errnentatif
Genus
A. Lactobacillus batang
spesies
1- betabacterium 6.8 28-40
B. Leuconostoc kokus
Spesies
1. cremoris 3 20-25
2. rnesenteroides 6.5 20-25
* Stamer (1980)
[image:22.603.102.527.186.712.2]1. Asam Organik
Akumulasi asam sebagai produk akhir dapat meningkatkan aktivitas antimikroba dalam produk fermentasi. Aktivitas antimikroba dari asam or-ganik tergantung pad a tiga faktor yaitu: (1) sema-ta-mata karena pengaruh pH, (2) tingkat disosiasi asam, (3) efek spesifik dari molekul asam itu sendiri (Smulders et al., 1986; Lindgren dan Dobrogosz, 1990).
Bakteri berkembang biak hanya dalam selang pH tertentu. Di luar selang pH itu pertumbuhan bakteri akan terganggu. Penurunan pH selama proses fermentasi tergantung pada jumlah asam yang dihasilkan oleh bakteri asam laktat dan kapasitas buffer dari makanan. Aktivitas antimi-kroba pH menu rut Smulders et al. (1986) tergantung
juga kepada bentuk ュッャ・ォセャ@ dari asam.
Efek penghambatan dari asam organik terutama tergantung jumlah asam tak terdisosiasi, karena asam terdisosiasi hanya memiliki efek penghambatan yang rendah. Asam tak terdisosiasi dapat
Asam asetat dilaporkan mempunyai efek
pengham-batan yang lebih besar bila dibanding asam laktat,
terutama terhadap khamir dan jamur. Beberapa
laporan menunjukkan asam asetat dan asam laktat
mempunyai hubungan yang sinergis dalam menghambat
pertumbuhan Salmonella dan khamir (Lindgren dan
Dobrogosz, 1990).
2. Bakteriosin
Bakteriosin merupakan peptida-peptida atau
protein dengan efek bakterisidal atau
bakteri-statik. Bakteriosin yang diproduksi oleh
bak-teri asam ャ。ォエ。セ@ dapat digunakan sebagai
penga-wet alami dalam industri pangan (Larsen et al.,
1993).
Berdasarkan spektrum aktivitasnya,
bakterio-sin dapat diklasifikasikan menjadi dua tipe. Tipe
pertama, bakteriosin dengan spektrum aktivitas
yang sempit, mempunyai efek sidal terhadap
or-ganisme yang mempunyai hubungan yang dekat.
Bak-teriosin yang termasuk kelompok ini antara lain:
plantaricin A, laktosin 27, dan diplokokin. Tipe
kedua, bakteriosin yang menghambat organisme gram
positif dengan spektrum yang lebih luas.
Bakteri-osin yang masuk kelompok ini antara lain:
atau galur dari bakteri pembusuk dan patogen pada makanan, seperti Listeria monocytogenes dan
Clos-tridium botulinum termasuk sasaran grup yang
terakhir (Hurst, 1983; Lindgren dan Dobrogosz, 1990; Marugg, 1991). Lebih ianjut lagi menurut Marugg (1991), bakteriosin merupakan senyawa yang tidak beracun terhadap manusia, sehingga bakterio-sin mempunyai potensi yang besar sebagai bahan pengawet dalam berbagai produk makanan (fermentasi dan non fermentasi) .
Lactococcus lactis menghasilkan suatu senyawa polipeptida yang disebut nisin. Nisin mempunyai spektrum antibakteri terhadap streptokoki, sta-filokoki, Bacillus sp., Clostridium, dan laktoba-silli. Sekarang nisin telah diterima sebagai bahan tambahan makanan, terutama karena aktivitas penghambatannya terhadap. spora (Lindgren dan Do-brogosz, 1990). Nisin stabil terhadap panas pada pH yang rendah dan merupakan peptida kecil atau senyawa protein, dengan aktivitas spektrum yang luas. Nisin terutama aktif menghambat bakteri gram positif (Gilliland, 1985).
lactis subsp. cremoris lain dan L. lactis
(Lindgren dan Dobrogosz, 1990).
Lactobacillus plantarum memproduksi laktolin,
yang berbeda karakteristiknya dengan nisin maupun
diplokokin. Lb. acidophilus memproduksi
antibio-tik : laktolidin, asidopilin, dan asidolin
(Gilli-land, 1985).
Pediococcus acidilactici SJ-1 yang diisolasi
dari produk fermentasi daging memproduksi senyawa
antibakteri yang aktif menghambat galur
Lactoba-cillus sp., Clostridium perfringens dan Listeria
monocytogenes. Senyawa ini sensitif terhadap enzim
proteolitik, diidentifikasi sebagai bakteriosin
dan diberi nama pediosin SJ-1. Pediosin SJ-l
stabil pad a selang pH yang lebar (pH 3 - 9),
teta-pi paling stabil pada selang pH yang rendah. Pada
selang pH 3 - 6, pediosin SJ-1 stabil terhadap
suhu proses yang tinggi (65-125°C), tetapi
aktivi-tasnya menurun secara nyata bila dipanaskan pada
pH 7.0 (Schved et al., 1993).
Menurut Marugg (1991), Pediococcus
acidilac-tici galur PAC 1.0 memproduksi bakteriosin
yang dikenal dengan nama pediosin PA-l. Pediosin
PA-1 aktif menghambat P. ad.dilactici, P.
pentasa-ceus, Lactobacillus plantarum, Lb. casei, Lb.
Listeria monocystogenes.
Pediosin PA-1 merupakan senyawa dengan berat molekul rendah dan merupakan protein tahan panas yang sensitif terhadap bebera-pa enzim proteolitik.3. Hidrogen Peroksida
Hidrogen peroksida dihasilkan oleh bakteri asam laktat dengan adanya oksigen melalui
aktivi-tas oksidasi flavoprotein atau peroksidasi NADH. Efek bakterisidal hidrogen peroksida disebabkan oleh efek oksidasi yang kuat pada sel bakteri dan perusakan struktur molekul dasar dari sel protein (Lindgren dan Qobrogosz, 1990). Hidrogen perok-sida dapat terakumulasi dan menjadi produk akhir dari suatu proses fermentasi (Hurst, 1983).
cremoris dan Lactococcus lactis subsp.
diacetylac-tis juga mempunyai aktivitas antimikroba terhadap
bakteri patogen dan bakteri pembusuk. Diasetil
lebih efektif menghambat bakteri gram negatif.
Dari penelitian didapatkan'bahwa diasetil baru
mempunyai aktivitas antimikroba bila terdapat
dalam konsentrasi lebih dari 170 ppm. Karena pada
umumnya konsentrasi diasetil dalam produk
fermen-tasi kurang dari 170 ppm, maka diasetil dianggap
kurang berpengaruh dalam pengawetan pangan.
Teta-pi kombinasi dengan metabolit lain mungkin
mem-berikan aktivitas antimikroba yang besar
(Gilli-land, 1985).
5. Karbon Dioksida
Akumulasi CO 2 (HC0 3-) dalam produksi fermen-tasi sayuran merupakan hasil respirasi endogenes
dari sel tanaman dan hasil aktivitas mikroba.
Peranan karbon dioksida dalam mengawetkan makanan
disebabkan oleh dua hal. Pertama, menciptakan
kondisi anaerobik dengan menggantikan molekul
oksigen yang ada dalam produk. Kedua, karbon
dioksida mempunyai aktivitas antimikroba.
Meka-nisme penghambatan belum diketahui secara pasti,
diduga karbon dioksida menghambat proses
dalam kedua lapisan membran lemak menyebabkan
gangguan fungsi permeabilitas (Lindgren dan
Dobro-gosz, 1990).
c. Peranan Bakteri Asam Laktat sebagai Bahan Penga-wet Makanan
Kultur bakteri asam laktat dapat digunakan
untuk memperpanjang masa simpan daging terutama
daging segar. Penambahan kultur Lb. brevis pada
irisan daging sapi dapat menghambat pertumbuhan
bakteri pembusuk gram negatif, sehingga masa
simpan daging sapi tersebut dapat diperpanjang
beberapa hari (Smith dan Palumbo, 1983).
Penambahan kultur campuran P. cerevisiae dan
Lb. plantarum dapat memperpanjang masa simpan
daging unggas segar maupun yang telah dimasak.
Pertumbuhan s. typhimurium dan s. aureus pada
daging unggas masak sarna sekali terhenti dengan
penambahan kultur campuran P. cerevisiae dan Lb.
plantarum. Kedua kultur campuran ini juga dapat
menghambat pertumbuhan Pseudomonas fluorescens,
P. fragi, dan P. putrefaciens pada daging unggas
masak (Raccach dan Baker, 1978).
Kultur Lb. plantarum, Lb. bulgaricus, dan L.
lactis yang masing-masing ditambahkan pada
pembusuk pada daging domba dengan sukses.
Ketiga ku1tur tersebut terbukti dapat menghambat
pertumbuhan bakteri psikotrofik batang gram
nega-tif, grup bakteri co1i-aerogenes, stafi1okoki, dan
bakteri pembusuk yang bersifat proteo1itik dan
1ipo1itik. Aktivitas antimikroba ketiga kultur
tersebut terutama disebabkan oleh produksi asam
(Smulders et a1., 1986).
Penambahan bakteri asam 1aktat dapat
memper-panjang masa simpan dan menghambat pertumbuhan
bakteri patogen pada daging dan produk ikan tanpa
fermentasi. Kultur bakteri asam laktat terse1eksi
yang 、ゥエ。ュ「。ィォ。セ@ pada daging sapi, daging unggas,
daging sapi yang dikemas vakum, dan udang dapat
memperpanjang masa simpan produk pangan tersebut.
Aktivitas antimikroba kemungkinan besar disebabkan
oleh hidrogen peroksida, asam, dan bakteriosin
(Lindgren dan Dobrogosz, 1990).
Penambahan nisin pada daging ham dapat
menurunkan penggunaan nitrit dari konsentrasi 150
ppm menjadi 40 ppm tanpa kehilangan 。ォエゥカゥセ。ウ@
pengawetan nitrit dan tidak terjadi perubahan
warna pada daging ham (Rayman et al., 1981 dalam
Hurst, 1983).
Keju cottage yang dibuat dengan penambahan
menghambat perubahan formasi dan degradasi protein
yang disebabkan oleh P. fragi dan P. putrefaciens (Babel, 1976). Produksi asam oleh starter bakteri
asam laktat akan menghambat pertumbuhan dan
menginaktifasi enterogenik 'E. coli se1ama
pem-buatan keju Camembert (Frank dan Marth, 1977).
Penambahan kultur L. lactis, bakteri
pengha-sil nisin, pada keju swiss dapat menghambat
keru-sakan yang disebabkan oleh C. butyricum dan C.
tyrobutyricum (Hirsch et al., 1951 dalam Hurst, 1983) .
D. PIKEL
Pikel adalah sejenis makanan pad at yang diawetkan
dengan menggunakan asam. Asam tersebut dapat berasal
dari proses fermentasi cairan buah atau sayuran itu
sendiri atau dapat pula ditambahkan cuka makan
(Frazier dan Westhoff, 1978).
Ketimun merupakan salah satu bahan yang sering
digunakan sebagai bahan baku pikel (Cruess, 1958).
Jenis pikel yang lain yaitu pikel campuran/acar/mixed
pickles terdiri dari dua atau lebih sayuran dalam satu
wadah fermentasi. Ketimun, kembang kol, cabai
hi-jau, bawang merah, buncis, dan tomat hijau merupakan
sayuran yang umumnya digunakan dalarn pembuatan acar
Pikel ketimun adalah produk fermentasi dari
keti-mun segar (Jay, 1986). Ketimun yang akan dibuat pikel
dipilih yang masih mentah dan segar, ketimun yang
luka atau busuk dapat menyebabkan kebusukan selama
proses fermentasi (Vaughn, 1985). '
Dalam fermentasi ketimun sering ditambahkan 1%
glukosa untuk membantu proses fermentasi terutama
kalau ketimun mengandung glukosa yang rendah sekali
(Muchtadi, 1989).
Pada umumnya ketimun difermentasi dalam larutan
garam pada kisaran 20 - 30oSalometer (sekitar 5 - 8 %
NaCl). Pada konsentrasi gar am demikian urutan
bakteri asam laktat yang tumbuh hampir sama dengan
sauerkraut. Tetapi pada ketimun spesies Leuconostoc
tidak pernah mendominasi stadium awal dari fermentasi
meskipun pada konsentrasi garam 5 % dan pada
konsen-trasi 8 %, spesies itu sama sekali tidak terdeteksi
lagi (Daulay dan Rahman, 1992; Vaughn, 1985).
Apabila fermentasi dilakukan dalam larutan garam
dengan konsentrasi 20 - 30 oSalometer garam, spesies
bakteri asam laktat yang paling banyak terdapat adalah
Pediococcus cerevisiae, Lactobacillus brevis dan Lb. plantarum. Dalam hal ini, Pediococcus cerevisiae dan
Lactobacillus brevis kurang tahan terhadap garam
dibandingkan dengan Lactobacillus plantarum sehingga
pada konsentrasi garam yang lebih tinggi (300
Salome-ter) (Daulay dan Rahman, 1992; Vaughn, 1985).
Stadium permulaan fermentasi pada umumnya
berlangsung selama 2 atau 3 hari dengan kekecualian
bisa berlangsung selama 7 hari atau lebih lama.
Selama periode ini, bakteri asam laktat dan khamir
yang melakukan fermentasi dan pengoksidasi tumbuh
dengan cepat, dan mikroorganisme yang tidak
diingin-kan berkurang atau keseluruhannya hilang sebagai
akibat dari peningkatan keasaman atau penurunan pH
(Daulay dan Rahman, 1992; Vaughn, 1985).
Dalam larutan garam fermentasi ketimun berkadar
garam rendah (5 % NaCl) , campuran dari spesies-spesies
yang toleran-asam-rendah dari Leuconostoc dan toleran-asam-tinggi dari Lactobacillus dan Pediococcus menjadi predominan pada stadium intermediat dari fermentasi
(Daulay dan Rahman, 1992; vaughn, 1985).
Stadium akhir dari fermentasi disempurnakan oleh
spesies-spesies Lactobacillus brevis, Lb. plantarum
dan Pediococcus cerevisiae. Bakteri-bakteri inilah
yang berperan untuk pembentukan asam laktat dalam
larutan garam dengan konsentrasi 20 - 30oSalometer.
Ketiga spesies tersebut terdapat apabila ketimun
di-fermentasi dengan konsentrasi garam 30oSalometer, akan
tetapi aktivitas dari Pediococcus cerevisiae sangat
ketika pH turun ke sekitar pH 3.7. Hal ini
mengaki-batkan hanya kedua spesies Lactobacillus yang tinggal
untuk menyelesaikan proses fermentasi. Pada akhir
fermentasi total keasaman adalah sekitar 0.90 % asam
laktat dengan pH 3.3 dengan syarat aktivitas khamir
oksidatif dikontrol dengan kondisi anaerobik (Daulay
dan Rahman, 1992; Vaughn, 1985).
Bakteri yang umumnya ditemukan mendominasi
fer-mentasi ketimun dalam berbagai tahap ferfer-mentasi dapat
dilihat pada Tabel 2. Semua bakteri yang tercantum
pada Tabel 2 tersebut dapat ditemukan dalam ketimun
yang difermentasi dalam larutan garam 20 - 30o
Salome-ter (Vaughn, 1954).
Suhu mempengaruhi proses fermentasi. Suhu antara
24 - 30°C merupakan suhu optimal untuk fermentasi
ketimun (Prescott dan Dunn, 1959).
Fermentasi asam laktat terjadi pad a keadaan
anaerob. Kondisi anaerob dicapai dengan cara menutup
bag ian mulut wadah dengan rapat. Oksigen yang
terda-pat pada ruangan yang tersisa akan segera habis oleh
proses respirasi sel dengan bantuan bakteri (Frazier
dan Westhoff, 1978). Khamir oksidatif dapat tumbuh
pada permukaan garam pada kondisi anaerobik tidak
sempurna. Khamir oksidatif tersebut akan mengoksidasi
asam laktat, menaikkan pH dan merangsang pertumbuhan
si ketimun dalam berbagai tahap fermentasi*
Tahap fermentasi Spesies bakteri dominan
Awal Aerobacter aerogenes
Aerobacter cloacae Eschericia ヲイ・セョ、ゥゥ@
Eschericia intermedium
Bacillus mesentericus-Bacillus megatherium groups Bacillus (Aerobacillus) polymyxa Bacillu's (Aerobacillus) macerans
Intermediat Leuconostoc mesenteroides
Lactobacillus plantarum Lactobacillus brevis Lactobacillus fermenti
Akhir
*
Lactobacillus plantarum Lactobacillus brevis Lactobacillus fermenti
Vaughn (1954)
E. KARAKTERISTIK BEBERAPA BAKTERI PERUSAK
1. Pseudo1llOnas f1.uorescens
Pseudomonas fluorescens merupakan bakteri
gram negatif, bersifat kemoorganotrof, yaitu
meng-gunakan senyawa organik sebagai sumber energi dan
sumber karbon. Metabolisme dilakukan dengan
respirasi, tidak pernah fermentatif (Pelczar dan
Chan, 1988)
Menurut Jay (1986), Pseudomonas banyak
terda-pat pada tanah, air, tumbuhan, saluran usus
menimbulkan kerusakan pada daging, unggas, telur,
dan hasil perikanan.
Sifat-sifat Pseudomonas yang penting yang
mempengaruhi pertumbuhannya pada makanan menu rut
Fardiaz (1989) adalah sebagai berikut: (1)
umumnya mendapatkan sumber karbon dari senyawa
bukan karbohidrat, (2) dapat menggunakan
senyawa-senyawa sumber nitrogen sederhana, (3) kebanyakan
spesies tumbuh baik pada suhu rendah, P. fluores-cens dapat tumbuh dengan baik pada suhu 37°C, (4) memproduksi senyawa-senyawa yang menimbulkan bau
busuk, (5) dapat mensintesa faktor-faktor
pertum-buhan dan vitamin, (6) beberapa spesies bersifat
proteolitik (memecah protein) dan lipolitik
(meme-cah lemak), atau pektinolitik (peme(meme-cah pektin) ,
(7) pertumbuhannya pada kondisi aerobik berjalan
cepat, dan biasanya berbentuk lendir, (8) Tidak
tahan panas dan keadaan kering, oleh karena
itu mudah dibunuh
pengeringan.
dengan proses pemanasan dan
2. iUcal.igenes sp.
Alcaligenes terdiri dari 9 spesies, merupakan bakteri gram negatif, berbentuk batang, tetapi
kadang-kadang berbentuk
gram positif (Jay, 1986).
bulat, atau bersifat
aerobik. Mempunyai suhu pertumbuhan yang optimum
pada kisaran 20 sampai 37°C. Kebanyakan spesies
merupakan penghuni saprofit yang umum pada sa luran
pencernaan vertebrata. Bakteri ini banyak
ditemu-kan pada produk susu, air, air laut, dan tanah
(Pelczar dan Chan, 1988).
Menurut Fardiaz (1989), Alcaligenes merupakan
jenis bakteri yang sering menimbulkan masalah
pada pendinginan makanan karena bakteri ini
ber-sifat psikrotrofik. Kebanyakan spesies bersifat
proteolitik, yaitu memecah protein menjadi asam
amino, pepton, kemudian amonia, sehingga
mengha-silkan reaksi alkali.
F. KARAKTERISTIK BEBERAPA BAKTERI PATOGEN
1. Escherichia coLi
Escherichia coli a.dalah suatu bakteri gram negatif berbentuk batang dan bersifat anaerobik
fakultatif. E. coli adalah bakteri koliform fekal dan biasanya digunakan sebagai mikroorganisme
indikator terhadap kontaminasi feses pada air dan
susu (Fardiaz, 1983).
Bakteri ini dapat menggunakan asetat sebagai
sumber karbon, tetapi tidak dapat menggunakan
sitrat. Glukosa dan beberapa karbohidrat lainnya
selanjutnya menghasilkan asam laktat, asetat, dan
format. Asam format kemudian dapat dipecah oleh
hidrogenliase menghasilkan CO 2 dan H2 dalam jumlah yang sama.
Kisaran suhu pertumbuhan E. coli adalah 30
sampai 40°C, dengan suhu optimum 37°C.
buhan optimum terjadi pada pH 7.0 - 7.5,
pada pH 4.0 dan maksimum pada pH 9.0.
minimum untuk pertumbuhan adalah 0.96.
Pertum-minimum
Nilai a w Bakteri
ini relatif sangat sensitif terhadap panas dan
dapat diinaktifkan pada suhu makanan at au selama
pemasakan makanan (Fardiaz, 1983).
E. coli sering mengkontaminasi makanan,
se-perti produk olahan susu, sayuran segar, dan
salad. Enteropatogenik E. coli sering menyebabkan
radang usus dengan waktu inkubasi antara 6 - 36
jam (Van Demark dan Batzing, 1987).
2. Listeria monocytogenes
Listeria monocytogenes merupakan bakteri
berbentuk batang agak bulat, kecil, dan gram
posi-tif. Bakteri ini memproduksi beta-hemolisis pada
agar darah, dan sangat sukar diisolasi. Bakteri
ini juga tumbuh baik pada suhu 4 - 6°C.
L. monocytogenes merupakan bakteri yang tahan
suhu 80°C selama 5 menit atau suhu 100°C selama 15
detik. Oleh karena itu perlakuan pasteurisasi
tidak dapat membunuh bakteri ini. Bakteri ini
juga tahan terhadap lingkungan yang kering
(Far-diaz, 1983).
3 • SaI1llOneIIa t:yphimuriUlll
Salmonella typhimurium merupakan bakteri gram
negatif, dan berbentuk batang (Fardiaz, 1989).
Bakteri ini bersifat anaerobik fakultatif dan
mampu tumbuh pada medium sintetis tanpa faktor
pertumbuhan khusus (Pelczar dan Chan, 1988).
Suhu pertu.mbuhan S. typhimurium berkisar
antara 5°C sampai 47°C, dengan suhu optimum 35
-37°C. Nilai pH untuk pertumbuhan bakteri ini
adalah antara 4.1 - 9.0, dengan pH optimum 6.5
-7.5. Pada pH dibawah 4.0 dan diatas 9.0, bakteri
ini akan mati secara perlahan-lahan.
optimumnya adalah 0.945 - 0.999.
Nilai a w
Makanan yang sering terkontaminasi oleh
S. typhimurium adalah telur, daging, ikan, dan
daging unggas. Bakteri ini dapat menyebabkan
salmonellosis, yaitu penyakit gastrointestinal
akut yang disebabkan oleh spesies-spesies
perut yang mendadak, demam, mual, dan muntah (Van
Demark dan Batzing, 1937).
4 • ウエ[。ーィケセッ」ッ」」オウ@ aureus
staphylococcus aureus adalah bakteri gram
positif, berbentuk kokus, hidup secara aerobik
ataupun anaerobik fakultatif, dan patogenik.
Galtir tertentu memproduksi enterotoksin yang
tahan panas (Pelczar dan Chan, 1933).
Suhu optimum untuk pertumbuhan S. aureus
adalah 35 - 37°C, dengan suhu minimum 6.7°C dan
suhu maksimum 45.5°C. Bakteri ini dapat tumbuh
pada pH 4.0 9.3, dengan pH optimum sekitar 7.0
-7.5 (Fardiaz, 1983).
S. aureus sering mengkontaminasi makanan
seperti daging dan produk-produk daging, ikan,
susu dan produk-produk susu.
Sifat patogen bakteri ini berhubungan dengan
produksi koagulase yaitu enzim yang mengkoagulasi
plasma darah, hemolisis (pemecahan) sel darah
merah, dan produksi deoksiribonuklease (DNAse)
yang tahan panas (Van Demark dan Batzing, 1987).
5. Vibrio ー。イ。ィ。・jャQoセケエZゥ」オウ@
Vibrio parahaemolyticus merupakan bakteri
agak melengkung, dan tidak tahan asam (Pelczar dan
Chan, 1988).
V. parahaemolyticus bersifat anaerobik fa-kultatif, dapat hidup pada konsentrasi NaCl
berki-sar antara 0.5 - 9 %, dengan konsentrasi optimun 3
%. suhu optimum untuk pertumbuhan adalah 37°C,
dengan suhu minimum 8°C dan suhu maksimum 44°C.
Bakteri ini dapat tumbuh pada pH 4.5 - 11, dengan
pH optimum 6.5 - 9.0. Aw minimal pertumbuhan 0.94
(Liston, 1980).
Makanan yang sering terkontaminasi oleh V.
parahaemolyticus 。、セャ。ィ@ makanan-makanan hasil laut seperti udang, lkan, kepiting, kerang, lobster,
dan sebagainya. Bakteri ini menyebabkan
berba-gai macam gejala penyakit yaitu diare ringan,
kejang perut, mual, muntah, pusing dan demam, dan
mengigil. Masa inkubasi dari mulai mengkonsumsi
makanan yang terkontaminasi sampai timbulnya
penyakit bervariasi dari 4 - 96 jam, dengan
rata-rata 12 - 24 jam, tergantung jumlah sel bakteri
yang tertelan dan daya tahan pender ita (Fardiaz,
A. BAHAN DAN MEDIA
Bahan mentah yang digunakan adalah ketimun, ikan
rucah segar (ikan peperek/ Leigona thidae) , acar
(berisi ketimun, bawang merah, dan cabai rawit) yang
diperoleh dari penjual sate di sekitar Bogar, garam,
dan gula. Bakteri yang digunakan adalah Alcaligenes
sp. atau Achromobacter sp. DSM 30002 dan
Pseudomo-nas fluorescens DSM 50106 dari Jerman, Escherichia
coli dan Staphylococcus aureus dari Laboratorium
Mikrobiologi Jurusan Teknologi Pangan, Fateta, IPB,
Salmonella typhimuri"um, Vibrio parahaemolyticus, dan
Listeria monocytogenes dari Balai Penelitian
Veteriner, Bogar.
Isolat bakteri asam laktat dipelihara dalam media
agar MRs-CaC0 3 semi padat. Untuk P. fluorescens
digu-nakan media agar Pseudomonas, untuk L. monocytogenes
media TSA, untuk V. parahaemolyticus media agar
Ma-rine, dan untuk bakteri penguji lain digunakan agar
Nutrien. Broth yang digunakan untuk menumbuhkan
kul-tur kerja bakteri asam laktat adalah MRS broth, untuk
L. monocytogenes digunakan BHI broth, dan untuk
bak-teri penguji lain ditumbuhkan dalam Nutrien broth.
Untuk identifikasi bakteri asam laktat
arginin broth , agar Leuconostoc, Litmus Milk, Gibson
semi padat, dan ·MRS broth.
Untuk menguji aktivitas antimikroba bakteri asam
laktat terhadap Alcaligenes sp. digunakan media TSA,
P. fluorescens: PA, E. coli: EMBA, L. monocytogenes: TSA, S. aureus: BPA, S. typhimurium: agar McConcey, V. parahaemolyticus: TCBSA.
Untuk menghitung jumlah bakteri asam laktat yang
dikontakkan. dengan P. fluorescens dalam media ekstrak ikan rucah digunakan agar MRS, agar MRS-Natrium azida
digunakan untuk menghitung bakteri asam laktat yang
dikontakkan dengan Alcaligenes sp., agar Nutrien
untuk menghitung jumlah P. fluorescens dan Alcaligenes sp. baik yang dikontakkan dengan bakteri asam laktat
atau tidak dalam media ekstrak ikan rucah.
Bahan-bahan lain yang digunakan yaitu NaCl
seba-gai pengencer, air pepton sebagai media pertumbuhan
bakteri asam laktat untuk menghasilkan hidrogen
perok-sida, dan media sintetik asam laktat sebagai media
pertumbuhan bakteri asam laktat untuk memproduksi
asam. Bahan kimia yang digunakan adalah NaOH, HC1,
B. METODE PENELITIAN
"1. Isolasi dan Identifikasi Bakteri Asam Laktat"dari
Pikel Ketimun Dan Acar
a. Pembuatan Pikel Ketimun
Untuk pembuatan pikel ketimun, dipilih
ketimun yang masih muda, dicuci, dipotong-potong
agar didapat ukuran yang seragam dan dimasukkan ke
dalam stoples yang berisi larutan garam dengan
konsentrasi 5% NaCl. Sebanyak 1% glukosa
ditam-bahkan untuk membantu proses fermentasi. Ketimun
diusahakan supaya terendam di bawah permukaan
larutan garam. ·Toples ditutup rapat. Fermentasi
dilakukan pada suhu kamar.
b. Isolasi Bakteri Asam Laktat
Isolasi bakteri asam laktat dari pikel
keti-mun dilakukan pada waktu fermentasi 2, 4, 6, 9,
12/ dan 16 hari. Isolasi bakteri asam laktat dari
acar yang dibeli dari tukang sate dilakukan sehari
setelah pembelian.
Cairan dari pikel ketimun dan acar diencerkan
dengan larutan NaCl 0,85% sampai pengenceran 10- 6 .
Sebanyak 1 ml contoh dari pengenceran 10- 5 - 10- 6
diambil dan dipindahkan ke dalam cawan petri
agar MRS dituang ke dalam cawan petri dan di-goyang secara mendatar. Setelah agar membeku, cawan diinkubasi dalam posisi terbalik pada suhu 37°C selama dua hari.
Cawan dengan kOloni-koloni yang terpisah dipilih, koloni-koloni yang mempunyai warna dan ukuran yang berbeda 、ゥセゥョ、。ィォ。ョ@ ke dalam cawan petri yang berisi agar MRS dengan membuat goresan kuadran. Inkubasi dilakukan pada suhu 37°C selama 2 hari. Jika koloni dalam cawan petri belum murni (misalnya besar koloni tidak seragam) maka diambil satu koloni dan dibuat goresan kuadran lagi pada agar MRS sampai diperoleh koloni-koloni dengan ukuran yang seragam.
Isolat-isolat bakteri asam laktat yang telah murni ditumbuhkan dalam MRS broth selama 2 hari. Kultur ini akan digunakan sebagai inokulum untuk identifikasi awal.
c. Identifikasi Bakteri Asam Laktat 1. Identifikasi awal
Identifikasi awal meliputi uj i katalase dan pewarnaan gram.
Uji katalase (Fardiaz, 1987) Satu loop
tersebut. Timbulnya gelembung-gelembung
oksigen pada kultur menunjukkan uji positif.
Bakteri asam laktat akan menunjukkan uji
kata-lase negatif.
Pewarnaan gram (Fardia'z, 1987). Satu loop
kultur cair disebarkan pada gelas obyek.
Kultur cair dikeringkan di udara dan difiksasi
dengan nyala api kecil. Pewarna kristal violet
diteteskan di atas film pada gelas obyek
selama 1 menit, kemudian dibilas dengan air
kran. sisa air yang tertinggal dibuang, dan
lapisan film kultur ditetesi dengan larutan
Lugol (yodium Gram) selama 1 menit. Setelah
dicuci kembali dengan air, kemudian dihilangkan
warnanya dengan menggunakan alkohol 95% selama
10 - 20 detik atau sampai warna biru tidak
luntur lagi. Setelah dicuci sebentar, kemudian
lapisan film kultur diwarnai dengan larutan
safran in selama 10 - 20 detik. Setelah dibilas
dengan air dan dikeringkan dengan kertas serap,
lapisan film bakteri diperiksa di bawah
mikros-kop dengan pembesaran 1000 kali. Bakteri asam
laktat merupakan bakteri gram positif ditandai
Isolat yang menunjukkan uji katalase nega-tif dan hasil pewarnaan gram biru-ungu disimpan di dalam MRS-CaC03 semi padat.
2. Uji Biokimia Bakteri asセ@ Laktat (Nuraida,
1988)
Sebagai inokulum untuk identifikasi, diambil satu sampai dua loop isolat dari media MRS-CaC03 semi padat. Ditumbuhkan pada media MRS broth selama 2 hari pada suhu 37°C
Produksi CO2 dari glukosa. Tes ini untuk membedakan bakteri homofermentatif dan
hetero-fermentatif 4engan menggunakan media. Gibson semi padat. Cara pembuatan media Gibson semi padat adalah sebagai berikut 10 ml mangan sulfat dieampur dengan 800 ml susu skim. Ke dalam eampuran tersebut ditambahkan 2,5 gr ekstrak khamir dan 50 gr glukosa. Larutan dipanaskan dalam penangas air. Selagi panas, ditambahkan 200 ml agar nutrien. Media ,didis-tribusikan ke dalam tabung reaksi dengan keda-laman 5-6 em, Sterilisasi dilakukan dengan menggunakan penangas air masing-masing 30 menit
selama 3 hari berturut-turut,
1 tetes inokulum ditambahkan dengan menggunakan
pipet tetes steril, kemudian ditambahkan 1 ml
agar cair steril 1,5%. Inkubasi dilakukan pada
suhu 37°C selama 2 - 5 hari. Bakteri laktat
heterofermentatif akan membentuk gas ditandai
dengan pecahnya atau meloncatnya agar.
Produksi amonia dari arginin. Tes ini
digunakan untuk membedakan laktobasili
hetero-fermentatif dan homohetero-fermentatif. Tes ini juga
digunakan untuk membedakan Leuconostoc dengan
bakteri asam laktat heterofermentatif lainnya.
Cara pembuatan MRS arginin broth 3 gr
L-arginin monohidrat dilarutkan dalam 1 liter
MRS broth, sterilisasi dilakukan dengan
auto-klaf 121°C selama 15 menit. Streptokoki
argi-nin broth: 5 gr tripton, 2,5 gr ekstrak
kha-mir, 0,5 gr glukosa, 2 gr K2 2HP0 4 , 3 gr L-arginin monohidrat dilarutkan dalam 1 liter air
destilata, sterilisasi dilakukan dengan
auto-klaf 121°C, 15 menit.
MRS arginin broth dan streptokoki arginin
broth diinokulasi dengan 1 tetes inokulum.
Kultur kemudian diinkubasikan selama 2 5
hari pada suhu 37°C. Sebanyak 1 ml kultur
dimasukkan ke dalam tabung reaksi, kemudian
sarna. p・ュ「・ョエオォセョ@ amonia ditandai dengan
pembentukan warna oranye kecoklatan setelah
penambahan Reagen Nessler.
Produksi dekstran dari sukrosa. Tes ini digunakan untuk membedakan 'Leuconostoc tertentu dengan bakteri laktat berbentuk koki lainnya.
Cara pembuatan agar Leuconostoc 10 gr
trip-ton, 5 gr ekstrak khamir, 5 gr K2HP0 4 , 5 gr triamonium sitrat, 5 gr sukrosa, 15 gr agar
bacto dilarutkan dalam 1 liter air destilata,
sterilisasi dilakukan dengan autoklaf 121°C
selama 15 menit. Kemudian agar cair tersebut
dipindahkan' ke dalam cawan petri s t e r i l .
Sebagai kontrol digunakan media yang mengandung
0,1 % sukrosa.
Bakteri asam laktat digores secara kuadran
pada agar Leuconostoc. Cawan petri diinkubasi
pad a suhu 37°C selama 2 - 5 hari. Pembentukan
dekstran ditandai dengan pembentukkan koloni
mukoid.
Pertumbuhan pada suhu berbeda. Satu tetes inokulum ditambahkan-ke dalam tabung MRS broth
(masing-masing duplo). Satu seri tabung
diin-kubasi pada suhu 15°C dan seri lainnya pada
Pertumbuhan pada 6.5% NaCl. MRS broth dengan 6.5% NaCl diinokulasi dengan 1 tetes
inokulum. Kultur kemudian diikubasikan pada
suhu 37°C selama 5 hari.
Reaksi pada Litmus Milk. Cara pembuatan
Litmus Milk 100 gr susu skim dan 0,75 gr
litmus dilarutkan dalam 1 liter air destilata,
larutan didistribusi ke dalam tabung reaksi,
sterilisasi dilakukan dengan autoklaf 121°C, 15
menit.
Satu tetes inokulum diinokulasikan ke
dalam Litmus Milk, kemudian diinkubasi pad a
suhu 37°C ウセャ。ュ。@ 2 - 5 hari.
terjadi pad a Litmus Milk diamati
Reaksi yang
a. Pemisahan whey atau penggumpalan susu karena
enzim proteolitik tanpa pembentukan asam
sehingga warna litmus tetap biru.
b. Pembentukan asam dengan atau tanpa
penggum-palan susu yang ditandai dengan perubahan
warna litmus menjadi merah muda.
C. Pembentukan gas yang ditandai dengan adanya
gelembung-gelembung.
Diagram isolasi dan identifikasi bakteri
asam laktat yang diisolasi dari pikel ketimun
Isolasi bakteri asam laktat
Purifikasi
uji katalase MMMMセNセI@ Katalase positif
Katalase negatif
Pewarnaan gram セ@ Gram negatif
Gram positif
Bakteri asam laktat
Uji biokimia:
- produksi CO 2 dari glukosa - produksi amonia dari arginin
- produksi dekstran dari sukrosa
- pertumbuhan pad a suhu berbeda
- pertumbuhan pada 6.5% NaCl
- reaksi pada Litmus Milk
[image:51.603.206.513.106.625.2]2. SELEKSI ISOLAT BAKTERI ASAM LAKTAT
Seleksi isolat bakteri asam laktat berdasarkan
kemampuannya dalam menghambat pertumbuhan mikroba
pem-busuk dan patogen dengan uji 、ゥヲオウセ@ sumur seperti yang
dilakukan oleh Garriga et al. (1993) dengan beberapa
modifikasi.
Ke dalam medium agar steril diinokulasikan
0.2 % bakteri indikator yang telah diinkubasi
selama sehari (suhu 37°C). Setelah membeku dibuat
lubang/sumur pada medium agar tersebut dan dispotkan
sebanyak 50 Ml kultur bakteri asam Iaktat yang telah
diinkubasi selama 2 bari pada suhu 37°C. Sebagai
kon-trol dispotkan MRS broth yang belum diinokulasi ke
da-lam sumur. Setelah diinkubasi selama 2 hari (37°C),
areal penghambatan yang terbentuk diukur. Areal
peng-hambatan berupa areal bening di tepi lubang/sumur
sam-pai tepi dimana terjadi pertumbuhan bakteri penguji,
dinyatakan dalam mm. Pengukuran dilakukan di beberapa
sisi, kemudian dirata-ratakan.
sebanyak 2-3 ulangan.
3. IDENTIFlKASI SENYAWA ANTIMIKROBA
a. Uji Bakteriosin
Uji ini dilakukan
Untuk melihat kemampuan isolat bakteri asam
difusi sumur seperti yang dilakukan oleh Garriga
et al. (1993) dengan beberapa modifikasi.
Kultur bakteri asam laktat setelah diinkubasi
selama 2 hari, dinetralkan dengan memakai NaOH 0,1
N hingga mencapai pH 7,0. Urituk memisahkan sel,
kultur yang telah dinetralkan disaring dengan
memakai kertas millipor berukuran steril 0,22 Mm.
Tahap selanjutnya sarna dengan metode di atas,
ke-cuali yang dispotkan ke dalam sumur adalah filtrat
kultur bakteri asam Iaktat dan sebagai bakteri
indikator digunakan P. fluorescens dan Alcaligenes sp ..
b. Kemampuan memproduksi asam
Untuk menentukan kemampuan bakteri asam
laktat dalam memproduksi asam, digunakan medium
sintetik asam Iaktat yang dibuat berdasarkan
Buchta (1983) dalam Wirjantaro (1993), yang
ter-diri dari 50 gil glukosa, 0.4% urea, 0.1% K2HP04 , 0.05% MgS0 4 , 0.05% KCI, 0.001% FeS0 4 .7H20, dan 0.05% ekstrak khamir.
Dua ose isolat dari MRS-caC0 3 semi padat di-pindahkan ke dalam MRS broth. Setelah inkubasi 2
hari, kultur digunakan sebagai inokulum untuk
pro-duksi asam. SepuIuh persen inokulum
diinkubasi dalam inkubator bergoyang pad a suhu
30°C.
Analisa terhadap asam laktat yang
terben-tuk dilakukan setiap hari sampai 4 hari inkubasi.
Setiap hari sejumlah media sintetik asam laktat
yang telah ditumbuhi oleh bakteri asam laktat
diambil secara aseptis. untuk memisahkan sel
bakteri asam laktat dari hasil metabolitnya maka
kultur disentrifus. Filtrat hasil sentrifus yang
akan digunakan untuk analisa asam.
dilakukan dengan cara titrasi.
Analisa asam
Sebelum NaOH digunakan untuk penetapan total
asam tertitraii, dilakukan standarisasi NaOH
Filtrat hasil sentrifus
diencerkan sampai 50 kali, sebanyak 10 ml filtrat
diambil untuk dititrasi dengan NaOH 0.01 N dengan
indikator fenoftalein 1% (Apriyantono et al,
1989). Hasilnya dinyatakan sebagai per sen asam
laktat.
ml NaOH x N NaOH x 0.09 x 100
% asam --- x pengenceran ml sampel
hari. kultur digunakan sebagai inokulum untuk
pro-duksi hidrogen peroksida. Sepuluh persen
inoku-lum diinokulasi ke dalam air pepton 1%. Inkubasi
dilakukan pada suhu 37°C.
Ke da1am 5 ml sampel bebas sel bakteri asam
laktat, ditambahkan 0.5 ml KI jenuh, 0.5 ml 0.001
M amonium molibdat dalam 1 N asam sulfat, digoyang
selama 1 menit, dan dititrasi dengan 0.001 N
Na-tiosulfat sampai warna kuning yang terbentuk
hampir hilang. Sejumlah indikator amilum 1%
ditambahkan ke da1am sampel dan titrasi
dilanjut-kan sampai warna biru mendadak lenyap. Untuk
menentukan ォッョセ・ョエイ。ウゥ@ H20 2 , digunakan kurva
standar hidrogen peroksida.
Sebelum digunakan Na-tiosulfat distandarisasi
dengan cara sebagai berikut: ke dalam erlenmeyer
ditambahkan 10 ml KI0 3 , .10 ml KI, dan 10 ml HC1. Sampel segera dititrasi dengan Na-tiosulfat sampai
warna muda sekali. Sejumlah 2 ml indikator amilum
ditambahkan ke dalam sampel, titrasi dilanjutkan
sampai warna mend adak lenyap.
4. PENGARUH WAKTU KONTAK BAKTERI ASAM LAKTAT DENGAN BAKTERI PERUSAK DALAM MEDIA EKSTRAK lKAN RUCAH
Untuk menguji kemampuan bakteri asam laktat dalam
sp. dan P. fluorescens) dilakukan uji kontak dalam
media ekstrak ikan (Gambar 2). Media ekstrak ikan
dibuat berdasarkan prosedur Vatana dan Rosario (1983)
dalam Olympia et al (1992). Dua belas gram ikan
di-blender dengan 50 ml air destilata. Disaring dengan
memakai kain saring. Ekstrak ikan kemudian ditepatkan
pHnya menjadi 6 dengan HCl 0.1 N. Untuk kontrol, ke
dalam media ekstrak ikan hanya ditambahkan bakteri
penguji saja. Interval waktu kontak yang digunakan
adalah 0, 4, 8, dan 24 jam, suhu inkubasi 30°C.
Untuk mempermudah pembahasan maka dilakukan
ana-lisis data dengan menghitung nilai log (Nc/No), dimana
Nc adalah jumlah miKroba pad a waktu c dan No adalah
jumlah mikroba tepat setelah inokulasi (0 jam). Jika
log (Nc/No) sama dengan nol berarti tidak terjadi
pertumbuhan mikroba, kalau lebih besar dari nol
berar-t i terjadi pertumbuhan, kalau lebih kecil dari nol
berarti terjadi kematian. Untuk melihat efek
bakteri-sidal atau bakteristatik nilai log (Nc/No) contoh
harus dibandingkan dengan nilai log (Nc/No) kontrol.
Jika nilai log (Nc/No) contoh berkurang sedangkan
nilai log (Nc/No) kontrol bertambah berarti terjadi
efek bakterisidal. Jika nilai log (Nc/No) kontrol
bertambah dan nilai log (Nc/No) contoh juga bertambah
tetapi tidak sebesar pertambahan nilai kontrol berarti
Isolat bakteri
asam laktat
.j,
MRS Broth
37°C, 2 hari
j
pemekatan
(10 9_10 10
koloni/ml broth)
1%
media ekstrak ikan
Mikroba penguji
1
Nutrient Broth
37°C, 2 hari
pengenceran
(10 5 -10 6
koloni/ml broth)
1%
30°C, 0, 4, 8, 24 jam
1
Analisa-total bakteri asam laktat
-total bakteri penguji
-total asam dan pH
[image:57.607.110.502.97.679.2]5. ANALISIS
a. Total Bakteri Asam Laktat dengan Metode Hitungan Cawan secara Agar Tuang (Fardiaz, 1987)
Dari pengenceran 10- 5 -10- 8 , sebanyak 1 ml
ekstrak ikan rucah yang telah diinokulasi
dipin-dahkan ke dalam cawan petri. Ke dalam cawan petri
dimasukkan agar cair ウエセイゥャN@ Cawan petri segera
digoyang secara mendatar. Setelah agar membeku,
cawan diinkubasi pada posisi terbalik pada suhu
30°C selama 2-3 hari.
Untuk menghitung total bakteri asam laktat
yang dikontakkan dengan P. fluorescens digunakan
media agar MRS. Untuk bakteri asam laktat yang
dikontakkan dengan Alcaligenes sp. digunakan media
agar MRS yang telah ditambah 0.0075% natrium
azida. Penambahan natrium azida dimaksudkan untuk
menghambat pertumbuhan Alcaligenes sp ..
b. Total Bakteri Penguji dengan Metode セャ・ウ@ and セウᆳ ra Surface cッセッョケ@ Count (Miles and Misra, 1969 dalam Harrigan dan Cance, 1976 ).
Pada pemupukan dengan metode ini, agar
nu-trien steril terlebih dahulu dituangkan ke dalam
cawan petri dan dibiarkan membeku. Setelah
membe-ku dengan sempurna, kemudian sebanyak 0.02 ml
dipipet pada permukaan agar tersebut. Inkubasi
dilakukan pada. suhu kamar selama sehari. Jumlah
koloni per cawan yang memenuhi syarat untuk
dihi-tung adalah 20 100 koloni per cawan. Jumlah
koloni per ml yang sebenarnya didapatkan dengan
mengalikan jumlah koloni per cawan dengan faktor
50. Pemupukan dilakukan duplo. <