STUDI ANALISIS RESIDU KLORPIRIFOS DALAM MINYAK SAWIT (Elaeis guineensis Jacq) MENGGUNAKAN KROMATOGRAFI GAS
DENGAN DETEKTOR PENANGKAP ELEKTRON
SKRIPSI
OLEH: YOGI SUGIANTO
NIM 060804036
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
STUDI ANALISIS RESIDU KLORPIRIFOS DALAM MINYAK SAWIT (Elaeis guineensis Jacq) MENGGUNAKAN KROMATOGRAFI GAS
DENGAN DETEKTOR PENANGKAP ELEKTRON
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: YOGI SUGIANTO
NIM 060804036
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
STUDI ANALISIS RESIDU KLORPIRIFOS DALAM MINYAK SAWIT (Elaeis guineensis Jacq) MENGGUNAKAN KROMATOGRAFI GAS
DENGAN DETEKTOR PENANGKAP ELEKTRON OLEH:
YOGI SUGIANTO NIM 060804036
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
(Prof. Dr. Sumadio Hadisahputra, Apt.) NIP. 19531128198303 1 002
(Prof. Dr. rer nat. Effendy De Lux Putra, SU., Apt.) NIP. 19530619198303 1 001
Pembimbing I,
(Prof. Dr. rer nat. Effendy De Lux Putra, SU., Apt.) NIP. 19530619198303 1 001
(Dr. M. Pandapotan Nasution, MPS., Apt.) NIP. 19490811197603 1 001
(Dr. Ginda Haro, M.Sc., Apt.) NIP. 19510816198003 1 002
(Chairul Azhar Dalimunthe, M.Sc., Apt.) NIP. 19490706198002 1 001
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT Yang Maha
Agung yang telah melimpahkan rahmat, hidayah, karunia dan kemudahan kepada
penulis sehingga dapat menyelesaikan penelitian dan penyusunan skripsi yang
berjudul “Studi Analisis Residu Klorpirifos dalam Minyak Sawit (Elaeis
Guineensis Jacq) Menggunakan Kromatografi Gas dengan Detektor Penangkap Elektron” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara Medan.
Penulis mempersembahkan rasa terima kasih yang tak terhingga dan
mendalam kepada Ayahanda tercinta H. Rapon dan Ibunda tersayang Hj. Hadijah
yang telah memberikan semangat, dukungan, kasih sayang dan cinta yang teramat
tulus, juga untuk mas Erianto (Arai Ponsel), kakanda Ernawati, S.Pd., kak ipar
Umy Rahmawati serta abang ipar Gatot Susantoro atas segala semangat, bantuan,
dan kasih sayang yang berlimpah yang telah diberikan, kepada keluarga besar
Alm. Giman dan keluarga besar Alm. Marmin atas semua doa, kasih sayang,
semangat, dan pengorbanan baik moril maupun materil. Yang tak terlupakan,
untuk dek Reny Seprianti, terima kasih atas semua pengorbanan, doa, dan kasih
saying tulus yang diberikan sangat membantu penulis mengarungi langkah
menuju sukses. Sebagai sumber inspirasi, si imut Nayla Yosa Anerga (Naya) yang
sangat dinanti perkembangannya menjadi sesosok insan yang berguna bagi nusa,
bangsa, dan agama. Semoga Allah SWT selalu melindungi kita semua dalam
Dalam kesempatan ini, penulis juga mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt. dan bapak Hasrul
Abdi Hasibuan, M. Si. selaku pembimbing yang telah memberikan waktu,
bimbingan dan nasehat selama penelitian hingga terselesaikannya penyusunan
skripsi ini.
2. Bapak Dekan dan Bapak/Ibu Pembantu Dekan, Bapak dan Ibu staf pengajar
Fakultas Farmasi USU yang telah mendidik penulis selama masa perkuliahan
dan Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt. selaku penasehat
akademik yang telah memberikan arahan dan bimbingan kepada penulis.
3. Bapak Dr. M. Pandapotan Nasution. MPS., Apt., Dr. Ginda Haro, M.Sc., Apt.,
dan Drs. Chairul Azhar Dalimunthe, M.Sc., Apt. selaku dosen penguji yang
telah memberikan saran, arahan dan kritik kepada penulis dalam penyelesaian
skripsi ini.
4. Bapak dan Ibu staf Laboratorium Pengolahan Hasil dan Mutu (PAHAM)
PPKS Medan yang telah memberikan arahan dan fasilitas selama penulis
melakukan penelitian dan pengalaman berharga penulis sebagai laboran.
5. Bapak dan Ibu staf Laboratorium Kimia Farmasi Kualitatif, rekan-rekan
asisten Laboratorim Kimia Farmasi Kualitatif yang telah memberikan bantuan
ilmu dan didikan serta pengalaman yang sangat berarti bagi penulis sebagai
asisten laboratorium.
6. Sahabat-sahabat penulis anggota pengajian farmasi : Muammar Alfarouq
(Mammert), Aulia Sumantri (Oli), Hendra Agustian (Obeng), Azhar Aliza
Prasetya (Ribud), Gokman U. Sidabutar (Daboe), Roni M. Situmorang
(Baron), Niki Agustina (Nidol), Fathul Jannah (Oel), Bang Riyan, Bang
Antun, Bang Yakub, Bang riza, Bang Reva, Bang Bagus, Bang Surya,
rekan-rekan mahasiswa farmasi khususnya stambuk 2006 atas dukungan, semangat,
bantuan dan persahabatan yang indah selama ini serta seluruh pihak yang telah
memberikan kasih sayang, bantuan, motivasi dan inspirasi bagi penulis selama
masa perkuliahan sampai penyusunan skripsi ini.
7. Rekan-rekan HMF periode 2009-2010 : Danny Parawita, Ayu Puspita,
Riwandy Yusuf Siregar, Ernal Salita, Nensi Kurnia Putri, Syafridah, Darwin,
Taufik, Jali, Febri, serta anggota HMF lainnya yang turut membantu penulis
dalam menyelesaikan skripsi ini.
8. Teman-teman penghuni setia 51: Hariyo Handoyo, Adnan, Budi, mas Putra
dan pak Rendra yang telah memberikan ketulusan dan keikhlasan atas
partisipasinya membantu penulis dalam menyelesaikan skripsi ini.
Semoga Allah SWT memberikan balasan yang berlipat ganda dan pahala
yang sebesar-besarnya kepada semua pihak yang telah membantu penulis
menyelesaikan skripsi ini.
Penulis mengharapkan kritik dan saran yang membangun dari semua pihak
guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat
bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Agustus 2010
Penulis,
STUDI ANALISIS RESIDU KLORPIRIFOS DALAM MINYAK SAWIT (Elaeis guineensis Jacq) MENGGUNAKAN KROMATOGRAFI GAS
DENGAN DETEKTOR PENANGKAP ELEKTRON ABSTRAK
Telah dilakukan penelitian tentang residu klorpirifos yang digunakan sebagai bahan aktif pestisida yang terdapat dalam minyak sawit (Elaeis guineensis Jacq). Penggunaan pestisida klorpirifos yang sangat luas di dunia pertanian dan perkebunan sehingga meninggalkan residu pada hasil pertanian dan perkebunan yang akan diproduksi. Bahaya adanya residu klorpirifos sangat fatal yaitu dapat mengakibatkan kematian.
Klorpirifos (suatu pestisida yang mengandung fosfor dan klorin) dapat ditentukan kadarnya dengan menggunakan kromatografi gas dilengkapi detektor penangkap elektron, kolom Rtx-1® pada suhu 300 0C, laju alir gas pembawa 1,61 ml/menit, suhu injektor dan detektor 325 0C. Suatu metode yang sederhana telah dilakukan untuk pembersihan analit dari pengotor yang terdapat dalam matriks berminyak (minyak sawit mentah dan minyak goreng). Metode ini meliputi elusi analit dengan kromatografi serapan menggunakan penyerap alumina dan pelarut petroleum eter. Metode ini mampu mengekstrak klorpirifos sehingga terbebas dari matriks minyak.
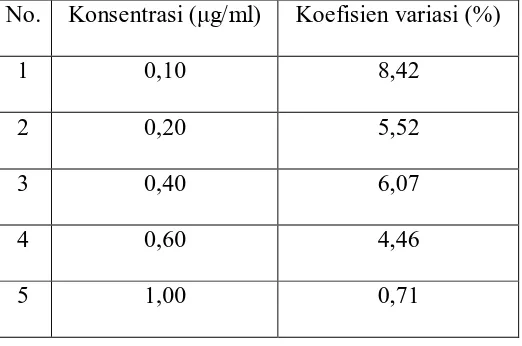
Validasi metode menunjukkan bahwa prosedur penelitian yang dilakukan memiliki akurasi dan presisi yang baik yakni dengan persen perolehan kembali pada rentang 85,67-108,80% dan koefisien variasi pada rentang 0,71-8,42%. Sedangkan batas deteksi dan batas kuantitasi berturut-turut adalah 0,036 µg/ml dan 0,12 µg/ml. Hasil yang didapat menunjukkan bahwa kromatografi gas dengan detektor penangkap elektron cocok untuk penentuan kadar klorpirifos dalam minyak sawit.
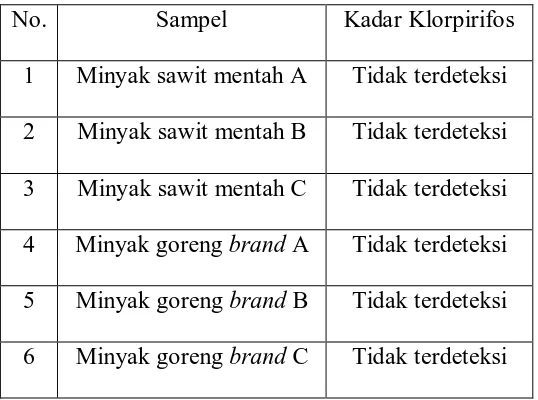
Dari hasil penelitian, disimpulkan bahwa sampel yang diuji yaitu minyak sawit mentah dan minyak goreng tidak tercemar residu klorpirifos sehingga dapat meningkatkan sistem keamanan pangan dalam industri kelapa sawit.
ANALYSIS STUDY OF CHLORPYRIFOS RESIDUE IN PALM OIL
(Elaeis guineensis Jacq) USING GAS CHROMATOGRAPHY WITH ELECTRON CAPTURE DETECTOR
ABSTRACT
A research has been done about the residue of chlorpyrifos, a substance which was used as active content in pesticide, in coconut palm oil (Elaeis
guineensis Jacq). The extensive usage of chlorpyrifos pesticide in the field of
farming and plantation leaves residue of chlorpyrifos in the farming and plantation product. The danger of chlorpyrifos residue presence is very fatal. It can lead to death.
Chlorpyrifos (a pesticide containing phosphorus and chlorine) was determined by using gas chromatography equipped with electron capture detector, Rtx-1 column at 300 oC temperature, flow rate of carrier gas 1.61 ml/minute, and injector and detector temperature of 325 oC. A simple method has been done to clean the analyte from the impurities in the oily matrix (crude palm oil and frying oil). The method involves elution of analyte with absorption chromatography using alumina as absorbant and petroleum ether as solvent. This method is capable of extracting chlorpyifos and freeing it from oil matrix.
The method validation showed that the research procedure conducted has good accuracy and precision with percent recovery at range 85.67-108.80% and variation coefficient at range 0.71-8.42%. While the limit of detection and limit of quantitation are 0.036 µg/ml and 0.12 µg/ml respectively. The result obtained showed that gas chromatography with electron capture detector is a suitable detector for the quantification of chlorpyrifos in crude palm oil.
From the result of the research, it was concluded that the tested sample, which were raw coconut palm oil and frying oil, are not contaminated with chlorpyrifos residue so that they can improve the food safety system in palm oil industries.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesa ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Kelapa Sawit ... 6
2.2 Standar Mutu Minyak Kelapa Sawit ... 7
2.3 Pestisida ... 7
2.3.1 Bahaya Pencemaran Pestisida ... 9
2.3.2.1 Klorpirifos ... 10
2.3.2.2 Cara Kerja Klorpirifos ... 11
2.3.3 Proses Analisis Residu Pestisida ... 11
2.4 Analisis Kualitatif/Kuantitatif ... 12
2.5 Kromatografi Gas ... 13
2.5.1 Detektor ECD (Electron Capture Detektor) ... 21
2.6 Kromatografi Kolom ... 22
2.6.1 Pengisian Kolom... 22
2.6.2 Penyerap ... 22
2.7 Validasi Data Analisis ... 23
2.7.1 Akurasi/Kecermatan ... 23
2.7.2 Presisi/Keseksamaan ... 24
2.7.3 Batas Deteksi ... 25
2.7.4 Batas Kuantitasi ... 25
BAB III METODOLOGI PENELITIAN... 26
10 µg/ml ... 27
3.3.3.3 Batas Deteksi dan Batas Kuantitasi ... 32
BAB V KESIMPULAN DAN SARAN ... 48
5.1 Kesimpulan ... 48
5.2 Saran ... .49
DAFTAR PUSTAKA ... 50
DAFTAR TABEL
Halaman
Tabel 1. Hasil Pengukuran Kurva Kalibrasi dengan Metode Kromatografi
Gas ... 38
Tabel 2. Nilai Koefisien Variasi dari Hasil Pengukuran Kurva Kalibrasi ... 41
Tabel 3. Hasil Pengukuran Uji Perolehan Kembali ... 44
Tabel 4. Nilai Koefisien Variasi dari Hasil Pengujian Akurasi ... 45
DAFTAR GAMBAR
Halaman
Gambar 1. Diagram Blok Kromatografi Gas ... 15
Gambar 2. Bagan Injektor dalam Kromatografi Gas ... 18
Gambar 3. Jenis Kolom Kromatografi Gas ... 19
Gambar 4. Kromatogram yang Diperoleh dari Kondisi Kromatografi yang Optimum dari Standar Klorpirifos 0,01 µg/ml... 34
Gambar 5. Kurva Kalibrasi Standar Klorpirifos ... 39
Gambar 6. Kromatogram Kurva Kalibrasi 1 µg/ml ... 39
Gambar 7. Kromatogram n-Heksan ... 40
Gambar 8. Kromatogram Petroleum Eter ... 42
Gambar 9. Kromatogram Blanko ... 43
Gambar 10. Kromatogram Uji Perolehan Kembali Klorpirifos 1 µg/ml ... 43
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar Sampel dan Proses Clean-up Sampel ... 53
Lampiran 2. Gambar Instrumen Kromatografi Gas ... 54
Lampiran 3. Gambar Perangkat Pendukung Penelitian Lainnya ... 56
Lampiran 4. Gambar Bahan yang Dipakai dalam Penelitian... 57
Lampiran 5. Perhitungan Persamaan Regresi dan Kurva Kalibrasi Standar Klorpirifos ... 58
Lampiran 6. Contoh Perhitungan Simpangan Baku (SB) dan Koefisien Variasi (KV) Hasil Kurva Kalibrasi Standar Klorpirifos ... 61
Lampiran 7. Data Perolehan Kembali dari Standar Klorpririfos ... 62
Lampiran 8. Contoh Perhitungan Uji Perolehan Kembali Standar Klorpirifos ... 64
Lampiran 9. Contoh Perhitungan Simpangan Baku Hasil Perolehan Kembali Standar Klorpirifos……... 65
Lampiran 10. Perhitungan Penetapan Batas Deteksi dan Batas Kuantitasi... 66
Lampiran 11. Bagan Pembuatan Aktifasi Penyerap Alumina ... 67
Lampiran 12. Bagan Pembuatan Larutan Standar klorpirifos ... 68
Lampiran 13. Bagan Pengemasan Kolom Kromatografi untuk Proses Clean-up ... 69
Lampiran 14. Kromatogram Hasil Pengukuran Kurva Kalibrasi Standar Klorpirifos ... 70
STUDI ANALISIS RESIDU KLORPIRIFOS DALAM MINYAK SAWIT (Elaeis guineensis Jacq) MENGGUNAKAN KROMATOGRAFI GAS
DENGAN DETEKTOR PENANGKAP ELEKTRON ABSTRAK
Telah dilakukan penelitian tentang residu klorpirifos yang digunakan sebagai bahan aktif pestisida yang terdapat dalam minyak sawit (Elaeis guineensis Jacq). Penggunaan pestisida klorpirifos yang sangat luas di dunia pertanian dan perkebunan sehingga meninggalkan residu pada hasil pertanian dan perkebunan yang akan diproduksi. Bahaya adanya residu klorpirifos sangat fatal yaitu dapat mengakibatkan kematian.
Klorpirifos (suatu pestisida yang mengandung fosfor dan klorin) dapat ditentukan kadarnya dengan menggunakan kromatografi gas dilengkapi detektor penangkap elektron, kolom Rtx-1® pada suhu 300 0C, laju alir gas pembawa 1,61 ml/menit, suhu injektor dan detektor 325 0C. Suatu metode yang sederhana telah dilakukan untuk pembersihan analit dari pengotor yang terdapat dalam matriks berminyak (minyak sawit mentah dan minyak goreng). Metode ini meliputi elusi analit dengan kromatografi serapan menggunakan penyerap alumina dan pelarut petroleum eter. Metode ini mampu mengekstrak klorpirifos sehingga terbebas dari matriks minyak.
Validasi metode menunjukkan bahwa prosedur penelitian yang dilakukan memiliki akurasi dan presisi yang baik yakni dengan persen perolehan kembali pada rentang 85,67-108,80% dan koefisien variasi pada rentang 0,71-8,42%. Sedangkan batas deteksi dan batas kuantitasi berturut-turut adalah 0,036 µg/ml dan 0,12 µg/ml. Hasil yang didapat menunjukkan bahwa kromatografi gas dengan detektor penangkap elektron cocok untuk penentuan kadar klorpirifos dalam minyak sawit.
Dari hasil penelitian, disimpulkan bahwa sampel yang diuji yaitu minyak sawit mentah dan minyak goreng tidak tercemar residu klorpirifos sehingga dapat meningkatkan sistem keamanan pangan dalam industri kelapa sawit.
ANALYSIS STUDY OF CHLORPYRIFOS RESIDUE IN PALM OIL
(Elaeis guineensis Jacq) USING GAS CHROMATOGRAPHY WITH ELECTRON CAPTURE DETECTOR
ABSTRACT
A research has been done about the residue of chlorpyrifos, a substance which was used as active content in pesticide, in coconut palm oil (Elaeis
guineensis Jacq). The extensive usage of chlorpyrifos pesticide in the field of
farming and plantation leaves residue of chlorpyrifos in the farming and plantation product. The danger of chlorpyrifos residue presence is very fatal. It can lead to death.
Chlorpyrifos (a pesticide containing phosphorus and chlorine) was determined by using gas chromatography equipped with electron capture detector, Rtx-1 column at 300 oC temperature, flow rate of carrier gas 1.61 ml/minute, and injector and detector temperature of 325 oC. A simple method has been done to clean the analyte from the impurities in the oily matrix (crude palm oil and frying oil). The method involves elution of analyte with absorption chromatography using alumina as absorbant and petroleum ether as solvent. This method is capable of extracting chlorpyifos and freeing it from oil matrix.
The method validation showed that the research procedure conducted has good accuracy and precision with percent recovery at range 85.67-108.80% and variation coefficient at range 0.71-8.42%. While the limit of detection and limit of quantitation are 0.036 µg/ml and 0.12 µg/ml respectively. The result obtained showed that gas chromatography with electron capture detector is a suitable detector for the quantification of chlorpyrifos in crude palm oil.
From the result of the research, it was concluded that the tested sample, which were raw coconut palm oil and frying oil, are not contaminated with chlorpyrifos residue so that they can improve the food safety system in palm oil industries.
BAB I PENDAHULUAN
1.1 Latar Belakang
Kepedulian terhadap sistem keamanan pangan dalam industri kelapa sawit
di masa mendatang sangat diperlukan mengingat sebagian besar minyak sawit
mentah (Crude Palm Oil, CPO) Indonesia digunakan sebagai bahan pangan,
selanjutnya CPO Indonesia juga diekspor ke luar negeri dengan total sekitar 12
juta ton. Data minyak dunia (Oilworld) menyebutkan, Indonesia berkontribusi 43
persen terhadap produksi CPO dunia (Hamzirwan, 2007; MPOB, 2007; Siahaan,
2008).
Penggunaan pestisida dalam menopang peningkatan produk pertanian
maupun perkebunan seperti kelapa sawit telah banyak membantu untuk
meningkatkan produksi pertanian dan perkebunan. Namun demikian penggunaan
pestisida ini dapat meninggalkan residu juga memberikan dampak negatif baik
terhadap manusia, biota maupun lingkungan (Andresima, 2008; Manuaba, 2009).
Pestisida yang digunakan pada perkebunan kelapa sawit terutama adalah
insektisida golongan organofosfat karena jenis pestisida ini mudah terurai di alam.
Karena insektisida relatif murah, penggunaannya cenderung berhasil, misalnya
klorpirifos yang digunakan untuk memberantas serangga pemakan (Handojo,
2009).
Insektisida dapat mempunyai efek samping terhadap lingkungan dan
kesehatan manusia, dan residunya merupakan masalah dalam kualitas dan
buah yang tidak terurai, kemudian akan diabsorbsi melalui kulit buah, juga masuk
melalui akar pada saat terjadi penyerapan mineral dari dalam tanah (Halimah,
2008; Handojo, 2009).
Klorpirifos bekerja dengan menghambat enzim kolin esterase pada sinaps
saraf sehingga aktivitas saraf tidak terkendali. Hal ini dapat mengakibatkan
kematian pada manusia dan hewan serta biota lainnya. Untuk mencegah terjadinya
gangguan kesehatan tersebut, kadar residu klorpirifos tidak boleh melebihi batas
yang diizinkan, yaitu data acceptable daily intake (ADI). ADI merupakan jumlah
maksimum pestisida yang boleh termakan perhari, untuk klorpirifos sebesar 0,01
mg/kg bb (Djojosumarto, 2008). Dengan adanya gannguan kesehatan yang
ditimbulkan oleh residu pestisida sehingga dibutuhkan metode analisis yang dapat
dipertanggungjawabkan untuk penentuan kadar pestisida pada minyak sawit demi
keamanan pangan dan menjaga kualitas CPO Indonesia (Halimah, 2008).
Penentuan zat yang bersifat toksik seperti residu pestisida dalam kadar
yang sangat rendah, misalnya dalam skala µg atau ng dapat dideteksi dengan teknik kromatografi (Adnan, 1997).
Richard (2006) melakukan penelitian tentang metode penentuan
klorpirifos pada minyak biji bunga matahari dengan metode High Performance
Liquid Chromatography (HPLC). Ainie (2000) menetapkan metode isolasi
pestisida organofosfat dari matriks berminyak dengan kromatografi permeasi gel
dimana analisisnya menggunakan kromatografi gas dengan detektor fotometri
nyala/flame photometric detector (FPD). Syahbirin (2001) melakukan penetapan
ionisasi nyala/Flame Ionization detector (FID) dimana prosedur pembersihan
menggunakan kromatografi kolom dengan penyerap florisil.
Muhamad (2002) mengoptimalkan prosedur ekstraksi dan pemurnian
klorpirifos dalam matriks berminyak dengan analisis metode menggunakan
kromatografi gas memakai detektor penangkap elektron/electron capture detector
(ECD). Suatu metode telah dilaporkan untuk penentuan kadar klorpirifos pada
minyak dan mentega dengan menggunakan suatu kolom tanah diatom dan
cartridge ekstraksi fase gerak/solid phase extraction (SPE) untuk memisahkan
senyawa yang diinginkan dari minyak (Gillespie, 1994).
Penentuan kadar klorpirifos pada olein kelapa sawit telah dilakukan oleh
Halimah (1999) menggunakan metode kromatografi gas dengan membandingkan
nilai validasi dari 2 detektor, yaitu detektor fotometri nyala dan detektor
penangkap elektron. Hasil yang didapat menunjukkan bahwa detektor penangkap
elektron lebih tepat untuk pendeteksian klorpirifos jika dibanding dengan detektor
fotometri nyala.
Dengan adanya masalah yang ditimbulkan dari residu klorpirifos terhadap
kesehatan manusia dan lingkungan serta mempengaruhi kualitas produksi dari
minyak sawit, maka peneliti tertarik untuk memperoleh data mengenai metode
analisis residu klorpirifos yang terdapat dalam minyak sawit yang penetapannya
diukur secara kromatografi gas dilengkapi dengan detektor penangkap elektron,
dimana proses clean-up dilakukan dengan elusi memakai kromatografi serapan
dengan penyerap alumina menggunakan pelarut petroleum ether. Metode ini
terpilih karena dinilai lebih sederhana dan memungkinkan analisis pestisida
1.2 Perumusan Masalah
• Apakah residu klorpirifos dalam minyak sawit (Elaeis guineensis Jacq) dapat ditentukan dengan metode kromatografi gas menggunakan detektor penangkap
elektron
• Apakah penggunaan metode kromatografi kolom dengan penyerap alumina mampu memurnikan residu pestisida dari minyak sawit
• Apakah minyak sawit tercemar residu klorprifos
1.3 Hipotesis
• Analisis residu klorpirifos dalam minyak sawit dapat ditentukan dengan metode kromatografi gas menggunakan detektor penangkap elektron
• Metode kromatografi kolom dengan penyerap alumina dapat digunakan dalam
clean-up residu klorpirifos dari minyak sawit
• Minyak sawit tidak tercemar residu klorpirifos
1.4 Tujuan Penelitian
Mengembangkan teknik analisis residu klorpirifos dalam minyak sawit
dengan metode kromatografi gas menggunakan detektor penangkap elektron
Melakukan metode clean-up menggunakan kromatografi serapan dengan
penyerap alumina memakai pelarut petroleum eter untuk memurnikan residu
klorpirifos dari minyak sawit
Menganalisis minyak sawit baik minyak sawit mentah dan minyak goreng
brand dengan metode kromatografi gas menggunakan detektor penangkap
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi informasi bagi masyarakat pengguna khususnya industri pengolahan kelapa sawit tentang cara analisis residu
klorpirifos dalam minyak sawit sehingga dapat mendukung sistem keamanan
BAB II
TINJAUAN PUSTAKA
2.1 Kelapa Sawit
Klasifikasi kelapa sawit adalah sebagai berikut :
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Keluarga : Palmaceae
Sub keluarga : Cocoideae
Genus : Elaeis
Spesies : Elaeis guineensis Jacq
Pohon Kelapa Sawit terdiri daripada dua spesies Arecaceae atau famili
Palma yang digunakan untuk pertanian komersil dalam pengeluaran minyak
kelapa sawit. Pohon kelapa sawit afrika, Elaeis guineensis Jacq, berasal dari
Afrika Barat di antara Angola dan Gambia, manakala pohon kelapa sawit amerika,
Elaeis oleifera, berasal dari Amerika Tengah dan Amerika Selatan. Kelapa sawit
termasuk tumbuhan pohon. Tingginya dapat mencapai 24 meter. Bunga dan
buahnya berupa tandan, serta bercabang banyak. Buahnya kecil dan apabila
masak, berwarna merah kehitaman. Daging buahnya padat. Daging dan kulit
buahnya mengandungi minyak. Minyaknya itu digunakan sebagai bahan minyak
goreng, sabun, dan lilin. Hampasnya dimanfaatkan untuk makanan ternak,
khususnya sebagai salah satu bahan pembuatan makanan ayam. Tempurungnya
2.2 Standar Mutu Minyak Kelapa Sawit
Mutu minyak kelapa sawit dapat dibedakan menjadi dua arti, pertama,
benar‐benar murni dan tidak bercampur dengan minyak nabati lain. Mutu minyak
kelapa sawit tersebut dapat ditentukan dengan menilai sifat‐sifat fisiknya, yaitu
dengan mengukur titik lebur angka penyabunan dan bilangan yodium. Kedua,
pengertian mutu sawit berdasarkan ukuran. Dalam hal ini syarat mutu diukur
berdasarkan spesifikasi standar mutu internasional yang meliputi kadar ALB, air,
kotoran, logam besi, logam tembaga, peroksida, residu pestisida dan ukuran
pemucatan (Anonim a, 2007).
Kebutuhan mutu minyak kelapa sawit yang digunakan sebagai bahan baku
industri pangan dan nonpangan masing‐masing berbeda. Oleh karena itu keaslian,
kemurnian, kesegaran, cemaran maupun aspek higienisnya harus lebih
diperhatikan. Rendahnya mutu minyak kelapa sawit sangat ditentukan oleh
banyak faktor. Faktor‐faktor tersebut dapat langsung dari sifat induk pohonnya,
penanganan pascapanen, atau kesalahan selama pemrosesan dan pengangkutan
(Anonim a, 2007).
2.3 Pestisida
Telah disadari bahwa pada umumnya pestisida merupakan bahan
berbahaya yang dapat menimbulkan pengaruh negatif terhadap kesehatan manusia
dan kelestarian lingkungan hidup. Namun demikian, pestisida juga dapat
memberikan manfaat, sehingga pestisida banyak digunakan dalam pembangunan
di berbagai sektor, termasuk pertanian. Memperhatikan manfaat dan dampak
diperoleh manfaat yang sebesar-besarnya dengan dampak negatif yang
sekecil-kecilnya (Anonim b, 2010).
Organisasi Pangan dan Pertanian (FAO 1986) mendefinisikan pestisida
adalah setiap zat atau campuran yang diharapkan sebagai pencegahan,
menghancurkan atau pengawasan setiap hama termasuk vector terhadap manusia
atau penyakit pada binatang, dan tanaman yang tidak disukai atau binatang yang
menyebabkan kerusakan selama atau dalam proses pencampuran dengan produksi,
penyimpanan atau pemasaran makanan, komiditi pertanian, kayu dan produksi
kayu, atau bahan makanan binatang, atau yang dapat dilakukan pada binatang
sebagai kontrol terhadap serangga, arachnoid, atau hama lain di dalam atau pada
tubuh binatang tersebut (Sari, 2002).
Pestisida secara luas diartikan sebagai suatu zat yang bersifat racun,
menghambat pertumbuhan atau perkembangan, tingkah laku, bertelur,
perkembangbiakan, mempengaruhi hormon, penghambat makan, membuat
mandul, sebagai pemikat, penolak dan aktivitas lainnya yang mempengaruhi
kesehatan. Pestisida sintetis telah berhasil menghantarkan sektor pertanian menuju
terjadinya “revolusi hijau”, yang ditandai dengan peningkatan hasil panen dan
pendapatan petani secara signifikan, sehingga Indonesia bisa mencapai
swasembada pangan pada tahun 1986 (Setyono, 2009).
Sebagai produk perlindungan tanaman, pestisida pertanan meliputi semua
zat kimia, campuran zat kimia, atau abhan lain (ekstrak tumbuhan,
• Mengendalikan atau membunuh organisme pengganggu tanaman (OPT). sebagai contoh insektisida, akarisida, fungisida, nematisida, moluskisida, dan
herbisida.
• Mengatur pertumbuhan tanaman, dalam arti merangsang atau menghambat pertumbuhan dan mengeringkan tanaman. Sebagai contoh obat pengatur
tumbuh, defoliant (senyawa kimia untuk merontokkan daun), dan dessicant
(senyawa untuk mengeringkan daun) (Djojosumarto, 2006).
2.3.1 Bahaya Pencemaran Pestisida
Penggunaan pestisida pertanian berpotensi menimbulkan dampak negatif
bagi pengguna, konsumen, lingkungan, serta dampak sosial ekonomi. Oleh karena
itu, penggunaan pestisida harus digunakan hati-hati. Penggunan pestisida bisa
mengontaminasi pengguna secara langsung sehingga mengakibatkan keracunan.
Keracunan tersebut dapat bersifat akut ringan, akut berat, dan kronis. Keracunan
akut ringan menimbulkan pusing, sakit kepala, iritasi kulit ringan, badan terasa
sakit, dan diare. Keracunan akut bert menimbulkan gejala mual, menggigil, kejang
perut, sulit bernafas, keluar air liur, pupil mata mengecil, dan denyut nadi
meningkat. Dapat juga mengakibatkan pingsan, kejang-kejang, bahkan
mengakibatkan kematian. Keracunan kronis lebih sulit dideteksi karena tidak
segera terasa dan tidak menimbulkan gejala serta tanda yang spesifik. Namun,
keracunan kronis dalam jangka waktu yang lama bisa menimbulkan gangguan
kesehatan seperti iritasi mata dan kulit, kanker, keguguran, cacat pada bayi, serta
Residu beberapa pestisida tetap tinggal dalam tanah dalam waktu yang
lama (persistent) dan dapat terbawa atau berpindah ke tempat lain
bahkan masuk kedalam rantai makanan.
Contoh: DDT, Endrin, Lindane, Endosulfan, klorpirifos
Pestisida tidak hanya membunuh serangga hama perusak, tetapi juga akan
membunuh serangga lain yang menguntungkan manusia (musuh alami hama).
Residu pestisida yang masih tertinggal di dalam buah, daun atau batang, bila tidak
hilang tercuci dapat ikut masuk termakan oleh manusia dan berbahaya bagi
kesehatan tubuh kita (Setyono, 2009).
2.3.2 Residu Pestisida
Pengertian residu adalah sisa insektisida yang ditinggalkan sesudah
perlakuan dalam jangka waktu yang telah menyebabkan terjadinya
peristiwa-peristiwa khemis dan fisis mulai bekerja. Ini untuk membedakan pengertian residu
dengan deposit. Deposit adalah bahan insektisida yang ditinggalkan segera
sesudah perlakuan. Karena residu mempunyai pengertian bahan sisa yang telah
dtinggal cukup lama, maka bahan residu sudah tak efektif lagi sebagai racun
langsung, namun masih berbahaya karena dapat terakumulasi. Oleh karena itu
diperlukan suatu cara untuk mendeteksi atau menganalisisnya, menggunakan
metode-metode tertentu yang umumnya telah dibakukan (Martono, 2009).
Struktur Molekul : C9H11Cl3NO3PS
Nama Kimia : O,O-diethyl O-3,5,6-trichloro-2-pyridyl phosphorothioate
Nama Dagang : Dursban
Densitas : 1,398 g/cm3 (43,5 0C)
Titik Uap : 160 oC
Berat Massa : 350,59 g/mol (WHO, 2004)
Klorpirifos merupakan insektisida selektif, diperkenalka tahun 1965, serta
bekerja sebagai racun kontak, racun lambung, dan inhalasi. Mengendalikan
serangga hama dari ordo Coleoptera, Diptera, Homoptera, dan Lepidoptera baik di
daun maupun di dalam tanah (Djojosumarto, 2006).
2.3.2.2 Cara kerja klorpirifos
Klorpirifos bekerja sebagai penghambat asetil kolin esterase (acetyl cholin
esterase inhibitor), bekerja dengan menghambat enzim kolin esterase pada sinaps
saraf sehingga aktivitas saraf tidak terkendali (Djojosumarto, 2006).
2.3.3 Proses Analisis Residu Pestisida
Ekstraksi atau pemisahan residu pestisida dari bahan utama yang dianalisis
(bagian tumbuhan, tanah, air dll.) dilakukan dengan melarutkan bahan ke dalam
suatu pelarut atau campuran pelarut. Pelarut harus mampu mengekstraksi residu
dalam jumlah maksimum dengan bahan-bahan sertaan yang minimal, supaya tidak
mengganggu hasil dan proses analisis. Komponen utama yang sering mengganggu
adalah lemak, pigmen dan gula. Pelarut yang sering dipergunakan: asetonitril,
dimetilsulfoksida, aseton, air (untuk pestisida polar); petroleum eter, dietil eter,
Pemurnian ekstrak dilakukan untuk menyingkirkan bahan-bahan
sisa/pengganggu seperti misalnya lemak, lilin, dan pigmen. Residu kemudian
dapat juga difraksinasi. Hasil fraksinasi kemudian dianalisis dengan
metode-metode kromatografi.. Metode-metode-metode kromatografi dilakukan dengan
memperhatikan mekanismenya (adsorpsi, pertukaran ion) atau kedudukan alatnya
(vertikal/kolom, horisontal atau datar) (Martono, 2009).
2.4 Analisis Kualitatif/Kuantitatif
Analisis dengan metode kromatografi antara lain :
• Kromatografi Cairan-Gas (KCG) atau Gas Liquid Chromatography (GLC) Merupakan metode yang paling umum dipakai, proses pemisahannya
berdasar pada partisi senyawa yang diuapkan melalui suatu fase stasioner
(cairan non-volatil pada suatu bahan padat pendukung) dengan fase gerak
berupa gas inert/gas mulia. Fase diam terdapat di dalam kolom dengan
diameter 2 - 4 mm, panjang 1000 - 2000 mm (baja tahan karat, gelas atau
teflon), terdapat juga kolom kapiler (dapat mencapai panjang 5-60 m). Bahan
penyangga fase diam harus memiliki sifat adsorpsi minimum, luas permukaan
besar, stabilitas yang baik (tanah diatom, teflon). Dalam menentukan fase cair
harus diperhatikan polaritas senyawa yang dipisahkan. Setelah komponen
yang dipisahkan melewati kolom, dilakukan deteksi dengan detektor. Respon
detektor dicatat dalam bentuk kromatogram, kemudian dapat dihitung secara
kuantitatif. Perhitungan kualitatif dilakukan dengan membandingkan puncak
• Kromatografi cair kinerja tinggi (High Performance Liquid Chromatography, HPLC)
Metode pemisahannya didasarkan pada perbedaan keseimbangan distribusi
komponen sampel antara dua fase: diam (kolom) dan gerak (sistem pelarut
yang mengalir).
• Spektrofotometri
Antara lain absorpsi cahaya UV dan tampak. Sesuai dengan hukum
Lambert-Beer :
A = log Io/I = (.c)/d
A adalah absorbansi, Io dan I adalah intensitas cahaya sebelum dan sesudah
melalui sampel, adalah koefisien ekstinsi, c konsentrasi dan d adalah jarak
tempuh cahaya dalam substansi sampel. Absorbansi merupakan fungsi
konsentrasi dari senyawa yang dianalisis (Martono, 2009).
2.5 Kromatografi gas
Dasar pemisahan secara kromatografi gas ialah penyebaran cuplikan
diantara dua fase, yaitu fase diam yang permukaannya luas dan fase lain berupa
gas yang melewati fase diam. Kromatografi gas ialah suatu cara untuk
memisahkan senyawa atsiri dengan mengalirkan arus gas melalui fase diam
berupa zat padat (Kromatografi gas padat). Jika fase diam berupa zat cair, cara
tadi disebut Kromatografi gas cair. Fase cair diselaputkan berupa lapisan tipis
pada zat padat yang lembam dan pemisahan didasarkan pada partisi cuplikan yang
Kromatografi gas cairan mekanisme pemisahan dengan partisi, teknik
kolom dan nama alat GLC dan kromatografi gas padat dengan mekanisme
pemisahan absorbsi, teknik kolom dan nama alat GSC. Namun GSC jarang
digunakan sehingga pada umumnya yang disebut dengan GC saat ini adalah GLC
(Madbardo, 2010).
Pada prinsipnya pemisahan dalam GC adalah disebabkan oleh perbedaan
dalam kemampuan distribusi analit diantara fase gerak dan fase diam di dalam
kolom pada kecepatan dan waktu yang berbeda (Madbardo, 2010).
Dalam kromatografi gas, fase gerak berupa gas lembam seperti helium,
nitrogen, argon, atau bahkan hydrogen yang digerakkan dengan tekanan melalui
pipa yang berisi fase diam. Untuk pemisahan secara kromatografi, fase diam cair
berada sebagai lapisan tipis yang diserap atau diikat secara kimia oleh
penyangga padat yang dikemas di dalam pipa logam, kaca, atau plastic yang
berdiameter kecil (2-8 mm) dan panjangnya sedang (1-10 m). Ini disebut kolom
kemas. Dalam sistem lain disebut kolom kapiler atau pipa terbuka fase diam
berupa film tipis (0,1-2 um) yang melekat pada dinding dalam pipa logam
kapiler atau pipa kaca kapiler berdiameter sangat kecil (0,2-1 mm) dan sangat
panjang (10-100 m) (Gritter, 1991).
Alat GLC atau GC terdiri atas 7 bagian, yaitu:
1. Silinder tempat gas pembawa/pengangkut
2. Pengatur aliran dan pengatur tekanan
3. Tempat injeksi cuplikan
4. Kolom
6. Pencatat
7. Terminal untuk 3, 4 dan 5
Gambar 1. Diagram Blok Kromatografi Gas
Bagian-bagian dari kromatografi gas :
1. Gas pengangkut/pemasok gas
Gas pengangkut (carrier gas) ditempatkan dalam silinder bertekanan
tinggi. Biasanya tekanan dari silinder sebesar 150 atm. Tetapi tekanan ini
sangat besar untuk digunakan secara Iangsung (Madbardo, 2010).
Gas pengangkut harus memenuhi persyaratan :
• Harus inert, tidak bereaksi dengan cuplikan, cuplikan-pelarut, dan material dalam kolom.
• Murni dan mudah diperoleh, serta murah.
• Sesuai/cocok untuk detektor.
• Harus mengurangi difusi gas (Madbardo, 2010)..
Gas-gas yang sering dipakai adalah : helium, argon, nitrogen, karbon
dioksida dan hidrogen. Gas helium dan argon sangat baik, tidak mudah
berhati-hati dalam pemakaiannya. Kadang-kadang digunakan juga CO2 (Madbardo,
2010).
Pemilihan gas pengangkut atau pembawa ditentukan oleh detektor yang
digunakan. Tabung gas pembawa dilengkapi dengan pengatur tekanan
keluaran dan pengukur tekanan. Sebelum masuk ke kromatografi, ada
pengukur kecepatan aliran gas serta sistem penapis molekuler untuk
memisahkan air dan pengotor gas lainnya. Pada dasarnya kecepatan alir gas
diatur melalui pengatur tekanan dua tingkat yaitu pengatur kasar (coarse)
pada tabung gas dan pengatur halus (fine) pada sistem kromatograf. Tekanan
gas masuk ke kromatograf (yaitu tekanan dari tabung gas) diatur pada 10 s.d
50 psi (di atas tekanan ruangan) untuk memungkinkan aliran gas 25 s.d 150
mL/menit pada kolom terpaket dan 1 s.d 25 mL/menit untuk kolom kapiler
(Madbardo, 2010).
2. Pengatur aliran dan pengatur tekanan
Ini disebut pengatur atau pengurang Drager. Drager bekerja baik pada
2,5 atm, dan mengalirkan massa aliran dengan tetap. Tekanan lebih pada
tempat masuk dari kolom diperlukan untuk mengalirkan cuplikan masuk ke
dalam kolom. Ini disebabkan, kenyataan lubang akhir dari kolom biasanya
mempunyai tekanan atmosfir biasa. Suhu kolom adalah tetap, yang diatur
oleh termostat, maka aliran gas tetap yang masuk kolom akan tetap juga.
Demikian juga komponen-komponen akan dielusikan pada waktu yang tetap
yang disebut waktu penahanan (the retention time), tR. Karena kecepatan gas
pengangkut sama dengan volume penahanan (the retention volume), vr.
Kecepatan gas akan mempengaruhi effisiensi kolom (Madbardo, 2010).
3. Tempat injeksi (The injection port)
Dalam pemisahan dengan GLC cuplikan harus dalam bentuk fase uap.
Gas dan uap dapat dimasukkan secara langsung. Tetapi kebanyakan senyawa
organik berbentuk cairan dan padatan. Hingga dengan demikian senyawa
yang berbentuk cairan dan padatan pertama-tama harus diuapkan. Ini
mem-butuhkan pemanasan sebelum masuk dalam kolom (Madbardo, 2010).
Tempat injeksi dari alat GLC selalu dipanaskan. Dalam kebanyakan alat,
suhu dari tempat injeksi dapat diatur. Aturan pertama untuk pengaturan suhu
ini adalah suhu tempat injeksi sekitar 50°C lebih tinggi dari titik didih
campuran dari cuplikan yang mempunyai titik didih yang paling tinggi. Bila
kita tidak mengetahui titik didih komponen dari cuplikan maka kita harus
mencoba-coba. Sebagai tindak lanjut suhu dari tempat injeksi dinaikkan. Jika
puncak-puncak yang diperoleh lebih baik, ini berarti bahwa suhu percobaan
pertama terlalu rendah. Namun demikian suhu tempat injeksi tidak boleh
terlalu tinggi, sebab kemungkinan akan terjadi perubahan karena panas atau
penguraian dari senyawa yang akan dianalisis (Madbardo, 2010).
Cuplikan dimasukkan ke dalam kolom dengan cara menginjeksikan
melalui tempat injeksi. Hal ini dapat dilakukan dengan pertolongan jarum
injeksi yang sering disebut "a gas tight syringe" (Madbardo, 2010).
Perlu diperhatikan bahwa kita tidak boleh menginjeksikan cuplikan
diinjeksikan pada waktu kita mengadakan analisa 0,5 -50 ml gas dan 0,2 -
20 ml untuk cairan seperti pada gambar di bawah (Madbardo, 2010).
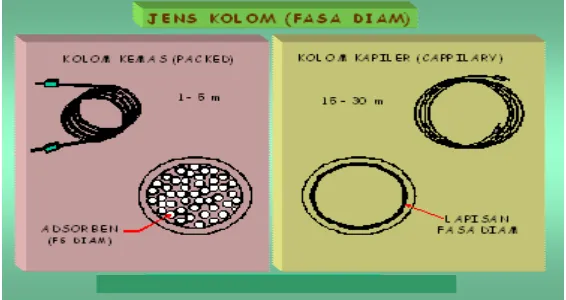
Gambar 2. Bagan Injektor dalam Kromatografi Gas 4. Kolom
Kolom merupakan jantung dari kromatografi gas. Bentuk dari kolom
dapat lurus, bengkok, misal berbentuk V atau W, dan kumparan/spiral.
Biasanya bentuk dari kolom adalah kumparan. Kolom selalu merupakan
bentuk tabung. Tabung ini dapat terbuat dari :
• Tembaga (murah dan mudah diperoleh)
• Plastik (teflon), dipakai pada suhu yang tidak terlalu tinggi.
• Baja (stainless steel), (mahal)
• Alumunium
• Gelas (Madbardo, 2010).
Ada 2 jenis kolom pada kromatografi gas yaitu kolom kemasdan kolom
penyangga yang lembam (inert) yang terdapat dalam tabung yang relatif
besar (diameter dalam 1-3 mm). Kolom kapiler jauh lebih kecil (diameter
dalam 0,10-,53 mm) dan dinding kapiler bertindak sebagai penyangga
lembamu untuk fase diam cair. Fase diam ini dilapiskan pada dinding kolom
atau bahkan dapat bercampur dengan sedikit penyangga lembam yang sangat
halus untuk memperbesar luas permukaan efektif. Tabung terbuat dari Silika
(SiO3) dengan kemurnian yang sangat tinggi. Panjang kolom 5-60 m dengan
tebal lapisan film 0,05-1 mikron (Rohman, 2007).
Gambar 3. Jenis Kolom Kromatografi Gas
5. Detektor
Detektor berfungsi sebagai pendeteksi komponen-komponen yang telah
dipisahkan dari kolom secara terus-menerus, cepat, akurat, dan dapat
digunakan pada suhu yang lebih tinggi. Detektor harus dapat dipercaya dan
mudah digunakan. Fungsi umumnya mengubah sifat-sifat molekul dari
senyawa organik menjadi arus listrik kemudian arus listrik tersebut diteruskan
ke rekorder untuk menghasilkan kromatogram. Detektor yang umum
• Detektor hantaran panas (Thermal Conductivity Detector)
• Detektor ionisasi nyala (Flame Ionization Detector)
• Detektor penangkap elektron (Electron Capture Detector)
• Detektor fotometrik nyala (Falame Photomertic Detector)
• Detektor nyala alkali
• Detektor spektroskopi massa
Detektor yang peka terhadap senyawa organik yang mengandung fosfor
adalah FID, ECD, dan FPD (Madbardo, 2010).
6. Oven kolom
Kolom terletak didalam sebuah oven dalam instrumen. Suhu oven harus
diatur dan sedikit dibawah titik didih sampel. Jika suhu diset terlalu tinggi,
cairan fase diam bisa teruapkan, juga sedikit sampel akan larut pada suhu
tinggi dan bisa mengalir terlalu cepat dalam kolom sehingga menjadi terpisah
(Madbardo, 2010).
7. Rekorder
Rekorder berfungsi sebagai pengubah sinyal dari detektor yang diperkuat
melalui elektrometer menjadi bentuk kromatogram. Dari kromatogram yang
diperoleh dapat dilakukan analisis kualitatif dan kuantitatif. Analisis kualitatif
dengan cara membandingkan waktu retensi sampel dengan standar. Analisis
kuantitatif dengan menghitung luas area maupun tinggi dari kromatogram.
Sinyal analitik yang dihasilkan detektor dikuatkan oleh rangkaian
elektronik agar bisa diolah oleh rekorder atau sistem data. Sebuah
rekorder bekerja dengan menggerakkan kertas dengan kecepatan tertentu. Di
detektor sehingga posisinya akan berubah-ubah sesuai dengan dinamika
keluaran penguat sinyal detektor. Hasil rekorder adalah sebuah
kromatogram berbentuk pik-pik dengan pola yang sesuai dengan kondisi
sampel dan jenis detektor yang digunakan. Rekorder biasanya dihubungkan
dengan sebuah elektrometer yang dihubungkan dengan sirkuit pengintregrasi
yang bekerja dengan menghitung jumlah muatan atau jumlah energi listrik
yang dihasilkan oleh detektor. Elektrometer akan melengkapi puncak-puncak
kromatogram dengan data luas puncak atau tinggi puncak lengkap dengan
biasnya (Madbardo, 2010).
Sistem data merupakan pengembangan lebih lanjut dari rekorder dan
elektrometer dengan melanjutkan sinyal dari rekorder dan elektrometer ke
sebuah unit pengolah pusat (CPU, Central Processing Unit) (Madbardo, 2010).
2.5.1 Detektor ECD (Electron Capture Detector)
Detektor ECD merupakan modifikasi dari FID yaitu pada bagian tabung
ionisasi. Dasar dari ECD ialah terjadinya absorbsi e- oleh senyawa yang
mempunyai afinitas terhadap e- bebas (senyawa-senyawa elektronegatif). Dalam
detektor gas terionisasi oleh partikel yang dihasilkan dari 3H atau 63Ni. Detektor
ini mengukur kehilangan sinyal ketika analit terelusi dari kolom kromatografi.
Detektor ini peka terhadap senyawa halogen, karbonil terkoyugasi, nitril, nitro,
dan organo logam, namun tidak peka terhadap hidrokarbon, keton, dan alkohol
2.6 Kromatografi Kolom
Kolom kromatografi dapat berupa pipa gelas yang dilengkapi dengan kran
dan gelas penyaring di dalamnya. Ukuran kolom tergantung pada banyaknya zat
yang akan dipisahkan. Untuk menahan penyerap yang diletakkan di dalam kolom
dapat digunakan gelas wool atau kapas (Sastrohamidjojo, 1985).
2.6.1 Pengisian kolom
Pengisian kolom harus menggunakan teknik yang tepat dan berhati-hati.
Pengisian yang tidak teratur dari penyerap akan mengakibatkan merusak
batas-batas pita kromatografi karena terdapat gelembung udara selama pengisian. Untuk
mencegah hal tersebut zat penyerap dibuat menjadi bubur dengan pelarut
kemudian dituangkan perlahan-lahan dalam kolom. Jika penyerap dibiarkan turun
perlahan-lahan dapat ditolong dengan mengguncang perlahan-lahan sisi kolom
maka akan diperoleh pengisian yang homogen (Sastrohamidjojo, 1985).
2.6.2 Penyerap
Ukuran partikel dan tingkat keaktifan dari penyerap berperan penting
dalam pengembangan sistem kromatografi. Alumina (Al2O3) adalah salah satu
penyerap yang banyak dipakai dalam beberapa bentuk modifikasi. Alumina
mempunyai titik aktif Al+, Al-OH, Al-, Al-OH+, dan bergantung pada
pembuatannya (Gritter, 1991).
Suatu pengertian yang digunakan dalam hubungannya dengan
penyerap-penyerap ialah aktifasi. Kadang-kadang dihubungkan dengan luas permukaan
spesifik dari zat padat, yaitu luas pemukaan yang diukur dalam meter persegi tiap
gram. Alumina dapat dibuat menjadi aktif dalam luas permukaan beratus-ratus
sebelum dipakai. Hal ini dapat dikerjakan dengan pemanasan, mungkin dengan
pengurangan tekanan. Untuk kebanyakan zat-zat padat, dengan tidak ada
keterangan lebih lanjut aktifasi dapat dilakukan dengan pemanasan pada suhu 200
o
C selama 2 jam (Sastrohamidjojo, 1985).
2.7 Validasi Data Analisis
Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada
prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut
memenuhi persyaratan untuk penggunaannya (WHO, 1992).
Validasi metode analisis bertujuan untuk memastikan dan mengkonfirmasi
bahwa metode telah sesuai dengan penggunaannya. Validasi biasanya
diperuntukkan untuk metode analisis yang baru dibuat dan dikembangkan
(Riyadi, 2009). Validasi merupakan persyaratan mendasar yang diperlukan untuk
menjamin kualitas dan reabilitas hasil dari semua aplikasi analitik (Ermer, 2005)
Validasi metode untuk prosedur analitik dimulai dengan pengumpulan
data validasi oleh pelaksana guna mendukung prosedur analitiknya (Bliesner,
2006). Data validasi mencakup pemaparan karakteristik metode yang dipakai,
faktor-faktor yang mempengaruhi karakteristik tersebut dan membuktikan bahwa
metode yang digunakan sesuai dengan tujuan yang dikehendaki (MacNeil, 2000).
2.7.1 Akurasi/kecermatan
Persen perolehan kembali digunakan untuk menyatakan kecermatan.
Kecermatan merupakan ukuran yang menunjukkan derajat kedekatan hasil
analisis dengan kadar analit sebenarnya. Kecermatan dapat ditentukan dengan dua
baku (standard addition method). Dalam metode simulasi, sejumlah analit bahan
murni pembanding kimia ditambahkan ke dalam campuran bahan pembawa
(plasebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan
kadar analit yang ditambahkan. Metode adisi dapat dilakukan dengan
menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang
diperiksa lalu dianalisis lagi dengan metode tersebut (WHO, 1992).
% Perolehan kembali = A F
C C
x 100%
Keterangan : CF = konsentrasi analit yang diperoleh setelah penambahan
larutan baku
CA = konsentrasi larutan baku yang ditambahkan (Harmita, 2004)
2.7.2 Presisi/keseksamaan
Presisi/keseksamaan biasanya dinyatakan sebagai simpangan baku relatif
dari jumlah sampel yang berbeda signifikan secara statistik (Rohman, 2007).
Berdasarkan rekomendasi ICH (the International Conference on the
Harmonisation), karakteristik presisi dilakukan pada 3 tingkatan, yakni
keterulangan (repeatability), presisi antara (intermediate precision) dan
reprodusibilitas (reproducibility). Keterulangan dilakukan dengan cara
menganalisis sampel yang sama oleh analis yang sama menggunakan instrumen
yang sama dalam periode waktu singkat. Presisi antara dikerjakan oleh analis
yang berbeda. Sedangkan reprodusibilitas dikerjakan oleh analis yang berbeda dan
2.7.3 Batas Deteksi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat
dideteksi yang masih memberikan respon signifikan dibandingkan dengan
blangko. Batas deteksi merupakan parameter uji batas (Harmita, 2004).
Penentuan batas deteksi suatu metode berbeda-beda tergantung pada
metode analisis itu menggunakan instrumen atau tidak. Pada analisis yang tidak
menggunakan instrumen batas tersebut ditentukan dengan mendeteksi analit
dalam sampel pada pengenceran bertingkat. Pada analisis instrumen batas deteksi
dapat dihitung dengan mengukur respon blangko beberapa kali lalu dihitung
simpangan baku respon blangko (Harmita, 2004).
Batas deteksi dapat dihitung dengan rumus sebagai berikut:
Batas Deteksi =
Batas kuantitasi merupakan parameter pada analisis renik dan diartikan
sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama (Harmita, 2004).
Simpangan baku respon dapat ditentukan berdasarkan simpangan baku
blanko, simpangan baku residual dari garis regresi atau simpangan baku intersep y
pada garis regresi (Rohman, 2007).
Batas Kuantitasi =
Slope SB
10
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Penelitian
ini dilaksanakan di Laboratorium Pengolahan Hasil dan Mutu (PAHAM) Pusat
Penelitian Kelapa Sawit (PPKS) Medan Sumatera Utara, pada bulan Januari 2010
hingga April 2010.
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah satu unit alat
Kromatografi Gas Simadzu 2010 dengan kolom Rtx-1® menggunakan detektor
penangkap elektron (Laboratorium PAHAM Pusat Penelitian Kelapa Sawit
Sumatera Utara), neraca analitik (Sartorius BL-2105), oven (Memmert), kapas,
kertas saring, bola karet, rotary evaporator (BUCHI R-210), penangas air,
desikator dan alat-alat gelas yaitu gelas tentukur (Pyrex), labu takar (Pyrex), pipet
volume (Duran), pipet tetes, dan kolom kromatografi.
3.2 Bahan
Sampel berupa minyak sawit mentah yang diperoleh di Pusat Penelitian
Kelapa Sawit Sumatera Utara dan minyak goreng kelapa sawit yang ada di
pasaran di daerah Medan.
Bahan-bahan kimia yang digunakan adalah petroleum eter Ligroine
natrium sulfat anhidrous p.a. (MERCK), dan pestisida standar klorpirifos
(Dursban).
3.3 Rancangan Penelitian 3.3.1 Penyiapan Bahan
3.3.1.1 Pembuatan Aktifasi Penyerap Alumina
Diambil 300 g alumina, lalu dimasukkan ke dalam gelas beaker 500 ml.
Kemudian dimasukkan ke dalam tanur. Diaktivasi pada suhu 400 0C selama 4
jam, lalu ditutup dengan aluminium voil dan dimasukkan ke dalam desikator.
3.3.1.2 Pembuatan Larutan Standar Klorpirifos 1000 µg/ml
Ditimbang sebanyak 100 mg standar klorpirifos, lalu dimasukkan ke
dalam labu tentukur 100 ml. Kemudian ditambah dengan sedikit pelarut
n-heksan, kocok hingga larut. Setelah larut, diencerkan lagi dengan pelarut sampai
garis tanda.
3.3.1.3 Pembuatan Larutan Standar Klorpirifos 100 µg/ml
Dipipet 5 ml larutan standar klorpirifos 1000 µg/ml, lalu dimasukkan ke
dalam labu tentukur 50 ml. Setelah itu, ditambahkan pelarut n-heksan sampai
garis tanda.
3.3.1.4 Pembuatan Larutan Standar Klorpirifos 10 µg/ml
Dipipet 5 ml larutan standar klorpirifos 100 µg/ml, lalu dimasukkan ke
dalam labu tentukur 50 ml. Setelah itu, ditambahkan pelarut n-heksan sampai
3.3.2 Analisis Kuantitatif
3.3.2.1 Penentuan Kondisi Optimum Kromatografi Gas
Kromatografi gas : Simadzu model 2010, dilengkapi dengan detektor
penangkap elektron 63Ni
Kolom : Rtx-1®, ketebalan film 0,25 µ m, 15 m x 0,25 mm.
Gas Pembawa : Gas Nitrogen
Laju Alir Gas Pembawa : 1,61 ml/menit
Temperatur Kolom : 150 0C ditahan selama 2 menit, lalu 300 0C ditahan
selama 1 menit
Temperatur Injeksi : 325 0C
Temperatur Detektor : 325 0C
3.3.2.2 Penentuan Deteksi Minimum Standar Klorpirifos
Dibuat standar klorpirifos dari 0,01 µg/ml; 0,02 µg/ml; 0,05 µg/ml; 0,1
µg/ml; 0,5 µg/ml; dan 1 µg/ml dari standar klorpirifos 10 µg/ml dengan
melarutkannya ke dalam n-heksan. Kemudian masing-masing konsentrasi
disuntikkan ke dalam sistem Kromatografi Gas dengan detektor penangkap
elektron. Diamati konsentrasi terkecil yang mampu dideteksi oleh alat
kromatografi gas dengan memunculkan area kromatogram pada waktu retensi
tertentu.
3.3.2.3 Penentuan Kurva Kalibrasi Standar Klorpirifos
Jika batas deteksi minimum 0,02 µg/ml, dibuat standar klorpirifos dari
0,02 µg/ml; 0,04 µg/ml; 0,06 µg/ml; 0,1 µg/ml; 0,2 µg/ml; 0,4 µg/ml; 0,6 µg/ml;
dan 1 µg/ml dengan melarutkannya ke dalam n-heksan. Kemudian masing-masing
3.3.2.4 Penentuan Uji Perolehan Kembali dan Clean-Up
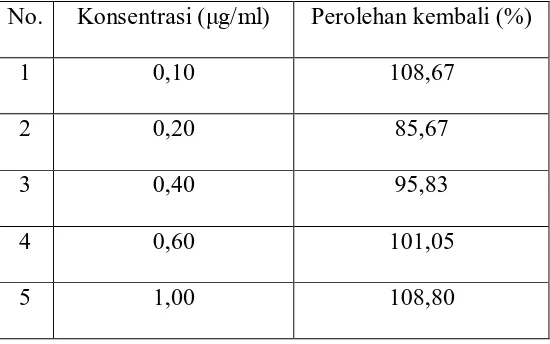
Persen perolehan kembali ditentukan dengan menggunakan metode
simulasi (spiked-placebo recovery) yaitu dibuat konsentrasi standar klorpirifos
dalam minyak sawit yang bebas dari cemaran klorpirifos dengan konsentrasi 0,1
µg/ml; 0,2 µg/ml; 0,4 µg/ml; 0,6 µg/ml; dan 1 µg/ml, kemudian dikocok selama
30 menit.
Setelah itu, dilakukan elusi dari analit dimana kolom kromatografi
dikemas dengan cara :
1. Alumina yang telah diaktifasi dibuburkan dengan petroleum eter, diaduk
sampai alumina terbebas dari udara dan terbuburkan sempurna
2. Dimasukkan kapas ke dasar kolom, kemudian dialirkan petroleum eter secara
kontinu sampai kapas terbebas dari gelembung udara
3. Dimasukkan 15 g alumina yang telah diaktifasi dan terbebas dari udara (2/3
tinggi kolom) kedalam kolom yang telah diisi kapas dengan pengaliran
petroleum eter berkelanjutan. Kolom dipadatkan dengan mengetuk dinding
kolom hingga alumina terdistribusi merata dalam kolom
4. Dialirkan terus petroleum eter selama 50 menit
5. Dimasukkan natrium sulfat anhydrous 1 gr ke dalam kolom, diratakan
permukaannya
6. Dimasukkan 1 gr analit
7. Dielusi dengan 50 ml petroleum eter. Dikumpulkan eluat dalam rotary
evaporator
8. Dipekatkan pada suhu 65 oC hingga 1 ml
3.3.2.5 Penetapan Kadar Klorpirifos dalam Sampel
1. Alumina yang telah diaktifasi dibuburkan dengan petroleum eter, diaduk
sampai alumina terbebas dari udara dan terbuburkan sempurna
2. Dimasukkan kapas ke dasar kolom, kemudian dialirkan petroleum eter secara
kontinu sampai kapas terbebas dari gelembung udara
3. Dimasukkan 15 gr alumina yang telah diaktifasi dan terbebas dari udara (2/3
tinggi kolom) kedalam kolom yang telah diisi kapas dengan pengaliran
petroleum eter berkelanjutan. Kolom dipadatkan dengan mengetuk dinding
kolom hingga alumina terdistribusi merata dalam kolom
4. Dialirkan terus petroleum eter selama 50 menit
5. Dimasukkan natrium sulfat anhydrous 1 gr ke dalam kolom, diratakan
permukaannya
6. Dimasukkan 1 gr sampel ke dalam kolom
7. Dielusi dengan 50 ml petroleum eter. Dikumpulkan eluat dalam rotary
evaporator
8. Dipekatkan pada suhu 65 oC hingga 1 ml
9. Disuntikkan ke dalam sistem alat kromatografi gas
Kadar klorpirifos yang terdapat dalam larutan sampel (X) dihitung dengan
mensubstitusikan luas puncak ke dalam persamaan regresi yang diperoleh dari
kurva kalibrasi pada bagian 3.3.2.3 sebagai Y. Hasilnya lalu dikali volume
larutan sampel (1 ml), kemudian dibagi dengan berat penimbangan sampel
sehingga diperoleh kadar klorpirifos dengan satuan µg/g sampel. Rumus
X(µg/ml)xVolume larutan sampel(ml) Berat penimbangan sampel(g)
KV = SB X
x 100%
Kadar klorpirifos dalam sampel (µg/g sampel)
3.3.3 Validasi Metode
3.3.3.1 Akurasi/Kecermatan
Akurasi ditentukan dengan menggunakan metode simulasi (spiked-placebo
recovery). Hasil dinyatakan dalam persen perolehan kembali.
Persen perolehan kembali dari analit dapat dihitung menurut persamaan
berikut :
% Perolehan kembali = A
CA = konsentrasi larutan baku yang ditambahkan
(Harmita, 2004)
3.3.3.2 Presisi
Presisi metode penelitian dinyatakan oleh simpangan baku relatif (Relative
Standard Deviation (RSD) atau disebut juga koefisien variasi (KV) dari
serangkaian data. KV dapat dirumuskan sebagai berikut :
Keterangan:
SB = simpangan baku
3.3.3.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi (Limit Of Detection/LOD) dan batas kuantitasi (Limit Of
Quantitation/LOQ) dihitung dari persamaan regresi kurva kalibrasi baku
pembanding. Batas deteksi dan batas kuantitasi dapat dihitung dengan
menggunakan rumus sebagai berikut :
Sy/x =
2 Yi)
-(Y 2
−
∑
n
Batas Deteksi =
Slope xSy/x
3
Batas Kuantitasi =
Slope xSy/x
10
Keterangan: Sy/x = residual standard deviation/simpangan baku residual
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Kondisi Kromatografi Gas yang Optimum
Kadar klorpirifos dalam minyak sawit ditentukan dengan kromatografi gas
memakai detektor penangkap elektron. Untuk mendapatkan hasil yang baik,
terlebih dahulu dicari kondisi optimum dari sistem kromatografi.
Pada analisis residu klorpirifos dengan metode kromatografi gas langkah
yang pertama dilakukan adalah mencari kondisi optimum dan kesesuaian sistem
kromatografi gas yang akan digunakan agar sistem dapat memisahkan residu
klorpirifos dalam analit dengan baik.
Kondisi sistem kromatografi gas diatur sedemikian sehingga didapat
teknik analisis yang optimum dimana gas pembawa memakai gas Nitrogen
dengan detektor penangkap elektron sehingga terjadi absorbsi elektron oleh
senyawa yang mempunyai afinitas terhadap elektron bebas. Dalam detektor, gas
terionisasi oleh partikel yang dihasilkan dari Ni63 sehingga kehilangan sinyal
dapat diukur ketika analit terelusi dari kolom kromatografi. Jenis detektor ini peka
terhadap senyawa halogen, karbonil terkunjugasi, nitril, nitro, dan organo logam.
Temperatur kolom 150 0C ditahan selama 2 menit, kemudian 300 0C
ditahan selama 1 menit, Temperatur Injeksi 325 0C, dan temperatur detektor 325
0
C. Suhu detektor lebih tinggi dibandingkan dengan suhu kolom sehingga
komponen yang dianalisis dapat terdorong keluar dari kolom menuju detektor.
Sebelum detektor dinyalakan, laju aliran gas pembawa Nitrogen diukur dengan
pembawa nitrogen sangat berpengaruh terhadap waktu retensi. Laju aliran gas
pembawa nitrogen dalam sistem kromatografi gas yang digunakan yaitu 1,61
ml/menit.
Kolom yang dipakai adalah jenis Rtx-1® yang mengandung fase diam
dimethyl polysiloxane 100% pabrikan Crossbond® yang bersifat nonpolar mampu
memisahkan dengan baik pestisida golongan organofosfat yang diuji, panjang
kolom 15 m, diameter dalam 0,25 mm dan ketebalan film 0,25 µ m.
Dari hasil penelitian yang dilakukan, didapat hasil optimum dalam
pengukuran standar klorpirifos dengan metode kromatografi gas menggunakan
detektor penangkap elaktron. Salah satu kromatogram yang diperoleh dari kondisi
kromatografi gas yang optimum dapat dilihat pada gambar.
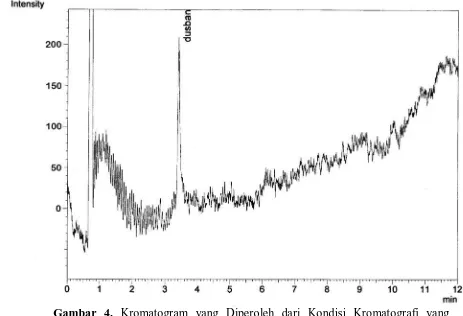
Gambar 4. Kromatogram yang Diperoleh dari Kondisi Kromatografi yang
Standar klorpirifos terdeteksi pada waktu retensi 3,382 menit, hal ini
menunjukkan secara kualitatif adanya senyawa klorpirifos pada analit yang diteliti
pada waktu retensi tersebut.
Waktu retensi merupakan waktu sejak penyuntikan sampai maksimum
puncak. Sifat ini merupakan ciri khas cuplikan dan fase cair pada suhu tertentu.
Tiap senyawa hanya memiliki satu waktu retensi saja, dimana waktu retensi ini
tidak terpengaruh oleh adanya komponen lain (Bonelli, 1988).
Pada kondisi tekanan tetap, laju aliran berbanding lurus dengan waktu
retensi. Waktu retensi merupakan ciri suatu cuplikan sehingga dapat digunakan
untuk mengidentifikasi suatu cuplikan dengan syarat suhu kolom harus tetap.
Identifikasi didasarkan pada perbandingan waktu retensi komponen yang tidak
dikenal dengan waktu retensi senyawa yang dikenal, yang dianalisis pada kondisi
yang sama (Bonelli, 1988).
Ainie (2000) melakukan analisis residu klorpirifos dalam matriks
berminyak dengan kromatografi gas Hewlett Parkard, Palo Alto menggunakan
kolom DB-1 (Folsom, California) panjang 30 m dengan diameter dalam 0,53 mm
dengan detektor fotometrik nyala (Flame Photometric Detector/FPD). Kondisi
operasi yang dipakai yaitu temperatur injektor dan detektor 250 0C, temperatur
Oven 90 0C, gas pembawa Helium dengan laju alir total 30 ml/menit. Temperatur
kolom 90 0C ditahan selama 6 menit, sampai 200 0C ditahan selama 6 menit
dengan kenaikan temperatur 6 0C.
Halimah (1999) melakukan penentuan kadar klorpirifos pada olein kelapa
sawit yang dimurnikan dengan kromatografi gas Hewlett Packard model 5890 seri
sebagai kolom nonpolar. Kondisi kerja yang digunakan sebagai berikut: aliran
kolom 2,7 ml/menit, suhu injektor 280 0C, suhu detektor 250 0C, suhu oven
diprogram untuk meningkat dari 190 0C sampai 220 0C pada 5 0C/menit yang
ditahan selama 4 menit.
Muhamad (2002) melaporkan tentang penentuan kadar residu klorpirifos
dalam matriks minyak dengan kromatografi gas Hewlett Packard model 5890
memakai detektor penangkap elektron menggunakan kolom kapiler HP5-MS
dimana parameter yang digunakan yaitu aliran kolom Nitrogen 2,7 ml/menit, suhu
injektor diatur pada 250 0C dalam mode kontinu dengan katup pembagi dimatikan
selama 0,75 menit.
4.2 Proses Clean-up
Proses Clean-up dilakukan dengan elusi menggunakan kromatografi
kolom, dimana digunakan penyerap alumina dan pelarut petroleum eter. Terlebih
dahulu sebelum digunakan alumina diaktivasi pada suhu 400 0C selama 4 jam
agar didapat permukaan alumina yang mampu menyerap lebih kuat. Alumina
sangat luas digunakan sebagai penyerap karena memiliki luas permukaan yang
spesifik beratus-ratus meter persegi, juga sangat mudah diperoleh dalam
perdagangan. Pelarut petroleum eter merupakan pelarut dengan polaritas yang
rendah sehingga mampu menarik senyawa klorpirifos melewati fase diam dalam
pemisahan dengan kromatografi kolom. Sifat pelarut yang mampu memisahkan
senyawa klorpirifos dari analit lainnya dijadikan alasan pemilihan pelarut dalam
Pengisian kolom harus menggunakan teknik yang tepat dan berhati-hati.
Pengisian yang tidak teratur dari penyerap akan mengakibatkan merusak
batas-batas pita kromatografi karena terdapat gelembung udara selama pengisian. Untuk
mencegah hal tersebut zat penyerap dibuat menjadi bubur dengan pelarut
kemudian dituangkan perlahan-lahan kedalam kolom. Jika penyerap dibiarkan
turun perlahan-lahan dapat ditolong dengan mengguncang perlahan-lahan sisi
kolom agar diperoleh pengisian yang homogen (Sastroamidjojo, 1985).
Elusi dilakukan selama 50 menit dengan mengalirkan pelarut petroleum
eter secara terus-menerus dengan tujuan agar klorpirifos terbawa oleh pelarut
melewati penyerap yang akan menghambat pengotor dalam analit minyak sawit.
Eluat yang diperoleh dipekatkan dan dianalisis dengan metode kromatografi gas.
Ainie (2000) melakukan proses clean-up dari matriks berminyak terhadap
klorpirifos dengan Kromatografi Permeasi Gel. Halimah (1999) memakai sistem
kromatografi serapan dalam melakukan proses clean-up dari olein kelapa sawit
dimana persiapannya sebagai berikut : Suatu kolom kromatografi yang
mengandung 1,5 cm lapisan dasar Na2SO4 anhidrat, 5 cm asam silikat dan 1,5 cm
lapisan atas Na2SO4 anhidrat disiapkan untuk prosedur clean-up. Kolom yang
berisi ekstrak sampel dielusi dengan 180 ml diklorometan dalam heksan 7,5% v’v
pada kecepatan 3-5 ml/menit. Eluat ditampung dalam labu alas kemudian
dipekatkan dengan rotavapor hingga 5 ml.
Mohamad (2002) melakukan penelitian tentang optimalisasi prosedur
ekstraksi dan clean-up pada penentuan kadar klorpirifos dalam matriks minyak,
dimana ekstraksi memakai petroleum eter. Proses clean-up menggunakan
4.3 Penentuan Kurva Kalibrasi Standar Klorpirifos
Analisis secara kuantitatif ditentukan dari kurva kalibrasi standar
klorpirifos berdasarkan luas puncak. Kurva kalibrasi standar klorpirifos dibuat
dengan konsentrasi 0,02 μg/ml; 0,04 μg/ml; 0,06 μg/ml; 0,1 μg/ml; 0,2 μg/ml; 0,4
μg/ml; 0,6 μg/ml; dan 1 μg/ml menggunakan pelarut n-heksan. Pengukuran luas
puncak tidak banyak dipengaruhi oleh kondisi kromatografi dibandingkan dengan
tinggi puncak, kecuali laju alir. Tetapi laju alir saat ini telah dapat diatur oleh
instrumen secara tepat dan konstan, sehingga pengukuran luas puncak merupakan
pilihan yang terbaik dalam analisis kuantitatif secara kromatografi gas.
Analisis yang dilakukan dengan metode kromatografi gas menggunakan
detektor penangkap elektron menunjukkan garis regresi yang baik dan memenuhi
persyaratan validasi. Hal tersebut dapat terlihat dari hasil pengukuran kurva
kalibrasi dimana didapat kurva yang linear dengan nilai yang mendekati 1.
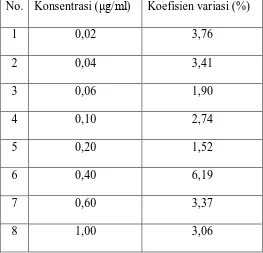
Hasil pengukuran kurva kalibrasi dapat dilihat pada tabel 1.
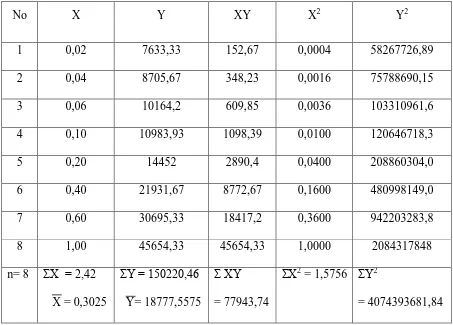
Tabel 1. Hasil Pengukuran Kurva Kalibrasi dengan Metode Kromatografi Gas No. Konsentrasi (μg/ml) Luas Puncak
1 0,02 7633,33
2 0,04 8705,67
3 0,06 10164,2
4 0,10 10983,93
5 0,20 14452
6 0,40 21931,67
7 0,60 30695,33
Konsentrasi Luas Area
Dari hasil pengukuran kurva kalibrasi didapat gambar kurva kalibrasi yang
dapat dilihat pada gambar 2.
Gambar 5. Kurva Kalibrasi Standar Klorpirifos 4.3.1 Persamaan Garis Regresi
Dari hasil perhitungan kurva kalibrasi diperoleh persamaan garis regresi Y =
38530,08X + 7122,21.
Salah satu kromatogram hasil analisis dari standar klorpirifos untuk
pembuatan kurva kalibrasi dapat dilihat pada gambar.