KEMAMPUAN BAKTERI KITINOLITIK DALAM
MENGHAMBAT INFEKSI Aspergillus sp. PADA IKAN NILA
(Oreochromis niloticus)
SKRIPSI
OLEH JEKMAL MALAU
080805027
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : KEMAMPUAN BAKTERI KITINOLITIK DALAM
MENGHAMBAT INFEKSI Aspergillus sp. PADA IKAN NILA (Oreochromisniloticus)
Kategori : SKRIPSI
Nama : JEKMAL MALAU
Nomor Induk Mahasiswa : 080805027
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
(FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di Medan, Juli 2012
Komisi Pembimbing
Pembimbing II Pembimbing I
Dedy Arief Hendriyanto, S.St.Pi, M.Si. Prof. Dr. Dwi Suryanto, M.Sc. NIP. 19780524 200003 1 002 NIP. 19640409 199403 1 003
Diketahui / Disetujui oleh
Departemen Biologi FMIPA USU
Dr. Nursahara Pasaribu, M.Sc.
PERNYATAAN
KEMAMPUAN BAKTERI KITINOLITIK DALAM MENGHAMBAT INFEKSI
Aspergillus sp. PADA IKAN NILA (Oreochromisniloticus)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa
kutipan dan ringkasan yang masing-masing dituliskan sumbernya.
Medan, Juli 2012
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas berkat kasih, rahmat dan kemurahan-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul, ”KEMAMPUAN BAKTERI KITINOLITIK DALAM MENGHAMBAT INFEKSI Aspergillus sp. PADA IKAN NILA (oreochromisniloticus)” dalam waktu yang ditetapkan.
Ucapan terima kasih penulis sampaikan kepada Prof. Dr. Dwi Suryanto, M.Sc selaku Dosen Pembimbing I dan kepada Bapak Dedy Arief Hendriyanto, S.St.Pi. M.Si. sebagai Dosen Pembimbing II yang telah banyak memberikan bimbingan dan arahan, waktu dan perhatiannya yang besar terutama saat memulai penulisan hingga penyusunan skripsi ini. Ucapan terima kasih juga saya sampaikan Prof. Dr. H. Erman Munir, M.Sc dan Dr. Miswar Budi Mulya, M.Si. sebagai Anggota Penguji yang telah banyak memberikan arahan dan saran dalam penyempurnaan penulisan skripsi ini.
Ucapan terima kasih juga saya ucapkan kepada Ibu Dra. Elimasni, M.Si. selaku Dosen Pembimbing Akademik saya dan juga kepada Ibu Dr. Nursahara Pasaribu, M.Sc. Ketua Departemen Biologi FMIPA USU dan Bapak Drs. Kiki Nurtjahja, M.Sc selaku Sekretaris Departemen Biologi FMIPA USU. Dr. Sutarman, M.Sc. selaku Dekan FMIPA USU. Ibu Nunuk Priyani, M.Sc. selaku kepala Laboratorium Mikrobiologi. Staf pengajar di Departemen Biologi FMIPA USU. Bapak Alm. Sukirmanto, Ibu Nurhasni Muluk, Ibu Roslina Ginting, dan Bang Erwin selaku Staf Pegawai Departemen BIOLOGI FMIPA USU.
Penulis juga mengucapkan banyak terima kasih kepada Ayahanda Asten Malau dan Ibunda Rose Simbolon yang sudah memberikan banyak dukungan baik dari segi moril maupun materiil sehingga penulis bisa menyelesaikan perkuliahan ini, dan kepada saudara saya yang saya sayangi dan cintai Abang Edi Supeno Malau, John Ali Malau danAdik Nia Daniaty Malau penulis ucapkan ribuan terima kasih atas segala cinta, kasih sayang, pengorbanan moril maupun materil, motivasi, kesabaran serta doa yang tidak akan pernah bisa penulis balas sampai kapanpun.
Terima kasih juga penulis ucapkan kepada Balai Karantina Ikan Kelas I Polonia Medan yang telah memberikan fasilitas dalam menyelesaikan skripsi ini, kak Ratna, Bang Mona, Bu Barita dan Pak Ramon yang selalu memberikan saran dan motivasi kepada penulis. Kepada Unit Pelayanan Teknis Daerah Budidaya yang telah memberikan bantuan dan dukungan.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan,oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun dalam melengkapi kekurangan serta penyempurnaan laporan hasil penelitian ini. Atas partisipasi dan dukungan penulis ucapkan terimakasih.
Medan, Juli 2012
KEMAMPUAN BAKTERI KITINOLITIK DALAM MENGHAMBAT INFEKSI Aspergillus sp. PADA IKAN NILA (Oreochromis niloticus)
ABSTRAK
Penelitian tentang kemampuan bakteri kitinolitik dalam menghambat infeksi
Aspergillus sp. pada ikan nila (Oreochromis niloticus) telah dilakukan di Laboratorium Mikrobiologi Karantina Ikan Kelas I Polonia, Medan dan Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan. Empat isolat jamur yaitu Aspergillus sp. 1,
Aspergillus sp. 2, Rhizopus sp. dan isolat yang belum teridentifikasi (Sp.1) yang diduga menyebabkan penyakit diisolasi dari ikan nila dan telur ikan mas koi. Uji patogenitas menunjukkan bahwa isolat jamur Aspergillus sp. 2 paling patogen dengan tingkat mati dan terinfeksi 70%. Uji antagonis menunjukkan bahwa enam isolat bakteri kitinolitik (Bacillus sp. BK13, Enterobacter sp. BK15, PB08, PB15,
Enterobacter sp. PB17 dan Bacillus sp. BK17) mampu menghambat pertumbuhan jamur dengan diameter zona hambat yang berbeda-beda. Isolat bakteri Enterobacter
sp. PB17 dan Bacillus sp. BK17 memiliki kemampuan tertinggi menghambat pertumbuhan semua jamur yang berbeda dengan diameter zona hambat 15,50 mm dan 11,53 mm. Pengujian penghambatan infeksi Aspergillus sp. 2 pada ikan nila menunjukkan bahwa isolat Bacillus sp. BK17 memiliki kemampuan tertinggi menurunkan jumlah ikan yang terinfeksi dan mati dengan jumlah ikan hidup mencapai 92%. Pengamatan dengan mengunakan Scanning Electron Microscope (SEM) menunjukkan bahwa isolat bakteri Bacillus sp. BK17 dan Enterobacter sp. PB17 mampu melekat pada sisik ikan, sehingga kemungkinan dapat menekan serangan patogen pada ikan.
ABILITY OF CHITINOLTYTIC BACTERIA TO INHIBIT INFECTION OF Aspergillus sp. IN TILAPIA (Oreochromis niloticus)
ABSTRACT
A study on ability of chitinoltytic bacteria to inhibit the Aspergillus sp. causal agent of disease in Tilapia fish has been done in the Laboratory of Microbiology Karantina Ikan Kelas I Polonia, Medan and Laboratory of Microbiology, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara, Medan. Four suspected pathogenic fungi i.e.Aspergillus sp. 1, Aspergillus sp. 2, Rhizopus sp. and Sp. 1 were isolated from Tilapia fish and koi goldfish eggs. Pathogenic test showed that Aspergillus sp. 2 was more pathogenic than the others, of which 70% of fish were affected. The ability of bacterial isolates to inhibit the fungal in vitro was evaluated by antagonism assay with dual plate on agar MSMC. The result of in vitro antagonism assay of all fungal isolation to six chitinolytic bacteria(Bacillus sp. BK13,
Enterobacter sp. BK15, PB08, PB15, Enterobacter sp. PB17 dan Bacillus sp. BK17) showed the ability of bacterial isolate to inhibit fungal growth with to some extent. Antagonistic test showed that bacterial isolate Enterobacter sp. PB17 and Bacillus sp. BK17 inhibited more of all fungal growth. However, bacterial isolate inoculation prior
Aspergillus spore inoculation in fish showed that Bacillus sp. BK17 was more capable of suppressing fungal disease, of which 92% of fish were healthy. Observation using Scanning Electron Microscope of fish skin showed that the bacterial isolate might attach to the fish, so capable possibility of suppressing pathogen in fish.
Keywords: Aspergillus sp., Bacillus sp., Enterobacter sp., fish disease, Scanning Electron Microscope
Halaman
2.1 Biologi Ikan Nila (Oreochromisniloticus) 5 2.2 Interaksi antara Imunitas Inang, Jasad Patogen dan
Lingkungan 2.3 Jamur Aspergillus sp.
6 7
2.4 Mikroorganisme Penghasil Kitinase 9
BAB 3 BAHAN DAN METODE
3.1 Waktu dan Tempat 11
3.2 Alat dan Bahan 11
3.3 Isolasi dan Identifikasi Jamur 12
3.4 Isolat Bakteri Penghasil Enzim Kitinase 12
3.5 Uji antagonis Isolat Bakteri Kitinolitik Terhadap Jamur
Secara In vitro 13
3.6 Pengamatan Struktur hifa Jamur Setelah Asai Antagonisme 14
3.7 Uji Patogenitas Jamur Terhadap Ikan Nila 15
3.8 Penghambatan Serangan Jamur pada Ikan Uji Secara In vivo 15 3.9 Pengamatan Perlekatan Bakter pada Ikan Nila 16
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi dan Karakterisasi Jamur 17
4.2 Hasil Pengujian Bakteri Kitinolitik Penghasil Enzim
Kitinase 20
4.3 Hasil Uji Antagonis Isolat Bakteri Kitinolitik Terhadap
Jamur 22
4.4 Pengamatan Struktur Hifa Abnormal Jamur Setelah Uji
Antagonisme 25
4.5 Hasil Patogenitas Jamur 27
4.7 Hasil Uji Perlekatan Bakteri Pada Ikan Nila 33
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 36
5.2 Saran 36
DAFTAR PUSTAKA 38
Halaman
DAFTAR GAMBAR
Tabel 4.1.1
Tabel 4.3.1
Karakterisasi Makroskopis dan Mikroskopis Jamur Hasil Isolasi
Uji Antagonisme in vitro Enam Isolat Bakteri Kitinolitik Terhadap Jamur Sejati
18
Halaman
Gambar 3.5.1 Metode pengukutan zona hambat koloni bakteri kitinolitik terhadap pertumbuhan koloni jamur
13
Gambar 4.1.1 Telur ikan mas koi dan ikan nila yang terserang jamur 17 Gambar 4.2.1Isolat Bakteri penghasil kitinase pada media agar MGMK 20 Gambar 4.3.1 Uji antagonisme bakteri kitinolitik pada media agar MGMK 22 Gambar 4.3.2 Diameter zoa hambat tertinggi dari masing-masing isolat
bakteri kitinolitik selama pengamatan 7 hari
24
Gambar 4.4.1 Perubahan morfologi hifa jamur setelah uji antagonisme dengan bakteri kitinolitik
26
Gambar 4.5.1 Persentase tingkat patogenitas (tingkat terinfeksi dan
mortalitas) isolat jamur terhadap ikan nila selama pengamatan 10 hari
28
Gambar 4.5.2 Ikan terinfeksi jamur Aspergillus sp. 2 pada uji patogenitas 29 Gambar 4.6.1Persentase penghambatan infeksi Aspergillus sp. 2 dengan uji
tantang isolat bakteri potensial secara in vivo
31
Gambar 4.7.1 Pengamatan perlekatan bakteri Bacillus sp. BK17 dan Enterobacter sp. PB17 pada sisik ikan nila
33
Halaman
Lampiran 1. Komposisi Medium MGMK Padat dan Cara Pembuatannya 45 Lampiran 2. Pembuatan Koloidal Kitin dengan cara Hidrolisis Parsial
(Rodriquez-Kabana et al., 1983)
46
Lampiran 3. Alur Kerja Uji Penghambatan Jamur secarain vitro 47
Lampiran 4. Preparasi Spora Jamur Sejati 48
Lampiran 5. Uji Patogenitas Jamur 49
Lampiran 6. Alur Kerja Isolat Bakteri Antagonis 50
Lampiran 7. Evaluasi Efek Bakteri Antagonis Tehadap Aspergillus sp. 2 secara in vivo
51
Lampiran 8. Pengamatan Perlekatan Bakteri Kitinolitik pada Ikan Nila Lampiran 9. Pengukuran pH dan Suhu
Lampiran10.Ikan Uji
Lampiran11.Bak Penyesuaian dan Aquarium
KEMAMPUAN BAKTERI KITINOLITIK DALAM MENGHAMBAT INFEKSI Aspergillus sp. PADA IKAN NILA (Oreochromis niloticus)
ABSTRAK
Penelitian tentang kemampuan bakteri kitinolitik dalam menghambat infeksi
Aspergillus sp. pada ikan nila (Oreochromis niloticus) telah dilakukan di Laboratorium Mikrobiologi Karantina Ikan Kelas I Polonia, Medan dan Laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan. Empat isolat jamur yaitu Aspergillus sp. 1,
Aspergillus sp. 2, Rhizopus sp. dan isolat yang belum teridentifikasi (Sp.1) yang diduga menyebabkan penyakit diisolasi dari ikan nila dan telur ikan mas koi. Uji patogenitas menunjukkan bahwa isolat jamur Aspergillus sp. 2 paling patogen dengan tingkat mati dan terinfeksi 70%. Uji antagonis menunjukkan bahwa enam isolat bakteri kitinolitik (Bacillus sp. BK13, Enterobacter sp. BK15, PB08, PB15,
Enterobacter sp. PB17 dan Bacillus sp. BK17) mampu menghambat pertumbuhan jamur dengan diameter zona hambat yang berbeda-beda. Isolat bakteri Enterobacter
sp. PB17 dan Bacillus sp. BK17 memiliki kemampuan tertinggi menghambat pertumbuhan semua jamur yang berbeda dengan diameter zona hambat 15,50 mm dan 11,53 mm. Pengujian penghambatan infeksi Aspergillus sp. 2 pada ikan nila menunjukkan bahwa isolat Bacillus sp. BK17 memiliki kemampuan tertinggi menurunkan jumlah ikan yang terinfeksi dan mati dengan jumlah ikan hidup mencapai 92%. Pengamatan dengan mengunakan Scanning Electron Microscope (SEM) menunjukkan bahwa isolat bakteri Bacillus sp. BK17 dan Enterobacter sp. PB17 mampu melekat pada sisik ikan, sehingga kemungkinan dapat menekan serangan patogen pada ikan.
ABILITY OF CHITINOLTYTIC BACTERIA TO INHIBIT INFECTION OF Aspergillus sp. IN TILAPIA (Oreochromis niloticus)
ABSTRACT
A study on ability of chitinoltytic bacteria to inhibit the Aspergillus sp. causal agent of disease in Tilapia fish has been done in the Laboratory of Microbiology Karantina Ikan Kelas I Polonia, Medan and Laboratory of Microbiology, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara, Medan. Four suspected pathogenic fungi i.e.Aspergillus sp. 1, Aspergillus sp. 2, Rhizopus sp. and Sp. 1 were isolated from Tilapia fish and koi goldfish eggs. Pathogenic test showed that Aspergillus sp. 2 was more pathogenic than the others, of which 70% of fish were affected. The ability of bacterial isolates to inhibit the fungal in vitro was evaluated by antagonism assay with dual plate on agar MSMC. The result of in vitro antagonism assay of all fungal isolation to six chitinolytic bacteria(Bacillus sp. BK13,
Enterobacter sp. BK15, PB08, PB15, Enterobacter sp. PB17 dan Bacillus sp. BK17) showed the ability of bacterial isolate to inhibit fungal growth with to some extent. Antagonistic test showed that bacterial isolate Enterobacter sp. PB17 and Bacillus sp. BK17 inhibited more of all fungal growth. However, bacterial isolate inoculation prior
Aspergillus spore inoculation in fish showed that Bacillus sp. BK17 was more capable of suppressing fungal disease, of which 92% of fish were healthy. Observation using Scanning Electron Microscope of fish skin showed that the bacterial isolate might attach to the fish, so capable possibility of suppressing pathogen in fish.
Keywords: Aspergillus sp., Bacillus sp., Enterobacter sp., fish disease, Scanning Electron Microscope
BAB 1
PENDAHULUAN
1.1Latar Belakang
Ikan nila (Oreochromisniloticus) merupakan salah satu spesies ikan yang banyak dibudidayakan untuk memenuhi kebutuhan protein hewani. Konsumsi ikan nila ini
mengalami peningkatan yang signifikan dari tahun ke tahun. Data FAO (2009)
melaporkan bahwa produksi ikan nila dunia terus mengalami peningkatan sekitar
769.936 tontahun 2007 menjadi berkisar 2,3 juta ton tahun 2008, sedangkan pada
tahun 2010 diperkirakan mencapai 2,5 juta ton (FAO, 2010). Dari sini terlihat ikan
nila merupakan salah satu jenis ikan yang bernilai ekonomis tinggi. Namun, potensi
yang besar dan prospek pengembangan yang begitu terbuka, bukan jaminan bahwa
budidaya ikan akan berjalan mulus, tanpa permasalahan. Banyak masalah yang
dihadapi oleh sektor budidaya ikan (Kordi & Ghufran, 2004), tanpa terkecuali dengan
budidaya ikan nila.
Penyakit merupakan salah satu kendala dalam budidaya ikan yang dapat
menyebabkan penurunan tingkat produksi ikan (Dewi, 2011). Perkembangan suatu
penyakit dalam akuakultur meliputi suatu interaksi yang kompleks antara tingkat
virulensi patogen, derajat imunitas inang, kondisi fisiologis dan genetik hewan, stress
dan padat tebaran (Irianto, 2004). Gangguan penyakit pada budidaya ikan merupakan
risiko biologis yang harus selalu diantisipasi. Hal ini mendorong adanya aplikasi
pengelolaan kesehatan yang terintegrasi dan berkesinambungan pada budidaya ikan
(Purwaningsih & Taukhid, 2010).
Salah satu penyakit yang menjadi masalah dalam budidaya ikan adalah
penyakit mikosis (Irianto, 2004; Kordi & Ghufran, 2004), terutama dalam budidaya
al.(1988), Olufemi & Robert (1986),Shrivastava (1996), danOsman et al.(2008) jamur yang menyerang ikan nila yaitu Saprolegnia, Aspergillus niger, Aspergillussp. dan A.
terreus.
Penelitian mengenai pengendalian jamur patogen yang menyerang ikan telah
banyak dilakukan, seperti menggunakan formalin,malachite green oxalate, NaCl,acetic acid(Irianto, 2003).Kordi & Ghufran, (2004) mengatakan bahwa penggunaan obat-obatan memiliki efek samping dan kelemahan dalam pengendalian
penyakit pada budidaya ikan. Pemakaian yang berlebihan dapat berdampak negatif
terhadap ikan diantaranya dapat membunuh organisme bukan sasaran, timbulnya
patogen yang resisten mempengaruhi pertumbuhan dan perkembangbiakan, serta
menimbulkan pencemaran lingkungan(Akbar, 2008). Antibiotik seperti Tetracyline
meninggalkan residu pada kulit, cloramphenicol menyebabkan nafsu makan menurun,
malachite green seperti yang dilaporkan dapat merusak anggota tubuh dan menyebabkan kanker terhadap pemakainya (Srivastava et al., 2003), kalium permanganat (KMnO4), formalin iodium, quinine sulfat dapat menyebabkan menurunnya daya tetas, merusak paru-paru, mata dan anggota tubuh lainnya.
Karena persoalan di atas saat ini banyak penelitian yang mencari kandidat
bahan anti jamur patogen ikan yang berasal dari alam atau bahan biologi (Dewi,
2011), yang dapat digunakan sebagai agen pengendalian hayati. Beberapa penelitian
telah dilakukan untuk memperoleh kandidat yang paling efektif sebagai agen
biokontrol yang diaplikasikan dalam bentuk probiotik (Irianto, 2003). Nogami &
Maeda (1992), Nogami et al. (1997), Kolndadacha et al. (2011) dan Balcazar et al. (2006) melaporkan beberapa jenis bakteri mampu digunakan sebagai agen pengendali
hayati yang diaplikasikan dalam bentuk probiotik.
Banyak bakteri yang berada diperairan atau lingkungan aquatikdilaporkan
memiliki kemampuan kitinolitik.Bakteri kitinolitik yang berasal dari air juga telah
dilaporkan mampu menghambat infeksi Saprolegnia pada telur gurami (Dewi, 2011). Beberapa bakteri kitinolitik pada air seperti danau yaitu Aeromonas sp.,
&Donderski, 2006)dan Chitinilyticum aquatile gen. nov., sp. dilaporkan memiliki kemampuan kitinolitik (Chang et al., 2007).
Pengendalian hayati jamur dengan menggunakan mikroorganisme kitinolitik
didasarkan pada kemampuan mikroorganisme tersebut dalam menghasilkan kitinase dan β -1,3 glukanase yang dapat melisis sel jamur (El-Katatny et al., 2000). Bakteri yang menghasilkan enzim kitin tersebut merupakan kandidat agen biokontrol karena
mampu mengkolonisasi lingkungan sekitarnya dengan cepat. Dengan sifat tersebut,
bakteri penghasil kitinase berpotensi sebagai agen pengendali hayati hama dan
penyakit akibat jamur patogen (Suryanto et al., 2006) begitu juga dengan bakteri antagonistik yang diuji, memiliki kemampuan kitinolitik sehingga berpotensi sebagai
biokontrol jamur patogen seperti Aspergillus yang menginfeksi ikan nila.
1.2Permasalahan
Potensi yang besar dan prospek pengembangan yang begitu terbuka bukan jaminan
bahwa budidaya ikan akan berjalan dengan mulus, tanpa permasalahan. Banyak
masalah dihadapi oleh sektor budi daya ikan. Masalah-masalah itu antara lain adalah
serangan penyakit yang disebabkan oleh jamur, diantaranya adalah serangan penyakit
oleh jamur Aspergillus sp.
Penggunaan bakteri kitinolitik sebagai pengendali hayati secara biologi yang
aman dan ramah lingkungan merupakan suatu alternatifdalam mengendalikan dan
menghambat perkembangan penyakit pada ikan, termasuk penyakit yang disebabkan
1.3Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahuikemampuan bakteri kitinolitik
sebagaipengendali infeksi jamur Aspergillus sp.pada ikan nila.
1.4Hipotesis
Adanya kemampuan yang berbeda dari isolat bakteri kitinolitik dalam
pengendalian infeksi jamur Aspergillus sp. pada ikan nila.
1.5Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang isolat bakteri
kitinolitik yang memiliki kemampuan menghambat pertumbuhan jamurAspergillus sp. sehingga dapat digunakan sebagai calon agen pengendalian hayati terhadap jamur
Aspergillus sp. pada ikan nila. Dengan demikian dapat memberikan kontribusi untuk pengendalian penyakit pada budidaya ikan nila khususnya terhadap jamur patogen
BAB 2
TINJAUAN PUSTAKA
2.1 Biologi Ikan Nila
Ikan nila (Oreochromis niloticus) merupakan ikan air tawar yang termasuk ke dalam famili Cichlidae dan merupakan ikan asal Afrika (Boyd, 2004). Ikan ini merupakan
jenis ikan yang diintroduksi dari luar negeri, ikan tersebut berasal dari Afrika bagian
timur di Sungai Nil, Danau Tangayika, Chad, Nigeria dan Kenya lalu dibawa ke
Eropa, Amerika, Negara-negara Timur Tengah dan Asia. Di Indonesia benih ikan nila
secara resmi didatangkan dari Taiwan oleh Balai Penelitian Perikanan Air Tawar
tahun 1969. Jenis ini merupakan ikan konsumsi air tawar yang banyak dibudidayakan
setelah ikan mas (Cyprinus carpio) dan telah dibudidayakan di lebih dari 85 negara (Dinas Perikanan dan Kelautan Daerah, 2001).
Ikan ini merupakan spesies ikan yang berukuran besar antara 200-400 gram,
memiliki sifat omnivora sehingga bisa mengkonsumsi makanan berupa hewan dan
tumbuhan (Amri & Khairuman,2003). Nila dapat tumbuh dan berkembang dengan
baik pada lingkungan perairan dengan kadar Dissolved Oxygen (DO) antara 2,0-2,5 mg/L. Secara umum nilai pH air pada budidaya ikan nila antara 5 sampai 10 tetapi
nilai pH optimum adalah berkisar 6-9 (Popma, 1999).Ikan nila umumnya hidup di
perairan tawar, seperti sungai, danau, waduk, rawa, sawah dan saluran irigasi,
memiliki toleransi yang luas terhadap salinitas sehingga ikan nila dapat hidup dan
berkembang biak pada perairan payau dengan salinitas antara 0-25 permil. (Setyo,
2006).
Suhu optimal bagi pertumbuhan ikan nila adalah antara 22-290C (Mjoun et al, 2010). Memiliki sifat omnivora sehingga sangat menyenangi pakan alami berupa
seperti pellet, dan dedak. (Rochdianto, 2009). Kondisi lingkungan yang baik dalam
wadah budidaya ikan nila akan menjadi faktor pendukung cepat lambatnya pemijahan.
Ikan nila akan mencapai dewasa dan siap untuk pemijahan dalam 5-6 bulan dengan
berat 150-400 gram (Popma, 1999; Mjoun et al., 2010).
2.2 Interaksi Antara Imunitas Inang, Jasad Patogen dan Lingkungan
Di lingkungan alam, ikan dapat diserang berbagai macam penyakit. Demikian juga
dalam pembudidayaannya, bahkan penyakit tersebut dapat menyerang ikan dalam
jumlah besar dan dapat menyebabkan kematian ikan, sehingga kerugian yang
ditimbulkan sangat besar (Kordi & Ghufran, 2004). Perkembangan suatu penyakit
dalam akuakultur meliputi suatu interaksi yang kompleks antara tingkat virulensi
patogen, derajat imunitas inang, kondisi fisiologis dan genetik hewan, stress dan padat
tebaran (Irianto, 2004). Secara umum faktor-faktor yang terkait dengan timbulnya
penyakit merupakan interaksi dari tiga faktor yaitu inang, patogen dan lingkungan
atau stressor eksternal yaitu perubahan di lingkungan yang tidak menguntungkan,
tingkat higienik yang buruk dan stress (Austin & Austin, 2007).
Lingkungan yang tidak optimal, misalnya suhu yang tinggi dapat
menyebabkan ikan stress. Dalam kondisi demikian pertahanan tubuh ikan menjadi
lemah sehingga mudah terserang penyakit infeksi (Kordi & Ghufran, 2004).Penyakit
infeksi menjadi ancaman utama keberhasilan akuakultur (Irianto, 2004). Respon inang
terhadap infeksi adalah terganggunya fungsi tubuh.
Sumber penyakit yang dapat menyebabkan infeksi pada ikan adalah jasad
patogen yang dapat dikelompokkan menjadi dua golongan yaitu patogen asli (true pathogen) dan patogen potensial (opportunistic pathogen)(Kordi & Ghufran, 2004). Patogen asli adalah organisme patogen yang selalu menimbulkan penyakit khas
apabila ada kontak dengan ikan sedangkan patogen potensial adalah organisme
patogen yang dalam keadaan normal hidup damai dengan ikan, akan tetapi jika
kondisi lingkungan menunjang akan menjadi patogen pada ikan (Bennett, 2009).
dengan sistem pertahanan tubuh (Kaufmann & Kabelitz, 2010). Pada ikan sistem
pertahanan itu berupa lendir, sisik, dan kulit (Bruno & Wood, 1999). Menurut Irianto
(2004) sistem imun bawaan antara lain terdiri dari penghalang fisik terhadap infeksi,
pertahanan humoral dan sel-sel fagositik. Teleostei memiliki sejumlah penghalang
fisik terhadap infeksi antara lain kulit dan mukus.
Mukus memiliki kemampuan menghambat kolonisasi mikroorganisme pada
kulit, insang dan mukosa. Mukus ikan mengandung immunoglobulin alami, bukan
sebagai respon dari pemaparan terhadap antigen. Immunoglobulin (antibodi) tersebut
dapat menghancurkan patogen yang menginvasi ikan.
Sisik dan kulit merupakan pelindung fisik yang melindungi ikan dari
kemungkinan luka dan sangat penting peranannya dalam mengendalikan osmolaritas
tubuh. Kerusakan sisik atau kulit akan mempermudah patogen menginfeksi inang.
Sejumlah mikroba flora normal hewan dapat berperan dalam menghambat atau
menghalangi terjadinya infeksi melalui antagonisme. Tiga mekanisme utama
antagonisme mikroba flora normal terhadap patogen yaitu kompetesi dalam
menempati situs perlekatan atau kolonisasi, antagonisme spesifik melalui produksi
senyawa penghambat berupa protein spesifik (bakteriosin) dan antagonisme
non-spesifik dengan memproduksi berbagai metabolit atau produk akhir yang menghambat
mikroba patogen antara lain berupa asam-asam organik dan peroksidase (Irianto,
2004).
2.3 JamurAspergillus sp.
Jamur Aspergillus sp. termasuk dalam Divisi Amastigomycota, kelas Ascomycetes, ordo Eurotiales, famili Eurotiaceae dan genus Aspergillus (Bendre & Kumar, 2010). Kelas Ascomycetes kebanyakan mikroskopis, hidup saprofit atau parasit, memiliki
askus yaitu kantung yang berisi sejumlah askospora. Jumlah askospora di dalam askus
bervariasi tergantung jenisnya. Hifa bersekat, bercabang, dinding sel terdiri atas kitin,
selulosa dan senyawa lainnya. Sebagian besar Ascomycetes berkembangbiak dengan
di ujung hifa. Konidia merupakan sel tunggal kadang bersekat. Jika konidia tersusun
seperti rantai pada ujung hifa disebut dengan katenulat. Konidia yang paling ujung
adalah yang paling dewasa, semakin ke pangkal semakin muda, konidia ini bersifat
basipetal. Jika konidia yang paling ujung adalah yang paling muda disebut dengan
akropetal sedangkan reproduksi seksual terjadi dengan adanya penggabungan inti-inti
yang kompatibel dari organ seksual. Miselium berasal dari perkecambahan askospora
yang tumbuh bercabang-cabang bersekat. Pada ujung-ujung miselium terdapat sel
sporogeneus/konidiofor yang membentuk konidia yang merupakan alat vegetatif dan
dapat berkecambah membentuk miselium baru (Alexopaulus & Mims, 1979).
Salah satu genus yang paling dikenal dari kelas Ascomycetes adalah
Aspergillus, merupakan jamur yang dapat memberikan dampak positif dan negatif pada kepentingan ekonomi perindustrian, pertanian dan bidang kesehatan
(Bennett, 2009).Aspergillus merupakan jamur patogen potensial yang dapat mengakibatkan aspergillosis. Di Indonesia, Aspergillus spp. Khususnya A. flavus
merupakan jamur yang dominan mencemari pakan dan bahan penyusun pakan
(Ahmad, 2009).Beberapa penelitian menunjukkan bahwa beberapa spesies Aspergillus
termasuk A. sydowii, telah banyak diisolasi dari lingkungan akuatik seperti laut (Alker
et al., 2001) dan bersifat patogen pada organisme akuatik. Pada karang laut, infeksi yang diakibatkan oleh kapang Aspergillus dapat berasosiasi dengan mikroba lainnya (Alker et al., 2001). Apergillus merupakan genus jamur patogen pada ikan (Olufemi & Robert., 1986). Olufemi dan Okaeme (1997) melaporkan bahwa keberadaan
Aspergillus sp. pada ikan nila (Oreochromis sp.) dapat menimbulkan infeksi yang mengakibatkan mikosis pada ikan. Infeksi Aspergillus pada ikan ditandai dengan adanya bercak putih abu-abu pada tubuh dengan pengamatan pada kulit dan insang
(Shrivastava, 1996).
Pada beberapa penelitian yang dilakukan terhadap infeksi Aspergillus pada beberapa jenis ikan, A. terreus merupakan jamur yang memiliki kemampuan yang tinggi penyebab mortalitas pada ikan(Battacharya et al., 1988). Seperti yang dilaporkan Shrivastava (1996), A. terreus mampu menginfeksi Channa punctatus,
Gambar 1.Aspergillus terreus colonies on the skin of Channa punctatus (Shrivastava AK, 1996).
2.4 Mikroorganisme Penghasil Kitinase
Mikroorganisme pendegradasi kitin dalam memperoleh nutrisi sebagai sumber karbon
dan nitrogen menggunakan enzim kitinase untuk memecah senyawa kitin. Organisme
yang dapat mendegradasi kitin tersebar luas di alam, termasuk organisme yang tidak
memiliki kitin seperti sebagian bakteri, virus, tumbuhan tingkat tinggi dan hewan
yang memiliki peran penting dalam fisiologi dan ekologi (Dewi, 2011). Organisme
yang mengandung kitin umumnya berasal dari kelompok mikroorganisme diantaranya
adalah dari kelompok jamur dan Aktinomycetes (Brzezinska et al.,2009).
Kitinase merupakan enzim yang mampu menghidrolisis polimer kitin menjadi
monomer N-asetilglukosamin atau kitin oligosakarida. Degradasi kitin oleh prokariot dan eukariot terjadi dalam dua tahap yang prosesnya melibatkan hidrolisis ikatan β-1,4 glikosida yang menghubungkan sub unit GlcNAc. Pertama endokitinase mengikat
tetramer dan polimer GlcNAc untuk menghasilkan disakarida kitobiose. Kitobiose
menghidrolisis kitobiose menjadi monomer N-asetilglukosamin pada tahap
kedua.Enzim pendegradasi kitin umumnya oleh beberapa organisme diinduksi oleh
kitosan, kitobiose dan glukosamin(Connel et al., 1998).
Aktifitas kitinase yang dihasilkan bakteri dan fungi sangat bervariasi, baik
2009).Bakteri yang sudah banyak dilaporkan mampu menghasilkan enzim kitinase
antara lain adalah Paenibacillus sp., Streptomyces sp.,(Singh, 1999),
Haloanaerobacter chitinovorans gen. Nov.,sp.(Liaw, 1992), Alteromonas, Ewingella, Pseudoalteromonas, Pseudomonas, Serratia, Vibrio (Chernin et al.,1998),Chitinimonas koreensis sp.(Kim-Yong et al., 2006) dan Bacillus thuringensis (Ramirez et al, 2004),. Selain itu bakteri yang berada diperairan atau lingkungan aquatik juga telah banyak dilaporkan memiliki kemampuan kitinolitik,
pada air tawar seperti danau antara lain Aeromonas sp., Chromobacterium
sp.,Ahydrophila dan Enterobacter aerogenes (Brzezinska & Donderski, 2006) serta
Chitinilyticum aquatile gen. nov., sp.(Chang et al., 2007).
Aktivitas kitinase dari bakteri kitinolitik sangat potensial digunakan sebagai
agen pengendalian hayati terhadap jamur patogen maupun serangan hama, karena
kedua organisme ini mempunyai komponen kitin pada dinding selnya (Widjajanti &
Muharni, 2011). Bakteri yang menghasilkan enzim kitin ini adalah kandidat agen
biokontrol karena mampu mengkolonisasi lingkungan sekitarnya dengan cepat.
Dengan sifat tersebut, bakteri penghasil kitinase berpotensi sebagai agen pengendali
hayati hama dan penyakit akibat jamur patogen (Suryanto et al., 2006). Sehingga bakteri kitinolitik sangat berpotensi sebagai agen pengendali hayati (biokontrol) untuk
menghambat infeksi jamurAspergillus sp. dan Oomycetes pada ikan walaupun kitin pada dinding sel Oomycetes merupakan komponen minor dan tidak lebih dari 4% dari
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Januari 2012sampai dengan Mei 2012,
bertempat di Laboratorium Mikrobiologi Karantina Ikan Kelas I Polonia, Medan
danLaboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Universitas Sumatera Utara. Pengambilan sampel jamur dari telur
ikan mas koi (Cyprinus carpio) dan ikan nila (Oreochromisniloticus)dilakukan di bak pembenihan dan kolam budidaya ikan nila yang berlokasi di Unit Pelaksana Teknis
Daerah(UPTD) Budidaya Kecamatan Medan Tuntungan, Propinsi Sumatera Utara.
Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah cawan petri, botol kaca steril, tabung
reaksi, gelas Beaker, labu Erlenmeyer, gelas ukur, spatula, jarum ose, bunsen, mikro
pipet, kertas saring, corong, cork borer No 2, hot plate, vorteks, pinset, stirer, jangka sorong, pipet serelogi, oven, inkubator, autoclaf, timbangan analitik, mikroskop
cahaya, spektrofotometer, kotak plastik, aerator akuarium, akuarium.
Bahan–bahan yang digunakan pada penelitian ini adalah sampel telur ikan lele
(Clarias batatas), telur ikan koi (Cyprinus sp.) dan ikan nila (Oreochromis sp.) yang terinfeksi jamur, ikan nila yang sehat, akuades steril, Subaround Dextrose Agar
larutan garam,blank disc (Oxoid), ketokenazol, alkohol 70%, aquadest, desinfektan, plastik, karet, kertas pembungkus, sarung tangan, Komposisi MGMK dapat dilihat
pada Lampiran 1.
3.3 Isolasi dan Identifikasi Jamur
Sampel telur ikan koi dan ikan nila yang terinfeksi jamurdiambil dan disimpan pada
plastik steril yang berbeda secara aseptis. Telur dan ikan terinfeksi diletakkan pada
cawan Petri steril dan kemudian ditanam pada media PDA.Untuk mendapatkan isolat
murni jamurditanam pada media SDA (Bruno & Wood, 1999) yang telah diberi
antibiotika kloramfenikol. Kultur diinkubasi pada suhu 28-30oC selama 48 jam.Hifa
jamurdiambil kemudian diamati morfologinya. Identifikasi jamur
dilakukanberdasarkan ciri-ciri dan karakter morfologis, secara makroskopis (visual)
maupun mikroskopis (di bawah mikroskop) (Permana & Kusmiati, 2007).
Karakterisasi dan identifikasi secara visual berdasarkan struktur dan warna koloni.
Identifikasi secara mikroskopis dilakukan dengan mengamati morfologi jamur di
bawah mikroskop dengan menggunakan metode slide culture menggunakan buku identifikasi dari Webster &Weber (2007), Alexopaulus & Mims (1979), Ganjar et al. (1999), Wolf & Wolf (1947) dan Thom & Raper, (1945)..
3.4 Isolat Bakteri Penghasil Enzim Kitinase
Isolat bakteri yang digunakan adalah bakteri kitinolitik koleksi Laboratorium
Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan
Alam, Universitas Sumatera Utara yaituBacillus sp. BK13, Enterobacter sp. BK15,
Bacillus sp. BK17, PB08, PB15 danEnterobacter sp. PB17. Isolat bakteri kitinolitik yang telah diperoleh ditumbuhkan untuk peremajaan pada agar MGMK (Suryanto,
2006). Isolat bakteri kitinolitik telah diseleksi dengan kemampuan mendegradasi
media agar kitin yang dapat dilihat dengan adanya zona bening di sekitar koloni
3.5 Uji Antagonis Isolat Bakteri Kitinolitik Terhadap Jamur Secara In Vitro
Kemampuan bakteri kitinolitik menghambat pertumbuhan jamur diuji dengan uji
antagonisme in vitro. Tepi bagian yang aktif tumbuh biakan jamur diambil dengan menggunakan cork borer, diinokulasikan pada agar MGMK yang telah ditambahkan 2% yeast ekstrak dengan jarak 3,5 cm dari kertas cakram tempat inokulan
bakteri.Selanjutnya suspensi bakteri kitinolitik yang telah dibuat dengan konsentrasi ≈
108 sel/ml (standart McFarland) diinokulasikan 100µ l pada cakram dengan diameter
0,6 cm di bagian tepi media kitin sebanyak 108sel/ml, dibuat 2 kali pengulangan.
Biakan diinkubasi pada suhu 28-30oC.Akitivitas penghambatan ditentukan
berdasarkan zona hambat yang terbentuk di sekitar koloni. Diameter zona hambat
dihitung dengan mengukur selisih radial pertumbuhan miselium jamur yang
terhambat oleh isolat bakteri. Pengamatan dimulai dari hari ke-4 sampai hari ke-7
(Suryanto et al., 2001). Alur kerja uji antagonisme in vitro dapat dilihat pada Lampiran 3.
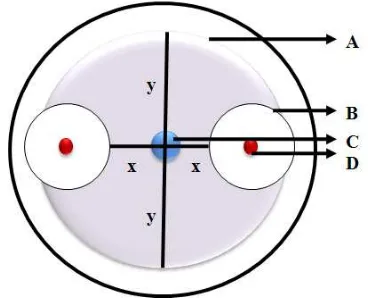
Gambar 3.5.1. Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni
jamur; A. Koloni jamur; B. Zona hambat bakteri kitinolitik terhadap
koloni jamur; C. Titik tengah jamur diletakkan; D. Koloni bakteri
kitinolitik; x. Diameter koloni jamur yang terhambat pertumbuhannya;
y. Diameter koloni jamur normal.
Pengukuran jari-jari zona hambat bakteri dilakukan dengan menggunakan jangka sorong. Jari-jari zona hambat
2 X Y k kitinoliti
Ket: Y= Diameter jamur yang tidak terhambat X= Dimeter jamur yang terhambat.
3.6 Pengamatan Struktur Hifa Jamur Setelah Asai Antagonisme
Pengamatan dilakukan dengan 2 cara yaitu secara visual dan mikroskopis.
Pengamatan secara visual dilakukan dengan cara melihat zona/luas pertumbuhan
miselium jamur. Pengamatan secara mikroskopis dilakukan dengan cara mengamati
ujung miselium pada daerah/zona hambat jamur. Ujung miselium jamuryang tumbuh
pada permukaan media agar MGMK dipotong berbentuk block square, kemudian diletakkan pada objek gelas, selanjutnya diamati adanya abnormalitas pertumbuhan
hifa jamur berupa pembengkokan ujung hifa, hifa terputus, lisis dinding sel hifa, hifa
terputus disertai lisis (Lorito et al.,1992). Pengamatan abnormalitas miselium diperoleh dari perubahan struktur hifa.
3.7 Uji Patogenitas Jamur Terhadap Ikan Nila
Isolat jamur diuji patogenitasnya terhadap sampel uji yaitu ikan nila sehat ukuran
3-5cm yang diperoleh dari pembenihan ikan nila Jl. Bunga Kartiol Kelurahan Baru
Ladang, Kecamatan Medan Tuntungan untuk mengetahui patogenitasnya terhadap
ikan nila. Isolat jamuryang digunakan dilakukan preparasi suspensi jamur. Ikan nila
sehat sebanyak 10ekor ditempatkan pada aquarium kaca percobaan yang telah
dipersiapkan sebelumnyadengan volume 10L air ledeng yang telah didiamkan selama
3 hari. Preparasi suspensi jamur dilakukan dengan menumbuhkan pada media GYB
dan diinkubasi pada suhu 28-30oC selama 2 hari untuk produksi konidia. Aplikasi
perlakuan dengan pemberian suspensi konidia jamur patogen sebanyak107spora/ml
(Zaki et al., 2010) ke dalam wadah aquarium kaca selama masa pengamatan 10 hari. Alur kerja preparasi spora/konidia jamur tersaji pada Lampiran 4. Kontrol tidak
diberikan isolat suspensi jamur. Pengamatan yang dilakukan adalah tingkat kematian
dan kemampuan tetap hidup(Atta, 2008). Reisolasi dilakukan terhadap jamur dengan
memotong bagian morfologi luar ikan yang menunjukkan gejala infeksi jamur. Bagian
tubuh yang diambil, dicuci dengan air steril sebanyak 3 kali dan ditanam pada media
disubkultur ke media SDA untuk dimurnikan, kemudian diamati di bawah mikroskop.
Alur kerja uji patogenitas dapat di lihat pada Lampiran 5.
3.8 Penghambatan Serangan Jamur pada Ikan Uji secara In Vivo
Ikan uji yang dipergunakan adalah ikan nilayang berasal dari pembenihan tradisional
di Tuntungan dengan ukuran 3-5cm, wadah yang digunakan adalah aquarium kaca
dengan ukuran 20X30X50 cm3. Tiap aquarium kaca diisi ikan sebanyak 10 ekor.
Isolat bakteri kitinolitik ditumbuhkan pada media agar MGMK pada suhu
28-300C selama 48 jam. Sebanyak 1 ml kultur bakteri kitinolitik yang setara dengan 108
sel/ml ditambahkan kedalam 10L air di aquarium kaca.Kelompok perlakuan yaitu
terdiri atas pemberian kandidat bakteri kitinolitik dengan dosis pemberian bakteri
yaitu 108 sel/ml. Suspensi bakteri yang telah dimasukkan ke dalam aquarium kaca
dibiarkan selama 48 jam, dan setelah 48 jam dilakukan uji tantang dengan pemberian
isolat suspensi jamur.Kelompok kontrol negatif yaitu ikan uji yang tidak diberikan
bakteri kitinolitik dan tidak diinfeksi jamur dan kontrol positif yaitu ikan uji dengan
pemberian suspensi bakteri. Setiap perlakuan dan kontrol dibuat 5 ulangan.
Infeksi ikan uji dapat dilakukan dengan menggunakan suspensi jamur. Koloni
jamur umur 2 hari dipotong dengan menggunakan cork borer No.2 (dengan diameter 5,5 mm) dan ditempatkan di cawan petri yang terdapat 20 mlGYA kemudian
diinkubasi pada suhu 28-30oC selama 24-48 jam. Miselium yang dipotong dibilas
dengan akuadest steril selama 3 kali kemudian dipindahkan ke dalam medium GYB
dan diinkubasi pada suhu 28-30oC selama 48 jam untuk produksi konidia. Konidia
diamati di bawah mikroskop kemudian jumlah konidia dihitung dengan menggunakan
haemocytometer.
Tahap evaluasi dilakukan untuk melihat pengaruh bakteri kitinolitik terhadap
infeksi jamur pada ikan uji. Parameter yang akan diamati adalah jumlah ikan yang
3.9Pengamatan Perlekatan Bakteri pada Ikan Nila
Sampel untuk pengamatan perlekatan bakteri pada ikan nila secara mikroskopis
diambil dari beberapa bagian ikan seperti sisik dan insang. Masing-masing bagian
tersebut dimsukkan ke dalam tabung reaksi, kemudian difiksasi dengan menggunakan
glutaraldehid 2,5%dan 1M potassium buffer posfat, difiksasi 1 malam pada suhu 4oC.
Hasil fiksasi dibilas dengan buffer fosfat 5 ml pada suhu ruang selama 15 menit
sebanyak 3 kali. Preparat didehidrasi dengan 5 ml etanol dengan konsentrasi 35, 50,
70 dan 95% selama 10 menit untuk masing-masing konsentrasi, selanjutnya
didehidrasi dengan 5 ml etanol absolut 96% selama 15 menit sebanyak 3 kali. Sampel
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi dan Karakterisasi Jamur
Hasil isolasi empat jenis jamur sejati diperoleh dari ikan nila dan telur ikan mas koi
yang terserang jamur. Ikan nila dan telur ikan mas koi yang terinfeksi jamur ditandai
dengan adanya bentukan hifa berwarna putih, abu-abu, kuning dan lesi/luka pada
bagian tubuh (Gambar 4.1.1). Serangan jamur yang dapat memberikan pengaruh
negatif terhadap kondisi ikan dianggap bersifat opurtunis, menyerang ikan ketika ikan
mengalami stess atau sistem imun yang menurun karena kondisi lingkungan yang
kurang menguntungkan atau efek sekunder dari infeksi bakteri atau virus atau ketika
ikan tersebut kehilangan perlindungan lendir karena penanganan yang kurang baik
(Quiniou et al.,1998).
Gambar 4.1.1 (A) Telur ikan mas koki dan (B) Ikan nila yang terserang jamur
Dari Gambar 4.1.1 hasil isolasi dan identifikasi diperoleh empat jenis jamur
sejati yaitu Rhizopus sp., sp.1, Aspergillus sp.1 dan Aspergillus sp.2. Jamur Rhizopus
sp. berasal dari telur ikan mas koi sedangkan jamur Sp.1, Aspergillus sp1. dan
Aspergillus sp2. berasal dari ikan nila.Kordi & Ghufran (2004) mengatakan bahwa penyakit yang disebabkan oleh jamur (mikosis) yang bersifat patogenik pada ikan
salah satunya adalah Aspergillus yang termasuk ke dalam ordo Moniliales.
A.fumigatus dan A. flavus merupakan penyebab utama dan kedua infeksi invatif dan non-invatif aspergillosis pada manusia dan hewan (Rai & Koviks, 2010). Hasil isolat
yang ditanam pada media SDA dapat dilihat pada Tabel 4.1.1.
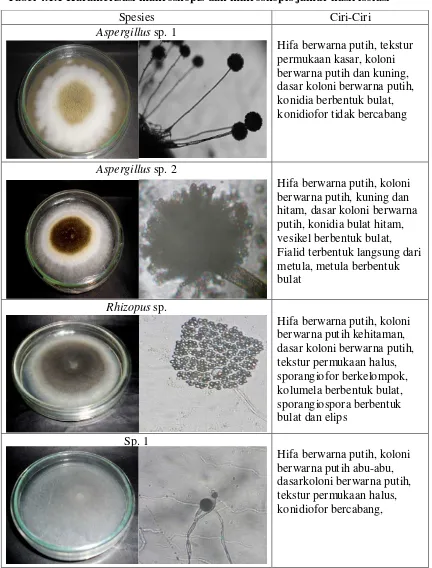
Tabel 4.1.1 Karakterisasi makroskopis dan mikroskopis jamur hasil isolasi
Isolat Rhizopus sp. ditanam pada media SDA memiliki hifa berwarna putih, koloni berwarna putih kehitaman, dasar koloni berwarna putih, tekstur permukaan halus.
Jamur Sp. 1 memiliki hifa berwarna putih, koloni berwarna putih abu-abu, dasar
koloni berwarna putih, tekstur permukaan halus. Aspergillus sp. 1. memiliki hifa berwarna putih, koloni berwarna putih kekunigan dan dasar koloni berwarna putih,
tekstur permukaan kasar, sedangkan pada Aspergillus sp. 2 memiliki hifa berwarna putih, koloni berwarna putih-kuning kehitaman, dasar koloni berwarna putih dan
tekstur permukaan kasar, konidia berwarna hitam.
Hasil pengamatan mikroskopis dengan menggunakan metode slide culture
menunjukkan bahwa Aspergillus yang diperoleh memiliki hifa yang bersekat, bercabang, pada bagian ujung konidiofor terdapat konidium non-motil. Konidia yang
paling ujung merupakan yang paling dewasa, semakin ke pangkal semakin muda.
Rhizopus terlihat memiliki hifa senositik, sporangiofor tidak bercabang, pada ujung sporangiofor terdapat sporangium yang berbentuk seperti bulatan bola pada kolumela.
Menurut Permana & Kusmiati (2007), ciri jamur Aspergillus memiliki hifa bersepta, miselia bercabang (terdapat di bawah permukaan merupakan hifa vegetatif,
sedangkan hifa yang muncul di atas permukaan umumnya hifa fertil), koloni kompak
konidiofor septat atau non-septat, sterigma atau fialid biasanya sederhana berwarna
atau tidak berwarna, konidia berwarna hijau coklat atau hitam dan beberapa spesies
tumbuh pada suhu 370C atau lebih. Karakterisasi Aspergillus tidak dapat terlepas dari bentukan konidia jamur pada umumnya (Wolf & Wolf, 1947).Dalam menentukan
deskripsi spesies pada Aspergillus, warna kepala konidia sering dibuat dasar utama dalam desikripsi spesies. Dinding konidia mungkin halus tetapi memberi bahan
pewarna yang cukup pada penyebarannya untuk memberikan warna koloni yang khas.
Penampakan koloni dari Aspergillus sangat bervariasi dan sangat dipengaruhi oleh usia, tingkat pertumbuhan, suhu inkubasi dan komposisi dari substrat (Thom & Raper,
1945).
Menurut Alexopaulus & Mims (1979), miseliumpada Rhizopus, telah berkembang dengan baik, hifa senositik tak bersepta, septa hanya terbentuk pada
membentuk rhizoid berperan seperti akar pada tumbuhan tinggi, hifa juga dapat
membentuk stolon yang menghubungkan rhizoid satu dengan rhizoid lainnya. Berbiak
secara aseksual dengan sporangiospora atau dengan fragmentasi hifa. Sporangiospora
dihasilkan oleh sporangium. Bentuk, warna dan ukuran serta ornamnetasi pada
dinding sporangiospora berbeda-beda untuk tiap spesies. Sporangium terbentuk pada
ujung sporangiofor yang mengalami pembengkakan.
4.2 Hasil Pengujian Bakteri Kitinolitik Penghasil Enzim Kitinase
Pada penelitian ini bakteri yang di uji di tanam pada media agar MGMK yang
komposisinya adalah garam mineral dan koloidal kitin. Isolat bakteri kitinolitik yang
digunakan adalah Bacillus sp. BK13, Enterobacter sp. BK15,Bacillus sp. BK17, PB08, PB15 dan Enterobacter sp. PB17. Dari hasil pengamatan yang dilakukan diperoleh bahwa keenam isolat bakteri yang diujikan memiliki kemampuan
menghasilkan enzim kitinase yang ditandai dengan adanya zona bening disekitar
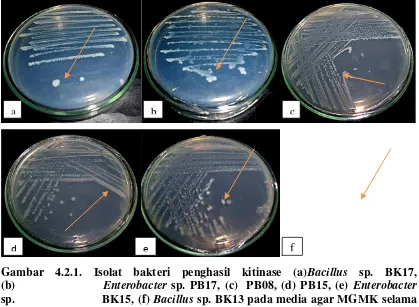
koloni (Gambar 4.2.1).
Gambar 4.2.1. Isolat bakteri penghasil kitinase (a)Bacillus sp. BK17, (b) Enterobacter sp. PB17, (c) PB08, (d) PB15, (e) Enterobacter sp. BK15, (f) Bacillus sp. BK13 pada media agar MGMK selama 4 hari. Tanda panah menunjukkan zona bening kitinase
a b c
Bakteri kitinolitik merupakan salah satu agen pengendali hayati jamur patogen
pada tanaman (Suryanto et al., 2005), pengendalian infeksi Saprolegnia pada telur ikan gurami (Dewi, 2011). Mikroba kitinolitik dapat ditapis dengan menggunakan
medium yang mengandung kitin. Koloidal kitin merupakan salah satu substrat yang
dapat digunakan untuk menginduksi protein enzim hidrolitik (Suryanto & Munir,
2006).Herdyastuti et al. (2009) melaporkan juga bahwa metode konvensional yang menggunakan koloidal kitin sebagai sumber substrat ditemukan sangat efektif untuk
menentukan aktivitas kitinase. Menurut Woo et al. (1996), banyak spesies bakteri yang mampu menguraikan kitin dan memanfaatkannya sebagai sumber karbon dan
nitrogen. Bacillus sp. BK13, Bacillus sp. BK17, Enterobacter sp. BK15, Enterobacter
sp PB17, PB08 dan PB15 merupakan bakteri kitinolitik yang mampu mensekresikan
enzim kitinase dan menggunakan koloidal kitin sebagai substrat yang dimanfaatkan
sebagai sumber karbon dan nitrogen. Dahiya et al. (2005) mengatakan bahwa
Enterobacter sp.NRG4 mampu menghasilkan kitinase pada media kultur kitin sehingga memungkinkan produksi kitobiose dan N-asetil D-glukosamin.
Adanya aktivitas kitinase ditandai dengan terbentuknya zona bening di sekitar
koloni bakteri pada medium agar kitin (Muharni, 2010). Mekanisme tersebut terjadi
karena adanya pemutusan ikatan pada senyawa kitin oleh kitinase yang merupakan
enzim yang bersifat induktif. Menurut Muharni (2010), zona bening terbentuk karena terjadinya pemutusan ikatan β-1,4 homopolimer N-asetilglukosamin pada kitin oleh kitinase menjadi monomer N-asetilglukosamin. Purwani et al. (2002), mengatakan bahwa degradasi kitin secara enzimatis oleh kitinase berlangsung secara bertahap.
Polimer kitin dipecah menjadi oligomer kitin dan selanjutnya akan diuraikan menjadi
monomer N-asetilglukosamin oleh β-N-asetilglukosaminide.
Wijaya (2002) juga menyatakan bahwa besarnya zona bening yang dihasilkan
tergantung pada jumlah monomer N-Asetilglukosamin yang dihasilkan dari proses hidrolisis kitin dengan memutus ikatan β-1,4 homopolimer N-asetilglukosamin. Semakin besar jumlah monomer N-asetilglukosamin yang dihasilkan semakin besar
zona bening yang terbentuk di sekitar koloni. Kitin sebagai substrat juga akan
4.3 Hasil Uji Antagonis Isolat Bakteri kitinolitik Terhadap Jamur Secara In vitro
Hasil uji antagonisme enam isolat bakteri kitinolitik terhadap jamur Rhizopus sp., Sp. 1, Aspergillus sp. 1, Aspergillus sp. 2 menunjukkan bahwa keenam isolat bakteri kitinolitik mampu menghambat pertumbuhan Rhizopus sp., Sp. 1, Aspergillus sp. 1.,
Aspergillus sp. 2 dengan kemampuan yang berbeda-beda. Mekanisme penghambatan yang terjadi pada uji antagonisme dapat diamati dengan terbentuknya zona bening
sebagai zona penghambatan pertumbuhan jamur oleh isolat bakteri kitinolitik.
Hasil uji antagonis dari isolat bakteri kitinolitik yang digunakan terhadap
jamur menunjukkan bahwa isolat bakteri tersebut mampu menghambat pertumbuhan
jamur sejati hasil isolasi yang ditandai dengan terbentuknya zona hambat. Zona
hambat umumnya mulai teramati pada hari keempat karena interaksi antara bakteri
dan jamur mulai terjadi. Zona hambat yang terbentuk terjadi ditandai dengan adanya
zona bening di sekitar koloni bakteri yang merupakan cerukan penipisan elevasi
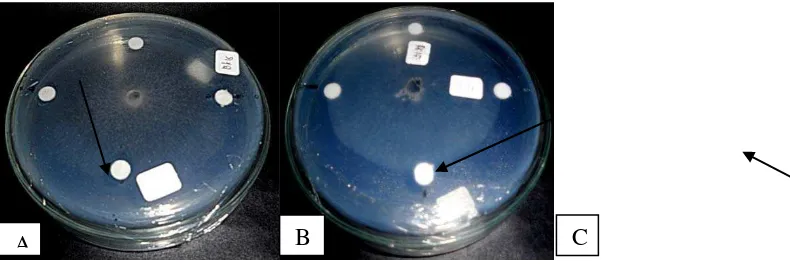
seperti terlihat pada Gambar 4.3.1
Gambar 4.3.1 Uji antagonisme bakteri kitinolitik (A) terhadap Rhizopus sp, (B) terhadap Sp. 1 dan (C) terhadap Aspergillus sp. pada media agar MGMK umur 4 hari
Adanya penghambatan masing-masing isolat bakteri kitinolitik terhadap jamur
dipengaruhi oleh adanya substrat kitin pada media sehingga kitinase pada keenam
isolat bakteri tersebut lebih cepat disekresikan. Kitin pada media uji terurai oleh
produksi kitinase isolat bakteri dan lama kelamaan akan terpacu untuk mendegradasi
dinding sel jamur. Isolat bakteri akan menggunakan kitin sebagai sumber karbon
untuk pertumbuhannya(Woo et al., 1996). Kemampuan mengkolonisasi lingkungan
sekitar yang cepat menyebabkan isolat bakteri tersebut mengkolonisasi miselium
jamur untuk menguraikan kitin yang ada pada dinding sel jamur. Penguraian kitin
pada dinding sel jamur dapat menghambat pertumbuhan jamur Rhizopus sp., Sp. 1,
Aspergillus sp. 1 dan Aspergillus sp. 2 yang mengalami kerusakan dinding sel. Perbedaan kemampuan bakteri kitinolitik dalam menghambat pertumbuhan
jamurRhizopus sp., Sp. 1, Aspergillus sp. 1 dan Aspergillus sp. 2 disajikan seperti pada Tabel 4.3.1.
Tabel 4.3.1 Uji Antagonisme In vitro Enam Isolat Bakteri Kitinolitik Terhadap Jamur Sejati
Pada pengamatan hari ketujuh dari enam isolat bakteri kitinolitik tersebut
Enterobacter sp. PB17 merupakan isolat bakteri yang menunjukkan daya hambat yang paling tinggi dalam menghambat pertumbuhan jamur dengan diameter daya hambat
PB15 dan PB08. Keenam Isolat bakteri kitinolitik yang digunakan memiliki
kemampuan daya hambat tertinggi yang berbeda-beda dalam menghambat
pertumbuhan jamur selama masa pengamatan tujuh hari (Gambar 4.3.2). Selain
kandungan kitin pada media uji yang digunakan, hal yang juga ikut mempengaruhi
besarnya zona hambat adalah banyak sedikitnya kandungan kitin yang terdapat pada
dinding sel jamur (Gohel et al., 2006).
Gambar 4.3.2. Diameter zona hambat tertinggi dari masing-masing isolat bakteri Bacillus sp. BK13,Enterobacter sp. BK15, Bacillus sp. BK17, PB08, PB15 dan Enterobacter sp. PB17 selama masa pengamatan 7 hari
Enterobacter sp. PB17 merupakan isolat bakteri yang memiliki tingkat daya hambat tertinggi dengan diameter daya hambat sebesar 15,50 mm, kemudian diikuti
oleh PB15 dengan diameter daya hambat 13,17 mm, Bacillus sp.BK17 dengan diameter daya hambat 13,13 mm, Bacillus sp. BK13 dengan diameter daya hambat 12,51 mm, PB08 dengan diameter 12,14 mm serta Enterobacter sp. BK15 dengan diameter daya hambat adalah 11,47 mm, ini bisa disebabkan karena perbedaan
kemampuan dalam mengeluarkan enzim kitinase dan glukanase juga banyak
sedikitnya kandungan kitin pada dinding sel jamur serta substrat yang digunakan.
Pengendalian jamur patogen secara hayati dengan menggunakan
musuh-musuh alami patogen telah banyak dikembangkan. Sebagian potensi pengendalian
yang dikembangkan mengarah pada penentuan mekanisme antagonisme antara
agensia pengendali hayati dengan patogen target (Indratmi, 2008). Menurut
El-katatnya et al. (2000) suatu kelompok organisme yang memiliki potensi sebagai agen pengendali hayati jamur berasal dari kelompok mikroorganisme penghasil kitinase.
Pengendalian hayati jamur dengan menggunakan mikroorganisme kitinolitik
didasarkan pada kemampuannya menghasilkan kitinase dan β-1,3-glukanase yang
dapat melisiskan sel jamur. Woo et al (1996) melaporkan bahwa Bacillus sp.WY22 memproduksi sejumlah besar kitinase ekstraselluler dan menunjukkan aktivitas yang
tinggi terhadap beberapa jamur. Velusamy & Kim (2011) juga melaporkan bahwa
Enterobacter sp. KB3 dapat mensekresikan enzim kitinase yang digunakan untuk menekan jamur patogen Rhizoctonia solani yang menunjukkan adanya penghambatan pertumbuhan hifa pada uji dual plate assay. Hidrolisis hifa jamur oleh kitinase akan menghasilkan pelepasan GlcNAc dengan kemampuan tersebut, Enterobacter sp telah dianggap sebagai agen kontrol biologis yang ideal dan telah banyak dievaluasi untuk
produksi kitinase (Chernin, 1995).
4.4 Pengamatan Struktur Hifa Abnormal JamurRhizopus sp, Sp. 1, Aspergillus sp. 1 dan Aspergillus sp. 2 setelah Uji Antagonisme
Pengamatan mikroskopis untuk melihat hifa abnormal jamur dilakukan pada hari
ketujuh. Dari uji antagonis yang dilakukan dengan menggunakan Rhizopus sp, Sp. 1,
Aspergillus sp.1 dan Aspergillus sp.2 yang diisolasi dari ikan nila sakit yang diduga terserang jamur dengan keenam bakteri kitinolitik. Mekanisme antagonis yang terjadi
antara bakteri kitinolitik dengan jamur memiliki penghambatan yang bervariasi,
memiliki aktivitas antagonis yang ditandai dengan penghambatan pertumbuhan
miselium. Efek aktivitas antagonis bakteri kitinolitik menyebabkan hifa jamur
mengalami abnormalitas yaitu berupa hifa terputus, hifa mengalami pembengkokan,
hifa menggulung, lisis pada dinding sel dan lisis pada ujung hifa (Gambar 4.4.1).
Dinding sel jamur merupakan struktur kompleks yang biasanya terdiri dari
kitin, 1,3-β d an 1 ,6-β glukan dan komponen lainnya. Hidrolisis dinding sel jamur
2006). Aspergillus merupakan salah satu genus jamur yang memiliki komponen dinding sel kitin yang tinggi dan mampu menginduksi kitin (Escott et al., 1998).
Gambar 4.4.1. Perubahan morfologi hifa jamur setelah uji antagonisme dengan bakteri kitinolitik. Hifa bengkok (A ; B), hifa terputus (C), hifa bengkok berlipat (D ; E), hifa menggulung (F), hifa terputus disertai lisis (G), lisis pada ujung hifa (H), lisis pada dinding sel hifa (I), Hifa normal Aspergillus sp.,Rhizopus sp. dan Sp. 1(J,K,L)(perbesaran 400X)
Menurut Rajarathanam et al, (1998), kitin pada jamur berbentuk mikrofibril yang memiliki panjang yang berbeda tergantung pada spesies dan lokasi selnya.
Mikrofibril merupakan struktur utama dari dinding sel jamur dan terdiri atas jalinan
rantai-rantai polisakarida yang saling bersilangan membentuk anyaman. Jalinan ini
kuat berikatan pada matriks. Kandungan kitin pada jamur bervariasi dari 4-9% berat
kering sel, tergantung spesies atau strain jamurnya. Parani & Saha (2009) melaporkan
A B C
D E F
G H I
bahwa beberapa jamur patogen Alternaria alternate, Aspergillus niger, Fusarium oxysporum, Helminthosporium sp. dan Culvularia sp. dapat dihambat oleh Serratia marcescens yang ditanam pada media CA dan PDA. Serratia marcescens mampu menghambat pertumbuhan miselia Aspergillus niger hingga mencapai 66,5% dan
Fusarium oxysporum 64,4% pada medium agar kitin. Serratia marcescens merupakan salah satu bakteri yang paling efektif dalam mendegradasi kitin dan dapat
diaplikasikan sebagai agen biokontrol jamur dan serangga (Brurberg et al., 2000).
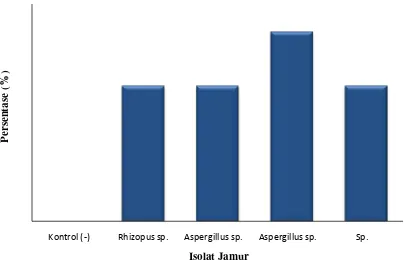
4.5 Hasil Patogenitas Jamur
Uji Patogenitas jamur dilakukan untuk mengetahui kemampuan isolat tersebut
menyebabkan penyakit mikosis pada ikan nila. Dari hasil uji patogenitas diperoleh
bahwa isolat yang memiliki tingkat patogenitas paling tinggi adalah Aspergillus sp. 2 yang diinokulasikan pada ikan nila kelompok perlakuan dengan persentase tingkat
infeksi sebesar 70%. Aspergillus sp. 1,Sp1dan Rhizopus sp. memiliki persentase tingkat infeksi yang sama sebesar 50%. Perbedaan tingkat patogenitas yang dimiliki
jamur Rhizopus sp., Sp. 1, Aspergillus sp. 1 dengan Aspergillus sp. 2 menunjukkan bahwa tingkat kekuatan menginfeksi ikan uji berbeda. Rerata persentase tingkat
infeksi dan tingkat kematian pada kelompok perlakuan, Aspergillus sp. 2 menunjukkan perbedaan dengan kelompok kontrol dengan nilai total terinfeksi dan
mati mencapai 70%. Hal ini menunjukkan bahwa isolat Aspergillus sp.2 yang diisolasi dari ikan nila bersifat patogen pada ikan nila (Gambar 4.5.1).
Gambar 4.5.1. Persentase tingkat patogenitas (tingkat terinfeksi dan mortalitas) isolat jamur Rhizopus sp., Sp. 1, Aspergillus sp.1 dengan Aspergillussp.2 terhadap ikan nila selama pengamatan 10 hari
Rifai et al. (2010) telah melaporkan bahwa dari hasil isolasi jamur yang dilakukan pada 240 ekor ikan Oreocrhomis dan 120 ekor Clarias gariepinus didapat 1658 isolat jamur. Aspergillus merupakan genus terbanyak yang diperoleh dengan tingkat persentase 43,0% sedangkan Rhizopus hanya 4,2%. Dari hasil uji patogenitas yang dilakukan genus Aspergillus yang paling patogen adalah A. flavus, kemudian diikuti oleh A. niger,A. fumigatus dan A. terreus.
Pada penelitian ini gejala klinis yang tampak terdapat pada ikan yang terserang
oleh jamur adalah adanya penempelan hifa pada bagian tubuh ikan yang berwarna
putih, abu-abu dan kekuningan (Gambar 4.5.2). Battacharya et al (1988) mengatakan infeksi A. terreus pada ikan ditandai dengan adanya warna putih abu-abu pada seluruh permukaan tubuh. Serangan infeksi yang diakibatkan oleh jamur pada awalnya akan
menginfeksi bagian epidermis dari tubuh ikan. Shrivastava (1996) melaporkan bahwa
gejala klinis yang disebabkan oleh infeksi A. terreus menunjukkan adanya lesi kulit putih abu-abu pada insang dan kulit. Pertumbuhan jamur dari kulit dan insang diamati
secara mikroskopis dengan menggunakan cotton blue dan kemudian ditanam pada
Sabouraunds agar medium (Battacharya et al., 1988). Hal yang sama juga dilaporkan
Kontrol (-) Rhizopus sp. Aspergillus sp. Aspergillus sp. Sp.
oleh Bruno & Wood (1999) menyebutkan bahwa gejala klinis infeksi awal adalah lesi
kulit berwarna putih atau abu-abu yang kemudian dapat berkembang cepat
menyebabkan kerusakan pada kulit dan otot sehingga ikan akan lemah dan kehilangan
keseimbangan.
Gambar 4.5.2 Ikan terinfeksi Jamur Aspergillus sp.2 pada uji patogenitas. (A) Penempelan miselium pada bagian tubuh ikan (B) Lesi pada bagian sisik ikan
Secara umum Aspergillus sulit menghasilkan tingkat infeksi dan mortalitas yang tinggi karena dipengaruhi beberapa faktor seperti suhu, pH dan aerasi.
Aspergillomycosis dapat terjadi pada ikan karena pengaruh faktor lingkungan, inang
dan patogen. Olufemi & Roberts (1986) melaporkan bahwa induksi
Aspergillomycosis pada ikan nila dilakukan dengan cara pemberian kontaminasi pada
makanan dengan kontaminasi oleh A. flavus.
Secara alami dalam kolam budidaya, penyakit mikosis merupakan suatu
penyakit yang disebabkan oleh beberapa jenis jamur yang berasosiasi dalam kelompok
tertentu dan pada saat kondisi lingkungan yang kurang baik, jamur tersebut terlihat
menjadi patogen. Menurut Srivastava (1996) A. terreus merupakan jamur yang ditemukan berasosiasi dengan beberapa ikan air tawar seperti Channa punctatus,
Heteropneustesfossilis dan clarius batrachus yang dibudidayakan pada kolam dan dapat menjadi patogen. Infeksi oleh jamur tersebut mengakibatkan kematian pada
ikan. Okaeme et al. (1988) melaporkan bahwa diantara jamur yang berhasil diisolasi,
Aspergillus dan Saprolegnia diketahui merupakan jamur yang berasosiasi dan mengakibatkan wabah penyakit pada ikan. Serangan infeksi oleh Aspergillus pada ikan mungkin saja disebabkan oleh adanya kontaminasi dari makanan. Makanan yang
terkontaminasi dengan A. flavus dapat menginduksi infeksi sistemik ikan nila pada
kolam dan akan memperlihatkan tanda-tanda klinis yang dapat diamati secara
eksperimental yaitu adanya perubahan warna kegelapan, aktivitas gerakan menurun
dan adanya abnormalitas pada organ. Infeksi pada temperatur di bawah batas toleransi
dapat mengakibatkan kematian dan gejala lesi yang parah (Olufemi & Robert., 1986).
Ikan yang terinfeksi diambil dan diisolasi pada media SDA kemudian
dilakukan pengamatan morfologi makroskopis dan mikroskopis. Reisolasi dilakukan
untuk membuktikan bahwa suatu penyakit disebabkan oleh jasad renik tertentu. Hasil
uji reisolasi pada ikan yang terinfeksi menunjukkan bahwa ikan tersebut yang
terinfeksi oleh isolat yang sama dengan isolat jamur uji yang diinfeksikan. Hal ini
menunjukkan ikan yang terinfeksi pada penelitian ini disebabkan karena isolat jamur
uji pada perlakuan.
4.6 Hasil Uji Antagonisme Secara In vivo
Isolat bakteri Bacillus sp. BK17 dan Enterobacter sp. PB17 yang memiliki diameter zona hambat tertinggi terhadap penghambatan pertumbuhan jamur pada uji
antagonisme secara in vitro dipilih untuk digunakan pada uji tantang secara in vivo. Isolat bakteri kitinolitik Bacillus sp. BK17 dan Enterobacter sp. PB17 diuji tantang dengan Aspergillus sp.2 yang memilki tingkat patogenitas tertinggi pada uji patogenitas. Isolat bakteri diinokulasikan pada ikan nila ukuran 5 cm selama 48 jam
kemudian diuji tantang dengan Aspergillus sp.2 selama masa pengamatan 10 hari dalam aquarium kaca dengan parameter pengamatan tingkat kematian (mortalitas),
tingkat terinfeksi dan tidak terinfeksi. Hasil uji menunjukkan bahwa isolat bakteri
Bacillus sp. BK17 dan Enterobacter sp. PB17 mampu menurunkan tingkat infeksi dan mortalitas pada ikan nila dengan perbedaan yang signifikan dibandingkan dengan
hasil uji patogenitas. Tingkat penghambatan infeksi jamur Aspergillus sp.2 yang diinokulasikan dengan bakteri potensial dapat dilihat seperti pada Gambar 4.6.1.
penghambatan infeksi oleh Aspergillus sp.2 dengan cara mengurangi tingkat mortalitas dan tingkat terinfeksi berturut- turut sebesar 92 dan 90% sampai pada hari
terakhir pengamatan. Konsep pengendalian penyakit secara biologis terutama dengan
menggunakan strain bakteri non pathogenic untuk mencegah penyakit telah dikembangkan sampai pada saat sekarang (Gram et al., 1999).
Gambar 4.6.1 Persentase Uji Evaluasiefek bakteri kitinolitik terhadap Aspergillus sp.2
Pada penelitian ini, Bacillus sp. BK17 dan Enterobacter sp. PB17 merupakan kandidat bakteri yang mungkin mampu menghasilkan metabolit tertentu seperti
kitinase untuk menghambat infeksi yang disebabkan oleh jamur. Kandidat bakteri
tersebut kemungkinan dapat menempel pada bagian mukus ikan dan mensekresikan
senyawa anti jamur. Beberapa penelitian telah melaporkan bahwa penggunaan
beberapa jenis bakteri mampu menurunkan infeksi penyakit pada ikan. Mekanisme
penghambatan infeksi Aspergillus sp.2 oleh bakteri potensial yang di uji secara in vivo
menunjukkan kemampuan dalam mengurangi tingkat infeksi dan mortalitas.
Mekanisme ini mungkin saja terjadi melalui pengeluaran zat antagonis oleh bakteri.
Mekanisme isolat bakteri dalam menghambat infeksi Aspergillus sp.2 kemungkinan disebabkan karena adanya kerja enzim hidrolitik yaitu kitinase dan glukanase.
Kemampuan bakteri dalam menghambat pertumbuhan Aspergillus
menghasilkan enzim hidrolitik seperti glukanase dan kitinase. Pengujian enzim
kitinase secara in vitro pada media agar MGMK menunjukkan bahwa bakteri potensial Bacillus sp. BK17 dan Enterobacter sp. PB17 mensekresikan enzim kitinase yang ditandai dengan terbentuknya zona bening pada sekitar koloni bakteri. Uji in vitro menunjukkan bahwa terdapat perubahan morfologi hifa ditandai dengan adanya abnormalitas yang menunjukkan adanya zat ekstraselular yang dikeluarkan bakteri
untuk menghambat pertumbuhan Aspergillus. Adanya rambatan senyawa antijamur yang dihasilkan oleh mikroba antagonis menyebabkan terjadinya penekanan pada
pertumbuhan jamur (Dewi, 2011).
Secara umum faktor-faktor yang terkait dengan timbulnya penyakit merupakan
interaksi dari tiga faktor yaitu inang, patogen dan lingkungan atau stressor eksternal
yaitu perubahan di lingkungan yang tidak menguntungkan, tingkat higienik yang
buruk dan stress (Austin & Austin, 2007). Status imunitas dan kesehatan ikan
mempengaruhi keberhasilan isolat bakteri potensial dalam menghambat infeksi
Aspergillus sp. 2 pada ikan nila saat uji in vivo. Ikan yang digunakan memiliki mekanisme pertahananan yaitu mengeliminasi spora yang menempel pada kulit
dengan peningkatan produksi mukus pada bagian tubuh ikan (Dewi, 2011). Pada ikan
sistem pertahanan itu berupa lendir (mukus), sisik dan kulit (Bruno & Wood, 1999).
4.7 Hasil Uji Perlekatan Bakteri Pada Ikan Nila
Uji perlekatan bakteri dilakukan untuk mengetahui apakah isolat bakteri potensial
yang digunakan yaitu Bacillus sp. dan Enterobacter sp. dapat melekat atau tersuspensi dalam air. Sisik ikan diambil dari masing-masing perlakuan dari tempat uji in vivo
sebelumnya dan dimasukkan ke dalam botol vial yang berisi alkohol 70% kemudian
dilakukan preparasi untuk foto dengan SEM.Perlekatanisolat bakteri Bacillus sp.
BK17 dan Enterobacter sp. PB17 dapat dilihat pada Gambar 4.7.1.
Gambar 4.7.1 Pengamatan perlekatan bakteri Bacillus sp. BK17 dan Enterobacter sp. PB17pada sisik ikan nila. (A) Kontrol (-) (B) Kontrol positif Bacillussp. BK17 (C) Kontrol positif Enterobacter sp. PB17 (D) Aspergillus +Bacillus sp. BK17 (E) Aspergillus + Enterobacter sp. PB17
A B
C D