ASPEK DIAGNOSIS DAN PATOGENESIS ISOLAT LOKAL
CANINE PARVOVIRUS (RIVS 57)
KETUT KARUNI NYANAKUMARI NATIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
KETUT KARUNI NYANAKUMARI NATIH. Aspek Diagnosis dan Patogenesis Isolat Lokal Canine Parvovirus (RNS 57). Dibimbing oleh SETYO WIDODO, BAMBANG JOENIMAN dan MDRAWATI SENDOW.
Canine Parvovirus (CPV) merupakan virus DNA (deoksiribo nucleic acid)
terkecil yang berselubung dengan rantai tunggal sebagai penyebab enteritis dan
miokarditis pada anjing. Virus ini masuk dalam famili Parvoviridae genus
parvovirus. Penelitian ini bertujuan untuk mengamati gejala klinis, kemunculan titer antibodi dan mempelajari kejadian ekskresi virus dalam feses setelah dilakukan inokulasi isolat lokal CPV (RIVS 57). Enarn (6) ekor anjing lokal sehat klinis
berumur 2 bulan dan nihil titer antibodi terhadap CPV dipergunakan dalam penelitian
ini. Dosis CPV (RIVS 57) sebesar 1 0 ' ~ ~ TCIDso
Iml
diinokulasikan per oral pada 2 ekoranak
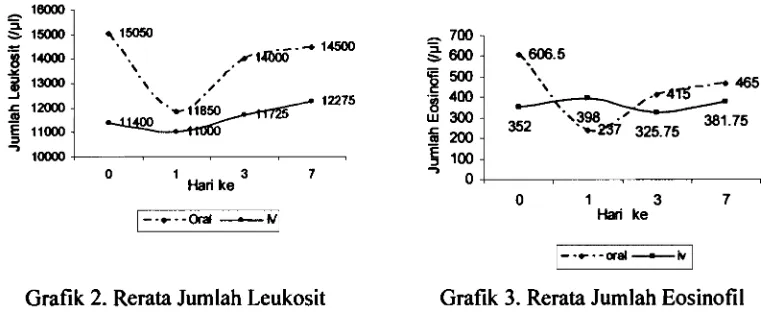
anjing dan per infravena pada 4 ekor sisanya.Hasil penelitian menunjukkan peningkatan suhu tubuh dan penurunan jumlah leukosit (21,26%) disertai p e n m a n jumlah absolut sel lirnfosit (34,89%) dan neutrofil (14,35%) lebih nyata pada aplikasi oral dibandingkan dengan aplikasi
intravena dan telah memunculkan titer antibodi pada 24 jam pertama. Kemunculan
antibodi pada aplikasi oral lebih responsif namun dengan titer rendah sebelurn hari
ke-3 dan mulai protektif pada hari ke-4 dengan puncaknya pada
hari
ke-10 (GMT =8192 HIU) dibanding aplikasi intravena dengan titer tinggi pada hari ke-3 dan protektif
hari
ke-5. Puncak titer antibodi pada aplikasi oral lebih tinggi dibandingpada aplikasi intravena.
.
Virus parvo anjing baik pada aplikasi oral maupun infravena tidak berhasil
diisolasi dari feses dengan menggunakan jaringan FK dan uji HA selama penelitian
berlangsung.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan
dalam
tesis sayayang berjudul:
ASPEK DIAGNOSIS DAN PATOGENESIS ISOLAT LOKAL CANINE PARVOVIRUS (RIVS 57)
merupakan gagasan atau hasil penelitian tesis saya sendiri, dengan pembimbingan Komisi Pembimbing, kecuali yang dengan jelas ditunjukan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas
dan
dapatdiperiksa kebenarannya.
Bogor, Pebruari 2005
ASPEK DIAGNOSIS DAN PATOGENESIS ISOLAT LOKAL
CANINE PARVOVIRUS (RIVS
57)
KETUT KARUNI
NYANAKUMARI
NATIHTesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada s
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANLAN BOGOR
Judul Tesis : Aspek Diagnosis dan Patogenesis Isolat Lokal Canine
Parvovirus (RIVS 57)
Nama : Ketut Karuni Nyanakumari Natih
N ~ P : 99752
Program Studi : Sains Veteriner
Disetuj ui Komisi Pembimbing
Drh. Bambann Joeniman, MS Anggota
Dr
Drh. Se o Widodo7 b E -
~rhhndrawati Sendow, MSc.
Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
!-
Prof. Dr. Ir. Sjafiida Manuwoto, MSc.
RIWAYAT
HIDUP
Penulis dilahirkan di Singaraja, Bali pada tanggal 21 Desember 1967 dari ayah Drs. I Ketut N. Natih, M. Hum. dan ibu Ketut Geniki. Penulis merupakan putri ke-empat dari enam bersaudara.
Tahun 1981 penulis lulus dari SD St. Fransiskus 111 Jakarta. Tahun 1984 penulis lulus dari SMP St. Fransiskus I1 Jakarta. Tahun 1987 penulis lulus dari SMA Negeri 21 Jakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur
Penelusuran Minat dan Bakat (PMDK). Pada tahun 1988 penulis memilih masuk
Fakultas Kedokteran Hewan, tahun 1992 penulis lulus Sarjana Kedokteran Hewan dan pada tahun 1993 penulis lulus sebagai Dokter Hewan.
PRAKATA
Dengan selesainya karya ilmiah ini, penulis mengucapkan angayubhagia
(bersyukur) kepada
Ida
Sang Hyang Widi WasatTuhan
Yang MahaEsa
atas segalaberkahNya yang termulia, yang dilimpahkan kepada penulis. Penelitian ini penulis laksanakan sejak Mei 2004 sampai Oktober 2004, dengan tema isolat lokal Canine Parvovirus. Judul karya ilmiah ini adalah Aspek Diagnosis dan Patogenesis Isolat Lokal Canine Parvovirus.
Dalam kesempatan ini penulis mengucapkan terima kasih kepada Dr. Drh. Setyo Widodo, Drh. Bambang Joeniman MS, Drh. Indrawati Sendow; MSc selaku
komisi pembirnbing atas segala bimbingannya; Dr. Drh. Danninto dan Dr. Drh
R.
M.Abdul Adjid selaku Kepala Balai Penelitian Veteriner (Balitvet) Bogor serta Drh. Dewa Made Ngurah Dhanna, MSc., Ph.D. selaku Kepala Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan (BBPMSOH) yang telah memberikan kesempatan untuk menyelesaikan karya ilmiah ini. Terimakasih penulis sampaikan kepada Kepala Bagian, Staf dan teknisi di bagian virologi Balitvet dan Drh. Ida Lestari Soedijar, MSc. beserta staf unit uji virologi BBPMSOH atas dukungan dan surnbang sarannya. Disarnping itu ucapan terimakasih penulis sampaikan kepada Drh. A. Maizir, Drh. Gatot Mudiarto, Heri Hoerudin dan Ipat Hikrnatul Isro atas bantuannya selama
pengambilan sampel dan pengurnpulan data. Yang tercinta suami (AKP I Nengah
Ganti, SH) dan anak (Putu Gayatridevi GK Natih) yang memberi semangat
dan
motivasi, orangtua dan seluruh keluarga atas segala dukungan, hoa
dan
kasihsayangnya. Tak lupa kepada ternan-teman yang tidak dapat disebutkan narnanya satu persatu yang telah mendukung selama penelitian sampai selesainya tesis ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Pebruari 2005
DAFTAR IS1
Halaman
DAFTAR TABEL
...
viiDAFTAR BAGAN
...
viiiDAFTAR GAMBAR
...
ixDAFTAR GRAFIK
...
x
DAFTAR LAMPIRAN
...
xiPENDAI-IITLUAN
...
1Latar Belakang
...
1Tujuan dan Manfaat Penelitian
...
2Hipotesa Penelitian
...
3TMJAUAN PUSTAKA
...
Canine Parvovirus (CPV)...
1.
Etiologi...
2.
Sifat Fisika dan Kimia...
3.
Sifat Biologis...
4.
Induk Semang...
5.
Sifat Antigen...
6.
Strain Canine Parvovirus...
7.
Penularan Canine Parvovirus...
Patogenesa Canine Parvovirus...
Diagnosis Canine Parvovirus.
.
...
1.
Gejala Klims...
a
.
Tipe Miokarditis...
b.
Tipe Enteritis...
2.
Pemeriksaan Serologis...
a
.
Uji Serum Netralisasi (SN)...
...
b
.
Uji Hambatan Hemaglutinasi (HI)c
.
Uji Antibodi Floresen...
d.
Enzirn Linked Immunosorbent Assay (Elisa)...
3.
Pemeriksaan Virologis...
...
a
.
Mikroskop Elektron (ME)b
.
Uji Hemaglutinasi(HA)
...
c
.
Enzim Linked Irnmunosorbent Assay (Elisa)...
d.
Polymerase Chain Reaction (PCR)...
4.
Pemeriksaan Histopatologi...
...
MATERI DAN METODA PENELITIAN
...
Tempat Penelitian
...
Materi Penelitian
1
.
Hewan Percobaan...
...
2
.
Isolat lokal CPV3
.
Sel Darah Merah Babi...
...
Metode Penelitian
1
.
Isolat Lokal (RIVS 57)...
a
.
Propagasi Biakan Jaringan Ginjal Kucing (Feline Kidney=FK)..
b
.
Propagasi Isolat Lokal CPV (RIVS 57). .
...
c.
Uji Kandungan Virus...
2.
Inokulasi Isolat Lokal CPV (RIVS 57)...
3.
Pengambilan Sampel...
a.
Darah (dengan EDTA)...
b.
Serum...
...
.
c Feses
4
.
Uji Laboratoris...
a.
Penghitungan Jumlah Sel Darah Putih (Leukosit) Total...
b.
Preparat Ulas Darah Untuk Diferensiasi Leukosit...
c.
Uji Hambatan Aglutinasi(HI)
...
d
.
Isolasi CPVdari
Feses pada Biakan Jaringan FK...
e.
Identifikasi Isolat virus dengan Uji Hemaglutinasi (HA)...
Peubah yang Diamati...
...
.
1 Gejala Klinis
2
.
Gambaran Hematologi...
...
.
3 Serologi
4
.
Isolasi CPV dari Feses...
a.
Pengamatan fisik...
b.
Pemeriksaan Laboratoris...
Analisis Data Penelitian...
HASIL DAN PEMBAHASAN...
Hasil
...
1.
Pengamatan Gejala klinis...
2.
Hematologi...
...
.
3 Serologis
4
.
Isolasi Virus Lokal CPV...
Pembahasan...
...
SIMPULAN
...
DAFTAR PUSTAKA
DAFTAR TABEL
Halaman
1
.
Contoh Penghitungan Titrasi Kandungan Virus Metoda Reed
&Munch
222
.
Dosis Inokulasi Isolat Lokal CPV
(IUVS 57)...
233
.
Hasil Pengamatan Gejala Klinis
...
394
.
Hasil Hematologi
...
405
.
Hasil Serologis
...
44ASPEK DIAGNOSIS DAN PATOGENESIS ISOLAT LOKAL
CANINE PARVOVIRUS (RIVS 57)
KETUT KARUNI NYANAKUMARI NATIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
KETUT KARUNI NYANAKUMARI NATIH. Aspek Diagnosis dan Patogenesis Isolat Lokal Canine Parvovirus (RNS 57). Dibimbing oleh SETYO WIDODO, BAMBANG JOENIMAN dan MDRAWATI SENDOW.
Canine Parvovirus (CPV) merupakan virus DNA (deoksiribo nucleic acid)
terkecil yang berselubung dengan rantai tunggal sebagai penyebab enteritis dan
miokarditis pada anjing. Virus ini masuk dalam famili Parvoviridae genus
parvovirus. Penelitian ini bertujuan untuk mengamati gejala klinis, kemunculan titer antibodi dan mempelajari kejadian ekskresi virus dalam feses setelah dilakukan inokulasi isolat lokal CPV (RIVS 57). Enarn (6) ekor anjing lokal sehat klinis
berumur 2 bulan dan nihil titer antibodi terhadap CPV dipergunakan dalam penelitian
ini. Dosis CPV (RIVS 57) sebesar 1 0 ' ~ ~ TCIDso
Iml
diinokulasikan per oral pada 2 ekoranak
anjing dan per infravena pada 4 ekor sisanya.Hasil penelitian menunjukkan peningkatan suhu tubuh dan penurunan jumlah leukosit (21,26%) disertai p e n m a n jumlah absolut sel lirnfosit (34,89%) dan neutrofil (14,35%) lebih nyata pada aplikasi oral dibandingkan dengan aplikasi
intravena dan telah memunculkan titer antibodi pada 24 jam pertama. Kemunculan
antibodi pada aplikasi oral lebih responsif namun dengan titer rendah sebelurn hari
ke-3 dan mulai protektif pada hari ke-4 dengan puncaknya pada
hari
ke-10 (GMT =8192 HIU) dibanding aplikasi intravena dengan titer tinggi pada hari ke-3 dan protektif
hari
ke-5. Puncak titer antibodi pada aplikasi oral lebih tinggi dibandingpada aplikasi intravena.
.
Virus parvo anjing baik pada aplikasi oral maupun infravena tidak berhasil
diisolasi dari feses dengan menggunakan jaringan FK dan uji HA selama penelitian
berlangsung.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan
dalam
tesis sayayang berjudul:
ASPEK DIAGNOSIS DAN PATOGENESIS ISOLAT LOKAL CANINE PARVOVIRUS (RIVS 57)
merupakan gagasan atau hasil penelitian tesis saya sendiri, dengan pembimbingan Komisi Pembimbing, kecuali yang dengan jelas ditunjukan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas
dan
dapatdiperiksa kebenarannya.
Bogor, Pebruari 2005
ASPEK DIAGNOSIS DAN PATOGENESIS ISOLAT LOKAL
CANINE PARVOVIRUS (RIVS
57)
KETUT KARUNI
NYANAKUMARI
NATIHTesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada s
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANLAN BOGOR
Judul Tesis : Aspek Diagnosis dan Patogenesis Isolat Lokal Canine
Parvovirus (RIVS 57)
Nama : Ketut Karuni Nyanakumari Natih
N ~ P : 99752
Program Studi : Sains Veteriner
Disetuj ui Komisi Pembimbing
Drh. Bambann Joeniman, MS Anggota
Dr
Drh. Se o Widodo7 b E -
~rhhndrawati Sendow, MSc.
Anggota
Diketahui
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
!-
Prof. Dr. Ir. Sjafiida Manuwoto, MSc.
RIWAYAT
HIDUP
Penulis dilahirkan di Singaraja, Bali pada tanggal 21 Desember 1967 dari ayah Drs. I Ketut N. Natih, M. Hum. dan ibu Ketut Geniki. Penulis merupakan putri ke-empat dari enam bersaudara.
Tahun 1981 penulis lulus dari SD St. Fransiskus 111 Jakarta. Tahun 1984 penulis lulus dari SMP St. Fransiskus I1 Jakarta. Tahun 1987 penulis lulus dari SMA Negeri 21 Jakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur
Penelusuran Minat dan Bakat (PMDK). Pada tahun 1988 penulis memilih masuk
Fakultas Kedokteran Hewan, tahun 1992 penulis lulus Sarjana Kedokteran Hewan dan pada tahun 1993 penulis lulus sebagai Dokter Hewan.
PRAKATA
Dengan selesainya karya ilmiah ini, penulis mengucapkan angayubhagia
(bersyukur) kepada
Ida
Sang Hyang Widi WasatTuhan
Yang MahaEsa
atas segalaberkahNya yang termulia, yang dilimpahkan kepada penulis. Penelitian ini penulis laksanakan sejak Mei 2004 sampai Oktober 2004, dengan tema isolat lokal Canine Parvovirus. Judul karya ilmiah ini adalah Aspek Diagnosis dan Patogenesis Isolat Lokal Canine Parvovirus.
Dalam kesempatan ini penulis mengucapkan terima kasih kepada Dr. Drh. Setyo Widodo, Drh. Bambang Joeniman MS, Drh. Indrawati Sendow; MSc selaku
komisi pembirnbing atas segala bimbingannya; Dr. Drh. Danninto dan Dr. Drh
R.
M.Abdul Adjid selaku Kepala Balai Penelitian Veteriner (Balitvet) Bogor serta Drh. Dewa Made Ngurah Dhanna, MSc., Ph.D. selaku Kepala Balai Besar Pengujian Mutu dan Sertifikasi Obat Hewan (BBPMSOH) yang telah memberikan kesempatan untuk menyelesaikan karya ilmiah ini. Terimakasih penulis sampaikan kepada Kepala Bagian, Staf dan teknisi di bagian virologi Balitvet dan Drh. Ida Lestari Soedijar, MSc. beserta staf unit uji virologi BBPMSOH atas dukungan dan surnbang sarannya. Disarnping itu ucapan terimakasih penulis sampaikan kepada Drh. A. Maizir, Drh. Gatot Mudiarto, Heri Hoerudin dan Ipat Hikrnatul Isro atas bantuannya selama
pengambilan sampel dan pengurnpulan data. Yang tercinta suami (AKP I Nengah
Ganti, SH) dan anak (Putu Gayatridevi GK Natih) yang memberi semangat
dan
motivasi, orangtua dan seluruh keluarga atas segala dukungan, hoa
dan
kasihsayangnya. Tak lupa kepada ternan-teman yang tidak dapat disebutkan narnanya satu persatu yang telah mendukung selama penelitian sampai selesainya tesis ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Pebruari 2005
DAFTAR IS1
Halaman
DAFTAR TABEL
...
viiDAFTAR BAGAN
...
viiiDAFTAR GAMBAR
...
ixDAFTAR GRAFIK
...
x
DAFTAR LAMPIRAN
...
xiPENDAI-IITLUAN
...
1Latar Belakang
...
1Tujuan dan Manfaat Penelitian
...
2Hipotesa Penelitian
...
3TMJAUAN PUSTAKA
...
Canine Parvovirus (CPV)...
1.
Etiologi...
2.
Sifat Fisika dan Kimia...
3.
Sifat Biologis...
4.
Induk Semang...
5.
Sifat Antigen...
6.
Strain Canine Parvovirus...
7.
Penularan Canine Parvovirus...
Patogenesa Canine Parvovirus...
Diagnosis Canine Parvovirus.
.
...
1.
Gejala Klims...
a
.
Tipe Miokarditis...
b.
Tipe Enteritis...
2.
Pemeriksaan Serologis...
a
.
Uji Serum Netralisasi (SN)...
...
b
.
Uji Hambatan Hemaglutinasi (HI)c
.
Uji Antibodi Floresen...
d.
Enzirn Linked Immunosorbent Assay (Elisa)...
3.
Pemeriksaan Virologis...
...
a
.
Mikroskop Elektron (ME)b
.
Uji Hemaglutinasi(HA)
...
c
.
Enzim Linked Irnmunosorbent Assay (Elisa)...
d.
Polymerase Chain Reaction (PCR)...
4.
Pemeriksaan Histopatologi...
...
MATERI DAN METODA PENELITIAN
...
Tempat Penelitian
...
Materi Penelitian
1
.
Hewan Percobaan...
...
2
.
Isolat lokal CPV3
.
Sel Darah Merah Babi...
...
Metode Penelitian
1
.
Isolat Lokal (RIVS 57)...
a
.
Propagasi Biakan Jaringan Ginjal Kucing (Feline Kidney=FK)..
b
.
Propagasi Isolat Lokal CPV (RIVS 57). .
...
c.
Uji Kandungan Virus...
2.
Inokulasi Isolat Lokal CPV (RIVS 57)...
3.
Pengambilan Sampel...
a.
Darah (dengan EDTA)...
b.
Serum...
...
.
c Feses
4
.
Uji Laboratoris...
a.
Penghitungan Jumlah Sel Darah Putih (Leukosit) Total...
b.
Preparat Ulas Darah Untuk Diferensiasi Leukosit...
c.
Uji Hambatan Aglutinasi(HI)
...
d
.
Isolasi CPVdari
Feses pada Biakan Jaringan FK...
e.
Identifikasi Isolat virus dengan Uji Hemaglutinasi (HA)...
Peubah yang Diamati...
...
.
1 Gejala Klinis
2
.
Gambaran Hematologi...
...
.
3 Serologi
4
.
Isolasi CPV dari Feses...
a.
Pengamatan fisik...
b.
Pemeriksaan Laboratoris...
Analisis Data Penelitian...
HASIL DAN PEMBAHASAN...
Hasil
...
1.
Pengamatan Gejala klinis...
2.
Hematologi...
...
.
3 Serologis
4
.
Isolasi Virus Lokal CPV...
Pembahasan...
...
SIMPULAN
...
DAFTAR PUSTAKA
DAFTAR TABEL
Halaman
1
.
Contoh Penghitungan Titrasi Kandungan Virus Metoda Reed
&Munch
222
.
Dosis Inokulasi Isolat Lokal CPV
(IUVS 57)...
233
.
Hasil Pengamatan Gejala Klinis
...
394
.
Hasil Hematologi
...
405
.
Hasil Serologis
...
44DAFTAR
BAGAN
Halaman
...
1.
Patogenesa Infeksi Canine Parvovirus (Hoskins 1 995)...
2.
Prosedur Propagasi Biakan Jaringan FK3
.
Prosedur Propagasi Isolat CPV (RIVS 57)...
. .
...
4.
Prosedur Uji Kandungan...
5.
Prosedur Perlakuan Serum6
.
Prosedur Preparat UlasDarah
...
...
.
7 Prosedur Uji HI
8
.
Prosedur Isolasi CPV dalam Biakan Jaringan FK...
DAFTAR GAMBAR
1
.
Hewan Percobaan Yang Digunakan
...
2.
Inokulasi Isolat b k a l CPV (RIVS 57) Aplikasi
Oral
...
3
.
Inokulasi Isolat Lokal CPV (RIVS 57) Aplikasi
Intravena ... 4.
Pengambilan Sampel Darah Pada Anjing
...
5
.
Biakan Jaringan FK Normal
...
6
.
CPE Canine Parvovirus pada Biakan Jaringan FK
...
.
.
...
...
7
.
Hasil Uji HI
...
.
8
HasilUji
HAHalaman
2929
29
29
29
29
1
.
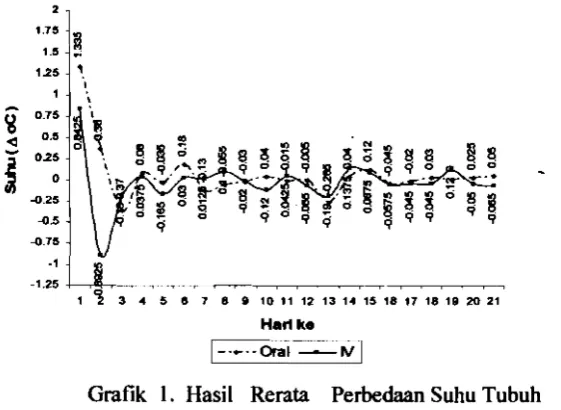
Hasil Rerata Perbedaan Suhu Tubuh...
39...
2
.
Rerata Jumlah Leukosit 423
.
Rerata Jumlah Eosinofil...
42 4.
Rerata Jumlah Neutrofil...
43...
5
.
Rerata Jumlah Limfosit 436
.
Rerata Jumlah Monosit...
44...
DAFTAR LAMPIRAN
Halaman
1 . Bahan dan Alat
...
562.
Pembuatan Medium...
5 7. . .
...
PENDAHULUAN
Latar Belakang
Anjing merupakan salah satu hewan kesayangan, yang dipelihara untuk berbagai
tujuan, diantaranya sebagai penjaga rumah, teman atau hiburan untuk menghilangkan
stress maupun sebagai simbol status.
Penyakit yang membahayakan anjing dan dapat membawa kematian adalah
infeksi muntaber yang disebabkan oleh Canine Parvovirus, ditandai dengan gejala
muntah dan mencret berdarah yang berakhir dengan kematian dalam waktu kurang dari 3 hari. Dari temuan nekropsi anjing yang mati menderita muntaber diperoleh dehidrasi
berat, usus mengalami dilatasi dan berisi cairan berwama merah hingga kehitaman. Secara histopatologis ditemukan degenerasi sampai nekrosis dan hiperplasia dari epitel
kripta usus bagian duodenum dan jejunum, juga ditemukan badan inklusi intranukleus
bersifat basofilik pada epitel kripta duodenum (Nelson et al. 1979; Macartney et al.
1984).
Canine Parvovirus diidentifikasi sejak tahun 1978 setelah berhasil diisolasi dari
anjing dengan gejala berak darah (haemorrhagic diarrhea) (Appel et al. 1979). Canine
Parvovirus merupakan virus DNA (deoksiribo nucleic acid) terkecil yang berselubung dengan rantai tunggal. Virus ini masuk dalam famili Parvoviridae genus parvovirus
(Russel dan Edington 1985).
Canine Parvovirus dapat menginfeksi berbagai ras anjing, umur ataupun jenis kelamin. Resiko paling tinggi terjadi pada anak anjing umur 6 minggu sampai 6 bulan (Glickrnan et al. 1985). Replikasi CPV terjadi dalam sel-sel yang membelah dengan cepat yaitu sel jantung dan sel epitel usus halus sehingga CPV berkembang dengan
cepat dalam tubuh anjing muda (umur kurang dari 6 bulan) yang masih banyak terjadi proliferasi sel-sel (Hoskins 1997).
Saat ini penyakit enteritis karena infeksi CPV pada anjing telah menyebar ke
seluruh dunia. Penyakit ini bersifat sangat menular dan fatal. Penularan sangat mudah
terjadi secara oral melalui feses yang tercemar CPV (Meunier et al. 1985; Hoskins
Banyak penelitian yang telah dilakukan untuk mengetahui gejala klinis, isolasi
virus dan epidemiologi CPV (Miura et al. 1986). Tetapi sampai saat ini Canine
Parvovirus tipe enteritis masih merupakan masalah di tempat-tempat praktek dan
petemakan karena menyebabkan angka kematian yang tinggi pada anak anjing dengan
tanda-tanda klinik adanya diare darah (Schultz 1995; Hoskins 1997).
Kejadian infeksi Canine Parvovirus pertarnakali di Indonesia pada tahun 1981.
Wabah pada anjing ini ditandai dengan gejala depresi, anoreksia, muntah dan diare dan
menyerang pada hampir semua umur hewan, kemudian dilakukan isolasi CPV dari feses
yang ditumbuhkan pada biakan jaringan ginjal kucing (Crandell Feline Kidney =
CRFK). Identifikasi terhadap CPV dilakukan dengan menggunakan uji hemaglutinasi
(Hemaglutination Test = HAT). Typing terhadap CPV dilakukan dengan monoklonal
antibodi (Jusa et al. 1991).
Sampai saat ini infeksi CPV pada anjing-anjing di Indonesia masih merupakan
masalah besar. Tingkat kematian yang terjadi hampir 100%. Tempi atas infeksi
parvovirus hanya dapat dilakukan berdasarkan gejala yang memperburuk keadaan hewan (Tilley et al. 1997). Menurut Glickrnan et al. (1985) faktor-faktor yang
mempengaruhi keganasan infeksi CPV adalah ada tidaknya kekebalan anjing, virulensi
virus, dosis infeksi, infeksi campuran yang mengikutinya dan kondisi lingkungan. CPV pada anak anjing akan menjadi lebih buruk jika disertai dengan adanya infeksi
parasit, stress di tempat baru, keadaan di dalam kandang yang terlalu padat, sanitasi
yang buruk, titer antibodi induk rendah dan kegagalan tubuh membentuk respon
kekebalan (Sajuthi 200 1).
Kualitas isolat lokal CPV sampai saat ini juga belum banyak dilakukan dan dipublikasikan. Penelitian ini dilakukan untuk mengetahui aspek diagnosis dan
patogenesis isolat lokal CPV yang diinokulasikan pada anjing lokal.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk:
1. Mengamati gejala klinis setelah inokulasi isolat lokal CPV (RIVS 57)
2. Mengukur titer antibodi yang terbentuk setelah inokulasi isolat lokal CPV
(RIVS 57)
Manfaat yang diharapkan dari penelitian ini adalah:
Mendapatkan informasi pendukung diagnosis dan patogenesis infeksi isolat lokal CPV (RIVS 57) yang diinokulasikan pada anjing lokal.
Hi potesa
TINJAUAN PUSTAKA
Canine Parnovirus (CPV)
1. Etiologi
Infeksi Canine Parvovirus dengan strain tipe 2 (CPV-2) merupakan salah satu penyakit virus pada anjing yang bersifat sangat kontagius dan fatal (Hoskins 1995; Kerr
2000).
Canine Parvovirus merupakan virus DNA (deoksiribo nucleic acid) rantai
tunggal yang berukuran 15-28 nm. Virus ini berbentuk ikosahedral simetris dan tidak
berselubung. CPV memiliki 32 kapsomir dan 3 struktur polipeptida (Russel dan
Edington 1985; Kerr 2000).
2. Sifat Fisika dan Kimia
Canine Parvovirus sangat stabil pada pH 3-9, suhu 56-60°C selarna 1 jam, pada
pelarut lemak dan pada konsentrasi garam yang tinggi (Afshar 1981; Russel dan Edington 1985; Kerr 2000). Canine Parvovirus dapat hidup bertahun-tahun dalarn
fomitus (Russel dan Edington 1985).
Canine Parvovirus akan mati melalui kontak dengan sodium hipokhlorida dan
gluteraldehyda (Kerr 2000). Menurut Afshar (1981) CPV dapat diinaktifkan dengan
formalin, O-propiolaktan, hydroxylamine dan radiasi ultra violet.
3. Sifat Biologis
Canine Parvovirus mudah bereplikasi dalam sel-sel yang sedang membelah dengan cepat (Afshar 198 1 ; Russel
dan
Edington 1985). Secara in vivo terjadi pada selepitel usus (kripta ileum), sumsum tulang dan fetus (Russel dan Edington 1985). Secara
in vitro CPV dapat tumbuh pada biakan jaringan primer organ anjing seperti ginjal, usus,
limpa, timus dan paru-paru, dan pada biakan jaringan organ kucing seperti ginjal dan paru-paru (Afshar 198 1). Canine Parvovirus selain dapat tumbuh pada biakan jaringan
primer, juga dapat tumbuh dengan baik pada biakan jaringan lestari seperti biakan jaringan CRFK (Crandell Feline Kidney), canine foetal kidney, canine melanoma,
canine Jbroblastic cells, A72 canine Jbroma dan MDCK (Madin Darby Canine
African green monkey, raccoon saliva?y gland dan bovine foetal spleen pada kondisi
biakan jaringan tidak membentuk sel selapis (Appel et al. 1979). Biakan jaringan ginjal
kucing merupakan biakan jaringan lestari yang paling sensitif untuk mengidentifikasi
CPV karena dapat menimbulkan efek sitopatik (Cythopathic Efect = CPE). Efek
sitopatik pada biakan jaringan FK atau CRFK terjadi pada 2-3 hari setelah inokulasi. Perkembangan virus ditandai dengan sel yang berbentuk bulat dan pelepasan sel-sel
serta adanya badan inklusi intranuklear (Joshi et al. 1998).
4. Induk Semang
Canine Parvovirus dapat menginfeksi anjing berbagai ms, umur ataupun jenis kelamin. Resiko umur paling tinggi terjadi pada anak anjing yang berumur 6 minggu
sampai 6 bulan. Predisposisi ras yang dilaporkan beresiko tinggi pada ms Rottweiler,
Dobermann pinscher, American pitbull terriers, German sheperd (Glickman et al.
1985; Houston et al. 1996; Hoskins 1997; Sajuthi 2001), English springer spaniels
(Glickman et al. 1985), Labrador retriever, Staford.vhire dan Alaskan sled (Hoskins
1997). Predisposisi ras dengan resiko rendah terjadi pada ras Toy poodle, Cocker spaniel dan ras carnpuran (Houston et al. 1996; Sajuthi 2001).
Bhut et al. (1998), berhasil mendeteksi CPV pada wild canines, yaitu pada wild
dogs (Cuan alpinus), jackals (Canis auxus) dan wolves (Canis lupusj.
Kejadian penyakit akibat infeksi CPV di Indonesia banyak menyemng anjing
muda berumur 2 bulan dan lebih sering terjadi pada ras Dobermann dan Rottweiler.
Pengamatan Sendow dan Syafiiati (2004) menunjukkan bahwa anjing lokal dapat
terinfeksi CPV, namun kasus klinis jarang terjadi.
5. Sifat antigen
Canine Parvovirus mempunyai hemaglutinin yang dapat mengaglutinasi
beberapa sel darah merah hewan seperti babi, Afican green monkey, anjing, shrew mouse, kuda, kucing, golden hamster dan domba (Senda et al. 1988). Penelitian mereka
membuktikan bahwa CPV dapat mengaglutinasi sel darah memh hewan-hewan tersebut
tetapi titernya tidak setinggi sel damh memh babi atau African Green Monkey. Mereka juga membuktikan bahwa CPV tidak dapat mengaglutinasi sel damh merah sapi,
terhadap CPV adalah sel darah merah babi dan sel darah merah monyel ekor panjang
(Macaca fmicularis). Dengan adanya sifat aglutinasi sel darah merah maka uji
hemaglutinasi dapat diterapkan untuk mendeteksi awal adanya antigen CPV (Mochizuki
et al. 1984; Deepa dan Saseendranath 2002).
6. Strain Canine Parvovirus
Pamsh et al. (1991), mengatakan bahwa tipe CPV hanya satu, tetapi varian
strain virus ini ada beberapa yang secara antigenik berbeda tetapi secara serologis sama.
Canine Parvovirus serotype-1 (CPV-1) atau Minute Virus of Canine (MVC)
pertama kali diisolasi dari feses anjing militer di Amerika Serikat pada tahun 1967
(Hoskins 1995). MVC tidak bersifat pathogen. Pada anjing umur 5-21 hari
menimbulkan gejala pneumoni miokarditis dan enteritis sedangkan pada anjing bunting
menyebabkan kematian fetus dan mumifikasi (Truyen 2000). Pada tahun 1978 ditemukan serotipe lain dari CPV yang dihubungkan dengan gejala diare pada anak
anjing di Amerika Serikat dan disebut sebagai Canine Parvovirus tipe-2 (CPV-2) atau
Canine Parvovirus Enteritis (Appel et al. 1979; Parrish et al. 1991). CPV-2 sarna sekali tidak berhubungan dengan MVC (Truyen et al. 2000).
Feline Panleukopenia (FPL) adalah penyakit virus yang menginfeksi kelwga
Felidae dan hewan yang dekat kekerabatannya seperti ~ustelidae,- Procyonidae dan
Viverridae. Sifat penyakit akut, ganas dan sistemik ditandai dengan kejadian yang tiba-
tiba, demam, muntah, diare dan leukopenia. Penyakit ini pertama kali terjadi pada tahun 1925. Beberapa peneliti menduga ada hubungan FPL dengan Mink Enteritis
Virus (MEV) karena mempunyai sifat kimia dan fisika yang sama. Tahun 1966 berhasil
mengidentifikasi FPL yang termasuk dalam kelwga Parvoviridae (Bittle 198 1 ; Truyen
2000).
Canine Parvovirus tipe-2 merupakan hasil mutasi dari Feline Panleukopenia
virus (FPV) (Erbeck 1981); Evermann 1981 ; Hoskins 1997; Nakamura et al. 2001). Feline Panleukopenia mempunyai kesamaan urutan basa nukleotida dengan CPV-2
lebih dari 98% (Parrish et al. 1991). Hubungan antara CPV dengan FPV secara
serologis sangat erat dan dapat dibuktikan dengan adanya reaksi silang pada uji HI, uji antibodi floresen, uji netralisasi dan immunoelektron mikroskopi (Hoskins 1997).
Selama tahun 1978 dengan pemeriksaan serologis pada anjing terbukti bahwa
Serikat. Canine Parvovirus serotype-2 ini hanya menginfeksi anjing dan canidae
lainnya seperti wolves, coyotes, south American dogs dan Asiatic raccoon dogs. Pada
tahun 1980 strain CPV-2 bermutasi menjadi tipe 2a (CPV-2a) dan pada tahun 1984
muncul varian lain yaitu tipe 2b (CPV-2b). Strain-strain ini disebut tipe antigen yang
baru yang dapat menginfeksi anjing dan kucing dengan gejala klinis CPV (Truyen 2000) juga pada domestic cats (Gamoh et al. 2003). Penelitian Pereira et al. (2000)
menunjukkan bahwa tipe strain CPV di Brazil menunjukkan bahwa selama tahun 1980-
an tipe strain yang dominan adalah CPV-2a dan pada tahun 1990-an adalah CPV-2b.
Pada tahun 2000 ditemukan lagi varian baru yaitu tipe 2c yang menginfeksi kucing dan
wild felidae (Nakamura et al. 2001). Hasil penelitian Truyen (2000) menunjukkan
bahwa ke-3 strain tersebut tidak dapat dibedakan secara serologis.
Adanya perubahan CPV-2 ini karena kemampuan parvovirus untuk bereplikasi
dan menyebar lebih efektif dalam adaptasi genetik (Parrish et al. 1988). Dengan analisa
phylogenetik memperlihatkan evolusi yang pmgresif dari tipe asli CPV. Kejadian tersebut mirip seperti yang terjadi pada virus influenza A (Parrish et al. 1991).
7. Penularan Canine Parvovirus
Penyakit yang disebabkan oleh Canine Parvoviws sangat kontagious. Sampai saat ini penularan CPV secara alami melalui kontak langsung dekan sekreta anjing
yang terinfeksi CPV atau makanan yang telah terkontarninasi oleh CPV. CPV dapat
diekskresikan melalui feses, air seni,air liur dan muntah (Appel et al. 1980). Alat-alat yang telah tercemar CPV seperti alat-alat kedokteran, grooming dan alat-alat kandang
yang tercemar feses juga merupakan sarana penularan (Gordon dan Angrick 1986;
Hoskins 1997).
Patogenesis Canine Parvovirus
Patogenesis CPV berhubungan erat dengan orgadtipe sel. Pada anak anjing umur kurang dari 8 minggu terjadi gangguan pada myocardium. Pada anak anjing yang
lebih tua terjadi gangguan pada epitel usus halus. Umumnya pada semua anjing terjadi
gangguan pada sumsum tulang, limfoid dan sel-sel darah (Hoskins 1995).
secara cepat dari anjing satu ke anjing yang laimya melalui oronasal yang ditularkan
lewat feses yang tercemar CPV (Hoskins 1995).
Setelah virus masuk melalui oronasal maka replikasi virus dimulai 1-2 hari
setelah infeksi di jaringan limfoid oropharing, limfonodus mesenterika dan timus.
Infeksi virus sistemik pada jaringan limfoid usus halus tejadi 3 hari setelah pasca
infeksi melalui viremia. Adanya plasma viremia terjadi 1-5 hari setelah infeksi (Hoskins 1995).
Pada kondisi normal, sel-sel bermigrasi dari epitel germinaVpangkal
limfonodus intestinal ke ujung vili usus halus. Selama migrasi sel-sel matang dan
mempunyai kemarnpuan menyerap. Pada anjing yang terinfeksi CPV, virus bereplikasi
di epitel germinal kripta usus sehingga sel-sel epitel rusak dan kolaps. Karena tejadi kerusakan pada epitel germinal mengkibatkan pergantian sel normal (biasanya antara 1
-
3 hari pada usus halus) terganggu dan vili menjadi pendek (Bolton dan Pass 1988;
Hoskins 1995). Akibat patologis yang te jadi pada infeksi virus pada epitel usus adalah
keharusan sel-sel epitel tersebut dalam jumlah banyak dalam waktu singkat lalu diganti dengan sel-sel yang muda tidak bisa mengabsorbsi cairan dan tidak menghasilkan enzim
sehingga te jadi pengeluaran cairan terus menerus. Hewan mati karena terlalu banyak cairan keluar (Bolton dan Pass 1988).
CPV juga merusak mitoticcaly active precursor sirkulasi sel leukosit dan limfoid.
Pada infeksi yang parah sering te jadi neutropenia dan limfopenia (Meunier et al. 1985; Hoskins 1995). Infeksi sekunder dari bakteri Gram negatif dan mikroflora anaerob
menyebabkan te jadinya komplikasi sehingga menyebabkan kerusakan hebat pada usus,
bakterimia clan endotoksemia serta Disseminated Intravascular Coagulation (DIC)
(Hoskins 1995).
Titer antibodi dalam serum dapat dideteksi sedini mungkin pada 3-4 hari setelah
infeksi dan akan konstan selarna kurang dari setahun (Carman dan Povey 1985; Hoskins 1997). Pada anjing-anjing yang sembuh dari infeksi CPV, kekebalan bertahan
selama 20 bulan lebih (Hoskins 1995). Penelitian Sendow dan Syafiiati (2004)
menunjukkan bahwa antibodi terhadap CPV masih dapat terdeteksi hingga 3 tahun.
Ekskresi aktif CPV dimulai pada hari ke-3 atau ke-4 setelah infeksi umumnya
sebelum gejala klinis muncul (Hoskins 1995). Menurut Carman dan Povey (1985)
antibodi. Antibodi lokal intestinal penting dalam terminal ekskresi virus dalam feses
(Hoskins 1995). Viremia selalu didahului shedding virus melalui feses (Meunier et al.
1985; Hoskins 1997). CPV berada dalam feses selama 7-10 hari (Schunck er al. 1995; Hoskins 1997). Pada penelitian Gamoh et al. 2003, shedding virus terjadi pada hari
ke-5. Virus ini akan berada dalam feses dengan titer yang tinggi dan akan disebarkan
ke induk semang yang cocok melalui oral (Schunck et al. 1995; Hoskins 1997).
CPV menimbulkan respon imunologik dimana terjadi ikatan antara antigen
CPV yang masuk ke dalam tubuh dengan antibodi yang terbentuk. Imunoglobulin (Ig)
yang berperan adalah IgM, IgG dan IgA. Pada peristiwa terjadinya infeksi CPV, Imunoglobulin M biasanya dibentuk terlebih dahulu sebagai respon terhadap virus yang
masuk kedalam tubuh. Pada uji serologi di laboratorium IgM bersama-sama dengan IgG
menyebabkan reaksi antigen-antibodi seperti terjadinya aglutinasi sel darah merah.
Imunoglobulin A terdapat didalam serum dan ada juga IgA sekretori (SIgA) sebagai
imunoglobulin utama dalam organ sekresi dan eksokrin. Immunoglobulin A sekretori terdapat dalam mukosa saluran pencemaan yang berfbngsi melindungi tubuh terhadap
masuknya antigen ke dalam tubuh dengan cam membalut antigen sehingga antigen tidak
dapat melekat pada mukosa (Tizard 1992). Target organ utama pada infeksi CPV
enteritis adalah usus halus. Menurut Nara et al. (1983), antibodi yang terbentuk pada usus adalah IgA, yang dapat memberikan proteksi memadai terhadap infeksi CPV.
Antibodi IgA ini dapat menyebabkan temetralisasinya virus yang diekskresikan pada feses sehingga apabila waktu yang tidak tepat dan lama pada saat pengambilan feses
Regional lymphmodus chopharing
Tonsil
Umur 6 minggu-6 bulan
4
6-10 Jaringan lymphoid Intesfiml gland P-W Sumsum tulang Sel epithel Hati *Peningkatan titer Ab
4
1
Gijal.Timbul gejala klinis (patologi)
Leucopenia-limphopenia
.She&- v i m sampai Intestinal gland
hari ke- 1 4 1mmunodef;ciency: Nekrosa epitel
Atropi timus
Lymphoid depletion pada Peningkatan
4
permeabilitas Limpa dan limphonodus Penunman absorpsi7 Infeksi skunder Parah
4 Enteropthy
Gram negavf sepsis Diare
Bagan 1. Patogenesa Infeksi Canine Parvovirus (Hoskiis 1925).
Diagnosis Canine Parvovirus
Diagnosis Canine Parvovirus dilakukan berdasarkan pengamatan gejala klinis,
pemeriksaan serologis, pemeriksaan virologis seperti isolasi dan identifikasi CPV dalam feses dan pemeriksaan histopatologi (Stann et al. 1984; Russel dan Edington
1985).
1. Gejala Klinis
Respon anjing yang terinfeksi Canine Pawovirus bewariasi dari tidak ada gejala atau subklinis hingga akut yang dapat berakibat fatal. Kasus subklinis lebih
banyak ditemukan, terutama pada anjing lokal (Sendow dan Syafiiati 2004). Keparahan
infeksi CPV tergantung pada umur hewan, tingkat stress, jenis hewan dan status
(Hoskins 1995). Makin muda umur anjing yang terinfeksi CPV makin parah gejala
klinisnya. Pada anjing umur 3-4 minggu, sel miosit pada jantung sedang aktif berkembang sehingga apabila pada umur tersebut terinfeksi CPV maka yang terserang
adalah jantung yang mengakibatkan kematian mendadak. Infeksi CPV pada anjing
yang berumur lebih dari 6 minggu, derajat pembelahan sel miosit mulai menurun tetapi derajat pembelahan sel mitotik pada kripta usus meningkat, sehingga menyebabkan muntah dan diare (McCandlish et al. 1979).
Gejala klinis yang ditimbulkan oleh infeksi CPV, yaitu:
a. Tipe Miokarditis
Canine Parvovirus dapat menyerang otot jantung sehingga disebut sebagai CPV
miokarditis. Infeksi CPV tipe miokarditis dapat terjadi saat masih dalam uterus atau
pada anak anjing umur kurang dari 4 minggu. Umumnya seluruh anak anjing dalarn satu
induk terinfeksi. Anak anjing sering ditemukan mati dalarn waktu 24 jam setelah
timbulnya gejala klinis seperti sesak napas, menangis, lemas, kadang-kadang muntah
dan selaput lendir pucat (McCandlish et al. 1981; Hoskins 1997). Mortalitas tipe
miokarditis berkisar atara 20% hingga 100%. Pada tipe miokarditis yang akut
umumnya anak anjing tersebut tidak mempunyai kekebalan bawaan dari induk,
sehingga vaksinasi induk yang akan dikawinkan sangat dianjurkan (sendow 2003).
Pada anak anjing berumur lebih dari 5 bulan gejala klinis yang tampak tidak
nyata, tetapi pada infeksi akut, ritme puls femoral irregular, jantung terdengar murmur dan aribnia (Robinson et al. 1980).
Di Indonesia, tipe miokarditis jarang ditemukan. Hal ini dapat disebabkan
karena umumnya induk anjing telah divaksinasi, sehingga anak yang dilahirkan
mempunyai maternal antibodi yang bertahan hingga 6 minggu (Sendow 2003).
b. Tipe Enteritis
Canine Parvovirus dapat menyerang gastrointestinal sehingga dikenal sebagai
CPV enteritis. Infeksi CPV pada saluran pencemaan ini lebih sering terjadi
dibandingkan dengan tipe miokarditis (Hoskins 1997). Masa inkubasi tipe enteritis adalah 7-1 4 hari setelah infeksi dengan gejala awal muntah, demam yaitu dengan suhu
seperti wama aspal (Meunier et al. 1985; Hoskins 1995). Umumnya neutropenia,
leucopenia dan limfopenia terjadi setelah gejala diare muncul (Macartney et al. 1984).
Leukopenia tejadi pada hari ke4-5 setelah infeksi dimana jumlah sel darah putih menurun hingga 30001pl (Afshar 1981; Stann et al. 1984). Morbiditas CPV tipe
enteritis berkisar antara 20% hingga 100% dan mortalitasnya mencapai 50%, sedangkan
pada anjing yang masih muda dan belum divaksinasi mortalitasnya dapat mencapai 100% (Eugster et al. 1978).
Canine Parvovirus enteritis akut dapat te jadi pada semua jenis anjing, umur
ataupun jenis kelamin. Tetapi anjing berumur antara 6 minggu sarnpai 6 bulan, ras
Rottewilers, Doberman pinscher dan Labrador retriever beresiko lebih tingg i (Hoskins 1995; Tilley et al. 1997).
Pada kasus CPV enteritis, Leib (1995) menyarankan untuk melakukan pemeriksaan feses, rectal cytology, complete blood count (CBC), profil biokimia,
pemeriksaan urin dan radiograph abdomen untuk konfirmasi adanya virus parvo.
Biasanya pada pemeriksaan laboratorium akan terlihat penurunan total protein, anemia,
neutropenia, limphopenia dan hipoglicemia (Leib 1995; Tams 1995).
2. Pemeriksaan Serologis
Adanya infeksi CPV, ditandai dengan pembentukkan antibbdi terhadap CPV
pada tubuh anjing tersebut. Untuk menentukan adanya antibodi terhadap CPV, dapat
dilakukan uji serologis dengan menggunakan beberapa perangkat diagnosis, diantaranya adalah uji serum netralisasi (SN), uji hambatan hemaglutinasi (HI), uji antibodi floresen
dan Enzim-link Iimmunosorbent Assay (ELISA) (Pamsh et al. 1982; Dubovi 1997).
Antibodi dengan konsentrasi tertinggi dan termudah diperoleh, berasal dari
serum darah. Serum diperoleh dengan membiarkan darah contoh membeku dan bekuan
beretraksi. Serum dapat disimpan beku pada suhu -20" C dan digunakan bila diperlukan.
Jika serum diperlukan tanpa aktivitas komplemen maka serum diinaktivasi dalam
penangas air dengan suhu 56°C selama 30 menit (Tizard 1992). Titer antibodi dalam
serum dapat dideteksi sedini mungkin pada 3 4 hari setelah infeksi dan akan konstan
a. Uji Serum Netralisasi (SN)
Prinsip dasar uji serum netralisasi CPV adalah terjadinya proses netralisasi
antigen CPV oleh antibodi. Uji serum netralisasi menggunakan virus dengan
konsentrasi konstan (100 TC1Dso) yang ditambahkan pada serum yang telah
diencerkan, kemudian ditambahkan larutan biakan jaringan ginjal kucing. Biakan
jaringan ginjal kucing tersebut diinkubasikan pada suhu 37'C sampai terlihat perubahan yaitu terbentuknya efek sitopatik (CPE) pada biakan jaringan sebagai tanda adanya
pertumbuhan virus. Ada atau tidak adanya antibodi yang terbentuk dibedakan dengan
ada atau tidaknya CPE (Dubovi 1997).
b. Uji Hambatan Hemaglutinasi (HI)
Prinsip dasar uji hambatan hemaglutinasi adalah CPV mempunyai kemampuan
untuk mengikat sel darah merah yang menyebabkan terjadi aglutinasi sel darah merah
tersebut. Spesifik antibodi CPV mengikat permukaan partikel virus sehingga mencegah
kemampuan virus untuk menempel pada sel darah merah yang menyebabkan aglutinasi terhambat. Reaksi ini disebut penghambatan hemaglutinasi. Uji ini menggunakan
jumlah virus standar sebanyak 4-8 hemaglutination units (HAU) (Dubovi 1997).
Uji hemaglutinasi merupakan uji yang pertarnakali dan sering digunakan untuk mengukur titer antibodi CPV. Menurut kegunaannya dalam mendeieksi antibodi, uji
ini ada dua, yaitu uji prosedur alfa dengan cara konsentrasi sera tetap dengan virus yang
diencerkan dan prosedur beta dengan cara virus standar dengan konsentrasi tetap dan
serum yang diencerkan (Dubovi 1997). Hoskins (1 997) mengatakan bahwa diagnosa CPV dapat dipastikan apabila dalam waktu 3 hari atau lebih setelah anjing menunjukkan gejala klinis dengan diperolehnya titer HI yang tinggi dalam serumnya.
Uji hemaglutinasi secara rutin dilakukan untuk menentukan diagnosa terhadap
infeksi CPV karena sensitif, mudah dikerjakan, cepat dan biayanya tidak mahal (Mathys
et al. 1983; Dubovi 1997). Sampai saat ini uji HA dan HI masih merupakan uji yang paling sering digunakan untuk diagnosa CPV (Deepa dan Saseendranath 2002; Heerden
et al. 2002).
Beberapa kendala dalam uji hemaglutinasi diantaranya membutuhkan darah
babi atau monyet ekor panjang yang ditidak mudah diperoleh, sel darah merah tersebut hanya dapat disimpan selama 2-3 minggu, memerlukan waktu untuk menyiapkan sel
"
bedloresen bila disinari dengan sinar ultraviolet. Misalnya zat warna fluorescein isothiocynate (FITC) yang berwarna hijau atau tetramethylrhodamine isothiayanate
yang berwarna merah. Dengan demikian letak antigen virus dalam jaringan dapat diketahui karena terbentuknya kompleks antigen antibodi yang memancarkan warna
pada pengamtan di bawah mikroskop ultraviolet.
Uji antibodi floresen banyak digunakan oleh laboratorium diagnostik komersil
Kendala penggunaan uji sntibodi floresen adalah membutuhkan waktu lebih lama
karena menggunakan teknik biakan jaringan dan konsentrasi titer antibodi hams tinggi, serta fasilitas rnikroskop floresen yang sangat mahal (Dubovi, 1997; Joshi et al. 1998).
d. Enzim Linked immunosorbent Assay (ELISA)
Prinsip dasar uji Elisa hampir sama dengan uji antibodi floresen, perbedaannya adalah antibodi tidak diwarnai tetapi disenyawakan dengan enzim. -Penerapan metode
ini dimulai sejak diketahui bahwa protein termasuk antigen virus dapat melekat pada permukaan plastik polystyrene, dengan demikian antigen atau antibodi dapat diabsorbsi
pada permukaan lempeng plastic untuk tujuan identi fikasi.
Menurut Ok et al. (2000) pemeriksaan serologis terhadap CPV dengan Elisa
sama sensitifnya dengan uji HI dan penelitian Deepa dan Saseendranath (2000)
menunjukkan bahwa Elisa lebih sensiti f dari pada AGID (Agar Gel Immunod~jision test ) dan CIEP (Counter Immunoelectrophoresis).
Elisa dapat digunakan sebagai uji penyaringan terhadap sampel dalarn jumlah
banyak dan relatif cepat, pembacaan hasil dapat dilakukan secara visual sehingga tidak membutuhkan peralatan khusus (Deepa dan Saseendranath 2000). Akhir-akhir ini, telah
pengenceran rendah sehingga hams dikonfirmasi dengan uji HI dengan menggunakan
spesifik antiserum dan prosedur HA sulit untuk diterapkan pada pemakaian mesin
semiotomatis (Mathys et al. 1983).
c. Uji Antibodi Floresen
Prinsip dasar uji antibodi floresen adalah antibodi diwarnai oleh zat warna
bedoresen bila disinari dengan sinar ultraviolet. Misalnya zat warna fluorescein
isothiocynate (FITC) yang berwarna hijau atau tetrarnethylrhodamine isothiocyanate
yang berwarna merah. Dengan demikian letak antigen virus dalam jaringan dapat
diketahui karena terbentuknya kompleks antigen antibodi yang memancarkan warna
pada pengamtan di bawah mikroskop ultraviolet.
Uji antibodi floresen banyak digunakan oleh laboratorium diagnostik komersil
Kendala penggunaan uji sntibodi floresen adalah membutuhkan waktu lebih lama
karena menggunakan teknik biakan jaringan dan konsentrasi titer antibodi harus tinggi,
serta fasilitas mikroskop floresen yang sangat mahal (Dubovi, 1997; Joshi et al. 1998).
d. Enzim Linked immunosorbent Assay (ELISA)
Prinsip dasar uji Elisa hampir sama dengan uji antibodi floresen, perbedaannya
adalah antibodi tidak diwarnai tetapi disenyawakan dengan enzim. -Penerapan metode
ini dimulai sejak diketahui bahwa protein termasuk antigen virus dapat melekat pada
permukaan plastik polystyrene, dengan demikian antigen atau antibodi dapat diabsorbsi
pada permukaan lempeng plastic untuk tujuan identifikasi.
Menurut Ok et al. (2000) pemeriksaan serologis terhadap CPV dengan Elisa
sama sensitifhya dengan uji HI dan penelitian Deepa dan Saseendranath (2000)
menunjukkan bahwa Elisa lebih sensitif daripada AGlD (Agar Gel Immunodrffirsion
test ) dan CIEP (Counter Immunoelectrophoresis).
Elisa dapat digunakan sebagai uji penyaringan terhadap sampel dalam jumlah
banyak dan relatif cepat, pembacaan hasil dapat dilakukan secara visual sehingga tidak
membutuhkan peralatan khusus (Deepa dan Saseendranath 2000). Akhir-akhir ini, telah
3. Pemeriksaan Virologis
Infeksi CPV tipe enteritis stadium akut, lebih dari lo9 partikel virus berada
dalam feses dan dapat bertahan selama 4 bulan dilingkunga~ya. Dengan demikian
selain sebagai sumber utama penularan infeksi CPV, feses juga berperan sebagai
substrat untuk diagnosa CPV (Mathys et al. 1983; Mildbrand et al. 1984; Hirasawa et
al. 1994). Pengambilan feses untuk isolasi virus lebih baik langsung dari rektum untuk
menghindari kontaminasi (Carman dan Povey 1985; Hoskins 1997).
CPV dalam feses dapat dideteksi dengan beberapa metoda seperti isolasi virus
dalam biakan jaringan, HA, Mikroskop Elektron (ME), Elisa dan DNA hybridization
(Mochizuki et al. 1984; Hirasawa et al. 1994; Savic-Jevdenic et al. 200 1).
Canine Parvovirus juga dapat diisolasi dari epitel lidah, rongga mulut dan
esophagus, usus halus, sumsum tulang, jaringan limfoid, organ p a r u - p a , limpa, hati,
ginjal dan otot jantung karena merupakan lokasi perkembangan CPV (Macartney et al.
1984; Hoskins 1997). Dari jaringan tersebut dengan mudah dapat diisolasi CPV dengan menggunakan sistem biakan jaringan selarna virion belurn dibalut oleh antibodi.
Bila anjing masih hidup, feses merupakan sampel terbaik untuk isolasi CPV (Hoskins
1997).
Isolasi dari feses dengan menggunakan biakan jaringan tidak
-
dilakukan oleh praktisi dokter hewan karena memerlukan fasilitas laboratorium, keahlian khusus sertamemerlukan waktu dan biaya yang besar. Menurut Cavalli et al. (2001), isolasi CPV pada biakan jaringan sangat sulit dan membutuhkan beberapa pasase dalam biakan
jaringan ginjal kucing.
Identifikasi dan deteksi CPV dapat dilakukan dengan beberapa cara yaitu: a. Mikroskop Elektron
Identifikasi CPV dapat dilakukan dengan mengunakan mikroskop elektron.
Mikroskop elektron dapat mendeteksi beberapa partikel dalam feses dengan melihat morfologinya (William 1980). Menurut Mathys et al. (1983) identifikasi CPV dengan
menggunakan mikroskop elektron sulit dilakukan dilaboratorium ataupun di klinik
hewan karena membutuhkan peralatan khusus dan waktu banyak serta biaya yang mahal.
b. Uji Hemaglutinasi
Infeksi Canine Parvovirus merupakan penyakit virus yang menular dan fatal
Savic-Jevdenic et al. (2001) menunjukkan bahwa dengan uji hemaglutinasi (HA), dapat
mendeteksi CPV dalam feses sehari setelah munculnya gejala klinis, sehingga cepat
melakukan pengobatan terhadap infeksi CPV. Uji HA merupakan uji yang biasa
dilakukan di klinik dengan menggunakan sel darah merah babi atau monyet ekor
panjang. Uji ini dianggap cukup sensitif dan cukup tinggi korelasinya dengan keberhasilan pengobatan (Sajuthi 2001). Adanya hemaglutinasi yang dibentuk oleh CPV merupakan ha1 penting karena sebagai karakteristik sempurna dari virus parvo
(Carmichael et al. 1980). Namun perlu dilanjutkan dengan uji HI dengan menggunakan
antibodi yang spesifik terhadap CPV untuk mengetahui apakah isolat virus yang diperoleh tersebut adalah CPV (Cavalli et al. 2001), karena menurut Hoskins (1997),
ada beberapa macam virus yang dapat diisolasi dari feses yang berasal dari anjing yang
mengalami enteritis. Virus tersebut antara lain coronavirus, rotavirus, astrovirus,
herpesvirus, enterovirus, calicivirus dan parainfluenza. Sebagian virus tersebut juga dapat mengaglutinasi sel darah merah.
c. Enzim Linked immunosorbent Assay (ELISA)
Elisa merupakan uji yang cepat dan sensitif untuk mendeteksi antigen CPV
pada sampel feses anjing. Akhir-akhir ini telah dikembangkan antibodi monoclonal
yang sangat spesifik terhadap CPV. Penggunaan antibodi monoklond menyebabkan uji
ini sangat spesifik dan dapat dilihat secara visual. Banja et al. (2002), menggunakan
Elisa untuk mendeteksi CPV saat terjadi wabah di Bhubaneswar pada 171 ekor anjing dengan gejala muntah dan diare. Korelasi dengan uji HA sebesar 2 95 % (Mildbrand
et al. 1984). Elisa dapat membedakan konsentrasi Ig G dan Ig M. Peningkatan
konsentrasi Ig M pada minggu pertarna infeksi CPV setelah itu diikuti peningkatan konsentrasi Ig G (Hoskins 1 997). Sampai saat ini Elisa merupakan alat diagnostik yang
penting untuk mendiagnosa CPV (Ok et al. 2000).
d. Polymerase Chain Reaction (PCR)
Teknik baru telah dikembangkan dalam mengamplifikasi DNA secara invitro
yang dikenal dengan teknik Polymerase Chain Reaction (PCR) telah digunakan untuk
diagnosa CPV, meskipun PCR sangat mahal, serta memerlukan ketrarnpilan khusus
Lebih lanjut teknik PCR mampu mendeteksi antigen yang telah dibalut antibodi maupun virus yang telah mati. PCR dapat digunakan sebagai altematif dari uji
konvensional seperti isolasi virus pada biakan jaringan yang membutuhkan waktu lama.
Deteksi antigen yang cepat dan spesifik pada sampel feses dapat dilakukan dalam sehari
sehingga terjadinya infeksi CPV dapat dideteksi lebih awal. Penelitian Meerarani et al.
(1996) menunjukkan bahwa PCR 72,9% antigen CPV dari 270 sampel feses sedangkan
dengan uji HA, hanya 61,1% antigen CPV terdeteksi. Data tersebut menunjukkan
bahwa PCR lebih sensitif dibandingkan dengan uji HA.
4. Pemeriksaan Patologi dan Histopatologi
Pemeriksaan patologi dan histopatologi merupakan penunjang bagi diagnosa CPV. Iierusakan yang ditimbulkan oleh CPV tergantung dari stadium dan daya tahan
tubuh anj ing tersebut.
a. Patologi dan Histopatologi Tipe Miokarditis
Perubahan makroskopik pada anak anjing yang mati mendadak tidak
menunjukkan adanya kelainan jantung, tetapi ada oedema pada paru-pam (Robinson et
al. 1980).
Perubahan mikroskopik, terlihat adanya miokarditis difusa non supuratif dengan infiltrasi limfosit, makrofag, sel plasma dan neutrofil. Pada sel miokardium terlihat
badan inklusi yang bersifat basofilik (Robinson et al. 1980).
b. Patologi dan Histopatologi Tipe Enteritis
Secara patologi dan histopatologi CPV enteritis memperlihatkan adanya lesi terutarna pada jaringan duodenum, jejunum, ileum dan limfonodus mesenterika (Miura
MATERI DAN METODE PENELITIAN
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Virologi Balai Penelitian Veteriner
(Balitvet) di Bogor, Laboratorium Virologi Balai Besar Pengujian Mutu dan Sertifikasi
Obat Hewan (BBPMSOH) di Gunungsindur Bogor dan Laboratorium Patologi Klinik
Fakultas Kedokteran Hewan Institut Pertanian Bogor selama 6 bulan mulai bulan Mei
2004 sarnpai dengan Oktober 2004.
Materi Penelitian
1. Hewan Percobaan:
Penelitian ini menggunakan enam ekor anak anjing lokal berumur 1 bulan
berasal dari Desa Karya Mekar, Kecamatan Cariy Kabupaten Daerah Tingkat I1 Bogor
dari ppulasi anjing yang bebas infeksi Canine Parvovirus (CPV) dengan riwayat belum
pemah divaksinasi. Terlebih dahulu anak anjing tersebut diambil darahnya untuk
mengetahui ada tidaknya antibodi terhadap CPV dengan menggunakan uji hambatan
hemaglutinasi (HI). Anak anjing yang digunakan pada penelitian ini harus negatif antibodi CPV atau mempunyai titer antibodi <8 HI Unit (HIU), dalam kondisi sehat, dan bebas terhadap infeksi parasit cacing maupun penyakit kulit. Dua minggu sebelum
perlakuan, anak anjing diberikan obat anti cacing yaitu drontal plus (Bayer) dengan
dosis 1 tablet per 10 kg berat badan. Selama perlakuan anak anjing ditempatkan pada kandang yang terpisah (Gambar 1).
2. Isolat lokal CPV:
Bahan yang akan diinokulasikan adalah isolat lokal yang telah diidentifikasi
sebagai virus CPV dengan kode RIVS 57 yang diperoleh dari bagian Virologi, Balai
Penelitian Veteriner (Balitvet), Bogor (Sendow dan Hamid 2004). Isolat tersebut berasal dari kerokan mukosa usus anjing yang terinfeksi CPV dengan gejala diare
berdarah yang ditumbuhkan ke dalam biakan jaringan ginjal kucing (Feline Kidney =
3. Sel Darah Merah Babi:
Sel darah merah babi digunakan dalam uji HA dan HI. Sel darah merah babi
diperoleh dari Rumah Potong Hewan (RPH) Kotamadya Bogor. Sel Darah merah babi
dicampur dengan larutan Alsever's (Lampiran Pembuatan Media Nomor 1) dengan perbandingan 1 bagian sel darah merah babi dan 1 bagian larutan Alsewer's dan
disimpan dalam keadaan dingin. Sampai dilaboratorium sel darah merah babi tersebut di
sentrifus (Lampiran Bahan dan Alat Nomor 30) pada kecepatan 750xg selama 10 menit,
kemudian cairan bagian atas sel darah merah dibuang selanjutnya ditambahkan larutan
Alsever's dengan perbandingan 1 bagian sel darah merah babi dan 4 bagian larutan Alsever's. Cairan tersebut disimpan pada suhu 4OC sampai akan digunakan. Larutan stock sel darah merah dapat disimpan paling lama 3 minggu.
Metoda Penelitian
1. Isolat Lokal CPV (RIVS 57)
Isolat lokal CPV (RIVS 57) telah dipasase sebanyak 8 kali pada biakan jaringan
ginjal kucing (Feline Kidney = FK) sebelum digunakan pada penelitian ini. Isolat
tersebut disimpan pada suhu -70' C, kemudian ditumbuhkan kembali pada biakan
jaringan FK.
-
a. Propagasi Biakan Jaringan Ginjal Kucing (Feline Kidney = FK)
Biakan jaringan FK yang telah membentuk sel selapis (monolayer) pada tissue
culturefrask besar (75 cm2)(Lampiran Bahan dan Alat Nomor 42) dipropagasi dengan
cara membuang media pada biakan jaringan FK. Umumnya biakan jaringan FK sudah
membentuk sel selapis berumur 3 sampai 4 hari, kemudian di cuci dengan PBS steril
(Lampiran Pembuatan Medium Nomor 16) sebanyak 2 kali sebelum ditambahkan 1'5
ml Tripsin Versen EDTA (ATV) (Lampiran Pembuatan Medium Nomor 21). Biakan
jaringan FK diinkubasikan pada suhu 37°C (Lampiran Bahan dan Alat Nomor 13)
selama 3-5 menit sambil sesekali digoyang dan dilanjutkan dengan pipeting yaitu
dengan menghisap dan menyemburkan secara hati-hati suspensi tersebut menggunakan pipet 5 ml steril (Lampiran Bahan dan Alat Nomor 29) sehingga sel-selnya lepas. Sel-
sel yang lepas akan terlihat jelas dibawah mikroskop (Lampiran Bahan dan Alat Nomor
23)' selanjutnya ditambahkan media penumbuh (GM) (Lampiran Pembuatan Media
Bahan dan Alat Nomor 36), disentrifis (Lampiran Bahan dan Alat Nomor 31) dengan
kecepatan 750xg selama 10 menit. Supernatan dibuang dan pelet ditambahkan 40 ml
media penumbuh (GM) ((Lampiran Pembuatan Media Nomor 11) dan dimasukkan
kedalam 2 tissue culture flask besar (75 cm2) (Lampiran Bahan dan Alat Nomor 42)
masing-masing 20 ml, kemudian diinkubasikan pada suhu 37°C (Lampiran Bahan dan Alat No 13). Skema prosedur propagasi biakan jaringan FK dapat dilihat pada Bagan 2.
b. Propagasi Isolat Lokal CPV (RIVS 57)
Isolat lokal CPV (RIVS 57) diperbanyak dalam biakan jaringan FK yang
ditumbuhkan pada tissue cultureflask kecil(25 cm2) (Lampiran Bahan
dan
Alat Nomor41). Media biakan jaringan FK yang telah membentuk 40% jaringan selapis, dibuang
secara aseptis menggunakan pipet 5 ml steril (Lampiran Bahan dan Alat Nomor 29),
kemudian dengan menggunakan pipet single channel 1000 pl (Lampiran Bahan dan
Alat Nomor 33) ditambahkan 300 pl isolat yang telah mengalami bekucair sebanyak 3
kali dan diinkubasikan dalam inkubator pada suhu 37" C (Lampiran Bahan dan Alat
Nomor 13) selama 1 jam sebelum ditambahkan media pemelihara (MM) (Lampiran
Pembuatan Media Nomor 10). Sel tersebut diamati selama 5 sampai 7 hari untuk
melihat ada tidaknya CPE, apabila CPE mencapai 80-90%, maka sel dan cairan dipanen
untuk kemudian dilakukan uji kandungan virus. Skema prosedur pr&pagasi isolat lokal CPV (RIVS 57) dapat dilihat pada Bagan 3.
c. Uji Kandungan Virus
Inokulum yang akan dititrasi dibekucairkan terlebih dahulu sebanyak 3 kali,
kemudian disentrifus (Lampiran Bahan dan Alat Nomor 30) dengan kecepatan 750xg
selama 10 menit. Supernatan dikoleksi untuk selanjutnya diuji kandungan virusnya. Uji kandungan virus memgunakan lempeng mikrotiter 96 lubang steril dengan
dasar datar ((Lampiran Bahan dan Alat Nomor 17). Supernatan diencerkan sepuluh kali secara serial dengan pengencer media pemelihara (MM) (Lampiran Pembuatan Media
Nomor 10) dari lo-' sampai lo-* pada botol MacCartney 5 ml steril (Lampiran Bahan
dan Alat Nomor 8) atau tabung 10 ml steril (Lampiran Bahan dan Alat Nomor
.
Denganmenggunakan pipet single channel 100 pl ((Lampiran Bahan
dan
Alat Nomor 32)sebanyak 50 pl per lubang dimasukkan dari masing-masing pengenceran sebanyak 4
dibuat sebagai pembanding dan disertakan pada lempeng mikrotiter yang sarna.
Sebanyak 100 pl biakan jaringan FK dalam media penumbuh dengan konsentrasi sel 2x10' per ml dimasukkan pada masing-masing lubang dengan meggunakan pipet multichannel 50pl-300 pl (Lampiran Bahan dan Alat Nomor 26), selanjutnya
diinkubasikan pada inkubator 37OC yang mengandung 5% COz (Lampiran Bahan dan
Alat Nomor 14). Pengamatan akan terjadinya CPE dilakukan setiap hari selama 5 sampai 7 hari. Skema prosedur uji kandungan virus dapat dilihat pada Bagan 4. Hasil
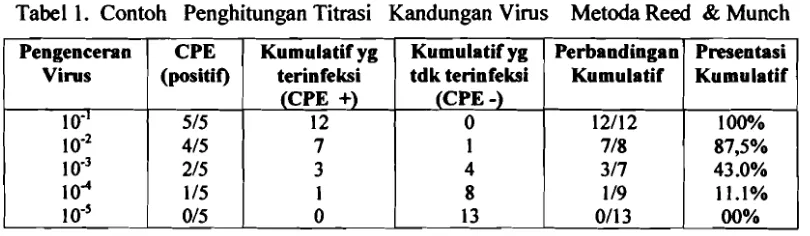
yang diperoleh dihitung dengan metoda Reed&Munch (1938) (Tabel 1).
Tabel 1. Contoh Penghitungan Titrasi Kandungan Virus Metoda Reed & Munch
Rumus TCIDso (Tissue Culture Infective Dose):
PD (Proportionate Distance) =
.
Diatas 50%
-
50%) = 87.5-
50 = 37.5 = 0,86(Diatas 50%
-
Dibawah 50%) 87,5-
43 4 3 32. Inokulasi Isolat Lokal CPV (RIVS 57):
Enam ekor anak anjing lokal yang telah diuji tidak mengandung antibodi
terhadap CPV, dan dinyatakan sehat diinokulasikan isolat lokal CPV (RIVS 57)
dengan dosis 1 0 ~ ~ ~ TCIDsdml (Tabel 2). Anak anjing tersebut telah berumur 2 bulan
saat digunakan pada penelitian ini.
Pengenceran Virus
lo-]
10" 1
u3
1
o4
10" perbandingany Kumulatif 12/12 7/8 317
1 I9 011 3
Kumulatif yg terinfeksi
(CPE
+)
12 7 3 1 0 CPE (positit) 515 415 2/5
1 I5 0/5
Presentasi Kumulatif
1
ow
87,5% 43.0% 11.1% 00% Kumulatif yg tdk terinfeksi
(CPE -)
0
1
4
[image:46.594.112.517.245.363.2]Tabel 2. Dosis Inokulasi Isolat Lokal CPV (RIVS 57)
Dua ekor anak anjing diinokulasikan isolat lokal CPV (RIVS 57) secara oral
sebanyak 50 ml per ekor (Gambar 2) dan empat ekor anak anjing diinokulasikan secara
intrmena sebanyak 5 ml per ekor (Gambar 3). Pengamatan gejala klinis dilakukan
setiap hari selama 21 hari. Suhu dicatat setiap pagi hari sehari sebelum inokulasi
sampai 21 hari setelah inokulasi. Selain gejala klinis, peubah lainnya seperti gambaran hematologi, hasil serologi dan ekskresi virus melalui feses juga diamati.
3. Pengarnbilan Sampel
a. Darah (dengan EDTA)
Darah dianbil dari anak anjing melalui vena cephalica antibrachii atau vena
saphena magna (Gambar 4). Sampel darah dimasukkan dalam tabung yang
mengandung ethylene diamine tetraacetic acid (EDTA) (Lampirh Bahan dan Alat
Nomor 44) diambil pada hari ke 0, 1, 3 dan 7. Pemeriksaan jumlah sel darah putih
(leukosit) total dilakukan di laboratorium Sekar Mandapa Bogor dan diferensiasi sel
leukosit diperiksa dengan preparat ulas darah yang difiksasi dengan methanol dan
diwarnai dengan Giemsa-May Grumvald
Titer 1 0'.VcID5d ml lo5,' TCID5d ml lo5.' TCID5d ml lo5.' TCID5d ml lo5,' TCID5d ml
1 05.' TCID5 d ml No. 1 2 3 4 5 6
b. Serum
Darah diambil pada hari ke-0 sampai hari ke-7, hari ke-10, hari ke-14, hari ke-
17 dan hari ke-2 1 pasca inokul