SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
CHOLILIA ABADIATUL MASRUROH
TINGKAT KEJADIAN
Escherichia coli
PENGHASIL
EXTENDED
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Tingkat Kejadian
Escherichia coli Penghasil Extended Spectrum Β-Lactamase pada Feses Ayam
Ras Pedaging di Kota Bogor adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016
Cholilia Abadiatul Masruroh
NIM B251140021
RINGKASAN
CHOLILIA ABADIATUL MASRUROH. Tingkat Kejadian Escherichia coli
Penghasil Extended Spectrum Β-Lactamase pada Feses Ayam Ras Pedaging di Kota Bogor. Dibimbing oleh MIRNAWATI B. SUDARWANTO dan HADRI LATIF.
Resistensi antibiotik merupakan masalah penting dalam dunia peternakan karena bakteri meningkatkan respon pertahanan diri terhadap antibiotik. Penggunaan antibiotik golongan Sefalosporin generasi ketiga untuk hewan penghasil pangan menyebabkan munculnya bakteri penghasil Extended Spectrum β-laktamase. Extended Spectrum β-laktamase (ESBL) banyak ditemukan di bakteri Escherichia coli pada beberapa tahun terakhir. Keberadaan E. coli
penghasil ESBL tersebut tidak hanya ditemukan pada manusia, namun juga pada sebagian besar hewan termasuk hewan ternak serta pada pangan. Gen pengkode ESBL diketahui terdapat di dalam plasmid sehingga mudah ditransfer oleh satu spesies bakteri ke spesies bakteri lain. Masalah kesehatan yang muncul akibat adanya E. coli penghasil ESBL antara lain terjadinya multidrug resistance,
kesulitan dalam deteksi dan pengobatan, serta meningkatnya angka kematian. Penelitian ini bertujuan untuk mengetahui tingkat kejadian E. coli penghasil
ESBL dan pola resistensinya terhadap antibiotik dari feses ayam ras pedaging di Kota Bogor.
Penelitian dilaksanakan pada bulan Juli 2015 sampai Januari 2016. Sebanyak 100 sampel feses diambil dari Sentra Pemotongan Ayam Kota Bogor. Isolasi E. coli dilakukan dengan menumbuhkan bakteri pada agar MacConkey lalu diidentifikasi menggunakan kit API 20E. Konfirmasi E. coli sebagai
penghasil ESBL dilakukan dengan metode cakram ganda. Pada penelitian ini digunakan Klebsiella pneumoniae ATCC 700603 dan Escherichia coli ATCC 25922 sebagai kontrol. Adapun pengujian kepekaan E. coli terhadap antibiotik
selain Sefalosporin generasi ketiga (sulfametaksazol, ampisilin, doksisiklin, kanamisin, streptomisin, dan eritromisin) dilakukan dengan metode disk diffusion.
Escherichia coli yang ditemukan dari penelitian ini sebesar 16 isolat dan
25%nya merupakan E. coli penghasil ESBL. Tingkat resistensi terhadap antibiotik
selain Sefalosporin generasi ketiga yaitu 93.7% (ampisilin), 75% (streptomisin), 68.75% (eritromisin), 62.5% (sulfametoksazol), 18.75% (doksisiklin), dan 6.25% (kanamisin). Hasil penelitian menunjukkan bahwa E. coli dari feses ayam ras
pedaging di Kota Bogor bersifat multidrug resistance. Sifat multidrug resistance
terhadap antibiotik golongan sefalosporin generasi ketiga dan golongan lain sering ditemukan pada bakteri penghasil ESBL. Bakteri komensal indikator yang bersifat
multidrug resistance dapat menjadi masalah kesehatan karena E. coli mampu
mentransfer gen resistennya kepada bakteri patogen.
SUMMARY
CHOLILIA ABADIATUL MASRUROH. The Occurance of Extended Spectrum β-Lactamase-Producing Escherichia coli from Broiler Chicken Feces in Bogor.
Supervised by MIRNAWATI B. SUDARWANTO and HADRI LATIF.
Antibiotical resistance is a major threat that is now facing because bacteria have developed a strong defensive response to the increasing use of antibiotics. The use of third generation cephalosporins in food animal production leads to Extended Spectrum β-lactamase producing bacteria. An increasing number of extended-spectrum β-lactamases (ESBLs) have been identified in Escherichia coli
during the last few years. They were not only detected in humans, but also in food animals and in food. ESBL-encoding genes are often carries on plasmids, wich can easily be transferred between species. The problems wich associated with ESBL-producing E. coli include multidrug resistance, difficulty in detection and
treatment, and increased mortality. The objective of this study was to determine the occurance and antibiotic sensitivity pattern of ESBL-producing E. coli isolated
from broiler faeces in Bogor.
Faecal samples (n=100) were collected from Centers of Chicken Slaughterhouse in Bogor from July 2015 to January 2016. Escherichia coli were
isolated using MacConkey agar and were identified by API 20E kit. ESBL-producing bacteria were tested using double disk method. Klebsiella pneumoniae
ATCC 700603 and Escherichia coli ATCC 25922 were used for the quality
control of the ESBL testing methods. Furthermore, the susceptibilty of E. coli to
other antibiotics (sulfamethoxazole, ampicillin, doxycycline, kanamycin, streptomycin, and erytromycin)was determined by disk diffusion test.
The result of this study showed tha the total of Escherichia coli were 16
isolates and 25% were found to be ESBL producers. Among the 16 isolates, resistance rate was very high for ampicillin (93.75%), followed by streptomycin (75%), erytromycin (68.75%), sulfamethoxazole (62.5%), doxycycline (18.75%), dan kanamycin (6.25%). These findings suggested that the Escherichia coli
isolates were multidrug resitance. Occurance of multidrug resistance to the third generation cephalosporins and other antibiotics was common among ESBL producers. The multidrug resistance in commensal indicator bacteria cause public health implications, since the bacteria that consist of resistant gene may spread resistance to pathogens.
©
Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
TINGKAT KEJADIAN
Escherichia coli
PENGHASIL
EXTENDED
SPECTRUM β
-LACTAMASE
PADA FESES AYAM
RAS PEDAGING DI KOTA BOGOR
PRAKATA
Segala puji dan syukur penulis panjatkan kepada kehadirat Allah SWT, atas limpahan rahmat, ridlo, hidayah, dan inayah-Nya sehingga penulis dapat menyelesaikan studi magister dan tesis ini sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada program studi Kesehatan Masyarakat Veteriner, Sekolah Pascasarjana, IPB. Shalawat dan salam semoga selalu tercurahkan kepada Nabi Muhammad SAW.
Ucapan terimakasih penulis ucapkan kepada komisi pembimbing, Prof Dr Drh Mirnawati B. Sudarwanto dan Dr Drh Hadri Latif, MSi yang telah bersedia dengan tulus membimbing, menuntun, memberi masukan berharga, memberi dorongan semangat, serta meluangkan waktu selama penulis melakukan penelitian, pembimbingan, penulisan karya ilmiah, dan menyelesaikan studi. Terima kasih penulis ucapkan kepada Bapak Dr Drh Trioso Purnawarman, MSi selaku dosen penguji luar komisi yang telah banyak memberikan saran dan perbaikan dalam penyelesaian tesis ini. Ucapan terima kasih juga penulis sampaikan kepada Dr Drh Yusuf Ridwan, MSi selaku Ketua Departemen Ilmu Penyakit Hewan dan Kesmavet FKH-IPB dan Dr Drh Denny Widaya Lukman, MSi sebagai Ketua Program Studi Kesehatan Masyarakat Veteriner FKH-IPB beserta seluruh staf kependidikan.
Penghargaan dan ucapan terima kasih juga penulis sampaikan kepada Kepala Laboratorium Kesehatan Masyarakat Veteriner, FKH IPB yang telah memberikan ijin untuk melakukan pengujian di Laboratorium Kesmavet FKH IPB. Ucapan terima kasih juga penulis haturkan untuk rekan-rekan mahasiswa pascasarjana S2 KMV angkatan 2014 yang telah bersama-sama dalam menempuh pendidikan di kampus FKH IPB yang selalu memberi semangat dan dorongan sehingga studi ini dapat diselesaikan.
Terima kasih kepada ayahanda Abdur Rohman dan Ibunda Eka Mutamimatuz Zuhro serta keluarga atas doa, dukungan, semangat, motivasi, dan kasih sayangnya. Penulis menyadari bahwa karya ilmiah ini masih jauh dari kesempurnaan sehingga diharapkan adanya saran dan kritik yang dapat membangun pada masa mendatang. Semoga tesis ini dapat bermanfaat bagi semua pihak.
Bogor, April 2016
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Hipotesis Penelitian 2
Rumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
Bakteri Escherichia coli 3
Extended Spectrum β-lactamase (ESBL) 4 Escherichia coli Penghasil ESBL 5
Escherichia coli Penghasil ESBL dalam Pangan Asal Hewan 6
Gen-gen yang Berpengaruh terhadap Keberadaan ESBL pada E. coli 7
Kejadian Cemaran Bakteri Penghasil ESBL 7
3 METODE 8
Waktu dan Tempat 8
Bahan dan Alat 8
Besaran Sampel 9
Penarikan Sampel 9
Analisis Laboratorium 9
Isolasi dan Identifikasi E.coli 9
Konfirmasi ESBL 10
Kepekaan E. coli Terhadap Antibiotik Lain 10
Analisis Data 11
4 HASIL DAN PEMBAHASAN 12
5 SIMPULAN DAN SARAN 18
DAFTAR PUSTAKA 18
LAMPIRAN 24
DAFTAR TABEL
1 Klasifikasi β-laktamase 5
2 Kriteria biokimia bakteri E. coli 10
3 Isolat bakteri penghasil ESBL 13
4 Kepekaan E. coli terhadap berbagai antibiotik 15
DAFTAR GAMBAR
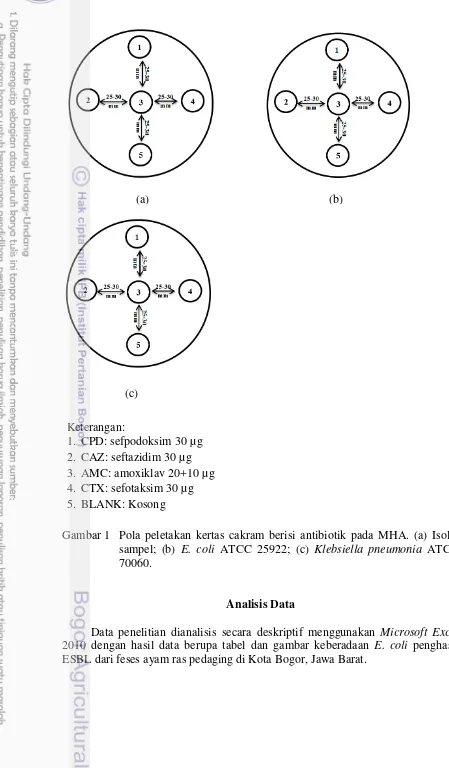
1 Pola peletakan kertas cakram berisi antibiotik pada MHA 11
2 Isolat bakteri penghasil ESBL 13
DAFTAR LAMPIRAN
1
1 PENDAHULUAN
Latar Belakang
Antibiotik merupakan agen antimikrobial yang banyak digunakan dalam dunia peternakan. Penggunaan antibiotik selain bertujuan untuk menghambat infeksi bakteri pada ternak, juga digunakan sebagai bahan tambahan dalam pakan agar ternak mengalami percepatan pertumbuhan (Santos et al. 2013). Penggunaan antibiotik pada hewan dapat mendorong terjadinya resistensi antibiotik, salah satunya E. coli yang menghasilkan Extended Spectrum β-lactamase (ESBL) (Santos et al. 2013; Hammerum et al. 2014; Suardana et al. 2014). Hubungan antara penggunaan antibiotik dan resistensi antibiotik didukung oleh bukti kronologis, biologis, dan epidemiologis yang telah lama dikenal. Hewan penghasil pangan termasuk ayam mengandung bakteri resisten ketika ternak diberi pakan dengan penambahan antibiotik, sehingga bakteri resisten tersebut dapat menyebar melalui pangan asal hewan (Hammerum et al. 2014).
Resistensi antibiotik merupakan masalah penting dalam kesehatan hewan dan manusia. Bakteri yang secara alamiah memiliki gen resisten terhadap antibiotik dapat mentransfer gen tersebut kepada bakteri lain. Selain itu, bakteri juga mampu menghasilkan enzim yang bekerja menghambat kinerja antibiotik (Aidara-Kane et al. 2013). Umadevi et al. (2011) mengatakan bahwa perkembangan resistensi antibiotik telah meluas di seluruh dunia. Resistensi antibiotik Sefalosporin generasi ketiga pada umumnya terjadi pada bakteri Gram negatif dengan menghasilkan Extended Spectrum β-lactamase (ESBL). Produksi ESBL tersebut merupakan mekanisme penting yang bertanggung jawab terhadap resistensi sefalosporin generasi ke 3. Selama beberapa dekade, bakteri Gram negatif berbentuk batang penghasil ESBL telah menjadi masalah utama di berbagai bidang. Peningkatan jumlah bakteri penghasil ESBL telah diidentifikasi selama beberapa tahun terakhir. Bakteri penghasil ESBL tidak hanya ditemukan di manusia, namun juga pada hewan ternak, dan di lingkungan sekitar hewan ternak. Bakteri penghasil ESBL, seperti E. coli dapat diisolasi dari berbagai hewan penghasil pangan yang diketahui merupakan reservoir bagi E. coli penghasil
ESBL (Schmid et al. 2013).
Enzim ESBL sendiri merupakan enzim yang dikode oleh plasmid yang menginaktifasi sebagian besar antibiotik golongan β-laktam, termasuk extended-spectrum dan very-broad-spectrum sefalosporin dan monobaktam. Enzim-enzim
tersebut dihambat oleh inhibitor β-laktamase, seperti asam klavulanat, sulbaktam, dan tazobaktam (Schmid et al. 2013). Gen ESBL berlokasi dalam plasmid yang dapat disebarkan dengan mudah antar dan intra spesies bakteri (Santos et al.
2013). Beberapa gen ESBL merupakan turunan mutan pengatur β-laktamase yang dimediasi oleh plasmid (seperti blaTEM/SHV) dan gen ESBL yang ditransfer melalui
lingkungan bakteri (seperti blaCTX-M) (Overdevest et al. 2011).
Beberapa kerugian yang disebabkan oleh infeksi bakteri penghasil ESBL antara lain terjadinya multidrug resistance, kesulitan dalam deteksi dan pengobatan, serta meningkatnya mortalitas (Umadevi et al. 2011). Beberapa
2
itu, hubungan sejumlah organisme yang resisten terhadap berbagai macam antibiotik akan membatasi pengobatan yang telah ada. Sebagai konsekwensinya, penderita infeksi meningkat, harus beristirahat lama di rumah sakit, dan biaya pengobatan semakin tinggi (Denisuik et al. 2012).
Indonesia merupakan negara dengan kebutuhan pangan asal hewan, terutama daging ayam yang tinggi dan belum memiliki data kasus tentang kejadian cemaran E. coli penghasil ESBL pada hewan penghasil pangan tersebut.
Oleh karena itu perlu dilakukan studi tentang cemaran bakteri penghasil ESBL sehingga peternak hewan penghasil pangan, termasuk ayam potong, diharapkan lebih bijak dalam menggunakan antibiotik. Kebijakan penggunaan antibiotik pada hewan penghasil pangan dapat bermanfaat bagi konsumen karena dapat menekan kerugian yang ditimbulkan oleh cemaran bakteri yang resisten terhadap antibiotik. Penelitian ini fokus pada keberadaan E. coli sebagai penghasil ESBL pada feses
ayam.
Hipotesis Penelitian Hipotesis penelitian ini adalah:
1. Bakteri E. coli yang terdapat dalam feses ayam potong di Kota Bogor
merupakan bakteri penghasil ESBL
2. Bakteri E. coli penghasil ESBL resisten terhadap satu atau beberapa jenis antibiotik β-laktam, yaitu sefpodoksim, seftadizim, dan sefotaksim.
Rumusan Masalah
Penggunaan antibiotik yang tidak bijak pada hewan ternak merupakan salah satu penyebab munculnya resistensi antibiotik pada bakteri. Salah satu bakteri yang resisten adalah E. coli yang menghasilkan ESBL. Bakteri E. coli penghasil
ESBL yang umumnya terdapat di saluran pencernaan hewan, khususnya ayam, dapat mencemari lingkungan dan menyebar melalui rantai makanan yang dapat berdampak pada hewan dan manusia. Selain itu, bakteri resisten ini dapat mentransfer materi genetiknya kepada bakteri lain baik secara langsung maupun tidak langsung. Resistensi E. coli memberikan dampak negatif terhadap peternakan, misalnya terjadinya multidrug resistance, meningkatnya infeksi ternak, waktu perawatan ternak yang semakin lama, dan penurunan produksi ternak. Selain berdampak bagi peternakan, masalah resistensi ini juga memberi dampak pada kesehatan masyarakat.
Tujuan Penelitian
Penelitian bertujuan untuk mendeteksi tingkat kejadian E. coli penghasil
3
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang keberadaan bakteri E. coli penghasil ESBL, khususnya yang berasal dari feses ayam ras
pedaging. Informasi tersebut dapat menjadi referensi bagi pemerintah dalam menekan penyebaran bakteri penghasil ESBL, khususnya E. coli, ke rantai
makanan dan lingkungan.
2 TINJAUAN PUSTAKA
Bakteri Escherichia coli
Bakteri E. coli dikenal sebagai golongan bakteri flora normal yang biasa
ditemukan di dalam saluran pencernaan manusia dan hewan. Meskipun merupakan flora normal, bakteri ini dapat menimbulkan beberapa gangguan kesehatan, seperti diare, infeksi saluran urin, kram perut, mual, gangguan saluran pernafasan, dan pneumonia. Infeksi tersebut muncul ketika manusia mengonsumsi makanan atau air yang terkontaminasi serta melalui kontak dengan manusia atau hewan yang telah terinfeksi (ECDC 2015; PHAC 2014; CDC 2015).
Pusat pengendalian dan pencegahan penyakit dunia (Centres for Disease Control and Prevention) (2015) membagi bakteri E. coli berdasarkan sifat patogenitasnya menjadi lima jenis, yaitu:
1. Bakteri E. coli enterotoksigenik (Enterotoxigenic E. coli/ ETEC)
Berbeda dengan STEC, bakteri yang tergolong ETEC jarang dikaitkan sebagai agen penyebab foodborne disease namun dikaitkan dengan penyebab diare
yang menyebar melalui air. Bakteri golongan ini dikenal sebagai agen penyebab diare oleh adanya toksin yang disekresi oleh baktei ETEC di dalam saluran usus yang dapat menstimulasi sekresi cairan berlebih. Toksin yang diproduksi oleh ETEC digolongkan menjadi dua, yaitu toksin yang stabil dalam pemanasan (heat stable toxin) dan toksin yang labil dalam pemanasan (heat labil toxin). Kedua toksin tersebut menyebabkan penyakit yang hampir mirip, meskipun tiap strain ETEC yang berbeda mensekresikan salah satu atau kedua toksin (CDC 2015; FDA 2013).
2. Bakteri E. coli enteropatogenik (Enterophatogenic E. coli/ EPEC)
Keberadaan bakteri yang termasuk dalam golongan EPEC dapat menyebabkan kelainan kesehatan yaitu diare berdarah atau berair yang disebut sebagai diare bayi (infantile diarrhoea). Meskipun digolongkan sebagai bakteri patogen, mekanisme virulensiya tidak berkaitan dengan sekresi enterotoksin yang dihasilkan oleh E. coli, melainkan melalui pelekatan pada dinding usus dan
proses perusakan jaringan (CDC 2015).
3. Bakteri E. coli enteroagregatif (Enteroaggregative E. coli/ EAEC)
E. coli enteroagregatif telah ditemukan di beberapa negara di dunia ini.
Penyebarannya dapat food-borne maupun water-borne. Patogenitas EAEC
4
disebabkan oleh EAEC belum jelas diketahui, tetapi diperkirakan menghasilkan sitotoksin yang menyebabkan terjadinya diare. Beberapa strain EAEC memiliki serotipe seperti EPEC. E. coli ini menyebabkan diare berair pada anak-anak dan dapat berlanjut menjadi diare persisten. Masa inkubasi diperkirakan antara 20 sampai 48 jam.
4. Bakteri E. coli enteroinfasif (Enteroinvasive E. coli/ EIEC)
E. coli enteroinfasif adalah E. coli penyerang saluran pencernaan yang dapat
menyebabkan penyakit yang dikenal sebagai bacillary dysentery (disentri yang
disebabkan oleh bakteri berbentuk batang). Tidak diketahui makanan apa saja yang mungkin menjadi sumber jenis-jenis EIEC patogenik yang menyebabkan penyakit disentri. Jenis-jenis EIEC yang menyebabkan penyakit ini berhubungan dekat dengan Shigella spp. Setelah masuk ke dalam saluran pencernaan, organisme EIEC menyerang sel epithel (sel-sel pada permukaan dinding usus bagian dalam), dan menimbulkan gejala disentri ringan, yang sering salah didiagnosa sebagai disentri yang disebabkan oleh jenis Shigella spp. Penyakit ini ditandai adanya lendir dan darah dalam kotoran individu yang terinfeksi. Dosis infektif EIEC diduga hanya sekitar 10 organisme (sama dengan Shigella ).
5. Bakteri E. coli enterohemoragis (Enterohemorrhagic E. coli/ EHEC)
Enterohemoragis berkaitan dengan konsumsi daging, buah, sayuran yang tercemar, khususnya di negara berkembang. Pangan asal hewan yang sering terkait dengan wabah EHEC di Amerika Serikat, Eropa, dan Kanada adalah daging sapi giling (ground beef). Selain itu, daging babi, daging ayam, daging
domba, dan susu segar (mentah). Serotipe utama yang berkaitan dengan EHEC adalah E. coli O157:H7, yang pertama kali dilaporkan sebagai penyebab wabah
foodborne disease pada tahun 1982-1983. Bakteri ini umumnya tinggal di usus hewan, khususnya sapi, tanpa menimbulkan gejala penyakit. Bakteri ini juga dapat diisolasi dari feses ayam, kambing, domba, babi, anjing, kucing, dan burung camar (WHO 2011).
Extended Spectrum β-lactamase (ESBL)
β-laktamase ialah kelompok enzim yang mampu menghidrolisis 4 jenis cincin antibiotik β-laktam, meliputi penisilin, sefalosporin, monobaktam, dan karbapenem. Enzim tersebut merupakan mekanisme resistensi yang paling sering dan paling penting terhadap antibiotik β-laktam. Oleh karenanya, perlu pemahaman tentang tipe β-laktamase yang diproduksi oleh berbagai jenis patogen sehingga diketahui sifat resistensinya terhadap satu atau lebih antibiotik (Parasakthi et al. 2001).
5
2004). Terdapat 4 golongan β-laktamase, yaitu Kelas A, B, C, dan D. Penjelasan tentang masing-masing kelas dirangkum dalam Tabel 1.
Tabel 1 Klasifikasi β-laktamase
Kelas Kelompok Karakteristik Jumlah enzim
A 1 Penisilinase pada Staphylococcus dan Enterococcus
23
2 Β-laktamase broad spectrum termasuk TEM-1 dan SHV-1, terutama terjadi pada bakteri Gram negatif
16
3 Extended spectrum β-lactamase (ESBL) 119
4 Β-laktamase Inhibitor-resistent TEM (IRT) 24
5 Enzim penghidrolis karbenisilin 19
6 Enzim penghidrolis kloksasilin (oksasilin) 31 7 Sefalosporinase yang dihambat oleh asam
klavulanat
20
8 Enzim penghidrolis karbapenem yang
dihambat oleh asam klavulanat
4
B Metallo-enzyme penghidrolis karbapenem
dan β-laktam lainnya kecuali monobaktam. Tidak dihambat oleh asam klavulanat
24
C Seringkali merupakan enzim kromosom
pada Gram negatif tetapi beberapa dikendalikan oleh plasmid. Tidak dihambat oleh asam klavulanat
51
D Enzim miscellaneous yang tidak sama
dengan kelompok lain
9
Sumber: Parasakthi et al. (2001)
Gen pembentuk ESBL diketahui setelah penemuan extended spectrum cephalosporin dan dikenalkan pertama kali di Eropa pada tahun 1980an. Selain itu, ESBL merupakan bentuk mutan TEM-1, TEM-2, dan SHV-1. Seringkali gen pembentuk ESBL berubah dari bentuk asli hanya dengan mengubah satu atau beberapa sekuen asam amino (Parasakthi et al. 2001). Enzim ESBL ini telah tersebar pada berbagai organisme. Enzim-enzim tersebut tidak hanya dapat menghidrolisis penisilin, namun juga antibiotik terbaru, yaitu golongan ke 3 sefalosporin dan monobaktam. E. coli penghasil ESBL dapat ditemukan di
manusia, hewan ternak, dan satwa liar, dalam jaringan saluran pencernaan, serta jaringan urin yang terinfeksi (Schaufler et al. 2015).
Escherichia coli Penghasil ESBL
6
waktu yang sangat lama meskipun tidak dibutuhkan, dapat dihubungkan sebagai faktor resiko yang secara signifikan dapat meningkatkan resistensi antibiotik (Nedbalcova et al. 2014).
Berbagai praktik di peternakan berpengaruh terhadap resistensi antibiotik, seperti pemberian pakan yang mengandung antibiotik. Selanjutnya, selama masa penggemukan, ternak juga dipelihara dengan diberi antibiotik. Praktik-praktik tersebut dihubungkan dengan kejadian produksi ESBL oleh bakteri (Haenni et al.
2014).
Hewan penghasil pangan telah dikenal sebagai reservoir bagi bakteri penghasil ESBL. Hewan penghasil pangan mampu menyebarkan bakteri yang bersifat resisten terhadap antibiotik melalui feses. Melalui feses, bakteri resisten yang terkandung dalam kotoran hewan dapat bermigrasi di sekitar peternakan, rumah potong hewan atau tempat potong unggas, dan selama pengolahan daging. Lingkungan sekitar peternakan dan rumah potong hewan atau tempat potong ayam juga akan terkontaminasi meskipun berjarak jauh dengan sumber kontaminasi. Beberapa jalur kontaminasi bakteri resisten terhadap antibiotik yang berkembang di peternakan, industri produksi pangan asal hewan atau di rumah potong hewan diantaranya pekerja yang telah terinfeksi oleh bakteri resisten yang berpotensi menyebarkan bakteri tersebut ke lingkungan atau orang di sekitarnya, air yang terdapat di industri yang telah terkontaminasi oleh bakteri resisten, dan melalui udara selama transportasi hewan (Price et al. 2007).
Escherichia coli Penghasil ESBL dalam Pangan Asal Hewan
Enterobacteriaceae, termasuk E. coli, merupakan penyebab utama infeksi yang serius, dan banyak golongan bakteri ini yang tingkat resistensinya meningkat terhadap beberapa antibiotik. Bakteri ini merupakan bakteri patogen opportunistik bagi hewan dan manusia yang bertanggungjawab dalam infeksi secara luas, antara lain infeksi saluran pencernaan, pneumonia, infeksi luka, dan septisemia. E. coli
banyak ditemukan di lingkungan dan saluran gastrointestinal baik hewan maupun manusia (Gundogan dan Avci 2013). Penyebaran E. coli yang bersifat multidrug resistance telah menjadi perhatian sebagai penyebab infeksi saluran pencernaan
dan pembuluh darah. Kecepatan dan tercapainya penyebaran bakteri E. coli jenis
ini dihubungkan dengan berbagai faktor, meliputi resistensi florokuinolon, terdapatnya gen virulen yang tinggi, memiliki alel tipe 1fimbriae FimH30, dan produksi ESBL CTX-M-15 (Petty et al. 2014).
Hubungan antara penggunaan antibiotik dan resistensi antibiotik didukung oleh bukti kronologis, biologis, dan epidemiologis. Bakteri komensal adalah bakteri yang rentan terhadap antibiotik selama perlakuan. Kerentanan bakteri tergantikan oleh sifat resistensi yang dapat menyebar ke host lain dan bakteri mampu mentransfer gen resisten tersebut kepada patogen lain. Bakteri enterik komensal resisten, diantaranya E. coli, dapat mengontaminasi rantai produk
pangan selama penyembelihan (Aidara-Kane et al. 2013). ESBL sendiri
7
enzimatik β-laktamase sehingga enzim ini dapat menghidrolisis sefalosporin generasi III dan aztreonam.
Gen ESBL pada bakteri E. coli feses telah diidentifikasi sebagai reservoir
utama di lingkungan, namun sumber utama kolonisasinya belum teridentifikasi secara jelas. Oleh karena bakteri pembawa gen ESBL adalah mikroflora normal dalam saluran gastrointestinal dan makanan merupakan sumber potensial bagi gen resisten tersebut. Keberadaan bakteri penghasil ESBL telah dilaporkan terdapat dalam hewan penghasil pangan, terutama pada ayam (Overdevest et al. 2011). Keberadaan bakteri penghasil ESBL dalam hewan penghasil pangan saat ini dikaitkan dengan masalah kesehatan masyarakat. Hal tersebut penting karena penyebaran dari hewan ke manusia dapat terjadi kapan saja (Santos et al. 2013).
Gen-gen yang Berpengaruh terhadap Keberadaan ESBL pada E. coli
Gen produksi ESBL muncul pada satu strain bakteri yang telah mengalami mutasi alamiah lalu menyebar ke strain yang lain, khususnya E. coli (HPA 2006). Enzim β-laktamase pada bakteri Gram positif dikode oleh gen yang berlokasi baik di kromosom maupun di plasmid, sedangkan pada Gram negatif berlokasi lebih banyak di plasmid. Gen yang berperan pada sintesis enzim β-laktamase terdiri dari
blaZ yang mengekspresikan enzim β-laktamase yang sebagian besar disekresikan ke media ekstraseluler meskipun sepertiganya melekat pada dinding sel (Satari 2011). Gen ESBL pada E. coli yang banyak dilaporkan terdapat pada hewan
penghasil pangan antara lain CTX-M-1, CTX-M-14, TEM-52, dan SHV-12 (Chiaretto et al. 2008).
Stefani et al. (2014) menambahkan bahwa analisis molekuler menunjukkan
enzim yang paling dominan adalah CTX-M-1 dan TEM-15. CTX-M juga merupakan tipe enzim yang sering muncul pada kejadian ESBL di peternakan dan rumah potong di Asia (30-33%). Di Eropa dilaporkan hanya 4-7%. Sifat dari TEM adalah dapat terekspresi bersama dengan CTX-M membentuk ESBL. Di berbagai negara, TEM dilaporkan sebagai enzim yang paling sering muncul pada hewan penghasil pangan, terutama ayam (Dierikx et al. 2012).
Kejadian Cemaran Bakteri penghasil ESBL
Laporan tentang kasus E. coli penghasil ESBL pada hewan penghasil pangan telah banyak dilakukan di berbagai negara. Penelitian yang dilakukan oleh Babypedmini dan Appalaraju (2004) menunjukkan E. coli penghasil ESBL
sebanyak 41% dan K. pneumonia penghasil ESBL sebesar 40%. Prevalensi E. coli
penghasil ESBL di Malaysia 5.6%, Jepang adalah 8.1%, Filipina 13.3%, Taiwan 16.7%, dan Indonesia 23% (Parasakhti et al. 2001). Isolat E. coli dari peternakan
unggas di Nigeria yang dideteksi oleh Carissa et al. (2013) yang positif sebagai
penghasil ESBL sebanyak 22.2%.
Schmid et al. (2013) melaporkan kejadian cemaran E. coli penghasil ESBL
8
terdapat pada karkas ayam potong sebesar 88.6% dan di kloaka ayam potong sebesar 72.5%. Sebagian besar bakteri tersebut merupakan E. coli. Sampling yang dilakukan pada lingkungan peternakan babi, meliputi penampungan limbah feses, usapan sepatu boot para pekerja, dan usapan tempat ternak selama penggemukan. Sampling pada feses ternak babi dilakukan sebanyak 3 kali dan menghasilkan prevalensi E. coli penghasil ESBL sebesar 45%, 29%, dan 36%. Hasil isolasi E. coli penghasil ESBL dari lingkungan menunjukkan prevalensi sebesar 47.6% dari
penampungan limbah feses dan usapan sepatu boot, serta 5.9% dari usapan kandang (Salviati et al. 2014). Penelitian terbaru (Sukmawinata 2015) menyatakan prevalensi E. coli penghasil ESBL dari feses sapi potong di kota Bogor, Indonesia adalah 15.8%.
Gundogan dan Avci (2013) melakukan penelitian terhadap keberadaan bakteri E. coli dan Klebsiella penghasil ESBL yang diisolasi dari pangan asal
hewan di Turki. Penelitian tersebut menunjukkan prevalensi sebesar 44.4% (E. coli), 38.5% (K. pneumonia), dan 26% (K. oxytoca). Isolat E. coli yang terdeteksi merupakan E. coli yang resisten terhadap ampisilin, sefotaksim, seftadizim, seftriakson, aztroenam, tetrasiklin, dan siprofloksasin. Selain itu, hasil penelitian di Paris yang dilakukan oleh Haenni et al. (2014) menunjukkan prevalensi E. coli
penghasil ESBL sebesar 29.4% dari 491 feses pedet yang diisolasi dari 12 rumah potong hewan.
Beberapa penelitian telah dilakukan untuk mengetahui sifat resistensi antibiotik E. coli terhadap berbagai jenis antibiotik. Cemaran bakteri E. coli yang resisten terhadap seftazidim 100%, sefotaksim 100% (Carissa et al. 2013),
amoksiklav 7% (Umadevi et al. 2011), ampisilin 36.7%, doksisiklin 3.3%
(Miranda et al. 2008), streptomisin 60.7%, kanamisin 36.6% (Haenni et al. 2014), dan eritromisin 96% (Byarugaba et al. 2011). Selain itu, Ahmed et al. (2014) dalam penelitianya menunjukkan adanya strain E. coli yang resisten
terhadap antibiotik ampisilin (81.2% pada tahun 2001 dan 73.5% pada tahun 2007), amoksiklav (63% pada tahun 2001 dan 65% pada tahun 2007), sefotaksim dan seftazidim (27% pada tahun 2001 dan 8% pada tahun 2007), serta streptomisin (67% pada tahun 2001 dan 2007).
3 METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juli 2015 sampai Januari 2016. Pengambilan feses ayam dilakukan di Sentra Pemotongan Ayam Kota Bogor, Jawa Barat. Analisis sampel dilakukan di Laboratorium Divisi Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan antara lain feses ayam, buffer peptone water
9
(Merck 1.05465.0500, Germany), Mueller Hinton agar, larutan KOH 3%, larutan
Kristal violet, larutan lugol, larutan aseton alkohol, larutan safranin, strip tes oksidase (Oxoid), tryptone broth (Oxoid LP0042, England), reagen Kovacs, larutan α-naphtol, MR-VP medium (Oxoid CM0155, England), cakram antibiotik,
isolat E. coli strain ATCC 25922, Klebsiella pneumonia strain ATCC 700603,
alkohol, dan kit API 20E.
Peralatan yang digunakan dalam penelitian ini adalah cooler box,timbangan
digital, spatula steril, tabung reaksi (20-50 mL) steril, tube shaker, cawan petri
steril (diameter 10 mm dan tinggi 15 mm), api bunsen, refrigerator, stomacher, penangas air, ose, autoklaf, waterbath, inkubator 35 ºC, dan inkubator 37 ºC.
Besaran Sampel
Besaran sampel (n) ditentukan berdasarkan rumus ukuran contoh untuk pendugaan prevalensi, yaitu:
�
=
4���2 Keterangan:n = besaran sampel; p = prevalensi dugaan; q = 1-p; dan
L2 = tingkat kesalahan (Martin et al. 1987).
Prevalensi (p) E. coli penghasil ESBL di Indonesia adalah 15.8% (Sukmawinata 2015), dengan tingkat kepercayaan 95% dan tingkat kesalahan (L) sebesar 7.5%. Hasil penghitungan berdasarkan rumus tersebut adalah besaran sampel minimal (n) sebanyak 95 sampel.
Penarikan Sampel
Teknik penarikan sampel yang dilakukan adalah Simple Random Sampling
(pengambilan sampel acak sederhana). Sampel diambil selama 10 tahap yaitu 10 sampel pertahap pada pukul 00.00–03.00 WIB. Sampel berupa usus ayam yang masih mengandung feses dan dimasukkan ke dalam cooler box. Sampel usus yang didapat langsung dibawa ke laboratorium untuk dilakukan pengambilan feses secara aseptis.
Analisis Laboratorium
Isolasi dan Identifikasi E. coli
Feses yang telah dikeluarkan dari usus ayam ditimbang sebanyak 10 g. Langkah awal dalam isolasi bakteri E. coli adalah dengan homogenisasi sampel menggunakan larutan BPW (buffered peptone water) 0.1% menggunakan
stomacher dengan perbandingan 1:10. Selanjutnya homogenat diambil sebanyak
10
pada suhu 37 ºC. Langkah berikutnya adalah sampel dikultivasi dengan diambil 1 ose lalu digoreskan pada agar MacConkey yang mengandung sefotaksim 1 µg/mL dan diinkubasi pada suhu 37 ºC selama 24 jam. Koloni yang diduga E. coli
disubkultur pada media tryptic soy agar dan diinkubasi selama 24 jam pada suhu
37 ºC. Koloni-koloni tersebut juga diuji KOH, pewarnaan Gram, oksidase, dan uji biokimia (indol, methyl red, Voges-Proskauer, dan sitrat). Isolat yang diduga sebagai E. coli juga dikonfirmasi melalui uji biokimia dengan kriteria hasil positif
ditunjukkan pada Tabel 2.
Tabel 2 Kriteria biokimia bakteri E. coli
Uji Indol Methyl red
Voges-Proskauer
Sitrat
Hasil reaksi + + - -
Subkultur dilakukan sekali lagi menggunakan media tryptic soy broth dan
diinkubasi pada suhu 37 ºC selama 24 jam. Isolat yang didapat kemudian diidentifikasi menggunakan kit API 20E (Sudarwanto et al. 2015).
Konfirmasi ESBL
Konfirmasi ESBL dalam penelitian dilakukan dengan metode cakram ganda (Double disk method) mengacu pada metode yang ditetapkan oleh British Society for Antimicrobial Chemotherapy (BSAC 2012). Biakan murni disiapkan dalam bentuk suspensi yang setara dengan kekeruhan 0.5 McFarland (1-2x108 cfu/mL). Biakan tersebut diambil menggunakan cotton swab steril dan disebarkan pada
permukaan Mueller Hinton agar (MHA), dan didiamkan selama ±5 menit. Selanjutnya kertas cakram yang berisi antibiotik diletakkan di atas MHA, yang telah disebar dengan biakan murni, dengan jarak antara 25-30 mm, dengan posisi seperti pada Gambar 1. Selanjutnya biakan tersebut diinkubasi pada suhu 35 ºC selama 24 jam. Konfirmasi ESBL ini dilakukan secara paralel bersama kontrol, yaitu E. coli ATCC 25922 sebagai kontrol negatif dan Klebsiella pneumonia
ATCC 700603 sebagai kontrol positif. Pola peletakan kertas cakram antibiotik digambarkan pada Gambar 1.
Kepekaan E. coli terhadap Antibiotik Selain Sefalosporin Generasi ke-3
Deteksi kepekaan E. coli terhadap beberapa antibiotik dilakukan dengan
metode disk diffusion. Biakan murni disiapkan dalam bentuk suspensi yang setara
dengan kekeruhan 0.5 McFarland (1-2x108 cfu/mL). Biakan tersebut diambil menggunakan cotton swab steril dan disebarkan pada permukaan Mueller Hinton agar (MHA), dan didiamkan selama 5-10 menit. Selanjutnya kertas cakram yang
11
Gambar 1 Pola peletakan kertas cakram berisi antibiotik pada MHA. (a) Isolat sampel; (b) E. coli ATCC 25922; (c) Klebsiella pneumonia ATCC
70060.
Analisis Data
Data penelitian dianalisis secara deskriptif menggunakan Microsoft Excel
2010 dengan hasil data berupa tabel dan gambar keberadaan E. coli penghasil
ESBL dari feses ayam ras pedaging di Kota Bogor, Jawa Barat. Keterangan:
1. CPD: sefpodoksim 30 µg 2. CAZ: seftazidim 30 µg 3. AMC: amoxiklav 20+10 µg 4. CTX: sefotaksim 30 µg 5. BLANK: Kosong
(a) (b)
12
4 HASIL DAN PEMBAHASAN
Bakteri E. coli merupakan bakteri Gram negatif yang memiliki habitat alami dalam saluran pencernaan hewan dan manusia dan memiliki morfologi berukuran 3-6 mm, berwarna merah, dan terdapat zona keruh di sekitar koloni. Berdasarkan morfologi koloni yang ditumbuhkan pada agar Mac Conkey dan uji biokimia, ditemukan isolat E. coli dari feses ayam ras pedaging sebanyak 48 dari 100 sampel. Sampel yang menunjukkan hasil positif sebagai E. coli melalui
konfirmasi kit API 20E adalah 16 sampel. Selain E. coli, bakteri Gram negatif lain yang juga ditemukan dalam pengujian kit API 20E adalah Serratia odorifera, Salmonella Arizonae, Pantoea spp., Kluyvera spp., Klebsiella oxytoca, Enterobacter amnigenus, Citrobacter sp., Cronobacter sakazakii, dan Rauoltella ornithinolytica.
Keberadaan E. coli pada sampel feses ayam ras pedaging dipaparkan
dalam penelitian Salih et al. (2014) yang mendeteksi adanya E. coli sebesar 0.66%
(5/576). Vasiu et al. (2014) menemukan adanya cemaran E. coli (68.75%) dari kloaka ayam ras pedaging.Penelitian lain (Ivana et al. 2011) mengidentifikasi 43 isolat E. coli dari 47 isolat dari sampel ayam ras pedaging sehat dan sakit.
Keberadaan isolat E. coli yang tinggi (90.67%) juga ditemukan oleh Lubote et al. (2014) menggunakan bantuan Kit API 20E. Sebaliknya, penelitian yang dilakukan oleh Hinenoya et al. (2014) tidak menemukan strain E. coli patogen pada sampel
feses ayam di peternakan Jepang, namun menemukan 88% strain dari feses pedet dan 31% dari feses babi.
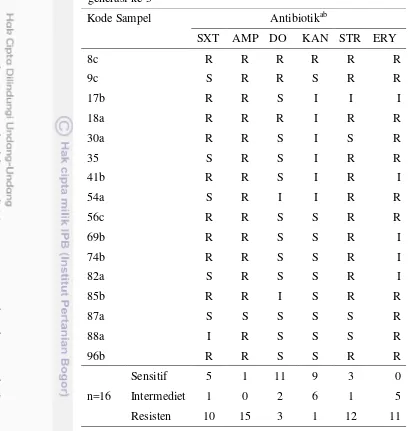
Bakteri penghasil ESBL dapat ditemukan dalam hewan penghasil pangan. Bakteri penghasil ESBL yang ditemukan dalam feses ayam ras pedaging dalam penelitian ini adalah sebanyak 7 sampel (Tabel 3). Berdasarkan hasil tersebut, isolat E. coli penghasil ESBL adalah 25% (4/16) dan bakteri penghasil ESBL lain
yang ditemukan adalah Pantoea spp. dan Serratia odorifera. Gambar 2
merupakan gambaran isolat yang positif sebagai penghasil ESBL. Meskipun cemaran E. coli penghasil ESBL sangat rendah, bakteri ini juga memiliki sifat
resisten terhadap beberapa antibiotik. Hasil tersebut disajikan dalam Tabel 5. Penelitian terdahulu menunjukkan adanya perbedaan prevalensi cemaran
E. coli penghasil ESBL pada ayam potong. Overdevest et al. (2011) menemukan adanya cemaran sebesar 79.8% pada daging ayam. Hasil penelitian yang dilakukan oleh Ahmed et al. (2014) menunjukkan adanya cemaran bakteri E. coli
penghasil ESBL sebanyak 13.4% sampel feses. Penelitian yang dilakukan di Indonesia mengenai tingkat cemaran bakteri penghasil ESBL masih fokus terhadap cemaran yang terjadi pada manusia. Kejadian infeksi bakteri penghasil ESBL di rumah sakit di Surabaya dari tahun 2006-2012, yaitu 34.84% (Kuntaman
13
Tabel 3 Isolat bakteri penghasil ESBL Kode
sampel
Bakteri Konfirmasi ESBL Pendugaan tipe
ESBL Sefpodoksim Seftazidim Sefotaksim
54a E. coli - - + CTX-M
Gambar 2 Isolat bakteri penghasil ESBL
Gen ESBL yang dimiliki oleh bakteri Gram negatif penghasil ESBL dapat diduga melalui pengujian resistensi antibiotik. Menurut Livermore dan Brown (2005), gen TEM dan SHV dapat dideteksi dengan antibiotik seftazidim, gen CTX dideteksi dengan antibiotik sefotaksim, sedangkan sefpodoksim merupakan antibiotik yang berguna untuk mendeteksi ketiga gen ESBL. Hasil penelitian (Tabel 4) memberikan gambaran bahwa sebagian besar isolat E. coli penghasil ESBL memiliki gen CTX dan hanya satu isolat yang memiliki ketiga gen ESBL. Gen pembentuk TEM dan SHV ditemukan pada elemen genetik yang motil yaitu plasmid sehingga mudah disebarkan. Adapun gen pembentuk CTX merupakan gen turunan kromosom (Livermore dan Brown 2005; EFSA 2011; Satari 2011).
Kejadian E. coli penghasil ESBL yang menyebar di seluruh dunia telah
memberikan masalah sistem penanganan kesehatan. Peningkatan prevalensi patogen penghasil ESBL dan evolusi mereka diakibatkan oleh meningkatnya frekuensi pemberian obat seperti penisilin, sefalosporin, monobaktam, dan karbapenem (Cheaito dan Matar 2014). Gen ESBL yang terdapat pada E. coli
pada awalnya muncul oleh adanya mutasi gen yang dimediasi oleh plasmid yaitu gen bla dengan tipe SHV dan TEM. Selanjutnya grup baru dari ESBL muncul yaitu CTX-M (Livermore dan Brown 2005; Ruppé et al. 2009; Cheaito dan Matar
14
Gen CTX-M merupakan gen yang tidak memiliki titik mutasi namun merupakan gen kromosom alami yang dimiliki oleh Kluyvera sp. Meskipun
Kluyvera spp. memiliki gen tersebut, bakteri ini tidak resisten terhadap sefotaksim. Keberadaan ujung promotor (promoter upstream) yang kuat
menimbulkan terekspresinya resistensi sefotaksim. Sekuen insersi yang mengandung promotor tersebut ditemukan pada isolat lain termasuk E. coli yang memperlihatkan fenotip CTX-M namun tidak ditemukan dalam isolat alami
Kluyvera (Rao 2012; Khosbayar et al. 2013). Gen CTX-M yang ditemukan pada
isolat lain terdapat di dalam plasmid yang memiliki kemampuan menyebar yang sangat tinggi (highly transmissible plasmids) sehingga resistensi menyebar dengan sangat cepat dan efisien. Bakteri yang mengekspresikan CTX-M sebagian besar merupakan bakteri co-resistance atau multiresisten (Livermore and Brown 2005; EFSA 2011). Sebagian besar kejadian cemaran bakteri penghasil ESBL adalah dikode oleh CTX-M (Khosbayar et al. 2013) dan merupakan resiko yang dapat
ditimbulkan oleh hewan penghasil pangan (EFSA 2011).
Beberapa penelitian telah dilakukan untuk mengetahui tingkat kejadian bakteri E. coli penghasil ESBL yang dikode oleh gen CTX-M. Penelitian yang
dilakukan oleh Dagi et al. (2015) menemukan sebanyak 8% memiliki gen CTX-M dan 77.4% memiliki gen gabungan TEM + CTX-M. Gen blaCTX-Mpada E. coli
yang ditemukan oleh Dierikx et al. (2010) sebanyak 8%. Castro et al. (2013)
mendeteksi adanya gen blaCTX-M sebesar 61.2% pada E. coli penghasil ESBL pada
ayam ras pedaging dari peternakan.
Keberadaan bakteri Enterobacteriaciae penghasil ESBL dalam sampel feses
hewan ternak menimbulkan risiko terjadinya kontaminasi pada karkas pada saat pemotongan, sehingga berpotensi adanya kontaminasi pada produk daging (Geser
et al. 2011). Enterobacteriaceae penghasil ESBL, termasuk E. coli yang mengontaminasi produk asal hewan berpotensi menyebabkan risiko kesehatan meskipun tingkat risikonya sulit untuk dikuantifikasi (EFSA 2011). Infeksi bakteri pengahsil ESBL melalui konsumsi pangan asal hewan dapat menyebabkan terbatasnya pilihan dalam penanganan pasien. Keadaan tersebut dapat memperpanjang masa perawatan, meningkatkan biaya pengobatan, meningkatkan tingkat kejadian penyakit, dan kematian (Khosbayar et al. 2013).
Escherichia coli sebagai penghasil ESBL juga dikaitkan dengan resistensi
15
Tabel 4 Kepekaan bakteri E. coli terhadap berbagai antibiotik selain sefalosporin generasi ke-3
SXT: Sulfamethoxazole (sulfametoksazol); AMP: Ampicillin (ampisilin); DO: Doxycycline (doksisiklin); KAN: Kanamycin (kanamisin); STR: Streptomycin (streptomisin); ERY: Erytromycin (eritromisin). bS: Sensitif; I: Intermediet; R: Resisten
Karakteristik E. coli yang diuji dengan antibiotik lain menunjukkan tingkat
resistensi tertinggi terjadi pada ampisilin (93.75%) yang diikuti oleh streptomisin (75%), eritromisin (68.75%), sulfametakzol (62.5%), doksisiklin (18.75%), dan kanamisin (6.25%). Tingginya prevalensi E. coli yang resisten terhadap ampisilin,
streptomisin, dan eritromisin merupakan indikasi tingginya pemakaian beberapa antibiotik tersebut (Byarugaba et al. 2011). Hasil penelitian juga memberikan informasi bahwa seluruh isolat E. coli yang ditemukan merupakan isolat yang
memiliki sifat multi-drug resistance. selain itu, tingginya prevalensi E. coli yang
16
Multi-drug resistance merupakan fenomena yang sering muncul pada
bakteri penghasil ESBL. Hal ini didukung oleh Haldorsen (2011) yang mengatakan bahwa gen-gen pengkode penghasil enzim resistensi seperti AME (Aminoglycoside modifying enzyme) dan ESBL sering ditemukan di dalam
plasmid bakteri. Antibiotik golongan aminoglikosida yang digunakan pada penelitian ini adalah streptomisin dan kanamisin.
Tingkat resistensi E. coli terhadap antibiotik golongan aminoglikosida pada
penelitian ini sebanyak 75% (terhadap streptomisin) dan 6.25% (terhadap kanamisin). Meskipun tingkat E. coli resisten kanamisin sangat rendah, namun
E. coli yang tedeteksi pada penelitian ini menunjukkan tingkat intermediet sebesar 37.5%. Pola intermediet merupakan pola yang mendekati resisten. Hal ini dapat menjadi kekhawatiran karena pola intermediet yang terbentuk di masa sekarang berpeluang berubah menjadi resisten di masa mendatang.
Salah satu penyebab utama meningkatnya prevalensi bakteri yang resisten terhadap kedua antibiotik golongan β-laktam dan aminoglikosida adalah adanya transfer gen yang terjadi pada elemen genetik seperti plasmid, integron, dan transposon (Halderson 2011; Allocati et al. 2013). Lebih lanjut, kombinasi dari
beberapa gen resisten menyebabkan bakteri resisten terhadap sebagian besar golongan antibiotik (Allocati et al. 2013).
Escherichia coli sering digunakan sebagai bakteri indikator resistensi
antibiotik, karena prevalensi yang tinggi dalam kotoran hewan yang sehat dan karena kemampuannya dalam menyebarkan beberapa faktor resistensi (Byarugaba
et al. 2011). Tingkat keberadaan bakteri komensal yang resisten terhadap
antibiotik merupakan indikator tekanan selektif yang disebabkan oleh penggunaan antibiotik dan memberikan gambaran adanya perlawanan bakteri patogen di masa mendatang. Tingkat resistensi antibiotik pada E. coli telah mencapai titik dimana bakteri tersebut menimbulkan beberapa masalah kesehatan (Costa et al. 2013).
Pengetahuan tentang resistensi antibiotik pada hewan penghasil pangan dan mekanisme perlawanan bakteri memberikan informasi penting tentang masalah antibiotik dan memberikan informasi yang dibutuhkan dalam merumuskan strategi dalam penekanan masalah resistensi antibiotik dan keamanan pangan. Pangan asal hewan terbukti menjadi sumber mayoritas foodborne yang disebabkan oleh Campylobacter, Yersinia, E. coli, dan non-typhoid Salmonella
(Byarugaba et al. 2011).
Escherichia coli yang memiliki habitat alami di dalam saluran pencernaan manusia dan mamalia lain banyak ditemukan sebagai bakteri resisten terhadap beberapa antibiotik, oleh karenanya perlu menjadi perhatian khusus. Meskipun keberadaan E. coli di dalam saluran pencernaan hanya sekitar 1% dari flora kolon, bakteri ini dapat mentransfer materi genetik resisten kepada bakteri lainnya (Marshall et al. 2009). Bakteri penghasil ESBL pada pangan asal unggas
menimbulkan dampak langsung terhadap kesehatan masyarakat, bukan hanya karena bakteri penghasil ESBL dapat menjadi sumber penularan gen resisten terhadap patogen usus, namun juga karena akuisisi gen virulensi dari patogen usus ke E. coli penghasil ESBL (Garcia-Graells et al. 2012). E. coli dapat menjadi
17
Secara umum transfer gen resisten dapat melalui tiga mekanisme, yaitu transformasi, konjugasi, dan transduksi. Masalah resistensi antibiotik sebagian besar berasal dari tranfer gen horizontal antar spesies bakteri. Mekanisme ini diketahui lebih efisien bagi bakteri untuk beradaptasi terhadap perubahan lingkungan dibandingkan dengan mutasi acak. Transformasi (Marshall et al.
2009) dan konjugasi (Marshall et al. 2009; Carissa et al. 2013; Hammerum et al. 2014) merupakan rute transfer yang paling sering muncul. Transfer gen resistensi antibiotik dari bakteri komensal kepada bakteri patogen tergantung pada kepadatan bakteri donor dan penerima, ketersediaan mekanisme transfer, nutrisi, dan tekanan selektif. Menurut Marshall et al. (2009), lingkungan usus merupakan lingkungan yang optimal untuk berlangsungnya mekanisme transfer gen.
O’brien (2002) mengatakan bahwa E. coli berperan dalam penyebaran gen resisten terhadap populasi bakteri antara hewan dan manusia melalui foodborne.
Hewan penghasil pangan dikenal sebagai reservoir bagi bakteri penghasil ESBL seperti E. coli (Byarugaba et al. 2011). Ayam ras pedaging sebagai salah satu hewan penghasil pangan berpotensi sebagai reservoir bagi bakteri penghasil ESBL. Bakteri penghasil ESBL tersebut dapat menyebar dari hewan ke manusia dan berpotensi menimbulkan penyakit zoonosa (Haenni et al. 2014; Reich et al. 2013). Penyebaran dapat melalui berbagai jalur, seperti melalui konsumsi daging yang terkontaminasi, melalui lingkungan yang telah tercemar feses mengandung
E. coli penghasil ESBL, dan juga melalui kontak dengan pasien atau individu
yang terinfeksi dengan bakteri penghasil ESBL.
Keberadaan cemaran bakteri resisten khususnya bakteri penghasil ESBL yang juga bersifat multidrug resistance menimbulkan masalah penting secara
global. Penyebaran E. coli yang bersifat multidrug resistance telah menjadi perhatian sebagai penyebab infeksi saluran pencernaan, pembuluh darah (Petty et al. 2014) dan saluran kemih (O’brein 2002). Penyakit yang timbul akibat
terinfeksi bakteri resisten tersebut mengakibatkan masalah kesehatan baik bagi manusia maupun hewan ternak, seperti meningkatnya biaya pengobatan, terbatasnya pilihan terapi terhadap pasien, masa rawat yang lebih lama, dan kematian (Lestari dan Severin 2009; Pajariu 2010). Bakteri E. coli adalah bakteri
18
5 SIMPULAN DAN SARAN
Simpulan
Keberadaan bakteri E. coli penghasil ESBL yang diisolasi dari feses ayam
ras pedaging di kota Bogor yaitu 25%. Cemaran E. coli penghasil ESBL dapat menjadi masalah penting bagi kesehatan hewan dan manusia. Seluruh E. coli
penghasil ESBL yang terdeteksi menunjukkan resisten terhadap antibiotik sefotaksim, sehingga diasumsikan bahwa bakteri-bakteri tersebut dikode oleh CTX-M. Keberadaan E. coli yang diisolasi dari feses ayam ras pedaging di kota
Bogor bersifat multidrug resistance. Bakteri E. coli penghasil ESBL yang juga
bersifat multidrug resistance dapat menyebarkan gen resistennya melalui pangan asal hewan dan lingkungan sehingga menjadi ancaman bagi kesehatan masyarakat.
Saran
Penelitian lanjutan perlu dilakukan untuk memastikan gen pengkode terbentuknya ESBL dari masing-masing isolat. Selain itu, perlu dilakukan deteksi
E. coli penghasil ESBL dari daging ayam, limbah peternakan dan rumah potong,
serta feses manusia. Keberadaan E. coli penghasil ESBL yang menjadi ancaman
19
DAFTAR PUSTAKA
Ahmed SF, Ali MMM, Mohamed ZK, Moussa T, Klena JD. 2014. Fecal carriage of extended-spectrum β-lactamases and AmpC-producing Escherichia coli
in Libyan community. Ann Clin Microbiol Antimicrob. 13(22):1-8.
Aidara-Kane A, Andremont A, Collignon P. 2013. Antimicrobial resistance in the food chain and the AGISAR initiative. J Infect Pub Health. 6:162-165. Allocati N, Masulli M, Alexeyev MF, Ilio CD. 2013. Escherichia coli in Europe:
an overview. Int J Environ Res Pub Health. 10:6235-6254 doi:10.3390/ijerph10126235.
Babypedmini S, Appalaraju B. 2004. Extended spectrum β–lactamases in urinary isolates of Escherichia coli and Klebsiella pneumonia prevalence and
susceptibility pattern in a tertiary care hospital. Indian J Med Microbiol. 22:172-4.
Bramantono, Purwati, Hamidah. 2012. The prevalence of extended spectrum beta-lactamase (ESBL) in third generation cephalosporin usage among sepsis patients in the department of internal medicine RSUD Dr. Soetomo Surabaya. Folia Med Indones. 49(4):244-251.
[BSAC] British Society for Antimicrobial Chemotherapy. 2012. Detection of extended-spectrum β-laktamases (ESBLs) in E. coli and Klebsiella species. (UK): Clinical Scientist.
Byarugaba DK, Kisame R, Olet S. 2011. Multi-drug resistance in commensal bacteria of food of animal origin in Uganda. Afr J Microbiol Res. 5(12):1539-1548.
Carissa D, Edward N, Michael A, Chika E, Charles E. 2013. Extended-spectrum β-laktamase-producing Escherichia coli strains of poultry origin in Owerri,
Nigeria. World J Med Sci. 8(4):349-354
doi:10.5829/idosi.wjms.2013.8.4.7443.
Castro B, Abreu R, Espigares-Rodriguez E, Madueño A, Moreno-Roldán E, Espigares M, Lecuona M, Arias A. 2013. Cross-sectional study of CTX-M-type extended spectrum beta-lactamases in Escherichia coli strains isolated
in healthy poultry. ESCMID [Poster]. [diunduh pada 2015 Okt 13]. Tersedia
pada:
www.progenie-molecular.com/Poster_ECCMID-BCN-CTXE_052014.pdf.
[CDC] Centers for Disease Control and Prevention. 2015. E. coli (Escherichia coli). Artikel [Internet]. [diunduh 2015 Jul 13]. Tersedia pada: http://www.cdc.gov/ecoli.
Cheaito K, Matar GM. 2014. The Mediterranean region: a reservoir for CTX-M-ESBL-producing Enterobacteriaceae. Jord J Biologic Sci. 7(1): 1-6.
Chiaretto G, Zavagnin P, Bettini F, Mancin M, Minorello C, Saccardin C, Ricci A. 2008. Extended spectrum β--lactamase SHV-12-producing Salmonella
from poultry. Vet Microbiol. 128:406-413.
[CLSI] Clinical and Laboratory Standards Institute. 2014. Performance Standards for Antimicrobial Suseptibility Testig: Twenty-Second Informational Suplement. Wayne (US): Clinical and Laboratory Standards Institute.
20
animals, and environment. Int J Environ Res Publ Health. 10:278-294
doi:10.3390/ijerph10010278.
Dagi HT, Al-Dulaimi AA, Kus H, Seyhan T, Findik D, Tuncer I, Arslan U. 2015. Genotype distribution of extended spectrum β-lactamase producing
Escherichia coli and Klebsiella pneumoniae. BiomedRes. 26(2):235-238.
Denisuik AJ, Simner PJ, Tailor F, Adam HJ, Lagacé-Wiens P, Mulvey MR, Baxter M, Hoban M, Zhanel GG. 2012. Dramatic increase in the prevalence of ESBL-producing Escherichia coli (EC) in Canadian hospitals over a 5-year period. 82nd Intercicence Conference on Antimicrobial Agents and Chemotherapy; 2012 Sept 9-12; San Francisco (CA).
Dierikx C, Essen-Zandbergen A, Veldman K, Smith H, Mevius D. 2010. Increased detection spectrum β-lactamase producing Salmonella enterocolitica and Escherichia coli isolates from poultry. Vet Microbiol.
145:273-278 doi:10.1016/j.vetmic.2010.03.019.
Dierikx C, Van Der Goot J, Fabri T, Van Essen-Zandbergen A, Smith H, Mevius D. 2012. Extended-spectrum-β-lactamase- and AmpC-β -lactamase-producing Escherichia coli in Dutch broilers and broiler farmers. Antimicrob Chemother. 68:60-87.
[ECDC] European Centre for Disease Prevention and Control. 2015. Escherichia coli (E. coli): Factsheet [Internet]. [diunduh 2015 Jul 13]. Tersedia pada:
http://ecdc.europa.eu/en/healthtopics/escherichia_coli/basic_facts/Pages/basi c_facts.aspx.
[EFSA] European Food Safety Authority. 2011. Scientific opinion on the public health risks of bacterial strains producing extended-spectrum β-lactamases and/or AmpC β-lactamase in food and food-producing animals. EFSA J. 9(8):2322-2417.
[FDA] U.S Food and Drug Administration. 2013. Foodborne illness and contaminants: Causes of foodborne illness. Bad Bug Book. (US): US Departement of Health & Human Services.
Garcia-Graells C, Botteldoorn N, Dierick K. 2012. Microbial surveillance of ESBL E. coli in poultry meats, a possible vehicle for transfer of
antimicrobial resistance to humans. WIV-ISP. 13:1-6.
Geser N, Stephan R, Kuhnert P, Zbinden R, Kaeppeli U, Cernela N, Haechler H. 2011. Fecal carriage of extended-spectrum β-laktamase-producing
Enterobacteriaceae in swine and cattle at slaughter in Switzerland. J Food Protect. 74(3):446-449.
Gundogan N, Avci E. 2013. Prevalence and antibiotic resistance of extended-spectrum beta-lactamase (ESBL) producing Escherichia coli and Klebsiella
species isolated from foods of animal origin in Turkey. Afr J Microbiol Res.7(31):4059-4064.
Haenni M, Châtre P, Métayer V, Bour M, Signol E, Madec JY, Gay E. 2014. Comparative prevalence and characterization of ESBL-producing Enterobacteriaceae in dominant versus subdominant enteric flora in veal calves at slaughterhouse, France. Vet Microbiol. 171:321-327.
Haldorsen BC. 2011. Aminoglycoside resistance in clinical Gram-negative isolates from Norway [thesis]. North Norway (NO): University of Tromsø. Hammerum AM, Larsen J, Andersen VD, Lester CH, Skytte TSS, Hansen F,
21
Characterization of extended-spectrum β-laktamase (ESBL)-producing
Escherichia coli obtained from Danish pigs, pig farmers, and their families from farms with high or no consumption of third- or fourth-generation sefalosporin. J Antimicrobiol Chemother. doi:10.1093/jac/dku180.
Hinenoya A, Shima K, Asakura M, Nishimura K, Tsukamoto T, Ooka T, Hayashi T, Ramamurthy T, Faruque SM, Yamasaki S. 2014. Molecular characterization of cytolethal distending toxin gene-positive Escherichia coli from healthy cattle and swine in Nara, Japan. BMC Microbiol.
14(97):1-13.
[HPA] Health Protection Agency. Factsheet on ESBLs. Essex Health Protection Unit Artikel [Internet]. [diunduh 2015 Jun 23]. Tersedia pada: http://www.gha.gi/wp-content/uploads/Infection-Control-ESBL-Factsheet-HPA.pdf.
Ivana D, Petrikkos G, Dimitrijević V, Charvalos E. 2011. Multidrug resistance and integrons in Escherichia coli isolated from chicken in Greece. Acta Veterin. 61(5-6):575-584.
Khosbayar T, Munguntsetseg B, Ochbadrakh B, Udval U, Batbaatar G, Wu J, Yong D. 2013. Plasmid analysis of ESBL producing Gram negative bacilli in Mongolia. Mongolian J Hea Sci. 10(1):90-100.
Kuntaman, Mertiasih NM, Hadi U. 2006. Multiresistance pattern of extended spectrum β-lactamase (ESBL)-Escherichia coli and Klebsiella pneumoniae
strains. Folia Med Indones. 42(1):40-46.
Lestari ES, Severin JA. 2009. Antimicrobial resitance in Indonesia: Prevalence, determinants and genetic basis [thesis]. Rotterdam (NL): Erasmus
Universiteit Rotterdam.
Livermore DM, Brown DFJ. 2005. Detection of β-lactames-mediated resistance.
BSAC [Internet]. [diunduh 2015 Okt 12]. Tersedia pada:
bsac.org.uk/wp-content/uploads/2012/02/Chapter_6.pdf.
Lubote R, Shahada F, Matemu A. 2014. Prevalence of Salmonella spp. And
Escherichia coli in raw milk value chain in Arusha, Tanzania. American J Res Communicat. 2(9):1-13.
Martin SW, Meek AH, Willeberg P. 1987. Veterinary Epidemiology: Priciples and Methods. Iowa (US): Iowa State University Pr.
Marshall BM, Ochieng DJ, Levy SB. 2009. Commensals: Underappreciated reservoir of antibiotic resistance. Microbe.4(5):231-238.
Miranda JM, Guarddon M, Vázquez BI, Fente CA, Barros-Veláazquez, Cepeda A, Franco CM. 2008. Antimicrobial resistance in Enterobacteriaceae strains isolated from organic chicken, conventional chicken and conventional turkey meat: A comparative survey. Food Cont. 19:412-416 doi:10.1016/j.foodcont.2007.05.002.
Nedbalcova K, Nechvatalova K, Pokludova L, Bures J, Kucerova Z, Koutecka L, Hera A. 2014. Resistance to selected beta-lactam antibiotics. Vet Microbiol. 171:328-336.
O’Brien TF. 2002. Emergence, spread, and environmental effect of antimicrobial resistance: how use of an antimicrobial anywhere can increase resistance to any antimicrobial anywhere else. Clin Infect Dis. 3:78-84.
22
Klutmans J. 2011. Extended-Spectrum β-laktamase genes of Escherichia coli in chicken meat and humans, the Netherlands. Emerg Infect Dis. 17(7):1216-1222 doi:10.3201/eid1707.110209.
Pajariu A. 2010. Infeksi oleh bakteri penghasil extended-spectrum beta-lactamase (ESBL) di RSUP Dr. Kariadi Semarang: Faktor risiko terkait penggunaan antibiotik [artikel ilmiah]. Semarang (ID): Universitas Diponegoro.
Parasakthi N, Arrifin H, Kamarulzaman A, Ibrahim HSM, Adnan A, Choeng I. 2001. Consensus guidelines for the management of infections by ESBL-producing bacteria. Kuala Lumpur (MY): Malaysian Society of Infectious Disease and Chemotherapy.
[PHAC] Public Health Agency of Canada. 2014. E. coli. Artikel [Internet].
[diunduh 2015 Jun 23]. Tersedia pada: http://www.phac-aspc.gc.ca/fs-sa/fs-fi/ecoli-eng.php.
Petty NK, Zakour NL, Stanton-Cook M, Skippington E, Totsika M, Forde BM. 2014. Global dissemination of a multidrug resistant Escherichia coli clone.
PNAS. 111(15): 5694-5699.
Price LB, Graham JP, Lackey LG, Roess A, Vailes R, Silbergeld E. 2007. Elevated risk of carrying gentamicin-resistant Escherichia coli among US. poultry workers. Environ Health Perspect. 115(12):1738-1742.
Rao S. 2012. CTX-M β-lactamases. [Internet]. [diunduh 2015 Okt 13]. Tersedia pada: www.microrao.com/micronotes/pg/ctx-m-beta-lactamases.pdf.
Reich F, Atanassova V, Klein G. 2013. Extended-spectrum β-lactamase- and ampc-producing enterobacteria in healthy broiler chickens, germany. Emerg Infect Dis. 19(8):1253-1259.
Ruppé E, Hem S, Lath S, Gautier V, Ariey F, Sarthou JL, Monchy D, Arlet G. 2009. CTX-M β-lactamases in Escherichia coli from community-acquired
urinary tract infections, Cambodia. Emerg Infect Diseas. 15(5):741-749 doi:10.3201/eid1505.071299.
Salih BM, Nour-Eddine B, Jamal-Eddine H, Benabdallah B, Mebrouk K. 2014. Genetic characterization of Shiga toxin-producing Escherichia coli strains isolated from frozen bovine meat in Algeria. Advan Environmen Biol. 8(1):6-13.
Salviati C, Friese A, Roschanski N, Laube H, Guerra B, Käsbohrer A, Kreienbrock L, Roesler U. 2014. Extended-spectrum beta-lactamases (ESBL)/AmpC beta-lactamases-producing Escherichia coli in German
fattening pig farms: a longitudinal study. Ber Münch Tierärztli Wochensch.
127(10):412-419.
Santos LL, Moura RA, Agilar-Ramires P, Castro AP, Lincopan N. 2013. Current status of extended-spectrum β-laktamase (ESBL)-producing Enterobacteriaceae in animals. FORMATEX. 3:1600-1607.
Satari MH. 2011. Mekanisme produksi enzim β-laktamase bakteri Gram positif dan Gram negatif. Bali Dental Science & Exhibition; 2011 Sept 17; Bali
(ID).
Schaufler K, Bethe A, Lübke-Becker A, Ewers C, Kohn B, Wieler LH, Geunther S. 2015. Putative connection between zoonotic multiresistant extended-spectrum β-lactamase (ESBL)-producing Escherichia coli in dog feces
23
Schmid A, Hörmansdorfer S, Messelhäusser U, Käsbohrer A, Sauter-Louis C, Mansfeld R. 2013. Prevalence of extended-spectrum β-lactamase-producing
Escherichia coli on Bavarian dairy and beef cattle farms. Appl Environment Microbiol. 79(9):3027-3032.
Severin JA, Mertaniasih NM, Kuntaman K, Lestari ES, Purwanto M, Toom NL, Duerink DO, Hadi U, Belkum A, Verburg HA, Goessens WH. 2010. Molecular characterization of extended-spectrum β-lactamases in clinical
Escherichia coli and Klebsiella pneumoniae isolates from Surabaya,
Indonesia. J Antimicrob Chemother. 65:465-469 doi:10.1093/jac/dkp471. Stefani S, Giovanelli I, Anacarso I, Condò C, Messi P, Niederhäusern S, Bondi M,
Iseppi R, Sabia C. 2014. Prevalence and characterization of extended-spectrum β-lactamase-producing Enterobacteriaceae in food-producing animals in Northern Italy. New Microbiol. 37:551-555.
Suardana W. Utama IH, Putriningsih PAS, Rudyanto MD. 2014. Uji kepekaan antibiotika isolat Escherichia coli O157:H7 asal feses ayam. Bul Vet Udayana. 6(1):19-27.
Sudarwanto MB, Ömer A, Sabrina O, Medeline G, Ewald U. 2015. Extended-spectrum β-lactamase (ESBL)-producing Klebsiella pneumoniae in bulk tank milk from dairy farms in Indonesia. J Food Pathog Dis. 12(7):585-590. doi:10.1089/fpd.2014.1895.
Sukmawinata E. 2015. Tingkat kejadian Escherichia coli penghasil Extended spectrum β-lactamase di feses sapi di rumah potong hewan ruminansia kota Bogor [tesis]. Bogor (ID): Institut Pertanian Bogor.
Tankhiwale SS, Jalgaonkar SV, Ahamad S, Hassani U. 2004. Evaluation of extended spectrum β-lactamase in urinary isolates. Indian J Med Res. 120:553-600.
Umadevi S, Kandhakumari G, Joseph NM, Kumar S, Easow JM, Stephen S, Singh UK. 2011. Prevalence and antimicrobial susceptibility pattern of ESBL producing Gram negative bacilli. J Clin Diagnos Res. 5(2):236-239. Vasiu A, Niculae M, Pall E, Spínu M. 2014. The potential zoonotic risk due to
cloacal flora in intesively raised broilers. Vet Med J. 60(1):62-65.
[WHO] World Health Organization. 2011. Enterohaemorrahagic Escherichia coli
24
25
26
RIWAYAT HIDUP
Penulis dilahirkan di Kediri, Jawa Timur pada tanggal 17 April 1991. Penulis adalah anak pertama dari tiga bersaudara dari pasangan Abdur Rohman dan Eka Mutamimatuz Zuhro. Pada saat ini penulis belum menikah.