AKTIVITAS ANTIOKSIDAN EKSTRAK DAUN PEPAYA
(Carica papaya (L). Var Kalina) DENGAN
PERLAKUAN TANAH LEMPUNG
DESI AMALIAWATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Antioksidan Ekstrak Daun Pepaya (Carica papaya (L). Var Kalina) dengan Perlakuan Tanah Lempung adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Desi Amaliawati
4
ABSTRAK
DESI AMALIAWATI. Aktivitas Antioksidan Ekstrak Daun Papaya (Carica papaya (L). Var Kalina) dengan Perlakuan Tanah Lempung. Dibimbing oleh WARAS NURCHOLIS dan INDA SETYAWATI.
Penambahan tanah lempung pada proses perebusan daun pepaya bertujuan mengurangi rasa pahit, namun belum diketahui dapat mempengaruhi aktivitasnya sebagai antioksidan. Oleh karena itu, penelitian ini bertujuan menguji aktivitas antioksidan dan komponen bioaktif daun papaya berdasarkan cara pengolahan. Aktivitas antioksidan ditentukan dengan metode DPPH dan diukur dengan spektrofotometer pada panjang gelombang 517 nm. Hasil penelitian menunjukkan ekstrak air dan etanol daun papaya yang telah diberi perlakuan tergolong memiliki aktivitas antioksidan yang sangat lemah, aktivitas antioksidan yang paling tinggi terdapat pada perebusan selama tiga menit dinyatakan dalam bentuk IC50, yaitu
528.495 ppm ekstrak etanol. Aktivitas antioksidan ini ditimbulkan oleh kandungan metabolit sekunder pada daun papaya, yaitu flavonoid dan fenolik. Hasil analisis menunjukkan bahwa tidak ada pengaruh aktivitas antioksidan, fenolik, dan flavonoid total daun papaya yang direbus dengan penambahan tanah lempung (P>0.05).
Kata kunci: Antioksidan, daun papaya, fenolik, flavonoid, tanah lempung,
ABSTRACT
DESI AMALIAWATI. Antioxidant activity Papaya Leaf Extract (Carica papaya (L). Var Kalina) with treatment Clays. Supervised by WARAS NURCHOLIS and INDA SETYAWATI.
The addition of clay in the boiling process aims to reducing the papaya leaves bitter taste, but has been known to affect the activity as an antioxidant. Therefore, the purpose of this research to test the antioxidant activity of papaya leaves and bioactive components based of boiling process. The antioxidant activity was determined by DPPH method and measured with a spectrophotometer at a wavelength of 517 nm. The results showed the water and ethanol extracts of papaya leaves that had been treated classified as weak antioxidant, antioxidant activity is highest at boiling for three minutes express as IC50, specifically 528.495
ppm ethanol extract with boiled for three minutes. This antioxidant activity caused by the content of secondary metabolites in leaves of papaya, such as flavonoids and phenolic. The analysis showed that there was no effect of antioxidant activity, phenolic and flavonoid total papaya leaves boiled with the addition of clay (P<0.05).
AKTIVITAS ANTIOKSIDAN EKSTRAK DAUN PEPAYA
(Carica papaya (L). Var Kalina) DENGAN
PERLAKUAN TANAH LEMPUNG
DESI AMALIAWATI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur kepada Allah SWT yang telah melimpahkan rahmat dan kasih sayang-Nya sehingga penelitian ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2014 hingga Febuari 2015 ini adalah antioksidan dengan judul Aktivitas Antioksidan Ekstrak Daun Pepaya (Carica papaya (L). Var Kalina) dengan Perlakuan Tanah Lempung. Terima kasih penulis sampaikan kepada bapak Waras Nurcholis dan ibu Inda Setyawati selaku pebimbing yang sangat sabar dan menjadi pencerah disaat penulis bimbang, ibu Sulistiyani selaku ketua kelayakan yang dengan sabar memeriksa format skripsi ini. Penulis juga mengucapkan terima kasih kepada seluruh staff komdik biokimia khususnya bapak Edi yang selalu membantu penulis dalam menjalani birokrasi selama penyusunan karya ini, kepada teknisi, peneliti serta pegawai pusat studi biofarmaka khususnya mas Endi, ibu nunuk, mba Ela, mba Wiwi, mas Ius yang bersedia membantu selama penelitian, kepada Alfiyan yang selalu membantu dengan penuh kesabaran dalam segala kondisi, temanku Pamungkas, ka Isti, dan pegawai lab PAU yang membantu penelitian ini, Indah dwi, Indah permata, Yoana, Yusuf, Carlita yang bersedia untuk mengecek format skripsi, serta sahabatku ka Nur hidayah, Chelsea, Kathirina, Lisa, dan Carolin yang selalu menyemangati.
Skripsi ini penulis persembahkan kepada mama, bapak, dan kaka tercinta yaitu Yuli Retna, Danang, dan Nanang atas limpahan kasih sayang yang tak terhingga yang selalu menyemangati, selalu bersedia membantu, dan mendoakan dengan ikhlas, Semoga penelitian ini bermanfaat bagi bidang biokimia dan masyarakat.
Bogor, Juli 2015
DAFTAR ISI
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
METODE PENELITIAN 2
Bahan dan Alat 2
Metode Penelitian 2
HASIL 4 Kadar Air dan Rendemen Ekstrak Air dan Etanol Daun Pepaya 4
Kadar Fenolik Total 4
Kadar Flavonoid Total 5
Aktivitas Antioksidan 6
PEMBAHASAN 6
Kadar Air dan Rendemen Ekstrak Daun Pepaya 6
Kadar Senyawa Fenolik Total 7
Kadar Senyawa Flavonoid Total 9
Aktivitas Antioksidan 10
SIMPULAN DAN SARAN 11
DAFTAR PUSTAKA 12
LAMPIRAN 16
DAFTAR GAMBAR
1 Rendemen ekstrak air dan etanol daun pepaya yang telah direbus 4 2 Kadar fenolik total ekstrak air dan etanol daun pepaya yang direbus dengan
tanah lempung 5
3 Kadar flavoid total ekstrak air dan etanol daun pepaya yang direbus dengan
tanah lempung 5
4 IC50 ekstrak air dan etanol daun pepaya yang direbus dengan tanah lempung 6
DAFTAR LAMPIRAN
1 Diagram alir penelitian 17
2 Kadar air dan rendemen ekstrak 18
3 Perhitungan inhibisi dan IC50 ekstrak daun pepaya 19
PENDAHULUAN
Daun papaya pada umumnya dimanfaatkan oleh masyarakat sebagai makanan dalam bentuk sayur maupun produk olahan lainnya. Kesadaran masyarakat untuk mengkonsumsi daun papaya karena masyarakat percaya bahwa daun papaya dapat memberikan manfaat bagi tubuh, salah satunya dapat meningkatkan daya tahan tubuh. Manfaat yang diperoleh jika mengkonsumsi daun pepaya, dikarenakan kandungan metabolit sekunder yang ada pada daun papaya dapat bertindak sebagai antioksidan (Ayoola et al. 2008), antibakteri (Suresh et al.
2008), antikanker (Rahmat et al. 2002) dan antiinflamasi (Gamulle et al. 2012). Antioksidan adalah zat penghambat reaksi oksidasi akibat radikal bebas yang dapat menyebabkan kerusakan asam lemak tak jenuh, membran dinding sel, pembuluh darah, basa DNA, dan jaringan lipid sehingga menimbulkan penyakit (Subeki 1998). Tubuh tidak mempunyai sistem pertahanan antioksidatif yang berlebihan, sehingga jika terjadi paparan radikal berlebih tubuh membutuhkan antioksidan eksogen (Rohdiana 2001).
Daun papaya segar dapat bertindak sebagai antioksidan eksogen. Namun, pemanfaatan daun papaya segar untuk dikonsumsi oleh sebagian masyarakat kurang disukai karena rasanya yang pahit, walaupun daun papaya tersebut telah melalui proses perebusan. Rasa pahit yang timbul disebabkan oleh kandungan alkaloid karpain dan enzim papain yang dominan pada daun papaya (Krishna et al. 2008), untuk menghilangkan rasa pahit masyarakat di daerah Sragen sering menambahkan tanah lempung dalam proses perebusan sebelum daun papaya tersebut dikonsumsi. Kearifan lokal ini diperoleh masyarakat secara turun temurun. Hingga saat ini akibat penambahan tanah lempung dalam proses perebusan, belum diketahui pengaruhnya terhadap kualitas daun papaya terkait dengan kandungan metabolit sekunder yang salah satunya bermanfaat sebagai antioksidan, seperti senyawa fenolik dan flavonoid (Figueroa et al. 2014).
Penelitian terhadap flavonoid total, fenolik total, dan antioksidan bagian dari tanaman pepaya telah banyak dilakukan. Akan tetapi, penelitian serupa untuk mengetahui perubahan komposisi metabolit sekunder dan aktivitas antioksidan daun papaya setelah direbus dengan tanah lempung belum dilakukan. Oleh karena itu, perlu dilakukan penelitian terkait pengaruh perebusan dengan penambahan tanah lempung terhadap kadar fenolik total, flavonoid total, dan aktivitas antioksidan.
2
Pusat Studi Biofarmaka, Institut Pertanian Bogor, yaitu dari bulan Desember 2014 hingga Febuari 2015.
BAHAN DAN METODE
Bahan dan Alat
Bahan – bahan yang digunakan adalah daun pepaya (Carica papaya (L).
Var Kalina), kertas saring, akuades, etanol, alumunium foil, kertas wrap, reagen folin ciocalteu 10 % (v/v), Na2NO3 7.5 % (b/v), serbuk katekin, NaNO2 5 %
(b/v), AlCl3 10 % (v/v), NaOH 1M, asam askorbat, dan DPPH.
Alat-alat yang dipakai yaitu oven, wadah, pipet Mohr, gelas piala, alat untuk blender, shaker incubator, tabung rotary evaporator, rotavapor, pipet tetes, tabung reaksi, bulb, penangas air, neraca analitik, labu Erlenmeyer, corong, cawan porselen, desikator, microplate sampel, Spektrofotometer UV-VIS, ELISA
reader, kuvet kuarsa, dan labu ukur.
Metode Penelitian
Pengambilan dan Preparasi Sampel
Sampel daun pepaya yang akan digunakan diperoleh dari kebun PKHT (Pusat Kajian Hortikultura), Balai Penelitian Tanaman Obat dan Aromatik (Balitro) Bogor. Sampel daun pepaya yang digunakan yaitu daun yang terletak pada posisi ke - 3 dari pucuk tanaman yang berumur 8 bulan. Sampel tanah yang digunakan berasal dari tanah daerah kota Sragen Jawa Tengah berwarna coklat ditimbang. Cawan tersebut ditimbang kembali hingga beratnya konstan. Sebanyak 1 gram daun papaya segar dimasukkan ke dalam cawan lalu dimasukkan ke dalam oven dengan suhu 105 oC selama 3 jam atau hingga beratnya konstan (batas perbedaan bobot tidak lebih dari 5 mg). Cawan kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin kemudian ditimbang. Kadar air daun papaya segar dapat ditentukan menggunakan rumus.
Perebusan Daun Papaya dengan Tanah Lempung
Daun papaya diberi tiga perlakuan yang berbeda, perlakuan pertama sebanyak 50 gram direbus selama tiga menit. Perlakuan kedua sebanyak 50 gram daun papaya direbus selama tiga menit dengan penambahan tanah lempung sebanyak 50 gram. Perlakuan ketiga sebanyak 50 gram daun papaya direbus selama lima menit dengan penambahan tanah lempung sebanyak 50 gram. Hasil perebusan ditiriskan dan dicuci bersih kemudian digiling menggunakan alat
Penyiapan Sampel Ekstrak Air (BPOM 2010)
Pembuatan ekstrak air pada penelitian ini menggunakan metode infundasi.Sampel daun papaya yang telah halus dimasukkan ke dalam gelas piala 1000 mL. Selanjutnya ke dalam gelas piala ditambahkan air 500 mL (1:10), kemudian dipanaskan dengan penangas air pada suhu 90 ºC selama 15 menit (terhitung sejak suhu mencapai 90 ºC) sambil diaduk dengan pengaduk. Hasil ekstraksi yang diperoleh kemudian disaring dengan kain penyaring sehingga diperoleh filtrat. Filtrat yang diperoleh dipekatkan menggunakan rotary evaporator dengan suhu 40 oC hingga diperoleh estrak dalam bentuk padatan. Penyiapan Sampel Ekstak Etanol 70% (BPOM 2005)
Sampel daun papaya diekstraksi dengan perbandingan 1:10 menggunakan metode maserasi, yaitu dengan cara merendam sampel daun papaya yang telah halus selama 6 jam dalam etanol 70 % sambil sekali-kali diaduk dengan shaker orbital, kemudian didiamkan selama 24 jam. Setelah direndam akan terbentuk maserat yaitu bagian yang jernih. Maserat yang diperoleh difiltrasi dan proses diulangi 3 kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dan diupakan dengan rotary evaporator pada suhu 40 oC hingga diperoleh ekstrak dalam bentuk padatan.
Uji Kandungan Fenolik Total (Javanmardi et al. 2003)
Sebanyak 0.2 mL dengan konsentrasi 200 ppm sampel daun papaya dalam bentuk ekstrak yang diperoleh dari penyiapan sampel ekstrak air dan etanol dicampurkan dengan 2.5 mL reagen Folin-Ciocalteu 10 %, dan 2 mL Na2CO3 7.5
% kemudian diinkubasi selama 15 menit pada suhu 45 oC. Absorban larutan diukur menggunakan spektrofotometer pada panjang gelombang 765 nm. Fenolik total ekstrak daun papaya dinyatakan sebagai milligram (mg) asam galat ekuivalen per gram bobot ekstrak basah (GAE mg/g ekstrak daun papaya). Standar yang digunakan adalah asam galat dengan konentrasi (0, 20, 40, 60, 80, 100 ppm). Fenolik total standar ditentukan dengan metode yang sama dengan sampel.
Uji Kandungan Flavonoid Total (Jiang et al. 2009)
Sebanyak 0.5 mL dengan konsentrasi 1000 mg/L sampel daun papaya dalam bentuk ekstrak yang diperoleh dari penyiapan sampel ekstrak air dan etanol dilarutkan ke dalam tabung reaksi yang berisi 5 mL akuades. Kemudian, 0.3 mL NaNO2 5 % ditambahkan ke dalam tabung reaksi. Setelah lima menit reaksi, 0.6
mL AlCl3 10 % ditambahkan dan setelah enam menit ditambahkan 2 mL NaOH 1
M. Absorban larutan diukur pada panjang gelombang 510 nm dan flavonoid total ekstrak daun papaya dinyatakan sebagai milligram (mg) katekin ekuivalen per gram ekstrak basah (KE mg/g ekstrak daun papaya. Standar yang digunakan adalah katekin dengan konsentrasi (0, 20, 40, 60, 80, 100 ppm). Flavonoid total dari standar ditentukan menggunakan metode yang sama dengan sampel.
Uji Antioksidan dengan Metode DPPH (Blois 1958)
4
dilakukan pengenceran dengan etanol berdasarkan konsentrasi yang diukur. Ke dalam tiap well ditambahkan 100 µL larutan DPPH 1mM dan diinkubasi pada ruangan gelap selama 30 menit, selanjutnya serapan diukur pada panjang gelombang 517 nm menggunakan ELISA reader. Sebagai kontrol positif dan pembanding digunakan vitamin C (konsentrasi 0, 1.25, 2.5, 5, 10, 20 ppm). Aktivitas antioksidan dari kontrol positif ditentukan menggunakan metode yang sama dengan sampel.
Analisis Data (Mattjik 2002)
Data penelitian dianalisis secara statistik menggunakan metode Rancangan Acak Lengkap (RAL). Jika terdapat perbedaan yang nyata antara perlakuan yang diberikan, maka analisis dilanjutkan dengan uji Duncan menggunakan software
minitab.
HASIL
Kadar Air dan Rendemen Ekstrak Air dan Etanol Daun Pepaya
Kadar air daun pepaya diukur menggunakan metode gravimetri. Pengukuran kadar air daun pepaya segar dilakukan sebanyak tiga ulangan. Kadar air daun pepaya yang diperoleh yaitu sebesar 74.50 %. Daun pepaya yang diberi perlakuan perebusan selama lima menit dengan penambahan tanah menghasilkan rendemen yang paling tinggi yaitu 11.53 % pada ekstrak air dan rendemen yang paling rendah yaitu pada daun pepaya yang direbus selama tiga menit dengan penambahan tanah pada ekstrak etanol sebesar 4.05 % (Gambar 1). Berdasarkan uji statistik sampel yang diberi perlakuan tidak berpengaruh secara signifikan terhadap rendemen pada taraf 5 % (P>0.05).
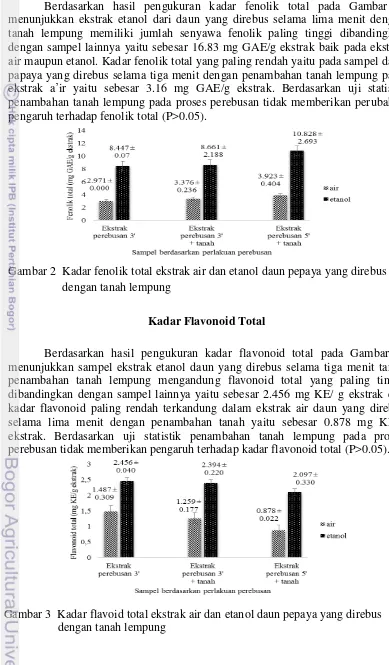
Kadar Fenolik Total
Berdasarkan hasil pengukuran kadar fenolik total pada Gambar 2, menunjukkan ekstrak etanol dari daun yang direbus selama lima menit dengan tanah lempung memiliki jumlah senyawa fenolik paling tinggi dibandingkan dengan sampel lainnya yaitu sebesar 16.83 mg GAE/g ekstrak baik pada ekstrak air maupun etanol. Kadar fenolik total yang paling rendah yaitu pada sampel daun papaya yang direbus selama tiga menit dengan penambahan tanah lempung pada ekstrak a’ir yaitu sebesar 3.16 mg GAE/g ekstrak. Berdasarkan uji statistik penambahan tanah lempung pada proses perebusan tidak memberikan perubahan pengaruh terhadap fenolik total (P>0.05).
Gambar 2 Kadar fenolik total ekstrak air dan etanol daun pepaya yang direbus dengan tanah lempung
Kadar Flavonoid Total
Berdasarkan hasil pengukuran kadar flavonoid total pada Gambar 3, menunjukkan sampel ekstrak etanol daun yang direbus selama tiga menit tanpa penambahan tanah lempung mengandung flavonoid total yang paling tinggi dibandingkan dengan sampel lainnya yaitu sebesar 2.456 mg KE/ g ekstrak dan kadar flavonoid paling rendah terkandung dalam ekstrak air daun yang direbus selama lima menit dengan penambahan tanah yaitu sebesar 0.878 mg KE/g ekstrak. Berdasarkan uji statistik penambahan tanah lempung pada proses perebusan tidak memberikan pengaruh terhadap kadar flavonoid total (P>0.05).
6
Aktivitas Antioksidan
Uji aktivitas antioksidan dari daun papaya yang diberi perlakuan memiliki nilai IC50 dari ekstrak dengan pelarut air, dan etanol 70% dapat dikatakan sangat
lemah, karena nilai IC50 yang diatas 200 ppm (Molyneux 2004). Semakin kecil
nilai IC50 menunjukkan kemampuan antioksidasi yang lebih baik dalam
menangkal radikal bebas. Hasil menunjukkan bahwa nilai IC50 yang terbaik
terdapat pada sampel ekstrak dengan perebusan tiga menit pada pelarut etanol 70% sebesar 528.495 ppm (Gambar 4). Berdasarkan uji statistik penambahan tanah lempung pada proses perebusan tidak memberikan pengaruh terhadap aktivitas antioksidan (P>0.05).
Gambar 4 IC50 ekstrak air dan etanol daun pepaya yang direbus dengan tanah
lempung
PEMBAHASAN
Kadar Air dan Rendemen Ekstrak Daun Pepaya
Pengukuran kadar air daun pepaya dilakukan dengan metode gravimetri, yaitu melalui proses pengeringan. Pengeringan merupakan proses menghilangkan air dari suatu bahan sehingga bahan tahan lama selama penyimpanan. Selain itu pengeringan akan meminimalkan senyawa kimia yang terurai oleh enzim. Penentuan kadar air daun pepaya segar bertujuan mengetahui kadar air yang umumnya digunakan oleh masyarakat untuk dikonsumsi dan untuk mengetahui kadar air daun pepaya yang digunakan dalam penelitian ini. Rata-rata kadar air yang diperoleh sebesar 74.50 % lebih rendah dibandingkan data kadar air daun pepaya segar menurut persatuan para ahli gizi Indonesia (2009) sebesar 75.40 %.
dengan metode ekstraksi lainnya (Astuti 2009). Metode ekstraksi secara infudasi menggunakan pelarut air (polar), dapat melarutkan senyawa alkaloid, triterpenoid, steroid, flavonoid, saponin, dan tannin (A’yun dan Laily 2015). Pelarut etanol (semipolar) digunakan untuk mengekstraksi secara maserasi, etanol 70 % dapat melarutkan flavonoid, saponin, dan alkaloid (Astuti 2009). Kedua metode ini menghasilkan rendemen yang berbeda. Perbedaan tersebut dikarenakan kemampuan pelarut dalam mengekstraksi/ menarik metabolit sekunder (Fardhani 2014).
Pelarut yang digunakan adalah pelarut yang dapat menarik sebagian besar metabolit sekunder yang terdapat dalam simplisia (Depkes RI 2008). Etanol memiliki rumus molekul C2H5OH, dimana C2H5OH merupakan gugus yang
bersifat non polar dan OH merupakan gugus yang bersifat polar, sehingga pelarut etanol dapat menarik kandungan kimia yang yang bersifat polar maupun non polar. Pemilihan pelarut air didasarkan pemanfaatan daun pepaya oleh masyarakat pada umumnya menggunakan air. Pelarut air memiliki kepolaran yang lebih tinggi dibandingkan dengan etanol, sehingga pelarut ini hanya dapat menarik senyawa aktif yang bersifat polar.
Hasil rendemen yang diperoleh, yaitu ekstrak air lebih tinggi dibandingkan dengan ekstrak etanol. Persentase rendemen menunjukkan banyaknya metabolit sekunder yang terekstrak dalam pelarut. Hasil tersebut membuktikan bahwa senyawa-senyawa aktif dalam daun pepaya lebih banyak terekstrak dalam air dibandingkan dengan etanol. Diduga kandungan metabolit yang ada pada daun papaya setelah direbus menggunakan tanah lempung cendrung bersifat polar. Kemungkinan lainnya pada ekstrak air memiliki pengotor yang lebih banyak dibandingkan dengan ekstrak etanol. Uji statistik menunjukkan bahwa perlakuan yang diberikan tidak berpengaruh terhadap rendemen yang dihasilkan pada taraf 5 %. Perbedaan rendemen yang diperoleh dapat disebabkan oleh beberapa faktor, yaitu ketebalan dinding sel, membran sel, dan pengaruh faktor genetik (Nurcholis 2008). Hasil penelitian Bustan et al. (2008) menunjukkan jumlah rendemen ekstrak dipengaruhi oleh waktu ekstraksi, jenis pelarut, perbandingan jumlah pelarut dengan bahan, suhu ekstraksi, dan ukuran partikel sampel.
Kadar Senyawa Fenolik Total
Penentuan kadar fenolik total bertujuan mengetahui jumlah keseluruhan senyawa golongan fenolik dalam sampel. Daun pepaya mengandung enzim papain, alkaloid karpain, pseudokarpain, glikosida, karposid, saponin, dan polifenol. Rasa pahit pada daun pepaya disebabkan oleh kandungan senyawa alkaloid karpain (C14H25NO2). Zat ini ampuh digunakan untuk menurunkan
demam, menurunkan tekanan darah, dan membunuh mikroba. Senyawa yang berpotensi sebagai antioksidan dalam tanaman adalah golongan fenolik seperti flavonoid, asam fenolik, lignin, asam sinamat, kumarin, tokoferol, dan tanin (Kahkonen et al. 1999). Polifenol dan flavonoid merupakan golongan fenol yang telah diketahui memiliki aktivitas antiseptik.
8
sebagai standar karena memiliki substansi yang stabil dan murni serta murah dibanding senyawa standar lainnya (Rahmawati 2009). Penentuan kandungan fenolik dapat dilakukan dengan menggunakan pereaksi Folin-Ciocalteu (Dass et al. 2012). Metode ini berdasarkan pada kekuatan mereduksi dari gugus hidroksi fenolik. Semua senyawa fenolik termasuk fenol sederhana dapat bereaksi dengan reagen Folin-Ciocalteu (Huang et al. 2005). Adanya senyawa aromatis fenol dapat mereduksi fosfomolibdat fosfotungstat menjadi molibdenum yang berwarna biru yang dapat diukur dengan spektrofotometer UV-Vis (Sudjadi dan Rohman 2004). Kandungan fenolik total dalam tumbuhan dinyatakan dalam GAE (galiic acid equivalent) yaitu jumlah kesetaraan miligram asam galat dalam 1 gram sampel (Gheldof dan Engeseth 2002).
Hasil penelitian menunjukkan ekstrak perebusan selama lima menit dengan penambahan tanah lempung mengandung fenolik total lebih tinggi dibandingkan tanpa tanah baik pada ekstrak etanol maupun air. Kadar fenolik daun pepaya yang direbus selama tiga menit dengan penambahan tanah lebih rendah dibandingkan perebusan selama lima menit. Hasil ini memperlihatkan bahwa lamanya waktu perebusan dengan penambahan tanah menghasilkan kadar fenolik total yang lebih besar dibandingkan tanpa penambahan tanah. Berdasarkan uji statistik, perlakuan yang diberikan tidak memberikan pengaruh yang nyata terhadap kadar fenolik total pada taraf 5 %. Kadar fenolik total pada penelitian lebih rendah jika dibandingkan dengan penelitian yang dilakukan oleh Addai et al. (2013) yang menggunakan buah pepaya segar varietas Hongkong dan Eksotika, yaitu sebesar 16.35-46.64 mg asam galat/100 g daun segar pada ekstrak metanol 50 % dan 67.50-63.38 mg asam galat/100 g daun segar pada ekstrak aseton 50 %.
Menurut Armin dan Ardila (2013), tanah lempung mengandung komponen anorganik seperti Al, Fe, Si, Ca, Na, K dan Mg serta oksigen. Pelarut polar akan melarutkan lebih baik zat-zat polar dan ionik. Menurut Baset et al. (1994), adanya elektrolit dapat menurunkan kelarutan zat terlarut. Pengaruh penambahan tanah pada proses perebusan hanya mempengaruhi rasa dari daun papaya namun tidak mempengaruhi kadar fenolik totalnya. Kadar fenolik total pada ekstrak etanol lebih besar dibandingkan dengan ekstrak air. Hal ini dikarenakan senyawa fenolik yang lebih bersifat polar telah terbuang pada air rebusan dan saat proses ekstraksi menggunakan pelarut air akan lebih rendah kadar fenoliknya dibanding etanol, karena etanol bersifat semi polar. Air merupakan pelarut universal, namun air memiliki polaritas yang paling besar dibandingkan dengan pelarut lainnya (Tiwari
et al. 2011). Ekstrak etanol lebih efektif pada tumbuhan yang mengandung polifenol, karena ekstrak etanol memiliki polaritas yang hampir sama dengan polifenol dibandingkan dengan ekstrak air. Selain itu, ekstrak etanol lebih efisien dalam mendegradasi dinding sel tumbuhan yang bersifat non-polar dan menyebabkan polifenol keluar dari sel. Sedangkan pada ekstrak air terjadi degradasi polifenol akibat aktivitas enzim polifenol oksidase, polifenol oksidase pada ekstrak etanol tidak aktif (Padmapriya et al. 2012).
Kadar Senyawa Flavonoid Total
adalah mengetahui hubungan antara aktivitas antioksidan dengan kandungan flavonoidnya. Dasar penentuan kandungan flavonoid secara spektrofotometri ini adalah adanya kemampuan flavonoid untuk membentuk kompleks dengan AlCl3
berwarna kuning, yang kemudian bereaksi dengan basa kuat (NaOH) membentuk warna merah muda yang diukur absorbansinya pada panjang gelombang 510 nm. Metode AlCl3 merupakan metode yang tepat untuk menentukan kadar flavonoid
golongan flavon dan flavonol (Chang et al. 2002).
Flavonoid merupakan salah satu dari kelompok senyawa fenolik yang dapat ditemukan di buah dan sayur (Farkas et al. 2004). Beberapa tahun belakang ini, flavonoid telah diteliti memiliki potensi yang besar untuk melawan penyakit yang disebabkan oleh penangkapan radikal (Amic et al. 2003). Berdasarkan perhitungan, total flavonoid lebih tinggi pada ekstrak daun yang direbus selama tiga menit tanpa penambahan tanah lempung dibandingkan dengan ekstrak daun papaya yang direbus lima menit pada ekstrak air maupun etanol. Flavonoid total pada percobaan menurun sedikit pada sampel yang direbus selama tiga menit menggunakan tanah dengan sampel yang direbus selama tiga menit tanpa tanah pada ekstrak air maupun etanol. Namun kadar flavonoid sampel menurun drastis pada ekstrak sampel perebusan dengan tanah lempung selama lima menit. Hal tersebut dapat diduga bahwa penurunan kadar flavonoid total disebabkan waktu perebusan. Semua perlakuan pada ekstrak etanol lebih besar dibandingkan ekstrak air. Berdasarkan uji statistik tidak terdapat pengaruh perlakuan terhadap kadar flavonoid pada taraf 5 %.
Kadar flavonoid total ekstrak etanol lebih banyak dibandingkan dengan ekstrak air disebabkan etanol mampu mengekstrak senyawa flavonoid yang bersifat polar maupun nonpolar dibandingkan dengan air yang hanya mengekstraksi senyawa flavonoid yang bersifat polar. Golongan flavonoid pada daun pepaya cenderung bersifat semipolar. Menurut penelitian Miean dan Mohamed (2001), golongan flavonoid yang dominan pada tanaman tropis, yaitu mirisetin, kuersetin, kaempferol, luteolin, dan apigenin. Senyawa flavonoid yang merupakan golongan dari polifenol tidak stabil terhadap perubahan pengaruh oksidasi, cahaya, dan perubahan kimia, sehingga apabila teroksidasi strukturnya akan berubah dan fungsinya sebagai bahan aktif akan menurun atau bahkan hilang (Handayani dan Sulistyo 2008).
Flavonoid total daun pepaya yang diperoleh lebih rendah jika dibandingkan dengan penelitian yang dilakukan oleh Miean dan Mohamed (2001), yaitu sebesar 1264 mg/kg berat kering pada tunas pepaya. Penelitian tentang total flavonoid pada dua jenis buah pepaya yaitu varietas Hongkong dan Eksotika oleh Addai et al. (2013) yang menyatakan bahwa ekstrak metanol 50 % antara 19.40-36.17 mg kuersetin/ 100 g daun segar dan 39.81-21.04 mg kuersetin/100 g daun segar pada ekstrak aseton 50 %. Berdasarkan hasil penelitian tentang pengaruh perebusan serta penambahan tanah terhadap daun pepaya, jika dibandingkan dengan kadar flavonoid total tanpa perlakuan maka dapat dikatakan bahwa daun pepaya yang telah diolah akan berkurang senyawa flavonoidnya.
Aktivitas Antioksidan
10
daun pepaya diukur menggunakan metode DPPH (1,1-diphenyl-2-picrylhydrazil). DPPH merupakan senyawa radikal bebas yang stabil dan tidak membentuk dimer akibat delokalisasi dari elektron bebas pada seluruh molekul. Uji aktivitas antioksidan dengan menggunakan metode ini didasarkan pada hilangnya warna ungu akibat tereduksinya DPPH oleh senyawa antioksidan dalam sampel, sehingga menghasilkan senyawa DPP Hidrazin (DPPHH) berwarna kuning. Metode ini tidak memerlukan substrat sehingga lebih sederhana dengan waktu analisis yang lebih cepat (Molyneux 2004). Metode DPPH telah banyak digunakan dalam analisis antioksidan seperti pada penelitian Anwariyah (2011) yang mengaji aktivitas antioksidan lamun Cymodocea rotundata dengan metode DPPH, selain itu Irianti et al. (2011) menguji aktivitas antioksidan DPPH oleh ekstrak etanolik batang brotowali dan fraksi-fraksinya.
Pengujian aktivitas antioksidan ekstrak air dan ekstrak etanol daun pepaya pada penelitian ini akan dibandingkan dengan aktivitas antioksidan yang dihasilkan oleh asam askorbat. Asam askorbat (vitamin C) dikenal sebagai antioksidan yang kuat karena dapat mendonorkan atom hidrogen dan membentuk radikal bebas askorbil yang relatif stabil seperti anion askorbat yang dapat menerima atom hidrogen lain dan membentuk asam dehidroaskorbat. Asam askorbat merupakan senyawa larut air yang memiliki cincin lakton tidak jenuh dengan dua gugus hidroksil melekat pada karbon berikatan rangkap. Struktur ini menyebabkan asam askorbat mudah dioksidasi menjadi asam dehidroaskorbat (Hart et al. 2003).
Aktivitas antioksidan hasil penelitian dinyatakan dalam IC50, yaitu
konsentrasi zat antioksidan yang menghasilkan persen penghambatan DPPH sebesar 50 %. Nilai IC50 diperoleh melalui persamaan linier antara persen inhibisi
dengan konsentrasi sampel. Semakin rendah nilai IC50 maka daya hambat ekstrak
terhadap radikal bebas semakin tinggi. Molyneux (2004) menggolongkan aktivitas antioksidan berdasarkan nilai IC50 yang diperoleh, yaitu sangat kuat (IC50<50
ppm), kuat (50 ppm< IC50>100ppm), sedang (100 ppm<IC50>150 ppm), lemah
(150 ppm<IC50>200 ppm), dan sangat lemah (IC50>200ppm).
Berdasarkan nilai IC50 yang diperoleh, daun yang direbus tiga menit tanpa
tanah pada ekstrak etanol memiliki aktivitas antioksidan tertinggi dengan nilai IC50 sebesar 525.495 ppm dan tergolong antioksidan sangat lemah. Berdasarkan
uji statistik, ekstrak etanol dan air ketiga sampel menunjukan tidak berpengaruh nyata terhadap penghambatan aktivitas radikal bebas DPPH. Hal ini ditunjukkan oleh nilai IC50 yang tidak terlalu berbeda antara ekstrak etanol dan ekstrak air
daun pepaya. Daun pepaya yang diberi perlakuan semuanya tergolong memiliki aktivitas antioksidan yang sangat lemah.
Aktivitas antioksidan ekstrak daun pepaya ini diduga karena kandungan senyawa flavonoid di dalamnya. Hal tersebut dikuatkan oleh hasil analisis komponen flavonoid ekstrak air dan etanol yang berbanding lurus dengan aktivitas antioksidan. Berdasarkan hasil penelitian, aktivitas antioksidan memiliki kolerasi positif terhadap kadar flavonoid, namun memiliki korelasi negatif dengan kadar fenolik.
Senyawa fenolik merupakan golongan yang besar, diduga senyawa fenolik yang masih tersisa dalam daun setelah perlakuan salah satunya adalah golongan flavonoid. Dapat dikatakan perlakuan menyebabkan penurunan fungsi dari daun pepaya sebagai sumber antioksidan alami terkait dengan menurunnya kadar flavonoid akibat perlakuan. Dewi (2006) menyatakan bahwa stabilitas komponen fenol terhadap panas mempengaruhi aktivitas antioksidannya. Aktivitas antioksidan cendrung menurun, hal ini disebabkan karena proses pemanasan menyebabkan beberapa perubahan kualitas baik secara fisik, biokimia, maupun komponen gizinya (Salunkhe dan Kadam 1990). Pemanasan meningkatkan laju oksidasi dan menyebabkan terjadinya degradasi yang membutuhkan panas. Perlakuan pemanasan dapat mempercepat oksidasi terhadap antioksidan yang terkandung dalam sistem bahan alam (Dewi 2006). Hal ini sesuai dengan pendapat Gazani et al. (1998) dalam Dewi (2006) yang menjelaskan bahwa pada pemanasan suhu tinggi dapat mengakibatkan kerusakan komponen tidak tahan panas termasuk didalamnya senyawa flavonoid. Sampai saat ini belum diketahui komponen yang bertindak sebagai antioksidan daun papaya yang labil terhadap pemanasan ataupun sebaliknya.
SIMPULAN DAN SARAN
Simpulan
Analisis kuantitatif yang dilakukan pada ekstrak air dan etanol daun papaya yang diberi perlakuan perebusan dan penambahan tanah lempung menunjukkan bahwa senyawa fenolik GAE dan flavonoid KE paling tinggi pada ekstrak etanol. IC50 yang terbaik pada perlakuan terdapat pada ekstrak etanol daun
yang direbus tanpa penambahan tanah selama tiga menit yang mempunyai nilai IC50 sebesar 528.495 ppm dan semua perlakuan tergolong memiliki aktivitas
antioksidan sangat lemah. Penambahan tanah lempung hanya mempengaruhi dari segi rasa, namun tidak mempengaruhi kadar fenolik, flavonoid total, dan aktivitas antioksidannya jika dibadingkan dengan daun yang direbus tanpa penambahan tanah lempung
Saran
12
DAFTAR PUSTAKA
Addai ZR, Abdullah A, Mutalib SA. 2013. Effect of extraction solvent on the phenolic content and antioxidant properties of two papaya cultivars. J Med Plant Research. 7(47):3353-3359.
Amic D, Amic DD, Beslo D, Trinasjtic N. 2003. Stucture-radical scavenging activity relationship of flavonoid. Croatica Chemica Acta. 76(1):55-61. Amrin, Ardila D. 2013. Analisis besi (Fe) dan aluminium (Al) dalam tanah
lempung secara spektrofotometri serapan atom. Prosiding semirata FMIPA Universitas Lampung [internet]. [Waktu dan tempat pertemuan tidak diketahui]. Lampung (ID): Jurusan Kimia FMIPA Universitas Negri Padang. hlm 17 – 22; [diunduh 2015 Apr 4]. Tersedia pada: http://jurnal.fmipa.unila.ac.id/index.php/semirata/article/view/785.
Andayani R. 2008. Penentuan aktivitas antioksidan, kadar fenolat total likopen pada buah tomat (Solanum lycopersicum L). J Sci and Tech Pharm. 13(1). Anwariyah S. 2011. Kandungan fenol, komponen fitokimia, dan aktivitas
antioksidan dalam lamun Cymodocea rotundata [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Astuti SD. 2009. Efek ekstrak etanol 70 % daun pepaya (Carica papaya, Linn.) terhadap aktivitas AST % ALT pada tikus galur wistar setelah pemberian obat tuberkulosis (isoniazid % rifampisin) [skripsi]. Surakarta (ID): Universitas Setia Budi.
A’yun Q, Laily AN. 2015. Analisis fitokimia daun pepaya (Carica papaya, L.) di balai penelitian tanaman aneka kacang dan umbi, Kendalpayak, Malang.
Seminar Nasional Konservasi dan Pemanfaatan Sumber Daya Alam
[internet]. [Waktu dan tempat tidak diketahui]. Malang (ID): Universitas Islam Negri Maulana Malik Ibrahim Malang. Hlm 134 – 137; [diunduh
2015 Mei 11]. Tersedia pada: http://jurnal.fkip.uns.ac.id/index.php/kpsda/article/view/5362/3778.
Ayoola GA, Coker HAB, Adesegun SA, Adepoju-bello AA, Obaweya K, Ezennia EC, Atangbayila TO. 2008. Phytochemical screening and antioxidant activities of some selected medicine plant used for malaria therapy in Southwestern Nigeria. Trop J Pharm Res. 7(3): 1019-1024.
Baset J, Pudjaatmaka AH, Setiono L. 1994. Vogel Kimia Analisis Kuantitatif Anorganik. Ed-4. Jakarta (ID): Erlangga.
Blois MS. 1958. Antioxidant determinations by the use of stable free radical.
Nature. 181:1199-1200.
BPOM. 2010. Acuan Sediaan Herbal Volume Kelima Edisi Pertama. Jakarta (ID): BPOMRI.
Bustan MD, Febriyani R, Papkhan H. 2008. Pengaruh waktu ekstraksi dan ukuran partikel terhadap oleoresin jahe yang diperoleh dalam berbagai jumlah pelarut. Journal Teknik Kimia. 15:16-26.
Chang CC, Yang MH, Wen HM, Chern JC. 2002. Estimation of total flavonoid content in propolis by two complementary colorimetric methode. Journal of Food and Drug Analysis. 10(2):178-182.
Dass AK, Rajkumar V, Verma AK, Swarup D. 2012. Moringa oleifera leaves extract: a natural antioxidant for retarding lipid peroxidation in cooced goat meat paties. International Journal Food Science Technology. 47:585-591. Depkes RI. 2008. Farmakope Herbal Indonesia Edisi I. Jakarta (ID): Departemen
Kesehatan Republik Indonesia.
Dewi K. 2006. Identifikasi dan karakterisasi antioksidan dari jus Aloe chinensis dan evaluasi potensi Aloe-Emodin sebagai antifotooksidan dalam sistem asam linoleat [disertasi]. Jogjakarta (ID): Universitas Gajah Mada.
Fardhani HL. 2014. Pengaruh metode ekstraksi secara infudasi dan maserasi daun asam jawa (Tamarindus indica L.) terhadap kadar flavonoid total [skripsi]. Jogjakarta (ID): Universitas Gajah Mada.
Farkas O, Jakus J, Herberger K. 2004. Quantitative structure antioxidant activity relationships of flavonoid compound. Molecules. 9:1079-1088.
Figueroa LA, Navarro LB, Vera MP, Petricevich VL. 2014. Antioxidant activity, total phenolic and flavonoid contents, and citotocixity evaluation of
Bougaanvillea xbutianna.In J Pharm Sci. 6(5):497-502.
Gamulle A, Ratnasoorya WD, Jayakody JRAC, Fernando C, Kanatiwela C, Udagama PV. 2012. Trombocytosis and anti-inflamatory properties, and toxicological evaluation of Carica papaya mature leaf concentrate in a murine model. Online Int J Med Plant Res. 1(2): 1-30.
Gheldof N, Engeseth NJ. 2002. Antioxidant capacity of honey form various floral source based on determination of oxygen radical absorbance capacity and inhibition of in vitro lopoprotein oxidant in human serum sampel. J Agr and Food Chem. 50(10):3050-3055.
Handayani R, Sulistyo J. 2008. Sintesis senyawa flavonoid-α-glikosida secara reaksi transglikosilasi enzimatik dan aktivitasnya sebagai antioksidan. J Biodiversitas. 9(1):1-4.
Hart H, Craine LE, Hart DJ. 2003. Kimia Organik: suatu Kuliah Singkat Edisi Kesebelas. Achmadi SS, penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: Organic Chemistry: A Short Course Elevent Edition.
14
Irianti T, Puspita A, Suryani E. 2011. Aktivitas penangkapan radikal 2,2-diphenyl-pikrilhidrazil oleh ekstrak etanolik batang brotowali (Tinospora crispa (L.) Miers) dan fraksi-fraksinya. Majalah Obat Tradisional.
16(3):138-144.
Javanmardi J, Stushnoff C, LockeE, Vivanco JM. 2003. Antioxidant activity and total phenolic content of Iranian Ocimum accessions. Food Chemistry.
83:547-550.
Jiang G, Prasad KN, Yang B, Dong X, Zhang H, Xie H, Jiang Y. 2009. Flavonoid content and antioxidant activities from Cinnamomum species. Innov Food Sci. Emerg. 10:627-632.
Kahkonen MP, Hopia AI, Furella HC. 1999. Antioxidant activity of extract containing phenolic compound. J Agr Food Chem. 47:3854-3962.
Krishna JL, Paridhavi M, Patel A. 2008. Review on nutritional, medical, and pharmacological properties of papaya (Carica papaya Linn.). Natural Product Radiance. 7(4):364-373.
Mattjik AA, Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SASS dan Minitab. Bogor (ID): Institut Pertanian Bogor.
Miean KH, Mohamed S. 2001. Flavonoid (myricetin, quercetin, kaemferol, luteolin, dan apigenin) content of edible tropical plants. J Agr Food Chem.
49(6):3106-3112.
Molyneux P. 2004. The use of the stable free radical (DPPH) for estimating antioxidant activity. J Sci and Tech. 26:211-219.
Nurcholish W. 2008. Profil senyawa penciri dan bioaktivitas tanaman temulawak pada agrobiofisik berbeda [tesis]. Bogor: Program Pasca Sarjana, IPB. Padmapriya K, Abishek D, Dutta D. 2012. Nicrowave assisted extraction of
mangiferin from Curcuma amada. Biotech. 2(1):27-30.
Persatuan Ahli Gizi Indonesia. 2009. Tabel Komposisi Pangan Indonesia. Jakarta (ID): PT. Alex Media Komputindo.
Rahmat A, Rosli R, Zain WNIWM, Endrini S, Sani HA. 2002. Antiproliferative activity of pure lycopene compared to both extracted lycopene and juice from watermelon (Citrullus vulgaris) and papaya (Carica papaya) on human breast and liver cancer cell line. J Med Sci. 2(2):55-58.
Rahmawati A. 2009. Kandungan fenol total ekstrak buah mengkudu (Morinda citrifolia) [skripsi]. Jakarta (ID): Universits Indonesia.
Rohdiana D. 2001. Radical scavanger activity of tea pholyphenol. Majalah Farmasi Indonesia. 12(1):53-58.
Sudjadi, Rohman A. 2004. Analisa Obat dan Makanan. Yogyakarta (ID): Pustaka Pelajar.
Subeki. 1998. Pengaruh cara pemasakan terhadap kandungan β-karoten beberapa macam sayuran serta daya serap dan retensinya pada tikus percobaan [tesis]. Bogor (ID): Institut Pertanian Bogor.
Suresh K, Deepa P, Harisaranraj R, Vaira AV. 2008. Antimicrobial and phytochemical investigation of the leaf of Carica papaya L., Cynodon dactylon (L.) Pres., Euporbhia hirta L., Melia azedarach L. dan Psidium guajava L. Etnhobotanical Leaflets. 12:1184-1191.
Tiwari P, Kumar B, Kaur M, Kaur G, Kaur H. 2011. Phytochemical screening and extraction. Int Pharmaceutica Science. 1(1): 98-106.
Walker J. 2012. The Protein Protocol Handbook. Totowa (US): Humana Press Inc.
WHO. 1998. Quality Control Method for Medical Plant Material. Geneva (CH): Healath Organitation.
Widyawati PS, Wijaya CH, Harjosworo PS, Sajuthi D. 2010. Pengaruh ekstraksi dan fraksinasi terhadap kemampuan menangkap radikal bebas DPPH (1,1-difenil-2-pikrilhidrazil) ekstrak dan fraksi daun beluntas (Pluchea indica
16
Lampiran 1 Diagram alir penelitian
Daun pepaya segar Penentuan kadar air
Daun pepaya rebus
3’ Daun pepaya rebus 3’ dengan tanah
Daun pepaya rebus 5’ dengan tanah Direbus 3’ dengan tanah Direbus 3’ dengan tanah Direbus 5’
Diekstraksi dengan air dan etanol
Ekstrak air rebus 3’ dan ekstrak etanol rebus 3’
Ekstrak air rebus 3’ dengan tanah dan ekstrak etanol rebus
3’dengan tanah
Ekstrak air rebus 5’ dengan tanah dan ekstrak etanol rebus
5’dengan tanah
Diuji fenolik total, flavonoid total, dan aktivitas antioksidan
Kadar fenolik total Kadar flavonoid total
18
Lampiran 2 Kadar air dan rendemen ekstrak Data kadar air daun pepaya
Ulangan Bobot sampel % Kadar air
Data hasil rendemen ekstrak air dan etanol
Lampiran 3 Perhitungan inhibisi dan IC50 ekstrak daun pepaya
I. Persen inhibisi dan IC50 vitamin C
Data absorban, persen inhibisi, dan IC50 vitamin C Konsentrasi
(ppm)
Absorban (λ 517 nm) Inhibisi (%) Rata-rata
inhibisi (%)
II. Persen inhibisi dan IC50 ekstrak air dan etanol daun pepaya
20
Lampiran 3. (Lanjutan)
Perhitungan persen inhibisi dan IC50 (lanjutan)
Sampel Konsentrasi
Ekstrak air daun rebus 3’ 50 ppm
a. Rata-rata inhibisi (%) =
=
= 7.15 % b. IC50
IC50ekstrak air daun rebus 3’
Persamaan linier:
Lampiran 4 Uji kadar fenolik total daun pepaya
Absorbansi standar asam galat pada kandungan total fenolik
Jenis larutan Absorban (λ 765 nm)
Standar 10 ppm 0.058
Absorban sampel dan kandungan total fenolik ekstrak
Pelarut Perlakuan Ulangan Absorban
22
Lampiran 4, (Lanjutan) Keterangan:
X = Kandungan fenolik awal FP = Faktor pengenceran Bobot awal sampel = 0.005 g
Contoh perhitungan ekstrak air Direbus 3’ ulangan 1
Total fenolik = = 2.971
Contoh perhitungan ekstrak etanol Direbus 3’ ulangan 1
Total fenolik =
Lampiran 5 Uji kadar flavonoid total daun pepaya Absorban standar katekin pada kandungan total flavonoid
Jenis larutan Absorban (λ 510 nm)
Standar 10 ppm 0.012
Absorban sampel dan kandungan total flavonoid ekstrak
Pelarut Perlakuan Ulangan Absorban
24
Lampiran 5. (Lanjutan) Keterangan:
X = Kandungan flavonoid awal FP = Faktor pengenceran
Bobot awal sampel = 0.01 g Contoh perhitungan ekstrak air Direbus 3’ ulangan 1
Total flavonoid =
= 1.706
Contoh perhitungan ekstrak etanol Direbus 3’ ulangan 1
Total flavonoid =
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 20 Desember 1993. Penulis merupakan anak ketiga dari tiga bersaudara dari pasangan Loso Darwanto dan Subewati. Penulis memulai jenjang pendidikan formal di SDN 03 Pagi, Jakarta Timur (2001-2005). Pendidikan menengah pertama ditempuh penulis di SMPN 90, Jakarta Timur (2005-2008) sementara pendidikan menengah atas ditemuh di SMAN 59, Jakarta Timur (2008-2011). Penulis diterima di Institut Pertanian Bogor pada tahun 2011 melalui jalur Seleksi Perguruan Tinggi Negri Undangan (SNMPTN undangan). Selama masa perkuliahan, penulis aktif dalam berbagai organisasi seperti Himpunan Profesi Biokimia Community of Research and Education in Biochemistry (CREBs) sebagai Badan Pengurus Harian (BPH) (2012-2013) dan anggota pengawas (2013-2014). Penulis juga aktif sebagai asisten mata kuliah Biologi Dasar, Mikrobiologi Dasar, Biokimia Umum, serta Biokimia Klinis.