INDUKSI KALUS JERUK SIAM TRIPLOID DAN
TRANSFORMASI GENETIK PADA JERUK SIAM
(
Citrus nobilis
L.)
DANU KUANSA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul induksi kalus jeruk siam triploid dan transformasi genetik pada jeruk siam (Citrus nobilis L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Danu Kuansa
ABSTRAK
DANU KUANSA. Induksi Kalus Jeruk Siam Triploid dan Transformasi Genetik pada Jeruk Siam (Citrus nobilis L.). Dibimbing oleh AGUS PURWITO dan MIA KOSMIATIN.
Penelitian bertujuan untuk mendapatkan komposisi media terbaik untuk induksi kalus jeruk siam triploid dari beberapa jenis eksplan dan regenerasi kalus jeruk hasil transformasi genetik. Penelitian dibagi menjadi 3 kegiatan. Kegiatan pertama ditujukan untuk menginduksi kalus embriogenik jeruk triploid dengan eksplan buku, ruas, dan daun yang diisolasi dari tunas in vitro jeruk siam triploid. Eksplan dikulturkan pada media MS + vitamin MW + EM 500 mgL-1 dengan penambahan BA 1; 2; dan 3 mgL-1. Kegiatan kedua merupakan kegiatan transformasi untuk mengintegrasikan konstruk gen yang berisi marka seleksi (gen gus dan antibiotik kanamisin) dengan vektor Agrobacterium tumefaciens pada kalus embriogenik jeruk triploid. Kegiatan ketiga dilakukan untuk meregenerasikan kalus embriogenik kandidat transforman pada beberapa formulasi media regenerasi. Kalus hasil proses transformasi genetik ditumbuhkan pada media-media yang mengandung vitamin MS dan MW dengan tambahan bahan organik EM 500 mgL-1 dan air kelapa 10; 20; dan 30%. Kalus hasil proses transformasi genetik yang sudah melalui proliferasi diregenerasikan pada media dasar MS dengan kombinasi ZPT IAA 0.01 mgL-1, BA 0.01 mgL-1, TDZ 0.01 mgL-1 dan Kinetin 0.01 mgL-1. Hasil penelitian menunjukkan bahwa konsentrasi BA yang optimal untuk induksi kalus adalah 3 mgL-1, sedangkan perbedaan jenis eksplan tidak memberikan hasil yang berbeda. Frekuensi pemberian antibiotik untuk membersihkan kalus dari bakteri A. tumefaciens menunjukkan hasil terbaik jika dilakukan setiap hari. Pertumbuhan terbaik kalus hasil transformasi genetik terjadi pada media MS yang mengandung vitamin MW dengan penambahan bahan organik EM 500 mgL-1. Kombinasi media yang digunakan untuk regenerasi kalus hasil transformasi genetik belum dapat meregenerasikan kalus menjadi tanaman.
Kata kunci: Antibiotik, bahan organik, komposisi media, konsentrasi BA, vitamin.
ABSTRACT
DANU KUANSA. Callus Induction of Triploid Siam Tangerine and Genetic Transformation of Siam Tangerine (Citrus nobilis L.). Supervised by AGUS PURWITO and MIA KOSMIATIN.
callus growth results of transformant callus occurs in medium MS containing vitamin MW with the addition of organic material EM 500 mgL-1. The combination of medium used for regeneration of transformant tangerine callus has not succesful yet in regenerating callus into planlet.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
INDUKSI KALUS JERUK SIAM TRIPLOID DAN
TRANSFORMASI GENETIK PADA JERUK SIAM
(
Citrus nobilis
L.)
DANU KUANSA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2014 ini adalah Induksi Kalus Jeruk Siam Triploid dan Transformasi Genetik pada Jeruk Siam (Citrus nobilis L.).
Terima kasih penulis ucapkan kepada:
1. Ayah, Ibu, Kakak, dan Adik yang telah memberikan dukungan, doa dan kasih sayangnya yang tak terhingga.
2. Bapak Dr Ir Agus Purwito, MSc.Agr dan Ibu Dr Mia Kosmiatin, SSi MSi selaku pembimbing yang telah banyak memberikan pengarahan, perhatian, dan saran selama ini.
3. Bapak Prof. Dr. Ir.Memen Surahman, MSc.Agr selaku dosen pembimbing akademik.
4. Ibu Dr Ir Diny Dinarti MSi selaku dosen penguji
5. Laboraturium in vitro Kelompok Peneliti Biologi Sel dan Jaringan, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB Biogen) sebagai tempat dilaksanakannya penelitian.
6. Beasiswa POM-IPB dan Bidik Misi yang telah membantu kelancaran studi saya di bidang keuangan.
7. Teman-teman Edelweiss AGH 47 khususnya Adi Sukmo, Budi Firman Haryono, I Made Arisudana Putra, Iskandar Zulkarnaen, Listya Pramudita, M. Prayogi, M. Taufiq Abdullah, Yogo Ardi Nugroho, Aisa Amanah, Erin Puspita Rini, Mita Dianasari, dan lain-lain.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2015
DAFTAR ISI
PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
Hipotesis 3
TINJAUAN PUSTAKA 3
Tanaman Jeruk 3
Kultur Jaringan 3
Media Tanam Kultur Jaringan 4
Induksi Kalus pada Jeruk 4
Transformasi Genetik Jeruk 5
METODE PENELITIAN 6
Waktu dan Tempat 6
Bahan dan Alat Penelitian 6
Metode Percobaan 6
Pelaksanaan Percobaan 9
Pengamatan 11
HASIL DAN PEMBAHASAN 11
KESIMPULAN DAN SARAN 22
Kesimpulan 22
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 26
DAFTAR TABEL
1. Persentase pengaruh asal eksplan dan konsentrasi BA terhadap
munculnya kalus pada minggu ke-8 11
2. Rekapitulasi sidik ragam pengaruh asal eksplan dan konsentrasi BA 12 3. Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk 12 4. Rekapitulasi sidik ragam pengaruh jenis vitamin dan konsentrasi EM
terhadap pertambahan berat kalus yang sudah ditransformasi 17 5. Pengaruh vitamin dan bahan organik terhadap pertambahan berat kalus
yang sudah ditransformasi 17
6. Pengaruh interaksi antara vitamin dan bahan organik terhadap pertambahan berat kalus yang sudah ditransformasi pada 2 minggu
pertama 18
DAFTAR GAMBAR
1. Kalus yang terbentuk pada minggu ke-2dan minggu ke-8 setelah kultur 13 2. Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk pada
eksplan daun jeruk siam yang diregenerasikan dari jaringan endosperma 14 3. Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk pada
eksplan ruas jeruk siam yang diregenerasikan dari jaringan endosperma 14 4. Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk pada
eksplan buku jeruk siam yang diregenerasikan dari jaringan endosperma 14 5. Persentase kalus berwarna putih kekuningan yang terbentuk saat
induksi kalus 15
6. Persentase kalus putatif transforman bersih/steril setelah perlakuan antibiotik dengan frekuensi pemberian antibiotik yang berbeda 15
7. Keragaan kalus saat transformasi genetik 16
8. Proliferasi kalus bagian 1 pada minggu ke-4 19
9. Pengaruh bahan organik terhadap pertambahan berat kalus yang sudah
ditransformasi 19
PENDAHULUAN
Latar Belakang
Jeruk merupakan salah satu komoditas tanaman buah yang sangat digemari di Indonesia. Buah jeruk selalu tersedia sepanjang tahun meskipun berasal dari berbagai daerah dan impor. Harga jeruk yang terjangkau juga menjadi salah satu alasan mengapa buah ini digemari.
Indonesia merupakan negara tropis, berbagai jenis jeruk banyak dijumpai dan dibudidayakan mulai dari dataran rendah hingga dataran tinggi. Bahkan beberapa jenis jeruk tersebut telah menjadi unggulan daerah maupun nasional, salah satunya di Sumatera Utara yaitu jeruk siam madu (Martasari dan Mulyanto 2008). Jeruk siam (Citrus nobilis lour var. microcorva) menjadi salah satu komoditi tanaman hortikultura yang mempunyai prospek baik dan termasuk tanaman unggulan nasional karena dibutuhkan oleh penduduk baik dalam negeri maupun luar negeri, kaya vitamin c dan zat penting lainnya untuk kesehatan manusia (Ditjen Hortikultura 2006). Tantangan untuk masa yang akan datang dalam mengantisipasi permintaan pasar adalah menciptakan tehnologi yang mampu meningkatkan produksi pertanian, baik kualitas maupun kuantitasnya, menciptakan nilai tambah serta meningkatkan efesiensi pemanfaatan sumberdaya (Nurasa dan Hidayat 2008)
Menurut Husni (2010) kebutuhan pasar dunia terhadap buah jeruk yang dikonsumsi segar saat ini perlu memenuhi kategori buah yang tidak berbiji (seedless), mudah dikupas, dan penampilan yang menarik. Perbaikan mutu buah melalui pemuliaan perlu segera dilakukan untuk memenuhi trend kebutuhan pasar dunia. Salah satu cara yang dapat digunakan untuk mendapatkan jeruk tanpa biji adalah dengan perbanyakan melalui kultur endosperma sehingga diperoleh tanaman triploid yang secara alami akan sulit membentuk biji (Kosmiatin 2013).
Periode Juvenil jeruk relatif lama, 3-15 tahun bergantung pada jenis, menjadi salah satu masalah penting dalam upaya pemuliaan jeruk. Perbaikan genetik tanaman jeruk bisa memakan waktu yang sangat lama jika tidak diupayakan percepatan fase reproduksi jeruk. Akibat dari lamanya masa vegetatif jeruk membuat proses pemuliaan secara konvensional dapat berlangsung cukup lama. Hal ini juga mempengaruhi nilai produksi buah jeruk karena lamanya waktu sampai tanaman jeruk dapat menghasilkan (Khan 2007).
2
Penggunaan kalus embriogenik pada transformasi genetik diharapkan mampu memberikan hasil yang lebih baik karena dari kalus embriogenik dapat diregenerasikan 1 sel menjadi tanaman lengkap, sehingga perubahan pada sel tersebut dapat terekspresi pada seluruh bagian tanaman.Tanaman yang dihasilkan diharapkan mampu mengekspresikan perubahannya (Kosmiatin et al. 2013).
Kemampuan kalus untuk tumbuh pasca transformasi genetik perlu diketahui karena kalus yang mengalami proses transformasi genetik akan mengalami stress sehingga kemampuan regenerasinya akan mengalami penurunan. Kemampuan tumbuh kalus dapat dilihat dari kemampuannya untuk berproliferasi. Proliferasi pada kalus dilakukan untuk memperbanyak kalus hasil transformasi. Kemampuan kalus untuk tumbuh atau berproliferasi dapat dilihat dari bertambahnya berat kalus dan diameter kalus (Wulansari et al. 2015).
Transformasi genetik akan dilakukan pada kalus yang diinduksi dari tunas jeruk siam triploid, sehingga tanaman transforman yang dihasilkan juga bersifat triploid. Kualitas buah tanaman triploid meningkat karena tidak berbiji, lebih besar, dan lebih produktif. Tanaman triploid lebih bernilai ekonomi karena dapat memperbaiki mutu dan kualitas buahnya (Kosmiatin 2013). Sifat tanaman triploid yang sulit untuk membentuk biji (embrio tidak fertil) juga dapat dimanfaatkan dalam transformasi genetik untuk mencegah terjadinya gene flow.
Pada jeruk, umumnya induksi kalus dilakukan dengan menambahkan BA pada media induksi kalusnya (Khan et al. 2009). Induksi kalus dari embrio nuselar dan zigotik jeruk Siam berhasil dilakukan dengan baik pada media MS modifikasi dengan penambahan BA 3 mgL-1 (Husni et al. 2010). Penggunaan komposisi media yang sama diharapkan mampu memberikan hasil yang sama baiknya pada tanaman triploid jeruk.
Beberapa variasi dan kombinasi dari Zat Pengatur Tumbuh (ZPT) digunakan untuk menentukan respon terbaik pada induksi kalus dari berbagai jenis eksplan. Jenis eksplan yang digunakan meliputi daun, batang/ruas, kotiledon, dan akar (Ali dan Mirza 2006).
Eksplan tanaman yang ditransformasi genetik dengan menggunakan
Agrobacterium tumefaciens akan mengalami infeksi oleh bakteri tersebut. Eksplan yang telah ditransformasi dipindahkan pada medium disinfeksi yang mengandung Sefotaksim selama 6 hari untuk mengeliminasi bakteri (Tangapo et al. 2012). Eliminasi bakteri dapat dilakukan dengan menggunakan teknik lain yaitu dengan meneteskan antibiotik secara langsung pada eksplan, namun efektivitas dari teknik ini masih perlu diketahui.
3 Tujuan
Tujuan percobaan ini adalah untuk mempelajari pengaruh konsentrasi BA dan jenis eksplan jeruk siam triploid terhadap induksi kalus, pengaruh frekuensi pemberian antibiotik pasca kokultivasi bakteri dalam proses transformasi genetik dan mempelajari kemampuan tumbuh dan regenerasi dari kalus hasil transformasi genetik.
Hipotesis
1. Terdapat konsentrasi BA optimum dan asal eksplan terbaik dari tunasin vitro jeruk triploid dalam induksi kalus.
2. Terdapat frekuensi optimum untuk sterilisasi kalus hasil transformasi genetik dengan menggunakan sefotaksim 400 mgL-1.
3. Terdapat komposisi media terbaik untuk proliferasi dan regenerasi kalus jeruk hasil transformasi genetik
TINJAUAN PUSTAKA
Tanaman Jeruk
Tanaman jeruk (Citrus sp.) merupakan tanaman buah tahunan yang berasal dari Asia. China dipercaya sebagai tempat jeruk pertama kali tumbuh. Tanaman jeruk telah tumbuh di Indonesia baik secara alami atau dibudidayakan semenjak ratusan tahun yang lalu. Tanaman jeruk di Indonesia merupakan peninggalan orang Belanda yang mendatangkan jeruk manis dan jeruk keprok dari Amerika dan Itali ke Indonesia (Menegristek 2000).
Jeruk memiliki biji yang bersifat poliembrionik dan berwarna sedikit kekuning-kuningan. Tanaman ini memiliki buah yang mengandung vitamin C dan flavonoid yang cukup tinggi. Jeruk juga mengandung vitamin lain yang tidak kalah penting yaitu vitamin A, tiamin niasin, riboflavin, asam pentonenat, biotin, asam folat, inotisol, dan tokoferol (BB-Pascapanen 2009). Jeruk Siam memiliki jumlah biji yang relatif banyak dalam setiap buahnya (15-23 biji per buah) sehingga kalah bersaing dengan buah jeruk impor (Husni et al. 2010)
Kultur Jaringan
4
Teknologi kultur jaringan juga dapat lebih menjamin keseragaman, bebas dari penyakit, serta biaya pengangkutan yang lebih murah.
Banyak metode dalam teknik kultur jaringan, selain untuk tujuan perbanyakan dalam jumlah besar dan cepat juga menjadi metode untuk tujuan pemuliaan tanaman, menghasilkan jenis tanaman yang baru yang memiliki sifat-sifat unggul yang diinginkan. Kultur jaringan juga menjadi sarana dalam pemuliaan non-konvensional seperti rekayasa genetika, mutagenesis in vitro, seleksi in vitro, kultur antera, memanipulasi jumlah kromosom dengan mutagen kimia, meregenerasikan jaringan tertentu seperti endosperma dengan kromosom 2n=3�, hibridasi somatik melalui fusi protoplas (Pierik 1997).
Media Tanam Kultur Jaringan
Media tanam sangat penting untuk pertumbuhan dan produksi tanaman yang optimal. Kondisi media tanaman yang sesuai bisa didapatkan dari kombinasi antara bahan-bahan organik maupun anorganik (Hartmann et al. 1990). Dalam pertumbuhan dan perkembangan tanaman secara in vitro, terdapat 4 faktor yang mempengaruhi, faktor-faktor tersebut adalah genetik, nutrisi, lingkungan dan bahan organik (Pierik 1997). Nutrisi dan bahan organik pada kultur jaringan disediakan dalam media yang digunakan, karena itu media memiliki peran yang penting dalam keberhasilan kultur jaringan.
Media kultur jaringan secara umum terdiri dari nutrisi makro, nutrisi mikro, karbon, vitamin, asam amino, dengan tambahan zat pengatur tumbuh (ZPT) dan bahan organik lainnya. Formulasi media Murashige Skoog (MS) merupakan formulasi yang paling sering digunakan karena mengandung unsur-unsur yang cukup lengkap untuk mendukung pertumbuhan tanaman (Evans et al. 1981). Media merupakan salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur jaringan. Media kultur secara fisik dapat berbentuk cair atau padat (Yusnita 2003). Penambahan ZPT pada media kultur merupakan kunci keberhasilan regenerasi tanaman secara in vitro.
Zat pengatur tumbuh (ZPT) berperan besar dalam mengarahkan pertumbuhan dan perkembangan sel tanaman. Kombinasi ZPT yang tepat akan menghasilkan pertumbuhan sel yang optimal (Wattimena 1992). Auksin (NAA, IBA, IAA, 2,4D) biasa digunakan untuk menginduksi pembentukan kalus, kultur suspensi, dan akar, dengan memacu pemanjangan dan pembelahan sel di dalam jaringan kambium (Pierik 1997). Sitokinin (BA, Kinetin, Zeatin) digunakan untuk pembentukan tunas. Zat penghambat seperti ABA berfungsi sebagai penghambat perkecambahan dini embrio somatik sehingga pendewasaan embrio somatik terjadi dengan normal dan ABA juga berperan sebagai inhibitor tanaman.
Induksi Kalus dan Embriogenesis Somatik pada Jeruk
5 terbentuk kalus embriogenik peran ZPT selanjutnya adalah mendewasakan serta mengecambahkan embrio somatik tersebut menjadi planlet (tanaman lengkap) (Merigo 2011).
Media MS banyak digunakan untuk menginduksi kalus jaringan tanaman Jeruk (Dominguez et al. 2000). Media MS juga dapat digunakan sebagai media dasar untuk menginduksi pembentukan kalus dari jaringan daun, batang dan kotiledon dari kecambah jeruk lemon (C. jambhiri Lush.) dengan keberhasilan 16-92% pada media dasar tersebut ditambahkan kombinasi ZPT 2,4-D, BA, dan NAA (Ali dan Mirza 2006).
Sutjahjo (1994) menjelaskan bahwa terdapat dua macam kalus yang terbentuk dalam kultur in vitro suatu tanaman, yaitu kalus embriogenik dan kalus non embriogenik. Kalus embriogenik adalah kalus yang mempunyai potensi untuk beregenerasi menjadi tanaman melalui organogenesis atau embriogenesis. Sedangkan kalus non embriogenik adalah kalus yang mempunyai kemampuan sedikit atau tidak mempunyai kemampuan untuk beregenerasi menjadi tanaman.
Embriogenesis somatik adalah proses berkembangnya sel-sel somatik (haploid mapun diploid) membentuk tanaman baru melalui tahapan perkembangan embrio yang spesifik tanpa melalui fusi gamet (Purnamaningsih 2002). Perbanyakan tanaman dengan teknik kultur jaringan melalui embriogenesis somatik dapat dikatakan berhasil bila persentase kalus embriogenik yang diperoleh cukup tinggi (Lizawati 2012). Yuwono (2008) menyatakan bahwa tahapan yang dilalui terdiri dari pembentukan kalus embriogenik, pendewasaan, dan tahap pengecambahan.
Keberhasilan embriogenesis somatik yang diinduksi ditentukan oleh beberapa faktor, antara lain tahap perkembangan jaringan dan formulasi media. Sifat embriogenik dari kalus yang dihasilkan terkait dengan asal eksplan yang digunakan. Kalus yang terbentuk dari jaringan nuselus mempunyai sifat embriogenik sehingga mudah membentuk embrio (Wulansari et al. 2015). Jaringan ini bersifat meristematis dan lebih responsif terhadap medium in vitro
dibandingkan dengan jaringan yang lebih dewasa (Devy et al. 2012). Transformasi Genetik Jeruk
Perkembangan ilmu pengetahuan, khususnya bidang biologi molekuler, mengenalkan teknik transformasi genetika sebagai suatu metode dalam upaya perbaikan tanaman. Teknik transformasi genetika digunakan sebagai metode untuk menciptakan varietas baru dengan sifat-sifat unggul. Transformasi gen melalui bakteri Agrobacterium tumefaciens merupakan cara yang relatif murah dan lebih alami dibandingkan dengan penggunaan particle bombardment dan
micro injection. Selain itu gen yang ditransformasi dengan A. tumefaciens
6
Seleksi terhadap sel-sel transforman merupakan faktor kunci dalam keberhasilan metode yang dikembangkan untuk transformasi genetik. Gen-gen penyebab tumor yang berasosiasi dengan A. tumefaciens (Hernalsteens et al. 1980) dapat digunakan sebagai penanda seleksi. Beberapa faktor mempengaruhi kemampuan atau efektifitas bahan kimia yang digunakan untuk seleksi. Bahan-bahan penyeleksi tersebut bersifat toksik untuk sel tanaman. Jadi toksin yang paling efektif adalah toksin yang menghambat pertumbuhan atau mematikan sel-sel non-transforman secara perlahan-lahan. Antibiotik kanamisin, G418 dan higromisin adalah antibiotik yang saat inisecara luas digunakan sebagai bahan penyeleksi. Tekanan seleksi akan optimal apabila menggunakan konsentrasi toksin yang paling rendah yang mampu mematikan jaringan yang tidak tertransformasi dan tetap mempertahankan pertumbuhan sel-sel transforman (Gatehouse et al.,1992).
METODE PENELITIAN
Waktu dan Tempat
Penelitian dilaksanakan di Laboratorium Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Jalan Tentara Pelajar, Cimanggu, Bogor. Percobaan ini dilaksanakan pada bulan Februari 2014 sampai dengan bulan Februari 2015.
Bahan dan Alat Penelitian
Bahan tanaman yang digunakan sebagai bahan eksplan adalah tunas in vitro jeruk siam (Citrus nobilis L.) triploid yang diregenerasikan dari jaringan endosperma. Media tumbuh yang digunakan sebagai media dasar adalah Murshige Skoog (MS) dengan tambahan formulasi vitamin MS, vitamin Morel Wetmore (MW), dan vitamin Murashige Tucker (MT). Tambahan bahan organik berupa Ekstrak Malt (EM) dan air kelapa. Zat pengatur tumbuh Benzil Adenin (BA),
Indole Acetic Acid (IAA), Thidiazuron (TDZ), dan Abscisic Acid (ABA). Suspensi
A. tumefaciens dan antibiotik (sefotaksim, kanamisin).
Peralatan yang digunakan di laboraturium yaitu otoklaf, laminar air flow cabinet, timbangan analitik, labu takar, gelas ukur, hot plate, stirrer, pH meter, labu erlenmeyer, botol kultur, cawan petri, gunting, pinset, scalpel, sprayer, pipet, rak kultur, label, penggaris, bunsen, kertas tissue, dan kamera.
Metode Percobaan
Percobaan I (Pengaruh jenis eksplan dan konsentrasi BA dalam induksi kalus)
7 Masing-masing perlakuan memiliki 22 ulangan pada setiap perlakuan sehingga terdapat 198 satuan percobaan (eksplan).
Yijk = μ + αi + ßj + (αß)ij+ εijk
Yijk = respon pengaruh bahan eksplan ke-i, konsentrasi BA ke-j, ulangan ke-k
μ = rataan umum
αi = pengaruh perlakuan bahan eksplan ke-i
ßj = pengaruh perlakuan konsentrasi BA ke-j
(αß)ij = pengaruh interaksi antara bahan eksplan ke-i dan konsentrasi BA ke-j
εijk = galat percobaan
i = 1, 2, 3 j = 1, 2, 3
k = 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, ..., 22
Percobaan II (Pengaruh intensitas pemberian antibiotik terhadap sterilitas kalus hasil transformasi genetik)
Media dasar yang digunakan pada percobaan ini adalah MS + vitamin MW + EM 500 mgL-1. Rancangan yang digunakan pada percobaan ini adalah RAL 1 faktor yaitu frekuensi pemberian antibiotik sefotaksim. Terdapat 3 taraf pemberian antibiotik yang digunakan yaitu 1 hari, 3 hari dan 5 hari sekali. Konsentrasi antibiotik yang digunakan adalah 400 mgL-1. Masing-masing taraf perlakuan diulang sebanyak 9 kali sehinggga diperoleh 27 satuan percobaan. Yik = μ + αi+ εik
Yik = respon pengaruh lama perendaman taraf ke-i pada ulangan ke-k
μ = rataan umum
αi = pengaruh lama perendaman taraf ke-i
εik = galat percobaan.
i = 1,2,3 k = 1,2,3, ..., 9
Percobaan III (Proliferasi Kalus Kandidat Transforman)
Percobaan ini dibagi menjadi 2 bagian berdasarkan kandungan media yang digunakan. Bagian pertama yaitu membandingkan formulasi vitamin MS dan vitamin MW dengan dan tanpa tambahan EM. Bagian kedua yaitu penambahan kandungan bahan organik EM dan air kelapa (10%, 20%, dan 30%). Bahan tanaman yang digunakan adalah kalus jeruk yang sudah ditransformasi dan terseleksi antibiotik
III. A. Pengaruh jenis formulasi vitamin dan konsentrasi EM dalam proliferasi kalus
Media dasar yang digunakan adalah media dasar MS. Rancangan yang digunakan pada percobaan adalah RAL faktorial 2 faktor. Faktor pertama adalah penambahan formulasi vitamin yang terdiri atas 2 jenis (MS dan MW), dan faktor kedua adalah konsentrasi EM yang terdiri atas 2 taraf konsentrasi (0 mgL-1 dan 500 mgL-1). Masing-masing taraf perlakuan memiliki 5 ulangan sehingga terdapat 20 satuan percobaan.
Yijk = μ + αi + ßj + (αß)ij+ εijk
Yijk = respon pengaruh bahan eksplan ke-i, konsentrasi BA ke-j, ulangan ke-k
8
αi = pengaruh perlakuan bahan eksplan ke-i
ßj = pengaruh perlakuan konsentrasi BA ke-j
(αß)ij = pengaruh interaksi antara bahan eksplan ke-i dan konsentrasi BA ke-j
εijk = galat percobaan
i = 1, 2 j = 1, 2
k = 1, 2, 3, 4, 5
III. B. Pengaruh air kelapa dalam proliferasi kalus
Media dasar yang digunakan pada percobaan ini adalah media MS + vitamin MW. Rancangan yang digunakan dalam percobaan ini adalah RAL 1 faktor, yaitu bahan organik. Terdapat 4 taraf bahan organik yaitu, EM 500 mgL-1 (kontrol), air kelapa 10%, 20%, dan 30%. Masing-masing taraf perlakuan memiliki 5 ulangan sehingga terdapat 20 satuan percobaan.
Yik = μ + αi+ εik
Yik = respon pengaruh lama perendaman taraf ke-i pada ulangan ke-k
μ = rataan umum
αi = pengaruh lama perendaman taraf ke-i
εik = galat percobaan.
i = 1,2,3,4 k = 1,2,3,4,5
Percobaan IV (Regenerasi Kalus Kandidat Transforman)
Percobaan ini dibagi menjadi 2 tahap berdasarkan kandungan media yang digunakan. Tahap pertama yaitu menggunakan berbagai Zat Pengatur Tumbuh (ZPT). Tahap kedua yaitu perbandingan antara vitamin dengan tambahan ABA serta melihat pengaruh interaksi antara tahap 1 dan 2. Bahan tanaman yang digunakan adalah kalus hasil proliferasi pada percobaan sebelumnya.
IV. A. Pengaruh penambahan ZPT dalam regenerasi kalus
Percobaan ini menggunakan media dasar MS + vitamin MW. Rancangan yang digunakan dalam percobaan ini adalah RAL 1 faktor dengan ZPT sebagai faktornya.Terdapat 4 jenis ZPT yaitu, IAA 0.01 mgL-1, BA 0.01mgL-1, TDZ 0.01 mgL-1, dan Kinetin 0.01 mgL-1. Masing-masing taraf perlakuan memiliki 5 ulangan sehingga terdapat 20 satuan percobaan.
Yik = μ + αi+ εik
Yik = respon pengaruh lama perendaman taraf ke-i pada ulangan ke-k
μ = rataan umum
αi = pengaruh lama perendaman taraf ke-i
εik = galat percobaan.
i = 1,2,3,4 k = 1,2,3,4,5
IV. B. Pengaruh penambahan formulasi vitamin dalam regenerasi kalus
9 Masing-masing perlakuan memiliki 3 ulangan sehingga diperoleh 36 satuan percobaan.
Yik = μ + αi + ßj + (αß)ij+ εijk
Yijk = respon pengaruh bahan eksplan ke-i, konsentrasi BA ke-j, ulangan ke-k
μ = rataan umum
αi = pengaruh perlakuan bahan eksplan ke-i
ßj = pengaruh perlakuan konsentrasi BA ke-j
(αß)ij = pengaruh interaksi antara bahan eksplan ke-i dan konsentrasi BA ke-j
εijk = galat percobaan
Botol yang akan digunakan, sebelumnya dicuci bersih dengan menggunakan air bersih kemudian disterilkan dalam otoklaf pada temperatur 121°C dengan tekanan 17.5 Psi selama 1 jam. Perhitungan waktu pemanasan dimulai setelah suhu yang diinginkan tercapai. Alat-alat tanam yang akan digunakan disimpan dalam oven dengan suhu 150oC
Pembuatan Media Tanam
Pembuatan media MS dilakukan dengan mengambil larutan dari setiap larutan stok media (makro, mikro, FE-EDTA, myoinositol) yang telah dibuat sesuai dengan volume yang diperlukan serta ditambah bahan perlakuan (vitamin, ZPT, bahan organik) sesuai dengan perlakuan masing-masing. Setelah semua larutan dimasukkan ke dalam labu takar ditambahkan gula sebanyak 30 g/l. Setelah itu dilakukan pengukuran pH dengan pH meter, pH media yang dibutuhkan adalah 5.8. Larutan media yang pH-nya telah diukur ditambahkan aquades hingga batas tera yang dibutuhkan. Larutan media yang telah siap ditambahkan agar phytagel sebanyak 2.5 g/l lalu dimasak. Larutan media yang sedang dimasak diaduk agar larutan tercampur merata. Kemudian larutan media dituang ke dalam botol kultur sebanyak 25 ml/botol. Lalu botol ditutup dengan aluminium foil. Semua media disterilkan dalam otoklaf pada suhu 121°C dengan tekanan 17.5 Psi selama 15 menit. Media yang telah dibuat disimpan di dalam ruang kultur.
I. Induksi Kalus
Eksplan yang telah diisolasi dari tunas in vitro ditanam berdasarkan jenis eksplan (daun, ruas, buku) dalam media dengan perlakuan BA sesuai dengan metode percobaan. Media dasar yang digunakan adalah media MS modifikasi vitamin MW dengan tambahan EM 500 mgL-1. Pada setiap botol ditanam 2-3 eksplan. Setiap eksplan merupakan 1 ulangan, terdapat 22 ulang pada setiap perlakuan.
10
II. Transformasi
Transformasi gen dilakukan dengan metode kokultivasi kalus jeruk siam dengan A. tumefaciens. Inokulasi kalus dengan suspensi bakteri A. tumefaciens dilakukan dengan cara ditambahkan pada botol media yang telah berisi kalus lalu botol ditutup dan disegel selama 15 menit. Selanjutnya, kalus yang telah diinokulasi dipindahkan ke kertas saring steril pada cawan petri untuk menyerap kelebihan cairan dan suspensi bakteri.
Kokultivasi kalus dengan Agrobacterium dilakukan dengan menanam kalus tersebut dalam botol tanpa antibiotik. Botol disegel dan diinkubasi dalam ruang gelap selama 3 hari.
Kalus yang telah melewati proses kokultivasi diberikan perlakuan antibiotik menggunakan sefotaksim 400 mgL-1 sebanyak 3 mL pada masing masing botol perlakuan. Pemberian antibiotik dilakukan sesuai dengan intensitas waktu yang telah ditentukan sebagai perlakuan yaitu 1, 3, dan 5 hari sekali.
Seleksi terhadap transforman dilakukan dengan selectable marker
kanamisin. Kalus ditumbuhkan pada media yang mengandung antibiotik kanamisin yang biasa digunakan sebagai bahan penyeleksi. Media yang digunakan mengandung kanamisin dengan konsentrasi 300 mgL-1.
III. Proliferasi kalus kandidat/putatif transforman
Eksplan yang digunakan pada tahap percobaan ini adalah eksplan kalus yang telah mengalami proses transformasi dan sudah terseleksi antibiotik kanamisin. Penanaman dilakukan dalam laminar air flow cabinet. Setiap botol berisi 1 kumpulan kalus dengan berat ± 0.6 g. Pengamatan dilakukan terhadap berat kalus pada masing-masing botol. Semua kultur disimpan dalam ruang kultur dengan suhu 25oC dan penyinaran selama 16 jam per hari. Perbanyakan kalus dilakukan selama 4 minggu pada tahap pengaruh vitamin dan bahan organik EM, dan 4 minggu pada tahap pengaruh bahan organik EM dan air kelapa dengan pengamatan pada berat kalus dilakukan setiap 2 minggu dengan melakukan penggantian media.
Proses proliferasi kalus dibagi menjadi 2 tahap kegiatan. Kegiatan pertama adalah mempelajari pengaruh vitamin, bahan organik EM, serta interaksi antara keduanya terhadap proliferasi kalus. Kegiatan kedua adalah mempelajari pengaruh bahan organik terhadap proliferasi kalus. Kumpulan kalus ditanam pada media masing-masing sesuai dengan perlakuan.
IV. Regenerasi
11 Pengamatan
Pengamatan terdiri dari beberapa parameter. Pada percobaan pertama pengamatan dilakukan dengan mengamati awal munculnya kalus, warna kalus, diameter kalus. Pada percobaan kedua diamati kondisi kalus terhadap kontaminasi bakteri. Pada percobaan ketiga pengamatan proliferasi dilakukan dengan mengukur pertambahan berat kalus yang terbentuk setiap 2 minggu. Pengamatan regenerasi dilakukan dengan mengamati waktu munculnya kalus globular, dan jumlah globular yang terbentuk.
HASIL DAN PEMBAHASAN
Induksi Kalus
Pengaruh Jenis Eksplan dan Konsentrasi BA dalam Induksi kalus
Induksi kalus merupakan salah satu metode kultur jaringan yang dilakukan dengan jalan memacu pembelahan sel secara terus menerus dari bagian tanaman tertentu seperti daun, akar, batang, dan sebagainya dengan menggunakan zat pengatur tumbuh hingga terbentuk massa sel. Massa sel (kalus) tersebut selanjutnya akan beregenerasi melalui organogenesis ataupun embryogenesis somatik hingga menjadi tanaman lengkap (Bustami 2011).
Kemampuan eksplan untuk membentuk kalus dipengaruhi oleh berbagai macam faktor. Asal bahan eksplan dan kandungan ZPT pada media tumbuh merupakan 2 faktor yang dapat mempengaruhinya. Tabel 1 menunjukan hasil persentase munculnya kalus pada minggu ke-8.
Tabel 1 Persentase pengaruh asal eksplan dan konsentrasi BA terhadap munculnya kalus pada minggu ke-8
Perlakuan Konsentrasi BA (mgL
-1
)
1.0 2.0 3.0
Daun 50% 41% 73%
Ruas 55% 41% 82%
Buku 55% 45% 73%
12
menunjukkan persentase pembentukan kalus yang lebih baik dibandingkan dengan eksplan daun.
Perbedaan konsentrasi BA yang digunakan dalam penelitian ini memberikan hasil yang cukup signifikan. Konsentrasi BA 3 mgL-1 memberikan hasil pada munculnya kalus minggu ke-8 dengan nilai persentase tertinggi pada setiap sumber eksplan. Hal ini sesuai dengan yang dinyatakan Kosmiatin (2013) media terbaik untuk induksi kalus embriogenik dari jaringan endosperma jeruk Siam Simadu adalah media MS modifikasi dengan penambahan 3 mgL-1 BA dan 500 mgL-1 EM.
Tabel 2 Rekapitulasi sidik ragam pengaruh asal eksplan dan konsentrasi BA
Perlakuan Minggu
2 4 6 8
Asal eksplan tn tn tn tn
Konsentrasi BA ** ** ** **
Interaksi tn tn tn tn
Keterangan: **: berpengaruh nyata pada taraf 1%. tn: tidak berpengaruh nyata.
Hasil analisis data secara statistik (Tabel 2) menunjukkan bahwa asal eksplan tidak memberikan pengaruh yang nyata pada setiap 2 minggu pengamatan. Sumber eksplan yang digunakan (daun, ruas, dan buku) memberikan pengaruh yang tidak signifikan pada diameter hasil kalus yang terbentuk. Konsentrasi BA sangat berpengaruh terhadap diameter kalus yang terbentuk pada setiap 2 minggu pengamatan yang dilakukan. Interaksi antara asal eksplan dan konsentrasi BA yang digunakan tidak memberikan perubahan yang terlihat pada hasil diameter kalus yang terbentuk. Pada umumnya untuk eksplan yang mempunyai kambium tidak perlu penambahan ZPT untuk menginduksi terbentuknya kalus karena secara alamiah pada jaringan berkambium yang mengalami luka akan tumbuh kalus untuk menutupi luka yang terbuka. Namun menurut Dodds dan Robert (1985) keberadaan kambium di dalam eksplan tertentu dapat menghambat pertumbuhan kalus bila tanpa penambahan zat pengatur tumbuh eksogen.
Tabel 3 Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk BA
Keterangan: aAngka pada kolom yang sama yang diikuti huruf yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan uji selang berganda Duncan pada taraf ɑ=5%
13 menunjukkan hasil tertinggi pada minggu-minggu berikutnya, keadaan ini berlanjut hingga akhir pengamatan di minggu ke-8. Minggu ke-4, rata-rata diameter konsentrasi BA 3 mgL-1 mencapai 2.02 mm, 2.65 mm pada minggu ke-6, dan 3.21 mm pada minggu ke-8. Diameter kalus yang terbentuk dari media dengan tambahan konsentrasi BA 3 mgL-1 menunjukkan perbedaan yang signifikan dengan konsentrasi BA 2 mgL-1 dan konsentrasi BA 1 mgL-1 yang berturut-turut mencapai rata-rata diameter 1.58 mm dan 1.71 mm pada minggu ke-4, 2.20 mm dan 2.24 mm pada minggu ke-6 serta 2.61 mm dan 2.71 mm pada minggu ke-8. Konsentrasi BA 2 mgL-1 memiliki hasil diameter paling kecil dibandingkan dengan 2 perlakuan lainnya, namun BA 1 mgL-1 dan BA 2 mgL-1 menunjukkan hasil yang tidak berbeda nyata.
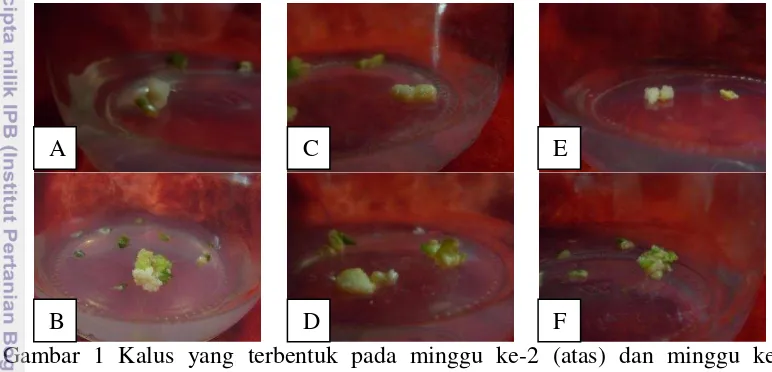
Gambar 1 Kalus yang terbentuk pada minggu ke-2 (atas) dan minggu ke-8 (bawah) setelah kultur. A-B: induksi kalus dari daun, C-D: induksi kalus dari ruas, E-F: induksi kalus dari buku
Kalus yang berhasil diinduksi dari eksplan menunjukkan performa yang hampir sama (Gambar 1) dimana pada awal pembentukan kalus, kalus yang terbentuk belum friable (remah). Pembentukan kalus friable baru terlihat jelas pada minggu ke-8 setelah kultur/penanaman. Green et al. (1983) menyatakan bahwa kalus embriogenik memiliki ciri-ciri friable (remah), kurang kompak, pertumbuhannya cepat dengan bentuk embriosomatik lebih jelas pada permukaan kalus, dan kalus berwarna putih sampai kuning.
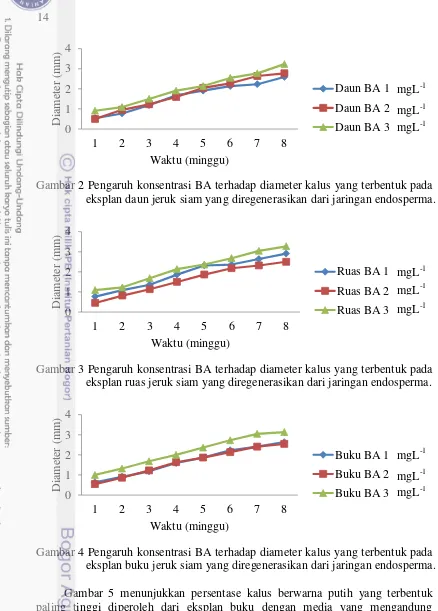
Grafik pengaruh konsentrasi BA terhadap diameter kalus pada masing-masing sumber eksplan dapat dilihat pada Gambar 2, Gambar 3 dan Gambar 4. Terlihat bahwa konsentrasi BA 3 mgL-1 pada setiap sumber eksplan memiliki nilai yang lebih tinggi dibanding konsentrasi BA 2 mgL-1 dan BA 1 mgL-1. Terutama pada kalus yang terbentuk dari eksplan yang berasal dari buku tunas, terlihat bahwa konsentrasi BA 3 mgL-1 memiliki grafik yang selalu berada di atas 2 grafik lainnya. Grafik yang dibentuk dari nilai kalus yang terbentuk dari daun menunjukkan konsentrasi BA 3 mgL-1 berada dekat dengan 2 grafik lainnya, namun berdasarkan hasil statistika nilai yang dihasilkan konsentrasi BA 3 mgL-1 masih berbeda sangat nyata dengan 2 perlakuan konsentrasi lainnya.Pemberian ZPT sitokinin dimaksudkan untuk merangsang proliferasi sel dan pertumbuhan kalus dari eksplan yang ditanam (Wardani et al. 2003).
A
F E
D C
14
Gambar 2 Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk pada eksplan daun jeruk siam yang diregenerasikan dari jaringan endosperma.
Gambar 3 Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk pada eksplan ruas jeruk siam yang diregenerasikan dari jaringan endosperma.
Gambar 4 Pengaruh konsentrasi BA terhadap diameter kalus yang terbentuk pada eksplan buku jeruk siam yang diregenerasikan dari jaringan endosperma. Gambar 5 menunjukkan persentase kalus berwarna putih yang terbentuk paling tinggi diperoleh dari eksplan buku dengan media yang mengandung konsentrasi BA 3 mgL-1 yaitu sebesar 86%. Persentase terendah diperoleh dari eksplan ruas dan buku dengan media yang mengandung konsentrasi BA 2 mgL-1. Nadeak et al. (2012) menyatakan tidak ditemukan pengaruh pemberian banyaknya konsentrasi zat pengatur tumbuh pada warna kalus.
15
Gambar 5 Persentase kalus berwarna putih kekuningan yang terbentuk saat induksi kalus
Transformasi Genetik
Pengaruh Intensitas Pemberian Antibiotik terhadap Sterilitas Kalus saat Transformasi Genetik
Kalus yang mengalami transformasi genetik dengan menggunakan A. tumefaciens akan mengalami kontaminasi oleh bakteri tersebut. Perlakuan dengan menggunakan sefotaksim 400 mgL-1 diberikan untuk mengeliminasi bakteri yang ada. Penggunaan sefotaksim pada penelitian ini karena antibiotik sefotaksim dan karbenisilin menunjukkan hasil yang paling efektif dalam mengeliminasi
Agrobacterium diantara 7 antibiotik yang diuji yaitu karbenisilin, sefotaksim, kanamisin, tetrasiklin, streptomisin, kloramfenikol, dan higromisin B (Silva dan Fukai 2001). Menurut Tangapo et al. (2012) hasil uji sensitivitas A. tumefaciens
terhadap sefotaksim menunjukkan bahwa bakteri masih tetap dapat tumbuh pada pemberian sefotaksim 100-200 mgL-1, pertumbuhan A. tumefaciens terhambat pada konsentrasi sefotaksim 400 mgL-1.
Gambar 6 Persentase kalus putatif transforman bersih/steril setelah perlakuan antibiotik dengan frekuensi pemberian antibiotik yang berbeda
16
memberikan hasil paling rendah dibandingkan 2 perlakuan lainnya dengan hasil 55.56% kalus bersih. Pemberian kalus dengan intensitas 1 hari sekali memberikan hasil terbaik pada penelitian ini karena dengan perlakuan yang lebih intensif sehingga tibak memberikan waktu bagi bakteri untuk tumbuh dan berkembang. Hasil dari percobaan (Gambar 7) menunjukkan bahwa kalus yang mengalami kontaminasi berhasil menjadi kalus yang steril.
Gambar 7 Keragaan kalus saat transformasi genetik A-B: kalus sebelum transformasi, C-D: kalus saat terinfeksi, E-F: kalus setelah eliminasi bakteri
Proliferasi
Kalus hasil transformasi genetik biasanya mengalami penghambatan pertumbuhan, bahkan sebagian eksplan akan mengalami kematian. Kematian eksplan karena proses transformasi genetik menggunakan Agrobacterium tumefaciens, diakibatkan kalus mengalami kontaminasi sehingga hanya sebagian kecil kalus yang mampu melewati tahap ini dan bertahan hidup. Untuk meningkatkan keberhasilan perolehan regeneran transforman, perlu dilakukan proses proliferasi untuk menambah jumlah kalus putatif transforman.
Pengaruh Jenis Formulasi Vitamin dan Konsentrasi Ekstrak Malt dalam Proliferasi Kalus
Berdasarkan Tabel 4, dapat diketahui bahwa penggunaan jenis vitamin dan konsentrasi bahan organik memberikan pengaruh yang nyata. Pada 2 minggu pertama setelah kultur, terlihat bahwa perbedaan jenis vitamin memberikan pengaruh yang berbeda nyata terhadap pertambahan berat kalus. Terjadi interaksi antara perlakuan vitamin dan konsentrasi EM yang memberikan pengaruh yang sangat nyata terhadap pertambahan berat kalus yang terbentuk meskipun perlakuan konsentrasi EM sendiri tidak memberikan pengaruh yang nyata pada 2 minggu pertama. Pengaruh konsentrasi EM mulai terlihat setelah 2 minggu kedua, hal ini dikarenakan EM merupakan tambahan bahan organik eksternal sehingga penyerapan terhadap bahan organik ini memerlukan waktu.
A C E
17
Tabel 4 Rekapitulasi sidik ragam pengaruh jenis vitamin dan konsentrasi EM terhadap pertambahan berat kalus yang sudah ditransformasi
Perlakuan 2 minggu pertama 2 minggu kedua Total pertambahan
Vitamin ** ** **
Konsentrasi EM tn * **
Interaksi ** tn tn
Keterangan: **: berpengaruh nyata pada taraf 1%. *: berpengaruh nyata pada taraf 5% tn: tidak berpengaruh nyata.
Pengamatan yang dilakukan setelah 2 minggu kedua menunjukkan bahwa jenis vitamin yang digunakan masih berpengaruh sangat nyata terhadap pertambahan berat kalus, pada minggu ini konsentrasi EM mulai menunjukkan pengaruh yang nyata terhadap parameter. Interaksi antara jenis vitamin dan konsentrasi EM pada 2 minggu kedua tidak memberikan pengaruh yang signifikan terhadap pertambahan berat kalus.
Bila dilihat secara langsung selama 4 minggu pengamatan, perlakuan jenis vitamin dan konsentrasi EM memberikan hasil pengaruh yang sangat nyata terhadap pertambahan berat kalus, namun interaksi antara jenis vitamin dan konsentrasi EM tidak memberikan pengaruh yang nyata. Kalus pada media perlakuan mengalami pertambahan volume karena terjadi pembelahan sel. Pada umumnya jumlah kalus bertambah dari semula, yang ditunjukkan dengan peningkatan berat basah kalus akhir menjadi 2 kali berat basah kalus awal.
Tabel 5 Pengaruh vitamin dan EM terhadap pertambahan berat kalus yang sudah ditransformasi
Perlakuan
Rata-rata pertambahan berat kalus (g) 2 minggu pertama 2 minggu kedua Total Vitamin
Keterangan: aAngka pada kolom yang sama yang diikuti huruf yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan uji selang berganda Duncan pada taraf ɑ=5%.
18
MS karena pada media MW terdapat ca-pantothenat dan biotin sedangkan pada media MS tidak terdapat vitamin tersebut (Husni et al. 2010). Biotin dan ca-pantothenat berfungsi dalam proses sintesis asam amino.
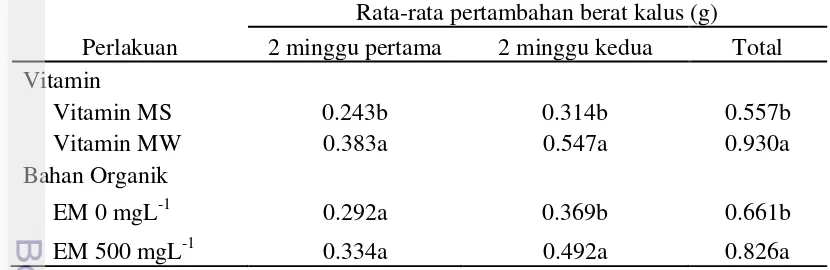
Pemberian bahan organik EM pada media memberikan pengaruh yang signifikan pada 2 minggu kedua setelah kultur dan total 4 minggu percobaan meskipun pengaruh pada 2 minggu pertama tidak terlihat berbeda. Rata-rata pertambahan berat kalus yang terjadi pada media tanpa menggunakan EM di 2 minggu pertama hanya 0.292 g dan 0.369 g di 2 minggu kedua dengan rata-rata total pertambahan kalus pada perlakuan ini mencapai 0.661 g. Pemberian EM 500 mgL-1 memberikan rata-rata pertambahan berat kalus sebesar 0.334 g pada 2 minggu pertama dan 0.492 g pada 2 minggu kedua dengan rata-rata total pertambahan berat kalus sebesar 0.826 g selama 4 minggu percobaan.
Penambahan EM pada media dimaksudkan untuk memberikan suplemen pada eksplan yang diharapkan dapat memacu pertumbuhan kalus (Dwimahyani 2007). Ekstrak malt menjadi salah satu kandungan yang ditambahkan pada media dasar yang digunakan dalam pertumbuhan dan perkembangan kalus, karena ekstrak malt merupakan bahan organik yang mudah diserap oleh kalus (Dodds dan Roberts 1985). Ekstrak malt merupakan sumber karbohidrat, ditujukkan untuk memulai embriogenesis di eksplan nuselus. Beberapa hormon tanaman, seperti auksin dan giberelin telah diidentifikasi ada dalam ekstrak malt. Ekstrak malt memainkan peran yang cukup penting dalam budidaya jeruk (Sridhar dan Aswath 2014).
Interaksi yang terjadi antara perlakuan jenis vitamin dan penambahan bahan organik di 2 minggu pertama memberikan pengaruh yang sangat nyata pada pertambahan berat kalus (Tabel 6). Interaksi antara vitamin MW tanpa tambahan EM menjadi perlakuan yang menghasilkan respon terbaik dengan rata-rata pertambahan kalus sebesar 0.4220 g pada 2 minggu pertama sedangkan vitamin MS tanpa tambahan EM menghasilkan respon terendah dengan rata-rata sebesar 0.1620 g pada 2 minggu pertama.
Tabel 6 Pengaruh interaksi antara vitamin dan bahan organik terhadap pertambahan berat kalus yang sudah ditransformasi pada 2 minggu pertama
Kombinasi Perlakuan Konsentrasi EM
0 mgL-1 500 mgL-1
Jenis Vitamin Vitamin MS 0.1620b 0.3240a
Vitamin MW 0.4220a 0.3440a
Keterangan: aAngka yang diikuti huruf yang berbeda menunjukkan hasil yang berbeda nyata berdasarkan uji selang berganda Duncan pada taraf ɑ=5%. EM: Ekstrak Malt, MS: Murashige Skoog, MW: Morel Wettmore.
Kalus yang diproliferasi pada media dengan penambahan formulasi vitamin MS dan formulasi vitamin MW dengan penambahan EM kurang memberikan hasil yang memuaskan sehingga kalus disub-kultur pada media dengan penambahan air kelapa. Air kelapa banyak ditambahkan pada media kultur in vitro karena air kelapa kaya akan bahan organik dan ZPT alami (Pierik 1997).
19
Gambar 8 Proliferasi kalus bagian 1 pada minggu ke-4 A: proliferasi pada media VMS; B: Proliferasi pada media VMS EM 500 mgL-1;C: Proliferasi pada media VMW; D: Proliferasi pada media VMW EM 500 mgL-1 Pengaruh Air Kelapa dalam Proliferasi Kalus
Penggunaan air kelapa sebagai bahan organik dapat dijadikan alternatif sebagai pengganti EM dalam kultur in vitro jeruk karena air kelapa kaya akan bahan organik dan sangat mudah didapat. Hasil analisis ragam menunjukkan bahwa penggunaan EM memberikan perbedaan yang sangat signifikan jika dibandingkan penggunaan air kelapa (Gambar 10). Penggunaan air kelapa 30% pada 2 minggu pertama memberikan hasil yang tidak berbeda nyata dengan penggunaan EM 500 mgL-1, namun pada 2 minggu kedua maupun jika dilihat selama 4 minggu percobaan secara langsung, penggunaan EM 500 mgL-1 masih memberikan respon yang jauh lebih baik jika dibandingkan dengan penggunaan air kelapa sebagai bahan organik. Percobaan penambahan air kelapa hingga 30% belum menunjukkan kemampuan air kelapa sebagai bahan organik yang cukup baik jika dibandingkan dengan menggunakan EM 500 mgL-1.
Gambar 9 Pengaruh bahan organik terhadap pertambahan berat kalus yang sudah ditransformasi
Konsentrasi air kelapa yang digunakan pada penelitian ini masih menunjukkan pertambahan yang positif bahkan pada konsentrasi 30%. Kalus hasil transformasi genetik masih menunjukkan pertumbuhan yang baik dengan konsentrasi 30%. Berdasarkan hasil ini, konsentrasi air kelapa yang lebih tinggi berpotensi menghasilkan pertumbuhan yang lebih baik lagi.
0
EM 500 air kelapa 10% air kelapa 20% air kelapa 30%
20
Gambar 10 Proliferasi kalus bagian 2 pada minggu ke-4 A: proliferasi pada media VMW EM 500 mgL-1; B: Proliferasi pada media VMW air kelapa 10%; C: Proliferasi pada media VMW air kelapa 20%; D: Proliferasi pada media VMW air kelapa 30%
Air kelapa digunakan untuk perbanyakan in vitro tanaman hias misalnya anggrek karena mengandung zat pengatur tumbuh alami yaitu sitokinin. Air kelapa yang masih muda adalah komponen yang efektif untuk media kultur jaringan yang dapat meningkatkan pertumbuhan sel, organ, jaringan ataupun seedling anggrek in vitro. Air kelapa mengandung ion anorganik (klorin, zat besi, magnesium, fosfor, kalium, sodium, sulfur), komponen nitrogen (thanolamine dan ammonia), asam amino dan semacamnya, enzim, asam organik. Selain itu, air kelapa juga mengandung gula antara 1,7 – 2,6 % dan protein 0,07 – 0,55 %. Selain kaya mineral, air kelapa juga mengandung bermacam-macam vitamin seperti asam sitrat, asam nikotinat, asam pantotenat, asam folat, niasin, riboflavin, dan tiamin (Arditti dan Ernst 1993). George dan Sherrington (1984) juga menjelaskan bahwa air kelapa 20% akan menginisiasi pertumbuhan kalus dari beberapa jenis jeruk dalam media MS. Penelitian ini menggunakan kalus yang sudah ditransformasi, pada umumnya kalus ini mengalami penurunan daya regenerasi sehingga respon terhadap media juga berbeda dengan respon pada kalus yang tidak ditransformasi.
Regenerasi
Jumlah ES fase globular yang terbentuk pada kalus merupakan salah satu indikasi kapabilitas atau kemampuan regenerasi pada kalus. Fase ini merupakan indikasi awal terjadinya regenerasi pada kalus.
PengaruhPenambahan ZPT dalam Regenerasi Kalus
Komposisi media dengan menggunakan ZPT sebagai faktor belum berhasil meregenerasikan kalus.Dapat dilihat dari Gambar 11, penampakan kalus pada minggu ke-6 masih belum menunjukkan adanya ES fase globular yang terbentuk. Selama 6 minggu pengamatan, masih belum terlihat adanya ES fase globular pada masing-masing media perlakuan namun kalus yang diamati terlihat mengalami pertambahan massa yang dapat dilihat secara langsung pada Gambar 11. Bila
A B
21 dilihat dari gambar, penambahan IAA memberikan hasil kalus yang lebih friabel/lebih embrionik dibandingkan dengan perlakuan lainnya karena IAA merupakan ZPT yang termasuk dalam golongan auksin yang biasa digunakan untuk pembentukan kalus (Wattimena 1992), sedangkan BA, Kinetin dan TDZ merupakan ZPT yang termasuk golongan sitokinin yang biasa digunakan untuk pembentukan tunas.
Gambar 11 Regenerasi kalus tahap 1 pada minggu pertama (atas) dan minggu ke-6 (bawah) A-B: regenerasi pada media VMW EM 500 IAA 0.01; C-D: regenerasi pada media VMW EM 500 BA 0.01; E-F: regenerasi pada media VMW EM 500 Kinetin 0.01; G-H: regenerasi pada media VMW EM 500 TDZ 0.01
Pengaruh Penambahan Formulasi Vitamin dalam Regenerasi Kalus
Regenerasi kalus hasil transformasi pada media dengan penambahan ZPT IAA, BA, Kinetin, dan TDZ belum memberikan hasil yang memuaskan, sehingga kalus disub-kultur pada media yang mengandung zat pengatur tumbuh ABA dengan konsentrasi 0.5 mgL-1. Setelah 6 minggu pengamatan pada tahap 2 penambahan ABA 0.5 dengan formulasi vitamin yang berbeda dilakukan, masih belum terlihat adanya ES fase globular yang terbentuk. Dapat dilihat pada Gambar 12, kondisi kalus pada minggu ke-6 masih belum menunjukkan adanya kalus ES fase globular, namun terlihat jelas adanya pertambahan massa kalus. Merigo (2011) menyatakan pendewasaan embrio somatik jeruk siam dengan menggunakan media MS dengan penambahan formulasi vitamin MW + 2.5 mgL
-1
ABA merupakan media terbaik dalam mendewasakan embrio somatik denganefisiensi pendewasaan sebesar 82.6%, namun pada penelitian ini masih belum terlihat adanya indikasi pendewasaan embrio somatik.
22
Gambar 13 Regenerasi kalus tahap 2 pada minggu pertama (atas) dan minggu ke-6 (bawah)A-B: regenerasi pada media VMW ABA 0.5; C-D: regenerasi pada media VMS ABA 0.5; E-F: regenerasi pada media VMT ABA 0.5
KESIMPULAN DAN SARAN
Kesimpulan
Konsentrasi BA optimal untuk menginduksi kalus dari eksplan daun, buku dan ruas jeruk adalah 3 mgL-1.Intensitas pemberian antibiotik 1 hari sekali merupakan intensitas terbaik untuk eliminasi bakteri. Media terbaik untuk proliferasi kalus hasil transformasi genetik adalah menggunakan media MS modifikasi MW dengan tambahan bahan organik EM 500 mgL-1.Kalus hasil transformasi genetik masih belum dapat beregenerasi dengan media kombinasi ZPT dan dengan media + ABA 0.5 mgL-1.
Saran
Perlu dilakukan penelitian transformasi yang dapat meregenerasikan kalus hasil transformasi genetik dengan kombinasi media lain untuk mengoptimasikan proses transformasi genetik pada jeruk hingga memperoleh individu tanaman transgenik jeruk.
DAFTAR PUSTAKA
Ali S, Mirza B. 2006. Micropropagation of rough lemon (Citrus jambhiri Lush.): Effect of explant type and hormone concentration. Acta Bot. Croat. 65(2): 137-146.
Arditti J, Ernst R. 1993.Micropropagation of Orchids.Wiley-interscience. New York (NY).
Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian. 2009. Jus Jeruk Siam: Di Balik Rasa Pahit Temukan Manfaat yang Menakjubkan. Warta Penelitian dan Pengembangan Pertanian. 31(2): 8-9.
E
A C
23 Bustami MU. 2011. Penggunaan 2,4-d untuk induksi kalus kacang tanah. Media
Litbang Sulteng. 4(2): 137-141.
Cardoza V, D’Souza L. 2002. Induction, development and germination of somatic embryos from nucellar tissues of cashew (Anacardium occidentale L.).
Scientia Horticulturae. 93: (3-4). 367-372.
Devy NF, Yulianti F, Hardiyanto. 2012. Perbanyakan massal embriokalamondin melalui teknologi somatik embriogenesis menggunakanbioreaktor. J Hort 22(1): 1-7.
Direktorat Jenderal Hortikultura. 2006. Analisis dan Evaluasi Hortikultura Unggulan. Jakarta
Dodds JH, Roberts LW. 1985. Experiments in Plant Tissue Culture. Cambridge (GB): Cambridge University Pr.
Dominguez A, Gurri J, Cambra M, Navarro L, Moreno P, Pena L. 2000.Efficient production of transgenic citrus plants expressing the coat protein gene of citrus triszea virus. Plant Cell Rep. 19(4): 427-433.
Dwimahyani I. 2007. Metode suspensi sel untuk membentuk spot hijau pada kultur in vitro galur mutan tanaman jarak pagar (Jatropha curcas L). Jurnal Ilmiah Aplikasi Isotop dan Radiasi. 3(2): 55-78.
Egertsdotter U. 1999. Somatic embriogenesis in picea suspensions culture. In : Hall DR (Ed.). Plant Cell Culture Protocols. New Jersey (US): Humana Pr. 51-60.
Evans D, Sharp W, Flick C. 1981. Plant regeneration from cell to callus.Hort. Rev
3:214-314.
Gatehouse AMR, Hilder VA, Boulter D. (eds). 1992. Plant Genetic Manipulation for Crop Protection. CAB International. United Kingdom.
George EF, Sherrington PD. 1984, Plant Propagation by Tissue Culture.Eastern Press: England.
Green CE, Armstrong CL, Anderson PC. 1983. Somatic genetic system in corn. In: Jowney K, Voellmy RW, Fazelahmad A, Schuttz J (Eds.). Molecular genetics of plants and animals. New York (US): Winter Symposium Series Ac Pr. 20: 147-157.
Hartmann HT, Kester DE, Davies FT Jr. 1990.Plant Propagation, Principles and practice fifth edition. Prentice Hall, Inc. New Jersey. Englewood.
Hernalsteens JP, Vliet FV, Beuckeleer MD, Depicker A, Engler G, Lemmers M, Holsters M, Montagu MV. and Schell J. (1980) The Agrobacterium tumefaciens Ti plasmid as a host vector systemfor introducing foreign DNA in plant cell. Nature 287:654-656.
Husni A. 2010. Fusi protoplas interspesies antara jeruk siam simadu dengan jeruk mandarin satsuma. [Disertasi]. Bogor (ID). Institut Pertanian Bogor.
Husni A, Purwito A, Mariska I, Sudarsono. 2010. Regenerasi jeruk siam melalui embriogenesis somatik. J. AgroBiogen. 6(2): 75-83.
Khan EU, Fu XZ, Wang J, Fan QJ, Huang XS, Zhang GN, Shi J, Liu JH. 2009. Regeneration and characterization of plants derived from leaf in vitro culture of two sweet orange (Citrus sinensis (L.) Osbeck) cultivars. Scientia Horticulturae. 120: 70-76
24
Kosmiatin M. 2013. Pembentukan tanaman triploid jeruk siam simadu (Citrus nobilis Lour) melalui kultur endosperma. [Disertasi]. Bogor (ID). Institut Pertanian Bogor.
Kosmiatin M, Purwito A, Wattimena GA, Mariska I. 2013. Induksi embriogenesis somatik dari jaringan endosperma jeruk siam (Citrus nobilis
Lour.) cv simadu. J. Agron. Indonesia 42(1): 44 – 51.
Leva A, Rinaldi LMR. (eds). 2012. Recent Advances in Plant in vitro Culture. Rijeka: InTech.
Lizawati. 2012. Proliferasi Kalus dan Embriogenesis Somatik Jarak Pagar (Jatropha curcas L.) dengan Berbagai Kombinasi Zpt dan Asam Amino. Bioplantae. 1(4).
Mariska I, Sukmadjaja D. 2003. Kultur jaringan abaka. Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. Bogor.
Martasari C, Mulyanto H. 2008. Teknik identifikasi varietas jeruk. IPTEK Hortikultura. 4: 6-12.
Menegristek. 2000. Jeruk. Kantor Deputi Menegristek Bidang Pendayagunaan dan Pemasyarakatan Ilmu Pengetahuan dan Teknologi. Jakarta. 16 hlm.
Merigo JA. 2011. Studi regenerasi tanaman jeruk keprok batu 55 (Citrus reticulata L.) melalui jalur embriogenesis somatik. [Tesis]. Bogor (ID). Institut Pertanian Bogor
Nadeak R, Anna N, Siregar EBM. 2012. Respon eskplan biji gaharu (Aquilaria malaccencis Lamk.) terhadap pemberian NAA dan IBA secara in vitro. Medan.
Nurasa T, Hidayat D. 2008. Analisis usahatani dan keragaan marjin pemasaran jeruk di Kabupaten Karo. Pusat Penelitian dan Pengembangan Sosial Ekonomi Kebijakan Pertanian, Badan Litbang pertanian, Bogor
Pareek A, Kothari SL. 2003. Direct somatic embryogenesis and plant regeneration from leaf cultures of ornamental species of Dianthus. Sci. Hort. 98: 449-459. Pierik RLM. 1997. In vitro Culture of Higher Plants. Wageningen. Kluwer Ac
Pub.
Purnamaningsih R. 2002. Regenerasi Tanaman Melalui Embriogenesis Somatik dan Beberapa Gen yang Mengendalikannya. Buletin AgroBio. 5(2): 51-58. Silva JAT, Fukai S (2001). The impact of carbenicillin, cefotaxime and
vancomycin on Chrysanthemum and Tobacco TCL morphogenesis and
Agrobacterium growth. Journal of Applied Horticulture 3:3-12
Sridhar TM, Aswath CR. 2014. Review on medicinal plants propagation: a comprehensive study on role of natural organic extracts in tissue culture medium. Department of Biotechnology. Indian Institute of Horticultural Research (IIHR). Bangalore. India.
Sutjahjo SH. 1994. Induksi keragaman somaklon ke arah ketenggangan terhadap keracunan aluminium pada tanaman jagung. [Disertasi]. Bogor (ID). IPB. Tangapo A, Marwani E, Dwivani FM. 2012. Transformasi dan ekspresi transien
gen pelapor Gusa pada Andrographis paniculata (Burm.F.) Wallich Ex Ness. J. Bioslogos. 2(1): 10-19.
25 Wattimena GA. 1992. Bioteknologi Tanaman. Departemen Pendidikan dan
Kebudayaan.Bogor (ID). IPB.
Wulansari A, Purwito A, Husni A, Sudarmonowati E. 2015. Kemampuan regenerasi kalus embriogenik asal nuselus jeruk siam serta variasi fenotipe tunas regeneran, Prosiding seminar nasional masyarakat biodiversitas Indonesia. Eds: Setyawan AD, et al. Bogor. 1(1): 97-104.
Yusnita. 2003. Kultur Jaringan Cara memperbanyak tanaman secara efisien.Jakarta. AgroMedia Pustaka.
26
LAMPIRAN
Lampiran 1 Komposisi media dasar kultur, vitamin dan komponen lainnya
Komposisi MS (mgL-1) MW (mgL-1)
Makcronutrient
KNO3 1900.000 1900.000
NH4Cl - -
NH4NO3 1650.000 1650.000
(NH4)2SO4 - -
MgSO4+7H2O 180.540 180.540
CaCl2+2H2O 332.020 332.020
NaH2PO4+2H2O - -
K2HPO4 170.000 170.000
KH2PO4 - -
KCl - -
Micronutrient
Na2EDTA - -
FeSO4+7H2O - -
FeNaEDTA 36.700 36.700
MnSO4+4H2O 16.900 16.900
ZnSO4+7H2O 8.600 8.600
CuSO4+5H2O 0.025 0.025
CoCl2+6H2O 0.025 0.025
Kl 0.830 0.830
H3BO3 6.200 6.200
Na2MoO4+2H2O 0.250 0.250
Vitamin
Myo inositol 10.000 10.000
Nicotinic acid 0.500 1.000
Pyridoxine HCL 0.500 1.000
Thiamine HCL 0.100 1.000
Biotin - 1.000
Ca-panthotenat - 0.500
Nicotinamide 0.500 1.000
27