UIN SYARIF HIDAYATULLAH JAKARTA
Uji Aktivitas Antimikroba Ekstrak Herba Kemangi
(Ocimum americanum L) terhadap Staphylococcus aureus
dan Candida albicans
SKRIPSI
NUR ATIKAH
108102000054
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
UIN SYARIF HIDAYATULLAH JAKARTA
Uji Aktivitas Antimikroba Ekstrak Herba Kemangi
(Ocimum americanum L) terhadap Staphylococcus aureus
dan Candida albicans
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
NUR ATIKAH
108102000054
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
iii
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikuti maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Nur Atikah
NIM : 108102000054
Tanda Tangan :
vi Nama : Nur Atikah
Program Studi : Farmasi
Judul Skripsi : Uji Aktivitas Antimikroba Ekstrak Herba Kemangi (Ocimum americanum L) terhadap Staphylococcus aureus dan Candida albicans.
Ocimum spp. merupakan salah satu tanaman yang digunakan sebagai bahan obat tradisional, karena memiliki khasiat sebagai antimikroba, antioksidan dan antipiretik. Tujuan penelitian ini adalah untuk mengetahui aktivitas antimikroba ekstrak herba kemangi terhadap Staphylococcus aureus (ATCC 25925) dan
Candida albicans (ATCC 10231). Ekstraksi dilakukan dengan metode maserasi. Pertama dimaserasi langsung menggunakan etanol 70 %, kedua dimaserasi menggunakan pelarut dengan kepolaran bertingkat yaitu n-heksana, etil asetat dan etanol 70 %. Konsentrasi larutan uji yang digunakan yaitu 4000, 2000, 1000, 500, 250, 125, 100, 50, 25 dan 12,5 g/mL. Pengujian aktivitas antimikroba
Staphylococcus aureus menggunakan metode difusi agar dan metode dilusi cair digunakan untuk Candida albicans. Dari hasil pengujian aktivitas antimikroba ekstrak herba kemangi fase n-heksana, fase etil asetat dan ekstrak etanol 70% masih mempunyai aktivitas pada konsentrasi 125 g/mL terhadap Staphylococcus aureus. Pengujian aktivitas antimikroba ekstrak herba kemangi fase etil asetat masih mempunyai aktivitas pada konsentrasi 500 g/mL terhadap Candida albicans. Sebagai kontrol positif digunakan amoksisilin 25 g/mL dan ketokonazol 10 g/mL. Sebagai kontrol negatif digunakan pelarut n-heksana, etil asetat dan etanol 70%. Berdasarkan hasil penapisan fitokimia ekstrak herba kemangi mengandung alkaloid, flavonoid, saponin, steroid, triterpenoid dan tanin.
Kata kunci : herba kemangi, Ocimum americanum L., antimikroba,
vii ABSTRACT
Name : Nur Atikah Program Study : Pharmacy
Title : Antimicrobial Activity Test of The Lemon Basil Herb (Ocimum americanum L) Extracts against Staphylococcus aureus and Candida albicans.
Ocimum spp. is one of the plants used as traditional medicine, as it has efficacy as an antimicrobial, antioxidant and antipyretic. This study aims to determine the antimicrobial activities of lemon basil herb extracts against Staphylococcus aureus
(ATCC 25925) and Candida albicans (ATCC 10231). Extraction was done by maceration method. The first direct maceration using 70% ethanol, the second maceration using solvents with a polarity that was stratified n-hexane, ethyl acetate and ethanol 70%. Extract concentrations used is 4000, 2000, 1000, 500, 250, 125, 100, 50, 25 and 12,5 g/mL. The activity antimicrobial of
Staphylococcus aureus using disc diffusion method and broth dilution method used for Candida albicans. The research results of the antimicrobial activity from lemon basil herb extracts n-hexane phase, ethyl acetate phase and 70% ethanol extracts still have activity at concentration 125 g/mL against Staphylococcus aureus. The activity antimicrobial of lemon basil herb extracts ethyl acetate phase still have activity at concentration 500 g/mL against Candida albicans. As positive control used amoxicillin 25 g/mL and ketoconazole 10 g/mL. As negative control used solvent n-hexane, ethyl acetate and 70% ethanol. The results from phytochemical screening of lemon basil herb extracts showed the presence alkaloids, flavonoids, saponins, steroids, triterpenoids and tannins.
Keywords: lemon basil herb, Ocimum americanum L., antimicrobial,
viii Assalamu’alaikum Wr. Wb.
Alhamdulillah, puji syukur kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya kepada saya sehingga dapat menyelesaikan penelitian dan penulisan skripsi dengan judul Uji aktivitas Antimikroba Ekstrak Herba Kemangi (Ocimum americanum L) terhadap Staphylococcus aureus dan
Candida albicans. Shalawat dan salam senantiasa tercurah kepada junjungan kita, Nabi Muhammad SAW. Penulisan skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Proses penelitian dan penyusunan skripsi ini tidak lepas dari dukungan dan bantuan berbagai pihak, mulai dari masa perkuliahan saya. Oleh karena itu pada kesempatan ini, saya ingin menyampaikan ucapan terimakasih yang sebesar-besarnya kepada :
1. Ibu Eka Putri, M. Si., Apt. selaku pembimbing pertama dan Prof. Dr. Atiek Soemiati, M. Si., Apt. selaku pembimbing kedua yang telah memberikan waktu, tenaga, semangat, ilmu, dan bimbingan kepada saya dalam proses penelitian dan penyelesaian skripsi saya ini.
2. Bapak Prof. Dr. (hc) dr. M.K Tadjudin Sp.And, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
3. Bapak Drs. Umar Mansur, M. Sc., Apt. selaku Ketua Program studi Farmasi FKIK Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
4. Bapak dan Ibu staf pengajar yang telah memberikan ilmu pengetahuan, bantuan, bimbingan dan motivasi sehingga saya dapat menyelesaikan studi di jurusan Farmasi FKIK Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
5. Seluruh karyawan program studi Farmasi yang telah banyak membantu saya selama penelitian dan penyelesaian skripsi.
ix
materil. Tiada apapun di dunia ini yang dapat membalas kebaikan dan kasih sayang yang telah kalian berikan. Kalian adalah inspirasi dan semangatku. 7. Untuk kakak, adik dan ponakanku tersayang yang selalu memberi semangat,
doa, cinta dan tawa yang selalu ku rindukan.
8. Kepada teman-teman Farmasi angkatan 2008, terimakasih untuk kebersamaan, candaan, dukungan, bantuan, semangat, saran dan kritik selama ini. Kebersamaan kita akan selalu terkenang.
9. Sahabat-sahabatku yang setia menemani cerita suka dan duka selama penelitian, Nur Ikhlas, Tia, Dini, Febri, Rere, Reni, Imeh, Mayang dan Rosa, terima kasih untuk semangat dan perhatian yang kalian berikan.
10.Serta semua pihak yang tidak dapat disebutkan satu persatu yang turut membantu menyelesaikan skripsi ini.
Akhir kata, atas segala kekurangan yang ada, penulis berharap semoga hasil penelitian ini dapat bermanfaat baik bagi kalangan akademis, khususnya bagi mahasiswa farmasi dan masyarakat pada umumnya.
Jakarta, Maret 2013
xii
3.3 Metode Penelitian ... 19
3.3.1 Pembuatan Ekstrak Herba Kemangi ... 19
3.3.2 Pengujian Parameter Ekstrak Herba Kemangi ... 21
3.3.3 Uji Penapisan Fitokimia Ekstrak Herba Kemangi ... 21
3.3.4 Pengujian Aktivitas Antimikroba Ekstrak Herba Kemangi 23 3.3.4.1 Sterilisasi Alat dan Bahan... 23
3.3.4.2 Pembuatan Medium ... 23
3.3.4.3 Peremajaan Mikroba ... 24
3.3.4.4 Pembuatan Suspensi (Inokulum) ... 24
3.3.4.5 Pembuatan Larutan Uji ... 25
3.3.4.6 Penentuan Aktivitas Antimikroba ... 25
BAB 4. HASIL DAN PEMBAHASAN ... 27
4.1 Hasil ... 27
4.1.1 Determinasi Tanaman ... 27
4.1.2 Karakteristik Ekstrak ... 27
4.1.3 Penapisan Fitokimia Ekstrak Herba Kemangi ... 28
4.1.4 Penentuan Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Mikroba Uji (Metode Difusi Agar) ... 29
4.1.5 Penentuan Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Mikroba Uji (Metode Dilusi Cair) ... 30
4.2 Pembahasan ... 31
BAB 5. KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
xiii
DAFTAR GAMBAR
Gambar 1. Tanaman Kemangi ... 4 Gambar 2. Hasil Skrining Fitokimia Ekstrak Herba Kemangi ... 48 Gambar 3. Hasil Uji Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap
Staphylococcus aureus dan Candida albicans (Metode Difusi Agar) .52 Gambar 4. Hasil Uji Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap
xiv
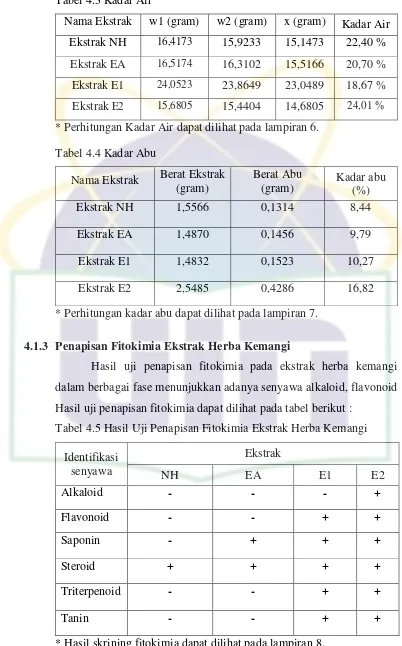
Tabel 4.1 Pemeriksaan Organoleptis Ekstrak Herba Kemangi ... 27
Tabel 4.2 Rendemen... 27
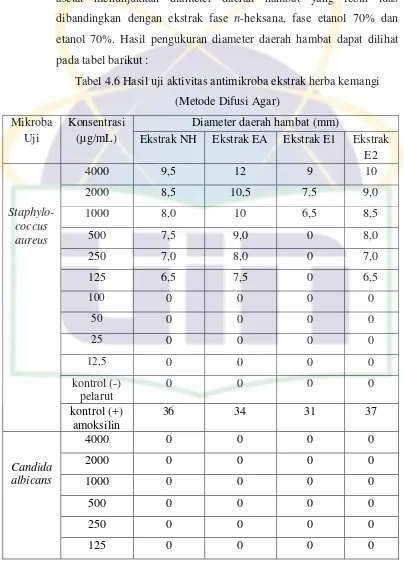
Tabel 4.3 Kadar Air... 28
Tabel 4.4 Kadar Abu ... 28
Tabel 4.5 Hasil Uji Penapisan Fitokimia Ekstrak Herba Kemangi ... 28
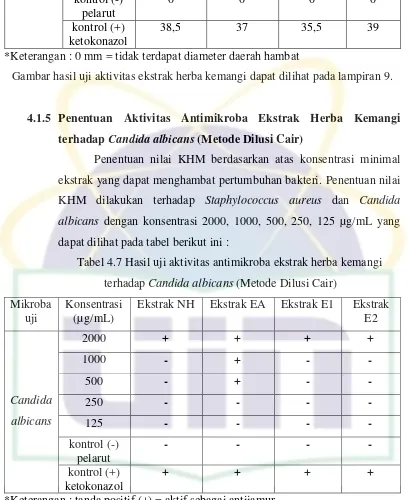
Tabel 4.6 Hasil Uji Aktivitas Antimikroba Ekstrak Herba Kemangi (Metode Difusi Agar) ... 29
Tabel 4.7 Hasil Uji Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Candida albicans (Metode Dilusi Cair) ... 30
xv
DAFTAR LAMPIRAN
Lampiran 1. Hasil Determinasi ... 40
Lampiran 2. Skema Proses Maserasi ... 41
Lampiran 3. Skema Penentuan Aktivitas Antimikroba Ekstrak Herba Kemangi (Metode Difusi Agar) ... 43
Lampiran 4. Skema Penentuan Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Candida albicans (Metode Dilusi Cair) ... 44
Lampiran 5. Perhitungan Rendemen Ekstrak Herba Kemangi ... 45
Lampiran 6. Perhitungan Kadar Air Ekstrak Herba Kemangi ... 46
Lampiran 7. Perhitungan Kadar Abu Ekstrak Herba Kemangi... 47
Lampiran 8. Hasil Skrining Fitokimia Ekstrak Herba Kemangi ... 48
Lampiran 9. Hasil Uji Aktivitas Antimikroba Ekstrak Herba Kemangi (Metode Difusi Agar) ... 52
Lampiran 10. Hasil Uji Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Candida albicans (Metode Dilusi Cair) ... 57
1 UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN
1.1Latar Belakang
Di Indonesia terdapat berbagai jenis tumbuhan obat, lebih dari 20.000
jenis tumbuhan obat tersebar di seluruh negara ini. Sekitar 1000 jenis tanaman
telah terdata dan baru sekitar 300 jenis yang sudah dimanfaatkan untuk
pengobatan secara tradisional. Penggunaan tanaman sebagai bahan obat
tradisional memerlukan penelitian ilmiah untuk mengetahui khasiatnya dan
digunakan sebagai sumber senyawa penuntun untuk sintesis senyawa obat
baru (Akbar, 2010).
Salah satu tanaman obat tradisional yang banyak dimanfaatkan
masyarakat Indonesia adalah Ocimum spp. Secara tradisional tanaman ini digunakan untuk mengobati, perut kembung atau masuk angin, demam,
melancarkan ASI, rematik dan sariawan (Umar, 2011), selain itu juga
digunakan untuk lalapan dan sebagai bumbu dalam masakan. Di India dan
sebagian wilayah di Afrika, seduhan daun kemangi disajikan untuk
menggantikan seduhan daun teh asli. Minuman tersebut biasanya disajikan
pada saat pergantian musim, ketika orang mudah terserang batuk, pilek,
ataupun demam. Di Eropa, minyak atsiri kemangi digunakan sebagai bahan
campuran pembuatan obat dan untuk perawatan tubuh seperti sabun mandi,
biang parfum, body lotion, minyak gosok, permen pelega tenggorokan, dan
juga minyak aroma terapi (Manawean, 2010).
Ocimum sp. merupakan salah satu genus tanaman tahunan yang termasuk famili Labiatae. Sampai sekarang sudah ditemukan 7 jenis tanaman
Ocimum, yaitu Ocimum gratissimum, Ocimum basillicum, Ocimum americanum L., Ocimum klimandschavicum, Ocimum minimum, Ocimum viridae L. dan Ocimum sanctum (Hadipoentyanti & Wahyuni, 2004).
Kandungan kimia pada Ocimum berbeda antara satu species dengan
species lainnya. Kandungan kimia Ocimum spp. yang pernah dilaporkan adalah minyak atsiri, saponin, tanin, flavonoid, steroid, terpenoid, alkaloid,
2
UIN Syarif Hidayatullah Jakarta 2010; Sarma & Babu 2011; Ladipo, Doherty & Kanife, 2010). Minyak atsiri
yang terkandung dalam genus Ocimum ini adalah eugenol, osimen, pinen, linalool, sineol, geraniol, metil kavikol, metil sinamat, sitral, kamfor, timol,
benzoil, sitronella, lionen, dan lain-lain (Martono, Hadipoentyanti & Udarno,
2004).
Penelitian yang telah ada menunjukkan bahwa Ocimum spp. mengandung senyawa yang bersifat insektisida, larvasida, nematisida,
antipiretik, fungisida, antibakteri dan antioksidan (Nurcahyanti, Dewi &
Timotius, 2011; Maryati, Fauzia & Rahayu, 2007).
Menurut penelitian sebelumnya, ekstrak kloroform Ocimum americanum L. dapat menghambat pertumbuhan bakteri Shigella dysenteriae
dan ekstrak metanolnya dapat menghambat pertumbuhan Klebsiella pneumonia, Salmonella paratyphy dan Staphylococcus aureus dengan diameter daerah hambat berturut-turut 10 mm, 9 mm, 7 mm dan 7 mm, namun
pada penelitian ini tidak melaporkan konsentrasi yang digunakan untuk uji
aktivitas antibakteri tersebut (Devi, Thirumaran, Arumungam, Anantharaman,
2010). Hasil penelitian lain menyebutkan ekstrak alkohol dari daun Ocimum americanum L. dapat menghambat pertumbuhan Staphylococcus aureus, Bacillus subtilis, Escherichia coli dan Pseudomonas aeruginosa dengan diameter daerah hambat berturut-turut 23 mm, 16 mm, 10 mm dan 10 mm
pada konsentrasi 100 mg/mL (Dhale, Birari & Dhulgande, 2010).
Metode ekstraksi yang digunakan pada penelitian ini yaitu dimaserasi
langsung dengan etanol 70% dan dimaserasi menggunakan pelarut dengan
kepolaran yang bertingkat yaitu n-heksana, etil asetat dan etanol 70%. Pengujian aktivitas antimikroba dari ekstrak herba kemangi terhadap
Staphylococcus aureus (ATCC 25925) dan Candida albicans (ATCC 10231) digunakan metode difusi agar dan dilusi cair. Sebagai kontrol positif
digunakan amoksisilin 25 g/mL dan ketokonazol 10 g/mL. Sebagai kontrol
UIN Syarif Hidayatullah Jakarta
1.2Rumusan Masalah
Apakah ekstrak herba kemangi fase n-heksana, fase etil asetat, fase etanol 70% dan ekstrak etanol 70% mempunyai aktivitas antimikroba
terhadap Staphylococcus aureus dan Candida albicans?
1.3Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui aktivitas antimikroba
ekstrak herba kemangi fase n-heksana, fase etil asetat, fase etanol 70% dan ekstrak etanol 70% terhadap Staphylococcus aureus dan Candida albicans.
1.4Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah
mengenai aktivitas ekstrak herba kemangi sebagai antimikroba terhadap
4 UIN Syarif Hidayatullah Jakarta
BAB 2
TINJAUAN PUSTAKA
2.1Deskripsi Tanaman Kemangi 2.1.1 Taksonomi
Taksonomi tanaman kemangi adalah sebagai berikut : a.Kingdom : Plantae
b.Divisi : Magnoliophyta
c.Kelas : Magnoliopsida
d.Ordo : Lamiales
e.Family : Lamiaceae atau Labiatae
f. Genus : Ocimum
g.Species : Ocimum americanum L.
Gambar 1. Tanaman kemangi Sumber : koleksi pribadi (Depok, 05/10/12)
2.1.2 Sinonim
a. Sinonim : Ocimum canum Sims, Ocimum affricanum Lour,
UIN Syarif Hidayatullah Jakarta
b. Nama daerah
1) Malaysia : Selaseh, kemangi, ruku-ruku
2) Inggris : American basil, Hoary basil, Lemon basil, Wild
basil
3) Indonesia : Surawung (Sunda), selasih putih, kemangi 4) Thailand : Maenglak
(Siemonsma & Piluek, 1994) 2.1.3 Morfologi
Morfologi Ocimum spp yang beragam dapat dibedakan dari bentuk dan warna batang, bentuk dan warna daun, bentuk rangkaian dan warna bunga, serta bentuk dan warna biji (Hadipoentyanti & Wahyuni, 2008).
Ocimum sp. merupakan herba tegak, sangat harum; tinggi 0,3-0,6 meter, umumnya batang berwarna hijau dan keunguan. Panjang tangkai daun 0,5-2 cm; helaian daun bulat memanjang dengan ujung runcing. Bentuk rangkaian bunga ada yang tunggal dan ada yang majemuk (bergerombol). Daun pelindung bulat telur dengan panjang 0,5-1 cm dengan kelopak sisi luar berambut (Martono, Hadipoentyanti & Udarno, 2004).
Terdapat variasi warna mahkota bunga pada Ocimum sp. yaitu putih, kuning dan keunguan, dengan panjang mahkota bunga 8-9 mm. Tanaman ini diperbanyak dengan biji. Biji Ocimum sp. berwarna hitam atau cokelat, bentuk bulat dengan ukuran biji relatif kecil (Steenis, 1981; Hadipoentyanti & Wahyuni, 2008).
Di Indonesia genus Ocimum yang dikenal adalah Ocimum gratissimum (Ocimum viridiflorum, Roth) atau dengan bahasa daerah Selasih Mekah, Selasih Jambi, ruku-ruku rimba, Ocimum canum Sims yang dikenal dengan kemangi, Ocimum basilicum atau selasih dan
Ocimum tenuiflorum (Ocimum sanctum L.) atau ruku-ruku (Hadipoentyanti & Wahyuni, 2008).
6
UIN Syarif Hidayatullah Jakarta a. Ocimum gratissimum L. bentuk daun panjang, cabang tulang 6-10,
dengan kelopak depan lebih pendek dan biji keras;
b. Ocimum africanum Lour (Ocimum canum Sims) mempunyai kelopak dan mahkota yang lebih pendek, bunga selalu putih ; c. Ocimum sanctum L, dengan kelopak yang berambut pendek atau
gundul (Steenis, 1981).
Tumbuhan Ocimum americanum L. memiliki morfologi yang sama dengan Ocimum basilicum namun memiliki bentuk bunga sedikit lebih kecil, berwarna putih, dengan benang sari menonjol dan lebih berambut. Tandan bunga banyak, penuh dan tegak. Warna daun hijau terang, bentuk daun bulat memanjang dengan bentuk ujung daun runcing-tumpul dan bentuk pangkal daun tumpul. Tepi daun bergerigi, permukaan daun halus dan panjang daun 4,9-9,8 cm. Tinggi tanaman 70-85 cm dengan warna batang hijau terang (Martono, Hadipoentyanti & Udarno, 2004).
Panen dilakukan apabila tanaman sudah berbunga penuh dan sudah mulai pembentukan biji serta daun-daun bagian bawah mulai berubah warna menjasi kekuningan yaitu sekitar 2-3 bulan masa tanam. Panen sebaiknya dilakukan sebelum daun tanaman berguguran (Hadipoentyanti & Wahyuni, 2008).
2.1.4 Ekologi dan penyebaran
Ocimum sp. banyak tumbuh di dataran rendah hingga ketinggian 1100 m dari permukaan laut. Tumbuh baik pada tanah terbuka, maupun agak teduh dan tidak tahan terhadap kekeringan. Lebih sering tumbuh liar; ditemukan di tepi jalan dan di tepi kebun. Tanaman ini berasal dari daerah Asia tropis.
UIN Syarif Hidayatullah Jakarta
2.1.5 Kandungan kimia
Kandungan kimia pada Ocimum americanum L. yaitu minyak atsiri, karbohidrat, fitosterol, alkaloid, fenolik, tanin, lignin, pati, saponin, flavonoid, terpenoid dan antrakuinon (Dhale, Birari & Dhulgande, 2010; Sarma & Babu, 2011). Minyak atsiri pada Ocimum americanum L. mengandung komponen kamfor, metil sinamat, sitral, geraniol, limonen dan linalool (Martono ,Hadipoentyanti & Udarno, 2004; Hadipoentyanti &Wahyuni, 2008).
2.1.6 Khasiat
Secara tradisional, Ocimum spp. digunakan sebagai obat untuk menyembuhkan beberapa penyakit seperti demam, mengurangi rasa mual, sakit kepala, sembelit, diare, batuk, penyakit kulit, penyakit cacing, gagal ginjal, epilepsi dan digunakan sebagai penambah aroma pada makanan (Nurcahyanti, Dewi & Timotius, 2011; Maryati, Fauzia & Rahayu, 2007).
Penelitian yang telah ada menyebutkan ekstrak petroleum eter dari Ocimum sanctum memiliki aktivitas sebagai antidiabetes dan antihiperkolesterolemia (Gupta, Mediratta, Singh, Sharma & Shukla, 2006), ekstrak metanolnya memiliki aktivitas antioksidan dan antineoplastik (Islam et al., 2011). Ekstrak air, etanol dan aseton
Ocimum gratissimum L. memiliki aktivitas antifungi (Amadi, Salami & Eze, 2010), ekstrak kloroformnya sebagai antioksidan (Okonkwo & Njoku, 2011). Ekstrak etanol, metanol dan n-heksana dari Ocimum basilicum sebagai antimikroba (Adiguzel et al., 2005), ekstrak petroleum eter, kloroform, alkohol, air dan minyak atsirinya memiliki aktivitas antioksidan dan hepatoprotektif (Meera, Devi, Kameswari, Madhumitha & Merlin, 2009). Ekstrak metanol Ocimum tenuiflorum
memiliki aktivitas sebagai antioksidan (Balaji, Prakash, Sunganya & Aravinthan, 2011).
8
UIN Syarif Hidayatullah Jakarta
2.2Ekstraksi
Ekstraksi adalah penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak dapat larut seperti serat, karbohidrat, protein dan lain-lain. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Dengan diketahuinya senyawa aktif yang terkandung dalam simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Depkes RI, 2000).
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani mengggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Depkes RI, 2000).
Ada beberapa cara metode ekstraksi dengan menggunakan pelarut yaitu : 1. Cara Dingin
a.Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar. Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
b.Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Prosesnya terdiri dari tahapan pengembangan bahan, tahapan maserasi antara, tahap perkolasi sebenarnya (penetesan/penemapungan ekstrak), terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan (Depkes RI, 2000).
2. Cara Panas
UIN Syarif Hidayatullah Jakarta
pengulangan proses pada residu pertama sampai 3-5 kali sehingga proses ekstraksi sempurna.
b. Soxhletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dikakukan dengan alat khusus sehingga terjadi ekstrak kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-50 C.
d. Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air 96-98 C (bejana infus tercelup dengan penangas air mendidih selama 15-20 menit).
e. Dekok adalah infus pada waktu yang lebih lama (≥ 30 C) dan temperatur sampai titik didih air (Depkes RI, 2000).
2.3Parameter dan Metode Uji Ekstrak 2.3.1 Parameter Non Spesifik
1. Kadar air
Parameter kadar air adalah pengukuran kandungan air yang berada di dalam bahan, dilakukan dengan cara yang tepat diantara cara titrasi, destilasi atau gravimetri (Depkes RI, 2000).
2. Kadar abu
10
UIN Syarif Hidayatullah Jakarta
2.3.2 Parameter Spesifik 1. Identitas
Parameter identitas ekstrak deskripsi tata nama yaitu nama ekstrak, nama latin tumbuhan dan bagian tumbuhan yang digunakan dan ekstrak dapat mempunyai senyawa identitas. Tujuannya adalah untuk memberikan identitas obyektif dari mana dan spesifik dari senyawa identitas.
2. Organoleptik
Parameter organoleptik ekstrak adalah penggunaan panca indera mendeskripsikan bentuk (padat, serbuk-kering, kental, cair), warna, bau (aromatik, tidak berbau), dan rasa (Depkes RI, 2000). 2.4Antimikroba
Antimikroba merupakan zat atau obat untuk membasmi jasad renik yang diperoleh dari sintesis atau yang berasal dari senyawa non organik. Bakteriostatik yaitu antimikroba yang hanya menghambat pertumbuhan mikroorganisme. Bakterisidal adalah antimikroba yang dapat membunuh mikroorganisme.
Mekanisme kerja antimikoba : 1. Menghambat sintesis dinding sel
Struktur dinding sel dapat dirusak dengan cara menghambat pembentukannya atau mengubahnya setelah terbentuk (Pelczar, 1988). 2. Menganggu keutuhan membran sel mikroba
Membran sitoplasma mempertahankan bahan-bahan tertentu di dalam sel serta mengatur aliran keluar-masuknya bahan-bahan lain. Membran memelihara integritas komponen-komponen selular. Kerusakan pada membran ini akan mengakibatkan terhambatnya pertumbuhan sel atau matinya sel (Pelczar, 1988).
3. Menghambat sintesis protein sel mikroba
UIN Syarif Hidayatullah Jakarta
dapat diperbaiki kembali. Suhu tinggi dan konsentrasi pekat beberapa zat kimia dapat mengakibatkan koagulasi (denaturasi) ireversibel (tidak dapat balik) komponen-komponen selular yang vital ini (Pelczar, 1988).
4. Menganggu metabolisme sel mikroba
Setiap enzim dari beratus-ratus enzim berbeda-beda yang ada didalam sel merupakan sasaran potensial bagi bekerjanya suatu penghambat. Banyak zat kimia telah diketahui dapat mengganggu reaksi biokimia. Penghambatan ini dapat mengakibatkan terganggunya metabolisme atau matinya sel (Pelczar, 1988).
5. Penghambatan sintesis asam nukleat dan protein
DNA, RNA dan protein memegang peranan penting di dalam proses kehidupan normal sel. Hal itu berarti bahwa gangguan apa pun yang akan terjadi pada pembentukan atau pada fungsi zat-zat tersebut dapat mengakibatkan kerusakan total pada sel (Pelczar, 1988).
2.4.1 Bakteri
Bakteri adalah mikroorganisme bersel satu dan berkembang biak dengan membelah diri (aseksual). Ukuran bakteri bervariasi baik penampang maupun panjangnya, tetapi pada umumnya penampang bakteri adalah sekitar 0,7-1,5 μm dan panjangnya sekitar 1-6μm.
Bakteri dibagi dalam golongan Gram positif dan Gram negatif berdasarkan reaksinya terhadap pewarnaan Gram. Perbedaan antara bakteri Gram positif dan Gram negatif diperlihatkan dari perbedaan dinding sel. Dinding sel bakteri Gram positif, Staphylococcus aureus
dan Streptococcus sp sebagian besar terdiri atas beberapa lapisan peptidaglikan yang membentuk struktur yang tebal dan kaku. Kekakuan pada dinding sel bakteri yang disebabkan karena lapisan peptidaglikan dan ketebalan peptidaglikan ini membuat bakteri Gram positif resisten terhadap lisis osmotik (Jawetz et al., 2001).
12
UIN Syarif Hidayatullah Jakarta
yang terdiri dari protein, lipoprotein, fosfolipid dan lipopolisakarida, daerah periplasma dan membran dalam.
Bakteri Gram negatif, Escherichia coli dan Pseudomonas sp terdiri atas satu atau sedikit lapisan peptidaglikan pada dinding selnya. Selain itu dinding sel bakteri Gram negatif ini tidak mengandung asam teikoat tetapi mengandung polisakarida dan lebih rentan terhadap kerusakan mekanik dan kimia.
2.4.1.1 Staphylococcus aureus
Klasifikasi Staphylococcus aureus adalah sebagai berikut: Divisi : Protophyta atau Schizophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Spesies : Staphylococcus aureus
2.4.1.2 Uraian Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram positif yang bersifat aerob atau anaerob fakultatif dan tahan hidup dalam lingkungan yang mengandung garam dengan konsentrasi tinggi, misalnya NaCl 10%. Staphylococcus berbentuk bulat atau kokus dengan diameter 0,4-1,2 µm. Hasil pewarnaan yang berasal dari perbenihan padat akan memperlihatkan susunan bakteri yang bergerombol seperti buah anggur.
Untuk membiakkan bakteri Staphylococcus diperlukan suhu optimal antara 28-38 C. Apabila bakteri tersebut diisolasi dari seorang penderita, suhu optimal yang diperlukan adalah 37 C, pH optimal untuk pertumbuhannya adalah 7,4. Bakteri
UIN Syarif Hidayatullah Jakarta
2.4.2 Jamur
Jamur adalah organisme heterotrofik. Jamur dapat berupa khamir yang tumbuh sebagai uniseluler atau berupa kapang yang tumbuh berupa filamen-filamen. Komponen penyusun dinding sel berupa kitin, selulosa atau glukan.
2.4.2.1 Candida albicans
Klasifikasi Candida albicans adalah sebagai berikut: Divisi : Ascomycota
Kelas : Saccharomycetes
Bangsa : Saccharomycetales
Suku : Saccharomycetaceae
Marga : Candida
Spesies : Candida albicans
Sinonim : Candida stellatoidea atau Oidium albicans
2.4.2.2 Uraian Candida albicans
Candida spp dikenal sebagai fungi dimorfik yang secara normal ada pada saluran pencernaan, saluran pernafasan bagian atas dan mukosa genital pada mamalia. Tetapi populasi yang meningkat dapat menimbulkan masalah. Beberapa spesies
Candida yang dikenal banyak menimbulkan penyakit baik pada manusia maupun hewan adalah Candida albicans.
Candida albicans merupakan fungi oportunistik penyebab sariawan, lesi pada kulit, vulvavaginistis, candida pada urin, gastrointestinal candidiasis yang dapat menyebabkan gastric ulcer atau bahkan dapat menjadi komplikasi kanker.
14
UIN Syarif Hidayatullah Jakarta
ini menyebabkan penyakit sistemik progresif pada penderita yang lemah atau kekebalannya tertekan. Candida dapat menimbulkan invasi dalam aliran darah, tromboflebitis, endokarditis, atau infeksi pada mata dan organ-organ lain (Jawetz et al., 1995).
2.4.3 Metode Pengujian Aktivitas Antimikroba
Pengujian mikrobiologi memanfaatkan mikroorganisme sebagai penentu konsentrasi komponen tertentu pada campuran kompleks kimia, untuk mendiagnosis penyakit tertentu, serta untuk menguji bahan kimia guna menentukan potensi mutagenik atau karsinogenik suatu bahan.
Pada uji ini diukur pertumbuhan mikroorganisme terhadap agen antimikroba. Kegunaan uji antimikroba adalah diperolehnya suatu sistem pengobatan yang efektif dan efisien.
Adapun metoda uji antimikroba antara lain sebagai berikut : 1. Metode difusi
a. Metode disc diffusion (metode Kirby Bauer) untuk menentukan aktivitas agen antimikroba. Piringan yang berisi agen antimikroba diletakkan pada media agar yang telah ditanami mikroorganisme yang akan berdifusi pada media agar tersebut. Area jernih mengindikasikan adanya hambatan pertumbuhan mikroorganisme oleh agen antimikroba pada permukaan media agar (Pratiwi, 2008).
UIN Syarif Hidayatullah Jakarta
yang menghambat pertumbuhan mikroorganisme pada media agar (Pratiwi, 2008).
c. Ditch plate technique. Pada metode ini sampel uji berupa agen antimikroba yang diletakkan pada parit yang dibuat dengan cara memotong media agar dalam cawan petri pada bagian tengah secara membujur dan mikroba uji (maksimum 6 macam) digoreskan ke arah parit yang berisi agen antimikroba (Pratiwi, 2008).
d. Cup-plate technique. Metode ini serupa dengan metode dics diffusion, dimana dibuat sumur pada media agar yang telah ditanami dengan mikroorganisme dan pada sumur tersebut diberi agen antimikroba yang diuji (Pratiwi, 2008).
e. Gradient-plate technique. Pada metode ini konsentrasi agen antimikroba pada media agar secara teoritis bervariasi dari 0 hingga maksimal. Media agar dicairkan dan larutan uji ditambahkan. Campuran kemudian dituang ke dalam cawan petri dan diletakkan dalam posisi miring. Nutrisi kedua selanjutnya dituang diatasnya dan diinkubasi selama 24 jam untuk memungkinkan agen antimikroba berdifusi dan permukaan media mengering. Mikroba uji (maksimal 6 macam) digoreskan pada arah mulai dari konsentrasi tinggi ke rendah. Hasil diperhitungkan sebagai panjang total pertumbuhan mikroorganisme maksimum yang mungkin dibandingkan dengan panjang pertumbuhan hasil goresan.
Bila :
X = panjang total pertumbuhan mikroorganisme yang mungkin Y = panjang pertumbuhan aktual
C = konsentrasi final agen antimikroba pada total volume media mg/mL atau µg/mL,
Maka konsentrasi hambat adalah; .
16
UIN Syarif Hidayatullah Jakarta
Yang perlu diperhatikan adalah dari hasil perbandingan yang didapat dari lingkungan padat dan cair, faktor difusi agen antimikroba dapat mempengaruhi keseluruhan hasil pada media padat (Pratiwi, 2008).
2. Metode dilusi
Metode dilusi dibedakan menjadi dua yaitu:
a. Metode dilusi cair/ broth dilution test (serial dilution).
Metode ini mengukur MIC (Minimum Inhibitory Concentration
atau Kadar Hambat Minimum, KHM) dan MBC (Minimum Bactericidal Concentration atau Kadar Bunuh Minimum, KBM). Cara yang dilakukan adalah dengan membuat seri pengeceran agen antimikroba pada medium cair yang ditambahkan dengan mikroba uji. Larutan uji agen antimikroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan mikroba uji ataupun agen antimikroba, dan diinkubasi selama 18-24 jam. Media cair yang tetap terlihat jernih setelah diinkubasi ditetapkan sebagai KBM (Pratiwi, 2008).
b. Metode dilusi padat/ solid dilution test.
Metode ini serupa dengan metode dilusi cair namun menggunakan media padat (solid). Keuntungan metode ini adalah satu konsentrasi agen antimikroba yang diuji dapat digunakan untuk menguji beberapa mikroba uji (Pratiwi, 2008).
3. Uji aktivitas antifungi
UIN Syarif Hidayatullah Jakarta
dilarutkan pada larutan agen antimikroba uji, dan selanjutnya pada interval waktu tertentu disubkultur pada media yang sesuai. Setelah diinkubasi, pertumbuhan fungi pun diamati (Pratiwi, 2008).
4. Uji Bioautografi
Uji bioautografi merupakan metode spesifik untuk mendeteksi bercak pada kromatogram hasil KLT (kromatografi lapis tipis) yang memiliki aktivitas antibakteri, antifungi, dan antivirus. Keuntungan metode ini adalah sifatnya yang efisien untuk mendeteksi adanya senyawa antimikroba karena letak bercak dapat ditentukan walaupun berada dalam campuran yang kompleks sehingga memungkinkan untuk mengisolasi senyawa aktif tersebut. Kerugiannya adalah metode ini tidak dapat digunakan untuk menentukan KHM dan KBM.
Ada dua macam metode bioautografi, yaitu :
a. Bioautografi langsung: dengan penyemprotan plat KLT dengan suspensi mikroorganisme atau dengan menyentuhkan plat KLT pada permukaan media agar yang ditanami mikroorganisme. Setelah inkubasi pada waktu tertentu, letak senyawa aktif tampak sebagai area jernih dengan latar belakang keruh.
18 UIN Syarif Hidayatullah Jakarta
BAB 3
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Pharmacy Drugs Research
dan Laboratorium Mikrobiologi, Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah, Jakarta. Waktu penelitian dilakukan dari bulan Mei 2012 hingga Januari 2013.
3.2Alat dan Bahan 3.2.1 Alat
Alat-alat yang akan digunakan dalam penelitian ini yaitu timbangan analitik (Sartonius CP224S), blender , tanur (Thermolyne), oven (Memmert), serangkaian alat rotary evaporator (N-1000 EYELA), Spektrofotometer UV-Vis (U-2910, Hitachi), gelas ukur (Pyrex), labu ukur (Pyrex), beaker gelas (Pyrex), cawan petri (Pyrex), erlenmeyer (Pyrex), cawan penguap, plat tetes, pipet tetes, batang pengaduk, corong (Iwake), botol gelap, botol timbang, spatula, pinset, tabung reaksi, rak tabung reaksi, jarum ose, bunsen, Laminar Air Flow
(EACI), refrigerator (Sanyo Medicool), hot plate dan magnetic stirrer
(Daiki KBLee 5001), pipet mikro (Epphendorf), vortex (Labnet), autoklaf (Tommy, tipe SS-325) dan inkubator (Gallenkamp).
3.2.2 Bahan
UIN Syarif Hidayatullah Jakarta
2. Media. Sebagai media pertumbuhan digunakan Nutrient Agar
(NA), SabouraudDextrose Agar (SDA) dan SabouraudDextrose Liquid yang diperoleh dari laboratorium mikrobiologi Fakultas Kedokteran Universitas Indonesia (FK UI)
3. Mikroba uji. Mikroba uji yang akan digunakan adalah
Staphylococcus aureus (ATCC 25925) dan Candida albicans
(ATCC 10231) yang diperoleh dari laboratorium mikrobiologi FK UI.
4. Bahan kimia. Pada proses maserasi pelarut yang digunakan n -heksana, etil asetat dan etanol 70%. Untuk skrining fitokimia menggunakan aquades, HCl 2 N, CHCl3, H2SO4 pekat, HCl
pekat, asam asetat anhidrad, FeCl3, serbuk Magnesium, reagen
Mayer serta NaCl 0,9% untuk media suspensi mikroba uji.
5. Bahan lain : kasa, kertas saring, alumunium foil, kertas cakram dan kapas steril.
6. Antimikroba pembanding digunakan amoksisilin 25 g/mL dan ketokonazol 10 g/mL yang diperoleh di laboratorium mikrobiologi FK UI.
3.3Metode Penelitian
3.3.1 Pembuatan Ekstrak Herba Kemangi
Herba kemangi hasil panen (34 kg) disortasi, dicuci sampai bersih dengan air mengalir dan dikeringkan dengan cara diangin-anginkan dan terlindung dari sinar matahari langsung, kemudian dirajang, diblender dan diperoleh serbuk simplisia kering (4,830 kg). Sebanyak 3,159 kg serbuk herba kemangi dimaserasi menggunakan pelarut dengan kepolaran yang bertingkat yaitu n-heksana, etil asetat dan etanol 70%.
20
UIN Syarif Hidayatullah Jakarta
dengan kain kasa, disaring lagi menggunakan kertas saring dan ampas diremaserasi sampai filtrat hasil saringan mendekati jernih (total pelarut n-heksana yang terpakai 29 L). Filtrat n-heksana dikentalkan menggunakan rotary vacuum evaporator sehingga diperoleh ekstrak kental fase n-heksana (ekstrak NH).
Ampas yang telah dimaserasi dengan pelarut n-heksana dikeringkan sampai semua pelarut menguap dan diperoleh serbuk simplisia kering. Kemudian dimaserasi lagi dengan pelarut etil asetat sampai semua serbuk terendam. Dibiarkan selama 2-3 hari, dengan pengocokan 2-3 kali. Setelah dimaserasi, disaring dengan kain kasa, sehingga diperoleh filtrat dan ampas. Filtrat hasil saringan dengan kain kasa, disaring lagi menggunakan kertas saring dan ampas diremaserasi sampai filtrat hasil saringan mendekati jernih (total pelarut etil asetat yang terpakai 25 L). Filtrat etil asetat dikentalkan menggunakan rotary vacuum evaporator sehingga diperoleh ekstrak kental fase etil asetat (ekstrak EA).
Ampas yang telah dimaserasi dengan pelarut etil asetat dikeringkan sampai semua pelarut menguap dan diperoleh serbuk simplisia kering. Kemudian dimaserasi lagi dengan pelarut etanol 70% sampai semua serbuk terendam. Dibiarkan selama 2-3 hari, dengan pengocokan 2-3 kali. Setelah dimaserasi, disaring dengan kain kasa, sehingga diperoleh filtrat dan ampas. Filtrat hasil saringan dengan kain kasa, disaring lagi menggunakan kertas saring dan ampas diremaserasi sampai filtrat hasil saringan mendekati jernih (total pelarut etanol 70% yang terpakai 20 L). Filtrat etanol dikentalkan menggunakan rotary vacuum evaporator sehingga diperoleh ekstrak kental fase etanol (ekstrak E1).
UIN Syarif Hidayatullah Jakarta
saring dan ampas diremaserasi sampai filtrat hasil saringan mendekati jernih. Filtrat dikentalkan menggunakan rotary vacuum evaporator
sehingga diperoleh ekstrak kental etanol 70% (ekstrak E2) (skema proses maserasi dapat dilihat pada lampiran 2).
3.3.2 Pengujian Parameter Ekstrak Herba Kemangi 1. Parameter Non Spesifik
a. Kadar Air
Ekstrak ditimbang sebanyak 1 gram, dimasukkan ke dalam cawan penguap yang sebelumnya telah dipanaskan dan ditara sampai bobot tetap. Dipanaskan dalam oven pada suhu 105 C selama 5 jam dan ditimbang. Sebelum dan setiap pemanasan, dibiarkan dalam eksikator hingga suhu kamar. Lanjutkan pemanasan dan timbang hingga bobot tetap (Depkes, 2000). b. Kadar Abu
Ekstrak ditimbang sebanyak 1 gram, dimasukkan ke dalam krus silikat yang telah dipijarkan dan ditara, lalu ekstrak diratakan. Pijarkan perlahan-lahan hingga arang habis, dinginkan, timbang. Jika arang tidak dapat hilang, tambahkan air panas, disaring menggunakan kertas saring bebas abu. Dipijarkan sisa kertas saring dalam krus yang sama. Filtrat dimasukkan ke dalam krus, diuapkan, dipijarkan hingga bobot tetap dan ditimbang. Kadar abu dihitung terhadap berat ekstrak (Depkes, 2000).
2. Parameter Spesifik (Organoleptik)
Pemeriksaan organoleptis ekstrak herba kemangi meliputi bentuk, warna dan bau ekstrak.
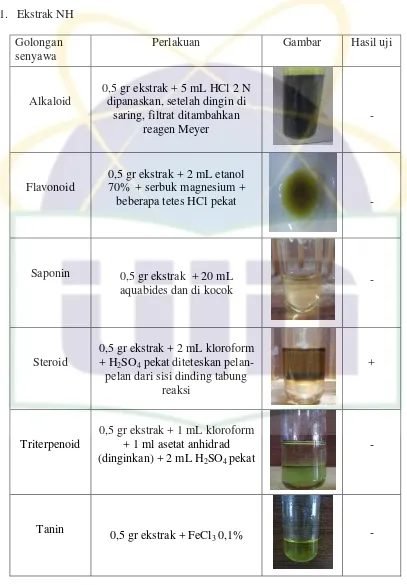
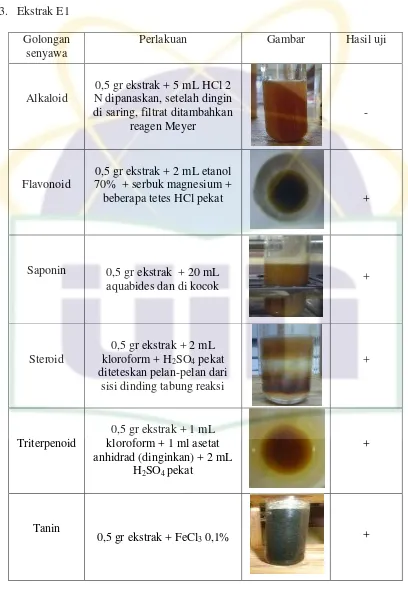
3.3.3 Uji Penapisan Fitokimia Ekstrak Herba Kemangi a. Identifikasi Alkaloid
22
UIN Syarif Hidayatullah Jakarta
air, setelah dingin di saring dan filtrat ditambahkan reagen meyer. Terbentuknya endapan atau kekeruhan menunjukkan adanya alkaloid (Farnsworth, 1966).
b. Identifikasi Flavonoid
Sebanyak 0,5 gr ekstrak dimasukkan ke dalam tabung reaksi ditambahkan 2 mL etanol 70%, ditambahkan 0,5 gr serbuk magnesium, kemudian ditambahkan beberapa tetes HCl pekat. Terbentuknya warna orange sampai merah menunjukkan adanya flavon, merah sampai merah keungunan menunjukkan adanya flavanon (Farnsworth, 1966).
c. Identifikasi Saponin
Sebanyak 0,5 gr ditambahkan dengan 20 ml aquabides. Kemudian dikocok, terbentuknya busa yang stabil selama beberapa menit menunjukkan adanya saponin (Farnsworth, 1966). d. Triterpenoid
Sebanyak 0,5 gr ekstrak dimasukkan ke dalam tabung reaksi, ditambahkan dengan 1 ml kloroform. Kemudian ditambahkan 1 ml asetat anhidrad lalu didinginkan. Setelah dingin, ditambahkan dengan H2SO4 pekat. Jika terbentuk warna
kemerahan, menunjukkan adanya triterpenoid (Mandal & Ghosal, 2012).
e. Steroid
Sebanyak 0,5 gr ekstrak dimasukkan ke dalam tabung reaksi, ditambahkan dengan 2 ml kloroform kemudian 2 ml H2SO4
pekat diteteskan pelan-pelan dari sisi dinding tabung reaksi. Pembentukan cincin warna merah menunjukkan adanya steroid (Mandal & Ghosal, 2012).
f. Tanin
Sebanyak 0,5 gr ekstrak dimasukkan ke dalam tabung reaksi, ditambahkan dengan FeCl3 0,1 %. Terbentuknya warna
UIN Syarif Hidayatullah Jakarta
3.3.4 Pengujian Aktivitas Antimikroba Ekstrak Herba Kemangi 3.3.4.1 Sterilisasi Alat dan Bahan
Seluruh alat yang akan digunakan dicuci bersih dan dikeringkan. Tabung reaksi, gelas ukur dan erlenmeyer ditutup mulutnya dengan kapas. Cawan petri dibungkus dengan kertas. Kemudian semuanya dimasukkan dalam plastik tahan panas dan disterilkan dengan autoklaf pada suhu 121 C selama 30 menit. Pinset dan jarum ose disterilkan dengan cara memijarkan pada pada api bunsen.
Seluruh media pembenihan (Nutrien Agar, Sabouraud Dextrose Agar dan Sabouraud Dextrose Liquid) disterilkan dengan autoklaf pada suhu 121 C selama 15 menit. Pengerjaan aseptis dilakukan di dalam Laminar Air Flow
yang sebelumnya telah dibersihkan dengan larutan alkohol 70%, lalu disterilkan dengan lampu UV yang dinyalakan selama kurang lebih 2 jam sebelum digunakan (Pertiwi, 2010).
3.3.4.2 Pembuatan Medium 1. Nutrient Agar (NA)
Sebanyak 28 gram medium disuspensikan ke dalam 1 L akuades. Medium dipanaskan sampai mendidih agar tercampur dengan sempurna. Kemudian didiamkan dan disterilkan di dalam autoklaf selama 15 menit, pada suhu 121 C, tekanan 1-2 atm.
2. SabouraudDextrose Agar (SDA)
24
UIN Syarif Hidayatullah Jakarta
3. SabouraudDextrose Liquid (SDL)
Sebanyak 30 gram medium disuspensikan ke dalam 1 L akuades. Medium dipanaskan sampai mendidih agar tercampur dengan sempurna. Kemudian didiamkan dan disterilkan di dalam autoklaf selama 15 menit, pada suhu 121 C, tekanan 1-2 atm.
3.3.4.3 Peremajaan Mikroba
1. Peremajaan Bakteri Uji (Staphylococcus aureus)
Bakteri uji diremajakan dengan menggoreskan bakteri menggunakan jarum ose pada media agar miring
Nutrien Agar dan diinkubasi pada suhu 37 C selama 24 jam (Nurcahyanti, Dewi & Timotius, 2011).
2. Peremajaan Jamur Uji (Candida albicans)
Jamur uji diremajakan dengan menggoreskan jamur menggunakan jarum ose pada media agar miring
Sabouraud Dextrose Agar dan diinkubasi pada suhu ruang selama 3 hari (Rathi, Bhaskar & Patel 2010).
3.3.4.4 Pembuatan Suspensi (Inokulum)
1. Pembuatan Suspensi Staphylococcus aureus
Staphylococcus aureus disuspensikan dalam larutan NaCl 0,9% steril. Kemudian suspensi tersebut diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 600 nm sampai diperoleh absorbansi 0,1 (setara dengan 1,5x106 CFU/mL) (Kuete et al., 2011). 2. Pembuatan Suspensi Candida albicans
UIN Syarif Hidayatullah Jakarta
3.3.4.5 Pembuatan Larutan Uji
Larutan uji dibuat dengan melarutkan ekstrak herba kemangi NH, EA, E1 dan E2 pada masing-masing pelarut. Untuk penentuan aktivitas antimikroba, konsentrasi larutan uji yang digunakan adalah 4000, 2000, 1000, 500, 250, 125, 100, 50, 25 dan 12,5 g/mL.
3.3.4.6 Penentuan Aktivitas Antimikroba 1)Metode Difusi Agar
a. Bakteri
Aktivitas antibakteri dapat ditentukan dengan metode difusi agar. Sebanyak 0,1 mL suspensi bakteri uji dimasukkan ke dalam cawan petri yang telah berisi medium NAsteril. Kemudian letakkan cakram kertas yang telah ditetesi larutan uji dengan konsentrasi 4000, 2000, 1000, 500, 250, 125, 100, 50, 25 dan 12,5 g/mL pada permukaan agar yang telah ditanami bakteri. Amoksisilin 25 g/mL digunakan sebagai kontrol positif dan pelarut n -heksana, etil asetat dan etanol 70% digunakan sebagai kontrol negatif. Diinkubasi selama 24 jam pada suhu 37 C. Aktivitas antibakteri diamati berdasarkan diameter daerah hambat yang ditunjukkan dengan daerah bening yang terbentuk disekeliling kertas cakram dan diukur menggunakan penggaris. Hasil pengukuran dicatat.
b. Jamur
26
UIN Syarif Hidayatullah Jakarta
medium agar secara merata. Kertas cakram steril diletakkan diatas medium agar dan ditetesi larutan uji dengan konsentrasi 4000, 2000, 1000, 500, 250 dan 125 g/mL. Diinkubasi pada suhu ruang selama 3 hari. Sebagai kontrol positif digunakan ketokonazol 10 g/mL. Aktivitas antijamur diamati berdasarkan diameter daerah hambat yang ditunjukkan dengan daerah bening yang terbentuk disekeliling kertas cakram dan diukur menggunakan penggaris. Hasil pengukuran dicatat. (Skema Penentuan Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Staphylococcus aureus dapat dilihat pada lampiran 3).
2)Metode Dilusi Cair
Metode dilusi cair dilakukan dengan menyiapkan beberapa tabung reaksi yang sudah steril, larutan uji dan larutan kontrol. Selanjutnya tiap-tiap tabung diisi dengan 0,5 mL medium SDL. Selanjutnya ditambahkan 0,5 mL larutan uji pada tabung reaksi yang pertama, di vortex, diambil 0,5 mL campuran medium SDL dan larutan uji pada tabung pertama dan ditambahkan pada tabung kedua dan seterusnya sampai konsentrasi 125 g/mL, lalu ambil 0,5 mL larutan pada tabung terakhir dan dibuang sehingga masing-masing tabung berisi 0,5 mL. Kemudian tambahkan 0,1 mL suspensi jamur 1,5x106 CFU mL dan 0,4 mL medium SDL pada masing-masing tabung reaksi dan di
vortex. Selanjutnya diinkubasi pada suhu 25-28 C selama 3 hari. Hasil percobaan diketahui berdasarkan kekeruhan (Skema Penentuan Aktivitas Antimikroba terhadap
27 UIN Syarif Hidayatullah Jakarta Pusat Penelitian Botani, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bogor menunjukkan bahwa tanaman yang digunakan dalam penelitian ini adalah herba kemangi (Ocimum americanum L.). Hasil determinasi dapat dilihat pada lampiran 1.
4.1.2 Karakteristik Ekstrak
Hasil uji pemeriksaan karakteristik ekstrak herba kemangi dalam berbagai fase dapat dilihat pada tabel berikut :
Tabel 4.1 Pemeriksaan Organoleptis Ekstrak Herba Kemangi
Parameter Ekstrak NH Ekstrak EA Ekstrak E1 Ekstrak E2 Bentuk
ekstrak
kental, berminyak,
lengket
Kental Kental kental
Warna hijau
Pemeriksaan Parameter Non Spesifik Ekstrak Herba Kemangi Tabel 4.2 Rendemen
28
* Perhitungan Kadar Air dapat dilihat pada lampiran 6. Tabel 4.4 Kadar Abu
Nama Ekstrak Berat Ekstrak (gram)
* Perhitungan kadar abu dapat dilihat pada lampiran 7. 4.1.3 Penapisan Fitokimia Ekstrak Herba Kemangi
Hasil uji penapisan fitokimia pada ekstrak herba kemangi dalam berbagai fase menunjukkan adanya senyawa alkaloid, flavonoid Hasil uji penapisan fitokimia dapat dilihat pada tabel berikut :
Tabel 4.5 Hasil Uji Penapisan Fitokimia Ekstrak Herba Kemangi Identifikasi
UIN Syarif Hidayatullah Jakarta
4.1.4 Penentuan Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Staphylococcus aureus dan Candida albicans dengan Metode Difusi Agar
Penentuan aktivitas ekstrak herba kemangi dalam fase etil asetat menunjukkan diameter daerah hambat yang lebih luas dibandingkan dengan ekstrak fase n-heksana, fase etanol 70% dan etanol 70%. Hasil pengukuran diameter daerah hambat dapat dilihat pada tabel barikut :
Tabel 4.6 Hasil uji aktivitas antimikroba ekstrak herba kemangi (Metode Difusi Agar)
30
*Keterangan : 0 mm = tidak terdapat diameter daerah hambat
Gambar hasil uji aktivitas ekstrak herba kemangi dapat dilihat pada lampiran 9.
4.1.5 Penentuan Aktivitas Antimikroba Ekstrak Herba Kemangi terhadap Candida albicans (Metode Dilusi Cair)
Penentuan nilai KHM berdasarkan atas konsentrasi minimal ekstrak yang dapat menghambat pertumbuhan bakteri. Penentuan nilai KHM dilakukan terhadap Staphylococcus aureus dan Candida albicans dengan konsentrasi 2000, 1000, 500, 250, 125 µg/mL yang dapat dilihat pada tabel berikut ini :
Tabel 4.7 Hasil uji aktivitas antimikroba ekstrak herba kemangi terhadap Candida albicans (Metode Dilusi Cair)
Mikroba uji
Konsentrasi (µg/mL)
Ekstrak NH Ekstrak EA Ekstrak E1 Ekstrak E2
*Keterangan : tanda positif (+) = aktif sebagai antijamur tanda negatif (-) = tidak aktif sebagai antijamur
UIN Syarif Hidayatullah Jakarta
4.2 Pembahasan
Ocimum spp. merupakan salah satu tanaman yang berkhasiat sebagai obat yang termasuk famili Labiatae. Sampai sekarang sudah ditemukan 7 jenis tanaman Ocimum, yaitu Ocimum gratissimum, Ocimum basillicum, Ocimum americanum L., Ocimum klimandschavicum, Ocimum minimum, Ocimum viridae L. dan Ocimum sanctum (Hadipoentyanti & Wahyuni, 2004).
Penelitian yang telah ada menunjukkan bahwa Ocimum spp. mengandung senyawa yang bersifat insektisida, larvasida, nematisida, antipiretik, fungisida, antibakteri dan antioksidan (Nurcahyanti, Dewi & Timotius, 2011; Maryati, Fauzia & Rahayu, 2007).
Bahan utama yang akan digunakan dalam penelitian ini adalah ekstrak herba kemangi (Ocimum americanum L.), sesuai dengan hasil determinasi yang dilakukan di Herbarium Bogoriense Pusat Penelitian Botani, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bogor. Herba kemangi diperoleh dari perkebunan daerah Grogol, Kecamatan Limo, Depok. Herba kemangi dipanen pada umur 2 bulan, dengan kondisi tanah gembur, tanpa pestisida dan sistem pengairan menggunakan air hujan dan air kali di dekat kebun.
Sebelum dimaserasi, herba kemangi yang telah dipanen, disortasi basah, dicuci dengan air mengalir dan dikeringkan (terlindung dari sinar matahari langsung). Selanjutnnya, herba kemangi diblender untuk memperoleh serbuk dengan tujuan untuk meningkatkan luas permukaan sampel sehingga pelarut lebih mudah masuk ke dalam sel dan menarik komponen aktif yang larut untuk keluar dari dalam sel.
Proses pembuatan ekstrak herba kemangi pada penelitian ini adalah metode ekstraksi maserasi menggunakan pelarut dengan kepolaran yang
32
UIN Syarif Hidayatullah Jakarta
Dari hasil ekstraksi diperoleh rendemen ekstrak NH 1,295%, ekstrak EA 2,355% dan ekstrak E1 5,4%. Dari hasil perhitungan tersebut dapat diketahui bahwa ekstrak fase etanol 70% mempunyai rendemen yang paling besar, karena kemungkinan kandungan senyawa polar pada ekstrak herba kemangi lebih banyak dibandingkan senyawa semi polar dan non polar. Rendemen ekstrak herba kemangi yang dimaserasi langsung dengan pelarut etanol 70% (E2) adalah 12,85%, hal ini dikarenakan senyawa yang bersifat non polar, semi polar dan polar tertarik semua oleh pelarut etanol 70%.
Selanjutnya dilakukan karakterisasi ekstrak untuk mengetahui karakteristik mutu dari ekstrak yang digunakan, karakterisasi yang dilakukan yaitu kadar air dan kadar abu.
Nilai kadar air ekstrak NH, EA, E1 dan E2 berturut-turut 22,40%, 20,70%, 18,67% dan 24,01%. Nilai ini menunjukkan kandungan air yang terdapat di dalam ekstrak. Ekstrak kering mempunyai kadar air < 5%, ekstrak kental 5-30% dan ekstrak cair > 30%. Berdasarkan rentang kadar air tersebut, ekstrak yang diperoleh termasuk ekstrak kental. Kadar air dikatakan cukup beresiko jika lebih dari 10%, diantaranya dapat mempengaruhi stabilitas ekstrak dan bentuk sediaan selanjutnya (Saifudin, Rahayu & Teruna, 2011).
Nilai kadar abu ekstrak NH, EA, E1 dan E2 berturut-turut 8,84%, 9,79%, 10,27% dan 16,82%. Nilai ini menunjukkan kandungan mineral internal dan eksternal yang berasal dari proses awal sampai terbentuknya ekstrak. Menurut Materia Medika Indonesia kadar abu yang diperbolehkan untuk ocimum sp. yaitu < 13%. Kadar abu yang diperoleh untuk ekstrak fase
n-heksana, fase etil asetat dan fase etanol 70% sesuai dengan literatur, tetapi untuk ekstrak etanol 70% melebihi kadar abu yang diperbolehkan.
Dari hasil penelitian sebelumnya diketahui kandungan kimia pada Ocimum americanum L. yaitu, minyak atsiri, karbohidrat, fitosterol, alkaloid, fenolik, tanin, lignin, pati, saponin, flavonoid, terpenoid dan antrakuinon (Dhale, Birari & Dhulgande, 2010; Sarma & Babu, 2011).
UIN Syarif Hidayatullah Jakarta
saponin, steroid, triterpenoid dan tanin. Untuk ekstrak yang dimaserasi langsung dengan etanol 70% (E2) menunjukkan hasil positif alkaloid, flavonoid, saponin, steroid, triterpenoid dan tanin.
Selanjutnya ekstrak yang diperoleh dilakukan uji aktivitas antimikroba terhadap Staphylococcus aureus (ATCC 25925) dengan metode difusi agar dan Candida albicans (ATCC 10231) dengan metode dilusi cair. Pelarut n -heksana, etil asetat dan etanol digunakan sebagai kontrol negatif. Amoksisilin
25 g/mL digunakan sebagai kontrol positif untuk uji antibakteri dan
ketokonazol 10 g/mL sebagai kontrol positif untuk antijamur.
Hasil pengujian aktivitas antimikroba ekstrak herba kemangi
menunjukkan ekstrak EA memiliki diameter hambat lebih besar dibandingkan dengan ekstrak NH, E1 dan E2 terhadap pertumbuhan bakteri
Staphylococcus aureus pada konsentrasi yang sama. Perbedaan kemampuan penghambatan tersebut diduga karena perbedaan pelarut yang digunakan, sehingga kandungan kimia dalam ekstrak juga berbeda-beda.
Berdasarkan penelitian diperoleh diameter daerah hambat ekstrak herba kemangi NH, EA, E1 dan E2 terhadap Staphylococcus aureus pada konsentrasi 4000 µg/mL secara berturut-turut, 9,5 mm, 12 mm, 9 mm, dan 10 mm. Pada konsentrasi 2000 µg/mL memiliki diameter daerah hambat 8,5 mm, 10,5 mm, 7,5 mm dan 9 mm. Pada konsentrasi 1000 µg/mL diameter daerah hambat masing-masing 8 mm, 10 mm, 6,5 mm dan 8,5 mm.
Ekstrak NH, EA, E1 dan E2 pada konsentrasi 500 µg/mL memiliki diameter daerah hambat 7,5 mm, 9 mm, 0 mm dan 8 mm. Pada konsentrasi 250 µg/mL diameter daerah hambatnya 7 mm, 8 mm, 0 mm dan 7 mm. Diameter daerah hambat pada konsentrasi 125 µg/mL secara berturut-turut 6,5 mm, 7,5 mm, 0 mm dan 6,5 mm. Ekstrak E1 pada konsentrasi 500, 250 dan 125 µg/mL sudah tidak menunjukkan aktivitas terhadap Staphylococcus aureus, hal ini diketahui dengan tidak adanya diameter daerah hambat yang terlihat disekeliling cakram kertas.
34
UIN Syarif Hidayatullah Jakarta
Staphylococcus aureus, hal ini diketahui dengan tidak adanya diameter daerah hambat yang terlihat disekeliling cakram kertas.
Selanjutnya dilakukan pengujian aktivitas antimikroba terhadap Candida albicans menggunakan metode dilusi cair dengan konsentrasi 2000, 1000, 500, 250 dan 125 µg/mL. Metode ini dilakukan karena pada metode difusi agar tidak terbentuk diameter daerah hambat Candida albicans, sehingga tidak dapat diketahui aktivitas antimikroba dari ekstrak herba kemangi terhadap Candida albicans.
Aktivitas antimikroba dapat dilihat dari kekeruhan larutan uji dan pertumbuhan mikroba saat dibiakkan pada medium agar padat. Berdasarkan penelitian yang telah dilakukan ekstrak EA menunjukkan aktivitas antimikroba yang lebih besar dibandingkan ekstrak lain, karena Candida albicans mulai menunjukkan adanya pertumbuhan pada konsentrasi 250 µg/mL, tetapi pada konsentrasi 500 µg/mL tidak terjadi pertumbuhan Candida albicans, sementara pada ekstrak NH, E1 dan E2 dapat menghambat pertumbuhan pada konsentrasi 2000 g/mL.
Aktivitas antimikroba dari ekstrak tanaman diklasifikasikan kuat jika
nilai KHM 100 µg/mL, sedang jika 100 > KHM ≤ 625 µg/mL dan lemah
nilai KHM 625 µg/mL (Kuete et al, 2011).
UIN Syarif Hidayatullah Jakarta
36 UIN Syarif Hidayatullah Jakarta
BAB 5
KESIMPULAN DAN SARAN
5.1Kesimpulan
1. Ekstrak herba kemangi fase n-heksana (NH), fase etil asetat (AE) dan fase etanol 70% (E1) serta ekstrak etanol 70% (E2) memiliki aktivitas antimikroba terhadap Staphylococcus aureus dan Candida albicans.
2. Ekstrak herba kemangi NH, EA dan E2 menunjukkan aktivitas terhadap Staphylococcus aureus sampai konsentrasi 125 g/mL dengan diameter daerah hambat berturut-turut 6,5 mm, 7,5 mm dan 6,5 mm.
3. Ekstrak herba kemangi E1 menunjukkan aktivitas sampai konsentrasi 1000 g/mL terhadap Staphylococcus aureus dengan diameter daerah hambat 6,5 mm.
4. Ekstrak herba kemangi EA menunjukkan aktivitasnya sampai konsentrasi 500 g/mL terhadap Candida albicans.
5. Ekstrak NH, E1 dan E2 hanya menunjukkan aktivitas pada konsentrasi 2000 g/mL terhadap Candida albicans.
5.2Saran
37 UIN Syarif Hidayatullah Jakarta
DAFTAR PUSTAKA
Adiguzel, Ahmet., et al. 2005. Antimicrobial Effects of Ocimum basilicum
(Labiatae) Extract. Turk J Biol, 29 : 155-160, (Online), (12 April 2012)
Akbar, Hendra Rizki. 2010. Isolasi dan Identifikasi Golongan Flavonoid Daun Dendang Gendis (Clinacanthus nutans) Berpotensi sebagai Antioksidan. Departemen Kimia : FMIPA IPB
Departemen Kesehatan Republik Indonesia. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat, Cetakan I. Jakarta
Devi, K., Devi G. K., Thirumaran, G., Arumugam, R., & Anantharaman, P. 2010. Antibacterial Activity of Selected Medicinal Plants from Parangipettai Coastal Regions Southeast Coast of India. Academic Journal of Plant Sciences, 3(3): 122-125. (Online). (11 April 2012, 08:52). http://www .idosi.org/ajps/3(3)10/5.pdf Dhale, D. A., Birari, A. R., & Dhulgande, G. S. 2010. Preliminary Screening of Antibacterial and Phytochemical Studies of Ocimum americanum Linn. Journal of Ecobiotechnology, (Online), 2/8 : 11-13, (11 April 2012) http://journal-ecobiotechnology.com
E, Amadi. J., Salami, S. O., & Eze, C.S. 2010. Antifungal Properties and Phytochemical Screening of Extracts of African Basil (Ocimum gratissimum L.). Agriculture and Biology Journal of North America, 1 (2) : 163-166., (Online): 2151-7525 (http://www.scihub.org/ABJNA, diakses pada tanggal 12 April 2012) Farnsworth, N. R. 1966. Biological and Phytochemical Screening of Plants. Journal of Pharmaceutical Sciences. 55: 225-276.
Ghosal, M., & Mandal, P. 2012. Phytochemical Screening and Antioxidant Activities of Two Selected ‘Bihi’ Fruits Used as Vegetables in Darjeeling Himalaya. International Journal of Pharmacy and Pharmaceutical Sciences. ISSN : 0975-1491. 4(2). (Online). (02 Mei 2012, 17:42). http:// www.mijppsjournal.com/ Vol4Issue2/3555.pdf.
Gupta, Shweta., Mediratta, Pramod K., Singh, Surender., Sharma, K K., & Shukla, Rimi. 2006. Antidiabetic, Antihypercholesterolaemic and Antioxidant Effect of Ocimum sanctum (Linn) seed Oil. Indian Journal of Experimental Biology, Vol. 44, pp. 300-304
Hadipoentyanti, Endang., & Wahyuni, Sri. 2008. Keragaman Selasih (Ocimum spp.) Berdasarkan Karakter Morfologi Produksi dan Mutu Herba, Jurnal Littri, (Online), Vol 14(4). hal. 141-148 (03 April 2012) http://www.perkebunan. litbang. deptan.go.id
38
UIN Syarif Hidayatullah Jakarta
Islam, M. Saiful., et al. 2011. In Vitro Antioxidant and Anti-neoplastic Activities of Ocimum sanctum Leaves in Ehrlich Ascites Carcinoma Bearing Mice. International Journal of Cancer Research, p. 1-13
J, Okonkwo. C., & U, Njoku. O. 2011. Antioxidant Effect of Ocimum gratissiumum LINN. Leaf Against Carbon Tetrachloride (CCl4)-Induced
Oxidative Stress in Wistar Albino Rats. International Journal of Current Research, Vol. 2, Issue. 1, pp. 001-007
Jawetz, E., et al. 1995. Mikrobiologi untuk Profesi Kesehatan, Edisi 16. Alih Bahasa oleh Dr. H. Tonang. Jakarta : EGC
K, Ladipo. M., F, Doherty. V., & C, Kanife U. 2010. Phytochemical Screening and Antibacterial Investigation of The Extract of Ocimum gratissimum (Scent Leaf) On Selected Enterobacteriaceae 6(2): 75-84
Kuete., et al. 2011. Antimicrobial Activities of the Methanol Extract and Compounds from Artocarpus communis (Moraceae). BMC Complementary and Alternative Medicine, 11:12. http://www.biomedcentral.com/1472-6882/11/42 Manawean, Yulia. 2010. Khasiat Daun Kemangi, hal 1-7. http://yuliamanawean. student.umm.ac.id/2010/02/11/khasiat-daun-kemangi
Martono, Budi., Hadipoentyanti, Endang., & Udarno, Laba. 2004. Plasma Nutfah Insektisida Nabati. Balai Penelitian Tanaman Rempah dan Obat Perkembangan Teknologi TRO VOL. XVI, No. 1, hal 52
Maryati., Fauzia, Ratna Sorayya., & Rahayu, Triastuti. 2007. Uji Aktivitas Antibakteri Minyak Atsiri Daun Kemangi (Ocimum basillicum L.) terhadap
Staphylococcus aureus dan Escherichia coli. Jurnal Penelitian Sains dan Teknologi, Vol. 8, No. 1 : 30-38
Meera, R., Devi, P., Kameswari, B., Madhumitha, B., & Merlin, N. J. 2009. Antioxidant and Hepatoprotective Activities of Ocimum basillicum Linn. and
Trigonella foenum-graecum Linn. against H2O2 and CCl4 Induced Hepatotoxicity
in Goat Liver. Indian Journal of Experimental Biology, Vol. 47, pp. 584-590 (Online). (11 April 2012, 13:10). http://nopr.niscair.res.in/bitstream/123456789/ 5044/1/IJEB% 2047(7)%20584-590.pdf
Nurcahyanti, Agustina. D. R., Dewi, Lusiawati., & Timotius, Kris H. 2011. Aktivitas Antioksidan dan Antibakteri Ekstrak Polar dan Non Polar Biji Selasih (Ocimum sanctum Linn). Jurnal Teknologi dan Industri Pangan, Vol. XXII, No.1 Pelczar, Michael J. and Chan, E. C. S. 1988. Dasar-Dasar Mikrobiologi 2. Terjemahan : Ratna Siri Hadioetomo., et al. Jakarta : UI Press
Pertiwi, Nursitasari. 2010. Uji Aktivitas Antibakteri dan Mekanisme Penghambatan Ekstrak Air Campuran Daun (Piper betle L.) dan Kaput Sirih (Ca(OH)2) terhadap Beberapa Bakteri Uji. Jurusan Farmasi, Fakultas Kedokteran
UIN Syarif Hidayatullah Jakarta
Pratiwi, Sylvia. T. 2008. Mikrobologi Farmasi. Jakarta : Erlangga
R, Balaji., G, Prakash., P, Sunganya Devi., & M, Aravinthan K. 2011. Antioxidant Activity of Methanol Extract of Ocimum tenuiflorum (Dried Leaf and Stem). International Journal of Pharma Research and Development, (online), 3 (1) : 20-27 (12 April 2012) www.ijprd.com
Rathi, Sanjesh G., Bhaskar, Vaidhun H., & Patel, Paras G. 2010. Antifungal Activity of Embelia Ribes Plant Extracts. International Journal on Pharmaceutical and Biological Research, Vol.1 (1) : 6-10
Saifudin, Aziz., Rahayu, Viesa., & Teruna, Hilwan Yuda. 2011. Standardisasi Bahan Obat Alam Edisi I. Yogyakarta : Graha Ilmu
Sarma, D. Sai Koteswar., & Babu, A. Venkata Suresh. 2011. Pharmacognostic and phytochemical studies of Ocimum americanum. Journal of Chemical and Pharmaceutical Research. Volume 3, Nomor 3. Hal. 337 – 347 (online). (09 April 2012, 09:06) www.jocpr.com
Siemonsma, J. S., & Piluek, K. 1994. Plant Resources of South-East Asia No. 8 Vegetable. Prosea Fundation. Bogor
Steenis, C. G. G. J. Van., et al. 1981. Flora, Untuk Sekolah di Indonesia, Cetakan Ketiga. Terjemahan oleh Ir. Moeso Surjowinoto., dkk. Jakarta : PT Pradniya Paramita
40 UIN Syarif Hidayatullah Jakarta