FRAKSINASI PROTEIN DAN KARAKTERISASI
SIFAT FUNGSIONAL TEPUNG
OKARA
ANITA MAYA SUTEDJA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Fraksinasi Protein dan Karakterisasi Sifat Fungsional Tepung Okara adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2010
Anita Maya Sutedja F251080221
ABSTRACT
ANITA MAYA SUTEDJA. Protein Fractionation and Functional Properties Characterization of Okara Flour. Supervised by: DAHRUL SYAH and SUKARNO.
Okara is the solid by product of soymilk and tofu processing with less utilization. The high water content of okara makes it deteriorated easily and therefore needs strategies to utilize it. Conversion to okara flour is one of best strategies. The utilization of okara must be based on its functional properties and characteristics of protein as the major composing components. Protein
fractionation and functional properties are used to characterize the okara flour. Osborne method has been applied in fractionation using 4 solvents, namely water, 0.5N NaCl, ethanol 70%, and 2% NaOH. Protein content of each fraction was quantified using Bradford method. The molecular weight was identified by SDS- PAGE electrophoresis. Functional properties determined were solubility, water absorption capacity, oil absorption capacity, emulsion capacity and stability, foaming capacity an stability, and gel formation. Coefficient of variant value δ
10% was used to obtain homogenized data. First attempt to fractionationate of protein from okara flour gave result that the recovery was only 8,59%. It was presumed that protein of okara flour in this research dominantly insoluble protein due to thermal processing during tofu making. Based on that fact, efforts to increase its protein recovery was developed using variables of appropriate extraction time, suspension pH and extraction temperature. Three step extraction for 3 hours combined with pH 9 and extraction temperature of 80 °C increased protein recovery to 46,23%. However, fractionation and its conditions did not affect the molecular weight of protein in fractions. Potential functional properties were the emulsion capasity and stability and also the water absorption capacity. Emulsion capacity of okara flour was 4,7867 ml oil/g sample or 18,0562 ml oil/g protein with its stability after 24 hours storage was 1,90 ml water/gram sample and the water absorption capacity was 5,9349 ml water/g sample or 22,3874 ml water/g protein.
Keyword: okara, protein, solubility, Osborne fractionation, functional properties
RINGKASAN
ANITA MAYA SUTEDJA. Fraksinasi Protein dan Karakterisasi Sifat Fungsional Tepung Okara. Dibimbing oleh: DAHRUL SYAH dan SUKARNO.
Okara merupakan hasil samping proses pengolahan susu kedelai dan tahu yang masih sedikit pemanfaatannya karena dianggap sebagai limbah yang patut dibuang. Kadar air yang cukup tinggi membuat okara mudah rusak (perishable product) sehingga perlu dikeringkan untuk memperpanjang umur simpannya.
Pengeringan dilakukan pada suhu 55°C selama 9 jam dalam cabinet dryer. Proses pengeringan tidak dilakukan pada suhu lebih dari 60 °C untuk menghindari terjadinya kerusakan pada okara basah, seperti pencoklatan maupun rusaknya protein yang terkandung dalam okara tersebut. Tepung okara yang dibuat diseragamkan ukuran pertikelnya sehingga tepung yang dihasilkan homogen. Tepung okara yang digunakan adalah yang berukuran hingga 150 , sehingga persentase rendemen terhadap okara basah menjadi 4,17 %. Persentase rendemen yang relatif kecil ini sehingga perlu upaya untuk meningkatkan persentase
rendemen ini, salah satu cara yang dapat dilakukan adalah dengan memperbaiki performansi alat penggiling yang dilakukan.
Kandungan protein yang cukup tinggi merupakan peluang bagi tepung okara untuk diaplikasikan pada produk olahan pangan. Pemilihan jenis dan pola pemanfaatan harus disesuaikan dengan karakteristik tepung okara itu sendiri. Karakterisasi yang dilakukan meliputi proksimat, kadar serat pangan, komposisi asam amino, fraksinasi protein dan sifat fungsional tepung okara.
Perbedaan ukuran partikel memberikan perbedaan yang nyata terhadap kadar air, abu, protein, lemak, dan serat pangan berdasarkan analisis uji t dengan
〈=0,05. Protein yang terdapat dalam tepung okara yang berukuran partikel δ 150
(untuk selanjutnya akan dibahas dengan istilah tepung okara) dengan kadar 26,5138% (db). Kadar serat pangan yang diperoleh dengan menggunakan AOAC metode enzimatis maupun nonenzimatis-gravimetri relatif kecil, baik pada tepung okara yang berukuran δ 150 (5,4987% dan 5,4037%) dan > 150 (7,6616% dan 7,1673%). Hal ini terkait dengan metode analisis yang digunakan bahwa metode tersebut hanya menganalisis komponen serat pangan yang tidak larut pada etanol. Kondisi ini relatif menunjukkan kadar hemiselulosa, selulosa dan lignin.
Sekitar 50% asam amino yang terkandung pada tepung okara merupakan asam amino esensial sehingga pemanfaatan tepung okara dalam produk pangan tidak hanya sebagai sumber protein tetapi juga mendukung dalam pemenuhan kebutuhan asam-asam amino esensial. Asam glutamat merupakan asam amino dengan jumlah paling banyak. Asam amino ini dapat memberikan kontribusi dalam flavor karena memberikan sensasi sensoris umami dan gurih pada produk yang dihasilkan.
Fraksinasi protein tepung okara untuk mengetahui bagaimana karakteristik kelarutan fraksi protein tepung okara. Fraksinasi protein dilakukan menggunakan metode Osborne, yaitu fraksinasi protein berdasarkan kelarutannya pada 4 jenis pelarut yang berbeda (air, larutan garam encer, etanol, dan larutan basa encer). Protein recovery yang diperoleh rendah (8,59%) karena sebagian besar protein okara tersebut berupa protein yang tak terlarut. Tahap pemanasan memungkinkan
terjadinya perubahan sifat kelarutan protein tepung okara tersebut. Adapun sifat kelarutan protein umum mendasari beberapa sifat fungsional protein sehingga dilakukan upaya untuk meningkatkan persentase protein recovery yang diperoleh.
Waktu ekstraksi mempengaruhi jumlah protein yang dapat terlarut. Hal ini tampak dengan terjadinya peningkatan protein recovery pada ekstraksi yang dilakukan menggunakan metode 2 (41,80%) dan metode 3 (38,97%) dibandingkan metode 1 (23,24%). Metode 1 menggunakan waktu eksraksi total 40 menit,
sedang Metode 2 dan 3 masing-masing selama 3 jam dan 5,5 jam. Adapun kombinasi dengan pemanasan 80 °C dapat menurunan kadar fraksi protein yang terukur bila dilakukan pada waktu ekstraksi yang lebih lama. Hal ini terkait dengan lamanya waktu ekstraksi yang memungkinkan terjadinya denaturasi protein sehingga menurunkan kelarutan protein. Dengan demikian Metode 2 dipilih sebagai metode ekstraksi yang dikombinasikan dengan pH dan suhu.
Tingkat keasaman (pH) merupakan salah faktor yang dapat mempengaruhi tingkat kelarutan protein pada suatu pelarut tertentu. Perubahan pH mengakibatkan terjadinya perubahan kadar masing-masing fraksi protein. pH 9 dipilih dengan pertimbangan tingkat kelarutan yang relatif lebih tinggi dan tidak menyebabkan perubahan pada protein. Proses ekstraksi pada pH 9 menyebabkan terjadinya perubahan konformasi muatan protein tersebut karena terjadi perubahan distribusi gugus samping polar yang bersifat kationik, anionik, dan nonionik. Hal ini sangat mempengaruhi interaksi antar protein dan antara protein dengan air. Kondisi ini menyebabkan terjadinya peningkatan protein recovery dari 11,31% menjadi 17,56%.
Suhu berperan sangat penting dalam meningkatkan kelarutan protein pada suatu pelarut. Peran panas mendukung kerja pelarut dalam mengekstraksi protein. Energi yang cukup besar yang diberikan oleh panas pada pelarut memberikan kemudahan pelarut untuk berpenetrasi ke dalam matriks bahan (tepung okara). Kondisi ini membantu mempercepat dan mempermudah terjadinya interaksi protein dengan pelarut. Suhu 80°C mampu meningkatkan kadar fraksi albumin, globulin, prolamin, dan glutelin, baik pada Metode 1 maupun Metode 2, sehingga total protein recovery yang diperoleh juga meningkat, yaitu dari 8,59% menjadi 23,24% dan 11,31% menjadi 41,80%.
Kombinasi antara pH dan suhu memberikan interaksi sinergis sehingga pengaruh terhadap peningkatan protein recovery lebih besar. Protein recovery pada perlakuan kombinasi pH 9 dan suhu 80°C (46,23%) lebih besar daripada perlakuan hanya pH 9 (17,56%) maupun suhu 80°C (41,80%) yang diamati pada metode yang sama. Kombinasi pH 9 dan suhu 80°C memberikan interaksi sinergis dalam meningkatkan kadar protein fraksi albumin, globulin, dan glutelin. Adapun fraksinasi metode Osborne ini relatif tidak mempengaruhi variasi berat molekul protein pada setiap fraksi protein.
Kelarutan protein merupakan salah satu karakteristik protein yang sangat penting. Kelarutan protein tepung okara dilakukan pada kisaran pH 2 hingga 12 dan diperoleh bahwa titik isoelektrik berada pada kisaran pH 4. Kelarutan protein tepung okara meningkat dengan semakin menjauhi titik isoelektriknya.
Karakteristik protein yang berada pada serat bagian non-egg-box memungkinkan sebagian protein lebih sulit untuk terlarut pada air, meskipun telah dilakukan perubahan pH yang menjauhi titk isoelektriknya (pI). Pemanasan yang dialami oleh okara selama pembuatan susu kedelai akan mengubah konformasi protein
yang ada sehingga mengubah sifat kelarutannya. Adanya komponen
makromolekul lain, seperti karbohidrat dan lemak juga mempengaruhi kelarutan protein tersebut.
Kelarutan protein yang rendah mempengaruhi sifat fungsional yang lain. Daya serap air (5,9349 ml air/g sampel atau sebesar 22,3874 ml air/g protein) dan daya serap minyak (2,7733 ml minyak/g sampel atau sebesar 10,4613 ml
minyak/g protein) tepung okara yang relatif rendah. Kondisi tersebut juga menyebabkan hilangnya kemampuan dalam membentuk foam dan gel. Kapasitas emulsi diukur dengan mengetahui jumlah maksimal minyak yang dapat digunakan oleh tepung okara untuk membentuk emulsi yang stabil. Kapasitas emulsi tepung okara adalah sebesar 4,7867 ml minyak/g sampel atau sebesar 18,0562 ml
minyak/g protein. Kestabilan emulsi setelah 24 jam penyimpanan sebesar 1,90 ml air/gram sampel dan dapat dikatakan cukup baik.
Serat pangan dalam tepung okara cukup mempengaruhi sifat fungsional tepung okara tersebut. Serat mampu membantu dalam pengikatan air, serta pembentukan dan kestabilan emulsi tepung okara. Serat juga berperan negatif pada sifat pembentukan foam dan gel tepung okara karena kecenderungnya lebih cepat dan lebih mudah menyerap air daripada protein. Serat pangan yang
mempengaruhi proses emulsifikasi sebenarnya tidak hanya berupa komponen polisakarida yang tidak dapat larut air. Komponen-komponen polisakarida terlarut juga mempengaruhi karakteristik emulsi tepung okara. Bagian hidrofilik
komponen polisakarida yang dapat larut juga berperan dalam mendukung kestabilan emulsi yang terbentuk karena dapat mencegah terjadinya agregasi dengan adanya gaya tolak menolak yang cukup kuat.
Produk pangan yang sesuai untuk dilakukan substitusi maupun penambahan tepung okara di dalamnya adalah produk pangan yang membutuhkan sifat
emulsifikasi sebagai prinsip dasar pembuatan produk tersebut. Hal ini terkait erat dengan sifat fungsional tepung okara yang mampu membuat emulsi yang baik dan kestabilan emulsifikasinya yang cukup baik. Contoh produk pangan yang memerlukan emulsifikasi yang stabil adalah produk restructured meat. Kemampuan tepung okara yang baik dalam membentuk emulsi serta
kestabilannya juga cukup tinggi sangat mendukung karakteristik produk yang diharapkan.
Nuget ayam merupakan salah satu produk restructured meat. Substitusi tepung okara sebanyak 20% memberikan kenampakan produk serupa, emulsi yang dihasilkan lebih baik daripada kontrol tetapi berat jenis produk juga menurun dan teksturnya berubah. Adanya substitusi tersebut juga menyebabkan kekerasan dan kelengketan nuget menurun sedangkan kekenyalannya meningkat.
Kata kunci: tepung okara, kelarutan, fraksinasi Osborne, sifat fungsional
♥ Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penetilian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya
tulis dalam bentuk apa pun tanpa izin IPB
FRAKSINASI PROTEIN DAN KARAKTERISASI
SIFAT FUNGSIONAL TEPUNG
OKARA
ANITA MAYA SUTEDJA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Penguji Luar Komisi pada Ujian Tesis: Dr. Ir. Dede R. Adawiyah, M.Si.
Judul Tesis : Fraksinasi Protein dan Karakterisasi Sifat Fungsional Tepung
Okara
Nama : Anita Maya Sutedja NIM : F251080221
Disetujui Komisi Pembimbing
Ketua
Dr. Ir. Dahrul Syah, M.Sc.
Ketua Program Studi Ilmu Pangan
Anggota Dr. Ir. Sukarno, M.Sc.
Diketahui
Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc.
Tanggal Ujian:
Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Tanggal Lulus: 18 Agustus 2010
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang maha Esa atas berkat, rahmat, dan penertaanNya sehingga penulis dapat menyelesaikan makalah Tesis yang berjudul “Fraksinasi Protein dan Karakterisasi Sifat Fungsional Tepung Okara” dengan baik.
Penulis pada kesempatan ini ingin menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Dahrul Syah, MSc. selaku Ketua Komisi Pembimbing dan Dr. Ir. Sukarno, MSc. selaku Anggota Komisi Pembimbing yang telah banyak meluangkan waktu, perhatian, dan bimbingan dalam penulisan makalah tesis ini.
2. Ibu Dr. Ir. Dede R. Adawiyah, M.Si. selaku dosen penguji luar komisi yang telah memberikan saran dan masukkannya.
3. Ibu Dr. Ir. Ratih Dewanti-Haryadi, M.Sc. selaku Ketua Mayor Ilmu Pangan beserta seluruh staf pengajar Program Mayor Ilmu Pangan atas dukungan dan bantuannya.
4. Orang tua, saudara, sahabat, teman, dan pihak lain yang tidak dapat disebutkan satu per satu yang telah banyak membantu dan memberikan motivasi kepada penulis dalam menyelesaikan penulisan makalah ini. Penulis menyadari bahwa masih ada banyak kekurangan pada makalah ini, oleh karena itu, sangat diharapkan adanya kritik dan saran untuk membantu penyempurnaannya.
Akhir kata penulis berharap agar makalah ini dapat bermanfaat bagi semua pihak yang membacanya.
Bogor, Agustus 2010
Anita Maya Sutedja
RIWAYAT HIDUP
Penulis dilahirkan di Surabaya pada tanggal 26 Juli 1980 dari pasangan ayah Ir. Athanasius Tedjahandayana dan ibu Dra. Lipawati Tantono, Apt. Penulis merupakan putri pertama dari dua bersaudara.
Tahun 1998 penulis lulus dari SMAK Santa Maria Surabaya dan pada tahun yang sama melanjutkan ke pendidikan tinggi. Penulis memilih pendidikan tinggi dengan Jurusan Teknologi Pangan, Fakultas Teknologi Pertanian, Universitas Katolik Widya Mandala Surabaya dan lulus pada Februari 2003. Penulis bekerja sebagai Staf Pengajar di Fakultas Teknologi Pertanian, Universitas Katolik Widya Mandala Surabaya sejak Agustus 2003.
Penulis selama masa kerjanya menjadi anggota Perhimpunan Ahli
Teknologi Pangan Indonesia (PATPI). Karya ilmiah berjudul Pengaruh Substitusi Tepung Gandum dengan Okara dan Tapioka terhadap Sifat Fungsional Adonan dan Roti Tawar telah diterbitkan pada Jurnal Teknologi Pangan dan Gizi Volume 5 Nomor 2 pada bulan Oktober 2004. Artikel dengan judul Efek Metode
Blanching Uap dalam Pembuatan Biskuit Tepung Tempe terhadap Penerimaan Konsumen dan Potensi Minyak Atsiri Daun Beluntas (Pluchea indica Less) sebagai Antioksidan Alami telah disajikan pada Seminar Nasional Pangan di Yogyakarta pada tahun 2008. Artikel lain berjudul Children Sensories Acceptance to Rice Cake Enriched with Defatted Rice Bran telah disajikan pada International Conference on Food Science and Technology di Semarang pada tahun 2008.
DAFTAR ISI 1.1. Latar Belakang 1.2. Rumusan Masalah 1.3. Tujuan Penelitian 1.4. Manfaat Penelitian
2. TINJAUAN PUSTAKA 2.1. Tinjauan Umum Okara
2.2. Komposisi Zat Gizi Okara
2.3. Serat Pangan Okara
2.4. Sifat Fungsional Protein 2.4.1. Kelarutan (Solubility)
2.4.2. Daya Serap Air (Water Absorption Capacity/WAC) 2.4.3. Daya Serap Minyak (Oil Absorption Capacity/OAC) 2.4.4. Kapasitas dan Stabilitas Emulsi (Emulsion Capasity/EC
and Emylsion Stability/ES)
2.4.5. Kapasitas dan Stabilitas Buih (Foam Capacity/FC and Foam Stability/FS)
2.4.6. Pembentukan Gel (Gel Formation) 2.5. Fraksinasi Osborne
2.5.1. Pengaruh pH terhadap Kelarutan Protein 2.5.2. Pengaruh suhu terhadap Kelarutan Protein 3. BAHAN DAN METODE
3.1. Bahan dan Peralatan
3.2. Waktu dan Tempat Penelitian 3.3. Metodologi
3.3.1. Pelaksanaan Penelitian 3.3.2. Prosedur Analisis
xv
Analisis kadar protein metode bradford
Analisis sodium dodecyl sulfate – polyacrilamide gel (SDS-PAGE) electrophoresis
Kadar air Kadar abu
Kadar lemak metode soxhlet
Kadar protein metode mikro kjeldhal
3.3.2.8.
Kadar serat pangan (dietary fiber) (tidak larut dan serat larut) metode enzimatis
Kadar total serat pangan (total dietary fiber) metode nonenzimatis-gravimetri
Analisis acid detergen fiber (ADF) Analisis neutral detergen fiber (NDF) Analisis lignin
Analisis asam amino menggunakan derivat o- pthalaldehide (OPA)
Analisis asam amino menggunakan derivat phenylisothiocyanat (PITC)
Kelarutan (solubility)
Daya serap air (water absorption capasity/WAC) uji sensoris
Daya serap minyak (oil absorption capasity/OAC) Pembentukan gel (gel formation)
Kapasitas dan stabilitas buih (foaming capacity/FC and foaming stability/FS)
Kapasitas dan stabilitas emulsi (emulsion capacity/EC and emulsion stability/ES)
Tekstur
4.1. Pembuatan Tepung Okara
4.2. Proksimat Tepung Okara
4.3. Komposisi Asam Amino
4.4. Analisis Fraksinasi Protein Berdasarkan Kelarutan (Metode
Osborne)
4.4.1. Pengaruh Waktu Ekstraksi terhadap Kadar Protein Fraksi dan Protein Recovery
4.4.2. Pengaruh pH dan Suhu Ekstraksi terhadap Kadar Protein Fraksi dan Protein Recovery
4.4.3. Pengaruh Perlakuan terhadap Kadar Fraksi Albumin 4.4.4. Pengaruh Perlakuan terhadap Kadar Fraksi Globulin 4.4.5. Pengaruh Perlakuan terhadap Kadar Fraksi Prolamin 4.4.6. Pengaruh Perlakuan terhadap Kadar Fraksi Glutelin 4.4.7. Pengaruh Perlakuan terhadap Total Fraksi dan Protein
Recovery
4.5. Pengaruh Fraksi Protein terhadap Berat Molekul Protein Fraksi
4.6. Komposisi Asam Amino Fraksi Protein Tepung Okara
4.7. Analisis Sifat Fungsional Protein Okara
4.7.1. Kelarutan (Solubility)
4.7.2. Daya Serap Air (Water Absorption Capacity/WAC) dan Daya Serap Minyak (Oil Absorption Capacity/OAC) 4.7.3. Pembentukan Gel (Gel Forming)
4.7.4. Kapasitas dan Stabilitas Buih (Foam Capacity/FC and Foam Stability/FS)
4.7.5. Kapasitas dan stabilitas Emulsi (Emulsion Capacity/EC and Emulsion Stability/ES)
4.8. Potensi Aplikasi pada Beberapa Produk Pangan
5. SIMPULAN DAN SARAN 5.1. Simpulan
5.2. Saran
DAFTAR PUSTAKA
LAMPIRAN
81 81 84 90 90 90 92 99
DAFTAR TABEL
Halaman
1 Jumlah dan tingkat produksi industri kecil menengah tahu tempe dan tingkat produksi industri besar berbasis kedelai
2 Komposisi zat gizi tiap 100 gram okara basah 3 Komposisi okara kering
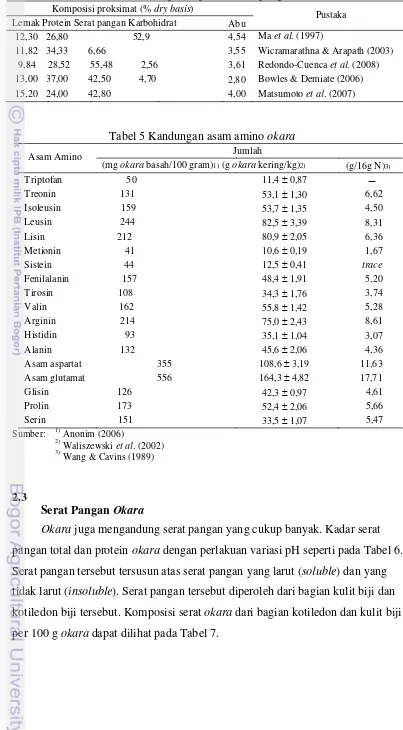
4 Komposisi proksimat tepung okara 5 Kandungan asam amino okara
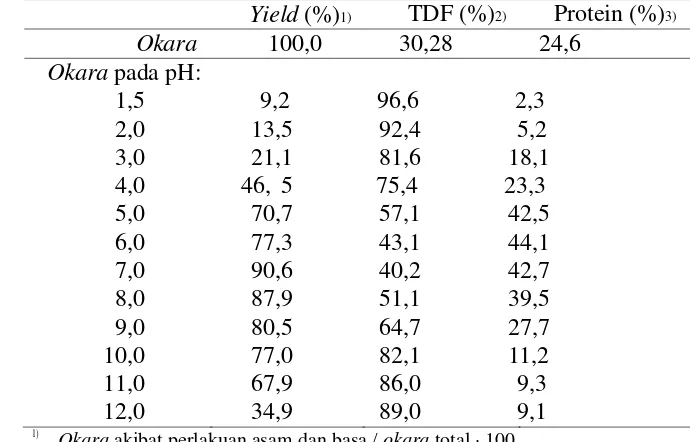
6 Kadar serat pangan total dan kadar protein okara yang diberi perlakuan kimiawi
7 Komposisi serat okara dari bagian kotiledon dan kulit biji per 100 g okara
8 Komposisi gula pada tepung kedelai dan water-unextractable solid 9 Komposisi serat tak larut, serat larut, dan total serat pada biji kedelai
dan okara
10 Kapasitas hidrasi residu asam amino
11 Pengaruh waktu pemanasan terhadap kelarutan protein 12 Neraca massa tahap pengeringan okara
13 Neraca massa tahap penggilingan dan pengayakan tepung okara 14 Rendemen pembuatan tepung okara
15 Komposisi proksimat tepung okara dan tepung kedelai
16 Kadar serat pangan tepung okara ukuran δ 150 menggunakan metode Van Soest
17 Kadar fraksi protein dan protein recovery pada berbagai perlakuan
1
5 5 6 6 7
7
8 9
12 24 44 44 45 48 51
58 18
19
Nilai pK dan kondisi muatan gugus samping asam amino
Berat jenis nuget kukus dan nuget goreng dengan perlakuan kontrol maupun yang disubstitusi 20% tepung okara
20 Profil tekstur produk nuget kukus dan nuget goreng dengan 87 perlakuan kontrol dan substitusi 20% tepung okara
DAFTAR GAMBAR
Model struktur komponen serat pada okara
Aspek dan hubungan antar sifat-sifat fungsional protein pada sistem pangan
Hipotesis tahapan proses pelarutan Tahapan hidrasi protein
Skematis lapisan hidrasi protein
Ikatan hidrogen antara molekul air dengan protein Pembentukan protein menstabilkan emulsi
Usulan model peran garam terhadap protein well-folded (a-c) dan protein tak terlarut (d-f)
9
9 Skematis folded protein
10 Proses pembuatan tepung okara
22 26 11 Skema pengeringan menggunakan radiasi sinar matahari dengan efek
rumah kaca 46
12 Kenampakan tepung okara yang dikeringkan menggunakan sinar
matahari 46
13 14 15 16
Reaksi o-phthalaldehyde (OPA) dengan asam amino primer Reaksi Phenylisothiosyanat (PITC) dengan asam amino Diagram komposisi asam amino tepung okara (%)
Pengaruh waktu ekstraksi terhadap kadar fraksi protein tepung okara 52 53 53 60 17 Pengaruh pH dan suhu terhadap protein terekstrak dari okara 61 18 Pengaruh pH terhadap kadar fraksi protein tepung okara 61 19 Pengaruh suhu terhadap kadar fraksi protein tepung okara
20
Pengaruh pH dan suhu terhadap kadar fraksi protein tepung okara Persentase komposisi fraksi protein tepung okara pada berbagai perlakuan
Matriks pengelompokan perlakuan berdasarkan hasil analisis uji pembeda Duncan
Pengaruh variasi perlakuan terhadap kadar fraksi albumin protein tepung okara
Pengaruh variasi perlakuan terhadap kadar fraksi globulin protein tepung okara
Pengaruh variasi perlakuan terhadap kadar fraksi prolamin protein tepung okara
Pengaruh variasi perlakuan terhadap kadar fraksi glutelin protein tepung okara
Pengaruh variasi perlakuan terhadap kadar total fraksi protein dan protein recovery tepung okara
63
28 Variasi berat molekul fraksi protein tepung okara 73 29
Komposisi asam amino fraksi protein tepung okara (%) Pengaruh pH terhadap kelarutan protein tepung okara Pengaruh pH terhadap kelarutan protein produk kedelai Pengaruh konsentrasi tepung okara terhadap pembentukan gel Pembentukan foam dan perubahan yang terjadi selama 30 menit pengamatan
Kenampakan minyak yang terpisah (a) dan air (b) pada emulsi Pola kestabilan emulsi tepung okara
Produk nuget kukus dan nuget goreng dengan perlakuan kontrol dan
74 yang disubstitusi 20% tepung okara
DAFTAR LAMPIRAN
Halaman
1 Reagensia untuk Analisis
2 Neraca Massa Pembuatan Tepung Okara
3 Perkiraan Kebutuhan Energi untuk Penggilingan Tepung Okara
100 103 105 4 Pengaruh Perbedaan Ukuran Partikel Tepung Okara terhadap Hasil 107
Analisis Proksimat Menggunakan Uji t
5 Perhitungan Protein Recovery Fraksinasi Metode Osborne 109 6 Perhitungan Jumlah NaOH yang Terkandung dalam Solven untuk 119
Ekstraksi dengan Peningkatan pH 9
7 Analisis Varians (ANOVA) Pengaruh Variasi Perlakuan terhadap 120 Kadar Fraksi dan Kadar Total Fraksi Protein Tepung Okara
8 Komposisi Asam Amino Tepung Okara dan Fraksi Protein Okara 123 9 Perhitungan Muatan Protein pada Variasi pH Suspensi Tepung Okara 124 10 Perhitungan Kadar Total Asam Amino Polar dan Nonpolar 125 11 Profil Tekstur Nuget Ayam Kukus dan Nuget Ayam Goreng dengan 126
BAB I PENDAHULUAN
1.1 Latar Belakang
Okara merupakan hasil samping proses pengolahan susu kedelai dan tahu yang masih sedikit pemanfaatannya karena pada umumnya dibuang begitu saja. Kadar air yang cukup tinggi membuat okara mudah rusak (perishable product) sehingga upaya memanfaatkannya harus diawali dengan memperpanjang umur simpannya. Cara yang paling memungkinkan untuk dilakukan adalah dengan mengeringkan dan menggiling menjadi tepung okara. Tepung okara memiliki kandungan serat pangan dan protein tidak larut terekstrak yang cukup tinggi. Beberapa penelitian menunjukkan potensi ini mengingat masih tingginya kadar protein (22,5 – 28,4 g/100 g) serta didukung kadar serat pangan yang memadai (O’Toole 1999; Sutedja 2004). Hal ini membuat tepung okara potensial sebagai sumber protein dan serat pangan dan memungkinkannya untuk diaplikasikan dalam berbagai produk olahan pangan.
Penggunaan kedelai untuk membuat tahu dan tempe oleh industri kecil, menengah, dan produk olahan dari kedelai oleh industri besar dalam jumlah yang cukup besar setiap tahunnya sangat mendukung dalam usaha pemanfaatan okara. Tingkat produksi tahu tempe industri kecil menengah dan tingkat produksi
industri besar berbasis kedelai tahun 2004 hingga 2007 ditunjukkan pada Tabel 1. Tabel 1 Jumlah dan tingkat produksi industri kecil menengah tahu tempe dan
tingkat produksi industri besar berbasis kedelai
Tahun
Jumlah Industri Kecil Menengah
Tahu Tempe (unit usaha)
Tingkat Produksi Industri Kecil Menengah Tahu Tempe
(ton)
Tingkat Produksi Industri Besar Berbasis
Kedelai (ton) 2004 84.100 2.390.000 117.311
2005 84.500 2.560.000 117.605 2006 84.900 2.670.000 117.900
2007 84.900 2.170.000 (data tidak diketahui)
Sumber: Antara (2008)
2
diperkirakan jumlah okara yang dihasilkan sekitar 2.170.000 kg. Jumlah tersebut menunjukkan bahwa tersedia okara dengan jumlah yang cukup dan potensial untuk dikembangkan dan dimanfaatkan lebih lanjut. Industri kecil menengah tahu umumnya terkumpul dalam suatu sentra. Adanya industri tahu yang
terkelompokkan dalam sentra-sentra produsen tersebut membantu dalam memudahkan pengumpulan okara tersebut.
Okara telah dimanfaatkan pada berbagai produk, terutama bakery products, seperti pizza, biskuit, dan roti tawar. Roti tawar merupakan salah satu jenis bakery products yang umum dan banyak dikonsumsi karena sifatnya yang praktis dan mudah divariasi dalam mengkonsumsinya. Beberapa peneliti telah melakukan penelitian yang menggunakan berbagai macam serat pangan dan ditemukan masalah utama, yaitu adanya penambahan serat pangan akan mereduksi volume loaf roti dan mengubah tekstur roti tersebut (Pomeranz et al. 1977; Chung et al. 1981, diacu dalam Ryan et al. 2002; Gomez et al. 2003; Sutedja 2004).
Pemanfaatan tepung okara sebagai salah satu komponen pangan yang memiliki kandungan protein dan serat pangan yang tinggi tidak dapat dilakukan dengan mudah. Pemilihan jenis dan pola pemanfaatan harus disesuaikan dengan karakteristik tepung okara itu sendiri.
Informasi mengenai karakteristik protein, terutama fraksi protein dan sifat fungsional tepung okara merupakan hal yang sangat penting dan mendasari aplikasinya pada berbagai produk pangan. Fraksinasi protein dilakukan
menggunakan metode Osborne, yaitu dilakukan berdasarkan kelarutannya pada berbagai pelarut. Fraksinasi ini dapat memberikan informasi jenis protein yang dominan dalam tepung okara tersebut. Beberapa karakteristik fungsional protein seperti: kelarutan protein, daya serap air, kapasitas dan stabilitas emulsi, daya serap minyak, daya serap air, serta kapasitas dan stabilitas foam, pada sisi yang lain, diperlukan guna mendukung mendukung dalam pemanfaatannya dengan lebih optimal.
1.2 Rumusan Masalah
3
tersebut sebagian besar berupa protein yang tak terlarut sehingga protein recovery yang diperoleh rendah. Sifat kelarutan protein umum mendasari beberapa sifat fungsional protein sehingga diperlukan upaya untuk meningkatkan persentase protein recovery yang diperoleh. Bagaimana pola kelarutan fraksi protein tepung okara dan perubahan pola yang terjadi akibat upaya peningkatan protein recovery perlu dianalisis sehingga diketahui karakteristik kelarutan protein okara tersebut.
Karakteristik sifat fungsional merupakan sifat-sifat yang diperlukan sebagai dasar untuk dapat mengaplikasikan suatu protein dalam pengolahan pangan. Bagaimana karakteristik sifat fungsional tepung okara yang diperoleh juga
diperlukan guna mendukung aplikasi tepung okara tersebut dengan lebih baik dan optimal. Sifat fungsional yang dominan akan menjadi dasar utama dalam
pemilihan produk pangan yang sesuai.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menguraikan pembuatan tepung okara dari okara basah dari pabrik tahu di Bogor.
2. Menguraikan karakteristik kelarutan fraksi protein okara dan upaya untuk meningkatkan persentase protein recovery yang diperoleh.
3. Menguraikan karakteristik sifat fungsional tepung okara yang diperoleh. 4. Menjajaki aplikasi tepung okara pada produk suatu pangan berdasarkan
sifat fungsionalnya yang menonjol.
1.4 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Umum Okara
Kata “okara” berasal dari bahasa Jepang. Huruf “o” yang terletak sebelum kata “kara” merupakan sebutan awalan dengan kehormatan untuk makanan di Jepang yang paling mudah untuk dikonsumsi. Kata “kara” berarti kulit atau kulit ari. Dengan demikian berdasarkan literatur, maka okara dapat diartikan sebagai kulit yang berharga (honorable shell) (Liu, 1997).
Okara adalah hasil samping dari pengolahan susu kedelai dan tahu yang mengandung protein dan serat cukup tinggi sehingga berpotensi untuk
meningkatkan kandungan gizi suatu produk pangan (Anonim 2005a). Okara dikenal juga sebagai residu dari penggilingan kedelai yang telah diekstraksi dan fraksi yang terlarut dalam air digunakan untuk memproduksi susu kedelai dan tahu (Noguchi 1987 diacu dalam O’Toole 1999). Beberapa istilah lain yang digunakan adalah tofukasu, soy pulp dan dou zha (Cina), bejee (Korea) (Liu 1997).
Okara telah banyak dimanfaatkan sebagai campuran bahan pangan. Masalah utama yang timbul pada pemanfaatan okara adalah kadar airnya yang cukup tinggi yaitu sekitar 80% sehingga perlu penyimpanan suhu dingin (refrigerated) atau dilakukan pengeringan secepat mungkin untuk menghindari kerusakan (Anonim 2005a). Salah satu usaha yang potensial untuk dilakukan adalah dengan melakukan pengeringan terhadap okara dan menghasilkan tepung okara.
5
2.2 Komposisi Zat Gizi Okara
Okara masih mengandung senyawa-senyawa nutrisi dalam jumlah cukup besar. Komposisi zat gizi okara basah dan kering seperti pada Tabel 2 dan 3. Tepung okara memiliki variasi komposisi pada beberapa penelitian sebelumnya. Komposisi zat gizi tepung okara dapat dilihat pada Tabel 4. Okara hanya
mengandung 17% dari protein kedelai, namun jumlah protein yang dapat diserap oleh tubuh kita hampir sama. Kualitas protein okara lebih tinggi dibandingkan produk kedelai lain seperti tahu, susu kedelai, dan whey kedelai (Prescott 2005). Kandungan asam amino okara dapat dilihat pada Tabel 5. Okara juga
mengandung isoflavon serta merupakan satu-satunya bahan nabati sumber ion besi bivalen yang mudah diserap tubuh (Anonim 2005b).
Tabel 2 Komposisi zat gizi tiap 100 gram okara basah Komponen Jumlah
Sumber: USDA human nutrition information service agriculture handbook
no. 8-16 diacu dalam Balhas (2003)
Sumber: Anonim (2006)
Waliszewski et al. (2002)
Wang & Cavins (1989)
6
Tabel 4 Komposisi proksimat tepung okara
Komposisi proksimat (% dry basis)
Lemak Protein Serat pangan Karbohidrat 12,30 26,80 52,9
Wicramarathna & Arapath (2003) Redondo-Cuenca et al. (2008)
Bowles & Demiate (2006) Matsumoto et al. (2007)
Tabel 5 Kandungan asam amino okara
Asam Amino Jumlah
(mg okara basah/100 gram)1) (g okara kering/kg)2) (g/16g N)3)
Serat Pangan Okara
42,3 ± 0,97
7
Tabel 6 Kadar serat pangan total dan kadar protein okara yang diberi perlakuan kimiawi
Protein / okara dengan perlakuan dengan reagen kimia, diukur menggunakan metode mikro kjedahl (koefisien N=5,71) ⋅ 100
Nilai merupakan rata-rata dengan n=3 Sumber: Hirotsugu dan Tetsuo (2000)
Kandungan hemiselulosa pada okara dapat difraksinasi berdasarkan kelarutan dalam air panas, kelarutan secara normal, dan kelarutan dalam basa dengan rasio 5:19:4 (O’Toole 1999). Kadar selulosa pada kulit biji lebih tinggi daripada kotiledon. Menurut Hisamatsu et al. (1995) diacu dalam O’Toole (1999), okara yang diekstraksi menggunakan senyawa alkali (24% KOH) menghasilkan arabinogalaktan sebagai komponen utama hemiselulosa.
Tabel 7 Komposisi serat okara dari bagian kotiledon dan kulit biji per 100 g okara Sumber: Takahashi (1968) diacu dalam O’Toole (1999)
8
jumlah yang mirip dengan tepung kedelai. Asam uronat pada WUS merupakan 90% dari jumlahnya pada tepung kedelai. Adapun Aspinall et al. (1967a, b) diacu dalam Yamaguchi et al. (1996) menyatakan bahwa asam uronat yang terdapat pada kotiledon tepung kedelai umumnya berupa asam galakturonat. Hal tersebut menunjukkan bahwa adanya pektin yang terdapat pada okara dan strukturnya lebih kompleks daripada dinding sel tanaman lainnya (Huisman et al. 1998; Aparicio et al. 2010). Komposisi serat tak larut, serat larut, dan total serat pada biji kedelai dan okara dapat dilihat pada Tabel 9.
Tabel 8 Komposisi gula pada tepung kedelai dan water-unextractable solid
Fraksi
Rha Fuc
Komposisi Gula (mol%)
Ara Xyl Man Gal Glc
Kandungan
Uronic karbohidrata acids
b dinyatakan sebagai % w/w. setelah pati dihilangkan secara enzimatis.
Sumber: Huisman et al. (1998)
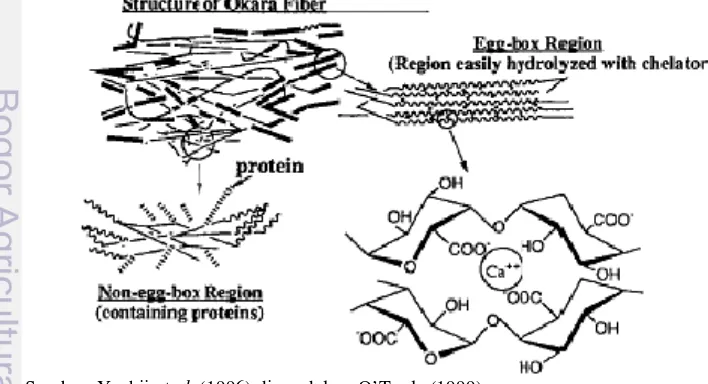
Okara memiliki ikatan silang polimer galakturonat di antara gugus karboksilnya, disebut dengan bagian consisted “egg-box” dan bagian non-egg- box terdapat protein hidrofobik. Struktur serat okara seperti pada Gambar 1. Apabila tidak terdapat senyawa pengkelat (chelator), maka okara akan terhidrolisis melalui mekanisme degragasi permukaan. Berdasarkan analisa pembentukan polisakarida larut air, tampak bahwa bagian egg-box pada okara mudah terdegradasi dengan adanya senyawa pengkelat, karena senyawa pengkelat tersebut melepaskan Ca2+ dan menghilangkan struktur okara (O’Toole 1999).
2.4 Sifat Fungsional Protein
at ur
(m
at
CP
Nilai gula netral menunjjukkan NCP netral setelah dikalikan denngan faktor 0,888 Nilai asam uronat menuunjukkan NCPP asam setelahh dikalikan denngan faktor 0,,91 m
Nilai glukkosa menunjukkkan CP setelaah dikalikan dengan faktor 0,89 d NSP meruupakan jumlahh seluruh kom mponen (NCP + CP)
AC
at
9
selama peengolahan pangan dan tidak dapa dengan mudah diuku menggunnakan pengujian fisis dan kiimia tunggaal.
Tabeel 9 Kompoosisi serat ttak larut, seerat larut, daan total seraat pada biji kedelaai dan okaraa
Biji keedelai Okkara
Komponnen mg/100 g baahan kering) Serat tak Serrat Tootal
((mg/100 g bbahan keringg) Sera tak Seerat Tootal laruut larrut serrat larrut laarut seerat Ramnosa
Data ditentuukan menggunnakan GC berddasarkan prosedur Englyst setelah enzymmatic digestion
seperti pada metode AOA gravimetri
NCP = Non cellulosic pollysaccharides, CP = Celluloosic polysacchharides, NSP = Non-starch polysaccharrides.
1 2
3
4
Sumber: Apparicio et al. (22010)
Sumber: Yoshii et al. (1996) diacu dalam O’Toole (1999)
M ,A
10
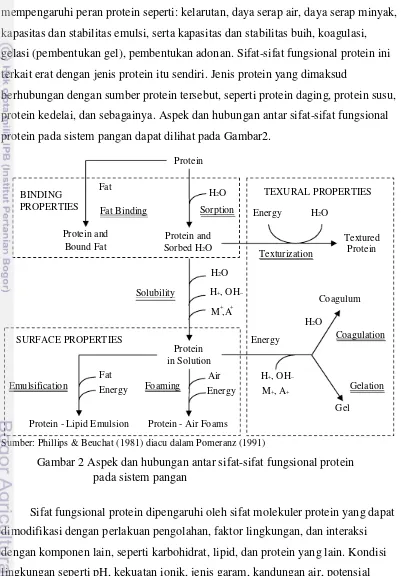
Sifat fungsional protein dapat dikelompokkan menjadi tiga kelompok utama, yaitu: (1) sifat hidrasi, seperti kelarutan atau kemampuan menahan air; (2) sifat permukaan, seperti emulsifikasi dan pembentukan buih; dan (3) interaksi antar protein, seperti gelasi (Smith 2003). Berbagai sifat fungsional protein yang mempengaruhi peran protein seperti: kelarutan, daya serap air, daya serap minyak, kapasitas dan stabilitas emulsi, serta kapasitas dan stabilitas buih, koagulasi, gelasi (pembentukan gel), pembentukan adonan. Sifat-sifat fungsional protein ini terkait erat dengan jenis protein itu sendiri. Jenis protein yang dimaksud
berhubungan dengan sumber protein tersebut, seperti protein daging, protein susu, protein kedelai, dan sebagainya. Aspek dan hubungan antar sifat-sifat fungsional protein pada sistem pangan dapat dilihat pada Gambar2.
Protein
BINDING Fat H2O TEXURAL PROPERTIES
PROPERTIES Fat Binding
Energy
Sorption H2O
Protein and
Bound Fat Sorbed HProtein and 2O
Texturization
Textured Protein
H2O
H+, OH– Solubility
+ + Coagulum
H2O SURFACE PROPERTIES
Protein Energy
in Solution
Coagulation
Fat
Emulsification Energy Foaming Energy Air HM+, OH– +, A+
Gel
Gelation
Protein - Lipid Emulsion Protein - Air Foams
Sumber: Phillips & Beuchat (1981) diacu dalam Pomeranz (1991)
Gambar 2 Aspek dan hubungan antar sifat-sifat fungsional protein pada sistem pangan
11
oksidasi-reduksi, dapat mempengaruhi sifat fungsional protein dalam suatu pangan. Perlakuan pengolahan yang dimaksud seperti pemanasan, pengeringan, penekanan, dan pembekuan. Sifat fungsional protein umumnya berubah selama penyimpanan terkait dengan adanya reaksi fisis dan kimia yang terjadi, seperti: agregasi protein, denaturasi, aktivitas enzim, oksidasi lipid, dan kerusakan oleh kristal es, serta faktor lainnya (Smith 2003).
2.4.1 Kelarutan (Solubility)
Sifat fungsional protein umumnya dipengaruhi oleh kelarutan protein. Protein tak terlarut memiliki keterbatasan penggunaan dalam pangan. Kelarutan protein merupakan kesetimbangan antara interaksi antar protein dengan interaksi antara protein dan solven. Interaksi utama yang mempengaruhi kelarutan adalah interaksi hidrofobik dan ionik. Interaksi hidrofobik menyebabkan interaksi antar protein sehingga menurunkan kelarutan sedangkan interaksi ionik menyebabkan interaksi antara protein dengan air sehingga meningkatkan kelarutan. Residu ionik menyebabkan dua gaya tolak menolak antar molekul protein dalam larutan, yaitu gaya repulsif elektrostatik antar protein yang memberikan muatan positif atau negatif pada pH selain titik isoelektriknya dan terkait lapisan hidrasi di sekeliling gugus ionik.
Proses pelarutan mempertimbangkan perubahan energi interaksi intermolekuler yang menyertai pencampuran antara solut (fase terlarut) dan solven (fase pelarut). Mekanisme proses dapat terjadi dalam 3 tahapan seperti pada Gambar 3. Tahap pertama berupa berubahnya molekul solut dari fase solut murni menjadi fase uap. Tahap kedua yaitu dengan pembetukan lubang pada pelarut untuk tempat bergabungnya molekul solut. Tahap ketiga merupakan tahap saat fase molekul solut bebas mengisi lubang yang ada pada solven (Augustijns & Brewster 2007).
2.4.2 Daya Serap Air (Water Absorption Capacity/WAC)
(D
Glu T Tyr His , Lys
e,
12
digunakann sebagai ffaktor penenntu dan peembatas dallam pengguunaan proteein di pangan.
Sumber: Augustijns & Brewster (20007)
Gaambar 3 Hippotesis tahaapan proses pelarutan
Mollekul air meengikat bebberapa guguus pada protein. Hal inni terkait deengan gugus bermuatan (iion-dipole interactions); gugus peptida uttama (backkbone
peptide); ggugus amidda pada Asnn dan Gln; gugus hidrroksil pada residu Ser,, Thr, dan Tyr (all dipole--dipole inteeractions); dan residuu nonpolar (dipole-indduced dipole intteraction, hidrasi hiddrofobik) Damodaran 1996). Kapasitas hidrasi
protein terrkait dengann komposissi asam amiino, yaitu seemakin bannyak residu yang bermuatan maka penngikatan air akan makiin meningkkat. Kapasita hidrasi residu asam aminno seperti pada Tabel 110.
Tabbel 10 Kapaasitas hidrassia residu assam amino Kelomppok
Polar
Ionik
Nonpollar
Residu asaam amino Asn, Gln, Ser, Thhr, Trp Pro,Tyr
Asp (uunionized), Glu (unionnized) Arg (uunionized)
Lys (uunionized) Asp-
- - Arg +
+ +
Ala, Gly, Val, Ile Leu, Met
Hiddrasi (mol h2o/mol residdu) 2
3 2 3 4 6 7 3 4 1
a dinyatakkan sebagai aair yang tidakk dapat beku (Phe 0
unfrozen waater) pada assam amino reesidu
berdasarrkan analisis ppolipeptida meenggunakan nuuclear magneetic resonancee.
B) ar se
se
ai
13
Mekkanisme prroses pengiikatan air oleh proteiin terjadi dalam bebberapa tahapan. Gugus ionik dengan afinitas tingg akan meengalami lebih dahulu pada
kondisi akktivitas air yyang rendahh, dilanjutkkan gugus polar dan noonpolar. Tahhapan pengikatann air dapatt dilihat padda Gambarr 4 dan skeema lapisann hidrasi prrotein seperi padda Gambar 55.
Sumber: Daamodaran (19996)
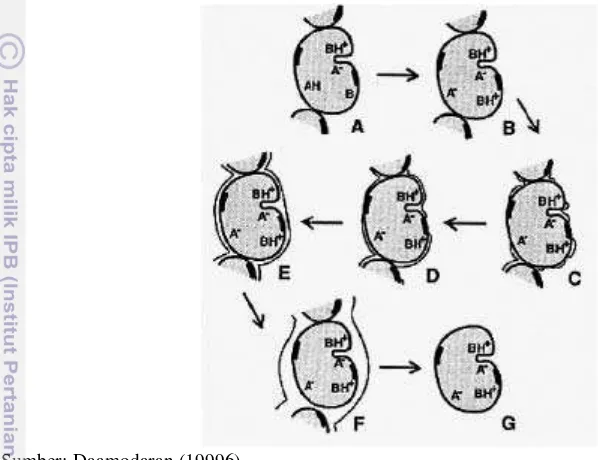
Gambar 4 Tahapan hidrasi prootein. (A) Protein unnhidrasi. (B Hidrasi awal terjadi ppada guguus bermuattan. (C) Air membbentuk forrmasi
mengeliliingi sisi pola dan bermmuatan. (D) Hidrasi terjjadi pada eluruh permukaaan yang pollar. (E) Hiddrasi hidrofofobik pada bagian nonppolar; lapisan monolayer terbentuk empurna. (F) Pembenntukan hubuungan antara airr yang teriikat dengann protein ddan air bebbas. (G) Hidrasi hidrodinaamis telah teerjadi sempuurna
n,
14
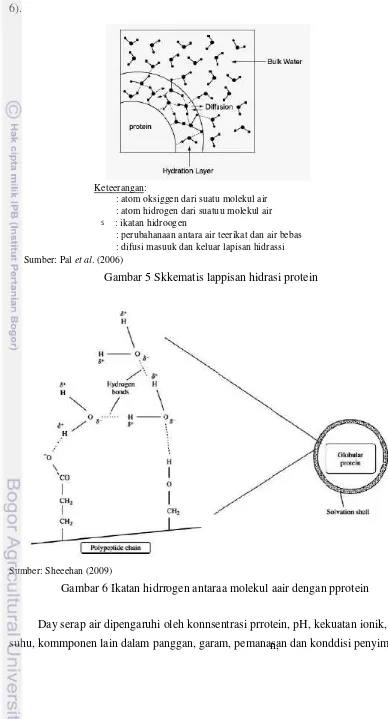
parsial daari perbedaaan keelektroonagatifan antara oksigen dan hiddrogen (Gaambar 6).
Keteerangan:
: atom oksiggen dari suatu molekul air : atom hidrogen dari suatuu molekul air
S : ikatan hidroogen
: perubahanaan antara air teerikat dan air bebas : difusi masuuk dan keluar lapisan hidrassi Sumber: Pal et al. (2006)
Gambar 5 Skkematis lappisan hidrasi protein
Sumber: Sheeehan (2009)
Gambar 6 Ikatan hidrrogen antaraa molekul aair dengan pprotein
15
(Zayas 1997). Protein akan mengikat air lebih banyak saat pH berada di atas maupun di bawah pI. Kondisi ini terkait dengan meningkatnya muatan dan gaya repulsifnya. Daya ikat air protein secara umum lebih besar pada pH 9 – 10 dibandingkan pH lainnya (Fennema 1996). Hal ini terkait dengan terionisasinya sulfidril dan residu tirosin. Muatan positif pada gugus ε-amino akan hilang di atas pH 10 sehingga mereduksi air yang terikat pada protein tersebut.
Perubahan konformasi protein selama pengolahan terjadi umumnya akibat adanya pemanasan. Pemanasan menyebabkan terbukanya struktur rantai
polipeptida dan dikenal dengan istilah denaturasi. Kapasitas pengikatan air pada protein terdenaturasi umumnya meningkat 10% lebih besar daripada native protein. Hal ini terkait dengan peningkatan area permukaan terhadap rasio massa yang terekspos. Denaturasi yang menyebabkan terjadinya agregasi protein akan menurunkan kapasitas pengikatan air karena adanya interaksi antar protein tersebut (Damodaran 1996).
2.4.3 Daya Serap Minyak (Oil Absorption Capacity/OAC)
Daya serap minyak merupakan salah satu sifat yang dimiliki protein dan sangat perlu untuk membantu penggunaan protein tersebut dalam olahan pangan dalam bentuk emulsi. Sumber protein, kondisi proses pengolahan, komposisi bahan tambahan, ukuran partikel, dan suhu merupakan faktor yang mempengaruhi protein dalam mengikat minyak (Zayas 1997). Kinsella dan Sathe et al. diacu dalam Zayas (1997) menyatakan bahwa penyerapan minyak ditentukan dengan pengikatan minyak oleh bagian nonpolar protein. Pengikatan minyak oleh protein tanaman merupakan kombinasi pengaruh dari konsentrasi protein, jumlah sisi nonpolar, serta interaksi antara protein, lipida, dan karbohidrat.
as
te jem
W) Em se em
lem
em
ar am
o.
/E em
16
2.4.4 Kaapasitas daan Stabilita Emulsi (Emulsion Capasity/EC and Emyylsion
Staability/ES)
Emuulsi merupakan sistem dispersi dari satu atau lebbih cairan yang
sebenarnyya tidak dappat bercamppur. Campuuran tersebuut distabilkkan oleh aggensia pengemulsi, yaitu yanng dapat meembentuk laapisan film yang menghhubungkan antar cairan terssebut (interfface film). PProtein dapaat mengadsoorpsi minyaak karena addanya residu asaam amino hiidrofobik yaang dapat erlepas dari matriks mbatan hidrrogen
di sekelilling molekkul air (Beelitz 2009)). Hal ini mengakibaatkan terjadinya penggantiaan molekul air yang terdapat pad bagian hidrofobik lapisan pemmbatas antara minnyak dan air (interfacce) dengan minyak. Emulsi dalam pangan dapat berupa 2 tipe, yaitu minyak dalam air (O/W dan air daalam minyak (W/O). mulsi dengan sisstem O/W umumnya membentuk tekstur yanng creamy edangkan mulsi dengan sisstem W/O memiliki teekstur greassy. Ilustrasii pelapisan molekul prrotein pada tetesan minyak maupun mak seperti pada Gambbar 7.
Sumber: Culbertson (22006)
Gambar 7 Pembentuukan proteein menstaabilkan mulsi. Proteein ditunjuukkan dengan gabungan lingkarann dan buujur sangkkar. Lingkaran melambanngkan residdu asam amiino hidrofiliik dan terorrientasi padaa fase polar. Buujur sangka melambaangkan residu asam mino hidroofobik
dan teroriientasi padaa fase nonpoolar. Garis ppenghubungg melambanngkan ikatan pepptida yang menghubunngkan antar asam amino
17
kondisi tertentu. Agensia pengemulsi yang menentukan kapasitas emulsi
tergantung pada kemampuannya membentuk lapisan film yang dapat mengadsorpsi di sekeliling globula dan menurunkan tegangan permukaan lapisan pembatas minyak-air (oil-water interface) (Zayas 1997). pH mempengaruhi total muatan dan kesetimbangan elektrostatis pada dan antar protein serta memodifikasi kemampuan protein tersebut untuk berinteraksi hidrofilik dan lipofilik (Elizalde et al. 1996).
Stabilitas emulsi (ES) merupakan kemampuan emulsi untuk mempertahankan dispersinya tanpa adanya pemisahan. Kapasitas dan stabilitas emulsi dipengaruhi oleh asal dan konsentrasi protein, pH, kekuatan ionik, dan viskositas sistem. Karakteristik emulsi yang dihasikan dipengaruhi desain
peralatan, suhu minyak, dan larutan protein (Zayas 1997). Stabilitas emulsi tidak dipengaruhi oleh kesetimbangan antara karakteristik hidrofilik-lipofilik protein tetapi terutama besarnya WAC protein hidrofilik (Elizalde et al. 1996).
Emulsi dengan stabilitas yang tinggi dapat diperoleh dengan mengkombinasikan beberapa agensia pengemulsi dengan tetap memperhatikan nilai kesetimbangan hidrofilik lipofilik (HLB). Zayas (1997) menyatakan bahwa penurunan tegangan permukaan dan antarmuka yang maksimal dapat dicapai saat indeks absorpsi air-minyak mendekati 2,0, yaitu absorpsi air oleh protein dua kali lebih besar daripada absorpsi terhadap minyak.
Protein yang cocok digunakan sebagai agensia pengemulsi pada emulsi minyak dalam air hendaknya memiliki berat molekul yang rendah, komposisi asam amino yang seimbang antara residu bermuatan, polar, dan nonpolar,
kelarutan yang baik dalam air, serta dapat membentuk permukaan hidrofobik yang baik dan konformasinya stabil (Belitz 2009). Perubahan interaksi elektrostatis akan mempengaruhi interaksi hidrofobik dan Van der Walls serta ikatan hidrogen. Kekuatan interaksi-interaksi tersebut merupakan faktor kritis dalam mengoptimasi sifat emulsifikasi protein pangan (Elizalde et al. 1996).
18
Kelarutan protein merupakan faktor yang penting dalam menentukan karakteristik pembentukan emulsi oleh protein. Tingkat kelarutan yang semakin meningkat akan menyebabkan terbentuknya emulsi dan foam yang semakin stabil pula (Zayas 1997). Kelarutan protein ini lebih berkontribusi terhadap kualitas emulsi dibandingkan terhadap jumlah minyak yang diperlukan untuk mengemulsi. Protein tak terlarut akan bersatu dan membantu meningkatkan kestabilan emulsi.
2.4.5 Kapasitas dan Stabilitas Buih (Foam Capacity/FC and Foam
Stability/FS)
Buih merupakan dispersi gas dalam cairan. Protein dapat menstabilkan buih dengan cara membentuk lapisan film yang fleksibel dan kohesif. Cherry &
McWatters diacu dalam Zayas (1997) menyatakan bahwa protein dalam cairan film harus: (1) dalam terlarut dalam larutan encer (aqueous); (2) dapat
terkonsentrasi pada lapisan pembatas air-udara; dan (3) berada pada kondisi terdenaturasi sehingga akan meningkatkan viskositas dan kekuatannya.
Protein akan teradsorpsi pada lapisan pembatas (interface) melalui area hidrofobik dan diikuti dengan denaturasi permukaan (partial unfolding). Adanya reduksi tegangan permukaan menyebabkan adsorpsi protein dan memfasilitasi pembentukan interface baru dan selanjutnya membentuk gelembung gas. Semakin cepat molekul protein terdifusi dalam interface maka denaturasi akan makin cepat terjadi sehingga buih akan semakin stabil (Belitz 2009).
Zayas (1997) menjelaskan bahwa pembentukan buih meliputi 3 tahapan, yaitu: (1) Protein globular terlarut terdifusi pada lapisan pembatas udara-air (air- water interface), terkonsentrat dan menurunkan tegangan permukaan; (2) Struktur protein terbuka (unfold) pada interface sehingga terorientasi bagian hidrofilik pada bagian polar dan hidrofobik pada bagian nonpolar; (3) Interaksi polipeptida membentuk lapisan film dengan dimungkinkan terjadi denaturasi dan koagulasi parsial. Protein akan terabsorpsi dengan cepat dan membentuk lapisan film yang stabil di sekeliling gelembung yang mendukung terbentuknya buih.
19
permukaan hidrofobik (hydrophobic interface) dan bagian hidrofobik protein tersebut (Dickinson 1986 diacu dalam Foegeding et al. 2006).
Interaksi elektrostatis memegang peran penting pada adsorpsi protein. Sifat pembentukan buih dapat dioptimalkan saat protein dikondisikan mendekati titik isoelektrisnya (pI) (Foegeding et al. 2006). Proses adsorpsi ini terjadi dengan cepat pada pI karena minimalnya tolakan elektrostatis pada protein yang bermuatan netral.
Buih akan runtuh akibat adanya gelembung gas yang besar terbentuk diantara gelembung-gelembung kecil karena terjadi disprotonasi. Stabilitas buih dipengaruhi oleh jumlah protein yang teradsorpsi dan kemampuan molekul
teradsorpsi mengalami asosiasi. Denaturasi permukaan umumnya akan melepaskan rantai samping asam amino yang dapat masuk dalam interaksi
intermolekuler (Belitz 2009). Buih dapat dirusak dengan adanya lipida dan pelarut organik karena sifat hidrofobisitasnya yang mampu menggantikan posisi protein pada permukaan gelembung gas. Adanya substansi yang tidak larut air juga dapat menyebabkan runtuhnya film protein pada buih (Zayas 1997).
2.4.6 Pembentukan Gel (Gel Formation)
Gel merupakan sistem dispersi minimal antara dua komponen dengan fase terdispersi membentuk matriks yang kohesif pada fase pendispersinya.
Pembentukan gel terjadi dengan adanya pengkondisian pH, penambahan ion-ion, maupun pemanasan dan pendinginan.
20
Agregasi umumnya terjadi melalui ikatan hidrogen intermolekuler yang dapat dengan mudah terputus dengan adanya pemanasan. Matriks polimer yang terbentuk bersifat termoreversibel, yaitu akan terbentuk gel saat larutan
didinginkan dan akan meleleh kembali saat dipanaskan (Belitz 2009).
Aggregated dispersions merupakan gel yang terbentuk dari protein globular akibat adanya pemanasan dan denaturasi. Protein yang mengalami thermal unfolding menyebabkan terlepasnya asam amino rantai samping yang dapat masuk ke dalam interaksi intermolekuler (Belitz 2009). Tingkat denaturasi penting untuk menentukan awal terjadinya agregasi. Denaturasi parsial melepaskan terutama gugus hidrofobik sehingga terbentuk gel dengan karakteristik termoplastik (termoireversibel).
2.5 Fraksinasi Osborne
Fraksinasi Osborne merupakan fraksinasi yang umum dikenal dan
digunakan untuk mengelompokkan protein, yaitu berdasarkan sifat kelarutannya dalam berbagai pelarut. Fraksinasi ini membedakan protein menjadi empat kelompok protein, yaitu albumin, globulin, prolamin, dan glutelin. Bender (2006) mendeskripsikan keempat fraksi protein berdasarkan kelarutan tersebut sebagai berikut:
1. Albumin merupakan kelompok protein yang larut air dan dapat dengan mudah terkoagulasi oleh panas.
2. Globulin merupakan kelompok protein yang terkoagulasi oleh panas dan dapat larut dalam larutan garam encer.
3. Prolamin dapat larut dalam etanol (alkohol) 70% tetapi tidak dapat larut dalam air dan alkohol absolut. Umumnya kaya akan asam amino prolin dan glutamin, tetapi rendah lisin.
4. Glutelin merupakan protein yang tidak larut dalam air dan larutan garam netral tetapi larut dalam larutan asam dan basa encer.
21
maka sedikit permukaannya yang bermuatan sehingga kelarutannya dalam air menjadi terbatas (Culbertson 2006).
Garam pada konsentrasi rendah (< 0,2 M) dapat meningkatkan kapasitas pengikatan air oleh protein. Hal ini terjadi karena ion garam terhidrasi mengikat lemah gugus protein yang bermuatan. Konsentrasi tersebut tidak mempengaruhi lapisan hidrasi pada gugus protein yang bermuatan. Peningkatan kemampuan pengikatan air ini terjadi karena air berasosiasi dengan ion yang terikat
(Damodaran 1996). Wolf (1972) menyatakan bahwa pada pH 7,0 dengan adanya penambahan 0,2 M NaCl pada larutan protein kedelai akan menurunkan kelarutan dari 58% menjadi 28% (Walker 1978). Konsentrasi garam yang tinggi
menyebabkan banyak air terikat pada ion-ion garam sehingga menyebabkan dehidrasi pada protein (Damodaran 1996). Peran garam terhadap protein seperti pada Gambar 8.
Pelarut organik efektif menyebabkan denaturasi pada protein kedelai (Wolf 1972). Alkohol akan membuat molekul protein terbuka (unfold) sehingga
mereduksi kelarutannya (Walker 1978).
Alkali mendenaturasi protein kedelai dengan cara mengganggu struktur internal molekul 11S dan terdisosiasi menjadi 7S dan akhirnya menjadi subunit 2 dan 3S (Wolf 1972 diacu dalam Walker 1978).
Protein globular umumnya membentuk struktur dengan sisi non polar dan kelompok peptida berada di dalam folded protein dan terkemas dengan kuat. Hal ini menyebabkan tingkat kelarutan protein menjadi terbatas. Skematis folded protein seperti pada Gambar 9. Banyak gugus yang berada pada kondisi awal (native) dan terpendam di dalam folded protein akan dapat bereaksi dengan solven setelah protein tersebut unfolded (Pace et al. 2004).
te ta
se m. io
f)
22
Sumber: Song J. 20099.
Gambar 8 Usulan model peran garam erhadap prootein well-ffolded (a-c) dan protein ak terlarut (d-f). (a) Molekul prootein well-ffolded dalam air bebas garam denggan kondisi pH mendekati pI. Bola hijau
melambanngkan mollekul proteein. Batangg abu-abu melambanngkan rantai sissi hidrofobbik. Batangg ungu dann biru mellambangkann sisi hidrofilik bermuatan positif dan negatif. Lingkaran daan arsiran merah melambanngkan kessetimbangann muatan. Bola keecil biru muda
melambanngkan moleekul air. (b)) Protein weell-folded daalam lingkuungan dengan edikit garam Bola meerah melammbangkan on garam deengan beberapa molekul air yang mengelilinnginya. (c) Kurva antara
konsentraasi garam teerhadap kellarutan prottein. (d) Prootein tak teerlarut dalam airr bebas garaam. Elips hijjau melambbangkan moolekul proteiin tak terlarut dengan sebaagian besar sisi hidrofoobik terpapaar di permuukaan. (e) Moleekul proteinn tak terlarrut dalam lingkungann dengan seedikit garam. (f Kurva anttara konsenntrasi garam terhadap kelarutan prrotein untuk prootein tak terllarut.
.
Sumber: Tannford (1962) ddiacu dalam PPace et al. (20004)
23
2.5.1 Pengaruh pH terhadap Kelarutan Protein
Protein bahan pangan umumnya berupa protein asam karena mengandung residu Asp dan Glu dalam jumlah yang lebih besar daripada jumlah residu Lys, Arg, dan His. Hal ini menyebabkan kelarutan minimal pada pH 4-5 dan kelarutan maksimum pada pH alkali (Damodaran 1996). Hidrofobisitas dan gaya tolak menolak akan meningkat dengan semakin meningkatnya interaksi hidrofobik antar protein sehingga protein akan tetap terlarut pada pI. Denaturasi akibat panas menyebabkan perubahan profil kelarutan protein pada variasi pH. Perubahan tersebut terkait dengan meningkatnya hidrofobisitas protein permukaan akibat struktur yang terbuka. Permukaan protein memiliki kesetimbangan muatan terkait dengan kandungan asam amino dan pH lingkungan protein tersebut (Culbertson 2006).
2.5.2 Pengaruh Suhu terhadap Kelarutan Protein
Suhu umumnya meningkatkan kelarutan molekul dalam solven sejalan dengan laju difusi melalui solven. Hal ini disebabkan oleh peran panas yang meningkatkan energi kinetik rata-rata pada molekul solven. Air sebagai solven akan mengalami hal tersebut dengan adanya pemutusan ikatan hidrogen pada air sehingga meningkatkan kapasitas solut terhadap sejumlah volume air (Sheehan 2009).
Panas akan mengganggu ikatan nonkovalen, seperti ikatan hidrogen terutama pada struktur biomakromolekul. Ikatan kovalen yang menggabungkan kelompok-kelompok molekul memiliki energi ikatan yang rendah daripada energi dalam kelompok-kelompok molekul sehingga adanya pemanasan dapat menyebabkan disintegrasi struktur kovalen yang ada (Culbertson 2006). Hal ini menyebabkan protein akan terputus menjadi komponen peptida dan asam-asam amino. Kapasitas pengikatan air umumnya menurun dengan meningkatnya suhu karena berkurangnya ikatan hidrogen dan kemampuan hidrasi gugus ionik (Damodaran 1996). Waktu pemanasan mempengaruhi kelarutan protein seperti pada Tabel 11.
24
sistein serta menurunkan kemampuan lisin dan sistein yang tidak rusak untuk dapat dicerna (Dudley-Cash, 1991 diacu dalam Rodica & Căpriţă 2007). Hal ini dapat dijelaskan dengan reaksi Maillard, yaitu asam amino bebas berikatan dengan gugus karbonil bebas (misalnya gula reduksi atau karbohidrat).
Tabel 11 Pengaruh waktu pemanasan terhadap kelarutan protein Waktu pemanasan
(menit)
Protein terlarut (%)
Protein terlarut terhadap total protein (%)
0 38,19 87,40 10 31,11 71,19 20 26,20 59,95 30 23,27 53,25 60 16,69 38,19
BAB III
BAHAN DAN METODE
3.1 Bahan dan Peralatan
Bahan utama penelitian ini adalah okara (ampas tahu) basah yang diperoleh dari Perusahaan Tahu Bandung “Ashor” yang bertempat di Jalan Cibanteng Proyek. Bahan untuk analisis meliputi: aquabidest, NaCl, etanol 70%, dan NaOH, bovine serum albumin (BSA), Coomasie Brilliant Blue (CBB) G-250, etanol 95%, asam fosforat 85%, akrilamida, N,N’-metilen-biasakrilamida, tris base, sodium dodecyl sulfate (SDS), amonium persulfat (APS), TEMED, glisin, bromphenol blue, coomasie brilliant blue R-250, heksana, asam asetat glasial, HCl, K2SO4, HgO, H2SO4 pekat, H2BO3, buffer natrium fosfat, termamyl, pankreatin, aseton, celite, n-oktil alkohol, buffer kalium borat, o-pthalaldehhide (OPA), phenylisothiocyanat (PITC), setil trimetil amonium bromida, EDTA – 2Na,
Na2B4O7.10H2O, sodium lauril sulfat, Na2HPO4, 2-etoksi-etanol, 〈-amilase, buffer fosfat (KH2PO4 – Na2HPO4), Na-Asetat (pH 6,5), buffer Na-asetat, merkaptoetanol, Brij-30 30%, buffer borat, Na-EDTA, tetrahidrofuran (THF), asetonitril, metanol, akuades, dan minyak kedelai.
Peralatan utama yang digunakan dalam pembuatan tepung okara meliputi: alat pengering kabinet (cabinet dryer), disc mill, dan ayakan berukuran 100 mesh. Peralatan utama untuk analisis adalah sentrifuse (Hettich Zentrifugen Micro 22R V3.02), vortex, spektrofotometer (Shimadzu UV-2450), perangkat elektroforesis minigel Mini-Protean (Bio-Rad), RP-HPLC, hand mixer (Sharp), hand bender (Black & Dekker), penangas air, pendingin balik, oven, tanur, desikator, freeze dryer (Labconco), texture analyzer (TA-TX2), neraca analitik, dan perangkat gelas (gelas beker, gelas ukur, labu takar).
3.2 Waktu dan Tempat Penelitian
26
Laboratorium Terpadu, Institut Pertanian Bogor dan Laboratorium Uji Bioteknologi, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia.
3.3 Metodologi
3.3.1 Pelaksanaan Penelitian
Penelitian ini akan dilaksanakan dalam 2 tahap, meliputi: Tahap 1
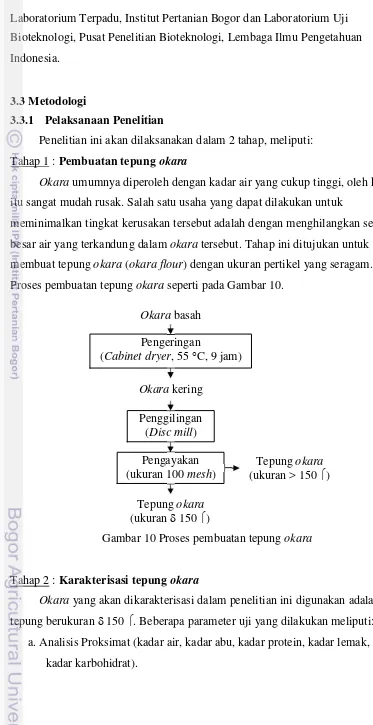
Okara umumnya diperoleh dengan kadar air yang cukup tinggi, oleh karena : Pembuatan tepung okara
itu sangat mudah rusak. Salah satu usaha yang dapat dilakukan untuk
meminimalkan tingkat kerusakan tersebut adalah dengan menghilangkan sebagian besar air yang terkandung dalam okara tersebut. Tahap ini ditujukan untuk
membuat tepung okara (okara flour) dengan ukuran pertikel yang seragam. Proses pembuatan tepung okara seperti pada Gambar 10.
Okara basah
Pengeringan
(Cabinet dryer, 55 °C, 9 jam) Okara kering
Penggilingan (Disc mill) Pengayakan
(ukuran 100 mesh) (ukuran > 150Tepung okara ) Tepung okara
(ukuran δ 150 )
Gambar 10 Proses pembuatan tepung okara
Tahap 2
Okara yang akan dikarakterisasi dalam penelitian ini digunakan adalah : Karakterisasi tepung okara
tepung berukuran δ 150 . Beberapa parameter uji yang dilakukan meliputi: a. Analisis Proksimat (kadar air, kadar abu, kadar protein, kadar lemak, dan
27
b. Analisis Kadar Serat Pangan
Kadar serat pangan yang terkandung dalam tepung okara diukur dengan menggunakan metode gravimetri dan enzimatis.
c. Analisis Komposisi Asam Amino
d. Fraksinasi Protein Metode Osborne dan Protein Recovery
Kadar protein terlarut ditentukan menggunakan metode Bradford dan analisis berat molekul protein fraksi menggunakan elektroforesis SDS- PAGE. Protein recovery merupakan persentase protein yang terlarut dari total protein yang terkandung dalam tepung okara tersebut. Agar dapat meningkatkan pemanfaatan protein pada tepung okara, maka dilakukan usaha meningkatkan protein recovery melalui modifikasi terhadap waktu ektraksi, serta penggunaan kombinasi pH suspensi dan suhu ekstraksi.
Waktu ekstraksi metode awal yaitu: tahap 1 selama 30 menit, tahap 2 selama 5 menit, dan tahap 3 selama 5 menit sehingga total waktu ekstraksi adalah 40 menit (untuk selanjutnya disebut dengan Metode 1). Modifikasi waktu ekstraksi dilakukan dengan memperpanjang waktu ekstraksi dari waktu ekstraksi pada metode awal. Modifikasi pertama berupa waktu ekstraksi pada tahap 1 selama 30 menit, tahap 2 selama 2 jam, dan tahap 3 selama 30 menit sehingga total waktu ekstraksi adalah 3 jam (untuk selanjutnya disebut dengan Metode 2). Modifikasi kedua berupa waktu ekstraksi dengan tahap 1 selama 3 jam, tahap 2 selama 2 jam, tahap 3 selama 30 menit sehingga total waktu ekstraksi sebesar 5,5 jam (untuk sela jutnya disebut dengan Metode 3).
Metode ekstraksi yang terpilih selanjutnya dikombinasikan dengan pH suspensi dan suhu ekstraksi yang ditingkatkan. pH suspensi awal adalah pH 6 (tanpa dimodifikasi) dan pH tersebut ditingkatkan menjadi 8 dan 9 dengan mempertimbangkan bahwa pH tersebut menjauhi titik isolektriknya. Suhu modifikasi yang digunakan adalah 80 °C, sedang suhu awalnya adalah suhu ruang (25 °C).
e. Sifat Fungsional Tepung Okara, meliputi: 1) Kelarutan (Solubility)
28
3) Daya serap minyak (Oil Absorption Capacity/OAC)
4) Kapasitas dan stabilitas emulsi (Emulsion Capasity/EC and Emylsion Stability/ES)
5) Kapasitas dan stabilitas buih (Foam Capacity/FC and Foam Stability/FS)
6) Pembentukan gel (Gel Forming)
Keseragaman data diupayakan dengan menetapkan nilai koefisien kovarian (koef. varian SD/rerata ⋅ 100%) yang diperoleh maksimal 10%. Pengaruh
ukuran partikel terhadap komposisi proksimat dianalisis dengan uji t dengan 〈 = 0,05. Pengaruh variasi perlakuan ekstraksi pada Fraksinasi Osborne dianalisis menggunakan analisis varian dengan 〈 = 0,05 dan apabila terdapat beda nyata dilanjutkan dengan uji pembeda nyata Duncan. Analisis dilaksanakan
menggunakan perangkat lunak SPSS 13 (Gomez & Gomez 1984).
3.3.2 Prosedur Analisis
Parameter-parameter yang digunakan untuk mendukung penelitian ini dilakukan dengan menggunakan metode sebagai berikut:
3.3.2.1 Fraksinasi Osborne (Lookhart dan Bean 1995 dengan modifikasi)
a.
Tepung okara (50 mg) diekstraksi dengan air deionisasi (500 μL) selama 30
Ekstraksi Albumin
menit, dengan divorteks selama 1 menit setiap 10 menit. Campuran selanjutnya disentrifugasi selama 20 menit pada 25.150 ⋅ g. Supernatan (ekstrak albumin) didekantasi dan disimpan sebagai ALB-1. Endapan (E.ALB-1) divorterks dengan
500 μL air deionisasi selama 1 menit, didiamkan selama 120 menit, dengan
divorteks selama 1 menit setiap 30 menit, dan disentrifugasi kembali seperti sebelumnya. Supernatan yang diperoleh dari dekantasi disimpan sebagai ALB-2. Endapan (E.ALB-2) yang diperoleh selanjutnya divorteks kembali selama 1 menit dan didiamkan selama 30 menit, dengan divorteks selama 1 menit setiap 10 menit,
dengan 500 μL air deionisasi, kemudian disentrifugasi kembali. Supernatan
29
b.
Endapan (E.ALB-3) diekstraksi dengan larutan 0,5N NaCl (500 μL) selama Ekstraksi Globulin
30 menit, dengan divorteks selama 1 menit dengan interval 10 menit. Campuran tersebut disentrifugasi selama 20 menit pada 25.150 ⋅ g. Supernatan (ekstrak globulin) didekantasi dan disimpan sebagai GLOB-1. Endapan (E.GLOB-1)
divorteks dengan 500 μL 0,5N NaCl selama 120 menit, dengan divorteks selama 1
menit setiap 30 menit, dan disentrifugasi seperti sebelumnya. Supernatan
disimpan sebagai GLOB-2. Endapan (E.GLOB-2) disentrifugasi dengan larutan 0,5 N NaCl yang lain selama 1 menit, didiamkan selama 30 menit, dengan divorteks selama 1 menit dengan interval 10 menit, dan diresentrufugasi. Supernatan disimpan sebagai GLOB-3 dan endapan (E.GLOB-3) divorteks
dengan air deionisasi (500 μL) selama 1 menit, didiamkan selama 30 menit,
dengan divorteks selama 1 menit dengan interval 10 menit, disentrifugasi, dan supernatannya (GLOB-3’) dibuang. Perlakuan ini menggunaan air dan bertujuan untuk mereduksi pengaruh garam pada endapan (E.GLOB-3’) saat dilakukan ekstraksi prolamin pada tahap selanjutnya.
c.
Endapan (GLOB-3’) diekstraksi menggunakan etanol 70% (500 μL) selama Ekstraksi Prolamin
30 menit, dengan divorteks selama 1 menit pada setiap 10 menitnya, selanjutnya disentrifugasi selama 20 menit pada 25.150 ⋅ g. Supernatan (ekstrak prolamin) didekantasi dan disimpan sebagai GLI-1. Endapan (E.GLI-1) divorteks dengan
500 μL etanol 70% selama 1 menit, didiamkan selama 120 menit, dengan
divorteks selama 1 menit setiap 30 menit, dan disentrifugasi seperti sebelumnya. Supernatan disimpan sebagai GLI-2 dan endapan (E. GLI-2) divorteks kembali
dengan etanol 70% sebanyak 500 μL selama 1 menit, didiamkan selama 30 menit,
dengan divorteks selama 1 menit dengan interval 10 menit, dan disentrifugasi. Supernatan yang diperoleh dituang dan disimpan sebagai GLI-3 dan endapan (E.GLI-3) digunakan untuk ekstraksi glutenin.
d.
Endapan (E.GLI-3) diekstraksi dengan larutan 0,2% NaOH (500 μL)
Ekstraksi Glutenin
30
(ekstrak glutelin) didekantasi dan disimpan sebagai GLU-1. Endapan (E.GLU-1)
divorteks dengan 500 μL 0,2% NaOH selama 120 menit, dengan divorteks selama
1 menit setiap 30 menit, dan disentrifugasi seperti sebelumnya. Supernatan disimpan sebagai GLU-2. Endapan (E.GLU-2) disentrifugasi dengan 500 μL
larutan 0,2% NaOH yang lain selama 1 menit, didiamkan selama 30 menit, dengan divorteks selama 1 menit dengan interval 10 menit, dan diresentrufugasi. Supernatan disimpan sebagai GLU-3 dan endapan (E.GLU-3) dianalisis kadar protein tak terlarut menggunakan metode micro Kjeldhal.
3.3.2.2 Analisis Kadar Protein Metode Bradford (Kruger NJ. 2002; Owusu-
Apenten, 2002) a.
Larutan Bovine Serum Albumin (BSA) (100-1000 g/ml) sebanyak 100 μL
Pembentukan Kurva Standar
dipipet ke dalam tabung reaksi berukuran 1,2 ⋅ 10 cm, kemudian ditambahkan 5 ml pereaksi Bradford (cara pembuatan pereaksi Bradford dapat dilihat pada Lampiran 1). Larutan tersebut kemudian divorteks dan diukur secara
spektrofotometri pada panjang gelombang (λ) 595 nm setelah diinkubasi selama 5
menit. Blanko dilakukan dengan menggunakan 100 μL akuades ditambahkan 5
mL perekasi Bradford dan diukur dengan cara yang sama. Kurva standar yang diperoleh digunakan untuk mengukur konsentrasi sampel.
b.
Sampel sebanyak 100 μL dipipet ke dalam tabung reaksi berukuran 1,2 ⋅ 10
Pengukuran Sampel
cm, kemudian ditambahkan 5 mL pereaksi Bradford. Larutan kemudian divorteks dan diukur secara spektrofotometri pada λ= 595 nm setelah diinkubasi selama 5 menit. Kadar protein sampel dihitung dengan menggunakan persamaan linier yang diperoleh dari kurva standar.
3.3.2.3 Analisis Sodium Dodecyl Sulfate -Polyacrylamide Gel (SDS-PAGE)
Electrophoresis (Bolag dan Edelstein, 1991)