ABSTRAK
STUDI PENGARUH PENAMBAHAN POLIOL
TERHADAP STABILITAS TERMAL ENZIM α- AMILASE DARI Bacillus subtilis ITBCCB148
Oleh
EVILIA ARIYANTI
Penggunaan enzim dalam bidang industri telah banyak dilakukan karena enzim memiliki tenaga katalitik yang luar biasa, yang umumnya jauh lebih besar daripada katalisator sintetik. Namun sebagian besar enzim mempunyai beberapa kendala, salah satunya adalah stabilitasnya yang rendah. Kendala ini dapat diatasi dengan penambahan poliol yang dapat meningkatkan stabilitas termal enzim.
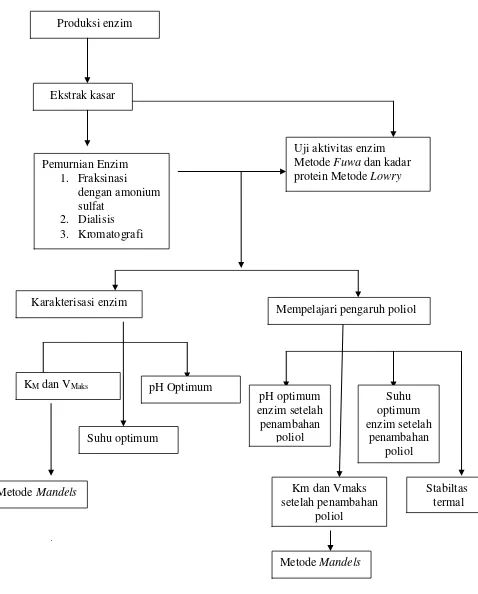
Penelitian ini bertujuan untuk meningkatkan stabilitas termal enzim α -amilase dari Bacillus subtilis ITBCCB148 dengan senyawa aditif yaitu sorbitol dan gliserol. Untuk mencapai tujuan tersebut pertama dilakukan produksi, isolasi dan pemurnian enzim. Pemurnian enzim α-amilase dilakukan melalui tiga tahap yaitu fraksinasi dengan amonium sulfat, dialisis, dan kromatografi kolom penukar ion dengan menggunakan CMC. Enzim hasil pemurnian dikarakterisasi dengan menggunakan sorbitol dan gliserol. Pengujian aktivitas α-amilase dilakukan dengan metode Fuwa dan metode Mandels, sedangkan pengukuran kadar protein dengan metode Lowry.
Hasil penelitian menunjukkan enzim hasil pemurnian memiliki pH optimum 6 suhu optimum 600C, dengan nilai KM dan Vmaks berturut-turut adalah 3,99 mg mL-1 substrat dan 3,8λ mol mL-1 menit-1. Proses pemurnian meningkatkan aktivitas spesifik enzim dari 393 U/mg untuk ekstrak kasar menjadi 12.000 U/mg untuk kromatografi kolom dengan tingkat kemurnian 30 kali.
Penambahan sorbitol tidak mengalami perubahan pH dan suhu optimum. Stabilitas termal enzim dengan penambahan sorbitol 0,5M mempunyai nilai KM = 1,98 mg mL-1 substrat, Vmaks = 1,19 mol mL-1 menit-1, t1/2 = 28,39 menit; ki = 0,02λ, ΔGi = 103,010 kJ mol-1 ; sorbitol 1M, KM = 1,86 mg mL-1 substrat, Vmaks = 1,44 mol mL-1 menit-1, t1/2 = 38,50 menit; ki = 0,018, ΔGi = 104,330 kJ mol-1; sorbitol 1,5M, KM = 1,35 mg mL-1 substrat, Vmaks = 3,93 mol mL-1 menit-1, t1/2 = 43,31 menit; ki = 0,016, ΔGi = 104,657 kJ mol-1. Enzim dengan penambahan sorbitol 0,5M; 1M; 1,5M memiliki aktivitas sisa berturut-turut adalah 16,96%; 33,22%; dan 41,69% setelah penyimpanan selama 60 menit pada suhu 600C.
enzim sebelum penambahan poliol.
BAB. II. TINJAUAN PUSTAKA
A. Enzim
Enzim merupakan unit fungsional dari metabolisme sel, bekerja dengan urutan- urutan yang teratur, mengkatalisis ratusan reaksi bertahap yang menyimpan dan mentransformasikan energi kimiawi dan membuat makromolekul sel dari prekusor sederhana (Lehninger, 1982).
Sifat enzim yang sangat penting adalah tingginya efisiensi dan derajat katalitiknya terhadap substrat. Efisiensi katalitik enzim berkaitan dengan orientasi optimum gugus aktif enzim dan substrat. Orientasi keduanya sangat mendukung sehingga saat terjadi reaksi tidak memerlukan energi yang besar untuk mengatur posisi. Spesifitas enzim berkaitan dengan reaksi enzim yang sangat spesifik, satu enzim hanya akan bereaksi dengan satu substrat atau setiap enzim menyebabkan perubahan satu langkah pada substratnya (Toha, 2001).
antara konsentrasi enzim dan substrat bagi aktivitas maksimumnya, begitu juga setiap enzim berfungsi secara optimal pada pH dan suhu tertentu (Lehninger, 1982).
B. Enzim Amilase
Enzim amilase merupakan enzim yang mempunyai aktivitas memecah molekul pati dan glikogen (Judoamidjojo et al., 1989). Menurut Winarno (1986), enzim amilase dapat dikelompokkan menjadi tiga golongan enzim yaitu :
1. α-amilase (α- 1,4 glukan – 4 – glukanhidrolase), yang memecah pati secara acak dari tengah atau dari bagian dalam molekul, karenanya disebut endoamilase.
2. β-amilase (β- 1,4 glukan maltohidrolase), yang menghidrolisis unit- unit gula dari ujung molekul pati, karenanya disebut eksoamilase.
3. Glukoamilase, yang dapat memisahkan glukosa dari terminal gula non- pereduksi substrat pati.
7
bersamaan untuk memecah suatu molekul polisakarida menjadi gula sederhana. Salah satu contoh aplikasinya yaitu pada pembuatan sirup jagung.
Enzim α-amilase (3.2.1.1), dapat menghidrolisis suatu substrat polisakarida yang memiliki ikatan α – 1,4 glukan - glukanhidrolase. Histidin, dithiothreitol dan mercaptoetanol berperan sebagai kofaktor enzim ini. Selain itu ada beberapa logam yang juga dapat berperan sebagai kofaktor antara lain Ca2+, Ba2+, Mn2+, Ag+, dan Fe2+. Sedangkan Hg2+, Ca2+, Mg2+, Fe2+, Al3+, Cd2+, dan Ni2+ berperan sebagai inhibitor (Schomburg dan Salzmann, 1991).
C. Isolasi dan Pemurnian Enzim 1. Homogenisasi
Homogenisasi digunakan untuk memecah sel dan mengekstraksi enzim agar didapatkan suspensi homogen. Alat yang digunakan disebut homogenisator seperti waring blender yang dapat diputar dengan motor dan diatur kecepatannya. Dalam pengerjaannya perlu dijaga jangan sampai berbusa karena enzim yang terekstrak akan terdenaturasi, proses ini dilakukan pada suhu 2-40C (Judoamidjojo et al., 1989).
2. Sentrifugasi
Sel-sel mikroba biasanya mengalami sedimentasi pada kecepatan 5000 g Sel-selama 15 menit (Scopes, 1984 dalam Walsh dan Headon, 1994).
3. Fraksinasi dengan amonium sulfat
Sebagian besar enzim berada dalam bentuk cairan sel sebagai protein terlarut. Kelarutan enzim tersebut merupakan interaksi polar dengan pelarut dan gaya tolak-menolak antara molekul yang bermuatan sama (Scopes, 1984).
9
4. Dialisis
Dialisis merupakan metode yang biasa digunakan untuk memisahkan garam dari larutan protein. Proses yang terjadi karena adanya perbedaan tekanan osmosis antara cairan yang ada di dalam membran dan yang di luar. Prosesnya, molekul protein atau enzim yang berukuran besar akan tertahan dalam kantung dialisis sedangkan molekul-molekul kecil seperti garam anorganik akan keluar melalui pori-pori membran. Keluarnya molekul menyebabkan distribusi ion-ion yang ada di dalam dan di luar kantong dialisis tidak seimbang. Untuk memperkecil pengaruh ini digunakan larutan buffer dengan konsentrasi rendah di luar kantong dialisis. Membran yang digunakan adalah selofan (Lehninger, 1982).
5. Kromatografi penukar ion
Kromatografi penukar ion adalah metode kromatografi yang paling umum digunakan untuk pemurnian protein (Bollag et al., 1996).
pada penukar dapat dielusi dari kolom dengan mengubah pH atau konsentrasi garam, misalnya NaCl. Penukar ion dengan matriks selulosa yang banyak digunakan dalam pemisahan adalah DEAE-selulosa dan CM-selulosa. Gugus DEAE, -OC2H5NH(C2H5)2 bermuatan positif pada pH 6,0-8,0 sehingga dapat digunakan untuk protein yang bermuatan negatif pada rentang pH tersebut. Sedangkan CM-selulosa (selulosa-OCH2COO-) dapat digunakan untuk pemisahan protein yang bermuatan positif pada pH 4,5 (Palmer, 1991 dalam Sariningsih, 2000).
Kelebihan metode ini dibandingkan dengan metode filtrasi gel adalah apabila menggunakan sampel yang banyak tidak terlalu dipengaruhi oleh tinggi kolom, sehingga efisiensi diameter kolom dapat ditingkatkan (Suhartono, 1989)
D. Kinetika Reaksi Enzim
11
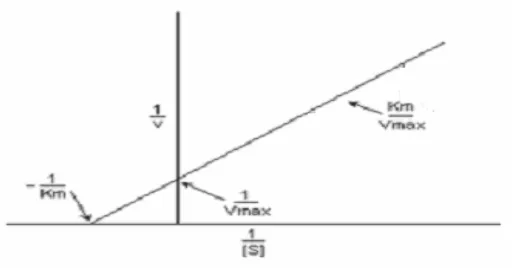
Untuk mempermudah menghitung konsentrasi substrat yang diperlukan dalam mencapai kecepatan maksimumnya, digunakan tetapan Michaelis-Menten. Nilai Vmaks dan KM (konstanta Michaelis–Menten) didapat dengan mengadakan percobaan penentuan kecepatan reaksi V pada perbedaan konsentrasi substrat, sehingga diperoleh :
V= ...(2)
Persamaan diatas dapat diubah menjadi :
Gambar 1. Kurva Lineweaver-Burk.
E. Stabilitas Enzim
Stabilitas enzim dapat diartikan sebagai kestabilan enzim selama penyimpanan dan penggunaan enzim tersebut, serta kestabilan terhadap senyawa yang bersifat merusak seperti pelarut tertentu (asam atau basa) oleh pengaruh suhu dan pH ekstrim (Wiseman, 1978 dalam Seriaty, 1991).
13
Enzim memiliki konstanta disosiasi pada gugus asam maupun basa, terutama pada gugus residu terminal karboksil dan terminal aminonya. Perubahan keaktifan enzim akibat perubahan pH lingkungan disebabkan terjadinya perubahan ionisasi enzim, substrat atau kompleks enzim-substrat (Winarno, 1986).
F. Bacillus subtilis
Bacillus subtilis adalah bakteri gram positif berbentuk batang yang dapat membentuk endospora, anaerobik fakultatif, ditemukan pada permukaan tanah, air, lingkungan akuatik, saluran pencernaan manusia dan hewan.
Sel Bacillus subtilis mempunyai ukuran panjang 2,0-8,0 µ dengan lebar 0,3-0.7 µ (Suriawiria, 1986). Bakteri ini tersusun dalam bentuk rantai dan bergerak dan berwarna keruh (Gupte, 1990).
Bakteri ini dapat tumbuh pada suhu 12 - 480C dan pH 6,5 – 10,8. Suhu optimum untuk pertumbuhan adalah 27 – 350C dengan pH 7,0 – 7,5.
Divisio : Protophyta Kelas : Schizomycetes Ordo : Eubacteriales Famili : Bacillaceae Genus : Bacillus
Bakteri ini mampu menghasilkan enzim amilase, protease, kaseinase dan antibiotik bacitrasin. Bacillus subtilis juga mampu memfermentasikan glukosa menghasilkan 2,3-butanadiol dan gas CO2 (Brock, 1979).
G. Senyawa Aditif Enzim
Senyawa aditif merupakan senyawa yang ditambahkan pada larutan enzim sehingga dapat meningkatkan stabilitas struktur protein enzim tanpa mempengaruhi interaksi kovalen pada enzim. Penggunaan senyawa aditif terbukti dapat mempertahankan konformasi enzim (Suhartono, 1989).
15
Beberapa jenis poliol yang digunakan dalam penelitian ini adalah: 1. Gliserol
Gliserol atau dikenal juga dengan gliserin atau glisil alkohol, memiliki berat molekul sebesar 92,094 g/mol, densitas 1.261 g/ cm3, titik didih 290 oC dan titik leleh 18 oC. Gliserol adalah gula alkohol yang memiliki tiga gugus hiroksil (- OH) yang bersifat hidrofilik, oleh karenanya gliserol dapat larut dalam air.
Gliserol merupakan komponen penting dalam trigliserida dan fosfolipid. Dalam keadaan murni merupakan senyawa yang tidak berbau, tidak berwarna, higroskopis, dan berupa cairan kental yang berasa manis. Struktur gliserol dapat dilihat pada Gambar 2.
Gambar 2. Struktur gliserol
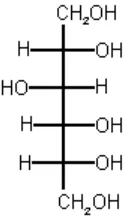
2. Sorbitol
makanan dan minuman rendah kalori. Struktur dari sorbitol dapat dilihat pada Gambar 3 :
Gambar 3. Struktur Sorbitol
III. METODE PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Biokimia dan Laboratorium Instrumentasi Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung, pada bulan September 2009 sampai dengan April 2010.
B. Alat dan Bahan
Alat- alat yang digunakan pada penelitian ini antara lain inkubator, laminar air flow, autoklaf (speed clave) model S-90N, shaker (orbit environ shaker), jarum ose, sentrifuse dingin (cold plate), tabung sentrifuga, pH meter, penangas air, lemari pendingin, termometer, neraca analitik, kolom kromatografi, spektrofotometer UV-Vis, dan peralatan umum laboratorium lainnya.
Mikroorganisme yang digunakan pada penelitian ini adalah jenis bakteri, yaitu Bacillus subtilis ITBCCB148 yang diperoleh dari Laboratorium Mikrobiologi dan
Teknologi Fermentasi ITB.
C. Prosedur Penelitian
1. Pembuatan Pereaksi
a. Pembuatan Peraksi Untuk Pengukuran Aktivitas α-amilase Metode Fuwa
(1.) Larutan KI : Kedalam labu takar 100 mL, sebanyak 2 gram KI dilarutkan dalam 10 mL aquades, ditambahkan 0,2 gram I2, lalu ditambahkan aquades hingga tanda batas.
(2.) Larutan pati : Kedalam labu takar 100 mL,sebanyak 0,1 gr pati dilarutkan dalam 100 mL aquades, dipanaskan hingga larut.
b. Pembuatan Pereaksi Untuk Pengukuran Aktivitas α-amilase Metode Mandels
19
c. Pembuatan Pereaksi Untuk Pengukuran Kadar Protein Metode Lowry
1.) Pereaksi A : 2 gram Na2CO3 dilarutkan dalam 100 ml NaOH 0,1 N
(2.) Pereaksi B : 5 ml larutan CuSO4.5H2O 0,1 % ditambahkan ke dalam 5 ml larutan Na(K)tartarat 1%
(3.) Pereaksi C : 100 ml pereaksi A dan 2 ml pereaksi B (4.) Pereaksi D : reagen Folin-Ciocelteau diencerkan dengan aquades dengan perbandingan 1:1
(5.) Larutan standar : larutan BSA (Bovine Serum Albumin) diencerkan hingga mengandung 0.100 –
0.250 mg/ml.
2. Produksi enzim α-amilase
Media inokulum dan media fermentasi yang digunakan adalah media yang mengandung yeast ekstrak 0,5%, pati 0,5%, KH2PO4 0,05%, MgSO4.7H2O 0,02%, dan CaCl2.2H2O 0,01% yang dilarutkan dalam akuades. Media disterilisasi pada suhu 1210C, tekanan 1 atm, selama ± 15 menit dalam autoklaf. Bacillus subtilis ITBCCB148 dari media agar miring dipindahkan ke dalam
dipindahkan ke media fermentasi dengan kecepatan 150 rpm pada suhu 320C selama 72 jam (Yandri et al., 2000).
3. Isolasi dan Pemurnian Enzim α –amilase
A. Isolasi Enzim α-amilase
1. Sentrifugasi
Sentrifugasi merupakan tahap awal pemurnian enzim. Metode ini digunakan untuk memisahkan enzim ekstraseluler dari sisa-sisa sel. Sentrifugasi akan menghasilkan filtrat yang jernih dan endapan yang terikat kuat pada dasar tabung, yang kemudian dipisahkan secara manual.
Media fermentasi yang berisi Bacillus subtilis ITBCCB148 yang telah dikocok menggunakan shaker inkubator selama 72 jam disentrifugasi pada 5000 rpm, suhu 40C selama 20 menit. Filtrat yang diperoleh merupakan ekstrak kasar enzim yang selanjutnya dilakukan uji aktivitas amilase dengan metode Fuwa dan pengukuran kadar protein metode Lowry.
2. Pengujian aktivitas α-amilase dan kadar protein
21
a. Pengujian aktivitas α-amilase metode Fuwa
Aktivitas enzim α-amilase ditentukan oleh metode Fuwa (Fuwa, 1954).
Sebanyak 250 µ L enzim ditambahkan 250 µL larutan pati 0,1%, dan diinkubasi pada suhu 600C selama 10 menit. Reaksi dihentikan dengan menambahkan 250 µ L HCl 1 N dan kemudian ditambahkan 250 µ L larutan KI dan 4 mL aquades kedalam tabung reaksi. Uji ini positif bila menghasilkan larutan kompleks berwarna kuning, kemudian absorbansi diukur dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 600 nm. Kontrol dibuat dengan cara yang sama tetapi menggunakan enzim yang sudah diinaktifkan.
b. Pengujian aktivitas α-amilase Metode Mandels
c. Penentuan kadar protein metode Lowry
Kadar protein enzim ditentukan dengan metode Lowry et al (1951). Sebanyak 0,1 mL enzim ditambahkan 0,9 mL akuades lalu direaksikan dengan 5 mL pereaksi C, lalu campuran diaduk secara merata dan dibiarkan selama 10 menit pada suhu kamar. Setelah itu ditambahkan dengan cepat 0,5 mL pereaksi D dan diaduk dengan sempurna, didiamkan selama 30 menit pada suhu kamar. Untuk kontrol, enzim diganti dengan 1 mL akuades, selanjutnya perlakuannya sama seperti sampel. Serapan diukur menggunakan spektrofotometer UV-VIS pada 750 nm. Untuk menentukan konsentrasi protein enzim digunakan kurva standar BSA (Bovine Serum Albumin)
4. Pemurnian Enzim
a. Fraksinasi dengan Amonium Sulfat [(NH4)2SO4]
23
dengan amonium sulfat ini, kemudian diuji aktivitasnya dengan metode Fuwa dan kadar proteinnya dengan metode Lowry.
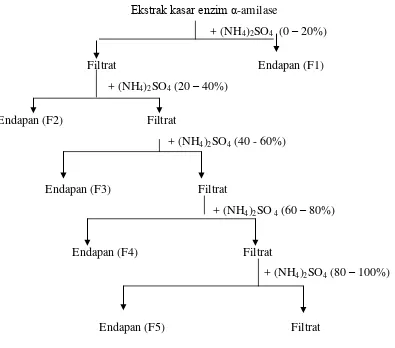
Skema proses fraksinasi dengan penambahan garam amonium sulfat dijelaskan pada Gambar 4.
Ekstrak kasar enzim α-amilase
+ (NH4)2SO4 (0 – 20%)
Filtrat Endapan (F1) + (NH4)2SO4 (20 – 40%)
Endapan (F2) Filtrat
+ (NH4)2SO4 (40 - 60%)
Endapan (F3) Filtrat
+ (NH4)2SO 4 (60 – 80%)
Endapan (F4) Filtrat
+ (NH4)2SO4 (80 – 100%)
Endapan (F5) Filtrat
b. Dialisis
Endapan enzim yang telah dilarutkan dari tiap fraksi amonium sulfat yang mempunyai aktivitas yang tinggi, dimasukkan dalam kantung selofan dan didialisis dengan bufer pospat pH 6; 0,01 M selama 40 jam dengan menggunakan stirer dalam suhu dingin. Kemudian hasil dialisis diuji aktivitas enzim dengan menggunakan metode Fuwa dan kadar proteinnya ditentukan dengan menggunakan metode Lowry.
c. Kromatografi Kolom
Proses kromatografi yang dilakukan adalah kromatografi penukar ion dengan menggunakan CMC. Proses pengerjaannya
sebagai berikut :
a. Pengembangan gel
CMC disuspensikan dalam akuades dan dibiarkan mengembang pada suhu kamar. Partikel halus dibuang dengan cara dekantasi. Setelah itu ditambahkan NaOH 0,5 M dan HCl 0,5 M kemudian distabilkan dengan buffer awal.
b. Penentuan buffer awal
25
buffer yang sesuai, diaduk 5-10 menit. Campuran selanjutnya di dekantasi dan diuji aktivitas enzimnya.
c. Penentuan buffer elusi
Penentuan buffer elusi dilakukan sama seperti di atas. Setelah CMC distabilkan menggunakan buffer pospat 0,1 M dan kemudian ke dalam masing – masing tabung ditambah 0,5 mL enzim, kemudian masing-masing tabung dielusi dengan buffer pospat dengan pH yang divariasikan, di aduk 5-10 menit. Campuran tersebut selanjutnya dibiarkan hingga CMC mengendap dan supernatan didekantasi dan diuji aktivitas enzimnya.
d. Pembuatan kolom gel
Pembuatan kolom gel dilakukan dengan membubuhi wool glass dibagian bawah. Kolom dipasang tegak lurus, kemudian gel yang telah disetimbangkan dimasukkan ke dalam kolom dengan bantuan batang pengaduk dan diusahakan jangan sampai ada gelembung udara di dalam kolom. Kran pengatur tetesan dibuka sedemikian rupa sehingga kecepatan tetes 15-20 mL/jam.
e. Penempatan cuplikan ke dalam kolom
Cuplikan (larutan enzim) diteteskan ke permukaan kolom secara perlahan-lahan.
f. Penampungan eluen
g. Pengukuran eluen
Pengukuran eluen dilakukan dengan spektrofotometer pada panjang gelombang 280 nm, selanjutnya absorbansi setiap fraksi diplotkan terhadap nomor fraksi.
h. Pengukuran aktivitas enzim
Setiap fraksi pada pola protein yang diperoleh dari pengukuran eluen di atas ditentukan aktivitasnya. Semua fraksi yang menunjukkan aktivitas enzim dikumpulkan menjadi satu, lalu ditentukan aktivitas unit dan aktivitas spesifiknya.
5. Karakterisasi Enzim
a. Penentuan Suhu Optimum Sebelum Penambahan Poliol
Untuk mengetahui temperatur optimum kerja enzim dilakukan dengan variasi suhu antara 55, 60, 65, 70, 75, dan 80oC, kemudian dilakukan pengukuran aktivitas enzim dengan metode Fuwa.
b. Penentuan pH Optimum Sebelum Penambahan Poliol
27
c. Penentuan Nilai KM dan VMaks Enzim Sebelum penambahan Poliol
Nilai KM dan VMaks enzim yang telah dimurnikan ditentukan dengan memvariasikan konsentrasi substrat yaitu 0,1; 0,2; dan 0,4, 0,6, 0,8
dan 1%. Dengan menggunakan data hasil penentuan pH dan suhu optimum, dilakukan pengukuran aktivitas enzim dengan metode Mandels. Kemudian data diplotkan kedalam kurva Lineweaver-Burk untuk penentuan nilai KM dan VMaks.
d. Penentuan pH optimum setelah penambahan poliol
e. Penentuan Suhu Optimum Setelah Penambahan Poliol
Larutan poliol ditambahkan pada enzim hasil pemurnian dengan perbandingan 1 : 1, ( enzim : poliol) untuk konsentrasi poliol masing–masing
0,5M; 1M; 1,5 M. Selanjutnya sebanyak 250 µL campuran enzim–poliol, kemudian di inkubasi selama 10 menit pada suhu 55, 60, 65, 70, 75 dan 800C dalam waterbath. Reaksi dihentikan dengan menambahkan 250 µL HCl 1 N dan ditambahkan 250 µL larutan KI dan 4 ml aquades. Sebagai kontrol, enzim yang telah diinaktifkan diinkubasi pada suhu dan waktu yang sama.
f. Penentuan Km dan Vmaks Setelah Penambahan Poliol
Nilai KM dan VMaks enzim setelah penambahan poliol ditentukan dengan memvariasikan substrat yaitu 0,1; 0,2; 0,4; 0,6; 0,8; dan 1% . Dengan menggunakan data hasil penentuan pH dan suhu optimum enzim setelah penambahan poliol, aktivitas enzim ditentukan dengan metode Mandels. Kemudian data diplotkan ke dalam kurva Lineweaver – Burk untuk penentuan nilai KM dan VMaks.
g. Uji stabilitas termal enzim (Yang et al., 1996)
29
Aktivitas awal enzim (tanpa perlakuan) di beri nilai 100%.
Aktivitas sisa = Aktivitas enzim setelah perlakuan x 100%
Aktivitas enzim awal (tanpa perlakuan)
(Virdianingsih, 2002)
V. SIMPULAN DAN SARAN
A. Simpulan
Dari hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa:
1. Enzim -amilase hasil pemurnian memiliki pH optimum 6 dan suhu optimum 60 oC. Nilai Km enzim hasil pemurnian adalah 3,99 mg/mL substrat dan harga Vmaks sebesar 3,89mol/mL menit.
2. Aktivitas spesifik enzim α-amilase hasil pemurnian 12.000 U/mg, meningkat 30 kali dibandingkan dengan ekstrak kasar yang memiliki aktivitas spesifik sebesar 393 U/mg.
3. Penambahan sorbitol pada enzim hasil pemurnian tidak menyebabkan perubahan pH dan suhu optimum. Enzim setelah penambahan sorbitol 0,5M mempunyai nilai KM = 1,98 mg mL-1 substrat, Vmaks = 1,19 mol mL-1 menit -1
, sorbitol 1M, KM = 1,86 mg mL-1 substrat, Vmaks = 1,44 mol mL-1 menit-1, sorbitol 1,5M, KM = 1,35 mg mL-1, Vmaks = 3,93 mol mL-1 menit-1.
1,75 mg mL-1 substrat, Vmaks = 1,41 mol mL-1 menit-1, gliserol 1,5M, KM = 2,15 mg mL-1 substrat, Vmaks = 1,71 mol mL-1menit -1.
5. Uji stabilitas termal enzim setelah penambahan sorbitol 0,5M; 1M; 1,5M pada pH 6 dan suhu 600C selama 60 menit masih memiliki aktivitas sisa berturut-turut adalah 16,96%; 33,22%; dan 41,69%. Enzim dengan penambahan sorbitol 0,5 M mempunyai t1/2 = 28,39 menit; ki = 0,02λ, ΔGi = 103,010 kJ mol-1; sorbitol 1M mempunyai t1/2 = 38,50 menit; ki = 0,018, ΔGi = 104,330 kJ mol-1, sorbitol 1,5M mempunyai t1/2 = 43,31 menit; ki = 0,016, ΔGi = 104,657 kJ mol-1.
6. Uji stabilitas termal enzim setelah penambahan gliserol 0,5M; 1M; 1,5M pada pH 6 dan suhu 600C selama 60 menit memiliki aktivitas sisa berturut-turut adalah 14,16%; 14,16%; 24,79%. Enzim dengan penambahan gliserol 0,5M dan 1M mempunyai t1/2 = 21,00 menit, ki = 0,033, ΔGi = 102,652 kJ mol-1, gliserol 1,5M mempunyai t1/2 = 27,72 menit, ki = 0,025, ΔGi = 103,421 kJ mol-1.
7. Penambahan poliol untuk enzim α-amilase dari Bacillus subtilis dapat meningkatkan stabilitas termal. Penurunan nilai ki, peningkatan waktu paruh dan ΔGi menunjukkan bahwa enzim dengan penambahan poliol lebih stabil
53
B. Saran
Dari hasil penelitian yang diperoleh, disarankan untuk menggunakan poliol jenis lain selain sorbitol dan gliserol atau dengan metode peningkatan stabilitas yang lain.
Oleh
EVILIA ARIYANTI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS Pada
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Judul : STUDI PENGARUH PENAMBAHAN POLIOL
TERHADAP STABILITAS ENZIM α-AMILASE DARI Bacillus subtilis
Nama : Evilia Ariyanti NPM : 0317011042 Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi pembimbing
Pembimbing I Pembimbing II
Dr. Ir. Yandri A.S., M.S Nurhasanah, M.Si
NIP 195609051992031001 NIP
2. Ketua Jurusan
STUDI PENGARUH PENAMBAHAN POLIOL TERHADAP
STABILITAS
TERMAL ENZIM α
-AMILASE DARI
Bacillus subtilis ITBCCB148
(Skripsi)
Oleh
Evilia Ariyanti
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
PENDIDIKAN FORMAL (SD s.d S1)
Tahun 2003 – 2010 : Jurusan Kimia FMIPA, Universitas Lampung
Periode 2005-2006 : Anggota Biro Usaha Mandiri HIMAKI UNILA
NAMA
: Evilia Ariyanti
Tempat, Tanggal Lahir : Bukit kemuning, 9 Januari 1986 Jenis Kelamin : Perempuan
Agama : Islam
Status Penikahan : Belum menikah Tinggi / Berat Badan : 167 cm/ 65 Kg Kewarganegaraan : Indonesia Alamat Rumah
Telp.
: Jl. Lintas sumatera No.77 Bukit kemuning Lampung Utara 34556
Alamat Saat Ini Telp.
: Jl. Sutan Jamil No 12 kedaton Bandar Lampung 35144.
No. HP : 081957127271
ASISTEN PRAKTIKUM YANG PERNAH DIJABAT
HOBI
PELATIHAN YANG PERNAH DIIKUTI
Studi pengaruh penambahan poliol terhadap stabilitas termal enzim α-amilase dari Bacillus subtilis ITBCCB148
Kimia Dasar I dan 2 untuk Fakultas Pertanian Biokimia untuk Fakultas Pertanian
RIWAYAT HIDUP
Penulis dilahirkan di Bukit Kemuning pada tanggal 9 Januari 1986 yang merupakan anak kedua dari tiga bersaudara buah hati pasangan Bapak Drs. Suroso dan Ibu Siti Zubaidah S.Pd.
Penulis memulai pendidikannya di TK PGRI 1 Bukit Kemuning pada tahun 1990. Pendidikan Sekolah Dasar diselesaikan pada tahum 1997 di SD Negeri 1 Sukamenanti kecamatan Bukit Kemuning. Kemudian dilanjutkan ke jenjang Sekolah Lanjutan Tingkat Pertama di SLTP Negeri 3 Bukit Kemuning dan lulus pada tahun 2000. Penulis menamatkan Sekolah Menengah Umum di SMU Negeri 1 Bukit Kemuning pada tahun 2003.
Pada tahun 2003 penulis diterima di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung melalui jalur SPMB. Selama menjadi mahasiswa, penulis pernah menjadi asisten Kimia Dasar 1 dan Kimia Dasar II serta Biokimia I untuk Fakultas Pertanian Universitas Lampung.
“
Dia mengetahui apa yang ada di
langit dan di bumi, dan mengetahui apa yang kamu rahasiakan
dan apa yang kamu nyatakan. Dan Allah Maha Mengetahui
segala isi hati
”
(QS. At-Tagabun 4)
“
Every adversity, every failure, every heartache,
carries with it the seed on
equal or gerater benefit
”
(Anonim)
“orang yang berani menghadapi kegagalan adalah
orang yang pernah mencapai kebesaran
”
Dengan Rahmat Allah Yang Maha Kuasa
Kupersembahkan Karya Kecilku ini Kepada:
Mama Terhebat dan Papa Terhormat, sebagai tanda bakti, kasih sayang dan tanggung
jawabku atas segala Doa dan pengorbanan yang telah diberikan.
Mbak Yulis Tiana Evayanti dan Adek Dimash Septian Adi Putra tersayang
Seluruh keluarga besarku
Yang selalu mendoakanmu keberhasilanku,
Almamater
DAFTAR ISI
Halaman
DAFTAR TABEL……….. v
DAFTAR GAMBAR ... vi
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA Enzim ... 5
Enzim Amilase ... 6
Isolasi dan Pemurnian Enzim ... 7
Kinetika Reaksi Enzim ... 10
Stabilitas Enzim ... 12
Bacillus Subtilis ... 13
Senyawa aditif enzim... 14
METODE PENELITIAN Tempat dan Waktu Penelitian ... 17
Alat dan Bahan ... 17
Prosedur Penelitian ... 18
Pembuatan Pereaksi ... 18
Pembuatan Pereaksi untuk Pengukuran Aktivitas α – Amilase
Metode Mandels ... 18
Pembuatan Pereaksi untuk Pengukuran Kadar Protein Metode Lowry ... 19
Produksi enzim α-amilase... 19
Isolasi dan Pemurnian Enzim ... 20
Isolasi enzim α-amilase ... 20
Sentrifugasi……….. 20
Pengujian aktivitas α-amilase dan kadar protein ... 20
Pengujian aktivitas α-amilase metode Fuwa……… 21
Penentuan Km dan Vmaks Enzim Setelah Penambahan
Fraksinasi dengan ammonium sulfat ... 32
Dialisis ... 33
Kromatografi kolom penukar ion dengan menggunakan CMC ... 34
Karakterisasi enzim α-amilase sebelum dan sesudah Penambahan poliol ... 36
Penentuan pH optimum enzim hasil pemurnian... 36
Penentuan suhu optimum enzim hasil pemurnian ... 37
Penentuan KM dan Vmaks enzim hasil pemurnian ... 39
Penentuan pH optimum setelah penambahan sorbitol dan gliserol ... 40
Penentuan suhu optimum setelah penambahan sorbitol dan gliserol ... 42
Penentuan KM dan Vmaks setelah penambahan sorbitol dan gliserol ... 43
Stabilitas termal enzim hasil pemurnian dan enzim setelah Penambahan sorbitol dan gliserol ... 46
Konstanta laju inaktivasi termal (ki), waktu paruh (t1/2), dan perubahn energi akibat denaturasi (ΔGi) enzim hasil pemurnian dan enzim setelah penambahan sorbitol dan gliserol ... 48
Waktu paruh (t1/2) ... 49
Perubahan energi akibat denaturasi (ΔGi) ... 49
KESIMPULAN DAN SARAN Simpulan ... 51
Saran ... 53
DAFTAR PUSTAKA ... 54
LAMPIRAN ... 56
Halaman Tabel
1. Pemurnian enzim α-amilase dari Bacillus subtilis ... 36 2. Nilai konstanta laju inaktivasi termal (nilai ki), waktu paruh (t1/2),
dan perubahan energi akibat denaturasi (ΔGi) enzim hasil pemurnian
dan sesudah penambahan poliol (0,5M; 1M; 1,5M) ... 48 3. Hubungan antara kejenuhan amonium sulfat dengan aktivitas
spesifik α-amilase……… 57
4. Pola Protein (A280nm) dan aktivitas unit (U/mL) enzim α-amilase dari Bacillus subtilis ITBCCB148 terhadap nomor fraksi pada
hasil kromatografi kolom penukar ion CMC……….. 57
5. Hubungan antara pH dengan aktivitas enzim α-amilase
hasil pemurnian……… 58
6. Hubungan antara suhu dengan aktivitas enzim α-amilase
hasil pemurnian……… 58
7. Hubungan antara aktivitas (U mL-1) enzim α-amilase hasil
pemurnian dengan konsentrasi substrat……….. 59 8. Penentuan pH optimum enzim α-amilase setelah penambahan
sorbitol 0,5 M; 1M; 1,5M……… 5λ
9. Penentuan pH optimum enzim α-amilase setelah penambahan
gliserol 0,5M; 1M; 1,5M………. 60
10. Penentuan suhu optimum enzim hasil pemurnian setelah
penambahan sorbitol 0,5M; 1M; 1,5M……….. 60
11. Penentuan suhu optimum enzim hasil pemurnian setelah
penambahan gliserol 0,5M; 1M; 1,5M……….. 61
12. Hubungan antara aktivitas (U mL-1) enzim α-amilase setelah penambahan sorbitol 0,5M; 1M; 1,5M dengan
13. Hubungan antara aktivitas (U mL-1) enzim α-amilase setelah penambahan gliserol 0,5M; 1M; 1,5M dengan
konsentrasi substrat……….. 61 14. Hubungan antara aktivitas unit (U mL-1) enzim α-amilase
hasil pemurnian dan setelah penambahan sorbitol 0,5M; 1M; 1,5M
terhadap stabilitas termal ………. 62
15. Hubungan antara aktivitas sisa (%) enzim hasil pemurnian dan setelah penambahan sorbitol 0,5M; 1M; dan 1,5M
terhadap stabilitas termal ……….. 63 16. Hubungan antara aktivitas unit (U mL-1) enzim hasil
pemurnian dan setelah penambahan gliserol 0,5M; 1M; dan 1,5M
terhadap stabilitas termal ………. 63 17. Hubungan antara aktivitas sisa (%) enzim hasil pemurnian
dan setelah penambahan gliserol 0,5M; 1M dan 1,5M
terhadap stabilits termal ……….. 64 18. Penentuan nilai ki ( konstanta laju inaktivasi termal) enzim
hasil pemurnian pada suhu 600C ………. 64 19. Penentuan nilai ki (konstanta laju inaktivasi termal) enzim
setelah penambahan sorbitol 0,5M pada suhu 600C ……… 65 20. Penentuan nilai ki (konstanta laju inaktivasi termal) enzim
setelah penambahan sorbitol 1M pada suhu 600C ………... 65 21. Penentuan nilai ki (konstanta laju inaktivasi termal) enzim
setelah penambahan sorbitol 1,5M pada suhu 600C ……… 65 22. Penentuan nilai ki (konstanta laju inaktivasi termal) enzim
setelah penambahan gliserol 0,5M pada suhu 600C ……… 65 23. Penentuan nilai ki (konstanta laju inaktivasi termal) enzim
setelah penambahan gliserol 1M pada suhu 600C ……… 66 24. Penentuan nilai ki (konstanta laju inaktivasi termal) enzim
setelah penambahan gliserol 1,5M pada suhu 600C ……… 66 25. Absorbansi glukosa pada berbagai konsentrasi untuk
penentuan kurva standar glukosa ………. 69
26. Absorbansi serum albumin sapi (BSA) pada berbagai
4. Skema Proses Fraksinasi Enzim dengan Penambahan
AmoniumSulfat ... 23 5. Diagram Alir Penelitian ... 30 6. Hubungan antara kejenuhan ammonium sulfat dengan
aktivitas spesifik enzim α-amilase
7. Kromatogram enzim α-amilase dari Bacillus subtilis
ITBCCB148 pada kolom CMC... 34 8. Hubungan antara pH dengan aktivitas enzim α-amilase
hasil pemurnian ………. 36 9. Hubungan antara suhu dengan aktivitas enzim α-amilase
hasil pemurnian ………... 38 10. Kurva Lineweaver-Burk enzim α-amilase hasil pemurnian …………... 39 11. pH optimum enzim hasil pemurnian dan enzim setelah
penambahan Sorbitol 0,5M; 1M dan 1,5M ………... 40
12. pH optimum enzim hasil pemurnian dan enzim setelah
penambahan Gliserol 0,5M; 1M; dan 1,5M ……….. 41
13. Suhu optimum enzim hasil pemurnian dan setelah
penambahan sorbitol 0,5M; 1M dan 1,5M ……… 42
14. Suhu optimum enzim hasil pemurnian dengan enzim
15. Kurva Lineweaver-Burk enzim setelah penambahan
sorbitol 0,5M; 1M; 1,5M ………... 44 16. Grafik Lineweaver-Burk enzim setelah penambahan
gliserol 0,5M; 1M; 1,5M ………. 45 17. Stabilitas enzim hasil pemurnian dan enzim setelah
penambahan sorbitol (0,5M; 1M; 1,5M) ………. 46 18. Stabilitas termal enzim hasil pemurnian dan enzim
setelah penambahan gliserol (0,5M; 1M; 1,5M) ……….... 47 19. ln (Ei/E0) terhadap waktu enzim hasil pemurnian
dengan enzim setelah penambahan gliserol 0,5M; 1M; 1,5M…………. 67
20. Kurva standar glukosa ………. 69 21. Kurva standar serum albumin sapi ……….. 70
DAFTAR PUSTAKA
Ahern T. J,, and A. M. Klibanov. 1987. Why Do Enzym Irreversibly Inactive at Hight Temperature. Biotec. I. Microbial Genetic Engineering and Enzyme Technology. Gustav Fischer. Stutgart. New York. PP. 131 – 136.
Bollag, D. M., Rozycki, M. D., and Edelstein, S. J. 1996. Protein Methods. 2nded. John Wiley and Sons, Inc., Publiction, New York.
Brock, T. D. 1979. Biology of Mycroorganism. 3rd Edition. Pentice Hall inc. New Jersey. Eijnsink, G. H., Sigrit, G., Torben, V. and Bertus van de Burg. 2005. Directed Evolution of
Enzyme Stability. Biomolecular Engineering. Elsevier Science Inc. New York. Fuwa, H. 1954. A New Method For Microdetermination of Amylase Activity by The Use of
amylase As The Subsratre. J. Biochem. Tokyo.
Girindra, Aisjah. 1993. Biokimia 1. Gramedia pustaka utama. Jakarta.
Gupte, S. 1990. Mikrobiologi Dasar. Alih Bahasa oleh Dr. Julius E. S. Binarupa Aksara. Jakarta.
Illanes, A. 1999. Stability of Biocatalysts. EJB Electronic Journal of Biotechnology. Universuaded Catolica de Valparaiso. Chille. Volume 2 (1).
Judoamidjojo, R. M,. Gumbira, S, E,, Hartoto, L. 1989. Biokonversi. Depdikbud Dirjen Dikti. PAU Bioteknologi IPB. Bogor.
Kazan, D., Haluk, dan E., Altan, E. 1996. Stabilization of Penicilin G Aclyase Againts pH by Chemical Cross- Linking. Process Biochemistry Vol. 31. No. 2. pp. 135 – 140. Larone, D. H. 2002. Medically Important Fungi. 4th ed. P 166. ASM Press. Washington Dc. Lehninger, A. L. 1982. Dasar – Dasar Biokimia. Alih Bahasa Oleh Maggy Thenawijaya.
Erlangga. Jakarta. 369 halaman.
Lowry, O.H., N.J., Rosebrough, A.L., Farr, R.J. Randall. 1951. Protein Measurement With the Folin Phenol Reagent, J. Biol. Chem. 193-265.
Mandels, M., A. Raymond, R. Charles. 1976. Measurement of Saccharifiying Cellulase. Biotech & Bioeng. Symp. No6. John Wiley & Sons Inc.
55
Sariningsih, R. 2000. Produksi Enzim Protease oleh Bacillus subtilis BAC-4. Skripsi. ITB. Bandung.
Schomburg, D dan Salzmann, M. 1991. Enzyme Handbook 4. Springer. Verlag Berlin Heidelberg. Germany.
Scopes, R.K. 1984. Protein Purification Principles and Practice. Springer- Verlag. New York. 282 hlm.
Seriaty, J. 1991. Pengaruh Penggunaan Aditif Terhadap Kestabilan Protease Bacillus Stearothermophilus Selama Penyimpanan. Skripsi IPB. Bogor.
Smith, J. E. 1990. Prinsip Bioteknologi. Diterjemahkan oleh U. F. Sumo, B. Sumantri, dan Subono. Penerbit gramedia. Jakarta.
Suhartono, M. T. 1989. Enzim dan Bioteknologi. Departemen Pendidikan dan Kebudayaan Dirjen DIKTI, PAU Bioteknolodi IPB. Bogor. 322 halaman
Suriawira, U. 1986. Pengantar Mikrobiologi Umum. Penerbit Angkasa. Bandung. Tarigan, P. 1988. Teknologi Fermentasi. PAU Bioteknologi ITB. Bandung. Toha, Abdul Hamid. 2001. Biokimia : Metabolisme Molekul. Alfabeta. Bandung.
Virdianingsih, R. 2002. Mempelajari Stabilitas Termal Enzim dari Bacillus pumilus yl dalam Pelarut Heksana, Toluena, dan Benzena. Skripsi IPB. Bogor.
Walsh, G., and D.R. Headon. 1994. Protein Biotechnology. John Wiley and Sons. New York
Winarno, F.G.1986. Enzim Pangan. PT. Gramedia Pustaka Utama. Jakarta.
Wirahadikusumah, M. 1997. Biokimia Protein, Enzim, dan Asam Nukleat. ITB Press. Bandung. 91 halaman.
Wulandari, P. 2008. Studi Pengaruh Penambahan Poliol Terhadap Stabilitas Termal Enzim α-amilase dari Rhizopus oryzae. Skripsi. Universitas Lampung. Bandar Lampung.
Yandri, A.S., M. Sindumarta, S. Soemitro dan Kosasih. 2000. Isolasi, pemurnian dan karakterisasi enzim α-amilase termostabil dari bakteri local Bacillus sp. B. 148, Prosiding Kimia Bersama ITB-UKM keempat, Bandung.
Yandri, A.S., 2004. Karakterisasi dan Modifikasi Kimia α-Amilase dari Bakteri Isolat Lokal Bacillus subtilis ITBCCB148. Disertasi. Institut Teknologi Bandung. Bandung.
www.wikipedia.org. Diakses pada tanggal 5 Desember 2007
Judul Skripsi : STUDI PENGARUH PENAMBAHAN POLIOL TERHADAP STABILITAS
ENZIM α-AMILASE DARI Bacillus subtilis ITBCCB148 Nama Mahasiswa : Evilia Ariyanti
Nomor Pokok Mahasiswa : 0317011042
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi Pembimbing
Dr.Ir. Yandri A.S., M.S Nurhasanah, M.Si
NIP. 131996794 NIP. 131804068
2. Ketua Jurusan
SANWACANA
Segala puji bagi Allah SWT yang telah menjadikan ilmu sebagai sifat kesempurnaan yang paling tinggi. Alhamdullillah, atas rahmat dan hidayah-Nya lah penulis dapat menyelesaikan skripsi yang berjudul :
STUDI PENGARUH PENAMBAHAN POLIOL TERHADAP STABILITAS TERMAL ENZIM ά- AMILASE DARI Bacillus Subtilis ITBCCB148
Dalam menyelesaikan skripsi ini penulis tidak luput dari bantuan dan bimbingan dari berbagai pihak. Dalam kesempatan ini, penulis ingin mengucapkan terima kasih kepada :
1. Bapak Dr. Ir Yandri A.S, M.S, selaku pembimbing I atas kesediaan dan kesabarannya meluangkan waktu dan memberikan bimbingan,nasehat, saran dan kritik dalam proses penyelesaian skripsi.
2. Ibu Nurhasanah, M.Si, selaku pembimbing II yang telah meluangkan waktu, memberikan bimbingan, motivasi dan saran selama penelitian.
3. Ibu Dian Herasari M.Si selaku pembahas atas saran dan kritik untuk kesempurnaan penulisan skrpsi ini.
4. Bapak Rudy TM Situmeang, M.Sc, selaku pembimbing akademik atas saran dan dukungan dalam membimbing penulis selama ini.
7. Mama “Terhebat” dan Papa “Terhormat” atas segala doa, kasih sayang, nasehat, materi, kesabaran serta cinta kasih yang tiada henti yang diberikan untuk keberhasilanku. Terima kasih dan maaf yang tak terhingga Aku ucapkan.
8. Mba Yulis Tiana Evayanti S.ST (terima kasih buat semuanya mbak) dan kak Dede, dek Dimash Septian Adi Putra serta keponakanku yang lucu Keysha yang selalu memberikan keceriaan, semangat, doa yang tiada henti untuk keberhasilanku. 9. Sahabat-sahabatku Indah Shofa Marwa S.Si, Pretty Wulandari S.Si, dan Beta
Ruziyani S.Si yang telah banyak membantu selama penelitian, terima kasih atas waktu, cerita, dukungan, kebersamaan, motivasi dan keceriaan yang mampu menghilangkan kepenatanku.
10. Teman-teman seperjuangan di Biokimia, Apriyanti S.Si, Devi, Endah Ratna Sari S.Si, Nina, Ferali, Nurdiana S.Si, Arsepti Wulandari S.Si terima kasih atas semua bantuan, dukungan dan kebersamaannya.
11. Teman-teman 2003 yang tersisa Ria urian, Misbahudinur S.Si , Rido Mirfan S.Si, Ronald, Yan Ricki, dan Septian Eri Sadewo S.Si. Terima kasih untuk semua bantuan dan kebersamaannya.
13. Teman- teman Kostan “Srikandi”, Reta, Tina, mbak Lupi, terima kasih atas kebersamaan, keceriaan, semangat yang diberikan selama ini.
14. Semua pihak tidak dapat disebutkan satu persatu, terimakasih atas segala bantuan dan dukungannya selama ini.
Semoga Allah SWT membalas segala kebaikan yang telah diberikan. Penulis menyadari tulisan ini jauh dari sempurna, untuk itu masukan-masukan positif sangat diharapkan untuk kemajuan di masa mendatang. Penulis berharap skripsi ini dapat bermanfaat bagi semua. Amin.
Bandar Lampung, Agustus 2010 Penulis
Evilia Ariyanti