( System of Rice Intensification )
ARUM ASRIYANTI SUHASTYO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Studi Mikrobiologi dan Sifat Kimia Mikroorganisme Lokal (MOL) yang digunakan pada Budidaya Padi
Metode SRI (System of Rice Intensification) adalah karya saya dengan arahan dari
komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
ARUM ASRIYANTI SUHASTYO. The study of Microbiology and Chemical Properties of Local Microorganisms (MOL) used in Rice Cultivation with the
Method of SRI (System of Rice Intensification). Supervised by ISWANDI ANAS,
DWI ANDREAS SANTOSA and YULIN LESTARI.
The use of local microorganism (MOL) liquid in the SRI method of rice cultivation developed in Indonesia starts early from the preparation of seedlings to vegetative phase, panicle formation and grain filling. MOL is a liquid that can be made from materials available around us such as a waste of vegetables, bamboo shoots, golden snails, maja fruit, gamal leaves, banana hump, cooked rice, urine of rabbits, etc. The liquid is generally given 10, 20, 30, 40 and 60 days after planting (DAP) or as needed. This study used the MOL liquid made from banana hump, golden snails and rabbit urine. The research objective was to determine the microbes, identify microbes, chemical properties and growth pattern microbes in the MOL of banana hump, golden snails and rabbit urine. The research was conducted at the Soil Biotechnology Laboratory of IPB starting from April 2010 to January 2011. It used a complete random design with one factor (time) and three replications. The results showed the patterns of microbial growth in the third MOL tends to decline after 7th day, while for fungi tended to decrease after 14th day. Azotobacter-like tend to increase after 7th day of fermentation. For
Azospirillum-like and MPF growth tends to decline after the 7th day and Cellulitic
Microbes growth tends to decline after 14th day of fermentation in the three types
of MOL. The results showed that the identification of microbial isolates by using
selective media NFB and NFM was not Azotobacter and Azospirillum , but is has
the characteristic and microbial properties such as Azotobacter and Azospirillum
so classified in Azotobacter-like and Azospirillum-like. The best fermentation time to obtain an optimum microbial population was in 7-14 days. The MOL of banana hump had a average the lowest pH value (4,2-4,5) and the highest EC value (10,44-12,82 µS/cm) during the fermentation process. The MOL of golden snail had a average the highest pH (4,5-6,55) and and the most oxidative-reductive Eh values [269- (-381) mV] during the fermentation process. The MOL of rabbit urine had the lowest average value of EC (2,18-2,23 µS/cm) and containes more elements of K, Ca, Mg, Cu, Zn, Fe and Mg than both of the other types of MOL. Further, Bacillus sp, Aeromonas sp, and Aspergillus niger were identified in the
MOL of banana hump. The MOL of golden snails contained Staphylococcus sp
and Aspergillus niger, whereas the MOL of rabbit urine had Bacillus sp,
Rhizobium sp, Pseudomonas sp, Aspergillus niger and Verticillium sp.
ARUM ASRIYANTI SUHASTYO. Studi Mikrobiologi dan Sifat Kimia Mikroorganisme Lokal (MOL) yang digunakan pada Budidaya Padi Metode SRI (System of Rice Intensification). Dibimbing oleh ISWANDI ANAS, DWI ANDREAS SANTOSA dan YULIN LESTARI.
SRI (System of Rice Intensification) merupakan salah satu metode
budidaya padi yang sedang dikembangkan oleh pemerintah sebagai salah satu upaya untuk meningkatkan produksi padi dalam rangka mempertahankan ketahanan pangan nasional. SRI menekankan pada manajemen pengelolaan tanah, tanaman dan air yang mampu meningkatkan produktivitas padi melalui pemberdayaan kelompok dan kearifan lokal yang berbasis pada kegiatan ramah lingkungan. Pada mulanya SRI dikembangkan di Madagaskar tahun 1984 dan pada tahun 1997 diperkenalkan di Indonesia. Budidaya SRI dapat menggunakan pupuk organik, anorganik maupun kombinasi antara pupuk organik dan anorganik.
Pada budidaya padi metode SRI penggunaan larutan MOL dilakukan sejak awal yaitu dari persiapan bibit, fase vegetatif, pembentukan malai sampai pengisian bulir padi. MOL merupakan cairan yang dapat dibuat dari limbah
sayuran, rebung, keong mas (Pomacea canaliculata), buah maja (Aegle
marmelos), limbah buah-buahan, daun gamal (Glirisida sepium), bonggol pisang, nasi, urin kelinci dan lain-lain. MOL mengandung unsur hara makro dan mikro dan juga mengandung mikrob yang berpotensi sebagai perombak bahan organik, perangsang pertumbuhan, dan sebagai agen pengendali hama penyakit tanaman. Berdasarkan kandungan yang terdapat dalam MOL tersebut, maka MOL dapat digunakan sebagai pendekomposer, pupuk hayati, dan sebagai pestisida organik terutama sebagai fungsida. Pada umunya para petani di berbagai daerah yang menggunakan metode SRI memberikan larutan MOL pada 10, 20, 30, 40 dan 60 hari setelah tanam (HST) atau sesuai kebutuhan. Hasilnya penggunaan dan pemberian larutan MOL mampu meningkatkan produksi padi serta meningkatkan
pula kesuburan tanah. Tujuan penelitian adalah untuk mengetahui,
mengidentifikasi mikrob serta sifat-sifat kimia dan pola pertumbuhan mikrob dalam MOL bonggol pisang, MOL keong mas dan MOL urin kelinci.
Penelitian ini dilakukan di Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian IPB sejak bulan April 2010- Januari 2011. Penelitian ini dilaksanakan dengan menggunakan rancangan acak lengkap (RAL) dengan dengan satu faktor (waktu) dan 3 ulangan. Selanjutnya penyeleksian berdasarkan nilai tengah tertinggi dari peubah menggunakan uji jarak berganda Duncan.
Hasil penelitian menunjukkan bahwa pola pertumbuhan mikrob pada ketiga MOL cenderung menurun setelah hari ke-7 sedangkan untuk fungi
cenderung menurun setelah hari ke-14. Azotobacter-like pada ketiga MOL
pertumbuhannya cenderung meningkat setelah hari ke-7 fermentasi. Untuk
dan Azospirillum-like. Waktu fermentasi terbaik sehingga dapat diperoleh populasi mikrob yang optimum adalah pada 7-14 hari. MOL bonggol pisang mempunyai rata-rata nilai pH terendah (4,2-4,5) dan nilai EC tertinggi (10,44-12,82 µS/cm) selama proses fermentasi. MOL keong mas mempunyai rata-rata nilai pH tertinggi (4,5-6,55) dan nilai Eh paling oksidatif-reduktif [269- (-381) mV] selama proses fermentasi. MOL urin kelinci mempunyai rata-rata nilai EC
terendah (2,18-2,23 µS/cm) dan mengandung unsur K2O, Ca, Mg, Cu, Zn, Fe dan
Mg lebih tinggi daripada kedua MOL yang lain. Pada MOL bonggol pisang teridentifikasi Bacillus sp, Aeromonas sp dan Aspergillus niger. Pada MOL keong mas teridentifikasi Staphylococcus sp dan Aspergillus niger, sedangkan pada MOL urin kelinci teridentifikasi Bacillus sp, Rhizobium sp, Pseudomonas sp,
Aspergillus niger dan Verticillium sp.
Kata kunci: Mikroorganisme Lokal (MOL), sifat kimia MOL, SRI (System of Rice
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
( System of Rice Intensification )
ARUM ASRIYANTI SUHASTYO
Tesis
Sebagai Salah Satu Syarat untuk Memperoleh gelar Magister Sains pada
Program Studi IlmuTanah
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Arum Asriyanti Suhastyo
NRP : A151080061
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Iswandi Anas, M.Sc. Ketua
Dr. Ir. Dwi Andreas Santosa, M.S. Dr. Ir. Yulin Lestari
Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Tanah
Dr. Ir. Atang Sutandi, M.Si. Dr. Ir. Dahrul Syah, MSc.Agr.
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang
berjudul “Studi Mikrobiologi dan Sifat Kimia Mikroorganisme Lokal (MOL)
yang digunakan pada Budidaya Padi Metode SRI (System of Rice Intensification)”
ini disusun sebagai salah satu syarat tugas akhir dalam mencapai gelar Magister Sains pada Program Studi Ilmu Tanah, Institut Pertanian Bogor.
Penulis menyampaikan rasa hormat dan terima kasih kepada Bapak Prof. Dr. Ir. Iswandi Anas, M.Sc., Bapak Dr. Ir. Dwi Andreas Santosa, M.S. dan Ibu Dr. Ir. Yulin Lestari selaku pembimbing yang banyak sekali memberikan arahan dan bimbingan sehingga penulisan karya ilmiah ini dapat diselesaikan. Terima kasih kepada Bapak Dr. Ir. Iman Rusmana, MSi yang telah bersedia menjadi penguji luar komisi. Terima kasih kepada Ditjen DIKTI Kementerian Pendidikan Nasional atas kesempatan yang diberikan kepada penulis dalam memperoleh beasiswa tugas belajar di Sekolah Pascasarjana IPB. Terima kasih kepada rekan-rekan penelitian Muchlis M Bakrie, S.P., Mila P Utami, S.P., serta kepada Bapak Togi R Hutabarat, S.P., Bapak Ir. Fakhrur Razie, M.Si, Bapak Sardjito, Ibu Asih Karyati, Ibu Julaeha, Enjelia, S.P., Sindy Marieta Putri, S.P., Yuli Ratna Pratiwi, S.P., Nesya Ayu Dewi, S.P., Dita Damayanti, S.P.,Richad Gunawan dan adik-adik Biotek atas bantuan dan kerjasamanya selama penelitian dan penulisan tesis berlangsung. Terima kasih kepada rekan-rekan Mayor Ilmu Tanah Angkatan 2008, Agroteknologi Tanah Angkatan 2008 dan Himpunan Mahasiswa Pascasarjana Ilmu Tanah atas kebersamaan yang terbina selama ini.
Pada kesempatan ini penulis juga ingin mengucapkan terima kasih kepada ayahanda Muchlas dan ibunda Sri Sudarsi, Mas Andung dan Mas Andin, Bapak dan Ibu Sabarno atas doa, dorongan dan motivasinya kepada penulis. Terima kasih kepada Mas Wawan atas doa, cinta, kesabaran, perhatian serta pengorbanan yang tulus.
Akhir kata, semoga tesis ini dapat bermanfaat bagi semua pihak yang terkait dan pihak-pihak yang membutuhkan informasi.
Bogor, Agustus 2011
Penulis dilahirkan di Banjarnegara, Jawa Tengah pada tanggal 10 Maret 1980, merupakan anak ketiga dari tiga bersaudara pasangan bapak Muchlas HS dan ibu Sri Sudarsi.
DAFTAR PUSTAKA ... 37
Halaman
1 Parameter penelitian, metode dan media tumbuh mikrob…... 14
2 Parameter dan metode/alat untuk analisis kimia……… 16
3 Kandungan unsur hara dan nisbah C/N MOL bonggol pisang,
MOL keong mas dan MOL urin kelinci………. 29
4 Identifikasi isolat mikrob dan fungi dari MOL bonggol pisang,
DAFTAR GAMBAR
Halaman
1 Diagram alir penelitian……… 17
2 Pola pertumbuhan mikrob total pada MOL bonggol pisang, MOL
keong mas dan MOL urin kelinci selama 21 hari... 18
3 Pola pertumbuhan fungi pada MOL bonggol pisang, MOL
keong mas dan MOL urin kelinci selama 21 hari... 20
4 Pola pertumbuhan Azotobacter-like pada MOL bonggol pisang,
MOL keong mas dan MOL urin kelinci selama 21 hari……….... 21
5 Pola pertumbuhan Azospirillum-like pada MOL bonggol pisang,
MOL keong mas dan MOL urin kelinci selama 21 hari……….... 23
6 Pola pertumbuhan Mikrob Pelarut Fosfat pada MOL bonggol
pisang, MOL keong mas dan MOL urin kelinci selama 21 hari… 24
7 Pola pertumbuhan Mikrob Selulolitik pada MOL bonggol pisang,
MOL keong mas dan MOL urin kelinci selama 21 hari………… 25
8 Nilai pH pada MOL bonggol pisang, MOL keong mas dan MOL
urin kelinci selama 21 hari……... 26
9 Nilai EC pada MOL bonggol pisang, MOL keong mas dan MOL
urin kelinci selama 21 hari……….. 27 10 Nilai Eh pada MOL bonggol pisang, MOL keong mas dan MOL
Halaman
1 Bahan dan komposisi media tumbuh mikrob yang dipergunakan
pada penelitian……… 43
2 Populasi mikrob total, fungi, Azotobacter-like, Azospirillum-like,
MPF dan Mikrob Selulolitik pada ketiga MOL………… 45
3 Analisis ragam populasi mikrob total, fungi, Azotobacter-like,
Azospirillum-like, MPF dan Mikrob Selulolitik pada MOL
bonggol pisang……… 46
4 Analisis ragam populasi mikrob total, fungi, Azotobacter-like,
Azospirillum-like, MPF dan Mikrob Selulolitik pada MOL keong
mas... 47
5 Analisis ragam populasi mikrob total, fungi, Azotobacter-like,
Azospirillum-like, MPF dan Mikrob Selulolitik pada MOL urin kelinci...
48
6 Sifat kimia urin kelinci, air sisa cucian beras, bonggol pisang dan
keong mas kering... 49 7 Nilai pH, EC, Eh MOL bonggol pisang, MOL keong mas dan
MOL urin kelinci... 49 8 Karakteristik dan identifikasi isolat bakteri dari MOL bonggol
pisang, MOL keong mas dan MOL urin kelinci... 50
9 Karakteristik dan identifikasi isolat fungi dari MOL bonggol
PENDAHULUAN
Latar Belakang
Komoditas tanaman pangan khususnya padi merupakan komoditas yang penting karena sebagian besar masyarakat Indonesia mengkonsumsi beras sebagai makanan pokok. Pemerintah telah banyak melakukan program dan kebijakan untuk meningkatkan produksi padi/gabah, diantaranya Program Bimas Gotong Royong, Pengelolaan Tanaman Terpadu (PTT) maupun kebijakan-kebijakan untuk menanam padi varietas unggul. Akan tetapi usaha-usaha tersebut masih perlu untuk ditingkatkan. Salah satu yang sekarang sedang dikembangkan adalah
metode budidaya SRI (System of Rice Intensification). SRI merupakan pendekatan
dalam teknik budidaya padi, yang menekankan pada manajemen pengelolaan tanah, tanaman dan air yang mampu meningkatkan produktivitas padi melalui pemberdayaan kelompok dan kearifan lokal yang berbasis pada kegiatan ramah lingkungan (Deptan, 2008).
Budidaya ini ditemukan oleh FR. Henri de Laulanie di Madagaskar pada tahun 1984 dan dikenalkan di Indonesia pada tahun 1997. Prinsip-prinsip dasar dari budidaya padi SRI adalah pindah tanam bibit berusia muda ( 8-10 hari setelah semai), ditanam sebanyak satu bibit per titik tanam dengan jarak tanam lebar 25 x 25 cm atau 30 x 30 cm, kondisi tanah lembab (tidak tergenang), penyiangan dilakukan sejak awal sekitar umur 10 hari diulang 2-3 kali dengan interval 10 hari, pemupukan dilakukan dengan pupuk anorganik, organik maupun kombinasi keduanya serta menganjurkan pemakaian bahan organik (kompos) (Berkelaar, 2001; Stoop et al, 2002).
Pada budidaya padi metode SRI penggunaan larutan MOL
(Mikroorganisme Lokal) dilakukan sejak awal yaitu dari persiapan bibit, fase vegetatif, pembentukan malai sampai pengisian bulir padi. MOL merupakan cairan yang dapat dibuat dari bahan-bahan yang ada disekitar kita seperti limbah
sayuran, rebung, keong mas (Pomacea canaliculata), buah maja (Aegle
Keunggulan penggunaan MOL yang paling utama adalah mudah dan murah. Petani dapat kreatif membuat MOL dengan memanfaatkan bahan-bahan yang ada disekitarnya. Cara membuat MOL mudah, bahan-bahan seperti limbah dapur, keong mas, urin kelinci, buah maja, bonggol pisang dan sebagainya dihaluskan atau dicincang kemudian dimasukkan kedalam drum plastik, kemudian dicampur dengan larutan yang mengandung glukosa seperti air nira, air kelapa atau air gula sebagai sumber energi, dan dibiarkan selama beberapa hari. Setelah itu larutan MOL dapat dipakai untuk menyemprot tanaman padi di sawah (NOSC, 2008) dan dapat juga digunakan sebagai aktivator dalam proses pembuatan kompos.
Proses pengomposan alami membutuhkan waktu yang sangat lama, antara 6-12 bulan sampai benar-benar bahan organik tersebut tersedia bagi tanaman. Proses pengomposan dapat dipercepat dengan menggunakan mikrob penghancur (dekomposer) dari beberapa bulan menjadi beberapa minggu saja. Seperti dilaporkan Husen dan Irawan (2008) penggunaan dekomposer lokal dari MOL pepaya dalam pengomposan jerami menurunkan nisbah C/N secara cepat sampai stabil sehingga dapat digunakan pada minggu ke-5 setelah inkubasi.
Para petani di berbagai daerah yang menggunakan metode SRI pada umumnya memberikan larutan MOL pada 10, 20, 30, 40 dan 60 hari setelah tanam (hst) atau sesuai kebutuhan (Kalsim, 2007) dengan dosis 4,8 l/ha (Setianingsih, 2009). Hasilnya penggunaan dan pemberian larutan MOL mampu meningkatkan produksi padi serta meningkatkan pula kesuburan tanah.
Tujuan Penelitian
1. Untuk mengetahui dan mengidentifikasi mikrob serta sifat-sifat kimia
yang terkandung dalam MOL bonggol pisang, MOL keong mas dan MOL urin kelinci.
2. Untuk mengetahui pola pertumbuhan mikrob pada MOL bonggol pisang,
MOL keong mas dan MOL urin kelinci. .
Hipotesis Penelitian
1. Pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci
mengandung mikrob serta sifat-sifat kimia.
2. Pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci pola
TINJAUAN PUSTAKA
SRI (System of Rice Intensification)
Budidaya SRI pertama kali ditemukan oleh seorang biarawan Yesuit asal Perancis yang bernama FR. Henri de Laulanie di Madagaskar pada tahun 1984. SRI merupakan sistem budidaya tanaman padi yang intensif dan efisien dengan manajemen yang berbasis pada pengelolaan tanah, tanaman dan air (DISIMP, 2006). SRI menerapkan pula proses pemberdayaan petani dalam pengelolaan lahan dan air dengan pertimbangan jauh kedepan yaitu nilai-nilai pertanian yang berkelanjutan (Deptan, 2008).
Prinsip dasar dari budidaya SRI yaitu penggunaan benih yang bermutu, bibit ditanam berumur muda (8-10 hari) dengan pola satu bibit per lubang dan ditanam dangkal dengan posisi perakaran berbentuk L. Jarak tanam yang lebih lebar 25 x 25 cm atau 30 x 30 cm, pengelolaan air dengan irigasi terputus (tanah lembab tapi tidak sampai tergenang) dan pengendalian hama terpadu dengan tidak menggunakan pestisida dan bahan-bahan sintetik. SRI ini tidak hanya bertujuan untuk meningkatkan produksi padi tetapi juga kesejahteraan petani melalui peningkatan pendapatan usaha tani (Sato dan Uphoof, 2006).
Pengelolaan lahan pertanian yang ramah lingkungan dengan menggunakan metode SRI melalui penggunaan kompos serta pemanfaatan MOL diyakini mampu memelihara kesuburan tanah, meningkatkan populasi mikrob tanah, menjaga kelestarian lingkungan sekaligus dapat mempertahankan serta meningkatkan produktivitas tanah. Beberapa penelitian telah dilakukan dan dilaporkan bahwa penggunaan kompos dan pupuk organik dalam metode SRI dapat meningkatkan populasi mikrob seperti Azospirilium, Azotobacter dan lain-lain dalam rizosfir secara berlipat dibandingkan dengan cara konvensional yang
biasa petani lakukan dalam melakukan budidaya tanaman padi (Uphoff et al.
2009). Secara khusus pemupukan organik pada budidaya SRI berkontribusi
menaikkan hampir empat kali lipat jumlah Azospirillum dan hampir dua kali lipat
Penggunaan larutan MOL pada budidaya padi SRI dilakukan dari mulai sebelum tanam sampai dengan pembentukan dan pengisian bulir padi. Penggunaan larutan sebelum tanam padi dilakukan pada saat pengomposan jerami yang nantinya diaplikasikan kedalam tanah. Pemberian larutan MOL sebagai pupuk cair biasanya dilakukan 5 kali yaitu pada 10, 20, 30,40, 60 hst (Kalsim, 2007) dan bisa berbeda-beda sesuai dengan tingkat kebutuhan petani.
Mikroorganisme Lokal (MOL)
MOL adalah cairan yang berbahan dari berbagai sumber daya alam yang tersedia setempat. MOL mengandung unsur hara makro dan mikro dan juga mengandung mikrob yang berpotensi sebagai perombak bahan organik, perangsang pertumbuhan dan sebagai agen pengendali hama penyakit tanaman. Berdasarkan kandungan yang terdapat dalam MOL tersebut, maka MOL dapat digunakan sebagai pendekomposer, pupuk hayati, dan sebagai pestisida organik terutama sebagai fungsida (Purwasasmita dan Kunia, 2009).
Para petani meracik MOL berdasarkan pengalaman atau pemahaman yang diambil dari pelatihan yang diberikan oleh para inisiator SRI. Berbagai larutan MOL dapat dibuat dari berbagai bahan yang tersedia disekitar kita. Beberapa contoh larutan MOL yang dibuat para petani antara lain: MOL buah-buahan, MOL daun gamal, MOL bonggol pisang, MOL sayuran, MOL rebung, MOL limbah dapur, MOL protein dan lain-lain (Purwasasmita dan Kunia, 2009).
Berbagai contoh MOL yang dibuat dan diaplikasikan para petani adalah MOL buah-buah untuk membantu bulir padi agar lebih berisi, MOL daun gamal untuk penyubur daun tanaman dan disemprotkan pada padi umur 30 hst, MOL bonggol pisang untuk dekomposer saat pembuatan kompos dan disemprotkan pada padi umur10, 20, 30 dan 40 hst. MOL sayuran untuk merangsang tumbuhnya malai dan disemprotkan pada umur padi 60 hari, MOL rebung untuk merangsang pertumbuhan tanaman dan disemprotkan pada padi umur 15 hari dan masih banyak MOL-MOL yang lain (Purwasasmita dan Kunia, 2009).
Mikrob
Pada ekosistem tanah terdapat berbagai jenis mikrob seperti: bakteri, fungi, aktinomisetes, protozoa dan ganggang. Keberadaan mikrob tersebut memiliki arti penting terhadap dinamika ekosistem tersebut. Mikrob tanah memiliki peran antara lain mendekomposisi residu tanaman, hewan dan mikrob, sebagai pemacu dan pengatur utama laju mineralisasi unsur-unsur hara dalam tanah serta sebagai penambat unsur-unsur hara dalam tanah (Killham, 1994).
Peran mikrob dalam siklus berbagai unsur hara terutama N, P dan K di dalam tanah sangat penting. Apabila salah satu jenis mikrob tersebut tidak berfungsi maka akan terjadi ketimpangan dalam daur unsur hara di dalam tanah. Bakteri merupakan kelompok mikrob dalam tanah yang paling dominan dan dapat berjumlah separuh dari biomassa mikrob di dalam tanah (Rao, 1994).
Fungi terdapat disetiap tempat terutama di darat dalam berbagai bentuk, ukuran dan warna. Pada umumnya fungi mempunyai kemampuan yang lebih baik dibanding bakteri dalam menguraikan sisa-sisa tanaman terutama yang mengandung hemiselulosa, selulosa dan lignin (Alexander, 1977). Selain dapat menguraikan bahan-bahan berkayu, fungi juga dapat menghasilkan zat yang bersifat racun sehingga dapat dipakai untuk mengontrol pertumbuhan/
perkembangan organisme pengganggu. Seperti fungi Tricoderma sp. yang efektif
mengendalikan patogen penyebab rebah kecambah Rhizoctonia solani, busuk
batang Fusarium sp., akar gada Plasmodiophora brassicae dan lain-lain (Nasahi,
oksidasi senyawa-senyawa organik (Killham, 1994). Fungi bersifat aerob obligat dimana oksigen diperlukan untuk kelangsungan hidupnya.
Beberapa genus dari bakteri seperti Rhizobium, Azotobacter, Azospirillum,
Pseudomonas terlibat dalam penambatan N2 dan penyedia unsur hara untuk
tanaman disekitar perakaran. Azotobacter, Azospirillum dan Mikrob Pelarut Fosfat
merupakan mikrob yang menguntungkan dalam meningkatkan pertumbuhan tanaman (Rao, 1994).
Azotobacter
Azotobacter merupakan bakteri penambat N2 non simbiotik yang bersifat
aerobik. Azotobacter juga memproduksi hormon pertumbuhan sitokinin dan
auksin yang dilaporkan pertama kali oleh Vancura dan Macurra pada tahun 1960
(Vancura 1988). Selain kemampuannya menambat N2 yang tinggi, Azotobacter
juga dapat meningkatkan panjang akar tanaman padi, menambah berat basah akar dan meningkatkan pertumbuhan tinggi tanaman padi (Razie, 2003).
Genus Azotobacter termasuk dalam grup Gram negatif, aerobik, berbentuk
batang hingga bulat, tunggal bergabung, tidak beraturan dan kadang-kadang
membentuk rantai dengan berbagai panjang, tidak motil (Holt et al. 1994). Koloni
Azotobacter mempunyai ciri-ciri berbentuk convex, smooth, putih, moist
(Wedhastri, 2002). Bakteri ini dapat hidup di tanah dan air. Walaupun bakteri ini
bersifat aerobik, namun dapat tumbuh dengan kadar oksigen yang rendah (Holt et
al. 1994).
Azospirillum
Azospirillum merupakan bakteri penambat N2 non simbiotik seperti
Azotobacter. Azospirillum termasuk ke dalam grup bakteri Gram negatif. Bakteri ini memiliki ciri khas yaitu memiliki sifat mikroaerofilik. Pada medium semi
padat yang mengandung malat, Azospirillum membentuk lapisan berwarna putih,
padat dan berombak yang disebut pelikel. Bentuk sel Azospirillum vibroid, koma
atau batang lurus dengan lebar sel 0,9-1,2 mm dengan suhu optimum untuk
tumbuh 34-37oC. Pertumbuhan Azospirillum sangat baik pada medium yang
Penambatan N2 oleh Azospirillum dimungkinkan karena adanya enzim
nitrogenase. Proses penambatan N2 dengan adanya enzim nitrogenase terjadi
sebagai berikut: energi ATP dan elektron feredoksin mereduksi protein Fe menjadi reduktan, kemudian reduktan mereduksi protein MoFe yang kemudian mereduksi N2 menjadi NH3 dengan hasil sampingan berupa gas H2. Bersamaan dengan itu terjadi reduksi asetilen menjadi etilen yang digunakan sebagai
indikator proses penambatan N2 secara biologis (Marschner, 1986).
Infeksi yang disebabkan oleh Azospirillum tidak menyebabkan perubahan
morfologi perakaran, tetapi meningkatkan jumlah rambut akar yang menyebabkan percabangan akar lebih berperan dalam penyerapan hara (Rahmawati, 2005). Selain itu berdasarkan hasil penelitian Razie (2003), Azospirillum juga mampu menambah panjang akar serta bobot basah akar padi. Menurut Lestari et al. (2007), Azospirillum menghasilkan hormon asam indol asetat yang secara nyata meningkatkan tinggi tanaman padi serta berpengaruh nyata terhadap panjang akar tanaman padi.
Mikrob Pelarut Fosfat
Mikrob Pelarut Fosfat (MPF) merupakan mikrob yang mempunyai kemampuan melarutkan P tidak tersedia menjadi bentuk yang dapat digunakan oleh tanaman. Pelarutan senyawa P oleh MPF berlangsung secara kimia dan biologis baik untuk bentuk P organik maupun anorganik. Mekanisme pelarutan fosfat secara kimia merupakan mekanisme pelarutan fosfat utama yang dilakukan oleh mikrob. Mikrob tersebut mengekskresikan sejumlah asam organik berbobot molekul rendah seperti oksalat, suksinat, tartrat, sitrat, laktat, asetat, formiat,
propionat dan lain-lain (Alexander, 1977; Beauchamp dan Hume, 1997).
Asam-asam organik tersebut akan membentuk senyawa komplek dengan ion Ca, Fe dan Al sehingga unsur P akan dibebaskan dan tersedia bagi tanaman. Meningkatnya asam-asam organik tersebut diikuti dengan penurunan pH yang tajam. Pelarutan fosfat secara biologis terjadi karena mikrob tersebut menghasilkan enzim antara lain enzim fosfatase (Lynch, 1983) dan enzim fitase (Alexander, 1977).
MPF terdiri dari golongan bakteri, fungi dan sedikit aktinomisetes. MPF
putida, P. fluorescens, P. denitrificans, Bacillus polymyxa, B. megatherium, Thiobacillus sp., serta Mycobaterium dan dari golongan fungi antara lain
Aspergillus niger, A.awamori, P. digitatum, P. bilaji dan lain-lain (Alexander, 1977). Populasi MPF dari golongan bakteri jauh lebih banyak dibandingkan dengan golongan fungi. Media selektif yang umum digunakan untuk mengisolasi
dan memperbanyak MPF adalah Agar Pikovskaya yang berwarna putih keruh,
karena mengandung P tidak larut seperti kalsium fosfat. Potensi MPF untuk melarutkan fosfat tidak tersedia dicirikan oleh zona bening (halozone) disekitar koloni mikrob (Rao, 1982).
Penggunaan MPF di bidang pertanian sangat dibutuhkan sebagai salah satu upaya meningkatkan ketersediaan senyawa P bagi tanaman. Penelitian
Setiawati (1998) secara umum menyatakan bahwa bakteri pelarut fosfat P.
putida dan P. fluorescens lebih banyak melarutkan P dari sumber AlPO4. Fungi pelarut fosfat Aspergillus niger dan Aspergillus ficuum lebih banyak melarutkan P dari Ca3(PO4)2. Penelitian Premono (1994) mendapatkan Aspergillus ficuum
mampu melarutkan bentuk-bentuk Ca-P dan Fe-P, sedangkan P. putida, P.
fluorescens mampu melarutkan Ca, Fe maupun occluded-P.
Beberapa peneliti mengemukakan bahwa keefektifan bakteri pelarut fosfat tidak hanya disebabkan oleh kemampuannya dalam melarutkan fosfat tetapi juga disebabkan kemampuannya dalam menghasilkan zat pengatur tumbuh, seperti asam indol asetat dan asam giberelin. Selain itu beberapa bakteri pelarut fosfat juga dapat berperan meningkatkan kesehatan akar dan pertumbuhan tanaman melalui proteksinya terhadap penyakit. Seperti pada penelitian Setiawati dan Mihardja (2008) P. putida dan P. diminuta secara in vitro dapat menghambat
pertumbuhan fungi patogen Rhizoctonia solani sebesar 58,35% dan 41,96%.
Mikrob Selulolitik
tersebut adalah selulase yang dihasilkan mikrob sebagai respon terhadap adanya
selulosa pada lingkungan hidupnya (Busto et al. 1995).
Umumnya mikrob yang mampu mendegradasi selulosa juga mampu mendegradasi hemiselulosa (Alexander,1977). Selulosa merupakan karbohidrat utama yang disintesis oleh tanaman dan menempati hampir 60% komponen penyusun struktur tanaman. Jumlah selulosa di alam sangat berlimpah sebagai sisa tanaman atau dalam bentuk limbah pertanian seperti jerami padi, sisa tanaman jagung, gandum dan kedelai. Sulitnya mendegradasi limbah tersebut menyebabkan petani lebih suka membakar jeraminya dilahan pertanian daripada memanfaatkannya kembali melalui pengomposan. Hal ini disebabkan karena sangat sedikitnya mikrob yang secara alami efektif untuk merombak limbah berselulosa.
Bakteri selulolitik antara lain adalah Clostridium acetobutylicum,
Ruminicoccus flavefaciens, Ruminicoccus albus dan Cillobacterium cellulosolvens (Lynd et al. 2002). Selain bakteri, fungi juga termasuk dalam kelompok Mikrob Selulolitik. Beberapa mikrob terutama dari kelompok fungi memiliki kemampuan untuk menghidrolisis selulosa alami melalui aktifitas selulolitik yang dimilikinya (Salma dan Gunarto, 1999). Sutedjo et al (1991) mengemukakan bahwa fungi dapat mendegradasi selulosa lebih baik di dalam tanah dan kompos terutama dibawah kondisi tropis. Mekanisme degradasi selulosa oleh berbagai mikrob tergantung sifat keadaan mikrob dan kondisi-kondisi dekomposisi.
Mikrob selain bersifat menguntungkan ada pula yang merugikan. Bakteri
maupun fungi yang bersifat merugikan, antara lain Ralstonia solanacearum yang
menyebabkan penyakit layu bakteri, Agrobacterium tumefaciens yang penyebab
tumor pada tumbuhan, Xanthomonas sp. yang penyebab penyakit kresek pada
tanaman padi dan lain-lain. Fungi yang merugikan antara lain Phytium penyebab
penyakit rebah semai, Phythophthora infestans penyebab penyakit pada daun
tanaman kentang, Fusarium oxysporum penyebab layu fusarium dan lain-lain
Pertumbuhan mikrob
Pertumbuhan merupakan peningkatan komponen-komponen sel yang selanjutnya menyebabkan peningkatan ukuran sel, peningkatan jumlah sel, atau peningkatan kedua-duanya. Kecepatan pertumbuhan masing-masing mikrob tidak sama. Hal ini sesuai dengan tahapan pertumbuhan mikrob yang terdiri dari 4 fase
yaitu pertama fase adaptasi (lag phase). Pada fase ini mikrob baru menyesuaikan
diri dengan lingkungannya yang baru sehingga kecepatan pertumbuhannya masih
rendah. Fase kedua merupakan fase pertumbuhan dipercepat (exponential phase),
selama fase ini metabolisme sel paling aktif, dipengaruhi pula oleh medium tempat tumbuhnya seperti pH, kandungan nutrien, juga kondisi lingkungannya.
Selanjutnya merupakan fase pertumbuhan tetap (stationary phase). Fase ini
didahului dengan melambatnya pertumbuhan mikrob karena beberapa sebab, misalnya nutrien pada medium yang semakin berkurang maupun adanya hasil-hasil metabolisme yang mungkin beracun sehingga menghambat pertumbuhan mikrob. Pada fase ini jumlah mikrob yang mati semakin meningkat sampai terjadi dimana kematian seimbang dengan pertumbuhan. Fase yang terakhir merupakan fase kematian (death phase). Pada fase ini jumlah mikrob yang mati semakin banyak karena beberapa sebab seperti habisnya nutrien dalam medium, habisnya energi cadangan dalam sel mikrob atau karena pengaruh kondisi lingkungan (Dwijoseputro, 2010).
Bahan makanan yang digunakan oleh mikrob dapat berfungsi antara lain sebagai sumber energi, bahan pembangun sel dan aseptor atau donor elektron. Secara garis besar bahan makanan dibagi menjadi tujuh golongan yaitu air, sumber energi, sumber karbon, sumber aseptor elektron, sumber mineral, faktor tumbuh, dan sumber nitrogen (Sumarsih, 2003).
Sifat Kimia
merupakan derajat kemasaman yang menunjukkan banyaknya ion H+ atau OH -dalam suatu larutan. Apabila ion H+ lebih banyak dari OH- disebut masam dan apabila ion OH- lebih banyak daripada ion H+ disebut basa (Tan, 1982). Derajat kemasaman penting bagi pertumbuhan mikrob. Sebagian besar mikrob menyukai pH netral (pH 7) untuk pertumbuhannya. Berdasarkan pH-nya mikrob dapat dikelompokkan menjadi 3 yaitu (a) mikrob asidofil, adalah kelompok mikrob yang dapat hidup pada pH 2,0 -5,0, (b) mikrob mesofil adalah kelompok mikrob yang dapat hidup pada pH 5,5 – 8,0, dan (c) mikrob alkalifil adalah kelompok mikrob yang dapat hidup pada pH 8,4 -9,5.
Sifat kimia lain yang terdapat dalam larutan MOL adalah konduktivitas listrik (EC, Electrical Conductivity) atau daya hantar listrik, dimana EC ini berhubungan dengan pengukuran kadar garam dalam larutan hara. EC memberi indikasi mengenai hara yang terkandung dalam larutan dan yang diserap oleh akar. Larutan kaya hara akan mempunyai EC yang lebih besar daripada larutan yang mempunyai sedikit hara. Nilai EC tergantung jenis ion yang terkandung dalam larutan hara, konsentrasi ion dan suhu larutan (Morgan, 2000).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian IPB sejak bulan April 2010- Januari 2011.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini terdiri dari bahan pembuat MOL
yaitu bonggol pisang Apu (Mussa paradisica linn), keong mas (Pomacea
canaliculata) dan urin kelinci, air sisa cucian beras, gula merah dari kelapa (gula
Jawa). Media untuk pertumbuhan mikrob yaitu Nutrient Agar (NA), Potato
Dextrosa Agar (PDA), Pikovskaya, Nitrogen Free Media (NFM), Nitrogen Free Bromthymol Blue (NFB), dan Carboxymethyl Cellulose (CMC) serta bahan-bahan kimia habis pakai untuk analisis kimia. Alat yang digunakan terdiri dari alat-alat laboratorium untuk analisis mikrob dan kimia.
Metode Penelitian
Penelitian ini dilaksanakan dengan menggunakan rancangan acak lengkap (RAL) dengan satu faktor (waktu) dan 3 ulangan. Selanjutnya penyeleksian berdasarkan nilai tengah tertinggi dari peubah menggunakan uji jarak berganda Duncan. Analisis data dilakukan dengan menggunakan Program SAS 9.1.
Model matematisnya adalah:
Yij = µ + αi + εij
dimana:
Yij = pengamatan pada perlakuan ke-I dan ulangan ke-j
µ = rataan umum
αi = pengaruh perlakuan waktu ke-i
Pelaksanaan Penelitian
Pembuatan MOL
1. Persiapan
Bahan yang digunakan masing-masing adalah bonggol pisang Apu (Musa
paradisiaca Linn) yang diiris-iris dengan ukuran ± 0,5 – 1 cm sebanyak 5 kg,
keong mas (Pomacea canaliculata) yang ditumbuk beserta cangkangnya
sebanyak 5 kg, urin kelinci 5 l, air sisa cucian beras 10 l (didapat dari 5 l beras yang dicuci dengan 10 l air) dan gula merah dari kelapa (gula Jawa) 1 kg yang kemudian diiris halus. Alat yang diperlukan adalah penumbuk, pisau, kayu pengaduk dan drum ukuran 18 l.
2. Cara pembuatan MOL
Air sisa cucian beras dicampur dengan gula merah (gula Jawa) yang telah diiris halus dimasukkan dalam drum kemudian diaduk sampai gula larut (air sisa cucian beras berubah warna menjadi coklat) kemudian dimasukkan keong mas, diaduk kembali sampai tercampur merata kemudian tutup drum dengan penutupnya. Begitu juga langkah-langkah untuk pembuatan MOL bonggol pisang dan MOL urin kelinci (NOSC, 2008).
Pengambilan sampel MOL
1. Pengambilan sampel MOL untuk analisis mikrob
Pengambilan sampel dilakukan pada 1x24 jam( hari 1), 7x24 jam (hari ke-7), 14x24 jam (hari ke-14) dan 21x24 jam (hari ke-21). Sampel MOL diambil dengan menggunakan pipet pada 3 kedalaman yang berbeda, yaitu 4 cm, 14 cm dan 23 cm.
2. Pengambilan sampel MOL untuk analisis kimia
Pengamatan
Analisis mikrob
Analisis mikrob dilakukan untuk mengetahui populasi mikrob total, fungi,
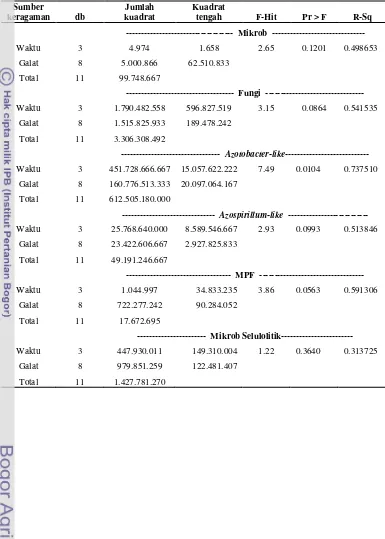
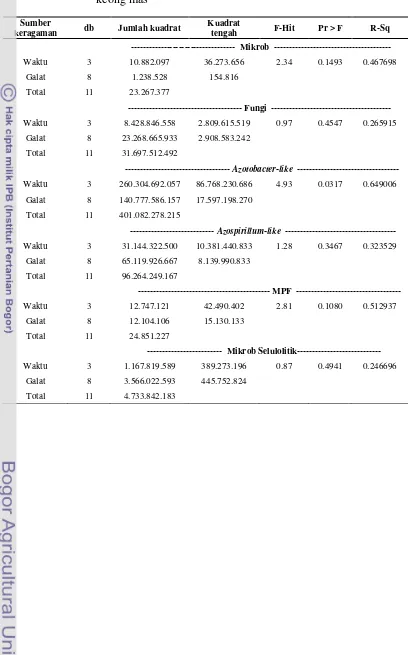
Azotobacter-like, Azospirillum-like, MPF dan Mikrob Selulolitik. Parameter penelitian, metode dan media tumbuh mikrob disajikan pada Tabel 1.
Tabel 1 Parameter penelitian, metode dan media tumbuh mikrob
Parameter Metode Media
Mikrob total Cawan hitung Nutrient Agar(NA) (Rao, 1982)
Fungi Cawan hitung Potato Dextrosa Agar (PDA) (Anas,
1989)
Azotobacter-like Cawan hitung Nitrogen Free Media (NFM) (Rao, 1982)
Azospirillum-like MPN Nitrogen Free Bromthymol Blue
(NFB) (Okon et al. 1977)
MPF Cawan hitung Pikovskaya (Rao, 1982)
Mikrob Selulolitik Cawan hitung Carboxymethyl Cellulose (CMC)
(Coronel dan Joson, 1986)
Seri pengenceran dibuat dengan terlebih dahulu menyiapkan erlenmeyer 250 ml yang berisi 90 ml larutan garam fisiologis (8,5 g NaCl per liter) dan tabung reaksi yang berisi 9 ml larutan garam fisiologis. Semua erlenmeyer dan tabung reaksi ditutup dengan kapas, penutupan ini dilakukan dengan hati-hati agar jangan sampai basah sewaktu diautoklaf. Erlenmeyer dan tabung reaksi yang berisi
larutan garam fisiologis diautoklaf selama 20 menit pada suhu 121oC dan
didinginkan sebelum digunakan lebih lanjut. Setelah dingin, 10 ml sampel larutan MOL dimasukkan ke dalam 90 ml larutan garam fisiologis steril tersebut,
selanjutnya dibuat seri pengenceran sampai 10-7. Seri pengenceran yang
digunakan untuk menetapkan populasi masing-masing parameter berbeda. Untuk mikrob total digunakan seri pengenceran 10-5, 10-6, 10-7, Azotobacter-like,
10-5, fungi dan MPF digunakan pengenceran 10-4, 10-5, 10-6. Sebanyak 1 ml larutan dari masing-masing seri pengenceran dipindahkan ke cawan petri yang kemudian dituang ke media biak sesuai dengan mikrob yang akan ditumbuhkan. Bahan dan komposisi media tumbuh mikrob yang digunakan disajikan pada Tabel Lampiran 1. Setelah itu cawan petri digoyang secara perlahan-lahan agar media dan suspensi tercampur sempurna, lalu diinkubasi pada suhu 25-30oC. Populasi
mikrob total, MPF, Azotobacter-like dan Mikrob Selulolitik dihitung setelah 3-5
hari, sedangkan untuk Azospirillum-like inkubasi dilakukan selama 7 hari.
Keseluruhan proses dilakukan secara steril untuk menghindari kontaminasi yang dapat mengganggu parameter yang ditetapkan.
Pemurnian
Pemurnian dilakukan dengan tujuan untuk memperoleh biakan murni yang diinginkan tanpa ada kontaminan dari mikrob lain. Pada tahap pemurnian untuk
Azotobacter-like dipilih koloni tunggal yang mempunyai bentuk paling besar,
moist dan bening. Untuk Azospirillum-like koloni yang dipilih berasal dari pelikel yang paling jelas sedangkan untuk MPF dan Mikrob Selulolitik dipilih koloni yang mempunyai zona bening paling luas. Koloni yang terpisah tersebut dipisahkan dengan cara pengoresan kuadran ke media yang baru.
Identifikasi
Identifikasi mikrob terpilih dilakukan berdasarkan ciri-ciri morfologi koloni seperti elevasi, pinggiran, warna, bentuk dan jenis Gram. Identifikasi secara fisiologis dilakukan dengan menggunakan alat KIT API NE 20 yaitu sistem
standar untuk identifikasi mikrob non-enterik. Untuk fungi identifikasi
berdasarkan karakter morfologi koloni secara makroskopi dan mikroskopi.
Analisis kimia
hari ke-1, 7, 14 dan 21 sedangkan untuk unsur hara pada hari ke-14. Parameter dan metode untuk analisis kimia disajikan pada Tabel 2.
Tabel 2 Parameter dan metode/alat untuk analisis kimia
Parameter Metode/Alat
pH pH meter/Fisher accumet® model 230A
Eh Eh meter/TOA
EC EC meter/wtw inolab cond level 1
N-NO3-, N-NH4+ Kjeldahl
C organik Walkey & Black
P2O5 Bray-1/Spektrofotometer Spectonic 20 Bausch &
Lomb
K2O Ekstrak HCl 25%/Flamefotometer Corning 405
Ca.Mg, Fe,Zn,Cu,Mn
NH4OAC pH 7/AAS Shimadzu AA-6300
Ekstrak HCl 0,05 N/AAS Shimadzu AA-6300
Analisis Data
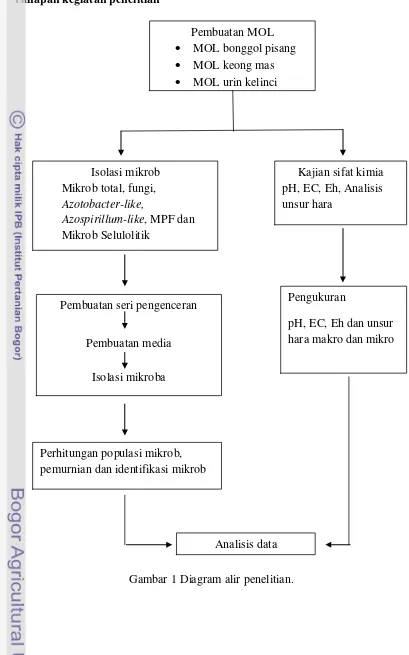
Tahapan kegiatan penelitian
Gambar 1 Diagram alir penelitian. Pembuatan MOL
MOL bonggol pisang
MOL keong mas
MOL urin kelinci
Isolasi mikrob Mikrob total, fungi,
Azotobacter-like,
Azospirillum-like, MPF dan Mikrob Selulolitik
Kajian sifat kimia pH, EC, Eh, Analisis unsur hara
Pembuatan seri pengenceran
Pembuatan media
Isolasi mikroba
Pengukuran
pH, EC, Eh dan unsur hara makro dan mikro
Perhitungan populasi mikrob, pemurnian dan identifikasi mikrob
HASIL DAN PEMBAHASAN
Populasi mikrob
Populasi mikrob pada MOL bonggol pisang, MOL keong mas dan MOL
urin kelinci meliputi total populasi mikrob, fungi, Azotobacter-like,
Azospirillum-like, MPF dan Mikrob Selulolitik. Pengamatan populasi mikrob pada ketiga MOL
dilakukan sebanyak 4 kali dengan selang waktu 7 hari sekali selama 21 hari. keong mas dan MOL urin kelinci selama 21 hari.
Pada Gambar 2 dapat dilihat bahwa populasi mikrob total selama 21 hari cenderung mengalami penurunan setelah hari ke-7 pada MOL keong mas dan MOL urin kelinci. Kondisi ini diduga terkait dengan nilai Eh (Gambar 10) yang nilainya terus mengalami penurunan setelah hari ke-7. Nilai Eh menunjukkan kondisi oksidatif dan reduktif dalam larutan. Nilai Eh ini berpengaruh terhadap kehidupan mikrob, kondisi reduktif menggambarkan aktivitas mikrob rendah akibat oksigen yang berkurang dan sebaliknya. Dampaknya adalah mikrob tidak
bisa bekerja dengan optimal terutama mikrob yang bersifat aerobik dalam mendekomposisi bahan-bahan organik.
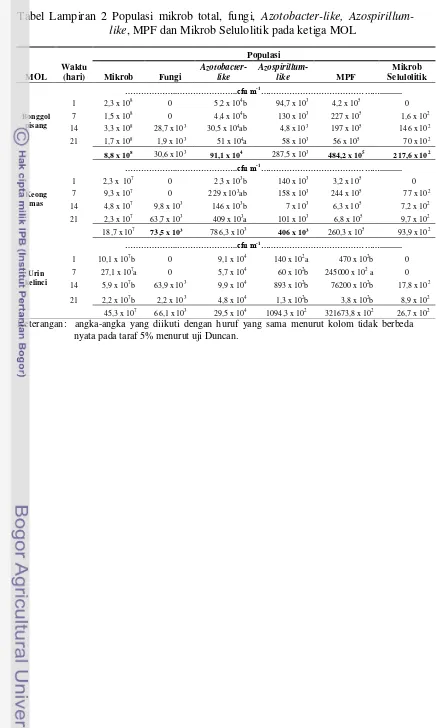
Berdasarkan hasil pengamatan, total populasi mikrob terbanyak terdapat pada MOL bonggol pisang (Tabel Lampiran 2). Hal ini diduga karena kandungan karbohidrat bonggol pisang yang tinggi. Bonggol pisang segar mengandung karbohidrat sebesar 11,6% sedangkan bonggol pisang kering mengandung karbohidrat 66,2% (Muslim, 2008) dan serat kasar 38,38% (Ekawati, 1993). Pada penelitian ini berdasarkan hasil analisis unsur hara, kandungan N, P dan K bonggol pisang berturut-turut sebesar 0,48, 0,05 dan 0,17 % (Tabel Lampiran 6). Apabila ditambah dengan air sisa cucian beras yang juga mengandung karbohidrat serta unsur hara makro-mikro (Tabel Lampiran 6) dan gula sebagai sumber glukosa, maka sumber makanan pada MOL bonggol pisang cukup untuk mendukung pertumbuhan mikrob.
Karbohidrat merupakan substrat utama yang diperlukan untuk fermentasi. Tingginya kandungan karbohidrat dan serat (selulosa) bonggol pisang disebabkan karena bonggol pisang merupakan tempat cadangan makanan bagi tanaman pisang selama pertumbuhannya. Selain itu berdasarkan hasil analisis kandungan unsur hara (Tabel 3) MOL bonggol pisang kandungan C organik-nya lebih tinggi (1,06%) dibandingkan dengan MOL yang lain.
Total populasi mikrob pada MOL keong mas dan MOL urin kelinci rata-rata mengalami pertumbuhan optimum pada hari ke-7 sedangkan MOL bonggol pisang pada hari ke-14. Hal ini diduga pada saat itulah kondisi lingkungan serta sumber bahan makanan untuk mikrob dalam keadaan yang tersedia dan optimum. Pertumbuhan mikrob selanjutnya mengalami penurunan dikarenakan sumber makanan yang tersedia diduga terus mengalami penurunan.
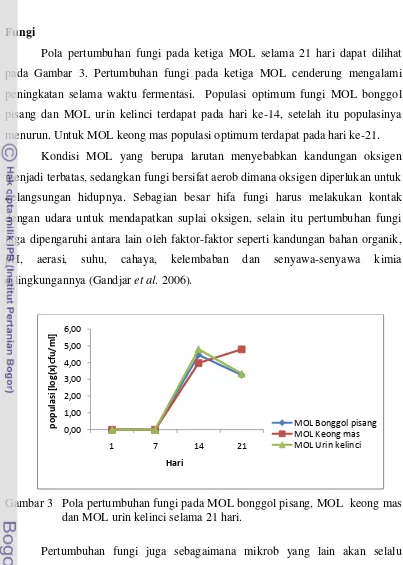
Fungi
Pola pertumbuhan fungi pada ketiga MOL selama 21 hari dapat dilihat pada Gambar 3. Pertumbuhan fungi pada ketiga MOL cenderung mengalami peningkatan selama waktu fermentasi. Populasi optimum fungi MOL bonggol pisang dan MOL urin kelinci terdapat pada hari ke-14, setelah itu populasinya menurun. Untuk MOL keong mas populasi optimum terdapat pada hari ke-21.
Kondisi MOL yang berupa larutan menyebabkan kandungan oksigen menjadi terbatas, sedangkan fungi bersifat aerob dimana oksigen diperlukan untuk kelangsungan hidupnya. Sebagian besar hifa fungi harus melakukan kontak dengan udara untuk mendapatkan suplai oksigen, selain itu pertumbuhan fungi juga dipengaruhi antara lain oleh faktor-faktor seperti kandungan bahan organik,
pH, aerasi, suhu, cahaya, kelembaban dan senyawa-senyawa kimia
dilingkungannya (Gandjar et al. 2006).
Gambar 3 Pola pertumbuhan fungi pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci selama 21 hari.
Pertumbuhan fungi juga sebagaimana mikrob yang lain akan selalu mengikuti fase pertumbuhan. Setiap mikrob mempunyai waktu yang berbeda-beda untuk mengikuti fase pertumbuhan, ada yang cepat melakukan penyesuaian pada media baru ada juga yang lambat. Fungi dapat tumbuh pada kisaran pH yang lebih luas yaitu 2,5-8,5 dengan pH optimum 5,5-7,5, dibandingkan kisaran pH pertumbuhan optimum bakteri sekitar 6,5-7,5 (Fardiaz, 1992).
Pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci waktu fermentasi tidak berpengaruh nyata terhadap total populasi fungi (Tabel Lampiran 2). Secara umum berdasarkan hasil pengamatan, total populasi fungi terbanyak terdapat pada MOL keong mas (Tabel Lampiran 2). Hal ini diduga terkait dengan nilai pH pada MOL keong mas yaitu setelah hari ke-7 fermentasi pH berkisar 6-6,5 yang merupakan kisaran pH optimum untuk pertumbuhan fungi yaitu 5,5-7,5.
Azotobacter-like
Pola pertumbuhan Azotobacter-like selama 21 hari pada ketiga MOL
dapat dilihat pada Gambar 4. Pola pertumbuhan Azotobacter-like pada ketiga
MOL cenderung mengalami peningkatan selama waktu fermentasi (Gambar 4).
Gambar 4 Pola pertumbuhan Azotobacter-like pada MOL bonggol pisang, MOL
keong mas dan MOL urin kelinci selama 21 hari.
Pertumbuhan optimum Azotobacter-like pada MOL bongggol pisang dan
MOL keong mas terjadi pada hari ke-21, sedangkan pada MOL urin kelinci pada hari ke-14. Berdasarkan hasil pengamatan, populasi Azotobacter-like tertinggi terdapat pada MOL bonggol pisang (Tabel Lampiran 2). Hal ini diduga karena kandungan C organik pada MOL bonggol pisang lebih tinggi daripada kedua MOL yang lain (Tabel 3). C organik merupakan sumber energi untuk pertumbuhan mikrob.
Azotobacter-like merupakan kelompok mikrob yang dapat tumbuh pada
media selektif Azotobacter dan mempunyai ciri-ciri seperti Azotobacter.
Azotobacter merupakan bakteri penambat N2 non simbiotik. Pada penelitian ini,
media selektif yang digunakan adalah NFM. Koloni Azotobacter mempunyai
ciri-ciri berbentuk bulat, convex, smooth, moist, berwarna putih, bening sampai keruh
(Wedhastri, 2002). Berdasarkan hasil identifikasi, teridentifikasi adanya Bacillus
sp. dan Staphylococcus sp. Hal ini menunjukkan bahwa kedua mikrob yang
teridentifikasi tersebut mempunyai ciri seperti Azotobacter sehingga digolongkan
sebagai Azotobacter-like.
Waktu fermentasi tidak berpengaruh nyata terhadap populasi
Azotobacter-like pada MOL urin kelinci (Tabel Lampiran 2). Hal ini dapat dilihat dari nilai Pr
> F (Tabel Lampiran 5). Pada MOL bonggol pisang populasi Azotobacter-like
pada hari ke-21 mempunyai pengaruh berbeda nyata dengan populasi pada hari ke-1 dan 7, tetapi tidak berbeda nyata dengan populasi pada hari ke-14. Hal ini dapat dilihat bahwa pada hari ke-21 populasi Azotobacter-like memiliki rataan
tertinggi yaitu 51 x 104 cfu/ml. Pada MOL keong mas, waktu fermentasi
berpengaruh nyata terhadap populasi Azotobacter-like. Populasi Azotobacter-like pada hari ke-21 berbeda nyata dengan hari ke-1 dan 14 tapi tidak berbeda nyata
dengan populasi pada hari ke-7. Begitu juga dengan populasi Azotobacter-like
pada hari ke-7 dengan hari ke-1 dan 14 tidak berbeda nyata.
Azospirillum-like
Pola pertumbuhan Azospirillum-like selama 21 hari pada ketiga MOL
dapat dilihat pada Gambar 5. Pola pertumbuhan Azospirillum-like pada MOL
bonggol pisang dan MOL keong mas mempunyai kecenderungan yang sama, yaitu menurun setelah hari ke-7 fermentasi, sedangkan pada MOL urin kelinci pertumbuhan cenderung terus menurun setelah hari ke-1 fermentasi.
Berdasarkan hasil pengamatan, populasi tertinggi Azospirillum-like
terdapat pada MOL keong mas (Tabel Lampiran 2). Azospirillum-like merupakan
kelompok mikrob yang dapat tumbuh pada media selektif Azospirillum dan
berombak. Akan tetapi berdasarkan hasil identifikasi, pada media NFB tumbuh
Bacillus sp., Staphylococcus sp. dan Rhizobium sp. Hal ini menunjukkan bahwa
mikrob tersebut mempunyai ciri seperti Azospirillum sehingga digolongkan dalam
Azospirillum-like.
Gambar 5 Pola pertumbuhan Azospirillum-like pada MOL bonggol pisang, MOL
keong mas dan MOL urin kelinci selama 21 hari.
Pada MOL bonggol pisang dan MOL keong mas waktu fermentasi tidak berpengaruh nyata terhadap populasi Azospirillum-like (Tabel Lampiran 2). Hal ini dapat dilihat dari nilai Pr > F (Tabel Lampiran 3 dan 4). Pada MOL urin kelinci populasi Azospirillum-like pada hari ke-1 berbeda nyata dengan populasi pada hari ke-7, 14 dan 21. Hal ini dapat dilihat bahwa pada hari ke-1
Azospirillum-like mempunyai rataan tertinggi yaitu sebesar 140 x 102 cfu/ml.
Mikrob Pelarut Fosfat
Pola pertumbuhan MPF selama 21 hari pada ketiga MOL dapat dilihat pada Gambar 6. Pola pertumbuhan MPF pada ketiga MOL terdapat kecenderungan yang sama yaitu pertumbuhan optimum terjadi pada hari ke-7 kemudian mengalami penurunan.
Hal ini menunjukkan bahwa pada hari ke-7 merupakan kondisi dimana semua faktor tumbuh yang diperlukan oleh MPF dalam keadaan tersedia. Selanjutnya populasi MPF mengalami penurunan, diduga karena bahan organik sebagai sumber karbonnya sudah mulai menurun ketersediaannya. Pada penelitian
ini MPF ditumbuhkan dengan media selektif Pikovskaya (Rao, 1982) yang berwarna putih keruh, dengan sumber P tidak larut adalah kalsium fosfat. Setelah diinkubasi selama 3-5 hari, potensi mikrob untuk melarutkan fosfat tidak tersedia dicirikan oleh adanya zona bening (halozone) disekitar koloni.
Gambar 6 Pola pertumbuhan MPF pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci.
Pada ketiga jenis MOL ini, semuanya mengandung MPF dan jumlah terbanyak terdapat pada MOL bonggol pisang (Tabel Lampiran 2). Tingginya populasi MPF pada MOL bonggol pisang diduga karena tingginya kandungan C organik MOL bonggol pisang (1,06%) dibandingkan dengan kedua MOL yang lain serta kandungan P (Tabel 3). Pada Tabel Lampiran 2 ditunjukkan bahwa waktu fermentasi tidak berpengaruh nyata terhadap populasi MPF pada MOL bonggol pisang dan MOL keong mas. Hal ini dapat dilihat dari nilai Pr > F (Tabel Lampiran 3 dan 4). Pada MOL urin kelinci populasi MPF pada hari ke-7 memiliki pengaruh berbeda nyata dengan populasi pada hari ke-1, 14 dan 21. Hal ini dapat dilihat bahwa pada hari ke-7 populasi MPF memiliki rataan tertinggi yaitu sebesar 245000 x 102 cfu/ml.
Mikrob Selulolitik
Pola pertumbuhan Mikrob Selulolitik selama 21 hari pada ketiga MOL dapat dilihat pada Gambar 7. Pola pertumbuhan Mikrob Selulolitik pada ketiga MOL cenderung mengalami peningkatan selama waktu fermentasi. Pada MOL
bonggol pisang dan MOL urin kelinci pertumbuhan mengalami peningkatan sampai hari ke-14 kemudian turun, sedangkan pada MOL keong mas peningkatan pertumbuhan sampai hari ke-7 selanjutnya menurun.
Gambar 7 Pola pertumbuhan Mikrob Selulolitik pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci selama 21 hari.
Rata-rata populasi Mikrob Selulolitik terbanyak terdapat pada MOL bonggol pisang (Tabel Lampiran 2). Hal ini diduga terkait dengan kandungan selulosa pada MOL bonggol pisang. Selulosa merupakan sumber karbon yang dibutuhkan dalam pertumbuhan mikrob. Pada penelitian ini digunakan bahan CMC sebagai sumber karbon karena merupakan bentuk selulosa yang mudah dihidrolisis. Mikrob yang dapat menghancurkan selulosa mempunyai daerah yang terang disekitar koloni (Anas, 1989). Tabel Lampiran 2 menunjukkan bahwa waktu fermentasi tidak berpengaruh nyata terhadap populasi Mikrob Selulolitik pada ketiga MOL.
Sifat Kimia MOL
Sebagaimana suatu proses pelapukan, bahan organik yang difermentasikan akan mengalami perubahan fisik maupun kimia oleh aktivitas mikrob. Perubahan fisik diindikasikan dengan hancurnya jaringan maupun sel bahan dan hal ini akan diikuti oleh perubahan kimia yang dicirikan dengan meningkatnya kandungan unsur dalam larutan hasil fermentasi. Sifat kimia yang diamati pada penelitian ini
meliputi nilai pH, EC, Eh dan kandungan unsur hara yang terkandung dalam MOL bonggol pisang, MOL keong mas dan MOL urin kelinci.
Nilai pH MOL
Dinamika perubahan pH selama 21 hari pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci dapat dilihat pada Gambar 8 dan Tabel Lampiran 7.
Gambar 8 Nilai pH pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci selama 21 hari.
Pada Gambar 8 terlihat bahwa rata-rata nilai pH pada MOL bonggol pisang dan MOL urin kelinci cenderung stabil, kecuali pada MOL keong mas pada hari ke-7 pH mengalami kenaikan. Rata-rata nilai pH terendah selama waktu fermentasi terdapat pada MOL bonggol pisang. Hal ini diduga karena kandungan karbohidrat yang tinggi pada bonggol pisang menyebabkan pH menjadi rendah karena perombakan karbohidrat secara anaerobik akan menghasilkan asam organik-asam organik seperti asam asetat, asam piruvat serta asam laktat. Rata-rata nilai pH MOL keong mas selama waktu fermentasi adalah yang tertinggi. Keong mas mengandung protein yang cukup tinggi selain kandungan bahan yang lain. Menurut Kusarpoko (1994) perombakan protein akan menghasilkan nitrogen dan amonia yang bersifat alkalis, sehingga perombakan protein ini akan menyebabkan nilai pH menjadi meningkat.
pada MOL mengeluarkan gas-gas sebagai hasil fermentasi atau respirasi.
Kebanyakan gas yang timbul karena aktivitas mikrob adalah CO2. Gas ini timbul
sebagai hasil pernafasan aerob maupun anaerob. Terlepasnya CO2 dalam larutan
akan membentuk senyawa asam karbonat (H2CO3) yang mudah terurai menjadi
ion-ion H+ dan HCO3-. Ion-ion H+ ini akan menentukan kemasaman
(Dwijoseputro, 2010). Makin lama waktu fermentasi berlangsung, maka tingkat dekomposisi bahan organik akan semakin lanjut. Kondisi ini mengakibatkan
peningkatan konsentrasi ion-ion H+ dalam larutan fermentasi sehingga pH
menjadi lebih rendah.
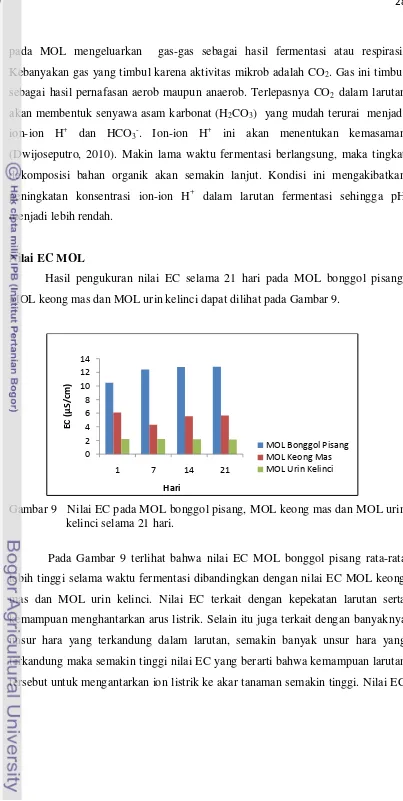
Nilai EC MOL
Hasil pengukuran nilai EC selama 21 hari pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci dapat dilihat pada Gambar 9.
Gambar 9 Nilai EC pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci selama 21 hari.
Pada Gambar 9 terlihat bahwa nilai EC MOL bonggol pisang rata-rata lebih tinggi selama waktu fermentasi dibandingkan dengan nilai EC MOL keong mas dan MOL urin kelinci. Nilai EC terkait dengan kepekatan larutan serta kemampuan menghantarkan arus listrik. Selain itu juga terkait dengan banyaknya unsur hara yang terkandung dalam larutan, semakin banyak unsur hara yang terkandung maka semakin tinggi nilai EC yang berarti bahwa kemampuan larutan tersebut untuk mengantarkan ion listrik ke akar tanaman semakin tinggi. Nilai EC
tergantung dari jenis ion yang terkandung dalam larutan, konsentrasi ion dan suhu larutan.
Nilai EC MOL bonggol pisang lebih tinggi daripada MOL keong mas dan MOL urin kelinci walaupun berdasarkan analisis unsur hara (Tabel 3) MOL urin kelinci mempunyai beberapa kandungan nilai unsur hara lebih tinggi. Hal ini diduga karena konsentrasi ion pada MOL bonggol pisang dan MOL keong mas lebih tinggi daripada MOL urin kelinci sehingga lebih pekat. Konsentrasi yang tinggi ini dipengaruhi oleh banyaknya jumlah partikel terlarut yang menyebabkan jarak antar partikel menjadi lebih rapat dan kemungkinan untuk terjadinya tumbukan lebih besar sehingga kemampuan untuk menghantarkan arus listriknya lebih besar. Menurut pernyataan Chalcedaas (1998) EC mengukur jumlah total partikel bermuatan listrik dalam larutan, tetapi tidak membedakan antara satu ion dengan ion lain sehingga EC tidak dapat mendeteksi keseimbangan hara dalam suatu larutan.
Nilai Eh MOL
Hasil pengukuran nilai Eh selama 21 hari pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci disajikan dalam Gambar 10.
Gambar 10 Nilai Eh pada MOL bonggol pisang, MOL keong mas dan MOL urin kelinci selama 21 hari.
Pada Gambar 10 terlihat bahwa dengan semakin lama waktu fermentasi nilai Eh semakin menurun. MOL bonggol pisang pada hari ke-1 mempunyai nilai Eh sebesar 175 m/V dan pada hari ke-21 nilai Eh sebesar -271 m/V. MOL keong
mas pada hari ke1 terukur nilai Eh sebesar 269 m/V dan pada hari ke21 sebesar -381 m/V sedangkan MOL urin kelinci pada hari ke-1 mempunyai nilai Eh sebesar 173 m/V menurun hingga -158 m/V pada hari ke-21 (Tabel Lampiran 7).
Kondisi MOL yang berupa larutan berpengaruh pada nilai Eh. Terjadi penurunan nilai Eh dengan semakin lama waktu fermentasi. Nilai Eh yang tinggi dan positif menunjukkan kondisi oksidatif, sebaliknya nilai Eh yang rendah bahkan negatif menunjukkan kondisi reduktif (Ponnamperuma, 1976). Nilai Eh bervariasi antara +400 sampai +700 mV selama oksigen masih ada dalam larutan. Setelah oksigen habis tingkat reduksi akan berkisar antara +400 sampai -300 mV. Pada MOL bonggol pisang, perubahan suasana menjadi reduktif terjadi lebih awal. Nilai Eh ini berpengaruh terhadap kehidupan mikrob, kondisi reduksi
menggambarkan konsumsi O2 tinggi dan sebagai indikator aktivitas mikrob yang
tinggi.
Kandungan unsur hara
Analisis kimia yang meliputi unsur hara makro dan mikro serta nisbah C/N yang terkandung dalam larutan MOL bonggol pisang, MOL keong mas dan MOL urin kelinci disajikan pada Tabel 3.
Tabel 3 Kandungan unsur hara dan nisbah C/N MOL bonggol pisang, MOL keong mas dan MOL urin kelinci
Kandungan unsur
hara Bonggol pisang Keong mas Urin kelinci
Proses fermentasi dilihat dari segi perubahan fisik berarti dekomposisi terhadap bentuk fisik dari bahan padatan. Hal ini berarti bahwa akan terjadi pembebasan sejumlah unsur penting dalam bentuk senyawa-senyawa kompleks maupun senyawa-senyawa sederhana kedalam larutan fermentasi.
Pada Tabel 3 dapat dilihat bahwa MOL keong mas mempunyai kandungan N tersedia dan nisbah C/N lebih tinggi daripada kedua MOL yang lain. Tingginya nilai N ini diduga selain berasal dari kandungan N bahan (Tabel Lampiran 6), juga seperti diketahui bahwa keong mas mengandung protein yang cukup tinggi 12,2 g/100 g daging keong mas (Suharto dan Kurniawati, 2008). Didalam jaringan N merupakan komponen penyusun dari banyak senyawa esensial seperti protein, asam amino, asam nukleat, nukleotida dan banyak senyawa penting untuk metabolisme. Pada proses dekomposisi (Buckman dan Brady, 1982) protein merupakan senyawa yang cepat terurai. Penguraian ini menghasilkan bentuk-bentuk sederhana senyawa nitrogen seperti NH4+, NO2-, NO3- maupun N2. Pada Tabel 3 juga dapat dilihat MOL keong mas memiliki kandungan P lebih tinggi daripada kedua MOL yang lain. Hal ini diduga berasal dari kandungan P bahan. Pada MOL urin kelinci kandungan unsur K, Ca, Mg, Cu, Zn, Fe, Mg lebih tinggi dibandingkan MOL bonggol pisang dan MOL keong mas. Ini menunjukkan bahwa MOL urin kelinci mempunyai nilai nutrisi yang lebih baik.
Identifikasi mikrob
Hasil identifikasi mikrob yang diisolasi dari MOL bonggol pisang, MOL keong mas dan MOL urin kelinci dengan menggunakan media selektif NFM, NFB, Pikovskaya dan CMC dapat dilihat pada Tabel 4. Karakterisasi dari isolat bakteri dan fungi yang dimurnikan didapatkan hasil seperti dapat dilihat pada Tabel Lampiran 8 dan 9.
Isolat BMBP1, BMKM1 dan BMUK1 merupakan isolat yang dapat tumbuh pada media NFM yang merupakan media selektif untuk isolasi
ada untuk diidentifikasi yaitu koloni tunggal dan mempunyai bentuk paling besar,
moist dan bening. Berdasarkan hasil identifikasi isolat tersebut bukan
Azotobacter melainkan teridentifikasi sebagai Staphylococcus sp. dan Bacillus sp. Hal ini menunjukkan bahwa pada media NFM dapat tumbuh mikrob lain yang
mempunyai ciri seperti Azotobacter. Azotobacter merupakan mikrob penambat N2,
sehingga kedua mikrob tersebut diduga mempunyai kemampuan seperti
Azotobacter, oleh karena itu dimasukkan kedalam golongan Azotobacter-like.
Tabel 4 Mikrob yang diisolasi dari MOL bonggol pisang, MOL keong mas dan MOL urin kelinci dengan menggunakan media selektif
Media
isolasi Sumber isolat Kode Identifikasi
NFM
MOL bonggol pisang BMBP1 Tidak teridentifikasi
MOL keong mas BMKM1 Staphylococcus sp.
MOL urin kelinci BMUK1 Bacillus sp.
NFB
MOL bonggol pisang BMBP2 Bacillus sp.
MOL keong mas BMKM2 Staphylococcus sp.
MOL urin kelinci BMUK2 Rhizobium sp.
Pikovskaya
MOL bonggol pisang BMBP3 Aeromonas sp.
FMBP3 Aspergillus niger
MOL keong mas BMKM3 Tidak teridentifikasi
FMKM3 Aspergillus niger
MOL urin kelinci BMUK3 Pseudomonas sp.
FMUK3 Aspergillus niger
CMC
MOL bonggol pisang FMBP4 Tidak teridentifikasi
MOL keong mas FMKM4 Aspergillus niger
MOL urin kelinci FMUK4 Verticillium sp.
Keterangan: B=Bakteri; F=fungi; MBP=MOL Bonggol Pisang; MKM=MOL Keong Mas; MUK=MOL UrinKelinci;1=media NFM; 2=media NFB; 3=media Pikovskaya; 4=media CMC
Isolat BMBP2, BMKM2 dan BMUK2 merupakan isolat yang dapat tumbuh pada media NFB yang merupakan media selektif untuk isolasi
Azospirillum yang berbentuk semi padat. Mikrob yang tumbuh pada media ini mempunyai ciri khas yaitu membentuk pelikel berwarna putih. Pada penelitian ini koloni yang diambil untuk diidentifikasi berasal dari pelikel yang paling jelas. Berdasarkan hasil identifikasi, ternyata bukan Azospirillum yang teridentifikasi
menunjukkan bahwa pada media ini yang berbentuk pelikel tidak hanya
Azospirillum akan tetapi terdapat mikrob-mikrob lain yang dapat tumbuh dan mempunyai bentuk yang sama. Mikrob-mikrob yang teridentifikasi tersebut
diduga mempunyai kemampuan seperti Azospirillum sehingga dimasukkan
kedalam golongan Azospirillum-like.
Isolat BMBP3, BMKM3 dan BMUK3 merupakan isolat yang dapat
tumbuh pada media Pikovskaya, media selektif untuk isolasi MPF. Media ini
berwarna putih keruh karena mengandung P tidak larut seperti kalsium fosfat. Ciri dari koloni mikrob yang berpotensi dapat melarutkan fosfat yang tidak tersedia adalah adanya zona bening (halozone) disekitar koloni. Pada penelitian ini, dasar untuk menentukan isolat yang akan identifikasi adalah dipilih satu koloni yang mempunyai zona bening paling luas. Berdasarkan hasil identifikasi
didapatkan Aeromonas sp. dan Pseudomonas sp. BMKM3 tidak teridentifikasi.
Aeromonas sp. dan Pseudomonas sp. termasuk dalam kelompok MFP yaitu mikrob yang mempunyai kemampuan melarutkan P yang terfiksasi dalam tanah dan mengubahnya menjadi bentuk yang tersedia sehingga dapat diserap oleh tanaman.
Isolat FMBP3, FMKM3 dan FMUK3 juga merupakan isolat yang berasal dari media Pikovskaya. Berdasarkan hasil identifikasi didapatkan bahwa isolat
yang diidentifikasi adalah Aspergillus niger. Aspergillus niger termasuk kedalam
fungi pelarut fosfat, yaitu fungi yang mempunyai kemampuan seperti bakteri pelarut fosfat.
Isolat FMBP4, FMKM4 dan FMUK4 diisolasi dari media CMC. Media CMC merupakan media untuk isolasi fungi selulolitik. Aktivitas mikrob selulolitik pada media CMC ditunjukkan denga adanya warna jernih tepat disekitar koloni setelah diwarnai merah kongo 1%. Berdasarkan hasil identifikasi pada media ini terdapat Aspergillus niger dan Verticillium sp. FMBP4 tidak teridentifikasi.