MENGGUNAKAN METODE SPEKTROSKOPI
ANGGI MANIUR
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Tetrakloromerkurat dengan Menggunakan Metode Spektroskopi. Dibimbing oleh
IRMANSYAH dan MAMAT RAHMAT.
Metode pengukuran gas Sulfur dioksida (SO2) yang sering digunakan di Indonesia adalah metode pararosanilin yang prosedurnya diatur pemerintah dalam Standar Nasional Indonesia 19-7119.7-2005. Kelemahan dari pengukuran dengan metode ini adalah hasil pengukuran tidak ditampilkan pada saat itu tetapi dua hari sesudahnya. Pada penelitian ini gas SO2 dijerap dalam larutan penjerap tetrakloromerkurat (TCM) kemudian diukur dengan metode spektroskopi sebagai tahapan awal pembuatan sensor kristal fotonik satu dimensi untuk mendeteksi gas SO2. Gas SO2 bereaksi dengan larutan penjerap TCM menghasilkan larutan tak berwarna dan panjang gelombang absorbansinya berada pada daerah ultraviolet, yaitu 280,11 nm. Penelitian ini mengkarakterisasi gas SO2 dengan metode spektroskopi, menghitung konsentrasi gas SO2 yang terjerap, menentukan kurva kalibrasi, menentukan konsentrasi secara real-time pada saat penjerapan beserta menentukan α (absorpsivitas) sebagai dasar pembuatan sensor kristal fotonik. Kurva kalibrasi yang diperoleh menunjukkan peningkatan konsentrasi gas SO2 yang terjerap menyebabkan intensitas yang ditransmisikan semakin menurun secara eksponensial. Nilai koefisien absorpsi yang diperoleh adalah 0,005 m2/ g.
MENGGUNAKAN METODE SPEKTROSKOPI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Institut Pertanian Bogor
Oleh:
ANGGI MANIUR
G74080011
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama : Anggi Maniur
NRP : G74080011
Departemen Fisika Institut Pertanian Bogor
Disetujui,
Dr. Ir. Irmansyah, M.Si.
Mamat Rahmat, M.Si.
Pembimbing I
Pembimbing II
Diketahui,
Dr. Akhiruddin Maddu, M.Si.
Ketua Departemen
melimpahkan rahmat dan karunia-Nya kepada saya sebagai penulis sehingga
dapat menyelesaikan laporan penelitian yang berjudul ”Karakterisasi Gas Sulfur
Dioksida dalam Penjerap Tetrakloromerkurat dengan Menggunakan Metode
Spektroskopi”.
Skripsi ini disusun agar penulis sebagai salah satu syarat kelulusan
program sarjana di Departemen Fisika Fakultas Matematika dan Ilmu
Pengetahuan Alam Institut Pertanian Bogor.
Keterbatasan manusia membuat penulis merasa perlu kritik dan saran dari
rekan-rekan demi perbaikan selanjutnya. Terima kasih.
Bogor, Juli 2012
1.
Tuhan Yesus Kristus untuk kasih karunia-Nya dan setiap berkat yang ada di
kehidupan penulis. Skripsi ini dipersembahkan untuk kemuliaan nama Tuhan.
2.
Bapak Sintua Parbuntian Hutasoit beserta keluarga besar Hutasoit, Mama
Anita Theresia Sitinjak beserta keluarga besar Sitinjak, Abang Roni Hutasoit,
S.P., Kakak Uly Christina, S.Pd., dan Kakak Julyanti,S.E., yang selalu ada
untuk penulis dalam suka maupun duka, untuk setiap kasih sayang dan segala
doa yang diberikan.
3.
Bapak Dr. Irmansyah, M.Si. sebagai pembimbing utama penulis dalam
penelitian ini atas segala nasehat dan bimbingan yang diberikan kepada
penulis dalam penelitian ini.
4.
Bapak Mamat Rahmat, M.Si. sebagai pembimbing kedua sekaligus pemimpin
dalam serangkaian penelitian tim
Photonic Crystal
atas kesabarannya
membimbing penulis dalam menyelesaikan penelitian ini.
5.
Bapak Abd. Djamil, M.Si. dan Ibu Mersi Kurniati, M.Si. sebagai penguji
yang telah bersedia menyempatkan waktunya dan memberikan masukan
kepada penulis.
6.
Bapak M. N. Indro, M.Si. sebagai editor dalam skripsi ini yang telah banyak
memberikan masukan cara penulisan kepada penulis.
7.
Kementrian Pendidikan Nasional (Kemendiknas) yang telah memberikan
Beasiswa Unggulan guna mendanai penelitian ini dan pendidikan penulis.
8.
Yayasan Karya Salemba Empat dan Perusahaan Gas Negara yang telah
memberikan beasiswa Beasiswa Reguler KSE-PGN guna membiayai
kehidupan penulis.
9.
Persekutuan Gereja Indonesia yang telah memberikan Beasiswa Yayasan
Beasiswa Oikumene guna membiayai pendidikan sarjana penulis.
10.
Mama Fince S. Lairihi beserta keluarga atas doa, dukungan, dan semangat
yang selalu diberikan kepada penulis di setiap waktu. Tuhan Yesus
memberkati.
11.
Nissa Sukmawati, Kak Dede Yulias, Kak Wenny Maulina, Kak Dita Budiarti,
Kak Arianti Tumanggor, Kak Erus Rustami, dan Kak Azis yang selalu
membantu penulis dalam penelitian. Penelitian ini tak kan selesai tanpa
kalian.
12.
Hardiyanti, sahabat yang selalu menemani penulis di kala suka maupun duka.
Terima kasih untuk segala waktu yang diberikan untuk menemani penulis.
Sahabat hanyalah sebuah kata dan kamu memberikannya makna.
13.
Ferry Albert, Friska Vida Angela Hutagaol, Stephani Utari, Andreas
Gonzales, Fitri Maisesi, dan Ghozie Dachlan. Kalian adalah orang-orang
hebat yang pernah ditemui penulis. Kesuksesan ada di tangan kita dan jangan
pernah berhenti untuk saling mendoakan.
14.
Inessya Feronica, sahabat yang selalu memotivasi penulis untuk tidak
menyerah dan terus maju, atas segala bentuk perhatian dan kasih sayang yang
diberikan di sepanjang tahun ini.
untuk keceriaan dan kasih sayang yang diberikan di sepanjang tahun ini.
18.
Kemabalam (Nidya Bela, Misran, Dewi Santami, Valentina Sokoastri, Virza
Maradhika, Ratiza Alifa), kalian adalah warga Bandarlampung di Bogor
paling hebat yang pernah penulis temui. Tetap jaga kekompakan kita.
19.
Pengajar Mafia Clubs (Ismail Saleh, Edwin Cahyadi, Zoraya Puspita, Novira
Sartika, Soni Fauzi, Akram) atas kebersamaan kita saat mengajar. Tetap jaga
kekompakan kita.
20.
Thephibhi (Haikal Catur Saputra, Pramita Riskia, Meita Puspitasari, Ivan
Daniel, Handrio Siregar, Ade Prisma, Roy Rimansyah, Uul, M. Kholid, dan
Adhitia Rahmana) atas kebersamaan kita dalam berbagai acara dan kompetisi
seni, sukses untuk kita.
21.
Rekan-rekan Fisika 43, 44, 45, 46, 47, 48 atas kebersamaan yang diberikan di
perkuliahan ini.
22.
Rekan-rekan Persekutuan Mahasiswa Kristen (PMK) IPB,
International
Association of Students in Agricultural and Related Sciences Indonesia
Penulis dilahirkan di Bekasi, 14 Oktober 1989 dari
pasangan Parbuntian Hutasoit dan Anita Theresia
Sitinjak. Penulis menyelesaikan pendidikan Taman
Kanak-Kanak hingga Sekolah Menengah Atas di
Bandarlampung yaitu TK Xaverius Panjang, SD
Xaverius 4 Bandarlampung, SMP Xaverius 3
Bandarlampung, dan SMA Negeri 2 Bandarlampung.
Penulis melanjutkan pendidikannya ke jenjang
perkuliahan di Departemen Fisika Institut Pertanian
Bogor melalui jalur Undangan Seleksi Masuk IPB
(USMI). Semasa kuliah, penulis aktif di organisasi
Paduan Suara Mahasiswa IPB Agria Swara sebagai
Tenor 2,
International Association of Students in
Agricultural and Related Sciences Indonesia, Local
Committee Bogor Agricultural University
sebagai
Staff of Human Resource
Development Department
, dan Persekutuan Mahasiswa Kristen IPB sebagai
bagian dari Komisi Kesenian.
Selama menjadi mahasiswa, penulis meraih beberapa penghargaan, antara
lain: Juara II Lomba Inovasi Teknologi Lingkungan ITS, Surabaya; Juara III
Mahasiswa Berprestasi tingkat Fakultas Matematika dan Ilmu Pengetahuan Alam
IPB (2011); Juara I Mahasiswa Berprestasi tingkat Departemen Fisika FMIPA
IPB (2011); Penerima Dana Direktorat Jenderal Pendidikan Tinggi Kementrian
Pendidikan Nasional untuk Program Kreativitas Mahasiswa – Penelitian dengan
judul
Kulkas Padang Pasir: Pemanfaatan Pasir sebagai Sekat dalam Kulkas Pot
in Pot Tanpa Energi Listrik untuk Pengawetan Bahan Pangan Sayuran dan
Buah-Buahan
(2011); Makalah Terbaik dalam Green Technology Competition ITB
dengan judul
Tungku Sekam sebagai Alternatif Energi Rumah Tangga Pedesaan
(2010); Juara I Solo Festival Musik PMK IPB (2011); bersama PSM IPB Agria
Swara meraih 2
gold medals
dan
The Most Outstanding Performance
dalam
1
stITB International Choir Competition
(2010); dan bersama
Thephibhi
menjadi
Juara I Lomba Vokal Grup pada IAC 2009, Finalis Trans TV Tallent Show
Suara
Indonesia
daerah audisi Jakarta (2010), dan Juara II
Jingle
pada acara
Tetranology
(Fateta Art and Technology
) Fakultas Teknologi Pertanian IPB (2010).
DAFTAR TABEL ...
x
DAFTAR GAMBAR ...
xi
DAFTAR LAMPIRAN ...
xii
BAB I. PENDAHULUAN ...
1
1.1 Latar Belakang Masalah...
1
1.2 Perumusan Masalah ...
1
1.3 Tujuan Penelitian ...
1
1.4 Batasan Masalah ...
1
1.5 Hipotesis ...
1
BAB II. TINJAUAN PUSTAKA ...
2
2.1 Udara ...
2
2.2 Pencemaran Udara ...
2
2.2.1 Indeks Standar Pencemar Udara ...
3
2.3 Sulfur Dioksida ...
3
2.4 Spektroskopi dan Hukum Beer-Lambert ...
4
2.5 Kristal Fotonik ...
5
BAB III. METODE PENELITIAN...
6
3.1 Waktu dan Tempat Penelitian ...
6
3.2 Alat dan Bahan ...
6
3.2.1 Alat ...
6
3.2.2 Bahan ...
6
3.3 Prosedur Penelitian ...
6
3.3.1 Penentuan Karakteristik Absorbansi dengan
Metode Spektroskopi ...
6
3.3.2 Pengambilan Data Transmitansi SO
2Menggunakan Metode
Spektroskopi
Non Real Time ...
7
3.3.2.1 Proses Penjerapan Gas SO
2...
7
3.3.2.2 Pengenceran dan Pembuatan Kurva Kalibrasi ...
7
3.3.3 Pengambilan Data Transmitansi SO
2Menggunakan Metode
Spektroskopi
Real Time ...
7
BAB IV. HASIL DAN PEMBAHASAN ...
7
4.1 Penentuan Karakteristik Absorbansi Gas SO
2...
7
4.2 Kurva Kalibrasi dan Nilai Absorpsivitas ...
8
4.3 Data
Real Time
dan Konsentrasi Gas SO
2yang Terjerap ...
9
4.4 Desain Sensor Kristal Fotonik ...
10
BAB V. KESIMPULAN DAN SARAN ...
11
5.1 Kesimpulan ...
11
5.2 Saran ...
12
DAFTAR PUSTAKA ...
12
Tabel 1. Komposisi udara kering dan bersih ...
3
Tabel 2. Nilai indeks standar pencemar udara. ...
4
Tabel 3. Pengaruh indeks standar pencemar udara untuk parameter SO
2...
4
Tabel 4. Panjang gelombang absorbansi gas SO
2dalam larutan
Gambar 1. Kota-Kota dengan Kasus Pencemaran Udara di Indonesia ...
2
Gambar 2. Prinsip penyerapan cahaya oleh larutan ...
5
Gambar 3.
Photonic Pass Band
. ...
6
Gambar 4. Perubahan transmitansi terhadap panjang gelombang ...
8
Gambar 5. Perubahan nilai transmitansi terhadap konsentrasi gas SO
2yang terjerap dalam larutan TCM ...
9
Gambar 6. Perubahan intensitas pada panjang gelombang 280,11 nm
setiap menit pada pengukuran selama 20 menit ...
9
Gambar 7. Perubahan konsentrasi gas SO
2yang terjerap terhadap waktu
secara
real time...
9
Gambar 8. Perubahan konsentrasi gas SO
2yang terjerap dalam skala
ISPU terhadap waktu secara
real time
...
10
Gambar 9. Konsentrasi gas SO
2yang terjerap setiap menit...
10
Gambar 10.Desain PPB kristal fotonik pada panjang gelombang
absorbansi 280,11 nm ...
11
Lampiran 1. Diagram alir penelitian ...
14
Lampiran 2. Data lapangan proses penjerapan dan perhitungan
konsentrasi gas SO
2...
15
Lampiran 3. Data lapangan proses penjerapan dan penentuan
nilai absorpsivitas. ...
19
Lampiran 4. Perhitungan menentukan nilai konsentrasi pada setiap
titik pengenceran. ...
20
Lampiran 5. Perhitungan normalisasi menentukan nilai intensitas dari
transmitansi pada proses pengenceran ...
20
Lampiran 6. Konversi satuan nilai intensitas dari
counts
menjadi watt/m
2. ...
20
Lampiran 7. Perhitungan untuk menentukan nilai indeks standar pencemar
udara (ISPU) dari konsentrasi gas SO
2yang terjerap. ...
21
Lampiran 8. Cara Uji Kadar Sulfur Dioksida (SO
2) dengan
Metoda Pararosanilin dengan menggunakan
spektrofotometer (SNI 19-7119.7-2005) ...
22
Lampiran 9. Skema penjerapan gas SO
2untuk menentukan
nilai panjang gelombang absorbansi ...
36
Lampiran 10.Skema pengujian gas SO
2real time
dengan
BAB I
PENDAHULUAN
1.1
Latar Belakang Masalah
Pencemaran udara diartikan sebagai adanya bahan-bahan atau zat-zat asing di dalam udara yang menyebabkan perubahan susunan (komposisi) udara keadaan normalnya.1 Kehadiran zat pencemar (berbentuk gas beracun dan partikel kecil yang dinamakan aerosol) ke dalam atmosfer sampai melampaui batas ambangnya akan mengganggu kehidupan manusia, hewan dan tumbuhan.2 Bila keadaan tersebut terjadi, maka udara dikatakan telah tercemar.Pencemaran udara di beberapa kota besar yang berpenduduk padat di Indonesia kini sudah mulai dirasakan terutama di daerah-daerah pemukiman dan perindustrian.3 Kecenderungan meningkatnya pencemaran udara adalah sejalan dengan bertambahnya konsumsi bahan bakar fosil terutama minyak bumi oleh industri, transportasi dan pemakaian rumah tangga. Pencemaran udara pada dasarnya berbentuk partikel (debu, gas, timah hitam) dan gas (Karbon Monoksida (CO), Nitrogen Oksida (NOx) , Sulfur Oksida (SOx), Hidrogen Sulfida (H2S), hidrokarbon). Udara yang tercemar dengan partikel dan gas ini dapat menyebabkan gangguan kesehatan yang berbeda tingkatan dan jenisnya tergantung dari macam, ukuran dan komposisi kimiawinya.4
Metode pengukuran pencemar udara sulfur dioksida (SO2) saat ini menggunakan metode pararosanilin sesuai dengan Standar Nasional Indonesia (SNI).5 Kelemahan dari metode ini adalah data yang tidak real time serta masih digunakan larutan tambahan yaitu formaldehida dan pararosanilin ke dalam larutan penjerap saat proses spektroskopi.
Hasil yang diharapkan dari karakterisasi gas SO2 dalam penjerap tetrakloromerkurat (TCM) dengan metode spektroskopi ini adalah didapatkannya nilai absorpsivitas untuk larutan TCM hasil penjerapan dan
transmitansi sebagai dasar untuk pembuatan desain kristal fotonik satu dimensi sebagai sensor gas SO2. Dengan menggunakan sensor berbasis kristal fotonik yang tersusun dari bahan periodik dengan indek bias yang berbeda, pengukuran dapat dilakukan secara kontinu dan data yang diperoleh real time karena proses pengukuran yang cepat.6
1.2 Perumusan Masalah
Bagaimana hasil kurva kalibrasi pengukuran kadar SO2 menggunakan metode spektroskopi?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk: 1. Menentukan karakteristik absorbansi
gas SO2
pada metode spektroskopi
. 2. Menghitung konsentrasi SO2 yangbereaksi dengan larutan penjerap TCM.
3. Menentukan kurva kalibrasi hubungan antara konsentrasi dan transmitansi dengan menggunakan metode spektroskopi.
4. Menentukan nilai α (absorpsivitas) untuk desain pembuatan sensor kristal fotonik satu dimensi untuk gas SO2.
1.4 Batasan Masalah
Batasan masalah dalam penelitian ini adalah: penentuan karakteristik absorbansi metode spektroskopi untuk gas SO2; penentuan kadar SO2 dengan menghitung konsentrasi (µg/m3); melakukan perbandingan terhadap hasil SNI; menentukan kurva kalibrasi SO2; dan menentukan nilai α (absorpsivitas).
1.5 Hipotesis
BAB II
TINJAUAN PUSTAKA
2.1 Udara
Udara adalah suatu campuran gas yang terdapat pada lapisan yang mengelilingi bumi. Komposisi campuran gas tersebut tidak selalu konstan dari waktu ke waktu. Komponen yang konsentrasinya paling bervariasi adalah uap air dan karbon dioksida. Jumlah air yang terdapat di udara bervariasi tergantung dari cuaca dan suhu.7
Giddings8 mengemukakan bahwa atmosfer pada keadaan bersih dan kering akan didominasi oleh 4 gas penyusun atmosfer, yaitu 78,09% N2; 20,95% O2; 0,93% Ar; dan 0,032% CO2; sedangkan gas-gas lainnya sangat kecil konsentrasinya. Komposisi udara kering , yaitu semua uap air telah dihilangkan. Komposisi udara kering yang bersih dikumpulkan di sekitar laut, dapat dilihat pada Tabel 1.
2.2 Pencemaran Udara
Pencemaran udara didefinisikan sebagai masuknya zat pencemar ke dalam atmosfer atau berubahnya komposisi udara baik oleh proses alami maupun
akibat kegiatan manusia sehingga menurunkan kualitas udara hingga tidak berfungsi sesuai peruntukkannya, yang diatur oleh UU-RI No. 4 Tahun 1982 tentang lingkungan hidup dan Keputusan Menteri No. KEP-02/MENKLH/I/1988 tentang pedoman penetapan baku mutu lingkungan.9
Pencemaran udara terjadi bila penambahan bahan atau zat ke dalam udara dalam konsentrasi dan jumlah tertentu sehingga mengakibatkan efek negatif yang dapat diukur pada organisme atau benda.10
Dari beberapa pengertian mengenai pencemaran udara tersebut di atas, dapat diartikan bahwa untuk mengetahui apakah lingkungan udara sudah tercemar atau belum dapat dilakukan perbandingan antara kondisi udara ideal dan kondisi udara aktual. Setiap unsur gas di udara dapat dibandingkan dengan unsur gas yang sama yang terdapat pada komposisi udara normal.11
Gambar 1. berikut memper-lihatkan jenis pencemaran udara yang terjadi di Indonesia berdasarkan pemberitaan di media massa.12
Gambar 1. Kota-Kota dengan Kasus Pencemaran Udara di Indonesia.12 Jakarta
Medan
Tabel 1. Komposisi udara kering dan bersih8
Komponen Konsentrasi dalam volume
(ppm) (%)
Nitrogen (N2) 780.900,0000 78,09000000
Oksigen (O2) 209.500,0000 20,95000000
Argon (Ar) 9.300,0000 0,93000000
Karbon dioksida (CO2) 320,0000 0,03200000
Neon (Ne) 18,0000 0,00180000
Helium (He) 5,2000 0,00052000
Metana (CH4) 1,5000 0,00015000
Kripton (Kr) 1,0000 0,00010000
H2 0,5000 0,00005000
H2O 0,2000 0,00002000
CO 0,1000 0,00001000
Xe 0,0800 0,00000800
O3 0,0200 0,00000200
NH3 0,0060 0,00000060
NO2 0,0010 0,00000010
NO 0,0006 0,00000006
SO2 0,0002 0,00000002
H2S 0,0002 0,00000002
2.2.1 Indeks Standar Pencemar
Udara
Indeks Standar Pencemar Udara (ISPU) digunakan sebagai masukan bagi pengambilan tindakan dalam upaya
pengendalian pencemaran udara. ISPU
adalah angka yang tidak mempunyai satuan yang menggambarkan kondisi kualitas udara lingkungan di lokasi dan waktu tertentu yang didasarkan kepada dampak terhadap kesehatan manusia, nilai estetika dan makhluk hidup lainnya.13
Rentang dan batas dari nilai indeks serta pengaruhnya dapat dilihat pada Tabel 2 dan Tabel 3. Tabel 2 menunjukkan rentang dan batas dari nilai ISPU. Tabel 3 menunjukkan rentang dan batas dari nilai ISPU SO2 serta pengaruhnya terhadap kesehatan manusia, nilai estetika dan makhluk hidup lainnya.
2.3 Sulfur Dioksida
SO2 adalah gas yang tidak mudah menyala, tidak mudah meledak, tidak berwarna, mudah larut dalam air, tetapi berbau dan dapat menyebabkan iritasi.
SO2 merupakan salah satu jenis agen oksidasi dan agen reduksi pada temperatur ruangan. Di atmosfer, SO2 memiliki kemampuan bereaksi secara fotokimia ataupun katalitik dengan material lain yang dapat membentuk sulfur trioksida, asam sulfur, dan garam dari asam sulfur.14
Pada konsentrasi antara 0,8 ppm – 1 ppm di udara, kehadirannya dapat dirasakan oleh kebanyakan orang, bahkan jika konsentrasinya lebih dari 8 ppm, gas ini berbau tajam dan dapat menyebabkan iritasi pada manusia. 14
Sumber-sumber sulfur secara alami adalah evaporasi percikan air laut, erosi debu
dari tanah kering yang mengandung sulfur, uap letusan gunung berapi, emisi H2S secara
biogenik dan persenyawaan organik
yang
mengandung
sulfur.
SO
2terdapat di alam secara normal pada
konsentrasi 0.3 – 1 ppm. Nilai
Ambang Batas untuk SO
2adalah
Tabel 2. Nilai indeks standar pencemar udara.13
Kategori Rentang ISPU Penjelasan
Baik 0 – 50
Tingkat kualitas yang tidak memberikan efek bagi kesehatan manusia atau hewan dan tidak berpengaruh pada tumbuhan, bangunan ataupun nilai estetika
Sedang 51 – 100
Tingkat kualitas udara yang tidak berpengaruh pada kesehatan manusia ataupun hewan tetapi berpengaruh pada tumbuhan yang sensitif, dan nilai estetika
Tidak Sehat 101 – 199
Tingkat kualitas udara yang bersifat merugikan pada manusia ataupun kelompok hewan yang sensitif atau bisa menimbulkan kerusakan pada tumbuhan ataupun nilai estetika
Sangat Tidak
Sehat 200 – 299
Tingkat udara yang dapat merugikan kesehatan pada sejumlah segmen populasi yang terpapar
Berbahaya 300 – lebih
Tingkat kualitas udara berbahaya yang secara umum dapat merugikan kesehatan yang serius pada populasi
Tabel 3. Pengaruh indeks standar pencemar udara untuk parameter SO2. 13
Kategori Rentang ISPU Penjelasan
Baik 0 – 50 Luka pada beberapa spesies tumbuhan akibat kombinasi dengan O3 (Selama 4 Jam)
Sedang 51 – 100 Luka pada beberapa spesies tumbuhan
Tidak Sehat 101 – 199 Bau, Meningkatnya kerusakan tumbuhan
Sangat Tidak Sehat 200 – 299 Meningkatnya sensitivitas pada pasien berpenyakit asma dan bronchitis
Berbahaya 300 – lebih Tingkat yang berbahaya bagi semua populasi yang terpapar
2.4 Spektroskopi dan Hukum
Beer-Lambert
Interaksi dari energi radiasi dengan bahan adalah merupakan dasar dari teori spektroskopi. Tidak semua zat dapat menyerap energi radiasi dari sinar. Energi radiasi dapat diserap jika dibutuhkan oleh zat untuk mengadakan
Transisi elektron adalah perpindahan di mana elektron yang terdapat di sekitar inti atom di dalam suatu molekul naik ke level energi yang lebih tinggi. Biasanya radiasi yang mempunyai energi antara 10 sampai 100 kkal/mol (ultraviolet, visible, mendekati infrared) dapat menyebabkan transisi elektron.16
Apabila radiasi atau cahaya putih dilewatkan melalui larutan, maka radiasi dengan panjang gelombang tertentu akan diserap (absorpsi) dan radiasi lainnya akan diteruskan (transmisi).17
Apabila suatu berkas radiasi dengan intensitas I0 dilewatkan melalui suatu larutan dalam wadah transparan maka sebagian radiasi akan diserap sehingga intensitas radiasi yang diteruskan I menjadi lebih kecil daripada I0. Transmitans dengan simbol T dari larutan merupakan fraksi dari intensitas radiasi yang diteruskan atau ditransmisi oleh larutan, yaitu:
T = I / I0 x 100% (1) Transmitans biasa dinyatakan dalam persen (%).17
Keterangan:
I0 = intensitas sinar yang datang; I = intensitas sinar yang
ditransmisikan;
c = konsentrasi larutan (kg/m3);
α = absorpsivitas (m3.kg-1.m-1);
x = tebal kuvet (m).
Gambar 2. Prinsip penyerapan cahaya oleh larutan.
Pengukuran dengan metode spektroskopi didasarkan hubungan antara berkas radiasi elektromagnetik yang ditransmisikan atau yang diabsorbsi dengan tebalnya cuplikan dan konsentrasi dari komponen penjerap. Penggunaan untuk analisa kuantitatif didasarkan pada Hukum Beer-Lambert yang menyatakan hubungan empirik antara intensitas cahaya yang ditransmisikan dengan tebalnya larutan dan hubungan antara intensitas tadi dengan konsentrasi zat.18
A = log I0 / I = α . x. c (2) dengan:
A = serapan;
Panjang gelombang (λmaks) yang digunakan untuk melakukan analisis kuantitatif suatu zat biasanya merupakan panjang gelombang di mana memberikan serapan yang maksimum, sehingga keakuratan pengukurannya akan lebih besar.18
2.5 Kristal Fotonik
Kristal fotonik adalah material dielektrik yang memiliki indeks bias atau permitivitas berbeda secara periodik, sehingga dapat mencegah perambatan cahaya dengan frekuensi dan arah tertentu. Rentang daerah frekuensi tersebut dinamakan photonic band gap (PBG).19
PBG terjadi jika gelombang elektromagnetik (EM) tegak lurus yang kontinu masuk ke struktur kristal fotonik. Sebagian gelombang tersebut direfleksikan oleh setiap lapisan batas medium dielektrik yang berbeda, dan setiap gelombang yang direfleksikan sefase dan saling bertumpangan sehingga terjadi interferensi konstruktif pada gelombang refleksinya serta menyebabkan pemantulan total pada selang panjang gelombang disekitar panjang gelombang operasinya.20
Pada saat periodisitas kristal fotonik diganggu dengan adanya cacat, maka akan muncul fenomena photonic pass band (PPB). Foton yang berasal I
I
I
0dari pancaran gelombang EM akan terlokalisasi di sekitar cacat, menimbulkan peningkatan medan yang besar. Akibatnya terbentuk mode resonansi di dalam PBG yang mana frekuensi gelombang EM datang sama dengan frekuensi mode cacat kristalnya. Lebar dan posisi PPB ini ternyata sangat bergantung pada karakteristik material (indeks bias) dan geometri (lebar) lapisan defeknya.20
Pada kristal fotonik dengan satu cacat, pengaruh indeks bias medium background sangat sensitif terhadap transmitansi PPB, sehingga pemilihan indeks bias medium background dapat digunakan untuk aplikasi sensor terutama untuk karakterisasi material berupa fluida (gas atau cair). Mekanisme yang dapat digunakan adalah dengan menempatkan cacat kristal fotonik dalam lingkungan yang ingin diketahui sifat fluidanya melalui pengukuran indeks bias menggunakan sistem sensor.20
Gambar 3. Photonic Pass Band.18
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian
Penelitian ini dilakukan mulai September 2011 hingga Februari 2012 di Laboratorium Biofisika Departemen Fisika, Laboratorium Fisika Material
Departemen Fisika, dan Pusat Penelitian Lingkungan Hidup (PPLH) yang seluruhnya berkedudukan di Institut Pertanian Bogor.
3.2 Alat dan Bahan
3.2.1 Alat
1. Tabung gelas (diameter 2,5 cm; tinggi 19,5 cm).
2. Tabung impinger (diameter 2,5 cm; tinggi 19,5 cm).
3. Spektrofotometer, USB Ocean Optik – 4000.
4. Sumber cahaya UV-VIS. 5. Pompa penghisap . 6. Bubbler.
7. Selang aliran gas. 8. Termometer digital. 9. Flowmeter.
10. Stopwatch. 11. Pipet tetes. 12. Gelas ukur. 13. Kuvet kuarsa.
14. Tabung penyimpan sampel. 15. Laptop.
16. Motor.
3.2.2 Bahan
1. Udara lingkungan.
2. Larutan penjerap tetrakloro-merkurat (TCM).
3. Air suling.
3.3 Prosedur Penelitian
3.3.1 Penentuan Karakteristik
Absorbansi dengan Metode
Spektroskopi
Larutan penjerap TCM dipersiapkan sebanyak 10 mL dan dimasukan ke dalam tabung penjerap yang telah disambungkan dengan pompa penghisap. Proses penghisapan dengan udara lingkungan dilakukan selama satu jam dengan laju alir 0,5 L/menit. Hasil dari pengujian dianalisis dengan spektroskopi di laboratorium untuk mendapatkan nilai panjang gelombang serapan maksimum, yang selanjutnya digunakan sebagai karakteristik absorbansi gas SO2 dalam penjerap TCM. % T ra n sm it an ce 100 80 60 40 20 0
350 400 450 500 550 600 650 700 750
3.3.2 Pengambilan Data
Transmitansi SO
2Menggunakan Metode
Spektroskopi
Non Real Time
3.3.2.1 Proses Penjerapan Gas SO
2 Larutan penjerap TCM dipersiapkan sebanyak 10 mL dan dimasukan ke dalam tabung penjerap yang telah disambungkan dengan pompa penghisap. Proses penghisapan dengan udara lingkungan dilakukan selama satu jam dengan laju alir 0,5 L/menit. Setiap 15 menit dicatat nilai suhu dan kelembaban untuk perhitungan di laboratorium PPLH IPB.3.3.2.2 Pengenceran dan
Pembuatan Kurva Kalibrasi
a) Optimalkan alat spektro-fotometer sesuai petunjuk penggunaan alat. b) Sampel gas SO2 10 mL dibagi dua,
5 mL pertama disimpan dalam tabung penyimpan sampel untuk pengujian di Lab PPLH IPB dan 5 mL dimasukan ke dalam gelas ukur dan diuji transmitansi terlebih dahulu sebagai sampel murni sebelum dencerkan.
c) Setiap penambahan larutan penjerap murni sebanyak 1 mL data transmitansi di catat.
d) Pengenceran di lakukan sampai nilai transmitansi mendekati 100%. e) Buat kurva kalibrasi hubungan
antara transmitansi dan konsentrasi.
3.3.3 Pengambilan Data
Transmitansi SO
2Menggunakan Metode
Spektroskopi
Real Time
Sumber cahaya LED UV dan fiber optic yang telah terhubung dengan ocean optic spectro-photometer USB 4000 UV-VIS dipasang pada tabung impinger kemudian tabung impinger dihubungkan dengan pompa penghisap
menggunakan selang. Pompa penghisap diatur dengan laju alir 0,5 L/menit. Proses penghisapan selama 20 menit. Data dicatat setiap 1 menit adalah transmitansi, suhu, kelembaban dan laju alir.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Karakteristik Absorbansi
Gas SO
2.Proses penjerapan gas SO2 menggunakan larutan tetrakloromerkurat (TCM) sesuai dengan metode pararosanilin (Lampiran 7). Jumlah sampel hasil pengambilan sampel tahap 1 sebanyak 11 sampel. Gas SO2 larut dalam penjerap TCM membentuk senyawa kompleks diklorosulfo-natomerkurat. Tidak ada perubahan warna larutan pada proses penjerapan.
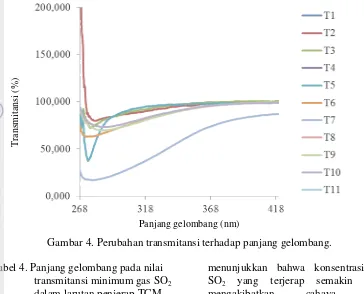
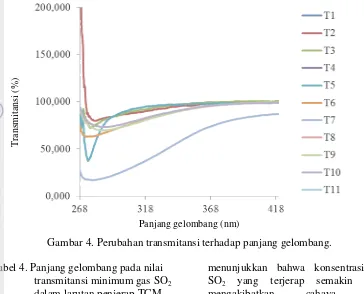
Spektrum transmitansi cahaya UV-Vis ketika dilewatkan pada larutan diklorosulfonatomerkurat ditampilkan pada Gambar 4. T1 adalah transmitansi hari pertama, T2 adalah transmitansi hari kedua dan selanjutnya. Secara keseluruhan selang panjang gelombang untuk serapan gas SO2 berada pada 268-318 nm dengan nilai ekstrim serapan yang bervariasi dari 277,14-281,38 nm sehingga diperoleh nilai panjang gelombang rata-rata pada transmitansi minimum gas SO2 adalah 280,11 nm seperti ditampilkan pada Tabel 4. Nilai panjang gelombang pada transmitansi minimum merupakan nilai panjang gelombang pada absorbansi maksimum. Panjang gelombang pada absorbansi maksimum ini merupakan karakteristik absorbansi dari gas SO2 dalam larutan TCM dan dijadikan sebagai acuan pembuatan sensor kristal fotonik satu dimensi.
Gambar 4. Perubahan transmitansi terhadap panjang gelombang.
Tabel 4. Panjang gelombang pada nilai transmitansi minimum gas SO2 dalam larutan penjerap TCM.
Transmitansi Panjang Gelombang (nm)
T1 281,38
T2 279,90
T3 281,38
T4 281,38
T5 277,14
T6 280,11
T7 280,11
T8 280,11
T9 280,11
T10 280,11
T11 280,11
Rata-rata 280,11
4.2 Kurva Kalibrasi dan Nilai Absorpsivitas
Validasi data hasil perhitungan konsentrasi gas SO2 yang terjerap berdasarkan data laboratorium Pusat Pengembangan Lingkungan Hidup (PPLH) Institut Pertanian Bogor (Lampiran 2). Kurva kalibrasi antara transmitansi dan konsentrasi (Gambar 5)
menunjukkan bahwa konsentrasi gas SO2 yang terjerap semakin besar mengakibatkan cahaya yang ditransmisikan semakin kecil karena diserap oleh larutan. Gambar 5 merupakan perbandingan perhitungan konsentrasi dengan pengujian di PPLH IPB, semakin besar konsentrasi gas SO2 yang terjerap semakin kecil cahaya yang ditransmisikan dan perubahan ini terjadi secara eksponensial. Pada penelitian ini memanfaatkan perubahan konsentrasi dan ketebalan dibuat tetap.
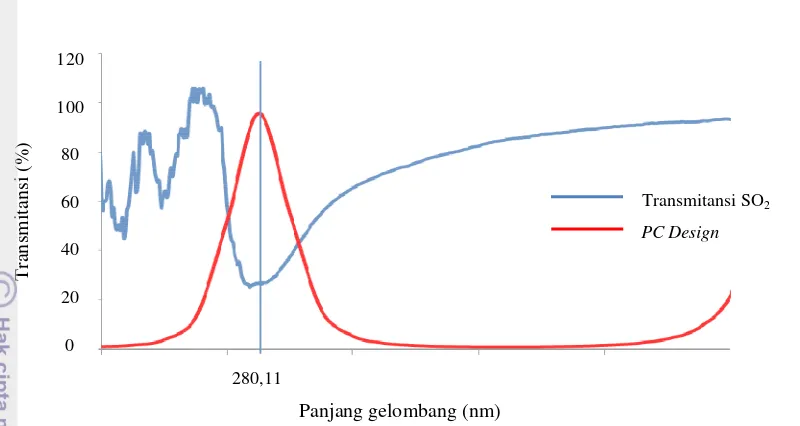
Absorpsivitas merupakan karakteristik material dan sifat penyerapan cahaya oleh larutan, hal ini menandakan bahwa seberapa besar larutan tersebut menyerap cahaya saat dilewatkan. Berdasarkan pada Gambar 5, diperoleh nilai absorpsivitas sebesar 0,005 m2/ g dari persamaan garis sesuai dengan persamaan Beer-Lambert dan nilai ini digunakan sebagai dasar untuk desain kristal fotonik satu dimensi untuk mendeteksi gas SO2 sesuai dengan panjang gelombang absorbansi gas SO2 dalam larutan penjerap TCM, yaitu 280,11 nm.
Panjang gelombang (nm)
Gambar 5. Perubahan nilai transmitansi terhadap konsentrasi gas SO2 yang terjerap dalam larutan TCM.
4.3 Data Real Time dan Konsentrasi Gas SO2 yang Terjerap.
Data real time menunjukkan konsentrasi gas SO2 yang terjerap dalam larutan penjerap TCM pada setiap menit, sehingga dapat diketahui secara langsung nilainya tanpa menunggu waktu yang lama dalam pengujian dan analisis sampel di laboratorium. Hal ini menjadi kelebihan dibandingkan metode pararosanilin yang merupakan Standar Nasional Indonesia untuk pengukuran gas SO2 (Lampiran 7).
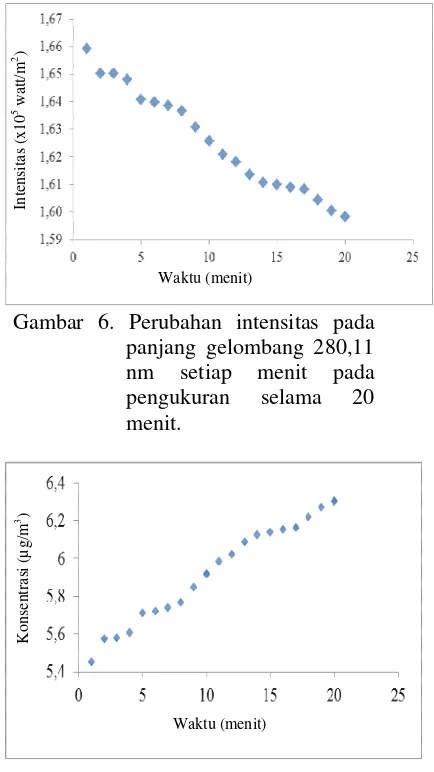
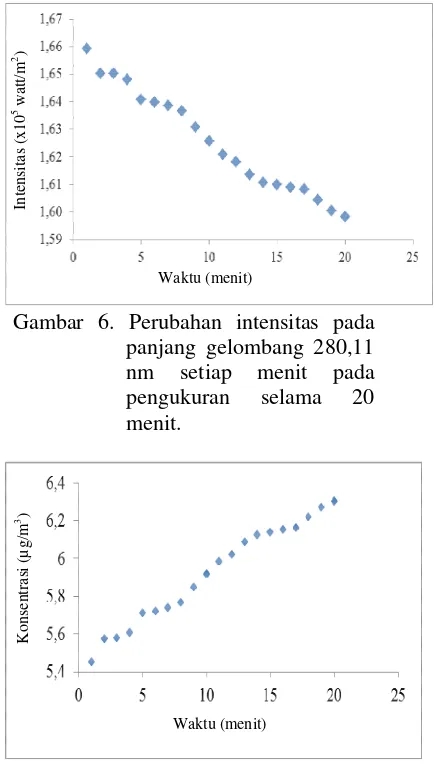
Pada pengukuran real time, variabel yang diamati adalah intensitas cahaya yang ditransmisikan terhadap waktu akibat perubahan konsentrasi SO2 yang terjerap dalam larutan TCM. Hasil pengujian transmitansi secara langsung didapatkan dalam bentuk spektrum pada Gambar 6. Berdasarkan Gambar 6, data kemudian diamati pada perubahan intensitas puncak-puncak transmitansi pada panjang gelombang 280,11 nm (Lampiran 1).
Gambar 6. Perubahan intensitas pada panjang gelombang 280,11 nm setiap menit pada pengukuran selama 20 menit.
Gambar 7. Perubahan konsentrasi gas SO2 yang terjerap terhadap waktu secara real time.
In te n si ta s (x 1 0
5 w
Konsentrasi gas SO2 yang terjerap setiap menit dapat ditampilkan pada gambar perubahan konsentrasi terhadap perubahan waktu (Gambar 7) yang berkebalikan dengan gambar perubahan intensitas cahaya terhadap waktu penjerapan (Gambar 6). Fenomena ini terjadi karena semakin besar konsentrasi gas SO2 yang terjerap mengakibatkan intensitas cahaya yang ditransmisikan semakin kecil. Selain dalam bentuk satuan µg/m3, kurva hubungan konsentrasi gas SO2 yang terjerap terhadap waktu juga dapat ditampilkan dalam skala ISPU (Gambar 8).
Gambar 8. Perubahan konsentrasi gas SO2 yang terjerap dalam skala ISPU terhadap waktu secara real time.
Hasil pengukuran di sekitar Departemen Fisika, FMIPA IPB, menunjukkan bahwa kondisi lingkungan berdasarkan konsentrasi SO2 dapat dikategorikan baik. Hal ini ditunjukkan dari nilai ISPU tertinggi sebesar 1,106 (Gambar 8) sedangkan nilai ISPU pada selang 0 – 50 dinyatakan bahwa kualitas udara masih dikategorikan baik (Tabel 2 halaman 4).
Pada pengukuran gas SO2 secara konvensional yaitu dengan metode pararosanilin, data yang ditampilkan merupakan data akumulasi gas SO2 yang terjerap dalam larutan penjerap TCM. Pada penelitian ini data konsentrasi yang terjerap setiap menit dapat ditampilkan
sehingga informasi yang disampaikan real time.
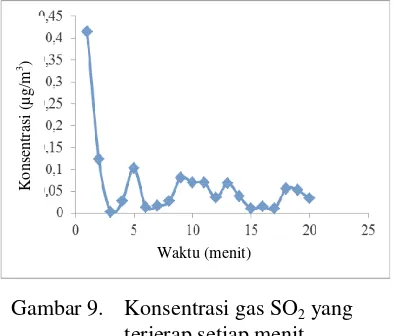
Gambar 9. menunjukkan jumlah gas SO2 yang terjerap setiap menitnya. Hal ini berarti tidak ada batasan bentuk kurva dari konsentrasi gas SO2 yang terjerap tiap menitnya pada proses penjerapan gas SO2 di udara lingkungan, karena gas SO2 di udara tidak dapat diperkirakan perubahan setiap saatnya.
Gambar 9. Konsentrasi gas SO2 yang terjerap setiap menit.
4.4 Desain Sensor Kristal Fotonik Satu Dimensi
Sebelum melakukan fabrikasi kristal fotonik satu dimensi, dilakukan simulasi dengan bantuan software filmstar. Puncak transmitansi Photonic Pass Band pada kristal fotonik didesain pada panjang gelombang absorbansi gas SO2 dalam larutan penjerap TCM yaitu 280,11 nm (Gambar 10), sehingga sensor ini spesifik pada panjang gelombang absorbansinya.
Sensor kristal fotonik dibuat dengan pola M=5, N=6, L=1. Cacat pertama dibuat tetap dengan ketebalan indeks bias tinggi dua kali yang berfungsi sebagai regulator dan cacat kedua dikosongkan yang berfungsi sebagai reseptor, untuk pendeteksian sampel yang dilewatkan. Material yang digunakan adalah OS-5 dengan indeks bias 2,1 (indeks bias tinggi) dan MgF2 dengan indeks bias 1,38 (indeks bias rendah). Substrat-1 (S1) dan substrat-2 (S2) menggunakan material BK-7 dengan indeks bias 1,52 (Gambar 11).
Gambar 10. Desain PPB kristal fotonik pada panjang gelombang operasi 280,11 nm.
Gambar 11. Desain kristal fotonik satu dimensi dengan dua cacat
.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Gas SO2 larut dalam penjerap TCM membentuk senyawa kompleks diklorosulfonatomerkurat. Tidak ada perubahan warna larutan pada proses penjerapan. Panjang gelombang operasi gas SO2 dalam larutan TCM sebesar 280,11 nm. Panjang gelombang ini berada pada daerah ultraviolet.
Konsentrasi gas SO2 yang terjerap dalam larutan TCM dapat ditentukan melalui pengenceran sampel dan membandingkan data hasil analisis dari PPLH IPB sehingga kurva kalibrasi hubungan antara konsentrasi dengan transmitansi dapat ditentukan.
Konsentrasi gas SO2 yang terjerap semakin lama semakin tinggi dan transmitansi semakin rendah.
Data real time menunjukkan bahwa semakin lama waktu penjerapan maka intensitas yang ditransmisikan semakin kecil. Fenomena ini terjadi karena semakin besar konsentrasi gas SO2 yang terjerap mengakibatkan intensitas cahaya yang ditransmisikan semakin kecil. Pada pengukuran gas SO2 secara konvensional yaitu dengan metode pararosanilin, data yang ditampilkan merupakan data akumulasi gas SO2 yang terjerap dalam larutan penjerap TCM. Pada penelitian ini data konsentrasi yang terjerap setiap menit dapat ditampilkan sehingga informasi yang disampaikan real time.
Absorpsivitas gas SO2 di dalam larutan penjerap TCM ditentukan dari
Panjang gelombang (nm)
T ra n sm it an si ( % ) 120 100 80 60 40 20 0 280,11
Transmitansi SO2
persamaan garis pada kurva kalibrasi diperoleh 0,005 m2/ g dan nilai ini menjadi dasar desain pembuatan sensor kristal fotonik untuk mendeteksi gas SO2 dengan panjang gelombang operasinya.
5.2 Saran
Penelitian selanjutnya diharapkan pengukuran gas SO2 tanpa menggunakan larutan penjerap dan menggunakan sumber cahaya LED yang sesuai dengan karakteristik absorbansinya.
DAFTAR PUSTAKA
1. Wardhana, W. A. (2004). Dampak Pencemaran Lingkungan. Yogyakarta: Andi Yogyakarta. 2. Soemarno, S. H. (1999).
Meteorologi Pencemaran Udara. Bandung: ITB.
3. Zendrato E. (2010). ”Pengukuran Kadar Gas Pencemar”. Web. 5
Maret 2012.
<http://repository.usu.ac.id/bitstrea m/123456789/20755/4/Chapter%20 I.pdf>.
4. Prabu, P. (2008). ”Dampak Pencemaran Udara Terhadap Kesehatan”. Web. 15 November 2011.
<http://putraprabu.wordpress.com/2 008/12/27/dampak-pencemaran-udara-terhadap-kesehatan/>.
5. [SNI] Standar Nasional Indonesia. (2005). Cara Uji Kadar Sulfur Dioksida (SO2) dengan Metode Pararosanilin dengan menggunakan spektrofotometer. SNI 19-7119.7-2005. Jakarta : Badan Standarisasi Nasional.
6. Rahmat, M. (2009). Design and Fabrication of One Dimensional Photonic Crystal as a Real Time Optical Sensor for Sugar Solution Concentration Detection [tesis]. Bogor : Program Pascasarjana, Institut Pertanian Bogor.
7. Fardiaz, S. (1992). Polusi Air dan Udara. Jakarta: Kanisius.
8. Giddings, J.S. (1973). Chemistry, Man and Environmental Change. New York: Canfield Press
9. UU-RI No. 4 Tahun 1982 tentang lingkungan hidup dan Keputusan
Menteri No.
KEP-02/MENKLH/I/1988 tentang pedoman penetapan baku mutu lingkungan.
10. Husin et al. (1991). Studi Tingkat Pencemaran Udara dan Hujan Asam di Daerah Bogor. Bogor : Pusat penelitian lingkungan hidup IPB Lembaga Penelitian Institut Pertanian Bogor.
11. Harmantyo, D. (1989). Studi Tentang Hujan Masam di Wilayah Jakarta dan Sekitarnya [disertasi]. Bogor : Fakultas Pasca Sarjana IPB.
12. Sadat et al. (2003). Udara Bersih Hak Kita Bersama. Jakarta: Pelangi 13. Badan Pengendalian Dampak
Lingkungan (BAPEDAL). (1998). Pedoman Teknis Perhitungan dan Pelaporan Serta Informasi Indeks Standar Pencemar Udara (ISPU). 14. Public Health Service (DHEW) .
(1969). Air Quality Criteria for Sulfur Oxides. Washington: US Department of Health, Education, and Welfare.
15. BMG. (2003). ”Pemantauan Kualitas Air Hujan”. Web. 15
November 2011.
http://www.bmg.go.id/kah.asp 16. Winarno, F.G. (1973).
Spektroskopi. Bogor: Departemen Teknologi Hasil Pertanian IPB 17. Nur, M. A. dan Hendra A. (1989).
Teknik Spektroskopi dalam Analisis Biologi. Bogor: IPB 18. Joni, I M. (2007). Diktat Mata
Kuliah Pengantar Biospektroskopi. Bandung: Universitas Padjajaran 19. Kurniawan, C. 2010. Analisis
Lampiran 1. Diagram alir penelitian
Pengambilan sampel uji (sampel dijerap dengan larutan TCM)
Sampel dikarakterisasi secara spektroskopi
Diperoleh panjang gelombang serapan maksimum
Pembuatan kurva kalibrasi dan penentuan nilai absorpsivitas.
Pengenceran dan
pengukuran transmitansi
secara spektroskopi.
Pengukuran nilai
konsentrasi di
Laboratorium PPLH.
Pengambilan data transmitansi SO
2menggunakan metode spektroskopi
real time
Perhitungan nilai konsentrasi gas SO
2yang terjerap
Analisis data
Selesai
Penulisan skripsi
Mulai
Lampiran 2. Data lapangan proses penjerapan dan perhitungan konsentrasi gas SO2. Hari/Tanggal : Rabu, 8 Februari 2012
Panjang Gelombang : 280,11 nm.
Data penjerapan gas SO2 secara real-time dengan laju alir 1 liter/menit. Waktu
(menit)
Suhu (0C)
Kelembaban (%)
Intensitas (counts)
Intensitas (watt/m2)*
Konsentrasi (µg/m3)**
Perubahan Konsentrasi
(µg/m3)***
PPB ISPU Status
0 28,0 75 172,02 - - - -
1 28,0 75 171,27 1,659244748 44,358283531 5,451743400 5,451743400 0,956 Baik 2 28,0 75 170,35 1,650331891 44,430098391 5,574155094 5,574155094 0,978 Baik 3 28,0 75 170,33 1,650138133 44,431663888 5,576823554 5,576823554 0,978 Baik 4 28,0 75 170,12 1,648103676 44,448112707 5,604861315 5,604861315 0,983 Baik 5 28,0 75 169,35 1,640644002 44,508599256 5,707963386 5,707963386 1,001 Baik 6 28,0 75 169,25 1,639675213 44,516474822 5,721387647 5,721387647 1,004 Baik 7 28,0 75 169,13 1,638512666 44,525931646 5,737507233 5,737507233 1,007 Baik 8 28,0 75 168,93 1,636575088 44,541707940 5,764398643 5,764398643 1,011 Baik 9 28,0 75 168,33 1,630762355 44,589149134 5,845264314 5,845264314 1,025 Baik 10 28,0 75 167,81 1,625724653 44,630401819 5,915581392 5,915581392 1,038 Baik 11 28,2 76 167,30 1,620783829 44,670985539 5,984758187 5,984758187 1,050 Baik 12 28,2 76 167,04 1,618264978 44,691722917 6,020105990 6,020105990 1,056 Baik 13 28,2 76 166,54 1,613421034 44,731693369 6,088237442 6,088237442 1,068 Baik 14 28,2 76 166,26 1,610708425 44,754129271 6,126480458 6,126480458 1,075 Baik 15 28,2 76 166,18 1,609933393 44,760546469 6,137418864 6,137418864 1,077 Baik 16 28,2 76 166,07 1,608867726 44,769375163 6,152467773 6,152467773 1,079 Baik
Lanjutan Lampiran 2
Waktu (menit)
Suhu (0C)
Kelembaban (%)
Intensitas (counts)
Intensitas (watt/m2)*
Konsentrasi (µg/m3)**
Perubahan Konsentrasi
(µg/m3)***
PPB ISPU Status
17 28,2 76 166,00 1,608189573 44,774996468 6,162049543 6,162049543 1,081 Baik 18 28,2 76 165,59 1,604217539 44,807968931 6,218252604 6,218252604 1,091 Baik 19 28,2 76 165,21 1,600536141 44,838601753 6,270467643 6,270467643 1,100 Baik 20 28,2 76 164,97 1,598211048 44,857985123 6,303507478 6,303507478 1,106 Baik
Keterangan:
*) Nilai intensitas dikonversi berdasarkan Lampiran .
**) Nilai konsentrasi diperoleh dengan persamaan y = 217,7x-0,044, dari kurva kalibrasi hasil dari normalisasi.
***) Nilai konsentrasi merupakan selisih konsentrasi dengan waktu sebelumnya.
Lanjutan Lampiran 2.
Data proses pengenceran sampel gas SO2, 8 Februari 2012.
V+dV (mL) T (%) Konsentrasi perhitungan (µg/m3) Konsentrasi PPLH (µg/m3) Intensitas (counts)
5 70,6160 187,0426 187,0426 171,2700
6 74,8030 176,5731 172,2300
7 76,6990 172,2083 172,6700
8 78,9300 167,3407 173,1800
9 80,7900 163,4881 173,6000
10 81,8500 161,3708 161,9730 173,8500
6 84,8830 152,3383 174,5400
7 85,7220 148,5725 174,7400
8 87,6770 144,3730 175,1900
9 88,3580 141,0492 175,3400
10 89,3510 139,2225 156,9591 175,5700
6 91,7160 131,4297 176,1100
7 92,3180 128,1808 176,2500
8 93,2090 124,5577 176,4500
9 94,3870 121,6900 176,7300
10 95,0320 120,1141 152,7809 176,8700
6 95,6300 113,3908 177,0100
7 95,7050 110,5878 177,0300
8 95,7460 107,4620 177,0400
9 96,0960 104,9879 177,1200
10 96,5680 103,6283 142,7530 177,2300
Lanjutan Lampiran 2.
V+dV (mL) T (%) Konsentrasi perhitungan (µg/m3) Konsentrasi PPLH (µg/m3) Intensitas (counts)
6 96,7860 97,82782 177,2800
7 96,8790 95,40952 177,3000
8 97,6190 92,71271 177,4700
9 97,9360 90,57822 177,5400
10 98,0680 89,40519 100,1347 177,5700
Dari data pengenceran dapat dibuat hubungan konsentrasi dan intensitas cahaya. Persamaan kurva dapat digunakan untuk menentukan nilai konsentrasi
dari data real-time.
y = 217,7x-0,044 R² = 0,8899
Lampiran 3.
Data lapangan proses penjerapan dan penentuan nilai absorpsivitas. Hari/Tanggal : Jumat, 18 November 2012Panjang Gelombang : 281,38 nm.
V+dV
(mL) Transmitansi (%)
Konsentrasi Perhitungan (µg/m3)
Konsentrasi PPLH (µg/m3)
5 34,6560 217,4228 217,4228
6 42,3530 181,1857
7 46,0470 155,3020
8 52,1290 135,8893
9 56,2810 120,7904
10 59,9050 108,7114 126,4151
6 64,6470 90,5928
7 69,3810 77,6510
8 73,3720 67,9446
9 75,0320 60,3952
10 76,5260 54,3557 57,6250
6 81,5130 45,2964
7 82,4530 38,8255
8 83,7960 33,9723
9 84,9730 30,1976
10 85,5450 27,1778 28,9945
6 87,2090 22,6482
7 90,7680 19,4127
8 92,9790 16,9861
9 97,6510 15,0988
10 98,1440 13,5889 11,4728
Dari data pengenceran dapat dibuat hubungan konsentrasi dan transmitansi (Gambar 10).
Lampiran 4. Perhitungan menentukan nilai konsentrasi pada setiap titik pengenceran.
C = x C0
Keterangan :
V0 = volume awal sampel (mL).
dV = penambahan volum setelah sampel ditambahkan dengan larutan kalium iodida (mL).
C = konsentrasi sampel yang dihitung (µg/m3). C0 = konsentrasi awal sampel (µg/m3).
Lampiran 5. Perhitungan normalisasi menentukan nilai intensitas dari transmitansi pada proses pengenceran.
I (counts) = Imax + ( T – Tmin)
Keterangan :
Imax = intensitas maximum pada proses penjerapan secara real-time (counts) . Imin = intensitas minimum pada proses penjerapan secara real-time (counts) . I = intensitas pada waktu tertentu untuk proses pengenceran sampel (counts). Tmax = transmitansi maximum pada proses pengenceran sampel (%) .
Tmin = transmitansi minimum pada proses pengenceran sampel (%) .
T = transmitansi pada waktu tertentu untuk proses pengenceran sampel (%).
Lampiran 6. Konversi satuan nilai intensitas dari counts menjadi watt/m2.
I
(
) =
sedangkan E =Keterangan :
E = energi cahaya (joule) .
h = konstanta planck (6.63x10-34 J.s) .
c = kecepatan cahaya (3x108m/s) .
λop = panjang gelombang operasi gas SO2 (nm).
Lampiran 7. Perhitungan untuk menentukan nilai indeks standar pencemar udara (ISPU) dari konsentrasi gas SO2 yang terjerap.
I = ( Xx – Xb) + Ib
Keterangan :
I = ISPU terhitung.
Ia = ISPU batas atas.
Ib = ISPU batas bawah.
Xa = konsentrasi udara lingkungan batas atas ( g/m3).
Xb = konsentrasi udara lingkungan batas bawah ( g/m3).
Xx = konsentrasi udara lingkungan hasil pengukuran ( g/ m
Lampiran 8. Cara Uji Kadar Sulfur Dioksida (SO
2) dengan Metoda Pararosanilin
dengan menggunakan spektrofotometer (SNI 19-7119.7-2005).
Standar ini digunakan untuk penentuan sulfur dioksida (SO
2) di udara ambien
menggunakan spektrofotometer dengan metoda pararosanilin.
Lingkup pengujian meliputi:
-. Cara pengambilan contoh uji gas sulfur dioksida dengan menggunakan larutan
penyerap.
-. Cara perhitungan volume contoh uji gas yang diserap.
-. Cara penentuan gas sulfur dioksida di udara ambien dengan metoda
pararosanilin menggunakan spektrofotometer pada panjang gelombang 550 nm
dengan kisaran konsentrasi 0,01 ppm sampai 0,4 ppm udara atau 25 µg/m
3sampai 1000 µg/m
3.
Acuan normatif
ASTM D2914-1995,
Test methode for sulfur dioxide content of the atmosphere
(West-Gaeke Method).
Cara Uji
Prinsip
Gas sulfur dioksida (SO
2) diserap dalam larutan penyerap tetrakloromerkurat
Lanjutan Lampiran 8
Bahan
1. Larutan penyerap tetrakloromerkurat (TCM) 0,04 M
-. Larutkan 10,86 g merkuri (II) klorida (HgCl
2) dengan 800 mL air suling ke
dalam gas piala 1000 mL.
-. Tambahkan berturut-turut 5,96 g kalium klorida (KCl) dan 0,066 g EDTA
[(HOCOCH
2)
2N(CH
2)
2N(CH
2COONa)
2.2H
2O], lalu aduk sampai homogen.
-. Pindahkan ke dalam labu ukur 1000 mL, enecerkan dengan air suling hingga
tanda tera lalu homogenkan.
2. Larutan induk natrium metabisulfit (Na
2S
2O
6)
-. Larutkan 0,3 g Na
2S
2O
5dengan air suling ke dalam gelas piala 100 mL.
-. Pindahkan ke dalam labu ukur 500 mL, encerkan dengan air suling hingga
tanda tera lalu homogenkan.
CATATAN1: 0,3 g Na2S2O5 dapat diganti dengan air suling dengan 0,4 g Na2SO3.
CATATAN2: Air suling yang digunakan telah dididihkan.
3. Larutan standar natrium metabisulfit (Na
2S
2O
6)
Masukkan 2 mL larutan induk sulfit ke dalam labu ukur 100 mL, encerkan sampai
tanda tera dengan larutan penyerap lalu homogenkan.
CATATAN: Larutan ini stabil selama 1 bulan jika disimpan dalam suhu kamar.
4. Larutan induk iod (I
2) 0,1 N
-. Masukkan dalam gelas piala berturut-turut 12,7 g iod dan 40,0 g kalium iodida
(KI).
-. Larutkan campuran tersebut dengan 25 mL air suling.
-. Pindahkan secara kuantitatif ke dalam labu ukur 1000 mL, encerkan dengan air
suling lalu homogenkan.
5. Larutan iod 0,01 N
Lanjutan Lampiran 8
6. Larutan indikator kanji
-. Masukkan dalam gelas piala 250 mL berturut-turut 0,4 g kanji dan 0,002 g
merkuri (II) iodida (HgI
2).
-. Larutkan secara hati-hati dengan air mendidih sampai volume larutan mencapai
200 mL.
-. Panaskan larutan tersebut sampai larutan jernih, lalu dinginkan dan pindahkan
ke dalam botol pereaksi.
7. Larutan asam klorida (HCl) (1+10)
Encerkan 10 mL HCl pekat dengan 100 mL air suling di dalam gelas piala 250
mL.
8. Larutan induk natrium tio sulfat (Na
2S
2O
3) 0,1 N
-. Larutkan 24,82 g Na
2S
2O
3.5H
2O dengan 200 mL air suling dingin yang telah
didinginkan ke dalam gelas piala 250 mL dan tambahkan 0,1 g natrium
karbonat (Na
2CO
3).
-. Pindahkan ke dalam labu ukur 1000 mL kemudian encerkan dengan air suling
sampai tanda tera dan homogenkan.
-. Diamkan larutan ini selama 1 hari sebelum dilakukan standarisasi.
9. Larutan Na
2S
2O
30,01N
-. Pipet 50 mL larutan induk Na
2S
2O
3, masukkan ke dalam labu ukur 500 mL.
-. Encerkan dengan air suling sampai tanda tera, lalu homogenkan.
10. Larutan asam klorida (HCl) 1 M
-. Masukkan 83 mL HCL 37% (
ρ
~ 1,19 g/mL) ke dalam labu ukur 1000 mL
yang berisi kurang lebih 300 mL air suling.
-. Encerkan dengan air suling sampai tanda tera, lalu homogenkan.
11. Larutan asam sulfamat (NH
2SO
3H) 0,6% b/v
Larutkan 0,6 g asam sulfamat ke dalam labu ukur 100 mL, encerkan dengan air
suling sampai tanda tera, lalu homogenkan.
Lanjutan Lampiran 8
12. Larutan asam fosfat (H
3PO
4) 3 M
Larutkan 205 mL H
3PO
485% (
ρ
~ 1,69 g/mL) ke dalam labu ukur 1000 mL yang
berisi kurang lebih 300 mL air suling, encerkan sampai tanda tera, lalu
homogenkan.
CATATAN: Larutan ini stabil selama 1 tahun.
13. Larutan induk pararosanilin hidroklorida (C
19H
17N
3.HCl) 0,2%
Larutkan 0,2 g pararosanilin hidroklorida ke dalam labu ukur 100 mL, encerkan
dengan larutan HCl 1 M sampai tanda tera, lalu homogenkan.
14. Penentuan kemurnian pararosanilin
-. Pipet 1 mL larutan induk pararosanilin masukkan ke dalam labu ukur 100 mL
dan encerkan dengan air suling sampai tanda tera, lalu homogenkan.
-. Pipet 5 mL larutan di atas dan 5 mL larutan penyangga asetat ke dalam labu
ukur 50 mL dan encerkan dengan air suling sampai tanda tera, lalu
homogenkan.
-. Setelah 1 jam ukur serapannya pada panjang gelombang 540 nm dengan
spektrofotometer.
-. Hitung kemurnian larutan induk pararosanilin dengan rumus sebagai berikut:
M =
dengan pengertian:
M
: kemurnian pararosanilin (%);
A
: serapan larutan pararosanilin;
W
: berat paraosanilin yang digunakan untuk membuat 50 mL larutan induk
paraosanilin (g);
Lanjutan Lampiran 8
15. Larutan kerja pararosanilin
-. Masukkan 40 mL larutan induk pararosanilin ke dalam labu ukur 500 mL,
(bila kemurnian larutan induk pararosanilin lebih kecil dari 100% tambahkan
setiap kekuarangan 1% dengan 0,4 mL larutan induk pararosanilin).
-. Tambahkan 50 mL larutan asam fosfat 3 M.
-. Tepatkan hingga tanda tera dengan air suling lalu homogenkan.
CATATAN: larutan ini stabil selama 9 bulan.
16. Larutan formaldehida (HCHO) 0,2% v/v
Pipet 5 mL HCHO 36%-38% (v/v) dan masukkan ke dalam labu ukur 1000 mL,
encerkan dengan air suling hingga tanda tera lalu homogenkan.
CATATAN: larutan ini disiapkan pada saat akan digunakan.
17. Larutan penyangga asetat 1 M (pH = 4,74)
-. Larutkan 13,61 g natrium asetat trihidrat (NaC
2H
5O
2.3H
2O) ke dalam labu
ukur 100 mL dengan 50 mL air suling.
-. Tambahkan 5,7 mL asam asetat glasial (CH
3COOH), dan encerkan dengan air
suling sampai tanda tera, lalu homogenkan.
Peralatan
a) peralatan pengambilan contoh uji SO
2sesuai gambar 4 dan 5 (setiap unit
peralatan disambung dengan selang silikon dan tidak mengalami kebocoran)
1) gambar 3 untuk pengambilan contoh uji 1 jam;
2) gambar 4 untuk pengambilan contoh uji 24 jam.
b) labu ukur 50 mL; 100 mL; 250 mL; 500 mL dan 1000mL;
c) pipet volumetrik 1 mL; 2 mL; 5 mL dan 50 mL;
d) gelas ukur 100 mL;
e) gelas piala 100 mL; 250 mL; 500 mL dan 1000 mL;
f) tabung uji 25 mL;
Lanjutan Lampiran 8
h) timbangan analitik dengan ketelitian 0,1 mg;
i) buret 50 mL;
j) labu erlenmeyer asah bertutup 250 mL;
k) oven;
l) kaca arloji;
m) termometer;
n) barometer;
o) pengaduk; dan
p) botol pereaksi.
Gambar -. Botol Penjerap
Midget Impinger
Keterangan gambar:
A adalah ujung silinder gelas yang berada di dasar labu dengan maksimum
diameter dalam 1 mm.
B adalah botol penjerap
midget impinger
dengan kapasitas volum 50 mL.
C adalah ujung silinder gelas yang berada di dasar labu dengan maksimum
diameter dalam 1 mm.
Lanjutan Lampiran 8
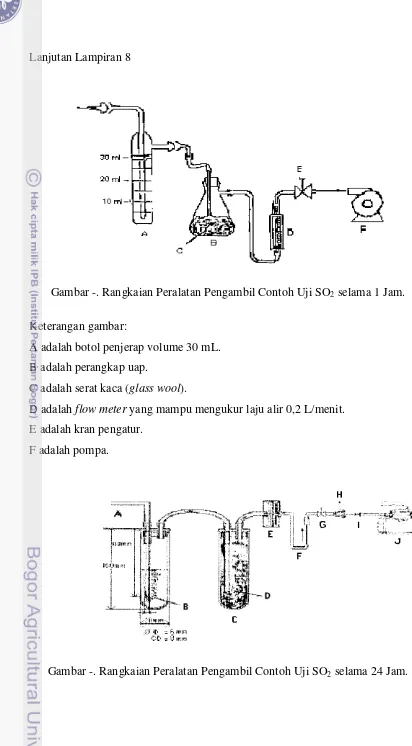
Gambar -. Rangkaian Peralatan Pengambil Contoh Uji SO
2selama 1 Jam.
Keterangan gambar:
A adalah botol penjerap volume 30 mL.
B adalah perangkap uap.
C adalah serat kaca (
glass wool
).
D adalah
flow meter
yang mampu mengukur laju alir 0,2 L/menit.
E adalah kran pengatur.
F adalah pompa.
Lanjutan Lampiran 8
Keterangan gambar:
A adalah tabung penjerap.
B adalah larutan penjerap.
C adalah perangkap uap.
D adalah
glasswool
.
E adalah
filter
membran.
F adalah
flowmeter
yang mampu mengukur laju alir 0,2 L/menit.
G adalah kran pengatur.
H adalah
rubber septum
.
I adalah jarum hipodermik.
J adalah pompa udara.
Pengambilan contoh uji
1. Pengambilan contoh uji selama 1 jam
-. Susun peralatan pengambilan contoh uji seperti pada gambar 4.
-. Masukkan larutan penyerap SO
2sebanyak 10 mL ke masing-masing botol
penyerap. Atur botol penyerap agar terlindung dari hujan dan sinar matahari
langsung.
-. Hidupkan pompa penghisap udara dan atur kecepatan alir 0,5 L/menit sampai 1
L/menit, setelah stabil catat laju alir awal F
1(L/menit).
-. Lakukan pengambilan contoh uji selama 1 jam dan catat temperatur dan
tekanan udara.
-. Setelah 1 jam, catat laju alir akhir F
2(L/menit) dan kemudian matikan pompa
penghisap.
-. Diamkan selama 20 menit setelah pengambilan contoh uji untuk
menghilangkan pengganggu.
Lanjutan Lampiran 8
2. Pengambilan contoh uji selama 24 jam
-. Susun peralatan pengambilan contoh uji seperti pada gambar 5.
-. Masukkan larutan penyerap SO
2sebanyak 50 mL ke masing-masing botol
penyerap. Atur botol penyerap agar terlindung dari hujan dan sinar matahari
langsung.
-. Hidupkan pompa penghisap udara dan atur kecepatan alir 0,2 L/menit, setelah
stabil catat laju alir awal F
1(L/menit).
-. Lakukan pengambilan contoh uji selama 24 jam dan catat temperatur dan
tekanan udara.
-. Setelah 24 jam, catat laju alir akhir F
2(L/menit) dan kemudian matikan pompa
penghisap.
-. Diamkan selama 20 menit setelah pengambilan contoh uji untuk
menghilangkan pengganggu.
Persiapan Pengujian
1. Standardisasi larutan natrium tiosulfat 0,01 N
-. Panaskan kalium iodat (KIO
3) pada suhu 180
0C selama 2 jam dan didinginkan
dalam desikator.
-. Larutan 0,09 g kalium iodat (KIO
3) ke dalam labu ukur 250 mL dan tambahkan
air suling sampai tanda tera, lalu homogenkan.
-. Pipet 25 mL larutan kalium iodat ke dalam labu erlenmeyer asah 250 mL.
-. Tambahkan 1 g KI dan 10 mL HCl (1+10) ke dalam labu erlenmeyer tersebut.
-. Tutup labu erlenmeyer dan tunggu 5 menit, titrasi larutan dalam erlenmeyer
dengan larutan natrium tiosulfat 0,1 N sampai warna larutan kuning muda.
-. Tambahkan 5 mL indikator kanji, dan lanjutkan titrasi sampai titik akhir
Lanjutan Lampiran 8
-. Hitung normalitas larutan natrium tio sulfat tersebut dengan rumus sebagai
berikut:
N =
dengan pengertian:
N
: konsentrasi larutan natrium tio sulfat dalam grek/L (N)
b
: bobot KIO
3dalam 250 mL air suling (g);
V
1: volume KIO
3yang digunakan dalam titrasi (mL);
V
2: volume larutan natrium tio sulfat hasil titrasi (mL);
35,67 : bobot ekivalen KIO
3(BM KIO
3/ 6);
250
: volume larutan KIO
3yang dibuat dalam labu ukur 250 mL;
1000 : konversi liter (L) ke mL.
2. Penentuan konsentrasi SO
2dalam larutan induk Na
2S
2O
6-. Pipet 25 mL larutan induk Na
2S
2O
5pada langkah di bagian Bahan nomor 2 ke
dalam labu erlenmeyer asah dan pipet 50 mL larutan iod 0,01 N ke dalam labu
dan simpan dalam ruang tertutup selama 5 menit.
-. Titrasi larutan dalam erlenmeyer dengan larutan tio 0,01 N sampai warna
larutan kuning muda.
-. Tambahkan 5 mL indikator kanji, dan lanjutkan titrasi sampai titik akhir
(warna biru tepat hilang), catat volume larutan penitar yang diperlukan (V
c).
-. Pipet 25 mL air suling sebagai blanko ke dalam erlenmeyer asah dan lakukan
langkah-langkah di atas (V
b).
-. Hitung konsentrasi SO
2dalam larutan induk tersebut dengan rumus sebagai
berikut:
Lanjutan Lampiran 8
dengan pengertian:
C
: konsentrasi SO
2dalam larutan induk Na
2S
2O
5(µg/mL);
V
b: volume natrium tio sulfat hasil titrasi blanko (mL);
V
c: volume natrium tio sulfat hasil titrasi larutan induk Na
2S
2O
5(mL);
N
: normalitas larutan natrium tio sulfat 0,01 N (N);
V
a: volume larutan induk Na
2S
2O
5yang dipipet (mL);
1000 : konversi gram ke µg;
32,03 : berat ekivalen SO
2(BM SO
2/2).
CATATAN: Melalui rumus di atas dapat diketahui jumlah (µg) SO2 tiap mL larutan induk
Na2S2O5, sedangkan jumlah (µg) SO2 untuk tiap mL larutan standar dihitung dengan
memperhatikan faktor pengenceran.
3. Pembuatan kurva kalibrasi
-. Optimalkan alat spektrofotometer sesuai petunjuk penggunaan alat.
-. Masukkan masing-masing 0,0 mL; 1,0 mL; 2,0 mL; 3,0 mL; dan 4,0 mL
larutan standar Na
2S
2O
5pada langkah di bagian Bahan nomor 3 ke dalam
tabung uii 25 mL dengan menggunakan pipet volume atau buret mikro.
-. Tambahkan larutan penyerap sampai volume 10 mL.
-. Tambahkan 1 mL larutan asam sulfamat 0,6% dan tunggu sampai 10 menit.
-. Tambahkan 2,0 mL larutan formaldehida 0,2%
-. Tambahkan 5,0 mL larutan pararosanilin.
-. Tepatkan dengan air suling sampai volume 25 mL, lalu homogenkan dan
tunggu sampai 30-60 menit.
-. Ukur serapan masing-masing larutan standar dengan spektrofotometer pada
panjang gelombang 550 nm.
-. Buat kurva kalibrasi antara serapan dengan jumlah SO
2(µg).
Pengujian contoh uji
1. Pengujian contoh uji untuk pengambilan contoh uji selama 1 jam
Lanjutan Lampiran 8
-. Lakukan langkah-langkah pada Pembuatan Kurva Kalibrasi langkah 4 hingga
langkah 8.
-. Baca serapan contoh uji kemudian hitung konsentrasi dengan menggunakan
kurva kalibrasi.
-. Lakukan langkah-langkah di atas untuk pengujian blanko dengan
menggunakan 10 mL larutan penyerap.
Perhitungan
1. Volume contoh uji udara yang diambil
Volume contoh uji udara yang diambil dikoreksi pada kondisi normal (25
0C, 760
mmHg) dengan menggunakan rumus sebagai berikut:
V =
x t x x
dengan pengertian:
V
: volume udara yang dihisap (L);
F
1: laju alir awal (L/menit);
F
2: laju alir akhir (L/menit);
t
: durasi pengambilan contoh uji (menit);
P
a: tekanan barometer rata-rata selama pengambilan contoh uji (mmHg);
T
a: temperatur rata-rata selama pengambilan contoh uji (K);
298
: temperatur pada kondisi normal 25
0C (K);
760
: tekanan pada kondisi normal 1 atm (mmHg).
2. Konsentrasi sulfur dioksida (SO
2) di udara ambien
-. Konsentrasi SO
2dalam contoh uji untuk pengambilan contoh uji selama 1 jam
dapat dihitung dengan rumus sebagai berikut:
Lanjutan Lampiran 8
dengan pengertian:
C
: konsentrasi SO
2di udara (µg/Nm
3);
a
: jumlah SO
2dari contoh uji dengan melihat kurva kalibrasi (µg);
V
: volume udara pada kondisi normal (L);
1000 : konversi liter (L) ke m
3.
-. Konsentrasi SO
2dalam contoh uji untuk pengambilan contoh uji selama 24 jam
dapat dihitung dengan rumus sebagai berikut:
C = x 1000 x
dengan pengertian:
C
: konsentrasi SO
2di udara (µg/Nm
3);
a
: jumlah SO
2dari contoh uji dengan melihat kurva kalibrasi (µg);
V
: volume udara pada kondisi normal (L);
50
: jumlah total larutan penyerap yang dipakai untuk pengambilan contoh uji
24 jam.
5
: volume yang dipipet untuk dianalisis dengan spektrofotometer.
Jaminan mutu dan pengendalian mutu
1. Jaminan Mutu
-. Gunakan termometer dan berometer yang terkalibrasi.