POTENSI ZEOLIT ALAM SEBAGAI ANTIOKSIDAN
DONY RAHMAD PRANOTO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Dibimbing oleh SRI SUGIARTI dan ETI ROHAETI.
Zeolit merupakan mineral aluminosilikat dengan struktur kerangka tiga
dimensi, memiliki pori dan saluran yang saling berhubungan sehingga
permukaannya menjadi sangat luas dan efektif sebagai adsorben. Selain itu, zeolit
memiliki permukaan bermuatan negatif yang dapat berinteraksi dengan senyawa
atau molekul bermuatan seperti 1,1-difenil-2-pikrilhidrazil (DPPH). Penelitian ini
bertujuan menentukan aktivitas penangkapan radikal bebas DPPH oleh zeolit
alam Indonesia, yaitu zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya. Uji
aktivitas antioksidan terhadap DPPH dilakukan pada zeolit tanpa perlakuan, zeolit
teraktivasi-suhu, dan zeolit teraktivasi-asam. Aktivitas antioksidan tertinggi
ditunjukkan oleh zeolit Sukabumi teraktivasi-suhu 100 °C sebesar 85.56% dan
zeolit Sukabumi teraktivasi-HCl 1 M sebesar 65.56%, tetapi belum sebaik asam
askorbat yang memiliki aktivitas antioksidan 92.14%. Hasil analisis mikroskop
elektron pemayaran dan difraksi sinar-X menunjukkan bahwa zeolit Banten,
Lampung, Sukabumi, dan Tasikmalaya adalah jenis klinoptilolit.
ABSTRACT
DONY RAHMAD PRANOTO. Potency of Natural Zeolite as Antioxidant.
Supervised by SRI SUGIARTI and ETI ROHAETI.
POTENSI ZEOLIT ALAM SEBAGAI ANTIOKSIDAN
DONY RAHMAD PRANOTO
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Disetujui
Pembimbing I
Sri Sugiarti, PhD
NIP 19701225 199512 2 001
Pembimbing II
Dr Eti Rohaeti, MS
NIP 19600807 198703 2 001
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih
dalam penelitian yang dilaksanakan sejak bulan Oktober 2011 ini adalah Potensi
Zeolit Alam sebagai Antioksidan.
Penulis mengucapkan terima kasih kepada Ibu Sri Sugiarti, PhD dan Ibu Dr
Eti Rohaeti, MS selaku pembimbing yang telah memberikan arahan, bimbingan,
motivasi, dan doa selama penelitian. Penulis juga mengucapkan terima kasih
kepada Ayahanda H M Sukarmin, Ibunda Hj Dewy Isbiyati, adik tersayang Mika
Asrini SSi, Rahman Yusuf, dan Winda Andarina SSi yang telah memberikan doa,
semangat, kasih sayang, dan dukungan selama masa studi hingga proses
penyusunan karya ilmiah ini.
Ucapan terima kasih juga penulis sampaikan kepada seluruh laboran, analis,
dan staf Laboratorium Anorganik. Tidak lupa ungkapan terima kasih juga penulis
sampaikan kepada sahabatku Muhammad Nazmi, Eristiadi, Indrazakti, dan
rekan-rekan peneliti (Gina, Putri Sinuhaji, Fitriani Siddiq, Noja, dan Endi). Terima
kasih pula kepada seluruh pihak yang telah membantu Penulis dalam
menyelesaikan karya ilmiah ini yang tidak dapat disebutkan satu per satu tanpa
maksud mengurangi rasa terima kasih. Semoga Allah SWT memberikan balasan
atas segala amal yang diperbuat dan senantiasa menyertai hamba-Nya dengan
kasih dan sayang-Nya.
Semoga karya ilmiah ini dapat memberikan manfaat.
Bogor, Mei 2012
pertama dari Bapak H. Muhammad Sukarmin dan Ibu Hj. Dewy Isbiyati. Penulis
lulus dari SMA Al-Azhar Medan pada tahun 2005 dan pada tahun yang sama
diterima di Diploma 3 Institut Pertanian Bogor (IPB) melalui jalur seleksi rapor.
Penulis lulus dari D3 IPB Bogor dengan predikat
sangat memuaskan
pada tahun
2008 dan melanjutkan pendidikan S1 melalui Program Alih Jenis Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor (IPB)
pada tahun 2009.
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
BAHAN DAN METODE
Alat dan Bahan ... 2
Metode Penelitian ... 2
HASIL DAN PEMBAHASAN
Preparasi Zeolit ... 3
Aktivasi Zeolit Alam ... 3
Aktivitas Antioksidan Zeolit ... 4
SIMPULAN DAN SARAN
Simpulan ... 7
Saran ... 7
DAFTAR PUSTAKA ... 7
vii
DAFTAR TABEL
Halaman
1 Aktivitas antioksidan zeolit alam tanpa perlakuan dan vitamin C ... 5
2 Aktivitas antioksidan zeolit alam teraktivasi-suhu ... 6
3 Aktivitas antioksidan zeolit alam teraktivasi-asam ... 6
DAFTAR GAMBAR
Halaman
1 Struktur dasar zeolit.. ... 1
2 Struktur 1,1-difenil-2-pikrilhidrazil (DPPH).. ... 2
3 Foto morfologi permukaan (SEM) zeolit alam Banten, Lampung,
Sukabumi, dan Tasikmalaya tanpa perlakuan dengan perbesaran 5000
... 3
4 Profil pola difraksi zeolit alam teraktivasi-suhu
100 °C pada sudut 2θ
.. ... 4
5 Perubahan warna larutan DPPH setelah penambahan zeolit alam tanpa
perlakuan ... 5
6 Perubahan warna larutan DPPH setelah penambahan zeolit teraktivasi-suhu 100
°C ... 6
7 Perubahan warna larutan DPPH setelah penambahan zeolit teraktivasi-HCl 1 M
viii
DAFTAR LAMPIRAN
Halaman
1
Bagan alir penelitian ... 11
2
Nilai
loss of ignition
(LOI) zeolit alam pada suhu 1100 °C ... 12
3
Data XRD ... 13
4
Profil pola puncak difraksi zeolit alam dibandingkan dengan profil pola
literatur ICDD ... 14
5
B
asis data puncak 2θ untuk zeolit alam (klinoptilolit tipe heulandit)
... 15
6
Skema reaksi dealuminasi dan dekationisasi ... 16
7
Sumbangan proton dari antioksidan ke radikal DPPH ... 17
8
Uji DPPH pada zeolit alam ... 18
9
Mekanisme zeolit menetralkan radikal DPPH ... 20
PENDAHULUAN
Zeolit merupakan salah satu mineral yang banyak terkandung di bumi terutama di Indonesia. Zeolit pertama kali ditemukan di alam oleh Baron Frederick C pada tahun 1756. Para ahli geologi menemukan 47 lokasi tambang zeolit di Indonesia, di antaranya tersebar di Pulau Sumatera, Sulawesi, dan Jawa (Suyartono & Husaini 1991). Zeolit dihasilkan dari proses hidrotermal pada batuan beku basa. Mineral ini biasanya ditemukan pada celah-celah atau retakan bebatuan. Zeolit banyak mengandung silika (Sutarti & Minta 1994). Banyak penelitian dilakukan untuk mengetahui proses terbentuknya zeolit. Salah satu asumsi mengatakan bahwa zeolit alam terbentuk dari reaksi debu vulkanik reaktif dengan air laut yang mengandung banyak garam alkali dan alkali tanah dengan proses kristalisasi selama 50000 tahun (Rosdiana 2006).
Zeolit merupakan kelompok silika yang dikenal sebagai tektosilika, yaitu mineral berbasis SiO44- dengan struktur tetrahedral yang membangun pola tiga dimensi dengan semua atom O-nya digunakan bersama dengan tetrahedral tetangga. Dengan demikian, dalam struktur ini nisbah Si:O adalah 1:2 dan muatan total kerangka adalah netral. Pada struktur zeolit, Si4+ dapat digantikan oleh Al3+ yang mengakibatkan pengurangan muatan positif pada kerangkanya. Muatan kerangka yang menjadi negatif dapat dinetralkan dengan pengikatan kation monovalen atau divalen terutama Na+, K+, Ca2+, dan Mg2+ (Gambar 1) (Rohaeti 2007).
Gambar 1 Struktur dasar zeolit (Las 2004). Kegunaan zeolit diklasifikasikan berdasarkan pada kemampuannya melakukan pertukaran ion, adsorpsi, atau katalis. Saat ini pemanfaatan mineral zeolit semakin meningkat, mulai dari penggunaan di dalam industri berskala kecil sampai besar. Di
negara maju seperti Amerika Serikat, zeolit sudah dimanfaatkan dalam industri (Saputra 2006). Zeolit juga telah dimanfaatkan di bidang kedokteran, yaitu sebagai antikanker (Kresimir & Miroslav 2001).
Penelitian mengenai manfaat zeolit sebagai antioksidan belum banyak dilakukan. Antioksidan merupakan zat yang berfungsi melindungi tubuh dari serangan radikal bebas. Radikal bebas sendiri merupakan sekelompok bahan kimia baik berupa atom maupun molekul yang memiliki elektron tidak berpasangan pada lapisan luarnya (Arief 2009). Radikal bebas dapat menimbulkan kerusakan sel dan menyebabkan penyakit kardiovaskular, penyakit saluran pernapasan, gangguan sistem kekebalan, karsinogenesis, bahkan dicurigai ikut berperan dalam proses penuaan (aging). Vitamin, polifenol, beta
karotena, dan mineral termasuk dalam golongan antioksidan. Secara alami, antioksidan sangat besar peranannya pada manusia untuk mencegah terjadinya penyakit. Antioksidan menekan kerusakan sel yang terjadi akibat proses oksidasi radikal bebas (Susanto et al. 2009).
Zeolit sebagai antioksidan memiliki beberapa kelebihan dibandingkan dengan antioksidan hasil ekstraksi dari tanaman. Pourmorad et al. (2006) menyatakan, aktivitas
antioksidan ekstrak tanaman (seperti
Mellilotus officinalis) lebih besar karena
memiliki kandungan fenolik dan flavonoid yang cukup tinggi. Namun, proses ekstraksi membutuhkan sampel cukup banyak, preparasi sampel yang cukup lama, dan juga banyak pelarut. Zeolit di sisi lain melimpah di alam, murah, dan penanganannya cukup sederhana, tetapi aktivitas antioksidannya diduga masih belum sebesar ekstrak tanaman (antioksidan klasik).
Gambar 2 Struktur 1,1-difenil-2-pikrilhidrazil (DPPH) (Astuti 2009).
Uji DPPH telah digunakan secara luas pada penelitian fitokimia untuk menguji aktivitas penangkapan-radikal dari ekstrak atau senyawa murni. Metode DPPH ini diharapkan dapat diterapkan pada mineral alam yang memiliki pori seperti zeolit. Penelitian dilaksanakan di Laboratorium Anorganik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dari bulan September 2011 hingga Februari 2012.
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan ialah neraca analitik, peralatan kaca, oven, tanur, pengaduk magnet, vorteks, spektrofotometer ultraviolet-tampak (Laboratorium Bersama IPB), mikroskop elektron pemayaran (SEM) Shimadzu(Badan Tenaga Atom Nasional-Serpong), dan difraktometer sinar-X (XRD) 6000 Shimadzu (Puslitbang Hutan Bogor). Selain itu, digunakan pula kamera digital untuk dokumentasi hasil kerja laboratorium dan lapangan.
Bahan yang digunakan ialah zeolit alam Indonesia dan berbagai bahan kimia lain baik dengan tingkat kemurnian spectroscopy grade
maupun teknis. Zeolit alam yang digunakan berasal dari 4 daerah penambangan, yaitu Banten, Lampung, Sukabumi, dan Tasikmalaya. Selanjutnya sampel tersebut diberi nama sesuai tempat asalnya. Bahan-bahan lain yang digunakan ialah larutan HCl 1, 2, 3, dan 4 M, larutan DPPH, akuades, pH universal, etanol, dan asam askorbat.
Metode Penelitian
Penelitian terbagi menjadi beberapa tahapan seperti ditunjukkan pada Lampiran 1. Preparasi Zeolit Alam
Zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya diseleksi dan dibersihkan dari
pengotor seperti tanah, ranting, dan lapukan organik. Zeolit dihaluskan dan diayak hingga memiliki ukuran 100 mesh, kemudian dicuci dengan menggunakan akuades. Serbuk zeolit yang diperoleh kemudian diaktivasi dan dicirikan menggunakan SEM.
Aktivasi Zeolit dengan Kalsinasi
(modifikasi Swantomo et al. 2009)
Zeolit alam hasil preparasi dibakar dalam tanur pada suhu 100, 200, 300, dan 400 °C selama 3 jam. Zeolit yang telah aktif siap digunakan untuk uji aktivitas antioksidan. Aktivasi Zeolit dengan Penambahan Asam (modifikasi Syafii 2011)
Aktivasi dilakukan dengan ragam konsentrasi asam untuk mendapatkan konsentrasi optimum sampai diperoleh zeolit aktif sebagai antioksidan. Sebanyak 100 g zeolit ditambahkan ke dalam 250 mL HCl dengan ragam konsentrasi 1, 2, 3, dan 4 M. Campuran diaduk dengan pengaduk magnet selama 60 menit, lalu didekantasi dan residu dicuci dengan akuades sampai pH filtrat 6–7. Kemudian residu dikeringkan dengan oven pada suhu 300 °C selama 3 jam.
Uji Aktivitas Antioksidan dengan Metode
DPPH (modifikasi Aranda et al. 2009)
Sebanyak 2 g zeolit alam teraktivasi-suhu dan teraktivasi-asam masing-masing dimasukkan ke dalam tabung reaksi dan ditambahkan 9 mL DPPH 125 µM dalam etanol. Campuran dihomogenkan pada suhu ruang dengan menggunakan vorteks pada kecepatan 1000 rpm selama 5 menit, kemudian disentrifugasi dengan kecepatan 4000 g selama 10 menit untuk memisahkan
endapan dan supernatan. Supernatan diukur serapannya pada panjang gelombang 517 nm. Blangko yang digunakan adalah pereaksi tanpa penambahan zeolit. Asam askorbat sebanyak 2 g digunakan sebagai kontrol positif. Kapasitas penghambatan radikal bebas dihitung berdasarkan persamaan
ktivitas penan kapan adikal AA 100
A adalah absorbans kontrol negatif (larutan
DPPH), sedangkan B adalah absorbans
HASIL DAN PEMBAHASAN
Preparasi Zeolit
Zeolit alam dari daerah Banten, Lampung, Sukabumi, dan Tasikmalaya masih mengandung pengotor non-zeolit seperti tanah, ranting, dan senyawa organik. Senyawa organik dan anorganik tersebut dapat dihitung sebagai loss of ignition (LOI), yaitu selisih
antara bobot sedimen sebelum dan sesudah pemijaran atau dengan kata lain, kadar zat yang hilang akibat pembakaran (Halide 2008). Nilai LOI zeolit Banten 16.97%, zeolit Lampung 16.08%, zeolit Sukabumi 15.81%, dan zeolit Tasikmalaya 12.20% (Lampiran 2). Hasil penelitian LIPI (2010) menunjukkan bahwa semakin tinggi nilai LOI pada zeolit, semakin banyak kandungan bahan organik.
Zeolit alam terlebih dahulu dihaluskan untuk menghomogenkan ukuran dan memperbesar luas permukaan agar kemampuannya sebagai adsorben lebih optimum (Mutngimaturrohmah et al. 2009).
Keberadaan pengotor non-zeolit dapat menutupi permukaan pori zeolit, maka perlu dihilangkan. Pencucian menggunakan air dapat menghilangkan pengotor yang larut dalam air. Zeolit hasil preparasi dianalisis menggunakan SEM untuk mengetahui mikro struktur, meliputi tekstur, morfologi, komposisi, dan informasi kristalografi permukaan zeolit (Nais & Wibawa 2011). Fotomikrograf ditunjukkan pada Gambar 3.
(a) (b)
(c) (d)
Gambar 3 Foto morfologi permukaan (SEM) zeolit alam Banten (a), Lampung (b), Sukabumi (c), dan Tasikmalaya (d) tanpa perlakuan dengan perbesaran 5000 .
Pencitraan SEM menunjukkan bahwa zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya berbentuk kubus tidak beraturan seperti bentuk struktur kristal klinoptilolit. Selain itu, terdapat pengotor yang menempel pada permukaan zeolit. Zeolit alam tersebut juga masih dikelilingi butiran-butiran kecil unsur zeolit yang tidak membentuk kristal atau amorf (Mustain et al. 2011).
Aktivasi Zeolit Alam
Aktivasi zeolit merupakan upaya memodifikasi keadaan pada struktur kerangka atau non-kerangka zeolit sehingga diperoleh sifat fisika dan kimia zeolit yang diinginkan (Srihapsari 2006). Aktivasi bertujuan memurnikan zeolit dari komponen pengotor, menghilangkan kation logam dan molekul air, sehingga memperbesar ukuran pori dan meningkatkan kapasitas adsorpsi (Rosdiana 2006). Dalam penelitian ini, aktivasi zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya diperlukan untuk meningkatkan aktivitasnya sebagai antioksidan. Aktivasi zeolit dapat dilakukan melalui beberapa cara, antara lain kalsinasi/pemanasan dan perendaman dalam asam atau basa.
Kalsinasi bertujuan mengeluarkan air atau garam pengotor dari dalam pori zeolit (Yuliusman et al. 2010). Menurut Saputra
(2006), pemanasan pada suhu di atas 400 °C menyebabkan kerusakan pada struktur kerangka tetrahedral zeolit. Karena itu, kalsinasi dilakukan pada suhu 100, 200, 300, dan 400 °C. Diharapkan pada ragam suhu tersebut diperoleh aktivitas zeolit paling tinggi sebagai antioksidan tanpa merusak struktur zeolit (Rakmatullah et al. 2007).
Keterangan:
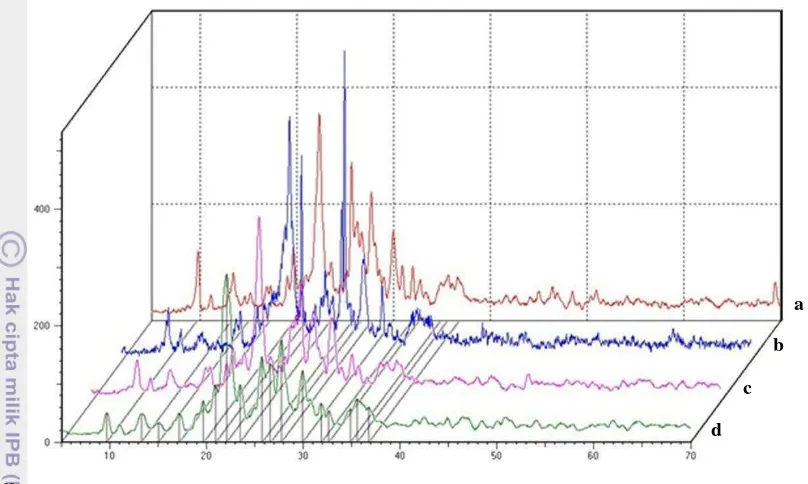
a = profil pola difraksi zeolit Banten, b = profil pola difraksi zeolit Lampung, c = profil pola difraksi zeolit Sukabumi, dan d = profil pola difraksi zeolit Tasikmalaya
Gambar 4 Profil pola difraksi zeolit alam teraktivasi-suhu 100 °C pada sudut 2θ. Hasil pembandingan memperlihatkan,
zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya termasuk jenis klinoptilolit dengan kandungan kation penyeimbang terbanyak ialah Ca dan Sr (Lampiran 4). Menurut Kresimir dan Miroslav (2001), zeolit jenis klinoptilolit memiliki komposisi kimia SiO2 50 55%, Al2O3 9.3 11.4%, Fe2O3 2.2 2.8%, Na2O 0.8 1.1%, K2O 2.9 4.3%, MgO 0.8 1.2%, CaO 13.7 17.2%, MnO 0.07 0.22%, dan air 14 16%. Puncak 2θ untuk mineral zeolit jenis klinoptilolit berdasarkan JCPDS No 17-0143 ialah 17.305, 22.319, 23.849, 24.850, 25.923, 26.108, 28.036, 30.063, 31.936, dan 32.655 (Lampiran 5). Perbedaan nilai sudut 2θ yang tidak terlalu jauh menunjukkan bahwa aktivasi pada suhu 100 °C tidak merusak struktur, tetapi hanya menguapkan air yang terdapat pada pori-pori zeolit. Diduga zeolit dari setiap daerah mengandung campuran zeolit jenis mordenit, karena puncak difraksi sinar-X yang dimiliki zeolit jenis mordenit (JCPDS No 6-239 den an puncak 2θ: 6.447, 9.745, 15.322, 22.254, 25.631, 26.332, 27.651, dan 30.937) juga dimiliki zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya, tetapi intensitasnya kecil.
Aktivasi zeolit secara kimia bertujuan membersihkan permukaan pori dari pengotor dan mengatur kembali letak atom yang dapat dipertukarkan (Ginting et al. 2007). Proses
aktivasi zeolit dengan perlakuan HCl pada konsentrasi tertentu menyebabkan zeolit mengalami dealuminasi dan dekationisasi, yaitu keluarnya Al dan kation-kation dari dalam kerangka zeolit (Lampiran 6). Dekationisasi memperluas permukaan zeolit, karena pengotor yang menutupi pori-pori zeolit berkurang. Permukaan yang semakin luas diharapkan meningkatkan kemampuan zeolit dalam proses adsorpsi (Fatimah 2009).
Aktivitas Antioksidan Zeolit
Metode DPPH digunakan untuk melihat potensi zeolit alam sebagai antioksidan. Metode ini mudah, cepat, dan peka untuk pengujian aktivitas antioksidan (Koleva et al.
2002). Kontrol positif yang digunakan adalah asam askorbat. Asam askorbat mudah mengalami oksidasi oleh radikal bebas karena mempunyai 2 gugus -OH enolik. Radikal bebas akan menarik atom hidrogen dari kedua gugus tersebut sehingga terbentuk radikal oksigen yang stabil dan tidak membahayakan karena elektron tak berpasangan didelokalisasikan melalui resonans (Cholison & Utami 2008) (Lampiran 7). Aktivitas antioksidan suatu senyawa dapat mengubah warna larutan DPPH dari ungu menjadi kuning. Warna ungu DPPH memberikan serapan kuat pada panjang gelombang 517 nm. Ketika elektron tak berpasangan pada a
d c
radikal DPPH menjadi berpasangan oleh sumbangan elektron dari senyawa yang memiliki aktivitas antioksidan, absorbans menurun secara stokiometri sesuai jumlah elektron yang diambil.
Semua sampel zeolit alam tanpa perlakuan aktivasi telah memiliki kemampuan menghambat senyawa radikal bebas, terlihat dari nilai absorbans yang lebih kecil dibandingkan dengan kontrol negatif (Lampiran 8). Namun, data pada Tabel 1 menunjukkan bahwa semua zeolit masih memiliki aktivitas antioksidan yang jauh lebih rendah dari pada asam askorbat (kontrol positif). Permukaan pori zeolit masih tertutupi pengotor sehingga perlu dilakukan aktivasi. Diduga mekanisme penangkapan radikal DPPH pada zeolit berbeda dengan asam askorbat. Zeolit tidak hanya menetralkan radikal DPPH dengan menyumbangkan elektron, tetapi juga menangkap dan mengadsorpsi radikal DPPH tersebut di dalam strukturnya (Lampiran 9).
Tabel 1 Aktivitas antioksidan zeolit alam tanpa perlakuan dan vitamin C
Sampel antioksidan Aktivitas (%)
Zeolit Banten 55.20
Zeolit Lampung 31.95
Zeolit Sukabumi 42.46 Zeolit Tasikmalaya 41.20
Asam askorbat 92.14
Menurut Sukmawardany et al. (2004),
zeolit di Indonesia, terutama zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya adalah jenis klinoptilolit. Hal tersebut didukung oleh hasil analisis SEM dan XRD. Struktur sangkar zeolit klinoptilolit mempunyai 2 pori utama. Pori pertama dibatasi oleh 10 oksigen berdiameter 10.685 Å, ditempati oleh logam alkali dan alkali tanah (Ca, Na, K, Mg, Fe, dan Sr). Pori kedua lebih kecil, dibatasi oleh 8 oksigen berdiameter 8.193 Å, dan ditempati oleh molekul air, logam alkali, dan alkali tanah (Lampiran 10) (Supardi 2010). Zeolit dapat mengadsorpsi molekul DPPH karena ukuran molekulnya lebih kecil dibandingkan dengan ukuran pori zeolit. Nisbah Si/Al pada struktur zeolit memengaruhi ukuran porinya. Zeolit jenis klinoptilolit memiliki nisbah Si/Al sedang. Semakin kecil nisbah Si/Al, diameter pori semakin besar. Atom Sr dan Ca sebagai kation penyeimbang struktur kerangka zeolit Banten, Lampung, Sukabumi, dan
Tasikmalaya memiliki jejari atom 1.914 dan 1.74 Å. Ukuran atom Sr dan Ca menyebabkan pelebaran sudut Si-O-Al sehingga membentuk pori yang besar (Kasmui et al. 2009). Semakin
besar diameter pori zeolit, semakin mudah DPPH teradsorpsi. Tipe utama interaksi adsorpsi DPPH dengan zeolit adalah gaya van der Waals, hasil interaksi dispersif dan induktif molekul DPPH dengan zeolit (Vasileva et al. 2010).
Permukaan zeolit yang bermuatan negatif dan keberadaan oksida logam sebagai reduktor mengakibatkan zeolit dapat menstabilkan radikal DPPH. Atom oksigen sebagai penghubung antara atom Si dan Al yang membentuk pori-pori intrakristalin memiliki 2 pasang elektron bebas. Elektron bebas tersebut akan disumbangkan kepada atom N pada molekul DPPH sehingga aktivitas radikal DPPH dapat diredam. Selain itu, oksida logam seperti Fe dan Mn pada struktur zeolit memiliki kemampuan melepas elektron yang dimiliki untuk mereduksi radikal DPPH. Keberadaan oksida logam Fe dan Mn sebagai reduktor pada zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya tidak teramati oleh XRD sehingga perlu dilakukan analisis dengan menggunakan spektroskopi sinar-X dispersif energi (EDX) untuk melihat komposisi kimia zeolit. Potensi zeolit alam sebagai antioksidan dapat terlihat dari perubahan warna ungu DPPH menjadi kuning (Gambar 5).
Keterangan:
a = larutan DPPH awal, b = zeolit Banten, c = zeolit Lampung, d = zeolit Sukabumi, dan e = zeolit Tasikmalaya.
Gambar 5 Perubahan warna larutan DPPH setelah penambahan zeolit alam tanpa perlakuan.
Hasil uji zeolit teraktivasi-kalsinasi (Tabel 2) menunjukkan peningkatan aktivitas antioksidan untuk pemanasan pada suhu 100 °C. Aktivitas antioksidan zeolit teraktivasi-suhu kemudian menurun dengan meningkatnya suhu.
Tabel 2 Aktivitas antioksidan zeolit alam teraktivasi-suhu
Sampel Zeolit
Aktivitas antioksidan (%) Suhu (°C) 100 200 300 400 Banten 79.94 42.56 34.92 4.78 Lampung 75.26 29.83 23.46 6.37 Sukabumi 85.56 37.26 31.85 7.54 Tasik 78.47 39.60 28.77 5.41 Pada suhu 100 °C pengotor atsiri seperti air telah teruapkan. Dehidrasi molekul air akan membentuk pori-pori dan saluran yang dapat mengadsorpsi molekul DPPH. Selain itu, logam pengotor seperti oksida logam Fe dan Mn tidak hilang pada suhu 100 °C dan dapat berperan sebagai reduktor yang meningkatkan aktivitas zeolit sebagai antioksidan. Perubahan warna DPPH dari ungu menjadi kuning terlihat jelas pada zeolit yang teraktivasi-suhu 100 °C (Gambar 6).
Keterangan:
a = zeolit Banten, b = zeolit Lampung, c = zeolit Sukabumi, dan d = zeolit Tasikmalaya.
Gambar 6 Perubahan warna larutan DPPH setelah penambahan zeolit teraktivasi-suhu 100 °C.
Pada suhu 400 °C terjadi perubahan fase zeolit sehingga aktivitasnya sebagai antioksidan menurun. Menurut Barrer (1982), suhu aktivasi yang terlalu tinggi menyebabkan dehidroksilasi gugus -OH pada struktur zeolit. Akibatnya, ikatan Si-O-Al putus dan terbentuk gugus siloksana (Si-O-Si) serta aluminium yang miskin gugus hidroksil. Menurut Saputra (2006), perbedaan komposisi kation penyeimbang dan nisbah Si/Al menyebabkan kestabilan zeolit alam terhadap suhu berbeda-beda pula. Zeolit alam dengan nisbah Si/Al tinggi lebih tahan terhadap suhu tinggi daripada yang nisbah Si/Al-nya rendah (Józefaciuk & Bowanko 2002). Zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya termasuk jenis klinoptilolit yang memiliki nisbah Si/Al sedang sehingga mudah rusak
pada suhu tinggi. Selama pemanasan pada suhu 400 °C terjadi perubahan warna zeolit alam. Hal ini dikarenakan zeolit mengalami perubahan struktur akibat pemanasan yang terlalu tinggi.
Hasil uji zeolit teraktivasi-asam (Tabel 3) menunjukkan peningkatan aktivitas antioksidan dibandingkan dengan zeolit tanpa perlakuan, tetapi menurun dibandingkan dengan zeolit teraktivasi-kalsinasi. Aktivitas antioksidan didapati semakin menurun seiring meningkatnya konsentrasi asam. Pada zeolit alam teraktivasi-asam, konsentrasi HCl 1 M menunjukkan aktivitas antioksidan paling tinggi.
Tabel 3 Aktivitas antioksidan zeolit alam teraktivasi-asam
Sampel Zeolit
Aktivitas antioksidan (%) 1 M 2 M 3 M 4 M Banten 63.18 59.80 49.44 48.15 Lampung 65.84 61.17 47.69 45.81 Sukabumi 66.56 56.11 48.98 44.02 Tasik 61.94 58.45 49.33 41.81 Pencucian zeolit dengan HCl 1 M meningkatkan luas permukaan karena berkurangnya pengotor berupa oksida logam dan zat lain yang terikat di sekitar kristal zeolit, yang tidak terlepas pada saat pencucian dengan air (Herawati et al. 1997). Perubahan
warna DPPH dari ungu menjadi kuning terlihat jelas pada zeolit yang teraktivasi-HCl 1 M (Gambar 7). Perubahan warna tersebut mengindikasikan aktivitas zeolit sebagai antioksidan.
Keterangan:
a = zeolit Banten, b = zeolit Lampung, c = zeolit Sukabumi, dan d = zeolit Tasikmalaya.
Gambar 7 Perubahan warna larutan DPPH setelah penambahan zeolit teraktivasi-HCl 1 M.
Penurunan aktivitas antioksidan zeolit pada aktivasi dengan konsentrasi HCl 4 M
a b c d
disebabkan oleh terjadinya dealuminasi (Vasileva et al. 2010). Ion H+ hasil
penguraian HCl dalam medium air akan diserang oleh atom oksigen yang terikat pada Si dan Al. Nilai energi disosiasi ikatan Al-O (116 kkal/mol) jauh lebih rendah daripada ikatan Si-O (190 kkal/mol), maka ikatan Al-O jauh lebih mudah terurai (Auerbach et al.
2003). Karena itu, ion H+ akan cenderung memutuskan ikatan Al-O pada kerangka zeolit dan terbentuk gugus silanol. Ion Cl– hasil penguraian ion HCl juga akan memengaruhi kekuatan ikatan Al-O dan Si-O. Ion Cl–
memiliki elektronegativitas yang tinggi (3.16) dan berukuran kecil (r = 0.97 Å), sehingga
mudah berikatan dengan kation bervalensi besar seperti Si4+ dan Al3+. Akan tetapi, ion Cl– akan cenderung berikatan dengan atom Al dikarenakan elektronegativitas atom Al lebih kecil (1.61) dibandingkan dengan Si (1.90) (Mutngimaturrohmah et al. 2009).
Dealuminasi ini merusak struktur kristal zeolit sehingga kemampuannya mengadsorpsi radikal DPPH menurun. Akibatnya aktivitas zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya sebagai antioksidan menjadi sangat kecil. Herawati et al. (1997) telah
membuktikan bahwa struktur klinoptilolit lebih tahan terhadap perlakuan dengan basa daripada perlakuan dengan asam.
SIMPULAN DAN SARAN
Simpulan
Aktivitas antioksidan zeolit Banten adalah 55.20%, lebih besar daripada zeolit Sukabumi, Tasikmalaya dan Lampung, yaitu 42.46%; 41.20%; dan 31.95%. Aktivitas tersebut diukur dengan metode DPPH. Morfologi SEM permukaan zeolit menunjukkan bentuk kubus tidak beraturan, mirip dengan kristal klinoptilolit. Aktivasi zeolit dengan suhu 100 °C dan dengan HCl dapat meningkatkan aktivitas antioksidan. Aktivitas antioksidan optimum diperoleh zeolit Sukabumi, yaitu sebesar 85.56% dengan aktivasi pada suhu 100 °C dan 66.56% pada aktivasi dengan HCl 1 M. Pencirian struktur menggunakan XRD pada zeolit yang memiliki aktivitas antioksidan paling tinggi menunjukkan bahwa zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya merupakan jenis klinoptilolit dengan kandungan kalsium dan strontium (Ca dan Sr).
Saran
Perlu dilakukan optimasi aktivasi zeolit agar diperoleh zeolit dengan aktivitas antioksidan yang terbaik serta modifikasi zeolit alam dengan oksida logam untuk meningkatkan aktivitas antioksidan.
DAFTAR PUSTAKA
Aranda RS, Lopez LAP, Arroyo JL, Garza BAA, de Torres JL. 2009. Antimicrobial and antioxidant activities of plants from northeast of Mexico. J Med 11:1-6.
Arief S. 2009. Radikal bebas. Medical [terhubung berkala]. http://smf.Unair. ac.id/journal [10 Mei 2010].
Astuti NY. 2009. Uji aktivitas penangkapan radikal DPPH oleh analog kurkumin monoketon dan heteroalifatik monoketon [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhamadiyah Surakarta. Auerbach SM, Corrado KA, Dutta PK, editor.
2003. Zeolite Science and Technology.
New York: Marcel Dekker.
Barrer RM. 1982. Hydrotermal Chemistry of Zeolites. London: Acad Pr. .
Cholison Z, Utami W. 2008. Aktivitas penangkapan radikal ekstrak etanol 70% biji jengkol. Pharmacon 9:33-40.
Fatimah D. 2009. Peningkatan kualitas zeolit alam Cikarang, Tasikmalaya dengan metoda asam mineral. Di dalam:
Optimalisasi Pemanfaatan Sumber Daya dan Mitigasi Kebencanaan di Indonesia. Prosiding Pemaparan Hasil Penelitian Puslit Geoteknologi; Bandung, 3 Des
2009. Bandung: Lembaga Ilmu Pengetahuan Indonesia; 3 Des 2009. hlm 1-7.
Ginting A, Anggraini D, Indaryati S, Kriswarini R. 2007. Karakterisasi komposisi kimia, luas permukaan pori, dan sifat termal dari zeolit Bayah, Tasikmalaya, dan Lampung. J Teknik Bahan Nuklir 3:1-48.
Halide H. 2008. Panduan Teknis CADS_TOOLS (Suatu Perangkat Pendukung Keputusan dalam Budidaya Keramba Jaring Apung). Chaidir M,
Tropical Finfish Cage Culture in Indonesian and Northern Australia.
Haryati T. 2011. Aktivitas antioksidan beberapa tanaman obat menggunakan zeolit alam sebagai bahan penompang [tesis]. Bogor: Pascasarjana, Institut Pertanian Bogor.
Herawati E, Soemantoyo R, Almanar. 1997. Pengaruh perlakuan kimiawi terhadap karakteristik zeolit alam Lampung. Di dalam: Proceedings of Seminar Ilmiah FT UI: Masalah dan Penanganan Limbah Industri, Tinjauan dari Aspek Teknologi,
VI.1-VI.5.
Józefaciuk G, Bowanko G. 2002. Effect of acid and alkali treatment on surface areas and adsorption energies of selected minerals. Clays Clay Minerals
50:771-783.
Kasmui, Sugianti N, Subiyanto. 2009. Perubahan ukuran pori pada modifikasi molekul ZSM-5 dengan ragam rasio Si/Al dan ragam rasio kation menggunakan metode mekanika molekuler. Nat Zeolite
22:1-19.
Koleva et al. 2002. Screening of plant extracts
for antioxidant activity: a comparative study on three testing methods. Phytochem Anal 13:8-17.
Kresimir P, Miroslav C. 2001. Natural zeolite clinoptilolite: new adjuvant in anticancer therapy. J Mol Med 78:708-720.
[LIPI] Lembaga Ilmu Pengetahuan Indonesia. 2008. Pengolahan Mineral Tekto-silika Alam untuk Subtitusi Impor Sediaan Bahan Baku Farmasi: Rekayasa Batuan sebagai Basis Mineral Antiseptik melalui Penanaman Inhibitor dengan Metode Kontinyu: Program Insentif Penelitian dan Perekayasaan LIPI Tahun 2010. Bandung:
LIPI.
Las I. 2004. Pengelolaan variabilitas iklim
untuk mendukung ketahanan pangan nasional [monograf]. Jakarta: Direktorat Jenderal Tanaman Pangan.
Mustain A, Falah M, Furoiddun M, Wibawa G. 2011. Pengurangan kandungan Ca2+ dari zeolit alam untuk meningkatkan kualitasnya menjadi zeolit A [abstrak]. Di dalam: Seminar Rekayasa Kimia dan Proses; Surabaya, 26 Jul 2011. Surabaya:
Institut Teknologi Sepuluh November ISSN 1411-4216. Abstr no E-05-1.
Mutngimaturrohmah, Gunawan, Khabibi. 2009. Aplikasi zeolit alam terdealuminasi dan termodifikasi HDTMA sebagai adsorben fenol [skripsi]. Semarang: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Diponegoro.
Nais F, Wibawa G. 2011. Peningkatan kapasitas zeolit alam Indonesia sebagai absorben pada produksi Bioethanol Fuel Grade. Di dalam: Prosiding Seminar Nasional Teknologi Industri XV; Surabaya,
12 Mei 2011. Surabaya: Institut Teknologi Sepuluh November. hlm 187-193.
Ozge G. 2005. Synthesis and characterization of clinoptilolite [thesis]. Middle: The Graduate School of Natural and Applied Sciences, The Middle East Technical University.
Pourmorad F, Hosseinimehr SJ, Shahabimajd N. 2006. Antioxidant activity, phenol, and flavonoid contents of some selected Iranian medical plants. J Biotechnol 11:
1142-1145.
Rakhmatullah DK, Wiradini G, Ariyanto NP. 2007. Pembuatan adsorden dari zeolit alam dengan karakteristik adsorption properties untuk kemurnian bioetanol [skripsi]. Bandung: Fakultas Teknologi Industri, Institut Teknologi Bandung.
Rohaeti E. 2007. Pencegahan pencemaran lingkungan oleh logam berat krom limbah cair penyamakan kulit: Studi kasus di Kabupaten Bogor [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Rosdiana T. 2006. Pencirian dan uji aktivitas katalitik zeolit alam teraktivasi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Saputra R. 2006. Pemanfaatan zeolit sintesis sebagai alternatif pengolahan limbah industri [skripsi]. Depok: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia.
Sukmawardany R, Latif NA, Sutisna T, Riva E. 2004. Inventarisasi dan evaluasi sumber daya mineral di daerah Kabupaten Lampung Barat dan Tanggamus-Provinsi Lampung. P3G 5:20-22.
Supardi. 2010. Preparasi dan Modifikasi Zeolit Alam sebagai Penyaring Limbah Cair Industri. Riset Unggulan Terpadu
PTPLR-BATAN.
Susanto A, Rhona D, Mardiyani I. 2009. Vitamin C sebagai antioksidan [skripsi]. Surakarta: Fakultas Peternakan, Universitas Sebelas Maret.
Sutarti M, Minta R. 1994. Zeolit. Tinjauan Literaturat. Jakarta: Pusat Dokumentasi
dan Informasi Ilmiah, LIPI.
Suyartono, Husaini. 1991. Tinjauan terhadap kegiatan penelitian karakteristik dan pemanfaatan zeolit di Indonesia yang dilakukan pusat pengembangan teknologi mineral pada periode 1980-1991. PTM 1:
12-19
Swantomo D, Kundari NA, Pambudi SL. 2009. Adsorpsi fenol dalam limbah dengan
zeolit alam terkalsinasi. Di dalam: Seminar Nasional V. Bandung: BATAN-STTN,
705-713.
Syafii F. 2011. Modifikasi zeolit melalui interaksi dengan Fe(OH)3 untuk meningkatkan kapasitas tukar anion. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Vasileva SU, Borodina EV, Kotova DL, Selemenev VF. 2010. Mechanism fixing vitamine E on clinoptilolite tuff. Di dalam: Hechkt, editor. Application of Natural Zeolite in Medicine and Cosmetology-ZEOMEDCOS. Proceedings of ZEOMEDCOS; Azerbaijan, 27-29 Sep
2010. London: Int Acad Sci H & E. hlm 86-92.
Yuliusman, Widodo, Yulianto, Yuda. 2010. Preparasi zeolit alam dengan larutan HF, HCl, dan kalsinasi untuk adsorpsi gas CO [abstrak]. Di dalam: Seminar Rekayasa Kimia dan Proses. Depok: Universitas
Lampiran 1 Bagan alir penelitian
Aktivasi dengan Penambahan Asam (HCl)
Penghancuran Zeolit Alam
Penyaringan Zeolit
Aktivasi Zeolit Alam
Uji Aktivitas Antioksidan dengan DPPH Zeolit Alam
Zeolit Alam Berukuran
100 Mesh SEM
Zeolit
Teraktivasi-HCl 1, 2, 3, & 4 M XRD
Aktivasi dengan Suhu
Lampiran 2 Nilai
loss of ignition
(LOI) zeolit alam pada suhu 1100 °C
Zeolit alam
Cawan
kosong (g)
Cawan + zeolit (g)
LOI (%)
Awal
Akhir
Banten
26.1968
27.1979
27.0280
16.97
Lampung
24.9304
25.9429
25.7801
16.08
Sukabumi
20.4241
21.4334
21.2738
15.81
Tasikmalaya
18.1955
19.1993
19.0768
12.20
Contoh perhitungan:
Lampiran 3 Data XRD
(a)
Data XRD zeolit Lampung
Proses data awal
Kelompok
: DiAS_Std_02_2012
Data
: Zeolit_Lampung_Dony
no. peak no. 2 theta (deg) d (A) I/II FMWH (deg) Intensity (Counts) Integrated Int (Counts) 1 49 28.0769 3.17554 100 0.12360 230 1529
2 37 23.6517 3.75870 59 0.11300 136 847
3 31 22.4107 3.96396 57 0.30180 132 2259
(b)
Data XRD zeolit Banten
Proses data awal
Kelompok
: DiAS_Std_02_2012
Data
: Zeolit_Banten_Dony
no. peak no. 2 theta (deg) d (A) I/II FMWH (deg) Intensity (Counts) Integrated Int (Counts) 1 17 22.3239 3.97917 100 0.60600 125 4451
2 21 25.6988 3.46375 74 0.31830 92 2186
3 24 27.7138 3.21631 54 0.42400 68 1382
(c)
Data XRD zeolit Sukabumi
Proses data awal
Kelompok
: DiAS_Std_02_2012
Data
: Zeolit_Sukabumi_Dony
no. peak no. 2 theta (deg) d (A) I/II FMWH (deg) Intensity (Counts) Integrated Int (Counts) 1 12 22.3541 3.97387 100 0.68670 108 4101
2 18 26.5784 3.35108 56 0.55000 60 1996
3 19 27.9115 3.19398 38 0.74000 41 1655
(d)
Data XRD zeolit Tasikmalaya
Proses data awal
Kelompok
: DiAS_Std_02_2012
Data
: Zeolit_Tasikmalaya_Dony
no. peak no. 2 theta (deg) d (A) I/II FMWH (deg) Intensity (Counts)
Integrated Int (Counts)
1 9 22.1326 4.01313 100 0.09070 101 5475
2 14 27.7617 3.21087 50 0.76000 50 2083
Lampiran 6 Skema reaksi dealuminasi dan dekationisasi
Lampiran 7 Sumbangan proton dari antioksidan ke radikal DPPH
O
O
H O
O
CH2OH
OH
H
+
NO2
O2N
NO2
N
N(C6H5)2
Asam askorbat DPPH
O
O
H O
O
CH2OH
OH
+
O2N NO2NO2
NH N(C6H5)2
O
O O
O
CH2OH
OH
H
+
NO2
O2N
NO2
N
N(C6H5)2
NO2
O2N
NO2
NH N(C6H5)2
O
O O
O
CH2OH
OH
+
Lampiran 8 Uji DPPH pada zeolit alam
(a) Zeolit alam tanpa perlakuan
Sampel zeolit Absorbans Aktivitas antioksidan (%)
Banten 0.422 55.20
Lampung 0.641 31.95
Sukabumi 0.542 42.46
Tasikmalaya 0.554 41.14
Vitamin C (kontrol positif) 0.074 92.14
Contoh perhitungan:
Persen aktivitas antioksidan zeolit Banten
ktivitas penan kapan adikal
A
A
100
0 942
0 942
0 422
100
55 20
(b) Zeolit alam teraktivasi-suhu
Suhu aktivasi (°C) Sampel zeolit Absorbans Aktivitas antioksidan (%)
100
Banten 0.189 79.94
Lampung 0.233 75.26
Sukabumi 0.136 85.56
Tasikmalaya 0.297 68.47
200
Banten 0.541 42.56
Lampung 0.661 29.83
Sukabumi 0.591 37.26
Tasikmalaya 0.569 39.60
300
Banten 0.613 34.92
Lampung 0.721 23.46
Sukabumi 0.642 31.85
Tasikmalaya 0.671 28.77
400
Banten 0.897 4.78
Lampung 0.882 6.37
Sukabumi 0.871 7.54
lanjutan Lampiran 8
Contoh perhitungan:
Persen aktivitas antioksidan zeolit Banten teraktivasi-suhu 100 °C
ktivitas penan kapan adikal
A
A
100
0 942
0 942
0 189
100
79 94
(c) Zeolit alam teraktivasi-asam (HCl)
Konsentrasi asam(M) Sampel zeolit Absorbans Aktivitas antioksidan (%) 1
Banten 0.347 63.18
Lampung 0.322 65.84
Sukabumi 0.315 66.56
Tasikmalaya 0.358 61.94
2
Banten 0.378 59.80
Lampung 0.366 61.17
Sukabumi 0.413 56.11
Tasikmalaya 0.391 58.45
3
Banten 0.476 49.44
Lampung 0.490 47.98
Sukabumi 0.471 49.98
Tasikmalaya 0.472 49.33
4
Banten 0.488 48.15
Lampung 0.510 45.81
Sukabumi 0.527 44.02
Tasikmalaya 0.548 41.81
Contoh perhitungan:
Persen aktivitas antioksidan zeolit Banten teraktivasi-HCl 1 M
ktivitas penan kapan adikal
A
A
100
0 942
0 942
0 347
100
Lampiran 9 Mekanisme zeolit menetralkan radikal DPPH
a. Adsorpsi molekul DPPH
Lampiran 10 Data struktur zeolit klinoptilolit tipe heulandit
10 ring
Dibimbing oleh SRI SUGIARTI dan ETI ROHAETI.
Zeolit merupakan mineral aluminosilikat dengan struktur kerangka tiga
dimensi, memiliki pori dan saluran yang saling berhubungan sehingga
permukaannya menjadi sangat luas dan efektif sebagai adsorben. Selain itu, zeolit
memiliki permukaan bermuatan negatif yang dapat berinteraksi dengan senyawa
atau molekul bermuatan seperti 1,1-difenil-2-pikrilhidrazil (DPPH). Penelitian ini
bertujuan menentukan aktivitas penangkapan radikal bebas DPPH oleh zeolit
alam Indonesia, yaitu zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya. Uji
aktivitas antioksidan terhadap DPPH dilakukan pada zeolit tanpa perlakuan, zeolit
teraktivasi-suhu, dan zeolit teraktivasi-asam. Aktivitas antioksidan tertinggi
ditunjukkan oleh zeolit Sukabumi teraktivasi-suhu 100 °C sebesar 85.56% dan
zeolit Sukabumi teraktivasi-HCl 1 M sebesar 65.56%, tetapi belum sebaik asam
askorbat yang memiliki aktivitas antioksidan 92.14%. Hasil analisis mikroskop
elektron pemayaran dan difraksi sinar-X menunjukkan bahwa zeolit Banten,
Lampung, Sukabumi, dan Tasikmalaya adalah jenis klinoptilolit.
ABSTRACT
DONY RAHMAD PRANOTO. Potency of Natural Zeolite as Antioxidant.
Supervised by SRI SUGIARTI and ETI ROHAETI.
PENDAHULUAN
Zeolit merupakan salah satu mineral yang banyak terkandung di bumi terutama di Indonesia. Zeolit pertama kali ditemukan di alam oleh Baron Frederick C pada tahun 1756. Para ahli geologi menemukan 47 lokasi tambang zeolit di Indonesia, di antaranya tersebar di Pulau Sumatera, Sulawesi, dan Jawa (Suyartono & Husaini 1991). Zeolit dihasilkan dari proses hidrotermal pada batuan beku basa. Mineral ini biasanya ditemukan pada celah-celah atau retakan bebatuan. Zeolit banyak mengandung silika (Sutarti & Minta 1994). Banyak penelitian dilakukan untuk mengetahui proses terbentuknya zeolit. Salah satu asumsi mengatakan bahwa zeolit alam terbentuk dari reaksi debu vulkanik reaktif dengan air laut yang mengandung banyak garam alkali dan alkali tanah dengan proses kristalisasi selama 50000 tahun (Rosdiana 2006).
Zeolit merupakan kelompok silika yang dikenal sebagai tektosilika, yaitu mineral berbasis SiO44- dengan struktur tetrahedral yang membangun pola tiga dimensi dengan semua atom O-nya digunakan bersama dengan tetrahedral tetangga. Dengan demikian, dalam struktur ini nisbah Si:O adalah 1:2 dan muatan total kerangka adalah netral. Pada struktur zeolit, Si4+ dapat digantikan oleh Al3+ yang mengakibatkan pengurangan muatan positif pada kerangkanya. Muatan kerangka yang menjadi negatif dapat dinetralkan dengan pengikatan kation monovalen atau divalen terutama Na+, K+, Ca2+, dan Mg2+ (Gambar 1) (Rohaeti 2007).
Gambar 1 Struktur dasar zeolit (Las 2004). Kegunaan zeolit diklasifikasikan berdasarkan pada kemampuannya melakukan pertukaran ion, adsorpsi, atau katalis. Saat ini pemanfaatan mineral zeolit semakin meningkat, mulai dari penggunaan di dalam industri berskala kecil sampai besar. Di
negara maju seperti Amerika Serikat, zeolit sudah dimanfaatkan dalam industri (Saputra 2006). Zeolit juga telah dimanfaatkan di bidang kedokteran, yaitu sebagai antikanker (Kresimir & Miroslav 2001).
Penelitian mengenai manfaat zeolit sebagai antioksidan belum banyak dilakukan. Antioksidan merupakan zat yang berfungsi melindungi tubuh dari serangan radikal bebas. Radikal bebas sendiri merupakan sekelompok bahan kimia baik berupa atom maupun molekul yang memiliki elektron tidak berpasangan pada lapisan luarnya (Arief 2009). Radikal bebas dapat menimbulkan kerusakan sel dan menyebabkan penyakit kardiovaskular, penyakit saluran pernapasan, gangguan sistem kekebalan, karsinogenesis, bahkan dicurigai ikut berperan dalam proses penuaan (aging). Vitamin, polifenol, beta
karotena, dan mineral termasuk dalam golongan antioksidan. Secara alami, antioksidan sangat besar peranannya pada manusia untuk mencegah terjadinya penyakit. Antioksidan menekan kerusakan sel yang terjadi akibat proses oksidasi radikal bebas (Susanto et al. 2009).
Zeolit sebagai antioksidan memiliki beberapa kelebihan dibandingkan dengan antioksidan hasil ekstraksi dari tanaman. Pourmorad et al. (2006) menyatakan, aktivitas
antioksidan ekstrak tanaman (seperti
Mellilotus officinalis) lebih besar karena
memiliki kandungan fenolik dan flavonoid yang cukup tinggi. Namun, proses ekstraksi membutuhkan sampel cukup banyak, preparasi sampel yang cukup lama, dan juga banyak pelarut. Zeolit di sisi lain melimpah di alam, murah, dan penanganannya cukup sederhana, tetapi aktivitas antioksidannya diduga masih belum sebesar ekstrak tanaman (antioksidan klasik).
Gambar 2 Struktur 1,1-difenil-2-pikrilhidrazil (DPPH) (Astuti 2009).
Uji DPPH telah digunakan secara luas pada penelitian fitokimia untuk menguji aktivitas penangkapan-radikal dari ekstrak atau senyawa murni. Metode DPPH ini diharapkan dapat diterapkan pada mineral alam yang memiliki pori seperti zeolit. Penelitian dilaksanakan di Laboratorium Anorganik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dari bulan September 2011 hingga Februari 2012.
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan ialah neraca analitik, peralatan kaca, oven, tanur, pengaduk magnet, vorteks, spektrofotometer ultraviolet-tampak (Laboratorium Bersama IPB), mikroskop elektron pemayaran (SEM) Shimadzu(Badan Tenaga Atom Nasional-Serpong), dan difraktometer sinar-X (XRD) 6000 Shimadzu (Puslitbang Hutan Bogor). Selain itu, digunakan pula kamera digital untuk dokumentasi hasil kerja laboratorium dan lapangan.
Bahan yang digunakan ialah zeolit alam Indonesia dan berbagai bahan kimia lain baik dengan tingkat kemurnian spectroscopy grade
maupun teknis. Zeolit alam yang digunakan berasal dari 4 daerah penambangan, yaitu Banten, Lampung, Sukabumi, dan Tasikmalaya. Selanjutnya sampel tersebut diberi nama sesuai tempat asalnya. Bahan-bahan lain yang digunakan ialah larutan HCl 1, 2, 3, dan 4 M, larutan DPPH, akuades, pH universal, etanol, dan asam askorbat.
Metode Penelitian
Penelitian terbagi menjadi beberapa tahapan seperti ditunjukkan pada Lampiran 1. Preparasi Zeolit Alam
Zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya diseleksi dan dibersihkan dari
pengotor seperti tanah, ranting, dan lapukan organik. Zeolit dihaluskan dan diayak hingga memiliki ukuran 100 mesh, kemudian dicuci dengan menggunakan akuades. Serbuk zeolit yang diperoleh kemudian diaktivasi dan dicirikan menggunakan SEM.
Aktivasi Zeolit dengan Kalsinasi
(modifikasi Swantomo et al. 2009)
Zeolit alam hasil preparasi dibakar dalam tanur pada suhu 100, 200, 300, dan 400 °C selama 3 jam. Zeolit yang telah aktif siap digunakan untuk uji aktivitas antioksidan. Aktivasi Zeolit dengan Penambahan Asam (modifikasi Syafii 2011)
Aktivasi dilakukan dengan ragam konsentrasi asam untuk mendapatkan konsentrasi optimum sampai diperoleh zeolit aktif sebagai antioksidan. Sebanyak 100 g zeolit ditambahkan ke dalam 250 mL HCl dengan ragam konsentrasi 1, 2, 3, dan 4 M. Campuran diaduk dengan pengaduk magnet selama 60 menit, lalu didekantasi dan residu dicuci dengan akuades sampai pH filtrat 6–7. Kemudian residu dikeringkan dengan oven pada suhu 300 °C selama 3 jam.
Uji Aktivitas Antioksidan dengan Metode
DPPH (modifikasi Aranda et al. 2009)
Sebanyak 2 g zeolit alam teraktivasi-suhu dan teraktivasi-asam masing-masing dimasukkan ke dalam tabung reaksi dan ditambahkan 9 mL DPPH 125 µM dalam etanol. Campuran dihomogenkan pada suhu ruang dengan menggunakan vorteks pada kecepatan 1000 rpm selama 5 menit, kemudian disentrifugasi dengan kecepatan 4000 g selama 10 menit untuk memisahkan
endapan dan supernatan. Supernatan diukur serapannya pada panjang gelombang 517 nm. Blangko yang digunakan adalah pereaksi tanpa penambahan zeolit. Asam askorbat sebanyak 2 g digunakan sebagai kontrol positif. Kapasitas penghambatan radikal bebas dihitung berdasarkan persamaan
ktivitas penan kapan adikal AA 100
A adalah absorbans kontrol negatif (larutan
DPPH), sedangkan B adalah absorbans
HASIL DAN PEMBAHASAN
Preparasi Zeolit
Zeolit alam dari daerah Banten, Lampung, Sukabumi, dan Tasikmalaya masih mengandung pengotor non-zeolit seperti tanah, ranting, dan senyawa organik. Senyawa organik dan anorganik tersebut dapat dihitung sebagai loss of ignition (LOI), yaitu selisih
antara bobot sedimen sebelum dan sesudah pemijaran atau dengan kata lain, kadar zat yang hilang akibat pembakaran (Halide 2008). Nilai LOI zeolit Banten 16.97%, zeolit Lampung 16.08%, zeolit Sukabumi 15.81%, dan zeolit Tasikmalaya 12.20% (Lampiran 2). Hasil penelitian LIPI (2010) menunjukkan bahwa semakin tinggi nilai LOI pada zeolit, semakin banyak kandungan bahan organik.
Zeolit alam terlebih dahulu dihaluskan untuk menghomogenkan ukuran dan memperbesar luas permukaan agar kemampuannya sebagai adsorben lebih optimum (Mutngimaturrohmah et al. 2009).
Keberadaan pengotor non-zeolit dapat menutupi permukaan pori zeolit, maka perlu dihilangkan. Pencucian menggunakan air dapat menghilangkan pengotor yang larut dalam air. Zeolit hasil preparasi dianalisis menggunakan SEM untuk mengetahui mikro struktur, meliputi tekstur, morfologi, komposisi, dan informasi kristalografi permukaan zeolit (Nais & Wibawa 2011). Fotomikrograf ditunjukkan pada Gambar 3.
(a) (b)
(c) (d)
Gambar 3 Foto morfologi permukaan (SEM) zeolit alam Banten (a), Lampung (b), Sukabumi (c), dan Tasikmalaya (d) tanpa perlakuan dengan perbesaran 5000 .
Pencitraan SEM menunjukkan bahwa zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya berbentuk kubus tidak beraturan seperti bentuk struktur kristal klinoptilolit. Selain itu, terdapat pengotor yang menempel pada permukaan zeolit. Zeolit alam tersebut juga masih dikelilingi butiran-butiran kecil unsur zeolit yang tidak membentuk kristal atau amorf (Mustain et al. 2011).
Aktivasi Zeolit Alam
Aktivasi zeolit merupakan upaya memodifikasi keadaan pada struktur kerangka atau non-kerangka zeolit sehingga diperoleh sifat fisika dan kimia zeolit yang diinginkan (Srihapsari 2006). Aktivasi bertujuan memurnikan zeolit dari komponen pengotor, menghilangkan kation logam dan molekul air, sehingga memperbesar ukuran pori dan meningkatkan kapasitas adsorpsi (Rosdiana 2006). Dalam penelitian ini, aktivasi zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya diperlukan untuk meningkatkan aktivitasnya sebagai antioksidan. Aktivasi zeolit dapat dilakukan melalui beberapa cara, antara lain kalsinasi/pemanasan dan perendaman dalam asam atau basa.
Kalsinasi bertujuan mengeluarkan air atau garam pengotor dari dalam pori zeolit (Yuliusman et al. 2010). Menurut Saputra
(2006), pemanasan pada suhu di atas 400 °C menyebabkan kerusakan pada struktur kerangka tetrahedral zeolit. Karena itu, kalsinasi dilakukan pada suhu 100, 200, 300, dan 400 °C. Diharapkan pada ragam suhu tersebut diperoleh aktivitas zeolit paling tinggi sebagai antioksidan tanpa merusak struktur zeolit (Rakmatullah et al. 2007).
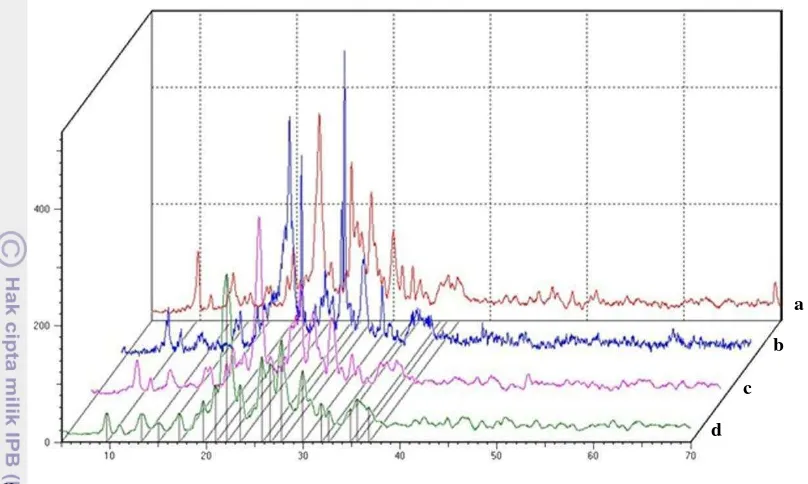
[image:34.595.106.300.486.749.2]Keterangan:
[image:35.595.112.516.88.330.2]a = profil pola difraksi zeolit Banten, b = profil pola difraksi zeolit Lampung, c = profil pola difraksi zeolit Sukabumi, dan d = profil pola difraksi zeolit Tasikmalaya
Gambar 4 Profil pola difraksi zeolit alam teraktivasi-suhu 100 °C pada sudut 2θ. Hasil pembandingan memperlihatkan,
zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya termasuk jenis klinoptilolit dengan kandungan kation penyeimbang terbanyak ialah Ca dan Sr (Lampiran 4). Menurut Kresimir dan Miroslav (2001), zeolit jenis klinoptilolit memiliki komposisi kimia SiO2 50 55%, Al2O3 9.3 11.4%, Fe2O3 2.2 2.8%, Na2O 0.8 1.1%, K2O 2.9 4.3%, MgO 0.8 1.2%, CaO 13.7 17.2%, MnO 0.07 0.22%, dan air 14 16%. Puncak 2θ untuk mineral zeolit jenis klinoptilolit berdasarkan JCPDS No 17-0143 ialah 17.305, 22.319, 23.849, 24.850, 25.923, 26.108, 28.036, 30.063, 31.936, dan 32.655 (Lampiran 5). Perbedaan nilai sudut 2θ yang tidak terlalu jauh menunjukkan bahwa aktivasi pada suhu 100 °C tidak merusak struktur, tetapi hanya menguapkan air yang terdapat pada pori-pori zeolit. Diduga zeolit dari setiap daerah mengandung campuran zeolit jenis mordenit, karena puncak difraksi sinar-X yang dimiliki zeolit jenis mordenit (JCPDS No 6-239 den an puncak 2θ: 6.447, 9.745, 15.322, 22.254, 25.631, 26.332, 27.651, dan 30.937) juga dimiliki zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya, tetapi intensitasnya kecil.
Aktivasi zeolit secara kimia bertujuan membersihkan permukaan pori dari pengotor dan mengatur kembali letak atom yang dapat dipertukarkan (Ginting et al. 2007). Proses
aktivasi zeolit dengan perlakuan HCl pada konsentrasi tertentu menyebabkan zeolit mengalami dealuminasi dan dekationisasi, yaitu keluarnya Al dan kation-kation dari dalam kerangka zeolit (Lampiran 6). Dekationisasi memperluas permukaan zeolit, karena pengotor yang menutupi pori-pori zeolit berkurang. Permukaan yang semakin luas diharapkan meningkatkan kemampuan zeolit dalam proses adsorpsi (Fatimah 2009).
Aktivitas Antioksidan Zeolit
Metode DPPH digunakan untuk melihat potensi zeolit alam sebagai antioksidan. Metode ini mudah, cepat, dan peka untuk pengujian aktivitas antioksidan (Koleva et al.
2002). Kontrol positif yang digunakan adalah asam askorbat. Asam askorbat mudah mengalami oksidasi oleh radikal bebas karena mempunyai 2 gugus -OH enolik. Radikal bebas akan menarik atom hidrogen dari kedua gugus tersebut sehingga terbentuk radikal oksigen yang stabil dan tidak membahayakan karena elektron tak berpasangan didelokalisasikan melalui resonans (Cholison & Utami 2008) (Lampiran 7). Aktivitas antioksidan suatu senyawa dapat mengubah warna larutan DPPH dari ungu menjadi kuning. Warna ungu DPPH memberikan serapan kuat pada panjang gelombang 517 nm. Ketika elektron tak berpasangan pada a
d c
radikal DPPH menjadi berpasangan oleh sumbangan elektron dari senyawa yang memiliki aktivitas antioksidan, absorbans menurun secara stokiometri sesuai jumlah elektron yang diambil.
Semua sampel zeolit alam tanpa perlakuan aktivasi telah memiliki kemampuan menghambat senyawa radikal bebas, terlihat dari nilai absorbans yang lebih kecil dibandingkan dengan kontrol negatif (Lampiran 8). Namun, data pada Tabel 1 menunjukkan bahwa semua zeolit masih memiliki aktivitas antioksidan yang jauh lebih rendah dari pada asam askorbat (kontrol positif). Permukaan pori zeolit masih tertutupi pengotor sehingga perlu dilakukan aktivasi. Diduga mekanisme penangkapan radikal DPPH pada zeolit berbeda dengan asam askorbat. Zeolit tidak hanya menetralkan radikal DPPH dengan menyumbangkan elektron, tetapi juga menangkap dan mengadsorpsi radikal DPPH tersebut di dalam strukturnya (Lampiran 9).
Tabel 1 Aktivitas antioksidan zeolit alam tanpa perlakuan dan vitamin C
Sampel antioksidan Aktivitas (%)
Zeolit Banten 55.20
Zeolit Lampung 31.95
Zeolit Sukabumi 42.46 Zeolit Tasikmalaya 41.20
Asam askorbat 92.14
Menurut Sukmawardany et al. (2004),
zeolit di Indonesia, terutama zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya adalah jenis klinoptilolit. Hal tersebut didukung oleh hasil analisis SEM dan XRD. Struktur sangkar zeolit klinoptilolit mempunyai 2 pori utama. Pori pertama dibatasi oleh 10 oksigen berdiameter 10.685 Å, ditempati oleh logam alkali dan alkali tanah (Ca, Na, K, Mg, Fe, dan Sr). Pori kedua lebih kecil, dibatasi oleh 8 oksigen berdiameter 8.193 Å, dan ditempati oleh molekul air, logam alkali, dan alkali tanah (Lampiran 10) (Supardi 2010). Zeolit dapat mengadsorpsi molekul DPPH karena ukuran molekulnya lebih kecil dibandingkan dengan ukuran pori zeolit. Nisbah Si/Al pada struktur zeolit memengaruhi ukuran porinya. Zeolit jenis klinoptilolit memiliki nisbah Si/Al sedang. Semakin kecil nisbah Si/Al, diameter pori semakin besar. Atom Sr dan Ca sebagai kation penyeimbang struktur kerangka zeolit Banten, Lampung, Sukabumi, dan
Tasikmalaya memiliki jejari atom 1.914 dan 1.74 Å. Ukuran atom Sr dan Ca menyebabkan pelebaran sudut Si-O-Al sehingga membentuk pori yang besar (Kasmui et al. 2009). Semakin
besar diameter pori zeolit, semakin mudah DPPH teradsorpsi. Tipe utama interaksi adsorpsi DPPH dengan zeolit adalah gaya van der Waals, hasil interaksi dispersif dan induktif molekul DPPH dengan zeolit (Vasileva et al. 2010).
[image:36.595.324.510.476.615.2]Permukaan zeolit yang bermuatan negatif dan keberadaan oksida logam sebagai reduktor mengakibatkan zeolit dapat menstabilkan radikal DPPH. Atom oksigen sebagai penghubung antara atom Si dan Al yang membentuk pori-pori intrakristalin memiliki 2 pasang elektron bebas. Elektron bebas tersebut akan disumbangkan kepada atom N pada molekul DPPH sehingga aktivitas radikal DPPH dapat diredam. Selain itu, oksida logam seperti Fe dan Mn pada struktur zeolit memiliki kemampuan melepas elektron yang dimiliki untuk mereduksi radikal DPPH. Keberadaan oksida logam Fe dan Mn sebagai reduktor pada zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya tidak teramati oleh XRD sehingga perlu dilakukan analisis dengan menggunakan spektroskopi sinar-X dispersif energi (EDX) untuk melihat komposisi kimia zeolit. Potensi zeolit alam sebagai antioksidan dapat terlihat dari perubahan warna ungu DPPH menjadi kuning (Gambar 5).
Keterangan:
a = larutan DPPH awal, b = zeolit Banten, c = zeolit Lampung, d = zeolit Sukabumi, dan e = zeolit Tasikmalaya.
Gambar 5 Perubahan warna larutan DPPH setelah penambahan zeolit alam tanpa perlakuan.
Hasil uji zeolit teraktivasi-kalsinasi (Tabel 2) menunjukkan peningkatan aktivitas antioksidan untuk pemanasan pada suhu 100 °C. Aktivitas antioksidan zeolit teraktivasi-suhu kemudian menurun dengan meningkatnya suhu.
Tabel 2 Aktivitas antioksidan zeolit alam teraktivasi-suhu
Sampel Zeolit
Aktivitas antioksidan (%) Suhu (°C) 100 200 300 400 Banten 79.94 42.56 34.92 4.78 Lampung 75.26 29.83 23.46 6.37 Sukabumi 85.56 37.26 31.85 7.54 Tasik 78.47 39.60 28.77 5.41 Pada suhu 100 °C pengotor atsiri seperti air telah teruapkan. Dehidrasi molekul air akan membentuk pori-pori dan saluran yang dapat mengadsorpsi molekul DPPH. Selain itu, logam pengotor seperti oksida logam Fe dan Mn tidak hilang pada suhu 100 °C dan dapat berperan sebagai reduktor yang meningkatkan aktivitas zeolit sebagai antioksidan. Perubahan warna DPPH dari ungu menjadi kuning terlihat jelas pada zeolit yang teraktivasi-suhu 100 °C (Gambar 6).
Keterangan:
a = zeolit Banten, b = zeolit Lampung, c = zeolit Sukabumi, dan d = zeolit Tasikmalaya.
Gambar 6 Perubahan warna larutan DPPH setelah penambahan zeolit teraktivasi-suhu 100 °C.
Pada suhu 400 °C terjadi perubahan fase zeolit sehingga aktivitasnya sebagai antioksidan menurun. Menurut Barrer (1982), suhu aktivasi yang terlalu tinggi menyebabkan dehidroksilasi gugus -OH pada struktur zeolit. Akibatnya, ikatan Si-O-Al putus dan terbentuk gugus siloksana (Si-O-Si) serta aluminium yang miskin gugus hidroksil. Menurut Saputra (2006), perbedaan komposisi kation penyeimbang dan nisbah Si/Al menyebabkan kestabilan zeolit alam terhadap suhu berbeda-beda pula. Zeolit alam dengan nisbah Si/Al tinggi lebih tahan terhadap suhu tinggi daripada yang nisbah Si/Al-nya rendah (Józefaciuk & Bowanko 2002). Zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya termasuk jenis klinoptilolit yang memiliki nisbah Si/Al sedang sehingga mudah rusak
pada suhu tinggi. Selama pemanasan pada suhu 400 °C terjadi perubahan warna zeolit alam. Hal ini dikarenakan zeolit mengalami perubahan struktur akibat pemanasan yang terlalu tinggi.
Hasil uji zeolit teraktivasi-asam (Tabel 3) menunjukkan peningkatan aktivitas antioksidan dibandingkan dengan zeolit tanpa perlakuan, tetapi menurun dibandingkan dengan zeolit teraktivasi-kalsinasi. Aktivitas antioksidan didapati semakin menurun seiring meningkatnya konsentrasi asam. Pada zeolit alam teraktivasi-asam, konsentrasi HCl 1 M menunjukkan aktivitas antioksidan paling tinggi.
Tabel 3 Aktivitas antioksidan zeolit alam teraktivasi-asam
Sampel Zeolit
Aktivitas antioksidan (%) 1 M 2 M 3 M 4 M Banten 63.18 59.80 49.44 48.15 Lampung 65.84 61.17 47.69 45.81 Sukabumi 66.56 56.11 48.98 44.02 Tasik 61.94 58.45 49.33 41.81 Pencucian zeolit dengan HCl 1 M meningkatkan luas permukaan karena berkurangnya pengotor berupa oksida logam dan zat lain yang terikat di sekitar kristal zeolit, yang tidak terlepas pada saat pencucian dengan air (Herawati et al. 1997). Perubahan
warna DPPH dari ungu menjadi kuning terlihat jelas pada zeolit yang teraktivasi-HCl 1 M (Gambar 7). Perubahan warna tersebut mengindikasikan aktivitas zeolit sebagai antioksidan.
Keterangan:
a = zeolit Banten, b = zeolit Lampung, c = zeolit Sukabumi, dan d = zeolit Tasikmalaya.
Gambar 7 Perubahan warna larutan DPPH setelah penambahan zeolit teraktivasi-HCl 1 M.
Penurunan aktivitas antioksidan zeolit pada aktivasi dengan konsentrasi HCl 4 M
a b c d
[image:37.595.103.304.43.824.2] [image:37.595.326.507.531.649.2]disebabkan oleh terjadinya dealuminasi (Vasileva et al. 2010). Ion H+ hasil
penguraian HCl dalam medium air akan diserang oleh atom oksigen yang terikat pada Si dan Al. Nilai energi disosiasi ikatan Al-O (116 kkal/mol) jauh lebih rendah daripada ikatan Si-O (190 kkal/mol), maka ikatan Al-O jauh lebih mudah terurai (Auerbach et al.
2003). Karena itu, ion H+ akan cenderung memutuskan ikatan Al-O pada kerangka zeolit dan terbentuk gugus silanol. Ion Cl– hasil penguraian ion HCl juga akan memengaruhi kekuatan ikatan Al-O dan Si-O. Ion Cl–
memiliki elektronegativitas yang tinggi (3.16) dan berukuran kecil (r = 0.97 Å), sehingga
mudah berikatan dengan kation bervalensi besar seperti Si4+ dan Al3+. Akan tetapi, ion Cl– akan cenderung berikatan dengan atom Al dikarenakan elektronegativitas atom Al lebih kecil (1.61) dibandingkan dengan Si (1.90) (Mutngimaturrohmah et al. 2009).
Dealuminasi ini merusak struktur kristal zeolit sehingga kemampuannya mengadsorpsi radikal DPPH menurun. Akibatnya aktivitas zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya sebagai antioksidan menjadi sangat kecil. Herawati et al. (1997) telah
membuktikan bahwa struktur klinoptilolit lebih tahan terhadap perlakuan dengan basa daripada perlakuan dengan asam.
SIMPULAN DAN SARAN
Simpulan
Aktivitas antioksidan zeolit Banten adalah 55.20%, lebih besar daripada zeolit Sukabumi, Tasikmalaya dan Lampung, yaitu 42.46%; 41.20%; dan 31.95%. Aktivitas tersebut diukur dengan metode DPPH. Morfologi SEM permukaan zeolit menunjukkan bentuk kubus tidak beraturan, mirip dengan kristal klinoptilolit. Aktivasi zeolit dengan suhu 100 °C dan dengan HCl dapat meningkatkan aktivitas antioksidan. Aktivitas antioksidan optimum diperoleh zeolit Sukabumi, yaitu sebesar 85.56% dengan aktivasi pada suhu 100 °C dan 66.56% pada aktivasi dengan HCl 1 M. Pencirian struktur menggunakan XRD pada zeolit yang memiliki aktivitas antioksidan paling tinggi menunjukkan bahwa zeolit Banten, Lampung, Sukabumi, dan Tasikmalaya merupakan jenis klinoptilolit dengan kandungan kalsium dan strontium (Ca dan Sr).
Saran
Perlu dilakukan optimasi aktivasi zeolit agar diperoleh zeolit dengan aktivitas antioksidan yang terbaik serta modifikasi zeolit alam dengan oksida logam untuk meningkatkan aktivitas antioksidan.
DAFTAR PUSTAKA
Aranda RS, Lopez LAP, Arroyo JL, Garza BAA, de Torres JL. 2009. Antimicrobial and antioxidant activities of plants from northeast of Mexico. J Med 11:1-6.
Arief S. 2009. Radikal bebas. Medical [terhubung berkala]. http://smf.Unair. ac.id/journal [10 Mei 2010].
Astuti NY. 2009. Uji aktivitas penangkapan radikal DPPH oleh analog kurkumin monoketon dan heteroalifatik monoketon [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhamadiyah Surakarta. Auerbach SM, Corrado KA, Dutta PK, editor.
2003. Zeolite Science and Technology.
New York: Marcel Dekker.
Barrer RM. 1982. Hydrotermal Chemistry of Zeolites. London: Acad Pr. .
Cholison Z, Utami W. 2008. Aktivitas penangkapan radikal ekstrak etanol 70% biji jengkol. Pharmacon 9:33-40.
Fatimah D. 2009. Peningkatan kualitas zeolit alam Cikarang, Tasikmalaya dengan metoda asam mineral. Di dalam:
Optimalisasi Pemanfaatan Sumber Daya dan Mitigasi Kebencanaan di Indonesia. Prosiding Pemaparan Hasil Penelitian Puslit Geoteknologi; Bandung, 3 Des
2009. Bandung: Lembaga Ilmu Pengetahuan Indonesia; 3 Des 2009. hlm 1-7.
Ginting A, Anggraini D, Indaryati S, Kriswarini R. 2007. Karakterisasi komposisi kimia, luas permukaan pori, dan sifat termal dari zeolit Bayah, Tasikmalaya, dan Lampung. J Teknik Bahan Nuklir 3:1-48.
Halide H. 2008. Panduan Teknis CADS_TOOLS (Suatu Perangkat Pendukung Keputusan dalam Budidaya Keramba Jaring Apung). Chaidir M,
POTENSI ZEOLIT ALAM SEBAGAI ANTIOKSIDAN
DONY RAHMAD PRANOTO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Gambar



Dokumen terkait
Untuk memperoleh suatu informasi dapat membantu mempercepat seseorang untuk memperoleh pengetahuan yang baru. Pengukuran pengetahuan dapat dilakukan dengan cara
Tujuan penelitian ini adalah memberikan bukti empiris mengenai pengaruh derajat desentralisasi fiskal, ketergantungan keuangan daerah, ruang fiskal, dan tingkat pembiayaan
Pada proses dalam memperoleh hasil analisis data, sebelum memberikan perlakuan yang berbeda pada kedua kelas yaitu kelas eksperimen dan keas kontrol.
Dengan demikian upaya para penggiat lingkungan dalam penanggulangan bencana banjir sungai Citarum di wilayah DAS Citarum Hulu merupakan kegiatan pemberdayaan masyrakat
Variabel Dependen Kinerja perawat dalam melaksanaka n komunikasi SBAR sesuai SOP melakukan komunikasi SBAR Imbalan adalah semua pengeluara yang dikeluarkan oleh
Hal ini mendorong penulis untuk merancang sebuah website yang merupakan solusi yang tepat untuk perusahaan. Dengan adanya website konsumen dapat melihat produk sepatu
kepada masyarakatnya. Dengan akad saya yang menjamin Rahmat. 2) Kemudian Pak Lurah menjamin atas Rahmat, supaya bank yakin. 3) Bank memberikan pinjaman, dengan akad Pak Lurah
Bank (sebagai pemilik dana) dan Nasabah bekerja sama dalam sebuah bisnis properti;. Bank dan nasabah bekerjasama dalam mengerjakan