Anagyrus lopezi De Santis (HYMENOPTERA: ENCYRTIDAE)
TERHADAP KUTU PUTIH YANG BERASOSIASI DENGAN
UBI KAYU (Manihot esculenta Crantz)
RANI DESSY KARYANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Pengujian Kesesuaian Inang Parasitoid Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) terhadap Kutu Putih yang Berasosiasi dengan Ubi Kayu (Manihot esculenta Crantz), adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
RANI DESSY KARYANI. Pengujian Kesesuaian Inang Parasitoid Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) Terhadap Kutu Putih yang Berasosiasi dengan Ubi Kayu (Manihot esculenta Crantz). Dibimbing oleh NINA MARYANA dan AUNU RAUF.
Parasitoid Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) diintroduksikan dari Thailand ke Indonesia pada awal tahun 2014, dengan maksud untuk mengendalikan hama baru pada tanaman ubi kayu yaitu kutu putih Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). Sebagai bagian dari prosedur karantina terhadap pemasukan agens hayati ke Indonesia, perlu dilakukan uji keamanan hayati agar parasitoid tersebut tidak menimbulkan dampak buruk terhadap spesies bukan sasaran. Penelitian bertujuan mempelajari kesesuaian parasitoid A. lopezi terhadap empat spesies kutu putih yaitu P. manihoti, Paracoccus marginatus Williams-Granara de Willink, Pseudococcus jackbeardsleyi Gimpel-Miller, dan Ferrisia virgata Cockerell (Hemiptera: Psedococcidae). Keempat spesies kutu putih ini umum dijumpai menyerang tanaman ubi kayu di Indonesia.
Penelitian mencakup uji kerentanan inang, preferensi inang, dan kesesuaian inang. Pada uji kerentanan inang, seekor imago parasitoid dipaparkan pada 10 ekor nimfa instar III dari setiap spesies kutu putih di dalam cawan petri selama 30 menit. Pada uji preferensi inang, seekor imago betina parasitoid dipaparkan pada 5 ekor nimfa instar III P. manihoti yang dipasangkan dengan 5 ekor nimfa instar III spesies kutu putih bukan sasaran dan diamati selama 30 menit. Pengamatan meliputi frekuensi penemuan inang, penyelidikan ovipositor, pengisapan inang, dan banyaknya telur yang diletakkan pada masing-masing spesies kutu putih. Pada uji kesesuaian inang, tiga ekor imago betina parasitoid dipaparkan pada 30 ekor nimfa instar III dari masing-masing spesies kutu putih selama 24 jam. Masa perkembangan pradewasa parasitoid dan banyaknya parasitoid yang muncul dicatat.
Hasil penelitian mengungkapkan bahwa pada uji kerentanan inang, parasitoid A. lopezi lebih sering mengunjungi P. manihoti (13.70±7.18 kali) daripada P. marginatus (9.85±10.24 kali), P. jackbeardsleyi (6.60±3.62 kali), dan F. virgata (5.75±4.09 kali). Begitu pula penyelidikan ovipositor lebih banyak terjadi pada P. manihoti (8.20±5.68 kali), dibandingkan pada P. marginatus (0.70±1.84 kali), P. jackbeardsleyi (0.35±0.68 kali), dan F. virgata (0.10±0.45 kali). Pada uji preferensi, parasitoid lebih banyak melakukan penemuan inang dan penyelidikan ovipositor pada P. manihoti dibandingkan pada spesies kutu putih lainnya. Pada uji kesesuaian inang, dari empat spesies kutu putih yang diuji, hanya P. manihoti yang merupakan inang yang sesuai bagi kehidupan parasitoid, dengan rataan banyaknya imago parasitoid yang muncul 7.40±2.17 individu. Tingkat kekhususan inang yang diperlihatkan oleh parasitoid A. lopezi dapat menghindari terjadinya pengaruh buruk pada spesies kutu putih lain yang menghuni pertanaman singkong.
SUMMARY
RANI DESSY KARYANI. Host Suitability Test of Parasitoid Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) for Mealybugs Species Associated with Cassava (Manihot esculenta Crantz). Supervised by NINA MARYANA and AUNU RAUF.
Parasitoid Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) was recently introduced from Thailand into Indonesia in early 2014, as an attempt to control a new exotic cassava mealybug Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). As part of quarantine procedures for importation of biological agents into Indonesia, it is necessary to conduct biosafety test to assure that the introduced parasitoids do not cause detrimental effects on non-target species. Our research objective was to study host susceptibility of A. lopezi on four species of mealybugs, namely P. manihoti, Paracoccus marginatus Williams-Granara de Willink, Pseudococcus jackbeardsleyi Gimpel-Miller, and Ferrisia virgata Cockerell (Hemiptera: Pseudococcidae). These mealybugs are very common attacking cassava in Indonesia.
Study was conducted in the laboratory including host susceptibility, host preference, and host suitability tests. For host susceptibility tets, a female parasitoid was exposed to 10 of 3rd instar nymphs of each species in a petri dish for 30 minutes. For host preference test, a female parasitoid was exposed to 5 of 3rd instar nymphs mealybug of P. manihoti paired with five other mealybugs of non target species and observed for 30 minutes. Number of host encounters, ovipositor probings, and eggs deposited on each mealybug species were counted. For host suitability test, three adult female parasitoids was exposed to 30 of 3rd instar nymphs mealybugs of each species for 24 hours. Immature development time of parasitoid and number of parasitoid adults emerged were counted.
Our studies revealed that for susceptability test, parasitoid A. lopezi encountered P. manihoti more often (13.70±7.18 times) as compared to P. marginatus (9.85±10.24 times), P. jackbeardsleyi (6.60±3.62 times), and F. virgata (5.75±4.09 times). So did ovipositor probing occurred more on P. manihoti (8.20±5.68 times) than on P. marginatus (0.70±1.84 times), P. jackbeardsleyi (0.35±0.68), and F. virgata (0.10±0.45 times). For preference test, host encounter and ovipositor probing by the parasitoid were more common on P. manihoti as opposed to other mealybug species. For host suitability test, out of four mealybug species tested, P. manihoti was the only suitable host for parasitoid development, with the number of progenies emerged 7.40±2.17 individuals. Host specific exhibited by parasitoid A. lopezi may prevent adverse effect to other mealybug species inhabiting cassava fields.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
PENGUJIAN KESESUAIAN INANG PARASITOID
Anagyrus lopezi De Santis (HYMENOPTERA: ENCYRTIDAE)
TERHADAP KUTU PUTIH YANG BERASOSIASI DENGAN
UBI KAYU (Manihot esculenta Crantz)
RANI DESSY KARYANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga penelitian karya ilmiah yang berjudul “Pengujian Kesesuaian Inang Parasitoid Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) terhadap Kutu Putih yang Berasosiasi dengan Ubi Kayu (Manihot esculenta Crantz)”, dapat selesai dengan baik. Karya ilmiah ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program Entomologi, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian merupakan bagian dari proyek CIAT-Asia “Emerging Pests and Diseases of Cassava in Southeast Asia: Seeking eco-efficient solutions to overcome a threat to livelihoods and industries”. Penghargaan dan terima kasih penulis ucapkan kepada Dr Ir Nina Maryana, MSi serta Prof Dr Ir Aunu Rauf, MSc, selaku komisi pembimbing yang telah meluangkan waktu untuk memberikan ilmu, pengarahan, saran, motivasi serta bimbingannya sejak perencanaan penelitian hingga selesainya penulisan karya ilmiah ini. Ucapan terima kasih juga disampaikan kepada Dra Dewi Sartiami, MSi atas kesediaan waktu dan ilmu yang diberikan dalam membantu identifikasi kutu putih, Dr Ir Pudjianto, MSi dan Prof Dr Ir Sri Hendrastuti Hidayat, MSi selaku ketua program studi pascasarjana Entomologi-Fitopatologi, yang selalu memberikan pengarahan dan motivasinya. Terimakasih juga disampaikan kepada Badan Karantina Pertanian atas beasiswa untuk melanjutkan sekolah pascasarjana yang telah diberikan selama ini, kepada keluarga Balai Karantina Pertanian Kelas II Cilegon, segenap staf, tenaga pengajar, dan semua laboran Dept. Proteksi Tanaman IPB, serta kepada Dr Ir Antarjo Dikin, MSc selaku penguji tamu yang telah menyediakan waktu dan memberi masukan bermanfaat bagi tesis ini dan penulis.
Rasa hormat dan terima kasih yang tidak terhingga penulis sampaikan pada suami tercinta, Andriyanta atas kasih sayang, kesabaran, dukungan, dan do’a yang tidak pernah putus sehingga perjuangan dalam penyelesaian studi dan penulisan karya ilmiah ini selesai. Teruntuk buah hatiku tercinta, Razania Latisha Qurrota Aini, terimakasih telah menjadi penyejuk hati dalam lelah, penyemangat dalam penat, dan pelengkap kebahagiaan. Rasa hormat dan terimakasih juga disampaikan untuk Ayahanda tercinta (Bapak Djasikin), kakak, adik, serta keluarga besar Bapak Sasmorejo dan Pakde Soemardjono atas dukungan dan do’anya.
Tidak lupa pada kesempatan ini penulis juga menyampaikan terima kasih kepada Bapak Wawan Yuandi dan Ibu Aisyah, rekan-rekan Laboratorium Ekologi Serangga (Mbak Nila, Evie, Edwin, Hendri, Mbak Indah, Pak Budi, Ibu Sulaeha, Mbak Uce, Yeni, dan Mba Tutut), rekan-rekan Entomologi/Fitopatologi IPB, khususnya mahasiswa Karantina angkatan ke-3 atas keceriaan dan kekompakannya bersama-sama, serta kepada pihak-pihak yang telah membantu dalam penelitian dan pembuatan tesis ini. Karya ini penulis persembahkan pada Ibunda tercinta, Ibu Mujiasih (almh). Akhirnya penulis berharap semoga tulisan ini bermanfaat bagi yang membutuhkannya serta bagi penulis sendiri.
Bogor, Mei 2015
DAFTAR ISI
Pengendalian Hayati Hama Melalui Introduksi Musuh Alami 10
Anagyrus lopezi 11
Prosedur Karantina dan Skrening bagi Introduksi Musuh Alami 12
BAHAN DAN METODE 14
Tempat dan Waktu Penelitian 14
Bahan dan Alat 14
Metode Pelaksanaan 14
Persiapan Tanaman Inang bagi Kutu Putih 14 Pengumpulan dan Identifikasi Kutu Putih 14 Perbanyakan dan Pemeliharaan Kutu Putih 14 Perbanyakan dan Pemeliharaan Parasitoid 15 Pengujian Kesesuaian Inang bagi A. lopezi 15 Pengujian Tingkat Kerentanan Kutu Putih sebagai Inang
parasitoid (Uji Tanpa Pilihan) 16
Pengujian Preferensi A. lopezi pada Spesies Inang (Uji Dua Pilihan) 16
HASIL 18
Spesies Kutu Putih Tanaman Ubi Kayu 18
Phenacoccus manihoti 18
Paracoccus marginatus 18
Pseudococcus jackbeardsleyi 19
Ferrisia virgata 20
Kesesuaian Jenis Spesies Inang 21
Kerentanan Spesies Inang (Uji Tanpa Pilihan) 23 Preferensi A. lopezi pada Spesies Inang (Uji Dua Pilihan) 25
PEMBAHASAN 28
Perilaku A. lopezi dalam Memarasit Kutu Putih 28
Telur dan Larva A. lopezi 31
Potensi A. lopezi sebagai Agens Hayati di Indonesia 32
SIMPULAN DAN SARAN 34
DAFTAR PUSTAKA 35
LAMPIRAN 41
xiii
DAFTAR TABEL
1. Perbandingan imago jantan dan betina A. lopezi yang muncul dari
inang P. manihoti 22
2. Pengukuran imago betina A. lopezi yang berhasil berkembang pada P.
manihoti 23
3. Penemuan inang, penyelidikan ovipositor, host feeding, dan oviposisi A. lopezi terhadap empat spesies kutu putih tanaman ubi kayu pada uji
tanpa pilihan 23
4. Penemuan inang, penyelidikan ovipositor, host feeding, dan oviposisi A. lopezi terhadap P. manihoti yang dipasangkan dengan spesies kutu
putih bukan sasaran pada uji dua pilihan 26
DAFTAR GAMBAR
1. Koloni kutu putih P. manihoti 18
2. Koloni kutu putih P. marginatus 19
3. Koloni P. jackbeardsleyi 20
4. Kutu putih F. virgata 21
5. Mumifikasi P. manihoti yang terparasit 22
6. Perilaku oviposisi A. lopezi pada P. manihoti 24
7. Telur A. lopezi 25
8. Larva A. lopezi 25
DAFTAR LAMPIRAN
1. Metode pembuatan slide preparat kutu putih Famili Pseudococcidae 42 2. Morfologi P. manihoti dalam bentuk slide preparat 43 3. Morfologi P. marginatus dalam bentuk slide preparat 44 4. Morfologi P. jackbeardsleyi dalam bentuk slide preparat 45 5. Morfologi F. virgata dalam bentuk slide preparat 46
6. Imago A. lopezi 47
7. Hasil pengolahan data analisis statistik uji Kruskal Wallis pada
pengujian kerentanan inang (uji tanpa pilihan) 48 8. Upaya penyelidikan ovipositor A. lopezi 51
9. A. lopezi yang terjerat lilin F. virgata 51
10.Hasil pengolahan data analisis statistik uji Mann Whitney pada
PENDAHULUAN
Latar Belakang
Meningkatnya perdagangan antara negara menyebabkan semakin besar pula peluang terjadinya perpindahan tanaman dan hewan ke lingkungan yang baru baik secara sengaja maupun tidak, sehingga tanpa disadari tanaman, hewan atau bahkan organisme pengganggu tumbuhan dapat berpindah dan terbebas dari faktor pembatas alami dari lingkungan aslinya (native). Keadaan seperti demikian dapat menimbulkan terjadinya reproduksi dalam waktu cepat dan berpotensi menjadi masalah yang serius. Serangga atau tanaman yang pindah dari habitat aslinya dapat menjadi hama eksotik atau yang kini lebih dikenal sebagai invasive species. Salah satu contoh hama eksotik yang saat ini menjadi ancaman besar bagi Indonesia adalah hama kutu putih tanaman ubi kayu atau dikenal dengan nama cassava pink mealybug, Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). Status hama kutu putih singkong ini di Indonesia merupakan organisme tumbuhan karantina (OPTK) A1 yang artinya keberdaannya dan penyebarannya sangat dicegah karena belum terdapat di Indonesia (Kementan 2011).
Cassava pink mealybug adalah hama penting utama di dunia pada tanaman ubi kayu. Di Afrika serangan terjadi sejak tahun 1970-an, menimbulkan kerusakan parah dan meyebabkan kehilangan hasil yang sangat besar, bahkan hingga masyarakat setempat mengalami kelaparan (Parsa et al. 2012). Keberadaan hama ini di Indonesia pertama kali dilaporkan tahun 2010 oleh Muniappan et al. (2011) dan hasil survei petani di Kabupaten Bogor pada tahun 2012-2013, saat musim kemarau tingkat serangannya dapat mencapai 100% (Wardani 2015) serta kehilangan hasil diperkirakan mencapai 30-50% (Dwianri 2013).
Terdapat rekomendasi pengendalian yang menjadi pendekatan utama dan paling banyak diterapkan oleh berbagai negara terhadap kutu putih eksotik ini, yaitu dengan mengoptimalkan keberadaan musuh alaminya. Phenacoccus manihoti merupakan hama native dari Amerika Selatan dan perlu waktu lama untuk mengetahui musuh alami lokal yang dapat bermanfaat, sehingga upaya alternatif pengendalian yang dapat dilakukan adalah dengan praktek klasik pengendalian hayati. Berbagai macam musuh alami diintroduksi dari Amerika Selatan ke Afrika untuk mengendalikan cassava mealybug¸ dan yang paling berhasil diterapkan adalah endoparasitoid, Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) (Neuenschwander 2001).
2
dijumpai musuh alami yang mampu mengendalikan serangan P. manihoti (Rauf 2014). Bedasarkan pertimbangan tersebut, Departemen Proteksi Tanaman, Fakultas Pertanian – IPB bekerjasama dengan International Center for Tropical Agriculture (CIAT) Vietnam dan FAO mengintroduksi parasitoid A. lopezi dari Thailand ke Indonesia pada bulan Maret 2014 (Wyckhuys et al. 2014).
Introduksi musuh alami yang berasal dari luar ke dalam wilayah Indonesia selain mampu memberi keuntungan, tidak menutup kemungkinan berpotensi menimbulkan pengaruh buruk terhadap biodiversitas lokal. Oleh karena itu, introduksi musuh alami perlu disertai analisis resiko tentang kemungkinan munculnya dampak negatif terhadap ekosistem di kemudian hari, seperti diatur dalam International Standards For Phytosanitary Measures (ISPM) Nomor 3 tentang Kode Etik Introduksi dan Pelepasan Agens Pengendalian Hayati (FAO 1996) yang terangkum pada Keputusan Menteri Pertanian (Kepmentan) Nomor: 411/Kpts/TP.120/6/95 tentang Pemasukan Agens Hayati ke dalam Wilayah Negara Indonesia dan ditindak lanjuti oleh Komisi Agens Hayati Nomor 226/Kpts/OT.160/L/9/06 tentang Pedoman Umum Pemasukan Agens Hayati ke dalam Wilayah Indonesia. Prosedur dalam pedoman tersebut di antaranya adalah harus memiliki izin pemasukan dari menteri pertanian dan telah teraudit melalui serangkaian pemeriksaan dari karantina pertanian sebagai upaya mencegah masuknya organisme yang tidak diinginkan yang berpotensi menjadi organisme yang merugikan, misalnya hama, patogen, hiperparasit atau musuh alami serangga berguna. Walaupun izin pemasukan dan prosedur karantina telah terlaksana, serangkaian pengujian tetap harus dilakukan di bawah pengawasan komisi agens hayati agar kemurnian, efektifitas dan keamanannya dapat terjaga.
Hal yang perlu dilakukan untuk memenuhi perundangan tersebut salah satunya adalah perlu dilakukan pengujian kekhususan inang dari parasitoid A. lopezi melalui pengujian kisaran inang ataupun preferensi dan parasitisasi terhadap kutu putih lain yang bukan sasarannya. Penentuan inang bukan sasaran perlu disesuaikan dengan kondisi ekologi Indonesia (Kuhlmann et al. 2006; Hogendoorn et al. 2013). Spesies kutu putih yang diuji dalam penelitian adalah yang umum dijumpai menyerang tanaman ubi kayu, yaitu P. manihoti, Pseudococcus jackbeardsleyi Gimpel and Miller, Paracoccus marginatus Williams and Granara de Wilink, dan Ferrisia virgata (Cockerell) (Hemiptera: Pseudococcidae).
Perumusan Masalah
keamanannya, preferensinya dan tingkat parasitisasinya serta kesesuaiannya bagi perkembangan hidupnya.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui kesesuaian perkembangan A. lopezi pada empat spesies kutu putih yang menjadi hama ubi kayu di Indonesia, yaitu P. manihoti, P. jackbeardsleyi, P. marginatus, dan F. virgata, beserta kerentanan masing-masing inang dan preferensinya.
Manfaat Penelitian
TINJAUAN PUSTAKA
Tanaman Ubi Kayu
Ubi kayu atau yang lebih dikenal dengan nama singkong dan ketela pohon termasuk ke dalam Famili Euphorbiaceae, Subfamili Crotonodeae, Suku Manihotae dan Genus Manihot. Pertama kali tanaman ini dikenal di Amerika Selatan namun lebih berkembang di Brazil dan Paraguay. Di Indonesia tanaman ubi kayu mulai dibudidayakan sejak tahun 1852 dan mulai menyebar hingga ke seluruh wilayah Nusantara tahun 1914-1918 pada saat Indonesia kekurangan bahan pangan beras. Pada tahun 1968 Indonesia menjadi negara penghasil ubi kayu nomor lima di dunia (Rukmana 1997).
Manfaat ubi kayu bagi manusia begitu banyak, dan hal ini menjadi alasan begitu tingginya minat dan permintaan masyarakat terhadap komoditas ini. Ubi kayu segar mempunyai komposisi kimiawi yang terdiri atas kadar air sekitar 60%, pati 35%, serat kasar 2.5%, protein 1%, lemak 0.5%, dan kadar abu 1% (BPPP 2011). Walaupun kadar airnya tinggi, bahan kering ubi kayu mengandung 250 – 300 kg karbohidrat dari setiap satu ton ubi kayu segar dan mengandung sejumlah nutrisi lainnya seperti vitamin C, tiamin, riboflavin, dan niasin (FAO 2013). Begitu tingginya nutrisi yang terkandung pada ubi kayu, kini ubi kayu telah banyak mengalami inovasi dalam pengelolaannya sehingga dapat meningkatkan pendapatan negara dan menjadi komoditas yang potensial dalam perdagangan dunia. Beberapa manfaat yang dapat diperoleh di antaranya adalah umbinya yang banyak diminati sebagai bahan diversifikasi pangan, mengingat ubi kayu merupakan salah satu pangan penghasil sumber karbohidrat tertinggi setelah padi dan jagung. Manfaat ubi kayu lainnya adalah sebagai bahan baku industri makanan seperti gaplek, tepung kasava, dan tapioka serta sebagai produk fermentasi seperti fruktosa, glukosa, bioetanol, dan berbagai asam organik (BPPP 2011). Di Indonesia sentra utama penghasil ubi kayu mulai menyebar di berbagai propinsi seperti Sumatera Utara, Lampung, Jawa Barat, Jawa Tengah, DI Yogyakarta, Jawa Timur, Nusa Tenggara Timur, dan Sulawesi Selatan, sedangkan sentra dunia terdapat di Negara Thailand dan Suriname (Suherman 2014).
Sama halnya dengan tanaman lainnya, tanaman ubi kayu termasuk rentan terhadap serangan hama dan penyakit tumbuhan, terutama apabila menggunakan bibit yang tidak sehat dan dengan praktek pengelolaan budidaya yang kurang tepat. Kehilangan hasil yang berat dapat terjadi akibat meningkatnya intensitas serangan organisme pengganggu tumbuhan pada area pertanaman ubi kayu yang luas, terutama pada areal penanaman ubi kayu yang secara terus menerus sepanjang tahun. Adapun beberapa jenis penyakit yang menjadi masalah di pertanaman ubi kayu di Asia di antaranya adalah hawar bakteri atau cassava bacterial blight (CBB) yang disebabkan oleh Xanthomonas campestris pv. manihoti, serta penyakit virus yang disebabkan oleh cassava mosaic disease (CMD), dan cassava brown streak disease (CBSD) (FAO 2013).
kerusakan pada tanaman ubi kayu. Spesies kutu kebul ini adalah Bemisia tabaci (Gennadius) dan B. tuberculata Bondar (Hemiptera: Aleyrodidae) (CABI 2008a). Selain kutu kebul, kutu putih juga menjadi hama utama yang pernah menyerang di sub-Sahara Afrika. Spesies kutu putih tersebut adalah P. manihoti dan Phenacoccus herreni Cox & Williams. Hama lainnya yang selalu menjadi masalah adalah tungau. Tungau masih selalu menjadi masalah utama di saat musim kemarau, umumnya adalah spesies Tetranychus urticae Koch dan T. kanzawai Kishida (Acari: Tetranychidae). Kehilangan hasil akibat serangan dapat berkisar antara 18 sampai 50% (FAO 2013).
Kutu Putih pada Tanaman Ubi kayu
Phenacoccus manihoti
P. manihoti merupakan salah satu hama eksotik yang tergolong invasif bagi Indonesia sejak tahun 2010 (Muniappan et al. 2011). Kutu putih ini menjadi hama penting utama di seluruh dunia pada pertanaman ubi kayu. Sifatnya yang partenogenesis teliotoki (hanya menghasilkan keturunan betina) membuat kutu putih ini mampu berkembang biak sangat cepat terutama pada musim kemarau. Kutu putih P. manihoti berasal dari Amerika Serikat, dan serangan pertama kali dilaporkan terjadi di Kinshasa, Kongo Negara Afrika pada tahun 1973. Selanjutnya kutu putih ini menyebar ke Asia pada tahun 2008 dan mulai pertama kali ditemukan di Negara Thailand, kemudian Kamboja, Laos, Vietnam, dan terbaru di Indonesia (Muniappan et al. 2011; Parsa et al. 2012; CABI 2013a).
Koloni P. manihoti umumnya berada di bawah permukaan daun ubi kayu, terutama bagian pucuk daun di sekitar tulang daun dan pada saat populasinya meningkat, kutu putih menyebar ke seluruh bagian tanaman. Selama siklus hidupnya P. manihoti mampu menghasilkan hingga 500 telur dalam satu ovisak. Ovisak adalah kantung lilin berwarna putih seperti kapas. Siklus hidupnya sejak telur hingga dewasa membutuhkan waktu sekitar 21 hari dengan lama stadium telur sekitar 8 hari, nimfa instar I sekitar 4 hari, nimfa instar II sekitar 4 hari, dan nimfa instar III sekitar 5 hari (Calatayud & Le Rü 2006). Imago betina kutu putih ini berwarna merah jambu dengan panjang tubuh 1.25 mm dan lebar 0.63 mm. Perkembangbiakannya bersifat paurometabola dengan tahapan telur, nimfa mencapai III instar lalu imago. Bentuk antara nimfa instar II, III, dan imago, tidak jauh berbeda, hanya imago berukuran lebih besar. Nimfa instar I berukuran panjang 0.41 mm dan lebar 0.17 mm, instar II panjang 0.60 mm dan lebar 0.26 mm, serta instar III panjang 0.86 mm dan lebar 0.39 mm. Baik nimfa maupun imago tubuhnya diselimuti dengan serabut lilin berwarna putih. Nimfa instar I bersifat crawler yang artinya sangat cepat bergerak dan mudah melakukan perpindahan dan penyebaran (Saputro 2013).
6
Upaya pengendalian terhadap kutu putih singkong ini banyak dilakukan oleh berbagai negara melalui pengendalian hayati klasik. Untuk menghindari serangan baru, petani disarankan untuk tidak menanam ubi kayu di musim akhir penghujan dan awal musim kemarau. Selain itu sebelum mulai penanaman, perendaman bibit ubi kayu dengan larutan insektisida juga mampu mencegah kehadiran hama ini (FAO 2013).
Pengendalian hayati klasik menjadi pendekatan utama dan hal yang paling tepat untuk mengatasi masalah hama ini di pertanaman. Upaya tersebut dilakukan dengan cara mengintroduksi musuh alami dari daerah hama/kutu putih berasal. Banyak jenis musuh alami kutu putih P. manihoti, baik dari kelompok predator maupun parasitoid. Beberapa spesies predator yang mampu memangsa P. manihoti adalah kumbang Famili Coccinellidae (Coleoptera), yaitu Hyperaspis spp. Redtenbacher, Exochomus sp. Redtenbacher, dan Diomus sp. Mulsant. Parasitoid yang berperan sebagai musuh alami P. manihoti di antaranya adalah Anagyrus nyombae Boussienguet, A. pseudococci (Girault), dan Epidinocarsis lopezi (De Santis) (CABI 2013a). Afrika menjadi negara pertama yang melakukan introduksi musuh alami untuk mengendalikan P. manihoti. Pada mulanya diintroduksi parasitoid Apoanagyrus diversicornis (Howard) (Hymenoptera: Encyrtidae) dan Allotropa sp. Foerster (Hymenoptera: Platygasteridae), serta predator Sympherobius maculipennis Klimmins (Neuroptera: Hemerobiidae) dari Brazil, namun ternyata belum berhasil dikembangkan (Neuenschwander 1994). Berbagai macam musuh alami lainnya diintroduksi ke Afrika untuk menekan kutu putih ubi kayu, dan dari berbagai macam musuh alami tersebut endoparasitoid Apoanagyrus lopezi asal Amerika Selatan adalah parasitoid yang paling berhasil mengendalikan kutu putih (Neuenschwander 2001). Musuh alami kutu putih yang ditemukan selama terjadi serangan di Bogor adalah predator Scymnus sp. Kugelann dan Chilocorus sp. Leach (Coleoptera: Coccinellinae). Selain itu juga ditemukan larva predator dari family Cecidomyiidae dan larva Plesiochrysa ramburi (Shneider) (Neuroptera: Chrysopidae). P. ramburi adalah musuh alami yang dominan ditemukan, namun keberadaannya meningkat di akhir musim kemarau pada saat populasi kutu putih mencapai puncaknya dan ubi kayu terserang berat (Wardani 2015).
Paracoccus marginatus
marginatus yang polifag dan memiliki banyak kisaran inang, membantu kutu ini untuk mudah mempertahankan hidupnya.
Gejala serangan diketahui dari gumpalan-gumpalan putih pada bagian tanaman yang terserang. Selanjutnya bagian tanaman yang terserang akan mengerut, mengering dan akhirnya pertumbuhan tanaman terhambat. Serangan berat dapat menyebabkan gugur buah dan daun (Walker et al. 2003). Tahap kerusakan dimulai dari bagian daun muda dekat pangkal batang, daun menjadi keriting dan tumbuh tidak normal. Hal tersebut mengakibatkan proses fotosintesis terhambat, tanaman banyak kehilangan energi untuk tumbuh dan akan semakin merana hingga akhirnya buah yang diproduksi tidak maksimal atau bahkan gagal produksi (Ivakdalam 2010).
Biologi P. marginatus belum banyak diteliti secara rinci. Spesies ini bereproduksi secara seksual, antara imago betina dan jantan berkembang melalui tahapan fase yang berbeda. Imago betina mengalami metamorfosis paurometabola yang berkembang dari telur kemudian melalui tiga tahapan instar nimfa dan imago betina tanpa sayap. Imago jantan mengalami metamorfosis holometabola, setelah fase telur terdapat dua tahap instar nimfa, setelah itu mengalami fase prapupa, kemudian pupa dan imago dengan sepasang sayap (CABI 2014). Rata-rata lama waktu perkembangan P. marginatus pada tanaman pepaya untuk individu betina adalah 31.8±3.83 hari dan siklus hidup individu jantan adalah 27.0±1.87 hari, dengan perbandingan betina dan jantan 4 : 1. Rata-rata jumlah telur P. marginatus yang dihasilkan sebanyak 490 butir per kantung telur (ovisak) (Pramayudi & Oktarina 2012).
Morfologi tubuh imago betina berbentuk oval atau lonjong dan diselubungi oleh lapisan lilin berwarna putih. Sekeliling tepi tubuhnya muncul filamen lilin pendek dengan panjang kurang dari seperempat panjang tubuhnya. Imago betina menghasilkan telur berwarna putih kekuningan, ditutupi dengan ovisak. Penyebaran dilakukan oleh nimfa instar pertama yang bersifat crawler, yaitu aktif bergerak dan berpindah serta dapat bertahan satu atau dua hari tanpa makan (Walker et al. 2003).
Suatu pengelolaan hama terpadu (PHT), termasuk praktek budidaya, pengendalian kimia dan pengendalian biologi dapat diterapkan untuk mengelola kutu putih pepaya. Musuh alami yang diketahui sebagai parasitoid kutu putih pepaya di antaranya adalah Acerophagus papayae (Noyes & Schauff), Anagyrus loecki (Noyes & Menezes), Anagyrus californicus Compere, dan Pseudaphycus sp. Timberlake (Hymenoptera: Encyrtidae) (Walker et al. 2003). Di India keempat parasitoid tersebut menyerang nimfa kutu putih pepaya instar II dan III, namun masih belum mampu menurunkan populasi hama dalam waktu singkat. Perpaduan dengan penggunaan predator Spalgis epius Westwood (Lepidoptera: Lycanidae) (Saengyot & Burikam 2011), kemudian C. montrouzieri Mulsant (Coleoptera: Coccinellidae), lalat syrphid, dan lacewings (Walker et al. 2003) cukup dapat membantu karena predator memangsa ovisak, nimfa, dan imago. Selain itu pengendalian insektisida botani menggunakan neem oil dan insektisida berbahan aktif profenofos 500 g/l dapat menjadi alternatif lain (Tanwar et al. 2010).
8
Kutu putih ini memiliki nama umum Jack Beardslyei mealybug atau kutu putih Jack Beardslyei. Spesies kutu putih ini adalah hama invasif terbaru yang telah memasuki India dengan nilai infestasi relatif rendah menyerang tanaman pepaya pada tahun 2012. Sebelumnya serangan hama ini banyak terjadi di daerah Neotropical dan negara Asia termasuk Singapura pada tahun 1958, Malaysia pada tahun 1969, Indonesia tahun 1973, Filipina tahun 1975, Brunei pada tahun 1979, Thailand pada tahun 1987, Vietnam dan Maladewa pada tahun 1994 dan Kamboja (Muniappan et al. 2011; Mani et al. 2013). Kutu putih jack beardsleyi menyerang banyak tanaman inang (polifag) dan diketahui mencapai 93 spesies tanaman baik itu tanaman pertanian, hortikultura, maupun tanaman hias (Mani et al. 2013). Sebanyak 22 spesies tanaman juga telah dilaporkan sebagai inang P. jackbeardsleyi di negara-negara Asia, di antaranya tanaman pisang, tomat, kentang, lada, lau, anggrek, dan anthurium (Shylesha 2013). Di India hama ini dilaporkan menyerang tanaman pepaya pada bagian daun, buah dan batang. Gejala kerusakan yang ditimbulkan umumnya sama dengan gejala kerusakan yang disebabkan kutu putih lainnya. Permukaan bawah daun ataupun pada bagian batang tanaman penuh tertutup ovisak dari kutu putih dan menyebabkan distorsi pada daun.
Ciri tubuh imago betina berbentuk oval, agak bulat jika terlihat dari bagian lateral dan berwarna keabu-abuan. Seluruh tubuh imago dipenuhi filamen lilin tipis, pada masing-masing bagian lateral terdapat 17 filamen dan pada bagian ujung terdapat sepasang filamen yang panjangnya sekitar setengah dari panjang tubuh dan terkadang tertutup ovisak (Shylesha 2013). Karakter morfologi di dalam slide preparat yaitu antena terdiri atas 8 ruas, tungkai berkembang baik, terdapat pori translusen pada femur dan tibia tungkai belakang. Pori diskoidal terdapat di dekat mata pada bagian sclerotised rim. Serari terdiri atas 17 pasang dan serari lobus anal dengan 2 seta konikal dan terdapat banyak pori trilokular pada sclerotised area. Serari lainnya terdapat pada area membran, kemudian serari anterior dengan seta relatif kecil dengan 2-3 seta tambahan. Serari nomor C7 dan pada bagian kepala dengan 3-4 seta konikal. Permukaan atas tubuh kutu putih dipenuhi secara merata dengan seta berukuran kecil (Mani et al. 2013).
Biologi kutu putih ini umumnya memerlukan waktu selama sekitar satu bulan untuk dapat menyelesaikan satu genarasi hidupnya. Imago betinanya mampu meletakkan telur sebanyak 300 sampai 600 telur di dalam ovisak. Dalam kondisi rumah kaca telur dapat menetas sekitar 10 hari. Nimfa yang baru keluar dari telur mulai aktif mencari makanan, dan tubuhnya mulai mengeluarkan lilin putih membentuk filamen untuk menutupi tubuhnya. Pertumbuhan nimfa hingga menjadi imago betina hanya mengalami perubahan pada ukuran tubuhnya saja, sedangkan nimfa yang akan menjadi imago jantan, setelah nimfa instar III, nimfa akan membentuk pupa dan muncul imago jantan. Imago jantan berukuran sangat kecil dan memiliki sepasang sayap (Mau & Kessing 2000).
musuh alami lokal dari setiap negara (Muniappan et al. 2011). Musuh alami yang diketahui mampu menekan populasi P. jackbeardsleyi adalah kumbang Coccinelidae, C. montrouzieri.
Ferrisia virgata
F. virgata memiliki nama umum striped mealybug. Ciri khas imago betina adalah adanya satu pasang filamen dari lilin pada bagian ujung tubuh seperti ekor dengan panjang setengah dari panjang tubuhnya. Ciri khas lainnya permukaan tubuh dilapisi lilin, kecuali pada bagian tengah dorsum gundul tanpa lilin dan terdapat dua strip memanjang seperti garis di bagian sub medial (Weicai Li et al. 2013). Imago berbentuk oval pipih, berwarna abu-abu gelap hingga terang, dengan panjang tubuh 4-4.5 mm, terdapat benang berserabut di bagian venter, lilin yang menutupi tubuhnya dapat menjadi perlindungan diri dari predator (William & Watson 1988).
F. virgata adalah salah satu jenis kutu putih polifag, menyerang sekitar 150 genus dari 68 famili tanaman, terutama spesies inang dari Fabaceae dan Euphorbiaceae. Di antara tanaman inangnya yang bernilai ekonomi penting yaitu alpukat, pisang, sirih, lada hitam, ubi kayu, kacang mete, kembang kol, jeruk, kakao, kopi, dan kapas. Di Indonesia F. virgata banyak dilaporkan sebagai hama utama pada tanaman kopi, sedangkan di Sudan menyerang banyak tanaman jambu biji, dan di beberapa negara bagian dunia umumnya sebagai hama kapas. F. virgata, di Afrika Barat dikenal juga sebagai vektor cocoa swollen shoot virus (CSSV) dan di Trinidad sebagai vektor cocoa Trinidad virus (CTV) (CABI 2013b).
Gejala serangan pada tanaman yang ditunjukkan hama ini adalah keriput pada awalnya, kemudian bagian tanaman yang terserang menjadi kering dan daunnya gugur. Kutu ini juga berfungsi sebagai vektor virus sehingga bagian tanaman juga dapat menjadi keriting karena terserang virus. Sumber lain menyebutkan gejala infestasi F. virgata tetap berkerumun di sekitar terminal tunas, daun dan buah, mengisap getah yang menyebabkan daun menguning, layu dan kering. Permukaan daun dan buah banyak ditutupi dengan embun madu yang kemudian menjadi media untuk pertumbuhan jamur jelaga hitam. Jamur jelaga dan lilin mengakibatkan penurunan area fotosintesis tanaman hias dan menghasilkan kehilangan nilai pasar (Williams dan Watson 1988; CABI 2013b)
10
Pengendalian terhadap stripe mealybug pada awal serangan yang meningkat perlu dilakukan sanitasi kebun dengan pemangkasan dan pemusnahan bagian tanaman yang terserang (CABI 2013b). Pengelolaan secara kimiawi menggunakan insektisida biasanya dinilai masih kurang efektif karena telur, nimfa dan imago ditutupi lapisan lilin yang tebal sehingga cairan insektisida sulit menembusnya. Namun penggunaan insektisida nabati dapat menjadi alternatif yang dapat digunakan karena sifatnya yang lebih ramah lingkungan dibandingkan dengan insektisida sintetik. Dilaporkan oleh Indriati dan Khaerati (2008) bahwa ekstrak daun nimba efektif mengendalikan F. virgata dengan tingkat kematian 29.89-86.9%. Upaya pengendalian lainnya yang lebih efektif dan aman adalah dengan mengupayakan keberadaan musuh alaminya. Musuh alami dari F. virgata banyak dilaporkan dari kelompok predator, cendawan, dan parasitoid. Umumnya pengendalian dilakukan dengan penggunaan predator C. montrouzieri (CABI 2013b), serta parasitoid dari beberapa genus Aenasius (Noyes & Ren 1995), Acerophagus dan Anagyrus (Noyes & Hayat 1994).
Pengendalian Hayati Hama Melalui Introduksi Musuh Alami
Pengendalian hayati adalah penggunaan organisme hidup untuk menekan kepadatan populasi atau memberi pengaruh terhadap organisme hama spesifik, yang membuat kepadatan populasi atau kerusakannya menurun bila dibanding dengan tidak tersedianya musuh alami. Musuh alami terdiri atas empat kelompok besar yaitu predator, parasitoid, patogen serangga (entomopatogen) dan agens hayati antagonis. Pengendalian hayati dengan mengoptimalkan kinerja musuh alami saat ini sudah banyak diadopsi oleh petani, namun terbatasnya ketersediaan musuh alami di alam mengharuskan adanya upaya strategi terutama dalam memproduksi musuh alami dalam jumlah besar. Jika tidak ada spesies musuh alami yang mampu secara efektif mengontrol populasi hama maka introduksi atau importasi musuh alami ke daerah yang terserang perlu dilakukan. Upaya demikian sering dikenal dengan istilah pengendalian hayati klasik. Umumnya pendekatan ini digunakan bila terjadi ledakan hama eksotik yang bersifat invasif, dan diharapkan setelah melepaskan musuh alami eksotik ke dalam lingkungan baru, nantinya musuh alami dapat mapan secara permanen dan mampu mengendalikan populasi hama dalam jangka panjang, tanpa perlu intervensi lebih lanjut (Purnomo 2010).
(Hymenoptera: Encyrtidae) untuk mengendalikan kutu loncat lamtoro, Heteropsylla cubana Crawford (Hemiptera: Psyllidae) pada tahun 1990-an (Rauf et al. 1988). Introduksi paling akhir pada Maret 2014, yaitu introduksi parasitoid A. lopezi untuk mengendalikan kutu putih singkong P. manihoti (Wyckhuys et al. 2014).
Anagyrus lopezi
Taksonomi dari A. lopezi memiliki nama sinonim Epidinocarsis lopezi atau sebelumnya dikenal juga dengan Apoanagyrus lopezi. Parasitoid ini tergolong ke dalam Ordo Hymenoptera, Subordo Apocrita, Superfamily Chalcidoidea, Family Encrytidae genus dari Anagyrus. Parasitoid yang tergolong ke dalam Family Encyrtidae umum juga disebut sebagai suku Anagyrini. Perilaku spesies parasitoid anggota Anagyrini sebagian besar memarasit secara endoparasitoid soliter, namun beberapa spesies lainnya diketahui dapat memarasit secara gregarius (Noyes & Hayat 1994). A. lopezi memarasit secara endoparasitoid soliter yang secara alami dapat mengendalikan nimfa dan imago kutu putih singkong P. manihoti. Parasitoid berasal dari Amerika Selatan, pertama kali diintroduksi ke Nigeria melalui International Institute Tropical Agriculture (IITA) untuk mengendalikan cassava mealybug (CMB) (Neuenschwander 1994, Neuenschwander 2001). Parasitoid dilepaskan ke dua lokasi yang salah satunya pada areal seluas 3 000 ha pertanaman ubi kayu di Abeokuta di Ogun State pada tahun 1982 (Odebiyi & Bokonon·Ganta 1986).
Informasi mengenai biologi A. lopezi ini masih sangat terbatas, dalam pengujian di laboratorium dalam kisaran suhu yang berfluktuasi antara 24-31°C dan kelembapan 79-90% menunjukkan bahwa perkembangan dari telur hingga imago berkisar antara 11-25 hari, dengan lama setiap tahap perkembangan telur 2 hari, larva instar I 1 hari, instar II 1 hari, instar III 2 hari, instar IV 2 hari, prapupa 4 hari, dan pupa 6 hari. Imago betina yang mampu meletakkan telur setelah melakukan perkawinan, hidup selama 13 hari. Imago betina yang tidak meletakan telur hidup lebih lama yaitu 25 hari. Nisbah kelamin jantan dan betina 1:2.3, atau lebih dominan betina (Odebiyi & Bokonon·Ganta 1986). Hal berbeda dilaporkan oleh Iziquel dan Le Rü (1992) yang menunjukkan hasil peneltiannya terhadap lama hidup dari A. lopezi di laboratorium pada suhu 26 °C rata-rata adalah 41.4 hari dengan kisaran 15-64 hari. Hasil tersebut hampir empat kali lebih besar dari laporan sebelumnya dan imago mampu meletakkan telur sebanyak 230 sampai 853 telur sepanjang hidupnya. Perbedaan tersebut dapat dipengaruhi oleh beberapa faktor di antaranya adalah kepadatan populasi inang yang berbeda, metode pengujian yang berbeda untuk mengukur keperidian, kurangnya pasokan nutrisi makanan bagi imago parasitoid betina, suhu percobaan, tanaman inang, dan keberadaan ekotipe dalam spesies A. lopezi atau dalam P. manihoti.
12
menyerang tanaman kapas di Paraguay, namun sangat sedikit sekali informasi mengenai ini.
Prosedur Karantina dan Skrening bagi Introduksi Musuh Alami Introduksi spesies dari suatu daerah ke daerah lain dapat terjadi secara sengaja maupun tidak. Keberadaan spesies tersebut dapat menjadi ancaman bagi produksi pertanian juga bagi flora dan fauna asli, bahkan juga bagi keselamatan dan kesehatan manusia. Hal-hal tersebut mendorong banyak negara membuat aturan karantina yang ketat untuk mencegah terjadinya introduksi spesies, termasuk juga agens pengendali hayati/musuh alami. Prosedur peraturan terhadap kegiatan pemasukan agens hayati bagi setiap negara yang terikat dalam perjanjian Sanitary and Phytosanitary (SPS) – World Trade Organization (WTO) dituang dalam pedoman internasional di bawah naungan International Plant Protection Convention (IPPC) yaitu International Standards For Phytosanitary Measures (ISPM) No.3 mengenai Kode Etik Introduksi dan Pelepasan Agen Pengendali Biologi (Code of Conduct for the Import and Release of Exotic Biological Control Agents) (FAO 1996). Aturan tersebut menjabarkan tuntunan bagi suatu negara untuk memformulasikan aturan-aturan yang dapat membantu dalam melakukan importasi dan pelepasan agen pengendali biologi yang mampu memperbanyak diri (self-replication) (termasuk parasitoid, predator, parasit, nematoda, organisme fitofag, dan patogen), serangga steril dan organisme menguntungkan lainnya (seperti mikoriza dan penyerbuk), termasuk yang dikemas atau yang termasuk sebagai produk komersial. Ketentuan ini juga digunakan untuk impor agens pengendali biologi non-pribumi dan organisme menguntungkan lainnya sebagai penelitian di fasilitas karantina (Nowell & Maynard 2005).
Di Indonesia dalam melakukan introduksi musuh alami diatur berdasarkan Surat Keputusan Menteri pertanian No. 411 Tahun 1995 tentang Pemasukan Agens Hayati ke dalam Wilayah Negara Republik Indonesia. Ijin pemasukan dan pelepasan musuh alami hanya dapat dikeluarkan berdasarkan SK Menteri Pertanian atas rekomendasi Komisi Agens Hayati yang mengacu kepada
“Pedoman Umum Pemasukan Agens Hayati ke dalam Wilayah Indonesia”, sebagaimana telah ditetapkan oleh Ketua Komisi Agens Hayati Nomor 226/Kpts/OT.160/L/9/06. Pedoman tersebut penting dilaksanakan sebagai bagian dari petunjuk serangkaian pengujian yang harus dilakukan sebelum agens hayati diusulkan pemasukannya dan diajukan pelepasannya, sehingga agens hayati yang dimasukkan ke daerah yang baru berperan efektif dan bermanfaat.
syarat kedua dilakukan untuk menjamin bahwa musuh alami yang diimpor tidak membawa bahan material lain seperti hama, patogen, dan musuh alami dari musuh alami yang diintroduksi (Purnomo 2010). Selama proses uji bagi kedua syarat tersebut, potensi musuh alami perlu diuji sebaik-baiknya terutama dalam hal kecenderungannya menyerang sejumlah spesies inang yang bukan sasaran. Seleksi terhadap inang bukan sasaran memerlukan pertimbangan yang cermat serta dikonsultasikan dengan ahli-ahli taksonomi dan biologi.
Rekomendasi kriteria dalam memilih daftar spesies inang bukan sasaran menurut Khulmann et al. (2006) adalah berdasarkan tiga kategori yang semuanya perlu menjadi pertimbangan dalam menentukan inang bukan sasaran. Kategori tersebut adalah: (1) kesamaan ekologi, artinya spesies hidup di habitat yang sama atau menggunakan tanaman inang yang sama dengan spesies sasaran; (2) kemiripan taksonomi atau filogenetik, artinya spesies berkerabat erat dengan spesies sasaran, dapat memiliki nama genus yang sama, famili, atau subfamili yang sama yang sebelumnya tidak dijumpai musuh alami; dan (3) pertimbangan perlindungan, yaitu spesies yang bermanfaat dan keberadaannya langka/hampir punah.
Ketiga kategori tersebut membantu memberikan rekomendasi spesies asli mana yang memungkinkan menjadi kisaran inang parasitoid. Dari ketiga kategori tersebut, prioritas harus ditujukan pada spesies yang cocok lebih dari satu kriteria. Umumnya akan diperoleh daftar yang begitu banyak dan menjadi tidak efektif dan tidak mudah untuk dilakukan pengujian, sehingga daftar yang diperoleh perlu disaring kembali dengan dua filter. Filter pertama yaitu dengan menghilangkan spesies yang memiliki sifat tumpang tindih dengan spesies target ataupun dengan agens pengendali hayati, dalam hal ini kriteria spesies yang dikesampingkan adalah yang kebutuhan iklimnya berbeda, fenologi berbeda, dan ukuran inang yang berbeda. Filter selanjutnya adalah memilih spesies yang tersedia dan mudah diperoleh dalam jumlah yang cukup banyak dalam waktu yang wajar serta memungkinkan untuk digunakan dalam pengujian kekhususan inang (Khulmann et al. 2006).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Bionomi dan Ekologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Kegiatan penelitian dilaksanakan pada bulan Juni 2014 sampai Januari 2015.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tanaman ubi kayu, umbi kentang (Solanum tuberosum L.) yang bertunas, labu parang (Cucurbita maxima Duchesne), dan bibit tanaman jambu biji (Psidium guajava L.). Bahan lainnya adalah parasitoid A. lopezi yang diintroduksi dari Thailand, serangga kutu putih dari spesies P. manihoti, P. marginatus, P. jackbeardsleyi, dan F. virgata. Digunakan pula pupuk cair, madu 10%, kapas, larutan fisiologis (larutan Ringer setara dengan NaCl 0.85%), tabung ependof serta alkohol 70%. Alat yang digunakan terdiri atas kurungan serangga, mikroskop stereo, mikroskop kompound, lampu duduk, kamera digital, kuas, jarum mikro, penggaris mini scale, ember plastik, wadah plastik, tabung mika berkasa, gelas objek, kertas label, tisu, timer, dan alat tulis.
Metode Pelaksanaan
Persiapan Tanaman Inang bagi Kutu Putih
Persiapan tanaman inang dilakukan untuk pemeliharaan dan perkembangbiakkan kutu putih P. manihoti. Persiapan tanaman meliputi penyiapan bibit tanaman ubi kayu berupa stek yang berasal dari petani. Stek ubi kayu ditumbuhkan di dalam ember plastik yang berisi air dengan campuran pupuk cair, selanjutnya stek dipelihara dan diletakkan di tempat yang cukup cahaya hingga tumbuh daun pucuk baru. Setiap tiga hari sekali ember berisi tanaman diisi kembali dengan air yang baru untuk menjaga kesegarannya.
Pengumpulan dan Identifikasi Kutu Putih
Empat spesies kutu putih yang akan diuji (P. manihoti, P. marginatus, P. jackbeardsleyi, dan F. virgata) dikumpulkan dari berbagai pertanaman di lapangan. Setiap bagian tanaman seperti pucuk daun, batang ataupun buah yang terdapat kutu putih uji dipotong dan dimasukkan ke dalam kotak plastik kecil bertutup kasa. Selanjutnya sampel dibawa ke laboratorium untuk dilakukan identifikasi, perbanyakan, dan pemeliharaan.
Identifikasi mengacu pada kunci identifikasi secara morfologi dari sampel yang hidup dan preparat slide untuk memastikan spesies kutu putih yang akan digunakan dalam pengujian (Williams & Granara de Willink 1992; Williams 2004). Cara pembuatan slide preparat terlampir pada Lampiran 1.
Perbanyakan dan Pemeliharaan Kutu Putih
jambu biji. Nimfa dan imago dari masing-masing spesies kutu putih yang diperoleh dari lapangan diinfestasikan pada masing-masing tanaman inang dalam pemeliharaan. Cara infestasi kutu putih pada tanaman inang yaitu dengan menempelkan langsung bagian tanaman yang mengandung koloni kutu putih atau dengan memindahkan kutu menggunakan kuas secara hati-hati. Pemeliharaan dan perbanyakan P. manihoti pada tanaman ubi kayu dan F. virgata pada bibit jambu biji, masing-masing dilakukan dalam kurungan serangga yang berbeda pada kondisi suhu lingkungan yang teduh namun hangat. Kurungan sama-sama berukuran 100 cm x 50 cm x 120 cm dengan sisi-sisi berbahan kaca dan kain trikod.
Perbanyakan dan pemeliharaan spesies kutu putih lainnya dilakukan menggunakan wadah plastik bertutupkan kain kassa dan dipelihara dalam kondisi gelap di dalam laboratorium. Sekitar tiga sampai empat minggu setelah infestasi awal, instar III dari setiap spesies sudah dapat dikumpulkan dan digunakan untuk pengujian.
Perbanyakan dan Pemeliharaan Parasitoid
A. lopezi yang diperoleh dari Thailand dalam bentuk imago dilepas ke dalam kurungan yang sudah berisi tanaman ubi kayu yang terinfestasi P. manihoti. Kurungan berukuran 50 cm x 45 cm x 45 cm, dengan pintu berlapis kain kassa berukuran sekitar 15 cm x 15 cm dan dinding terbuat dari kassa dan mika. Dalam kurungan juga digantungkan kapas yang mengandung cairan madu 10%. Setiap dua minggu sekali, tanaman ubi kayu yang sudah mengering akibat serangan kutu putih dan terinfestasi parasitoid dikeluarkan dari kurungan dan diganti dengan tanaman baru yang segar dan sudah terinfestasi P. manihoti. Tanaman ubi kayu yang kering tersebut dipotong-potong dan dimasukan ke dalam kotak plastik berkassa berukuran 20 cm x 25 cm untuk memperoleh imago parasitoid baru. Setiap hari imago yang keluar kembali dimasukkan ke dalam kurungan pemeliharaan menggunakan aspirator dan sebagian yang masih berumur satu hari digunakan dalam pengujian. Pemeliharaan parasitoid dilakukan di laboratorium dalam ruangan khusus, dengan suhu ruang 27 °C dan RH 60%. Kurungan berada di bawah penyinaran dua lampu TL 70 Watt berjarak sekitar 20 cm di atas kurungan dengan lama penyinaran 12 jam gelap dan 12 jam terang.
Pengujian Kesesuaian Inang bagi A. lopezi
16
lopezi betina yang berumur satu hari dan sudah kopulasi dipaparkan ke dalam kurungan selama 24 jam dan setelah itu parasitoid dikeluarkan kembali. Pengujian dilakukan terhadap kutu putih fase nimfa instar III dan dilakukan sebanyak 10 ulangan untuk setiap spesies kutu putih. Pengujian dilakukan di dalam ruangan bersuhu 27 oC dan RH 60% dengan pencahayaan atas lampu TL 70 watt berjarak 30 cm dan waktu terang 12 jam dan gelap 12 jam. Kutu putih diamati setiap hari untuk mengetahui kemunculan parasitoid yang baru.
Keturunan parasitoid dikumpulkan dan dihitung nisbah kelamin serta ukuran parasitoid. Pengukuran dilakukan pada panjang tibia kiri belakang dan total panjang tubuh (dari kepala sampai ujung abdomen). Kriteria yang digunakan untuk menentukan kesesuaian inang adalah jumlah parasitoid yang muncul per ulangan, nisbah kelamin, waktu perkembangan dan ukuran parasitoid.
Pengujian Tingkat Kerentanan Kutu Putih sebagai Inang Parasitoid (Uji Tanpa Pilihan)
Pengujian tingkat kerentanan spesies kutu putih dilakukan dengan cara menempatkan sepuluh kutu putih dari setiap spesies berbeda secara berkelompok di dalam cawan petri yang berbeda beralaskan tisu yang terpisah satu sama lain. Dalam hal ini per cawan petri berisi 10 ekor kutu putih dari spesies yang sama. Sebelumnya setiap cawan petri sudah berisi selembar daun ubi kayu sebagai pakan dari kutu putih. Selanjutnya satu ekor parasitoid betina yang berumur satu hari dan sudah berkopulasi dimasukkan ke dalam setiap cawan. Pada setiap cawan, parasitoid dan kutu putih diamati secara terus menerus selama 30 menit untuk diamati dan dicatat jumlah pertemuannya dengan inang (encounter), penyelidikan ovipositor (ovipositor probing) dan pengisapan inang (host feeding) dari parasitoid terhadap inang. Setelah 30 menit pemaparan, parasitoid dikeluarkan dan setelah dua hari pasca pemaparan, seluruh kutu putih yang telah terpapar parasitoid dibedah dalam setetes larutan fisiologis di atas permukaan gelas objek menggunakan jarum mikro. Pembedahan dilakukan di bawah mikroskop stereo dan dilanjutkan menggunakan mikroskop kompound untuk mengamati jumlah telur atau larva parasitoid yang terdapat di dalam tubuh per inang. Pengujian dilakukan terhadap setiap spesies kutu putih fase nimfa instar III dengan masing-masing pengujian dilakukan sebanyak 20 ulangan. Rata-rata suhu harian dan kelembaban relatif selama pengujian berlangsung masing-masing adalah 29.18 °C (kisaran 27.1-30.7 ºC) dan 57.68% (kisaran 32-77%).
Jumlah pertemuan, penyelidikan ovipositor, host feeding, inang yang terparasit (host parasitized) oleh imago A. lopezi, jumlah total telur yang diletakkan dan atau larva yang berkembang per parasitoid betina, dan jumlah telur dan atau larva parasitoid per inang, digunakan sebagai kriteria untuk menentukan tingkat kerentanan spesies inang. Hasil dari pengujian ini menjadi kriteria dalam menentukan tingkat parasitisasi dan kerentanan setiap spesies inang. Pengolahan data dilakukan dengan uji Kruskal-Wallis menggunakan progam SPSS 22.0 dan diuji lanjut dengan uji Dunn pada tingkat kepercayaan 95%.
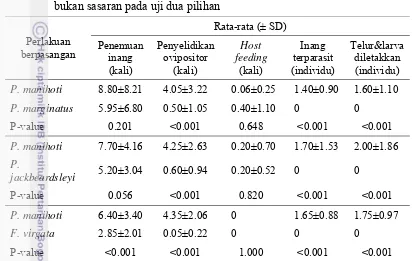
Pengujian Preferensi A. lopezi pada Spesies Inang (Uji Dua Pilihan)
berisi dua spesies kutu putih yang berbeda. Pengujian dilakukan juga terhadap setiap spesies kutu putih lainnya. Setiap cawan petri yang sudah diberi alas tisu, sebelumnya sudah berisi selembar daun ubi kayu. Selanjutnya parasitoid betina yang sudah berumur satu hari dan melakukan kopulasi dimasukkan ke dalam cawan petri untuk mulai dilakukan pengujian.
Pada setiap cawan, parasitoid dan kutu putih diamati secara terus menerus selama 30 menit untuk diamati dan dicatat jumlah pertemuannya, penyelidikan ovipositor dan pengisapan inang dari parasitoid terhadap kedua pilihan inang uji. Setelah 30 menit pemaparan, parasitoid dikeluarkan dan dua hari kemudian seluruh kutu putih yang telah terpapar parasitoid dibedah dalam setetes larutan fisiologis di atas permukaan gelas objek. Pembedahan menggunakan jarum mikro, dilakukan di bawah mikroskop stereo dan dilanjutkan menggunakan mikroskop kompound. Pengamatan meliputi jumlah telur atau larva parasitoid yang berkembang dari satu imago parasitoid dan jumlah telur atau larva di dalam tubuh per inang. Masing-masing pengujian dilakukan sebanyak 20 ulangan dan dilakukan terhadap setiap spesies kutu putih fase nimfa instar tiga III. Rata-rata suhu harian dan kelembaban relatif selama pengujian berlangsung masing-masing adalah 29.25 °C (kisaran 27.3-31.6 ºC) dan 59.9% (kisaran 43-79%).
HASIL
Spesies Kutu Putih pada Ubi Kayu
Phenacoccus manihoti
Ciri morfologi tubuh nimfa dan imago betina P. manihoti yang hidup adalah berwarna merah muda, berbentuk oval, dan peruasan tubuhnya sangat jelas serta dilapisi oleh tepung lilin berwarna putih (Gambar 1). Selain itu mata relatif menonjol dan tungkai berkembang dengan baik dan berukuran sama. Imago jantan kutu putih ini tidak dihasilkan karena P. manihoti berkembangbiak secara partenogenesis teliotoki.
Beberapa ciri khusus P. manihotii dari hasil pembuatan slide preparat sesuai dengan kunci yang disusun oleh Williams dan Granara de Willink (1992), yaitu tubuhnya memiliki 18 pasang serari (Lampiran 2a), masing-masing dengan dua seta lankeolat yang membesar tanpa seta auksilari kecuali pada bagian lobus anal. Seta pada bagian dorsal berbentuk seperti jarum dan lankeolat seperti pisau, tanpa kumpulan pori trilokular di sekitar setal collars. Pori quinquelokular banyak terdapat di sekitar kepala bagian anterior hingga ke bagian clypheolabral shield, mencapai 32-68 (Lampiran 2e). Umumnya lempeng pori multilokular banyak terdapat di dorsal sekitar tepi, juga pada bagian toraks (Lampiran 2c). Sekelompok saluran tubular banyak terdapat di sekitar tepi dorsal tubuhnya. Karakter penting lainnya adalah antena yang memiliki 9 ruas dan kadang dengan 7 atau 8 ruas (Lampiran 2d), terdapat dentikel pada kuku, tibia tungkai belakang tanpa pori translusen dan sebuah sirkulus yang berbentuktanduk (Lampiran 2b).
Gambar 1 Koloni kutu putih P. manihoti
Paracoccus marginatus
Morfologi yang dapat diamati secara langsung terhadap tubuh imago betina P. marginatus adalah tubuhnya yang berwarna kekuningan dilapisi filamen lilin putih pada permukaan dorsal, terlihat seperti kerutan melintang di antara setiap ruas tubuhnya. Tubuh imago betina berbentuk oval berukuran panjang 2-3 mm dan lebarnya 1.4 mm (Gambar 2a). Spesimen P. marginatus jika dimasukkan ke dalam alkohol akan berubah warna menjadi hitam, sehingga penanganan untuk koleksi perlu dimasukkan ke dalam air panas atau direbus sebentar terlebih dahulu sebelum menggunakan alkohol. Imago jantannya memiliki sepasang sayap, panjangnya berukuran sekitar 1 mm dengan toraks yang melebar sekitar 0.3 mm
(Gambar 2b). Tubuh imago jantan berwarna coklat, namun seringkali selama fase pra pupa dan pupa berwarna merah muda. Antena terdiri dari 10 ruas dan bagian pori lateral mengeluarkan sepasang filamen lilin seperti ekor berwarna putih, selain itu terdapat tonjolan yang tersklerotisasi pada bagian toraks dan kepala (Walker et al. 2003, Sharma et al. 2013).
Gambar 2 Koloni kutu putih P. marginatus, (a) nimfa dan imago betina, (b) imago jantan
Ciri morfologi P. marginatus yang sudah dibuat dalam bentuk slide preparat adalah terdapat pori trilokular dan saluran tulubar pada bagian dorsal tanpa kombinasi (Lampiran 3a). Seta bagian dorsal dengan seta flagel, umumnya lebih tipis dari seta serari. Karakteristik yang menjadi penciri utama adalah serari di bagian anterior dengan sepasang lobus anal, tanpa seta tambahan. Serari berjumlah 18 pasang, umumnya sekitar 8 pasang terdapat pada abdomen dan sebagian di toraks. Panjang antenanya 310-370 µm dengan 8 ruas (Lampiran 3b). Serari lobus anal masing dengan 2 seta konikal yang panjangnya masing-masing 125-130 µm, umumnya dengan 3 seta auksilar dan beberapa pori trilokular, semua dalam ukuran kecil, dengan sklerotisasi area yang lemah (Lampiran 3d). Tidak terdapat lempeng pori multilokular dari tepi ventral lateral hingga toraks. Secara umum oral rim saluran tubular berkembang baik terbatas pada tepi tubuh bagian dorsal (Lampiran 3c). Tungkai berkembang dengan baik dan banyak terdapat pori translusen pada koksa belakang, namun tidak terdapat pada tibia tungkai belakang atau hanya terwakili satu atau dua pada distal (Lampiran 4g) (Williams & Granara de Willink 1992, Parsa et al. 2012).
Pseudococcus jackbeardsleyi
Karakter khas kutu putih P. jackbeardsleyi secara langsung yang dapat terlihat adalah tubuh oval dan memiliki banyak filamen lilin di seluruh sisi-sisi tubuhnya. Terdapat dua filamen lilin panjang di bagian ujung posterior yang mencapai setengah dari panjang tubuh (Gambar 3a). Tubuh pra dewasa berwarna merah muda kecoklatan dan semakin jelas menjelang imago. Imago betina berwarna keabu-abuan sedangkan yang jantan berwarna orange tua dan memiliki sepasang sayap (Gambar 3b). Calon imago jantan setelah mencapai nimfa instar III akan membentuk pupa terlebih dulu. Imago jantan berukuran sekitar 1.5 mm.
b
0.5 mm
a
20
Gambar 3 Koloni P. jackbeardsleyi, (a) nimfa dan imago betina, (b) imago jantan
Pengamatan terhadap ciri P. jackbeardsleyi dalam bentuk slide preparat imago betina adalah ada bagian yang tersklerotisasi di sekitar mata yang dikelilingi dengan 4-9 pori diskoidal (Lampiran 4e) dan terdapat banyak oral-rim tubular duct di sekitar dorsal abdomen (Lampiran 4a). Menurut Mani et al. (2013) dan Williams (2004), karakteristik morfologi yang digunakan dalam identifikasi P. jackbeardsleyi adalah antena betina terdiri dari 8 ruas (Lampiran 4d), tungkai berkembang baik, pori translusen terdapat pada femur dan tibia tungkai belakang dan tidak terdapat pada koksa belakang. Serari dengan 17 pasang dan serari lobus anal dengan 2 seta konikal dengan banyak pori trilokular pada daerah yang tersklerotisasi (Lampiran 4c dan 4g). Serari lainnya terdapat di daerah yang bermembran. Serari bagian anterior dengan seta yang relatif lebih kecil dengan 2 sampai 3 seta auksilar. Serari VII (C7) dan serari di bagian kepala dengan 3-4 seta konikal. Permukaan dorsal dipenuhi pori trilokular dan seta kecil yang tersebar hampir merata, selain itu seluruh serari bagian frontal dengan oral rim tubular duct tepat di bagian belakangnya. Oral rim tubular duct lainnya terdapat di submedian dan submarginal pada bagian toraks dan abdomen. Masing-masing oral rim tubular duct sering dengan 1 atau 2 seta pendek dan 1 atau 2 pori diskoidal berdekatan dengan rim, terdapat satu per satu di belakang setiap serari bagian frontal. Di antara lobus anal dan serari ke-2 dari belakang terdapat oral collar tubular duct (Lampiran 4b). Permukaan ventral dengan seta yang ramping. Lempeng pori multilokular terdapat pada ruas abdomen V sampai VII (Lampiran 4f).
Ferrisia virgata
Ciri morfologi F. virgata yang sangat khas dan secara langsung dapat terlihat pada kutu putih yang hidup adalah bentuk tubuhnya yang oval memanjang dan sedikit ramping serta permukaan tubuhnya penuh dengan lapisan lilin (Gambar 4a & 4c). Pada imago betina, bagian tengah dorsum terdapat dua stripe memanjang seperti garis di bagian sub medial, gundul tanpa dilapisi lilin (Gambar 4c). Selain itu baik nimfa maupun imago pada ujung posteriornya terdapat sepasang filamen lilin yang panjangnya hampir setengan dari panjang tubuhnya. Imago jantan memiliki sepasang sayap, panjang tubuh sekitar 1.5 mm berwarna cokelat terang dan gelap di bagian toraks (Gambar 4b).
3 mm
a b
Gambar 4 Kutu putih F. virgata , (a) nimfa, (b) imago jantan, (c) imago betina
Identifikasi pemeriksaan mikroskopis melalui slide preparat imago betina F. virgata (Lampiran 5a) disesuaikan dengan kunci identifikasi menurut Williams dan Granara de Willink (1992) serta Williams (2004). Ukuran tubuh kutu ini relatif besar, yaitu mencapai 5 mm dan umumnya bentuk abdomen lonjong. Ciri utama adalah adanya saluran tubular yang membesar, kemudian setiap lubang dikelilingi oleh lingkaran serta daerah yang tersklerotisasi dengan 2-4 seta yang tumpul dan 1 atau 2 pori diskoidal berbentuk oval didekat tepi (Lampiran 5d). Saluran tubular ini berkelompok sebanyak 2 atau 3 di sekeliling tepi tubuh kutu putih, kecuali pada abdomen ruas VII. Pada permukaan ventral terdapat seta tumpul dan biasanya lebih panjang daripada yang terdapat di dorsum. F. virgata dapat dikenali juga dari serari lobus anal yang masing-masing dengan 2 seta konikal dan lempeng pori multilokular (Lampiran 5b). Ciri ini terdapat pada ruas abdomen VI sekitar vulva dalam satu baris yang jelas dan selalu berjumlah setidaknya 8 lempeng pori multilokular atau lebih (Lampiran 5e). Antena terdiri dari 8 ruas (Lampiran 5c). Oral collar tubular duct kecil ramping dan sedikit, terdapat di antara ruas abdomen V dan ruas posterior serta dalam kelompok kecil di tepi ruas abdomen, satu atau dua juga terdapat pada tepi tubuh di setiap ruas anterior dari lobus anal sampai bagian kepala.
Kesesuaian Jenis Spesies Inang
Keberhasilan A. lopezi berkembang menyelesaikan hidupnya hingga menjadi imago hanya terjadi pada uji kesesuaian menggunakan inang kutu putih P. manihoti. Selain ditunjukkan dengan kemunculan imago, kesesuaian A. lopezi sebagai inang P. manihoti adalah terjadinya mumifikasi pada kutu putih baik yang diuji pada media tanaman inang ubi kayu maupun kentang bertunas (Gambar 5). Mumifikasi dan kemunculan imago parasitoid tidak terjadi pada P. marginatus, P. jackbeardsleyi, maupun F. virgata yang sengaja dipaparkan tiga ekor parasitoid betina selama 24 jam pada uji kesesuaian ini. Ketiga spesies kutu putih tersebut tetap mampu berkembang biak menghasilkan keturunan yang baru.
c
2 mm
b
0.5 mm
a
22
Gambar 5 Mumifikasi P. manihoti yang terparasit, (a) pada tanaman ubi kayu, (b) pada kentang bertunas
Kemunculan imago parasitoid sebagai keturunan A. lopezi yang dipaparkan terhadap 30 ekor P. manihoti menggunakan media tanaman inang kutu putih berupa kentang bertunas, rata-rata setiap ulanganya menghasilkan sebanyak 7.40±2.17 individu, dengan perbandingan rata-rata jantan dan betina 5:2 (Tabel 1). Imago jantan A. lopezi muncul lebih banyak dan lebih dahulu muncul, dengan lama perkembangan A. lopezi sejak infestasi hingga menjadi imago rata-rata kisaran antara 14.9-26.4 hari. Hasil berbeda dan menunjukkan jumlah yang lebih banyak ditunjukkan pada kemunculan imago A. lopezi yang dipaparkan terhadap 30 ekor P. manihoti menggunakan media tanaman inang kutu putih berupa tanaman ubi kayu. Rata-rata kemunculan total imago parasitoid adalah 11.7±5.12 individu, dengan perbandingan rata-rata jantan dan betina 7:5 (Tabel 1). Kemunculan imago jantan juga lebih banyak dibandingkan dengan betina dan jantan muncul lebih dulu daripada betina. Lama perkembangan A. lopezi sejak infestasi hingga menjadi imago rata-rata kisarannya antara 15.5-24 hari.
Tabel 1 Perbandingan imago jantan dan betina A. lopezi yang muncul dari inang P. manihoti
Tanaman ubi kayu 69 (6.90±6.71) 48 (4.80±3.68) 117 (11.7±5.12)a
Total 120 71 191
a
Nilai pada kolom yang sama yang diikuti oleh huruf yang sama tidak menunjukkan beda nyata (Uji BNT α = 5%).
Ukuran tubuh A. lopezi betina lebih besar daripada jantan (Lampiran 6), dan pengukuran panjang tubuh dan panjang tibia sebelah kiri betina menjadi kriteria penilaian kebugaran parasitoid. Imago betina yang muncul dari inang, P. manihoti yang diujikan menggunakan kentang bertunas umumnya berukuran relatif lebih kecil dibadingkan dengan parasitoid yang muncul dari inang, P. manihoti yang diujikan menggunakan ubi kayu. Masing-masing panjang tubuhnya rata-rata
0.5 mm
b a
berturut-turut adalah 1.26±0.32 mm dan 1.75±0.21 mm. Panjang tibia sebelah kirinya rata-rata adalah 0.37±0.14 mm dan 0.47±0.08 mm (Tabel 2).
Tabel 2 Pengukuran imago betina A. lopezi yang berhasil berkembang pada P. manihoti
Media inang P. manihoti Kisaran Rata-rata ± SDc Jumlah
ulangan (n)
Panjang tubuh (mm)
Kentang bertunasa 0.75-1.78 1.26±0.32b 23
Tanaman ubi kayub 1.25-2.00 1.75±0.21a 30
Panjang Tibia kiri (mm)
Kentang bertunas 0.25-0.75 0.37±0.14b 23
Tanaman ubi kayu 0.28-0.53 0.47±0.08a 30
a
Imago muncul dari P. manihoti dengan media inang kentang bertunas; b Imago muncul dari P. manihoti dengan media inang tanaman ubi kayu; c Nilai pada kolom yang sama yang diikuti oleh huruf yang sama tidak menunjukkan beda nyata (Uji BNT α = 5%).
Kerentanan Spesies Inang (Uji Tanpa Pilihan)
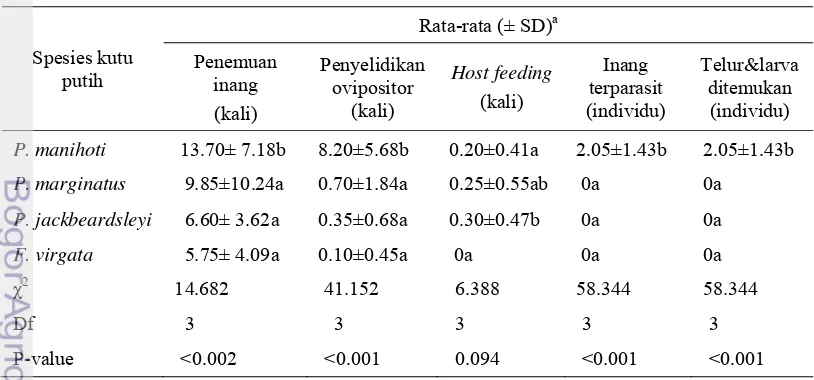
Pada percobaan tanpa pilihan terhadap empat spesies kutu putih, parasitoid A. lopezi memperlihatkan respon yang berbeda nyata dalam hal penemuan inang (P=0.002), penyelidikan ovipositor (P<0.001) dan banyaknya inang terparasit (P<0.001) (Tabel 3, Lampiran 7).
Tabel 3 Penemuan inang, penyelidikan ovipositor, host feeding dan oviposisi A. lopezi terhadap empat spesies kutu putih tanaman ubi kayu pada uji tanpa pilihan (pengamatan dalam 30 menit)
Spesies kutu
P. manihoti 13.70± 7.18b 8.20±5.68b 0.20±0.41a 2.05±1.43b 2.05±1.43b
P. marginatus 9.85±10.24a 0.70±1.84a 0.25±0.55ab 0a 0a
P-value <0.002 <0.001 0.094 <0.001 <0.001
a
Nilai pada kolom yang sama yang diikuti oleh huruf yang sama tidak menunjukkan beda nyata (Uji Dunn α = 5%).