PREFERENSI, KESESUAIAN DAN PARASITISME Anagyrus
lopezi (DE SANTIS) (HYMENOPTERA: ENCYRTIDAE)
PADA BERBAGAI INSTAR KUTU PUTIH SINGKONG,
Phenacoccus manihoti MATILE-FERRERO
(HEMIPTERA: PSEUDOCOCCIDAE)
EVIE ADRIANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Preferensi, Kesesuaian dan Parasitisme Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) pada Berbagai Instar Kutu Putih Singkong, Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
Evie Adriani NRP A351130021
RINGKASAN
EVIE ADRIANI. Preferensi, Kesesuaian dan Parasitisme Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) pada Berbagai Instar Kutu Putih Singkong, Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). Dibimbing oleh AUNU RAUF dan PUDJIANTO.
Singkong (Manihot esculenta Crantz) merupakan salah satu komoditas yang sangat populer di Indonesia, karena dapat dijadikan sebagai bahan pangan, pakan, dan bahan baku industri. Indonesia merupakan negara penghasil singkong terbesar keempat di dunia, dengan produksi mencapai 24.2 juta ton pada tahun 2012. Pada beberapa tahun belakangan ini, salah satu kendala dalam budidaya singkong adalah adanya serangan hama baru yaitu kutu putih Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). Hama yang berasal dari Amerika Selatan ini masuk ke Afrika tahun 1973, kemudian Thailand 2008, dan Indonesia tahun 2010. Tanaman yang terserang berat memperlihatkan gejala bunchy top, distorsi batang, dan daun meranggas. Serangan berat dapat menyebabkan kehilangan hasil 30-50%. Untuk mengendalikan hama ini, pada bulan Maret 2014 Indonesia telah mendatangkan musuh alaminya yaitu parasitoid Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) dari Thailand.
Penelitian bertujuan menentukan tingkat: (1) preferensi peletakan telur parasitoid pada berbagai instar kutu putih; (2) kesesuaian parasitoid pada berbagai instar kutu putih; dan (3) parasitisme, superparasitisme dan enkapsulasi parasitoid pada berbagai instar kutu putih. Penelitian dilakukan dengan uji tanpa pilihan dan uji pilihan berpasangan. Pengujian dilakukan dengan cara memasukkan instar kutu putih yang sesuai bersama potongan daun singkong ke dalam kurungan mika berbentuk silinder (t=7 cm, d=10 cm). Ke dalam kurungan kemudian dimasukkan imago parasitoid dan dibiarkan selama 24 jam. Pengaruh instar inang terhadap berbagai parameter biologi dan kebugaran parasitoid diperiksa dengan analisis ragam dan uji t.
Hasil penelitian menunjukkan bahwa pada uji tanpa pilihan, tingkat parasitisasi pada nimfa-2, nimfa-3, dan imago berkisar 7-8 ekor, berbeda sangat nyata dengan pada nimfa-1 (3.25 ekor). Pada inang nimfa-1, rataan banyaknya telur parasitoid yang diletakkan yaitu 3.70 butir, jauh lebih sedikit dibandingkan pada instar lainnya yang berkisar 9-10 butir. Pada uji pilihan berpasangan, parasitoid A. lopezi lebih memilih nimfa-2, -3, dan imago dibandingkan nimfa-1. Rataan banyaknya inang yang terparasit yaitu 0.90 hingga 2.30 ekor pada nimfa-1, jauh lebih rendah dibandingkan pada nimfa-2 (7.55 ekor), nimfa-3 (8.05 ekor), dan imago (7.40 ekor). Begitu pula banyaknya telur parasitoid yang diletakkan per inang pada nimfa-1 (0.75-0.99 butir) lebih rendah dibandingkan pada instar lainnya (1.20-1.39 butir). Terdapat perbedaan nyata antara rataan banyaknya inang terparasit pada nimfa-2 (4.85 ekor) dengan nimfa-3 (7.45 ekor), serta banyaknya telur parasitoid yang diletakkan per inang yaitu 1.05 butir pada nimfa-2 dan 1.nimfa-21 butir pada nimfa-3. Banyaknya inang yang terparasit dan banyaknya telur parasitoid yang diletakkan tidak berbeda pada pasangan perlakuan inang imago dengan nimfa-2 dan nimfa-3.
perkembangan pradewasa parasitoid yang paling singkat terjadi pada inang imago P. manihoti, yaitu berkisar 15-16 hari. Perbedaan instar inang juga berpengaruh nyata terhadap rataan banyaknya keturunan parasitoid yang muncul dan terhadap nisbah kelamin. Pada inang nimfa-1, banyaknya imago parasitoid yang muncul 4.00 ekor, sedangkan pada instar lainnya berkisar 11-13 ekor. Nisbah kelamin (proporsi jantan terhadap total keturunan) parasitoid yang muncul dari inang nimfa-1 lebih banyak jantan yaitu 0.87, sedangkan yang muncul dari inang imago lebih banyak betina yaitu 0.28.
Tingkat parasitisme A. lopezi pada imago, nimfa-2, dan nimfa-3 kutu putih berturut-turut 82, 72, dan 71%, lebih tinggi dibandingkan pada nimfa-1 (33%). Tingkat superparasitisme juga lebih tinggi pada imago (36%) dan nimfa-2 (31%) dibandingkan pada nimfa-3 (27%), dan paling rendah terjadi pada nimfa-1 (18%). Begitu pula rataan banyaknya telur yang diletakkan per inang terparasit pada nimfa-3 dan imago sekitar 1.6 butir lebih tinggi dibandingkan pada nimfa-1 (1.1 butir).
Superparasitisme lebih sering dijumpai pada kutu putih yang berukuran besar (imago, nimfa-3, nimfa-2) dibandingkan pada inang yang berukuran kecil (nimfa-1). Dari 55 ekor kutu putih nimfa-1 yang terparasit, sebanyak 90.9% berisi 1 butir, dan sisanya berisi 2 butir (7.3%) dan 3 butir (1.8%) telur parasitoid. Dari total 446 ekor nimfa-2, -3, dan imago yang terparasit, proporsi yang mengandung satu butir telur parasitoid berkisar 60-70%, sisanya berisi 2 butir (17-25%), 3 butir (5-12%), dan ≥ 4 butir (1-4%).
Tingkat enkapsulasi agregat paling tinggi terdapat pada imago (8.40%), berbeda sangat nyata dengan pada nimfa-1 (1.10%), namun tidak berbeda nyata dengan nimfa-2 (3.10%) dan nimfa-3 (5.80%). Dari total 257 butir telur parasitoid yang diletakkan di dalam tubuh imago kutu putih, sebanyak 25 butir mengalami enkapsulasi. Sementara dari 212, 199, dan 74 butir telur di dalam tubuh nimfa3, -2, dan -1 yang mengalami enkapsulasi berturut-turut 13, 8, dan 1 butir. Tingkat enkapsulasi efektif tidak berbeda nyata antara berbagai instar inang, dengan nilai berkisar antara 1-2%. Dari 163 ekor imago kutu putih yang terparasit, hanya 3 ekor yang terenkapsulasi secara efektif. Begitu pula dari 141 ekor nimfa-3, 143 ekor nimfa-2, dan 65 ekor nimfa-1 yang terparasit, masing-masing tidak lebih dari 2 ekor yang terenkapsulasi secara efektif.
Kata kunci: Anagyrus lopezi, kutu putih, parasitoid, Phenacoccus manihoti, singkong
SUMMARY
EVIE ADRIANI. Preference, Suitability, and Parasitism of Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) on Various Instars of Cassava Mealybug, Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). Supervised by AUNU RAUF and PUDJIANTO.
Cassava (Manihot esculanta Crantz) is one of the most popular crops in Indonesia, since it can be used as food, feed and raw materials for industry. Indonesia is the fourth largest cassava producer in the world, with the production reached 24.2 million tons in 2012. In recent years, one of the problems in cassava cultivation is the invasion of a new pest, namely cassava mealybug Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). The pest was originated from South America, and came into Africa in 1973, then to Thailand in 2008 and Indonesia in 2010. Plants attacked show bunchy tops, distorted stems, and leaf drops. Attack by the cassava mealybug caused yield losses about 30-50%. To control this pest, Indonesia has introduced a parasitoid Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) from Thailand in March 2014.
Research was carried out with the objectives to determine: (1) ovipositional preference of parasitoid on the various stages of mealybug; (2) suitability of various stages of mealybug for parasitoid development; and (3) level of parasitism, superparasitism, and encapsulation on various stages of mealybug. Researches were conducted with no-choice and paired-choice tests, where P. manihoti and cassava leaves were introduced into a cylinder plastic cage (h=7 cm, d=10 cm). A single mated female parasitoid then was introduced into the cage for 24 hours. Effects of different host stages on various biological parameters and fitness of the parasitoid were examined using analysis of variance and t-test.
Our research showed that, for no-choice experiment, parasitisation on nymph-2, nymph-3, and adult ranged 7-8 mealybugs, and significantly higher than those on nymph-1 (3.25 mealybugs). Average number of parasitoid eggs laid per host were 3.70 eggs on nymph-1, and much lower than those on other instars which were 9-10 eggs. On paired-choice test, female A. lopezi preferred more nymph-2, nymph-3 and adult than nymph-1. Average number of mealybugs ranged 0.90 until 2.30 on nymph-1, much lower as compared to those on nymph-2 (7.55 mealybugs), nymph-3 (8.05 mealybugs), and adult (7.40 mealybugs). Similarly, number of eggs laid by parasitoids on mealybug nymph-1 (0.75-0.99 eggs) was lower than those on other instars (1.20-1.39 eggs). There was a significant difference of number of host parasitized between nymph-2 (4.85 mealybugs) and nymph-3 (7.45 mealybugs), and number of eggs laid per host on nymph-2 (1.05 eggs) and nymph-3 (1.21 egss). On paired-choice test, number of mealybugs parasitized and number of eggs laid by parasitoids per host were not significantly different between those on adults and nymph-2 and nymph-3.
biased (0.87) on nymph-1, whereas on adult mealybugs was female biased (0.28). Rate of parasititation of A. lopezi on adult, nymph-2, nymph-3 were 82%, 72%, and 71%, respectively, and higher than those on nymph-1 (33%). Rate of superparasitism on adult was 36% and nymph-2 31% which were higher than those on nymph-3 (27%), and the lowest was on nymph-1 (18%). Similarly, the number of parasitoid eggs laid on nymph-3 and adult (1.6 eggs) were higher than those on nymph-1 (1.1 eggs).
Superparasitism was more common on bigger size mealybugs (adult, nymph-3, and nymph-2) than those on smaller one (nymph-1). Based on 55 nymph-1 mealybugs parasitized, about 90.9% with 1 egg, and the rests with 2 eggs (7.3%) and 3 eggs (1.8%). From 446 nymph-2, nymph-3, and adult parasitized, proportion with 1 egg was 60-70%, 2 eggs 17-25%, 3 eggs 5-12%, and ≥ 4 eggs was about 1-4%.
Rate of agregate encapsulation was highest on adult (8.40%), and differed significantly with those on nymph-1 (1.10%), but not with nymph-2 (3.10%) and nymph-3 (5.80%). As many as 25 out of 257 eggs laid in adult mealybug were encapsulated. Whereas of 212 eggs laid on nymph-3, 199 eggs on nymph-2, and 74 eggs on nymph-1, about 13, 8, and 1 parasitoid eggs were respectively encapsulated. Rate of effective encapsulation was not significantly different among various stages of mealybug, and ranged 1-2%. Only 3 out of 163 mealybug adults with effective encapsulation. Similarly, from 141 nymph-3, 143 nymph-2, and 65 nymph-1, no more than two parasitized mealybugs with effective encapsulation.
Key words: Anagyrus lopezi, parasitoid, mealybug, cassava, Phenacoccus manihoti
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
PREFERENSI, KESESUAIAN DAN PARASITISME Anagyrus
lopezi (DE SANTIS) (HYMENOPTERA: ENCYRTIDAE)
PADA BERBAGAI INSTAR KUTU PUTIH SINGKONG,
Phenacoccus manihoti MATILE-FERRERO
(HEMIPTERA: PSEUDOCOCCIDAE)
EVIE ADRIANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Preferensi, Kesesuaian dan Parasitisme Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) pada Berbagai Instar Kutu Putih Singkong Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae)
Nama : Evie Adriani NRP : A351130021
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Aida Vitayala S Hu
Diketahui oleh
Tanggal Ujian: 28 Januari 2016 Tanggal Lulus: Ketua Program Studi Entomologi
Dr Ir Pudjianto, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr Dr Ir Pudjianto, MSi
Anggota Prof Dr Ir Aunu Rauf, MSc
Ketua
Formatted: Indent: Hanging: 2.75 cm, Right: -1 cm
Formatted: Indent: Hanging: 2 cm
Formatted: Indent: Hanging: 2 cm, Right: -1 cm
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala nikmat dan karunia-Nya yang tak terhingga sehingga penulis dapat
menyelesaikan penelitian dan penulisan tesis dengan judul “Preferensi, Kesesuaian dan Parasitisme Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) pada Berbagai Instar Kutu Putih Singkong, Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae)”, dapat selesai dengan baik. Karya ilmiah ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program studi Entomologi, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian merupakan bagian dari proyek CIAT-Asia “Emerging Pests and Diseases of Cassava in Southeast Asia: Seeking eco-efficient solutions to overcome a threat to livelihoods and industries”.
Penghargaan dan terima kasih penulis sampaikan kepada Bapak Prof Dr Ir Aunu Rauf, MSc dan Bapak Dr Ir Pudjianto, MSi selaku pembimbing yang telah memberikan ilmu, pengarahan, motivasi, kritik dan saran selama penulis mulai merencanakan penelitian, melaksanakan penelitian hingga penyelesaian penelitian dan penyelesaian penulisan karya ilmiah. Ucapan terima kasih juga ditujukan kepada ketua program studi Entomologi, bapak Dr. Ir. Pudjianto, MSi atas pengarahannya. Terima kasih disampaikan kepada Pimpinan dan seluruh staf Departemen Proteksi Tanaman, Fakultas Pertanian IPB, Pimpinan dan staf Laboratorium Ekologi Serangga atas segala bantuan bantuan fasilitas untuk penelitian penulis. Terima kasih juga disampaikan kepada Direktorat Jenderal Pendidikan Tinggi-Kementerian Ristek dan Pendidikan Tinggi atas bantuan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) selama proses perkuliahan berlangsung.
Rasa hormat dan ungkapan terima kasih juga disampaikan kepada Ayah (M. Arfah Djama), Ibu (Hasrawati) serta seluruh keluarga atas doa, motivasi dan dukungan yang selalu diberikan. Ucapan terima kasih juga disampaikan kepada Laboran Ekologi Serangga, Bapak Wawan Yuandi serta rekan-rekan Laboratorium Ekologi Serangga (Pak Budi, Mbak Rani, Bu Sulaeha, Mbak Tutut, Mbak Indah, Mbak Uce, Mbak Yeni, Mas Hendri, Mas Edwin, Eka, Juju, Nisa, Safira dan Fajrin), dan juga rekan-rekan Entomologi 2013 atas kebersamaan dan kekompakannya, serta terima kasih kepada rekan-rekan HPT Unhas 2008 (Aryo Ent 2014, Hishar Fit 2012 dan Asti Fit 2012) atas motivasi dan bantuannya serta pihak-pihak yang telah membantu dalam penelitian dan pembuatan tesis ini.
Semoga karya ilmiah ini bermanfaat bagi pengembangan disiplin ilmu Entomologi dan pengendalian hayati dan bagi yang membutuhkan dalam pengembangan ilmu pengetahuan.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
I PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 3
Hipotesis 3
II TINJAUAN PUSTAKA 4
Kutu Putih Phenacoccus manihoti 4
Morfologi 4
Biologi dan Ekologi 5
Kerusakan pada Tanaman 5
Parasitoid Anagyrus lopezi 6
Morfologi 6
Biologi dan Ekologi 6
Interaksi A. lopezi dengan Inang Utamanya 8
Pemanfaatan A. lopezi dalam Pengendalian Hayati P. manihoti 9 III PENGARUH INSTAR INANG TERHADAP OVIPOSISI,
PERKEMBANGAN, DAN NISBAH KELAMIN Anagyrus lopezi (DE SANTIS) (HYMENOPTERA: ENCYRTIDAE), PARASITOID
Phenacoccus manihoti MATILE-FERRERO (HEMIPTERA:
PSEUDOCOCCIDAE) 11
Abstrak 11
Abstract 11
Pendahuluan 12
Metode Penelitian 13
Hasil 17
Pembahasan 20
Kesimpulan 21
Daftar Pustaka 21
IV TINGKAT PARASITISME, SUPERPARASITISME, DAN
ENKAPSULASI Anagyrus lopezi (DE SANTIS) (HYMENOPTERA: ENCYRTIDAE), PARASITOID KUTU PUTIH SINGKONG
Phenacoccus manihoti MATILE-FERRERO (HEMIPTERA:
PSEUDOCOCCIDAE) 23
Abstrak 23
Abstract 23
Pendahuluan 24
Metode Penelitian 25
Hasil 26
Pembahasan 29
Kesimpulan 30
Daftar Pustaka 30
4
VI KESIMPULAN DAN SARAN 38
Simpulan 38
Saran 38
VII DAFTAR PUSTAKA 39
LAMPIRAN 45
5
DAFTAR TABEL
3.1 Parasitisasi (
x
±SD) A. lopezi pada berbagai instar inang 173.2 Preferensi (
x
±SD) parasitoid pada berbagai pasangan instar inang 183.3 Masa perkembangan pradewasa parasitoid (
x
±SD) pada berbagaiinstar inang 19
3.4 Banyaknya keturunan dan nisbah kelamin parasitoid (
x
±SD) yangmuncul dari berbagai instar inang 19
3.5 Ukuran panjang tubuh dan tibia (
x
±SD) imago betina parasitoidyang muncul dari berbagai instar inang 20
4.1 Tingkat parasitisme, superparasitisme, dan banyaknya
telur (
x
±SD) yang diletakkan parasitoid A. lopezi pada kutu putihP. manihoti 26
4.2 Persentase banyaknya telur parasitoid A. lopezi yang
diletakkan pada kutu putih P. manihoti 27
4.3 Tingkat enkapsulasi agregat dan efektif parasitoid A. lopezi
(
x
±SD) oleh kutu putih P. manihoti 28DAFTAR GAMBAR
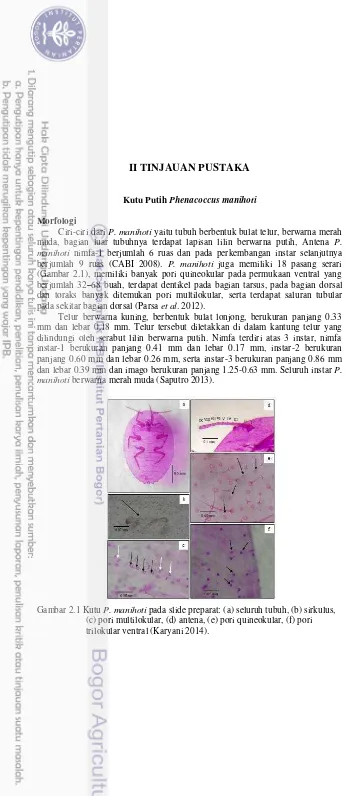
2.1 Kutu P. manihoti pada slide preparat 4
2.2 Gejala serangan P. manihoti 6
2.3 Fase perkembangan A. lopezi 7
2.4 Imago betina Anagyrus lopezi 7
3.1 Mumi kutu P. manihoti 14
3.2 Stadium inang kutu putih P. manihoti 15
3.3 Imago A. lopezi 16
3.4 Telur A. lopezi 18
4.1 Telur parasitoid A. lopezi 27
4.2 Larva A. lopezi 28
4.3 Kutu putih P. manihoti dengan telur atau larva
DAFTAR LAMPIRAN
1. Kurungan berbentuk tabung yang digunakan pada pengujian kerentanan instar inang dan preferensi instar inang serta
pada pengamatan parasitisme dan enkapsulasi 46
2. Kurungan berbentuk tabung yang digunakan pada pengujian
kesesuaian instar inang 46
3. Perbanyakan massal parasitoid A. lopezi 46
4. Hasil pengujian kerentanan instar inang (uji tanpa pilihan) 47 5. Hasil pengujian preferensi instar inang (uji dengan pilihan) 48
I PENDAHULUAN
Latar Belakang
Singkong (Manihot esculenta Crantz) merupakan salah satu komoditas pangan yang sangat populer, baik untuk dikonsumsi langsung oleh masyarakat maupun sebagai bahan baku berbagai industri di Indonesia. Meningkatnya minat masyarakat dalam pemanfaatan singkong sebagai bahan pangan merupakan salah satu indikasi positif bagi tercapainya upaya diversifikasi pangan dalam mendukung ketahanan pangan di Indonesia (LIPI 2014). Singkong berasal dari benua Amerika, tepatnya dari negara Brazil. Penyebarannya hampir ke seluruh dunia, antara lain Afrika, Madagaskar, India, dan Tiongkok. Singkong berkembang di negara-negara yang terkenal wilayah pertaniannya dan masuk ke Indonesia pada 1852. Singkong telah dijadikan referensi solusi alternatif sebagai sumber pangan masa depan sekaligus pakan ternak diIndonesia (RISTEK 2001).
Indonesia merupakan negara penghasil singkong terbesar keempat di dunia setelah Brazil, Nigeria, dan Thailand. Produksi singkong di Indonesia pada 2012 mencapai 24.2 juta ton, dan menurun menjadi 23.9 juta ton pada 2013 (BPS 2014). Kendala utama yang menyebabkan menurunnya produktivitas yaitu faktor bibit dan luasan lahan pertanaman. Selain itu, ada juga faktor budidaya dan serangan hama dan penyakit.
Kutu putih Phenacoccus manihoti Matile-Fererro (Hemiptera: Pseudo-coccidae) merupakan hama yang paling banyak menimbulkan kerusakan pada pertanaman singkong. Hama ini berasal dari Amerika Selatan dan masuk ke Afrika pada 1973 yang menyebabkan kehilangan hasil hingga 82% (Nwanze 1982; Schulthess et al. 1991). Pada 2008, kutu putih P. manihoti dilaporkan terdeteksi di Thailand dan menyebabkan kehilangan hasil sekitar 30% (Winotai 2010). Di Indonesia, hama P. manihoti pertama kali ditemukan di Bogor pada 2010 (Muniappan et al. 2011). Berdasarkan survei petani di Kabupaten Bogor, kehilangan hasil diperkirakan berkisar 30-50% (Dwianri 2013; Wardani 2015).
Pengendalian kutu putih P. manihoti perlu dilakukan dengan tepat dan menggunakan cara yang tidak berbahaya bagi lingkungan. Pengendalian yang ramah lingkungan dapat berupa pengendalian secara biologi dengan cara memanfaatkan organisme ataupun mikroorganisme antagonis seperti parasitoid, predator, dan patogen serangga. Pengendalian yang telah dilakukan untuk mengatasi serangan kutu putih pada singkong di Afrika adalah dengan menggunakan pengendalian hayati, seperti pemanfaatan beberapa spesies kumbang Coccinellidae sebagai predator dan Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) sebagai parasitoid (James et al. 2000). Menurut Chakupurakal et al. (1994), populasi parasitoid A. lopezi meningkat dan mampu bertahan hingga 4 tahun setelah pelepasan pertama.
2
parasitoid tersebut telah berhasil dikembangbiakkan di laboratorium Bionomi dan Ekologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, IPB. Tahapan berikutnya dari upaya introduksi musuh alami adalah pengujian kekhususan inang. Hasil penelitian Karyani (2015) menunjukkan bahwa dari empat spesies kutu putih yang diuji, parasitoid A. lopezi hanya memarasit P. manihoti. Dengan demikian dapat dipastikan bahwa pelepasan parasitoid di lapangan diperkirakan tidak akan menimbulkan pengaruh buruk terhadap spesies kutu putih lain yang menghuni pertanaman singkong.
Keberhasilan pengendalian hayati dengan parasitoid sering menghadapi kendala biologis, di antaranya adalah superparasitisme. Superparasitisme dapat terjadi karena seekor betina meletakkan telur pada inang yang sebelumnya sudah diletaki telur oleh dirinya sendiri (self-superparasitism) atau oleh betina yang lain (conspecifics superparasitism) (van Dijken et al. 1992). Kendala biologis lain yang memengaruhi keefektifan suatu parasitoid adalah enkapsulasi. Enkapsulasi merupakan mekanisme imun dari inang sebagai respon terhadap keberadaan endoparasitoid atau organisme asing lain di dalam tubuh (Blumberg 1997).
Upaya pengendalian hayati kutu putih P. manihoti dengan parasitoid A. lopezi perlu didukung pemahaman tentang interaksi inang-parasitoid. Pemahaman interaksi ini diperlukan tidak hanya untuk keperluan pembiakan massal parasitoid, tetapi juga dalam kaitannya dengan waktu yang tepat untuk melakukan pelepasan parasitoid (Sagarra dan Vincent 1999). Hingga saat ini, informasi tentang tingkat parasitisasi dan superparasitisme; kerentanan dan kesesuaian berbagai instar P. manihoti bagi kehidupan parasitoid A. lopezi berupa keberhasilan keturunan parasitoid yang muncul, lama perkembangan pradewasa parasitoid dan nisbah kelamin belum diketahui. Begitu pula tingkat enkapsulasi parasitoid A. lopezi oleh kutu putih P. manihoti belum diketahui.
Rumusan Masalah
3
Tujuan Penelitian
Penelitian bertujuan menentukan tingkat: (1) preferensi peletakan telur parasitoid pada berbagai instar kutu putih; (2) kesesuaian parasitoid pada berbagai instar kutu putih; dan (3) parasitisme, superparasitisme dan enkapsulasi parasitoid pada berbagai instar kutu putih.
Hipotesis
4
II TINJAUAN PUSTAKA
Kutu Putih Phenacoccus manihoti
Morfologi
Ciri-ciri dari P. manihoti yaitu tubuh berbentuk bulat telur, berwarna merah muda, bagian luar tubuhnya terdapat lapisan lilin berwarna putih, Antena P. manihoti nimfa-1 berjumlah 6 ruas dan pada perkembangan instar selanjutnya berjumlah 9 ruas (CABI 2008). P. manihoti juga memiliki 18 pasang serari (Gambar 2.1), memiliki banyak pori quineokular pada permukaan ventral yang berjumlah 32–68 buah, terdapat dentikel pada bagian tarsus, pada bagian dorsal dan toraks banyak ditemukan pori multilokular, serta terdapat saluran tubular pada sekitar bagian dorsal (Parsa et al. 2012).
Telur berwarna kuning, berbentuk bulat lonjong, berukuran panjang 0.33 mm dan lebar 0.18 mm. Telur tersebut diletakkan di dalam kantung telur yang dilindungi oleh serabut lilin berwarna putih. Nimfa terdiri atas 3 instar, nimfa instar-1 berukuran panjang 0.41 mm dan lebar 0.17 mm, instar-2 berukuran panjang 0.60 mm dan lebar 0.26 mm, serta instar-3 berukuran panjang 0.86 mm dan lebar 0.39 mm dan imago berukuran panjang 1.25-0.63 mm. Seluruh instar P. manihoti berwarna merah muda (Saputro 2013).
5
Biologi dan Ekologi
P. manihoti merupakan hama yang bersifat partenogenetik telitoki, yaitu semua keturunan yang dihasilkan adalah betina. Siklus hidup P. manihoti berlangsung sekitar 21 hari, dengan perincian telur 7-8 hari, nimfa-1 4.58 hari, nimfa-2 4.20 hari, dan nimfa-3 4.58 hari. Rataan lama hidup imago 34.38 hari, dengan keperidian 570 butir telur. Laju pertambahan instrinsik (rm) sebesar 0.213 keturunan betina per betina per hari. Rata-rata masa generasi (T) adalah 28.48 hari dan laju reproduksi bersih (Ro) selama periode ini sebesar 456.02. Laju
pertambahan terbatas (λ) sebesar 1.24 kali per hari dan masa ganda (Dt) selama
3.22 hari (Saputro 2013).
Koloni P. manihoti biasanya berada pada bagian bawah daun singkong dan terutama menyerang bagian pucuk tanaman, sehingga mengakibatkan distorsi pada tanaman singkong (CABI 2008). Nimfa-1 merupakan nimfa yang aktif bergerak dan biasa disebut dengan crawler, nimfa tersebut aktif dalam penyebaran sedangkan instar kutu putih yang lain bergerak lamban dan cenderung menetap pada inangnya (Saputro 2013). Pada saat menetap pada permukaan daun, P. manihoti mengangkat dan menurunkan antena dan tungkainya secara berulang-ulang, kemudian labium dibiarkan menempel pada permukaan daun agar beradaptasi dengan phylloplane. Sebelum stilet melakukan penetrasi ke dalam jaringan tanaman, P. manihoti mengevaluasi kualitas gizi tanaman dengan cara melakukan kontak berulang-ulang menggunakan organ gustatori dan organ penciuman yang terletak di bagian labium dan antena P. manihoti (Renard et al. 1998).
Suhu lingkungan yang sesuai bagi perkembangan P. manihoti yaitu 14.7˚C sampai 28˚C. Hama ini biasanya biasanya berkembang pesat sepanjang musim kemarau. Pada kondisi tersebut, imago P. manihoti dapat menghasilkan sekitar 500 telur dengan rata-rata perkembangan telur menjadi imago sekitar 33 hari. Masa inkubasi telur selama 8 hari (CABI 2008). Potensi peningkatan populasi P. manihoti di lapangan, dipengaruhi oleh faktor lingkungan seperti iklim, suhu, tanaman inang dan musuh alami. Faktor iklim yang diperkirakan berpengaruh kuat terhadap perkembangan populasi P. manihoti adalah curah hujan, semakin tinggi curah hujan di lapangan, maka semakin rendah populasi dari P. manihoti (Wardani 2015).
Tanaman singkong M. esculanta dan beberapa spesies dari Manihot merupakan tanaman inang dari P. manihoti. Walaupun demikian, di laboratorium kutu P. manihoti dapat dipelihara pada Talinum triangulare (sejenis ginseng)dan Aqeratum comyzodies (babadotan) (Essien et al. 2013). Varietas tanaman singkong yang rentan terhadap serangan P. manihoti yaitu yang mengandung kadar asam sianida (HCN) yang tinggi yaitu varietas Adira-2, 4, Malang-6, UJ-3 dan UJ-5; sedangkan varietas yang rendah kadar asam sianida (HCN) yaitu Adira-1 (Wardani 2015).
Kerusakan pada Tanaman
6
fungi yang berwarna hitam, sehingga mampu mengurangi fotosintesis. Gejala serangan P. manihotiyaitu bagian atas tanaman menjadi kerdil atau “bunchy top” dan distorsi batang, sehingga memiliki kualitas buruk sebagai bibit singkong yang berdampak pada tanaman tahun berikutnya (Neuenshwander dan Hammond 1988).
Laporan outbreak pertama yang disebabkan oleh P. manihoti pada April 2008 yang menyerang 200 ribu hektar lahan singkong di Thailand, sehingga mengakibatkan produksi singkong mengalami penurunan hingga 25% (Cox 2010). Hama kutu putih P. manihoti mengakibatkan kerugian hingga 50% di Indonesia pada 2010. Hama ini menyebar dengan sangat cepat pada musim kemarau, sehingga dapat mengakibatkan kerugian hingga 90% (Wardani 2015).
Gambar 2.2 Gejala serangan P. manihoti; (a) daun singkong yang terserang P. manihoti, (b) kerdil pada bagian pucuk dan distorsi batang (Dokumentasi pribadi)
Parasitoid Anagyrus lopezi
Morfologi
Ciri-ciri A. lopezi yaitu tubuh berukuran 1.26 -1.75 mm (Karyani 2015), funikel terdiri dari 4 ruas, palpus maksila terdiri dari 4 ruas, dan palpus labium terdiri dari 3 ruas. Betina A. lopezi mempunyai skapus berbentuk rata dan lebar, tiap ruas pada funikel lebih panjang daripada skapus, clavus terdiri dari 3 ruas, mesoskutum tanpa notauli. Pada bagian sayapnya terdapat vena submarginal yang tidak lebih besar dari stigma, gaster lebih pendek dari toraks dan ovipositor tersembunyi, sedangkan jantan A. lopezi mempunyai ciri-ciri skapus berbentuk rata serta sedikit lebar, dan terdapat 6 ruas pada funikel dan clavus (Noyes dan Hayat 1994; Moursi 1948).
Biologi dan Ekologi
A. lopezi merupakan endoparasitoid dengan larva terdiri dari 4 instar. Total siklus hidup mulai dari telur (Gambar 2.3) hingga imago (Gambar 2.4) yaitu 11-25 hari, dengan rataan 18 hari. Lama stadium telur berlangsung 2 hari, larva instar-1 berlangsung 1 hari, larva instar-2 1 hari, larva instar-3 2 hari, instar-4 4 hari, dan pupa 6 hari (Odebiyi dan Bokonon-Ganta 1986). Pupa memiliki kokon berwarna kuning yang terdapat di lapisan luar akhir posterior. Imago muncul
7
diantara operkulum yang terpotong pada bagian ujung posterior inang yang telah terparasit (Noyes dan Hayat 1994).
A. lopezi merupakan parasitoid spesifik pada inang P. manihoti. Pada saat peletakan telur, bekas tusukan ovipositor di integumen inang akan terlihat jelas. Telur A. lopezi terletak pada integumen inang serta memiliki kemampuan berkembang lama dan berbentuk bulat telur. Tidak terdapat lapisan aeroskopik pada telur sebelum embrio berkembang dengan menyeluruh. Setelah telur menetas, larva yang bersifat apneustik akan mengapung secara bebas dalam rongga tubuh inang (Noyes dan Hayat 1994; Maple 1947).
Gambar 2.3 Fase perkembangan A. lopezi: a) telur; b) larva instar-1 tampak lateral; c) larva instar-4 tampak lateral (Odebiyi & Bokonon-Ganta 1986)
Parasitoid A. lopezi merupakan parasitoid soliter dengan tipe perkembangbiakan partenogenesis arenotoki. A. lopezi mampu bereproduksi pada
kondisi lingkungan mencapai suhu 29˚C. Dalam kondisi yang baik di lapangan,
satu ekor betina A. lopezi mampu meletakkan 5–6 telur/hari, sedangkan di laboratorium yang terdapat banyak inang, betinaA. lopezi mampu meletakkan telur hingga 45 telur (Rivnay dan Perzelan 1943).
Lama hidup A. lopezi yaitu 25 hari bila meletakkan telur, sedangkan 13 hari bila tidak meletakkan telur. Seekor imago betina mampu meletakkan telur hingga 68 telur selama hidupnya. Nisbah kelamin dari A. lopezi yaitu 1:2.3 (Neuensch-wander dan Hammond 1988).
Gambar 2.4 Imago betina Anagyrus lopezi (Georgen 2010)
a b
8
Interaksi A. lopezi dengan Inang Utamanya
Tahapan pemilihan inang menurut Godfray (1994) yang pertama yaitu parasitoid menentukan habitat inang, kemudian penemuan inang lalu penerimaan inang dan yang terakhir kesesuaian inang. Penentuan habitat inang yaitu dengan cara mengenali jenis tanaman yang dimakan oleh inang. Faktor yang dipertimbangkan oleh parasitoid dalam menentukan preferensi habitat inang yaitu temperatur, kelembaban, intensitas cahaya, angin, sumber makanan, kondisi yang baik untuk terbang dan habitat yang baik untuk berjalan. Intensitas cahaya yang tinggi baik bagi aktifitas beberapa parasitoid (Vinson 1976).
Pada penentuan lokasi inang, parasitoid dapat secara langsung menemukan inang melalui senyawa kimia yang dikeluarkan oleh inang maupun secara tidak langsung melalui aktifitas yang dilakukan oleh inang. Beberapa sinyal yang digunakan oleh parasitoid dalam menemukan lokasi inang yaitu menggunakan organ penglihatan, organ pendengaran, organ penciuman dan organ perabaan. Cara parasitoid mengenali inangnya meliputi adanya: senyawa kimia yang berasosiasi dengan inang, embun madu yang dikeluarkan oleh inang, senyawa kimia dari fungi yang bersimbiose dengan inang, senyawa kimia yang dikeluarkan oleh tumbuhan yaitu zat volatil yang dikeluarkan oleh tanaman ketika terserang oleh hama serta mengenali feromon yang dikeluarkan oleh jantan dan betina parasitoid. Hal tersebut umumnya hanya mampu dilakukan oleh parasitoid betina (Godfray 1994).
Salah satu penyebab betina A. lopezi menemukan inangnya yaitu berasal dari senyawa kimia yang dihasilkan oleh tanaman singkong karena adanya respon atau gangguan dari sekumpulan P. manihoti (Nadel dan Alphen 1987). Imago A. lopezi betina tertarik pada senyawa kimia berupa zat volatil dari singkong yang terserang P. manihoti. Respon tersebut menguntungkan A. lopezi untuk menemukan inang. Jadi, terdapat simbiosis mutualisme antara singkong dengan parasitoid A. lopezi (Souissi dan Le Ru 1999).
Setelah parasitoid menemukan inangnya, maka parasitoid dihadapkan pada berbagai pertimbangan untuk mengambil keputusan yaitu menggunakan inang sebagai tempat peletakan telur, menolak inang untuk meletakkan telur dan memakan inang (host feeding). Pertimbangan yang umum dalam penerimaan inang yaitu kualitas inang serta kecukupan nutrisi dari inang untuk menunjang perkembangan keturunannya (Godfray 1994). Pada pengujian yang dilakukan terdapat pada tahapan ini.
Pada penerimaan inang, sebelum parasitoid memutuskan untuk meletakkan telurnya, parasitoid melakukan pemilahan inang meliputi inang sehat dengan inang sakit, inang berukuran besar dengan inang berukuran kecil dan inang yang telah dipararasit dengan inang yang belum diparasit. Setelah itu akan muncul stimulus untuk meletakkan telur atau kesesuaian inang. Setelah meletakkan telur, parasitoid akan mengeluarkan senyawa kimia penanda pada inangnya. Hal tersebut berfungsi untuk menghindari superparasitisme, serta membantu parasitoid betina lain agar tidak meletakkan telur di inang yang telah terparasit (Godfray 1994).
9
menggunakan ovipositornya. Instar-1 merupakan tahapan inang yang paling sering mengalami host feeding (Driesche et al. 1987). Kopulasi betina A. lopezi hanya terjadi sekali, sedangkan jantan lebih dari sekali. Betina yang kopulasi dapat memproduksi keturunan jantan dan betina atau disebut deuterotoki, sedangkan betina yang tidak kopulasi hanya memproduksi jantan saja atau disebut arenotoki(Odebiyi dan Bokonon-Ganta 1986).
Telur yang telah diletakkan oleh parasitoid A. lopezi tidak sepenuhnya dapat berkembang dengan baik karena adanya respon enkapsulasi yang diberikan oleh P. manihoti (Giordanengo dan Nenon 1990). Sistem pertahanan inang yang paling umum adalah kemampuan untuk mengenkapsulasi telur atau larva instar awal dari parasitoid (Godfray 1994). Enkapsulasi yaitu pertahanan umum yang diberikan oleh inang dalam menanggapi invasi dari endoparasitoid atau organisme asing lainnya (Blumberg 1997). Proses enkapsulasi ini melibatkan kolaborasi dari sel yang berbeda yaitu hemosit yang mampu mengenal organisme pengganggu yang terdapat di dalam tubuh inang, sel tersebut akan menempel pada organisme pengganggu tersebut. Selanjutnya memberi sinyal kepada sel lain untuk membentuk kapsul melanin setelah parasitoid meletakkan telurnya ke inang, mungkin telur atau larva parasitoid akan tertekan dan sulit untuk bernafas (Wajnberg dan Ris 2009). Enkapsulasi membawa efek yang kurang baik dalam pengendalian hayati dan tidak efektif dalam mempertahankan keberadaan parasitoid yang eksotik atau hasil introduksi di daerah yang baru. Faktor yang memengaruhi frekuensi enkapsulasi parasitoid dalam Famili Psuedococcidae meliputi: inang dan spesies parasitoid, usia fisiologis inang, kondisi fisiologis inang, superparasitisme, suhu dan tanaman inang (Blumberg 1997).
Pseudococcus calceolariae mampu mengenkapsulasi sebesar 89% dari inang yang ada. Planococcus citri juga dapat mengenkapsulasi sebesar 60% dari inang yang ada. Hal ini dikarenakan adanya respon imun yang tinggi dari inang tersebut (Suma et al. 2011). Telur yang diletakkan oleh A. lopezi dapat dienkapsulasi oleh P. manihoti hingga sekitar 25%, walaupun demikian larva seringkali dapat melepaskan diri dari kapsul dan berhasil hidup hingga menjadi imago (Giordanengo dan Nenon 1990).
Nisbah kelamin A. lopezi dapat dengan mudah ditentukan dalam pembiakan di laboratorium. Instar yang muda atau instar-1 dan -2 dapat menghasilkan imago parasitoid jantan karena ukurannya yang lebih kecil, sedangkan instar-3 dan imago kutu putih dapat segera menghasilkan imago parasitoid betina. Oleh karena sifat A. lopezi yang selektif dalam memilih inang, maka A. lopezi dapat segera meletakkan telur ketika telah menemukan inang. Nisbah kelamin dari populasi A. lopezi yang terdapat di lapangan tergantung pada kepadatan inang. P. manihoti dapat meletakkan telur pada inang kecil untuk produksi imago parasitoid jantan dan inang besar untuk produksi imago parasitoid betina (Dijken et al. 1991). Waktu oviposisi betina yaitu 13 hari dan dapat bertahan hidup hingga 25 hari (Odebiyi dan Bokonon-Ganta 1986).
Pemanfaatan A. lopezi dalam Pengendalian Hayati P. manihoti
10
hirsutus dapat meletakkan telur pada semua instar dan imago, tetapi lebih banyak meletakkan telur pada instar-3, hal ini disebabkan ukuran tubuhnya lebih besar dan tingkat enkapsulasinya kurang atau tidak ada jika dibandingkan dengan imago yang dapat mengenkapsulasi telur parasitoid hingga 60% (Sagarra dan Vincent 1999). Spesies lainnya yaitu A. mangicola dapat meletakkan telur pada semua instar dan imago dari kutu putih mangga (Rastrococcus invadens) (Bokonon-Ganta et al. 1995).
Peledakan hama P. manihoti pertama kali terjadi di Kongo pada 1973 (Herren dan Neuenschwander 1991), mengakibatkan gejala kerdil pucuk dan distorsi tanaman, sehingga terjadi kehilangan hasil hingga 80%. Selain itu, sekitar 200 juta penduduk di Afrika kekurangan karbohidrat, protein, dan vitamin (Herren 1987). Oleh sebab itu, dilakukan introduksi A. lopezi pada 1981 yang mampu bekerja dengan sukses di 25 negara di Afrika Barat (Winotai 2010). Selanjutnya pada Maret 1984 sampai September 1985, terjadi pelepasan parasitoid di Kabupaten Kinshasa, Kongo terhadap 205 ekor P. manihoti dan hasilnya terjadi penurunan populasi P. manihoti (Hennessey dan Muaka 1987).
11
III PENGARUH INSTAR INANG TERHADAP OVIPOSISI,
PERKEMBANGAN, DAN NISBAH KELAMIN Anagyrus lopezi
(De Santis) (HYMENOPTERA: ENCYRTIDAE), PARASITOID
Phenacoccus manihoti Matile-Ferrero (HEMIPTERA:
PSEUDOCOCCIDAE)
ABSTRAK
Parasitoid Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) di introduksikan dari Thailand ke Indonesia pada 2012 untuk mengendalikan hama kutu putih Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae). Dalam kaitan dengan penyediaan imago parasitoid yang berkualitas dalam jumlah banyak, kiranya perlu dilakukan penelitian dengan tujuan untuk menentukan instar inang kutu putih singkong yang paling rentan terhadap parasitisasi, preferensi parasitoid terhadap berbagai instar inang, dan kesesuaian instar inang. Pada pengujian tanpa-pilihan dan pilihan berpasangan, setiap individu imago parasitoid betina diparasitisasikan pada nimfa-1, nimfa-2, nimfa-3 dan imago kutu putih. Pada pengujian tanpa pilihan, tingkat parasitisme dan banyaknya telur yang diletakkan paling tinggi pada nimfa-2, nimfa-3 dan imago; sementara tingkat mortalitas yang diperkirakan karena host feeding paling tinggi pada nimfa-1. Pada uji pilihan berpasangan, nimfa-2 dan nimfa-3 serta imago paling dipilih untuk peletakan telur oleh parasitoid. Pada inang yang berukuran besar, masa perkembangan pradewasa parasitoid lebih singkat, keturunan betina yang muncul lebih banyak dan berukuran lebih besar. Hal ini mengisyaratkan bahwa nimfa-3 paling sesuai untuk perbanyakan massal parasitoid.
Kata kunci: Anagyrus lopezi, kutu putih, parasitoid, Phenacoccus manihoti, singkong
ABSTRACT
12
female-biased, and size was larger. This may suggest that third nymphal instar is the most suitable host for mass-rearing of parasitoids.
Key words: Anagyrus lopezi, cassava, mealybug, parasitoid, Phenacoccus manihoti
PENDAHULUAN
Kutu putih Phenacoccus manihoti Matile-Fererro (Hemiptera: Pseudo-coccidae) merupakan hama yang paling banyak menimbulkan kerusakan pada pertanaman singkong. Hama yang berasal dari Amerika Selatan ini pada tahun 1973 masuk ke Afrika dan menyebabkan kehilangan hasil hingga 82% (Schulthess et al. 1991). Pada tahun 2008, kutu P. manihoti dilaporkan terdeteksi di Thailand dan menyebabkan kehilangan hasil sekitar 30% (Winotai et al. 2010). Di Indonesia, hama ini pertama kali ditemukan di Bogor pada tahun 2010 (Muniappan et al. 2011). Berdasarkan survei petani di Kabupaten Bogor, kehilangan hasil diperkirakan 30-50% (Wardani 2015).
Upaya pengendalian hayati kutu putih singkong bermula ketika awal tahun 1980-an didatangkan parasitoid Anagyrus lopezi (De Santis) (Hymenoptera: Encyrtidae) dari Paraguay ke Afrika (Nweke 2009). Dilaporkan bahwa parasitoid A. lopezi telah menyebar dan menetap di 28 negera di Afrika, dan mampu menekan serangan kutu putih hingga 90%. Norgaard (1988) memperkirakan nilai B/C ratio = 149:1 dari kegiatan pengendalian hayati dengan introduksi dan pelepasan parasitoid A. lopezi. Kutu putih P. manihoti masuk ke Thailand pada tahun 2008, kemudian pada tahun 2009 pemerintah Thailand segera mendatangkan parasitoid ini dari Benin (Lefroy 2010). Seperti halnya yang terjadi di Afrika, introduksi parasitoid A. lopezi ke Thailand dilaporkan telah berhasil menekan kerusakan dan kerugian akibat serangan kutu putih P. manihoti di negara tersebut (FAO 2011).
Berdasarkan keberhasilan di Afrika dan Thailand, maka Fakultas Pertanian-IPB melalui kerjasama dengan CIAT dan FAO telah mendatangkan parasitoid A. lopezi dari Thailand ke Indonesia pada Maret 2014 (Wyckhuys et al. 2014). Kini parasitoid tersebut telah berhasil dikembangbiakkan di laboratorium Bionomi dan Ekologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian-IPB. Tahapan berikutnya dari upaya introduksi musuh alami adalah pengujian kekhususan inang. Hasil penelitian menunjukkan bahwa dari empat spesies kutu putih yang diuji, parasitoid A. lopezi hanya memarasit P. manihoti (Karyani 2015). Dengan demikian, pelepasan parasitoid ini di lapangan diperkirakan tidak akan menimbulkan pengaruh buruk terhadap spesies kutu putih lain yang menghuni pertanaman singkong.
13
mengetahui: (1) instar kutu putih P. manihoti yang paling rentan terhadap parasitasi oleh A. lopezi, (2) preferensi peletakan telur parasitoid pada berbagai instar kutu putih, dan (3) instar kutu putih yang paling sesuai untuk peletakan telur, perkembangan, dan kemunculan imago parasitoid.
METODE PENELITIAN
Kegiatan penelitian dilaksanakan di Ruang Pembiakan Serangga dan Laboratorium Bionomi dan Ekologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian berlangsung sejak bulan Agustus 2014 sampai Agustus 2015. Selama penelitian berlangsung, rata-rata suhu ruangan ±27oC dengan kelembaban relatif ±60%, dan dengan 12 jam terang dan 12 jam gelap.
Penyiapan Bibit Singkong M. esculenta
Bibit singkong yang diperoleh dari pertanaman singkong milik petani di Kecamatan Dramaga dan Sukaraja, Kabupaten Bogor, Jawa Barat digunakan untuk membiakkan P. manihoti. Stek singkong dengan panjang sekitar 17 cm dimasukkan dengan posisi tegak ke dalam ember plastik (t=14 cm, d=11.5 cm), kemudian dimasukkan air sebanyak 250 ml ke dalam ember. Setiap tiga hari ditambahkan air sebanyak 100 ml. Bibit singkong dibiarkan tumbuh selama 3 minggu hingga muncul daun.
Perbanyakan Kutu Putih P. manihoti
P. manihoti yang digunakan dalam percobaan ini berasal dari hasil pembiakan massal di laboratorium. Nimfa instar-1 P. manihoti diinfestasikan pada bibit singkong yang berumur tiga minggu. Dua minggu setelah itu, kutu putih sudah mencapai instar-3 dan siap digunakan untuk pembiakan parasitoid A. lopezi. Sebagian dari nimfa instar-3 tersebut dibiarkan berkembang hingga menjadi imago dan bertelur. Daun yang terserang P. manihoti dipotong-potong dan diinfestasikan pada bibit singkong yang masih sehat. Dengan cara ini, nimfa kutu putih akan berpindah dan berkembang biak pada bibit singkong yang baru.
Selama pembiakan dan penelitian berlangsung, nimfa instar-1 atau crawlers kutu putih berkeliaran pada permukaan rak maupun kurungan. Agar instar-1 ini dapat digunakan untuk pembiakan massal, helaian daun singkong diletakkan tersebar pada rak dan kurungan. Hal ini menyebabkan instar-1 kutu putih akan berkumpul pada daun untuk makan. Sehari kemudian, daun yang telah dipenuhi instar-1 dipindahkan pada bibit singkong yang baru.
Perbanyakan Parasitoid A. lopezi
14
papan, bagian atas dari lembaran plastik, dan bagian samping terbuat dari kain kasa. Pada bagian depan terdapat pintu berukuran (p=15 cm, l=15 cm). Pintu tersebut digunakan untuk memasukkan bibit singkong. Pada permukaan dalam dari atap kurungan digantungkan kapas yang telah diresapi larutan madu 10% sebagai makanan imago parasitoid.
Sekitar 50 pasang imago parasitoid A. lopezi dimasukkan ke dalam kurungan pembiakan. Setelah sekitar dua minggu, tanaman yang telah kering dan juga terdapat mumi P. manihoti (Gambar 3.1) dikumpulkan dengan cara memotong daun dengan menggunakan gunting dan dimasukkan ke dalam kurungan plastik (p=25 cm, l=20 cm, t=20 cm). Kurungan plastik ini digunakan untuk mendapat-kan imago A. lopezi. Sebagian dari imago parasitoid yang muncul digunakan untuk pengujian dan sebagian lainnya digunakan untuk pembiakan massal seperti prosedur di atas. Pemindahan imago parasitoid, baik untuk keperluan pengujian maupun untuk pembiakan massal dilakukan dengan bantuan aspirator. (Lampiran 3)
Gambar 3.1 Mumi kutu P. manihoti
Penyiapan Instar P. manihoti
Nimfa instar-1 diperoleh dari telur P. manihoti yang baru menetas. Instar-1 yang digunakan dalam pengujian yaitu yang telah berumur sekitar satu hari. Instar-2, -3, dan imago diperoleh dengan melakukan prosedur sebagai berikut. Nimfa instar-1 (p=0.41 mm, l=0.17 mm) yang diperoleh dari pembiakan P. manihoti dimasukkan ke dalam kurungan kecil berbentuk tabung (t=47 cm, d=14 cm). Kurungan tersebut terbuat dari mika yang berisi bibit singkong berumur tiga minggu. Lima hari kemudian, nimfa instar-1 (p=0.41 mm, l=0.17 mm) telah menjadi instar-2 (p=0,60 mm, l=0.26 mm) yang siap digunakan untuk pengujian. Prosedur yang sama dilakukan untuk mendapatkan nimfa instar-3 (p=0.86 mm, l=0.39 mm) dan imago (p= 1.25 mm, l=0,63 mm) (Gambar 3.2), yaitu masing-masing 10 dan 15 hari setelah infestasi instar-1. Acuan masa perkembangan setiap instar ini didasarkan pada hasil penelitian Saputro (2013) dan Wardani (2015).
15
Gambar 3.2 Stadium inang kutu putih P. manihoti;(a) imago, (b) nimfa-3, (c) nimfa-1, (d) nimfa-2
Pengujian Kerentanan Instar Inang (Uji Tanpa Pilihan)
Masing-masing 10 ekor nimfa-1, -2, -3, dan imago P. manihoti secara terpisah diinfestasikan pada setiap helai daun singkong dengan menggunakan kuas halus. Selanjutnya, setiap helai daun dimasukkan ke dalam kurungan mika berbentuk silinder (t=7 cm, d=10 cm). Bagian atas kurungan yang juga terbuat dari mika, diberi lubang berbentuk persegi (p=4cm, l=4cm), kemudian ditutupi dengan kain organdi (Lampiran 1). Selanjutnya, seekor imago betina A. lopezi umur 1-2 hari yang telah kawin dimasukkan ke dalam setiap kurungan (Gambar 3.3). Pada dinding kurungan bagian dalam dioleskan setetes madu takaran 0.25 ml tanpa pengenceran dengan menggunakan jarum, madu tersebut berfungsi sebagai makanan parasitoid. Kurungan selanjutnya diberi label yang berisi informasi sesuai keperluan.
Setelah 24 jam, parasitoid dikeluarkan dan kutu putih dipelihara hingga 24 jam berikutnya. Selanjutnya, dilakukan pemeriksaan banyaknya telur parasitoid yang diletakkan di dalam tubuh kutu putih. Untuk maksud tersebut, setiap kutu putih diambil dari daun, kemudian diletakkan di atas gelas objek. Selanjutnya, kutu diberi setetes larutan fisiologis (NaCl) untuk kemudian dibedah. Pembedahan menggunakan jarum mikro dan dilakukan di bawah mikroskop stereo Olympus tipe SZ51 dengan tipe lensa WHSZ10X-H/22 dan perbesaran 4x. Banyaknya telur yang ditemukan pada masing-masing instar inang dicatat. Untuk memastikan bahwa semua telur telah terhitung, kutu putih yang telah dibedah kemudian diamati lagi di bawah mikroskop compound Olympus NEA dengan perbesaran 10x/0.25. Banyaknya inang yang terparasit per parasitoid, banyaknya telur parasitoid yang diletakkan per ulangan, dan banyaknya telur parasitoid yang diletakkan per inang digunakan sebagai kriteria untuk menentukan kerentanan instar inang. Pada percobaan ini digunakan 20 ulangan untuk setiap perlakuan instar inang, atau total sebanyak 800 ekor P. manihoti dan 80 ekor imago betina A. lopezi.
d a c
a a
b a
1.25 mm
0.86 mm
[image:35.595.107.347.126.310.2]16
Gambar 3.3 Imago A. lopezi; (a) betina, (b) jantan
Pengujian Preferensi Instar Inang (Uji Dua-Pilihan)
Sepuluh ekor P. manihoti dari setiap instar secara terpisah diinfestasikan pada sehelai daun singkong dengan menggunakan kuas halus. Daun kemudian dimasukkan ke dalam kurungan mika berbentuk silinder, seperti yang digunakan pada pengujian kerentanan instar inang. Seekor imago betina A. lopezi berumur 1-2 hari dimasukkan ke dalam kurungan. Dengan menggunakan jarum bertangkai, dinding kurungan diolesi madu dengan takaran 0.25 ml sebagai makanan parasitoid. Percobaan ini menggunakan enam perlakuan yang masing-masing terdiri dari dua instar kutu putih yang berbeda. Kombinasi pasangan instar inang yang digunakan yaitu nimfa-1 dengan nimfa-2, nimfa-1 dengan nimfa-3, nimfa-1 dengan imago, nimfa -2 dengan instar-3, instar-2 dengan imago, dan nimfa-3 dengan imago.
Setelah 24 jam, parasitoid dikeluarkan dari kurungan dan kutu putih dibiarkan hidup selama 24 jam berikutnya. Selanjutnya, setiap kutu putih diambil dari daun dan diletakkan di atas gelas objek dan diberi setetes larutan fisiologis (NaCl) untuk dibedah seperti yang dilakukan pada pengujian kerentanan instar inang di atas. Kriteria yang digunakan untuk menentukan preferensi yaitu banyaknya inang yang diparasit dan banyaknya telur yang diletakkan pada setiap instar inang. Percobaan ini menggunakan 20 ulangan untuk setiap perlakuan instar inang, dengan total sebanyak 2600 ekor P. manihoti dan 120 ekor parasitoid yang digunakan dalam pengujian.
Pengujian Kesesuaian Instar Inang
Masing-masing 20 ekor nimfa-1, -2, -3, dan imago P. manihoti secara terpisah diinfestasikan pada tunas kentang G3 yang diperoleh dari Pangalengan, Bandung, Jawa Barat. Selanjutnya, kentang dimasukkan ke dalam kurungan mika berbentuk silinder (t=20 cm, d=12 cm) yang bagian atas kurungan atau tutupnya diberi lubang berukuran 4 cm x 4 cm dan ditutup kain organdi (Lampiran 2). Dua ekor imago betina parasitoid dimasukkan ke dalam tabung selama 24 jam agar meletakkan telur pada kutu putih. Kutu putih dan larva parasitoid yang ada di dalam tubuh inang dibiarkan berkembang.
Pengamatan banyaknya imago parasitoid yang muncul dilakukan setiap hari, dan dibedakan berdasarkan jenis kelaminnya. Parasitoid yang muncul dikumpulkan ke dalam tabung eppendorf ukuran 1 ml yang berisi alkohol 70% sebanyak 0.5 ml. Pengukuran panjang tibia tungkai belakang sebelah kiri dari imago betina dilakukan dengan menggunakan mini tool di bawah mikroskop stereo Olympus tipe SZ51 dengan tipe lensa WHSZ10X-H/22. Kriteria yang
17
digunakan untuk menentukan kesesuaian instar inang adalah banyaknya parasitoid yang muncul per inang, nisbah kelamin, masa perkembangan, dan ukuran parasitoid. Percobaan dilakukan sebanyak 5 ulangan.
Analisis Data
Analisis ragam dilakukan untuk memeriksa pengaruh instar inang terhadap rataan banyaknya inang yang terparasit, banyaknya telur yang diletakkan per inang, masa perkembangan pradewasa parasitoid, banyaknya parasitoid yang muncul, nisbah kelamin, dan ukuran parasitoid, yang dilanjutkan dengan uji Tukey pada taraf 5%. Preferensi parasitoid terhadap pasangan instar inang diperiksa melalui uji t. Seluruh pengolahan data dilakukan dengan bantuan program SPSS 16.
HASIL
Kerentanan Instar Inang (Uji Tanpa Pilihan)
Pada uji tanpa pilihan, semua instar inang mampu diparasit oleh A. lopezi (Tabel 3.1). Perbedaan instar inang berpengaruh sangat nyata (F=50.63; db=3, 79; P<0.001) terhadap banyaknya inang yang diparasit. Parasitisasi pada nimfa-2, nimfa-3, dan imago berkisar 7-8 ekor, yang berbeda sangat nyata (P<0.001) dengan pada nimfa-1 (3.25 ekor). Banyaknya telur yang diletakkan oleh parasitoid juga dipengaruhi oleh instar inang (F=18.79; db=3, 79; P<0.001) (Gambar 3.4). Pada inang nimfa-1, rataan banyaknya telur parasitoid yang diletakkan yaitu 3.70 butir, jauh lebih sedikit dibandingkan pada instar lainnya yang berkisar 9-10 butir (Tabel 3.1, Lampiran 4).
Selama pengamatan inang terparasit, sering dijumpai adanya kutu putih yang mati mengerut. Kematian ini diduga karena adanya kegiatan penusukan ovipositor yang dilanjutkan dengan pengisapan cairan inang oleh imago parasitoid (host-feeding). Besarnya kematian semacam ini berbeda di antara berbagai instar inang (F=20.59; db=3, 79; P<0.001), dengan yang terbanyak terjadi pada inang nimfa-1 yaitu 2.60 ekor dan terendah pada imago yaitu 0.20 ekor.
Tabel 3.1 Parasitisasi (
x
±SD) A. lopezi pada berbagai instar inang1 InstarInang
Banyaknya inang terparasit (ekor)
Banyaknya telur parasitoid (butir)
Banyaknya inang yang mati (ekor)
Nimfa-1 3.25 ± 1.94 a 3.70 ± 2.30 a 2.60 ± 1.14 a
Nimfa-2 7.15 ± 1.04 b 9.95 ± 2.80 b 1.05 ± 1.05 b
Nimfa-3 7.05 ± 1.09 b 10.60 ± 4.89 b 0.70 ± 1.26 bc
Imago 8.15 ± 1.14 b 9.95 ± 2.80 b 0.20 ± 0.41 c
18
0.025 mm
Gambar 3.4 Telur A. lopezi
Preferensi Instar Inang (Uji Dua-Pilihan)
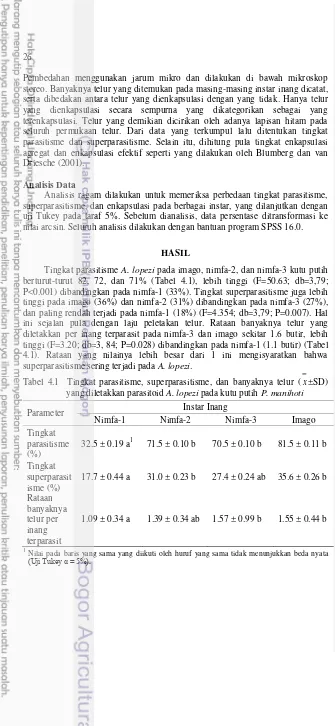
[image:38.595.55.384.316.814.2]Berdasarkan uji pilihan berpasangan, parasitoid A. lopezi lebih memilih nimfa-2, -3, dan imago dibandingkan nimfa-1 (P<0.001). Rataan banyaknya inang yang terparasit yaitu 0.90 hingga 2.30 ekor pada nimfa-1, jauh lebih rendah dibandingkan pada nimfa-2 (7.55 ekor) (t=-9.980; db=38 ; P<0.001), nimfa-3 (8.05 ekor) (t=-10.347; db=38 ; P<0.001), dan imago (7.40 ekor) (t=-9.810; db=38 ; P<0.001). Begitu pula banyaknya telur parasitoid yang diletakkan per inang pada nimfa-1 (0.75-0.99 butir) lebih rendah dibandingkan pada instar lainnya (1.20-1.39 butir). Terdapat perbedaan nyata antara rataan banyaknya inang terparasit pada nimfa-2 (4.85 ekor) dengan nimfa-3 (7.45 ekor) (t=-5.186; db=38 ; P<0.001), serta banyaknya telur parasitoid yang diletakkan per inang yaitu 1.05 butir pada nimfa-2 dan 1.21 butir pada nimfa-3. Banyaknya inang yang terparasit dan banyaknya telur parasitoid yang diletakkan tidak berbeda pada pasangan perlakuan inang imago dengan nimfa-2 dan nimfa-3 (P<0.001) (Tabel 3.2, Lampiran 5).
Tabel 3.2 Preferensi (
x
±SD) parasitoid pada berbagai pasangan instar inangPasangan instar inang
Banyaknya inang terparasit (ekor)
Banyaknya telur parasitoid/inang terparasit (butir)
Nimfa-1 2.30 ± 1.89 a 0.83 ± 0.44 a
Nimfa-2 7.55 ± 1.39 b 1.23 ± 0.28 b
Nimfa-1 2.45 ± 1.73 a 0.99 ± 0.48 a
Nimfa-3 8.05 ± 0.99 b 1.20 ± 0.21 a
Nimfa-1 0.90 ± 0.97 a 0.75 ± 0.55a
Imago 7.40 ± 1.82 b 1.39 ± 0.34 b
Nimfa-2 4.85 ± 1.73 a 1.05 ± 0.11 a
Nimfa-3 7.45 ± 1.43 b 1.21 ± 0.22 a
Nimfa-2 6.35 ± 1.56 a 1.19 ± 0.23 a
Imago 7.05 ± 1.79 a 1.64 ± 1.21 a
Nimfa-3 6.30 ± 1.66 a 1.15 ± 0.16 a
19
Kesesuaian Instar Inang
Parasitoid A. lopezi mampu berkembang pada berbagai instar inang yang diujikan. Namun demikian, perbedaan instar inang berpengaruh sangat nyata terhadap masa perkembangan pradewasa parasitoid jantan (F=17.49; db=3, 107; P<0.001) maupun betina (F=41.66; db=3, 94; P<0.001). Masa perkembangan pradewasa parasitoid pada inang nimfa-1 yaitu 24.5 hari untuk jantan dan 32.0 hari untuk betina, lebih lama dibandingkan pada nimfa lainnya (P<0.001). Masa perkembangan pradewasa parasitoid yang paling singkat terjadi pada inang imago P. manihoti, yaitu berkisar 15-16 hari (Tabel 3.3).
Tabel 3.3 Masa perkembangan pradewasa parasitoid (
x
±SD) pada berbagai instar inang1Instar inang Masa perkembangan pradewasa (hari)
Jantan Betina
Nimfa-1 24.50 ± 4.08 a 32.00 ± 1.41 a
Nimfa-2 19.09 ± 3.76 b 21.27 ± 3.12 b
Nimfa-3 18.08 ± 4.03 bc 19.50 ± 3.99 b
Imago 16.19 ± 0.66a c 15.90 ± 0.83 c
1Nilai pada kolom yang sama yang diikuti oleh huruf yang sama tidak menunjukkan beda nyata (Uji Tukey α = 5%)
Selain terhadap masa perkembangan pradewasa, perbedaan instar inang berpengaruh nyata (F=12.13; db=3, 19; P<0.001) terhadap rataan banyaknya keturunan parasitoid yang muncul dan terhadap nisbah kelamin (F=7.00; db=3, 19; P=0.003). Pada inang nimfa-1, banyaknya imago parasitoid yang muncul 4.00 ekor, jauh lebih rendah dibandingkan pada instar lainnya yang berkisar 11-13 ekor (Tabel 3.4). Hal ini tampaknya terkait dengan perilaku imago parasitoid yang lebih sedikit meletakkan telur pada nimfa-1 seperti disebutkan terdahulu. Keturunan parasitoid yang muncul dari inang nimfa-1 lebih banyak jantan, yaitu dengan nisbah 0.87, berbeda nyata (P=0.002) dengan yang muncul dari inang imago yaitu dengan nisbah 0.27 (Tabel 3.4).
Tabel 3.4 Banyaknya keturunan dan nisbah kelamin parasitoid (
x
±SD) yang muncul dari berbagai instar inang1Instar inang Keturunan (ekor) Nisbah kelamin
(jantan/total keturunan)
Nimfa-1 4.00 ± 2.73 a 0.87 ± 0.22 a
Nimfa-2 12.80 ± 2.68 b 0.52 ± 0.29 ab
Nimfa-3 12.40 ± 1.34 b 0.64 ± 0.17 ab
Imago 11.40 ± 3.43 b 0.27 ± 0.13 b
1Nilai pada kolom yang sama yang diikuti oleh huruf yang sama tidak menunjukkan beda nyata (Uji Tukey α = 5%)
[image:39.595.90.400.542.614.2]20
1.30 mm, jauh lebih pendek dibandingkan yang muncul dari instar lainnya yang berkisar 1.65-1.89 mm (Tabel 3.5). Begitu pula ukuran panjang tibianya lebih pendek.
Tabel 3.5 Ukuran panjang tubuh dan tibia (
x
±SD) imago betina parasitoid yang muncul dari berbagai instar inang1Instar inang Panjang (mm) n
Tubuh Tibia kiri
Nimfa-1 1.30 ± 0.00 a 0.35 ± 0.07 a 2
Nimfa-2 1.65 ± 0.28 ab 0.47 ± 0.07 a 30
Nimfa-3 1.89 ± 0.34 c 0.52 ± 0.07 c 22
Imago 1.79 ± 0.19 b 0.45 ± 0.05 ab 41
1
Nilai pada kolom yang sama yang diikuti oleh huruf yang sama tidak menunjukkan beda nyata
(Uji Tukey α = 5%)
PEMBAHASAN
Penelitian mengungkapkan bahwa parasitoid A. lopezi meletakkan telur pada seluruh instar P. manihoti. Walaupun demikian, secara umum nimfa-3 dan imago paling banyak diparasit. Hal ini sejalan dengan hasil penelitian Chong dan Oeting (2007) yang mendapatkan bahwa parasitoid Anagyrus sp lebih memilih instar Phenacoccus sp yang berukuran lebih besar untuk peletakan telurnya. Bertschy et al. (2000) juga melaporkan bahwa tingkat parasitisasi Aenisius vexans pada inang Phenacocuccus herreni lebih tinggi pada nimfa-3 dan imago. Menurut Quicke (1997) perbedaan ukuran tubuh inang menentukan jumlah dan kualitas makanan yang tersedia bagi parasitoid. Dalam hal ini, tingginya tingkat parasitasi dari A. lopezi pada imago P. manihoti diperkirakan terkait dengan pemenuhan nutrisi yang lebih banyak dan baik bagi perkembangan keturunan parasitoid, dan agar keturunan tersebut mampu menjadi imago betina yang memiliki kebugaran yang baik (Godfray 1994). Berbeda dengan parasitisasi, kegiatan host-feeding lebih banyak terjadi pada nimfa-1. Menurut Neuenschwander dan Sullivan (1987) keefektifan parasitoid A. lopezi dalam mengendalikan P. manihoti salah satunya disebabkan oleh adanya perilaku host-feeding.
Dalam penelitian ini ditunjukkan bahwa parasitoid yang muncul dari instar lanjut (nimfa-2, -3, dan imago) memiliki masa perkembangan pradewasa yang lebih singkat, persentase betina di sekitar 50% atau lebih, serta ukuran tubuhnya lebih besar. Lebih singkatnya masa perkembangan pradewasa mungkin terkait dengan pemenuhan nutrisi yang lebih lengkap dan lebih cepat diperoleh pada instar lanjut, sehingga ketika penyerapan nutrisi telah cukup, maka parasitoid dapat semakin cepat berkembang menjadi imago. Hal serupa terjadi pula pada penelitian Sagarra dan Vincent (1999) yang mendapatkan bahwa masa perkembangan parasitoid A. kamali pada kutu putih nimfa-3 dan imago lebih cepat 9.5 hari dibandingkan pada nimfa-1 dan -2.
21
(1994) parasitoid memilih inang yang berukuran kecil untuk peletakan telur jantan, sementara inang yang berukuran besar untuk telur betina. Selain itu, parasitoid A. lopezi yang muncul dari instar lanjut berukuran lebih besar daripada yang muncul dari nimfa-1. Ukuran tubuh parasitoid, terutama betina, biasanya berkorelasi dengan kebugaran. Betina yang berukuran besar umumnya meletakkan telur yang lebih banyak selama hidupnya (van Dijken dan van Alphen 1991).
Hasil penelitian yang dilakukan menawarkan implikasi praktis bagi upaya pembiakan massal parasitoid A. lopezi. Berdasarkan pertimbangan preferensi imago parasitoid, masa perkembangan pradewasa yang lebih singkat, nisbah kelamin yang bias betina, ukuran tubuh yang lebih besar pada inang instar lanjut, kiranya instar P. manihoti nimfa-3 merupakan inang yang paling tepat untuk digunakan dalam pembiakan massal parasitoid.
KESIMPULAN
Parasitoid A. lopezi lebih banyak memarasit kutu P. manihoti nimfa-2 dan -3 serta imago yang belum membentuk ovisak. Hal ini ditunjukkan oleh banyaknya inang yang terparasit dan banyaknya telur yang diletakkan. Pada percobaan pilihan berpasangan, nimfa-2, -3 dan imago lebih dipilih oleh parasitoid untuk peletakan telur dibandingkan nimfa-1. Parasitoid yang muncul dari inang yang berukuran besar, masa perkembangan pradewasanya lebih singkat, jumlah keturunannya lebih banyak betina, dan ukuran tubuhnya lebih besar. Oleh karena itu, nimfa-3 lebih sesuai digunakan sebagai inang untuk keperluan pembiakan massal parasitoid.
DAFTAR PUSTAKA
Bertschy C, Turlings TCJ, Belloti A, Dorn S. 2000. Host stage preference and sex allocation in Aenasius vexans, an encyrtid parasitoid of the cassava mealybug. Entomol Exp Appl. 95(3):283-291.
Chong JH, Oetting DR. 2007. Progeny finess of the mealybug parasitoid Anagyrus SP.NOV.NR.Sinope (Hymenoptera: Encyrtidae) as affected by brood size, sex ratio and host quality. Florida Entomologist. 90(4): 656-664. Driesche RG, Belloti A, Herrera CJ, Castilo JA. 1986. Encapsulation rates of two encyrtids parasitoids by two Phenacoccus spp of cassava mealybugs in Colombia. Entomol Exp Appl. 42:79-82.
[FAO] Food and Agriculture Organisation of the United Nations. 2011. Report of capacity building for spread prevention and management of cassava pink mealybug in the Greater Mekong Subregion. Bangkok [TH]: FAO Published. pp 56.
Giordanengo P, Nenon JP. 1990. Melanization and encapsulation of eggs and larvae of Epidinocarsis lopezi by its host Phenacoccus manihoti; effects of superparasitism and egg laying patterns. Entomol Exp Appl. 56: 155-163. Godfray HCJ. 1994. Parasitoids Behavioral and Evolutionary Ecology. New
22
Karyani RD. 2015. Pengujian kesesuaian inang parasitoid, Anagyrus lopezi De Santis (Hymenoptera: Encyrtidae) terhadap kutu putih yang berasosiasi dengan singkong (Manihot esculanta Crantz) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Lefroy D. 2010. CIAT: Cassava under threat: Pest and disease outbreaks put SE Asia onhigh alert [Internet]. [diunduh 2015 Mei 12]. Tersedia pada:http://www.ciatnews.cgiar.org/2010/01/20/cassava-under-threat/. Muniappan R, Shepard BM, Watson GW, Carner GR, Rauf A, Sartiami D,
Hidayat P, Afun JVK, Goergen G, Rahman AKMZ. 2011. New records of invasive insects (Hemiptera: Sternorrhyncha) in Southern Asia and West Africa. J Agr and Urban Entomol. 26(4):167-174.
Neuenschwander P, Sullivan D. 1987. Interactions between the endophagous parasitoid Epidinocarsis lopezi and its host, Phenacoccus manihoti. Insect Sci Applic. 8:857-859.
Norgaard RB. 1988. The biological control of cassava mealybug in Africa. Amer J Agr Econ. 70(2):366-371.
Nweke F. 2009. Controlling cassava mosaic virus and cassava mealybug in Sub Saharan Africa. IFPRI Discussion Paper 00912.
Quicke DLJ. 1997. Parasitic Wasps. London (GB): Chapman & Hall.
Sagarra LA, Vincent C. 1999. Influence of host stage on oviposition, development, sex ratio, and survival of Anagyrus kamali Moursi (Hymenoptera: Encyrtidae), a parasitoid of the Hibiscus mealybug, Maconellicoccus hirsutus Green (Homoptera: Pseudococcidae). Biological Control. 15:51-56.
Saputro AR. 2013. Biologi dan potensi peningkatan populasi kutu putih singkong, Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae): Hama pendatang baru di Indonesia [skripsi]. Bogor (ID): Institut Pertanian Bogor. Schulthess F, Baumgartner JU, Delucchi V, Guttierez AP. 1991. The influence of
the cassava mealybug, Phenacoccus manihoti Mat-Ferr (Homoptera: Psedococcidae) on yield formation of cassava, Manihot esculanta Crantz. J Appl Entomol. 111:155-165.
van Dijken JJ, Alphen van JJM. 1991.Sex allocation in Epidinocarsis lopezi : The influence of host size distribution and its effect on the population sex ratio in cassava fields in Africa. Redia. 74:195-201.
van Dijken JJ, Neuenschwander P, Alphen JJM, Hammond WNO. 1991. Sex ratios in field populations of Epidinocarsis lopezi, an exotic parasitoid of the cassava mealybug in Africa. Ecol Entomol. 16(2):233-240.
Wardani N. 2015. Kutu putih singkong, Phenacoccus manihoti Matile-Ferrero (Hemiptera: Pseudococcidae), hama invasif baru di Indonesia [disertasi]. Bogor (ID): Institut Pertanian Bogor.