(ToCV) DAN TOMATO INFECTIOUS CHLOROSIS VIRUS
(TICV) DENGAN REVERSE-TRANSCRIPTION POLYMERASE
CHAIN REACTION (RT-PCR)
AMELIA ANDRIANI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
AMELIA ANDRIANI. Deteksi Diferensial Tomato Chlorosis Virus (ToCV) dan
Tomato Infectious Chlorosis Virus (TICV) dengan Reverse Transcription-Polymerase Chain Reaction (RT-PCR). Dibimbing oleh GEDE SUASTIKA.
Tanaman tomat (Lycopersicon esculentum Mill.) merupakan salah satu komoditas hortikultura yang sangat potensial untuk dikembangkan. Namun, upaya peningkatan produksi dan mutu tomat untuk memenuhi kebutuhan nasional dan ekspor menghadapi banyak kendala, salah satunya adalah gangguan organisme pengganggu tumbuhan (OPT). Beberapa tahun terakhir ini terdapat penyakit baru yang menyerang tanaman tomat yang disebabkan oleh Tomato chlorosis virus
(ToCV) dan Tomato infectious chlorosis virus (TICV). Penyakit yang diinduksi oleh ToCV maupun TICV tidak dapat dibedakan gejalanya. Penelitian ini bertujuan untuk mendapatkan metode deteksi diferensial TICV dan ToCV melalui
reverse transcription polymerase chain reaction (RT-PCR). Sampel tanaman tomat yang positif terinfeksi tunggal oleh ToCV maupun TICV, dan yang positif terinfeksi ganda oleh TICV dan ToCV diperoleh dari hasil penelitian terdahulu. Untuk menguji penerapan metode RT-PCR terhadap sampel dari lapangan, beberapa sampel juga diperoleh dari sentra produksi tomat di beberapa daerah seperti Cianjur, Cipanas, Lembang, dan Garut. Sampel daun yang diambil dari lapangan di ekstraksi dan dideteksi dengan metode RT-PCR dan PCR, kemudian hasil PCR dielektroforesis. Untuk dapat membedakan virus ToCV dan TICV yang menginfeksi tanaman tomat, deteksi dilakukan dengan menggunakan primer khusus, yaitu ToCV-CF (5’GTGTCAGGCCATTGTAAACCAAG-3’) ToCV-CR (5’CACAAAGCGTTTCTTTTCATAAGCAGG-3’), TICV-CF (5’AATCGGTAG TGACACGAGTAGCATC-3’) dan TICV-CR (5’-CTTCAAACATCCTCCATCT GCC-3’) yang dapat mengamplifikasi virus secara terpisah. Hasil penelitian ini menunjukkan bahwa pasangan primer ToCV dan TICV benar-benar spesifik hanya mendeteksi virusnya masing-masing. Panjang pita produk RT-PCR untuk ToCV diperoleh 360 bp, sedangkan untuk TICV adalah 417 bp. Kedua pasang primer untuk ToCV dan TICV yang dicampur dapat digunakan untuk mendeteksi kedua virus ini, baik yang menginfeksi tunggal maupun bersama-sama dalam jaringan tanaman tomat. Selain utuk mendeteksi virus, metode RT-PCR dengan kedua pasang primer ini juga dapat diterapkan untuk diagnosis.
Kata kunci: Tomato chlorosis virus (ToCV), Tomato infectious chlorosis virus
(ToCV) DAN TOMATO INFECTIOUS CHLOROSIS VIRUS
(TICV) DENGAN REVERSE-TRANSCRIPTION POLYMERASE
CHAIN REACTION (RT-PCR)
AMELIA ANDRIANI
A34060895
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
LEMBAR PENGESAHAN
Judul : Deteksi Diferensial Tomato Chlorosis Virus (ToCV) dan
Tomato Infectious Chlorosis Virus (TICV) dengan
Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
Nama : Amelia Andriani
NRP : A34060895
Disetujui,
Diketahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, M.Sc. NIP. 19640204 199002 1 002
Tanggal Lulus :
Pembimbing I
Penulis dilahirkan di Cirebon pada tanggal 10 April 1988 dari pasangan Yos Ristono (Alm) dan Hj. Mutmainah. Penulis merupakan anak keempat dari empat bersaudara.
Penulis menyelesaikan pendidikan menengah umum di SMA Negeri 4 Cirebon pada tahun 2006. Pada tahun yang sama, penulis diterima sebagai mahasiswa program studi Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Ujian Saringan Masuk IPB (USMI). Selama kuliah, penulis mengikuti kegiatan kepanitiaan dan organisasi di IPB, yaitu Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) sebagai Staf Divisi Kewirausahaan periode 2007-2008 dan Staf Divisi Pengembangan Minat dan Bakat 2008-2009.
PRAKATA
Puji serta syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul “Deteksi Diferensial Tomato Chlorosis Virus (ToCV) dan Tomato Infectious Chlorosis Virus (TICV) dengan Reverse Transcription-Polymerase Chain Reaction (RT-PCR)”. Skripsi ini disusun sebagai syarat untuk memperoleh gelar Sarjana Pertanian pada program studi Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Rasa terimakasih yang tulus penulis sampaikan untuk kedua orang tua Yos Ristono (Alm), Hj. Mutmainah, kakak-kakakku Deni Andrianto, Erwin Rianto, dan Triani Risnawati, serta keluarga tercinta yang selalu memberikan kasih sayang, semangat, nasihat, dan doa bagi putrinya. Terima kasih pula kepada Dr. Ir. Gede Suastika, M.Sc. yang telah bersedia menjadi dosen pembimbing dan telah membimbing, memberikan ilmu, dan perhatiannya selama penelitian, serta memberikan arahan kepada penulis sehingga skripsi ini dapat terselesaikan dengan baik. Penulis juga mengucapkan terima kasih kepada Dr. Ir. I Wayan Winasa, M.Si. selaku dosen penguji tamu yang telah memberikan masukan dan menyediakan waktu serta perhatiannya.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada rekan-rekan Laboratorium Virologi Tumbuhan Mba Tuti, Mba Pipit, Mba Devi, Mba cici, Pak Irwan, Ibu Ifa, Ibu Rita, Herlie, Laras, Lara, Dillah yang telah membantu penulis selama di laboratorium. Terima kasih kepada temanku Alghienka Defaosandi atas bantuannya terhadap penulis. Terima kasih juga untuk sahabat-sahabatku tercinta, Sari Nurulita, Lia Nazirah, dan Vani Nur Oktaviany yang selalu membantu dan memberikan motivasi kepada penulis, serta kepada Gilang Aditya Rahayu yang senantiasa menemani, memberikan motivasi, doa, dan kasih sayang yang tulus. Terima kasih juga kepada teman-teman DPT angkatan 41, 42, 43, 44, 45 serta pihak-pihak lain yang tidak dapat penulis sajikan satu persatu. Penulis berharap, semoga hasil penelitian ini dapat memberikan manfaat bagi yang memerlukan
Bogor, Januari 2011
Halaman
Tomato Infectious Chlorosis Virus (TICV) ... 5
Reverse Transcription-PCR (RT-PCR) ... 7
Penerapan Metode RT-PCR untuk Sampel dari Lapangan ... 24
KESIMPULAN DAN SARAN ... 28
Kesimpulan ... 28
Saran ... 28
Halaman
1 Reagensia PCR dan konsentrasi yang diperlukan untuk validasi pasangan primer ToCV dan TICV yang digunakan secara terpisah
terhadap 3 template cDNA yang berbeda ………. 16
2 Reagensia PCR dan konsentrasi yang diperlukan untuk validasi pasangan primer ToCV dan TICV yang digunakan secara
bersamaan1………... 17
DAFTAR GAMBAR
Halaman
1 Gejala penyakit klorosis pada tanaman tomat yang disebabkan oleh
ToCV……….. 3
2 Partikel TICV berbentuk seperti benang, memanjang (filamentous) dan lentur (flexuous) (Liu et al. 2000)……… 6 3 Gejala penyakit klorosis pada tanaman tomat yang disebabkan oleh
TICV………..………... 7
4 Gejala penyakit klorosis pada daun tomat yang disebabkan oleh ToCVdan/atauTICV ... 18
5 Gejala penyakit klorosis akibat infeksi ToCV dan/atau TICV di areal pertanaman tomat di wilayah Cipanas (kiri), Cianjur (tengah), dan Lembang (kanan)………... 19
6 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan pasangan primer spesifik ToCV-CF dan ToCV-CR terhadap sampel daun tanaman tomat yang positif terinfeksi tunggal oleh ToCV (lajur 1), positif terinfeksi tunggal oleh TICV (lajur 2), dan positif terinfeksi ganda oleh kedua virus ToCV dan TICV (lajur 3). Lajur 4 adalah kontrol negatif dari tanaman sehat dan lajur M adalah marker 100 bp DNA ladder ………... 21
7 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan pasangan primer spesifik TICV-CF dan TICV-CR terhadap sampel daun tanaman tomat yang positif terinfeksi tunggal oleh ToCV (lajur 1), positif terinfeksi tunggal oleh TICV (lajur 2), dan positif terinfeksi ganda oleh kedua virus ToCV dan TICV (lajur 3). Lajur 4 adalah kontrol negatif dari tanaman sehat dan lajur M adalah marker 100 bp DNA ladder ………... 22
8 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan campuran primer ToCV-CF, ToCV-CR, TICV-CF, dan TICV-CR terhadap sampel daun tanaman tomat yang positif terinfeksi tunggal oleh ToCV (lajur 1), positif terinfeksi tunggal oleh TICV (lajur 2), dan positif terinfeksi ganda oleh kedua virus ToCV dan TICV (lajur 3). Lajur 4 adalah kontrol negatif dari tanaman sehat dan lajur M adalah marker 100 bp DNA ladder ... 24
9 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan campuran primer ToCV-CF, ToCV-CR, TICV-CF, dan TICV-CR terhadap sampel daun tanaman tomat yang bergejala klorosis dari Lembang (lajur 1 dan 3), Cipanas (lajur 2), Cianjur (lajur 4), Garut (lajur 5). Lajur 6 adalah kontrol negatif dari tanaman sehat dan lajur M adalah marker 100 bp DNA
PENDAHULUAN
Latar Belakang
Tanaman tomat (Lycopersicon esculentum Mill.) merupakan salah satu komoditas hortikultura yang sangat potensial untuk dikembangkan, karena
mempunyai nilai ekonomi yang cukup tinggi dan potensi ekspor yang besar.
Upaya peningkatan produksi dan mutu tomat untuk memenuhi kebutuhan nasional
dan ekspor menghadapi banyak kendala, salah satunya adalah gangguan
organisme pengganggu tanaman (OPT) (Maskar & Gafur 2006). Tanaman tomat
merupakan salah satu tanaman yang rentan terhadap infeksi virus. Beberapa jenis
virus telah dilaporkan dapat menyerang tanaman tomat, diantaranya yaitu
Cucumber Mosaik Virus (CMV), Tobacco Mosaik Virus (TMV), dan Pepper Yellow Leaf Curl Virus (PepYLCV) (Bambang 2008).
Beberapa tahun terakhir ini terdapat penyakit baru yang menyerang tanaman
tomat yang disebabkan oleh virus yang disebut dengan penyakit klorosis. Penyakit
klorosis ini telah banyak dilaporkan menyerang tanaman tomat di berbagai negara
penghasil tomat dunia (Dalmon et al. 2008; Louro et al. 2000). Pertama kali penyakit klorosis ini dilaporkan menyerang tanaman tomat di daerah California,
Amerika Serikat pada tahun 1989 (Duffus et al. 1996; Wisler et al. 1996, 1998b). Beberapa tahun kemudian penyakit ini dengan cepat menyebar ke seluruh dunia
seperti Yunani (Dovas et al. 2002), Perancis (Jacquemond et al. 2008), Italia (Parella 2007; Vaira et al. 2002), Spanyol (Navas-Castillo et al. 2000), dan Indonesia. Menurut Suastika et al. (2010), penyakit klorosis pada tanaman tomat telah menyebar di daerah sentra produksi tomat di Jawa, Bali, dan Lombok.
Gejala utama penyakit klorosis yaitu menguningnya jaringan intervenal di
antara tulang daun tomat terutama daun-daun tua, mirip dengan gejala yang
disebabkan oleh kekurangan unsur hara (Accotto et al. 2001; Navas-Castillo et al. 2000). Wisler et al. (1998a) juga menerangkan bahwa gejala menguning awalnya terjadi pada daun tua di bagian bawah yang kemudian secara bertahap akan
2
ukuran buah tomat dan mengganggu proses pemasakan buah, sehingga
mengakibatkan kerugian ekonomi (Navas-Castillo et al. 2000).
Berdasarkan hasil penelitian, penyakit klorosis pada tomat disebabkan oleh
dua virus yang berbeda, yaitu Tomato chlorosis virus (ToCV) and Tomato infectious chlorosis virus (TICV) (Duffus et al. 1996; Suastika et al. 2010; Wisler
et al. 1998b). Penyakit yang diinduksi oleh ToCV maupun TICV tidak dapat dibedakan gejalanya (Dovas et al. 2002). Gejala yang muncul juga akan sama bila kedua virus ini bersama-sama menginfeksi tanaman tomat (Wintermantel et al. 2008). Oleh karena itu, diperlukan suatu metode yang dapat mendeteksi kedua virus ini secara terpisah (differensial diagnostic method). Pada penelitian ini, didesain suatu primer yang dapat digunakan dalam reverse transcription polymerase chain reaction (RT-PCR) yang dapat mengamplifikasi sebagian genom ToCV dan TICV secara terpisah.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan metode deteksi diferensial TICV
dan ToCV melalui RT-PCR.
Manfaat Penelitian
Metode deteksi diferensial TICV dan ToCV yang diperoleh dalam
penelitian ini akan sangat berguna bagi Badan Karantina Tumbuhan Indonesia
dalam melaksanakan tugasnya sebagai filter masuknya virus tumbuhan ke wilayah
TINJAUAN PUSTAKA
Tomato Chlorosis Virus (ToCV)
ToCV merupakan virus tanaman tomat yang termasuk ke dalam genus
Crinivirus, famili Closteroviridae yang terbatas pada jaringan floem. Virus ini pertama kali menyerang tanaman tomat di rumah kaca di daerah Florida
utara-tengah sejak tahun 1989 (Wisler et al. 1996, 1998b) dan menyebar dengan cepat ke seluruh dunia. Keberadaan ToCV telah dilaporkan di berbagai negara, seperti
Spanyol (Navas-Castillo et al. 2000), Portugal (Louro et al. 2000), Yunani (Dovas
et al. 2002), Perancis (Jackuemond et al. 2008), dan Taiwan (Tsai et al. 2004). Bahkan diduga ToCV sudah tersebar di Indonesia.
Gejala tanaman tomat yang terinfeksi oleh ToCV yaitu menguningnya daun
menyerupai gejala kekurangan nutrisi, kemudian gejala menguning berlanjut
hingga ke jaringan intervenal di antara tulang daun (interveinal yellowing). Klorosis awalnya terjadi pada daun-daun tua di bagian bawah, kemudian
berkembang ke bagian pucuk tanaman (Gambar 1). Gejala lanjut menyebabkan
daun menjadi lebih tebal dan kriting, serta mudah rapuh jika dipatahkan
(Navas-Castillo et al. 2000).
Gambar 1 Gejala penyakit klorosis pada tanaman tomat yang disebabkan oleh
ToCV
4
terdiri atas kapsid, kapsid tersebut tidak mempunyai envelope, kapsid atau
nukleokapsid memanjang dengan simetri helix. ToCV merupakan kelompok RNA
dengan panjang partikel 800-850 nm (Wintermantel et al. 2005). Virus ini mempunyai dua jenis genom (bipartite) berupa RNA utas tunggal single-stranded
RNA (ssRNA), yaitu RNA 1 dan RNA 2 yang masing-masing berukuran 7,8 dan
8,2 kbp (Wisler et al. 1998b). RNA 1 memiliki 8595 nukleotida, terdiri dari empat open reading frames (ORFs) dan mengkodekan protein yang terlibat dalam replikasi virus. RNA 2 terdiri dari sembilan ORFs dengan panjang 8247
nukleotida, dan mengkodekan beragam protein yang terlibat dalam perlindungan
genom yaitu sebuah protein kecil yang hidrofobik, sebuah protein yang terkait
dengan virion dengan ukuran 55-60 kDa, dan dua jenis protein mantel yaitu main capsid protein (CP) dan minor capsid protein (CPm). Selubung protein minor (CPm) pada ToCV membentuk bagian ekor atau ujung virion yang berperan
dalam penularan dengan kutu kebul (Wintermantel et al. 2005). CPm dari ToCV memiliki ksepesifikan dengan reseptor Trialeurodes vaporarorium dan Bemisia tabaci. Menurut Wintermantel & Wisler (2006), kespesifikan virus dan vektornya sangat ditentukan oleh reseptor yang ada pada stilet serangga dengan CP dari
virus bersangkutan.
Virus ToCV terbatas pada jaringan floem (Medina et al. 2003) dan terakumulasi pada tingkat rendah pada tanaman yang terinfeksi, sehingga
pembuatan antiserum masih sulit untuk dilakukan. Sampai saat ini hanya
antiserum poliklonal untuk TICV yang baru tersedia (Duffus et al. 1996), sehingga deteksi yang bisa dilakukan adalah deteksi molekuler melalui Reverse Transcription-Polymerase Chain Reaction (RT-PCR). Menurut Wintermantel et al. (2009), ToCV memiliki sikuen poli (A) pada awal urutan nukeotida RNAnya, sehingga dalam metode RT-PCR dapat digunakan primer oligo (dT).
ToCV memiliki kisaran inang yang luas, tetapi berdasarkan hasil penelitian
Duffus et al. (1996), menunjukkan bahwa ToCV tidak menginfeksi selada. ToCV mampu menginfeksi 24 spesies inang tanaman dari tujuh keluarga yang berbeda
(Wintermantel & Wisler 2006).
ToCV tidak bisa ditularkan secara mekanis, sehingga penyebarannya
persisten oleh empat spesies vektor kutu kebul dari ordo Hemiptera, famili
Aleyrodidae, yaitu Trialeurodes vaporarorium, T. abutilonea, dan Bemisia tabaci
biotipe A dan B (Wisler et al. 1998a). Vektor T. abutilonea dan B. tabaci biotipe B dilaporkan lebih efisien menularkan ToCV dibandingkan T. vaporarorium dan
B. Tabaci biotipe A. ToCV ditularkan oleh keempat kutu kebul tersebut secara semipersisten (Wintermantel & Wisler 2006).
Tomato Infectious Chlorosis Virus (TICV)
TICV pertama kali ditemukan di lahan tomat di daerah California tahun
1993. Lahan pertanaman tomat di daerah Irvine (Orange, California) terserang
penyakit klorosis. Tanaman yang sakit ini menunjukkan gejala menguning pada
bagian di antara tulang daun (interveinal yellowing), nekrosis, dan serangan yang parah menyebabkan kehilangan hasil di seluruh daerah. Penelitian selanjutnya
menunjukkan bahwa penyakit ini disebabkan oleh Tomato infectious chlorosis virus (TICV). Virus ini tidak hanya menginfeksi tanaman tomat, tetapi juga menginfeksi tanaman budidaya lain yang mempunyai nilai ekonomi, dan juga
dapat menginfeksi beberapa gulma (Duffus et al. 1994). Penyakit ini menyebar dan menimbulkan kerugian yang sangat besar di negara penghasil tomat seperti
Italia (Vaira et al. 2000), Yunani (Dovas et al. 2002), Perancis (Dalmon et al. 2005), dan Spanyol (Font et al. 2002). Di Asia, TICV telah menyebar di Jepang (Hartono et al. 2003), Taiwan (Tsai et al. 2004), dan bahkan sudah ada di Indonesia (Hartono & Wijonarko 2007; Suastika et al. 2010).
Sama seperti ToCV, TICV juga memiliki inang yang luas. TICV mampu
menyerang 26 spesies dari delapan keluarga yang berbeda. Inang TICV mencakup
beberapa tanaman penting termasuk tomat (Lycopersicon esculentum Mill.), tomatilo (Physalis ixocarpa Brot.), kentang (Solanum tuberosum L.), artichoke (Cynara scolymus L.), selada (Lactuca sativa L.), bunga petunia (Petunia x hybrida Vilm.), dan Ranunculus (Lie et al. 1998).
TICV termasuk ke dalam genus Crinivirus, famili Closteroviridae yang terbatas pada jaringan floem. Virus ini diketahui sebagai virus yang
6
abutilonea, dan Bemisia tabaci biotipe A dan B (Wisler et al. 1998a), TICV hanya ditularkan oleh T. vaporarorium (Hemiptera: Aleyrodidae).
Taksonomi TICV, yaitu:
Kingdom : Virus
Filum : Not divided
Kelas : Not divided
Ordo : Unassigned
Family : Closteroviridae
Genus : Crinivirus
Spesies : Tomato infectious chlorosis virus
(Duffus et al. 1994)
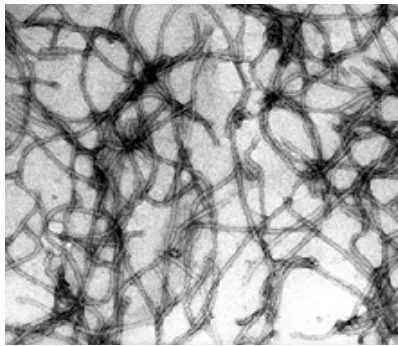
Partikel TICV memiliki panjang rata-rata 645 nm, modal length 850 nm, dan partikel terpanjang 1600 nm (Duffus et al. 1996; Liu et al. 2000). Menurut Wisler et al. (1996) hasil ekstraksi tanaman tomat sakit dan purifikasi menunjukkan partikel virus yang seperti benang (threadlike) berbentuk panjang (filamentous), lentur (flexuous), dengan panjang 850 sampai 900 nm, lebar 12 nm (Gambar 2).
Gambar 2 Partikel TICV berbentuk seperti benang, memanjang (filamentous) dan lentur (flexuous) (Liu et al. 2000).
TICV berbentuk memanjang, lentur, partikel berfilamen dengan ukuran
yaitu genomik RNA 1 dan RNA 2 dengan ukuran 7,8 dan 7,4 kb (Liu et al. 2000). Genom virus menyandikan protein struktural dan protein non struktural. RNA 1
mengkode dua jenis protein yang terlibat dalam replikasi virus, sedangkan RNA 2
mengandung beberapa gen yaitu untuk sebuah protein kecil yang hidrofobik
(small hydrophobic protein), sebuah protein berukuran sekitar 60 kDa, dan dua jenis protein mantel yaitu main capsid protein (CP) dan minor capsid protein
(CPm) (Wintermantel et al. 2005).
Infeksi TICV pada tanaman tomat menyebabkan daun-daun tomat klorosis,
yaitu menguning di antara tulang daun (interveinal yellowing) (Gambar 3). Pada perkembangan selanjutnya daun-daun menjadi rapuh (leaf brittleness), mengalami nekrotik pada beberapa bagian dan warna bagian yang nekrotik menjadi merah
keunguan (bronzing), kebugaran (vigor) tanaman menjadi sangat berkurang, dan apabila menghasilkan buah maka ukurannya jauh lebih kecil dari normal dan
proses pematangannya terganggu, serta mudah gugur (early senescence) sehingga sangat menurunkan bahkan meniadakan nilai ekonomi tanaman yang terinfeksi
(Duffus et al. 1996; Dalmon et al. 2008).
Gambar 3 Gejala penyakit klorosis pada tanaman tomat yang disebabkan oleh
TICV
Reverse Transcription-PCR (RT-PCR)
Teknik RT-PCR dikembangkan untuk melakukan analisis terhadap molekul
RNA hasil transkripsi yang terdapat dalam jumlah sangat sedikit di dalam sel.
Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai
8
(complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Teknik RT-PCR ini sangat berguna untuk mendeteksi
ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis,
maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yuwono
2006).
Teknik RT-PCR memerlukam enzim transkriptase balik (reverse transcription). Enzim transkriptase balik adalah enzim DNA polymerase yang menggunakan molekul RNA sebagai cetakan untuk menyintesis molekul DNA
(cDNA) yang komplementer dengan molekul RNA tersebut. Beberapa enzim
transkriptase balik yang dapat digunakan antara lain mesophilic viral reverse transcriptase (RTase) yang dikode oleh virus avian myoblastosis (AMV) maupun oleh virus moloney murine leukemia (M-MuLV), dan Tth DNA polymerase. RTase yang dikode oleh AMV maupun M-MuLV bersifat sangat prosesif dan
mampu menyintesis cDNA sampai sepanjang 10 kb, sedangkan Tth DNA polymerase mampu menyintesis cDNA sampai sepanjang 1-2 kb (Yuwono 2006).
Berbeda dengan Tth DNA polymerase, enzim RTase AMV dan M-MuLV mempunyai aktivitas RNase H yang akan menyebabkan terjadinya degradasi RNA
dalam hybrid RNA: cDNA. Aktivitas semacam ini dapat merugikan jika
berkompetisi dengan proses sintesis DNA selama proses produksi untai pertama
cDNA. Enzim RTase yang berasal dari M-MuLV mempunyai aktivitas RNase H
yang lebih rendah dibandingkan dengan yang berasal dari AMV (Yuwono 2006).
Enzim M-MuLV mencapai aktivitas maksimum pada suhu 37ºC sedangkan
enzim AMV pada suhu 42ºC dan Tth DNA polymerase mencapai aktivitas maksimum pada suhu 60-70ºC. Penggunaan enzim M-MuLV kurang
menguntungkan jika RNA yang digunakan sebagai cetakan mempunyai struktur
sekunder yang ekstensif. Di lain pihak, penggunaan Tth DNA polymerase kurang menguntungakan jika ditinjau dari kebutuhan enzim ini terhadap ion Mn karena
ion Mn dapat memengaruhi ketepatan (fidelity) sintesis DNA. Meskipun demikian, enzim Tth DNA polymerase mempunyai keunggulan karena dapat digunakan untuk reaksi transkripsi balik sekaligus proses PCR dalam satu langkah
Reaksi transkripsi balik dapat dilakukan dengan menggunakan beberapa
macam primer yaitu (Yuwono 2006):
1. Oligo (dT) sepanjang 12-18 nukleotida yang akan melekat pada ekor poli (A)
pada ujung 3’ mRNA mamalia. Primer semacam ini pada umumnya akan
menghasilkan cDNA yang lengkap.
2. Heksanukleotida acak yang akan melekat pada cetakan mRNA yang
komplementer pada bagian manapun. Primer semacam ini akan menghasilkan
cDNA yang tidak lengkap (parsial).
3. Urutan nukleotida spesifik yang dapat digunakan secara selektif untuk
menyalin mRNA tertentu.
Polimerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) adalah suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan
cara in vitro. Metode ini banyak digunakan untuk berbagai macam manipulasi dan analisis genetik, misalnya untuk melipatgandakan suatu molekul DNA. Dengan
metode ini, segmen tertentu pada DNA dapat digandakan hingga jutaan kali lipat
dalam waktu relatif singkat. Kelebihan lain metode PCR adalah bahwa reaksi ini
dapat dilakukan dengan menggunakan komponen dalam jumlah sangat sedikit,
misalnya DNA cetakan yang diperlukan hanya sekitar 5 µg, oligonukleotida yang
diperlukan hanya sekitar 1 mM, dan reaksi ini biasa dilakukan dalam volume
50-100 µl (Yuwono 2006). Menurut Muladno (2010), PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target
tersebut melalui bantuan enzim dan oligonukleotida sebagai primer dalam suatu
thermocycler. Panjang target DNA berkisar antara puluhan sampai ribuan nukleotida yang posisisnya diapit sepasang primer. Primer yang berada sebelum
10
Empat komponen utama pada proses PCR adalah (1) DNA template
(cetakan), yaitu fragmen DNA yang akan dilipatgandakan, (2) oligonukleotida
primer, yaitu suatu sekuen oligonukleotida pendek (15-25 basa nukleotida) yang digunakan untuk mengawali sintesis rantai DNA, (3) deoksiribonukleotida
trifosfat (dNTP), terdiri atas dATP, dCTP, dGTP, dTTP, dan (4) enzim Taq DNA
polymerase, yaitu enzim yang melakukan katalisis reaksi sintesis rantai DNA. Komponen lain yang juga penting adalah senyawa buffer (Yuwono 2006).
Reaksi pelipatgandaan suatu fragmen DNA dengan cara PCR terdiri dari
tiga tahapan atau tiga reaksi, yaitu denaturasi, penempelan primer (annealing), dan pemanjangan primer (extension).
Denaturasi
Tahapan pertama dimulai dengan melakukan denaturasi DNA cetakan
sehinggga rantai DNA yang berantai ganda (double stranded) akan terpisah menjadi rantai tunggal (single stranded). Denaturasi DNA dilakukan dengan menggunakan panas (95ºC) selama 1-4 menit (Yuwono 2006). Denaturasi yang
tidak lengkap mengakibatkan DNA mengalami renaturasi (membentuk DNA untai
ganda kembali) secara cepat, dan ini mengakibatkan gagalnya proses PCR.
Adapun waktu denaturasi yang terlalu lama, mungkin dapat mengurangi aktivitas
enzim Taq polymerase (Muladno 2010).
Penempelan Primer (Annealing)
Tahap kedua yaitu penempelan primer (annealing) pada DNA cetakan yang telah terpisah menjadi rantai tunggal yang dilakukan pada suhu 55ºC selama 1
menit. Primer akan membentuk jembatan hidrogen dengan cetakan pada daerah sekuen yang komplementer dengan sekuen primer (Yuwono 2006). Pada tahapan ini, primer forward yang runutan nukleotidanya berkomplemen dengan salah satu untai tunggal akan menempel pada posisi komplemennya. Demikian juga primer reverse akan menempel pada untai tunggal lainnya (Muladno 2010).
Setelah kedua primer menempel pada posisinya masing-masing, enzim Taq polymerase mulai mensintesis molekul DNA baru yang dimulai dari ujung 3’nya masing-masing primer (Muladno 2010). Sintesis DNA ini terjadi pada suhu 72ºC
selama 1-2 menit. Pada suhu ini, DNA polymerase akan melakukan proses
polimerasi rantai DNA yang baru berdasarkan informasi yang ada pada DNA
cetakan dengan bantuan enzim Taq DNA polymerase (Yuwono 2006).
Setelah terjadi polimerasi, rantai DNA yang baru akan membentuk jembatan
hidrogen dengan DNA cetakan. DNA rantai ganda yang terbentuk dengan adanya
ikatan hidrogen antara rantai DNA cetakan dengan rantai DNA baru hasil
polimerasi selanjutnya akan didenaturasi lagi dengan menaikkan suhu inkubasi
menjadi 95ºC. Rantai DNA yang baru tersebut selanjutnya akan berfungsi sebagai
cetakan bagi reaksi polimerasi berikutnya. Ketiga tahapan tersebut diulangi lagi
sampai 25-30 siklus sehingga pada akhir siklus akan didapatkan molekul-molekul
DNA rantai ganda yang baru hasil polimerasi dalam jumlah yang jauh lebih
banyak dibandingkan dengan jumlah DNA cetakan yang digunakan (Yuwono
12
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Survei penyakit klorosis dan koleksi sampel tanaman tomat sakit dilakukan
di sentra produksi tomat di daerah Cianjur, Cipanas, Lembang, dan Garut. Deteksi
virus dilakukan di Laboratorium Virologi, Departemen Proteksi Tanaman,
Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari bulan
Februari sampai Oktober 2010.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini yaitu sampel daun tomat yang
bergejala penyakit klorosis. Selain bahan tanaman, digunakan juga beberapa
bahan kimia atau reagensia yang dipergunakan untuk ekstraksi RNA, RT-PCR,
PCR, dan elektroforesis. Bahan-bahan yang digunakan untuk ekstraksi RNA
diantaranya yaitu, nitrogen cair, merkaptoethanol, ethanol 96%, buffer RLT,
buffer RW1, buffer RPE, dan RNAse free water. Bahan-bahan yang diperlukan untuk RT-PCR yaitu 50 mM DTT (dithiothreitol), M-MuLV Rev, 10 mM dNTP (deoksiribonukleotida triphosphat), RNAse inhibitor, oligo (dT), dan H2O. Untuk
PCR, diperlukan bahan kimia seperti buffer PCR 10X + Mg2+, 10 mM dNTP,
H2O, Taq DNA polymerase, sucrose cresol 10X, dan primer. Selain itu, agarose,
buffer Tris-Acetat EDTA (TAE) 0,5X, dan ethidium bromida juga diperlukan sebagai bahan pembuatan gel dalam proses elektroforesis.
Alat-alat yang digunakan dalam penelitian ini adalah sarung tangan, mortar
dan pistil, tabung mikro 2 ml, mesin sentrifuse, pipet, QIAshredder spin column
ungu, RNeasy mini colomn pink, Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA), alat pencetak gel, alat elektroforesis,
Metode Penelitian
Penyediaan Sampel Tanaman Tomat Sumber ToCV dan TICV
Bahan yang digunakan dalam penelitian ini yaitu sampel daun tomat yang
bergejala penyakit klorosis. Sampel tanaman tomat yang positif terinfeksi tunggal
oleh Tomato chlorosis virus (ToCV) maupun Tomato infectious chlorosis virus
(TICV), dan yang positif terinfeksi ganda oleh TICV dan ToCV diperoleh dari
hasil penelitian terdahulu (Fitriasari 2010).
Pengambilan Sampel Tanaman Tomat di Lapangan yang Terserang Virus
Beberapa sampel diperoleh dari lapangan untuk menguji penerapan metode
RT-PCR terhadap sampel dari lapangan. Pengambilan sampel dilakukan di sentra
produksi tomat di beberapa daerah seperti Cianjur, Cipanas, Lembang, dan Garut.
Sampel daun yang diambil dari lapangan dideteksi di laboratorium.
Deteksi Diferensial ToCV dan TICV Melalui RT-PCR
Untuk dapat membedakan virus ToCV dan TICV yang menginfeksi tanaman
tomat, dilakukan deteksi virus melalui metode RT-PCR dan menggunakan primer
khusus yang dapat digunakan dalam RT-PCR yang dapat mengamplifikasi virus
secara terpisah.
Ekstraksi RNA total. RNA total diekstraksi dari jaringan daun tanaman tomat bergejala penyakit klorosis dengan menggunakan Rneasy Plant Mini Kits
(Qiagen Inc., Chatsworth, CA., USA). Tahapannya adalah sebanyak 0,1 g sampel
daun digerus dengan menggunakan mortar dan pistil steril dengan bantuan
nitrogen cair. Hasil gerusan dimasukkan ke dalam tabung mikro 2 ml dan
ditambahkan 450 µl buffer RLT yang mengandung 1% merkaptoethanol,
kemudian divortex. Sampel diinkubasi pada suhu 56ºC selama 10 menit. Sampel
dipipet, lalu dimasukkan ke dalam QIAshredder spin column ungu dan ditempatkan pada tabung koleksi 2 ml, lalu disentrifuse pada kecepatan 13000
14
koleksi, lalu dipindahkan ke dalam tabung mikro 2 ml baru. Kemudian
ditambahkan 0,5 vol ethanol 96% (± 225 ml) dan dicampur dengan rata. Sampel
dimasukkan (± 650 ml) termasuk endapan yang terbentuk ke dalam RNeasy mini colomn pink, kemudian ditempatkan pada tabung koleksi 2 ml lalu disentrifuse pada kecepatan 10000 rpm selama 15 detik. Cairan yang terdapat pada tabung
koleksi dibuang, kemudian ditambahkan 700 ml buffer RW1 ke dalam RNeasy colomn, lalu ditutup dengan baik dan disentrifuse pada kecepatan 10000 rpm selama 15 detik untuk mencuci colomn. RNeasy colomn dipindahkan ke dalam tabung koleksi 2 ml baru, buffer RPE dipipet sebanyak 500 µl lalu dimasukkan ke
dalam RNeasy colomn dan ditutup rapat, disentrifuse pada kecepatan 10000 rpm selama 15 detik. Tabung koleksi digunakan kembali, ditambahkan sebanyak 500
µl buffer RPE lalu disentrifuse pada kecepatan 10000 rpm selama 2 menit. Untuk
meyakinkan bahwa colomn telah kering, colomn dipindahkan pada tabung koleksi baru, kemudian disentrifuse pada kecepatan 10000 rpm selama 1 menit.
Selanjutnya, 40 µl RNAse free water ditambahkan ke dalam RNeasy colomn, didiamkan 10 menit lalu disentrifuse pada kecepatan 10000 rpm selama 1 menit.
Siapan RNA total ini digunakan sebagai template dalam reaksi RT-PCR.
Sintesis cDNA. RNA hasil ekstraksi selanjutnya ditranskripsi balik menjadi cDNA (complementary DNA) dengan menggunakan teknik Reverse Transcription
(RT). Reaksi RT dibuat dengan total volume 10 µl yang mengandung 2 µl RNA
total, 1 µl buffer RT 10X, 0,35 µl 50 mM DTT (dithiothreitol), 2 µl 10 mM dNTP (deoksiribonukleotida triphosphat), 0,35 µl M-MuLV Rev, 0,35 µl RNase inhibitor, 0,75 µl oligo (dT), dan 3,2 µl H2O. Komponen-komponen tersebut
digunakan untuk satu kali reaksi RT. Reaksi RT dilakukan dalam sebuah
Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA) yang diprogram untuk satu siklus pada suhu 25ºC selama 5 menit, 42ºC
selama 60 menit, dan 70ºC selama 15 menit. Siapan cDNA hasil RT ini,
digunakan sebagai DNA template dalam reaksi PCR.
Amplifikasi DNA dengan PCR. Amplifikasi DNA virus dilakukan dengan metode Polymerase Chain Reaction (PCR) dengan menggunakan pasangan primer yang telah didesain khusus untuk mengamplifikasi virus secara terpisah.
ToCV-CF GTGTCAGGCCATTGTAAACCAAG-3’) dan ToCV-CR
(5’-CACAAAGCGTTTCTTTTCATAAGCAGG-3’) dengan prediksi ukuran produk
360 bp. Sedangkan pasangan primer yang spesifik digunakan untuk mendeteksi
virus TICV yaitu TICV-CF (5’-AATCGGTAGTGACACGAGTAGCATC-3’)
dan TICV-CR (5’-CTTCAAACATCCTCCATCTGCC-3’) dengan prediksi
ukuran produk 417 bp. Dalam penelitian ini, dilakukan tiga cara untuk
mengamplifikasi DNA ToCV, TICV, dan keduanya. Pertama, pasangan primer
ToCV digunakan untuk mengamplifikasi DNA ToCV, TICV, dan campuran
kedua DNA tersebut. Kedua, digunakan pasangan primer TICV untuk
mengamplifikasi DNA ToCV, TICV, dan campuran kedua DNA tersebut. Ketiga,
digunakan pasangan primer TICV dan ToCV yang dicampur untuk
mengamplifikasi DNA ToCV, TICV, dan campuran kedua DNA tersebut.
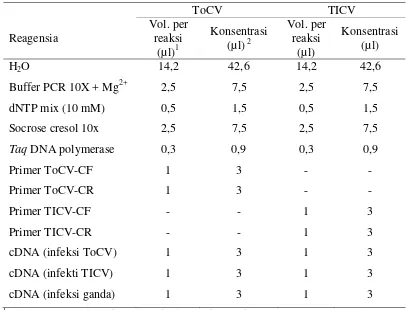
Komponen reagensia yang diperlukan untuk cara 1 dan 2 terlihat pada Tabel 1,
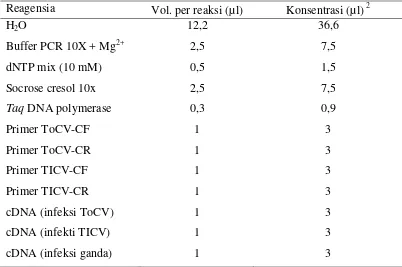
sedangkan komponen reagensia untuk cara ketiga terlihat pada Tabel 2. Untuk
mendeteksi sampel dari lapangan, PCR dilakukan dengan mencampur kedua
primer.
Reaksi PCR dengan total volume 25 µl, terdiri atas 1 µl masing-masing
primer, 2,5 µl buffer PCR 10X + Mg2+, 0,5 µl 10 mM dNTP, 2,5 µl sucrose cresol
10X, 0,3 µl Taq DNA polymerase, 14,2 µl H2O, dan 1 µl DNA template.
Amplifikasi ini dilakukan pada Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA). Amplifikasi ini didahului dengan denaturasi awal pada 94ºC selama 4 menit. Kemudian dilanjutkan dengan 30
siklus yang terdiri dari denaturasi pada 94ºC selama 1 menit, penempelan primer
(annealing) pada 62ºC selama 1 menit, dan pemanjangan (Extension) pada 72ºC selama 2 menit. Khusus untuk siklus terakhir, ditambahkan 10 menit pada 72ºC
untuk tahapan sintesis, dan siklus berakhir pada suhu 4ºC. Setelah dilakukan PCR,
maka hasil yang diperoleh dapat dielektroforesis. PCR dilakukan berkali-kali
untuk melihat validasi pasangan primer ToCV, pasangan primer TICV, dan
16
Tabel 1 Reagensia PCR dan konsentrasi yang diperlukan untuk validasi pasangan primer ToCV dan TICV yang digunakan secara terpisah terhadap 3 template cDNA yang berbeda
Volume total yang diperlukan sebanyak 25 µl untuk 1X reaksi. 2
Tabel 2 Reagensia PCR dan total konsentrasi yang diperlukan untuk validasi pasangan primer ToCV dan TICV yang digunakan secara bersamaan1
Reagensia Vol. per reaksi (µl) Konsentrasi (µl) 2
H2O 12,2 36,6
Pasangan primer ToCV dan pasangan primer TICV dicampur dalam 1 tube PCR. 2
Volume total yang diperlukan sebanyak 75 µl untuk 3X reaksi.
18
HASIL DAN PEMBAHASAN
Penyakit klorosis beberapa tahun terakhir ini telah menyerang pertanaman
tomat di beberapa negara. Menurut Duffus et al. (1996) dan Wisler et al. (1998b) penyakit klorosis pada tomat disebabkan oleh dua virus, yaitu Tomato chlorosis virus (ToCV) and Tomato infectious chlorosis virus (TICV).
Gejala penyakit yang diinduksi oleh ToCV tidak dapat dibedakan dengan
gejala penyakit yang diinduksi oleh TICV (Dovas et al. 2002). Gejala yang muncul juga akan sama bila kedua virus ini bersama-sama menginfeksi tanaman
tomat (Wintermantel et al. 2008). Di lapangan, gejala penyakit kedua virus ini terlihat sama. Gejala ToCV dan TICV pada tanaman tomat yaitu menguningnya
daun yang terbatas antara tulang daun tetapi tulang daun tampak terlihat berwarna
hijau (Gambar 4). Gejala menguning pada umumnya diikuti dengan perubahan
warna daun bagian atas menjadi ungu, sehingga terkadang petani sering
menyebutnya sebagai “Penyakit Ungu” (Hartono & Wijonarko 2007).
Gambar 4 Gejala penyakit klorosis pada daun tomat yang disebabkan oleh ToCV dan/atau TICV
Wisler et al. (1998a) menerangkan bahwa gejala menguning awalnya terjadi pada daun tua di bagian bawah yang kemudian secara bertahap akan berkembang
nekrosis, daun menggulung ke bawah, dan diikuti dengan masalah pertumbuhan
serta penurunan hasil produksi buah tomat. Serangan penyakit ini akan
mempengaruhi ukuran buah tomat dan penundaan proses pemasakan buah,
sehingga mengakibatkan kerugian ekonomi (Navas-Castillo et al. 2000). Di areal pertanaman tomat, tanaman yang terserang virus ini menyebar dengan pola
spot-spot tidak merata di seluruh lahan (Gambar 5).
Gambar 5 Gejala penyakit klorosis akibat infeksi ToCV dan/atau TICV di areal pertanaman tomat di wilayah Cipanas (kiri), Cianjur (tengah), dan Lembang (kanan)
Crinivirus merupakan kelompok virus yang terbatas pada jaringan floem (Medina et al. 2003) dan terakumulasi pada tingkat rendah pada tanaman yang terinfeksi, sehingga pembuatan antiserum masih sulit untuk dilakukan. Sampai
saat ini hanya antiserum poliklonal untuk TICV yang baru tersedia (Duffus et al. 1996), sedangkan antiserum untuk ToCV belum tersedia, sehingga deteksi virus
tidak dapat dilakukan melalui uji serologi, terutama deteksi virus ToCV. Oleh
karena itu, deteksi kedua virus ini dilakukan melalui pendekatan molekuler
terutama Reverse Transcription-Polymerase Chain Reaction (RT-PCR). Deteksi dengan RT-PCR memerlukan sepasang primer yang didesain khusus untuk
mendeteksi virus secara terpisah. Primer-primer yang digunakan dalam metode
ini, seperti terlihat pada Tabel 3 telah didesain khusus berdasarkan analisa sikuen
20
Tabel 3 Oligonukleotida primer yang digunakan dalam PCR untuk meng- amplifikasi virus ToCV dan TICV secara terpisah
Primer Sekuen 5’-3’ Ukuran
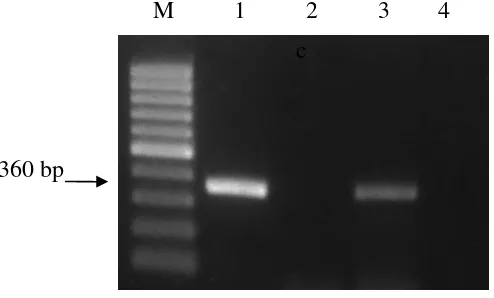
Primer ToCV-CF dan ToCV-CR berhasil mendeteksi virus ToCV melalui
metode RT-PCR terhadap sampel yang positif terserang ToCV. Berdasarkan isolat
NC007341 yang berasal dari USA, Florida (Wintermantel et al. 2005), primer ToCV-CF dengan sekuen GTGTCAGGCCATTGTAAACCAAG terletak pada
posisi 4682-4705 dan primer ToCV-CR dengan sekuen CACAAAGCGTTTC
TTTTCATAAGCAGG terletak pada posisi 5014-5041. Oleh karena itu, produk
PCR adalah sebesar 360 bp. Gambar 6 menunjukkan hasil PCR dengan panjang
pita DNA sebesar 360 bp.
Pasangan primer ToCV tunggal terbukti spesifik hanya mendeteksi virus
ToCV saja, sedangkan sampel yang positif TICV tidak teramplifikasi oleh primer
ini. Hal ini dapat dilihat dalam Gambar 6, lajur 1 dengan sampel yang positif
terinfeksi tunggal oleh ToCV, maka pita DNA akan muncul dengan panjang 360
bp. Pada lajur 2 dengan sampel yang positif terinfeksi tunggal oleh TICV, pita
DNA tidak muncul karena TICV tidak teramplifikasi oleh pasangan primer ToCV
dengan pasangan primer ToCV, maka pita DNA yang muncul hanya satu, yaitu
pita DNA ToCV saja dan pita DNA TICV tidak terlihat (lajur 3). Hal ini
membuktikan pasangan primer ToCV benar-benar spesifik hanya mendeteksi
virus ToCV saja. Tanaman yang sehat jika diamplifikasi dengan menggunakan
pasangan primer ini, juga tidak akan manghasilkan pita DNA (lajur 4).
M 1 2 3 4
c
360 bp
Gambar 6 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan pasangan primer spesifik ToCV-CF dan ToCV-CR terhadap sampel daun tanaman tomat yang positif terinfeksi tunggal oleh ToCV (lajur 1), positif terinfeksi tunggal oleh TICV (lajur 2), dan positif terinfeksi ganda oleh kedua virus ToCV dan TICV (lajur 3). Lajur 4 adalah kontrol negatif dari tanaman sehat dan lajur M adalah marker 100 bp DNA ladder
Validasi Pasangan Primer TICV
Gejala penyakit yang diinduksi, baik oleh ToCV maupun TICV tidak dapat
dibedakan keduanya (Dovas et al. 2002). Namun, jika dilakukan deteksi melalui deteksi molekuler dengan menggunakan metode RT-PCR dan PCR, maka akan
didapatkan hasil yang berbeda. Berdasarkan hasil penelitian, setelah dilakukan
amplifikasi, ternyata panjang pita DNA TICV lebih panjang daripada panjang pita
DNA ToCV. Pita DNA ToCV berukuran 360 bp, sedangkan pita DNA TICV
berukuran 417 bp. Pada Gambar 7 terlihat pita DNA yang muncul dengan panjang
417 bp. Hasil panjang pita DNA tersebut sesuai dengan hasil perhitungan yang
telah dilakukan terhadap isolat TICV-CA4 segment RNA2. Berdasarkan isolat
FJ542306 yang berasal dari USA (Orilio & Navas castillo 2009), amplifikasi
cDNA TICV menggunakan primer TICV-CF dengan sekuen
22
primer TICV-CR dengan sekuen CTTCAAACATCCTCCATCTGCC terletak
pada posisi 6023-6045, sehingga produk PCR sebesar 417 bp.
Sama halnya dengan pasangan primer ToCV yang hanya mendeteksi virus
ToCV, pasangan primer TICV tunggal juga spesifik hanya mendeteksi virus
TICV saja. Dalam Gambar 7 terlihat hasil yang berbeda dengan Gambar 6.
Sampel tanaman tomat yang positif terinfeksi tunggal oleh ToCV tidak
teramplifikasi dengan pasangan primer TICV, sehingga pita DNA tidak muncul
(lajur 1). Sedangkan sampel yang positif terinfeksi tunggal TICV menunjukkan
pita DNA dalam gel agarose dengan panjang 417 bp (lajur 2). Untuk sampel yang
terinfeksi ganda oleh kedua virus ini yaitu ToCV dan TICV, maka pita DNA yang
terlihat hanya pita DNA TICV saja, sedangkan pita DNA ToCV tidak terlihat. Hal
ini dikarenakan pasangan primer TICV hanya mengamplifikasi sampel yang
terinfeksi TICV saja.
Hasil pada Gambar 6 dan 7 menunjukkan bahwa pasangan primer ToCV
dan TICV benar-benar spesifik hanya mendeteksi virusnya masing-masing.
Primer ToCV hanya menempel pada sikuen DNA ToCV, dan primer TICV
menempel pada sikuen DNA TICV.
M 1 2 3 4
417 bp
Validasi Pasangan Primer ToCV dan TICV
Melalui metode RT-PCR dengan menggunakan pasangan primer ToCV dan
TICV ternyata terbukti dapat mendeteksi kedua virus, baik ToCV maupun TICV.
Berbeda dengan metode yang digunakan dalam menentukan validitas terhadap
pasangan primer ToCV dan TICV dimana pasangan primer masing-masing
digunakan secara terpisah, dalam metode ini pasangan primer ToCV dan TICV
digunakan secara bersamaan, tercampur bersama komponen-komponen PCR yang
lain. Hasil yang didapatkan jika pasangan primer ToCV dan TICV digunakan
secara bersamaan terlihat dalam Gambar 8 yang menunjukkan kespesifikan kedua
primer tersebut.
Dalam Gambar 8, lajur 1 dimana sampel yang digunakan adalah sampel
positif terinfeksi tunggal oleh ToCV, terlihat jika kedua primer ToCV dan TICV
dicampur maka pita DNA yang terlihat adalah pita DNA ToCV dengan ukuran
360 bp. Hal ini dikarenakan pasangan primer ToCV hanya mengamplifikasi virus
yang spesifik yaitu ToCV saja, sedangkan virus TICV tidak teramplifikasi. Begitu
pula jika sampel yang digunakan adalah sampel positif terinfeksi tunggal oleh
TICV, maka DNA yang teramplifikasi adalah DNA TICV sehingga yang terlihat
dalam gel agarose adalah pita DNA TICV dengan ukuran 417 bp (lajur 2). Pita
DNA ToCV tidak muncul karena primer TICV hanya mendeteksi secara spesifik
virus TICV saja.
Untuk sampel yang terinfeksi ganda oleh ToCV dan TICV, jika
diamplifikasi menggunakan kedua primer tersebut, maka pita DNA yang muncul
akan terlihat double seperti terlihat pada Gambar 8, lajur 3. Ketika kedua pasangan primer digunakan secara bersamaan untuk mengamplifikasi sampel
yang terinfeksi ganda oleh kedua virus tersebut, maka kedua pasangan primer
tersebut akan menempel pada pasangan DNAnya masing-masing. Pasangan
primer ToCV akan menempel pada sikuen DNA ToCV dan terbentuk pita DNA
ToCV pada gel agarose, dan pasangan primer TICV akan menempel juga pada
sikuen DNA TICV sehingga terbentuk pita DNA TICV. Seperti terlihat pada
24
panjang, berada di bagian lebih atas dengan ukuran 417 bp daripada pita DNA
ToCV yang hanya berukuran 360 bp dan berada di bawah pita DNA TICV.
Meskipun pita DNA terletak bersamaan dalam satu lajur, namun kedua pita DNA
tersebut masih dapat terlihat jelas perbedaannya karena ukuran keduanya memang
berbeda.
Dengan metode pencampuran kedua primer ini maka dapat diketahui bahwa
kedua primer ToCV dan TICV dapat digunakan untuk mendeteksi kedua virus ini,
baik yang terinfeksi tunggal maupun yang terinfeksi ganda. Selain untuk
mendeteksi virus, metode RT-PCR dengan kedua pasang primer ini juga dapat
diterapkan untuk diagnosis. Tidak hanya diagnosis terhadap sampel hasil
penularan saja, tetapi juga dapat dilakukan untuk mendiagnosis sampel dari
lapangan.
M 1 2 3 4
417 bp 360 bp
Gambar 8 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan campuran primer ToCV-CF, ToCV-CR, TICV-CF, dan TICV-CR terhadap sampel daun tanaman tomat yang positif terinfeksi tunggal oleh ToCV (lajur 1), positif terinfeksi tunggal oleh TICV (lajur 2), dan positif terinfeksi ganda oleh kedua virus ToCV dan TICV (lajur 3). Lajur 4 adalah kontrol negatif dari tanaman sehat dan lajur M adalah marker 100 bp DNA ladder
Penerapan Metode RT-PCR untuk Sampel dari Lapangan
Penyakit klorosis saat ini sudah ditemukan di Indonesia. Pertama kali
ditemukan di sentra pertanaman tomat di Magelang, Jawa Tengah dan
Purwakarta, Jawa Barat (Hartono & Wijonarko 2007). Penyakit klorosis yang
disebabkan oleh ToCV dan TICV bahkan sudah menyebar luas di berbagai
klorosis menyerang areal pertanaman tomat di daerah Bogor, Cianjur, dan Garut
dengan persentase kejadian penyakit yang berbeda-beda.
M 1 2 3 4 5 6
417 bp
360 bp
Gambar 9 Hasil amplifikasi DNA genom virus dengan metode RT-PCR menggunakan campuran primer ToCV-CF, ToCV-CR, TICV-CF, dan TICV-CR terhadap sampel daun tanaman tomat yang bergejala klorosis dari Lembang (lajur 1 dan 3), Cipanas (lajur 2), Cianjur (lajur 4), Garut (lajur 5). Lajur 6 adalah kontrol negatif dari tanaman sehat dan lajur M adalah marker 100 bp DNA ladder
Metode RT-PCR tidak hanya dapat dilakukan terhadap sampel dari hasil
penularan saja, tetapi juga dapat diterapkan untuk sampel dari lapangan terhadap
individu yang berbeda-beda wilayahnya. Hal ini terbukti dari hasil pada Gambar 9
yang memperlihatkan hasil amplifikasi terhadap beberapa sampel yang berasal
dari berbagai wilayah, yaitu Cianjur, Cipanas, Lembang, dan Garut. Metode
dilakukan dengan cara yang sama seperti yang dilakukan terhadap sampel hasil
penularan, yaitu melalui metode PCR menggunakan pasangan primer spesifik
ToCV dan TICV yang dicampur. Ketika primer ToCV dan TICV hadir dalam
campuran reaksi, bersama dengan komponen-komponen PCR yang lain, maka
terbukti bahwa pasangan primer ini dapat mendeteksi kedua virus ini, baik yang
terinfeksi tunggal oleh ToCV atau TICV saja maupun yang terinfeksi ganda oleh
kedua virus tersebut. Seperti yang terlihat pada Gambar 9, berdasarkan hasil
amplifikasi terbentuk pita DNA yang terlihat jelas dengan ukuran 360 bp untuk
ToCV dan 417 bp untuk TICV.
Sampel yang berasal dari Cianjur dan Cipanas menunjukkan bahwa tanaman
26
yang berasal dari Lembang terdeteksi terinfeksi tunggal oleh TICV. Terlihat pada
Gambar 9 lajur 1 dan 3, pita DNA yang terbentuk berukuran lebih panjang
daripada pita DNA yang terbentuk pada lajur 2 dan 4. Hal ini menandakan bahwa
RT-PCR yang dilakukan terhadap jaringan daun yang diambil dari tanaman tomat
bergejala klorosis di Lembang, positif terinfeksi tunggal oleh TICV, sedangkan
sampel dari Cianjur dan Cipanas positif terinfeksi tunggal oleh ToCV. Sampel
dari Garut terinfeksi ganda oleh kedua virus tersebut, seperti terlihat pada lajur 5
yang menunjukkan pita DNA double ToCV dan TICV dengan ukuran yang bebeda antara keduanya.
ToCV dan TICV merupakan virus-virus yang tergolong ke dalam genus
Crinivirus, dan telah diketahui bahwa virus-virus dalam genus ini tidak dapat ditularkan melalui cairan perasan tanaman sakit ataupun melalui benih (Martelli et al. 2002). Oleh karena itu, yang menjadi agens utama dalam penyebaran penyakit klorosis di lapangan adalah kutu kebul. Korelasi antara penyebaran penyakit
klorosis dengan populasi kutu kebul telah dibuktikan dalam penelitian
Navas-Castillo et al. (2000) yang menyatakan bahwa tingkat kejadian penyakit klorosis di lapangan berkorelasi positif dengan tingkat populasi kutukebul. Beberapa
spesies kutu kebul yang menjadi agens utama penyebar virus ToCV dan TICV
dan telah diteliti oleh beberapa peneliti di berbagai wilayah dunia diantaranya
yaitu Bemisia tabaci, Trialeurodes vaporarorium, dan Trialeurodes abutilonea
(Hemiptera: Aleyrodidae) (Wisler et al. 1998a). ToCV ditularkan oleh B. tabaci,
T. vaporarorium, dan T. Abutilonea, sedangkan TICV hanya ditularkan oleh T. vaporarorium (Wisler et al. 1998a).
Perbedaan deteksi virus dari berbagai wilayah ini dipengaruhi oleh faktor
ketinggian tempat. Hal ini juga bersesuaian dengan keberadaan kutu kebul.
Menurut hasil penelitian Fitriasari (2010), diketahui bahwa dari ketinggian 0-1000
mdpl (meter di atas permukaan laut) di dominasi oleh B. tabaci, ketinggian 1000-1200 mdpl di dominasi oleh B. tabaci dan T. vaporarorium, sedangkan ketinggian di atas 1200 mdpl hanya di dominasi oleh T. vaporarorium. Hasil penelitian dalam Gambar 9 sesuai dengan pernyataan tersebut. Di daerah Cianjur dan
Cipanas yang wilayahnya terletak pada ketinggian antara 1000-1200 mdpl,
tunggal oleh TICV karena wilayahnya berada di ketinggian lebih dari 1200 mdpl.
Daerah Garut yang letak wilayahnya berada di ketinggian di atas 1200 mdpl,
terinfeksi ganda oleh kedua virus tersebut.
Jika dilihat dari gejalanya, ToCV dan TICV tidak dapat dibedakan. Dalam
penelitian ini, dengan metode RT-PCR menggunakan pasangan primer yang
didesain khusus untuk ToCV dan TICV pada tanaman tomat, baik yang terinfeksi
tunggal maupun yang terinfeksi ganda perbedaan kedua virus dapat dilihat.
Perbedaannya dapat terlihat dari besarnya ukuran panjang pita DNA yang
28
KESIMPULAN DAN SARAN
Kesimpulan
Melalui metode RT-PCR dengan pasangan primer yang didesain khusus
untuk ToCV, yaitu ToCV-CF (5’-GTGTCAGGCCATTGTAAACCAAG-3’) dan
ToCV-CR (5’CACAAA GCGTTTCTTTTCATAAGCAGG-3’) dan pasangan
primer yang didesain khusus untuk TICV, yaitu TICV-CF(5’AATCGGTAGTG
ACACGAGTAGCATC-3’) dan TICV-CR (5’CTTCAAACATCCTCCATCTGC
C-3’) valid digunakan sebagai metode deteksi diferensial ToCV dan TICV pada
tanaman tomat.
Metode RT-PCR dengan pasangan primer tersebut dapat digunakan untuk
mendeteksi virus, baik yang terinfeksi tunggal maupun terinfeksi ganda terhadap
sampel hasil penularan maupun sampel yang berasal dari lapangan.
Saran
Perlu dilakukan sikuen hasil PCR untuk memastikan bahwa pita DNA
DAFTAR PUSTAKA
Acotto GP, Vaira AM, Vecchiati M, finetti Sialer MM, Gallitelli D, Davino M. 2001. Firs report of Tomato chlorosis virus in Italy. Plant Disease 85:1208. Bambang C. 2008. Tomat Usaha Tani dan Penanganan Pascapanen.
Yogyakarta: Kanisius.
Bos L. 1990. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta: Gajahmada University Press. Terjemahan dari: Introduction to Plant Virologi.
Dalmon A, Bouyer S, Cailly M, et al. 2005. First report of Tomato chlorosis virus and Tomato infectious chlorosis virus in France. Plant Disease 89: 1243.
Dalmon A, Fabre F, Guilbaud L, Lecoq H, Jacquemond M. 2008. Comparative whitefly transmission of Tomato chlorosis virus and Tomato infectious chlorosis virus from single or mixed infections. Plant Pathology: 1365-3059
Dovas CI, Katis NI, Avgelis AD. 2002. Multiplex detection of Criniviruses
associated with epidemics of a yellowing disease of tomato in Greece.
Plant Disease 86: 1345-1349.
Duffus JE, Liu HY, Wisler GC. 1994. A new Closterovirus of tomato in Southern California transmitted by the greenhouse whitefly (Trialeurodes vaporariorum). Phytopathology 84(10): 1072-1073.
Duffus JE, Liu H-Y, Wisler GC. 1996. Tomato infectious chlorosis virus - a new clostero-like virus transmitted by Trialeurodes vaporariorum.
European Journal of Plant Pathology 102: 219-226.
Duriat AS, et al. 1997. Teknologi Produksi Tomat. Bandung: Balai Penelitian Tanaman Sayuran.
Fitriasari ED. 2010. Keefektifan kutukebul dalam menularkan virus penyebab penyakit kuning pada tanaman tomat [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Font MJ, Culebras PM, Jorda MC, Louro D, Vaira AM, Accoto GP. 2002. First report of Tomato infectious chlorosis virus in Spain. Plant Disease 86: 696. Hadidi A, Khetarpal RK, Koganezawa H. 1998. Plant Virus Disease Control.
Amerika: APS Press.
30
Hartono S, Wijonarko A. 2007. Karakterisasi biologi molekuler Tomato infectious chlorosis virus penyebab penyakit kuning pada tanaman tomat di Indonesia. Jurnal Akta Agrosia Edisi Khusus 2: 139-146.
Hidayat A, et al. 1991. Hasil-hasil Penelitian Sayuran dataran Rendah. Prosiding Lokakarya Nasional Sayuran: Evaluasi dan Perencanaan Penelitian serta Pengembangan Produksi dan Industri Sayuran di Indonesia. Kerjasama: Badan Litbang Pertanian-AVRDC-JSIF-ATA 395: 89-113.
Jacquemond M, Verdin E, Dalmon A, Guilbaud L, Gognalons P. 2008. Serological and molecular detection of Tomato chlorosis virus and Tomato infectious chlorosis virus in tomato. Plant Pathology: 1365-3059.
Klaasen VA, Boeshore M, Koonin L, Tian T, Falk B. 1995. Genome structure and phylogenetic analysis of Lettuce infectious yellow virus, a whitefly-transmited bipartite Closterovirus. Virologi 208: 99-110.
Lie RH, Wisler GC, Liu HY, and Duffus JE. 1998. Comparison of diagnostic techniques for detecting Tomato infectious chlorosis virus. Plant Disease
82: 84-88.
Liu HY, Wisler GC, Duffus JE. 2000. Particle lengths of whitefly-transmitted Criniviruses. Plant Disease 84: 803-805.
Louro, D, Accotto GP, and Vaira AM. 2000. Occurrence and diagnosis of
Tomato chlorosis virus in Portugal. European Journal of Plant Pathology 106: 589-592.
Martelli GP, Agranovsky AA, Bar-Joseph M. 2002. The family Closteroviridae
revised. Archives of Virology 147: 2039-2044.
Maskar, Gafur S. 2006. Budidaya Tomat. Balitbang Pertanian Sulawesi Tengah: Agro Inovasi.
Medina V, Rodrigo G, Tian T, et al. 2003. Comparative cytopathology of
Crinivirus infections in different plant hosts. Annals of Applied Biology
143: 99–110.
Muladno. 2010. Teknologi Rekayasa Genetika. Ed ke-2. Bogor: IPB Press. Navas-Castillo J, Camero R, Bueno M, Moriones E. 2000. Severe yellowing
outbreaks in tomato in Spain associated with infections of Tomato chlorosis virus. Plant Disease 84: 835-837.
Orílio AF, Navas-Castillo J. 2009. The complete nucleotide sequence of the RNA2 of the Crinivirus Tomato infectious chlorosis virus: isolates from North America and Europe are essentially identical. Archives of Virology
154(4): 683-687.
Parella G. 2007. Interveinal Yellowing caused by Tomato infectious chlorosis virus in Lettuce and Escarole in Southern Italy. Journal Phytopathology
156: 190-192.
International Congress 2010: Agricultural Adaptation in Response to Climate Change. Sanur, Bali, Indonesia, 14th-18th November 2010.
Tsai WS, Shih SL, Green SK, Hanson P, Liu HY. 2004. First report of the occurrence of Tomato chlorosis virus and Tomato infectious chlorosis virus
in Taiwan. Plant Disease 88: 311.
Vaira AM, Accotto GP, Vecchiati M, Bracaloni M. 2002. Tomato infectious chlorosis virus causes leaf yellowing and reddening of tomato in Italy.
Phytoparasitica 30: 290-294.
Verhoeven JTJ, Willemen TM, Roenhorst JW, Van der vlugt RAA. 2003. First report of Tomato infectious chlorosis virus in tomato in Indonesia. Plant Disease 87: 872.
Wisler GC, Liu H-Y, Klaassen VA, Duffus JE, Falk BW. 1996. Tomato infectious chlorosis virus has a bipartite genome and induces phloem-limited inclusions characteristic of the Closteroviruses. Phytopathology 86: 622–626.
Wisler GC, Duffus JE, Liu H-Y, Li RH. 1998a. Ecology and epidemiology of whitefly-transmitted Closteroviruses. Plant Disease 82: 270–280.
Wisler GC, Li RH, Liu H-Y, Lowry DS, Duffus JE, 1998b. Tomato chlorosis virus: a new whitefly-transmitted, phloem-limited, bipartite Closterovirus of tomato. Phytopathology 88: 402–409.
Wintermantel WM, Wisler GC, Anchieta1 AG, et al. 2005. The complete nucleotide sequence and genome organization of Tomato chlorosis virus. Arch Virol 150: 2287–2298.
Wintermantel WM, Wisler GC. 2006. Vector specificity, host range, and genetic diversity of Tomato chlorosis virus. Plant Disease 90: 814-819.
Wintermantel WM, Cortez AA, Anchieta AG, Gulati-Sakhuja A, Hladky LL. 2008. Co-infection by two Crinivirus alters accumulation of each virus in a host-specific manner and influences efficiency of virus transmission.
Phytopathology 98: 1340-1345.
Wintermantel WM, Hladky LL, Sakhuja AG, Li R, Liu H-Y, Tzanetakis IE. 2009. The complete nucleotide sequence and genome organization of
Tomato infectious chlorosis virus: a distinct crinivirus most closely related to Lettuce infectious yellows virus. Arch Virol 150: 2310-2317.