IDENTIFIKASI
TOMATO INFECTIOUS CHLOROSIS VIRUS
DAN
TOMATO CHLOROSIS VIRUS
MELALUI
REVERSE
TRANSCRIPTION POLYMERASE CHAIN REACTION
(RT-PCR) DAN SIKUEN NUKLEOTIDA
SARI NURULITA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
SARI NURULITA. Identifikasi Tomato Infectious Chlorosis Virus dan Tomato Chlorosis Virus melalui Reverse Transcription Polymerase Chain Reaction (RT-PCR) dan Sikuen Nukleotida. Dibimbing oleh GEDE SUASTIKA.
Tomato Infectious Chlorosis Virus (TICV) dan Tomato Chlorosis Virus
(ToCV) beberapa tahun ini dilaporkan mulai masuk dan menyerang sejumlah pertanaman tomat di Indonesia. TICV dan ToCV merupakan patogen yang berasal dari genus Crinivirus dan famili Closteroviridae. Penyakit yang ditimbulkan oleh TICV dan ToCV ini mempunyai gejala yang hampir sama di lapangan, yaitu menguning pada bagian interveinal daun, bintik-bintik nekrotik kecil, mengeriting, dan gejala lanjutan akan menyebabkan daun tampak berwarna merah kecoklatan. TICV dapat ditularkan oleh Trialeurodes vaporariorum sedangkan ToCV dapat ditularkan oleh Bemisia tabaci biotipe A dan B,
Trialeurodes abutilonea, dan T. vaporarium. Penelitian ini bertujuan untuk mengidentifikasi virus-virus yang berasosiasi dengan penyakit klorosis pada tanaman tomat di Indonesia melalui RT-PCR dan sikuen nukleotida. Metode penelitian ini meliputi ekstraksi RNA virus, sintesis cDNA, amplifikasi DNA, visualisasi hasil RT-PCR, sikuen nukleotida dan analisis filogenetika dengan menggunakan program Bioedit V7.0.5, ClustalW, dan Genetyx versi 7. Berdasarkan hasil RT-PCR menggunakan primer spesifik menunjukkan bahwa amplifikasi TICV menghasilkan panjang pita DNA sebesar 417 bp dan ToCV sebesar 360 bp. Sikuen nukleotida produk RT-PCR tersebut memastikan bahwa penyakit klorosis pada tanaman tomat di Indonesia berasosiasi dengan infeksi TICV dan ToCV. Analisis homologi sikuen nukleotida dan filogenetika menunjukkan bahwa isolat TICV asal Indonesia tergabung dalam satu subsub kelompok dengan isolat TICV asal Jepang dan Spanyol. Adapun untuk isolat ToCV asal Indonesia tergabung ke dalam satu subsubkelompok dengan isolat ToCV asal Amerika.
Kata Kunci: Tomato Infectious Chlorosis Virus (TICV), Tomato Chlorosis Virus
IDENTIFIKASI
TOMATO INFECTIOUS CHLOROSIS VIRUS
DAN
TOMATO CHLOROSIS VIRUS
MELALUI
REVERSE
TRANSCRIPTION POLYMERASE CHAIN REACTION
(RT-PCR) DAN SIKUEN NUKLEOTIDA
SARI NURULITA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul skripsi : Identifikasi Tomato Infectious Chlorosis Virus dan Tomato Chlorosis Virus melalui Reverse Transcription Polymerase Chain Reaction (RT-PCR) dan Sikuen Nukleotida
Nama : Sari Nurulita
NRP : A34063298
Disetujui Pembimbing
Dr. Ir. I Gede Suastika, M.Sc. NIP. 19620607 198703 1 003
Diketahui
Ketua Departemen Proteksi Tanaman
Dr. Ir. Dadang, M.Sc. NIP. 19640204 199002 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Tuban pada tanggal 19 Juli 1988, anak ke tiga dari tiga
bersaudara putri pasangan Bapak Kamtari dan Ibu Suti’ah. Pada tahun 2006
penulis berhasil menyelesaikan pendidikan di SMA Negeri 1 Jatirogo dan pada tahun yang sama terdaftar sebagai mahasiswa IPB melalui jalur USMI.
Selama menuntut ilmu di IPB, penulis aktif di berbagai organisasi dan kegiatan kemahasiswaan, yaitu: Koran Kampus IPB (2007-2008); Himasita IPB (2007-2009); berbagai pelatihan dan seminar; menjadi asisten praktikum mata kuliah Biologi Patogen Tumbuhan (2008), Dasar-Dasar Proteksi Tanaman (2009), Hama dan Penyakit Tanaman Setahun (2009), Ilmu Penyakit Tumbuhan Dasar (2010), serta Hama dan Penyakit Tanaman Benih dan Pasca Panen (2010); Program Kreativitas Mahasiswa Bidang Penelitian (2010); serta Field Course Tropical Biodiversity and Assessment bersama mahasiswa dari University of Vienna, Austria (2010).
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan penulisan tugas akhir
yang berjudul “Identifikasi Tomato Infectious Chlorosis Virus dan Tomato Chlorosis Virus melalui Reverse Transcription Polymerase Chain Reaction (RT-PCR) dan Sikuen Nukleotida.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dr. Ir. Gede Suastika, M.Sc. selaku dosen pembimbing atas segala dukungan, nasehat, dan ilmu selama penelitian ini hingga terselesaikannya skripsi ini. Terima kasih tidak lupa penulis ucapkan kepada Dr. Ir. Pudjianto, M.Si. selaku dosen penguji tamu atas kritik, saran, dan nasehatnya. Ucapan terima kasih juga penulis haturkan kepada Dr. Ir. Kikin H. Mutaqin, M.Si. dan Dr. Ir. Damayanti Buchori, M.Sc. selaku dosen pembimbing akademik yang telah membimbing penulis selama belajar di Departemen Proteksi Tanaman.
Ucapan terima kasih penulis persembahkan kepada orang tua dan keluarga
atas segala do’a, kasih sayang yang tulus, dan dukungan yang tiada henti-hentinya; Virology Crew (Mbak Tuti Legiastuti, Pak Irwan Lakani, Herlie, Lara, Laras, Haryanto, Dillah, Bu Rita, Mbak Pipit, Kak Aceu, Bu Tri Asmira, Bu Asti, Bu Endang, Bu Ifa, Mbak Cici, Mbak Devi, dan Pak Edi); sahabatku (Vani Nur Oktaviany, Amelia Andriani, dan Lia Nazirah); teman-teman seperjuangan DPT 43, Yona Shylena, Alghienka Defaosandi, dan Meike Isna Rahmawati; adik-adikku DPT 44 dan 45; teman-teman kost Edelweis; teman-teman IPMRT Tuban; serta teman-teman field course 2010 atas dukungan, persahabatan, pembelajaran, inspirasi, serta segala pengalaman suka dan duka bersama penulis.
Penulis juga mengucapkan terima kasih kepada seluruh dosen dan staf Departemen Proteksi Tanaman serta berbagai pihak yang tidak dapat disebutkan satu per satu. Semoga hasil penelitian ini dapat bermanfaat bagi kita semua.
Bogor, Januari 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Tomato Infectious Chlorosis Virus (TICV) ... 4
Tomato Chlorosis Virus (ToCV) ... 5
BAHAN DAN METODE ... 7
Tempat dan Waktu Penelitian ... 7
Bahan dan Alat ... 7
Metode …………... 7
Ekstraksi RNA Total ……... 7
Sintesis Complementary (c) DNA ... 8
Amplifikasi DNA …... 9
Visualisasi Hasil RT-PCR ... 10
Sikuen Nukleotida dan Analisis Filogenetika ... 10
HASIL DAN PEMBAHASAN ... 11
Penyakit Klorosis pada Tanaman Tomat di Lapangan ……... 11
Deteksi dengan RT-PCR ... 12
Sikuen Nukleotida dan Analisis Filogenetika TICV ... 13
Sikuen Nukleotida dan Analisis Filogenetika ToCV... 15
KESIMPULAN DAN SARAN ……….. 18
Kesimpulan ……… 18
Saran ……….………… 18
DAFTAR PUSTAKA ... 19
DAFTAR TABEL
Halaman
1 Komposisi bahan RT-PCR untuk satu kali reaksi …….…………... 8 2 Komposisi bahan PCR untuk satu kali reaksi ……... 9
3 Tingkat kesamaan sikuen nukleotida sebagian gen coat protein (CP)
beberapa isolat TICV menggunakan program Bioedit V.7.0.5 ... 14 4 Tingkat kesamaan sikuen nukleotida sebagian gen minor coat
protein (CPm) beberapa isolat menggunakan program Bioedit
DAFTAR GAMBAR
Halaman 1 Gejala Crinivirus pada pertanaman tomat ………...………... 11 2 Hasil amplifikasi sample DNA Crinivirus dengan menggunakan
metode RT-PCR ….……….. 12 3 Perbandingan hasil sikuen nukleotida sebagian gen coat protein (CP)
TICV menggunakan program ClustalW……….. 13 4 Filogeni kekerabatan beberapa isolat TICV berdasarkan sebagian
gen coat protein (CP) menggunakan program Genetyx v 7 ……….… 15 5 Perbandingan hasil sikuen nukleotida sebagian gen minor coat
protein (CPm) ToCV menggunakan program ClustalW………. 16
6 Filogeni kekerabatan beberapa isolat ToCV berdasarkan sebagian
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Tomat (Licopersicon esculentum Mill.) merupakan salah satu produk hortikultura Indonesia yang mempunyai nilai ekonomis tinggi. Menurut BPS (2009), tomat merupakan komoditas yang relatif stabil produksinya. Produksi tomat mulai tahun 2005-2008 mengalami kenaikan, yaitu mulai dari 647.020 hingga 689.420 ton. Walaupun terus mengalami kenaikan, produksi tomat Indonesia belum mencapai tingkat yang optimal untuk skala industri.
Buah tomat banyak dimanfaatkan sebagai bahan berbagai olahan bernilai ekonomis. Selain sebagai pelengkap masakan, buah tomat dapat diolah menjadi minuman segar, saus, sari buah, dodol, maupun langsung dikonsumsi sebagai buah segar dan lalapan. Buah tomat mengandung berbagai senyawa penting bagi kesehatan manusia seperti vitamin A, B1, B2, C (Astawan 2008), kalori, β -karoten, flavonoid, dan likopen (Maskar & Gafur 2006).
Tomat merupakan salah satu tumbuhan perdu dari famili Solanaceae yang rentan terhadap berbagai organisme pengganggu tanaman (OPT) khususnya patogen. Berbagai penyakit penting seperti layu fusarium, layu bakteri, keriting atau mosaik sering menjadi kendala dalam budidaya tomat karena berpengaruh langsung terhadap kualitas serta kuantitas produksinya (Maskar & Gafur 2006). Beberapa tahun terakhir ini, dilaporkan bahwa penyakit baru yang disebabkan oleh Tomato Infectious Chlorosis Virus (TICV) dan Tomato Chlorosis Virus
(ToCV) mulai masuk dan menyerang sejumlah pertanaman tomat di Indonesia (Hartono & Wijonarko 2007; Suastika et al. 2010). Hasil penelitian sebuah perusahaan pertanian pada tahun 1993 melaporkan bahwa TICV pertama kali muncul dan menginfeksi tanaman tomat pada sejumlah tempat di negara bagian California seperti Orange, San Diego, San Benito, dan Orange County (Duffus et al. 1996). Berbeda dengan TICV, ToCV pertama kali ditemukan pada pertanaman tomat di Florida bagian Utara sekitar tahun 1996 (Wintermantel & Wisler 2006).
nekrotik kecil (Wintermantel & Wisler 2006), dan gejala lanjutan akan menyebabkan daun tampak berwarna merah kecoklatan (Wisler et al. 1998a).
Walaupun memiliki gejala yang hampir sama, TICV dan ToCV mempunyai vektor yang berbeda. TICV dapat ditularkan oleh Trialeurodes vaporariorum
(Duffus et al. 1996) ToCV dapat oleh Bemisia tabaci biotipe A dan B,
Trialeurodes abutilonea (Wisler et al. 1998b), dan T. vaporarium (Wintermantel & Wisler 2006).
TICV dan ToCV mempunyai kisaran inang yang luas. Tomat dan sejumlah tanaman dengan nilai ekonomi tinggi dari famili Solanaceae dan Compositae serta beberapa gulma merupakan inang potensial bagi penyebaran TICV (Duffus et al. 1996; EPPO 2005; Liu et al. 2000; Wisler et al. 1996) dan ToCV. Menurut Trenado et al. (2007) Physalis ixocarpa dan P. peruviana juga merupakan inang bagi ToCV.
Kisaran inang yang luas dan serangannya yang dapat menurunkan produksi pada berbagai komoditas penting, TICV dan ToCV menjadi masalah yang serius (Wintermantel & Wisler 2006). Walaupun gejala yang ditimbulkan tidak terdapat pada bunga dan buah, tetapi gejala yang terdapat pada daun dapat mengganggu proses fotosintesis. Hal ini menyebabkan penurunan produksi buah secara signifikan (Wisler et al. 1998a).
Metode pengenalan gejala yang tepat serta metode deteksi dan informasi yang lengkap merupakan komponen penting dalam pengandalian penyakit. Penelitian mengenai bioekologi vektor dan penyakit klorosis pada tanaman tomat berdasarkan ketinggian tempat telah dilaporkan oleh Fitriasari (2010). Akan tetapi, identifikasi virus-virus yang berasosiasi dengan penyakit klorosis melalui
reverse transcription- polymerase chain reaction (RT-PCR) dan sikuen nukleotida belum pernah dilakukan di Indonesia.
Tujuan Penelitian
3
Manfaat Penelitian
TINJAUAN PUSTAKA
Tomato Infectious Chlorosis Virus (TICV)
TICV merupakan patogen yang berasal dari genus Crinivirus dan famili
Closteroviridae (Fauquet et al. 2005). Pengelompokan famili Closteroviridae ini berdasarkan pada panjang partikel dan sepasang genom ssRNA (Fauquet et al.
2005; Hull 2002). Menurut Wisler et al. (1998b), pengelompokan berdasarkan panjang partikel merupakan ciri khusus virus yang ditularkan oleh kutudaun secara semipersisten.
Adapun pengelompokan berdasarkan sepasang genom ssRNA merupakan virus yang ditularkan oleh kutukebul yang mempunyai partikel pendek. Sejumlah virus yang ditularkan melalui vektor kutukebul mempunyai sepasang genom ssRNA, yaitu genom RNA 1 dengan panjang 7,8 kb dan RNA 2 panjangnya 7,4 kb ( Li et al. 1998). RNA 1 mengandung beberapa gen yang produknya berfungsi dalam replikasi virus, sedangkan produk gen yang terdapat pada RNA 2 berfungsi dalam pergerakan partikel virus dari sel ke sel dan penularan melalui serangga vektornya (Wintermantel et al. 2009).
Partikel TICV ini mempunyai panjang rata-rata 645 nm, panjangnya mulai dari 850-900 nm, dan partikel terpanjang mencapai 1.600 nm (Duffus et al. 1996; Liu et al. 2000). TICV merupakan virus yang bertahan di jaringan floem dalam jumlah yang sedikit (Wintermantel 2004).
TICV pertama kali ditemukan pada tahun 1993 di sejumlah tempat di Negara Bagian California seperti Orange, San Diego, San Benito, dan Yolo County. Berbagai tanaman hortikultura penting dan bernilai ekonomi tinggi dapat menjadi inang potensial bagi penyebaran TICV (Duffus et al. 1996). Berbagai tanaman penting yang susep terhadap TICV tersebut di antaranya adalah tomat (L. esculentum), kentang (Solanum tuberosum), letus (Lactuca sativa), dan kenopodium (Chenopodium capitatum) (Li et al. 1998).
5
sebagian besar terlihat jelas pada bagian daun, tetapi beberapa virus juga menyebabkan gejala berupa garis-garis seperti belang pada bagian batang, buah, dan akar.
Terdapat beberapa cara penularan virus dari tanaman satu ke tanaman lain. Cara penularan virus meliputi gesekan dengan bagian vegetatif tumbuhan, pelukaan mekanik dengan sap inokulum, terbawa benih, dan melalui vektor spesifik seperti serangga, nematoda, dan cendawan (Agrios 2005). TICV merupakan virus yang ditularkan oleh vektor serangga, yaitu T. vaporariorum
(Duffus et al. 1996; Wintermantel 2004).
Daerah persebaran TICV kini semakin meluas hingga ke Asia dan Eropa. Daerah persebaran TICV di Eropa meliputi beberapa negara seperti Italia (Wisler
et al. 1998a), Yunani (Dovas et al. 2002), Spanyol (Lozano et al. 2006). Adapun untuk persebaran TICV di Asia meliputi Taiwan (Tsai et al. 2004); Jepang (Hartono et al. 2003); dan Indonesia (Hartono & Wijonarko 2007; Suastika et al. 2010).
Tomato Chlorosis Virus (ToCV)
ToCV merupakan anggota kedua dari Genus Criniviruse setelah TICV dan masuk ke dalam famili Closteroviridae (Fauquet et al. 2005, Wintermantel & Wisler 2006; Wisler et al. 1998b). Seperti halnya famili Closteroviridae yang lain, ToCV mempunyai panjang partikel sekitar 850 nm dengan bentuk seperti benang (EPPO 2005; Wisler et al. 1996), membentuk badan inklusi di dalam jaringan floem, dan mempunyai sepasang genom. Sepasang genom ToCV ini terdiri dari RNA 1 dan RNA 2 dengan panjang masing-masing sebesar 7,8 dan 8,2 kb (Wisler
et al. 1996).
RNA 1 mengkode dua jenis protein yang terlibat dalam replikasi virus, sedangkan RNA 2 mengandung beberapa gen, sebuah protein berukuran 60 kDA, dan dua jenis protein selubung, yaitu Coat Protein major (CP) dan Coat Protein minor (CPm). CPm pada ToCV merupakan bagian ujung virion yang berfungsi dalam penularan dengan reseptornya, yaitu T. vaporariorum dan B. tabaci
1998b), dan T. vaporarium (Wintermantel & Wisler 2006). Vektor yang paling berpotensi dalam penularan ToCV dilihat dari persistensinya adalah B. tabaci
biotipe A, diikuti oleh B. tabaci biotipe B, T. abutilonea, dan T. vaporarium
(Wintermantel & Wisler 2006). Walaupun TICV dan ToCV keduanya mempunyai vektor yang sama, yaitu T. vaporarium, akan tetapi kedua virus ini dapat dibedakan melalui deteksi differensial molekular dan pengamatan gejala pada tanaman indikator N. benthamiana dan N. clevelandii (Wisler et al. 1998b).
Kisaran inang ToCV sangat luas, meliputi 24 tanaman dari tujuh famili yang berbeda, yaitu Aizoaceae, Amaranthaceae, Apocynaceae, Chenopodiaceae, Compositae, Plumbaginaceae, dan Solanaceae (Wintermantel & Wisler 2006). Selain itu, menurut Trenado et al. (2007), ToCV juga dapat menginfeksi gulma
Physalis ixocarpa dan P. peruviana.
Gejala akibat infeksi ToCV pada daun berupa klorotik berwarna kuning yang dimulai dari daun bawah dan menyebar hingga ke titik tumbuh, serta menguningnya bagian interveinal yang berkembang menjadi bercak-bercak nekrotik berwarna merah kecoklatan (Wisler et al. 1998a), mengeriting (Hirota et al. 2010), lebih tebal, dan krispi (EPPO 2005; Wisler et al. 1996). Gejala yang mengakibatkan terhambatnya proses fotosintesis pada daun ini mengakibatkan penurunan produksi tomat (Wisler et al. 1998a).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Survei penyakit klorosis dan koleksi tanaman sakit dilakukan di sejumlah pertanaman tomat di daerah Cipanas, Garut, dan Lembang Jawa Barat. Identifikasi virus dilakukan di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan mulai Maret hingga November 2010.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini berupa satu set Qiagen RNeasy Plant Mini Kit, komponen RT PCR, dan PCR. Adapun alat yang digunakan berupa kamera digital, alat tulis, dan GPS.
Metode Ekstraksi RNA Total
Sebanyak 0,1 gram daun bergejala digerus dengan Nitrogen cair dan ditambahkan 450 µl buffer ekstraksi yang mengandung 1% merkaptoethanol. Hasil gerusan dimasukan ke dalam tabung mikro 2 ml dan diinkubasi pada suhu 56oC selama 10 menit. Sampel yang telah diinkubasi kemudian dimasukan ke dalam QIA shredder spin colomn yang berwarna ungu dan disentrifugasi dengan kecepatan 13.000 rpm selama 2 menit. Setelah itu, pipet supernatan tanpa menyentuh pelet ke dalam tabung mikro 2 ml dan tambahkan Ethanol 96% sebanyak 0,5 volume (± 225 µl). Suspensi tersebut dicampur rata dengan pipet.
ditambahkan pada colomn dan disentrifugasi selama 2 menit dengan kecepatan 10.000 rpm.
QIA shredder spin colomn pink kemudian dipindahkan ke dalam tabung koleksi baru dan disentrifugasi selama 1 menit dengan kecepatan 10.000 rpm untuk memastikan bahwa colomn telah kering. Setelah itu, QIA shredder spin colomn pink dipindahkan ke dalam tabung 1,5 ml kemudian ditambahkan RNeasy free water sebanyak 450 µl dan diamkan selama 10 menit. Setelah didiamkan selama 10 menit kemudian disentrifugasi kembali selama 1 menit dengan kecepatan 10.000 rpm untuk mendapatkan hasil ekstraksi berupa RNA total.
Sintesis Complementary (c) DNA
Reaksi Reverse Transcription (RT) atau transkipsi balik merupakan proses yang digunakan untuk merubah RNA menjadi DNA. Adapun komposisi yang digunakan dalam reaksi RT terdapat pada Tabel 1.
Tabel 1 Komposisi bahan RT PCR untuk satu kali reaksi
Komponen Volume (µl)
H2O 3,2
Buffer RT 10x 1
DTT 50 mM 0,35
dNTP 10 mM 2
MMuLV Rev 0,35
RNAse Inhibitor 0,35
Oligo d(T) 10 mM 0,75
RNA 2
Total volume 10
Penggunaan primer oligo d(T) pada RT-PCR ini ditujukan untuk amplifikasi
pada ujung 5’ dsRNA yang mempunyai poly(A)- dan poly(C)- sehingga forward
primer pada 3’ mempunyai poly(A)- semua (Wintermantel et al. 2009).
9
Amplifikasi DNA
PCR digunakan untuk memperbanyak pita DNA yang telah terbentuk dari proses RT. Adapun komposisi bahan yang digunakan dalam PCR terdapat pada Tabel 2.
Tabel 2 Komposisi bahan PCR untuk satu kali reaksi
Komponen Volume (µl)
H2O 16,3
Buffer 10x + Mg2+ 2,5
Sucrose cresol 10x 2,5
dNTP 10mM 0,5
Primer F 10µM 1
Primer R 10µM 1
Taq DNA pol 5 u/µl 0,2
cDNA 1
Total volume 25
Primer yang digunakan dalam proses PCR merupakan pasangan primer yang spesifik untuk mendeteksi TICV dan ToCV. Sikuen nukleotida primer yang spesifik untuk TICV yaitu TICV-CF (5’-AATCGGTAGTGACACGAGTAGCATC-3’) dan TICV-CR
(5’-CTTCAAACATCCTCCATCTGCC-3’) yang dapat mengamplifikasi genom virus pada bagian coat protein (CP) dengan produk PCR sebesar 417 bp. Sikuen nukleotida primer spesifik untuk deteksi ToCV adalah pasangan primer spesifik ToCV-CF
(5’-GTGTCAGGCCATTGTAAACCAAG-3’) dan ToCV-CR dengan sekuen (5’ -CACAAAGCGTTTCTTTTCATAAGCAGG-3’) yang dapat digunakan mengamplifikasi genom virus pada bagian minorcoat protein (CPm) sebesar 360 bp.
Program amplifikasi terdiri atas 30 siklus dengan tahapan predenaturasi pada suhu 94oC selama 4 menit, kemudian denaturasi (fase pemisahan utas DNA) pada suhu 94oC selama 1 menit, suhu 62oC selama 1 menit untuk annealing
Visualisasi Hasil RT-PCR
Amplifikasi DNA hasil PCR dilakukan dengan elektroforesis gel Agarosa 1%. Sebanyak 0,3 gram Agarosa dicampur dengan 30 ml buffer TBE dan dipanaskan hingga tercampur rata. Setelah larutan Agarosa tersebut hangat, kemudian ditambahkan Etidium Bromida sebanyak 0,5 x volume larutan per 10 ml, yaitu 1,5 µl. Larutan tersebut kemudian dituang ke dalam cetakan dan didiamkan selama satu jam. Setelah terbentuk gel, maka sebanyak 10 µl marker DNA dan 7 µl DNA hasil PCR dimasukkan masing-masing ke dalam sumur gel dan dilakukan elektroforesis. Elektroforesis dilakukan selama 60 menit dengan voltase sebesar 50V. DNA yang telah dielektroforesis kemudian divisualisasi di bawah UV transiluminator.
Sikuen Nukleotida dan Analisis Filogenetika
Sikuen-sikuen nukleotida dilakukan dengan pembuatan produk PCR sampel yang positif mengandung virus TICV dan ToCV sebanyak 50µl. Sampel tersebut kemudian dikirim ke PT Macrogen Inc., Seoul, Korea untuk dilakukan sikuen nukleotida.
Hasil sikuen nukleotida kemudian digunakan untuk analisis kesejajaran dengan sikuen nukleotida TICV atau ToCV yang telah dipublikasikan di
GeneBank dengan program BLAST (Basic Local Alignment Search Tools) (NCBI 2010). Data sikuen nukleotida yang terpilih kemudian dimodifikasi dan analisis spesifisitas nukleotida dilakukan dengan program multiple alignment, ClustalW dengan software Bioedit V7.0.5 sebelum dilakukan analisis filogenetika. Analisis filogenetika dilakukan dengan menggunakan program Genetyx versi 7 berdasarkan pendekatan Unweighted Pair Group Method with Arithmetic Mean
HASIL DAN PEMBAHASAN
Penyakit Klorosis pada Tanaman Tomat di Lapangan
Penyakit klorosis ditemukan telah menyerang semua varietas tomat yang dibudidayakan oleh petani di beberapa daerah sentra produksi tomat di Indonesia. Penyakit klorosis pada tanaman tomat di Indonesia pertama kali dilaporkan oleh Hartono & Wijonarko (2007) di daerah Magelang, Jawa Tengah. Penyakit
klorosis ini pada awalnya disebut sebagai “penyakit ungu” karena gejala lanjut
pada daun menunjukkan warna merah kecokelatan hingga keunguan (Hartono & Wijonarko 2007).
Penyakit klorosis ini juga sudah mulai masuk dan menyerang sejumlah sentra pertanaman tomat di Jawa Barat seperti, yaitu di daerah Cipanas, Lembang, dan Garut (Fitriasari 2010; Suastika et al. 2010). Penyakit klorosis ini menyerang dan menimbulkan gejala pada semua varietas yang ditanam, yaitu Shinta, Warani, dan Martha.
Berdasarkan pengamatan di lapangan, terlihat bahwa gejala penyakit klorosis berasosiasi dengan adanya populasi kutukebul sebagai vektor penyakit. Gejala yang tampak di lapangan berupa menguningnya jaringan interveinal daun bagian yang lebih bawah. Gejala lebih lanjut menunjukkan perubahan warna dari kekuningan menjadi merah kecoklatan dan daun terlihat agak mengeriting (Gambar 1).
Gambar 1 Gejala penyakit klorosis pada pertanaman tomat di Cipanas (A), Lembang (B), Garut (C), D = gejala awal dan E = gejala lanjut penyakit klorosis
Vektor yang ditemukan di lapangan adalah kutukebul T. vaporariorum dan
B. tabaci. Populasi vektor di lapangan pada ketinggian lebih dari 1000 m dpl lebih didominasi oleh T. vaporariorum, sedangkan pada ketinggian kurang dari 1000 m dpl jumlah populasi B. tabaci lebih banyak. Hal ini sesuai dengan hasil penelitian Fitriasari (2010) yang menyatakan bahwa faktor ketinggian tempat mempengaruhi jumlah populasi kutukebul yang berperan sebagai vektor penyakit klorosis. Selain itu, populasi kutukebul dipengaruhi juga oleh kondisi cuaca. Pada musim hujan, rata-rata populasi kutukebul di lapangan mengalami penurunan. Sebaliknya, pada musim kemarau populasi kutukebul di lapangan mengalami kenaikan.
Deteksi dengan RT-PCR
Sampel pada ketiga daerah survey yang diambil berasal dari varietas Warani, Sintha, dan Martha. Sampel tersebut kemudian dideteksi dengan RT-PCR untuk mendapatkan isolat yang positif mengandung virus TICV dan ToCV. Berdasarkan deteksi RT-PCR terlihat bahwa sampel dari ketiga daerah tersebut positif terserang Crinivirus (Andriani 2011, komunikasi pribadi).
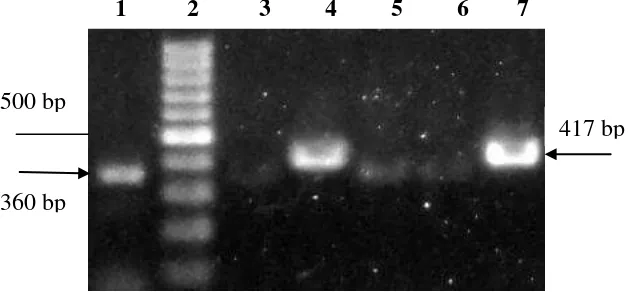
Pada penelitian ini, deteksi dengan RT-PCR hanya berhasil mengamplifikasi sample tanaman yang berasal dari daerah Cipanas. Kedua isolat dari varietas Warani dan Sinta positif mengandung virus TICV serta varietas Ratna positif mengandung virus ToCV (Gambar 2).
Gambar 2 Hasil amplifikasi sampel DNA Crinivirus dari lapangan dengan menggunakan metode RT-PCR. Lajur 1: ToCV varietas Ratna Cipanas (+), Lajur 2: marker DNA 100 bp, Lajur 3: sampel asal Lembang (-), Lajur 4: TICV varietas Sintha Cipanas (+), Lajur 5 dan 6: sampel asal Garut (-), Lajur 7: TICV varietas Warini Cipanas (+) 500 bp
360 bp
417 bp
13
Amplifikasi dengan teknik RT-PCR menggunakan pasangan TICV-CF dan TICV-CR berhasil mendapatkan fragmen virus TICV dengan ukuran sebesar 417 bp. Adapun pasangan ToCV-CF dan ToCV-CR berhasil mendapatkan fragmen virus ToCV dengan ukuran sebesar 360 bp. Besaran fragmen DNA hasil amplifikasi ini sesuai dengan primer yang didesain untuk kedua virus tersebut (Hirota et al. 2009). Fragmen DNA hasil PCR selanjutnya digunakan dalam sikuen nukleotida.
Sikuen Nukleotida dan Analisis Filogenetika TICV
Analisis perunutan nukleotida dengan ClustalW menunjukkan bahwa gen protein selubung TICV asal Indonesia memiliki homologi dengan TICV yang berasal dari negara lain seperti Amerika, Italia, Jepang, Perancis, dan Spanyol (Gambar 3).
AMERIKA 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 INDONESIA 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 ITALIA 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 JEPANG 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 PERANCIS 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 SPANYOL 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 ************************************************************ AMERIKA 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 INDONESIA 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 ITALIA 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 JEPANG 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 PERANCIS 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 SPANYOL 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 *********************************************************
Gambar 3 Perbandingan hasil sikuen nukleotida sebagian gen coat protein (CP) TICV asal Indonesia, Amerika, Italia, Jepang, Perancis, dan Spanyol menggunakan program ClustalW [tanda * menunjukkan nukleotida
yang identik]
Hal ini juga terlihat berdasarkan similaritas berdasarkan nilai penyejajaran (alignment score) yang mengindikasikan kesamaan urutan nukleotida antar isolat walaupun tidak semuanya 100% (Tabel 3).
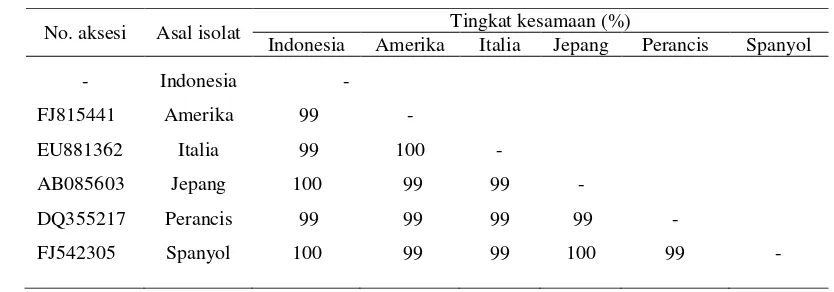
Hasil analisis pada Tabel 3 menunjukkan bahwa sikuen gen CPm isolat TICV asal Indonesia sama dengan yang berasal dari Jepang dan Spanyol, tetapi berbeda sedikit atau mempunyai kemiripan 99% dengan isolat asal Amerika, Italia, dan Perancis. Menurut Fauquet et al. (2005) apabila terdapat persamaan sikuen nukleotida dari gen protein selubung antara satu virus dengan virus yang lain dengan nilai lebih dari 90%, maka virus-virus tersebut merupakan spesies virus yang sama. Berdasarkan hasil tersebut maka dapat dikatakan bahwa isolat TICV yang menyerang sejumlah pertanaman tomat di beberapa negara termasuk Indonesia adalah spesies yang sama.
Tabel 3 Tingkat kesamaan sikuen nukleotida sebagian gen coat protein (CP) isolat TICV asal Indonesia, Amerika, Italia, Jepang, Perancis, dan Spanyol menggunakan program Bioedit V.7.0.5
No. aksesi Asal isolat Tingkat kesamaan (%)
Indonesia Amerika Italia Jepang Perancis Spanyol
- Indonesia -
FJ815441 Amerika 99 -
EU881362 Italia 99 100 -
AB085603 Jepang 100 99 99 -
DQ355217 Perancis 99 99 99 99 -
15
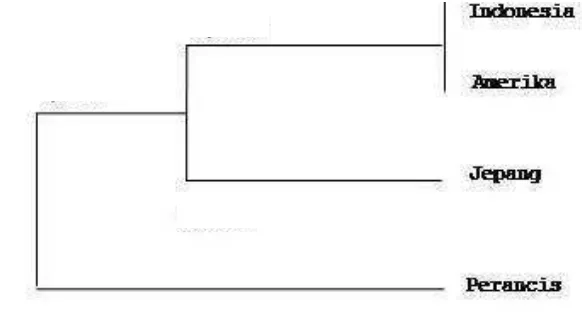
Analisis filogenetika pada kladogram menunjukkan bahwa hubungan kekerabatan keenam isolat tersebut terbagi menjadi dua sub kelompok (Gambar 4). Subkelompok pertama terbagi lagi menjadi dua subsubkelompok, yaitu subsubkelompok I yang terdiri dari isolat asal Jepang, Spanyol, dan Indonesia, sedangkan subsubkelompok II hanya terdiri dari isolat asal Perancis. Subkelompok ke dua terdiri dari isolat asal Amerika dan Italia. Kedekatan hubungan kekerabatan isolat TICV asal Indonesia dengan isolat TICV asal Jepang dengan homologi 100% sesuai dengan hasil penelitian sebelumnya yang dilaporkan oleh Hartono & Wijonarko (2007).
Gambar 4 Filogenetika kekerabatan isolat-isolat TICV asal Indonesia, Amerika, Italia, Jepang, Perancis, dan Spanyol berdasarkan sikuen nukleotida sebagian gen coat protein (CP) menggunakan program Genetyx v7
Sikuen Nukleotida dan Analisis Filogenetika ToCV
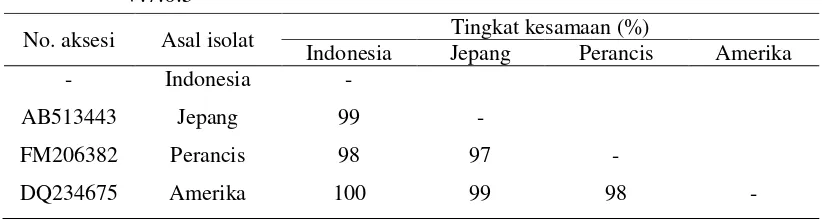
Analisis similaritas berdasarkan nilai penyejajaran (alignment score) menunjukkan bahwa isolat ToCV asal Indonesia memiliki nilai kesamaan lebih dari 90% dengan isolat dari tiga negara lainnya (Tabel 4). Berdasarkan Tabel 4 terlihat bahwa isolat ToCV asal Indonesia sama dengan isolat ToCV asal Amerika dengan nilai kemiripan sebesar 100%.
Tabel 4 Tingkat kesamaan sikuen nukleotida sebagian dari gen minor coat protein (CPm) beberapa isolat ToCV menggunakan program Bioedit
V.7.0.5
No. aksesi Asal isolat Tingkat kesamaan (%)
Indonesia Jepang Perancis Amerika - Indonesia -
AB513443 Jepang 99 -
FM206382 Perancis 98 97 -
Analisis perunutan nukleotida dengan ClustalW menunjukkan bahwa gen protein selubung ToCV asal Indonesia memiliki homologi dengan ToCV yang berasal dari negara lain seperti Jepang, Perancis, dan Amerika (Gambar 5).
NDONESIA 1:ATATCTACCTTGACTCAGGAAGAGGATAAGATACTGAACTTTGCGCGATATCGGTAGACC 60 JEPANG 1:ATATCCACCTTGACTCAGGAAGAGGATAAGATACTGAACTTTGCGCGATATCGGTAGACC 60 PERANCIS 1:ATATCTACCTTGACTCAGGAAGAGGATAAGATACTGAACTTTGCGCGATATCGGTAGACC 60 AMERIKA 1:ATATCTACCTTGACTCAGGAAGAGGATAAGATACTGAACTTTGCGCGATATCGGTAGACC 60 *****.****************************************************** INDONESIA 61:GACTAAATTTTCGTTTCTCAGTCTATGTGTCAGGCCATTGTAAACCAAGGGACCTCAGTT 120 JEPANG 61:GACTAAATTTTCGTTTTTCAGTCTATGTGTCAGGCCATTGTAAACCAAGGGACCTCAGTT 120 PERANCIS 61:GACTAAATTTTTGTTTCTCAGTCTATGTGTCAGGCCATTGTAAACCAAGGGACCTCAGTT 120 AMERIKA 61:GACTAAATTTTCGTTTCTCAGTCTATGTGTCAGGCCATTGTAAACCAAGGGACCTCAGTT 120 ***********.****.******************************************* INDONESIA 121:AAAGCAGCCGGTAATAACAGTCTTGAAAACTACTTTGAGGTAGATGGTGCGAGATTTAAT 180 JEPANG 121:AAAGCAGCCGGTAATAACAGTCTTGAAAACTACTTTGAGGTAGATGGTGCGAGATTTAAT 180 PERANCIS 121:AAGGCAGCCGGTAATAGCAGTCTTGAAAATTACTTTGAGGTAGATGGTGCGAGATTTAAT 180 AMERIKA 121:AAAGCAGCCGGTAATAACAGTCTTGAAAACTACTTTGAGGTAGATGGTGCGAGATTTAAT 180 **.*************.************.****************************** INDONESIA 181:GGAAAACTCCGGATTTGATAAATGAGGTTAGACCCAAAATGTCCGATGTTCCAAACGCTA 240 JEPANG 181:GGAAAACTCCGGATTTGATAAATGAGGTTAGACCCAAAATGTCCGATGTTCCAAACGCTA 240 PERANCIS 181:GGAAAACTCCGGATTTGATAAATGAGGTTAGACCCAAAATGTCCGATGTTCCGAACGCTA 240 AMERIKA 181:GGAAAACTCCGGATTTGATAAATGAGGTTAGACCCAAAATGTCCGATGTTCCAAACGCTA 240 ****************************************************.******* INDONESIA 241:TACGTGGTACGCCAGAAGTCATGAAAAGATTATTCTTTATCCGGTCTTATTAAGCCTGAT 300 JEPANG 241:TACGTGGTACGCCAGAAGTCATGAAAAGATTATTCTTTATCCGGTCTTATTAAGCCTGAT 300 PERANCIS 241:TACGTGGTACGCCAGGAGTCATGAAAAGATTATTCTTTATCCGGTCTTATTAAGCCTGAT 300 AMERIKA 241:TACGTGGTACGCCAGAAGTCATGAAAAGATTATTCTTTATCCGGTCTTATTAAGCCTGAT 300 ***************.******************************************** INDONESIA 301:TATCATTTACAATTCAAACATGGCGTATTACCAAGCCATGGTACCGGCGATTATATAAAT 360 JEPANG 301:TATCATTTACAATTCAAACATGGCGTATTACCAAGCCATGGTACCGGCGATTATATAAAT 360 PERANCIS 301:TATCATTTACAATTCAAACATGGCGTACTACCAAGCCATGGTACCGGCGATTATATAAAT 360 AMERIKA 301:TATCATTTACAATTCAAACATGGCGTATTACCAAGCCATGGTACCGGCGATTATATAAAT 360 ***************************.********************************
Gambar 5 Perbandingan hasil sikuen nukleotida sebagian dari gen minor coat protein (CPm) ToCV asal Indonesia, Jepang, Perancis, dan Amerika menggunakan program ClustalW [tanda * menunjukkan nukleotida yang identik]
Seperti halnya dengan TICV, analisis filogenetika ToCV pada kladogram menunjukkan bahwa hubungan kekerabatan keempat isolat tersebut terbagi menjadi dua subkelompok (Gambar 6). Subkelompok pertama terbagi lagi menjadi dua subsubkelompok, yaitu subsubkelompok I yang terdiri dari isolat asal Indonesia dan Amerika, sedangkan subsubkelompok II hanya terdiri dari isolat asal Jepang. Subkelompok kedua adalah isolat ToCV asal Perancis.
17
dapat diindikasikan bahwa ToCV yang ada di Indonesia mungkin berasal dari Amerika dan Jepang. Hal ini diperkuat pada penggunaan primer spesifik pasangan ToCV-CF dan ToCV-CR yang pada penelitian sebelumnya juga digunakan untuk mendeteksi isolat ToCV asal Jepang (Hirota et al. 2010). Primer spesifik pasangan ToCV-CF dan ToCV-CR tersebut didesain berdasarkan pada kedekatan hubungan kekerabatan dengan isolat asal Amerika (Hirota et al. 2010).
Gambar 6 Filogenetika kekerabatan isolat-isolat ToCV asal Indonesia, Jepang, Perancis, dan Amerika berdasarkan sikuen nukleotida sebagian gen
minor coat protein (CPm) menggunakan program Genetyx v 7
Berdasarkan primer spesifik yang digunakan, deteksi melalui RT-PCR dan sikuen nukleotida baik pada TICV maupun ToCV hanya mampu mengamplifikasi sebagian panjang genom. Sikuen TICV sebesar 417 bp dan ToCV sebesar 360 bp dari panjang sebenarnya yang berkisar antara 740-780 bp.
KESIMPULAN DAN SARAN
Kesimpulan
Melalui RT-PCR dan sikuen nukleotida sebagian genom virus dapat disimpulkan bahwa penyakit klorosis pada tanaman tomat di Indonesia berasosiasi dengan infeksi TICV dan ToCV, seperti yang sudah dilaporkan terjadi di beberapa negara penghasil tomat dunia. Analisis secara filogenetika menunjukkan bahwa isolat TICV asal Indonesia tergabung dalam satu sub kelompok dengan isolat TICV asal Jepang dan Spanyol. Adapun untuk isolat ToCV asal Indonesia tergabung ke dalam satu sub kelompok dengan isolat ToCV asal Amerika.
Saran
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed ke-5. London: Elsevier Academic Press. Astawan M. 2008. Sehat bersama tomat. Kompas 12 Oktober 2008 [on-line].
http://www.kompas.com [20 April 2009].
[BPS] Badan Pusat Statistik. 2009. Production of Vegetables in Indonesia. Jakarta: BPS.
Dovas CI, Katis NI. 2002. Multiplex detection of criniviruses associated with epidemics of a yellowing disease of tomato in Greece. Plant Disease 86: 1345-1349.
Duffus JE, Liu HY, Wisler GC. 1996. Tomato infectious chlorosis virus-a new clostero-like virus transmitted by Trialeurodes vaporariorum. European Journal of Plant Pathology 102: 219-226.
[EPPO] European and Mediterranean Plant Protection Organization. 2005.
Tomato chlorosis crinivirus. Bulletin EPPO 35: 439-441.
Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA, editor. 2005. Virus Taxonomy Eight Report of the International Committee on Taxonomy of Viruses. San Diego: Virol Div Int Union of Microb Soc. Fitriasari ED. 2010. Keefektifan kutukebul dalam menularkan virus penyebab
penyakit kuning pada tanaman tomat [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor
Hartono S, Natsuki T, Sayama H, Atarashi H, Okuda S. 2003. Yellowing disease of tomatoes caused by Tomato infectious chlorosis virus newly recognized in Japan. Journal of General Plant Pathology 69: 61-64.
Hartono S, Wijonarko A. 2007. Karakterisasi biologi molekuler Tomato Infectious Chlorosis Virus penyebab penyakit kuning pada tanaman tomat di Indonesia. Akta Agrosia 2: 139-146.
Hirota T, Natsuaki T, Murai T, Nishigawa H, Niibori K, Goto K, Hartono S, Suastika G, Okuda S. 2010. Yellowing disease of tomato caused by
Tomato chlorosis virus newly recognized in Japan. J Gen Plant Pathol 76: 168-171.
Hull R. 2002. Matthew’s Plant Virology. Ed ke-4. San Diego: Academic Press. Li RH, Wisler GC, Liu HY, Duffus JE. 1998. Comparison of diagnostic
techniques for detecting tomato invectious chlorosis virus. Plant Disease
82(1): 84-86.
Liu HY, Wisler GC, Duffus JE. 2000. Particle lengths of whitefly-transmitted criniviruses. Plant Disease 84: 803-805.
Martelli GP, Agranovsky AA, Bar-Joseph M. 2002. The family closteroviridae revised. Arch Virol 147: 2039-2044.
Maskar, Gafur S. 2006. Budidaya Tomat. Balitbang Pertanian Sulawesi Tengah: Agro Inovasi.
[NCBI] National Center for Biotechnology Information. 2010. Basic Local Alignment Search Tool. http://www.ncbi.nlm.nih.gov/BLAST [11 Desember 2010].
Suastika G, Hartono S, Nishigawa H, Natsuaki T. 2010. Yellowing disease outbreaks in tomato in Indonesia associated with infection of tomato chlorosis virus and tomato infectious chlorosis virus. Abstract ISSAAS International Congress 2010: Agricultural Adaptation in Response to Climate Change; Sanur, Bali, Indonesia14th-18th November 2010.
Sudiono, Yasin N. 2006. Karakterisasi kutukebul (Bemisia tabaci) sebagai vektor virus gemini dengan teknik PCR-RAPD. J. HPT Tropika 6(2): 113-119. Trenado HP, Fortes IM, Louro D, Navas-Castillo J. 2007. Physalis ixocarpa and
P. peruviana, new natural hosts of Tomato chlorosis virus. Eur J Plant Pathol 118: 193-196.
Tsai WS, Shih SL, Green SK, Hanson P. 2004. First report of the occurrence of
Tomato infectious chlorosis virus in Taiwan. Plant Disease 88: 311.
Wintermantel WM. 2004. Emergence of green house whitefly (Trialeurodes vaporariorum) transmitted criniviruses as threats to vegetable and fruit production in North America. APS Net [jurnal on-line]. http://www.apsnet.org/online/feature/whitefly/whitefly.pdf [24 Maret 2009].
Wintermantel WM, Wisler GC. 2006. Vector specificity, host range, and genetic diversity of Tomato chlorosis virus. Plant Disease 90: 814-819.
Wintermantel WM, Hladky LL, Gulati-Sakhuja A, Li R, Liu HY, Tzanetakis IE. 2009. The complete nucleotide sequence and genome organization of tomato infectious chlorosis virus: a distinct crinivirus most closely related to lettuce infectious yellow virus. Arch Virol 154: 1335-1342.
Wisler GC, Liu HY, Klaassen VA, Duffus JE, Falk BW. 1996. Tomato infectious chlorosis virus has a bipartite genome and induces phloem limited inclusions characteristic of the closteroviruses. Phytopathology 86: 622-626.
Wisler GC, Duffus JE, Liu HY, Li RH. 1998a. Ecology and epidemiology of whitefly-transmitted closteroviruses. Plant Disease 82(3): 270-280.
Lampiran 1 Hasil sikuen nukleotida gen CPm TICV isolat asal Indonesia
10 20 30 40 50 60
ACCTCAACTG ACTTCTACAC ATTCGTTTTT AAAAATCGGT AGTGACACGA GTAGCATCAA
70 80 90 100 110 120
ACCTGTAAAA AATGATGTGT TAATAGAAAA AATAAAAACC TTTGAAGATA TCCTGGTCGC
130 140 150 160 170 180
AGCTGTTGAA GATCATAAAG ACATAGAGGA AGATAGATCA AAATATGAAC TACCTGACGT
190 200 210 220 230 240
AACGTCTGAA TTTCAACAGG AAGATAAGAT AAAACAAGTG AGGTTGTATG ACGTGTTGGA
250 260 270 280 290 300
TTGTGGTGGC AAATCTTTCT CCACTTTAAC CATTAACGCA AAATTTAAGC CTTTCAAATT
310 320 330 340 350 360
TGTAGATATG GTTAACTTAT TGCAGTTGTG GTATGGAGAC TCAAAATCTA ACAATTTAGA
370 380 390 400 410 420
23
Lampiran 2 Hasil sikuen nukleotida gen CP ToCV isolat asal Indonesia
10 20 30 40 50 60
ATATCTACCT TGACTCAGGA AGAGGATAAG ATACTGAACT TTGCGCGATA TCGGTAGACC
70 80 90 100 110 120
GACTAAATTT TCGTTTCTCA GTCTATGTGT CAGGCCATTG TAAACCAAGG GACCTCAGTT
130 140 150 160 170 180
AAAGCAGCCG GTAATAACAG TCTTGAAAAC TACTTTGAGG TAGATGGTGC GAGATTTAAT
190 200 210 220 230 240
GGAAAACTCC GGATTTGATA AATGAGGTTA GACCCAAAAT GTCCGATGTT CCAAACGCTA
250 260 270 280 290 300
TACGTGGTAC GCCAGAAGTC ATGAAAAGAT TATTCTTTAT CCGGTCTTAT TAAGCCTGAT
310 320 330 340 350 360
IDENTIFIKASI
TOMATO INFECTIOUS CHLOROSIS VIRUS
DAN
TOMATO CHLOROSIS VIRUS
MELALUI
REVERSE
TRANSCRIPTION POLYMERASE CHAIN REACTION
(RT-PCR) DAN SIKUEN NUKLEOTIDA
SARI NURULITA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
SARI NURULITA. Identifikasi Tomato Infectious Chlorosis Virus dan Tomato Chlorosis Virus melalui Reverse Transcription Polymerase Chain Reaction (RT-PCR) dan Sikuen Nukleotida. Dibimbing oleh GEDE SUASTIKA.
Tomato Infectious Chlorosis Virus (TICV) dan Tomato Chlorosis Virus
(ToCV) beberapa tahun ini dilaporkan mulai masuk dan menyerang sejumlah pertanaman tomat di Indonesia. TICV dan ToCV merupakan patogen yang berasal dari genus Crinivirus dan famili Closteroviridae. Penyakit yang ditimbulkan oleh TICV dan ToCV ini mempunyai gejala yang hampir sama di lapangan, yaitu menguning pada bagian interveinal daun, bintik-bintik nekrotik kecil, mengeriting, dan gejala lanjutan akan menyebabkan daun tampak berwarna merah kecoklatan. TICV dapat ditularkan oleh Trialeurodes vaporariorum sedangkan ToCV dapat ditularkan oleh Bemisia tabaci biotipe A dan B,
Trialeurodes abutilonea, dan T. vaporarium. Penelitian ini bertujuan untuk mengidentifikasi virus-virus yang berasosiasi dengan penyakit klorosis pada tanaman tomat di Indonesia melalui RT-PCR dan sikuen nukleotida. Metode penelitian ini meliputi ekstraksi RNA virus, sintesis cDNA, amplifikasi DNA, visualisasi hasil RT-PCR, sikuen nukleotida dan analisis filogenetika dengan menggunakan program Bioedit V7.0.5, ClustalW, dan Genetyx versi 7. Berdasarkan hasil RT-PCR menggunakan primer spesifik menunjukkan bahwa amplifikasi TICV menghasilkan panjang pita DNA sebesar 417 bp dan ToCV sebesar 360 bp. Sikuen nukleotida produk RT-PCR tersebut memastikan bahwa penyakit klorosis pada tanaman tomat di Indonesia berasosiasi dengan infeksi TICV dan ToCV. Analisis homologi sikuen nukleotida dan filogenetika menunjukkan bahwa isolat TICV asal Indonesia tergabung dalam satu subsub kelompok dengan isolat TICV asal Jepang dan Spanyol. Adapun untuk isolat ToCV asal Indonesia tergabung ke dalam satu subsubkelompok dengan isolat ToCV asal Amerika.
Kata Kunci: Tomato Infectious Chlorosis Virus (TICV), Tomato Chlorosis Virus
PENDAHULUAN
Latar Belakang
Tomat (Licopersicon esculentum Mill.) merupakan salah satu produk hortikultura Indonesia yang mempunyai nilai ekonomis tinggi. Menurut BPS (2009), tomat merupakan komoditas yang relatif stabil produksinya. Produksi tomat mulai tahun 2005-2008 mengalami kenaikan, yaitu mulai dari 647.020 hingga 689.420 ton. Walaupun terus mengalami kenaikan, produksi tomat Indonesia belum mencapai tingkat yang optimal untuk skala industri.
Buah tomat banyak dimanfaatkan sebagai bahan berbagai olahan bernilai ekonomis. Selain sebagai pelengkap masakan, buah tomat dapat diolah menjadi minuman segar, saus, sari buah, dodol, maupun langsung dikonsumsi sebagai buah segar dan lalapan. Buah tomat mengandung berbagai senyawa penting bagi kesehatan manusia seperti vitamin A, B1, B2, C (Astawan 2008), kalori, β -karoten, flavonoid, dan likopen (Maskar & Gafur 2006).
Tomat merupakan salah satu tumbuhan perdu dari famili Solanaceae yang rentan terhadap berbagai organisme pengganggu tanaman (OPT) khususnya patogen. Berbagai penyakit penting seperti layu fusarium, layu bakteri, keriting atau mosaik sering menjadi kendala dalam budidaya tomat karena berpengaruh langsung terhadap kualitas serta kuantitas produksinya (Maskar & Gafur 2006). Beberapa tahun terakhir ini, dilaporkan bahwa penyakit baru yang disebabkan oleh Tomato Infectious Chlorosis Virus (TICV) dan Tomato Chlorosis Virus
(ToCV) mulai masuk dan menyerang sejumlah pertanaman tomat di Indonesia (Hartono & Wijonarko 2007; Suastika et al. 2010). Hasil penelitian sebuah perusahaan pertanian pada tahun 1993 melaporkan bahwa TICV pertama kali muncul dan menginfeksi tanaman tomat pada sejumlah tempat di negara bagian California seperti Orange, San Diego, San Benito, dan Orange County (Duffus et al. 1996). Berbeda dengan TICV, ToCV pertama kali ditemukan pada pertanaman tomat di Florida bagian Utara sekitar tahun 1996 (Wintermantel & Wisler 2006).
nekrotik kecil (Wintermantel & Wisler 2006), dan gejala lanjutan akan menyebabkan daun tampak berwarna merah kecoklatan (Wisler et al. 1998a).
Walaupun memiliki gejala yang hampir sama, TICV dan ToCV mempunyai vektor yang berbeda. TICV dapat ditularkan oleh Trialeurodes vaporariorum
(Duffus et al. 1996) ToCV dapat oleh Bemisia tabaci biotipe A dan B,
Trialeurodes abutilonea (Wisler et al. 1998b), dan T. vaporarium (Wintermantel & Wisler 2006).
TICV dan ToCV mempunyai kisaran inang yang luas. Tomat dan sejumlah tanaman dengan nilai ekonomi tinggi dari famili Solanaceae dan Compositae serta beberapa gulma merupakan inang potensial bagi penyebaran TICV (Duffus et al. 1996; EPPO 2005; Liu et al. 2000; Wisler et al. 1996) dan ToCV. Menurut Trenado et al. (2007) Physalis ixocarpa dan P. peruviana juga merupakan inang bagi ToCV.
Kisaran inang yang luas dan serangannya yang dapat menurunkan produksi pada berbagai komoditas penting, TICV dan ToCV menjadi masalah yang serius (Wintermantel & Wisler 2006). Walaupun gejala yang ditimbulkan tidak terdapat pada bunga dan buah, tetapi gejala yang terdapat pada daun dapat mengganggu proses fotosintesis. Hal ini menyebabkan penurunan produksi buah secara signifikan (Wisler et al. 1998a).
Metode pengenalan gejala yang tepat serta metode deteksi dan informasi yang lengkap merupakan komponen penting dalam pengandalian penyakit. Penelitian mengenai bioekologi vektor dan penyakit klorosis pada tanaman tomat berdasarkan ketinggian tempat telah dilaporkan oleh Fitriasari (2010). Akan tetapi, identifikasi virus-virus yang berasosiasi dengan penyakit klorosis melalui
reverse transcription- polymerase chain reaction (RT-PCR) dan sikuen nukleotida belum pernah dilakukan di Indonesia.
Tujuan Penelitian
3
Manfaat Penelitian
TINJAUAN PUSTAKA
Tomato Infectious Chlorosis Virus (TICV)
TICV merupakan patogen yang berasal dari genus Crinivirus dan famili
Closteroviridae (Fauquet et al. 2005). Pengelompokan famili Closteroviridae ini berdasarkan pada panjang partikel dan sepasang genom ssRNA (Fauquet et al.
2005; Hull 2002). Menurut Wisler et al. (1998b), pengelompokan berdasarkan panjang partikel merupakan ciri khusus virus yang ditularkan oleh kutudaun secara semipersisten.
Adapun pengelompokan berdasarkan sepasang genom ssRNA merupakan virus yang ditularkan oleh kutukebul yang mempunyai partikel pendek. Sejumlah virus yang ditularkan melalui vektor kutukebul mempunyai sepasang genom ssRNA, yaitu genom RNA 1 dengan panjang 7,8 kb dan RNA 2 panjangnya 7,4 kb ( Li et al. 1998). RNA 1 mengandung beberapa gen yang produknya berfungsi dalam replikasi virus, sedangkan produk gen yang terdapat pada RNA 2 berfungsi dalam pergerakan partikel virus dari sel ke sel dan penularan melalui serangga vektornya (Wintermantel et al. 2009).
Partikel TICV ini mempunyai panjang rata-rata 645 nm, panjangnya mulai dari 850-900 nm, dan partikel terpanjang mencapai 1.600 nm (Duffus et al. 1996; Liu et al. 2000). TICV merupakan virus yang bertahan di jaringan floem dalam jumlah yang sedikit (Wintermantel 2004).
TICV pertama kali ditemukan pada tahun 1993 di sejumlah tempat di Negara Bagian California seperti Orange, San Diego, San Benito, dan Yolo County. Berbagai tanaman hortikultura penting dan bernilai ekonomi tinggi dapat menjadi inang potensial bagi penyebaran TICV (Duffus et al. 1996). Berbagai tanaman penting yang susep terhadap TICV tersebut di antaranya adalah tomat (L. esculentum), kentang (Solanum tuberosum), letus (Lactuca sativa), dan kenopodium (Chenopodium capitatum) (Li et al. 1998).
5
sebagian besar terlihat jelas pada bagian daun, tetapi beberapa virus juga menyebabkan gejala berupa garis-garis seperti belang pada bagian batang, buah, dan akar.
Terdapat beberapa cara penularan virus dari tanaman satu ke tanaman lain. Cara penularan virus meliputi gesekan dengan bagian vegetatif tumbuhan, pelukaan mekanik dengan sap inokulum, terbawa benih, dan melalui vektor spesifik seperti serangga, nematoda, dan cendawan (Agrios 2005). TICV merupakan virus yang ditularkan oleh vektor serangga, yaitu T. vaporariorum
(Duffus et al. 1996; Wintermantel 2004).
Daerah persebaran TICV kini semakin meluas hingga ke Asia dan Eropa. Daerah persebaran TICV di Eropa meliputi beberapa negara seperti Italia (Wisler
et al. 1998a), Yunani (Dovas et al. 2002), Spanyol (Lozano et al. 2006). Adapun untuk persebaran TICV di Asia meliputi Taiwan (Tsai et al. 2004); Jepang (Hartono et al. 2003); dan Indonesia (Hartono & Wijonarko 2007; Suastika et al. 2010).
Tomato Chlorosis Virus (ToCV)
ToCV merupakan anggota kedua dari Genus Criniviruse setelah TICV dan masuk ke dalam famili Closteroviridae (Fauquet et al. 2005, Wintermantel & Wisler 2006; Wisler et al. 1998b). Seperti halnya famili Closteroviridae yang lain, ToCV mempunyai panjang partikel sekitar 850 nm dengan bentuk seperti benang (EPPO 2005; Wisler et al. 1996), membentuk badan inklusi di dalam jaringan floem, dan mempunyai sepasang genom. Sepasang genom ToCV ini terdiri dari RNA 1 dan RNA 2 dengan panjang masing-masing sebesar 7,8 dan 8,2 kb (Wisler
et al. 1996).
RNA 1 mengkode dua jenis protein yang terlibat dalam replikasi virus, sedangkan RNA 2 mengandung beberapa gen, sebuah protein berukuran 60 kDA, dan dua jenis protein selubung, yaitu Coat Protein major (CP) dan Coat Protein minor (CPm). CPm pada ToCV merupakan bagian ujung virion yang berfungsi dalam penularan dengan reseptornya, yaitu T. vaporariorum dan B. tabaci
1998b), dan T. vaporarium (Wintermantel & Wisler 2006). Vektor yang paling berpotensi dalam penularan ToCV dilihat dari persistensinya adalah B. tabaci
biotipe A, diikuti oleh B. tabaci biotipe B, T. abutilonea, dan T. vaporarium
(Wintermantel & Wisler 2006). Walaupun TICV dan ToCV keduanya mempunyai vektor yang sama, yaitu T. vaporarium, akan tetapi kedua virus ini dapat dibedakan melalui deteksi differensial molekular dan pengamatan gejala pada tanaman indikator N. benthamiana dan N. clevelandii (Wisler et al. 1998b).
Kisaran inang ToCV sangat luas, meliputi 24 tanaman dari tujuh famili yang berbeda, yaitu Aizoaceae, Amaranthaceae, Apocynaceae, Chenopodiaceae, Compositae, Plumbaginaceae, dan Solanaceae (Wintermantel & Wisler 2006). Selain itu, menurut Trenado et al. (2007), ToCV juga dapat menginfeksi gulma
Physalis ixocarpa dan P. peruviana.
Gejala akibat infeksi ToCV pada daun berupa klorotik berwarna kuning yang dimulai dari daun bawah dan menyebar hingga ke titik tumbuh, serta menguningnya bagian interveinal yang berkembang menjadi bercak-bercak nekrotik berwarna merah kecoklatan (Wisler et al. 1998a), mengeriting (Hirota et al. 2010), lebih tebal, dan krispi (EPPO 2005; Wisler et al. 1996). Gejala yang mengakibatkan terhambatnya proses fotosintesis pada daun ini mengakibatkan penurunan produksi tomat (Wisler et al. 1998a).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Survei penyakit klorosis dan koleksi tanaman sakit dilakukan di sejumlah pertanaman tomat di daerah Cipanas, Garut, dan Lembang Jawa Barat. Identifikasi virus dilakukan di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan mulai Maret hingga November 2010.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini berupa satu set Qiagen RNeasy Plant Mini Kit, komponen RT PCR, dan PCR. Adapun alat yang digunakan berupa kamera digital, alat tulis, dan GPS.
Metode Ekstraksi RNA Total
Sebanyak 0,1 gram daun bergejala digerus dengan Nitrogen cair dan ditambahkan 450 µl buffer ekstraksi yang mengandung 1% merkaptoethanol. Hasil gerusan dimasukan ke dalam tabung mikro 2 ml dan diinkubasi pada suhu 56oC selama 10 menit. Sampel yang telah diinkubasi kemudian dimasukan ke dalam QIA shredder spin colomn yang berwarna ungu dan disentrifugasi dengan kecepatan 13.000 rpm selama 2 menit. Setelah itu, pipet supernatan tanpa menyentuh pelet ke dalam tabung mikro 2 ml dan tambahkan Ethanol 96% sebanyak 0,5 volume (± 225 µl). Suspensi tersebut dicampur rata dengan pipet.
ditambahkan pada colomn dan disentrifugasi selama 2 menit dengan kecepatan 10.000 rpm.
QIA shredder spin colomn pink kemudian dipindahkan ke dalam tabung koleksi baru dan disentrifugasi selama 1 menit dengan kecepatan 10.000 rpm untuk memastikan bahwa colomn telah kering. Setelah itu, QIA shredder spin colomn pink dipindahkan ke dalam tabung 1,5 ml kemudian ditambahkan RNeasy free water sebanyak 450 µl dan diamkan selama 10 menit. Setelah didiamkan selama 10 menit kemudian disentrifugasi kembali selama 1 menit dengan kecepatan 10.000 rpm untuk mendapatkan hasil ekstraksi berupa RNA total.
Sintesis Complementary (c) DNA
[image:44.595.122.505.398.604.2]Reaksi Reverse Transcription (RT) atau transkipsi balik merupakan proses yang digunakan untuk merubah RNA menjadi DNA. Adapun komposisi yang digunakan dalam reaksi RT terdapat pada Tabel 1.
Tabel 1 Komposisi bahan RT PCR untuk satu kali reaksi
Komponen Volume (µl)
H2O 3,2
Buffer RT 10x 1
DTT 50 mM 0,35
dNTP 10 mM 2
MMuLV Rev 0,35
RNAse Inhibitor 0,35
Oligo d(T) 10 mM 0,75
RNA 2
Total volume 10
Penggunaan primer oligo d(T) pada RT-PCR ini ditujukan untuk amplifikasi
pada ujung 5’ dsRNA yang mempunyai poly(A)- dan poly(C)- sehingga forward
primer pada 3’ mempunyai poly(A)- semua (Wintermantel et al. 2009).
9
Amplifikasi DNA
[image:45.595.117.504.188.410.2] [image:45.595.118.507.189.409.2]PCR digunakan untuk memperbanyak pita DNA yang telah terbentuk dari proses RT. Adapun komposisi bahan yang digunakan dalam PCR terdapat pada Tabel 2.
Tabel 2 Komposisi bahan PCR untuk satu kali reaksi
Komponen Volume (µl)
H2O 16,3
Buffer 10x + Mg2+ 2,5
Sucrose cresol 10x 2,5
dNTP 10mM 0,5
Primer F 10µM 1
Primer R 10µM 1
Taq DNA pol 5 u/µl 0,2
cDNA 1
Total volume 25
Primer yang digunakan dalam proses PCR merupakan pasangan primer yang spesifik untuk mendeteksi TICV dan ToCV. Sikuen nukleotida primer yang spesifik untuk TICV yaitu TICV-CF (5’-AATCGGTAGTGACACGAGTAGCATC-3’) dan TICV-CR
(5’-CTTCAAACATCCTCCATCTGCC-3’) yang dapat mengamplifikasi genom virus pada bagian coat protein (CP) dengan produk PCR sebesar 417 bp. Sikuen nukleotida primer spesifik untuk deteksi ToCV adalah pasangan primer spesifik ToCV-CF
(5’-GTGTCAGGCCATTGTAAACCAAG-3’) dan ToCV-CR dengan sekuen (5’ -CACAAAGCGTTTCTTTTCATAAGCAGG-3’) yang dapat digunakan mengamplifikasi genom virus pada bagian minorcoat protein (CPm) sebesar 360 bp.
Program amplifikasi terdiri atas 30 siklus dengan tahapan predenaturasi pada suhu 94oC selama 4 menit, kemudian denaturasi (fase pemisahan utas DNA) pada suhu 94oC selama 1 menit, suhu 62oC selama 1 menit untuk annealing
Visualisasi Hasil RT-PCR
Amplifikasi DNA hasil PCR dilakukan dengan elektroforesis gel Agarosa 1%. Sebanyak 0,3 gram Agarosa dicampur dengan 30 ml buffer TBE dan dipanaskan hingga tercampur rata. Setelah larutan Agarosa tersebut hangat, kemudian ditambahkan Etidium Bromida sebanyak 0,5 x volume larutan per 10 ml, yaitu 1,5 µl. Larutan tersebut kemudian dituang ke dalam cetakan dan didiamkan selama satu jam. Setelah terbentuk gel, maka sebanyak 10 µl marker DNA dan 7 µl DNA hasil PCR dimasukkan masing-masing ke dalam sumur gel dan dilakukan elektroforesis. Elektroforesis dilakukan selama 60 menit dengan voltase sebesar 50V. DNA yang telah dielektroforesis kemudian divisualisasi di bawah UV transiluminator.
Sikuen Nukleotida dan Analisis Filogenetika
Sikuen-sikuen nukleotida dilakukan dengan pembuatan produk PCR sampel yang positif mengandung virus TICV dan ToCV sebanyak 50µl. Sampel tersebut kemudian dikirim ke PT Macrogen Inc., Seoul, Korea untuk dilakukan sikuen nukleotida.
Hasil sikuen nukleotida kemudian digunakan untuk analisis kesejajaran dengan sikuen nukleotida TICV atau ToCV yang telah dipublikasikan di
GeneBank dengan program BLAST (Basic Local Alignment Search Tools) (NCBI 2010). Data sikuen nukleotida yang terpilih kemudian dimodifikasi dan analisis spesifisitas nukleotida dilakukan dengan program multiple alignment, ClustalW dengan software Bioedit V7.0.5 sebelum dilakukan analisis filogenetika. Analisis filogenetika dilakukan dengan menggunakan program Genetyx versi 7 berdasarkan pendekatan Unweighted Pair Group Method with Arithmetic Mean
HASIL DAN PEMBAHASAN
Penyakit Klorosis pada Tanaman Tomat di Lapangan
Penyakit klorosis ditemukan telah menyerang semua varietas tomat yang dibudidayakan oleh petani di beberapa daerah sentra produksi tomat di Indonesia. Penyakit klorosis pada tanaman tomat di Indonesia pertama kali dilaporkan oleh Hartono & Wijonarko (2007) di daerah Magelang, Jawa Tengah. Penyakit
klorosis ini pada awalnya disebut sebagai “penyakit ungu” karena gejala lanjut
pada daun menunjukkan warna merah kecokelatan hingga keunguan (Hartono & Wijonarko 2007).
Penyakit klorosis ini juga sudah mulai masuk dan menyerang sejumlah sentra pertanaman tomat di Jawa Barat seperti, yaitu di daerah Cipanas, Lembang, dan Garut (Fitriasari 2010; Suastika et al. 2010). Penyakit klorosis ini menyerang dan menimbulkan gejala pada semua varietas yang ditanam, yaitu Shinta, Warani, dan Martha.
[image:47.595.78.511.548.676.2]Berdasarkan pengamatan di lapangan, terlihat bahwa gejala penyakit klorosis berasosiasi dengan adanya populasi kutukebul sebagai vektor penyakit. Gejala yang tampak di lapangan berupa menguningnya jaringan interveinal daun bagian yang lebih bawah. Gejala lebih lanjut menunjukkan perubahan warna dari kekuningan menjadi merah kecoklatan dan daun terlihat agak mengeriting (Gambar 1).
Gambar 1 Gejala penyakit klorosis pada pertanaman tomat di Cipanas (A), Lembang (B), Garut (C), D = gejala awal dan E = gejala lanjut penyakit klorosis
Vektor yang ditemukan di lapangan adalah kutukebul T. vaporariorum dan
B. tabaci. Populasi vektor di lapangan pada ketinggian lebih dari 1000 m dpl lebih didominasi oleh T. vaporariorum, sedangkan pada ketinggian kurang dari 1000 m dpl jumlah populasi B. tabaci lebih banyak. Hal ini sesuai dengan hasil penelitian Fitriasari (2010) yang menyatakan bahwa faktor ketinggian tempat mempengaruhi jumlah populasi kutukebul yang berperan sebagai vektor penyakit klorosis. Selain itu, populasi kutukebul dipengaruhi juga oleh kondisi cuaca. Pada musim hujan, rata-rata populasi kutukebul di lapangan mengalami penurunan. Sebaliknya, pada musim kemarau populasi kutukebul di lapangan mengalami kenaikan.
Deteksi dengan RT-PCR
Sampel pada ketiga daerah survey yang diambil berasal dari varietas Warani, Sintha, dan Martha. Sampel tersebut kemudian dideteksi dengan RT-PCR untuk mendapatkan isolat yang positif mengandung virus TICV dan ToCV. Berdasarkan deteksi RT-PCR terlihat bahwa sampel dari ketiga daerah tersebut positif terserang Crinivirus (Andriani 2011, komunikasi pribadi).
Pada penelitian ini, deteksi dengan RT-PCR hanya berhasil mengamplifikasi sample tanaman yang berasal dari daerah Cipanas. Kedua isolat dari varietas Warani dan Sinta positif mengandung virus TICV serta varietas Ratna positif mengandung virus ToCV (Gambar 2).
Gambar 2 Hasil amplifikasi sampel DNA Crinivirus dari lapangan dengan menggunakan metode RT-PCR. Lajur 1: ToCV varietas Ratna Cipanas (+), Lajur 2: marker DNA 100 bp, Lajur 3: sampel asal Lembang (-), Lajur 4: TICV varietas Sintha Cipanas (+), Lajur 5 dan 6: sampel asal Garut (-), Lajur 7: TICV varietas Warini Cipanas (+) 500 bp
360 bp
417 bp
[image:48.595.157.473.504.650.2]13
Amplifikasi dengan teknik RT-PCR menggunakan pasangan TICV-CF dan TICV-CR berhasil mendapatkan fragmen virus TICV dengan ukuran sebesar 417 bp. Adapun pasangan ToCV-CF dan ToCV-CR berhasil mendapatkan fragmen virus ToCV dengan ukuran sebesar 360 bp. Besaran fragmen DNA hasil amplifikasi ini sesuai dengan primer yang didesain untuk kedua virus tersebut (Hirota et al. 2009). Fragmen DNA hasil PCR selanjutnya digunakan dalam sikuen nukleotida.
Sikuen Nukleotida dan Analisis Filogenetika TICV
Analisis perunutan nukleotida dengan ClustalW menunjukkan bahwa gen protein selubung TICV asal Indonesia memiliki homologi dengan TICV yang berasal dari negara lain seperti Amerika, Italia, Jepang, Perancis, dan Spanyol (Gambar 3).
AMERIKA 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 INDONESIA 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 ITALIA 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 JEPANG 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 PERANCIS 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 SPANYOL 301:TGTAGATATGGTTAACTTATTGCAGTTGTGGTATGGAGACTCAAAATCTAACAATTTAGA 360 ************************************************************ AMERIKA 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 INDONESIA 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 ITALIA 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 JEPANG 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 PERANCIS 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 SPANYOL 361:GCTGTTGATACGTTATGATGAATCACAACGAGATAGATTGACACTTCAACTATGTAT 417 *********************************************************
Gambar 3 Perbandingan hasil sikuen nukleotida sebagian gen coat protein (CP) TICV asal Indonesia, Amerika, Italia, Jepang, Perancis, dan Spanyol menggunakan program ClustalW [tanda * menunjukkan nukleotida
yang identik]
Hal ini juga terlihat berdasarkan similaritas berdasarkan nilai penyejajaran (alignment score) yang mengindikasikan kesamaan urutan nukleotida antar isolat walaupun tidak semuanya 100% (Tabel 3).
Hasil analisis pada Tabel 3 menunjukkan bahwa sikuen gen CPm isolat TICV asal Indonesia sama dengan yang berasal dari Jepang dan Spanyol, tetapi berbeda sedikit atau mempunyai kemiripan 99% dengan isolat asal Amerika, Italia, dan Perancis. Menurut Fauquet et al. (2005) apabila terdapat persamaan sikuen nukleotida dari gen protein selubung antara satu virus dengan virus yang lain dengan nilai lebih dari 90%, maka virus-virus tersebut merupakan spesies virus yang sama. Berdasarkan hasil tersebut maka dapat dikatakan bahwa isolat TICV yang menyerang sejumlah pertanaman tomat di beberapa negara termasuk Indonesia adalah spesies yang sama.
Tabel 3 Tingkat kesamaan sikuen nukleotida sebagian gen coat protein (CP) isolat TICV asal Indonesia, Amerika, Italia, Jepang, Perancis, dan Spanyol menggunakan program Bioedit V.7.0.5
No. aksesi Asal isolat Tingkat kesamaan (%)
Indonesia Amerika Italia Jepang Perancis Spanyol
- Indonesia -
FJ815441 Amerika 99 -
EU881362 Italia 99 100 -
AB085603 Jepang 100 99 99 -
DQ355217 Perancis 99 99 99 99 -
[image:50.595.95.512.592.738.2]15
Analisis filogenetika pada kladogram menunjukkan bahwa hubungan kekerabatan keenam



![Gambar 5 Perbandingan hasil sikuen nukleotida sebagian dari gen minor coat protein (CPm) ToCV asal Indonesia, Jepang, Perancis, dan Amerika menggunakan program ClustalW [tanda * menunjukkan nukleotida yang identik]](https://thumb-ap.123doks.com/thumbv2/123dok/857044.381452/26.595.96.493.159.550/perbandingan-nukleotida-indonesia-perancis-menggunakan-clustalw-menunjukkan-nukleotida.webp)