UJI SEROLOGI DIFERENSIAL DAN SIMULTAN UNTUK
Tomato chlorosis virus (ToCV) DAN Tomato infectious chlorosis
virus (TICV) PADA TANAMAN TOMAT
LAILATUS SA’ADAH
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Uji Serologi Diferensial dan Simultan untuk Tomato chlorosis virus (ToCV) dan Tomato infectious chlorosis virus (TICV) pada Tanaman Tomat” adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2013
Lailatus Sa’adah NIM A34090028
*Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak luar IPB harus didasarkan pada perjanjian kerja sama yang terkait.
ABSTRAK
LAILATUS SA’ADAH. Uji Serologi Diferensial dan Simultan Tomato chlorosis virus (ToCV) dan Tomato infectious chlorosis virus (TICV) pada Tanaman Tomat. Dibimbing oleh GEDE SUASTIKA.
Tomato clorosis virus (ToCV) dan Tomato infectious chlorosis virus (TICV) merupakan Criniviruses yang mengakibatkan gejala yang sama berupa klorosis pada tomat. Penyakit ini ditandai dengan klorosis pada jaringan antar tulang daun, daun menjadi lebih tebal dan rapuh, beberapa daun mengalami nekrotik, dan bagian daun berubah menjadi merah keunguan (bronzing). Kedua virus ini menyebabkan penurunan kuantitas dan kualitas produksi buah, sehingga menjadi masalah yang serius pada pertanaman tomat di Indonesia. Antiserum poliklonal yang diproduksi menggunakan protein selubung masing-masing virus yang diekspresikan pada Escherichia coli telah tersedia sebelumnya. Penelitian ini bertujuan menggunakan antiserum tersebut untuk menganalisa hubungan serologis kedua virus dan untuk pengembangan metode deteksi diferensial dan simultan. Tanaman tomat yang terinfeksi tunggal maupun ganda oleh ToCV dan TICV, yang telah dianalisis terlebih dahulu dengan diferensial reverse transcription-polymerase chain reaction, digunakan sebagai sumber virus. Analisis menggunakan gel agarose presipitation test (AGPT) dan dot immunobinding assay (DIBA), ditemukan bahwa tidak ada reaksi silang yang diamati antara antiserum ToCV dan TICV. Hal ini menunjukkan bahwa kedua virus tersebut tidak memiliki hubungan serologi. Sehingga berimplikasi bahwa kedua antiserum tersebut dapat digunakan dalam metode deteksi serologi diferensial untuk ToCV dan TICV. Selanjutnya, campuran antiserum ToCV dan TICV dalam AGPT dan DIBA dapat mendeteksi kedua virus dalam jaringan tanaman tomat yang terinfeksi ganda. Deteksi kedua virus secara simultan dalam uji serologi tunggal dapat menghemat waktu dan biaya. Metode serologi yang dikembangkan pada penelitian ini diharapkan menjadi cara terbaik untuk diagnosis kedua virus ini.
Kata kunci: agarose gel presipitation test, antiserum, Crinivirus, dot immunobinding assay
ABSTRACT
LAILATUS SA’ADAH. Differential and Simultaneous Serological Test for Tomato chlorosis virus (ToCV) and Tomato infectious chlorosis virus (TICV) in Tomato Plant. Supervised by GEDE SUASTIKA
Tomato chlorosis virus (ToCV) and Tomato infectious chlorosis virus (TICV) are two Criniviruses inducing similar yellowing symptoms in tomato. The disease was characterized by interveinal chlorosis, leaf brittleness, and limited necrotic flecking or bronzing on tomato leaves. Both viruses cause a decline in plant vigor and reduce fruit yield, and are emerging as serious production problems for tomato field in Indonesia. Polyclonal antisera produced using capsid proteins of both viruses expressed in Escherichia coli were already prepared previously. Here, we used the antisera to analize serological relationship of the viruses and for development of differential and simultaneous detection methods. Symptomatic tomato plants, single and mix infected by ToCV and TICV after analyzed by differential reverse-transcription polymerase chain reaction, were used as virus sources. By applying agarose gel presipitation test (AGPT) and dot immunobinding assay (DIBA), it was found that no cross-reactions were observed between ToCV and TICV antisera. This finding indicated that the two viruses are serologically unrelated. This implies that the two antisera could be used in differential serological detection methods for ToCV and TICV. Further, mixture of ToCV and TICV antisera used in AGPT and DIBA allowed simultaneously detection of both viruses in mix infected tomato plant tissues. Detection of both viruses in a single serological test is both time and cost saving. These serological methods developed here appeared the best way to achieve a reliable diagnosis of these viruses.
Keywords: agarose gel presipitation test, antisera, Crinivirus, dot immunobinding assay
UJI SEROLOGI DIFERENSIAL DAN SIMULTAN UNTUK
Tomato chlorosis virus (ToCV) DAN Tomato infectiouschlorosis
virus (TICV) PADA TANAMAN TOMAT
LAILATUS SA’ADAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Uji Serologi Diferensial dan Simultan untuk Tomato chlorosis virus (ToCV) dan Tomato infectious chlorosis virus (TICV) pada Tanaman Tomat
Nama Mahasiswa : Lailatus Sa’adah NIM : A34090028
Disetujui oleh
Dr. Ir. Gede Suastika, M.Sc Pembimbing Skripsi
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, M.Agr Ketua Departemen Proteksi Tanaman
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat- Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul "Uji Serologi Diferensial dan Simultan Tomato chlorosis virus (ToCV) dan Tomato infectious chlorosis virus (TICV) pada Tanaman Tomat". Skripsi ini merupakan salah satu syarat dalam memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr. Ir. Gede Suastika, M. Sc. selaku dosen pembimbing akademik sekaligus dosen pembimbing skripsi atas bimbingannya selama penelitian. Dr. Ir. Sri Hendrastuti Hidayat, M. Sc, dan Dr. Ir. Tri Asmira Damayanti, M. Agr yang telah memberikan saran, nasihat, dan pengarahan selama bekerja di Laboratorium. Staf pengajar di Departemen Proteksi Tanaman yang telah memberikan mata kuliah di Departemen Proteksi Tanaman. Kepada Fitrianingrum Kurniawati, M. Si dan Sari Nurulita, SP yang telah menjadi tutor selama penelitian. Teman-teman Laboratorium Virologi yang senantiasa membantu selama penelitian, teman-teman HPT 46 dan teman-teman “Midori” yang selalu ada dalam suka dan duka, serta Bapak, Ibu, kakak-kakak dan saudara kembar penulis yang selalu memberikan semangat, motivasi, doa, dan kasih sayang yang tulus, dan instansi BUMN yang telah memberikan beasiswa.
Semoga skripsi ini bermanfaat
Bogor, Desember 2013
DAFTAR ISI
DAFTAR GAMBAR vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan 1
Manfaat 2
BAHAN DAN METODE 3
Tempat dan Waktu 3
Bahan Penelitian 3
Metode Penelitian 3
Tanaman Sumber Virus 3
Uji Serologi 4
HASIL DAN PEMBAHASAN 6
Tanaman Sumber ToCV dan TICV 6 Uji Serologi Diferensial ToCV dan TICV 7 Uji Serologi Simultan ToCV dan TICV 9
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 12
vii
DAFTAR GAMBAR
1 Gejala penyakit klorosis pada tanaman tomat varietas Marta yang ditemukan saat survei di daerah Pacet, Cianjur, Jawa Barat. (a) gejala intervenal yellowing; (b) leaf brittleness; (c)merah keunguan (bronzing); dan (d) nekrotik
6
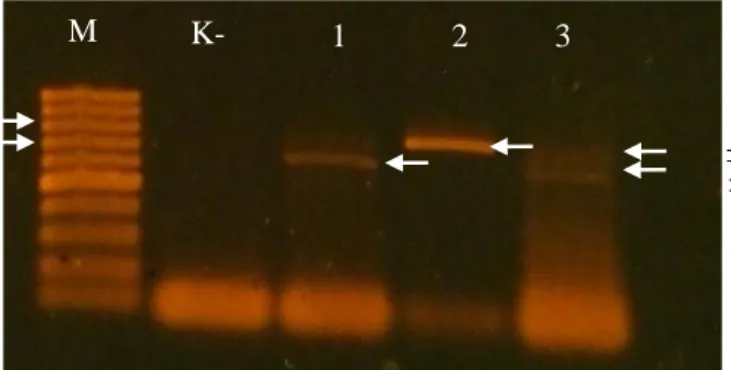
2 Hasil amplifikasi DNA virus dengan metode reverse transcriptation-polymerase chain reaction menggunakan campuran primer ToCV dan TICV. Lajur 1, sampel tanaman tomat yang positif terinfeksi oleh ToCV; lajur 2 yang positif terinfeksi TICV; dan lajur 3, yang positif terinfeksi ganda oleh ToCV dan TICV. K- (kontrol negatif) dari tanaman sehat dan M adalah marker 100 bp DNA ladder
7
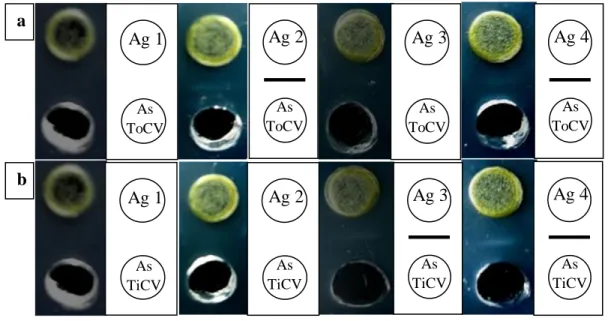
3 Reaksi antiserum (a) ToCV; dan (b) TICV pada agarose gel presipitation test. Ag 1: sap tanaman tomat sehat (tanpa gejala), Ag 2: sap tanaman tomat terinfeksi ToCV, Ag 3: sap tanaman tomat terinfeksi TICV, dan Ag 4: sap tanaman tomat terinfeksi ganda ToCV dan TICV
8
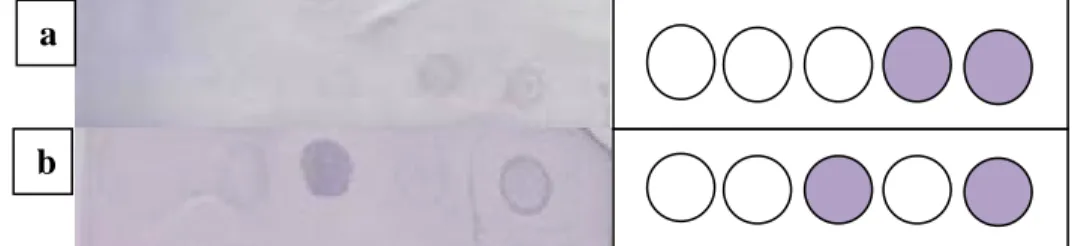
4 Reaksi antiserum (a) ToCV; dan (b) TICV pada dot immonobinding assay. Bufer (B), sap tanaman sehat (K-), sap tanaman tomat terinfeksi TICV (Ti), sap tanaman tomat terinfeksi ToCV (To), dan sap tanaman tomat terinfeksi ganda ToCV dan TICV (TiTo)
9
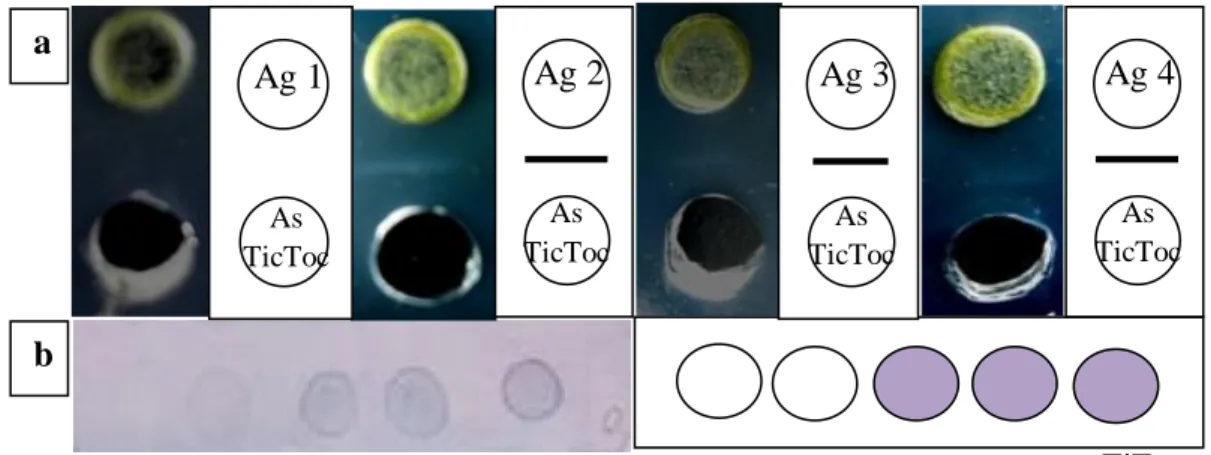
5 Uji secara simultan dengan mencampurkan antiserum ToCV dan TICV. (a) AGPT; (b) DIBA. Ag 1: sap tanaman tomat sehat (tanpa gejala), Ag 2: sap tanaman tomat terinfeksi ToCV, Ag 3: sap tanaman tomat terinfeksi TICV, dan Ag 4: sap tanaman tomat terinfeksi ganda ToCV dan TICV
PENDAHULUAN
Latar Belakang
Penyakit klorosis pada tanaman tomat telah diketahui disebabkan oleh dua virus yang berbeda yaitu Tomato chlorosis virus (ToCV) dan Tomato infectious chlorosis virus (TICV) dari genus Crinivirus (Duffus et al. 1996; Suastika et al. 2010; Wisler et al. 1998b). Kedua virus ini dapat menginfeksi tanaman tomat secara terpisah (single infection) maupun bersama-sama (mixed infection). Gejala yang diinduksi oleh ToCV maupun TICV tidak dapat dibedakan baik pada infeksi tunggal maupun ganda (Dovas et al. 2002; Wintermantel et al. 2008). Gejala khas dari penyakit ini adalah terjadi klorosis atau menguning pada jaringan antar tulang daun terutama pada daun-daun tua, mirip dengan gejala akibat kekurangan unsur hara (Accotto et al. 2001; Navas-Castillo et al. 2000). Menurut Navas-Castillo et al. (2000) gejala klorosis diawali pada daun tua di bagian bawah yang kemudian secara bertahap berkembang ke bagian pucuk tanaman. Akibat penyakit ini, kuantitas maupun kualitas produksi tomat menjadi sangat menurun karena ukuran buah menjadi jauh lebih kecil dari normal dan proses pemasakan buah terganggu, sehingga secara ekonomi sangat merugikan.
Cara pengendalian yang tepat untuk mengatasi penyakit klorosis pada tanaman tomat memerlukan metode deteksi yang tepat untuk mendiagnosis penyebabnya. Berbagai metode deteksi telah dikembangkan untuk mendeteksi dan mengidentifikasi virus pada tanaman tomat, salah satunya adalah reverse transcription-polymerase chain reaction (RT-PCR) (Andriani 2011). Namun demikian, metode molekuler ini memerlukan peralatan dan bahan yang relatif lebih mahal dibandingkan metode lain, misalnya uji serologi. Uji serologi adalah pengujian keberadaan virus menggunakan antiserum (Hull 2002; Naidu and Hughes 2003). Beberapa teknik serologi yang sering digunakan untuk mendeteksi atau mengidentifikasi virus pada jaringan tanaman antara lain agarose gel presipitation test (AGPT), dot immunobinding assay (DIBA) dan enzyme linked immunosorbent assay (ELISA) (Bos 1990; Naidu and Hughes 2003).
Penelitian sebelumnya telah berhasil membuat antiserum terhadap ToCV dan TICV dan telah tersedia di Laboratorium Virologi Tumbuhan IPB. Kedua antiserum poliklonal ini merupakan hasil immunisasi kelinci dengan protein selubung (CP) masing-masing virus hasil ekspresi pada Escherichia coli (Kurniawati 2012). Suatu antiserum poliklonal, karena mengenal beberapa (lebih dari satu) jenis epitope pada antigen, memiliki kemungkinan bereaksi silang (cross reaction) dengan virus lain yang umumnya masih anggota genus yang sama (Gebre-Selassie et al. 1981; Wetter and Conti 1988; Letschertet al. 2002). Antiserum ToCV dan TICV yang telah tersedia belum diketahui reaksi serologinya.
Tujuan
Tujuan penelitian ini adalah menganalisis hubungan serologi antara ToCVdan TICV, serta memanfaatkan antiserum ToCV dan TICV untuk uji serologi diferensial dan simultan.
2
Manfaat
Metode deteksi secara diferensial dan simultan untuk TICV dan ToCV yang diperoleh dalam penelitian ini berguna dalam menghitung kejadian penyakit yang terinfeksi tunggal maupun ganda di lapangan.
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Waktu penelitian dilakukan dari bulan April sampai September 2013.
Bahan Penelitian
Bahan yang digunakan adalah tanaman tomat yang bergejala klorosis dari daerah Pacet, Cianjur, Jawa Barat, dan antiserum TICV dan ToCV dari hasil penelitian terdahulu.
Metode Penelitian Tanaman Sumber Virus
Tanaman tomat bergejala klorosis diambil langsung dari lapangan yaitu daerah Pacet, Cianjur, Jawa Barat. Infeksi TICV dan ToCV secara tunggal maupun ganda pada tanaman sumber virus diverifikasi melalui reverse transcription-polymerase chain reakction (RT-PCR). Kegiatan ini meliputi ekstrasi RNA total, sintesis complementary (c)DNA, amplifikasi DNA dan visualisasi dengan elektroforesis.
Ekstraksi RNA Total. Total RNA diekstraksi dari daun tomat begejala klorosis menggunakan Rneasy Plant Mini Kits (Qiagen Inc., Chatsworth, CA., USA). Daun tomat sebanyak 0.1 gram digerus menggunakan mortar dan pistil dalam nitrogen cair sampai menjadi tepung kemudian ditambahkan 450 μl buffer ekstraksi yang mengandung 1% mercaptoethanol. Hasil gerusan dimasukkan ke dalam QIA shredder spin colomn yang berwarna merah dan disentrifugasi dengan kecepatan 13.000 rpm selama 2 menit. Supernatan yang diperoleh dipindahkan ke dalam tabung mikro baru dan ditambahkan ethanol 96% sebanyak 0.5 volum supernatan. Setelah tercampur rata, siapan dimasukan ke dalam QIA shredder spin colomn pink dan disentrifugasi dengan kecepatan 13.000 rpm selama 1 menit. QIA shredder spin colomn pink tersebut ditambahkan buffer RW1 sebanyak 500 μl, kemudian disentrifugasi kembali dengan kecepatan 13.000 rpm selama 1 menit untuk mencuci kolom. Colomn dipindahkan ke tabung koleksi baru, selanjutnya ditambahkan 750 μl buffer RW2 dan disentrifugasi dengan kecepatan 13.000 rpm selama 1 menit. QIA shredder spin colomn pink kemudian dipindahkan ke dalam tabung koleksi baru dan disentrifugasi selama 3 menit pada kecepatan 13.000 rpm agar kering. Setelah itu, QIA shredder spin colomn pink dipindahkan ke dalam tabung 1.5 ml kemudian ditambahkan RNeasy free water sebanyak 50 μl dan didiamkan selama 1 menit. Kemudian disentrifugasi kembali selama 1 menit pada kecepatan 13.000 rpm untuk mendapatkan hasil ekstraksi berupa RNA total.
Sintesis complementary (c)DNA. RNA hasil ekstraksi digunakan sebagai cetakan dalam sintesis cDNA dengan menggunakan teknik reverse transcription
4
(RT). Reaksi RT dilakukan dengan total volume 10 µl yang mengandung 2 µl RNA total, 2 µl buffer RT 10X, 0.35 µl 50 mM DTT (dithiothreitol), 0.5 µl 10 mM dNTP (deoksiribonukleotida triphosphat), 0.35 µl M-MuLV Rev, 0.35 µl RNase inhibitor, 0.75 µl oligo dT, dan 3.7 µl H2O. Reaksi RT dilakukan dalam
sebuah Automated Thermal cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA) yang diprogram untuk satu siklus pada suhu 25 ºC selama 5 menit, 42 ºC selama 60 menit, dan 70 ºC selama 15 menit. Siapan cDNA hasil RT digunakan sebagai cetakan dalam reaksi PCR.
Amplifikasi DNA. cDNA hasil RT digunakan untuk memperbanyak pita DNA dengan PCR. Reaksi PCR dilakukan pada volume 25 µl terdiri dari12.5 µl Go Tag Green Master Mix 2x (Promega, Madison, USA), 6.5 µl H2O, 1 µl Primer
F TICV-CP, 1µl Primer R TICV-CP, 1µl Primer F ToCV-CP, 1µl Primer R ToCV-CP, dan 2µl cDNA. Komponen-komponen tersebut untuk satu kali reaksi. Amplifikasi genom TICV dan ToCV dilakukan menggunakan sepasang primer TICV CP-F 5’-AATTAAGGATCCGAAAACTTATCTGGTAATGCAAAC-3’ dan TICVCP-R 5’-AATTAAAAGCTTTTAGCATGGGTGTTTCATATCAGCC-3’. ToCV CP-F 5’-AATTAAGGATCCGAGAACAGTGCYGTTGC-3’ dan ToCV CP-R 5’-AATTAAAAGCTTTTAGCAACCAGTTATCGATGCAAG-3’. Proses ini dilakukan dengan metode duplex dengan denaturasi awal pada 94ºC selama 4 menit, dilanjutkan dengan 30 siklus untuk ToCV yang terdiri dari denaturasi pada 94 ºC selama 1 menit, penempelan primer (annealing) pada 45 ºC selama 1 menit, dan pemanjangan (Extension) pada 72 ºC selama 2 menit. Dilanjutkan dengan 30 siklus untuk TICV yang terdiri dari denaturasi pada 94 ºC selama 1 menit, penempelan primer (annealing) pada 55 ºC selama 45 detik, dan pemanjangan (Extension) pada 72 ºC selama 2 menit. Khusus untuk siklus terakhir ditambahkan 10 menit pada 72 ºC, dan inkubasi pada suhu 4 ºC.
Elektroforesis. Elektroforesis menggunakan gel Agarose 1%. Agarosa ditimbang sebanyak 0.3 gram, dicampur dengan 30 ml buffer TBE 0.5 x (Tris 0.5 M, asam borat 0.65 M, dan EDTA 0.02 M), dan dipanaskan dalam microwave selama 2 menit hingga agarosa larut kemudian dituang ke dalam pencetak gel. Sisir ditempatkan di dekat tepian gel dan gel didiamkan hingga mengeras selama satu jam. Setelah gel siap, maka sebanyak 4 μl marker 100 bp DNA ladder dan 7 μl hasil PCR dimasukkan masing-masing ke dalam sumur gel dan dilakukan elektroforesis. Elektroforesis dilakukan selama 30 menit dengan voltase sebesar 50 Volt, dilanjutkan dengan voltase 100 Volt selama 10 menit. Gel agarose hasil running direndam dalam larutan ethidium bromade selama 10 menit, kemudian direndam dalam air steril selama 5 menit. Kemudian divisualisasi di bawah UV transiluminator. Pita DNA yang terbentuk pada hasil elektroforesis tersebut diambil gambarnya menggunakan kamera digital yang telah tersedia.
Uji Serologi
Metode yang digunakan untuk uji serologi diferensial dan simultan dalam penelitian yaitu Agarose Gel Precipitation Test (AGPT) dan Dot Immunobinding Assay (DIBA).
AGPT. Metode ini dilakukan dengan menggunakan media agarosa 1% dalam reaksi antigen-antibodi. Media agar dibuat dengan melarutkan 0.1 g 4
5
agarosa, 0.01 g natrium azid, 5 ml PBS (NaCl 8 g, Na2HPO4 1.15 g, KH2PO4 0.2
g, KCl 0.2 g, akuades 1000 ml pH 7.5) dan 5 ml akuabides yang dipanaskan dalam microwave selama 1 menit. Agar cair tersebut dituangkan di atas gelas obyek setebal ± 2 mm, didiamkan hingga agar memadat. Kemudian dibuat dua lubang dengan cork borer berdiameter 4 mm dan jarak antar lubang 4 mm. Lubang satu diisi antiserum, dan lubang yang lain diisi 20 ul sap daun tomat sumber virus. Sap dibuat dengan menggerus 0.1 g daun tomat dalam 1 ml PBS (1:10 b/v). Antiserum ToCV dan antiserum TICV yang digunakan dalam penelitian ini merupakan hasil penelitian sebelumnya yaitu hasil immunisasi kelinci dengan protein produk ekspresi gen protein selubung (CP) TICV dan ToCV pada Escherichia coli (Kurniawati 2012). Reaksi antigen-antibodi dibiarkan terjadi pada suhu ruang dan diamati sampai terbentuk garis presipitasi.
DIBA. Metode ini dilakukan mengikuti Mahmood et al. (1997) yang dimodifikasi. Membran nitroselulosa sebelum digunakan direndam terlebih dahulu dalam TBS (Tris-HCl 0.02 M, NaCl 0.15 M, pH 7.5) selama 10 detik dan dikeringanginkan, kemudian diblot dengan 4ul sap sumber virus. Sap disiapkan dengan menggerus daun tomat sumber virus dalam TBS (1:1 b/v) dan Sap disentrifugasi pada 5000 rpmselama 2 menit. Setelah itu, membran diberi perlakuan berturut-turut sebagai berikut: (1) direndam dalam larutan blocking (skim milk 2% dalam TBS yang mengandung Triton X-100 2%) selama 30 menit, kemudian dicuci 5 kali dengan dH2O; (2) direndam dalam larutan antiserum
1:1000 (v/v, dalam TBS yang mengandung 2% skim milk) diinkubasi semalam pada suhu 4oC, selanjutnya dicuci dengan TBST (Tris-HCl 0.02 M, NaCl 0.15 M, + Tween-20 0.05%, pH 7.5) sebanyak 5 kali; (3) direndam dalam konjugat (goat anti rabbit-IgG) 1:1000 (v/v, dalan TBS yang mengandung 2% skim milk) selama 60 menit, kemudian dicuci dengan TBST sebanyak 5 kali; (4) direndam dalam substrat NBT/BCIP (45 ul nitro blue tetrazolium, dan 35 ul bromo chloro indolil phosphate dilarutkan dalam 10 ml buffer AP [Tris-HCl 0.1 M, NaCl 0.1M, MgCl2 5mM, pH 9.5]) sampai terjadi perubahan warna menjadi ungu pada membran nitroselulosa yang ditetesi sap, dan reaksi dihentikan dengan merendam dalam dH2O.
HASIL DAN PEMBAHASAN
Tanaman Sumber ToCV dan TICV
Survei telah dilakukan pada pertanaman tomat di daerah Pacet, Cianjur, Jawa Barat (dengan ketinggian 1200 mdpl). Ditemukan banyak tanaman tomat yang memperlihatkan gejala klorosis pada saat survei. Penyakit ini ditandai dengan perubahan warna kuning pada jaringan diantara tulang daun (interveinal yellowing) (Gambar 1a), yang dimulai dari daun-daun tua di bagian bawah kemudian berkembang ke bagian pucuk; daun menjadi lebih tebal dan rapuh (leaf brittleness) (Gambar 1b); kadang-kadang terjadi perubahan warna pada bagian daun menjadi merah keunguan (bronzing) (Gambar 1c); dan pada gejala lanjut beberapa bagian daun klorotik mengalami nekrotik (Gambar 1d). Gejala semacam ini bersesuaian dengan gejala yang diinduksi oleh ToCV dan TICV menurut peneliti terdahulu (Dalmon et al. 2008; Duffus et al. 1996; Li et al. 1998; Navas-Castillo et al. 2000; Wintermantel et al. 2006; Wisler et al. 1998a).
Gambar 1 Gejala penyakit klorosis pada tanaman tomat varietas Marta yang ditemukan saat survei di daerah Pacet, Cianjur, Jawa Barat. (a) gejalaintervenal yellowing; (b) leaf brittleness; (c) merah keunguan (bronzing); dan (d) nekrotik.
Beberapa tanaman tomat bergejala klorosis yang dikoleksi dari lahan petani di tempat pengambilan sampel berhasil diverifikasi sebagai sumber ToCV dan TICV dengan metode RT-PCR. PCR dilakukan dengan mencampur kedua pasangan primer ToCV dan TICV yang telah diketahui dapat digunakan untuk mendeteksi kedua virus tersebut baik yang menginfeksi tunggal maupun ganda (Andriani 2011). Hasil visualisasi di bawah sinar UV (Gambar 2) menunjukkan ditemukannya tanaman tomat yang terinfeksi tunggal oleh ToCV atau TICV, dan yang terinfeksi ganda. Tanaman yang terinfeksi oleh ToCV ditunjukkan oleh adanya pita DNA berukuran 700 bp, sesuai dengan primer yang digunakan (Fitriasari 2010). Begitu juga dengan tanaman tomat yang terinfeksi oleh TICV ditandai oleh pita DNA berukuran 792 bp, sesuai dengan primer yang digunakan (Orillio dan Navas-Castillo 2009). Sedangkan tanaman tomat yang terinfeksi ganda oleh ToCV dan TICV ditandai dengan adanya kedua pita DNA tersebut.
7
Gambar 2 Hasil amplifikasi DNA virus dengan metode reverse transcriptation-polymerase chain reaction menggunakan campuran primer ToCV dan TICV. Lajur 1, sampel tanaman tomat yang positif terinfeksi oleh ToCV; lajur 2 yang positif terinfeksi TICV; dan lajur 3, yang positif terinfeksi ganda oleh ToCV dan TICV. K- (kontrol negatif) dari tanaman sehat dan M adalah marker 100 bp DNA ladder.
Hasil pengamatan di lapangan dan hasil deteksi virus melalui RT-PCR memperlihatkan bahwa tanaman tomat yang terinfeksi tunggal ToCV atau TICV maupun terinfeks ganda kedua virus ini memperlihatkan gejala dengan variasi yang tidak dapat dibedakan. Beberapa peneliti terdahulu juga menemukan hal yang sama (Dalmon et al. 2008; Dovas et al. 2002; Font et al. 2002; Jacquemond et al. 2008). Ketiga sampel tanaman tomat (yang terinfeksi tunggal ToCV atau TICV dan yang terinfeksi ganda) ini digunakan sebagai sumber virus untuk penelitian selanjutnya.
Uji Serologi Diferensial ToCV dan TICV AGPT
Antiserum ToCV dan antiserum TICV yang diuji berhasil dilihat reaksi serologinya terhadap virus target melalui metode AGPT. Pada AGPT, antibodi yang terkandung dalam antiserum akan berdifusi dalam media agar dan bertemu dengan antigen dari partikel virus target membentuk kompleks antigen-antibodi. Kompleks antigen-antibodi terbentuk secara bertahap sampai jumlahnya mencukupi untuk terlihat sebagai garis presipitasi (Hutchison 1962; Nickel et al. 2004; Noordam 1973).
Seperti disajikan dalam Gambar 3a, garis presipitasi (yang merupakan signal positif) hanya terjadi pada reaksi antara antiserum ToCV terhadap sap tanaman tomat yang terinfeksi ToCV dan sap tanaman yang terinfeksi ganda. Garis presipitasi tidak terbentuk pada reaksi antara antiserum ToCV terhadap sap tanaman tomat sehat (tanpa gejala) dan antara antiserum ToCV dengan sap tanaman tomat yang terinfeksi TICV. Demikian juga, dalam Gambar 3b, terjadi reaksi antara antiserum TICV terhadap sap tanaman tomat yang terinfeksi TICV dan sap tanaman yang terinfeksi ganda. Garis presipitasi tidak terbentuk pada reaksi antara antiserum TICV dengan sap tanaman tomat sehat dan antara antiserum TICV dengan sap tanaman tomat yang terinfeksi ToCV.
Hasil penelitian ini memperlihatkan bahwa jenis-jenis antibodi yang terkandung pada antiserum ToCV dan TICV tersebut hanya mengenali epitope
M K- 1 2 3
800 bp
700 bp ±792 bp
8
yang terdapat pada masing-masing virus target. Dengan kata lain, antiserum yang diuji tidak bereaksi silang baik terhadap protein tanaman maupun terhadap virus lain. Kespesifikan reaksi masing-masing antiserum ini memungkinkan penggunaannya sebagai perangkat uji serologi diferensial untuk deteksi ToCV dan TICV pada jaringan tanaman tomat.
Gambar 3 Reaksi antiserum (a) ToCV; dan (b) TICV pada agarose gel presipitation test. Ag 1: sap tanaman tomat sehat (tanpa gejala), Ag 2: sap tanaman tomat terinfeksi ToCV, Ag 3: sap tanaman tomat terinfeksi TICV, dan Ag 4: sap tanaman tomat terinfeksi ganda ToCV dan TICV.
DIBA
Metode DIBA juga sangat baik mengekspresikan reaksi serologi antiserum ToCV dan TICV yang diuji. Pada DIBA, partikel virus target yang terkandung dalam sap tanaman sumber virus diimobilisasi pada membran Nitropure nitrocellulose, kemudian antibodi (yang terkandung dalam antiserum) yang diaplikasikan berikatan dengan partikel virus pada epitope yang dikenalinya. Konjugat (yang mengandung enzim avidin) mengenali dan berikatan dengan antiserum, sehingga terjadi rantai ikatan virus-antibodi-konjugat. Enzim (yang dikonjugasikan pada konjugat) kemudian akan merubah warna substrat menjadi ungu (Lin et al. 1990), yang merupakan signal positif untuk DIBA. Dalam reaksi DIBA, jumlah enzim yang sedikit saja sudah dapat menyebabkan perubahan warna substrat (Somowiyarjo 1997), sehingga DIBA dianggap metode yang cukup sensitif. Kebutuhan antiserum dalam reaksi DIBA tidak banyak, dan terlihat pada penelitian ini hanya dibutuhkan antiserum dengan pengenceran 1000 kali. Jika dibandingkan dengan AGPT yang memerlukan antiserum tanpa diencerkan, kebutuhan antiserum untuk DIBA sangat sedikit.
Seperti pada AGPT, pada DIBA pun terlihat kespesifikan reaksi antiserum ToCV dan TICV yang diuji (Gambar 4). Bila antiserum ToCV diaplikasikan, signal positif DIBA terjadi hanya pada daerah membran yang diblot dengan sap tanaman tomat yang terinfeksi ToCV baik tunggal maupun ganda (dengan TICV) (Gambar 4a). Demikian juga antiserum TICV memberikan signal positif DIBA
b a Ag 1 As ToCV Ag 2 As ToCV Ag 3 As ToCV Ag 4 As ToCV Ag 1 As TiCV Ag 3 As TiCV Ag 2 As TiCV Ag 4 As TiCV 8
9
hanya pada daerah membran yang diblot dengan sap sumber TICV tunggal maupun ganda (dengan ToCV) (Gambar 4b). Kespesifikan reaksinya semakin jelas karena kedua antiserum ini memberikan signal negatif terhadap sap tanaman tomat sehat (tanpa gejala) maupun sap yang mengandung virus heterologousnya. Pada DIBA, metode serologi yang lebih sensitif dari AGPT, juga tidak terdeteksi adanya reaksi silang antara ToCV dan TICV.
Gambar 4 Reaksi antiserum (a) ToCV; dan (b) TICV pada dot immonobinding assay. Bufer (B), sap tanaman sehat (K-), sap tanaman tomat terinfeksi TICV (Ti), sap tanaman tomat terinfeksi ToCV (To), dan sap tanaman tomat terinfeksi ganda ToCV dan TICV (TiTo).
Uji Serologi Simultan ToCV dan TICV
Seperti pada hasil survei dan deteksi virus yang telah dipaparkan di atas, tanaman tomat bergejala klorosis mungkin akibat terinfeksi oleh ToCV atau TICV secara tunggal maupun ganda, dan tanaman tomat yang terinfeksi oleh ToCV atau TICV baik secara tunggal maupun ganda tidak memperlihatkan gejala khas untuk masing-masing kejadian. Oleh karena itu, deteksi yang dilakukan dengan antiserum terhadap salah satu virus akan meloloskan virus yang lainnya. Agar tidak terjadi hal semacam ini maka dapat dilakukan uji serologi menggunakan kedua antiserum ini secara terpisah. Namun demikian, cara ini akan membutuhkan reaktan dalam jumlah dua kali lipat.
Berdasarkan penelitian ini berhasil dilakukan uji serologi simultan terhadap ToCV dan TICV dengan mencampur kedua jenis antiserum dalam satu reaksi. Hasil yang cukup jelas dapat terlihat dengan menggunakan metode AGPT maupun DIBA (Gambar 5). Campuran antiserum ToCV dan TICV memberikan signal positif terhadap sap tanaman tomat yang terinfeksi ToCV atau TICV saja maupun yang terinfeksi kedua virus tersebut, dan tidak memberikan signal positif terhadap sap tanaman sehat (tanpa gejala) pada AGPT maupun DIBA. Dengan demikian, capuran antiserum ToCV dan TICV pada penelitian ini dapat diaplikasikan untuk deteksi simultan virus-virus tersebut pada tanaman tomat. Uji serologi simultan ini, terutama metode DIBA, dapat dianjurkan untuk digunakan sebagai alat deteksi virus pada bahan tanaman tomat bagi Badan Karantina Tumbuhan agar tidak terjadi kecolongan salah satu virus ToCV dan TICV, yang masih termasuk Organisme Pengganggu Tanaman Karantina (OPTK) A1.
a
b
B K
-
10
Gambar 5 Uji secara simultan dengan mencampurkan antiserum ToCV dan TICV. (a) AGPT; (b) DIBA. Ag 1: sap tanaman tomat sehat (tanpa gejala), Ag 2: sap tanaman tomat terinfeksi ToCV, Ag 3: sap tanaman tomat terinfeksi TICV, dan Ag 4: sap tanaman tomat terinfeksi ganda ToCV dan TICV.
B K- Ti To TiTo b a Ag 1 As TicToc Ag 2 As TicToc Ag 3 As TicToc Ag 4 As TicToc B K- Ti To TiTo b 10
SIMPULAN DAN SARAN
Simpulan
ToCV tidak mempunyai hubungan serologi dengan TICV, walaupun kedua virus ini merupakan anggota dalam satu genus Crinivirus. Berdasarkan kespesifikannya, antiserum ToCV dan TICV dapat digunakan untuk uji serologi diferensial. Campuran antiserum ToCV dan TICV dapat diaplikasikan untuk uji serologi simultan terhadap kedua virus ini, baik melalui AGPT maupun DIBA.
Saran
Perlu dilakukan pengujian menggunakan antiserum ToCV dan TICV terhadap sampel tanaman tomat terinfeksi virus dalam jumlah yang lebih banyak untuk membuktikan kesahihan deteksi diferensial maupun simultan.
DAFTAR PUSTAKA
Accotto GP, Vaira AM, Vecchiati M, finetti Sialer MM, Gallitelli D, Davino M. 2001. First report ofTomato chlorosis virus in Italy. Plant Dis. 85(11):1208. Andriani A. 2011. Deteksi diferensial Tomato chlorosis virus (ToCV) dan Tomato
infectious chlorosis virus (TICV) dengan reverse transcription-polymerase chain reaction (RT-PCR) [skripsi]. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor.
Bos L. 1990. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta (ID): Gadjah Mada University Press. Terjemahan dari: Introduction toPlant Virology.
Dalmon A, Fabre F, Guilbaud L, Lecoq H, Jacquemond M. 2008. Comparative whitefly transmission of Tomato chlorosis virus and Tomato infectious chlorosis virus from single or mixed infections. Plant Pathol. 58(2):221-227.
Dovas CI, Katis NI, Avgelis AD. 2002. Multiplex detection of Criniviruses associated with epidemics of a yellowing disease of tomato in Greece. Plant Dis. 86(12):1345-1349.
Duffus JE, Liu H-Y, Wisler GC. 1996. Tomato infectious chlorosisvirus a new clostero-like virus transmitted by Trialeurodes vaporariorum. Eur J Plant Pathol. 102(3):219-226.
Fitriasari ED. 2010. Keefektifan kutukebul dalam menularkan virus penyebab penyakit kuning pada tanaman tomat [tesis]. Bogor (ID):Sekolah Pascasarjana, Institut Pertanian Bogor.
FontMJ, Culebras PM, Jorda MC, Louro D, Vaira AM, Accoto GP. 2002. First report of Tomato infectious chlorosis virus in Spain. Plant Dis. 86(6):696. Gebre-Selassié K, Dumas de Vaulx, Marchoux G, Pochard E. 1981. Le virus de
la mosaïque du tabac chez le piment. I Apparition en France du pathotype P1-2. Agronomie 1(10): 853-858. doi 10.1051/agro:19811005.
Hull R. 2002. Plant Virology. Ed ke-4. San Diego: Acedemic Press.
Jacquemond M, Verdin E, Dalmon A, Guilbaud L, Gognalons P. 2008. Serological and molecular detection of Tomato chlorosis virus and Tomatoinfectious chlorosis virus in tomato. Plant Pathol. 58(2):210-220. Hutchison JGP. 1962. A method for permanent preservation of antigen-antibody
precipitation lines in agar. J Clin Pathol. 15(2):185.
Kurniawati F. 2012. Karakterisasi dan ekspresi gen coat protein Tomato infectious chlorosis virus pada Escherichia coli [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Letschert B, Adam G, Lesemann DE, Willingmann P, Heinze C. 2002. Detection and differentiation of serologically cross-reacting Tobamoviruses of economical importance by RT-PCR and RT-PCR-RFLP. J Virol Methods. 106(1): 1-10.
Li RH, Wisler GC, Liu HY, and Duffus JE. 1998. Comparison of diagnostic techniques for detecting Tomato infectious chlorosis virus. Plant Dis. 82(1):84-88.
13
Lin NS, Hsu YH, Hsu HT. 1990. Immunological detection of plant viruses and a mycoplasma-like organism by direct tissue blotting on nitrocellulose membranes. Phytopathology. 80(9):824-828.
Mahmood, T., Hein, G. L., and French, R. C. 1997. Development of serological procedures for rapid and reliable detection of wheat streak mosaic virus in a single wheat curlmite. Plant Dis. 81(3):250-253.
Naidu RA, Hughes JDA. 2003. Methods for the detection of plant viral diseasesin plant virology in sub-Saharan Africa, Proceedings of plant virology, IITA, Ibadan, Nigeria. Eds. Hughes JDA, Odu B, pp. 233- 260.
Navas-Castillo J, Camero R, Bueno M, Moriones E. 2000. Severe yellowing outbreaks in tomato in Spain associated with infections of Tomato chlorosisvirus. Plant Dis. 84(8):835-837.
Nickel O, Targon MLPN, Fajardo TVM, Machado MA, Trivillin AP. 2004. Polyclonal antibodies to the coat protein of Apple stem grooving virus expressed in Escherchia coli: production and use in immunodiagnosis. Fitopatol Bras. 29(5). doi:10.1590/S0100-41582004000500017.
Noordam D. 1973.Identification of Plant Viruses Methods and Experiments.Wageningen (UR): Center for Agricultural Publishing and Documentation.
Orílio AF, Navas-Castillo J. 2009. The complete nucleotide sequence of the RNA2 of the CrinivirusTomato infectious chlorosis virus: isolates from North America and Europe are essentially identical. Arch of Virol. 154(4): 683-687.
Somowiyarjo S, Sumardiyono YB, Suharno. 1997. Pemanfaatan membran nitroselulosa untuk pengiriman antigen uji dalam deteksi TMV dengan DIBA.J Perlind Tan Indonesia.3(1):1-5.
Suastika G, Hartono S, Nishigawa H, Natsuaki T. 2010. Yellowing disease outbreaks in tomato in Indonesia associated with infection of Tomato chlorosis virus and Tomato infectious chlorosis virus[abstract]. Di dalam: ISSAAS International Congress 2010: Agricultural Adaptation in Response to Climate Change; 2010 Nov 14-18; Denpasar (ID): ISSAAS.
Wetter C. and Conti M. 1988. Pepper mild mottle virus. CMI/AAB Descriptions of Plant Viruses N°330.
Wintermantel WM, Cortez AA, Anchieta AG, Gulati-Sakhuja A, Hladky LL. 2008. Co-infection by two Crinivirus alters accumulation of each virus in a host-specific manner and influences efficiency of virus transmission. Phytopathology. 98(12):1340-1345.
Wintermantel WM, Wisler GC. 2006. Vector specificity, host range, and genetic diversity of Tomato chlorosis virus. Plant Dis. 90(6):814-819.
Wisler GC, Duffus JE, Liu H-Y, Li RH. 1998a. Ecology and epidemiology of white.y-transmitted Closteroviruses. Plant Dis. 82(3):270–280.
Wisler GC, Li RH, Liu H-Y, Lowry DS, Duffus JE, 1998b. Tomato chlorosisvirus: a new white.y-transmitted, phloem-limited, bipartite Closterovirus of tomato. Phytopathology.88(5):402–409.
RIWAYAT HIDUP
Penulis dilahirkan di Malang pada tanggal 26 Desember 1990, anak bungsu dari pasangan Bapak Nur Hadi Ro’is dan Ibu Umnia Ulfah. Tahun 2009 penulis menamatkan Sekolah Menengah Atas Negeri 1 Gondanglegi, dan pada tahun yang sama diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjadi mahasiswa IPB, pada tahun 2009-2013 penulis menjadi anggota Koperasi Mahasiswa IPB (KOPMA IPB). Anggota Capung Fotografi Club Departemen Proteksi Tanaman (2010-2012), Anggota Organik Farming Club Departemen Proteksi Tanaman (2010-2013). Tahun 2011 penulis magang di Laboratorium Virologi, Departemen Proteksi Tanaman IPB. Menjadi asisten praktikum Ilmu Penyakit Tanaman Dasar semester Ganjil tahun ajaran 2011-2012, dan semester Ganjil tahun ajaran 2012-2013, asisten praktikum Virologi semester Genap tahun ajaran 2013-2014. Tahun 2011 penulis didanai oleh Direktorat Jendral Pendidikan Tinggi dalam usulan Program Kreatifitas Mahasiswa bidang Kewirusahaan (PKM-K), dan tahun 2012 dalam bidang Penelitian (PKM-P). Penulis menjadi juara II lomba Catur dalam rangka SERI-Art di Fakultas Pertanian.