BAKTERI USUS ITIK (Anas domestica) SEBAGAI KANDIDAT PROBIOTIK
Oleh
Aris Indriawan
Bakteri selulolitik dalam melakukan aktivitas enzim selulase dipengaruhi suhu lingkungan. Suhu tubuh itik dapat berpengaruh terhadap aktivitas enzim selulase. Penelitian ini bertujuan untuk mengetahui pengaruh suhu terhadap aktivitas enzim selulase bakteri usus itik. Metode yang digunakan dalam peneltian ini terdiri dari dua tahap, yaitu karakterisasi isolat bakteri dari usus itik dan uji aktivitas enzim selulase. Penelitian ini menggunakan Rancangan Acak Lengkap Kelompok (RALK) dengan tiga ulangan sebagai kelompok. Faktor pertama adalah jenis isolat bakteri. Faktor kedua adalah suhu inkubasi terhadap aktivitas enzim selulase, yaitu 35°C, 40°C, 45°C dan 50°C. Data aktivitas enzim selulase yang diperoleh diolah menggunakan Analisis Ragam (Anara). Analisis data dilanjutkan dengan menggunakan BNT (Beda Nyata Terkecil) dan Polinomial Ortogonal. Hasil penelitian menunjukkan bahwa isolat bakteri dari usus itik yang ditemukan adalahLactobacillus. Jenis isolat bakteri dan suhu inkubasi berpengaruh terhadap aktivitas enzim selulase. Aktivitas enzim selulase ketiga Lactobacillus dipengaruhi suhu yang berbeda. Isolat bakteri Oc15 memiliki aktivitas enzim selulase tertinggi pada suhu 45°C dan terendah pada suhu 50°C, sedangkan isolat bakteri Oc14 dan Oi30 memiliki aktivitas enzim selulase tertinggi pada suhu 35°C dan terendah pada suhu 50°C. Aktivitas enzim selulase tertinggi pada isolat bakteri Oc15.
RIWAYAT HIDUP
Penulis adalah anak kedua dari tiga bersaudara yang di lahirkan
dari pasangan Bapak Mukhtar dan Ibu Suliyah. Penulis dilahirkan
di Gaya Baru VIII, Kecamatan Seputih Surabaya, Kabupaten
Lampung Tengah pada tanggal 2 Agustus 1992.
Penulis menyelesaikan Pendidikan Taman Kanak di TK Aisiyah pada tahun 1998,
Pendidikan Sekolah Dasar di SDN 2 Srikaton pada tahun 2004, Sekolah Lanjutan
Tingkat Pertama (SLTP) di MTs Ma’arif 12 Manbaul Ulum pada tahun 2007 dan Sekolah Menengah Atas (SMA) di SMAN 1 Seputih Surabaya pada tahun 2010.
Pada tahun 2010, penulis terdaftar sebagai mahasiswa Jurusan Biologi Fakultas
Matematika dan Ilmu Pengetahuan Alam Universita Lampung melalui jalur
SNMPTN. Selama menjadi mahasiswa, penulis aktif di bidang Himpunan
Mahasiswa Biologi (HIMBIO), Rois FMIPA dan UKM Penelitian. Penulis
pernah menjadi asisten dosen Mikrobiologi Umum untuk mahasiswa Biologi
FMIPA dan FKIP, mahasiswa STIKES UMITRA, dan Asisten Mikologi untuk
mahasiswa Biologi FMIPA. Penulis pernah melaksanakan Kerja Praktik (KP) di
Balai Besar Pengembangan dan Pengendalian Hasil Perikanan (BBP2HP) Jakarta
Keberhasilan seseorang bukan dilihat dari hasilnya melainkan dari
sebuah proses menuju keberhasilan tersebut
Better late than never
Jangan pernah membenci seseorang yang telah menyakitimu walaupun
sudah menghancurkan hidupmu
Gold will not buy everything
Umur bukan menjadi pembatas seseorang untuk memperkaya ilmu dan
cakrawala
PERSEMBAHAN
✁✂ ✄ ☎✆ ✝✁ ✞✁ ✁ ✄✂✞✟ ✠✡ ✡ ✞✁ ✄✁ ✄ ☎ ✞☛, segala puji bagi Allah SWT yang telah
memberikan rahmat dan hidayah-Nya yang engkau berikan selama ini.
Teriring doa, rasa syukur dan segala kerendahan hati dengan segala
cinta dan kasih sayang kupersembahkan karya sederhana ini untuk
orang-orang yang berarti dan berharga dalam hidupku.
Bapak dan mamak, seseorang yang sangat mulia yang telah
membesarkanku, mendidikku, menyayangiku dan mendoakanku dengan
setulus hati tanpa pamrih dan tanpa batas.
Para pendidikku, atas bimbingan, motivasi, saran, kritik dan ajarannya
sehingga aku bisa menghadapi dunia dengan bijaksana dan arif.
Puji syukur penulis ucapkan kehadirat Allah SWT, karena atas rahmat dan
hidayah-Nya skripsi ini dapat diselesaikan dengan baik. Penulis menulis skripsi
ini sebagai tugas akhir untuk mencapai gelar Sarjana Sains Jurusan Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung dengan
judul“Pengaruh Suhu Terhadap Aktivitas Selulase Isolat Bakteri Usus Itik (Anas
domestica) Sebagai Kandidat Probiotik” yang dilaksanakan pada bulan Januari
sampai dengan April 2014.
Penelitian ini merupakan bagian dari proyek yang dilaksanakan oleh Dr. Ir. Rudy
Sutrisna, M.S. yang sepenuhnya didanai oleh Dirjen DIKTI Kementrian
Pendidikan Nasional melalui hibah bersaing pada tahun 2013.
Penulis menyadari bahwa banyak sekali bantuan yang penulis dapatkan selama
menyelesaikan skripsi ini. Dengan terselesaikan skripsi ini penulis ingin
menyampaikan rasa terimakasih kepada :
1. Ibu Dra. C. N. Ekowati, M.Si., selaku Pembimbing I yang telah dengan sabar
memberi saran, ide, motivasi, kritik dan berbagi ilmu serta membimbing
2. Bapak Dr. Ir. Rudy Sutrisna, M.S., selaku Pembimbing II yang telah dengan
sabar membimbing, memberi motivasi, saran-saran, kritik dan berbagi ilmu
serta membantu penulis selama proses menyelesaikan skripsi ini.
3. Bapak Dr. Sumardi, M.Si., selaku Pembahas yang selalu memberi motivasi,
saran-saran, kritik, serta koreksinya sehingga skripsi ini menjadi lebih baik.
4. Ibu Dra. Elly L. Rustiati, M.Sc., selaku koordinator Seminar Usul.
5. Bapak Drs. Hendri Busman, M.Biomed., selaku koordinator Seminar Hasil.
6. Bapak Drs. M. Kanedy, M.Si., selaku koordinator Skripsi.
7. Ibu Dra. Yulianty, M.Si., selaku Pembimbing Akademik yang telah memberi
saran, bantuan, motivasi, ide dan kasih saying selama penulis menuntut ilmu
dikampus.
8. Ibu Dra. Nuning Nurcahyani, M.Sc., selaku Ketua Jurusan Biologi FMIPA
Universitas Lampung.
9. Bapak Prof. Suharso, Ph.D., selaku Dekan FMIPA Universitas Lampung.
10. Bapak dan mamak tercinta yang selalu memberikan doa dan motivasi baik
materi dan moral selama penulis menyelesaikan skripsi ini.
11. Kedua saudariku, mbak Maria Ulfa dan adikku Umi Fatimatuz Zahra yang
selalu memberikan kasih sayang, motivasi, bantuan, semangat dan doanya
selama ini.
12. Sahabat-sahabat seperjuangan mikroholic khususnya Ana Sulastri Sirait,
Novaria Situmorang, Aulia Murti Novita Sari, Shofia Rodiah, Nurul Maulida,
Lestari dan Rizki Fajri Moro Handayani yang telah memberikan dukungan
dukungan selama penulis menyelesaikan skripsi ini.
13. Ibu Kusuma Handayani, M.Si., atas segala ilmu, saran, motivasi dan canda
tawa selama ini.
14. Segenap dosen yang telah mendidik, memberikan ilmu dan motivasi yang
bermanfaat kepada pemulis selama menuntut ilmu dikampus.
15. Seluruh Staff dan karyawan FMIPA Unila atas bantuan dan kerjasamanya
selama proses perkuliahan.
16. Pak Imron, Pak Hambali, Pak Sutris, Mbak Nunung, Mbak Ida atas bantuan
yang diberikan kepada penulis selama melakukan penelitian.
17. Sahabat-sahabatku Biologi 2010, Nyimas Farisa Nadhilla, Sonia Malinda,
Khusnul Lestari, Dwi Oktarina, Linda Wati, Rita Asmara, Devi Gusneta
Mala, Eka Rahmawati, Billi Andreas, Dewi Chusniasih, Arinjani Dwi H,
Rodhi Lestari, Meita Mahardianti, Rika Erviana, Ismalia Husna, Yunita
Lestari, Anggia Putri, Siti Latifa Sonia, Annisa Mulia Anasis, Windi Astika
Sari, Yusrina Avianti, Suci Nathalia, Andhara Ratna Maharani, Pipin
Yuliana, Elisa Nur Fitriana, Wikke Febryaeldi, Citra Oktrine Saragih, Desima
Putri, Dimas Djuli Handoko, Elga Octavianata, Eko Budiono, Adi Ilhan
Nuari, Avy R., Sutanto Pindias Putra dan Faisal Rais, terimakasih atas
kebersamaannya selama ini yang telah memberikan semangat, motivasi dan
berbagi ilmu.
18. Sahabat-sahabatku Kak Ngudi Waluyo, Kak David, Fahri, Hariz, Faradilla
Putri, Muhammad Haikal, Hanna Ade Pertiwi, Lusi Maulida, Erliyanto, Arif
Wuriyanto, Mega Khusnul, Harsa, Dio Alif Aditya, Rana Andriana, Amanda
Samurti Pertiwi, Oki, Dimash Adi Putra Septian, Mbak Ria, Mbak Mei
Rukmana, Mbak Istifanda (Ista), Kak Odo, Betty, Tito, Awalia, Maretha,
Mellin, Elisa, Ute, Nina, Franz Wolfeneck, Hafeez dan Rick terimakasih atas
kebersamaannya selama ini yang telah memberikan semangat, motivasi dan
berbagi ilmu.
19. Teman-teman kerja praktik di laboratorium mikrobiologi BBP2HP Jakarta
Timur khususnya Ina Sawitri dan Anisa Aulia Akbar.
20. Teman-teman dormitory BKIPM Jakarta Timur khususnya Habib, Mega, Ari,
Ega, Febbi dan dewi yang sudah banyak membantu di dormitory BKIPM.
21. Ibu Ety Kurniawati, M.Si. dan Pak Sulhan selaku pembimbing kerja praktik
di Laboratorium Mikrobiologi BBP2HP Jakarta Timur.
22. Serta semua pihak yang telah memberikan dukungan, motivasi dan bantuan
yang diberikan selama penulis menyelesaikan skripsi.
Akhir kata, penulis menyadari bahwa dalam penyusunan skripsi ini masih jauh
dari kesempurnaan dan banyak kekurangan, saran dan kritik yang bersifat
membangun dari setiap pembaca sangat penulis harapkan demi kesempurnaan
skripsi ini. Semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi
kita semua.
Bandar Lampung, 15 Juli 2014
Penulis,
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 4
D. Kerangka Pikir ... 4
E. Hipotesis ... 5
II. TINJAUAN PUSTAKA A. Bakteri Selulolitik ... 6
B. Probiotik ... 8
C. Selulosa ... 10
D. Enzim Selulase ... 12
III. METODE PENELITIAN A. Tempat dan Waktu Penelitian ... 17
B. Alat dan Bahan ... 17
C. Metode Penelitian ... 18
D. Analisis Data ... 19
E. Cara Kerja ... 19
1. Peremajaan ... 19
2. Karakterisasi Bakteri Selulolitik Secara Mikroskopik ... 19
3. Uji Katalase ... 19
4. Uji Motilitas ... 20
5. Uji Gelatin ... 20
6. Uji Fermentasi Gula ... 20
ii
8. Pembuatan Suspensi Isolat Bakteri ... 21
9. Produksi Enzim Selulase ... 22
10. Penyiapan Enzim Selulase Kasar ... 22
11. Penentuan Aktivitas Enzim Selulase ... 22
12. Penentuan Kurva Standar Glukosa ... 24
F. Prosedur Kerja ... 25
IV. HASIL DAN PEMBAHASAN A. Karakterisasi Secara Morfologi dan Fisiologi Isolat Bakteri dari Usus Itik ... 26
B. Uji Selulolitik Kualitatif Isolat Bakteri dari Usus Itik ... 28
C. Pengaruh Suhu Terhadap Aktivitas Enzim Selulase Isolat Bakteri dari Usus Itik... 31
V. SIMPULAN DAN SARAN A. Simpulan ... 37
B. Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Tabel Halaman
1. Hasil karakterisasi secara morfologi isolat bakteri dari usus itik ... 26
2. Hasil karakterisasi secara fisiologi isolat bakteri dari usus itik... 27
3. Uji BNT indeks selulolitik dari kelima isolat bakteri... 30
4. Aktivitas enzim selulase ketiga isolat bakteri terhadap pengaruh suhu ... 32
5. Hasil perhitungan nilai indeks selulolitik ... 55
6. Hasil perhitungan rata-rata indeks selulolitik... 56
7. Perhitungan analisis ragam indeks selulolitik dari kelima isolat bakteri.. 57
8. Analisis ragam indeks selulolitik dari kelima isolat bakteri... 59
9. Nilai absorbansi standar glukosa ... 60
10. Hasil pengukuran absorbansi dengan spektrofotometer... 62
11. Nilai aktivitas enzim selulase dari ketiga isolat bakteri dari usus itik... 71
12. Analisis ragam aktivitas enzim selulase ketiga isolat bakteri dari usus itik 76 13. Analisis ragam aktivitas enzim selulase pada isolat Oc14 ... 78
14. Uji BNT aktivitas enzim selulase pada isolat Oc14 ... 79
15. Analisis ragam aktivitas enzim selulase pada isolat Oc15 ... 84
16. Uji BNT aktivitas enzim selulase pada isolat Oc15 ... 85
17. Analisis ragam aktivitas enzim selulase pada isolat Oi30... 90
iv
DAFTAR GAMBAR
Gambar Halaman
1. Rumus kimia β-glukosa, β-selobiosa dan rantai selulosa... 11
2. Mekanisme kerja enzim selulase ... 13
1 3. Diagram alir penelitian ... 25
4. Histogram indeks selulolitik isolat bakteri dari usus itik ... 28
5. Pengaruh suhu terhadap aktivitasenzim selulase isolat bakteri Oc14 ... 33
6. Pengaruh suhu terhadap aktivitasenzim selulase isolat bakteri Oc15 ... 33
7. Pengaruh suhu terhadap aktivitasenzim selulase isolat bakteri Oi30 ... 34
8. Uji katalase isolat bakteri dari usus itik... 46
9. Uji fermentasi galaktosa isolat bakteri dari usus itik... 46
10. Uji Fermentasi glukosa isolat bakteri dari usus itik ... 47
11. Uji Fermentasi sukrosa isolat bakteri dari usus itik... 47
12. Uji Fermentasi laktosa isolat bakteri dari usus itik... 47
13. Uji Motilitas isolat bakteri dari usus itik ... 48
14. Uji Gelatin isolat bakteri dari usus itik... 49
15. Morfologi isolat bakteri dari usus itik ... 50
16. Pewarnaan gram isolat bakteri dari usus itik ... 51
17. Pewarnaan spora isolat bakteri dari usus itik... 52
19. Produksi enzim selulase isolat bakteri dari usus itik ... 54
20. Pengujian aktivitas enzim selulase isolat bakteri dari usus itik... 54
1
BAB I. PENDAHULUAN
A. Latar Belakang
Pakan merupakan kebutuhan utama dalam usaha pemeliharaan ternak itik,
karena pakan berfungsi sebagai penghasil energi. Jenis pakan yang biasa
digunakan oleh peternak itik adalah bekatul, jagung, singkong, bekicot dan
bahan pakan lain yang dapat digunakan dalam kadar tertentu seperti tongkol
jagung, kulit buah kakao dan eceng gondok. Bahan pakan ini banyak
mengandung serat kasar salah satunya adalah selulosa. Menurut Irawadi
(1990) bekatul dan tongkol jagung mengandung selulosa (40-60%),
hemiselulosa (20-30%) dan lignin (15-30%). Kulit buah kako mengandung
36,23% selulosa, 1,14% hemiselulosa dan 20-27,95% lignin (Ammirroenas,
1990), singkong mengandung 43,60% selulosa, 10% hemiselulosa dan 7%
lignin (Artiyani, 2011), eceng gondok mengandung 64,51% selulosa dan
7,69% lignin (Roechyati, 1983).
Bahan pakan juga mengandung protein, lemak, abu dan air. Oleh karena itu
bahan pakan ini dapat digunakan sebagai bahan pakan ternak, sebagai sumber
energi dan sumber karbon bagi pertumbuhan mikroorganisme (Ardiansyah,
2010) yang terdapat dalam saluran pencernaan itik. Di dalam saluran
Lactobacillussp. danBacillussp. merupakan mikroorganisme yang
menguntungkan (Martin, 1995) danEscherichia coli, Salmonellasp. dan
Staphylococcus aureusmerupakan mikroorganisme yang merugikan (Fuller,
1992).
Lactobacillussp. danBacillussp. merupakan mikroorganisme yang dapat
menghasilkan berbagai enzim, salah satunya adalah enzim selulase (Khabbah,
2007; Moat dan Foster, 1988). Bakteri selulolitik menghasilkan enzim
selulase yang dapat menguraikan selulosa menjadi glukosa. Dalam penelitian
Khabbah (2007),Lactobacillus collinoidesdapat menghasilkan aktivitas
enzim selulase sebesar 3,300 x 10-3± 0,0002 µmol mL-1.
Itik tidak dapat menghasilkan enzim selulase. Oleh karena itu, diperlukan
bakteri selulolitik yang ditambahkan sebagai bakteri probiotik dalam pakan
itik. Probiotik merupakan mikroorganisme hidup beserta substansinya yang
mampu mendukung keseimbangan mikro-flora dalam saluran pencernaan
(Fuller, 1992). Salah satu bakteri probiotik adalahLactobacillus. Dalam
penelitian Gunawanet al.(2003), penambahanLactobacillus acidophilus
sebanyak 2% dan 4% dalam ransum ayam mampu meningkatkan produksi
telur, menurunkan kolesterol dan menekan konversi ransum. Hal ini
disebabkan olehLactobacillusdapat meningkatkan kandungan gizi dalam
usus dengan membantu proses pencernaannya. Salah satunya dengan
menghasilkan enzim ekstraseluler, yaitu enzim selulase, sehingga dapat
3
Isolat bakteri yang digunakan dalam penelitian ini adalah isolat yang berasal
dari usus itik. Isolat ini dapat tumbuh pada media yang mengandung selulosa
dan bersifat selulolitik karena dapat membentuk zona bening pada ujicongo
redtetapi belum dilakukan karakterisasi enzim selulasenya.
Pada umumnya enzim mempunyai suhu optimum dalam melakukan
aktivitasnya. Kecepatan reaksi enzim sangat ditentukan oleh perubahan suhu
(Hastowo dan Lay, 1994). Austin (1988) menyatakan bahwa degradasi
maksimum diperkirakan terjadi pada suhu 25-37°C, suhu inkubasi sangat
berpengaruh terhadap aktivitas enzim, yaitu pada suhu rendah enzim akan
bekerja lambat dan meningkat sampai suhu 45°C. Kecepatan rekasi enzim
meningkat 100% dengan kenaikan suhu 10°C sampai batas tertentu.
Itik memiliki suhu tubuh 38,9-41,9°C (Oluyemi dan Roberts, 1979). Salah
satu persyaratan bakteri dapat dijadikan probiotik, aktivitas enzimnya harus
cukup baik pada suhu tubuh itik. Oleh karena itu, perlu diteliti aktivitas
enzim selulase isolat bakteri dari usus itik pada suhu inkubasi yang sesuai
dengan suhu tubuh itik.
B. Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui pengaruh suhu terhadap
C. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi yang ilmiah bagi
peneliti dan masyarakat, khususnya tentang bakteri selulolitik dari usus itik
dan kemampuan aktivitas enzim selulase isolat bakteri selulolitik tersebut
yang dapat digunakan sebagai kandidat probiotik pakan ternak dan untuk
usaha pengembangan industri enzim selulase di masa mendatang.
D. Kerangka Pikir
Bakteri selulolitik merupakan bakteri yang memiliki kemampuan untuk
menguraikan polimer selulosa menjadi senyawa-senyawa yang lebih
sederhana berupa glukosa. Bakteri ini mempunyai enzim selulase yang dapat
menghidrolisis selulosa menjadi struktur molekul yang lebih sederhana untuk
keperluan proses metabolisme bakteri tersebut dan organisme lain yang
memerlukan (Ibrahim dan El-diwany, 2007)
Kemampuan bakteri dalam memproduksi enzim sangat dipengaruhi oleh
faktor gen dan lingkungan. Faktor gen dapat mempengaruhi tingkat
kemampuan enzimatik karena enzim disintesis di sitoplasma. Di dalam inti
sel terdapat DNA yang disusun oleh beberapa gen-gen yang dapat mengkode
pembentukan selulase yang berfungsi untuk menguraikan selulosa yang
terdapat di dalam substrat. Namun, ekspresinya juga dipengaruhi oleh
lingkungan, salah satunya adalah suhu (Pelczaret al., 1993).
Suhu dapat mempengaruhi kerja enzim, karena enzim terdiri atas protein.
5
gugus reaktif terhambat dalam bereaksi dengan substrat. Enzim selulase dapat
melakukan aktivitasnya pada kisaran suhu 25-45°C. Semakin tinggi suhu
kecepatan reaksi kimia enzim akan semakin cepat, akan tetapi enzim akan
mengalami perubahan konformasi jika terlalu di atas suhu optimum
(Sutiamiharja, 2008).
Itik memiliki suhu tubuh 38,9-41,9 °C, pada suhu ini berpengaruh terhadap
aktivitas enzim selulase pada tubuh itik.
E. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah perbedaan suhu inkubasi
berpengaruh terhadap aktivitas enzim selulase yang dihasilkan oleh isolat
BAB II. TINJAUAN PUSTAKA
A. Bakteri Selulolitik
Sebagian besar bakteri selulolitik berbentukcoccusyang memperlihatkan tipe
struktur dinding sel Gram-positif dan berbentukbacillyang memperlihatkan
tipe struktur dinding sel Gram-negatif (Ogimoto dan Imai, 1981). Struktur
dinding sel bakteri memeliki peran khusus dalam integritas selular, bentuk dan
stabilitas fisiologis. Sel bakteri Gram-positif mempunyai dinding tebal yang
terdiri dari suatu jaringan multilayer peptidoglikan (sekitar 30-70% dari bobot
total dinding sel) yang terikat oleh membran bagian dalam. Sel bakteri
Gram-negatif mempunyai dinding relatif tipis dari peptidoglikan yang terisi diantara
dua membran (<10% dari bobot totol dinding sel). Membran luar terdiri dari
lipoprotein dan liposakarida. Kedua tipe Gram mempunyai membran bagian
dalam dengan tipikal struktur dua lapis potein/lemak dari membran
sitoplasmik (Ling, 1990).
Bakteri selulolitik merupakan bakteri yang dapat menghidrolisis kompleks
selulosa menjadi oligosakarida yang lebih kecil dan akhirnya menjadi glukosa.
Glukosa tersebut digunakan sebagai sumber nutrisi dan karbon bagi
pertumbuhan organisme ini. Bakteri selulolitik mensintesis seperangkat
7
selulase. Mikroba mensintesis enzim selulse selama tumbuh pada media
selulosa (Ibrahim dan El-diwany, 2007).
Mikroba yang dapat menghidrolisis selulosa kristal dapat mensekresikan
kompleks selulase (Shinmadaet al,1994). Selulase dihasilkan karena adanya
respon terhadap selulosa pada lingkungannya. Proses ini berlangsung apabila
sel bakteri berkontak langsung pada permukaan selulosa (Bustoet al, 1995).
Kemampuan biosintesis selulase dapat dimiliki oleh banyak mikroba (Raza
dan shafiq-Ur-Rehman, 2008).
Beberapa bakteri selulolitik yang berhasil diisolasi dari rumen ternak adalah
kelompok bakteri dariFibrobacter succinogenes, Butirivibrio fibrisolendan
Ruminococcus albus (Madigan, 1997; Weimer, 1999), sedangkan dari usus
ayam petelur ditemukan kelompok bakteri selulolitik dariBacillus
laterosporus, Bacillus coagulans, Bacillus circulansdanBacillus alvei
(Sjofjan, 2007). Bakteri ini dapat menghidrolisis selulosa menjadi glukosa
karena memiliki enzim selulase. Selain itu, bakteri ini menghasilkan suksinat,
asetat, format dan butirat.
Secara alami, bakteri mampu menghidrolisis selulosa baik secara anaerob
maupun aerob. Bakteri selulolitik dapat mendegradasi senyawa selulosa dan
akan menghasilkan air dan karbondioksida pada kondisi aerob, sedangkan
pada kondisi anaerob akan menghasilkan molekul hidrogen dan senyawa
methan. Bakteri selulolitik anaerob hanya dapat tumbuh pada sumber selulosa
dan produk selulolitiknya. Bakteri ini tidak dapat tumbuh pada oligosakarida,
(Lyndet al, 2002). Bakteri selulolitik aerob dapat menggunakan sumber
karbon lain di samping glukosa. Bakteri selulolitik digolongkan menjadi dua
berdasarkan akan kebutuhan oksigen, yaitu kelompok bakteri aerob dan
anaerob. Bakteri selulolitik aerob meliputi bakteriPseudomonas, Cellvibrio,
Cellulomonas, Bacillus, Actinommycetes(Streptomyces, Microbispora,
Thermomonospora) danAcidothermus,sedangkan bakteri selulolitik anaerob
meliputiRuminococcus, Clostridium, Caldocellum, Bacteroidesdan
Acetivibrio(Fogarty dan Kelly, 1990).
Bakteri selulolitik anaerob dapat diklasifikasikan menjadi bakteri mesofil
pembentuk spora, bakeri mesofil bukan pembentuk spora dengan bentukbacill
ataucoccusdan bakteri termofil yang menghasilkan spora. Bakteri anaerob
banyak ditemukan di alam adalah anggota genusClostridium. Sebagian jenis
bakteri anaerob dapat memecah selulosa pada temperatur 60-65°C. Mikroba
ini terdistribusi secara luas di alam dan dapat ditemukan dalam intestinum
binatang, sungai dan tanah lumpur (Salle, 1974).
B. Probiotik
Fuller (1992) menyatakan bahwa bahan probiotik adalah makanan tambahan
(feed suplement) berupa jasad hidup yang mempunyai pengaruh
menguntungkan bagi ternak induk semangnya. Mikroorganisme yang dapat
dimanfaatkan sebagai probiotik antara lain tidak toksik, mampu bertahan pada
suasana asam dan cairan empedu, dapat berkoloni dan melakukan kegiatan
metabolisme di dalam usus, dapat tumbuh lama dan menghambat mikroba
9
Pernyataan ini kemudian diperbaharui oleh Salminenet al.(1999) probiotik
yaitu sediaan sel mikroba atau komponen dari sel mikroba yang mempunyai
pengaruh menguntungkan pada kesehatan dan kehidupan inangnya.
Menurut Fuller (1991) bakteri probiotik harus memiliki persyaratan yaitu
memberikan efek yang menguntungkan pada host, tidak patogenik dan tidak
toksik, mengandung sejumlah besar sel hidup, mampu bertahan dalam kondisi
yang tidak menguntungkan dan melakukan kegiatan metabolisme dalam usus,
tetap hidup selama dalam penyimpanan sampai waktu digunakan, mempunyai
sifat sensori yang baik, diisolasi darihost.
Menurut Mujiasih (2001) mikroorganisme yang sering digunakan sebagai
probiotik adalahBacillus coagulans, B. lentis, B.pumilus, B. brevis, B. alvei,
B. circulans, Bifidobacterium adolescentis, B. animalis, B. bifidum, B.
infantis, B. longum, B. thermopilus, Bacteroides amylophilus, B. ruminicola,
Lactobacillus acidophilus, L. brevis, Streptococcus oremoris, S. faecium, S.
lactis, S. thermophilus, Leiconostoc mesenteroidesdanPediococcus
acidolacticii. Penggunaan probiotik pada ternak unggas bertujuan untuk
memperbaiki saluran pencernaan dengan cara: (1) menekan reaksi
pembentukan racun dan metabolit yang bersifat karsinogenik (penyebab
kanker), (2) merangsang reaksi enzim yang dapat menetralisir senyawa
beracun yang tertelan atau dihasilkan oleh saluran pencernaan, (3) merangsang
produksi enzim (enzim selulase, protease dan alfa-amilase) yang digunakan
untuk mencerna pakan, (4) memproduksi vitamin dan zat zat yang tidak
penggunaan probiotik dapat memperbaiki performa ayam broiler meliputi
rataan bobot hidup, konversi pakan dan menurunkan mortalitas.
C. Selulosa
Selulosa merupakan komponen struktural tumbuhan yang tidak dapat dicerna
oleh manusia dengan rumus molekul (C6H10O5)n. Salah satu jenis
polisakarida karbohidrat dari β-glukosa adalah selulosa. Tumbuhan berkayu
dan berserat yang sangat melimpah di alam banyak mengandung selulosa.
Karbohidrat utama yang disintesis oleh tanaman adalah selulosa dan
menempati hampir 60% komponen penyusun struktur tanaman (Salma dan
Gunarto,1999). Ujung polimer (eksoselulase) atau kepingan polimer selulase
dapat memecah molekul glukosa menjadi molekul yang lebih kecil melalui
pencernaan internal (endoselulase).
Selulosa di alam banyak ditemukan sebagai selulosa natif yang masih
berikatan dengan senyawa lainnya seperti lignin dan selulosa. Selulosa dapat
dijadikan serbuk bahkan dimurnikan dengan derajat kristalinitas tinggi seperti
avisel. Avisel merupakan selulosa mikrokristal yang banyak dimanfaatkan
dalam industri farmasi terutama sebagai pengikat pada proses pembuatan
tablet cetak langsung. Avisel bersifat sukar larut dibandingkan dengan serbuk
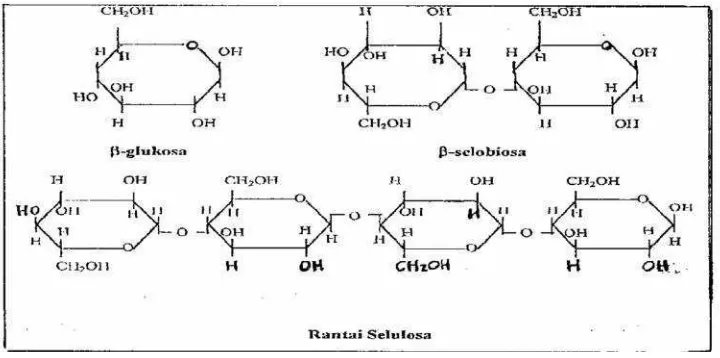
selulosa. Selulosa adalah suatu homopolimer rantai lurus yang disusun oleh
unitβ-glukosa, dua molekul β-glukosa digabungkan melalui suatu ikatan 1,4
untuk membentuk β3-selobiosa. Molekul selulosa adalah polimer sederhana
rantai lurus yang terdiri dari 1000-10.000 unit selobiosa yang saling
11
1990). Rumus β-glukosa dan β-selobiosa serta rantai selulosa
ditunjukkan pada Gambar 1.
Gambar 1. Rumus kimia β-glukosa, β-selobiosa dan rantai selulosa (Salle,
1974).
Terdapat beberapa faktor yang mempengaruhi proses hidrolisis selulosa, yaitu
tipe substrat, suhu, waktu, pH, konsentrasi substrat, pemanfaatan enzim
kembali dan tipe reaktan, banyak dari faktor-faktor tersebut saling
ketergantungan sehingga menjadikan keseluruhan proses benar-benar lengkap
(Linko, 1975).
Laju metabolisme selulosa dapat diatur oleh beberapa pengaruh, yaitu
lingkungan, karakteristik fisik dan kimia tanah yang bervariasi memiliki
kapasitas selulolitik yang berbeda. Faktor lingkungan utama yang
mempengaruhi transformasi tersebut, yaitu suhu, aerasi, kelembapan, pH,
tingkat kesediaan nitrogen, keberadaan karbohidrat lainnya dan proporsi
D. Enzim Selulase
Selulase merupakan enzim yang mampu menguraikan selulosa menjadi
menjadi senyawa yang lebih serdehana, yaitu glukosa (Schlecel dan Schmidt,
1994). Struktur selulase terdiri atas satu pusat katalitik, daerah pengikat
selulosa dan rantai terglikolisasi. Enzim selulase adalah enzim ekstraseluler
yang dihasilkan oleh bakteri selulolitik jika di dalam media hidupnya terdapat
selulosa sebagai sumber karbon dan energi (Rahayu, 1991). Selulosa berperan
sebagai induser dalam sintesis selulase yang memiliki dua fungsi, yaitu
sebagai induser pada sintesis enzim dan sebagai sumber karbon untuk
pertumbuhan sel (Gong dan Tsao, 1979).
Enzim selulase merupakan suatu protein yang terdiri dari 434 residu asam
amino. Enzim ini memiliki beberapa sisi aktif yang terletak di beberapa
bagian pada rantai protein tersebut. Sisi aktif enzim selulase antara lain pada
glutamat 212, aspartat 214, glutamat 217, histidin 228, glutamat 295
(Winarno, 1986).
Selulase terdiri dari tiga komponen enzim, yaitu endo-β-1,4-glukanase,
ekso-β-1,4-glukanase dan β-glukosidase. Ketiga komponen enzim ini bekerjasama
dalam menghidrolisis selulosa menjadi senyawa yang lebih sederhana, yaitu
glukosa (Schlecel dan Schmidt, 1994).
Mekanisme kerja enzim selulase dimulai dari proses hidrolisis selulosa yang
13
Gambar 2. Mekanisme kerja enzim selulase (Whithers, 1995).
Mekanisme di atas adalah proses hidrolisis selulosa oleh bakteri yang
dilakukan dengan bantuan enzim ekstraseluler, yaituendo β-1,4-glukanase,
ekso β-1,4-glukanase dan β-glukosidase. Enzim endo β-1,4-glukanase
menghirdrolisis polimer secara acak dan menghasilkan molekul selulosa
sederhana. Selulosa sederhana atau dua subunit glukosa dihidrolisis oleh ekso
β-1,4-glukanase pada bagian ujung sehingga menghasilkan selobiosa
disakarida. Selanjutnya selobiosa dihidrolisis oleh enzim β-glukosidase
menjadi glukosa. Enzim mempunyai kekhasan dalam mengenali dan mengikat
substrat, karena enzim mempunyai sisi aktif yang digunakan untuk mengikat
substrat, sisi aktif enzim yang dimiliki sangat spesifik. Enzim selulase
mempunyai gugus aktif–COOH yang merupakan gugus aktif dari asam amino
jenis asam aspartat (Whithers, 1995).
Enzim merupakan protein yang terdapat di dalam sel hidup sehingga
mempengaruhi aktivitas enzim, yaitu suhu, pH, sinar ultraviolet, konsentrasi
substrat dan enzim, senyawa pengaktif (activator) dan senyawa penghambat
(inhibitor) (Salle, 1974).
Suhu dapat mempengaruhi terhadap aktivitas enzim, pertumbuhan dan
metabolisme bakteri. Enzim dapat berfungsi dengan baik sebagai katalisator
pada suhu optimum, jika suhu menyimpang dari suhu optimum maka aktivitas
enzim akan menurun (Hastowo dan Lay, 1994). Kecepatan reaksi suatu enzim
seiring dengan peningkatan suhu. Suhu memiliki dua pengaruh yang saling
berlawanan terhadap aktivitas enzim, yaitu meningkatnya suhu akan
meningkatkan aktivitas enzim tetapi sebaliknya juga mendenaturasi enzim
(Martoharsono, 1993). Menurunnya aktivitas mengikuti meningkatnya suhu
di atas optimum biasanya disebabkan oleh kerusakan enzim. Sebagian besar
enzim mempunyai aktivitas optimum pada suhu antara 30°C dan 40°C (Volk
dan Wheeler, 1988).
Shabib (1992) menyatakan bahwa peningkatan suhu di atas suhu optimum
menyebabkan rusaknya enzim karena enzim mengalami denaturasi.
Kecepatan reaksi enzim sangat ditentukan oleh perubahan suhu. Sensitifitas
enzim terhadap perubahan suhu ini dikenal dengan kestabilan enzim atau
kestabilan panas (heat stability). Kestabilan panas berarti sampai berapa
derajat pengaruh suhu tersebut terhadap kestabilan enzim (Zey, 1996). Suhu
rendah dapat menyebabkan laju aktifitas enzim sangat lambat tetapi pada suhu
tinggi laju aktifitas enzim sangat cepat sehingga reaksi enzimatik praktis
15
Perbedaan sumber enzim menyebabkan perbedaan daya tahan panas. Istilah
yang digunakan untuk menyatakan pengaruh suhu terhadap laju reaksi enzim
adalah koefisien suhu (Q10) yang biasanya bernilai sekitar 2,0. Hal ini berarti
bahwa laju reaksi akan mencapai dua kali lipat untuk peningkatan suhu 10°C
sampai denaturasi terjadi (Martoharsono, 1993). Setiap enzim mempunyai
suhu optimum,maksimum dan minimum (Salle, 1974). Karakteristik suhu
tersebut dipengaruhioleh sejumlah faktor seperti misalnya konsentrasi enzim,
sifat dasar dan konsentrasi substrat, pH dan keberadaan senyawa pengaktif
dan penghambat. Pada umumnya enzim memiliki aktifitas optimum pada
suhu optimum yang sama dengan suhu optimum untuk pertumbuhan sel
bakteri (Rodwell, 1985).
Enzim merupakan protein yang tersusun atas asam amino, oleh karena itu
pengaruh pH berhubungan erat dengan sifat asam-basa yang dimiliki oleh
protein. Umumnya enzim menunjukkan titik optimum aktifitas pada pH
tertentu (Martoharsono, 1993). Volk dan Wheeler (1988) menyatakan bahwa
konsentrasi ion hidrogen, yaitu keasaman atau kebasaan larutan sangat
mempengaruhi aktifitas suatu enzim. Hal ini disebabkan karena asam amino
yang merupakan pusat aktif enzim harus berada dalam keadaan ionisasi yang
tepat agar menjadi aktif. Setiap enzim memiliki pH maksimum, optimum dan
minimum. Nilai-nilai pH tersebut bervariasi dengan suhu, tipe dan
konsentrasi substrat, tipe larutan penyangga (buffer), ada atau tidak adanya
senyawa penghambat atau pengaktif dan waktu yang dibutuhkan enzim
Efek sinar ultraviolet salah satunya adalah merusak dan memodifikasi kerja
enzim. Kecepatan perusakan itu secara praktis tidak tergantung pada suhu
tetapi dipengaruhi oleh pH dan kondisi lingkungan yang lain. Enzim yang
murni lebih mudah rusak oleh sinar ultraviolet daripada enzim yang sama
dalam preparasi yang kurang murni. Enzim, seperti halnya bakteri dan sel
hidup lainnya paling sensitif pada panjang gelombang yang sama dari sinar
UV, yaitu di sekitar 2650 Å (Salle, 1974).
Menurut Salle (1974), semakin tinggi konsentrasi substrat mungkin dapat
meningkatkan atau mengurangi kecepatan suatu reaksi enzimatik, jika
konsentrasi substrat jumlahnya lebih sedikit daripada jumlah enzim maka
suatu peningkatan kandungan substrat akan meningkatkan kecepatan reaksi.
Laju aktivitas enzim akan meningkat dengan meningkatnya kadar substrat
sampai suatu titik tertentu. Sekali enzim jenuh dengan substrat, penambahan
kadar substrat tidak akan berpengaruh pada kecepatan reaksi. Makin rendah
kadar substrat yang akan menghasilkan aktivitas maksimum, yaitu
menjenuhkan enzim maka makin besar hubungan yang dimiliki enzim dengan
substratnya (Volk dan Wheeler, 1988).
Beberapa substansi yang dapat memulihkan aktivitas enzim disebut dengan
aktifator, sedangkan substansi lain yang dapat menghambat aktivitas enzim
disebut dengan inhibitor. Substansi-substansi tersebut mungkin salah satunya
bersifat spesifik atau non-spesifik, yaitu meliputi senyawa asam, logam berat,
17
BAB III. METODE PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Jurusan Biologi
FMIPA Universitas Lampung dari bulan Januari sampai dengan April 2014.
B. Alat dan Bahan
1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah laminarair flow
cabinet, autoclave,neraca analitik, inkubator, oven, jarum ose,
erlenmeyer, kompor listrik,vortex mixter,micropipette, pipet tips,
spektrofotometer, cawan petri, kapas, tabung reaksi,alumunium foil,
batang pengaduk, botol, bunsen, water bath shaker, gelas ukur, pinset
dan mikroskop.
2. Bahan
Bahan yang digunakan dalam penelitian ini adalah 5 isolat bakteri
selulolitik koleksi Sutrisna, Liman dan Ekowati (2012), MRSAgar(De
Man Rogosa and Sharpe Agar), MRSBroth(De Man Rogosa and
Sharpe Broth), Agar Bacteriological,Nutrien Agar, gelatin, CMC
(Carboxy Methyl Cellulose), aquades, garam fisiologis, laktosa, sukrosa,
indikatorcongo red0,1%, indikatorphenol red, alkohol 70% dan
spirtus.
C. Metode Penelitian
Pada penelitian ini digunakan 5 isolat bakteri dari usus itik koleksi Sutrisna,
Liman dan Ekowati (2012) yang telah diremajakan. Koloni bakteri diberi
kode huruf dan angka. Huruf O dan K menunjukkan asal bakteri dari usus
itik yang diberi perlakuan bahan pakan dalam ransum berupa onggok (O) dan
kakao (K). Huruf i dan c menunjukkan asal bakteri dari usus itik yang
diambil dari bagianileum(i) dancolon(c), sedangkan angka untuk
membedakan antara bakteri satu dengan bakteri yang lainnya. Isolat bakteri
di uji indeks selulolitik secara kualitatif berdasarkan zona jernih yang
terbentuk dengan metode titik. Hasil dari uji indeks selulolitik dilakukan
analisis ragam dan dilanjutkan dengan uji BNT (Beda Nyata Terkecil)
dengan taraf 5% untuk menentukan isolat bakteri yang memiliki aktivitas
enzim selulase terbaik. Tiga isolat bakteri yang memiliki indeks selulolitik
tertinggi di uji aktivitas enzimnya. Uji aktivitas enzim selulolitik isolat
bakteri disusun dengan Rancangan Acak Kelompok Lengkap (RAKL)
dengan 3 ulangan sebagai kelompok. Untuk menentukan perbedaan aktifitas
enzim selulase, dilakukan dengan Rancangan Perlakuan Faktorial 3 x 4, yaitu
jenis isolat bakteri (Oc14, Oc15 dan Oi30) dan suhu inkubasi (suhu 35°C,
40°C, 45°C dan 50°C). Aktivitas selulase ditentukan berdasarkan kadar
glukosa yang terbentuk dengan CMC (Carboxy Methyl Cellulose) sebagai
19
absorbansinya dibaca dengan menggunakan spektrofotometer pada panjang
gelombang 540 nm (Hafnirsa, 2007).
D. Analisis Data
Data aktivitas enzim selulase yang diperoleh diolah menggunakan Analisis
Ragam (Anara) dan dilanjutkan dengan menggunakan BNT (Beda Nyata
Terkecil) dan Polinomial Ortogonal.
E. Cara Kerja
1. Peremajaan
Isolat (Oi27, Oi30, Ki2, Oc14, Oc15) bakteri dari usus itik koleksi
Sutrisna, Liman dan Ekowati (2012), diremajakan pada tabung reaksi
yang berisi media MRSAgarpadat miring, kemudian di inkubasi selama
48 jam di dalamanaerobic jarpada suhu kamar.
2. Karakterisasi Bakteri Selulolitik Secara Mikroskopik
Karakterisasi mikroskopik yang diamati meliputi bentuk sel, sifat bakteri
Gram dan ada tidaknya spora (Salle, 1974).
3. Uji Katalase
Uji katalase, masing-masing isolat bakteri umur 48 jam di ambil satu ose
dan diletakkan di atasobject glassyang telah diberi dua ose akuades,
menandakan bahwa bakteri bersifat katalase positif (Hastowo dan Lay,
1994).
4. Uji Motilitas
Uji motilitas, masing-masing isolat bakteri umur 48 jam di ambil satu
ose dan di tusukkan secara lurus atau vertikal pada media NA (Nutrien
Agar) padat yang telah disiapkan pada tabung reaksi, kemudian
diinkubasi pada suhu kamar selama 48 jam dalamanaerobic jar.
Dikatakan motil jika pertumbuhan koloni bakteri menyebar, sedangkan
nonmotil jika pertumbuhan koloni bakteri tidak menyebar.
5. Uji Gelatin
Uji gelatin, masing-masing isolat bakteri umur 48 jam di ambil satu ose
dan diinokulasikan pada medium nutrien gelatin yang telah disiapkan
pada tabung reaksi, kemudian diinkubasi pada suhu kamar selama 48
jam dalam anaerobic jar. Kemudian kultur diletakkan pada pendingin
dengan suhu 4°C selama 30 menit. Indikator pengamatan reaksi positif
jika medium gelatin tetap menjadi cair, dan negatif jika medium gelatin
menjadi padat (Lay, 1994).
6 Uji Fermentasi Gula
Uji fermentasi gula, masing-masing isolat bakteri umur 48 jam di ambil
satu ose dan diinokulasikan pada media uji (glukosa, galaktosa, laktosa
21
diinkubasi pada suhu kamar selama 48 jam dalamanaerobic jar.
Setelah waktu inkubasi selesai, diamati perubahan warna pada media
dan terbentuknya gelembung udara pada tabung durham. Perubahan
warna media menjadi kuning menunjukkan adanya fermentasi
sedangkan terbentuknya gelembung udara pada tabung Durham
menunjukkan bahwa bakteri menghasilkan gas pada proses
metabolismenya.
7. Uji Selulolitik Kualitatif
Uji selulolitik kualitatif, masing-masing isolat bakteri umur 48 jam di
ambil satu ose dan diinokulasikan pada media MRSAgar+ CMC 1%.
Kemudian isolat bakteri dititikkan pada permukaan media, lalu
diinkubasi selama 48 jam pada suhu kamar. Koloni yang telah tumbuh
kemudian ditetesi dengan indikatorcongo red0,1 %, didiamkan selama
10 menit, kemudian dibilas dengan NaCl 1%. Zona bening yang
terbentuk di sekitar bakteri mengindikasikan adanya aktivitas enzim
selulase. Kemudian indeks selulolitik dapat diukur dengan cara
membandingkan antara diameter zona bening dengan diameter koloni
yang terbentuk (Nurkanto, 2007).
8. Pembuatan Suspensi Isolat Bakteri
Isolat bakteri selulolitik yang sudah diremajakan pada media MRS Agar
yang berisi 50 ml media MRS Broth+ CMC 1%, kemudian diinkubasi
selama 48 jam di dalamanaerobic jarpada suhu kamar.
9. Produksi Enzim Selulase
Stater bakteri selulolitik diinokulasikan sebanyak 10% ke dalam 50 ml
media MRSBroth+ CMC 1%. Lalu diinkubasi padaanaerobic jar
selama 48 jam pada suhu kamar (Martien, 2000).
10. Penyiapan Enzim Selulase Kasar
Kultur bakteri yang telah tumbuh selama 48 jam tersebut dikocok
denganwater bath shakeryang didinginkan dengan es (suhu± 10°C)
pada kecepatan 120 rpm selama 2 jam. Setelah itu disentrifugasi dengan
kecepatan 4000 rpm selama 10 menit, selanjutnya supernatan (filtrate
enzim) yang didapat dianalisi aktivitas enzim (Yani dan Djajasukma,
1991; Saskiawan dan Sastraatmadja, 1991).
11. Penentuan Aktivasi Enzim Selulase
Penentuan aktivitas enzim selulase dilakukan berdasarkan kadar glukosa
yang dihasilkan. Kadar glukosa di ukur dengan menggunakan metode
DNS (Miller, 1995). Supernatan diambil sebanyak 0,5 ml, lalu
diencerkan dengan menggunakan buffer sitrat pH 6,0 sebanyak 2 ml.
Kemudian dihomogenkan dan diambil larutannya sebanyak 0,75 ml,
dicampurkan dengan CMC 0,5% dalam buffer sitrat sebanyak 0,75 ml
23
sedangkan campuran enzim dan larutan CMC 0,5% yang langsung
dipanaskan tanpa diinkubasi selama 30 menit yang digunakan sebagai
kontrol, ke dalam campuran tersebut ditambahkan 1,5 ml
3,5-dinitrosaliclic acid. Dihomogenkan dan dipanaskan dengan air
mendidih selama 15 menit. Kemudian didinginkan dengan air dingin
selama 20 menit selanjutnya diukur absorbansinya dengan menggunakan
spektrofotometer dengan panjang gelombang 540 nm. Absorbansi yang
diperoleh digunakan untuk menentukan kadar gula dengan rumus
persamaan regresi linier Y = a + bx. a dan b diperoleh dari perhitungan
gula standar, Y merupakan nilai absorbansi pada panjang gelombang
540 nm dan x adalah kadar glukosa yang dihasilan. Satu unit dari
aktivitas selulase diartikan sebagai jumlah dari enzim yang melepaskan
µmol glukosa dalam satu menit pada kondisi pengujian.
Penentuan aktivitas enzim selulase per unit dapat ditentukan dengan rumus:
Aktivitas enzim =
( )
Keterangan:
Faktor pengenceran : 5 kali
Berat molekul glukosa : 180 gr/mol
Waktu inkubasi : 30 menit
Aktivitas enzim pun dapat dikonversikan ke dalam satuan nkat. 1 unit =
jumlah dari enzim yang melepaskan nmol glukosa dalam satu detik pada
kondisi pengujian.
12. Pembuatan Kurva Standar Glukosa
Larutan standar yang digunakan adalah glukosa dengan interval
konsentrasi 0-200 µg yaitu 0 µg, 25 µg, 50 µg, 75 µg, 100 µg, 125 µg,
150 µg, 175 µg, 200 µg masing-masing larutan diambil sebanyak 0,75
ml, ditambahkan 0,75 ml larutan buffer sitrat CMC 0,5% sebagai
substrat dan 1,5 ml larutan DNS sebagai pereaksi. Kemudian
dihomogenkan, lalu dipanaskan dalam air mendidih selama 15 menit.
Selanjutnya didinginkan dalam air dingin selama 20 menit. Pengukuran
absorbansi dilakukan dengan menggunakan spektrofotometer dengan
25
F. Prosedur Kerja
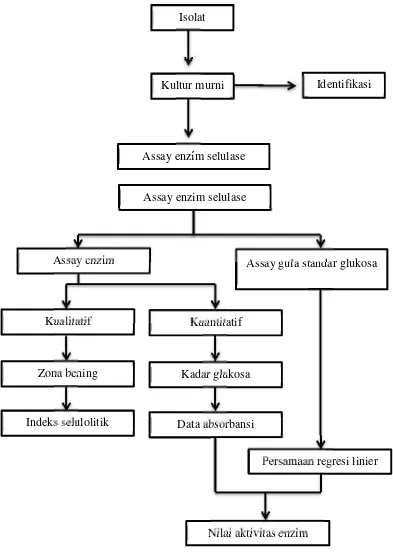
[image:42.595.118.511.153.707.2]Diagram alir penelitian adalah sebagai berikut.
Gambar 3. Diagram alir penelitian
Isolat
Kultur murni Identifikasi
Assay enzim selulase
Assay enzim selulase
Assay enzim Assay gula standar glukosa
Kualitatif Kuantitatif
Zona bening Kadar glukosa
Indeks selulolitik Data absorbansi
Persamaan regresi linier
A. Simpulan
Berdasarkan hasil penelitian maka dapat disimpulkan.
1. Kelima isolat bakteri dari usus itik mempunyai kemampuan menguraikan
selulosa dan berasal dari genusLactobacillus.
2. Isolat bakteri Oc15 memiliki aktivitas enzim selulase tertinggi pada suhu
inkubasi 45°C, sedangkan terendah pada suhu inkubasi 50°C.
3. Isolat bakteri Oc14 dan Oi30 memiliki aktivitas enzim selulase tertinggi
pada suhu inkubasi 35°C, sedangkan suhu terendah pada suhu inkubasi
50°C.
4. Isolat bakteri Oc15 memiliki aktivitas enzim selulase tertinggi.
B. Saran
Berdasarkan penelitian yang telah dilakukan maka dapat disarankan bahwa
isolat bakteri Oc15 dapat dijadikan sabagai probiotik untuk pakan tambahan
ransum itik, karena aktivitas enzim selulasenya masih dapat bekerja dengan
38
DAFTAR PUSTAKA
Ammirroenas, D.E. 1990. Mutu ransum berbentuk pellet dengan bahan serat biomassa pod cokelat (Theobroma cacaoL) untuk pertumbuhan sapi perah jantan (Tesis). Fakultas Pascasarjana Institut Pertanian Bogor. Bogor. 121 hlm.
Ardiansyah. 2010. Sehat dengan Mengkonsumsi Bekatul. Suara Pembaruan 23 Agustus 2010.
Artiyani, A. 2011. Bioetanol Dari Limbah Kulit Singkong Melali Proses Hidrolisis dan Fermentasi denganSaccharomyces cerevisiae. ITS. Surabaya.
Atlas, R. M. dan R. Barta. 1998. Microbial ecology: Fundamental and Aplications. Menlo Park.: Benjamin/Summings Science Publishing.
Austin, B. 1988. Metode-metode untuk Bakteriologi Akuatik(terjemahan Ratna Hadioetomo). PAU IPB. Bogor. p: 125-133.
Busto MD, Ortega N, Perez-Mateos M. 1995. Induction of β–glukosidase in
fungal and soil bacterial cultures. Soil Biol Biochem27:949-954.
Campbell, Neil A., Jane B. dan Reece. 2002. Biologi I, Edisi Kelima Jilid I. Erlangga. Jakarta.
Chou LS, Weimer B. 1999. Isolation and characterization of acid and bile tolerant isolates from strains ofLactobacillus acidophilus. Journal Dairy Science. 62:23-31.
Dybker, R. 2001. Unit “Katal” for Catalytic Activity (IUPAC Technical Support). Pure Appl. Chem. 73:927-931.
Ernawati. 2008. Prosedur Pemeriksaan Bakteri Lab. Bakteriologi Balai Karantina Ikan Kelas I. Sultan Mahmud Bdarudin II.
Fuller, R. 1991. Probiotic The Scientific Basis. Chapman and Hall. London. P:1-8
Fuller R. 1992. History and development of probiotics. In:ProbioticThe Scientific BasisR. Fuller (ed). Chapman and Hall, London. P:1-8
Girindra, A. 1992. Biokimia I. PT Gramedia Pustaka. Jakarta.
Gong, C.S dan G.T Tsao. 1979. Cellulase and Biosynthesis Regulation. Di dalam D. Perlman [ed] Annual Report of Fermentation process. Academic Press. New York.
Gunawan dan M. M. S. Sundari. 2003. Pengaruh Penggunaan Probiotik dalam Ransum Terhadap Produktivitas Ayam (Jurnal). IPB. Bogor.
Khabbah, N. 2007. Penetuan Kondisi Optimum Aktivitas Selulase Hasil IsolatL. collinoides(Skripsi). FMIPA Universitas Brawijaya. Malang.
Hadioetomo, R. S. 1993. Mikrobiologi Dasar Dalam Praktek. Gramedia. Jakarta.
Hafnirsa. 2007. Uji Aktifitas Enzim Selulase dari Isolat Mikrofungi Saprofit Perkebunan Kopi Sumberjaya, Lampung Barat(Skripsi). Universitas Lampung. Bandar Lampung.
Hastowo, S dan B. W. Lay. 1994. Analisis Mikrobia di Laboratorium. PT. Rajawali Press. Jakarta. p: 167-169.
Holt, J.G., N.R. Kreig, P.H.A. Sneath, J.T. Staley, & S.T. Williams. 2000. Bergey’s Manual ofDetermina tive Bacteriology. Ninth Edition. Lippincott Williams and Wilkins, Philadelphia. 787 pages.
Ibrahim, A. S. S & El-diwany AI. 2007. Isolation and identification of new cellulases producing thermophilic bacteria from an Egyptian hot spring and some properties of the crude enzyme. J Appl Sci1:473-478.
Irawadi, T. T. 1990. Selulase. IPB PAU Bioteknologi. Bogor.
Lay,B. W. 1994. Analisis Mikroba di Laboratorium. PT Raja Grafindo Persada. Jakarta : 168 hlm.
40
Linko, M. 1975. An Evaluation of Enzymatic Hydrolysis of Cellulosic Materials. Technical Research Centre of Finland. Biotechnical Laboratory. Helsinki. Finland. p: 27-45.
Lynd LR, Weimer PJ, Zyl WH, Pretorius I. 2002. Microbiol cellulose utilization: fundamentals and biotechnology. Microbiol Mol Biol Rev66:506-793.
Madigan, M.T dan J.M. Martinko. 1997. Brock; Biology of Microorganisms. 8th edition. Pearson Prentice Hall. USA.
Madigan, M.T., J.M.Martinko dan J. Parker. 2000. Biology of Microorganisms. 9th edition. Prentice Hall International, Inc. New Jersey.
Martien, R. 2000. Isolasi dan identifikasi Bakteri Selulolitik serta
Kemampuannnya dalam Memproduksi Enzim Selulase dengan Waktu Inkubasi yang Berbeda dari Hutan Mangrove Tegakan Rhizophora sp. di Desa Kemujan, Karimunjawa(Skripsi). Jurusan Biologi FMIPA Undip. Semarang.
Martoharsono, S. 1993. Biokimia. Cetakan ke-14. UGM Press. Yogyakarta.
Martin, A. 1977. Intoduction of Soil Microbiology. 2ndEdition. John Wiley & Sons. USA.
Martin R. G. 1995. Using yeast culture and lactic acid bacteria in broiler breeder diets. In:Biotechnology in The feed industry. TP. Lyons & KA
Jacques (Eds). Proc. Alltech s Eleventh Annual Symp. pp. 371-378.
Meryandini, Anja, Wahyu Widosari, Besty Maranatha, Titi Candra Sunarti, Nisa Rachmania dan Hasrul. 2009. Isolasi Bakteri Selulolitik dan
Karakterisasi Enzimnya (Jurnal). IPB. Bogor.
Miller, G. L. 1959. Use of Dinitrosalicylacid Reagen for Determination of Reducing Sugar. Anal Chemistry; 426-428.
Moat, A. G. & Foster J. W. 1988. Microbial Physiology 2nd Ed. John Wiley and Sons. New York.
Mujiasih. 2001. Performan ayam broiler yang diberi antibiotik zinc bacitracin, probioticBacillussp. Dan berbagai levelSaccharomyces
cerevisiaedalam ransumnya (Skripsi). Fakultas peternakan Institut Pertanian Bogor. Bogor.
Nurkanto, Arif. 2007. Identifikasi Aktinomistes Tanah Hutan Pasca Kebakaran Bukit Bangkirai Kalimantan Timur dan Potensinya Sebagai
Pendegradasi Selulosa dan Pelarut Posfat. Pusat Biologi (LIPI).
Ogimoto, K. dan S. Imai. 1981. Atlas of Rumen Microbiology. Japan Scientific Societies Press. Tokyo.
Oluyemi, J. A. dan F. A. Roberts. 1979. Poultry Production in Warm Wet Climates. The MacMillan Press. Hongkong.
Pelczar, M. J., Chzn, E.C.S.and Krieg, N.R. 1993. Microbiology Concept and Applications. International edition. Micraw-Hill, Inc. United State of America, 947 pages.
Pelczar, M. J., Jr dan E. C. S. Chan. 2008. Dasar-Dasar Mikrobiologi. Universitas Indonesia Press. Jakarta.
Rahayu, W. P.. 1990. Teknologi Fermentasi Umbi-umbian dan
Biji-bijian. Depdikbud. IPB. Bogor.
Raza AM, Shafiq-Ur-Rehman. 2008. Production and characterization of endo-β-1,4-glukanase from thermofilic fungus. J Biotechnol8: 3297-3302.
Rodwell. 1985. Biokimia Harper. Edisi 20. Penerbit Buku EGC. Jakarta.
Roechyati, R. 1983. Kandungan kimia eceng gondok;Surabaya. Salamah, S. 2001. Pembuatan Karbon Aktif dari Tempurung Kelapa dengan Perlakuan Karbonat; Prosiding SeminarNasional “Kejuangan” Teknik
Kimia, Yogyakarta; Yogyakarta.
Salle, A. J. 1974. Fundamental Principles of Bacteriology. 7thEdition. Tata McGraw-Hill Publishing Company Limited. New Delhi. p: 807-809.
Salma dan Gunarto. 1999. Enzim Selulase Dari Trichoderma spp. Jurnal Mikrobiologi Indonesia. Vol. 2, No.2.
Salminen S, A. Ouwehand, Y. Benno, Y. K. Lee. 1999. Probiotic: how should they be defined. Trends food Sci techol10:107-110
Sari, R. 2012. Karakterisasi Bakteri Probiotik yang Berasal dari Saluran Pencernaan Ayam Pedaging (Skripsi). Universitas Hasanuddin. Makassar.
42
Saskiawan, I dan Sastraatmadja. 1991. Produksi Enzim Selulase Biak-Biak Aspergillus sp. pada Medium Campuran Serbuk Gergaji dan Dedak. Prosiding Hasil Penelitian Litbang SDH. LIPI. Bogor. p: 199-203.
Schlecel, Hans. G. dan Karin Schmidt. 1994. MikrobiologiUmum. Edisi Keenam. Gadjah Mada University Press. Yogyakarta.
Scott, M. L., M. C. Nesheim dan R. J. Young. 1982. Nutritions of The Chicken. Second Ed. M. L. Scoot and Associates Ithaca. New York.
Seifert, H. S. H & F Gessler. 1997. Continous oral application of probiotic B.cereusan alternative to prevention of enteroxamia. Anim Res and Dev. 46: 30-38.
Shabib, N. 1992. Pemahaman Seluk Beluk Biokimia dan Penerapan Enzim. PT. Citra Adutya Bakti. Bandung. p:89.
Shinmada K, Karita S, Sakka K, Ohmiya K. 1994. Cellulase, Xylanase, and Their Genes from Bacteria. Marcel Dekker Inc. New York.
Sjofjan, O. 2007. Isolasi dan IdentifikasiBacillusspp. Dari Usus Ayam Petelur Sebagai Sumber Probiotik (Jurnal). Universitas Brawijaya. Malang.
Suharto. 1999. Pengolahan BekicotUntuk Pakan Ternak. Balai Penelitian Ternak. Bogor.
Sumardi, Cristina Nugroho Ekowati dan Dwi Haryani. 2010. IsolasiBacillus Penghasil Selulase dari Saluran Pencernaan Ayam Kampung (Jurnal). Universitas Lampung. Bandar Lampung.
Surono, I. S. 2004. Probiotik Susu Feremntasi dan Kesehatan. Tri Cipta Karya. Jakarta.
Susilowati, D. N., Rosmimik, Saraswati R., Simanungkalit R. D. M. dan Gunarto L. 2008. Koleksi, Karakterisasi, dan Preservasi Mikroba Penyubur Tanah dan Perombah Bahan Organik. Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian.
www.indobiogen.or.id/terbitan/pdf/warta_23_desember_2003.pdf
Sutiamiharja, N. 2008. Isolasi Bakteri dan Uji Aktivitas Amilase kasar
Termofilik dari Sumber Air Panas Gurukinayan Karo Sumatera Utara. USU Repository. Sumatera Utara.
Sutrisna, R., Liman, dan CN Ekowati. 2012. Pola Simbiotik Non-starch Polysaccharidese Limbah Agroindustri dan Campuran Bakteri
Volk, W.A. dan M. F. Wheeler, 1993. Mikrobiologi Dasarjilid I hal. 184-185. Erlangga. Jakarta. 396 hlm.
Weimer P.J.et.al. 1999. Effect of Diet on Population of Three Species of Ruminal Cellulolytic Bacteria in Lactating Dairy Cows. Journal of Dairy Science. Vol. 82.
Whither, S.G. dan R. Aebersold. 1995. Approaches to Labelling and Identification of Active Site Residues in Glucosidases. Jurnal of Protein Science4: 361-372.
Winarno, F. G.. 1986. Enzim Pangan. Cetakan Kedua. PT. Gramedia. Jakarta.
Yani, A. I. dan E. Djajasukma. 1991. Produksi Enzim Selulase dari Sepuluh Biak Kapang Aspergillus pada Media Singkong. Prosiding Hasil Penelitian Litbang SDH. LIPI. Bogor. p: 195-198.
Yuwanta, T., Zuprizal, Endang Sutriswati Rahayu dan Rudy Sutrisno. 2003. Konstribusi Pencernaan Fermentasi Itik yang Menggunakan Limbah Industri Pertanian Sebagai Sumber Serat Kasar Dalam Ransum (Karya Ilmiah Hasil Penelitian). Lembaga Penelitian UGM. Yogyakarta.
Zey, A.. 1996. Pengaruh Beberapa Ion Logam, pH dan Temperatur Terhadap Aktivitas Enzim D-glukosa Oksidase. Majalah BPPT: Kajian