DAFTAR PUSTAKA
Abro, S., Pouilloux, Y. & Barrault, J. 1997. Selective synthesis of monoglycerides from glycerol and oleic acid in the presence of solid catalysts. Stud. Surf. Sci. Catal. 108: 539-546.
Allen, R., Marvin,W., Krishnamurthy.,R.,1982. Bailey’s Industrial Oil And Fat. Fourth Edition. New York : John Wiley and Sons .
Awang, R., Ahmad, S., Grazmah, G., 2001. Properties Of Sodium Soap Derived From Palm-Based Dihidroxystrearic Acid, Journal of Oil Palm Research, Vol 13.33, Malaysia
Awang,R., Ahmad,S., Ibrahim,M., Yunus,W., 2004 .Synthesis Of Monoglycerides From Dihidroxystearic Acid:Effect Of ReactionParameters. Malaysia : Journal Of Chemistry.Vol 6.No.1. 13-19
Bangun, N., Manullang, W., Panggabean, L., Sembiring, S. B., Simangunsong, R., Bali, P., Panjaitan, F., 2015. Performance of Tetraphenylsulfonato
Disilane in Catalttic Transesterification of Crude Palm Oil and Esterification of Fatty Acids with Secondary Alcohols. Procedia Chemistry, 14 : 295 – 300
Basumatary, S. 2013. Transesterification with Heterogenous Catalyst in Production of Biodiesel : A Review. Journal of Chemical and Pharmaceutical Research. 5(1):1-7.
Bossaert, W.D., De Vos, D.E., Van Rhijn, W.M., Bullen, J., Grobet, P.J. & Jacobs, P.A. 1999. Mesoporous sulfonic acids as selective heterogeneous catalysts for the synthesis of monoglycerides. J. Catal. 182: 156-164.
Bonnardeaux, J., 2006. Glycerin Overview.Department Of Agriculture and Food. Australia.
Endalew, A. 2011. Inorganic Heterogenous Catalyst for Biodiesel Production From Vegetable Oils.Biomass And Bioenergy;35;3787-3809Fang Lin, 2013. Carbon-coated Mesoporous Silica Functionalized With Sulfonic Acid Groups and its Application to Acetalization.Dalian Institute of Chemical Physics, Chinese Academy of Sciences. Published by Elsevier B.V.;34:932-941
Ferretti, C. 2007. Monoglyceride synthesis by glycerolysis of methyl oleate on MgO: Catalytic and DFT study of the active site , Ind. Eng. Chem. Res. 48
Gates, B. 1991. Catalytic Chemistry. USA. John Wiley & Sons
Guan, G., K. Kusakabe, N. Sakurai, dan K. Moriyama. 2009. Transesterification of Vegetable Oil to Biodisel Fuel Using Acid Catalyst in the presence of Dimehyl Ether. Volume 88.
Guner, F.S., Sirkecioglu, A., Ydmaz, S., Erciyes, A.T. & Erdem-Senatalar, A. 1996. Esterification of oleic acid with glycerol in the presence of sulfated iron oxide catalyst. Journal of American Oil Chemist’s Society 73(3): 347-351.
Gunstone, F.D. 2004. The Chemistry of Oils and Fats. Australia: Blackwell Publishing Company Ltd.
Heykants, E., Verrelst, W.H., Parton, R.F. & Jacobs, P.A. 1997. Shape-selective zeolite catalysed synthesis of monoglycerides by esterification of fatty acids with glycerol. Stud. Surf. Sci. Catal. 105: 1277-1284.
Helwani, Z. 2009. Solid Heterogenous Catalysts for Transesterification of Trigliserides With Methanol: A Review. Appl Catal A:363:1-10
Kang, S. 2013. Recent Advances in Carbon-Based Sulfonated Catalyst : Preparation and Application. International Review of Chemical Engineering. Vol 5, N.2; 133-144
Kaewthong W, (2005), “Continuous Production of Monoacylglycerols by Glycerolysis of Palm Olein with Immobilized Lipase”, Journal of Process Biochemistry, Elsevier, vol 40 hal 1525 1530.
Ketaren, S. 1986. Pengantar Tehknologi Minyak dan Lemak Pangan. Cetakan Pertama. Jakarta. Universitas Indonesia Press.
Kimmel T., (2004), “Kinetic Investigation of The Base-Catalyzed Glyserolysis of Fatty Acid Methyl Ester”, Genehmigte Dissertation. Technischen Universitat Berlin, Berlin
Lawson.H.,1985. Standards For Fat And Oil. Wesport : The Avi Publishing Company.Inc
Leach, B. E. 1983. Applied Industrial Catalysist. Volume 2. New York. Academic Press
Mostafa, N.A, Maher, A, Abdelmoez, W. 2013. Production of mono-, di-, and triglycerides from Waste Fatty Acids through Esterification with Glycerol. Advances in Bioscience and Biotechnology, 4: 900 - 907
Noureddini H. Medikonduru, (1997), “Glycerolysis of Fats and Methyl Esters”, Journal of Biomaterials, University of Nebraska, Lincoln
Otera, J. 2013. Esterification: Methods, Reaction and application. Weinheim. Wiley- VCH Verlag GmbH & Co.KgaA.
Shriver, D. & Atkins, P. 1999. Inorganic Chemistry. Third Edition. New York. Oxford University Press.
Sleight, H. W. 1983. Catalyst Design And Section, Applied, Industry Catalyst. New York : Academic press.
Suhardjo dan Kusharto, C.M. 1992. Prinsip-Prinsip Ilmu Gizi. Yogyakarta: Penerbit Kanisius
Voort, P., Muylaert, I., Verbeckmoes, A., Spileers, J., Demuynck, A., Peng, Li, Clippel, F., Sels, B. 2013.Synthesis of Sulfonated Mesoporous Phenolic Resins and Their Application in Esterification and Asymmetric Aldol Reactions.Material Chemistry and Physics.138 (2013) 131-139.
Wang, Z., Wang, Z., Bai, Y., Fu, B., Liu, H., Song, A., Zhang, Z., Zhang, M. 2012. Sulfonated Polyethersulfone Directly Sinthesized Through Sulfonic Monomer As A New Stable Solid Acid Catalyst for Esterification.Catalyst Communications. 27 (2012) 164-168.
Watanabe, T., Shimizu, M., Sugiura, M., Sato, M., Kohori, J., Yamada, N., Nakanishi, K., 2003. Optimization of reaction conditions for the production of DAG using immobilized
BAB 3
METODE PENELITIAN
3.1. Alat
- Spektrofotometer FT-IR Shimadzu
- Kromatografi Gas
- Corong Pisah 250 ml Pyrex
- Neraca Analitis Mettler
- Hotplate Stirrer Cimarec
- Pengaduk Magnet
- Termo Control
- Pompa Vakum (Vacuum Pump)
- Labu Erlenmeyer 250 ml Pyrex
- Termometer 3600C Boeco
- Gelas Beaker 100 ml Pyrex
- Gelas Ukur 25 ml Pyrex
3.2. Bahan
- Asam Oleat 93% PT Wilmart
- Normal Heksan Bratachem
- Gliserol PT Baristan
- 1,2-dimetil-1,1,2,2-tetrafenildisilane p.a Marck
- Dichloromethane p.a Merck
3.3 Prosedur Penelitian
3.3.1. Reaksi Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 2 : 1 Reaksi Esterifikasi dilakukan dalam autoclave satinless steel dengan mencampurkan
3,04 gram asam oleat, 1 gram gliserol,0,1 gram katalis
1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana dengan pelarut n-heksana dan dimasukkan pengaduk
magnet. Reaksi berlangsung pada suhu 120oC selama 10 jam sambil diaduk. Setelah 10 jam reaksi, campuran hasil reaksi diekstraksi dengan n-heksan dan akuades. Fraksi
yang larut dalam akuades dicuci berulang – ulang dengan n-heksan, dikeringkan dan
divakum. Fraksi yang larut dalam n-heksan dikeringkan lalu divakum. Produk
berupa cairan kuning kecoklatan kemudian ditimbang. Kemudian dikarakterisasi
3.3.2. Reaksi Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 1 : 1 Reaksi Esterifikasi dilakukan dalam autoclave satinless steel dengan mencampurkan
6,09 gram asam oleat, 1 gram gliserol, 0,1 gram katalis
1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana dengan pelarut n-heksana dan dimasukkan pengaduk
magnet. Reaksi berlangsung pada suhu 140oC selama 10 jam sambil diaduk. Setelah 10 jam reaksi, campuran hasil reaksi diekstraksi dengan n-heksan dan akuades. Fraksi
yang larut dalam akuades dicuci berulang – ulang dengan n-heksan, dikeringkan dan
divakum. Fraksi yang larut dalam n-heksan dikeringkan lalu divakum. Produk
berupa cairan kuning kecoklatan lalu ditimbang. Kemudian dikarakterisasi dengan
FT-IR dan Kromatografi Gas. Hal yang sama dilakukan untuk reaksi esterifikasi asam
3.4. Bagan Penelitian
3.4.1. Reaksi Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 2 : 1
6,09 gram Asam Oleat
dimasukkan kedalam autoclave stainless steel
ditambahkan 1 gram gliserol dan 0,1 gram katalis 1,2-dimetil-1,1,2,2 tetrafenilsulfonatodisilana
dimasukkan magnetic bar
dipanaskan pada suhu 140oC selama 10 jam sambil diaduk dan divakum
Campuran Hasil Reaksi
ditambahkan n-heksan
fraksi n-heksan fraksi
akuades
dikeringkan
divakum
ditimbang
hasil dianalisa dengan GC, FT-IR
dicuci dengan n-heksan berulang-ulang dikeringkan
divakum
katalis ditambahkan akuades
3.4.2. Reaksi Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 1 : 1
3.04 gram Asam Oleat
dimasukkan kedalam autoclave stainless steel ditambahkan 1 gram gliserol dan 0,1 gram katalis 1,2-dimetil-1,1,2,2 tetrafenilsulfonatodisilana
dimasukkan magnetic bar
dipanaskan pada suhu 120oC selama 10 jam sambil diaduk dan divakum
Campuran Hasil Reaksi
ditambahkan n-heksan
fraksi n-heksan fraksi akuades dikeringkan
divakum ditimbang
hasil dianalisa dengan GC, FT-IR
dicuci dengan n-heksan berulang-ulang dikeringkan divakum
katalis ditambahkan akuades
diekstraksi
Catatan : Dilakukan prosedur yang sama untuk perbandingan asam oleat dengan
BAB 4
HASIL DAN PEMBAHASAN
Penelitian ini dilakukan untuk membuat monooleilgliserol dan dioleilgliserol
dari reaksi antara asam oleat dengan gliserol dalam pelarut n-heksana menggunakan
katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana (DMTFS). Perbandingan asam
oleat dengan gliserol dibuat tiga macam yaitu, 2 : 1, 1 : 1, 1 : 2. Hasil reaksi
esterifikasi pada perbandingan 1 : 1, yang paling banyak terbentuk adalah digliserida
sedangkan monogliserida masih sedikit, hal ini disebabkan gugus OH pada posisi 1
dan 3 pada gliserol adalah sama sifatnya. Dengan mengurangi konsentrasi asam oleat
dapat meningkatkan kadar monogliserida. Sehingga dilakukan reaksi esterifikasi
dengan perbandingan asam oleat dengan gliserol yaitu 1 : 2. Dibawah ini akan
diuraikan pembuatan dioleilgliserol dan monooleilgliserol.
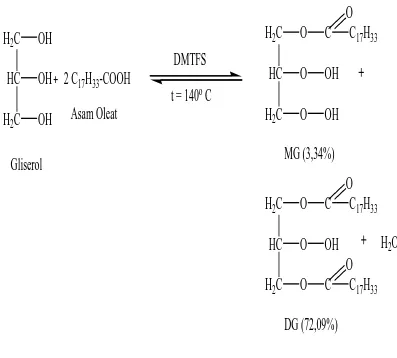
4.1. Pembuatan Dioleilgliserol Perbandingan Mol Asam Oleat : Gliserol 2 : 1
Reaksi esterifikasi antara asam oleat dengan gliserol dalam pelarut n-heksana dengan
perbandingan mol asam oleat : gliserol yaitu 2 : 1 yang berlangsung pada suhu
140oC selama 10 jam dengan menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) menghasilkan campuran monogliserida dan
Persamaan reaksi esterifikasi ditunjukkan pada Gambar 4.1.
H
2C
HC
H
2C
OH
OH
OH
2 C
17H
33-COOH
Gliserol
Asam Oleat
DMTFS
t = 140
oC
H
2C
HC
H
2C
O
O
O
C
OH
OH
C
17H
33MG (3,34%)
O
H
2C
HC
H
2C
O
O
O
C
OH
C
O
C
17H
33C
17H
33DG (72,09%)
O
H
2O
Gambar 4.1. Reaksi esterifikasi asam oleat dengan gliserol perbandingan 2 : 1 membentuk campuran monogliserida dan digliserida
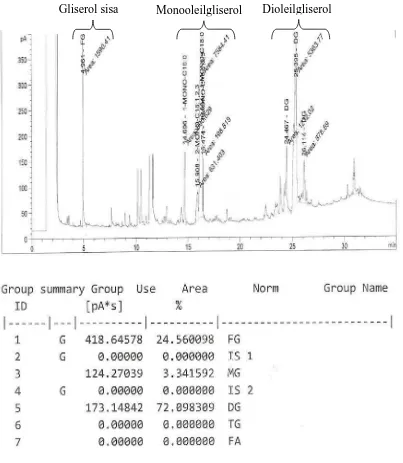
Kromatogram produk reaksi esterifikasi asam oleat dengan gliserol dengan
perbandingan mol 2 : 1 dapat dilihat pada gambar 4.2.
Dari kromatogram produk reaksi esterifikasi asam oleat dengan gliserol pada
terbentuk dioleilgliserol sebanyak 72.09 % dan hasil sampingnya monooleilgliserol
sebanyak 3.34 % dan trigliserida tidak terbentuk.
Gambar 4.2. Kromatogram produk esterifikasi asam oleat dengan gliserol pada suhu 140oC perbandingan mol 2 : 1
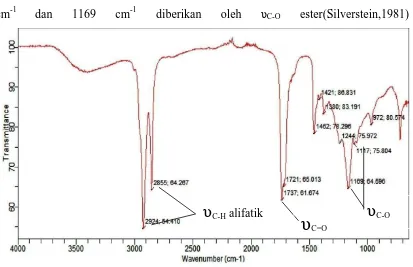
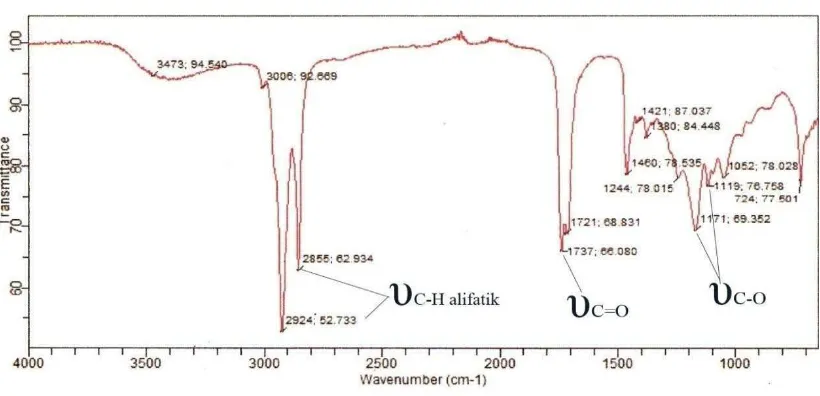
Spektrum FT-IR dari produk esterifikasi ditunjukkan pada Gambar 4.3. Pita serapan
pada bilangan gelombang 2924 cm-1 dan 2855 cm-1 diberikan oleh υC-H alifatik dari
rantai oleat, υC=O dari karbonil asam karboksilat pada bilangan gelombang 1721 cm-1
dan pita serapan pada bilangan gelombang 1737 cm-1 menunjukkan regangan υC=O
dari ester. Ini menunjukkan bahwa ester telah terbentuk. Pita serapan ini bergeser
sebesar 28 cm-1 dari 1079 cm-1 pada asam oleat (Lampiran 1) menjadi 1737 cm-1 pada ester dan didukung juga dengan pita serapan pada bilangan gelombang 1117
cm-1 dan 1169 cm-1 diberikan oleh υC-O ester(Silverstein,1981)
Gambar 4.3. Spektrum FT-IR produk esterifikasi asam oleat dengan gliserol pada suhu 140oC dengan perbandingan mol 2 : 1
4.2. Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 1 : 1
Pada reaksi esterifikasi asam oleat dengan gliserol perbandingan 2 : 1 pada suhu
140oC ternyata menghasilkan MG hanya 3.34 % dan DG 72.09 %. MG yang dihasilkan masih sangat kecil, ini mungkin disebabkan oleh suhu yang terlalu tinggi
dan jumlah asam oleat yang terlalu banyak. Oleh karena itu untuk menaikkan
υ
C=Oυ
C-Operolehan MG, maka pada reaksi esterifikasi asam oleat dengan gliserol diturunkan
suhunya menjadi 120oC dan perbandingan asam oleat : gliserol = 1 : 1. Reaksi esterifikasi antara asam oleat dengan gliserol dalam pelarut n-heksana dengan
perbandingan mol asam oleat : gliserol adalah 1 : 1 pada suhu 120oC selama 10 jam dengan menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana
(DMTFS) menghasilkan campuran monogliserida dan digliserida berupa cairan
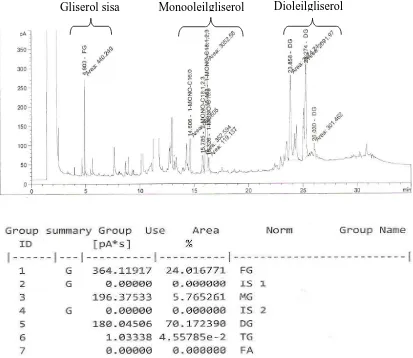
kental berwarna kuning. Kromatogram produk reaksi esterifikasi asam oleat dengan
gliserol dengan perbandingan mol 2 : 1 dapat dilihat pada gambar 4.4.
Gambar 4.4. Kromatogram produk esterifikasi asam oleat dengan gliserol pada suhu 120oC perbandingan mol 1 : 1
Dari kromatogram produk reaksi esterifikasi asam oleat dengan gliserol pada
suhu 120OC selama 10 jam dengan perbandingan 1 : 1 hanya dapat mengkonversi gliserol sebanyak 75.98 % dan 24.01 % masih belum bereaksi. Dari yang 75.98 %
gliserol yang terkonversi, terbentuk monooleilgliserol sebanyak 70.17 % dan
dioleilgliserol sebanyak 5.76 % dan trigliserida tidak terbentuk.
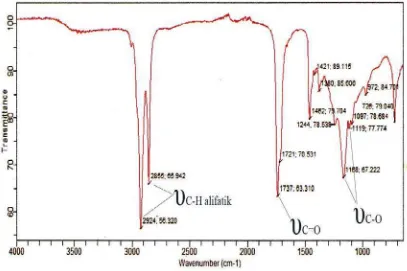
Spektrum FT-IR dari produk esterifikasi yang diperoleh ditunjukkan pada
Gambar 4.5. Pita serapan pada bilangan gelombang 2924 cm-1 dan 2855 cm-1 diberikan oleh υC-H alifatik dari asam oleat, υC=O dari karbonil asam karboksilat pada
bilangan gelombang 1721 cm-1 dan pita serapan pada bilangan gelombang 1737 cm-1 menunjukkan regangan υC=O dari ester. Ini menunjukkan bahwa ester telah terbentuk..
Pita serapan ini bergeser sebesar 28 cm-1 dari 1709 cm-1 pada asam oleat(Lampiran 1) menjadi 1737 cm-1 pada υC=O pada ester dan didukung juga dengan pita serapan pada
bilangan gelombang 1117 cm-1 dan 1169 cm-1 diberikan oleh υC-O ester (Silverstein,
1981).
Gambar 4.5. Spektrum FT-IR produk esterifikasi asam oleat dengan gliserol pada suhu 120oC perbandingan mol 1 : 1
Monogliserida yang diperoleh pada reaksi esterifikasi asam oleat dengan gliserol
pada rasio mol 1 : 1 masih sedikit yaitu 5.76 %, hal ini dikarenakan gugus OH posisi
Dengan mengurangi konsentrasi asam oleat dapat meningkatkan kadar monogliserida.
Sehingga dicoba untuk melakukan reaksi esterifikasi asam oleat dengan gliserol
dengan rasio mol 1 : 2.
4.3. Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 1 : 2
Reaksi esterifikasi antara asam oleat dengan gliserol dalam pelarut n-heksana dengan
perbandingan mol asam oleat : gliserol yaitu 1 : 2 yang berlangsung pada suhu
120oC selama 10 jam dengan menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) menghasilkan campuran monogliserida dan
digliserida berupa cairan kental berwarna kuning. Kromatogram produk reaksi dapat
dilihat pada gambar 4.6
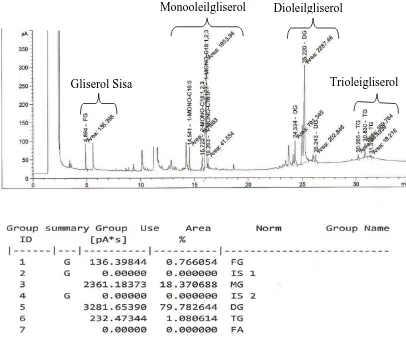
Gambar 4.6. Data kromatografi Gas campuran produk esterifikasi asam oleat dengan gliserol perbandingan mol 1 : 2
Gliserol Sisa
Monooleilgliserol Dioleilgliserol
Dari Kromatogram produk reaksi esterifikasi asam oleat dengan gliserol pada
suhu 120oC selama 10 jam dapat mengkonversikan 100 % gliserol. Dari 100 % yang terkonversi, monooleilgliserol yang terbentuk meningkat dari 5.76 % menjadi 18.37
% dan dioleilgliserol juga meningkat dari 70.17 % menjadi 79.78 %.
Spektrum FT-IR dari produk yang diperoleh ditunjukkan pada Gambar 4.7.
Pita serapan pada bilangan gelombang 2924 cm-1 dan 2855 cm-1 diberikan oleh υC-H
alifatik dari asam oleat, υC=O dari karbonil asam karboksilat pada bilangan
gelombang 1721 cm-1 dan pita serapan pada bilangan gelombang 1737 cm-1 menunjukkan regangan υC=O dari ester. Ini menunjukkan bahwa ester telah terbentuk..
Pita serapan ini bergeser sebesar 28 cm-1 dari 1709 cm-1 pada asam oleat(Lampiran 1) menjadi 1737 cm-1 υC=O pada ester dan didukung juga dengan pita serapan pada
bilangan gelombang 1117 cm-1 dan 1169 cm-1 diberikan oleh υC-O ester. (Silverstein,
1981).
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
- Reaksi esterifikasi antara asam oleat dengan gliserol dalam pelarut n-heksana
dengan perbandingan mol 2 : 1 dilakukan pada suhu 140oC selama 10 jam menggunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana(DMTFS)
menghasilkan monooleilgliserol sebesar 3.34 %, dioleilgliserol sebanyak
72.098 %, dengan perbandingan mol 1 : 1 dilakukan pada suhu 120oC selama 10 jam menghasilkan monooleilgliserol sebanyak 5.76 %, Dioleilgliserol
70.17 %, dengan perbandingan mol 1 : 2 dilakukan pada suhu 120oC selama 10 jam menghasilkan monooleilgliserol sebanyak 18.37 %, dioleilgliserol
sebanyak 79.78 %. Jelas terlihat bahwa dengan mengurangi konsentrasi asam
oleat dapat meningkatkan jumlah monogliserida yang terbentuk.
- Dari hasil reaksi esterifikasi asam oleat dengan gliserol, digliserida adalah
produk yang paling banyak terbentuk. Hal ini disebabkan Gugus OH pada
posisi 1 dan 3 memiliki sifat yang sama. Sehingga monogliserida yang
terbentuk menjadi sedikit.
5.2. Saran
Reaksi esterifikasi diduga dipengaruhi oleh waktu reaksi, oleh sebab itu diharapkan
kepada peneliti selanjutnya untuk melakukan reaksi ini dengan waktu reaksi yang
BAB 2
TINJAUAN PUSTAKA
2.1. Katalis
Katalis merupakan suatu senyawa yang dapat meningkatkan laju reaksi tetapi tidak terkonsumsi oleh reaksi. Katalis meningkatkan laju reaksi dengan energi aktivasi
Gibbs yang lebih rendah (Shriver. D, dkk, 1999). Katalis tidak mengubah posisi
keseimbangan. Katalis semata – mata menurunkan halangan energy aktivasi diantara
pereaksi dengan produk sehingga keseimbangan dapat dicapai lebih cepat
dibandingkan dengan tanpa katalis (Leach, 1983).
Katalis yang berada pada fase yang sama dengan reaktan disebut sebagai
katalis homogen. Sedangkan katalis yang berada pada fase yang berbeda dengan
reaktannya (dapat berupa padatan, cairan yang tidak daapat bercampur) disebut
katalis heterogen ( Helwani, 2009 ).
Suatu katalis biasanya bekerja dengan membentuk ikatan kimia ke satu atau
lebih pereaksi yang kemudian dapat memfasilitasi konversi dari pereaksi menjadi
produk. Katalis tidak mempengaruhi kesetimbangan reaksi. Penjelasan kimia dari
proses katalisis secara kualitatif mengambil bentuk berupa mekanisme reaksi (Gates,
2.1.1. Katalis Homogen
Katalis homogen terdiri atas dua jenis yaitu katalis asam homogen dan katalis basa
homogen. Katalis basa yang umum digunakan adalah KOH dan NaOH. Penggunaan
katalis ini menimbulkan masalah yaitu sulit dipisahkan dari hasil reaksi. Katalis
asam homogen yang sering digunakan adalah H2SO4, HCl dan H3PO4. Akan tetapi
penggunaan katalis ini memerlukan waktu reaksi yang lama, dapat menyebabkan
korosi pada reactor yang digunakan (Helwani, 2009).
Penggunaan katalis asam homogen seperti asam sulfat umumnya memerlukan
waktu reaksi yang lebih lama karena dilakukan pada suhu rendah. Katalis ini juga
cenderung sangat sulit untik dipisahkan. Dalam pengembangan kearah kimia hijau
telah membawa kemajuan terhadap perkembangan katalis asam fase padat, dimana
material ini dapat menggantikan cairan asam yang bersifat korosif yang banyak
digunakan dalam industri (Guan. G, dkk, 2009).
2.1.2 Katalis Heterogen
Katalis heterogen juga terdiri atas dua jenis yaitu katalis heterogen yang bersifat basa
dan katalis heterogen yang bersifat asam. Beberapa katalis heterogen telah disintesis
baik yang bersifat asam maupun basa. Katalis heterogen basa yang paling umum
digunakan adalah senyawa-senyawa oksida logam seperti oksida logam alkali dan
oksidaa logam alkali tanah seperti MgO, CaO, SrO dan BaO (Endalew, 2011).
Keuntungan menggunakan katalis heterogen adalah mudah dipisahkan dari produk
yang terlarut dalam medium reaksi (Sleight, H. W. 1983)
Selain katalis heterogen basa, katalis heterogen asam juga telah banyak
katalis yang paling diminati saat ini karena memiliki gugus –SO3H dengan kerangka
karbon yang stabil sehingga mudah dipisahkan dari sistem reaksi (Kang, 2013).
Katalis heterogen asam berbasis sulfonat disintesis melalui reaksi sulfonasi.
Reaksi sulfonasi adalah suatu reaksi kimia yang dilakukan untuk memodifikasi
senyawa kimia dengan memasukkan gugus sulfonat (-SO3H) pad cincin aromatis
sebagai rantai utamanya. Sulfonasi merupakan salah satu reaksi elektofilik. Reaksi
sulfonasi dari senyawa polimer aromatis dapat menjadi reaksi yang sangat kompleks
karena sifat reversibilitas dari reaksi tersebut. Senyawa seperti H2SO4 dan SO3 adalah
bahan pensulfonasi yang paling umum digunakan untuk berbagai senyawa polimer
yang mengandung cincin aromatis misalnya polistirena (Wang. Z, 2012).
2.2 Minyak dan Lemak
Minyak dan lemak merupakan senyawa yang sangat melimpah dialam dalam bentuk
lipida. Minyak dan lemak berbentuk triester dari reaksi kondensasi antara tiga
molekul asam lemak dengan sebuah molekul gliserol. Triester tersebut umumnya
dikenal dengan trigliserida.
Lemak dan minyak yang dijumpai dialam terdiri dari trigliserida campuran
yang merupakan ester dari asam lemak rantai panjang. Trigeliserida dapat berwujud
cair atau padat. Pada umumnya minyak berwujud cair pada suhu kamar karena
mengandung sejumlah besar asam lemak tak jenuh seperti oleat, linoleat, dan
linolenat. Sedangkan lemak umumnya berwujud padat pada suhu kamar karena
mengandung sejumlah besar asam lemak jenuh seperti stearat, palmitat, dan laurat.
Minyak dapat diperoleh dari tumbuh-tumbuhan dan lemak dapat diperoleh dari
Minyak dan lemak yang diperdagangkan merupakan campuran-campuran dari
lipid, mayoritas tersusun atas triasilglisrerol bersama dengan diasilgliserol,
monoasilgliserol dan asam lemak bebas. Kebanyakn minyak dan lemak biasanya
dinamai berdasarkan sumber biologisnya (seperti minyak kedelai) tetapi
masing-masing minyak dan lemak memiliki rentang parameter fisika, kimia, dan
komposisinya sehingga dapat dikenali (Gunstone, 2004).
2.3. Asam Lemak
Asam lemak terbagi dua yaitu asam lemak jenuh dan tak jenuh. Dalam bahan pangan,
asam lemak jenuh yang paling banyak ditemukan adalah asam palmitat, yaitu 15% -
50% dari seluruh asam lemak yang ada, sedangkan asam stearat paling banyak pada
lemak atau minyak dari biji-bijian. Asam lemak tak jenuh (unsaturated fatty acid), di
datangkan dari luar tubuh, umumnya tidak dapat disintesa sendiri oleh tubuh. Asam
jenis ini biasa dikenal dengan asam lemak esensial, misalnya asam oleat, linoleat,
dan linolenat, yang banyak terdapat pada minyak sayur, minyak jagung, minyak
kacang, kedelai, dan alpukat. Asam lemak esensial ini berfungsi untuk membantu
proses pertumbuhan, selain itu dapat mempertahankan kesehatan kulit terutama
mencegah terjadinya peradangan kulit (Marsetyo, 1991).
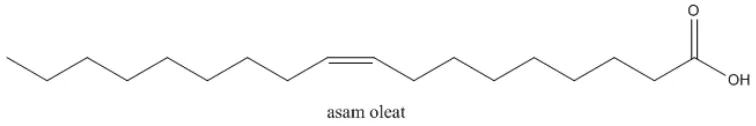
2.4 Asam Oleat
Asam lemak ini memiliki struktur sebagai berikut :
Asam Oleat pada suhu ruang berupa cairan kental dengan warna kuning pucat atau
kuning kecokelatan. Asam ini memiliki aroma yang khas. Beberapa sifat asam oleat
dapat dilihat sebagai berikut :
1. Massa molar : 282,4614 gr/mol
2. Densitas : 0,895 gr/ml
3. titik leburnya 15.3 °C
4. Titik Didih : 3600C (633 K) 5. Tidak larut dalam air
6. Larut dalam methanol (CH3OH)
Asam oleat merupakan asam lemak tak jenuh yang banyak terkandung dalam minyak
nabati. Kandungan terbesar asam oleat adalah pada minyak zaitun (55-80%), pada
kelapa sawit mencapai 30-45% . Dalam bidang kesehatan, asam oleat bermanfaat
untuk menjaga kesehatan kulit. Selain itu juga asam oleat, dengan satu ikatan
rangkap, bersifat netral terhadap LDL (tidak menurunkan atau menaikkan), tetapi
dapat meningkatkan lipoprotein HDL (Suhardjo , dkk, 1992).
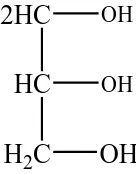
2.5 Gliserol
Gliserol memiliki rumus kimia C3H5(OH)3. Gliserol merupakan trihidrat alkohol,
dimana mempunyai dua gugus hidroksil primer dan satu gugus hidroksil sekunder.
2HC
HC
H
2C
OH
OH
OH
H
2C
HC
H
2C
O
O
O
C
C
C
O
O
O
R
R
R
3H
2O
2HC
HC
H
2C
OH
OH
OH
3R - COOH
Trigliserida
Air
Gliserol
Asam Lemak
[H
+]
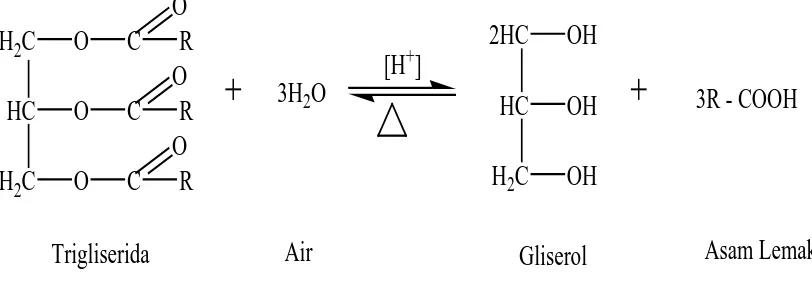
Gliserol mimiliki titik lebur 18,2oC dan titik didihnya 290 oC yang diikuti dengan adanya dekomposisi (Bonnardeaux, J., 2006). Gliserol alami merupakan hasil
samping proses konversi lemak dan minyak. Dari proses splitting lemak dapat
diperoleh 15– 20 % larutan gliserol dalam air. Proses transesterifikasi menghasilkan
75 – 90 % gliserol dalam alkohol. Proses ini tergantung pada perbandingan jumlah
alkohol dan lemak ataupun minyak dan konsentrasi katalis. (Noureddini, H., 1997)
Fungsi utama dari gliserol adalah sebagai humectant (suatu zat yang berfungsi
untuk menjaga kelembutan dan kelambaban). Gliserol juga dapat digunakan sebagai
pelarut, pemanis, pangawet dalam makanan serta sebagai zat emollient dalam
kosmetik. Berdasarkan sifatnya, gliserol banyak digunakan sebagai zat pemplastis
(plasticizer) dan minyak pelumas dalam mesin pengolahan makanan dan minuman.
Hal ini disebabkan karena gliserol tidak beracun. Gliserol juga digunakan dalam
industri resin alkil untuk menjaga sifat kelarutan. Resin alkil merupakan suatu bahan
pengikat dalam cat dan tinta. Dalam penggunaannya secara keseluruhan, baik sebagai
zat aditif, sifat gliserol yang tidak beracun dan aman selalu menjadi suatu hal yang
menguntungkan (Bonnardeaux, J., 2006).
2.6. Gliserida
Gliserida disebut juga asilgliserol merupakan senyawa ester antara gliserol dan asam
lemak. Gliserida yang bersifat padat pada suhu kamar disebut lemak sedangkan yang
bersifat cair disebut minyak. Gliserida dengan 1,2, dan 3 rantai asam lemak, maka
masing-masing disebut mono, di dan triasilgliserol (trigliserida). (Wirahadikusumah,
1985).
2.6.1. Monogliserida
Monogliserida pertama sekali disintesis pada tahun 1853, dan baru pada tahun 1960
dibuat dalam skala industri melalui reaksi gliserolisis trigliserida.
H
2C
HC
H
2C
O
OH
OH
C
R
O
Gambar 2.4. Struktur Monogliserida (Awang, R. 2004)
Monogliserida dapat dihasilkan melalui reaksi antara berbagai substrat dengan
gliserol. Berdasarkan jenis substratnya, monogliserida dapat dibuat melalui reaksi
esterifikasi langsung antara asam lemak dengan gliserol, reaksi transesterifikasi
trigliserida dengan gliserol, reaksi transesterifikasi metil ester asam lemak dengan
gliserol, reaksi hidrolisis trigliserida atau lemak dan reaksi kondensasi asam lemak
Monogliserida sangat penting sebagai bahan pencampuran dalam pembuatan
kue dan juga penting sebagai shortening (termasuk cairan dalam susu dan telur).
Monogliserida yang ditambahkan sebagai shortening sangat penting untuk
memberikan sifat emulsifikasi dalam pembuatan kue yang berkualitas tinggi, juga
dalam pembuatan es dan ragi. Emulsifier ini juga bertindak sebagai pelembut dalam
roti (Lawson,H., 1985).
2.6.2 Digliserida
Digliserida adalah senyawa kimia yang merupakan hasil ikatan kimia antara gliserol
dengan 2 buah asam lemak bebas.
H
2C
HC
H
2C
O
OH
O
C
C
O
R
R
O
Gambar 2.5. Struktur Molekul 1,3-digliserida (Watanabe,dkk, 2003)
Digliserida dapat dihasilkan dari asam lemak melalui proses esterifikasi
dengan gliserol. Selain itu, dapat juga dihasilkan dari berbagai macam minyak nabati
melalui pengolahan trigliserida yang terkandung dalam minyak nabati dalam jumlah
yang besar. Digliserida dapat disintesis dari trigliserida melalui berbagai proses,
antara lain melalui reaksi gliserolisis, hidrolisis dan dengan menggunakan reagen
Grignard melalui proses deasilasi kimia (Fennema, 1996). Selain itu, digliserida juga
dapat disintesis dengan menggunakan bantuan enzim lipase seperti 1,3-regioselektif
lipase terkekang yang mampu mensintesis 1,3-digliserida dari gliserol dan asam
2.7 Esterifikasi
Esterifikasi adalah salah satu jenis reaksi dimana reaksi tersebut untuk menghasilkan
ester. Ester merupakan sebuah hidrokarbon yang diturunkan dari asam karboksilat.
Sebuah asam karboksilat mengandung gugus -COOH, dan pada sebuah
ester
jenis. Esterifikasi juga dapat diartikan sebagai transformasi asam karboksilat atau
turunannya menjadi ester. Reaksi langsung antara alkohol dan asam karboksilat
secara umum dibantu dengan katalis asam. Reaksi ini dapat berlangsung baik jika
dilakukan pada suhu tinggi (Otera, J. 2003).
Reaksi esterifikasi gliserol dengan asam oleat diperkirakan berlangsung secara
bolak-balik (reversible) yang menghasilkan produk samping adalah air. Air akan
menyebabkan reaksi berbalik kearah kiri (reaksi hidrolisa) akan menjadi besar,
dengan demikian pengendalian terhadap jalannya reaksi adalah sangat penting.
Produk gliserol monooleat akan maksimum diperoleh bila kesetimbangan reaksi
dipertahankan bergeser ke kanan. Hal ini dapat dilakukan dengan cara pengambilan
produk gliserol monooleat atau air, dan menggunakan salah satu reaktan berlebih.
Salah satu cara yang paling mudah adalah mengambil produk sampingnya yaitu air,
yakni dengan mengkondensasikannya atau menggunakan vakum. Pengurangan
produk air sekaligus dapat mengurangi resiko terjadinya reaksi hidrolisa (reaksi
balik). Reaksi esterifikasi akan berjalan lambat jika dilakukan tanpa menggunakan
katalis. Untuk mendapatkan konversi yang tinggi dengan waktu yang relatif singkat
perlu adanya bantuan katalis. Reaksi dapat dijalankan dengan adanya katalis asam,
katalis basa maupun enzimatik (Kimmel, 2004). Reaksi umum esterifikasi asam oleat
2HC
HC
H2C
OH
OH
OH
2R - COOH
2HC
HC
H2C O OH OH C O R
2H2O
2HC
HC
H2C O OH OH C O R
2R - COOH
2HC
HC
H2C O O OH C O R C O
R 2H2O
2HC
HC
H2C O O OH C O R C O
R 2R - COOH
2HC
HC
H2C O O O C O R C O R C O R
2H2O
Gliserol Asam Lemak Monogliserida Air
Monogliserida Asam Lemak Digliserida Air
Digliserida Asam Lemak Trigliserida Air
Gambar 2.6. Reaksi Umum Esterifikasi antara Gliserol dan Asam Lemak
2.8. Reaksi Gliserolisis
Gliserolisis adalah reaksi penting antara gliserol dengan minyak atau lemak unruk
memproduksi mono dan Di-Asil Gliserol. Reaksi gliserolisis akan berjalan lambat
jika dilakukan tanpa menggunakan katalis. Untuk mendapatkan konversi yang tinggi
dengan waktu yang relative singkat perlu adanya bantuan katalis. Reaksi dapat
yang biasa digunakan dalam gliserolisis ini adalah NaOH. Persamaan reaksinya
sebagai berikut:
H2C-OH H2C-OH
| |
H C-OH + NaOH HC-OH + H2O
| |
H2C-OH H2C-ONa
Natrium Gliserolat
H2C-O-CO-R1 H2C-OH H2C-O-CO-R1 H2C-OH
| | | |
H C-O-CO-R2 + HC-OH HC-O-CO-R2 + HC-OH
| | | |
H2C-O-CO-R3 H2C-ONa H2C-O-Na H2C-OCO-R3
Natrium Diasil Gliserida Monogliserida
Kelemahan reaksi gliserolisis dengan menggunakan katalis logam alkali
adalah suhu reaksi cukup tinggi yaitu 220-250 0C. Temperatur yang tinggi ini menyebabkan produk yang dihasilkan berwarna gelap dan terbentuk bau yang tidak
diinginkan (Noureddini, H, 1997). Selain menggunakan katalis sodium gliserolat,
reaksi gliserolisis bisa juga dilakukan dengan menggunakan katalis enzim. Enzim
yang sering dipakai adalah enzim lipase. Temperatur yang digunakan reaksi
gliserolisis dengan katalis enzim sekitar 300C. Hal ini disebabkan katalis enzim tidak bias bekerja atau akan mati pada suhu yang tinggi. Oleh karena temperature yang
digunakan rendah, reaksi gliserolisis dengan katalis enzim membutuhkan energy yang
rendah. Kelemahan dari penggunaan enzim sebagai katalis adalah mahalnya harga
enzim (Kaewthong, W. 2005).
Gliserolisis dilakukan di industri untuk menghasilkan monogliserida dari
gliserol dan trigliserida. Reaksi antara trigliserida dengan gliserol untuk
sehingga dapat meningkatkan kelarutan gliserol pada fasa minyak dimana kelarutan
gliserol dalam minyak hanya sekitar 4 % pada temperatur kamar. Katalis basa seperti
NaOH, KOH dan Ca(OH)2 digunakan untuk mempercepat proses tersebut. Pada akhir
reaksi, katalis dinetralisasi dan campuran reaksi didinginkan dengan cepat. Langkah
ini sangat penting untuk meminimalkan kesetimbangan reaksi. Produk yang
dihasilkan dari proses tersebut adalah campuran monogliserida, digliserida,
trigliserida juga asam lemak bebas.
Dalam gliserolisis untuk mengurangi terbentuknya kembali trigliserida maka
dapat ditambahkan gliserol berlebih ke dalam campuran reaksi. Dengan penambahan
gliserol ini maka trigliserida akan mengalami gliserolisis untuk membentuk
monogliserida. Hanya saja terbentuknya digliserida dari campuran monogliserida
tidak dapat dihindarkan karena adanya reaksi interesterifikasi antara trigliserida dan
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Monogliserida dan digliserida merupakan senyawa kimia penting yang dapat
diaplikasikan di dalam berbagai bidang seperti industri makanan, kosmetik, farmasi,
pelumas dan bahan emulsifier dalam proses produksi bahan pangan berlemak
misalnya margarine, mentega kacang, roti, biskuit dan es krim. Hal ini dikarenakan
monogliserida dan digliserida memiliki gugus karboksil yang bersifat lipofilik dan
gugus hidroksil yang bersifat hidrofilik(Watanabe, dkk, 2004).
Untuk memperoleh senyawa Monogliserida dan digliserida tersebut dapat
dilakukan dengan tiga cara yakni; yang pertama, melalui reaksi esterifikasi langsung
antara asam lemak dengan gliserol, yang kedua, melalui reaksi transesterifikasi
trigliserida dengan gliserol, dan yang ketiga,melalui reaksi transesterifikasi metil ester
asam lemak dengan gliserol (Awang,R. dkk ,2004). Cara esterifikasi langsung antara
asam lemak dengan gliserol adalah cara yang paling tepat untuk menghasilkan
monogliserida dan digliserida dikarenakan asam lemak bebas dapat terlebih dahulu
terikat didalam pembentukan monogliserida (Guner, F. S, dkk,1996) sedangkan cara
transesterifikasi trigliserida dengan gliserol memiliki kelemahan yaitu suhu reaksi
yang tinggi yaitu 220-2500C. Temperatur yang tinggi ini menyebabkan produk yang dihasilkan berwarna gelap dan terbentuk bau yang tidak diinginkan (Noureddini, H,
Beberapa peneliti terdahulu yang berhasil membuat senyawa monogliserida
dan digliserida yaitu diantaranya melalui reaksi transesterifikasi terhadap metil
palmitat dengan gliserol dengan katalis KOH dalam pelarut metanol pada suhu
215-2200C memberikan hasil sebesar 50,6 % (Allen, R. 1982). Esterifikasi antara gliserol dan asam palmitat pada suhu 195oC dengan menggunakan katalis ZnCl2 (Mostafa,
N.A, 2013).
Demikian juga melalui reaksi gliserolisis metil oleat dengan gliserol untuk
membentuk monooleil gliserol dan dioleil gliserol dengan menggunakan katalis MgO
pada suhu 2200C (Farretti, C. 2007) dan pembuatan monooleilgliserol dan dioleilgliserol melalui proses esterifikasi langsung antara asam oleat dengan gliserol
dengan menggunakan katalis clipnoptilolite yang direaksikan pada suhu 1700C (Gunner, dkk, 1996).
Dalam reaksi esterifikasi antara gliserol dengan asam laurat dan asam oleat
banyak digunakan katalis heterogen seperti, katalis resin kation padat (Abro , S,
1997), Molecular Sieve Zeolit (Heykants, dkk, 1997), Sulfated iron oxide (Gunner,
dkk, 1996), Mesoporus material (Bossaert, dkk, 1999).
Umumnya pada reaksi esterifikasi digunakan katalis asam sulfat, namun
katalis ini dapat menimbulkan korosi pada reaktor, pencemaran lingkungan dan
tidak dapat digunakan kembali sehingga harga produk lebih mahal (Basumatary,
2013). Dan kebanyakan peneliti – peneliti terdahulu melakukan reaksi esterifikasi
untuk membentuk monogliserida dan digliserida pada suhu yang sangat tinggi. Oleh
karena itu, sangat menarik jika digunakan katalis berbasis sulfonat yang tahan pada
suhu tinggi, salah satunya yaitu katalis sulfonato disilana. Penggunaan katalis padat
dengan gugus fungsi asam sulfonat telah banyak dikembangkan untuk mengatasi
kelemahan – kelemahan tersebut, dimana telah dketahui bahwa semakin banyak
gugus sulfonat yang terikat maka reaksi akan berlangsung dengan baik dan juga
katalis dengan gugus sulfonat memiliki aktivitas katalitik yang tinggi dan tahan pada
Bangun, N dkk, 2015 telah mensintesis katalis asam berbasis disilana
sulfonat. Katalis ini disintesis dengan mensulfonasi senyawa
1,2-dimetil-1,1,2,2-tetrafenildisilana. Katalis ini telah digunakan untuk transesterifikasi CPO berkadar
asam lemak bebas tinggi yaitu 8% pada suhu 160 oC dan didapatkan yield 96% untuk menghasilkan biodiesel, dan juga telah digunakan untuk esterifikasi asam stearat dan
palmitat dengan alkohol sekunder dan memberikan hasil yang baik. Dari penelitian
yang dilakukan oleh Bangun, N dkk, katalis sulfonatodisilana ini memiliki kestabilan
termal yang sangat baik sehingga dapat digunakan pada suhu tinggi dan bersifat
reusable.
Dari uraian diatas, diketahui bahwa katalis
1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana dapat mengkatalisis dengan baik reaksi esterifikasi asam
lemak rantai panjang dengan alkohol primer dan sekunder dan juga reaksi
transesterifikasi CPO untuk menghasilkan biodisel. Sehingga menarik jika katalis
1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana (DMTFS) yang digunakan oleh
Bangun, N dkk dicoba untuk membuat monooleilgliserol dan dioleilgliserol.
1.2. Permasalahan
- Dalam menghasilkan monogliserida, sangat sulit untuk memproteksi gugus
OH yang ketiga sehingga lebih banyak digliserida yang dihasilkan. Oleh
karena itu dilakukan reaksi esterifikasi dengan mengurangi konsentrasi asam
oleat
- Umumnya pada reaksi esterifikasi digunakan katalis yang tidak tahan pada
suhu tinggi sehingga dalam penelitian ini akan digunakan katalis yang tahan
1.3. Tujuan Penelitian
Untuk memperoleh monooleilgliserol dan dioleilgliserol dari reaksi esterifikasi asam
oleat dengan gliserol menggunakan katalis 1,2-dimetil-1,1,2,2
tetrafenilsulfonatodisilana
1.4. Manfaat Penelitian
Dapat memberikan informasi ilmiah terhadap penggunaan katalis asam heterogen
berbasis sulfonat pada reaksi esterifikasi antara asam oleat dengan gliserol
menghasilkan monogliserida dan digliserida.
1.5. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Anorganik FMIPA USU Medan.
Analisa Kromatografi Gas dilakukan di PT WBI (Wilmar Bioenergi Indonesia)
Dumai. Karakterisasi produk dengan spektroskopi FT-IR dilakukan di PT Soci ,
Medan.
1.6. Metodologi Penelitian
- Reaksi esterifikasi dilakukan di dalam autoclave stainless steel dengan
mencampurkan asam oleat, gliserol, dan katalis
1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana(DMTFS) dengan pelarut n-heksana dan
gliserol yaitu 2 : 1. Reaksi esterifikasi dilakukan pada suhu 1400C selama 10 jam sambil diaduk. Setelah 10 jam, reaksi dihentikan kemudian Campuran
hasil reaksi diekstraksi dengan n-heksan dan air dan akan terbentuk dua fraksi.
Fraksi n-heksan di uapkan untuk memisahkan produk dari pelarutnya
kemudian dikeringkan dan divakum sedangkan fraksi air yang merupakan
katalis dikeringkan kemudian divakum. Hasil esterifikasi yang diperoleh
dianalisa dengan Kromatografi Gas dan FT-IR.
- Reaksi esterifikasi dilakukan di dalam autoclave stainless steel dengan
mencampurkan asam oleat, gliserol, dan katalis
1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana(DMTFS) dengan pelarut n-heksana dan
dimasukkan pengaduk magnet dengan perbandingan asam oleat dengan
gliserol yaitu 1 : 1 . Reaksi esterifikasi dilakukan pada suhu 1200C selama 10 jam sambil diaduk. Setelah 10 jam, reaksi dihentikan kemudian Campuran
hasil reaksi diekstraksi dengan n-heksan dan air dan akan terbentuk dua fraksi.
Fraksi n-heksan di uapkan untuk memisahkan produk dari pelarutnya
kemudian dikeringkan dan divakum sedangkan fraksi air yang merupakan
katalis dikeringkan kemudian divakum. Hasil esterifikasi yang diperoleh
dianalisa dengan Kromatografi Gas dan FT-IR. Hal yang sama dilakukan
PEMBUATAN MONOOLEILGLISEROL DAN DIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL
MENGGUNAKAN KATALIS 1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
ABSTRAK
Reaksi esterifikasi antara asam oleat dengan gliserol dengan menngunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana telah menghasilkan monooleilgliserol dan dioleilgliserol. Pengujian hasil esterifikasi dilakukan dengan spektroskopi FT-IR dan Kromatografi Gas. Reaksi esterifikasi dilakukan dalam autoclave stainless steel pada suhu 140oC selama 10 jam dengan rasio mol asam oleat : gliserol = 2 : 1 menghasilkan MG 3.34 %, DG 72.09 % untuk rasio mol asam oleat : gliserol = 1 : 1 dilakukan pada suhu 120oC selama 10 jam Menghasilkan MG 5.76 %, DG 70.17 %, dan untuk rasio mol asam oleat dengan gliserol = 1 : 2 dilakukan pada suhu 120oC selama 10 jam menghasilkan MG 18.37 % dan DG 79.78 % .
PRODUCTION OF MONOOLEYLGLYCEROL AND DIOLEYLGLYCEROL FROM ESTERIFICATION OF OLEIC ACID AND GLYCEROL USING
1,2-DIMETHYL-1,1,2,2-TETRAPHENYLSULFONATODISILANE AS CATALYST
ABSTRACT
The esterification of oleic acid with glycerol using 1,2-dimethyl-1,1,2,2-tetraphenylsulfonatodisilane as catalyst have given monooleylglycerol and dioleylglycerol. Obtained product from both reaction were characterized by FT-IR and gas chromatography. The esterification was carried in autoclave stainless steel at 140oC for 10 hours with molar ratio of oleic acid to glycerol was 2 : 1 producing MG 3.34 %, DG 72.09 %, for molar ratio of oleic acid to glycerol was 1 : 1 at 120oC for 10 hours producing MG 5.76 %, DG 70.17 %, and for molar ratio of oleic acid to glycerol was 1 : 2 at 120oC for 10 hours producing MG 18.37 % dan DG 79.78 % .
PEMBUATAN MONOOLEILGLISEROL DAN DIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL
MENGGUNAKAN KATALIS 1,2, -DIMETIL-1,1,2,2, TETRAFENILSULFONATODISILANA
SKRIPSI
DANIEL SIANTURI 110802026
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PEMBUATAN MONOOLEILGLISEROL DAN DIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL
MENGGUNAKAN KATALIS 1,2, -DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DANIEL SIANTURI 110802026
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul :
Kategori : Skripsi
Nama : Daniel Sianturi
Nomor Induk Mahasiswa : 110802026
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas :
Disetujui di
Medan, Oktober 2015
Komisi Pembimbing:
Pembimbing 2 Pembimbing 1
Prof.Dr. Seri Bima Sembiring, M.Sc Dr. Nimpan Bangun, M.Sc NIP 194907181976031001 NIP 195012221980031002
Diketahui/Disetujui oleh:
Departemen Kimia FMIPA USU Ketua,
Dr.Rumondang Bulan,MS NIP: 195408301985032001
Pembuatan Monooleilgliserol Dan Dioleilgliserol dari Esterifikasi Asam Oleat dengan Gliserol menggunakan katalis 1,1-dimetil- 1,1,2,2- tetrafenilsulfonatodisilana
PERNYATAAN
PEMBUATAN MONOOLEILGLISEROL DAN DIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL
MENGGUNAKAN KATALIS 1,2, -DIMETIL-1,1,2,2,- TETRAFENIL SULFONATODISILANA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Oktober 2015
DANIEL SIANTURI
PENGHARGAAN
Segala puji dan syukur penulis ucapkan kepada Tuhan Yesus Kristus sumber segala kasih sebab atas berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini dengan baik.
Dengan segala kerendahan hati penulis mengucapkan terima kasih kepada Bapak Dr. Nimpan Bangun, M.Sc selaku dosen pembimbing I dan kepala laboratorium Kimia Anorganik yang telah banyak memberikan arahan serta dukungan dana dalam menyelesaikan penelitian hingga penulisan skripsi ini dan kepada Bapak Prof. Dr. Seri Bima Sembiring, M.Sc selaku dosen pembimbing II yang telah banyak memberikan motivasi, wawasan ilmu kimia, mengajarkan keterampilan kerja maupun penulisan laporan hasil penelitian.Terima kasih kepada Ibu Dr. Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia yang telah memberikan dukungan selama penyelesaian skripsi ini, kepada Ibu Dra. Tirena Siregar ST, M.Eng selaku dosen pembimbing akademik, staf dosen Lab. Kimia Anorganik serta seluruh dosen dan staf pegawai yang telah banyak memberikan bimbingan selama penulis menjalani perkuliahan.
Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada ayah dan ibu tercinta N. Sianturi dan N. Pakpahan yang telah memberikan semangat dan dukungan selama ini hingga penulis dapat menyelesaikan masa studi serta Kakak, Abang dan Adik tercinta.
Penulis juga sangat berterima kasih kepada orang-orang yang telah banyak membantu asisten Lab. Kimia Anorganik Bg Rizal, Bg Paulus, Bg Fantoso, K’ Lois, Bg Mars, K’Tio, K’ Nabila, K’Rahel, K’Wiwi, Anita, Juwita, Suryati, Baron, Freddy, Rendi, Claresta, Lince, Sahabat-sahabatku stambuk 2011 terutama teman seperjuangan Lianta dan Fernando. Juga kepada teman-teman Kos 35 Fernandes dan Sutan serta teman-teman lainnya yang tidak bisa penulis sebutkan satu persatu. Kiranya Tuhan yang akan membalas semua kebaikan yang telah dilakukan untuk penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan dan kiranya dapat memberikan manfaat bagi siapa saja yang membacanya demi kemajuan ilmu pengetahuan terutama daalam bidang kimia.
PEMBUATAN MONOOLEILGLISEROL DAN DIOLEILGLISEROL DARI ESTERIFIKASI ASAM OLEAT DENGAN GLISEROL
MENGGUNAKAN KATALIS 1,2,-DIMETIL-1,1,2,2,-TETRAFENILSULFONATODISILANA
ABSTRAK
Reaksi esterifikasi antara asam oleat dengan gliserol dengan menngunakan katalis 1,2-dimetil-1,1,2,2-tetrafenilsulfonatodisilana telah menghasilkan monooleilgliserol dan dioleilgliserol. Pengujian hasil esterifikasi dilakukan dengan spektroskopi FT-IR dan Kromatografi Gas. Reaksi esterifikasi dilakukan dalam autoclave stainless steel pada suhu 140oC selama 10 jam dengan rasio mol asam oleat : gliserol = 2 : 1 menghasilkan MG 3.34 %, DG 72.09 % untuk rasio mol asam oleat : gliserol = 1 : 1 dilakukan pada suhu 120oC selama 10 jam Menghasilkan MG 5.76 %, DG 70.17 %, dan untuk rasio mol asam oleat dengan gliserol = 1 : 2 dilakukan pada suhu 120oC selama 10 jam menghasilkan MG 18.37 % dan DG 79.78 % .
PRODUCTION OF MONOOLEYLGLYCEROL AND DIOLEYLGLYCEROL FROM ESTERIFICATION OF OLEIC ACID AND GLYCEROL USING
1,2-DIMETHYL-1,1,2,2-TETRAPHENYLSULFONATODISILANE AS CATALYST
ABSTRACT
The esterification of oleic acid with glycerol using 1,2-dimethyl-1,1,2,2-tetraphenylsulfonatodisilane as catalyst have given monooleylglycerol and dioleylglycerol. Obtained product from both reaction were characterized by FT-IR and gas chromatography. The esterification was carried in autoclave stainless steel at 140oC for 10 hours with molar ratio of oleic acid to glycerol was 2 : 1 producing MG 3.34 %, DG 72.09 %, for molar ratio of oleic acid to glycerol was 1 : 1 at 120oC for 10 hours producing MG 5.76 %, DG 70.17 %, and for molar ratio of oleic acid to glycerol was 1 : 2 at 120oC for 10 hours producing MG 18.37 % dan DG 79.78 % .
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak iv
Abstract v
Daftar Isi vi
Daftar Gambar viii
Daftar Singkatan ix
Daftar Lampiran x
Bab 1. PENDAHULUAN Latar Belakang 1
Permasalahan 3
Pembatasan Masalah 4
Tujuan Penelitian 4
Manfaat Penelitian 4
Lokasi Penelitian 4
Metodologi Penelitian 4
Bab 2. TINJAUAN PUSTAKA 2.1. Katalis 6
2.1.1. Katalis Homogen 7
2.1.2. Katalis Heterogen 7
2.2. Minyak dan Lemak 8
2.3. Asam Lemak 9
2.4. Asam Oleat 9
2.5. Gliserol 10
2.6. Gliserida 12
2.6.1. Monogliserida 12
2.6.2. Digliserida 13
2.7. Esterifikasi 14
2.8. Gliserolisis 15
Bab 3. METODE PENELITIAN 3.1. Alat 18
3.2. Bahan 19
3.3.2. Esterifikasi Asam Oleat dengan Gliserol
Perbandingan mol 1 : 1 20
3.4. Bagan Penelitian 3.4.1. Esterifikasi Asam Oleat dengan gliserol Perbandingan Mol 2 : 1 21
3.4.2. Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 1 : 1 22
Bab 4. HASIL DAN PEMBAHASAN 4.1. Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 2 : 1 23
4.2. Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 1 : 1 26
4.3. Esterifikasi Asam Oleat dengan Gliserol Perbandingan Mol 1 : 2 29
Bab 5. KESIMPULAN DAN SARAN 5.1. Kesimpulan 31
5.2. Saran 31
Daftar Pustaka 32
DAFTAR GAMBAR
[image:47.612.122.509.182.536.2]Nomor Judul Halaman
Gambar
2.1. Struktur Asam Oleat 9
2.2. Struktur Gliserol 10
2.3. Reaksi umum pembentukan gliserol 11
2.4. Struktur Monogliserida 12
2.5. Struktur 1,3-digliserida 13
2.6. Reaksi umum esterifikasi antara gliserol dan dengan asam lemak 15
3.4.1. Bagan esterifikasi asam oleat dengan gliserol Perbandingan mol 1 : 1 21
3.4.2. Bagan esterifikasi asam oleat dengan gliserol Perbandingan mol 2 : 1 22
4.1. Reaksi esterifikasi asam oleat dengan gliserol Perbandingan mol 2 : 1 24
4.2. Data Kromatogram produk esterifikasi perbandingan mol 2 : 1 25
4.3. Spektrum FT-IR produk esterifikasi perbandingan mol 2 : 1 26
4.4. Data Kromatografi Gas produk esterifikasi perbandingan mol 1 : 1 27
4.5. Spektrum FT-IR produk esterifikasi perbandingan 28
mol 1 : 1 4.6. Data Kromatogram produk esterifikasi perbandingan 29
DAFTAR SINGKATAN
FT-IR = Fourier Transform – Infra Red
GC = Gas Chromatography
CPO = Crude Palm Oil
WBI = Wilmar Bionergi Indonesia
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran