Lampiran 3. Kromatografi Lapis Tipis Ekstrak Pekat Kloroform Tumbuhan Senduduk Merah (Melastoma sanguineum Sims) Sebelum
Kromatografi Kolom
II
E
I
E
II
E
E
E
III
IV
Keterangan :
Fase diam : Kieselgel 60 F254
E : Ekstrak pekat lapisan kloroform daun tumbuhan senduduk merah
No Fase gerak Jumlah noda Rf
I n-heksana : etilasetat 90:10 v/v 1 0,26
II n-heksana : etilasetat 80:20 v/v 2 0,46 0,54
III n-heksana : etilasetat 70:30 v/v 3
0,24
0,34
0,50
IV n-heksana : etilasetat 60:40 v/v 4
0,39
0,52
0,69
0,77
Merah (Melastoma sanguineum Sims) setelah penggabungan fraksi
II
E
I
E
II
E
E
E
III
IV
Keterangan
Fase diam : Kieselgel 60 F254
E :Ekstrak pekat daun tumbuhan senduduk merah setelah kolom kromatografi
No Fraksi Jumlah Noda Rf
I 10-35 3
0,78
0,66
0,56
II 36-45 3
0,47
0,40
0,34
III 46-55 2 0,27
0,20
IV 56-63 2 0,06
0,14
I
E
II
E
Keterangan
Fase diam : Kieselgel 60 F254
E : Ekstrak etil asetat pasta hasil kromatografi kolom yang kedua
No Fase Gerak Jumlah Noda Rf
I n-heksana : etilasetat 60:40 v/v 2 0,22 0,44
Lampiran 6. Kromatografi Lapis Tipis Senyawa Murni Hasil Isolasi
I
E
II
E
Keterangan
Fase diam : Kieselgel 60 F254
E : Ekstrak etil asetat pasta hasil isolasi
No Fase Gerak Jumlah Noda Rf
I n-heksana : etilasetat 60:40 v/v 1 0,25
Lampiran 8. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ = 0-16 ppm
O
O
OH
OH OCH3
HO 1
2 3 4 5
6
7 9
10
1' 2' 3'
4'
Lampiran 9. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ = 6,8-7,5 ppm
O
O
OH
OH OCH3
HO 1
2 3 4 5
6
7 9
10
1' 2' 3'
4'
Lampiran 10. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ = 3,0-7,0 ppm
O
O
OH
OH OCH3
HO 1
2 3 4 5
6
7 9
10
1' 2' 3'
4'
DAFTAR PUSTAKA
Adnan, 1997. Teknik Kromatografi Untuk Analisis Bahan Makanan. Penerbit Andi. Yogyakarta
Dachriyanus, 2004. Analisis Struktur Senyawa Organik. Andalas University Press. Padang
Gritter, R.J. 1991. Pengantar Kromatografi. Edisi Kedua. Penerbit ITB. Bandung
Harborne, J.B. 1987. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan.Penerjemah : Kosasih Padmawinata dan Iwang Soediro. Edisi Ketiga. ITB Press. Bandung
Hariana, A. 2013. Tumbuhan Obat dan Khasiatnya. Penebar Swadaya. Jakarta
Heim, E. 2015. Flora and Vegetation of Bali Indonesia. Books on Demand. Switzerland
Heinrich, M., Barnes, J., Gibbons, S., Williamson, E.M. 2010. Farmakognosi dan Fitoterapi. Penerbit Buku Kedokteran EGC. Jakarta
Hidayat, P. 2013. Kitab Tumbuhan Obat. Agriflo. Jakarta Holm, L. 1997. World Weeds . John Wiley & Sons. Canada
Jacobs, T.L. 1974. Laboratory Practise of Organic Chemistry. Fifth Edition. Macmillan Publishing Co Inc.New York
Jenie, U. A. 2014. Teknik Modern Spektroskopi NMR: Teori dan Aplikasi dalam Elusidasi Struktur Molekul Organik. LIPI Press.Jakarta
Mabry, T.J., Markham, K.R., Thomas, M.B. 1970. The Sistematic Identification of Flavonoids. Springer Verlag.New York
Manito, P. 1981. Biosintesis Produk Alami. Terjemahan Koensoemardiyah. IKIP Semarang Press. Semarang
Markham,K.R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan KosasiPadmawinata. ITB Press. Bandung
Nakanishi, K., Goto, T., Ito, S., Natori, S., Nosoe, S. 1974. Natural Product Chemistry.Volume 1.Kodansha Ltd Academic Press. Tokyo
Pasto, D.J. 1992. Experiment and Techniquen Organic Chemistry. Prentice Hall,Inc. New Jersey
Pavia, D.L., Lampman, G.M., Kriz, G.S. 1979. Introduction to Spectroscopy: A Guide for Students of Organic Chemistry. Saunders College. Philadelphia
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi Keenam. Penerbit ITB. Bandung.
Sarker, S et al 2006.Natural Product Isolation.Second Edition. Humana Press Inc. New Jersey
Sastrohamidjojo,H. 1996. Sintesis Bahan Alam. Gadjah Mada University Press. Yogyakarta
Satiadarma, K. 2004. Asas Pengembangan Prosedur Analisis. Airlangga University Press. Surabaya.
Supratman, U. 2010. Elusidasi Struktur Senyawa Organik. Widya Padjajaran. Bandung
Sudjadi. 1986. Metode Pemisahan. Penerbit Kanisius.Yogyakarta
Wiryowidagdo, S. 2008. Kimia dan Farmakologi Bahan Alam.Penerbit Buku Kedokteran EGC. Jakarta
Wu-Yang Huang., Yi-Zhou Cai., Harold Corke., Mei Sun. 2010. Survey of
BAB 3
METODE PENELITIAN
3.1 Alat-alat
1. Spektrofotometer 1H-NMR Jeol/Delta2NMR 500MHz
2. Spektrofotometer FT-IR Shimadzu 3. Spektrofotometer UV-Vis
4. Rotarievaporator Buchi R-114
5. Labu Rotarievaporator 1000 mL Schoot/Duran 6. Ekstraktor 5000 mL Schoot/Duran 7. Kolom Kromatografi Pyrex
8. Alat Destilasi
9. Lampu UV 254 nm/356 nm UVGL 58 10.Neraca Analitis Mettler AE 200 11.Corong Kaca
12.Corong Pisah 500 mL Pyrex
19.Statif dan Klem 20.Penangas Air 21.Batang Pengaduk 22.Chamber
3.2 Bahan-Bahan
1. Daun Senduduk Merah
2. Metanol Destilasi
3. Etil Asetat Teknis
4. N-Heksana Teknis
5. Kloroform Teknis
6. Aquadest
7. Pereaksi Benedict 8. HCl 6%
9. FeCl3 5% 10.NaOH 10% 11.Serbuk Mg 12.HCl(p) 13.H2SO4(p) 14.Kapas
15.Silika Gel (70-230 mesh) ASTM E.Merck. KgA 16.Plat KLT silika gel 60 F254 E.Merck.Art 554
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun Tumbuhan Senduduk Merah
Serbuk daun senduduk merah diidentifikasi dengan menggunakan cara uji Fitokimia. Untuk membuktikan adanya senyawa flavonoida yang terdapat dalam daun senduduk merah maka dilakukan uji pendahuluan secara kualitatif dengan reaksi warna sebagai berikut:
1. Dimasukkan ± 10 gram serbuk daun senduduk merah yang telah dikeringkan ke dalam dua gelas Erlenmeyer
2. Ditambahkan 25 mL metanol ke dalam gelas Erlenmeyer 3. Didiamkan selama 1 jam
4. Disaring
5. Dimasukkan ekstrak sampel ke dalam tabung reaksi
6. Ditambahkan pereaksi FeCl3 5% menghasilkan larutan berwarna hitam 7.
3.3.3 Ekstraksi Daun Tumbuhan Senduduk Merah
3.3.4 Analisis Kromatografi Lapis Tipis
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak kloroform dengan menggunakan fase diam silika gel 60F254 Merck. Analisis ini bertujuan untuk mencari sistem dan perbandingan pelarut yang sesuai untuk kromatografi kolom. Fasa gerak yang digunakan adalah campuran pelarut n-heksana:etil asetat dengan perbandingan 90:10, 80:20, 70:30, 60:40, 50:50 (v/v).
Dimasukkan 10 ml campuran larutan fase gerak n-heksana: etil asetat 90:10 (v/v) ke dalam bejana kromatografi, kemudian dijenuhkan. Di totolkan ekstrak pekat kloroform pada plat KLT kemudian dimasukkan plat ke dalam bejana yang telah berisi campuran pelarut yang telah dijenuhkan, lalu di tutup dan di elusi. Plat yang telah di elusi, di keluarkan dari bejana, lalu di keringkan.
Di amati noda yang terbentuk dibawah sinar UV, kemudian difiksasi dengan pereaksi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut n-heksana:etil asetat dengan perbandingan 80:20, 70:30, 60:40, 50:50 (v/v).
3.3.5 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kromatografi kolom dilakukan terhadap ekstrak pekat kloroform yang telah diperoleh. Fasa diam yang digunakan adalah silika gel 40 (70-230 mesh) ASTM dan fasa gerak yaitu heksana 100%, campuran pelarut n-heksana:etil asetat dengan perbandingan 90:10, 80:20, 70:30, 60:40 (v/v).
ditampung dalam botol vial setiap ± 10 mL, lalu di KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian diuapkan sampai terbentuk pasta.
3.3.6 Pemurnian
Senyawa yang telah diperoleh dari hasil isolasi dengan kromatografi kolom dilarutkan kembali dengan etil asetat lalu dianalisis KLT untuk mengetahui apakah senyawa yang diperoleh sudah murni atau belum. Setelah itu dilakukan kembali kromatografi kolom dengan fase gerak yang seragam yaitu n-heksana : etil asetat dengan perbandingan 60:40 (v/v). Hasil isolasi direkristalisasi dengan menggunakan etil asetat dan n-heksana hingga diperoleh senyawa murni yang dibuktikan dengan noda yang tunggal pada uji KLT.
3.3.7 Uji kemurnian Hasil isolasi dengan Kromatografi Lapis tipis (KLT)
Uji kemurnian pasta dilakukan dengan kromatografi lapis tipis dengan menggunakan fasa diam silika gel 60 F254 dengan fasa gerak n-heksana:etil asetat 70:30 (v/v). Dimasukkan 10 mL larutan fasa gerak ke dalam bejana kromatografi lapis tipis, lalu dijenuhkan. Ditotolkan pasta yang sebelumnya dilarutkan dengan etil asetat pada plat KLT. Dimasukkan plat KLT tersebut ke dalam bejana kromatografi lapis tipis yang telah jenuh. Setelah pelarut fasa gerak merembes sampai batas tanda, plat KLT dikeluarkan dari bejana, dikeringkan, diamati di bawah sinar UV, dan difiksasi dengan menggunakan pereaksi FeCl3 5% dalam metanol menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa flavonoida.
3.3.8 Identifikasi Senyawa Hasil Isolasi
3.3.8.1 Identifikasi dengan Spektrofotometer UV-Vis
Analisis dengan alat Spektrofotometer UV-Vis diperoleh dari Laboratorium Kimia Organik Bahan AlamInstitut Teknologi Bandung (ITB), Jawa Barat dengan menggunakan pelarut metanol dan diperoleh data yang dapat dilihat pada Gambar 4.1.
3.3.8.2 Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
Analisis dengan alat Spektrofotometer FT-IR diperoleh dari Laboratorium Pusat Penelitian Kimia – LIPI, Kawasan PUSPITEK Serpong, Tangerang dengan menggunakan KBr dan diperoleh data yang dapat dilihat pada Gambar 4.2.
3.3.8.3Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton
(1H-NMR)
3.4 Bagan Uji Flavonoida
- Ekstraksi dengan pelarut metanol
Serbuk daun tumbuhan senduduk merah
( Melastoma sanguineum Sims )
di ekstraksi dengan metanol disaring
dimasukkan ke dalam 1 tabung reaksi Tabung I
ditambahkan pereaksi FeCl3 5% diamati perubahan warna
Larutan Hitam
diamati warna larutan
- Ekstraksi dengan pelarut etil asetat
Serbuk daun tumbuhan senduduk merah
( Melastoma sanguineum Sims )
di ekstraksi dengan etil asetat disaring
dimasukkan ke dalam 1 tabung reaksi Tabung I
ditambahkan pereaksi FeCl3 5% diamati perubahan warna
Larutan Hitam
diamati warna larutan
3.5 Bagan Penelitian
1600 gram serbuk daun senduduk merah ( Melastoma sanguineum Sims )
diuji Flavonoida
dimaserasi dengan metanol hingga terendam didiamkan selama ± 24 jam
diulangi sebanyak 5 kali disaring
Ekstrak metanol
diuji dengan FeCl3 5%
dipekatkan dengan rotarievaporator
Ekstrak pekat metanol
diuapkan hingga semua pelarut metanol habis menguap
dilarutkan dengan etilasetat secara berulang-ulang sampai bening disaring
diekstraksi partisi dengan n-heksana hingga bening
Lapisan metanol Lapisan n-heksana
non flavonoid (tidak dilanjutkan) diuji dengan FeCl3 5%
dipekatkan dengan rotarievaporator
dihidrolisa dengan HCl 6% sambil dipanaskan selama 60 menit sambil diaduk
didinginkan disaring
Ekstrak metanol asam Residu
(senyawa gula) diekstraksi partisi dengan kloroform sebanyak 3 kali
Lapisan kloroform lapisan metanol
asam dipekatkan dengan rotarievaporator
Ekstrak pekat kloroform
Sisa Sampel (Ampas)
diuapkan hingga seluruh etilasetat menguap
diuji dengan FeCl3 5%
Lanjutan
Ekstrak pekat kloroform
diuji dengan FeCl3 5%
diuji KLT untuk mengetahui eluen yang sesuai
dikolom kroatografi dengan fase diam silika gel dan fase gerak(eluen) n-heksana : etilasetat (90:10; 80:20; 70:30; 60:40) (v/v)
ditampung tiap fraksi sebanyak ± 10 mL dalam botol vial diuji Kromatografi Lapis Tipis
digabung fraksi dengan harga Rf yang sama
Fraksi 1-9 (90:10) v/v
Fraksi 10-35 (80:20) v/v
Fraksi 36-45
(70:30) v/v Fraksi 46-55(60:40) v/v
Fraksi 56-63
spektrometer 1H-NMR Hasil positif Hasil positif Hasil positif Hasil positif diuji FeCl3 5% diuji FeCl3 5% diuji FeCl3 5% diuji FeCl
3 5% diuji FeCl3 5%
Hasil Analisis Senyawa Murni
Dianalisis Kromatografi Lapis Tipis dengan eluen n-heksana : etil asetat (60:40) (v/v)
Dikolom kromatografi dengan
fase diam silika gel dan fase gerak (eluen) n-heksana : etil asetat (60:40) (v/v) Diuji Kromatografi Lapis Tipis
Digabung fraksi dengan harga Rf yang sama
fraksi 1-9
(60:40) v/v fraksi 10-20(60:40) v/v
Hasil positif Hasil positif
Direkristalisasi
Dianalisis Kromatografi Lapis Tipis
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Hasil skrining fitokimia terhadap ekstrak metanol dan etil asetat daun tumbuhan senduduk merah (Melastoma sanguineum Sims) menunjukkan bahwa ekstrak metanol dan ekstrak etil asetat sampel positif terhadap pereaksi-pereaksi flavonoida.
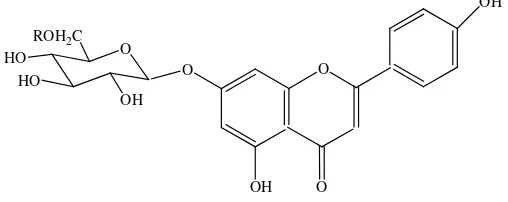
Hasil elusi dari perbandingan pelarut n-heksana:etil asetat 70:30 v/v pada fraksi 36-45, dipisahkan kembali pada alat kolom dan direkristalisasi dengan n-heksana dan etil asetat untuk mendapatkan senyawa murni. Sehingga diperoleh senyawa murni berupa pasta berwarna kuning kecoklatan seberat 4,4 mg, dan nilai harga Rf = 0,25 (n-heksana : etil asetat 60:40 v/v) dan Rf= 0,51 (kloroform : metanol 80:20 v/v).
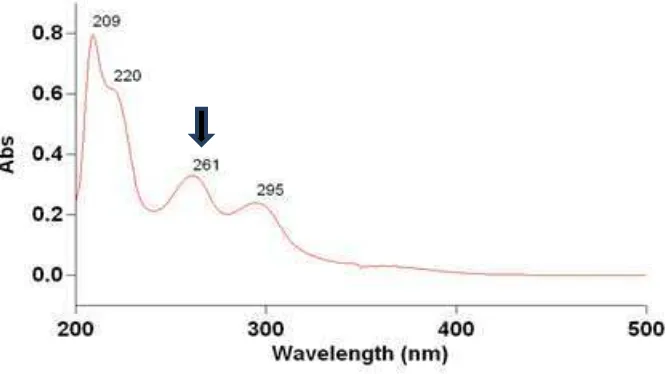
Spektrum Ultraviolet-Visible (UV-Vis) senyawa hasil isolasi dengan menggunakan pelarut metanol dan data serapan panjang gelombang Ultraviolet-Visible (UV-Vis) dapat dilihat pada Gambar 4.1 dan Tabel 4.1 berikut :
Tabel 4.1 Serapan panjang gelombang Ultraviolet-Visible (UV-Vis) senyawa hasil isolasi
NO Wavelength (nm) Absorbansi
1. 261,00 0.330
Hasil analisis Spektrofotometer Ultraviolet-Visible (UV-Vis) dengan pelarut
metanol memberikan panjang gelombang maksimum (λ maks) 261,00 nm.
Hasil ini menunjukkan bahwa golongan dari struktur flavonoida yang diperoleh termasuk golongan flavonol.
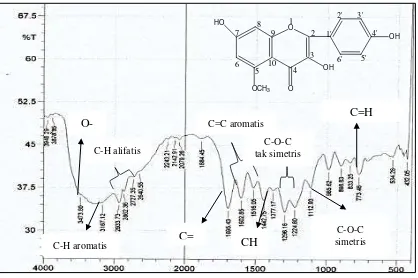
Hasil analisis spektrometer FT-IR dari senyawa hasil isolasi dapat dilihat pada Gambar 4.2.sebagai berikut:
Gambar 4.2. Spektrum Inframerah (FT-IR) senyawa hasil isolasi
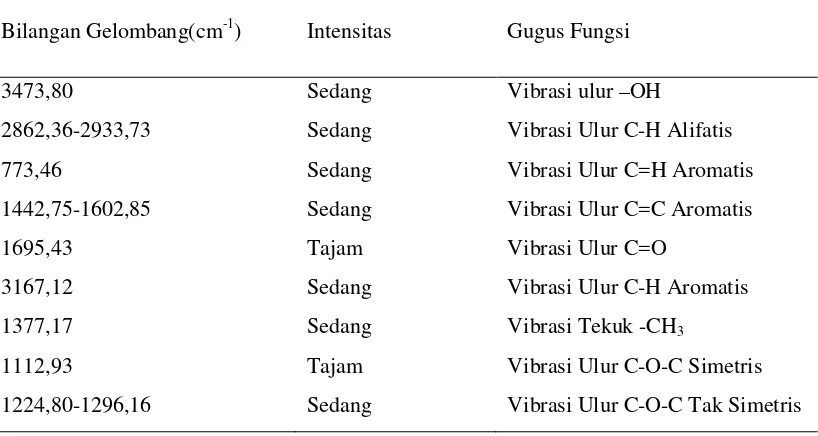
Dari analisis Spektrofotometer Infra Merah (FT-IR) memeberikan pita-pita serapan pada daerah bilangan gelombang (cm-1) seperti pada tabel 4.2.
Tabel 4.2 Interpretasi Spektrum FT-IR Senyawa Hasil Isolasi
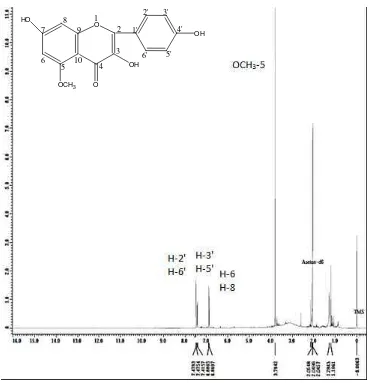
Berikut adalah hasil analisis Spektrofotometri Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut aseton-d6 dan TMS sebagai standar :
Bilangan Gelombang(cm-1) Intensitas Gugus Fungsi
3473,80 Sedang Vibrasi ulur –OH
2862,36-2933,73 Sedang Vibrasi Ulur C-H Alifatis
773,46 Sedang Vibrasi Ulur C=H Aromatis
1442,75-1602,85 Sedang Vibrasi Ulur C=C Aromatis
1695,43 Tajam Vibrasi Ulur C=O
3167,12 Sedang Vibrasi Ulur C-H Aromatis
1377,17 Sedang Vibrasi Tekuk -CH3
1112,93 Tajam Vibrasi Ulur C-O-C Simetris
Gambar 4.3. Spektrum 1H-NMR senyawa hasil isolasi pada δH= 0-16,0 ppm
Hasil analisis Spektrofotometer Resonansi Magnetik Inti Proton (H1-NMR) senyawa hasil isolasi dengan menggunakan pelarut Aseton-d6 dan TMS sebagai
O
O
OH
OH OCH3
HO 1
2 3 4 5
6
7 9
10
1' 2' 3'
4'
standar yang memberikan signal-signal pergeseran kimia dengan penjelasan sebagai berikut:
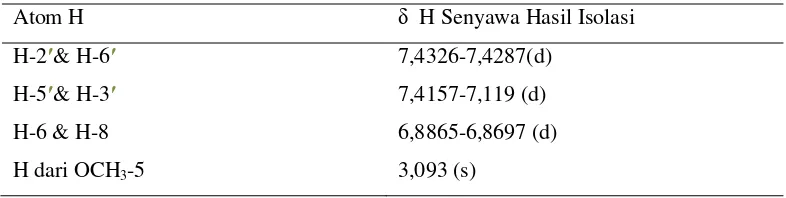
Tabel 4.3 Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi
Atom H δ H Senyawa Hasil Isolasi
H-2′& H-6′ 7,4326-7,4287(d) H-5′& H-3′ 7,4157-7,119 (d) H-6 & H-8 6,8865-6,8697 (d)
4.2Pembahasan
Dari hasil isolasi senyawa flavonoida dari daun tumbuhan senduduk merah (Melastoma sanguineum Sims) mulai dari proses ekstraksi maserasi diperoleh ekstrak pekat sebanyak 476,86 g kemudian dilarutkan dengan menggunakan pelarut etil asetat untuk pemisahan senyawa senyawa yang diduga merupakan tanin diperoleh sebanyak 255,96 g dan ekstrak pekat 94,10 g. Ekstrak pekat yang diperoleh dipartisi kembali dengan menggunakan pelarut n-heksana dan dihidrolisa dalam suasana asam lalu dipartisi dengan kloroform hingga diperoleh 1,46 g. Analisis kromatografi lapis tipis sebelum kromatografi kolom didapat perbandingan pelarut yang sesuai untuk memisahkan senyawa flavonoida dari daun tumbuhan senduduk merah adalah n-heksana : etil asetat 60:40 v/v yang menunjukkan pemisahan yang lebih baik dari noda yang dihasilkan (Lampiran 3). Hasil analisis kromatografi lapis tipis terhadap eluat hasil kolom kromatografi dengan eluen yang seragam n-heksana : etil asetat 60:40 v/v yang menunjukkan masih terdapat beberapa noda pada fraksi yang digabungkan (Lampiran 4). Ditunjukkan bahwa noda yang dihasilkan pada plat kromatografi lapis tipis pada fraksi 36-45 dengan pereaksi FeCl3 5% yangpaling baik maka dilakukan pemurnian pasta hasil isolasi dengan kolom kromatografi kembali dengan eluen n-heksana : etil asetat 60:40 v/v. Hasil analisa kromatografi lapis tipis terhadap eluat hasil kolom kromatografi yang kedua kali dengan eluen yang seragam n-heksana : etil asetat 60:40 v/v yang menunjukkan masih terdapat beberapa noda yang dihasilkan pada plat kromatografi lapis tipis pada fraksi 10-20 dengan pereaksi FeCl3 5% sangat baik (Lampiran 5) maka dilakukan kembali pemurnian pasta dengan rekristalisasi menggunakan pelarut etil asetat dan n-heksana, kemudian dikromatografi Lapis Tipis kembali untuk menentukan harga Rf pasta hasil isolasi (Lampiran 6) dengan dua eluen yang berbeda, yaitu n-heksan : etil asetat 60:40 v/v diperoleh harga Rf sebesar 0,25dan kloroform : metanol 80:20 v/v diperoleh Rf sebesar 0,51.
Hasil interpretasi Spektrum Inframerah (FT-IR) dan Spektrum Resonansi Magnetik Inti Proton (1H-NMR) dalam standar TMS diperoleh:
Pergeseran kimia pada daerahδ = 6,8865-6,8697 ppmpuncakdoublet menunjukkan proton H-6 dan H-8 dan pada cincin A senyawa flavonoida yang sesuai dengan peak spektrum standar pembanding pada lampiran 13. Sedangkan pergeseran kimia pada daerah δ = 7,4326-7,4287 ppm puncak doublet menunjukkan proton-proton dari H-2’ & H-6’ dan pergeseran δ = 7,4157-7,4119 ppm puncak doublet menunjukkan proton-proton dari H-3’ & H-5’. Hal ini didukung oleh peak spektrum standar pembanding pada lampiran 13.
Pergeseran kimia pada daerah δ = 7,4793- 7,4754 ppm puncak doublet menunjukkan proton-proton pada posisi H-5’ dan H-2’menunjukkan coupling para dengan nilai ± 1 Hz. Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 985,62 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur C-H dan pada bilangan gelombang 1442,75-1602,85 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C pada sistem aromatik.
Pergeseran kimia pada daerah δ = 3,093 ppm puncak singlet menunjukkan adanya proton dari gugus metoksi H-4′ pada cincin B senyawa flavonoid. Hal ini didukung oleh peak spektrum standar pembanding pada lampiran 13, dimana gugus metoksi terdapat pada daerah δ = 3,5-4,0 ppm dengan puncak singlet dan juga spektrum inframerah pada bilangan gelombang 2862,36-2933,73 cm-1 dengan puncak sedang menunjukkan vibrasi tekuk C-H alifatis dari CH3, dan pada bilangan gelombang 1224,80-1296,16 cm-1dengan puncak sedang menunjukkan vibrasi ulur C-O-C tak simetris.
Meskipun demikian, penulis mengakui bahwa data hasil 1H-NMR masih kurang murni karena adanya campuran dari senyawa hasil isolasi.Gambar 4.4 berikut ini merupakan struktur flavonol yang diperoleh dari senyawa hasil isolasi:
O O
OH OH
OCH3
HO 1 2
3
4 5
6
7 9
10
1'
2' 3'
4'
5' 6' 8
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Hasil uji flavonoida dengan menggunakan pereaksi FeCl3 5% menunjukkan bahwa daun tumbuhan senduduk merah (Melastoma sanguineum Sims) mengandung senyawa flavonoida.
2. Hasil isolasi yang diperoleh dari 1600 g daun tumbuhan senduduk merah (Melastoma sanguineum Sims) merupakan pasta kuning kecoklatan sebanyak 4,4 mg dengan harga Rf=0,25 dengan eluen n-heksana : etilasetat 70:30 v/v. 3. Hasil analisis dengan Spektrofotometri UV-Visible, Spektrofotometri
Inframerah (FT-IR) dan Spektrofotometri Resonansi Magnetik Inti Proton (1 H-NMR) menunjukkan bahwa senyawa hasil isolasi dari daun tumbuhan senduduk merah (Melastoma sanguineum Sims)diduga adalah senyawa flavonoida golongan flavonol.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Senduduk Merah (Melastoma sanguineum Sims)
Tumbuhan senduduk merah (Melastoma sanguineum Sims) adalah tanaman yang berkhasiat, memiliki banyak manfaat.Penyebaran tanaman ini berada di daerah-daerah tropis.Dalam bidang farmakologi, potensi dari tumbuhan ini belum banyak dikembangkan manusia (Heim, 2015).
2.1.1 Sistematika Tumbuhan Senduduk Merah
Daun Senduduk Merah (Melastoma sanguineum Sims) Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae
Ordo : Myrtales
Famili : Melastomataceae Genus : Melastoma
Spesies :Melastoma sanguineum Sims Nama Lokal : Senduduk Merah
(Herbarium Bogoriense, 2016)
2.1.2 Morfologi dan Manfaat Tumbuhan Senduduk Merah
Senduduk Merah banyak tumbuh di kawasan Asia tropis sampai subtropis (Holm, 1997).Setiap bagian dari tumbuhan ini memiliki beberapa manfaat, salah satunya adalah bagian daun yang dapat dimanfaatkan untuk mengobati penyakit seperti diare dan sariawan (Hidayat, 2013).
2.2Senyawa Organik Bahan Alam
Pada hakekatnya, kimia bahan alam merupakan pengetahuan yang telah dikenal sejak peradaban manusia tumbuh. Contohnya adalah pembuatan bahan makanan, pewarnaan benda, obat-obatan atau stimulan dan sebagainya (Sastrohamidjojo, 1996).
Pada pertengahan abad ke 18, pengetahuan ini berkembang sehingga dapat dipisahkan beberapa senyawa organik dari makhluk hidup serta hasil produksinya. Dalam keahliannya di bidang ini seorang ahli kimia Jerman, Karl Eilhelm Scheele (1742-1786) telah berhasil memisahkan beberapa senyawa sederhana. Biogenesis dari produk alami, meskipun pada mulanya berkaitan dengan kimia organik dan biokimia, menjadi berlainan karena memiliki tujuan yang berlainan. Kimia organik terutama mempelajari tentang struktur, sifat-sifat kimia dan fisika, serta cara sintesisnya, baik secara alami ataupun invitro dari zat-zat kimia tetapi cenderung untuk mengabaikan sifat-sifat khusus dari bahan alam, misalnya tentang cara pembentukan dan peran biologisnya. Biokimia, berusaha menjawab pertanyaan-pertanyaan yang paling banyak diajukan terutama tentang metabolism primer, dan mengabaikan proses-proses sekunder misalnya tentang pembentukan alkaloid, terpena dan lain-lain (Manitto, 1981).
Dengan meningkatnya jenis dan tipe senyawa yang ditemukan di berbagai bahan alam, berkembang juga sistem klasifikasi senyawa yang berasal dari bahan alam.
Ada 4 jenis klasifikasi yang digunakan (Nakanishi et al, 1974). 1. Klasifikasi Berdasarkan Struktur Kimia
Klasifikasi ini adalah klasifikasi formal berdasarkan kerangka struktur molekul, yaitu :
a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak, gula-gula dan hampir semua asam amino.
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid.
c. Senyawa benzenoid atau aromatik, seperti fenol dan kuinon.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Pengembangan bahan alam yang didahului dengan pengamatan dan pengalaman empirik khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak yang diikuti dengan isolasi komponen murni.
3. Klasifikasi Berdasarkan Taksonomi
Klasifikasi ini didasarkan pada pengkajian morfologi komparatif atau taksonomi tumbuhan.Di dalam hewan dan sebagian mikroorganisme metabolit akhir biasanya diekskresikan ke luar tubuh, sedangkan di dalam tumbuhan, metabolit tersebut disimpan di dalam tubuh tumbuhan.Walaupun beberapa metabolit selama ini diketahui spesifik pada tumbuhan tertentu, tetapi sekarang telah diketahui tersebar di dalam berbagai tumbuhan, misalnya alkaloid dan isoprenoid telah dapat diisolasi dari berbagai genus, spesies, suku, atau ordo.Bahkan di dalam satu spesies terdapat sejumlah komponen yang memiliki struktur dasar yang berkaitan.
Pengetahuan tentang kandungan komponen tumbuhan berkembang dengan sangat pesat karena berkembangnya metode ekstraksi, isolasi dan karakterisasinya.Hal ini mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke pembagian kandungan tumbuhan berdasarkan taksa tumbuhan. Dengan kata lain, isi kandungan tumbuhan dianggap sebagai tanda bagi evolusi dan klasifikasi tumbuhan.
4. Klasifikasi berdasarkan Biogenesis
Biogenesis dan biosintesis memiliki arti yang sama dan sering kali digunakan tanpa perbedaan. Namun, istilah biogenesis biasanya digunakan untuk reaksi pembentukan yang masih dalam taraf hipotesis, sedangkan jika reaksi tersebut telah dibuktikan secara eksperimen, digunakan istilah biosintesis.
Berbagai teori tentang pembentukan senyawa metabolit primer dan metabolit sekunder telah dikemukakan di dalam berbagai publikasi. Diawali dengan teori aturan isoprena pada tahun 1930, yang menyatakan bahwa semua terpenoid dibentuk dari unit isoprena 5-C, dilanjutkan dengan teori poliketometilena untuk senyawa fenolik, yang merupakan saran pertama bagi biosintesis asetogenin (poliketida).
Komponen pembangun utama untuk atom-atom karbon dan nitrogen di dalam semua senyawa bahan alam berasal dari 5 kelompok prekursor seperti terlihat pada Gambar 2.1 dibawah ini :
Asetil ko-A
Malonil ko-A unit 2C(Me-C
O
) poliketida (asetogenin)
a.
b. asam sikimat unit 6C-3C (6C-1C atau 6C-2C) senyawa fenolik
c. asam mevalonat unit prenil isoprenoid
CH2=C-CH2-CH2
Me
d. unit asam amino seperti fenilanalina, tirosina, ornitina, lisina, dan triptofan
alkaloid
e. 5-5'-deoksiadenilmetionina unit 1C
Gambar 2.1 Kelompok Prekursor pembangun Utama semua Senyawa BahanAlam (Wiryowidagdo, 2008).
2.3 Metabolit Sekunder
2.4Senyawa Flavonoida
Senyawa flavonoida diturunkan dari unit C6-C3 (fenil propana) yang bersumber dari asam sikimat (via fenilalanin) dari unit C6 yang diturunkan dari jalur poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA yang bergabung dengan unit C6-C3 sebagai KoA tioester untuk membentuk unit awal triketida.Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan yang terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida.Unit awal triketida mengalami siklisasi oleh enzim kalkon sintase untuk membentuk gugus kalkon pada flavonoid.Kemudian terjadi siklus untuk menghasilkan cincin piranon yang mengandung inti flavanon, yang dapat memiliki ikatan C2-C3 teroksidasi (tidak jenuh) untuk menghasilkan gugus flavon, atau dihidroksilasi pada posisi C3 cincin piranon untuk menghasilkan gugus flavanol pada flavonoid.
Sistem penomoran untuk turunan senyawa flavonoid menurut Robinson, dapat dilihat pada Gambar 2.2 berikut :
O
Gambar 2.2 Sistem penomoran pada Flavonoid (Robinson, 1995)
Senyawa flavonoid sangat bermanfaat dalam makanan karena berupa senyawa fenolik, senyawa ini yang bersifat antioksidan kuat. Banyak kondisi penyakit yang diketahui bertambah parah oleh adanya radikal bebas seperti superoksida dan hidroksil, dan flavonoid memiliki kemampuan untuk menghilangkan dan secara efektif menyapu spesies pengoksidasi yang merusak itu. Oleh karena itu, makanan yang kaya akan flavonoid dianggap penting untuk mengobati penyakit (Heinrich et al, 2009).
2.4.1Biosintesis Flavonoida
adalah senyawa 1,2 diarilpropana, sedang senyawa-senyawa neoflavonoida adalah senyawa 1,1 diarilpropana.
Senyawa flavonoida diturunkan dari unit C6-C3 (fenil propana) yang bersumber dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur poliketida.Fragmen poliketida ini disusun dari tiga molekul malonil-KoA yang bergabung dengan unit C6-C3 (sebagai KoA tioester) untuk membentuk unit awal triketida.Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida (Heinrich et al, 2009).
Semua varian flavonoida saling berkaitan karena alur biosintesis yang sama yang melalui alur sikimat dan alur asetat-malonat. Flavonoida yang pertama kali terbentuk pada biosintesis adalah khalkon dan semua bentuk diturunkan darinya melalui berbagai alur. Modifikasi flavonoida lebih lanjut mungkin terjadi pada berbagai tahap dan menghasilkan: penambahan (atau pengurangan) hidroksilasi, metilasi gugus hidroksil atau inti flavonoida, metilenasi gugus orto-dihidroksil, dimerisasi (pembentukan biflavonoida), dan glikosilasi gugus hidroksil (pembentukan flavonoida O-glikosida) atau inti flavonoida (pembentukan flavonoida C-glikosida).
Jalur Biosintesa hubungan antara jenis monomer flavonoida dari alur asetat-malonat dan alur sikimat dapat dilat pada Gambar 2.3 berikut :
2.4.2 Klasifikasi Senyawa Flavonoida
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida (Harborne, 1987).
Dalam tumbuhan, flavonoid terdapat dalam berbagai bentuk struktur. Keragaman struktur flavonoid ini disebabkan karena perbedaan tahap modifikasi dari struktur dasar flavonoid, antara lain :
1. Flavonoida O-glikosida
Pada flavonoida O-glikosida (Gambar 2.4) yang biasanya terdapat pada flavonoid, dimana satu gugus hidroksil flavonoida atau lebih terikat pada satu gula (lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikolisasi menyebabkan flavonoida menjadai kurang reatif dan lebih mudah larut dalam air, sifat ini memungkinkan penyimpanan flavonoid di dalam vakuola sel. Walaupun gugus hidroksil pada setiap posisi dalam inti flavonoid dapat di glikosilasi, kenyataannya hidroksil pada tempat tertentu mempunyai peluang yang lebih besar untuk terglikosilasi ketimbang tempat-tempat lain. Sudah diakui bahwa dalam tumbuhan O-glikosilasi dan metilasi terjadi sebagai salah satu tahap akhir pada biosintesis dan katalisasi oleh enzim yang sangat khas. Ada kalanya glikosida mengalami modifikasi lebih lanjut, yaitu asilasi. Glikosida terasilasi mempunyai satu gugus hidroksil gula yang berkaitan dengan asam asetat atau asam ferulat.
O
2. Flavonoida C-glikosida
Gula terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon tahan asam jika disbanding dengan O-glikosida. Glikosida yang demikian disebut C-glikosida (Gambar 2.5). Gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoida. Jenis glukosa yang pada umumnya dan galaktosa menjadi bagiannya juga ramnosa, xilosa, dan arabinosa. Jadi walaupun isoflavon, flavanon, dan flavonol kadang-kadang terdapat dalam bentuk C-glikosida, sebegitu jauh hanya flavon C-glikosida yang paling lazim ditemukan.
O
Gambar 2.5 Flavonoid-C-glikosida (Markham, 1988). 3. Flavonoida Sulfat
Senyawa ini mengandung satu ion sulfat atau lebih yang terikat pada hidroksi fenol atau gula. Senyawa ini sebenarnya bisulfat karena terdapat sebagai garam, yaitu flavon-O-SO3K. Banyak yang berupa glikosida bisulfat, bagian bisulfat terikat pada hidroksil fenol yang mana saja masih bebas atau pada gula.
4. Biflavonoid
O
Gambar 2.6 Biflavonoid (Markham, 1988). 5. Aglikon flavonoid yang aktif-optik
Sejumlah aglikon flavonoid (Gambar 2.7) mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonoida ini adalah flavanon, dihidroflavonol, katekin, rotenoid, dan beberapa biflavonoid. Putaran aglikon flavonoid alam berkaitan dengan stereokimia mutlak flavonoid.
O
Gambar 2.7 Aglikon flavonoid yang aktif-optik (Markham, 1988).
Robinson (1995), mengelompokkan flavonoid beradasarkan keragaman pada rantai C3 yaitu :
1. Flavanon
Flavanon (Gambar 2.8) terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk, dua glikosida yang paling lazim adalahneringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O O
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon (Gambar 2.9) dianggap sebagai induk dalam nomenklatur
kelompok senyawa flavonoida
Gambar 2.9 Flavon 3. Flavonol
Flavonol (Gambar 2.10)paling sering terdapat terdapat sebagai glikosida, biasanya 3-glikosida, dan aglikon flavonoid yang umum yaitu kamferol, kuersetin, dan mirisetin yang berkhasiat sebagai antioksidan dan antiinflamasi.
O O
Gambar 2.10 Flavonol 4. Isoflavon
Merupakan isomer flavon, jumlahnya sangat sedikit dan sebagai fitoaleksin (senyawa pelindung) yang terbentuk dalam tumbuhan untuk pertahanan terhadap penyakit. Isoflavon (Gambar 2.11) sukar dicirikan karena reaksinya tidak khas dengan pereaksi manapun.
O O
Gambar 2.11 Isoflavon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar flavanonol (Gambar 2.12) ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
O O
OH
Gambar 2.12 Flavanonol 6. Kalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat tua dengan sinar UV bila dikromatografi kertas.Aglikon khalkon dapat dibedakan dari glikosidanya karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air.Struktur kalkon dapat dilihat pada gambar 2.13.
O
Gambar 2.13 Kalkon 7. Auron
O
CH
O
Gambar 2.14 Auron 8. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu.Katekin (Gambar 2.15) dan proantosianidin adalah dua golongan senyawa yang mempunyai banyak kesamaan dengan semua senyawa tanpa warna.
Gambar 2.15 Katekin
9. Antosianin
Antosianin adalah pigmen pada daun, bunga dan batang tanaman yang memiliki banyak warna biru, lembayung, violet, dan semua yang mendekati warna merah. Antosianin (Gambar 2.16) terdapat juga dalam bagian lain tumbuhan tinggi kecuali fungus. Antosianin selalu terdapat dalam bentuk glikosida. Faktor-faktor yang mempengaruhi warna dari antosianin yaitu pH, logam dalam bentuk kompleks dan juga tanin.
O
OH
+
Gambar 2.16 Antosianin 10.Leukoantosianidin
O
Gambar 2.17 Leukoantosianidin
2.4.3 Sifat Kelarutan Flavonoida
Senyawa flavonoid termasuk senyawa polar, karena mempunyai sejumlah gugus hidroksil ataupun suatu gugus gula.Hal ini memungkinkan flavonoid dapat larut dalam pelarut polar seperti etanol (EtOH), metanol (MeOH), butanol, aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain.Flavonoid yang berupa aglikon merupakan golongan polifenol yang memiliki sifat senyawa fenol yaitu bersifat agak asam, Keberadaan gugus gula yang terikat pada flavonoid (glikosida) cenderung menyebabkan flavonoid lebih mudah terlarut dalam air.Namun hal sebaliknya tidak berlaku pada aglikon yang kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.5 Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang biasa digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak sampel dan beberapa tetes HCl pekat, warna orange, pink, merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan 2,3-dihidro dan xanton dan hanya flavanonol yang memberikan perubahan warna merah pekat sampai magenta, flavanon dan flavonol akan memberi warna merah muda yang lemah sampai magenta.
kebiru-biruan. Flavanon memberikan warna orange sampai merah (Cannell, 1998).
3. NaOH 10% , menghasilkan larutan biru violet
4. FeCl3 5%, menghasilkan warna kehijauan, warna biru, dan warna hitam-biru (Robinson, 1995).
2.6Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam satu golongan (Muldja, 1995).
2.6.1 Ekstraksi
Terdapat sejumlah metode ekstraksi, yang paling sederhana adalah ekstraksi dingin (dalam labu besar berisi biomassa), dengan cara ini bahan kering hasil gilingan diekstraksi pada suhu kamar secara berturut-turut dengan pelarut yang kepolarannya makin tinggi. Keuntungan utama cara ini adalah merupakan metode ekstraksi yang mudah karena ekstrak tidak dipanaskan sehingga kemungkinan kecil bahan alam terurai. Penggunaan pelarut dengan peningkatan kepolaran secara berurutan memungkinkan pemisahan bahan alam berdasarkan kelarutannya (dan polaritasnya) dalam ektraksi. Ekstraksi dingin memungkinkan banyak senyawa terekstraksi, meskipun beberapa senyawa memiliki kelarutan terbatas dalam pelarut ekstraksi pada suhu kamar (Heinrich et al, 2009).
proses akhir pelarut akan berdifusi keluat dari sel bersama dengan metabolit (Sarker, 2007).
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1996).
2.6.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak digunakan sebagai tahap awal pemurnian ekstrak.Partisi menggunakan dua pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat.
Partisi biasanya dilakukan melalui dua tahap:
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di lapisan organik
2. Air/diklorometan atau air/kloroform atau air/etil asetat untuk membuat fraksi agak polar di lapisan organik. Ini merupakan metode pemisahan yang mudah dan mengandalkan kelarutan bahan alam dan bukan interaksi fisik dengan medium lain (Heinrich et al, 2009).
2.6.3 Hidrolisa
2.6.4 Kromatografi
Saat ini kromatografi adalah teknik pemisahan yang paling umum dan sering digunakan dalam bidang kimia analisis dan dimanfaatkan untuk analisis baik secara kualitatif dan kuantitatif atau bahkan analisis preparatif. Teknik kromatografi telah berkembang dan digunakan untuk memisahkan dan mengkuantifikasi komponen-komponen yang kompleks, baik organik maupun anorganik (Sudjadi, 2007).
Kromatografi adalah suatu teknik pemisahan yang pertama kali dipakai untuk memisahkan zat-zat warna tanaman.Pemisahan dengan teknik ini dijalankan dengan mengadakan manipulasi atas dasar perbedaan sifat-sifat fisik dari zat-zat yang menyusun suatu campuran (Adnan, 1997).
Semua teknik kromatografi pada dasarnya menggunakan dua fasa, yaitu fasa tetap dan fasa bergerak. Pemisahan tergantung pada gerakan relatif dari kedua fasa tersebut. Kromatografi dapat digolongkan sesuai dengan sifat dari fasa tetap, jika berupa zat padat dikenal sebagai kromatografi serapan (absorption chromatography) dan jika berupa zat cair dikenal sebagai kromatografi partisi (partition chromatography) (Sastrohamidjojo, 1985).
Proses Sorpsi
Sorpsi merupakan proses pemindahan solut dari fasa gerak ke fasa diam, sedangkan proses sebaliknya pemindahan solut dari fasa diam ke fasa gerak disebut desorpsi. Keduanya terjadi secara terus-menerus selama pemisahan karena sistem kromatografi berada dalam keadaan kesetimbangan dinamis. Solut akan terdistribusi diantara dua fasa yang sesuai dengan perbandingan distribusinya untuk menjaga keadaan yang setimbang. Beberapa mekanisme yang terlibat pada proses sorpsi yaitu adsorpsi, partisi, pertukaran ion, dan eksklusi ukuran.
Adsorben
Adanya air dari atmosfer yang diserap oleh permukaan silika gel mampu mendeaktifkan permukaannya karena air akan menutup sisi aktif silika gel. Hal ini dapat diatasi dengan memanaskan pada suhu 1050C, meskipun demikian reprodusibilitasnya sulit dicapai kecuali jika suhu dan kelembapan benar-benar dijaga secara hati-hati. Semakin polar solut maka akan semakin tertahan kuat ke dalam adsorben silika gel ini (Sudjadi, 2007).
2.6.4.1 Kromatografi Lapis Tipis
Dalam kromatografi lapis tipis, fase diamnya merupakan penjerap berukuran kecil dengan diameter partikel antara 10-30µm. Semakin kecil ukuran partikel fase diam, maka semakin baik kinerja efisiensi dan resolusi kromatografi lapis tipis. Penjerap yang sering digunakan adalah silika dan serbuk selulosa, sementara mekanisme sorpsi yang utama pada KLT adalah partisi dan adsorbsi. Fase gerak yang dikenal sebagai pelarut pengembangakan bergerak sepanjang fase diam akibat adanya pengaruh kapiler pada pengembangan secara menaik (ascending) ataupun pengaruh gravitasi pada pengembangan secara menurun (descending) (Sudjadi, 2007).
2.6.4.2Kromatografi Kolom
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penjerap yang berada dalam tabung kaca. Pelarut sebagai fasa gerak dibiarkan mengalir melalui kolom. Pita senyawa pelarut bergerakmelalui kolom dengan laju berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari alas kolom (Gritter, 1991).
2.6.5 Kristalisasi
Kristalisai adalah pengendapan kristal dari larutan yang terbuat dari bhan tertentu. Selama proses pembentukan kristal, molekul akan cenderung menjadi melekat kristal tumbuh terdiri dari jenis yang sama molekul karena cocok dalam kisi kristal untuk molekul struktur yang sama daripada molekul yang lain. Jika proses kristalisasi diperbolehkan untuk terjadi dalam mendekati kondisi kesetimbangan, preferensi molekul untuk deposit pada permukaan terdiri dari molekul seperti akan menyebabkan peningkatan dalam kemurnian bahan kristal. Sehingga proses rekristalisasi adalah salah satu metode yang paling penting tersedia bagi ahli kimia untuk pemurnian padatan (Pasto, 1992).
2.6.5.1 Rekristalisasi
Amorf yang diperoleh dari hasil isolasi dilarutkan kembali dengan EtOAc, diaduk hingga semua amorf larut sempurna.Kemudian ditambahkan n – heksana secara perlahan – lahan hingga pembentukan kembali senyawa yang lebih murni dari sebelumnya dan jatuh di dasar wadah.Didekantasi larutan bagian atas wadah. Lalu diuapkan sisa pelarut dari amorf hingga diperoleh kristal yang benar – benar bebas dari pelarut (Jacobs, 1974).
2.7 Teknik Spektroskopi
Teknik analisis spektroskopi berasaskan antaraksi radiasi elektromagnet dengan komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai parameter analisis. Pada spektroskopi pembangkit sinyal adalah hasil antaraksi energi radiasi elektromagnet dengan elektron dalam atom/molekul analit.
Teknik analisis spektroskopi berasaskan antaraksi radiasi elektromagnet dengan komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai parameter analisis. Karena pada setiap teknik spektroskopi antaraksi radiasi elektromagnet dengan komponen atom/ molekul khas dan tidak semuanya sama, uraian teknik analisis didahului dengan mekanisme antaraksi tersebut, serta fenomena yang dipakai sebagai parameter analisisnya (Satiadarma , 1995).
2.7.1 Spektroskopi Ultraviolet (UV-Vis)
Spektrofotometer UV-Vis merupakan pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel.Spektrofotometer UV-Vis umumnya digunakan untuk menentukan jenis kromofor, ikatan rangkap terkonjugasi, serta menganalisis senyawa organik secara kuantitatif dengan menggunakan hukum Lambert-Beer (Dachriyanus, 2004).
Penyerapan sinar ultraviolet dan tampak oleh suatu molekul organik akan menghasilkan transisi diantara tingkat energi elektronik pada molekul tersebut, dan karenanya sering dinamakan spektrometri elektronik. Panjang gelombang serapan merupakan ukuran perbedaan tingkatan-tingkatan energi transisi elektronik dari orbital tersebut.
Ciri spektrum khas spektrumialah kekuatan nisbi yang rendah pada pita I dalam dihidroflavon, dihidroflavonol, dan isoflavon serta kedudukan pita I pada spektrum kalkon, auron, dan antosianin yang terdapat pada panjang gelombang yang tinggi. Ciri ini nisbi tak berubah bahkan juga bila pola oksigenasi berubah, sekalipun rentang maksimal serapan pada jenis flavonoid yang berlainan tumpang tindih sebagai keragaman pola oksigenasi.
Petunjuk mengenai rentang maksima utama yang diperkirakan untuk setiap jenis flavonoid yang disajikan pada tabel 2.1 (Markam,1988) dibawah :
Tabel 2.1 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida
No Pita II (nm) Pita I (nm) Jenis Flavonoida
1 250-280 310-350 Flavon
2 250-280 330-360 Flavonol (3-OH tersubstitusi)
3 250-280 350-385 Flavonol (3-OH bebas)
4 245-274 310-330 bahu Isoflavon
5 275-295 300-330 bahu Flavanon dan dihidroflavonol
6 230-270
(kekuatan rendah)
340-390 Khalkon
7 230-270
(kekuatan rendah)
380-430 Auron
Perubahan penyulihan pada cincin A cenderung tercerminkan pada serapan pita II, sedangkan perubahan penyulihan pada cincin B dan C cenderung lebih jelas tercermin pada serapan pita I.
2.7.2Spektroskopi Inframerah(FT-IR)
Spektrofotometer inframerah umumnya digunakan untuk menentukan gugus fungsi senyawa organik dan mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya.
Pengukuran spektrum inframerah dilakukan pada daerah cahaya tengah (mid-infrared) yaitu pada panjang gelombang 2.5 – 50µm atau bilangan gelombang 4000 – 200 cm-1. Sehingga energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Setiap jenis ikatan kimia dan gugus fungsi memiliki pita absorbsi inframerah yang khas dan spesifik.
Karakteristik frekuensi vibrasi IR dipengaruhi oleh perubahan yang sangat kecil pada molekul sehingga sulit untuk menentukan struktur yang hanya berdasarkan pada data IR saja. Spektrum IR berguna untuk mengidentifikasi suatu senyawa dengan membandingkannya dengan spektrum senyawa standar terutama pada daerah sidik jari. Secara praktikal, spektrum IR hanya dapat digunakan untuk menentukan gugus fungsi (Dachriyanus, 2004).
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul, antara lain:
1. Streching (vibrasi regang/ulur) : vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
2. Bending (vibrasi lentur/tekuk) : vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan.
Oleh karena itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Contohnya, ikatan O-H menyerap energi pada frekuensi 3330 cm -1
panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang berlainan ini disebut cara vibrasi fundamental (Supratman, 2010).
2.7.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometer resonansi magnetik inti (Nuclear Magnetic Resonance), yang disingkat sebagai NMR, merupakan instrumen yang sangat penting untuk memperoleh informasi senyawa kimia, juga dapat menyelesaikan dan memecahkan masalah atau informasi yang sebelumnya sulit untuk diperoleh.
NMR mempunyai peranan penting dalam ilmu kimia, disebabkan oleh dua faktor. Pertama, penerapan NMR yang terbaru dimana hasil peningkatan selama beberapa tahun terakhir. Kedua, spektrometer NMR merupakan instrumen yang tersedia di pasaran berkembang terus, dan memenuhi standar sensitivitas, fleksibilitas, efisiensi, kecanggihan komputasi, dan harga yang sesuai dipasaran (Jenie, 2014).
Pada tahap ini akan ditunjukkan jumlah atom hidrogen yang berhubungan dengan gugus tertentu (integrasi) dan bagaimana gugus tersebut terlindungi (shielded) atau tidak terlindungi. Ada perlindungan atau tidak terjadi akibat adanya gugus menarik elektron atau menarik elektron (Supratman, 2010).
BAB 1
PENDAHULUAN
1.1Latar Belakang
Senyawa fenol atau polifenol merupakan zat pada tumbuhan yang memiliki cincin aromatik dengan satu atau lebih gugus hidroksil.Sebagian besar senyawa fenolik larut dalam air. Senyawa ini secara alami berikatan dengan gula dalam bentuk glikosida dan ditemukan didalam vakuola tanaman. Di alam terdapat sekitar 8000 jenis tanaman yang mengandung senyawa fenol dan setengahnya adalah flavonoid. Flavonoid memiliki struktur yang hampir sama, sesuai dengan atom C15dari inti heterosiklik dari flavon jika disamakan dengan bentuk utama dari fenolik seperti metoksi maupun sustituen lainnya (Harborne, 1993).
Efek flavonoid terhadap macam-macam organisme sangat banyak macamnya dan dapat menjelaskan mengapa tumbuhan yang mengandung flavonoid dipakai dalam pengobatan tradisional.Aktivitas antioksidannya mungkin dapat menjelaskan mengapa flavonoid tertentu merupakan komponen aktif tumbuhan yang digunakan secara tradisional untuk mengobati gangguan fungsi hati (Robinson, 1995).
Hampir semua flavonoid merupakan senyawa yang berwarna kuning dan tersebar pada warna bunga dan buah-buahan (Sarker, 2007). Senyawa flavonoid diduga sangat bermanfaat dalam makanan karena berupa senyawa fenolik, senyawa ini yang bersifat antioksidan kuat. Oleh karena itu, makanan yang kaya flavonoid dianggap penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung (Heinrich, 2010).
Indonesia sampai India (Heim, 2015).Tanaman ini telah dimanfaatkan untuk mengobati penyakit seperti wasir dan pendarahan pada luka (Hidayat, 2013).
Huang Chai et al, (2010)menyatakan bahwa buah dan biji dari tumbuhan senduduk merah (Melastoma sanguineum Sims) mempunyai kemampuan sebagai antioksidan, total karotenoid dan total fenolik. Pada biji yaitu 189.8 mmol/100 g DW untuk antioksidan, 13.4 g/100 g DW untuk total fenolik, dan 22.3 µ mol/g DW untuk total karotenoid.Sementara pada buah yaitu 120.4 mmol/100 g DW untuk antioksidan dan 19.7 µ mol/g DW untuk total karotenoid.
Dari uraian di atas dan berdasarkan literatur mengenai kandungan kimia yang terdapat pada daun tumbuhan senduduk merah , maka peneliti tertarik untuk melakukan penelitian terhadap daun tumbuhan senduduk merah (Melastoma sanguineum Sims) khususnya mengenai senyawa flavonoida yang terkandung di dalamnya dan golongannya.
Dari uji pendahuluan yang peneliti lakukan dengan uji skrining fitokimia menunjukkan bahwa ekstrak metanol dan etil asetat daun tumbuhan senduduk merah mengandung senyawa flavonoida.
1.2Permasalahan
Permasalahan dalam penelitian ini adalah untuk mengetahui golongan flavonoida yang terkandung dalam daun tumbuhan senduduk merah (Melastoma sanguineum Sims).
1.3 Tujuan Penelitian
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya tentang golongan senyawa flavonoida yang terkandung dalam daun tumbuhan senduduk merah(Melastoma sanguineum Sims).
1.5Lokasi Penelitian
1. Tempat pengambilan sampel
Sampel yang digunakan diperoleh dari Lau Debuk debuk, Desa Semangat Gunung, Berastagi, Kabupaten Karo, Sumatera Utara.
2. Tempat melakukan penelitian
Penelitian dilakukan di laboratorium Kimia Bahan Alam Hayati, Departemen Kimia FMIPA-USU, Medan
3. Lokasi Identifikasi Senyawa
Analisis Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR),Analisa Spektrofotometer Inframerah (FT-IR) dilakukan di pusat penelitian Kimia-LIPI, kawasan PUSPIPTEK Serpong, Tangerang dan analisa spektrofotometer UV-Visible dilakukan di Laboratorium Kimia Organik Bahan AlamInstitut Teknologi Bandung (ITB), Bandung, Jawa Barat.
1.6Metodologi Penelitian
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHANSENDUDUK
MERAH(Melastoma sanguineum Sims)
ABSTRAK
Isolasisenyawa flavonoida yang terkandung di dalam daun tumbuhan senduduk merah (Melastoma sanguineum Sims) dilakukan dengan cara ekstraksi maserasidenganpelarutmetanol. Ekstrak metanol dipekatkan lalu dilarutkan dengan etil asetat kemudian disaring dan diuapkan hingga seluruh etil asetat menguap. Ekstrak pekat etil asetat yang diperoleh dilarutkan dengan metanol dan diekstraksi partisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 6% dan selanjutnya diekstraksi partisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan eluen n-heksana : etil asetat 90:10; 80:20; 70:30; 60:40 (v/v).Fraksi dari perbandingan (70:30) v/v selanjutnya dikristalisasi untuk mendapatkan senyawa murni.Senyawa murni yang diperoleh dari hasil isolasi berbentuk pasta berwarna kuning kecoklatan dengan massa= 4,4 mg dengan harga Rf= 0,25. Selanjutnya senyawa yang diperoleh dianalisis dengan Spektrofotometer UV-Visible, Inframerah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR). Dari hasil identifikasi data spektrofotometer diindikasikan senyawa hasil isolasi adalah senyawa flavonoida golongan flavonol.
ISOLATION OF FLAVONOID COMPOUNDS FROM THE LEAVES
OFSENDUDUK MERAH PLANTS (Melastoma sanguineum Sims)
ABSTRACT
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
SENDUDUK MERAH (Melastoma sanguineum Sims)
SKRIPSI
DEBBY EUNIKE MAGDALENA
120802077
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN SENDUDUK MERAH
(Melastoma sanguineum Sims)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DEBBY EUNIKE MAGDALENA 120802077
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul :Isolasi Senyawa Flavonoida Dari Daun Tumbuhan Senduduk Merah (Melastoma sanguineum Sims)
Kategori : Skripsi
Nama Mahasiswa : Debby Eunike Magdalena Nomor Induk Mahasiswa : 120802077
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas :Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara
Disetujui di
Medan, September2016
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Prof. Dr. Tonel Barus Drs. Albert Pasaribu, M.Sc NIP: 1945 0801 1974 121001 NIP: 1964 0810 1991 031002
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUNTUMBUHAN SENDUDUK MERAH(
Melastoma sanguineum
Sims
)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2016
PENGHARGAAN
Puji syukur penulis panjatkan kehadiran Tuhan Yang Maha Esa atas berkat dan karunia yang begitu luar biasa karena melalui penyertaanNya skripsi ini dapat diselesaikan dalam waktu yang indah yang telah ditetapkanNya.
Ucapan terima kasih secara khusus penulis sampaikan dengan segala kerendahan hati kepada kedua orang tua penulis, Papa tercinta S. Simanullang SE, Mama terkasih R.E Siagian, SH atas doa, dukungan dan perhatian kepada penulis sejak mula terlahir ke dunia sampai pada seorang Sarjana dan sampai selama-lamanya, serta adik tersayang Theofilus Hans Juliher, atas bantuan, dukungan dan doa kepada penulis. Penulis juga menyadari bahwa skripsi ini tidak akan selesai tanpa adanya bantuan dari berbagai pihak, maka penulis mengucapkan terima kasih yang luar biasa kepada:
1. Bapak Drs. Albert Pasaribu, M.Scselaku pembimbing I sekaligus Sekretaris Departemen Kimia FMIPA USU dan Bapak Prof. Dr. Tonel Barus selaku dosen pembimbing II yang telah banyak membimbing, mengajari dan memotivasi penulis selama melakukan penelitian dan penulisan skripsi.
2. Ibu Dr. Rumondang Bulan Nasution, M.S selaku Ketua Departemen Kimia FMIPA USU, serta kepada Bapak Dr. Hamonangan Nainggolan, M.Sc selaku dosen PA penulis dan kepada semua staf pengajar di Kimia FMIPA USU. 3. Kepala Laboratorium Bapak Lamek Marpaung, M.Phil, Ph.D atas bantuan,
kepercayaan dan kerja samaselama saya menjadi asisten dan kepada seluruh asisten Laboratorium Kimia Bahan Alam Hayati (Bangcin, Geo, Pochan, Nangin, Jedong, Ronal, Ferdinand, Wita, dan Yuni).
4. Kepada Sahabat-sahabatku DeLoDieRo (Gloria, Rohma, DieAve, dan Kak Togi).
5. Seluruh teman-teman saya stambuk 2012 beserta adik-adik stambuk 2013, 2014 dan 2015 terimakasih atas dukungannya.
6. Kepada seluruh keluarga besar penulis yang selalu memotivasi, membantu serta mendoakan penulis.
Kiranya Tuhan selalu memberikan perlindungan dan kasih sayang kepada kita. Tuhan memberkati kita semua.
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHANSENDUDUK
MERAH(Melastoma sanguineum Sims)
ABSTRAK
Isolasisenyawa flavonoida yang terkandung di dalam daun tumbuhan senduduk merah (Melastoma sanguineum Sims) dilakukan dengan cara ekstraksi maserasidenganpelarutmetanol. Ekstrak metanol dipekatkan lalu dilarutkan dengan etil asetat kemudian disaring dan diuapkan hingga seluruh etil asetat menguap. Ekstrak pekat etil asetat yang diperoleh dilarutkan dengan metanol dan diekstraksi partisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 6% dan selanjutnya diekstraksi partisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan eluen n-heksana : etil asetat 90:10; 80:20; 70:30; 60:40 (v/v).Fraksi dari perbandingan (70:30) v/v selanjutnya dikristalisasi untuk mendapatkan senyawa murni.Senyawa murni yang diperoleh dari hasil isolasi berbentuk pasta berwarna kuning kecoklatan dengan massa= 4,4 mg dengan harga Rf= 0,25. Selanjutnya senyawa yang diperoleh dianalisis dengan Spektrofotometer UV-Visible, Inframerah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR). Dari hasil identifikasi data spektrofotometer diindikasikan senyawa hasil isolasi adalah senyawa flavonoida golongan flavonol.
ISOLATION OF FLAVONOID COMPOUNDS FROM THE LEAVES
OFSENDUDUK MERAH PLANTS (Melastoma sanguineum Sims)
ABSTRACT
DAFTAR ISI
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
Bab 1 PENDAHULUAN 1.1 Latar Belakang 1.2 Permasalahan 1.3 Tujuan Penelitian 1.4 Manfaat Penelitian 1.5 Lokasi Penelitian 1.6 Metodologi Penelitian
1 Bab 2 TINJAUAN PUSTAKA
2.1 Tumbuhan Senduduk Merah
1.1.1 Sistematika Tumbuhan Senduduk Merah 1.1.2 Morfologi dan Manfaat Tumbuhan 2.2 Senyawa Organik Bahan Alam
2.3 Metabolit Sekunder 2.4 Senyawa Flavonoida
2.4.1 Biosintesis Flavonoida
2.4.2 Klasifikasi Senyawa Flavonoida 2.4.3 Sifat Kelarutan Flavonoida 2.5 Skrining Fitokimia
2.6 Teknik Pemisahan 2.6.1 Ekstraksi 2.6.2 Partisi 2.6.3 Hidrolisa 2.6.4 Kromatografi
2.6.4.1 Kromatografi Lapis Tipis 2.6.4.2 Kromatografi Kolom 2.6.5 Kristalisasi
2.6.5.1 Rekristalisasi 2.7 Teknik Spektroskopi
Bab 3 METODE PENELITIAN 3.1 Alat-alat
3.2 Bahan-bahan 3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun Tumbuhan Senduduk Merah
3.3.3 Ekstraksi Daun Tumbuhan Senduduk Merah 3.3.4 Analisis Kromatografi Lapis Tipis
3.3.5 Isolasi Senyawa Flavonoida dengan KromatografiKolom
3.3.6 Pemurnian
3.3.7 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
3.3.8 Identifikasi Senyawa Hasil Isolasi
3.3.8.1iIdentifikasi dengan Spektrofotometer UV-Visible
3.3.8.2Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
3.3.8.3Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR)
3.4 Bagan Uji Flavonoida
3.4.1 Maserasi dengan menggunakan pelarut metanol 3.4.2 Maserasi dengan menggunakan pelarut etil asetat
3.5 Bagan Penelitian
31
Bab 4 HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian
4.2 Pembahasan
41 41 46 Bab 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 5.2 Saran
49 49 49
DAFTAR PUSTAKA 50
DAFTAR TABEL
Nomor Tabel
Judul Halaman
2.1 Rentangan Serapan Spektrum UV-Visible golongan
Flavonoida 28
4.1 Serapan panjang gelombang Ultraviolet-Visible
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Kelompok prekursor pembangun utama senyawa bahan alam 9 2.2 Sistem penomoran pada Flavonoida 10
2.3 Biosintesis Flavonoida 12
2.4 Flavonoid-O-Glikosida 13
2.5 Flavonoid-C-Glikosida 14
2.6 Biflavonoid 15
2.7 Aglikon flavonoid yang aktif-optik 15
2.8 Flavanon 16
2.9 Flavon 16
2.10 Flavonol 17
2.11 Isoflavon 17
2.12 Flavanonol 18
2.13 Kalkon 18
2.14 Auron 19
2.15 Katekin 19
2.16 Antosianin 20
2.17 Leukoantosianidin 20
4.1 Spektrum Ultraviolet-Visible (UV-Vis) Senyawa Hasil Isolasi
41
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1 Gambar daun tumbuhan Senduduk Merah
(Melastoma sanguineum Sims) 53
2 Hasil Determinasi daun tumbuhan Senduduk Merah
(Melastoma sanguineum Sims) 54
3 Kromatogram Lapisan Tipis Ekstrak Pekat Kloroform daun tumbuhan Senduduk Merah (Melastoma sanguineum Sims) sebelum
Kromatografi Kolom 55
4 Kromatografi Lapis Tipis ekstrak daun tumbuhan Senduduk Merah (Melastoma sanguineum Sims)
setelah penggabungan fraksi 56 5 Kromatografi Lapis Tipis Setelah Kromatografi Kolom
yang Kedua
57
6 Kromatografi Lapis TipisSenyawa Murni Hasil Isolasi 58 7 Spektrum Ultraviolet-Visible beberapa senyawa Flavonoida 59 8 Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi
pada δ=0-16,0 ppm 60
9 Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi
pada δ=6,8-7,5 ppm 61
10 Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi
pada δ=3,0-7,0 ppm 62