ISOLASI DAN KARAKTERISASI KOLAGEN DARI KULIT
IKAN BUNTAL PISANG (
Tetraodon lunaris
)
FIQI FAISAL
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Karakterisasi Kolagen dari Kulit Ikan Buntal Pisang (Tetraodon lunaris) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Fiqi Faisal
ABSTRAK
FIQI FAISAL. Isolasi dan Karakterisasi Kolagen dari Kulit Ikan Buntal Pisang (Tetraodon lunaris). Dibimbing oleh BUSTAMI IBRAHIM dan PIPIH SUPTIJAH.
Kolagen merupakan salah satu jenis protein yang banyak terkandung dalam tubuh hewan dengan proporsi sekitar 30% dari total protein dalam tubuh secara keseluruhan. Pemanfaatan limbah kulit ikan buntal pisang menjadi kolagen adalah salah satu alternatif untuk meningkatkan nilai jual limbah. Tujuan penelitian ini adalah untuk mengisolasi dan mengkarakterisasi kolagen yang berasal dari kulit ikan buntal pisang. Pretreatment yang digunakan yaitu perbedaan konsentrasi NaOH (0,05; 0,1; dan 0,2 M) dan lama waktu perendaman (2, 4, 6, dan 8 jam).
Pretreatment terbaik yang didapatkan yaitu konsentrasi NaOH sebesar 0,1 M dengan lama peredaman 6 jam karena dapat menghilangkan protein non-kolagen secara maksimum dengan nilai protein terlarut paling kecil yaitu 0,142 mg/ml. Rendemen kolagen yang dihasilkan yaitu 8,65%. Kolagen memiliki nilai pH 5,49 dan kelarutan 79%. Analisis spektra Fourier transform infrared (FTIR) menunjukkan wilayah penyerapan utama amida A, B, I, II, dan III masing-masing pada 3310, 2935, 1651, 1551, dan 1242 cm-1. Spektroskopi FTIR menunjukkan
bahwa molekul kolagen memiliki struktur heliks tiga yang kompak stabil oleh ikatan hidrogen.
Kata kunci: FTIR, ikan buntal, kolagen, NaOH,rendemen.
ABSTRACT
FIQI FAISAL. Isolation and Characterization Collagen from Skin of Puffer Fish (Tetraodon lunaris). Supervised by BUSTAMI IBRAHIM and PIPIH SUPTIJAH.
Collagen is one type of proteins in the animal’s body with proportion about 30% of total whole body proteins. Utilization of waste from puffer fish skin to produce collagen is one alternative to increase its market value. The purpose of the research was to isolate and to characterize collagen from skin of puffer fish. Pretreatment was used different concentration of NaOH (0.05; 0.1; and 0.2 M) and soaking time (2, 4, 6, and 8 hours). The best results of pretreatment was used NaOH 0.1 M and 6 hours soaking time, it could remove noncollagen protein respectively with the lowest soluble protein value (0.142 mg/ml). The yield, pH, and solubility of collagen were 8.65%, 5.49, and 79% respectively. Fourier transform infrared (FTIR) spectra analysis showed major absorption bands of amide A, B, I, II and III at 3310, 2935, 1651, 1551, and 1242 cm-1 respectively. FTIR spectroscopic revealed that collagen molecules had the compact triple helical structure stabilized mainly by the hydrogen bond.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Skripsisebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
ISOLASI DAN KARAKTERISASI KOLAGEN DARI KULIT
IKAN BUNTAL PASANG (
Tetraodon luaris
)
Judul Skripsi : Isolasi dan Karakterisasi Kolagen dari Kulit Ikan Buntal Pisang (Tetraodon lunaris)
Nama : Fiqi Faisal
NIM : C34100006
Program studi : Teknologi Hasil Perairan
Disetujui oleh,
Dr Ir Bustami Ibrahim, MSc Dr Dra Pipih Suptijah, MBA Pembimbing I Pembimbing II
Diketahui oleh,
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Februari 2014 dengan judul skripsi Isolasi dan Karakterisasi Kolagen dari Kulit Ikan Buntal Pisang (Tetraodon lunaris).
Dalam kesempatan ini, dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan penelitian ini, yaitu:
1. Dr Ir Bustami Ibrahim, MSc dan Dr Pipih Suptijah, MBA selaku dosen pembimbing yang telah memberikan pengarahan dalam penyusunan skripsi ini.
2. Dr Eng Uju, SPi MSi selaku dosen penguji dan Prof Dr Ir Djoko Santoso, MSi selaku Ketua Departemen Teknologi Hasil Perairan.
3. Seluruh dosen, pegawai, dan staf TU Departemen Teknologi Hasil Perairan atas bantuannya selama ini.
4. Ayah dan Ibu tercinta yang telah memberikan semangat, dukungan moril dan materi serta cinta yang luar biasa kepada penulis.
5. Teman-teman THP 47 untuk kebersamaan dan kerjasama selama menempuh studi di THP.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 2
Waktu dan Tempat ... 2
Bahan dan Alat ... 2
Prosedur Penelitian ... 3
Metode Analisis ... 4
HASIL DAN PEMBAHASAN ... 8
Karakteristik Bahan Baku ... 8
Optimasi Ekstraksi Kolagen ... 9
Karakteristik Kolagen ... 11
Rendemen Kolagen ... 11
Nilai pH Kolagen ... 11
Kelarutan Kolagen ... 12
Analisis Gugus Fungsi dengan Fourier Transform InfraRed (FTIR)... 12
KESIMPULAN DAN SARAN ... 14
Kesimpulan ... 14
Saran ... 14
DAFTAR PUSTAKA ... 14
LAMPIRAN ... 17
DAFTAR TABEL
1 Morfometrik dan bobot ikan buntal pisang ... 8 2 Komposisi kimia kulit ikan buntal pisang dan berbagai ikan lain ... 9 3 Rendemen kolagen kulit ikan buntal pisang dan beberapa kulit ikan
lainnya ... 11 4 Nilai pH kolagen kulit ikan buntal pisang dan ikan lainnya ... 11 5 Karakteristik gugus fungsi kolagen kulit ikan buntal pisang dan ikan
lainnya ... 13
DAFTAR GAMBAR
1 Diagram alir pembuatan kolagen ... 3 2 Ikan buntal pisang ... 8 3 Diagram batang rendemenb bagian tubuh ikan butal pisang
(Tetraodon lunaris) ... 8 4 Protein terlarut pada NaOH sisa perendaman kulit. ... 10 5 Spektrum infrared kolagen ... 12
DAFTAR LAMPIRAN
1 Kurva regresi linier standar BSA. ... 18 2 Hasil uji Anova nilai konsentrasi protein larutan NaOH sisa
perendaman kulit ... 18 3 Hasil uji DMRT untuk pengaruh konsentrasi NaOH terhadap nilai
konsentrasi protein larutan sisa perendaman ... 18 4 Hasil uji DMRT untuk pengaruh waktu perendaman terhadap nilai
PENDAHULUAN
Latar Belakang
Ikan buntal merupakan ikan yang mempunyai nilai gizi yang tinggi. Ikan ini sangat digemari di Negara Jepang sebagai menu masakan yang mempunyai cita rasa yang lezat dan sangat bergizi. Ikan buntal pisang ini secara empiris sangat digemari oleh nelayan-nelayan di daerah Gebang, Kabupaten Cirebon. Kulit ikan buntal tidak dimanfaatkan dengan baik karena yang dikonsumsi hanya dagingnya sedangkan kulit menjadi limbah. Kulit ikan ini sangat potensial untuk diolah sehingga dapat meningkatkan nilai komersialnya. Salah satu upaya pengolahan yang dapat dilakukan yaitu pembuatan kolagen dari kulit ikan buntal pisang.
Kandungan protein yang cukup tinggi pada kulit ikan buntal menjadikan kulit ini sangat potensial sebagai bahan baku kolagen. Kolagen adalah salah satu dari jaringan ikat utama protein hewani dan telah banyak digunakan sebagai bahan biomedis. Kolagen adalah protein yang paling berlimpah dalam jaringan hewan dengan proporsi 30% dari total protein tubuh sebagai komponen utama dari jaringan ikat, otot, gusi dan kulit (Kittiphattanabawon et al. 2005). Aberoumand (2012) menyatakan kolagen merupakan biomaterial yang penting bagi aplikasi medis karena sifatnya yang biodegradable. Kolagen telah banyak digunakan untuk kepentingan biomedis, pharmaceutical, industri makanan, industri obat, dan industri kosmetik. Keistimewaan penggunaan kolagen berkaitan dengan karakteristik fisikokimia dari kolagen diantaranya mudah diserap dalam tubuh, sifat antigenitas rendah, afinitas dengan air tinggi, tidak beracun, biocompatible
dan biodegradable, relatif stabil, dapat disiapkan dalam berbagai bentuk sesuai kebutuhan, dan mudah dilarutkan dalam air maupun asam (Lee et al. 2001).
Sumber bahan baku produksi kolagen yang banyak beredar di pasaran adalah kulit dan tulang babi maupun sapi. Merebaknya issu penyakit sapi gila atau lebih dikenal dengan istilah bovine spongiform encephalopathy (BSE) mengakibatkan kekhawatiran pengguna kolagen yang berasal dari hewan darat ini. Penggunanan jenis bahan yang berasal dari babi dilarang bagi umat Islam juga mengakibatkan terbatasnya penggunaan kolagen dari babi. Perlu ada upaya untuk mencari alternatif sumber kolagen lain. Ikan merupakan salah satu pilihan sebagai alternatif sumber kolagen yang baik. Pemanfaat kulit ikan sebagai bahan baku kolagen merupakan alternatif untuk mengatasi masalah-masalah tersebut. Pembuatan kolagen dari kulit ikan buntal pisang sangat potensial untuk dikembangkan mengingat besarnya pemanfaatan kolagen bagi berbagai industri serta kurangnya pemenuhan kebutuhan kolagen di Indonesia secara lokal.
2
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menentukan perlakuan terbaik dengan menggunakan perbedaan konsentrasi NaOH dan lama waktu perendaman serta mengisolasi dan mengkarakterisasi kolagen yang berasal dari kulit ikan buntal pisang.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi penentuan pretreatment terbaik serta isolasi dan karakterisasi kolagen. Karakterisasi kolagen meliputi analisis proksimat, analisis FTIR, analisis kelarutan, analisis pH, pengolahan data serta penulisan laporan.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari sampai Juni 2014. Preparasi, Uji Bradford dan analisis kelarutan dilakukan di Laboratorium Pengetahuan Bahan Baku Industri Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis proksimat di Laboratorium Analisis Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Analisis Gugus Fungsi dilakukan di Laboratorium Fisika, Departemen Fisika, Fakultas MIPA, Institut Pertanian Bogor. Analisis Titik Leleh dilakukan di Laboratorium Kimia Organik, Departemen Kimia, Fakultas MIPA, Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah ikan buntal pisang (Tetraodon lunaris). Bahan yang digunakan untuk pembuatan kolagen adalah aquades, NaOH 1 M dan asam asetat (CH3COOH 98%). Bahan yang digunakan analisis kuantitatif protein adalah larutan Bradford. Analisis proksimat menggunakan bahan aquades, H2SO4, NaOH, HCl, H3BO4 dan pelarut heksana 96%. Bahan-bahan lain meliputi bahan untuk analisis karakteristik kolagen.
3
Karakterisasi kolagen
Preparasi
Freez dryer
Ekstraksi dengan air (40 °C, 3 jam) dengan rasio kulit dengan air = 1:2 (b/v)*2
(Hidrolisis)
Perendaman dengan CH3COOH 0,3 M dengan rasio (1:6)
(b/v) selama 2 jam*2
Netralisasi
Netralisasi
Kandungan protein terendah
Uji konsentrasi protein terlarut pada larutan sisa perendaman NaOH
setiap 2 jam
(Deproteinasi)
Perendaman dalam larutan NaOH rasio kulit terhadap larutan NaOH (1:10) (b/v) konsentrasi NaOH = 0,05
M; 0,1 M: 0,2 M waktu = 8 jam*1
Analisis Proksimat
Kolagen
Kolagen larut
air
Kulit hasil perendaman NaOH perlakuan terbaik
Kulit ikan buntal pisang
Prosedur Penelitian
Penelitian ini diawali dengan preparasi sampel yaitu dilakukan pemisahan kulit ikan buntal dari perairan Gebang, Kabupaten Cirebon. Selajutnya dilakukan tahap karakterisasi bahan baku kulit ikan buntal, penentuan perlakuan terbaik pada pembuatan kolagen, ekstraksi kolagen, dan karakterisasi kolagen.
Gambar 1 Diagram alir pembuatan kolagen
4
Preparasi bahan baku
Preparasi dilakukan dengan memisahkan bagian kulit dari bagian ikan lainnya. Kulit ikan dipotong hingga ukurannya 1 x 1 cm. Kulit ikan disimpan pada suhu -20°C hingga akan digunakan. Karakterisasi bahan baku meliputi analisis proksimat kulit.
Optimasi ekstraksi kolagen (Kittiphattanabawon et al. 2010)
Pembuatan kolagen diawali dengan perendaman kulit pada larutan alkali. Larutan alkali digunakan untuk menghilangkan protein non-kolagen pada sampel. Kulit ikan direndam dalam larutan NaOH konsentrasi 0,05 M; 0,1 M; dan 0,2 M dengan perbandingan 1:10 (b/v) selama 6 jam pada suhu ruang. Larutan NaOH diganti setiap 2 jam sekali kemudian diuji kandungan protein secara kuantitatif dengan uji Bradford untuk menentukan konsentrasi NaOH dan lama waktu perendaman terbaik.
Hidrolisis (modifikasi Sukkwai et al. 2011)
Hidrolisis dilakukan dengan perendaman kulit dalam larutan CH3COOH 0,3 M selama 2 jam dengan perbandingan sampel dan pelarut yaitu 1:6 (b/v). Sampel kulit dicuci menggunakan larutan akuades hingga netral. Proses dilakukan pada suhu ruang.
Ekstraksi kolagen (Nur’aenah 2013)
Sampel kemudian diekstraksi menggunakan akuades selama 2 jam pada suhu 40ºC dengan perbandingan sampel dan pelarut yaitu 1:2 (b/v). Hasil ekstraksi yang diperoleh merupakan kolagen larut air yang selanjutnya perlu dikeringbekukan agar diperoleh kolagen kering dalam bentuk lembaran, tepung ataupun kristal. Diagram alir pembuatan kolagen disajikan pada Gambar 1.
Metode Analisis
Analisis yang dilakukan pada karakterisasi kolagen dari kulit ikan buntal yaitu analisis proksimat, analisis rendemen, analisis kelarutan, analisis pH, analisis FTIR.
Analisis protein terlarut (Bradford 1976)
Uji Bradford dilakukan untuk menentukan konsentrasi protein pada sampel dengan Bovine Serum Albumin (BSA) sebagai standar. Larutan Bradford dibuat dengan mencampurkan 10 mg Coomasive Briliant Blue (CBB) dengan 5 ml etanol 96%, kemudian ditambahkan 10 ml larutan asam Ortofosfat 85% dan akuades hingga volumenya mencapai 500 ml. Larutan Bradford tersebut kemudian disaring menggunakan kertas saring.
5 Analisis proksimat (SNI 1992-01-2891)
Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis kadar air, abu, lemak, protein dan abu tak larut asam.
1) Analisis kadar air
Cawan porselen dikeringkan dalam oven selama 30 menit, lalu cawan didiamkan dalam desikator selama 15 menit. Selanjutnya cawan ditimbang hingga menunjukkan berat yang konstan. Selanjutnya sampel sebanyak 2 gram ditimbang dalam cawan dan dikeringkan dalam oven pada suhu 105oC selama 3 jam atau sampai beratnya konstan. Cawan beserta isinya kemudian didinginkan dalam desikator dan ditimbang hingga diperoleh bobot tetap. Perhitungan kadar air dapat dilihat sebagai berikut:
Kadar air (%) = −
−
�
%
Keterangan :
A = berat cawan kosong (gram)
B = berat cawan + sampel awal (gram) C = berat cawan + sampel kering (gram) 2) Analisis kadar abu
Cawan pengabuan dikeringkan di dalam oven selama satu jam pada suhu 105.oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel yang telah ditimbang sebanyak 5 g dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 1 jam, selanjutnya dimasukkan ke dalam desikator hingga suhu ruang, kemudian ditimbang hingga didapatkan berat yang konstan. Kadar abu ditentukan dengan rumus:
Kadar abu (%) = −
−
�
%
Keterangan :
A = berat cawan porselen kosong (gram) B = berat cawan dengan sampel (gram)
C = berat cawan dengan sampel setelah dikeringkan (gram) 3) Analisis kadar protein
6
dibaca dan dicatat. Larutan blanko dianalisis seperti contoh. Dengan metode ini diperoleh kadar nitrogen total yang dihitung. Kadar protein dihitung dengan rumus sebagai berikut:
N (%) = �− × �� × 4
� ×
×
%
Keterangan:
S = Volume titran sampel (ml) B = Volume titran blanko (ml) W = Bobot sampel kering (mg)
% Kadar Protein: % Nitrogen x faktor konversi
Keterangan : Protein mengandung rata-rata 16 % nitrogen Faktor konversi = 100 %
16 %
=
6,25
4) Kadar lemak
Sebanyak 2 gram sampel disebar diatas kapas yang beralas kertas saring dan digulung membentuk thimble, kemudian dimasukkan ke dalam labu soxhlet. Sampel diekstraksi selama 6 jam dengan pelarut lemak berupa heksan sebanyak 150 ml. Lemak yang terekstrak dikeringkan dalam oven pada suhu 100 oC selama 1 jam. Kadar lemak dihitung dengan rumus:
Kadar lemak (%) = � � �
�
×
%
Analisis rendemen (AOAC 1995)
Rendemen kolagen diperoleh dari perbandingan berat kering kolagen yang dihasilkan dengan berat bahan kulit. Rendemen diperoleh dengan rumus:
Rendemen kolagen (%) = � � � � ��
� ℎ
×
%
Analisis kelarutan (modifikasi Kittiphattanabawon et al. 2005)
Analisis kelarutan yaitu 100 mg sampel dilarutkan dalam 10 ml akuades kemudian diaduk hingga larut. Larutan disaring menggunakan kertas saring bebas abu kemudian dioven dengan suhu 100oC selama 60 menit lalu ditimbang. Kelarutan diperoleh dengan rumus:
Kelarutan (%) = � � � � � − −
� �
×
%
Keterangan:
A = Berat kertas saring awal (gram) B = Berat kertas saring akhir (gram) Analisis pH (AOAC 2005)
7 Analisis gugus fungsi dengan FTIR (Muyonga et al. 2004)
Analisis FTIR dilakukan untuk mengetahui gugus fungsi dan keberadaan kolagen yang dihasilkan. Kolagen sebanyak 0,2 gram dihaluskan dengan KBr dalam mortar hingga homogen, kemudian dimasukkan ke dalam cetakan pellet dan dipadatkan serta divakum dalam mesin pencetak pellet. Selanjutnya pellet dimasukkan ke dalam sel dan dimasukkan pada media penempatan sel dengan ditembakkan sinar dari spektofotometer inframerah IR-408 yang sudah dinyalakan dengan kondisi yang stabil, kemudian dilakukan pendeteksian menggunakan tombol detektor dan akan dihasilkan rekorder histogram FTIR pada monitor yang akan menampilkan puncak-puncak dari gugus fungsi yang terdapat pada sampel. Histogram yang diperoleh selanjutnya akan dianalisis untuk memperoleh data kualitatif maupun kuantitatif.
Analisis data (Steel dan Torrie 1993)
Data yang diperoleh dari penelitian tahap pendahuluan (pretreatment) dianalisis dengan menggunakan softwear Statistical Product and Service Solutions (SPSS) 17. Analisis statistik data penelitian diolah dengan Rancangan Acak Faktorial dengan 2 faktor yaitu konsentrasi NaOH sebanyak 3 taraf (0,05M; 0,1 M; 0,2 M) dan faktor lama waktu perendaman dengan 4 taraf (2 jam, 4 jam, 6 jam, 8 jam). Semua perlakuan dilakukan sebanyak 2 kali ulangan. Model rancangannya adalah:
Yijk = μ + τi + βj+ (τ β)ij + εijk Keterangan:
Yijk = Nilai pengamatan dari perlakuan konsentrasi NaOH ke-i, perlakuan lama perendaman ke-j dan ulangan ke-k
μ = Nilai rataan umum populasi
τi = Pengaruh perlakuan konsentrasi NaOH ke-i βj = Pengaruh lama waktu perendaman ke-j
(τβ)ij = Pengaruh interaksi perlakuan konsentrasi NaOH ke-i dengan lama waktu perendaman ke-j
εijk = Galat pengamatan pada perlakuan konsentrasi NaOH ke-i, perlakuan lama waktu perendaman ke-j dan ulangan ke-k.
Data yang diamati dianalisis secara statistik dengan analisis ragam (ANOVA). Apabila hasil analisis menunjukkan berpengaruh nyata, maka
dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) dengan taraf
kepercayaan 95%. Hipotesis Pengaruh kosentrasi NaOH:
H0 = Perbedaan konsentrasi NaOH, waktu perendaman, dan interaksi antar perlakuan tidak berpengaruh nyata terhadap total protein non-kolagen terlarut.
8
HASIL DAN PEMBAHASAN
Karakteristik Bahan Baku
Karakteristik bahan baku merupakan sifat penting untuk mengetahui potensi yang terdapat pada bahan tersebut. Pengukuran morfometrik dan bobot ikan buntal pisang (Gambar 2) dengan beberapa parameter yaitu panjang baku, panjang total, tinggi, lebar dan bobot. Ikan buntal pisang memiliki panjang baku rata-rata 11,83cm, panjang total rata-rata 14,07 cm, lebar rata-rata 2,50 cm, tinggi rata-rata 4,63 cm, dan bobot total rata-rata 67,67 g. Perbedaan ukuran dan bobot dari ikan buntal dipengaruhi oleh pertumbuhan. Morfometrik dan bobot ikan dapat dilihat pada Tabel 1.
Gambar 2 Ikan buntal pisang Tabel 1 Morfometrik dan bobot ikan buntal pisang
Parameter Satuan Nilai
Panjang baku cm 11,83±1,04
Panjang total cm 14,07±1,08
Tinggi cm 4,63±0,12
Lebar cm 2,50±0,20
Bobot g 67,67±1,53
Gambar 3 Diagram batang proporsi bagian tubuh ikan buntal pisang (Tetraodon lunaris)
30,79
13,68
10,02
45,52
0 10 20 30 40 50 60
daging kulit jeroan tulang dan kepala
(%
)
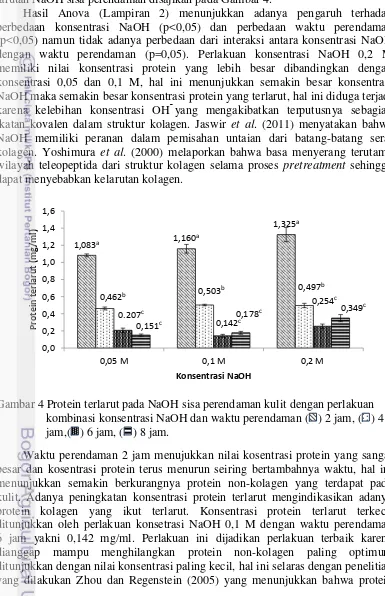
9 Ikan yang telah dihitung morfometrik dan bobotnya segera dipreparasi untuk memisahkan daging, tulang dan kepala, kulit, dan jeroan agar dapat menghitung rendemen dari ikan buntal. Rendemen merupakan presentasi bobot bagian tubuh yang dapat dimanfaatkan sehingga mengetahui nilai ekonomis dari suatu bahan baku. Semakin tinggi nilai rendemen dari bahan baku maka semakin tinggi pula nilai ekonomisnya. Persentasi rendemen ikan buntal pisang dapat dilihat pada Gambar 3.
Rendemen tertinggi terdapat pada kepala sebesar 45,52%, dan rendemen terendah terdapat pada jeroan sebesar 10,02%. Rendemen daging sebesar 30,79% dan rendemen kulit sebesar 13,68%. Rendemen kulit yang cukup tinggi berpotensi untuk digunakan sebagai bahan baku kolagen. Komposisi kimia kulit ikan buntal pisang perlu diketahui untuk menentukan kandungan gizi yang terdapat di dalam kulit tersebut. Komposisi kimia merupakan salah satu indikasi kualitas suatu bahan. Analisis komposisi kimia yang dilakukan pada penelitian ini meliputi kadar air, protein, lemak, dan abu. Komposisi kimia kulit ikan buntal pisang dan beberapa kulit ikan lain disajikan pada Tabel 2.
Tabel 2 Komposisi kimia kulit ikan buntal pisang dan berbagai ikan lain
Sumber kulit Kadar air Kadar protein Kadar lemak Kadar abu
(% bb) (% bb) (% bb) (% bb)
Ikan buntal pisang 74,00±0,50 23,08±0,41 0,49±0,05 1,81±0,56 Ikan cobia1 71,79±0,49 19,02±0,21 7,09±0,18 1,36±0,16
Ikan pari2 63,80 28,49 6,08 0,65
Keterangan : 1(Ariesta 2014); 2(Nur’aenah 2013).
Kadar air ikan buntal 74,0% lebih besar dibandingkan dengan ikan pari 63,8% maupun ikan cobia 71,79%. Kadar protein kulit ikan buntal pisang 23,08% lebih rendah dari kadar protein pada kulit ikan pari 28,49% (Nur’aenah 2013) tetapi lebih tinggi dari kulit ikan cobia 19,02% (Ariesta 2014). Kadungan protein kulit ikan buntal pisang yang tinggi berpotensi untuk digunakan sebagai bahan baku kolagen. Kadar lemak 0,49% lebih rendah dari kulit ikan pari dan kulit ikan cobia. Kadar abu 1,81% lebih tinggi dari kulit ikan pari dan kulit ikan cobia. lebih rendah dari kulit ikan pari dan kulit ikan cobia. Perbedaan komposisi kimia pada bahan disebabkan oleh perbedaan spesies, habitat, umur, jenis pakan, serta teknik preparasi bahan (Songchotikunpan et al. 2008). Proses pretreatment kulit bertujuan untuk menghilangkan protein non-kolagen, lemak dan mineral-mineral dalam kulit ikan sehingga dapat meningkatkan kualitas kolagen yang dihasilkan. Kandungan lemak dan mineral pada kolagen akan mengganggu efektivitas kolagen dalam pengaplikasiannya (Shon et al. 2011).
Optimasi Ekstraksi Kolagen
10
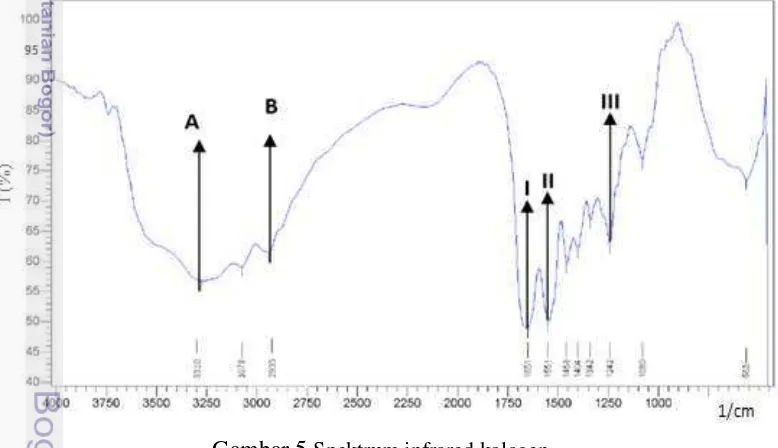
Zhou dan Regenstein (2005) menunjukkan bahwa penggunaan larutan basa pada proses pretreatment kulit lebih efektif dalam proses pengeluaran protein non-kolagen dan hanya menyebabkan tingkat kehilangan non-kolagen yang rendah dibandingkan dengan penggunaan larutan asam. Konsentrasi protein terlarut pada larutan NaOH sisa perendaman disajikan pada Gambar 4.
Hasil Anova (Lampiran 2) menunjukkan adanya pengaruh terhadap perbedaan konsentrasi NaOH (p<0,05) dan perbedaan waktu perendaman (p<0,05) namun tidak adanya perbedaan dari interaksi antara konsentrasi NaOH dengan waktu perendaman (p=0,05). Perlakuan konsentrasi NaOH 0,2 M memiliki nilai konsentrasi protein yang lebih besar dibandingkan dengan konsentrasi 0,05 dan 0,1 M, hal ini menunjukkan semakin besar konsentrasi NaOH maka semakin besar konsentrasi protein yang terlarut, hal ini diduga terjadi karena kelebihan konsentrasi OHˉyang mengakibatkan terputusnya sebagian ikatan kovalen dalam struktur kolagen. Jaswir et al. (2011) menyatakan bahwa NaOH memiliki peranan dalam pemisahan untaian dari batang-batang serat kolagen. Yoshimura et al. (2000) melaporkan bahwa basa menyerang terutama wilayah teleopeptida dari struktur kolagen selama proses pretreatment sehingga dapat menyebabkan kelarutan kolagen.
Gambar 4 Protein terlarut pada NaOH sisa perendaman kulit dengan perlakuan kombinasi konsentrasi NaOH dan waktu perendaman ( ) 2 jam, ( ) 4 jam,( ) 6 jam, ( ) 8 jam.
Waktu perendaman 2 jam menujukkan nilai kosentrasi protein yang sangat besar dan kosentrasi protein terus menurun seiring bertambahnya waktu, hal ini menunjukkan semakin berkurangnya protein non-kolagen yang terdapat pada kulit. Adanya peningkatan konsentrasi protein terlarut mengindikasikan adanya protein kolagen yang ikut terlarut. Konsentrasi protein terlarut terkecil ditunjukkan oleh perlakuan konsetrasi NaOH 0,1 M dengan waktu perendaman 6 jam yakni 0,142 mg/ml. Perlakuan ini dijadikan perlakuan terbaik karena dianggap mampu menghilangkan protein non-kolagen paling optimum ditunjukkan dengan nilai konsentrasi paling kecil, hal ini selaras dengan penelitian yang dilakukan Zhou dan Regenstein (2005) yang menunjukkan bahwa protein
11 non-kolagen dapat dihilangkan dengan perendaman dalam larutan NaOH dengan konsentrasi 0,1 mol/L NaOH.
Karakteristik Kolagen
Karakteristik kolagen merupakan sifat penting untuk mengetahui potensi yang terdapat pada kolagen tersebut. Kolagen yang dihasilkan memiliki bentuk seperti serat berwarna putih dan tidak beraroma. Karakteristik kolagen yang dilakukan berupa nilai rendemen, pH, kelarutan, dan analisis gugus fungsi. Rendemen Kolagen
Rendemen merupakan persentase kolagen yang dihasilkan dengan bahan baku awal. Rendemen menunjukkan bagian bahan baku yang dapat dimanfaatkan dan menjadi suatu parameter yang penting untuk mengetahui nilai ekonomis serta keefektifan suatu bahan atau produk. Hasil penelitian menunjukkan kolagen kulit ikan buntal pisang memiliki rendemen yang lebih tinggi dari ASC (acid soluble collagen) dan PSC (pepsin soluble collagen) ikan patin siam (Singh et al. 2011), namun lebih rendah dari rendemen kulit ikan cobia (Rachycentron canadum) (Tabel 3). Potaros et al. (2009) menyatakan bahwa perbedaan nilai rendemen pada kolagen yang dihasilkan dapat disebabkan oleh perbedaan metode ekstraksi, konsentrasi larutan untuk menghilangkan protein non-kolagen, dan jenis bahan, suhu dan lama waktu produksi.
Tabel 3 Rendemen kolagen kulit ikan buntal pisang dan beberapa kulit ikan lainnya
Sumber Kolagen Rendemen % (bb)
Kulit ikan buntal pisang (Tetraodon lunaris) 8,65 Kulit ikan cobia (Rachycentron canadum)1 10,51
ASC kulit ikan patin siam2 5,1
PSC kulit ikan patin siam2 7,7
Keterangan : 1(Ariesta 2014); 2(Signh et al. 2011).
Nilai pH Kolagen
Nilai pH merupakan parameter untuk mengukur derajat keasaman suatu larutan. Nilai pH kolagen kulit ikan buntal pisang bersifat asam yaitu 5,49±0,04. Nilai pH kolagen kulit ikan buntal lebih tinggi dari kolagen kulit ikan pari tetapi lebih rendah dari kulit ikan cobia. Perbedaan nilai pH sangat dipengaruhi oleh konsentrasi larutan yang digunakan baik asam atau basa dan proses netralisasi. Kombinasi proses asam dan basa cenderung menghasilkan pH mendekati netral (Zhou dan Regenstein 2005). Penetralan berpengaruh pada pH akhir kolagen karena dapat mengurangi sisa-sisa larutan asam atau basa akibat perendaman. Nilai pH kolagen dari kulit ikan buntal pisang disajikan pada Tabel 4.
Tabel 4 Nilai pH kolagen kulit ikan buntal pisang dan ikan lainnya
Sumber Kolagen Nilai pH
Kulit ikan buntal pisang (Tetraodon lunaris) 5,49±0,04 Kulit ikan cobia (Rachycentron canadum)1 7,08±0,01
Kulit ikan pari (Pastinachus solocirostris)2 5,00
12
Kelarutan Kolagen
Kelarutan merupakan kemampuan suatu bahan tertentu (solute) untuk larut dalam suatu pelarut (solvent). Pelarut yang digunakan untuk melarutkan kolagen yaitu akuades. Kelarutan kolagen ditentukan dengan membandingkan kolagen terlarut terhadap total kolagen awal. Kelarutan kolagen yang dihasilkan yaitu 79%. Hasil ini lebih rendah jika dibandingkan dengan kelarutan kolagen dari kulit ikan pari (Nur’aeah 2013) sebesar 99,5%. Perbedaan kelarutan dapat disebabkan perbedaan titik isoelektrik. Ahmad dan Benjakul (2010) menjelaskan bahwa pada titik isoelektrik protein bermuatan nol sehingga interaksi hidrofobik meningkat dan terjadi pengendapan protein terlarut pada pH titik isolektrik tersebut. Kelarutan juga dipegaruhi oleh suhu dan proses pengadukan.
Analisis Gugus Fungsi dengan Fourier Transform InfraRed (FTIR)
Spektroskopi FTIR merupakan teknik analisis yang biasa dimanfaatkan untuk menentukan gugus fungsi pada suatu senyawa. Setiap frekuensi sinar (termasuk inframerah) mempunyai bilangan gelombang tertentu. Apabila frekuensi IR tertentu diserap oleh sampel senyawa organik, maka akan timbul vibrasi dalam molekul senyawa tersebut (Nagarajan et al. 2012). Analisis FTIR yang dilakukan pada penelitian ini bertujuan memastikan senyawa atau gugus fungsi yang terdeteksi merupakan senyawa penyusun kolagen berdasarkan gugus-gugus fungsi struktur kolagen.
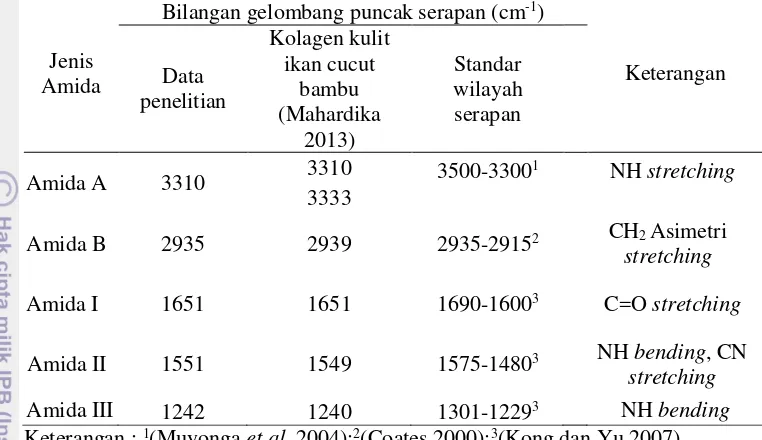
Gambar 5 Spektrum infrared kolagen
Karakteristik gugus fungsi kolagen hasil analisis FTIR disajikan pada Tabel 5. Puncak serapan amida A yang dimiliki kolagen dari kulit ikan buntal pisang terdeteksi pada bilangan gelombang 3310 cm-1. Muyonga et al. (2004)
menyatakan bahwa bilangan gelombang yang dimiliki amida A yaitu 3500–3300 cm-1, ketika N-H pada peptida dipengaruhi oleh ikatan hidrogen posisinya
bergeser ke frekuensi yang lebih rendah. Coates (2000) menyatakan senyawa dengan bilangan gelombang 3360–3310 cm-1 memiliki karakteristik NH
13 Tabel 5 Karakteristik gugus fungsi kolagen kulit ikan buntal pisang dan ikan
lainnya
Jenis Amida
Bilangan gelombang puncak serapan (cm-1)
Keterangan
Adanya puncak pada bilangan gelombang 2935 cm-1 mengindikasikan
adanya gugus khas kolagen yaitu amida B. Coates (2000) menyatakan gugus amida B dengan wilayah serapan pada bilangan gelombang 2935–2915 cm-1atau
2865–2845 cm-1. Kong dan Yu (2007) menyatakan bilangan gelombang yang
mengindikasikan serapan amida B terbentuk dari asymmetrical stretch of CH2. Kong dan Yu (2007) menyatakan bahwa amida I terdeteksi pada kisaran bilangan gelombang 1690–1600 cm-1. Bilangan gelombang amida I yang
terdeteksi pada kolagen dari kulit ikan buntal pisang yaitu 1651 cm-1. Nilai ini
serupa dengan hasil yang diperoleh oleh Mahardika (2013), kulit ikan cucut bambu memiliki gugus amida I pada bilangan gelombang 1651 cm-1. Nilai
bilangan gelombang pada ASC kulit ikan surf lebih rendah yaitu 1640 cm-1. Shah
dan Manekar (2012) menyatakan bahwa amida I terkait dengan vibrasi peregangan gugus karbonil. Amida I merupakan gugus fungsi khas yang menyusun kolagen. Nagarajan et al. (2012) menyatakan bahwa nilai bilangan gelombang amida I gelatin dari kulit luar cumi-cumi yaitu 1635–1632 cm-1.
Bilangan gelombang pada kisaran 1633 cm-1merupakan karakteristik random coil
pada gelatin, hal ini berarti bahwa senyawa molekul yang dihasilkan dari proses ekstraksi benar kolagen.
Kong dan Yu (2007) menyatakan wilayah serapan amida II yaitu pada kisaran 1575–1480 cm-1. Wilayah serapan pada bilangan gelombang 1551 cm-1
mengindikasikan adanya gugus fungsi amida II. Nilai ini serupa dengan bilangan gelombang pada PSC kulit ikan stripped catfish yaitu 1551 cm-1 namun lebih
tinggi jika dibandingkan dengan ASC kulit ikan surf yaitu 1541 cm-1. Amida II
terkait dengan adanya gugus CN stretching dan NH bending.
Wilayah serapan pada bilangan gelombang 1242 cm-1 mengindikasikan
adanya gugus fungsi amida III. Nilai ini lebih tinggi dibandingkan dengan hasil yang diperoleh oleh Singh et al. (2012), PSC kulit ikan stripped catfish yaitu 1244 cm-1. Penelitian Nagarajan et al. (2012) menghasilkan gelatin dari kulit luar
14
1236,86–1235,79 cm-1. Nikoo et al. (2011) menyatakan wilayah serapan gelatin
memiliki nilai bilangan gelombang pada kisaran 1235 cm-1yang mengindikasikan
hilangnya struktur triple heliks akibat perubahan α-heliks menjadi struktur random coil (single heliks) yang disebabkan denaturasi kolagen menjadi gelatin, hal ini menunjukkan bahwa ekstrasi kulit ikan buntal pisang dengan air pada suhu 40ºC menghasilkan kolagen bukan gelatin yang ditunjukkan dengan masih adanya struktur triple heliks.
KESIMPULAN DAN SARAN
Kesimpulan
Perlakuan terbaik pada pembuatan kolagen dari kulit ikan buntal pisang (Tetraodon lunaris) yaitu konsentrasi NaOH 0,1 M selama 6 jam pada proses
pretreatment. Rendemen yang dihasilkan dari proses ekstraksi kolagen yaitu 8,65% (bb). Karakteristik kolagen sebagai berikut memiliki nilai pH 5,49 dan kelarutan kolagen 79%. Uji spektroskopi FTIR menunjukkan wilayah penyerapan utama amida A, B, I, II, dan III masing-masing pada 3310, 2935 , 1651 , 1551 dan 1242 cm-1. Struktur triple heliks pada amida I dan III mengindikasikan bahwa
senyawa yang dihasilkan adalah kolagen. Saran
Perlu dilakukan perbedaan perlakuan asam asetat. Perlu dikembangkan pengaplikasian kolagen kulit ikan buntal pisang pada bidang farmasi maupun kosmetik. Perlu dikembangkan pembuatan nanokolagen dari kulit ikan buntal pisang. Perlu diupayakan pengolahan kulit ikan buntal pisang menjadi produk lain yaitu gelatin dan enzim.
DAFTAR PUSTAKA
Aberoumand A. 2012. Comparative study between different methods of collagen extraction from fish and its properties. World Applied Sciences Journal 16 (3): 316-319.
Ahmad M, Benjakul S. 2010. Extraction and characterisation of pepsin solubilised collagen from the skin of unicorn leatherjacket (Aluterus monocerous).
Food Chemistry 120:817-824.
[AOAC] Association of Official Analytical Chemyst. 1995. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia (US) : Published by The Association of Official Analytical Chemist, Inc.
15 Virginia (US): Published by The Association of Official Analytical Chemist, Inc.
Ariesta C. 2014. Ekstraksi dan karakterisasi kolagen dari kulit ikan cobia (Rachycentron canadum) [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72: 248-254.
Coates J. 2000. Interpreration of infrared spectra, a practical approach. Di dalam: Meyers RA, editor. Encyclopedia of Analytical Chemistry. Chichester (GB): John Wiley & Sons Ltd.
Jaswir I, Monsur HA, Salleh HM. 2011. Nano-structural analysis of fish collagen extracts for new process development. Afr J Biotechnol 10(81):18847-18854.
Kittiphattanabawon P, Benjakul S, Visessanguan W, Nagai T, Tanaka M. 2005. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus). Food Chemistry 89: 363–372.
Kittiphattanabawon P, Benjakul S, Visessanguan W, Shahidi F. 2010. Isolation and characterization of collagen from the cartilages of brownbanded bamboo shark (Chiloscyllium punctatum) and blacktip shark (Carcharhinus limbatus). Food Science and Technology 43: 792–800. Kong J, Yu S. 2007. Fourier transform infrared spectroscopic analysis of protein
secondary structures. Acta Biochim Biophys Sin 39(8): 549–559.
Kumar MH, Spandana V, Poonam T. 2011. Extraction and determination of collagen peptide and its clinical importance from tilapia fish scales (Oreochromis niloticus). International Research Journal of Pharmacy 2(10): 97-99.
Lee CH, Singla A, Lee Y. 2001. Biomedical application of collagen. International Journal of Pharmaceutics 22: 1-22.
Mahardika S. 2013. Isolasi dan karakterisasi kolagen nanopartikel dari kulit ikan cucut bambu (Chiloscyllium punctatum) [skripsi]. Bogor (ID): Program Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu kelautan, Institut Pertanian Bogor.
Muyonga JH, Cole CGB, Duodu KG. 2004. Characterisation of acids soluble collagen from skins of young and adulti Nile perch (Lates niloticus). Food Chemistry 85(1): 81-89.
Nagai T, Suzuki N, Tanoue Y, Kai N, Nagashima T. 2010. Characterization of acid soluble collagen from skins of surf Smelt (Hypomesus pretiosu japonica Brevoort). Journal Food and Nutrition Science 1: 59-66.
Nagarajan M, Benjakul S, Prodpran T, Songtipya P, Kishimura H. 2012. Characteristics and functional properties of gelatin from splendid squid (Loligo formosana) skin as affected by extraction temperatures. Food Hydrocolloids 29: 389-397.
Nikoo M, Xu X, Benjakul S, Xu G, Ramires-Suarez JC, Ehsani A, Kasankala LM, Duan X, Abass S. 2011. Characterization of gelatin from the skin of farmed Amur sturgeon Acipenser schrenckii. International Aquatic Research 3: 135-145.
Nur’aenah N. 2013. Ekstraksi dan karakterisasi kolagen dan nanopartikel kolagen
16
kosmetik [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Potaros T, Raksakulthai N, Runglerdkreangkrai J, Worawattanamateekul W. 2009. Characteristics of collagen from nile tilapia (Oreochromis niloticus) skin isolated by two different methods. Kasetsart Journal 43: 584-593. Shah V, Manekar A. 2012. Isolation and characterization of collagen from the
placenta of buffalo (Bovidae bubalus bubalis) for the biomaterial applications. Trend in Life Science 1(4): 26–32.
Shon J, Ji-Hyun E, Hwang SJ, Jong-Bang E. 2011. Effect of processing conditions on functional properties of collagen powder from Skate (Raja kenojei) skins. Food Sci Biotechnol 20(1):99-106.
Singh P, Benjakul S, Maqsood S, Kishimura H. 2011. Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus). Food Chemistry 124: 97–105.
[SNI] Standar Nasional Indonesia.1992. SNI 01-2891-1992: Cara Uji Makanan dan Minuman. Jakarta (ID): Dewan Standarisasi Nasional.
Songchotikunpan P, Tattiyakul J, Supaphol P. 2008. Extraction and electrospinning of gelatin from fish skin. International Journal of Biological Macromolecules 42: 247-255.
Steel RGD & Torrie JH. 1993. Prinsip dan Prosedur Statistika, Suatu Pendekatan Biometrik. Bambang Sumantri, penerjemah. Jakarta (ID): Gramedia Pustaka Utama. Terjemahan dari: Principles and Procedures of Statistics: A Biometrical Approach.
Sukkwai S, Kijroongrojana K, Benjakul S. 2011. Extraction of gelatin from bigeye snapper (Priacanthus tayenus) skin for gelatin hydrolysate production. International Food Research Journal 18(3): 1129-1134. Yoshimura K, Terashima M, Hozan D, Shirai K. 2000. Preparation and dynamic
viscoelasticity characterization of alkali-solubilized collagen from shark skin. J Agric Food Chemistry 48:685-690.
17
18
Lampiran 1 Kurva regresi linier standar BSA.
Lampiran 2 Hasil uji Anova nilai konsentrasi protein larutan NaOH sisa
NaOH N Rata-rata konsentrasi terlarut (mg/ml) Notasi
19 Lampiran 4 Hasil uji DMRT untuk pengaruh waktu perendaman terhadap nilai
konsentrasi protein larutan sisa perendaman
Waktu
perendaman N
Rata-rata konsentrasi terlarut
(mg/ml) Notasi
2 jam 6 3,568 A
4 jam 6 1,462 B
8 jam 6 0,678 C
6 jam 6 0,604 C
20
RIWAYAT HIDUP
Penulis bernama lengkap Fiqi Faisal dilahirkan pada tanggal 17 November 1991 di Cirebon. Penulis adalah anak ketiga dari pasangan Bapak Farchan dan Ibu
Sumi’ah. Penulis memulai jenjang pendidikan formal di Sekolah Dasar Negeri 1 Kepongpongan tahun 1998-2004. Penulis melanjutkan pendidikan di SMP Negeri 11 Cirebon tahun 2004-2007. Pendidikan menengah atas ditempuh penulis di SMA Negeri 1 Cisarua, Bandung Barat tahun 2007-2010.
Penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) dengan program studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor tahun 2010 dan menerima Beasiswa Bidik Misi. Selama kuliah penulis aktif dalam kegiatan kemahasiswaan antara lain UKM Catur tahun 2010-2012 dan divisi PSDM Himasilkan pada tahun 2011-2013.